Este documento es de distribución gratuita y llega gracias a El mayor portal de recursos educativos a tu servicio!
|
|
|
- María Elena Bustamante Morales
- hace 7 años
- Vistas:
Transcripción
1 Este documento es de distribución gratuita y ega gracias a Ciencia Matemática E mayor porta de recursos educativos a tu servicio!
2 LOS GASES CONTENIDOS.- Leyes de os gases:.. Ley de Boye-Mariotte..2. Ley de Chares Gay.Lussac. 2.- Gases ideaes. 3.- Teoría cinética de os gases. 4.- Ecuación genera de un gas idea. 5.- Voumen ar. 6.- Mezca de gases. Presión parcia. LEYES DE LOS GASES Ley de Boye-Mariotte A Temperatura constante se cumpe que: p x V = constante; p V= p V 2 2 Ley de Chares Gay-Lussac A p constante se cumpe que: V constante ; T = V V2 = T T 2 ECUACIÓN GENERAL DE LOS GASES IDEALES. Iguamente puede demostrarse que: p constante ; T = p p2 = T T 2 Con o que uniendo as tres fórmuas queda: p V = constante T La constante depende de a cantidad de gas. Para Para n es p V = R T p V = n R T
3 que suee escribirse de a siguiente forma: p V = n R T en donde R toma e vaor: R = 0,082 atm / K = 8,3 J/ K Condiciones normaes Se denominan condiciones normaes (C.N.) a as siguientes condiciones de presión y temperatura: Ejempo: p = atmósfera T = 0 ºC = 273 K A presión de 3 atm y 20 ºC, una cierta masa gaseosa ocupa un voumen de 30 itros. Cacua e voumen que ocuparía en condiciones normaes. p V p V p V T 3atm K = V = = = 83,86itros T T p T atm 293K Ejercicio A: Cacua a masa ecuar de un gas, sabiendo que 32,7 g de mismo ocupan a 50ºC y 3040 mm de Hg de presión un voumen de 6765 m. Ejercicio B: Qué voumen ocupará un de cuaquier gas en condiciones normaes? Ejercicio C: La densidad de gas butano (C 4 H 0 ) es,7 g x L cuando su temperatura es 75 ºC y a presión en e recinto en que se encuentra 640 mm Hg. Cacua su masa ar. TEORÍA CINÉTICA DE LOS GASES (POSTULADOS). Los gases están formados por partícuas separadas enormemente en comparación a su tamaño. E voumen de as partícuas de gas es despreciabe frente a voumen de recipiente. Las partícuas están en movimiento continuo y desordenado chocando entre sí y con as paredes de recipiente, o cua produce a presión. Los choques son perfectamente eásticos, es decir, en eos no se pierde energía (cinética). La energía cinética media es directamente proporciona a a temperatura. PRESIÓN PARCIAL Cuando existe una mezca de gases se denomina presión parcia de un gas a a presión ejercida por as écuas de ese gas como si é soo ocupara todo e voumen. Se cumpe, por tanto a ey de os gases para cada gas por separado.
4 Si, por ejempo hay dos gases A y B, entonces: p V = n R T ; p V = n R T A A Sumando miembro a miembro ambas ecuaciones: ( ) ( ) R B B p + p V = n +n T A B A B Como a suma de a presiones parciaes es a presión tota: p = p + p se obtiene que: p V = n R T (ecuación genera) La presión parcia es directamente proporciona a nº de es: Tota A B na pa na = pa = p = χa donde χ A se ama fracción ar de A. n p n nb Iguamente: pb = p = χb n na nb na + nb Sumando ambas presiones parciaes: pa + pb = p+ p = p = p n n n Ejempo: Una mezca de de 4 g de CH 4 y 6 g de C 2 H 6 ocupa un voumen de 2,75 itros. Cacua: a) a temperatura de a mezca si a presión tota es de 0,5 atm; b) a presión parcia de cada gas. a) nch ( ) = 4g 0,25 6g = 4 ; nch ( ) = 6g 0,20 30g = 2 6 n tota = n (CH 4 ) + n (C 2 H 6 ) = 0,25 + 0,20 = 0,45 p V 0,5 atm 2,75 T = = = 295K n R 0,45 0,082atm K b) ( ) ( ) = nch = 0,20 0,5 =0,222atm 2 6 pch 2 6 p atm ntota 0,45 ( ) ( ) = nch = 0,25 0,5 =0,278atm 4 pch4 p atm ntota 0,45 Se comprueba que 0,278 atm + 0,222 atm = 0,5 atm. Ejercicio D: En un recipiente de 3 itros introducimos 20 g etano (C 2 H 6 O) y 30 g de propanona (acetona) (C 3 H 6 O) y caentamos hasta os 50 ºC, con o cua ambos íquidos pasan a estado gaseoso. Cacua: a) a presión parcia de cada gas.; b) a presión en e interior de recipiente; c) a fracción ar de cada gas.
5 GASES Leyes de os gases.- Una cierta cantidad de gas ocupa 200 cm 3 a,5 atm y 20 ºC. Qué voumen ocupará a 720 mmhg y 80 ºC? 2.- a) Qué voumen ocuparán 3,4 es de N 2 O 5 en condiciones normaes? b) Y a 2 atm y 50 ºC? 3.- Cacua a masa ecuar de un gas, sabiendo que 0,67 g de mismo ocupan a 50 ºC y 360 mm de Hg de presión un voumen de 225 m. 4.- Un recipiente contiene 8 g de CO 2, a a presión de 6 atm y 27 ºC de temperatura. Cacua a cantidad de CO 2 que sae de recipiente cuando su presión se reduce a 2 atm. 5.- En un recipiente de 5,0 itros hay C 2 (g) a 2 atm y 200 ºC. Lo vaciamos y o enamos de N 2 (g) hasta acanzar a misma presión y temperatura, a) Cuántos es de coro y nitrógeno había encerrados en cada momento?; b) Qué masa de cada gas ha habido encerrada?; c) Cuá es a densidad de coro en condiciones normaes? 6.- Cuá será a masa ecuar de un gas si sabemos que 2,44 g de mismo ocupa 500 cm 3 a,5 atm y 27 ºC? 7.- Cuá será a densidad de gas metano a) en condiciones normaes? b) a 50ºC y,7 atm? 8.- La densidad de un gas que contiene coro es 3,58 g/l a,2 atm y 7 ºC. a) Cuá será su masa ecuar? b) De qué gas se trata? 9.- 6,76 g de un gas ocupa un voumen de 2 itros a 680 mm de Hg y 40 ºC. Averigua su fórmua ecuar si se sabe que su composición centesima es de 73,20 % de C, 24,74 % de C y 2,06 % de H. 0.- La atmósfera tiene aproximadamente un 2 % en masa de oxígeno, un 78 % de de nitrógeno y un % de argón. Cuá es a fracción ar y a presión parcia de cada gas a presión atmosférica?. Souciones a os ejercicios 3 p V p' V' p V T', 5atm 200cm 353K 760mmHg = V' = = = 38,5cm T T ' T p' 293K 720 mmhg atm 2. a) V = n V ar = 34, 224, = 76,2 itros b) V 3. n R T 3,4 0,082 atm 423 K = = = 59,0 itros p K 2atm m R T 0,67 g 0,082 atm 323 K 760 mm Hg M = = = p V K 2, mm Hg atm 28,0 g 3
6 2 4. E recipiente tendrá un voumen: m R T 8 g 0,082 atm 300 K V = = = 0, 745 itros M p 44 g K 6atm V M p 0, g 2atm R 0, m = = = 267, g T atm K K Por tanto, saen de recipiente 8 g 2,67 g = 5,33 g p V 2 atm 5, 0 5. a) n = = = 0,258 es tanto de C 2 como de N 2. R T 0,082 atm K 473 K b) V M p 5, 0 70, 9g 2atm R 0, m = = = T atm K K V M p 5, 0 28, 0g 2atm m = = = R T 0,082 atm K 473K 8,3 g de C 2 7,22 g de N 2 d R T M p 70, 9g atm c) M = d = = = 3,7 g p R T 0, 082atm K 273K m R T 2,44 g 0,082 atm 300 K 6. M = = = 80,0 g p V K 0, 5 5, atm M p 6, 0g atm 7. a) d = = = 0,7 g R T 0, 082atm K 273K M p 6, 0g 7, atm b) d = = =,03 g R T 0, 082atm K 323K d R T 3, 58 g 0, 082atm K 290 K 8. a) M = = = 70,9 g p 2, atm b) Obviamente se trata de C 2, ya que su masa ecuar es justo e dobe de su masa atómica. m R T 6,76 g 0,082 atm 33 K 760 mmhg g 9. M = = = 95, p V K 680 mmhg 2 atm 95, Por cada de compuesto habrá: 73, 20 gc = 70, 97 gde C 00 95, 95, 24, 74 gc = 23, 99 gde C y 20, 6 gh = 200, gde H , 97 gde C 399, gde C 200, gde H 2 de C ; 2 de C ; 35, 45 g 2, 0 g 2 de H 0, g uego su fórmua ecuar será: C 2 H 2 C 2 2g de O2 78 g de N2 0. En 00 g de aire hay: = 0, 656 de O 2 ; = 2, 786 de N 32, 0 g 2 28, 0 g g de Ar y = 0, 025de Ar 39, 9 g E número de es tota será: (0, , ,025) = 3,436 es Y as fracciones ares de cada gas son:
7 3 0, 625 2, 786 0, 025 χ(o 2) = = 0,8 ; χ(n 2) = = 0,8 ; χ(ar) = = 0,0 3, 436 3, 436 3, 436 Souciones a os ejercicios de os apuntes: m m A.- Como n = p V = R T M M Despejando M queda: m R T 32 g 0,082 atm 323 K 760 mm Hg M = = = p V K 6, mm Hg atm B.- Despejando e voumen: n R T 0,082 atm 273 K V = = = p K atm 22,4 itros g 32 E voumen de un (V/n) se denomina voumen ar, que se expresa como 22,4 / y es idéntico para todos os gases ta y como indica a hipótesis de Avogadro. m C.- Como: n = M (C H ) 4 0 m R T m d R T M = y como a densidad: d = M = p V V p d R T,7 g 0,082 atm 384,5 K 760 mm Hg g M = p = K 640 mm Hg atm = 58 que coincide con e vaor numérico cacuado a partir de M at : M (C 4 H 0 ) = 4 M at (C) +0 M at (H)= 4 2 u + 0 u = 58 u m 20g m 30g D.- a) n (C2H6O) = 0, 43 ; n (C 3H6O) 0, 52 M = 46g = = M = 58g = p(c H O) p(c H O) n(c H O) R T 0,43 0,082 atm 423 K V K 3 = 2 6 = = n(c H O) R T 0,52 0,082 atm 423 K V K 3 = 3 6 = = b) tota p = p(c H O) + p (C H O) = 5, 03atm + 5, 98atm =,0 atm c) ntota = n(c2h6o) + n (C3H6O) = 0, , 52 = 0, 95 n(c2h6o) 2 6 χ 3 6 n(c3h 6 tota tota 5,03 atm 5,98 atm 043, O) 052, χ(c H O)= = = 0,45 ; (C H O)= = = 0,55 n 095, n 095, Podemos comprobar que as presiones parciaes de cada gas pueden obtenerse mutipicando a presión tota por cada fracción ar respectiva.
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2014 La fórmula empírica de un compuesto orgánico es C 4 H 8 S. Si su masa molecular es 88, determine:
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO. Nombre Grupo Matrícula PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P)
 Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
Etapa 4 GASES SUS LEYES Y COMPORTAMIENTO Nombre Grupo Matrícula PROPIEDADES DE LOS GASES: I. Completa correctamente la siguiente tabla. PROPIEDAD DESCRIPCIÓN UNIDADES DE MEDICION PRESION (P) VOLUMEN (V)
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
Estequiometría y Leyes Ponderales
 Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
GASES IDEALES. 1 atm = 760 mmhg = 760 Torr = 1013 hpa
 GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
GASES IDEALES Para comprender los problemas de este capítulo es necesario leer previamente la Teoría Cinética de los Gases, el concepto de Variables de Estado y las Leyes de los Gases. Ecuación general
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2012 Se disponen de tres recipientes que contienen en estado gaseoso 1 L de metano, 2 L de nitrógeno
Unidad 0 CÁLCULOS QUÍMICOS. Unidad 0. Cálculos químicos
 Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
Unidad 0 CÁLCULOS QUÍMICOS Unidad 0. Cálculos químicos 1 0. Leyes ponderales Leyes que rigen las combinaciones químicas. Se basan en la experimentación y miden cuantitativamente la cantidad de materia
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón. Trabajo Práctico: Leyes de los gases
 Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
Instituto Carlos Tejedor Educación Secundaria Fisicaquímica Segundo año A Profesor Carlos Castañón Trabajo Práctico: Leyes de los gases 1) La ley de Boyle establece que, a temperatura constante, la presión
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
Leyes de los gases. Ley de Gay-Lussac o del volumen constante. Ecuación de estado de los gases ideales p? V = n? R? T. volumen molar densidad del gas
 PRESENACIÓN OS GASES PRESENACIÓN Esta unidad se centra en el estudio de los gases y sus leyes. Dentro de cada ley se ha establecido la misma metodología. Primero se introduce una breve explicación sobre
PRESENACIÓN OS GASES PRESENACIÓN Esta unidad se centra en el estudio de los gases y sus leyes. Dentro de cada ley se ha establecido la misma metodología. Primero se introduce una breve explicación sobre
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
GASES IDEALES. P. V = n. R. T
 GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
GASES IDEALES Lic. Lidia Iñigo A esta altura de tus estudios seguramente ya sabés que hay muchas sustancias formadas por moléculas, qué es una molécula, y que una sustancia determinada puede presentarse
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
GASES 09/06/2011. La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: La atmósfera
 La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
La Tierra está rodeada por una mezcla de gases que se denomina atmósfera, cuya composición es la siguiente: GASES Nitrógeno 78% Oxígeno 21% Otros gases 1% La atmósfera también almacena otros gases Vapor
MAGNITUDES MOLARES COMPOSICIÓN DE LAS DISOLUCIONES. Actividad 7. Actividad 1. Actividad 8. Actividad 2. Actividad 9. Actividad 3.
 MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
MAGNITUDES MOLARES {Respuesta: [a] 0, mol; [b] 0,82 mol; [c] 0,56 mol} Actividad [a] En qué se parecen y en qué se diferencian las siguientes magnitudes: masa molecular relativa y masa molar? [b] Calcula
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS
 I E S M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS Índice general 1. El átomo y el enlace 6 2. Leyes básicas de la Química 9 b1fq-res-atomo.tex 1. El átomo y el enlace Unidad
I E S M A R I A N O B A Q U E R O DPTO. DE FÍSICA Y QUÍMICA EJERCICIOS RESUELTOS Índice general 1. El átomo y el enlace 6 2. Leyes básicas de la Química 9 b1fq-res-atomo.tex 1. El átomo y el enlace Unidad
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES
 TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
TEORICO-PRÁCTICO N 5: LEYES DE LOS GASES IDEALES FUNDAMENTO TEÓRICO: La materia puede estar en tres estados: sólido, líquido y gaseoso. Los gases, no tienen forma ni volumen fijo, las fuerzas que mantienen
UNIDAD 3 ESTADO GASEOSO
 UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
UNIDAD DIDÁCTICA 3 UNIDAD 3 ESTADO GASEOSO En la naturaleza, las sustancias se puede presentar en tres diferentes estados de agregación: sólido, líquido y gaseoso, cada uno de los cuales se distingue por
Ley de Boyle. A temperatura constante, el volumen de una muestra dada de gas es inversamente proporcional a su presión
 LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
LOS GASES Un gas es una porción de materia cuya forma y volumen son variables ya que se adaptan a la del recipiente que lo contiene, el cual ocupan totalmente. LEYES DE LOS GASES Ley de Boyle Robert Boyle,
Soluciones. DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I)
 Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
Soluciones DESCRIPCION MACROSCOPICA DE UN GAS IDEAL (Serway, Cap 19, vol I) 1. Demuestre que 1 mol de cualquier gas a presión atmosférica de 101 kpa y temperatura de 0ºC ocupa un volumen de 22,4 L. n =
ESTEQUIOMETRÍA. 3.- LEYES VOLUMÉTRICAS: 3.1. Ley de los volúmenes de combinación de gases o de Gay-Lussac. 3.2. Ley de Avogadro.
 ESTEQUIOMETRÍA 1.- ECUACIONES. SÍMBOLOS Y FÓRMULAS QUÍMICAS. 2.- LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS: 2.1. Ley de la conservación de la masa o de Lavoisier. 2.2. Ley de las proporciones constantes
ESTEQUIOMETRÍA 1.- ECUACIONES. SÍMBOLOS Y FÓRMULAS QUÍMICAS. 2.- LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS: 2.1. Ley de la conservación de la masa o de Lavoisier. 2.2. Ley de las proporciones constantes
2.6 Prismas y paralelepípedos
 UNIDAD Geometría.6 Prismas y paraeepípedos 5.6 Prismas y paraeepípedos OBJETIVOS Cacuar e área atera y e área tota de prismas rectos. Cacuar e voumen de prismas rectos. Resover probemas de voúmenes en
UNIDAD Geometría.6 Prismas y paraeepípedos 5.6 Prismas y paraeepípedos OBJETIVOS Cacuar e área atera y e área tota de prismas rectos. Cacuar e voumen de prismas rectos. Resover probemas de voúmenes en
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Física y química 1º bachillerato
 TEMA 2: GASES. PROPIEDADES. LEYES. TEORIA CINETICO-MOLECULAR. 1.- Estados de agregación de la materia. Cambios de estado. 2.- Teoría cinético-molecular. 3.- Leyes de los gases. 3.1. Ley de Boyle-Mariotte.
TEMA 2: GASES. PROPIEDADES. LEYES. TEORIA CINETICO-MOLECULAR. 1.- Estados de agregación de la materia. Cambios de estado. 2.- Teoría cinético-molecular. 3.- Leyes de los gases. 3.1. Ley de Boyle-Mariotte.
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA 1. Sustancias, mezclas y combinaciones La materia puede aparecer en dos formas: Homogénea, cuando sus propiedades y su composición son idénticas en cualquier
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA 1. Sustancias, mezclas y combinaciones La materia puede aparecer en dos formas: Homogénea, cuando sus propiedades y su composición son idénticas en cualquier
La uma, por ser una unidad de masa, tiene su equivalencia en gramos:
 UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
UNIDAD 2 Magnitudes atómico-moleculares Introducción Teórica La masa de un átomo depende del átomo en cuestión, es decir del número de protones y neutrones que contenga su núcleo. Dicha magnitud es muy
LEY DE BOYLE: A temperatura constante, el volumen (V) que ocupa una masa definida de gas es inversamente proporcional a la presión aplicada (P).
 CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
CÁTEDRA: QUÍMICA GUÍA DE PROBLEMAS N 3 TEMA: GASES IDEALES OBJETIVO: Interpretación de las propiedades de los gases; efectos de la presión y la temperatura sobre los volúmenes de los gases. PRERREQUISITOS:
ASPECTOS CUANTITATIVOS EN QUÍMICA
 5 ASPECTOS CUANTITATIVOS EN QUÍMICA SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Cantidades en Química. La masa atómica de la plata que encontramos en las tablas es de 07,87 u. Determina la abundancia
5 ASPECTOS CUANTITATIVOS EN QUÍMICA SOLUCIONES A LAS ACTIVIDADES DE FINAL DE UNIDAD Cantidades en Química. La masa atómica de la plata que encontramos en las tablas es de 07,87 u. Determina la abundancia
F A P = F A ESTADOS DE LA MATERIA ESTADO GASEOSO PROPIEDADES DE LOS GASES
 ESTADO GASEOSO ROIEDADES DE LOS GASES ESTADOS DE LA MATERIA Estados de la materia Sólido Líquido Gaseoso Bibliografía: Química la Ciencia Central - T.Brown, H.Lemay y B. Bursten. Química General - McMurry-Fay
ESTADO GASEOSO ROIEDADES DE LOS GASES ESTADOS DE LA MATERIA Estados de la materia Sólido Líquido Gaseoso Bibliografía: Química la Ciencia Central - T.Brown, H.Lemay y B. Bursten. Química General - McMurry-Fay
todoesquimica.bligoo.cl
 todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
todoesquimica.bligoo.cl Ley de conservación de la masa (Lavoisier) Ley de proporciones definidas (Proust) Ley de proporciones múltiples (Dalton). Ley de proporciones recíprocas (Ritcher) Ley de volúmenes
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
LEY CERO DE LA TERMODINÁMICA Y TEMPERATURA.
 ara aprender Termodinámica resolviendo problemas Silvia érez Casas RESIÓN. F La presión se define como:. La presión ejercida por un gas se debe al A incesante choque de las moléculas que lo constituyen
ara aprender Termodinámica resolviendo problemas Silvia érez Casas RESIÓN. F La presión se define como:. La presión ejercida por un gas se debe al A incesante choque de las moléculas que lo constituyen
CONCEPTOS BÁSICOS EN QUÍMICA
 CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
CONCEPTOS BÁSICOS EN QUÍMICA MOLES, ÁTOMOS Y MOLÉCULAS 1.-/ Calcule la masa molar de las siguientes sustancias: a) Disulfuro de carbono. b) Óxido de nitrógeno (III). c) Hidróxido de berilio. d) Carbonato
Seminario de Química 2º Bachillerato LOGSE Unidad 0: Repaso Química 1º Bachillerato
 A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
A) Composición Centesimal y Fórmulas químicas 1.- Determina la composición centesimal del Ca3(PO4)2. Datos: Masas atómicas (g/mol): Ca=40; P=31; O=16 S: Ca= 38,7%; P=20%; O=41,3% 2.- Determina la composición
LEYES FUNDAMENTALES DE LA QUÍMICA
 CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
CONTENIDOS LEYES FUNDAMENTALES DE LA QUÍMICA 1.- La Química en la antigüedad. La Alquimia. 2.- Sustancias homogéneas y heterogéneas. Elementos y compuestos. (Repaso)..- Leyes fundamentales de la Química..1.
LABORATORIO DE FISICOQUIMICA. PRACTICA No. 1 PROPIEDADES DE LOS GASES
 LABORAORIO DE FISICOQUIMICA RACICA No. 1 ROIEDADES DE LOS GASES OBJEIVOS. Al terminar la práctica el alumno será capaz de: 1. Comprobar experimentalmente la ley de Boyle. 2. Comprobar experimentalmente
LABORAORIO DE FISICOQUIMICA RACICA No. 1 ROIEDADES DE LOS GASES OBJEIVOS. Al terminar la práctica el alumno será capaz de: 1. Comprobar experimentalmente la ley de Boyle. 2. Comprobar experimentalmente
UNIVERSIDAD DE LEÓN. ESyTIA y EIIIIyA. Prof. Dr. Miguel Celemín Matachana. Dilatación térmica de los gases
 Cap. II: Termodinámica. Lección : Dilatación térmica de los gases Dilatación térmica de los gases La ecuación que proporciona la dilatación de un volumen no sirve para los gases si no se especifica la
Cap. II: Termodinámica. Lección : Dilatación térmica de los gases Dilatación térmica de los gases La ecuación que proporciona la dilatación de un volumen no sirve para los gases si no se especifica la
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
FÍSICA Y QUÍMICA -Valdepeñas de Jaén-
 Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de litio b) Carbonato de amonio c) 2,3-dimetilbutano d) Na 2 O 2 e) H 3 PO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CHO Res. a) Li 2 CrO 4 ; b)
Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de litio b) Carbonato de amonio c) 2,3-dimetilbutano d) Na 2 O 2 e) H 3 PO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CHO Res. a) Li 2 CrO 4 ; b)
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio
DEPARTAMENTO DE FISICA UNIVERSIDAD DE SANTIAGO DE CHILE GASES IDEALES
 INTRODUCCIÓN GASES IDEALES Las dos primeras unidades del programa de cuarto medio estudian temas estrechamente ligados entre si como lo es la teoría cinética, temperatura, calor, termodinámica. Abordaremos
INTRODUCCIÓN GASES IDEALES Las dos primeras unidades del programa de cuarto medio estudian temas estrechamente ligados entre si como lo es la teoría cinética, temperatura, calor, termodinámica. Abordaremos
Ley de los Gases Unidad II
 Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
Ley de los Gases Unidad II Introducción Presión Volumen Cantidad de gas Ley de Abogadro Enunciado Ejemplos Recurso Educaplus Ley de Boyle Enunciado Ejemplos Ley de Charles Enunciado Ejemplos Actividades
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
LEYES FUNDAMENTALES DE LA QUÍMICA SUSTANCIAS PURAS Cambios físicos Cambios Químicos TRANSFORMACIÓN No implican cambio de composición Ejemplo: Cambio de fase COMPUESTOS COMBINACIONES QUIMICAS DE ELEMENTOS
Unidad 4: Estado Gaseoso Introducción Teórica
 Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
Unidad 4: Estado Gaseoso Introducción Teórica En esta unidad vamos a ampliar y explicar algunas de las características del estado gaseoso que ya han sido tratadas en la Unidad 1, como por ejemplo la de
IES La Magdalena. Avilés. Asturias GASES
 GASES IES La adalena. Avilés. Asturias Teoría cinética de la materia ara poder explicar (ver preuntas más abajo) y entender el comportamiento de la materia, existe un modelo teórico que se basa en los
GASES IES La adalena. Avilés. Asturias Teoría cinética de la materia ara poder explicar (ver preuntas más abajo) y entender el comportamiento de la materia, existe un modelo teórico que se basa en los
FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN
 1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
LOS GASES Y SUS LEYES DE
 EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
EMA : LOS GASES Y SUS LEYES DE COMBINACIÓN -LAS LEYES DE LOS GASES En el siglo XII comenzó a investigarse el hecho de que los gases, independientemente de su naturaleza, presentan un comportamiento similar
Física y Química 1ºBachillerato Ejemplo Examen. Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Ioduro de Calcio:
 Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Física y Química 1ºBachillerato Ejemplo Examen Formulación. (1 puntos) Formula correctamente los siguientes compuestos: Óxido Fosfórico: Silano: Carburo Potásico: Ácido perclórico: Fosfato de Sodio: Hidruro
Ejercicios de la unidad didáctica 2.- Estados físicos de la materia: Estados de agregación de la materia
 Nombre y apellidos: Ejercicios de la unidad didáctica 2.- Estados físicos de la materia: Estados de agregación de la materia La materia puede presentarse en estado sólido, líquido o gaseoso. Son los llamados
Nombre y apellidos: Ejercicios de la unidad didáctica 2.- Estados físicos de la materia: Estados de agregación de la materia La materia puede presentarse en estado sólido, líquido o gaseoso. Son los llamados
INSTITUCION EDUCATIVA LA PRESENTACION
 INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: QUIMICA DOCENTE: OSCAR GIRALDO HERNANDEZ TIPO DE GUIA: CONCEPTUAL - EJERCITACION PERIODO
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: QUIMICA DOCENTE: OSCAR GIRALDO HERNANDEZ TIPO DE GUIA: CONCEPTUAL - EJERCITACION PERIODO
Gases. Sustancias que existen como gases a 1.0 atm y 25 C. Características físicas de los gases
 Sustancias que existen como gases a 1.0 atm y 25 C Gases Basado en Capítulo 5 de Química (Chang, 2007) Dr. Hernández-Castillo Características físicas de los gases Toman la forma y volumen de sus recipientes
Sustancias que existen como gases a 1.0 atm y 25 C Gases Basado en Capítulo 5 de Química (Chang, 2007) Dr. Hernández-Castillo Características físicas de los gases Toman la forma y volumen de sus recipientes
Solución: Según Avogadro, 1 mol de cualquier gas, medido en condiciones normales ocupa 22,4 L. Así pues, manteniendo la relación: =1,34 mol CH 4
 Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
Ejercicios Física y Química Primer Trimestre 1. Calcula los moles de gas metano CH 4 que habrá en 30 litros del mismo, medidos en condiciones normales. Según Avogadro, 1 mol de cualquier gas, medido en
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
TEMA 0: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. Calcule: a) Los moles de metano que quedan. b) Las moléculas
Materiales recopilados por la Ponencia Provincial de Química para Selectividad TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
TEMA 1: QUÍMICA DESCRIPTIVA EJERCICIOS DE SELECTIVIDAD 96/97 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano
III. ESTADOS DE LA MATERIA
 III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
Equilibrio de fases en sistemas mul2componentes. Dr. Abel Moreno Cárcamo Ins3tuto de Química, UNAM carcamo@unam.mx / abel.moreno@mac.
 Equiibrio de fases en sistemas mu2componentes Dr. Abe Moreno Cárcamo Ins3tuto de Química, UNAM carcamo@unam.mx / abe.moreno@mac.com DIAGRAMAS DE FASE DE SISTEMAS DE DOS COMPONENTES Un sistema de dos componentes
Equiibrio de fases en sistemas mu2componentes Dr. Abe Moreno Cárcamo Ins3tuto de Química, UNAM carcamo@unam.mx / abe.moreno@mac.com DIAGRAMAS DE FASE DE SISTEMAS DE DOS COMPONENTES Un sistema de dos componentes
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
TEMA I: REACCIONES Y ESTEQUIOMETRIA
 TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA I: REACCIONES Y ESTEQUIOMETRIA 1. De un recipiente que contiene 32 g de metano, se extraen 9 10 23 moléculas. a) Los moles de metano que quedan. b) Las moléculas de metano que quedan. c) Los gramos
TEMA 1. CONCEPTOS ELEMENTALES DE QUÍMICA. 1.- LA MATERIA.
 TEMA 1. CONCEPTOS ELEMENTALES DE QUÍMICA. 1. LA MATERIA. 2. SUSTANCIAS QUÍMICAS Y SUS FÓRMULAS. MASAS ATÓMICAS Y MOLECULARES. EL MOL. 2. LEYES PONDERALES DE LAS REACCIONES QUÍMICAS. 4. LEYES QUE RIGEN
TEMA 1. CONCEPTOS ELEMENTALES DE QUÍMICA. 1. LA MATERIA. 2. SUSTANCIAS QUÍMICAS Y SUS FÓRMULAS. MASAS ATÓMICAS Y MOLECULARES. EL MOL. 2. LEYES PONDERALES DE LAS REACCIONES QUÍMICAS. 4. LEYES QUE RIGEN
Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras
 Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras medir b. Litros c. Moles d. Kilogramos 2) Cuál es la
Parte I. Escoge la mejor contestación 1) Cuál es la unidad básica para medir cantidades de sustancias? a. Depende del tipo de sustancia que quieras medir b. Litros c. Moles d. Kilogramos 2) Cuál es la
EJERCICIOS Y CUESTIONES RESUELTAS DE COMPOSICIÓN CENTESIMAL Y FÓRMULAS QUÍMICAS
 EJERCICIOS Y CUESTIONES RESUELTAS DE COMPOSICIÓN CENTESIMAL Y FÓRMULAS QUÍMICAS Antes de que entréis en materia quiero daros unos consejos con el fin de que sepáis trabajar con ejercicios resuelto. 1.-
EJERCICIOS Y CUESTIONES RESUELTAS DE COMPOSICIÓN CENTESIMAL Y FÓRMULAS QUÍMICAS Antes de que entréis en materia quiero daros unos consejos con el fin de que sepáis trabajar con ejercicios resuelto. 1.-
Respuesta: a) La fracción molar de NaCl es 0,072 b) La concentración másica volumétrica de NaCl es 0,231 g/cc
 Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
Ejercicio 1: La densidad a 4 ºC de una solución acuosa de NaCl al 20% en peso es 1,155 g/cc a) Calcule la fracción molar de NaCl b) Calcule la concentración másica volumétrica de NaCl La masa molecular
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
TEMA 7: (productos de la reacción) por la reorganización de los átomos formando moléculas nuevas. Para ello es
 TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
TEMA 7: REACCIONES QUÍMICAS Una Reacción Química es un proceso mediante el cual unas sustancias (reactivos) se transforman en otras (productos de la reacción) por la reorganización de los átomos formando
Química 2º Bach. B Cálculos elementales 09/11/04 Nombre: Correo electrónico: Laboratorio. Problemas DEPARTAMENTO DE FÍSICA E QUÍMICA
 DEPARTAMENTO DE FÍSICA E QUÍMICA Química 2º Bach. B Cálculos elementales 09/11/04 Nombre: Correo electrónico: Problemas 1. Un recipiente cerrado de 10,0 dm 3 contiene butano gas a 2 0 C y 740 mmhg. Otro
DEPARTAMENTO DE FÍSICA E QUÍMICA Química 2º Bach. B Cálculos elementales 09/11/04 Nombre: Correo electrónico: Problemas 1. Un recipiente cerrado de 10,0 dm 3 contiene butano gas a 2 0 C y 740 mmhg. Otro
Fórmulas químicas y Composición Centesimal de un Compuesto químico. 1º bachillerato
 Fórmulas químicas y Composición Centesimal de un Compuesto químico. 1º bachillerato Hagamos una recapitulación de lo visto hasta el momento dentro de la Química: a) Conocemos las partículas y subpartículas
Fórmulas químicas y Composición Centesimal de un Compuesto químico. 1º bachillerato Hagamos una recapitulación de lo visto hasta el momento dentro de la Química: a) Conocemos las partículas y subpartículas
TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I).
 TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I). 1. Introducción. 2. Leyes de los gases ideales. Concepto de presión. Relación entre p y V de un gas. Ley de Boyle. Relación entre T y V de un gas.
TEMA 2.- ESTADOS DE AGREGACIÓN DE LA MATERIA. GASES (I). 1. Introducción. 2. Leyes de los gases ideales. Concepto de presión. Relación entre p y V de un gas. Ley de Boyle. Relación entre T y V de un gas.
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
Compuestos comunes que son gses a temperatura ambiente. Gases - propiedades macroscópicas
 Las propiedades químicas de un gas dependen de su naturaleza (elementos que lo forman y composición), sin embargo todos los gases tienen propiedades físicas marcadamente similares. Compuestos comunes que
Las propiedades químicas de un gas dependen de su naturaleza (elementos que lo forman y composición), sin embargo todos los gases tienen propiedades físicas marcadamente similares. Compuestos comunes que
Pv = nrt P T P T. Ing. Magno Cuba Atahua
 TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
TEORI CINÉTIC DE LOS GSES Un gas ideal es un gas cuyas moléculas están tan separadas que raramente chocan unas con otras. uesto que éste es el caso para cualquier gas real a baja ideales a baja densidad
UNIVERSIDAD NACIONAL SANTIAGO ANTÚNEZ DE MAYOLO
 UNIVERSIDAD NACIONAL SANTIAGO ANTÚNEZ DE MAYOLO DEPARTAMENTO ACADÉMICO CIENCIAS M. RAMÍREZ G. 1 Dr. Miguel RAMÍREZ GUZMÁN Teoría Cinética Molecular Ofrece un modelo para explicar las propiedades de los
UNIVERSIDAD NACIONAL SANTIAGO ANTÚNEZ DE MAYOLO DEPARTAMENTO ACADÉMICO CIENCIAS M. RAMÍREZ G. 1 Dr. Miguel RAMÍREZ GUZMÁN Teoría Cinética Molecular Ofrece un modelo para explicar las propiedades de los
Ud 5: Cálculos en circuitos neumáticos.
 4 Ud 5: Cálculos en circuitos neumáticos. Presión absoluta y relativa. Presión relativa, es el valor de la presión indicado por un manómetro, tomando como referencia cero la presión atmosférica ( Pat )
4 Ud 5: Cálculos en circuitos neumáticos. Presión absoluta y relativa. Presión relativa, es el valor de la presión indicado por un manómetro, tomando como referencia cero la presión atmosférica ( Pat )
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES.
 CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
CONTENIDOS BÁSICOS. HIPÓTESIS DE AVOGADRO, CANTIDAD DE MATERIA, LEY DE LOS GASES IDEALES. CUESTIONES E1S2013 La fórmula molecular del azúcar común o azúcar de mesa (sacarosa) es C12H22O11. Indique razonadamente
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS TEMA ESTADO GASEOSO GRADO DÉCIMO DOCENTE LAURA VERGARA
 COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS TEMA ESTADO GASEOSO GRADO DÉCIMO DOCENTE LAURA VERGARA PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA 1. A 1 atmosfera de presión y en recipientes
COLEGIO ROSARIO SANTO DOMINGO BANCO DE PREGUNTAS TEMA ESTADO GASEOSO GRADO DÉCIMO DOCENTE LAURA VERGARA PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA 1. A 1 atmosfera de presión y en recipientes
Dpto. de Física y Química 1º BCH FÍSICA Y QUÍMICA. Formulación:
 Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de plata b) Hidróxido de bismuto (III) c) 2,2-dimetilbutano d) K 2 O 2 e) PbHPO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CH 3 Res. a) Ag 2 CrO
Formulación: 0.- Formule o nombre los compuestos siguientes: a) Cromato de plata b) Hidróxido de bismuto (III) c) 2,2-dimetilbutano d) K 2 O 2 e) PbHPO 4 f) CH 2 =CHCH 2 CH 2 CH 2 CH 3 Res. a) Ag 2 CrO
Leyes de los gases ideales
 QUIMICA GENERAL 1 Leyes de los gases ideales La mayoría de las sustancias pueden existir en los tres estados de la materia, dependiendo el estado del sistema de la presión y de la temperatura. En muchos
QUIMICA GENERAL 1 Leyes de los gases ideales La mayoría de las sustancias pueden existir en los tres estados de la materia, dependiendo el estado del sistema de la presión y de la temperatura. En muchos
El modelo cinético molecular para un gas ideal
 El modelo cinético ecular para un gas ideal En 166, Robert Boyle encontró que el volumen de un gas a temperatura constante es proporcional al inverso de la presión ley de Boyle 1 (1) P En 1787, Jacques
El modelo cinético ecular para un gas ideal En 166, Robert Boyle encontró que el volumen de un gas a temperatura constante es proporcional al inverso de la presión ley de Boyle 1 (1) P En 1787, Jacques
Gases 8/12/2014. La estructura y presión de un gas. Presión Fuerza por unidad de área. Unidad en SI
 Gases La estructura y presión de un gas Los gases se componen de partículas que: se mueven rápidamente y al azar dentro de un envase. Viajan en linea recta hasta que chocan, empujan y rebotan. Ocupan todo
Gases La estructura y presión de un gas Los gases se componen de partículas que: se mueven rápidamente y al azar dentro de un envase. Viajan en linea recta hasta que chocan, empujan y rebotan. Ocupan todo
EJERCICIOS DE TERMOQUÍMICA.
 EJERCICIOS DE TERMOQUÍMICA. 1º.- A temperatura ambiente, el calor de formación del dióxido de carbono es de -94.030 cal/mol, y el calor de combustión del monóxido de carbono es de -67.410 cal/mol. Calcular
EJERCICIOS DE TERMOQUÍMICA. 1º.- A temperatura ambiente, el calor de formación del dióxido de carbono es de -94.030 cal/mol, y el calor de combustión del monóxido de carbono es de -67.410 cal/mol. Calcular
2003, Ernesto de Jesús Alcañiz
 2003, Ernesto de Jesús Alcañiz 5 Gases y líquidos 5.1 La teoría cinético-molecular de los gases 5.2 Predicciones de la teoría cinético-molecular 5.3 Los gases reales: ecuación de Van der Waals 5.4 Propiedades
2003, Ernesto de Jesús Alcañiz 5 Gases y líquidos 5.1 La teoría cinético-molecular de los gases 5.2 Predicciones de la teoría cinético-molecular 5.3 Los gases reales: ecuación de Van der Waals 5.4 Propiedades
6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23
![6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23 6. Cuál es el número total de átomos en 0,100 mol de [ Pt (NH 3 ) 2 Cl 2 ]? A. 11 B. 6,02 x 10 22 C. 3,01 x 10 23 D. 6,62 x 10 23](/thumbs/20/396963.jpg) 1. Cuál contiene mayor número de iones? A. 1 mol de Al 2 (SO 4 ) 3 B. 1 mol de Mg 3 (PO 4 ) 2 C. 2 moles de K 3 PO 4 D. 3 moles de NaNO 3 2. Cuántos átomos hay en 0,10 mol de PtCl 2 (NH 3 ) 2? A. 6,0 x
1. Cuál contiene mayor número de iones? A. 1 mol de Al 2 (SO 4 ) 3 B. 1 mol de Mg 3 (PO 4 ) 2 C. 2 moles de K 3 PO 4 D. 3 moles de NaNO 3 2. Cuántos átomos hay en 0,10 mol de PtCl 2 (NH 3 ) 2? A. 6,0 x
FÍSICA Y QUÍMICA 1º Bachillerato Ejercicios: Estequiometría (II)
 1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
1(7) Ejercicio nº 1 El metano arde con oxígeno produciendo dióxido de carbono y agua. Si se queman 2 kg de metano calcula: a) Los gramos de oxígeno necesarios. b) Los gramos de dióxido de carbono producidos.
Capítulo 10. Efectos de superficie. Sistema respiratorio
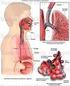 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Los gases y la Teoría Cinética
 2 Los gases y la Teoría Cinética Objetivos Antes de empezar En esta quincena aprenderás a: Distinguir los distintos estados de la materia. Sus Propiedades. Concretar el modelo de gas que vamos a utilizar.
2 Los gases y la Teoría Cinética Objetivos Antes de empezar En esta quincena aprenderás a: Distinguir los distintos estados de la materia. Sus Propiedades. Concretar el modelo de gas que vamos a utilizar.
Bases Físicas y Químicas del Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Universidad Pablo de Olavide- pág.
 Bases Físicas y Químicas de Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Uniersidad Pabo de Oaide- pág. 1 71. Apicamos Ley de Henry: C=K h.p 1º De os datos de soubiidad a P N2 = 1bar
Bases Físicas y Químicas de Medio Ambiente 2004/2005. Hoja 9 Corregida Área de Química-Física. Uniersidad Pabo de Oaide- pág. 1 71. Apicamos Ley de Henry: C=K h.p 1º De os datos de soubiidad a P N2 = 1bar
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 014 QUÍMICA TEMA 5: EQUILIBRIO QUÍMICO Junio, Ejercicio 3, Opción A Reserva 1, Ejercicio 3, Opción A Reserva 1, Ejercicio 6, Opción B Reserva, Ejercicio 5, Opción
LAS REACCIONES QUÍMICAS.
 1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
1 Ajustes de reacciones químicas. LAS REACCIONES QUÍMICAS. Ejercicios de la unidad 8 1.- Ajusta por tanteo las siguientes reacciones químicas: a) C 3 H 8 + O CO + H O; b) Na + H O NaOH + H ; c) KOH + H
