PROTOCOLO 2016 Enfermedad de Fabry
|
|
|
- Óscar Poblete Castro
- hace 7 años
- Vistas:
Transcripción
1 PROTOCOLO 2016 Enfermedad de Fabry Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo. Ley Subsecretaría de Salud Pública División de Prevención y Control de Enfermedades Departamento AUGE y de Coordinación Evidencial y Metodológica
2 2 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 La Ley Crea un Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo y otorga cobertura financiera universal a diagnósticos, medicamentos, dispositivos de uso médico y alimentos de alto costo de demostrada efectividad, de acuerdo a lo establecido en los Protocolos respectivos, garantizando que los mismos sean accesibles en condiciones de calidad y eficiencia.
3 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD Para mayor información sobre el manejo clínico de las personas con Enfermedad de Fabry, consulte el documento Orientaciones para el Manejo Clínico de la Enfermedad de Fabry disponible en
4 4 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 ÍNDICE DIAGRAMA DE FLUJO DE LA RED... 5 I. PROCESO CLÍNICO DE ATENCIÓN... 6 II. INTRODUCCIÓN... 9 III. OBJETIVO GENERAL... 9 IV. OBJETIVOS ESPECÍFICOS V. ÁMBITOS DE LA APLICACIÓN VI. POBLACIÓN OBJETIVO VII. DEFINICIONES VIII. MANEJO CLÍNICO IX. AUTORIZACIÓN DE COBERTURA DE TRATAMIENTOS X. REQUISITOS DE INFORMACIÓN BIBLIOGRAFÍA... 21
5 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD DIAGRAMA DE FLUJO DE LA RED
6 6 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 I. PROCESO CLÍNICO DE ATENCIÓN El proceso clínico considerado para las condiciones específicas de salud incorporadas a la Ley se encuentra establecido en las Orientaciones Técnicas, Protocolos, flujos de atención y documentos asociados para la implementación de la Ley. Las condiciones específicas de salud ingresadas en el decreto vigente pueden organizarse en dos grupos o flujos diferentes de acuerdo a la naturaleza de la garantía. El grupo de condiciones específicas de salud que requieren ser confirmadas por algún método diagnóstico, el cual también puede estar garantizado, y el otro grupo que ya cuenta con un diagnóstico y que están solicitando una terapia de segunda línea o de mayor complejidad terapéutica, para lo cual debe pasar por un Comité Técnico de Expertos que validará este requerimiento, de acuerdo a criterios establecidos en las orientaciones y protocolos. La Red de atención se organizará en cuatro etapas: I. Sospecha fundada II. Confirmación III. Tratamiento IV. Seguimiento I. Sospecha fundada Se generará por especialistas o subespecialistas, tanto públicos y privados, relacionados a la patología a diagnosticar. Esta etapa no está garantizada en la Ley, pero es esencial para dar inicio al proceso, dado que está fundamentada en los antecedentes clínicos del paciente más exámenes generales y específicos de la condición de salud.
7 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD La sospecha fundada deberá ser levantada por un prestador individual con registro de especialidad en la Superintendencia de Salud, de acuerdo a la patología en sospecha o un prestador institucional que cuente con los especialistas acreditados. II. Confirmación La etapa de confirmación de la Enfermedad de Fabry estará a cargo de un Prestador aprobado 1 que cuente con el examen Gold estándar, en este caso el criterio diagnóstico sería: - En hombres: Determinación de actividad enzimática de Alfa-galactosidasa A en leucocitos o fibroblastos. - En mujeres: Estudio molecular, que incluya la secuenciación en individuos sin mutación conocida y la búsqueda de mutaciones específicas, cuando se conoce la alteración familiar. Una vez confirmado, el tratante deberá notificar al paciente su calidad de Beneficiario de la Ley y emitir la receta para inicio de la terapia. III. Tratamiento Consiste en la entrega o administración del fármaco Agalsidasa (Galactosidasa Recombinante), por un prestador aprobado lo más cercano posible al domicilio del paciente. 1 Corresponde a cualquier persona natural o jurídica, establecimiento o institución, que se encuentre aprobada, conforme a lo dispuesto en el decreto N 54 del Ministerio de Salud de 2015, que aprueba Reglamento que Establece Normas para el Otorgamiento y Cobertura Financiera de los Diagnósticos y Tratamientos incorporados al sistema establecido en la Ley N
8 8 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 IV. Etapa de Seguimiento Esta etapa no está garantizada en la Ley, pero es fundamental para la integralidad del proceso de atención. Debe ser realizado por equipo multidisciplinario cada 6 a 12 meses, con la finalidad de controlar la evolución clínica y la respuesta al tratamiento farmacológico.
9 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD II. INTRODUCCIÓN La Enfermedad de Fabry (EF) es una enfermedad multisistémica, crónica, progresiva, de carácter hereditario, recesiva y ligada al cromosoma X. Es producida por un déficit de la actividad de la enzima alfa-galactosidasa, consecuencia de una mutación en el gen que codifica la proteína, en la región Xq22.1 del cromosoma X (1), determinando así el depósito de glucoesfingolípidos neutros, principalmente globotriaosilceramida (Gb3), el cual se acumula en los lisosomas de diversos tejidos, pero también en el retículo endoplásmico, la membrana y el núcleo de las células endoteliales vasculares, y de forma predominante en órganos como piel, riñón, corazón y sistema nervioso (2). Ésto puede causar una amplia gama de síntomas que afectan a todo el organismo, provocando una enfermedad grave y reduciendo la esperanza de vida entre los individuos afectados. En la literatura se han descrito los síntomas de esta enfermedad tanto en hombres como en mujeres, aunque la aparición de éstos pueden ser más tardíos y variables en las mujeres. La incidencia de la EF no es bien conocida, en Europa se ha observado 1 caso cada nacidos vivos (1: nacidos vivos hombres). (2,3) La EF es la segunda patología de depósito lisosomal más prevalente, después de la enfermedad de Gaucher. Según datos de Orphanet, en Europa la prevalencia estimada de la EF es de 2,22/ nacidos vivos. (4) III. OBJETIVO GENERAL Proporcionar un marco común para el manejo clínico de la Enfermedad de Fabry.
10 10 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 IV. OBJETIVOS ESPECÍFICOS - Estandarizar el diagnóstico de la Enfermedad de Fabry. - Estandarizar el tratamiento de la Enfermedad de Fabry. V. ÁMBITOS DE LA APLICACIÓN Dirigido a profesionales multidisciplinarios del equipo de salud que atienden personas con Enfermedad de Fabry. VI. POBLACIÓN OBJETIVO Personas con sospecha clínica fundada de Enfermedad de Fabry, mayores de 16 años, y menores de 16 años de acuerdo a criterios específicos. VII. DEFINICIONES La enfermedad de Fabry es un trastorno metabólico hereditario debido a mutaciones en el gen de la alfa-galactosidasa A (GLA), situado en el cromosoma X (Xq22.1), que originan un déficit de su actividad enzimática. Ésto determina el depósito de glucoesfingolípidos neutros (principalmente globotriaosilceramida -Gb3-), de forma prominente en lisosomas, pero también en el retículo endoplásmico, la membrana y el núcleo de las células endoteliales vasculares, y de forma predominante en órganos como piel, riñón, corazón y sistema nervioso. Es una enfermedad multisistémica grave que afecta a ambos sexos, cuyas manifestaciones clínicas (acroparestesias, trastornos de la sudoración, lesiones cutáneas como angioqueratomas, y manifestaciones gastrointestinales), pueden estar ya presentes en la infancia. El carácter progresivo de su evolución natural ocasiona una serie de complicaciones graves principalmente renales, cardiacas y cerebrovasculares que reducen la expectativa y calidad de vida. (2)
11 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD VIII. MANEJO CLÍNICO La garantía explícita de protección financiera en el tratamiento de la Enfermedad de Fabry comprende la confirmación diagnóstica y el medicamento de reemplazo enzimático, ya sea con Agalsidasa alfa o con Agalsidasa beta. La garantía de Oportunidad: Con sospecha clínica fundada, comenzará a hacer uso del beneficio específico de confirmación diagnóstica en un plazo no mayor a 30 días (personas sexo masculino, actividad enzimática en leucocitos; para mujeres, se debe contar con estudio molecular), desde la recepción del formulario de sospecha y muestra de sangre en institución confirmadora. Con confirmación diagnóstica, hará uso del beneficio específico de inicio de tratamiento en un plazo no mayor a 60 días, desde la indicación de terapia al paciente por parte del médico tratante. Continuidad, en conformidad a lo prescrito por el médico para el caso específico. Confirmación Diagnóstica En hombres: El Gold Standard para el diagnóstico definitivo es la demostración de la deficiencia enzimática severa en leucocitos. La actividad enzimática en plasma, determinada habitualmente en muestra obtenida en papel filtro, puede tener falsos negativos, por lo que es preferible la determinación Alfa-galactosidasa A en leucocitos o cultivos celulares, o realizar un estudio molecular del gen GLA. Se han descrito más de 500 mutaciones. En mujeres: La actividad enzimática dentro de rangos normales no descarta la condición, así como tampoco confirma el tener una actividad enzimática deficiente, lo que obliga a recomendar estudio molecular, que incluya la secuenciación en individuos sin mutación conocida y la búsqueda de mutaciones específicas, cuando se conoce la alteración familiar. Por tanto, se
12 12 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 recomienda realizar estudio enzimático y luego molecular en algún hombre sintomático de la familia antes de buscar la mutación en una mujer. En el caso de que no existan familiares hombres afectados conocidos, se debe proceder con el estudio genético. El diagnóstico prenatal es posible, se realiza entre la 10 a y 12 a semanas de gestación mediante una biopsia de las vellosidades coriales, o con el estudio de células obtenidas por amniocentesis entre la 15 a y 18 a semanas de gestación. (4) Tratamiento farmacológico El tratamiento específico de la Enfermedad de Fabry se realiza con terapia de reemplazo enzimático (TRE), específicamente con Agalsidasa alfa y Agalsidasa beta(4,5). Una vez confirmado el diagnóstico se propone que el inicio de la TRE sea evaluada caso a caso por el equipo multidisciplinario, considerando la presencia de criterios mayores y menores (Tabla 1)(6), así: - 1 criterio mayor. - 2 ó más criterios menores o, - Según progresión clínica.
13 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD Tabla 1: Criterios mayores y menores Enfermedad de Fabry Criterios Mayores - Compromiso cardíaco: miocardiopatía hipertrófica o arritmias o cardiopatía isquémica. - Compromiso renal: microalbuminuria o proteinuria o insuficiencia renal crónica (creatinina sérica > 1,5 mg/dl); biopsia renal compatible. - Compromiso neurológico: signos clínicos o neurorradiológicos de enfermedad cerebrovascular o dolor neuropático moderado a severo, recurrente o refractario a terapia sintomática. Criterios Menores - Dolor neuropático leve a moderado. - Dolor neuropático severo con buena respuesta al tratamiento farmacológico. - Hipohidrosis o trastornos de la termorregulación. - Hipoacusia o vértigo. - Angioqueratomas. - Trastornos gastrointestinales: diarrea y dolores abdominales típicos. - Córnea verticillata. - Retraso en la velocidad crecimiento pondoestatural. - Doppler transcreaneano anormal (disminución de las velocidades de flujo o ausencia de la vasoreactividad cerebral). - Test de cuantificación sensitivo (QST) anormal. - Resonancia magnética o TAC de cerebro alterados. - Ecocardiograma con Doppler tisular alterado. - Electrocardiograma anormal. En menores de 16 años, se recomienda considerar los siguientes criterios de ingreso a la terapia de reemplazo enzimático: - Dolor neuropático severo que no responde a 3 meses de uso de manejo óptimo de dolor. - Microalbuminuria persistente definida por la mediana de 3 muestras de orina matutinas consecutivas. - Proteinuria de 24 hrs > 250mg/día (considerar uso de inhibidores de ECA). - Índice de masa ventricular de VI >p Crisis Isquémicas Transitorias, Ataque Cerebro Vascular o Resonancia Nuclear Magnética de encéfalo que muestre lesiones en sustancia blanca (con manifestaciones clínicas o sub-clínicas).
14 14 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 En pacientes menores de 16 años con diagnóstico confirmado de Enfermedad de Fabry y que no cumplan con los criterios de ingreso a terapia de reemplazo enzimático, se recomienda incorporar a un programa de seguimiento, para detección temprana de la sintomatología. Administración: Agalsidasa Alfa: Dosis 0,2 mg/kg de peso. Vía Intravenosa. Velocidad de administración 40 minutos. Intervalo cada 2 semanas. Agalsidasa Beta: Dosis 1 mg /kg de peso. Vía Intravenosa. Velocidad de administración 15 mg/hora (inicial). Intervalo cada 2 semanas. Se recomienda la terapia coadyuvante según el escenario clínico, por ejemplo, estatinas y ácido acetilsalicílico para la reducción del riesgo tromboembólico, inhibidores de la enzima convertidora de angiotensina (IECA) o bloqueadores del receptor de la angiotensina (ARA II), para el manejo de la proteinuria e hipertensión arterial, y medicamentos antiepilépticos para el manejo del dolor neuropático. Instrucciones de preparación: Agalsidasa Alfa: Su forma farmacéutica es una solución transparente e incolora. Cada 1 ml de concentrado de solución para perfusión contiene 1 mg de agalsidasa alfa. Cada ampolla de 3,5 ml de concentrado contiene 3,5 mg de agalsidasa alfa.
15 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD Diluir el volumen total de concentrado de Agalsidasa alfa necesario en 100 ml de una solución de cloruro de sodio al 0,9%, usando técnica aséptica. Una vez diluida, la solución debe mezclarse suavemente, sin agitarla. Agalsidasa Beta: Su forma farmacéutica es en polvo blanco o blanquecino para perfusión. Cada frasco ampolla contiene 35 mg ó 5 mg de agalsidasa beta. La solución reconstituida tiene que diluirse posteriormente en una solución intravenosa de cloruro de sodio al 0,9%. Debe sacarse del refrigerador el número de frasco ampollas a utilizar y dejar que se estabilicen a temperatura ambiente (aproximadamente 30 minutos). Cada frasco ampolla es para un único uso. La dosis del paciente (en mg) 5 mg / ml = Número de ml reconstituido necesario para la dosis del paciente. Ejemplo: Paciente dosis = 80 mg, entonces, 80 mg 5 mg / ml = 16 ml reconstituidos. Reconstituya cada frasco ampolla de 35 mg con 7,2 ml de agua para preparaciones inyectables (Presentación de 5 mg reconstituir con 1,1 ml de agua para soluciones inyectables). Evite el impacto violento del agua estéril sobre el liofilizado y la formación de espuma. Ésto se consigue añadiendo lentamente el agua para preparaciones inyectables mediante goteo por la pared interior del frasco ampolla y no directamente sobre el liofilizado. Incline cada frasco ampolla con cuidado y hágalo rotar suavemente. No invierta ni agite el frasco ampolla. La solución, una vez reconstituida, contiene 5 mg de agalsidasa beta por ml, y presenta una apariencia transparente e incolora. Antes de diluirla, compruebe visualmente que la solución reconstituida de cada frasco ampolla no contenga partículas ni haya cambiado de color. No utilice la solución si observa partículas extrañas o cambios de color. Después de la reconstitución, se recomienda diluir rápidamente para minimizar la formación de partículas proteicas. Antes de añadir el volumen reconstituido necesario para la dosis del paciente, se recomienda retirar de la bolsa de perfusión un volumen equivalente de solución intravenosa de cloruro sódico al 0,9%. Elimine el aire contenido en la bolsa de perfusión para
16 16 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 minimizar la interfase aire/líquido. Invierta cuidadosamente o de un masaje suave a la bolsa de perfusión para mezclar la solución diluida. No sacuda ni agite excesivamente la bolsa de perfusión. Extraiga lentamente de cada frasco ampolla 7 ml (equivalentes a 35 mg), de solución reconstituida hasta completar el volumen necesario para la dosis del paciente. A continuación, inyecte lentamente la solución reconstituida directamente en la solución intravenosa de Cloruro de Sodio al 0,9% (evitando hacerlo en un espacio de aire), hasta una concentración final entre 0,05 mg/ml y 0,7 mg/ml. Determine el volumen total de solución para perfusión de cloruro de sodio al 0,9% (entre 50 y 500 ml) basándose en la dosis inicial. Para dosis inferiores a 35 mg use un mínimo de 50 ml, para dosis de 35 a 70 mg use un mínimo de 100 ml, para dosis de 70 a 100 mg use un mínimo de 250 ml y para dosis mayores de 100 mg use sólo 500 ml. Instrucciones de administración: En ausencia de estudios de compatibilidad, estos medicamentos no deben mezclarse con otros. No deben administrarse de forma concomitante con cloroquina, amiodarona, benoquina ni gentamicina, ya que estas sustancias pueden inhibir la actividad intracelular de alfa-galactosidasa. (7)(8) Agalsidasa Alfa: Administrar la solución para perfusión durante 40 minutos, utilizando una vía intravenosa con filtro incorporado. Agalsidasa Beta: Para la administración de la solución diluida, se recomienda usar un filtro en línea de 0,2 µm con baja unión a las proteínas plasmáticas para eliminar cualquier partícula proteica. La velocidad inicial de perfusión no debe exceder de 0,25 mg/min (15 mg/hora), para reducir al mínimo la posibilidad de que se produzcan reacciones asociadas con la perfusión. Una vez se haya determinado la tolerancia del paciente, la velocidad de perfusión puede aumentarse gradualmente en las perfusiones posteriores.
17 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD Dentro de las reacciones adversas relacionadas con la perfusión informadas con más frecuencia han sido calosfríos, enrojecimiento, y fiebre leve y aumento de la fatiga después de terminar infusión. (7) La perfusión puede interrumpirse temporalmente (de 5 a 10 minutos), hasta que los síntomas remitan, momento en que podrá reanudarse la perfusión. Los efectos leves y transitorios pueden no precisar tratamiento médico ni interrupción de la perfusión. Por otra parte, la administración previa por vía oral o intravenosa de antihistamínicos o corticosteroides, antipiréticos de 1 a 24 horas antes de la perfusión, puede evitar reacciones posteriores en aquellos casos en los que ha sido preciso un tratamiento sintomático. Acciones a considerar si se presentan efectos adversos graves (2): - Identificar otros factores desencadenantes. - Valorar si la premedicación es insuficiente o inadecuada. - Aumentar tiempo de infusión. - Identificar anticuerpos antienzima. - Cambiar de medicación. - Suspender el tratamiento. Almacenamiento: Desde el punto de vista microbiológico el medicamento debe utilizarse inmediatamente. La solución reconstituida no se debe almacenar y debería diluirse rápidamente. La solución diluida se puede mantener un máximo de 24 horas a una temperatura entre 2 C y 8 C, a menos que la dilución se haya efectuado en condiciones asépticas controladas y validadas. (7)(8)
18 18 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 Seguimiento El seguimiento de las personas con Enfermedad de Fabry es responsabilidad de un equipo multidisciplinario (neurología, cardiología, nefrología, dermatología, oftalmología, otorrinolaringología, psiquiatría o psicología) (9), requiriendo controles cada seis meses, o anuales dependiendo de la presencia de signos de deterioro, además de un examen médico general antes de volver a estudiar, trabajar o realizar deporte, evaluando a su vez el rendimiento, grado de depresión, los hábitos y desarrollo somático. (11) En cuanto a exámenes se recomienda un examen neurológico una vez confirmado el diagnóstico, acompañado de una resonancia magnética cerebral, estudio neurocognitivo, y luego controles cada 6 meses. A nivel cardiológico junto con la evaluación inicial se sugiere realizar un ECG (electrocardiograma) y ecocardiograma, que deben repetirse a los seis meses, y al primer y segundo año desde la confirmación diagnóstica; Radiografía de tórax y Holter de ritmo cardiaco que se sugiere realizar nuevamente al primer año. (6) A nivel auditivo junto con el examen físico se recomienda hacer pruebas audiológicas. Para evaluar compromiso renal inicialmente se sugiere incluir: exámenes de orina completa, microalbuminuria, y proteinuria 24 horas, BUN, y depuración de creatinina en 24 horas. En cuanto a periodicidad, en personas con TRE y enfermedad renal crónica (ERC) se sugiere esta evaluación dependiendo de la etapa en la cual se encuentre el (la) paciente: etapas 1 y 2 cada 6 meses; etapa 3 cada 3 meses; etapa 4 y 5 mensual y en portadores asintomáticos se propone cada 2-3 años un control nefrológico. (11) Se recomienda que estas personas sean vistas por su médico tratante, al menos cada 6 meses desde el diagnóstico definitivo.
19 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD IX. AUTORIZACIÓN DE COBERTURA DE TRATAMIENTOS La autorización del tratamiento por parte del prestador se hará basándose en la evaluación técnica de los formularios de sospecha diagnóstica presentadas, requiriéndose para ello la siguiente documentación: Formulario de sospecha fundada. Fotocopia de Cédula de Identidad del paciente. Exámenes complementarios (sólo si son requeridos por la institución confirmadora). X. REQUISITOS DE INFORMACIÓN Requisitos de información para formularios que deberán ser digitados de manera electrónica en el sistema informático dispuesto por FONASA para el seguimiento del proceso asistencial de la Ley , al cual podrá acceder a través de la página web de Fonasa FORMULARIO DE SOSPECHA FUNDADA 1. Datos del paciente 2. Datos establecimiento de referencia 3. Evaluación clínica a) Evaluación visual b) Evaluación cardiaca c) Evaluación auditiva d) Evaluación respiratoria e) Evaluación neurológica f) Evaluación gastrointestinal g) Evaluación traumatológica 4. Otros antecedentes relevantes 5. Médico responsable del formulario 6. Equipo clínico a cargo en establecimiento de referencia 7. Equipo clínico a cargo
20 20 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD 2016 FORMULARIO CONFIRMACIÓN DIAGNÓSTICA 1. Datos del paciente 2. Datos Establecimiento de referencia 3. Confirmación 4. Datos de institución o comisión que confirma Institución que confirma Profesional responsable confirmación FORMULARIO SEGUIMIENTO Y EVALUACIÓN 1. Datos del paciente 2. Datos del Centro de Seguimiento 3. Seguimiento 4. Cronograma Seguimiento FORMULARIO SOLICITUD CAMBIO CENTRO DE ADMINISTRACIÓN DE TRATAMIENTO 1. Datos del paciente 2. Datos del Centro de Referencia 3. Datos Centro Administración de Tratamiento 4. Profesional responsable de la solicitud
21 PROTOCOLO ENFERMEDAD DE FABRY LEY MINISTERIO DE SALUD BIBLIOGRAFÍA 1. Ries M, Gupta S, Moore DF, Sachdev V, Quirk JM, Murray GJ, et al. Pediatric Fabry disease. Pediatrics Mar;115(3):e García de Lorenzo A. Consenso para el estudio y tratamiento de la enfermedad de Fabry. Fundación GETER. Med Clínica. 2011;137(4): Romero B, Ángel M, Mateos L y, De AG. Enfermedad de Fabry en España. Análisis de 24 casos. Med Clínica Jun 12;123(02): Orphanet. Prevalence of rare diseases: Bibliographic data Jul; Barba Romero MA, García de Lorenzo y Mateos A, Groupo Español de Estudio de FOS. [Fabry s disease in Spain. Study of 24 cases]. Med Clínica Jun 12;123(2): Carmen Varas, Griselda Gómez, Miguel Morales. Guía Clínica: consernso para Chile en enfedrmedad de Fabry. Rev Chil Neuro-Psiquiat. 2012;50(3): European Medicines Agency - Find medicine - Replagal [Internet]. [cited 2015 Dec 7]. Available from: ed_ jsp&mid=wc0b01ac058001d European Medicines Agency - Find medicine - Fabrazyme [Internet]. [cited 2015 Dec 7]. Available from: ed_ jsp&mid=wc0b01ac058001d Desnick RJ. Enzyme replacement therapy for Fabry disease: lessons from two alpha-galactosidase A orphan products and one FDA approval. Expert Opin Biol Ther Jul;4(7): Eng CM, Germain DP, Banikazemi M, Warnock DG, Wanner C, Hopkin RJ, et al. Fabry disease: Guidelines for the evaluation and management of multi-organ system involvement. Genet Med Sep;8(9): Constantin T, Székely A, Ponyi A, Gulácsy V, Ambrus C, Kádár K, et al. Management of Fabry disease. Orv Hetil Aug;151(31):
PROTOCOLO 2015 ENFERMEDAD DE FABRY
 PROTOCOLO 2015 ENFERMEDAD DE FABRY Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo. Ley 20.850 Subsecretaría
PROTOCOLO 2015 ENFERMEDAD DE FABRY Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo. Ley 20.850 Subsecretaría
MUCOPOLISACARIDOSIS I
 PROTOCOLO 2015 MUCOPOLISACARIDOSIS I Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo. Ley 20.850 Subsecretaría
PROTOCOLO 2015 MUCOPOLISACARIDOSIS I Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo. Ley 20.850 Subsecretaría
MANEJO CLÍNICO ENFERMEDAD DE FABRY. Orientaciones 2016
 Orientaciones 2016 MANEJO CLÍNICO ENFERMEDAD DE FABRY Subsecretaría de Salud Pública División de Prevención y Control de Enfermedades Departamento Secretaría AUGE y de Coordinación Evidencial y Metodológica
Orientaciones 2016 MANEJO CLÍNICO ENFERMEDAD DE FABRY Subsecretaría de Salud Pública División de Prevención y Control de Enfermedades Departamento Secretaría AUGE y de Coordinación Evidencial y Metodológica
PROTOCOLO 2016 Profilaxis de la Infección del Virus Respiratorio Sincicial con Palivizumab para prematuros con y sin diagnóstico de DBP
 Subsecretaría de Salud Pública División de Prevención y Control de Enfermedades Departamento AUGE y de Coordinación Evidencial y Metodológica PROTOCOLO 2016 Profilaxis de la Infección del Virus Respiratorio
Subsecretaría de Salud Pública División de Prevención y Control de Enfermedades Departamento AUGE y de Coordinación Evidencial y Metodológica PROTOCOLO 2016 Profilaxis de la Infección del Virus Respiratorio
FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA
 1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
1.3.1. FICHA TÉCNICA, ETIQUETADO Y PROSPECTO FICHA TÉCNICA MÓDULO 1. AGUA INYECCION GRIFOLS 1 1. NOMBRE DEL MEDICAMENTO Agua para Inyección Grifols 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Grifols Disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Profilaxis de la Infección del Virus Respiratorio Sincicial con Palivizumab para prematuros con DBP
 PROTOCOLO 2015 Profilaxis de la Infección del Virus Respiratorio Sincicial con Palivizumab para prematuros con DBP Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera
PROTOCOLO 2015 Profilaxis de la Infección del Virus Respiratorio Sincicial con Palivizumab para prematuros con DBP Para el Otorgamiento de las Prestaciones que cuentan con el Sistema de Protección Financiera
2 PROTOCOLO PALIVIZUMAB LEY MINISTERIO DE SALUD 2015
 2 PROTOCOLO PALIVIZUMAB LEY 20.850 - MINISTERIO DE SALUD 2015 La Ley 20.850 Crea un Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo y otorga cobertura financiera universal
2 PROTOCOLO PALIVIZUMAB LEY 20.850 - MINISTERIO DE SALUD 2015 La Ley 20.850 Crea un Sistema de Protección Financiera para Diagnósticos y Tratamientos de Alto Costo y otorga cobertura financiera universal
Enfermedad de Fabry. Análisis Familiar. Folleto de información para el paciente
 Enfermedad de Fabry Folleto de información para el paciente La enfermedad de Fabry es una patología rara, que actualmente tiene tratamiento Con este folleto esperamos dar respuesta a algunas de las preguntas
Enfermedad de Fabry Folleto de información para el paciente La enfermedad de Fabry es una patología rara, que actualmente tiene tratamiento Con este folleto esperamos dar respuesta a algunas de las preguntas
Protocolo sobre Plan Cuidados Ambulatorios para pacientes con Problemas de Salud con alto riesgo de Hospitalización CESFAM Santa Cecilia 2015
 Protocolo sobre Plan Cuidados Ambulatorios para pacientes con Problemas de Salud con alto riesgo de Hospitalización CESFAM Santa Cecilia 2015 Elaborado por: Nadia Villaroel Jaqueline Egaña Diana Silva
Protocolo sobre Plan Cuidados Ambulatorios para pacientes con Problemas de Salud con alto riesgo de Hospitalización CESFAM Santa Cecilia 2015 Elaborado por: Nadia Villaroel Jaqueline Egaña Diana Silva
- Como disolvente de medicamentos en polvo o liofilizados, previamente a su administración. - Como diluyente de soluciones y/o medicamentos.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables SERRACLINICS. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml contienen agua para preparaciones inyectables. ph: 5,0-7,0
Enfermedad de Fabry-Anderson 18 casos en Almería COMPLEJO HOSPITALARIO TORRECÁRDENAS
 18 casos en Almería UNIDAD DE GESTIÓN CLÍNICA DE NEFROLOGÍA UNIDAD DE GESTIÓN CLÍNICA DE NEFROLOGÍA COMPLEJO HOSPITALARIO TORRECÁRDENAS Introducción Descrita en 1898 por dos dermatólogos de forma independiente
18 casos en Almería UNIDAD DE GESTIÓN CLÍNICA DE NEFROLOGÍA UNIDAD DE GESTIÓN CLÍNICA DE NEFROLOGÍA COMPLEJO HOSPITALARIO TORRECÁRDENAS Introducción Descrita en 1898 por dos dermatólogos de forma independiente
Condiciones para acceder al Sistema de Protección Financiera (SPF) para Diagnósticos y Tratamientos de Alto Costo.
 Condiciones para acceder al Sistema de Protección Financiera (SPF) para Diagnósticos y Tratamientos de Alto Costo. Este documento tiene por objeto comunicarle las condiciones establecidas en el Sistema
Condiciones para acceder al Sistema de Protección Financiera (SPF) para Diagnósticos y Tratamientos de Alto Costo. Este documento tiene por objeto comunicarle las condiciones establecidas en el Sistema
Concepción, marzo 01 de Estimado Afiliado:
 Concepción, marzo 01 de 2016 Estimado Afiliado: De acuerdo a las instrucciones impartidas por la Superintendencia de Salud, informamos la creación del nuevo Sistema de Protección Financiera, según Ley
Concepción, marzo 01 de 2016 Estimado Afiliado: De acuerdo a las instrucciones impartidas por la Superintendencia de Salud, informamos la creación del nuevo Sistema de Protección Financiera, según Ley
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Atosiban NORMON 7,5 mg/ ml solución inyectable EFG. Atosiban
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Atosiban NORMON 7,5 mg/ ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información
PROSPECTO: INFORMACIÓN PARA EL USUARIO Atosiban NORMON 7,5 mg/ ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene información
Farmacología a de la insuficiencia cardiaca
 Farmacología a de la insuficiencia cardiaca En la insuficiencia cardiaca, el corazón n es incapaz de mantener un volumen minuto adecuado, en relación n con el retorno venoso y con las necesidades tisulares
Farmacología a de la insuficiencia cardiaca En la insuficiencia cardiaca, el corazón n es incapaz de mantener un volumen minuto adecuado, en relación n con el retorno venoso y con las necesidades tisulares
SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO
 70 SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO 10 Introducción: El Síndrome Hemolítico Urémico Atípico (SHUa) es una enfermedad ultra rara que afecta principalmente a los riñones pero también puede afectar a otros
70 SÍNDROME HEMOLÍTICO URÉMICO ATÍPICO 10 Introducción: El Síndrome Hemolítico Urémico Atípico (SHUa) es una enfermedad ultra rara que afecta principalmente a los riñones pero también puede afectar a otros
Composición. Cada 100 ml de solución contiene: cloruro de sodio 10 g. agua para inyectables c.s.p. 100 ml. Proporciona meq/ml:
 Composición Cada 100 ml de solución contiene: cloruro de sodio 10 g agua para inyectables c.s.p. 100 ml Proporciona meq/ml: 1 / 13 sodio 1,711 Cloruro 1,711 Osmolaridad 3,422 mosmol/ml. Acción farmacológica
Composición Cada 100 ml de solución contiene: cloruro de sodio 10 g agua para inyectables c.s.p. 100 ml Proporciona meq/ml: 1 / 13 sodio 1,711 Cloruro 1,711 Osmolaridad 3,422 mosmol/ml. Acción farmacológica
SODIOFOLIN 50 mg/ml solución para inyección o perfusión intravenosa
 L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
L e a t o d o e l p r o s p e c t o d e t e n i d a m e n t e a n t e s d e e m p e z a r En este prospecto 1. Qué es Sodiofolin 50 mg/ml solución para inyección o perfusión intravenosa y para qué se utiliza
Qué es la enfermedad de Fabry?
 Qué es la enfermedad de Fabry? FOLLETO PARA PACIENTES CON ENFERMEDAD DE FABRY Información sobre la enfermedad de Fabry Este folleto ha sido realizado con la colaboración de Shire Pharmaceuticals Ibérica,
Qué es la enfermedad de Fabry? FOLLETO PARA PACIENTES CON ENFERMEDAD DE FABRY Información sobre la enfermedad de Fabry Este folleto ha sido realizado con la colaboración de Shire Pharmaceuticals Ibérica,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Dolovet vet 2,4 g polvo para uso oral. 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Principio(s) activo(s): Ketoprofeno
PROTOCOLO PILOTO GES MINISTERIO DE SALUD Subsecretaría de Salud Pública División de prevención y Control de Enfermedades Secretaría Técnica GES
 PROTOCOLO PILOTO GES 2008 Prevención Secundaria de la Insuficiencia renal crónica Terminal Documento de Trabajo MINISTERIO DE SALUD División de prevención y Control de Enfermedades Secretaría Técnica GES
PROTOCOLO PILOTO GES 2008 Prevención Secundaria de la Insuficiencia renal crónica Terminal Documento de Trabajo MINISTERIO DE SALUD División de prevención y Control de Enfermedades Secretaría Técnica GES
FICHA TÉCNICA. MENCEVAX AC es una preparación liofilizada de polisacáridos purificados de Neisseria meningitidis (meningococo) de los grupos A y C.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MENCEVAX AC Vacuna de polisacáridos meningocócicos, grupos A y C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. MENCEVAX AC es una preparación liofilizada de polisacáridos
FICHA TÉCNICA. Solución transparente e incolora, sin partículas visibles, estéril y apirógena.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de sodio 0,9% PHYSAN solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Cada 100 ml de solución contienen: Cloruro de sodio 0,9 g - Composición
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Cloruro de sodio 0,9% PHYSAN solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Cada 100 ml de solución contienen: Cloruro de sodio 0,9 g - Composición
Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012
 Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
Fecha de publicación: 29 de marzo de 2012 - Categoría: MEDICAMENTOS USO HUMANO, SEGURIDAD.Referencia: MUH (FV), 05/2012 Se han producido casos de sobredosis con la administración IV de Perfalgan 10mg/ml
Enfermedad de Fabry. Update del tractament. Formació Continuada 2014 Societat Catalana de Nefrologia. JV Torregrosa. Hospital Clinic, Barcelona
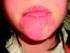 Enfermedad de Fabry Update del tractament Formació Continuada 2014 Societat Catalana de Nefrologia Que es la Enfermedad de Fabry? Enfermedad de almacenamiento lisosomal La Enfermedad de Fabry, (Angioqueratoma
Enfermedad de Fabry Update del tractament Formació Continuada 2014 Societat Catalana de Nefrologia Que es la Enfermedad de Fabry? Enfermedad de almacenamiento lisosomal La Enfermedad de Fabry, (Angioqueratoma
Dr. Max Santiago Bordelois Abdo Esp. 2do Grado en Medicina Intensiva y Emergencias. Profesor Auxiliar CUBA
 Dr. Max Santiago Bordelois Abdo Esp. 2do Grado en Medicina Intensiva y Emergencias. Profesor Auxiliar CUBA Se presenta entre un 5 y 7 % del embarazo. TA diastólica > ó = a 110 mmhg en una toma aislada.
Dr. Max Santiago Bordelois Abdo Esp. 2do Grado en Medicina Intensiva y Emergencias. Profesor Auxiliar CUBA Se presenta entre un 5 y 7 % del embarazo. TA diastólica > ó = a 110 mmhg en una toma aislada.
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Prospecto: información para el paciente. Fisiológico B.Braun 0,9% Solución para perfusión
 Prospecto: información para el paciente Fisiológico B.Braun 0,9% Solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto ya que puede
Prospecto: información para el paciente Fisiológico B.Braun 0,9% Solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto ya que puede
Guía de Práctica Clínica GPC. Terapia Inmunosupresora en el Trasplante Renal. Guía de Referencia Rápida
 Guía de Práctica Clínica GPC Terapia Inmunosupresora en el Trasplante Renal Guía de Referencia Rápida Número de Registro IMSS-112-08 Guía de Referencia Rápida Z94 Órganos y Tejidos Trasplantados GPC Terapia
Guía de Práctica Clínica GPC Terapia Inmunosupresora en el Trasplante Renal Guía de Referencia Rápida Número de Registro IMSS-112-08 Guía de Referencia Rápida Z94 Órganos y Tejidos Trasplantados GPC Terapia
Vehículo para la dilución y reconstitución de medicamentos por vía parenteral.
 agencia española de medicamentos y productos sanitarios FICHA TECNICA NOMBRE DEL MEDICAMENTO Agua para inyección Meinsol, disolvente para uso parenteral COMPOSICION Agua para inyección 1 g por 1 ml. Para
agencia española de medicamentos y productos sanitarios FICHA TECNICA NOMBRE DEL MEDICAMENTO Agua para inyección Meinsol, disolvente para uso parenteral COMPOSICION Agua para inyección 1 g por 1 ml. Para
Leidofs. Tabletas SAGARPA Q presentación 100 mg SAGARPA Q presentación 400 mg
 Leidofs Tabletas SAGARPA Q-7692-124 presentación 100 mg SAGARPA Q-7692-126 presentación 400 mg Frasco con 90 tabletas Frasco con 90 tabletas Fórmula Cada ml contiene: Gabapentina Excipiente cbp 100 y 400
Leidofs Tabletas SAGARPA Q-7692-124 presentación 100 mg SAGARPA Q-7692-126 presentación 400 mg Frasco con 90 tabletas Frasco con 90 tabletas Fórmula Cada ml contiene: Gabapentina Excipiente cbp 100 y 400
FICHA TÉCNICA. Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Meinsol, disolvente para uso parenteral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Agua para preparaciones inyectables 1 g por
80 enfermedades garantizadas
 1 80 enfermedades garantizadas El AUGE es un mecanismo fijado por Ley para priorizar garantías en la prevención, tratamiento y rehabilitación de enfermedades específicas que representan el mayor impacto
1 80 enfermedades garantizadas El AUGE es un mecanismo fijado por Ley para priorizar garantías en la prevención, tratamiento y rehabilitación de enfermedades específicas que representan el mayor impacto
13. Organización de la consulta con el paciente DM2
 13. Organización de la consulta con el paciente DM2 Las preguntas que se van a responder son: Cuáles son los criterios de derivación a consulta especializada que se proponen? Cuál es el estudio inicial
13. Organización de la consulta con el paciente DM2 Las preguntas que se van a responder son: Cuáles son los criterios de derivación a consulta especializada que se proponen? Cuál es el estudio inicial
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 25 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN BROMOCRIPTINA 4.2 Posología y forma
Guía Rápida GES. 22. Epilepsia No refractaria en Personas Desde 1 Año y Menores de 15 Años. Departamento GES de Redes Asistenciales
 Departamento GES de Redes Asistenciales División de Gestión de la Red Asistencial Gobierno de Chile Ministerio de Salud Guía Rápida GES 22. Epilepsia No refractaria en Personas Desde 1 Año y Menores de
Departamento GES de Redes Asistenciales División de Gestión de la Red Asistencial Gobierno de Chile Ministerio de Salud Guía Rápida GES 22. Epilepsia No refractaria en Personas Desde 1 Año y Menores de
Emergencia hipertensiva
 Asepeyo, Mutua de Accidentes de Trabajo y Enfermedades Profesionales de la Seguridad Social nº 151 Autores: Dirección de Asistencia Sanitaria Diseño Dirección de Comunicación www.asepeyo.es 1 Índice 1.
Asepeyo, Mutua de Accidentes de Trabajo y Enfermedades Profesionales de la Seguridad Social nº 151 Autores: Dirección de Asistencia Sanitaria Diseño Dirección de Comunicación www.asepeyo.es 1 Índice 1.
Ley Ley Ricarte Soto Sistema Informático. Colegio Médico 06 de Mayo de 2016
 Ley 20.850 Ley Ricarte Soto Sistema Informático Colegio Médico 06 de Mayo de 2016 cnavarro@fonasa.cl Sistema de Información Trazabilidad de los procesos Trazabilidad de Procesos Clínico - Asistencial Medicamento
Ley 20.850 Ley Ricarte Soto Sistema Informático Colegio Médico 06 de Mayo de 2016 cnavarro@fonasa.cl Sistema de Información Trazabilidad de los procesos Trazabilidad de Procesos Clínico - Asistencial Medicamento
Guía de Referencia Rápida. Diagnóstico y Tratamiento del Cor Pulmonale para el 1º,2º y 3º nivel de Atención Médica.
 Guía de Referencia Rápida Diagnóstico y Tratamiento del Cor Pulmonale para el 1º,2º y 3º nivel de Atención Médica. Guía de Referencia Rápida 127.9 Corazón pulmonar crónico. GPC Diagnóstico y tratamiento
Guía de Referencia Rápida Diagnóstico y Tratamiento del Cor Pulmonale para el 1º,2º y 3º nivel de Atención Médica. Guía de Referencia Rápida 127.9 Corazón pulmonar crónico. GPC Diagnóstico y tratamiento
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO
 ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
ANEXO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS EN RELACIÓN CON LA UTILIZACIÓN SEGURA Y EFICAZ DEL MEDICAMENTO CONDICIONES O RESTRICCIONES A IMPLEMENTAR EN LOS ESTADOS MIEMBROS
HIPERTENSION ARTERIAL
 HIPERTENSION ARTERIAL El propósito general de esta, como otras guías de práctica clínica, es disminuir la variabilidad de la práctica clínica, poniendo a disposición de los usuarios la síntesis de la evidencia
HIPERTENSION ARTERIAL El propósito general de esta, como otras guías de práctica clínica, es disminuir la variabilidad de la práctica clínica, poniendo a disposición de los usuarios la síntesis de la evidencia
Actualización de temas GINA Dra. Patricia Arizmendi Agosto 2014
 Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
Cloruro de sodio 0,9% Tecsolpar solución para perfusión. Ión sodio: 154 mmol/l (154 meq/l ), ión cloruro: 154 mmol/l ( 154 meq/l)
 1. NOMBRE DEL MEDICAMENTO Cloruro de sodio 0,9% Tecsolpar solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio 0,9 g Composición iónica:
1. NOMBRE DEL MEDICAMENTO Cloruro de sodio 0,9% Tecsolpar solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada 100 ml de solución contienen: Cloruro de sodio 0,9 g Composición iónica:
Análisis de impacto presupuestal de los agentes anti-inhibidor con actividad bypass para el control del sangrado agudo en pacientes con hemofilia e
 Análisis de impacto presupuestal de los agentes anti-inhibidor con actividad bypass para el control del sangrado agudo en pacientes con hemofilia e inhibidores 1 Grupo desarrollador Instituto de Evaluación
Análisis de impacto presupuestal de los agentes anti-inhibidor con actividad bypass para el control del sangrado agudo en pacientes con hemofilia e inhibidores 1 Grupo desarrollador Instituto de Evaluación
Hipertensión arterial Intervenciones básicas en infografías
 Hipertensión arterial Intervenciones básicas en infografías Fuentes: 1. Guía de práctica clínica sobre hipertensión arterial. Osakidetza, actualización 2007 2. PCAI Hipertensión Arterial Asturias, actualización
Hipertensión arterial Intervenciones básicas en infografías Fuentes: 1. Guía de práctica clínica sobre hipertensión arterial. Osakidetza, actualización 2007 2. PCAI Hipertensión Arterial Asturias, actualización
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Ancesol 10 mg/ml solución inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 ml contiene: Sustancia
PROTOCOLO DE HIPERTENSIÓN ARTERIAL. Cualquier persona que pertenezca a la zona de salud y que acuda al sistema sanitario por cualquier motivo.
 PROTOCOLO DE HIPERTENSIÓN ARTERIAL. 1. Objetivos. Detección y control de los hipertensos 2. Criterios de inclusión. 3. Captación. 4. Actividades. Cualquier persona que pertenezca a la zona de salud y que
PROTOCOLO DE HIPERTENSIÓN ARTERIAL. 1. Objetivos. Detección y control de los hipertensos 2. Criterios de inclusión. 3. Captación. 4. Actividades. Cualquier persona que pertenezca a la zona de salud y que
Hospital Clínico Universiterio Valladolid
 Hospital Clínico Universiterio Valladolid Teresa Gordaliza Rodríguez Ana Mª González Gutierrez Laura Morchón Alvarez Rosario Diéz Muñoz Mercedes Verano Moral. Ubeda, 10 de Octubre de 2008 : CASO CLÍNICO
Hospital Clínico Universiterio Valladolid Teresa Gordaliza Rodríguez Ana Mª González Gutierrez Laura Morchón Alvarez Rosario Diéz Muñoz Mercedes Verano Moral. Ubeda, 10 de Octubre de 2008 : CASO CLÍNICO
SERVICIO SALUD ARAUCANIA NORTE PROTOCOLO REFERENCIA CONTRARREFERENCIA EPILEPSIA PROTOCOLO DE REFERENCIA Y CONTRARREFERENCIA
 PROTOCOLO DE REFERENCIA Y RED ASISTENCIAL SERVICIO DE SALUD ARAUCANIA NORTE. OBJETIVOS: ESTABLECER UNA COORDINACION PARA LA DERIVACION ENTRE LA ATENCION PRIMARIA Y HOSPITALES COMUNITARIOS, HACIA LA ATENCION
PROTOCOLO DE REFERENCIA Y RED ASISTENCIAL SERVICIO DE SALUD ARAUCANIA NORTE. OBJETIVOS: ESTABLECER UNA COORDINACION PARA LA DERIVACION ENTRE LA ATENCION PRIMARIA Y HOSPITALES COMUNITARIOS, HACIA LA ATENCION
Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada
 ZYPADHERA Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada Instrucciones para la reconstitución y administración dirigido a Profesionales Sanitarios Información sobre
ZYPADHERA Olanzapina en polvo y disolvente para suspensión inyectable de liberación prolongada Instrucciones para la reconstitución y administración dirigido a Profesionales Sanitarios Información sobre
Potasio G.E.S. 0,02 meq/ml en cloruro de sodio 0.9% solución para perfusión
 Prospecto: información para el usuario Potasio G.E.S. 0,02 meq/ml en cloruro de sodio 0.9% solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Prospecto: información para el usuario Potasio G.E.S. 0,02 meq/ml en cloruro de sodio 0.9% solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
TRATAMIENTO INMUNOSUPRESOR AMBULATORIO PARA PACIENTES CON TRASPLANTE DE ÓRGANOS SÓLIDOS
 TRATAMIENTO INMUNOSUPRESOR AMBULATORIO PARA PACIENTES CON TRASPLANTE DE ÓRGANOS SÓLIDOS Realizada: Noviembre 2015 TRATAMIENTO INMUNOSUPRESOR AMBULATORIO PARA PACIENTES CON TRASPLANTE DE ÓRGANOS SÓLIDOS
TRATAMIENTO INMUNOSUPRESOR AMBULATORIO PARA PACIENTES CON TRASPLANTE DE ÓRGANOS SÓLIDOS Realizada: Noviembre 2015 TRATAMIENTO INMUNOSUPRESOR AMBULATORIO PARA PACIENTES CON TRASPLANTE DE ÓRGANOS SÓLIDOS
Paciente con aumento de enzimas musculares sintomáticos
 Paciente con aumento de enzimas musculares sintomáticos Dr. Andrés Nascimento Osorio Unidad de patología Neuromuscular, Servicio de Neurología. Hospital Sant Joan de Déu. U.B. Barcelona-Spain Aumento de
Paciente con aumento de enzimas musculares sintomáticos Dr. Andrés Nascimento Osorio Unidad de patología Neuromuscular, Servicio de Neurología. Hospital Sant Joan de Déu. U.B. Barcelona-Spain Aumento de
Prevención, diagnóstico y tratamiento del Pie Diabético en el primer nivel de atención
 Guía de Práctica Clínica GPC Prevención, diagnóstico y tratamiento del Pie Diabético en el Evidencias y recomendaciones Catálogo maestro de guias de práctica clínica: SSA-005-08 CIE 10 AE11.5: Diabetes
Guía de Práctica Clínica GPC Prevención, diagnóstico y tratamiento del Pie Diabético en el Evidencias y recomendaciones Catálogo maestro de guias de práctica clínica: SSA-005-08 CIE 10 AE11.5: Diabetes
PROSPECTO: INFORMACIÓN PARA EL USUARIO Cloruro de sodio Fresenius Kabi 5,84% solución inyectable
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Cloruro de sodio Fresenius Kabi 5,84% solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO Cloruro de sodio Fresenius Kabi 5,84% solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto, ya
Prevención de Progresión de la Enfermedad Renal Crónica en el paciente Diabético
 Prevención de Progresión de la Enfermedad Renal Crónica en el paciente Diabético Raul Plata-Cornejo Instituto de Nefrología La Paz - Bolivia Objetivos Reconocer a la DBT como una enfermedad crónica de
Prevención de Progresión de la Enfermedad Renal Crónica en el paciente Diabético Raul Plata-Cornejo Instituto de Nefrología La Paz - Bolivia Objetivos Reconocer a la DBT como una enfermedad crónica de
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
Santiago, O _6 E~t. 2m5
 supersalud.gob.cl: Intendencia de Fondos y Seguros Previsionales Subdepartamento de Regulación CIRCULAR IF/N 254 Santiago, O _6 E~t. 2m5 DEFINE E INSTRUYE USO DEL FORMULARIO DE NOTIFICACIÓN A LOS PACIENTES
supersalud.gob.cl: Intendencia de Fondos y Seguros Previsionales Subdepartamento de Regulación CIRCULAR IF/N 254 Santiago, O _6 E~t. 2m5 DEFINE E INSTRUYE USO DEL FORMULARIO DE NOTIFICACIÓN A LOS PACIENTES
Los fármacos aparecen por orden alfabético, y de cada uno de ellos se comentan brevemente sus
 Los fármacos aparecen por orden alfabético, y de cada uno de ellos se comentan brevemente sus como las precauciones más importantes que debemos adoptar en su manejo. Cada uno de estos apartados está enfocado
Los fármacos aparecen por orden alfabético, y de cada uno de ellos se comentan brevemente sus como las precauciones más importantes que debemos adoptar en su manejo. Cada uno de estos apartados está enfocado
INFECCIÓN DURANTE EL EMBARAZO, Prevención, Diagnóstico y Tratamiento de la. en el Primer Nivel de Atención DEL TRACTO URINARIO BAJO
 GUÍA DE PRÁCTICA CLÍNICA GPC Actualización 2016 Prevención, Diagnóstico y Tratamiento de la INFECCIÓN DEL TRACTO URINARIO AJO DURANTE EL EMARAZO, en el Primer Nivel de Atención Guía de Referencia Rápida
GUÍA DE PRÁCTICA CLÍNICA GPC Actualización 2016 Prevención, Diagnóstico y Tratamiento de la INFECCIÓN DEL TRACTO URINARIO AJO DURANTE EL EMARAZO, en el Primer Nivel de Atención Guía de Referencia Rápida
Enfermedad Renal Crónica en el SNS
 Jornadas de seguimiento de estrategias Enfermedad Renal Crónica en el SNS Del 29 al 30 de Noviembre de 2013 Palma de Mallorca PAPEC: Programa de Atención a Pacientes con Enfermedades Crónicas Amador Ruiz
Jornadas de seguimiento de estrategias Enfermedad Renal Crónica en el SNS Del 29 al 30 de Noviembre de 2013 Palma de Mallorca PAPEC: Programa de Atención a Pacientes con Enfermedades Crónicas Amador Ruiz
Potasio G.E.S. 0,04 meq/ml en cloruro de sodio 0,9% solución para perfusión
 Prospecto: información para el usuario Potasio G.E.S. 0,04 meq/ml en cloruro de sodio 0,9% solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Prospecto: información para el usuario Potasio G.E.S. 0,04 meq/ml en cloruro de sodio 0,9% solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROTOCOLO PARA REALIZAR CONSULTAS ADICIONALES POR SOSPECHA O DIAGNÓSTICO RECIENTE DE HIPERTENSIÓN ARTERIAL
 PROTOCOLO PARA REALIZAR CONSULTAS ADICIONALES POR SOSPECHA O DIAGNÓSTICO RECIENTE DE HIPERTENSIÓN ARTERIAL SUBJETIVO Completar historia de Factores de Riesgo Cardiovasculares: Historia Familiar (Hipertensión,
PROTOCOLO PARA REALIZAR CONSULTAS ADICIONALES POR SOSPECHA O DIAGNÓSTICO RECIENTE DE HIPERTENSIÓN ARTERIAL SUBJETIVO Completar historia de Factores de Riesgo Cardiovasculares: Historia Familiar (Hipertensión,
Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita.
 Pág. 1 de 5 Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita. El objetivo de esta alerta internacional es difundir información sobre la seguridad y eficacia
Pág. 1 de 5 Domperidona: pequeño aumento del riesgo de arritmias ventriculares graves o muerte cardiaca súbita. El objetivo de esta alerta internacional es difundir información sobre la seguridad y eficacia
Contenido del prospecto
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Fresenius Kabi solución para perfusión Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Fresenius Kabi solución para perfusión Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
FOLLETO DE INFORMACIÓN AL PACIENTE DOLGENAL SOLUCIÓN INYECTABLE 30mg/1mL
 FOLLETO DE INFORMACIÓN AL PACIENTE DOLGENAL SOLUCIÓN INYECTABLE 30mg/1mL DOLGENAL Ketorolaco Trometamol 30 mg/1 ml Solución inyectable Vía de Administración: I.M. - I.V. Venta bajo receta médica en establecimientos
FOLLETO DE INFORMACIÓN AL PACIENTE DOLGENAL SOLUCIÓN INYECTABLE 30mg/1mL DOLGENAL Ketorolaco Trometamol 30 mg/1 ml Solución inyectable Vía de Administración: I.M. - I.V. Venta bajo receta médica en establecimientos
PROTOCOLO PARA REALIZAR LA SEGUNDA CONSULTA POR SOSPECHA O DIAGNÓSTICO RECIENTE DE HIPERTENSIÓN ARTERIAL
 PROTOCOLO PARA REALIZAR LA SEGUNDA CONSULTA POR SOSPECHA O DIAGNÓSTICO RECIENTE DE HIPERTENSIÓN ARTERIAL SUBJETIVO Completar historia de Factores de Riesgo Cardiovasculares: Historia Familiar (Hipertensión,
PROTOCOLO PARA REALIZAR LA SEGUNDA CONSULTA POR SOSPECHA O DIAGNÓSTICO RECIENTE DE HIPERTENSIÓN ARTERIAL SUBJETIVO Completar historia de Factores de Riesgo Cardiovasculares: Historia Familiar (Hipertensión,
Recomendaciones para prevenir el ataque cerebrovascular (ACV) Viernes, 26 de Octubre de :22
 El control de factores de riesgo como la hipertensión arterial y la adopción de hábitos saludables por parte de la población son fundamentales para prevenir el Ataque Cerebrovascular (ACV), que provoca
El control de factores de riesgo como la hipertensión arterial y la adopción de hábitos saludables por parte de la población son fundamentales para prevenir el Ataque Cerebrovascular (ACV), que provoca
RECOMENDACIONES ACTUALES PARA LA VALORACIÓN DE LA FUNCIÓN RENAL EN PEDIATRÍA
 RECOMENDACIONES ACTUALES PARA LA VALORACIÓN DE LA FUNCIÓN RENAL EN PEDIATRÍA Blanca Valenciano Fuente Unidad de Nefrología Pediátrica Servicio de Pediatría CHUIMI Las Palmas de GC, 30 abril 2015 Valoración
RECOMENDACIONES ACTUALES PARA LA VALORACIÓN DE LA FUNCIÓN RENAL EN PEDIATRÍA Blanca Valenciano Fuente Unidad de Nefrología Pediátrica Servicio de Pediatría CHUIMI Las Palmas de GC, 30 abril 2015 Valoración
GLUCOCEMIN 33% Solución inyectable Glucosa monohidrato, 330 mg/ml
 PROSPECTO: INFORMACIÓN PARA EL USUARIO GLUCOCEMIN 33% Solución inyectable Glucosa monohidrato, 330 mg/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO GLUCOCEMIN 33% Solución inyectable Glucosa monohidrato, 330 mg/ml Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto,
Rol del laboratorio clínico en la pesquisa, control y tratamiento de la ERC. Dr. Carlos Zúñiga San Martín
 Rol del laboratorio clínico en la pesquisa, control y tratamiento de la ERC. Dr. Carlos Zúñiga San Martín Facultad de Medicina Universidad de Concepción Chile Objetivos de la Presentación 1.Revisar el
Rol del laboratorio clínico en la pesquisa, control y tratamiento de la ERC. Dr. Carlos Zúñiga San Martín Facultad de Medicina Universidad de Concepción Chile Objetivos de la Presentación 1.Revisar el
Síndrome de QT largo Lunes, 21 de Marzo de :38 - Actualizado Sábado, 15 de Octubre de :28
 Qué es el síndrome de QT largo? El síndrome de QT largo es la condición en la que una alteración en ciertos canales iónicos de las células del corazón da lugar a la prolongación del intervalo QT del electrocardiograma,
Qué es el síndrome de QT largo? El síndrome de QT largo es la condición en la que una alteración en ciertos canales iónicos de las células del corazón da lugar a la prolongación del intervalo QT del electrocardiograma,
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Suero Fisiológico Fresenius Kabi solución para perfusión. Cloruro de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Fresenius Kabi solución para perfusión Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
PROSPECTO: INFORMACIÓN PARA EL USUARIO Suero Fisiológico Fresenius Kabi solución para perfusión Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
Dr. Enrique Méndez Taylor Medicina Interna - Cardiología
 Dr. Enrique Méndez Taylor Medicina Interna - Cardiología 1. En los adultos con hipertensión,.mejoran los eventos de salud si se inicia la terapia farmacológica antihipertensiva a umbrales específicos de
Dr. Enrique Méndez Taylor Medicina Interna - Cardiología 1. En los adultos con hipertensión,.mejoran los eventos de salud si se inicia la terapia farmacológica antihipertensiva a umbrales específicos de
Síndrome periódico asociado a la criopirina (CAPS)
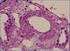 www.printo.it/pediatric-rheumatology/ar/intro Síndrome periódico asociado a la criopirina (CAPS) Versión de 2016 1. QUÉ SON LOS CAPS 1.1 En qué consiste? El síndrome periódico asociado a la criopirina
www.printo.it/pediatric-rheumatology/ar/intro Síndrome periódico asociado a la criopirina (CAPS) Versión de 2016 1. QUÉ SON LOS CAPS 1.1 En qué consiste? El síndrome periódico asociado a la criopirina
Necesidad de colaboración entre clínicos y patólogos en el abordaje del paciente con nefropatía lúpica Explicar las bases racionales y las
 Necesidad de colaboración entre clínicos y patólogos en el abordaje del paciente con nefropatía lúpica Explicar las bases racionales y las indicaciones de la biopsia renal en pacientes con NL Exponer los
Necesidad de colaboración entre clínicos y patólogos en el abordaje del paciente con nefropatía lúpica Explicar las bases racionales y las indicaciones de la biopsia renal en pacientes con NL Exponer los
Cloruro de Calcio Braun 100mg/ml Solución inyectable
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Cloruro de Calcio Braun 100mg/ml Solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto, ya que
PROSPECTO: INFORMACIÓN PARA EL USUARIO Cloruro de Calcio Braun 100mg/ml Solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto, ya que
Consejo de Salubridad General Identificación de tratamientos y medicamentos asociados a gastos catastróficos PROTOCOLO TÉCNICO
 Diagnóstico Unidad Médica con Pediatra, Hematólogo Estudios de laboratorio: Biometría hemática completa, con cuenta de plaquetas. Estudio de hemostasia: tiempo de trombina (TT), tiempo de sangrado, tiempo
Diagnóstico Unidad Médica con Pediatra, Hematólogo Estudios de laboratorio: Biometría hemática completa, con cuenta de plaquetas. Estudio de hemostasia: tiempo de trombina (TT), tiempo de sangrado, tiempo
Fabrazyme 5 mg polvo para concentrado para solución para perfusión
 Fabrazyme 5 mg polvo para concentrado para solución para perfusión 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de Fabrazyme contiene 5 mg de agalsidasa beta. Una vez
Fabrazyme 5 mg polvo para concentrado para solución para perfusión 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial de Fabrazyme contiene 5 mg de agalsidasa beta. Una vez
CONVULSIONES FEBRILES
 CONVULSIONES FEBRILES 1. ETIOLOGIA Se reconoce un componente genético importante (cromosomas 8 t 19) y una predisposición familiar, con posible patrón autonómico dominante. La fiebre que da origen a la
CONVULSIONES FEBRILES 1. ETIOLOGIA Se reconoce un componente genético importante (cromosomas 8 t 19) y una predisposición familiar, con posible patrón autonómico dominante. La fiebre que da origen a la
ACICLOVIR SALA 250 mg polvo para solución para perfusión EFG. Responsable de la fabricación:
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Competencias en el área de Nefrología
 COMPETENCIAS CLÍNICAS EN EL ÁREA DE NEFROLOGÍA NEF-. ASIGNATURA: NEFROLOGÍA 84. COMPETENCIAS MECES: Marco Español de Cualificaciones para la Educación Superior Competencia: Competencias básicas en el área
COMPETENCIAS CLÍNICAS EN EL ÁREA DE NEFROLOGÍA NEF-. ASIGNATURA: NEFROLOGÍA 84. COMPETENCIAS MECES: Marco Español de Cualificaciones para la Educación Superior Competencia: Competencias básicas en el área
Preeclampsia hipertensiva del embarazo. Detección y atención temprana. Dr. Luis Alcázar Alvarez Jefe de Gineco-obstetricia, ISSSTE
 Preeclampsia hipertensiva del embarazo. Detección y atención temprana Dr. Luis Alcázar Alvarez Jefe de Gineco-obstetricia, ISSSTE Qué es la preeclampsia/eclampsia? Es una complicación grave del embarazo
Preeclampsia hipertensiva del embarazo. Detección y atención temprana Dr. Luis Alcázar Alvarez Jefe de Gineco-obstetricia, ISSSTE Qué es la preeclampsia/eclampsia? Es una complicación grave del embarazo
COMPETENCIAS CLÍNICAS EN EL ÁREA DE PATOLOGÚIA CARDIOVASCULAR ASIGNATURAS: PATOLOGÍA CARDIOVASCULAR
 COMPETENCIAS CLÍNICAS EN EL ÁREA DE PATOLOGÚIA CARDIOVASCULAR ASIGNATURAS: PATOLOGÍA CARDIOVASCULAR 74. COMPETENCIAS MECES: Marco Español de Cualificaciones para la Educación Superior Competencia: COMPETENCIAS
COMPETENCIAS CLÍNICAS EN EL ÁREA DE PATOLOGÚIA CARDIOVASCULAR ASIGNATURAS: PATOLOGÍA CARDIOVASCULAR 74. COMPETENCIAS MECES: Marco Español de Cualificaciones para la Educación Superior Competencia: COMPETENCIAS
Hospital Civil de Guadalajara Dr. Juan I. Menchaca Área que Genera
 CONCEPTO Se define como hipertensión arterial a la elevación de las mediciones sistólicas, diastólicas o ambas a cifras iguales o mayores a la percentila 95 para la edad y sexo, por lo menos en tres determinaciones.
CONCEPTO Se define como hipertensión arterial a la elevación de las mediciones sistólicas, diastólicas o ambas a cifras iguales o mayores a la percentila 95 para la edad y sexo, por lo menos en tres determinaciones.
Prospecto: información para el usuario. Acetato de Potasio B. Braun 1 meq/ml concentrado para solución para perfusión
 Prospecto: información para el usuario Acetato de Potasio B. Braun 1 meq/ml concentrado para solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene
Prospecto: información para el usuario Acetato de Potasio B. Braun 1 meq/ml concentrado para solución para perfusión Lea todo el prospecto detenidamente antes de empezar a usar el medicamento, porque contiene
UBICACIÓN GUÍA ADAPTACIÓN SUGERIDA OBSERVACIONES
 Depresión DEP UBICACIÓN GUÍA ADAPTACIÓN SUGERIDA OBSERVACIONES 1. Pág. 11, primer Busque enfermedades médicas Busque enfermedades médicas concomitantes, Se incluye en la columna, último concomitantes,
Depresión DEP UBICACIÓN GUÍA ADAPTACIÓN SUGERIDA OBSERVACIONES 1. Pág. 11, primer Busque enfermedades médicas Busque enfermedades médicas concomitantes, Se incluye en la columna, último concomitantes,
Influencia de la estenosis de la arteria renal en la evolución clínica de los pacientes con isquemia grave de las extremidades inferiores
 Influencia de la estenosis de la arteria renal en la evolución clínica de los pacientes con isquemia grave de las extremidades inferiores GERMANS TRIAS I PUJOL HOSPITAL Servicio de Angiología y Cirugía
Influencia de la estenosis de la arteria renal en la evolución clínica de los pacientes con isquemia grave de las extremidades inferiores GERMANS TRIAS I PUJOL HOSPITAL Servicio de Angiología y Cirugía
Prospecto: información para el usuario. Cloruro de Calcio Braun 100mg/ml Solución inyectable
 Prospecto: información para el usuario Cloruro de Calcio Braun 100mg/ml Solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto, ya que
Prospecto: información para el usuario Cloruro de Calcio Braun 100mg/ml Solución inyectable Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto, ya que
CONSULTA DE ENFERMEDADES RARAS
 CONSULTA DE ENFERMEDADES RARAS PRESENTACIÓN DEL PROBLEMA Las llamadas Enfermedades Raras, también conocidas como Enfermedades Minoritarias o Enfermedades Metabólicas Hereditarias son un grupo de enfermedades
CONSULTA DE ENFERMEDADES RARAS PRESENTACIÓN DEL PROBLEMA Las llamadas Enfermedades Raras, también conocidas como Enfermedades Minoritarias o Enfermedades Metabólicas Hereditarias son un grupo de enfermedades
Fiebre mediterránea familiar
 www.printo.it/pediatric-rheumatology/mx/intro Fiebre mediterránea familiar Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de fiebre mediterránea familiar (FMF) se
www.printo.it/pediatric-rheumatology/mx/intro Fiebre mediterránea familiar Versión de 2016 2. DIAGNÓSTICO Y TRATAMIENTO 2.1 Cómo se diagnostica? El diagnóstico de fiebre mediterránea familiar (FMF) se
FICHA TÉCNICA. Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección 6.1.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Oculotect 50 mg/ml colirio en solución en envase unidosis 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene 50 mg de povidona K25. Para consultar la lista
PROSPECTO. GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable
 PROSPECTO GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable GOBEMICINA 250 (Ampicilina) INYECTABLE VIA INTRAVENOSA E INTRAMUSCULAR COMPOSICION Cada vial contiene: «250» AMPICILINA
PROSPECTO GOBEMICINA 250 Inyectable GOBEMICINA 500 Inyectable GOBEMICINA 1 g Inyectable GOBEMICINA 250 (Ampicilina) INYECTABLE VIA INTRAVENOSA E INTRAMUSCULAR COMPOSICION Cada vial contiene: «250» AMPICILINA
SEGURO GENERAL DEL RIESGOS DEL TRABAJO
 INSTITUTO ECUATORIANO DE SEGURIDAD SOCIAL SEGURO GENERAL DEL RIESGOS DEL TRABAJO NORMA DE SALUD Y SEGURIDAD PARA USO DEL MERCURIO 5. VIGILANCIA Y CONTROL BIOLOGICO El control biológico tiene una serie
INSTITUTO ECUATORIANO DE SEGURIDAD SOCIAL SEGURO GENERAL DEL RIESGOS DEL TRABAJO NORMA DE SALUD Y SEGURIDAD PARA USO DEL MERCURIO 5. VIGILANCIA Y CONTROL BIOLOGICO El control biológico tiene una serie
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO TOLFEDINE 4% 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. INGREDIENTES ACTIVOS: Ácido tolfenámico... 4,00 g EXCIPIENTES:
PROTOCOLO DEL CODIGO ICTUS.
 PROTOCOLO DEL CODIGO ICTUS. UGC DE CUIDADOS CRÍTICOS Y URGENCIAS COMPLEJO HOSPITALARIO DE JAÉN Unidad de Cuidados Críticos y Urgencias 1 INTRODUCCION El accidente cerebral agudo (ACVA), también llamado
PROTOCOLO DEL CODIGO ICTUS. UGC DE CUIDADOS CRÍTICOS Y URGENCIAS COMPLEJO HOSPITALARIO DE JAÉN Unidad de Cuidados Críticos y Urgencias 1 INTRODUCCION El accidente cerebral agudo (ACVA), también llamado
