Programa formativo EPOC
|
|
|
- Santiago Olivares Acuña
- hace 7 años
- Vistas:
Transcripción
1 Programa formativo EPOC Módulo 3. Espirometría y otras pruebas funcionales respiratorias Coordinador Luis Puente Maestu Autores María Jesús Rodríguez Nieto Felip Burgos Rincón Jordi Giner Donaire Julia García de Pedro Francisco García Río Jesús Molina París Consell Català de Formació Continuada SProfessions Sanitàries
2 Índice Programa formativo EPOC Módulo 3. Espirometría y otras pruebas funcionales respiratorias Coordinador Luis Puente Maestu Jefe de Sección de Pruebas Funcionales y Broncoscopia. Servicio de Neumología Hospital General Universitario Gregorio Marañón. Madrid Universidad Complutense de Madrid Autores María Jesús Rodríguez Nieto Laboratorio de Función Pulmonar Servicio de Neumología Fundación Jiménez Díaz-Capio. Madrid Felip Burgos Rincón Centro Diagnóstico Respiratorio Servicio de Neumología (ICT) IDIBAPS - Universitat de Barcelona Hospital Clínic. Barcelona Jordi Giner Donaire Servicio de Neumología Hospital de la Santa Creu i Sant Pau. Barcelona Julia García de Pedro Médico Adjunto. Servicio de Neumología Hospital General Universitario Gregorio Marañón Madrid Francisco García Río Servicio de Neumología Hospital Universitario La Paz. Madrid Facultad de Medicina Universidad Autónoma de Madrid. IdiPAZ. Madrid Jesús Molina París Especialista en Medicina Familiar y Comunitaria Centro de Salud «Francia». Fuenlabrada. Madrid
3 2013 Ferrer Internacional, S.A. Editado por EdikaMed, S.L. Josep Tarradellas, Barcelona Quedan rigurosamente prohibidas, sin la autorización escrita de los titulares del Copyright, la reproducción (parcial o total), distribución, comunicación pública o transformación de esta obra, salvo excepción prevista por la ley. Diríjase a EdikaMed, S.L. (www. edikamed.com; ) o a CEDRO (Centro Español de Derechos Reprográficos, / ) si necesita fotocopiar o escanear fragmentos de esta obra.
4 Índice III Índice Introducción VII Parte TEÓRICA 1 El sistema respiratorio 3 Luis Puente Maestu Introducción 3 Estructura 3 Músculos respiratorios 6 Propiedades estáticas 6 Dinámica pulmonar 7 Compresión dinámica 9 Atrapamiento aéreo 10 Obstrucción de las vías aéreas centrales 11 Mecanismos de protección de los pulmones contra los agentes inhalados 12 Bibliografía 14 Generalidades de la espirometría 15 María Jesús Rodríguez Nieto Objetivos 15 Terminología de la espirometría 15 Maniobra espiratoria forzada 17 Papel diagnóstico y pronóstico de la espirometría en las enfermedades respiratorias 18 Bibliografía 19 Espirometría de calidad 20 Felip Burgos Rincón Introducción 20 Tipos de espirómetros. Espirómetro de oficina frente al de laboratorio 21 Calibraciones de los equipos 23 Factores ambientales y técnicos relevantes 23 Control de la infección 23 Precisión y reproducibilidad Control de calidad 24 Bibliografía 26
5 IV Módulo 3 Espirometría y otras pruebas funcionales respiratorias Técnica de la espirometría 28 Jordi Giner Donaire Preparación del equipo 28 Preparación del sujeto 28 Posición del sujeto 29 Datos atmosféricos y antropométricos 29 Realización de la prueba 29 Valoración de la maniobra, aceptabilidad 29 Valoración de la maniobra reproducibilidad 32 Calidad de las maniobras 33 Guardar registros 34 Bibliografía 34 Interpretación de la espirometría 35 Julia García de Pedro Introducción 35 Valores de normalidad 37 Parámetros espirométricos necesarios para la interpretación de la espirometría 38 Patrones espirométricos 39 Estrategia de interpretación de la espirometría 45 Bibliografía 45 Evaluación de los cambios en la espirometría 46 Francisco García Río, Elizabet Martínez Cerón, Delia Romera Cano Prueba de broncodilatadores 46 Evaluación en la EPOC 51 Evaluación en el asma 51 Evaluación en las enfermedades intersticiales 52 Evaluación en las enfermedades neuromusculares 52 Bibliografía 52 La espirometría en atención primaria 54 Jesús Molina París Manejo de pacientes respiratorios en atención primaria. Papel de la espirometría 54 La espirometría como herramienta de detección (screening) 56 Variables a considerar en la espirometría en atención primaria. Papel del FEV6 58 Organización de la espirometría en atención primaria 59 Conclusión 63 Bibliografía 63
6 Índice V Otras pruebas funcionales 65 Luis Puente Maestu, Rosa Gómez García, Julio Vargas Espinal, Jorge Chancafe Morgan Introducción 65 Flujo máximo espiratorio 65 Gasometría arterial 66 Difusión de monóxido de carbono por respiración única 67 Presiones respiratorias máximas 75 Pruebas de provocación bronquial 77 Pruebas farmacológicas 77 Medición del óxido nítrico exhalado 80 Prueba de marcha de 6 minutos y desaturación de oxígeno durante el ejercicio 81 Ergoespirometría 81 Bibliografía 82 Test de evaluación 87 Parte PRÁCTICA 93 Generalidades de la espirometría 95 María Jesús Rodríguez Nieto Espirometría de calidad 97 Felip Burgos Rincón Técnica de la espirometría 99 Jordi Giner Donaire Interpretación de la espirometría 101 Julio García de Pedro Evaluación de los cambios en la espirometría 104 Francisco García Río, Elizabet Martínez Cerón, Delia Romera Cano La espirometría en atención primaria 107 Jesús Molina París
7
8 Índice Introducción VII La medición de la función pulmonar es una parte fundamental del diagnóstico de los pacientes con sospecha de enfermedades respiratorias, que además permite definir su gravedad, la capacidad para tolerar intervenciones en las que puedan ocurrir complicaciones pulmonares o en las que se espere la pérdida de función respiratoria y monitorizar la evolución de los procesos respiratorios. La información que obtendremos mediante el estudio de la función del aparato respiratorio es objetiva, precisa, reproducible y, por lo tanto, fiable. En los últimos tiempos se está poniendo énfasis en el manejo del paciente basándose en sus síntomas, en parte debido a que nos hemos dado cuenta de que la situación funcional de un paciente depende de una serie compleja de factores y no siempre guarda una relación suficientemente estrecha con una única variable de función pulmonar, en parte porque estas últimas no tienen resolución suficiente para detectar cambios que sí son consistentemente apreciados por el paciente, como mejoría en sus síntomas en la práctica y en los ensayos clínicos. Sin embargo, aunque la función pulmonar no sea el único factor a considerar, los síntomas del paciente tampoco pueden ser el único criterio diagnóstico o que dirija nuestras decisiones terapéuticas, pues sabemos que muchos pacientes minimizan o exageran sus síntomas, y la discrepancia entre síntomas y función puede darnos la pista de la existencia de procesos concomitantes. Son numerosas las pruebas funcionales respiratorias (PFR), cada una tiene sus indicaciones precisas y su utilidad. Las que podemos denominar como PFR básicas son la espirometría y la curva flujo-volumen forzadas, la prueba broncodilatadora y la gasometría arterial, pero otras pruebas, como la espirometría lenta, la determinación de presiones respiratorias máximas, la medición de la fracción espirada de óxido nítrico, el test de difusión pulmonar y la valoración de la capacidad de esfuerzo son sumamente útiles en muchos pacientes y cualquier profesional que maneje pacientes con enfermedades respiratorias debe tener conocimiento de ellas. Otros test, como la determinación de los volúmenes pulmonares y las pruebas de broncoprovocación, son muy útiles en situaciones precisas. Para la realización de todas estas mediciones necesitamos distintos equipos que deben cumplir los requisitos técnicos que se establecen en las normativas vigentes. Igualmente es imprescindible la calibración adecuada de los aparatos previa a su uso de acuerdo a las especificaciones del fabricante, así como seguir las normas de control de la infección e higiene establecidas. El personal que realiza las pruebas debe estar familiarizado con los equipos y tener la experiencia suficiente en su realización para obtener unos resultados de calidad. Precisamente, la falta de reconocimiento de la importancia de los controles de calidad y de la necesidad de que quien haga e interprete las pruebas funcionales, en particular la espirometría, tenga la formación y experiencia necesarias subyace en el patente fracaso en su implantación generalizada, incluso en países como el nuestro, con recursos económicos para implantar una prueba tan esencial.
9 VIII Módulo 3 Espirometría y otras pruebas funcionales respiratorias Precisamente, el contribuir a la formación y difusión de la espirometría en particular y de las pruebas funcionales respiratorias en general es la razón de ser de esta obra, en la que hemos podido contar con un nutrido grupo de las autoridades en este campo. Luis Puente Maestu Jefe de Sección de Pruebas Funcionales y Broncoscopia. Servicio de Neumología Hospital General Universitario Gregorio Marañón. Madrid Universidad Complutense de Madrid
10 Parte TEÓRICA
11
12 El sistema respiratorio 3 El sistema respiratorio Luis Puente Maestu Jefe de Sección de Pruebas Funcionales y Broncoscopia. Servicio de Neumología Hospital General Universitario Gregorio Marañón. Madrid Universidad Complutense de Madrid Introducción Las células del cuerpo requieren producir sin cesar la energía necesaria para crecer, repararse y mantener sus funciones vitales y, para ello, necesitan un suministro continuo de oxígeno; de hecho, una persona puede vivir sólo unos pocos minutos sin este elemento. El oxígeno procede de la capa gaseosa que envuelve la Tierra, la atmósfera; los niveles en los que se desarrolla la vida, la biosfera, contienen un 20,946% de oxígeno, un 78,084% de nitrógeno y, aproximadamente, 1% de vapor de agua, 0,934% de argón, 0,046% de dióxido de carbono y otros gases nobles en menor proporción, además de partículas en suspensión; a esta mezcla la llamamos aire. La función principal del sistema respiratorio es, por un lado, extraer oxígeno del aire y transferirlo a la sangre, la cual a su vez lo transporta a las células, y, por otro, excretar a la atmósfera el dióxido de carbono producido en el metabolismo; los puntos donde tiene lugar este proceso son los alveolos (parénquima pulmonar). El intercambio de gases ocurre de forma pasiva a favor de los gradientes de presión y químicos que existen entre el gas alveolar y la sangre de los capilares pulmonares e implica tanto la difusión a través de la membrana alveolocapilar como la combinación o disociación química con la hemoglobina presente en los capilares pulmonares. Al proceso conjunto de la difusión a través de la membrana alveolocapilar más la combinación química con la hemoglobina lo denominamos «transferencia de gases». Para mantener esta transferencia, el gas alveolar debe renovarse periódicamente con el aire que circula por las vías aéreas (la nariz y la boca, la faringe, la tráquea y los bronquios), el cual tiene que llegar en las cantidades necesarias, limpio, húmedo y a 37 C (temperatura corporal). El motor de esta renovación del gas alveolar, llamada ventilación, son los músculos respiratorios (diafragma e intercostales, auxiliares de la respiración, abdominales y faríngeos) (fig. 1). Una persona en reposo respira alrededor de 6 litros de aire por minuto (l/min). En un ejercicio intenso la cantidad puede aumentar a más de 75 l/min. Durante una jornada de 8 horas de actividad moderada, la cantidad de aire que se respira puede ser de hasta 8,5 m 3 [1]. Además, en el proceso de transporte a y desde las células al pulmón también están involucrados la sangre, el sistema cardiocirculatorio y el cerebro. La sangre lleva el oxígeno desde los pulmones al resto del cuerpo y devuelve el dióxido de carbono para ser eliminado, el corazón genera la fuerza para mover la sangre a la velocidad y presión adecuadas en todo el cuerpo y, finalmente, el buen funcionamiento de todo el sistema está dirigido por el cerebro y el sistema nervioso autónomo. Estructura El aire entra por la boca o la nariz, pasa por la faringe (garganta) y de ahí baja a la trá-
13 4 Módulo 3 Espirometría y otras pruebas funcionales respiratorias quea. Al llegar a los pulmones, la tráquea se divide en dos, los bronquios principales, uno hacia cada pulmón. A su vez, los bronquios se bifurcan dicotómicamente en varias ocasiones en bronquios cada vez de menor calibre, que a su vez se dividen en ramas más pequeñas llamadas bronquiolos. En conjunto, los bronquios y bronquiolos se denominan «árbol bronquial», debido a que su aspecto es similar a la ramificación de un árbol invertido. Después de un total de 23 divisiones, los bronquiolos terminan en los conductos alveolares, que contienen grupos de alveolos; son las zonas donde el oxígeno y el dióxido de carbono son finalmente transferidos a la circulación sanguínea [2,3] (fig. 2). La tráquea y, aproximadamente, la primera docena de divisiones de los bronquios, tienen anillos o, al menos, láminas de cartílago en sus paredes que impiden que se colapsen [2]. El resto de las vías aéreas y los alveolos no tienen cartílago y son deformables, variando su calibre cuando los pulmones se expanden y se contraen. Los vasos del sistema arterial pulmonar acompañan a bronquios y bronquiolos, y también se van ramificando hasta terminar en capilares, que están en contacto directo con los alveolos formando tupidos ovillos (fig. 3). La transferencia pasiva de gases, sobre todo la del oxígeno, es un proceso relativamente ineficiente, por lo que, para conseguir extraer suficiente oxígeno, la superficie alveolar de los pulmones es muy grande (28 m 2 en reposo y llega hasta 100 m 2 en una respiración profunda o en el ejercicio) [2,4]. Esta dimensión es incluso insuficiente para difundir la cantidad de oxígeno necesaria a la sangre en situaciones extremas, como es el caso de los deportistas a máximo rendimiento y, especialmente, a cierta altura sobre el nivel del mar, lo que se pone en evidencia porque la diferencia entre las presiones alveolar y arterial de oxígeno se eleva con respecto a la de reposo y la sangre no se satura [5]. Cier- Figura 1. El sistema respiratorio Laringe Tráquea Nariz Boca Pulmón derecho Lóbulo superior derecho Lóbulo medio Lóbulo iinferior derecho Bronquios Pulmón izquierdo Lóbulo superior izquierdo Lóbulo inferior izquierdo
14 Parte TEÓRICA El sistema respiratorio 5 Figura 2. Diagrama esquemático de la vía aérea Estructura Diámetro (mm) Cilios Cartílago Músculo liso Células caliciformes Laringe Tráquea Forma de C Bronquios principales Anillos Bronquios lobulares Láminas Bronquios segmentarios Otros bronquios Láminas Láminas Bronquiolos 0, Bronquiolos terminales < 0, Figura 3. Alveolos con su vascularización Arteria pulmonar Vena pulmonar Bronquiolo Alveolo
15 6 Módulo 3 Espirometría y otras pruebas funcionales respiratorias tas enfermedades pulmonares que afectan a los alveolos, los capilares o a la hemoglobina, pueden interferir con la difusión y reducir la cantidad de oxígeno que llega al torrente sanguíneo. La necesidad de una superficie de intercambio tan grande tiene dos implicaciones importantes: en primer lugar, como la estructura pulmonar es la repetición del diseño básico del que evolucionó, es decir, un saco (alveolo) con un conducto (vía aérea) en el que no se produce intercambio de gases, obliga a un exceso de capacidad ventilatoria (volumen de aire que entra en los pulmones en 1 min), parte de la cual (aproximadamente un 15% en ejercicio y un 35% en reposo) entra y sale sin haber participado en el intercambio gaseoso (espacio muerto) [6] y, en segundo lugar, aumenta la exposición del sistema respiratorio al daño causado por inhalación de materiales tóxicos e irritantes o a amenazas biológicas, como alérgenos, inmunógenos y agentes infecciosos [2]. Músculos respiratorios Para mover el aire desde el exterior del organismo a las unidades de intercambio debe hacerse la fuerza suficiente para vencer la elasticidad e inercia del sistema respiratorio, y que la cavidad torácica se expanda para crear una presión negativa (inferior a la atmosférica) en el alveolo que produzca una corriente de aire hacia el interior de los pulmones (inspiración). Normalmente, la fuerza se genera por contracción de los músculos inspiratorios (el principal es el diafragma), pero, en circunstancias especiales, puede ser un sistema de soporte ventilatorio (un respirador). En cualquier caso, el volumen de gas que llega a los alveolos para una determinada presión viene determinado por las propiedades mecánicas de la pared torácica, el parénquima pulmonar y las vías aéreas. Durante una inspiración máxima, el diafragma se contrae hacia abajo, presionando las vísceras abdominales; para hacer palanca hacia arriba, mueve las costillas, lo que aumenta el diámetro de la cavidad torácica (los músculos intercostales externos tienen el mismo efecto al contraerse durante la inspiración). Cuando se necesitan ventilaciones extremadamente elevadas o cuando hay dificultad respiratoria también pueden actuar como músculos inspiratorios los escalenos y los esternocleidomastoideos del cuello [2]. La espiración es básicamente un proceso pasivo, como veremos más adelante, pero, cuando se necesitan ventilaciones elevadas, por ejemplo, al hacer ejercicio, los músculos intercostales internos y los músculos abdominales se contraen para reducir el volumen pulmonar al final de la espiración (volumen teleespiratorio), más allá de lo que lo hace en reposo, consiguiendo por un lado que el volumen corriente (el volumen movilizado durante una respiración) sea mayor sin aumentar la resistencia elástica y, por otro, almacenar fuerza como en un resorte, ya que, por debajo del 60% de la capacidad vital, la tendencia de la caja torácica es expandirse (o sea, inspiratoria) [1]. Propiedades estáticas Tanto los pulmones como la pared torácica son estructuras elásticas que, de forma simplificada, pueden considerarse como globos, porque al igual que éstos, se requiere cierta presión para distenderlos y, cuando se deja de aplicar, se desinflan hasta recuperar la forma original [1,2,7-10]. En condiciones fisiológicas ambas están perfectamente acopladas por la presión pleural, que mantiene los pulmones expandidos contra la pared torácica, de forma que, en ausencia de cambios en el contenido sanguíneo del interior del tórax, las variaciones de volumen de ambos son idénticos [8]. Las presiones que se necesitan para inflar y desinflar el tórax se pueden derivar de la relación descrita en la figura 4. Los músculos inspiratorios son los responsables de inflar el tórax por encima del punto de equilibrio (también llamado capacidad funcional
16 Parte TEÓRICA El sistema respiratorio residual o FRC, en las siglas internacionales) y, como hemos dicho, los músculos espiratorios son capaces de llevar al tórax por debajo de la FRC [1,2,7-10]. Estos conceptos sobre la elasticidad del sistema respiratorio son útiles, porque permiten deducir los cambios funcionales en pacientes con alteraciones restrictivas, sea por causa de debilidad de los músculos respiratorios, por alteraciones de la pared torácica o por mayor elasticidad (rigidez) de los pulmones (tabla 1). Dinámica pulmonar Para que el aire entre a los pulmones, los músculos respiratorios han de vencer no sólo la elasticidad del sistema, sino también su inercia y la de del gas que entra, así como la 7 resistencia al paso del aire por el árbol bronquial. A diferencia de la elasticidad, que no se afecta por el movimiento, las fuerzas que se requieren para vencer la resistencia y la inercia están marcadamente influidas por la velocidad del flujo de aire y, por tanto, las consideramos propiedades dinámicas [2,11]. En circunstancias normales, las fuerzas inerciales son despreciables y no hablaremos más de ellas pese a que tienen cierta relevancia en los pacientes con síndrome de obesidadhipoventilación y nos centraremos en las resistencias. En un fluido con flujo laminar el flujo (F) depende de la diferencia de presión entre el principio y el final del tubo (ΔP) y de la resistencia (R): F = ΔP / R (fórmula 1) Figura 4. Relaciones presión-volumen del sistema respiratorio (línea continua) obtenidas añadiendo las presiones elásticas del pulmón y de la pared torácica (línea discontinua) 100 Pared Pulmón 100 Capacidad pulmonar total (%) FRC Pared y pulmón Capacidad vital (%) Volumen residual Presión elástica (cmh2o) FRC: capacidad funcional residual.
17 8 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Esta ecuación es relevante para interpretar la espirometría, porque nos viene a decir que cualquier medición de flujo como, por ejemplo, el volumen espiratorio forzado en el primer segundo (FEV1), puede estar disminuido, tanto si aumentan las resistencias de la vía aérea como si disminuye la diferencia de presión entre el alveolo y la boca. Cuando el pulmón es menos elástico (o más distensible, la distensibilidad es la inversa de la elasticidad), como ocurre en el enfisema, también disminuyen los flujos espiratorios, ya que el pulmón tiene menor elasticidad y genera menor presión en el alveolo [1,2,11-14]. Volviendo a la resistencia, si el flujo es laminar, dependerá del número, longitud y sección global de las vías aéreas y de la viscosidad del gas. En la mayor parte de las vías respiratorias, los flujos son laminares, pero a flujos en la boca mayores de 0,5 l/s 1 empiezan a aparecer turbulencias en las vías aéreas centrales. Cuando el flujo es turbulento, la resistencia también depende de la densidad y el número de bifurcaciones [2,11], pero la modelización de los flujos turbulentos es muy compleja y, en definitiva, sólo afecta a la magnitud de la relación entre ΔP y flujo pero no cambia los conceptos generales del modelo de flujo laminar expresado por la fórmula 1, por lo que no entraremos en más detalles. La longitud de la vía aérea varía con el ciclo respiratorio de una persona a otra y, también, en una misma persona; sin embargo, dado que la resistencia aumenta de forma proporcional a la cuarta potencia del radio, el calibre de las vías aéreas es, con mucho, el factor más importante que determina las resistencias. El calibre de la vía aérea depende de la rigidez de su pared, del tono muscular liso, de la tracción radial ejercida por los alveolos vecinos (por los que se verá afectada por la elasticidad y el volumen del pulmón) y de la presencia de moco, edema, secreciones o compresiones de la pared. Una propiedad importante para comprender el fenómeno de atrapamiento aéreo es el comportamiento de las resistencias con el volumen. Las vías aéreas aumentan aproximadamente un 60% su diámetro y un 40% su longitud desde la máxima espiración (volumen residual) a la máxima inspiración (ca- Tabla 1. Causas de restricción Pérdida de fuerza muscular respiratoria Esclerosis lateral amiotrófica Distrofia muscular de Duchenne Distrofia miotónica de Steinert Alteraciones hidroelectrolíticas severas Miastenia gravis Poliomielitis Secciones medulares altas Aumento de la rigidez del tórax Grandes quemados Esclerodermia Cifoescoliosis Espondilitis anquilopoyética Toracoplastia Fibrotórax Aumento de la elasticidad pulmonar Enfermedades intersticiales Edema de pulmón Pérdida de volumen pulmonar Cirugía con resección Derrame pleural Neumotórax
18 Parte TEÓRICA El sistema respiratorio pacidad pulmonar total). En ausencia de tono muscular liso, prácticamente todo el aumento del diámetro se ha producido ya a FRC, a partir de la cual la mayor parte del aumento de resistencia se debe al alargamiento de las vías aéreas. Esto hace que las resistencias aumenten relativamente poco al expulsar aire desde capacidad pulmonar total hasta FRC y drásticamente por debajo de FRC, dando una relación hiperbólica entre la resistencia de la vía aérea y el volumen [2]. Compresión dinámica La compresión dinámica es un fenómeno de gran importancia para entender la maniobra espirométrica. La presión que empuja el aire fuera de los pulmones durante la espiración es la alveolar, que es la suma de la presión originada por la retracción elástica espontánea del pulmón (Pst) y la presión transmitida al espacio pleural por el efecto de la contracción de los músculos espiratorios y la retracción elástica de la pared torácica (Ppl) y viene descrita por la siguiente fórmula: Palv = Pst + Ppl (fórmula 2) Pst es siempre positiva 1, mientras que la presión pleural es habitualmente negativa en respiración corriente, aunque se hace positiva en las espiraciones vigorosas. Por tanto, durante la espiración forzada la presión alveolar es la suma algebraica de dos valores positivos, y es la presión que se disipa en vencer las resistencias desde el alveolo a la boca, donde la presión es 0 [1]; por tanto, como vemos en la figura 5, debe haber un punto en el que la presión dentro de la luz de las vías aéreas sea igual a la presión que las rodea; este punto en el que las presiones dentro y fuera de la vía aérea se igualan, se denomina «punto de igual presión» [1,2,9,11-14]. Proximal a este punto, la presión dentro 9 de la vía aérea es menor que la externa y se produce una compresión. Se ha podido determinar empíricamente que hay un punto a partir del cual los aumentos de presión pleural (hacer más fuerza espiratoria) no se traducen en aumentos de flujo espiratorio, es decir, el esfuerzo extra no consigue que se expulse el aire a mayor velocidad. La explicación más probable es que dichos esfuerzos espiratorios, al aumentar la presión pleural, por un lado aumentan la presión alveolar, pero por otro aumentan la compresión de la vía aérea, que eleva la resistencia en una magnitud equivalente y se cancelan [1,2,9,11-14]. En estas condiciones, la presión que empuja el gas alveolar en la región distal al punto de igual presión es Palv Ppl que, como podemos deducir de la fórmula 2, es Pst, y las resistencias Figura 5. Diagrama esquemático del concepto de punto de «igual presión» Punto de igual presión Ppl = 10 cmh2o Pst = 10 cmh2o Palv = 10 cmh2o +10 A un determinado volumen durante la espiración forzada, la presión pleural (Ppl) y la presión elástica del pulmón (Pst) son iguales a 10 cmh2o. La presión alveolar (Palv) es, por tanto, de 20 cmh2o. Esta es la presión que empuja el gas alveolar hacia la boca (donde la presión es 0), gas que se disipa circulando por los bronquios en este paso. En consecuencia, habrá un punto en el recorrido por las vías aéreas en el que la presión dentro y fuera de la pared será de «igual presión». Próxima al punto de igual presión, la vía aérea se comprime, al ser la presión externa superior a la interna. 1 Cabe recordar que en fisiología respiratoria se usa como referencia la presión atmosférica; así, decimos que una presión es positiva cuando es mayor que la atmosférica y negativa cuando es menor.
19 10 Módulo 3 Espirometría y otras pruebas funcionales respiratorias son las ofrecidas por las vías aéreas entre los alveolos y el punto en el que se inicia la compresión a partir del cual la velocidad de salida del aire está limitada, no puede ser mayor por mucha fuerza que hagamos. Esta limitación explica la reproducibilidad de los flujos espiratorios en la espirometría, pues no depende de la colaboración del paciente, que, si ha realizado el llenado máximo inicial de los pulmones (lo que maximiza Pst) obtiene aproximadamente el mismo FEV1, ya que la espiración es un proceso pasivo resultante de la tendencia natural a la retracción (elasticidad o retracción elástica) del pulmón y la pared torácica expandidos y de las resistencias de las vías aéreas distales al punto de igual presión, o sea que, si el llenado pulmonar ha sido máximo, la mayor o menor fuerza espiratoria mejora algo el pico de flujo máximo, pero no el FEV1. Otra consecuencia del punto de igual presión es que, a medida que el pulmón se desinfla, la Pst baja, al estar los alveolos menos distendidos la compresión de la vía aérea ocurre más y más distal, por lo que los flujos a bajos volúmenes pulmonares son lo más representativo de las vías aéreas más periféricas. A diferencia de la espiración, la entrada del aire en la inspiración no está limitada, pues durante la inspiración la Ppl es negativa y cuanto más esfuerzo inspiratorio se hace más se distiende la vía aérea. Por este motivo, las enfermedades de la vía aérea sobrecargan los músculos inspiratorios, ya que la adaptación fisiológica a una reducción en el flujo espiratorio es intentar prolongar la espiración y el flujo máximo espiratorio no se puede aumentar más, reduciendo el tiempo que dura la inspiración; para ello, se aumenta la velocidad de la inspiración, lo que obliga a una contracción más rápida y enérgica de los músculos inspiratorios, que pueden llegar a fatigarse [1,2,9,11-14]. Si el pulmón es más distensible (menos elástico) de lo fisiológico, como ocurre en el enfisema, se vuelve menos capaz de volver a su tamaño normal durante la espiración, produciendo una mayor limitación al flujo espiratorio indistinguible de un aumento de la resistencia de la vía aérea a la espiración. Si el pulmón se hace menos distensible (enfermedades inspiratorias) se facilita la espiración, pero hay que hacer más trabajo para aumentar el volumen (inspirar) [1]. Atrapamiento aéreo La limitación al flujo espiratorio también puede afectar a los volúmenes pulmonares. La mayoría de las enfermedades pulmonares incide de forma heterogénea en distintas zonas del pulmón y, por tanto, su elasticidad y la resistencia de las vías aéreas a las que están unidos también se afectan heterogéneamente. Tanto al aplicar presión para llenar los pulmones como al vaciarlos el volumen aumenta o disminuye de una forma exponencial (más rápido al principio y más lento al final) y la velocidad depende de la elasticidad y, sobre todo, de la resistencia 2 [1,11]. La curva volumen/tiempo de la espiración forzada tiene forma exponencial, al ser la suma de los comportamientos de todas las unidades alveolares (fig. 6); algunas unidades de vaciado muy lento pueden no tener tiempo suficiente para vaciarse en una espiración normal. En consecuencia, al contener más gas alveolar del fisiológico al final de la espiración, el volumen residual es mayor y la capacidad vital menor, lo que hace que la capacidad vital pueda estar disminuida por factores dinámicos y, por tanto, no ser siempre un buen reflejo de la capacidad pulmonar total (TLC), por lo que el «patrón restrictivo» en la espirometría debe confirmarse con la medición de la TLC o con un cuadro clínico compatible. 2 En sistemas que siguen la fórmula 1, y asumiendo una resistencia (R) y una compliancia (C) fijas, la ecuación que describe el cambio de volumen con el tiempo es: V(t) = Palv C e t/rc, donde V(t) es el volumen en un momento dado de la espiración y RC la constante de tiempo, es decir, el determinante de la velocidad.
20 Parte TEÓRICA El sistema respiratorio Obstrucción de las vías aéreas centrales Aunque estas lesiones eran raras en el pasado, hoy en día se ven con alguna frecuencia casos de estenosis de las vía aéreas centrales (tráquea y bronquios principales) por tumores como consecuencia de intubaciones prolongadas, traqueotomías, reflujo o enfermedades reumáticas. En general hay dos tipos de obstrucciones, las fijas y las variables, que pueden ser intra- o extratorácicas. En sujetos normales, los flujos inspiratorios son mayores que los espiratorios, por lo que el flujo espiratorio al 50% de la capacidad vital es aproximadamente el 0,8 del inspiratorio. 11 Esto se debe a que, como explicamos anteriormente, durante la inspiración se produce una distensión de la vía aérea, mientras que durante la espiración se produce una compresión. En pacientes con obstrucción variable extratorácica, el estrechamiento producido por la estenosis empeora en inspiración, porque la disminución de presión dentro de la vía aérea causa que la presión atmosférica que la rodea la comprima; durante la espiración el sitio de la obstrucción se dilata al haber una presión mayor que la atmosférica dentro de la vía aérea. En consecuencia, el flujo espiratorio al 50% de la capacidad vital llega a ser mayor de 2 veces el inspiratorio. En pacientes con obstrucción variable intra- Figura 6. Diagrama esquemático del vaciamiento de las unidades alveolares Normal Volumen espiratorio (%) Lenta Muy lenta Tiempo espiratorio (s) El vaciado de las unidades alveolares no es instantáneo y sigue un patrón exponencial decreciente, como el que vemos en la figura. Una unidad normal se vacía rápidamente y en 1 s se ha vaciado del 80 al 85%. Las unidades más lentas tardan más tiempo y a los 6 s (línea discontinua), el tiempo mínimo que dura una espiración correcta en una maniobra de espirometría forzada aún tiene cierta cantidad de gas. Este fenómeno se llama atrapamiento aéreo. A medida que la espiración es más breve, como ocurre cuando el paciente muestra taquipnea, como en el ejercicio, no se pueden vaciar más unidades y el volumen de las unidades lentas es cada vez mayor (línea de puntos). Este fenómeno se denomina «hiperinsuflación dinámica».
21 12 Módulo 3 Espirometría y otras pruebas funcionales respiratorias torácica ocurre lo contrario. Al generar presión negativa intratorácica se dilata la estrechez, que empeora cuando la presión pleural es positiva, como ocurre en la espiración; así, la relación flujo espiratorio al 50% de la capacidad vital llega a ser menor de 0,3. Cuando la obstrucción es fija o se localiza en el opérculo torácico afecta tanto en inspiración como en espiración [2]. Mecanismos de protección de los pulmones contra los agentes inhalados Los contaminantes en el aire pueden ser en forma de gases (vapores), líquidos (aerosoles o nieblas) o sólidos (humos y polvos). Los productos químicos tóxicos y los materiales irritantes que se inhalan pueden dañar el árbol bronquial o los pulmones y causar daños en otras partes del cuerpo, al permitir los pulmones el paso de algunas moléculas químicas a la sangre [2]. La primera línea defensiva está en las vías aéreas, que impiden la llegada de todas, salvo de las partículas más pequeñas, a alveolos. Las partículas de tamaño mayor de 10 µm se depositan en la nariz [2]. Para poner esta cifra en perspectiva diremos que normalmente podemos ver a simple vista partículas menores de 50 µm (media décima de milímetro). Las partículas de 10 µm sólo son perceptibles al microscopio, aunque a veces se pueden ver cuando la luz se refleja en ellos (los clásicos haces de luz que se filtran por la ventana). La deposición de las partículas en el aparato respiratorio depende de su tamaño, masa y forma. Las que se depositan en los alveolos tienen un diámetro aerodinámico entre 0,5 y 2 µm, las partículas mayores se depositan en los bronquios por sedimentación o inercia [2], y las menores lo hacen por difusión, ya que son sensibles a los movimientos brownianos de los gases del aire. El movimiento de las moléculas de gas en las vías aéreas terminales no es por convención, sino que se produce básicamente por difusión entre el gas de las vías aéreas y el de los alveolos; esta difusión es varios órdenes de magnitud menor para las partículas pequeñas y se produce también radialmente, con la diferencia de que las partículas quedan atrapadas en la pared y el oxígeno y el anhídrido carbónico fluyen hacia o desde la sangre [2,15]. Los pulmones tienen varios mecanismos para protegerse de la contaminación por partículas y agentes infecciosos. El vello de la nariz proporciona la primera barrera mediante la filtración de las partículas grandes de polvo y otros materiales. Sin embargo, cuando las personas hacen ejercicio o trabajan duro, tienen que respirar por la boca para coger aire suficiente, imposibilitando así el filtrado nasal [2]. Siempre que los materiales irritantes toquen las paredes de las vías respiratorias, se desencadena tos refleja, que fuerza al gas en los pulmones a salir rápidamente, lo que generalmente expulsa el irritante. Además, toda la superficie de la nariz, la tráquea, los bronquios y los bronquiolos más grandes está recubierta de células ciliares, que tienen unas finas vellosidades en su superficie y están cubiertas con una fina capa de moco que atrapa material extraño. La capa de moco está compuesta de una doble capa sol-gel en la superficie del epitelio: la capa pegada es líquida sol y la más externa está formada por placas más viscosas e impermeables, para impedir la deshidratación de los cilios. Éstos se mueven rítmicamente hacia la laringe en la capa sol del moco y sus puntas rozan por debajo las placas de moco viscoso desplazándolas y, con ellas, las partículas que haya atrapado. Este proceso se denomina «ascensor mucociliar» (fig. 7) [2,3]. Los macrófagos alveolares fagocitan las partículas que se depositan más allá del límite de los cilios y se mueven proximalmente hasta
22 Parte TEÓRICA El sistema respiratorio 13 Figura 7. Representación esquemática del funcionamiento del epitelio ciliado En este esquema se observan los cilios moviéndose sincronizadamente, formando olas que baten la lámina mucosa líquida (sol). Las puntas de los cilios golpean la superficie interna de las placas de gel moviéndolas hacia la laringe. alcanzar dicho límite para «coger» el ascensor mucociliar. Los macrófagos también vuelven a entrar en el intersticio para volver a salir por los bronquiolos, presumiblemente en los puntos en los que se encuentran los agregados linfáticos de la unión entre los bronquios y los bronquiolos terminales; ocasionalmente entran en los linfáticos, desde donde pueden distribuirse por todo el organismo. Cierta evidencia sugiere que esto sólo ocurre cuando la carga de partículas es muy grande y desborda la capacidad del tráfico superficial e intersticial hacia el ascensor mucociliar [2]. Las partículas bioactivas desencadenan una respuesta inflamatoria que también contribuye a su eliminación, aunque con frecuencia deja secuelas estructurales y funcionales. La tos generalmente elimina las partículas irritantes al instante y el ascensor mucociliar puede precisar unas pocas horas; sin embargo, en las áreas más distales de los pulmones puede necesitar mucho más tiempo para limpiar las partículas extrañas [2]. En los pulmones sanos, la exposición temporal a partículas o materiales irritantes aumenta la producción de moco y macrófagos alveolares según sea necesario para eliminar la materia extraña, para luego volver a niveles normales. Cuando los pulmones se enfrentan a una exposición prolongada o repetida de contaminantes del aire, al final pueden verse desbordados y, como consecuencia, se acumulan los contaminantes, causando las enfermedades pulmonares por exposición [2]. El hábito de fumar contribuye a la enfermedad pulmonar de diversas maneras: daña mecanismos de defensa naturales, inhibiendo los macrófagos y el movimiento ciliar; activa los
23 14 Módulo 3 Espirometría y otras pruebas funcionales respiratorias macrófagos, induciendo reacciones inflamatorias en el intersticio y en la vía área que cambian su estructura, y aumenta la producción de moco de los pulmones, irritando las vías respiratorias, y la inhibición de la obra de los macrófagos y la escalera mucociliar [2]. Bibliografía 1. Younes M. Determinants of thoracic excursions during exercise. En: Whipp BJ, Wasserman K, eds. Exercise: pulmonary physiology and patophysiology. New York: Dekker; p Murray JF. Respiration. En: Smith-Thier, eds. Pathophysiology: the biological principles of disease. Philadelphia: Saunders; p Horsfield K. The structure of the tracheobronquial tree. En: Scadding JG, Cumming G, Thurlbeck WM, eds. Scientific foundations of respiratory medicine. London: Heinemann; p Warren PM. Gas exchange between alveolus and capillary. En: Scadding JG, Cumming G, Thurlbeck WM, eds. Scientific foundations of respiratory medicine. London: Heinemann; p Hughes JMB. Diffusive gas exchange. En: Whipp BJ, Wasserman K, eds. Exercise: pulmonary physiology and patophysiology. New York: Dekker; p Whipp BJ, Wasserman K. Coupling of ventilation to pulmonary gas exchange during exercise. En: Whipp BJ, Wasserman K, eds. Exercise: pulmonary physiology and patophysiology. New York: Dekker; p Konno K, Mead J. Static volume-pressure characteristics of the rib cage and abdomen. J Appl Physiol. 1968; 24(4): Agostoni E. Mechanics of the pleural space. Physiol Rev. 1972;52(1): Mead J. Mechanical properties of lungs. Physiol Rev. 1961;41: Rahn H, Otis AB. The pressure-volume diagram of the thorax and lung. Am J Physiol. 1946;146(2): Green M, Pride NB. Normal respiratory mechanics. En: Scadding JG, Cumming G, Thurlbeck WM, eds. Scientific foundations of respiratory medicine. London: Heinemann; p Mead J, Turner JM, Macklem PT, Little JB. Significance of the relationship between lung recoil and maximum expiratory flow. J Appl Physiol. 1967;22(1): Pedley TJ, Schroter RC, Sudlow MF. Energy losses and pressure drop in models of human airways. Respir Physiol. 1970;9(3): Pride NB, Permutt S, Riley RL, Bromberger-Barnea B. Determinants of maximal expiratory flow from the lungs. J Appl Physiol. 1967;23(5): Chang HK, Cheng RT, Farhi LE. A model study of gas diffusion in alveolar sacs. Respir Physiol. 1973;18(3):
24 Parte TEÓRICA El sistema respiratorio Generalidades de la espirometría 15 María Jesús Rodríguez Nieto Laboratorio de Función Pulmonar. Servicio de Neumología Fundación Jiménez Díaz-Capio. Madrid Objetivos Los objetivos de este capítulo son: a) conocer los parámetros que se utilizan de forma rutinaria en las espirometrías y ser capaces de identificar dónde se realizan estas medidas, y b) establecer el valor diagnóstico y pronóstico de esta prueba en la evaluación de los pacientes respiratorios. Terminología de la espirometría La espirometría es una prueba que mide, en condiciones controladas, el volumen de aire (litros) que un sujeto puede inspirar y espirar en función del tiempo. Es importante recordar los distintos volúmenes y capacidades pulmonares, tal como está representado en la figura 1. Se trata de un gráfico donde vemos el volumen que moviliza un sujeto en función del tiempo, siendo la línea ascendente la inspiración y la descendente la espiración. Al principio, el sujeto respira en reposo, movilizando una cantidad de aire en cada ciclo que denominamos «volumen corriente» (VC) o «volumen tidal» (VT); después, se le indica que expulse todo el aire hasta vaciarse y, desde esta situación, que llene completamente el pecho. La cantidad de aire que queda en el pulmón tras una espiración al máximo o forzada se llama «volumen residual» (RV), el cual no se puede medir con una espirometría. El volumen de aire que entra o sale del pulmón, al inspirar desde RV o espirar desde la situación en la que el pulmón está completamente lleno, se conoce como «capacidad vital inspiratoria o espiratoria» (VC ins o esp). El volumen de reserva espiratorio es la cantidad de aire que se expulsa desde la espiración a Vc hasta RV, y el volumen de reserva inspiratorio es la cantidad de aire que se introduce en el pulmón desde la inspiración a Vc hasta el punto de máxima inspiración. El volumen de aire que contiene el pulmón en el punto de máxima inspiración es la capacidad pulmonar total (TLC). El volumen de aire que contiene el pulmón al final de la espiración a Vc es la capacidad residual funcional (FRC). Estos dos volúmenes (TLC y FRC) tampoco se pueden medir con una espirometría. Los valores espirométricos se obtienen de una maniobra espiratoria forzada de capacidad vital, que requiere que el paciente expulse el aire rápidamente desde el punto de máxima inspiración. De esta maniobra espiratoria forzada se obtienen los parámetros más importantes de la espirometría. Estos parámetros son: Capacidad vital forzada (FVC). Es el volumen de aire que el sujeto exhala en una maniobra espiratoria forzada después de una inspiración máxima. Se expresa en litros en condiciones BTPS (Body Temperature and Pressure Saturated with water vapor), es decir, corregido para la temperatura corporal y presión ambiental saturada con vapor de agua.
25 16 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 1. Trazado del volumen que moviliza un sujeto en función del tiempo, con los distintos volúmenes y capacidades pulmonares Volumen de reserva inspiratorio Volumen corriente Volumen de reserva espiratorio Volumen residual Capacidad vital inspiratoria Capacidad residual funcional Capacidad pulmonar total Volumen espiratorio forzado en el primer segundo (FEV1). Es el máximo volumen de aire exhalado en el primer segundo de una espiración máxima, realizada después de una inspiración máxima. Se expresa también en litros (BTPS) Estandarización del FEV1 sobre la FVC (FEV1/FVC). Es el porcentaje de la FVC que el paciente puede espirar en el primer segundo de una espiración forzada, realizada después de una inspiración máxima. Se expresa en %. Está característicamente disminuido en la patología obstructiva. Pico de flujo espiratorio (PEF). Es el flujo más alto alcanzado en la espiración forzada, comenzando la maniobra sin pausa desde una inspiración máxima. Se genera antes de haber expulsado el 15% de la FVC. Se expresa en litros por segundo (l/s) o en litros por minuto (l/min). Este parámetro se puede medir también de una forma sencilla con unos dispositivos portátiles utilizados, sobre todo, en el tratamiento del asma (peak flow meter). FEF25-75%. Es el flujo espiratorio forzado medio entre el 25 y el 75% de la FVC; también se conoce como flujo mesoespiratorio. Se expresa en l/s. Este parámetro es sensible pero no específico de la patología obstructiva. Volumen espiratorio forzado a los 6 s (FEV6). Es el máximo volumen de aire exhalado a los 6 s de una espiración máxima realizada tras una inspiración máxima. Se expresa en litros (BTPS). Se puede utilizar en vez de la FVC y para normalizar el FEV1
26 Parte TEÓRICA Generalidades de la espirometría (FEV1/FEV6). Es reproducible y supone un menor esfuerzo para los pacientes, pero su empleo está menos extendido. Además de estos valores, el informe de las espirometrías contiene un gráfico con los flujos espiratorios (a veces también inspiratorios) en función del volumen (curva flujo-volumen). Este gráfico aporta información valiosa sobre la mecánica respiratoria del sujeto y permite identificar algunos errores en la maniobra. Como veremos ahora, en esta curva aparecen la mayoría de estos parámetros. Maniobra espiratoria forzada Trazados volumen-tiempo y flujo-volumen 17 El resultado de la espirometría se representa de forma gráfica con dos trazados: curva volumen-tiempo y curva flujo-volumen (fig. 2). La curva volumen-tiempo de un sujeto normal permite ver cómo la mayor parte de la FVC se exhala en el primer segundo, con una pronunciada caída del volumen al principio de la maniobra. En este gráfico podemos comprobar los errores de la maniobra en cuanto a su finalización: para que sea correcta, el sujeto debe mantener la espiración más de 6 s o que en el trazado se observe una meseta, es decir, que espira < 0,025 l en 1 s. La curva flujo-volumen, como hemos comentado antes, nos informa de la mecánica respiratoria, cambiando claramente su morfología en la patología obstructiva. La evaluación del trazado de esta curva es sensible a problemas para aceptarla como correcta en cuanto al inicio (el pico de flujo debe estar al principio de la maniobra) y problemas durante la maniobra, que limitan el flujo espiratorio y hacen que el resultado no sea aceptable (cierre de glotis, tos, esfuerzo submáximo u obstrucción de la boquilla). Para una correcta evaluación de la espirometría es necesario disponer de estos dos trazados, ya que se complementan en la información que aportan. Identificación de los diferentes parámetros en los trazados En la figura 3 vemos ambas curvas para un sujeto normal. La FVC se identifica bien en las dos, ya que es el punto de mayor volu- Figura 2. Curvas flujo-volumen y volumen-tiempo de una maniobra espiratoria forzada de capacidad vital de un sujeto sano Volumen Flujo Tiempo Curva flujo-volumen Volumen Curva volumen-tiempo
27 18 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 3. FVC, FEV1 y PEF en curvas espirométricas FVC PEF FEV1 Volumen Flujo FEV1 Tiempo 6 s Volumen FVC men espirado. Es fácil ver el FEV1 en la curva volumen-tiempo, pero no en la flujo-volumen. Actualmente, la mayoría de los equipos marca un punto en el trazado de la curva flujovolumen, cerca de la FVC en sujetos normales, que corresponde al FEV1. El PEF sólo se ve en la curva flujo-volumen y, como ya se ha comentado, cabe estar atentos a que esté al comienzo de la espiración forzada. En la figura 4 está representado el cálculo del flujo mesoespiratorio, que sería Vm/Tm. Papel diagnóstico y pronóstico de la espirometría en las enfermedades respiratorias La espirometría desempeña un papel importante y diferencial en el cuidado de los pacientes con enfermedades respiratorias y, también, en su prevención. Ofrecen información objetiva de la función del pulmón, la cual se debe interpretar junto con los datos clínicos del paciente que muchas veces son subjetivos, p. ej., la disnea. Además, proporciona información reproducible, comparable en el tiempo, que permite controlar el curso o el tratamiento de estas enfermedades. Es realmente importante, porque como todos sabemos, los síntomas respiratorios correlacionan pobremente la gravedad de la enfermedad y su progresión. También son importantes para establecer el pronóstico tanto los valores basales (p. ej., en la enfermedad pulmonar obstructiva crónica, EPOC), como los cambios a lo largo del tiempo. Así, en la fibrosis pulmonar hay estudios que demuestran que cambios en 6-12 meses en la FVC (disminución de la FVC > 10%) predicen peor pronóstico. Figura 4. Cálculo del flujo espiratorio forzado entre el 25 y el 75% de la capacidad vital 75% 25% VC Volumen tm Vm FEF25-75% = Vm/tm Tiempo
28 Parte TEÓRICA Generalidades de la espirometría 19 Tabla 1. Indicaciones de la espirometría Diagnóstico Evaluación pulmonar Motivada por síntomas: tos, sibilancias, disnea Motivada por signos físicos: sibilancias, crepitantes, tiempo espiratorio alargado, cianosis, acropaquias, alteración en la caja torácica, alteración en la mecánica diafragmática, patrón respiratorio o frecuencia respiratoria alterados Motivada por otras pruebas diagnósticas: alteración en los gases sanguíneos, alteraciones radiológicas o en la oximetría Evaluación en enfermedades no pulmonares Enfermedades neuromusculares, sobre todo si hay debilidad muscular Enfermedades inflamatorias, incluidas las conectivopatías y la enfermedad inflamatoria intestinal Enfermedades por exposición Profesional Medioambiental Fármacos con toxicidad pulmonar Radioterapia (pulmón, cuello, cabeza y parte superior del abdomen) Control y seguimiento Enfermedades pulmonares: beneficio del tratamiento, progresión, pronóstico, detección de cambios subclínicos. Enfermedades sistémicas con afectación pulmonar Cribado Fumadores > 45 años o fumadores con síntomas respiratorios Personas expuestas en su trabajo Estudios de salud pública Evaluación de la incapacidad Estudio preoperatorio Resección pulmonar Cirugía toracoabdominal Estudios epidemiológicos de salud En la tabla 1 se resumen las numerosas indicaciones de la espirometría. Es esencial en el diagnóstico de algunas enfermedades, como el asma y la EPOC y, siendo estas enfermedades tan prevalentes, la utilización de espirometría intenta ampliar al ámbito de la atención primaria con el objetivo de diagnosticarlas mejor. Las enfermedades obstructivas (asma, EPOC, enfisema) muestran un patrón espirométrico diferente de las restrictivas (fibrosis, alteraciones de la pared torácica, patología pleural, etc.). En el caso de un patrón obstructivo, se puede realizar una prueba broncodilatadora, administrando después de la espirometría basal un broncodilatador y, tras unos minutos, repetir la espirometría. Esta prueba se define como positiva si mejora un 12% y 200 ml el FEV1 y/o la FVC. Sirve para poner de manifiesto la presencia de hiperreactividad bronquial, presente en enfermedades de la vía aérea y necesaria para el diagnóstico de asma. La espirometría es una técnica segura, barata y rápida comparada con otras pruebas diagnósticas, pero requiere la cooperación del paciente para que los datos sean válidos. El técnico que la realiza debe adquirir unos conocimientos y habilidades concretos para obtener pruebas válidas y familiarizarse con los equipos. Todas estas razones hacen que a veces sea difícil de implementar en atención primaria. Bibliografía Miller MR, Hankinson J, Brusasco V, et al.; ATS/ERS Task Force. Standardisation of spirometry. Eur Respir J. 2005;26: Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function test. Eur Respir J. 2005;26:
29 20 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Espirometría de calidad Felip Burgos Rincón Centro Diagnóstico Respiratorio. Servicio de Neumología (ICT) IDIBAPS - Universitat de Barcelona Hospital Clínic. Barcelona Introducción La espirometría forzada (EF) es una prueba esencial en el diagnóstico, control y manejo de las enfermedades respiratorias [1,2]. Diversas guías clínicas [3-5] nacionales e internacionales ponen el acento en la utilización extensiva de la espirometría como instrumento básico para la detección precoz de pacientes con enfermedad pulmonar obstructiva crónica (EPOC). Esto es especialmente importante al constatarse que una gran proporción de pacientes con EPOC están sin diagnosticar, incluso en fases relativamente avanzadas de la enfermedad. La utilización de la espirometría está incrementándose día a día y de manera muy importante en diversos ámbitos externos a los laboratorios de función pulmonar (LFP), como la asistencia primaria. Diversos estudios han puesto énfasis en la importancia de garantizar la calidad de la espirometría en el ámbito de la atención primaria. Eaton et al. [6] evaluaron 30 centros en Nueva Zelanda y observaron que en el grupo de centros con entrenamiento se realizaban un mayor número de espirometrías correctas que en los centros sin adiestramiento; no obstante, los autores sugieren que, además de un aprendizaje específico en la realización de la espirometría, se deberían efectuar programas continuados de control de calidad. La problemática que se presenta en la realización de la espirometría en atención primaria puede ser minimizada con la implementación de nuevos espirómetros que contengan un software que permita un empleo más sencillo y apropiado que los diseñados en la actualidad. Los espirómetros deberían incluir mensajes cuando las maniobras no cumplan los criterios de calidad exigidos por las normativas y que permitieran al personal que la realiza mejorar la calidad de la espirometría. Aunque esta calidad todavía no se ha alcanzado, es un objetivo asumible, tal como se ha demostrado en estudios epidemiológicos [7,8]; no obstante, la falta de estrategias globales no ha permitido su generalización. Por lo tanto, es posible aspirar a una espirometría de calidad en todos los ámbitos asistenciales, incluso, en medios no sanitarios, como el domicilio del propio paciente y las farmacias [9]. Diversos autores han demostrado que un modelo centralizado [10-14] y con tecnología, basado en web, puede garantizar altos niveles de calidad [14]. En definitiva, el objetivo de conseguir una espirometría de calidad requiere la integración de estrategias diversas: formación [15,16], definición de estándares para la transmisión de la información [17], requerimientos técnicos en las adquisiciones de aparatos [17] y modelos de control de calidad centralizados [14]. El impacto creciente de las tecnologías de la información y comunicación (TIC) en medicina son una realidad, y no cabe duda de que la espirometría no será ajena a estos cambios tecnológicos; es preciso que esté en la anamnesis como se merece, por historia y utilidad clínica: sólo integrando la función pulmonar
30 Parte TEÓRICA Espirometría de calidad 21 Figura 1. Espirómetro de agua John Hutchinson (Museo de Historia de la Medicina, Londres) Tabla 1. Tipos de espirómetros De agua Espirómetros volumétricos Secos Pistón Medidores de flujo Fleisch Lilly en los registros informáticos podremos garantizar un adecuado control de calidad. Tipos de espirómetros. Espirómetro de oficina frente al de laboratorio La espirometría se conoce desde 1846, cuando John Hutchinson presentó el primer equipo para medir los volúmenes pulmonares en la publicación «On the capacity of the lungs and on the respiratory functions, with a view of establishing a precise and easy method of detecting disease by the spirometer» (fig. 1); en ella describía que la capacidad vital se relacionaba directamente con la altura e inversamente con la edad del individuo. Actualmente podemos dividir los espirómetros por la tecnología que emplean para medir los volúmenes pulmonares (tabla 1), Pitot Turbina Ultrasonidos Filamento caliente
31 22 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 2. Jeringa de calibración de 3 litros pero cada vez más se utiliza la división entre equipos de laboratorio y equipos de atención primaria (espirómetros de oficina); esta división no debería implicar una menor calidad de éstos por ser pequeños y más baratos, sino que todos ellos deberían cumplir con las Figura 3. Calibración con jeringa de 3 litros
32 Parte TEÓRICA Espirometría de calidad recomendaciones ERS/ATS (European Respiratory Society/American Thoracic Society), 2005 [18]. Calibraciones de los equipos Los espirómetros, como cualquier equipo de control y/o diagnóstico, pueden generar valores erróneos y, por tanto, información clínica sesgada; por ello, debemos calibrar o comprobar (check) para minimizar dichos errores. Una buena calibración debe realizarse diariamente con una jeringa de 3 l, y la desviación debe ser inferior a ± 3,5% (2,895 l - 3,105 l) (fig. 2). Para realizar la calibración deben seguirse la normas de cada fabricante, pero, como norma general, deberían efectuarse 2-3 desplazamientos de la jeringa para homogeneizar la temperatura entre el sensor y la jeringa, y entre 3 y 5 maniobras de calibración con un error inferior a ± 3,5% (fig. 3). Figura 4. Condiciones ambientales Temperatura C Presión atmosférica mmhg Humedad % Factores ambientales y técnicos relevantes 23 La temperatura es un elemento importante a tener en cuenta, dado que se utiliza para efectuar la corrección a valores BTPS (Body Temperature and Pressure Saturated with water vapor) en los que expresaremos los resultados finales de la EF; asimismo, se deberían introducir los valores de presión atmosférica y de humedad relativa (fig. 4). Actualmente muchos equipos incorporan sensores de estos parámetros. Control de la infección No hay evidencia científica de que la espirometría pueda producir transmisión infecciosa, aunque se puede especular que el riesgo de transmisión de microorganismos es inversamente proporcional a la frecuencia de limpieza y de cambio de las partes contaminables de los equipos. Como norma general deberíamos: a) usar boquillas desechables; b) desmontar, limpiar, desinfectar y secar perfectamente las piezas, tubos, etc., no desechables; c) evitar la acumulación de vapor de agua en los sensores y los tubos (fig. 5); d) cambiar, entre pacientes, las pinzas; e) limpiarnos las manos después de cada exploración y entre pacientes, y f) si se utilizan filtros, desecharlos entre pacientes. Precisión y reproducibilidad La precisión de los equipos debe cumplir los requerimientos de estandarización ERS/ATS [18]: «El espirómetro debe ser capaz de acumular volumen durante 15 s (se recomiendan tiempos más largos) y medir volúmenes 8 l (BTPS) con una precisión de, por lo menos, ± 3% del valor o ± 0,050 l el mayor de los dos valores, con flujos entre 0 y 14 l/s 1. La
33 24 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 5. Vapor de agua depositado en el sensor Figura 6. Algoritmo de selección de la espirometría [18] Vapor de H2O No No No Realizar la maniobra de FVC Sí Cumple los criterios de aceptabilidad? Sí Se han logrado 3 maniobras aceptables? Sí Se cumplen los criterios de repetibilidad entre maniobras? (máximo 8 maniobras) resistencia total al flujo de aire a 14 l/s 1 debe ser < 1,5 cmh2o/l 1 /s 1 (0,15 kpa/l 1 /s 1 (v. Recomendaciones mínimas para equipos de espirometría). La resistencia total debe ser medida con cualquier tubo, válvulas, filtros previos, etc., que pueda colocarse entre el sujeto y el espirómetro. Algunos equipos pueden mostrar cambios en la resistencia debidos a la condensación de vapor de agua, y los requerimientos de precisión deben cumplirse bajo condiciones BTPS hasta 8 maniobras de FVC consecutivas, realizadas en un periodo de 10 minutos sin inspiración, desde el instrumento». En resumen, los criterios de repetitividad entre maniobra son: Después de obtener 3 maniobras aceptables, aplicar los siguientes criterios: Los dos valores más altos de FVC no deben diferir más de 0,150 l. Los dos valores más altos de FEV1 no deben diferir más de 0,150 l. Si ambos criterios se cumplen, la prueba puede concluirse. Si ninguno de los dos criterios se cumple, continuar la prueba hasta que: Determinar el mayor FVC y FEV1 Seleccionar la maniobra con la mayor suma FVC + FEV1 para determinar otros índices Guardar e interpretar Ambos criterios se cumplen al analizar las maniobras aceptables adicionales, o Se han realizado un total de 8 maniobras (opcional), o El paciente/sujeto no puede o no debe continuar. Guardar, como mínimo, las 3 maniobras satisfactorias (fig. 6) Control de calidad Un aspecto fundamental para conseguir un buen control de calidad es que todos los profesionales relacionados con la medición de la EF estén formados. Por lo tanto, es crucial diseñar una formación reglada, como se ha propuesto en Cataluña y en Europa a través del Plan Director de Enfermedades Respiratorias (PDMAR) y la European Respiratory Society (ERS) [15,16], respectivamente, para entrenar profesionales que sean capaces de obtener espirometrías de calidad.
34 Parte TEÓRICA Espirometría de calidad 25 Figura 7. Ejemplo de control de la linealidad a tres flujos diferentes Sin lugar a dudas, el primer control de calidad que cabe realizar es calibrar los espirómetros diariamente; asimismo, deberíamos realizar una comprobación semanal de la linealidad, con, al menos, 3 rangos de flujo diferentes (alto, medio y bajo) (fig. 7). Para un control de calidad óptimo son útiles tanto la presentación en pantalla de flujovolumen como las de volumen-tiempo, y los profesionales que realizan la EF deberían inspeccionar visualmente la ejecución de cada maniobra, para controlar su calidad, antes de proceder a una nueva maniobra (fig. 8). Esta inspección requiere que los trazados cumplan los requerimientos de tamaño mínimo y resolución que se establecen en los estándares ERS/ATS [18]. En resumen, para garantizar una espirometría de calidad debemos diseñar una estrategia global que incluya: a) formación reglada; b) definición de estándares para la transmisión de la información; c) requerimientos técnicos en las adquisiciones de aparatos que cumplan con criterios de conectividad, y d) diseño de modelos de control de calidad centralizados.
35 26 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 8. Gráficas volumen-tiempo y flujo-volumen FVC PEF FEV1 Volumen Flujo FEV1 Tiempo 6 s Volumen FVC Curva flujo-volumen Curva volumen-tiempo En la curva volumen-tiempo, el punto más elevado del trazado corresponde a la FVC. Si se traza una línea vertical en el primer segundo, puede verse dónde corta la curva, el volumen correspondiente es el FEV1. La curva de volumen permite ver la correcta finalización de la maniobra (meseta o plateau). La curva fujo-volumen permite ver el correcto inicio de la maniobra y su transcurso con una buena visualización, pero es bastante ineficaz para ver la finalización. Bibliografía 1. Becklake MR. Evaluation of tests of lung function for screening for early detection of chronic obstructive lung diseases. En: Macklem PT, Permutt S, eds. The lung in the transition between health and disease. New York/ Basel: Dekker; p Celli BR. The importance of spirometry in COPD and asthma: effect on approach to management. Chest. 2000;117:S Bateman ED, Hurd SS, Barnes PJ, et al. Global strategy for asthma management and prevention: GINA executive summary. Eur Respir J. 2008;31: Peces-Barba G, Barbera JA, Agustí A, et al. Diagnosis and management of chronic obstructive pulmonary disease: joint guidelines of the Spanish Society of Pulmonology and Thoracic Surgery (SEPAR) and the Latin American Thoracic Society (ALAT). Arch Bronconeumol. 2008;44: Rabe KF, Hurd S, Anzueto A, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med. 2007;176: Eaton T, Withy S, Garrett JE, et al. Spirometry in primary care practice: the importance of quality assurance and the impact of spirometry workshops. Chest. 1999;116: Pérez Padilla R, Vázquez García JC, Márquez MN, Menezes AM. Spirometry quality-control strategies in a multinational study of the prevalence of chronic obstructive pulmonary disease. Respir Care. 2008;53: Enright PL, Skloot GS, Cox-Ganser JM, et al. Quality of spirometry performed by 13,599 participants in the World Trade Center worker and volunteer medical screening program. Respir Care. 2010;55(3): Castillo D, Guayta R, Giner J, et al.; FARMAEPOC group. COPD case finding by spirometry in high-risk customers of urban community pharmacies: a pilot-study. Respir Med. 2009;103(6): Bonavia M, Averame G, Canonica W, et al. Feasibility and validation of telespirometry in general practice: the Italian «Alliance» study. Respir Med. 2009;103: Bellia V, Pistelli R, Catalano F, et al. Quality control of spirometry in the elderly. The SARA (SAlute Respiration nell Anziano) study. Am J Respir Crit Care Med. 2000;161: Spirometry Monitoring Technology - SPIROLA. NIOSH - Spirometry in Occupational Medicine. U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health. Disponible en: cdc.gov/niosh/spirometry/spirola.html 13. Masa JF, González MT, Pereira R, et al. Validity of spirometry performed online. Eur Respir J. 2011;37:911-8.
36 Parte TEÓRICA Espirometría de calidad 14. Burgos F, Disdier C, López de Santamaría E, et al.; Group. Telemedicine enhances quality of forced spirometry in primary care. Eur Respir J. 2012;39(6): Escarrabill J, Roger N, Burgos F, et al.; Grupo de Función Pulmonar y equipo directivo del PDMAR. Diseño de un programa de formación básico para conseguir espirometrías de calidad. Educ Med. 2012;15(2): Cooper BG, Steenbruggen I, Mitchell S, et al.; HER- MES Spirometry: the European Spirometry Driving Licence. Breathe. 2011;7: Salas T, Rubies C, Gallego C, et al. Requerimientos técnicos de los espirómetros en la estrategia para garantizar el acceso a una espirometría de calidad. Arch Bronconeumol. 2011;47(9): Miller MR, Hankinson J, Brusasco V, et al. Standardisation of spirometry. Eur Respir J. 2005;26 (319-38).
37 28 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Técnica de espirometría Jordi Giner Donaire Servicio de Neumología Hospital de la Santa Creu i Sant Pau. Barcelona Para la correcta realización de una espirometría nos basaremos en las recomendaciones que la ATS (American Thoracic Society) y la ERS (European Respiratory Society) propusieron el año 2005 [1] y que, posteriormente, Levy et al. [2] universalizaron. También nos guiaremos por los «Procedimientos» que en su día propuso la SEPAR (Sociedad Española de Neumología y Cirugía Torácica) [3]. En primer lugar, es necesario disponer de un espacio reservado y exclusivo, lo que significa que, durante su realización, no debe compartirse con otro tipo de pruebas, ya que será necesario dar una orden firme (grito, estímulo) para conseguir un buen inicio de la maniobra y, posteriormente, continuar incitando al paciente hasta el final. Además, es conveniente que éste se siente en un sillón amplio, cómodo y con brazos, ya que, aunque no es habitual, puede sufrir un pequeño síncope debido al esfuerzo que se le pide al realizar la maniobra; los brazos del sillón asegurarán que el paciente no caiga. ello, el primer paso que debe realizarse diariamente es la calibración, o, en su defecto, la comprobación de la medición (en los equipos que no permiten realizar la calibración) con una jeringa de 3 litros de volumen. Así, se realizarán 3 maniobras de espiración e inspiración a flujos distintos (fig. 1), hasta que el equipo nos indique que está calibrado. Una vez conformado, ya está listo para su utilización. Preparación del sujeto Para la realización de la espirometría informaremos al paciente que: no debe fumar en las horas previas, debe evitar comidas Figura 1. Calibración, 3 emboladas a diferentes flujos (rápido, lento y mediano), el orden no tiene mayor importancia Preparación del equipo Además del espirómetro, es necesario disponer de un tallímetro y una báscula para recoger los datos antropométricos, una estación meteorológica para obtener los datos atmosféricos (presión, temperatura y humedad), una pinza nasal, el contenedor de filtros y boquillas y una jeringa de calibración. Como todo equipo de medición, el espirómetro requiere asegurar la medida que realiza; para
38 Parte TEÓRICA Técnica de la espirometría copiosas o bebidas abundantes, debe controlar previamente la medicación broncodilatadora y procurar no realizar ejercicio con anterioridad; es conveniente que no lleve ropa ajustada que pudiera dificultar la realización de maniobras máximas. Con respecto a los fármacos broncodilatadores, se advertirá al paciente evitarlos, si es posible, durante el periodo de tiempo adecuado a cada uno (tabla 1), para obtener los datos de su estado basal. En algunos casos, por indicación médica o por imposibilidad del paciente para mantenerse sin tomar la medicación, la espirometría puede realizarse sin suspenderlos. En tal caso se registrará el nombre del fármaco, el tiempo que hace que lo ha tomado y el número de inhalaciones en principio, no es preciso suspender los corticosteroides inhalados. Posición del sujeto Para la realización de la espirometría, el sujeto estará cómodamente sentado, con la espalda apoyada en el respaldo del sillón y se vigilará que durante la maniobra no se incline hacia delante; para ello, se apoyará la mano sobre su hombro impidiendo la inclinación. Tabla 1. Tiempo de espera aconsejado para realizar la espirometría después de haber tomado medicación broncodilatadora Fármaco Horas Agonistas b2 de acción corta 6 Agonistas b2 de acción larga 12 Anticolinérgicos de acción corta 6 Anticolinérgicos de acción larga 24 Teofilinas retardadas Datos atmosféricos y antropométricos 29 Antes de realizar la espirometría introduciremos los datos atmosféricos. Esta acción se realiza constante y automáticamente si el espirómetro dispone de una estación meteorológica incorporada; en caso contrario, será suficiente con entrarlos para el proceso de calibración, ya que se mantendrán hasta la siguiente calibración. El siguiente paso es la introducción de los datos antropométricos: fecha de nacimiento (edad según los modelos) y sexo, para que el equipo calcule los parámetros de referencia. Además, junto a los datos antropométricos, siempre deberá identificarse la persona que ha dirigido la espirometría y que es, por tanto, el responsable directo; en general, todos los programas tienen una identificación del «técnico» que ha realizado la prueba. Realización de la prueba Se darán al sujeto las instrucciones necesarias, que deberán ser precisas, claras y concisas, para obtener su máxima colaboración. Se le indicará que: a) coja todo el aire que pueda; b) que se coloque la boquilla en la boca, mordiéndola pero sin deformarla, y c) se le pedirá que sople fuerte, seguido y sin parar hasta que se le indique. Uno de los problemas más habituales en la realización de la espirometría es que el paciente pare la espiración ante su sensación de que no le queda más aire, pero se le debe advertir que, aunque tenga tal impresión, debe continuar hasta que se le indique y que será verificado por el técnico a través de la gráfica. Valoración de la maniobra, aceptabilidad Para realizar una valoración de las maniobras, en primer lugar deberán observarse las gráficas, tanto la de flujo-volumen (esta
39 30 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 2. Obsérvese cómo algunos de los posibles errores en las maniobras pueden o no apreciarse según se visualice con la maniobra de flujo-volumen o de volumen-tiempo 6 (l) 12 (l/s) (s) (l) curva nos dará una muy buena información del inicio y del final de la maniobra, pero escasa del transcurso) como la de volumentiempo (de la que podemos obtener muy buena información del inicio y transcurso de la maniobra y muy escasa del final), ya que la información que nos facilitan es complementaria, como puede apreciarse en la figura 2, para tener en cuenta la aceptabilidad de las maniobras, es decir, que éstas no contengan errores. Los errores pueden ocurrir en el inicio, en el transcurso o/y en la finalización de la maniobra: El inicio de la maniobra debe ser rápido, brusco y sin vacilaciones. Un indicativo de ello es el volumen extrapolado, que debe ser inferior a 150 ml o el 5% de la capa- Figura 3. Ejemplos de maniobra mal iniciada y bien iniciada 12 (l/s) 12 (l/s) (l) (l) Maniobra mal iniciada Maniobra bien iniciada
40 Parte TEÓRICA Técnica de la espirometría Figura 4. Cómo se calcula, por extrapolación retrograda, el inicio de la maniobra Punto de tiempo 0 Volumen extrapolado cidad vital forzada (FVC) (este parámetro lo calcula habitualmente el espirómetro). En la mayoría de los equipos, cuando no se cumple esta condición, se indica con un aviso de «error de extrapolación» (EX). En la figura 3 se representan ejemplos de maniobras, una con un mal inicio y otra con buen inicio. La extrapolación retrógrada es el procedimiento para determinar el punto cero de tiempo y de volumen o flujo (inicio calculado de la maniobra). En la figura 4 puede apreciarse cómo se calcula 31 en una maniobra espirométrica de volumen-tiempo: se prolongan las líneas base de tiempo y volumen (en color negro), y el punto donde se cortan es el punto de tiempo «cero» extrapolado. Otra forma de evaluar el inicio es que el peak flow rigth (PFR) se encuentre en los 120 primeros milisegundos de la maniobra; en caso contrario, el equipo nos avisa de que se ha producido un error (fig. 5). El transcurso de la maniobra debe ser una curva continua y sin artefactos. Para verificarlo, deberemos observar la maniobra de flujo-volumen en la de volumentiempo es muy difícil de observar, a menos que éste sea muy evidente. Sobre todo, debe procurarse que estas alteraciones, generalmente por tos durante la espiración, no se produzcan en el primer segundo, ya que podría alterar la medición del FEV1 (fig. 6). El tercer y último punto en la inspección de la maniobra es la finalización, que debe ser suave, sin cambios en el último segundo, como se aprecia en la figura 7. Igual que al inicio, el equipo indica que el final no es correcto con el mensaje de «error final de la prueba» (FP) o simi- Figura 5. Maniobras sin error de extrapolación pero con el PFR posterior a los primeros 120 milisegundos 12 (l/s) 12 (l/s) (l) (l)
41 32 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 6. Ejemplos de un transcurso de la maniobra incorrecto y correcto 12 (l/s) 12 (l/s) (l) (l) Transcurso de la maniobra incorrecto Transcurso de la maniobra correcto lar. Además, el tiempo de la maniobra debería ser igual o superior a 6 s (3 s en los menores de 10 años). Cuando no se cumple este criterio, el equipo indica «error tiempo de la prueba» (TP) (fig. 8). Este último requisito muchas veces es difícil de conseguir, sobre todo en individuos sanos y en jóvenes. Valoración de la maniobra, reproducibilidad Una vez obtenido un mínimo de tres maniobras aceptables, sin errores, se verificará la reproducibilidad de las maniobras; para ello es necesario un mínimo de dos maniobras en que las diferencias entre las mejores FVC Figura 7. Ejemplo de maniobra mal finalizada (el flujo se interrumpe bruscamente) y bien finalizada 12 (l/s) 12 (l/s) (l) (l) Maniobra mal finalizada Maniobra bien finalizada
42 Parte TEÓRICA Técnica de la espirometría Figura 8. Ejemplo de maniobra mal finalizada, tiempo de la maniobra inferior a 6 s, sólo puede apreciarse en la curva volumen-tiempo (l) y FEV1 sean inferiores a 150 ml (100 ml si la FVC es inferior a 1 l). Para conseguir unas buenas maniobras, éstas deben ser aceptables (sin errores) y entre ellas, además, ser reproducibles. La figura 9 muestra ejemplos de reproducibilidad. Calidad de las maniobras La evaluación final de la espirometría debe realizarse desde tres vertientes diferentes: la gráfica, el grado de calidad y, finalmente, (s) 33 los valores espirométricos. Actualmente, el grado de calidad de la espirometría es poco utilizado, pero cada día es más frecuente en estudios epidemiológicos y debería extenderse como un dato adicional de la prueba. El grado de calidad de la espirometría no tiene una definición universal; diferentes autores han utilizado distintas propuestas pero, si partimos de las recomendaciones de la ATS/ERS-2005 [1], los que utilizan Pérez-Padilla et al. [4] en el estudio Platino parecen los más coherentes. Los definió de la siguiente forma: Grado A: tres maniobras aceptables (sin errores) y, entre las dos mejores FVC y FEV1, una diferencia inferior a 150 ml. Grado B: tres maniobras aceptables (sin errores) y, entre las dos mejores FVC y FEV1, una diferencia entre 150 y 200 ml. Grado C: dos o tres maniobras aceptables (sin errores) y, entre las dos mejores FVC y FEV1, una diferencia entre 201 y 250 ml. Grado D: dos o tres maniobras aceptables (sin errores) y, entre las dos mejores FVC y FEV1, una diferencia superior a 250 ml. Grado E: una sola maniobra aceptable (sin errores). Grado F: ninguna maniobra aceptable (sin errores). Figura 9. Ejemplo de maniobras reproducibles (l/s) M1 M2 M3 (l) Parámetro M1 (%) M2 (%) M3 (%) REF Mejor FVC Mejor FEV1 (l) (l) 3,77 3, ,77 3, ,77 3, ,22 3,18 MFEV1/MFVC (%) 83,57 83,57 83,57 FVC FEV1 FEV1/FVC PEF FEF50% FEF25%-75% (l) (l) (%) (l/s) (l/s) (l/s) 3,77 3,15 83,57 10,68 5,77 4, ,65 3,03 83,18 11,14 5,75 4, ,58 3,00 83,66 10,49 5,76 3, ,22 3,18 75,50 8,53 3,92 2,95
43 34 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Guardar registros De las tres maniobras sin errores se escogerá siempre la mejor FVC y el mejor FEV1, aunque se encuentren en maniobras distintas. En el caso de que estos valores se obtengan de una maniobra con errores, deberá indicarse. El resto de parámetros se seleccionarán de la maniobra con mayor suma de FVC y FEV1. Bibliografía 1. Miller MR, Hankinson J, Brusasco V, et al. Standardization of spirometry. Eur Respir J. 2005;26: Levy ML, Quanjer PH, Booker T, et al. Diagnostic spirometry in primary care. Proposed standards for general practice compliant with American Thoracic Society and European Respiratory Society recommendations. A General Practice Airways Group (GPIAG)1 document, in association with the Association for Respiratory Technology & Physiology (ARTP) and Education for Health. Prim Care Respir J. 2009;18(3): Casan P, Burgos F, Barberà JA, Giner J. Procedimientos de evaluación de la función pulmonar. Manual de procedimientos n.º 3. Madrid: Luzán 5; p Pérez-Padilla R, Vázquez-García JC, Márquez MN, Menezes AMB; PLATINO Group. Spirometry quality-control strategies in a multinational study of the prevalence of chronic obstructive pulmonary disease. Respir Care. 2008;53(8):
44 Parte TEÓRICA Interpretación de la espirometría Interpretación de la espirometría 35 Julia García de Pedro Médico Adjunto. Servicio de Neumología Hospital General Universitario Gregorio Marañón. Madrid Introducción La espirometría es una prueba funcional respiratoria básica, pero es la de mayor utilidad en el estudio de la función pulmonar. Es una exploración sencilla, reproducible, no invasiva, que consiste en el análisis, bajo circunstancias controladas, de la magnitud absoluta de los volúmenes pulmonares y la rapidez con que éstos pueden ser movilizados (flujos aéreos). Cuando hablamos de espirometría solemos referirnos a la espirometría forzada, que es la de mayor utilidad en la práctica clínica, pero no tenemos que olvidarnos de la espirometría lenta, que nos da una información complementaria a la forzada. En capítulos anteriores ya se ha explicado la técnica de realización de la espirometría y los criterios de aceptabilidad, así como sus indicaciones y contraindicaciones. En este capítulo vamos a interpretarla partiendo de que la maniobra es aceptable y reproducible, que son los primeros pasos, e imprescindibles, para su interpretación. el flujo en función del volumen (fig. 2: curva flujo-volumen). En la figura 3 están representadas una espirometría lenta (A), en la que, tras una espiración máxima, el paciente inhala hasta capacidad pulmonar total, y tras una breve pausa exhala de forma lenta, utilizando todo el tiempo que precise, hasta volumen residual. En la maniobra forzada (B), desde capacidad pulmonar total se le pide al paciente que exhale de forma vigorosa y rápida todo el volumen de aire en el menor tiempo posible, hasta volumen residual. En la maniobra forzada, el volumen de aire exhalado en el primer segundo es el FEV1 (flujo espiratorio máximo en el primer segundo). El gráfico C de la figura 3 representa la curva flujo-volumen. Figura 1. Gráfica volumen-tiempo 1 s FEF25-75% Los resultados de la espirometría se deben expresar tanto en valores numéricos (en valor absoluto y como porcentaje del valor teórico de referencia) como en representaciones gráficas. Volumen FVC FEV1 Con respecto a las expresiones gráficas, las podemos realizar de dos tipos, una que representa el volumen exhalado en función del tiempo (fig. 1: gráfica volumen-tiempo) y otra Tiempo FVC: capacidad vital forzada. FEV1: flujo espiratorio máximo en el primer segundo. FEF25-75%: flujos mesoespiratorios.
45 36 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 2. Curva flujo-volumen Flujo PEF: flujo espiratorio pico. Volumen Una vez que se ha conseguido una espirometría aceptable y reproducible, tenemos que comparar los resultados obtenidos con los valores de referencia. La correcta interpretación de la espirometría requiere utilizar valores de referencia apropiados para el paciente, con los cuales se comparan sus resultados obtenidos. En este contexto hay que tener en cuenta que el mejor valor de referencia de un sujeto son sus valores previos; por lo tanto, además de compararlos con los teóricos, en la práctica clínica se deben comparar con los resultados anteriores. Los valores de referencia se obtienen de ecuaciones de predicción que se han realizado a partir de amplios estudios epidemiológicos en sujetos sanos no fumadores con las mismas características antropométricas de altura, peso, sexo, etnia y edad. Por esto es importante utilizar las ecuaciones obtenidas con muestras de sujetos de nuestra comunidad. Lo ideal sería que cada laboratorio de función pulmonar obtuviera sus propias ecuaciones de predicción a partir de estudios en sujetos sanos de su población en los que se realizan las pruebas funcionales con la misma metodología, pero esto no suele estar al alcance de la mayoría de los centros. La Sociedad Española de Neumología y Cirugía Torácica (SEPAR), en su manual de procedimientos de evaluación de la función pulmonar [1], recomienda la utilización como valores de referencia para la espirometría forzada los obtenidos en el es- Figura 3. Comparación de la espirometría lenta (A), forzada (B) y curva flujovolumen (C) A B C 1 s PEF VCIN IC IRV VT ERV FEV1 FVC MEF25 MEF50 MEF75 VCIN: capacidad vital inspiratoria. IC: capacidad inspiratoria. IRV: volumen de reserva inspiratorio. VT: volumen corriente. ERV: volumen de reserva espiratorio. MEF 75,50,25: flujo espiratorio máximo al 75%, 50% o 25% de la capacidad vital forzada. PEF: flujo espiratorio pico.
46 Parte TEÓRICA Interpretación de la espirometría Figura 4. Expresión numérica de los resultados de la espirometría VC IN [l] IC [l] ERV [l] FEV [l] FVC [l] FEV 1 % VC IN... [%] FEV 1 % FVC.... [%] PEF [l/s] FEF [l/s] FEF [l/s] FEF [l/s] MMEF 75/25...[l/s] Teor Med % (M1/T) 3,79 3,85 101,5 2,71 2,42 89,5 1,09 1,62 149,3 2,92 3,25 111,2 3,66 4,04 110,6 76,8 84,53 110,1 80,43 7,79 9,54 122,6 1,46 0,92 63,1 4,11 4,38 106,8 6,86 8,78 128,0 3,41 3,04 89,3 Teor: valores de referencia o teóricos. Med: valores medidos. (M1/T): porcentaje de los valores medidos sobre los teóricos. l: litros. l/s: litros por segundo. tudio multicéntrico de Barcelona por Roca et al. y que han sido ampliamente validados para la población española. Por lo tanto, en la expresión numérica de los resultados tenemos tres columnas de datos (fig. 4): una donde se registran los valores de referencia del paciente para cada variable (valores teóricos), otra con los valores obtenidos en el paciente (valores absolutos o valores medidos) y otra donde se expresa el porcentaje de los valores obtenidos en relación con los valores de referencia (valores relativos o porcentuales). Este porcentaje se calcula dividiendo el valor observado entre el de referencia y se multiplica por 100: Valor de referencia (%) = (Valor observado / Valor de referencia) 100 Las ecuaciones de referencia no deben ser extrapoladas para pacientes cuya edad o estatura está fuera del rango de sujetos incluidos en el estudio de referencia. El empleo de factores de corrección para individuos de otras etnias no es tan adecuado 37 como el de ecuaciones de predicción específicas según la etnia, pero, si no disponemos de estas ecuaciones de predicción, se pueden utilizar los coeficientes de corrección. Por ejemplo, para afroamericanos se pueden obtener sus valores predichos multiplicando por 0,88 los valores de los sujetos caucásicos de su misma edad, sexo, peso y estatura [2,3]. Para orientales, el factor de corrección sería de 0,94 [4]. Estos ajustes se realizan en los valores del FEV1 y FVC (capacidad vital forzada), pero no en la relación FEV1/FVC. Todos los parámetros funcionales estudiados en un mismo paciente deben compararse con los valores teóricos obtenidos de la misma fuente de referencia. Valores de normalidad Se considera el rango normal para los parámetros de función pulmonar (FVC y FEV1) el comprendido entre el 80 y el 120% del valor de referencia calculado según las ecuaciones de predicción. Esto supone un amplio margen en el cual pueden producirse cambios, estando dentro del rango teórico de referencia, bien como resultado de la enfermedad o por el tratamiento. Por esto en muy importante la comparación de los resultados no sólo con los teóricos, sino también con los previos del paciente, si se dispone de ellos. Esta forma de expresar los resultados es sencilla, cómoda y de uso muy generalizado, pero considerar el límite inferior de la normalidad el 80% del valor de referencia, es arbitrario y carece de base científica sólida. Recientemente se está incorporando el criterio de límite inferior de normalidad (LIN) para expresar los parámetros de función pulmonar en relación con los valores de referencia. Las ecuaciones de predicción implican una definición de «salud» o «enfermedad» en términos estadísticos. Este límite inferior de normalidad se refiere estadísticamente a valores que se encuentran por debajo del percentil 5,
47 38 Módulo 3 Espirometría y otras pruebas funcionales respiratorias es decir, los que presentan menos del 5% de las personas sanas no fumadoras. Si los valores de referencia siguen una distribución normal o gaussiana (y tanto el FEV1 como la FVC siguen una distribución muy cerca de la normal salvo en edades extremas de la vida), este percentil 5 es equivalente al intervalo de confianza del 95% (IC 95%), que se puede calcular de la siguiente manera: LIN = valor de referencia (1,645 error estándar estimado [SEE]) Según la propia definición del IC 95%, estamos suponiendo que entre los sujetos «normales» hay un 5% de ellos que se encuentran fuera de este intervalo de referencia. Esto es muy importante para tenerlo en cuenta a la hora de interpretar los resultados de la espirometría, ya que no todos los sujetos que se sitúen por debajo del límite inferior de referencia deben considerarse patológicos. Parámetros espirométricos necesarios para la interpretación de la espirometría Los parámetros más importantes que se obtienen de la espirometría y curva flujo-volumen son los siguientes: Parámetros de volumen: Volumen corriente (VT), volumen de reserva inspiratorio (VRI) y volumen de reserva espiratorio (VRE) se obtienen de la espirometría lenta. Capacidad inspiratoria (CI): suma del VT y VRI. Máximo volumen de aire que puede inhalarse desde el final de una espiración normal hasta capacidad pulmonar total. Capacidad vital inspiratoria (CVI): es la suma del VT, VRI y VRE. Máximo volumen de aire que puede inhalarse desde una posición de espiración máxima. FVC: volumen de aire exhalado en una maniobra espiratoria forzada desde capacidad pulmonar total a volumen residual. En sujetos sanos suele ser similar a la CVI, pero en presencia de fenómenos obstructivos, debido a la compresión dinámica de la vía aérea, la FVC es menor a la CVI. Se habla de atrapamiento aéreo cuando la CVI es, al menos, un 10% mayor que la FVC. Parámetros de flujo: FEV1: volumen espirado en el primer segundo de una espiración forzada. PEF: flujo espiratorio pico o máximo flujo registrado en la espiración. FEF25-75%: flujo máximo mesoespiratorio. FEF75%, 50%, 25%: flujos instantáneos espiratorios forzados al 75, el 50 o el 25% de la FVC. Tanto los flujos instantáneos espiratorios como los mesoespiratorios se consideran indicadores de la vía aérea pequeña, pero su mayor variabilidad, tanto dentro de un paciente como en la población sana, hace difícil establecer el valor de normalidad. En general se considera que están afectados cuando son menores del 55-60% del valor teórico, que se corresponde con un IC del 90% [8]. En otras publicaciones se designan como FEF25%, 50%, 75%, porque se refieren a los flujos instantáneos forzados cuando se ha espirado el 25, el 50 o el 75% de la FVC. Las dos denominaciones son válidas. Relación FEV1/FVC (FEV1 %): indica la proporción de la FVC que se exhala durante el primer segundo de la maniobra de espiración forzada. Este valor es un cociente y lo tenemos que mirar en la columna de los datos obtenidos del paciente. Es el parámetro más importante para definir si existe o no obstrucción de la vía aérea, pero no se utiliza para graduar esta obstrucción. En general se considera normal un cociente del 75%, pero no se considera
48 Parte TEÓRICA Interpretación de la espirometría patológico hasta que no es menor de 0,7 o, expresado en tanto por ciento, del 70%. Este punto de corte, como límite inferior de normalidad, puede llevar a un importante número de resultados falsos negativos en jóvenes, así como al sobrediagnóstico de EPOC (enfermedad pulmonar obstructiva crónica) en personas mayores asintomáticas no fumadoras [5]. Para este parámetro también se está valorando la posibilidad de referirlo al LIN del 95% con el objetivo de disminuir los errores referidos anteriormente. Se llama índice de Tiffeneau a la relación entre el FEV1 y la CVI, y es más sensible que el cociente FEV1/FVC para detectar obstrucción de la vía aérea. De todos estos parámetros, para la interpretación de la espirometría, vamos a fijarnos básicamente en la FVC (parámetro de volumen), el FEV1 (parámetro de flujo) y el cociente FEV1/FVC (relación entre el flujo y el volumen). Como se ha comentado previamente, el límite inferior de la normalidad para el FEV1 y la FVC se establece en el percentil 95. Tradicionalmente se viene trabajando con el valor del 80% respecto al valor de referencia para estas variables y del 70% para el cociente FEV1/FVC. Vamos a seguir estos criterios a la hora de interpretar la espirometría. Patrones espirométricos Del análisis del registro gráfico de la espirometría, y sobre todo de la curva flujo-volumen, así como de los parámetros numéricos obtenidos, podemos identificar una capacidad ventilatoria normal (entendida como dentro del rango de referencia) o bien anormal. Es muy importante tener en cuenta que la espirometría nos da patrones de alteración ventilatoria, por sí sola no es «diagnóstico de nada», hay que integrar la información que nos proporciona con los datos clínicos del paciente, así como valorar la evolución en el tiempo de estos parámetros. 39 Los patrones espirométricos con los que nos podemos encontrar son los que siguen a continuación. Patrón normal Tanto el FEV1 como la FVC son superiores al 80% y la relación entre ellos superior al 70%, con una morfología de la curva flujo-volumen, como se muestra en la figura 2. En la figura 5 se muestra un ejemplo de espirometría dentro del rango de referencia. Patrón obstructivo En el defecto ventilatorio obstructivo hay un desproporcionado descenso del flujo aéreo máximo en relación con el volumen máximo Figura 5. Espirometría y curva flujo-volumen dentro del rango de referencia Flujo [l/s] VC IN [l] FVC [l] EV [l] FEV 1 % VC max..[%] PEF [l/s] FEF [l/s] FEF [l/s] FEF [l/s] MMEF 75/ [l/s] FEF 50 % FVC.....[%] F/V es F/V in 1 Volumen [l] Teor M1 M1/T % 3,40 3,92 115,1 3,41 3,78 110,6 2,95 3,03 102,7 82,07 77,50 94,4 6,80 8,61 126,6 5,96 7,15 120,0 4,25 2,84 66,8 1,91 0,84 44,2 3,71 2,23 60,1 124,6 75,21 60,4 Teor: valores de referencia o teóricos. Med: valores medidos. (M1/T): porcentaje de los valores medidos sobre los teóricos. l: litros. l/s: litros por segundo.
49 40 Módulo 3 Espirometría y otras pruebas funcionales respiratorias pulmonar que puede ser movilizado. Esta disminución del flujo aéreo puede ser debida a un aumento de las resistencias de la vía aérea (como sucede en patologías como el asma o la bronquitis) y/o a una disminución de la presión de retracción elástica pulmonar (como, p. ej., en el enfisema). El parámetro funcional que define la obstrucción es la disminución de la relación del FEV1/ FVC. Se han propuesto diferentes criterios para esta obstrucción como, por ejemplo, que sea menor al límite inferior del margen de referencia (IC 95%), que sea inferior al 88% del teórico en hombres o inferior al 89% del teórico en mujeres o que esté por debajo del 70% [6]. Este último criterio es el más sencillo, fácil de establecer y no requiere utilizar valores de referencia, por lo que es el que recomiendan las guías clínicas para el diagnóstico de obstrucción [7]. La relación FEV1/FVC disminuida implica un descenso del flujo aéreo en relación con el volumen pulmonar. El cociente FEV1/ CVI también diagnostica la obstrucción y, en los casos de obstrucción leve a moderada, se obtienen resultados similares de FVC y CVI. En los casos de obstrucción grave con colapso dinámico de la vía aérea y atrapamiento aéreo, la FVC puede ser significativamente menor que la CVI y la relación FEV1/FVC subestima el grado de obstrucción. Por lo tanto, se aconseja utilizar el máximo valor de la FVC o la CVI como denominador del cociente [3]. En los procesos obstructivos que cursan con descenso de la FVC por atrapamiento aéreo, este descenso es menor a la disminución del FEV1, por lo que el cociente FEV1/FVC es inferior al valor normal [8]. documento de estandarización de las pruebas de función pulmonar, publicado por la Sociedad Europea y Americana de Neumología [3], se establece la siguiente clasificación de gravedad de la obstrucción, indicando que el número de categorías y los puntos de corte son arbitrarios: Obstrucción leve: FEV1 entre el 70 y el 80% del valor teórico. Obstrucción moderada: FEV1 entre el 60 y el 69% del valor teórico. Obstrucción moderada-severa: FEV1 entre el 50 y el 59% del valor teórico. Obstrucción severa: FEV1 entre el 35 y el 49% del valor teórico. Obstrucción muy severa: FEV1 inferior al 35% del valor teórico. La SEPAR establece otros puntos de corte para el FEV1: leve (65-80%), moderado (64-50%), intenso (49-35%) y muy intenso (menor del 35%) [1]. En la figura 7 tenemos un ejemplo de patrón de obstrucción de la vía aérea, donde se observa un FEV1 disminuido (54,7%) y una relación FEV1/FVC también disminuida (53,4%). En este ejemplo el cociente FEV1/FVC es muy similar al FEV1/CVI (52,1%). Es una alteración obstructiva moderada-severa. Los niveles de disfunción pulmonar se asocian con distintos grados de alteración para Figura 6. Morfología obstructiva de la curva flujo-volumen La morfología de la curva flujo-volumen es cóncava hacia el eje de abscisas, como se muestra en la figura 6, y más cóncava y alargada cuanto mayor es la obstrucción. La gravedad de la obstrucción viene determinada por el nivel de descenso del FEV1. En el Flujo Volumen
50 Parte TEÓRICA Interpretación de la espirometría el ejercicio, dificultades para las actividades de la vida diaria, morbilidad y mortalidad tanto por causas respiratorias como por otras causas, básicamente cardiovasculares y neoplásicas [9]. Figura 7. Patrón obstructivo 41 Cambios precoces en la vía aérea producidos por obstrucción de la pequeña vía aérea (menor de 2 mm de diámetro y responsable del 25% de la resistencia total al flujo aéreo) se pueden ver en el enlentecimiento de la parte final de la espirometría y en esta forma cóncava de ella, sin que se hayan producido cambios importantes en el resto de parámetros ventilatorios. Cuantitativamente, se pueden reflejar en una desproporcionada disminución de los flujos instantáneos a bajos volúmenes pulmonares, cuando queda por exhalar el 25% de la FVC (FEF25%), y una disminución de los flujos mesoespiratorios (FEF25-75%) con respecto a la disminución del FEV1. Esta alteración se ha descrito en fumadores e individuos expuestos a la inhalación de tóxicos en el ambiente laboral, en pacientes asmáticos, después de infecciones respiratorias o en pacientes con insuficiencia ventricular izquierda incipiente [10]. En el ejemplo de la figura 8 tenemos una espirometría con un FEV1 y FVC dentro del rango de referencia, pero con un descenso del cociente FEV1/FVC, así como una disminución de los flujos mesoespiratorios y espiratorios instantáneos a bajos volúmenes pulmonares. Patrón restrictivo El patrón ventilatorio restrictivo se caracteriza por una disminución de los volúmenes pulmonares. Se habla de restricción cuando la CPT (capacidad pulmonar total) es inferior al percentil 5 del valor de referencia y una relación Figura 8. Patrón obstructivo: disminución de flujos mesoespiratorios y espiratorios a bajos volúmenes pulmonares Flujo [l/s] 10 Flujo [l/s] F/V es Volumen [l] F/V in 1 Teor Medidos % teóricos Teor Med1 Med1/teor FEV [l] 2,91 1,59 54,7 FEV [l] 2,68 2,21 82,5 FVC [l] 3,66 2,98 81,4 FVC [l] 3,45 3,21 92,9 FEV 1 % VC IN..[%] 76,4 52,1 68,2 FEV 1 % VC IN.. [%] 75,0 62,7 83,7 FEV 1 % FVC...[%] 53,4 FEV 1 % FVC... [%] 68,8 PEF [l/s] 7,76 6,58 84,8 PEF [l/s] 7,42 6,16 83,1 FEF [l/s] 1,43 0,15 10,5 FEF [l/s] 1,22 0,16 13,1 FEF [l/s] 4,08 0,69 16,8 FEF [l/s] 3,83 1,38 36,0 FEF [l/s] 6,85 1,59 23,2 FEF [l/s] 6,62 4,57 68,9 MMEF 75/25 [l/s] 3,34 0,70 21,0 MMEF 75/25..[l/s] 3,00 1,07 35,7
51 42 Módulo 3 Espirometría y otras pruebas funcionales respiratorias FEV1/FVC normal [3]. La espirometría no mide la CPT, para ello hay que realizar una pletismografía o aplicar métodos de dilución de gases. Fisiopatológicamente, hay un descenso de la capacidad vital con unos flujos aéreos conservados o aumentados para el volumen pulmonar [8]. Se puede sospechar restricción en la espirometría cuando la capacidad vital está reducida, la relación FEV1/ FVC elevada (superior al 85-90%) y la morfología de la curva flujovolumen es convexa hacia el eje de abscisas, como se muestra en la figura 9. A veces, un patrón restrictivo con una FVC disminuida y una relación elevada del FEV1/ FVC es producido por un esfuerzo submáximo (inspiratorio y/o espiratorio) o por una obstrucción de la vía aérea con atrapamiento aéreo y compresión dinámica de la vía aérea. Por lo tanto, una disminución de la capacidad vital no implica un fenómeno de restricción, para confirmarlo hay que objetivar un descenso de la CPT. Alteración ventilatoria restrictiva y enfermedad pulmonar restrictiva no son sinónimos, puesto que hay muchos defectos ventilatorios restrictivos de causa extraparenquimatosa, como defectos de la caja torácica, enfermedades neuromusculares, obesidad mórbida, etc. Figura 9. Morfología restrictiva de la curva flujo-volumen Flujo Volumen La graduación de la restricción en la espirometría se hace según la FVC. Diversas sociedades científicas han establecido diferentes y arbitrarios puntos de corte para establecer los grados de afectación. La ATS (American Thoracic Society) ha clasificado la alteración restrictiva en las siguientes categorías [11]: Restricción leve: FVC entre el 70 y el 80% del valor teórico. Restricción moderada: FVC entre el 60 y el 69% del valor teórico. Restricción moderada-grave: FVC entre el 50 y el 59% del valor teórico. Restricción grave: FVC entre el 35 y el 49% del valor teórico. Restricción muy grave: FVC < 35% del valor teórico. La SEPAR establece otros puntos de corte para la FVC: leve (65-80%), moderada (64-50%), intensa (49-5%) y muy intensa (< 34%) [1]. En la figura 10 tenemos un ejemplo de patrón espirométrico restrictivo con una disminución de la FVC, que es del 59,1%, y un relación elevada de los flujos en función del volumen exhalado (FEV1/FVC del 96%). Un caso particular de defecto ventilatorio restrictivo es el producido por debilidad de los músculos respiratorios y hay algunas características de la espirometría de estos pacientes, que nos pueden hacer sospecharlo. En estos enfermos hay una disminución de las presiones máximas alcanzadas, por lo que hay un cierto enlentecimiento en alcanzar la presión espiratoria máxima que se traduce en un pico de flujo reducido y alcanzado más tarde en la espiración. También suele observarse una reducción de los flujos inspiratorios. Respecto a la restricción, la espirometría es más útil para excluirla que para confirmarla. Menos de un 3% de los pacientes que tengan una FVC mayor del 80% del valor de referencia tendrán una restricción [12].
52 Parte TEÓRICA Interpretación de la espirometría Patrón mixto En este patrón hay características de los dos patrones anteriores, el obstructivo y el restrictivo. Se define fisiológicamente cuando el cociente FEV1/FVC y la CPT están por debajo del percentil 5 de sus valores de referencia [3]. Se caracteriza en la espirometría por una disminución de los parámetros de volumen (FVC) y de flujo (FEV1) junto con una reducción menor de la relación FEV1/FVC. En la figura 11 se presenta un ejemplo de patrón mixto, donde vemos una disminución de la FVC (54,5%) y, sobre todo, una disminución del FEV1 [29,2] con una relación FEV1 disminuida (41,4%). El trastorno ventilatorio mixto puede darse en formas avanzadas de enfermedades que afectan tanto a la vía aérea como al parénquima pulmonar, como por ejemplo en la fibrosis quística, bronquiectasias o neumoconiosis; Figura 10. Patrón restrictivo 4 Flujo [l/s] F/V es 43 también puede deberse a la coexistencia de varias enfermedades (p. ej., enfermedad pulmonar obstructiva crónica y fibrotórax) o a la afectación de la vía aérea en el seno de enfermedades intersticiales. Un planteamiento clínico frecuente es saber si el descenso de la FVC en una espirometría con FEV1 y relación FEV1/FVC disminuidas se debe a atrapamiento aéreo o a la coexistencia de un defecto restrictivo asociado. Para despejar esta incógnita son de ayuda otros aspectos clínicos del paciente, como saber si padece obesidad, o alguna alteración de la pared torácica, fibrotórax, etc. Si no se dan ninguna de estas circunstancias, la causa más frecuente es el atrapamiento aéreo, que podemos inferir al comparar la CVI con la FVC. Se ha estimado que, cuando la CVI es un 10% mayor que la FVC, hay signos radiológicos de atrapamiento aéreo [6]. En estos casos, la repetición de la espirometría tras la adminis- Figura 11. Patrón mixto Volumen [l] 0,5 1 1,5 2 2, Volumen [l] 4 F/V in Teor Medidos % teóricos Teor Medidos % teóricos FEV [l] 2,65 0,77 29,2 FEV [l] FVC [l] FEV 1 % VC IN.. [%] FEV 1 % FVC... [%] PEF [l/s] FEF [l/s] FEF [l/s] FEF [l/s] MMEF 75/25..[l/s] 2,63 3,36 75,5 7,36 1,22 3,81 6,54 3,07 1,91 1,99 88,0 96,1 4,57 0,98 3,09 4,30 2,61 72,5 59,1 116,5 62,0 80,0 81,1 65,7 85,1 FVC [l] FEV 1 % VC IN.. [%] FEV 1 % FVC... [%] PEF [l/s] FEF [l/s] FEF [l/s] FEF [l/s] MMEF 75/25..[l/s] FEF 50 % FVC.. [%] 3,43 74,79 7,38 1,20 3,80 6,59 2,95 110,93 1,87 40,66 41,40 2,48 0,30 0,56 0,24 16,07 54,5 54,4 33,6 7,9 8,5 8,0 14,5
53 44 Módulo 3 Espirometría y otras pruebas funcionales respiratorias tración de un fármaco broncodilatador produce un aumento de la FVC, mientras que en los casos de defectos restrictivos apenas se modifica. Ante la duda, se debe determinar la CPT por pletismografía. Patrón de obstrucción de vía aérea central y superior La disminución del calibre de la vía aérea superior interfiere con los factores que determinan el flujo máximo, haciendo que el flujo aéreo sea constante e independiente del volumen en la maniobra inspiratoria y/o espiratoria, presentando la curva flujo-volumen una morfología en meseta característica [13]. Según donde se localice la lesión, podemos clasificarla en lesión extratorácica, por encima del manubrio esternal, y lesión intratorácica, por debajo del manubrio esternal. Según la colapsabilidad de la obstrucción, se puede clasificar en obstrucción o estenosis variable (el calibre de la obstrucción varía según la presión transmural) u obstrucción o estenosis fija (la rigidez de la lesión hace que el calibre de la vía aérea no se afecte por el juego de presiones inspiratorias y espiratorias). Las lesiones obstructivas en este nivel no suelen afectar el FEV1 o la FVC, que pueden mantenerse en rangos de normalidad, pero sí suele disminuir de forma importante el PEF. Un aumento en el cociente FEV1 (ml)/pef (l/ min) superior a 8 debe alertarnos sobre la posibilidad de que exista patología de vía aérea superior (VAS), una vez que se ha descartado un pobre esfuerzo de la maniobra espiratoria [3]. Cuando ya existe afectación del FEV1, indica que la obstrucción es más intensa, siendo el orificio de la VAS inferior a 6 mm [6]. El análisis de la curva flujo-volumen es muy importante a la hora de detectar este tipo de patología. Se requieren al menos tres maniobras reproducibles de esfuerzo inspiratorio y espiratorio máximo para diagnosticar la obstrucción de VAS. Se distinguen tres tipos de obstrucción (fig. 12): Obstrucción fija (central o de VAS): morfología en meseta tanto de la rama inspiratoria como espiratoria de la curva flujo-volumen. El flujo es similar en la inspiración y en la espiración, y es proporcional al grado de obstrucción. Se observa en estenosis traqueales postintubación o en tumoraciones endotraqueales. Obstrucción variable extratorácica: se observa una meseta en la rama inspiratoria Figura 12. Patrones de obstrucción de vía aérea superior (VAS). A. Obstrucción fija, B. Obstrucción variable extratorácica: aumenta la obstrucción durante la inspiración, C. Obstrucción variable intratorácica: aumenta la obstrucción durante la espiración A B C
54 Parte TEÓRICA Interpretación de la espirometría de la curva flujo-volumen. Los flujos espiratorios no se afectan. La obstrucción es mayor durante la inspiración, porque se genera una presión más negativa intratraqueal que favorece el colapso de la zona estenosada. Por ejemplo, se ve este tipo de obstrucción en la parálisis de cuerdas vocales. Obstrucción variable intratorácica: muestra una meseta en la rama espiratoria de la curva flujo-volumen. Durante la espiración, la presión pleural se transmite a la zona de la lesión, aumentando la obstrucción. Estrategia de interpretación de la espirometría La estrategia de interpretación de las pruebas de función de pulmonar y, en concreto, de la espirometría, debe seguir dos pasos: Clasificar el tipo de alteración ventilatoria, si la hay, y su gravedad (misión de laboratorio de función pulmonar). Para ello primero se comparan los resultados obtenidos en el test con los valores de referencia de los sujetos sanos y posteriormente se comparan con patrones fisiológicos de anormalidad (obstructivo o restrictivo). Se puede seguir la siguiente estrategia, partiendo del cociente FEV1/FVC: Si es < 70% (o por debajo del LIN): obstructivo. Para valorar la gravedad, mirar el FEV1. Si es > 70% (o por encima del LIN), mirar la FVC: Si es > 80%: normal. Si es < 80%: restrictivo. Valorar la gravedad según la FVC. Integrar estos resultados en el contexto clínico del paciente (misión del clínico que atiende al paciente). En este punto es muy importante comparar con pruebas previas 45 del paciente para conocer la evolución en el tiempo de los resultados obtenidos. Bibliografía 1. Casan P, Burgos F, Barberà JA, Giner J. Procedimietnos de evaluación de la función pulmonar. En: Puente Maestu L, coord. Manual SEPAR de procedimientos. Madrid: Luzán 5; p Enright PL. Reference values for pulmonary function testing. Disponible en: reference-values-for-pulmonary-function-testing? source=search_result&selectedtitle=3%7e150. Actualización, mayo Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests. Eur Respir J. 2005;26: Korotzer B, Ong S, Hansen JE. Etnic diffferences in pulmonary function in healthy nonsmoling Asian-Americans and European-Americans. Am J Respir Crit Care Med. 2000;161: Hardie JA, Buist AS, Vollmer WM, et al. Risk of overdiagnosis od COPD in asymptomatic elderly neversmokers. Eur Respir J. 2002;20: García Río F. Interpretación de una espirometría en seis pasos. En: Guía Práctica: espirometría y pruebas funcionales respiratorias. Madrid: Entheos; p Guía de práctica clínica de diagnóstico y tratamiento de la enfermedad pulmonar obstructiva crónica. SEPAR- ALAT; Disponible en: 8. Gold WM. Pulmonary function testing. En: Murray JF, Nadel JA. Textbook of respiratory medicine. 2. a ed. Philadelphia: WB Saunders; p Young RP, Hopkins R, Eaton TE. Forced expiratory volumen in one second: not just a lung function test but a marker of premature death from all causes. Eur Respir J. 2007;30: Miller A. Spirometry and maximun expiratory flowvolumen curves. En: Miller A. Pulmonary function test in clinical and occupational lung disease. Orlando: Grune & Stratton; p American Thoracic Society. Standardization of spirometry update. Am J Respir Crit Care Med. 1995; 152: Aaron SD, Dales RE, Cardinal P. How accurate is spirometry at predicting restrictive pulmonary impairment? Chest. 1999;115: Toroges B, Pons S, Agustí AGN. Espirometría: análisis de flujos y volúmenes pulmonares. En: Agustí AGN. Función pulmonar aplicada. Puntos clave. Barcelona: Doyma; p
55 46 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Evaluación de los cambios en la espirometría Francisco García Río, Elizabet Martínez Cerón, Delia Romera Cano Servicio de Neumología. Hospital Universitario La Paz. Madrid. Facultad de Medicina. Universidad Autónoma de Madrid. IdiPAZ. Madrid El análisis de los cambios experimentados por los parámetros espirométricos a lo largo del tiempo y su respuesta a determinadas intervenciones proporcionan información adicional de gran interés clínico. La prueba de broncodilatadores, que constituye la forma más sencilla de estudiar los cambios inducidos, permite identificar la presencia de reversibilidad bronquial, que representa una respuesta fisiológica en la que participan de forma integrada el epitelio de la vía aérea, el músculo liso bronquial, su inervación y determinados mediadores. El grado de reversibilidad alcanzado depende de las características propias del sujeto (como la edad, el carácter crónico y la gravedad de la limitación al flujo aéreo), pero también de factores externos (como las exposiciones ambientales transitorias o la estación del año), que pueden condicionar la labilidad bronquial. Para la correcta evaluación de esta prueba también es necesario tener en cuenta la presencia de una infección respiratoria asociada, la hora en la que se realiza y la interrupción del broncodilatador antes del estudio. Resulta evidente la relevancia de ciertas características farmacológicas, como la clase de fármaco, la dosis empleada, la vía de administración y, en caso de fármacos inhalados, la técnica de inhalación y el sistema de liberación del aerosol, así como el intervalo entre la administración del fármaco y la medida de la función pulmonar. En este sentido, es importante considerar que, a veces, se necesita un ciclo corto de corticosteroides para mejorar la respuesta a los fármacos agonistas b2-adrenérgicos mediante el incremento del número de receptores b2 [1]. Como se comentará después, también debe valorarse la reproducibilidad del índice usado y la probabilidad de sesgo en las medidas de función pulmonar. Prueba de broncodilatadores Se trata de un procedimiento muy sencillo e inocuo. De hecho, sus contraindicaciones prácticamente se limitan a las de la espirometría, esto es, a la imposibilidad de realizar una maniobra correcta, a la falta de colaboración, al neumotórax, al angor o al desprendimiento de retina. La existencia de una traqueostomía, de problemas bucales, de hemiparesias faciales o de intolerancia a la boquilla son contraindicaciones relativas [2]. No existen contraindicaciones absolutas para la utilización de fármacos broncodilatadores, salvo la hipersensibilidad a los mismos. Sus escasos efectos secundarios (temblor y palpitaciones, sobre todo) no contraindican la administración de agonistas b2-adrenérgicos en pacientes con cardiopatías [3]. En definitiva, la prueba de broncodilatadores es un procedimiento rápido (aumenta la duración de la espirometría en sólo 15 minutos), barato y seguro en todas las edades,
56 Parte TEÓRICA Evaluación de los cambios en la espirometría 47 por lo que, a diferencia de la provocación bronquial, no precisa supervisión directa de un médico. Selección del fármaco broncodilatador Aunque para valorar la reversibilidad bronquial pueden utilizarse corticosteroides inhalados o sistémicos, los fármacos empleados con mayor frecuencia son los broncodilatadores, tanto agonistas b2-adrenérgicos como anticolinérgicos. La reducción en la concentración intracelular de calcio que determina la relajación del músculo liso bronquial puede ser alcanzada por la activación del receptor del segundo mensajero intracelular 3,5 - AMPc (monofosfato de adenosina cíclico) o 3 5 -GMPc (monofosfato de guanosina cíclico), que produce salida de calcio de la célula o almacenamiento intracelular en el retículo sarcoplásmico o en la mitocondria, aunque también existen mecanismos independientes del segundo mensajero, relacionados con la activación del canal transmembrana de potasio. Los agonistas b2-adrenérgicos se unen a receptores b2 de la membrana celular del músculo liso de la vía aérea, favoreciendo la liberación de AMPc que, mediante la activación de proteincinasas, reduce el calcio intracelular y, activando la proteína estimulante G, por la activación del canal de potasio, favorece la salida de calcio de la célula. La capacidad de los agonistas b2-adrenérgicos para relajar el músculo liso bronquial es independiente del estímulo que haya causado la obstrucción [4]. Por su parte, los anticolinérgicos antagonizan la transmisión en los receptores muscarínicos y bloquean el reflejo broncoconstrictor colinérgico. Resulta especialmente relevante el bloqueo de los receptores M3, localizados en el músculo liso y en las glándulas submucosas, responsables de la liberación de calcio desde los depósitos intracelulares y de una reducción de AMPc, que favorecería la contracción del músculo liso. Los anticolinérgicos no afectan a la broncoconstricción producida por la acción, por ejemplo, de la histamina sobre el músculo liso. Además, no actúan por igual sobre todo el árbol bronquial, puesto que la broncoconstricción colinérgica afecta fundamentalmente a las grandes vías aéreas [4]. En la actualidad, los agonistas b2-adrenérgicos son, sin duda, los más utilizados. Salbutamol y terbutalina son agonistas b2 selectivos de acción rápida y con similares efectos. Los agonistas b2 de acción prolongada (salmeterol, formoterol o indacaterol) no han demostrado ventajas adicionales frente a los anteriores. Al comparar el efecto de dosis progresivas de salbutamol y de bromuro de ipratropio en pacientes con asma o enfermedad pulmonar obstructiva crónica (EPOC), se obtiene una respuesta broncodilatadora similar [5]. En el asma bronquial, se ha verificado que salbutamol e ipratropio son equipotentes para lograr broncodilatación aguda. Estos hallazgos también son aplicables en la bronquitis crónica, aunque la equivalencia de ambos fármacos en estos pacientes es más dudosa, porque el efecto de broncodilatación que logran es menor. Sin embargo, otros estudios demuestran que, en asmáticos, los agonistas b2 son más eficaces que los anticolinérgicos, mientras que, en EPOC resultan similares. Algunos autores incluso refieren que el ipratropio es más efectivo que los agonistas b2- adrenérgicos en la EPOC. La vía de administración del fármaco recomendable para la prueba de broncodilatadores es la inhalada, puesto que requiere menos dosis, actúa de forma más rápida y tiene pocos efectos secundarios. Sin embargo, debe considerarse la posibilidad de seleccionar presentaciones en cartucho presurizado, en dispositivos de polvo seco o en solución para nebulizar. La eficacia de los cartuchos presurizados, que preferiblemente deberían acoplarse a cámaras espaciadoras, y la de los dispositivos de polvo seco es muy similar.
57 48 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Se ha comprobado que, en pacientes con limitación al flujo aéreo, la administración de terbutalina con un sistema Turbuhaler resulta tan rápida y eficaz como con un cartucho presurizado [6]. Con respecto a la nebulización, los cartuchos presurizados liberan menos dosis, son más fáciles de utilizar, más baratos y no requieren una limpieza tan exhaustiva, puesto que no son reservorios de contaminación nosocomial. Sin embargo, estos dispositivos requieren una mínima colaboración para realizar la técnica de inhalación de forma adecuada, que algunos pacientes no alcanzan. En general, es preferible utilizar el cartucho presurizado o el dispositivo de polvo seco del propio paciente, de modo que permite valorar su eficacia y revisar la técnica de inhalación [7]. Sólo en pacientes incapaces de realizar una maniobra de inhalación adecuada se podría utilizar un nebulizador con pieza bucal o mascarilla. En cualquier caso, la administración del fármaco siempre debe ser supervisada por un técnico o enfermera. No existe un consenso universal en cuanto a la dosis óptima para realizar una prueba de broncodilatación. Se acepta que resulta razonable emplear la dosis habitual de cada fármaco, aunque se ha demostrado que dosis más altas son seguras y potencian el grado de broncodilatación. Aunque la respuesta dosis-dependiente es más evidente en la EPOC, también se describe una respuesta del FEV1 dosis-dependiente en asmáticos, hasta 1,2-1,6 mg de salbutamol. A partir de dicha dosis, no se obtiene un incremento relevante de la broncodilatación y sí de los efectos secundarios. Se ha descrito que 0,6 mg de salbutamol aseguran una mayor diferencia entre asma y EPOC, aunque tampoco garantizan la discriminación [8]. Por todo ello, la dosis de salbutamol recomendada en la actualidad consiste en 4 puffs de 0,1 mg [1]. Medida de la respuesta Los broncodilatadores reducen la resistencia de la vía aérea, aumentan el flujo aéreo e incrementan el volumen espirado. Por tanto, el efecto de estos fármacos se puede medir por el cambio que originan en los flujos espiratorios o en las resistencias. La repetición de la espirometría a los 15 minutos de la administración de broncodilatador constituye el procedimiento más habitual para evaluar la reversibilidad (fig. 1), siendo el FEV1 (volumen espiratorio forzado en el primer segundo) y la FVC (capacidad vital forzada) los parámetros más habituales. La elección del FEV1 como marcador de respuesta broncodilatadora tiene reconocidas ventajas [5]. Mantiene una buena relación con escalas patológicas de diámetro de la vía aérea, Figura 1. Curva flujo-volumen basal y después de la administración de broncodilatadores Flujo Es [l/s] Flujo In [l/s]
58 Parte TEÓRICA Evaluación de los cambios en la espirometría 49 es un excelente predictor de mortalidad por limitación crónica al flujo aéreo, es muy reproducible y sensible a la obstrucción de la vía aérea. Su sensibilidad es mayor que la de la auscultación o los síntomas, hasta el punto de que cambios en el FEV1 pueden preceder a la aparición de síntomas [6]. Sin embargo, en algunos asmáticos graves, la reducción de la resistencia de la vía aérea puede acompañarse de un incremento de la FVC sin apenas cambios en el FEV1. La maniobra de FVC induce cambios en el calibre de la vía aérea de pacientes asmáticos. Durante la inspiración profunda, disminuye la resistencia de la vía aérea debido a la histéresis del músculo liso bronquial, que reduce la tensión después de ser estirado. En la espiración forzada se desencadena una broncoconstricción, presumiblemente por un mecanismo vagal tras la estimulación de receptores irritantes, que contrarresta la disminución de la resistencia originada durante la inspiración profunda. Los flujos mesoespiratorios proporcionan una medida sensible de la obstrucción de la vía aérea, pero resultan muy dependientes del volumen pulmonar. Puesto que el broncodilatador aumenta la FVC, el FEF25-75% (flujo espiratorio forzado medio entre el 25 y el 75% de la capacidad vital forzada) subestima el incremento del flujo aéreo, por lo que sólo resulta un parámetro útil en la valoración de broncorreversibilidad si se mide en condiciones de isovolumen, es decir, al mismo volumen pulmonar que antes de administrar los broncodilatadores (FEF25-75%FVC inicial). Expresión de la respuesta broncodilatadora En la tabla 1 se muestran las ecuaciones para calcular los índices de reversibilidad más utilizados. Aunque no existe un acuerdo unánime, la mayoría de los estudios publicados en esta última década parecen coincidir en la identificación del índice más rentable. En enfermos con limitación crónica al flujo aéreo, se comprobó que el porcentaje del valor previo y el porcentaje del valor posible son dependientes del FEV1 inicial. Esta importante desventaja del porcentaje del previo limita su valor diagnóstico y pronóstico [4]. Por el contrario, el porcentaje del teórico y el cambio en valor absoluto sólo están débilmente relacionados o no relacionados con el de FEV1 inicial, por lo que no resultan influidos por la función pulmonar basal. Además, se ha comprobado que los mejores discriminantes entre asma y EPOC son el porcentaje teórico y el cambio en valor absoluto, aunque su sensibilidad diagnóstica resulte baja [5]. Aun reconociendo que ninguno de los índices disponibles cumple de forma óptima las características del índice ideal (independencia del FEV1 previo, elevado poder discriminativo entre asma y EPOC y alta reproducibilidad), parece que el cambio con respecto al teórico es el que más se aproxima a este modelo. Hace años, se asumía que el porcentaje del previo informaba mejor del beneficio clínico Tabla 1. Principales índices para la valoración de la reversibilidad bronquial Absoluto = postbd previo Porcentaje con respecto al previo = [(postbd previo) / previo] 100 Porcentaje con respecto al teórico = [( postbd previo) / teórico] 100 Porcentaje del posible = [(postbd previo) / (teórico previo)] 100 Porcentaje ponderado = [(postbd previo) / (postbd + previo) / 2)] 100 Porcentaje del máximo = [(postbd previo) / incremento máximo] 100 Porcentaje del alcanzable = [(postbd previo) / (máximo previo)] 100 postbd: tras broncodilatadores.
59 50 Módulo 3 Espirometría y otras pruebas funcionales respiratorias alcanzable con los broncodilatadores, pero esto nunca ha sido demostrado. Aunque el porcentaje del posible sea poco dependiente del FEV1 inicial y más reproducible que otros índices, debería ser reservado para pacientes con obstrucción grave, de forma que el denominador (teórico previo) no sobrevalore la respuesta broncodilatadora. Análisis de la respuesta broncodilatadora Para la comparación de pruebas fisiológicas es necesario tener en cuenta las características de los equipos de función pulmonar, la capacidad y colaboración del paciente, la calibración del equipo, la obtención de maniobras satisfactorias y, por supuesto, la variabilidad de los parámetros analizados [5]. Dado que la variabilidad de la obstrucción bronquial está presente en diversos trastornos, de forma que algunos pacientes experimentan cambios muy acusados en el calibre de sus vías aéreas, resulta evidente que, para que la respuesta broncodilatadora sea clara, debe exceder esta variabilidad espontánea y superar la respuesta observada en individuos sanos. En sujetos sanos se han descrito desviaciones estándar de medidas repetidas de FVC y FEV1 de 148 y 183 ml, respectivamente. En estos voluntarios, el límite superior del intervalo de confianza al 95% (IC 95%) para la respuesta broncodilatadora del FEV1 oscila del 7,7 al 10,5% ( ml) y para la de la FVC entre 5,2 y 10,7% [5]. La variación de las medidas fisiológicas es mayor en enfermos con asma o EPOC. En asmáticos, se describe una variabilidad de la FVC y del FEV1 después de la administración de un placebo en aerosol del 11-13%, lo que supone el doble de la obtenida en voluntarios sanos. En pacientes con EPOC, el coeficiente de variabilidad interdía intrapaciente para el FEV1 se sitúa en torno al 8% y su IC 95% para la respuesta a placebo alcanza 160 ml. Pese a que la variabilidad a largo plazo en enfermos obstructivos es mayor que en sujetos sanos, el límite de confianza superior al 95% es muy similar en personas sanas y en enfermos estables, situándose en torno a 190 ml [4]. El análisis estadístico aplicado al estudio de la broncorreversibilidad considera significativo cualquier cambio que resulte mayor de la variabilidad de la medida. Existen dos aproximaciones metodológicas recomendables [7]. Una consistiría en determinar la respuesta broncodilatadora en sujetos normales y definir el percentil 95 en la distribución normal. Según este modelo, cambios en el FEV1 mayores de ml o superiores al 9% de variación con respecto al teórico se consideran relevantes. La segunda aproximación se basa en determinar la respuesta a un placebo y establecer el límite superior del IC 95%. En este caso, se establecen como significativas variaciones del FEV1 mayores de ml o del 8,55% del teórico [7]. Por todo ello, a lo largo de las últimas décadas se ha producido una considerable evolución en los criterios de broncorreversibilidad [9]. No obstante, en el momento actual, se considera que una prueba de broncodilatadores es positiva cuando se detecta un incremento de la FVC o del FEV1 de, al menos, 0,2 l y 12% con respecto a su valor basal [10]. Si se tiene en cuenta la diferencia intraindividual en la respuesta a los broncodilatadores, resulta simplista considerar que el resultado de una única prueba de broncodilatadores es suficiente para evaluar los potenciales beneficios terapéuticos del tratamiento broncodilatador. Por otra parte, la correlación entre broncodilatación y broncoconstricción es muy débil, por lo que no es posible inferir la existencia de hiperrespuesta bronquial a partir de una prueba de broncodilatadores.
60 Parte TEÓRICA Evaluación de los cambios en la espirometría 51 Evaluación en la EPOC La respuesta broncodilatadora se encuentra inversamente relacionada con el grado de obstrucción, por lo que suele resultar más acusada en pacientes con EPOC moderada que en los que tienen enfermedad grave. Por otra parte, los pacientes con obstrucción grave responden poco a los broncodilatadores, por el edema y obstrucción de la vía aérea por las secreciones bronquiales. A su vez, la intensidad de la reversibilidad también depende del atrapamiento aéreo [4], manteniendo una relación directamente proporcional con el volumen residual. Por último, se debe tener presente que algunos pacientes con EPOC experimentan una reducción paradójica del FEV1 postbroncodilatador, debido a un esfuerzo inicial variable o a la compresión del gas intratorácico. En pacientes con EPOC, la prueba de broncodilatadores tiene un papel limitado para identificar los posibles beneficios clínicos del tratamiento a largo plazo con estos fármacos. De hecho, se ha comprobado que, en pacientes con EPOC no reversible, los broncodilatadores mejoran la disnea, posiblemente por un descenso de la capacidad residual funcional y un incremento de la capacidad inspiratoria, tanto en reposo como en ejercicio. Además, los broncodilatadores tienen otros efectos beneficiosos en la EPOC, no directamente relacionados con la limitación al flujo aéreo. Pueden contribuir a la prevención de episodios de broncoconstricción, aumentar la fuerza y resistencia a la fatiga de los músculos inspiratorios, incrementar el acalaramiento mucociliar, reducir síntomas nocturnos como la tos o disminuir la presión de la arteria pulmonar y potenciar la fracción de eyección, tanto del ventrículo derecho como del izquierdo [11-13]. Por tanto, en los pacientes con EPOC y una prueba de broncodilatadores negativa, los broncodilatadores siguen siendo los fármacos de primera elección. Con respecto al tratamiento con corticosteroides inhalados en la EPOC, algunos autores proponen que la presencia de una prueba de broncodilatadores positiva podría suponer una indicación para éste. Sin embargo, es un tema controvertido, sobre el que no se ha establecido un consenso definitivo. En la diferenciación entre asma bronquial y EPOC, los estudios de broncorreversibilidad tienen un valor muy limitado. Se describen respuestas negativas en enfermos con una exacerbación infecciosa grave del asma y también es conocido que hay pacientes con EPOC que presentan una destacada reversibilidad. Evaluación en el asma La prueba de broncodilatadores resulta útil para el diagnóstico de asma, por lo que debería ser rutinaria en todo paciente con sospecha de este trastorno. Permite verificar la eficacia del tratamiento, comparar diversos tipos de broncodilatadores y evaluar distintas vías de administración. También se emplea en estudios epidemiológicos y en ensayos clínicos, en los que se suele monitorizar la variabilidad del FEV1 postbroncodilatador. Es aconsejable realizar una prueba de broncodilatadores en la primera visita y en todas las consultas de seguimiento de pacientes con asma bronquial [3]. Es obvio que la presencia de una prueba de broncodilatadores positiva pone de manifiesto la existencia de reversibilidad bronquial y, como tal, puede ser suficiente para establecer el diagnóstico de asma bronquial en pacientes con clínica compatible y con una alteración ventilatoria obstructiva. Sin embargo, existen algunas circunstancias en las que se pueden ocasionar falsos negativos: a) que el enfermo se encuentre en una fase de estabilidad clíni-
61 52 Módulo 3 Espirometría y otras pruebas funcionales respiratorias ca, con valores normales, por lo que el grado de mejoría puede ser limitado; b) que permanezca bajo el efecto de un tratamiento broncodilatador administrado con anterioridad; c) que tenga una mala técnica de inhalación, y d) que la broncoconstricción haya sido producida por fenómenos no susceptibles de mejorar con broncodilatadores, tales como el remodelado de la arquitectura de las vías aéreas por la respuesta inflamatoria [5]. En pacientes con sospecha de asma, la ausencia de respuesta broncodilatadora positiva no debería excluir un ensayo terapéutico de 6-8 semanas con broncodilatadores y/o corticosteroides inhalados, para revaluar el estado clínico y el cambio en el FEV1 al final de dicho periodo [10]. Una respuesta positiva en un paciente asmático indica que los broncodilatadores producen una reducción de la obstrucción al flujo aéreo, con mejoría del estado funcional y disminución de la disnea. No obstante, la reversibilidad no es un predictor de mortalidad en asma [14]. Aunque estudios previos asociaban un alto grado de reversibilidad con una menor supervivencia, se ha comprobado que esta asociación es dependiente de la relación entre reversibilidad y obstrucción basal de la vía aérea. En cualquier caso, sí parece claro que un alto grado de reversibilidad indica un mal control del asma. Evaluación en las enfermedades intersticiales La alteración fisiológica común de las enfermedades intersticiales consiste en un trastorno restrictivo, con disminución de los volúmenes y capacidades pulmonares y conservación de los flujos aéreos. Dado que el deterioro de la mecánica ventilatoria suele ser debido a la reducción de la distensibilidad pulmonar, a cambios en las propiedades elásticas del pulmón y al incremento de la tensión superficial, la función de la vía aérea suele estar preservada, por lo que la prueba de broncodilatadores no resulta especialmente relevante [15]. No obstante, en algunas enfermedades intersticiales primarias, como la sarcoidosis, la prevalencia de la reversibilidad bronquial resulta algo más elevada. Evaluación en las enfermedades neuromusculares Producen fundamentalmente una alteración ventilatoria restrictiva, con reducción de los volúmenes pulmonares por debilidad tanto de los músculos inspiratorios como de los espiratorios. En esta situación, la prueba de broncodilatadores tampoco desempeña un gran papel, ni para el diagnóstico ni para el seguimiento. No obstante, puede resultar útil en el diagnóstico diferencial y permite descartar patrones restrictivos ficticios por atrapamiento aéreo. Bibliografía 1. Pellegrino R, Rodarte JR, Brusasco V. Assessing the reversibility of airway obstruction. Chest. 1998;114: Quanjer PH, Tammeling GJ, Cotes JE, et al. Lung volume and torced ventilatory flows. Eur Respir J. 1993;6 Suppl 16: GEMA. Guía Española para el Manejo del Asma. Madrid: Luzán 5; Villasante C, García Río F. Estudio de la broncorreversibilidad. En: Perpiñá M, Picado C, eds. Manual de técnicas y procedimientos en asma. Barcelona: Prous Science; p Enright PL, Lebowitz MD, Cockroft DW. Physiologic measures: pulmonary function tests. Asthma outcome. Am J Respir Crit Care Med. 1994;149:S Bridge PD, Ranganathan S, McKenzie SA. Measurement of airway resistance using the interrupter technique in preschool children in the ambulatory setting. Eur Respir J. 1999;13: Brand PLP, Quanjer PH, Postma DS, et al. Interpretation and bronchodilator response in patients with obstructive airways disease. Thorax. 1992;47:
62 Parte TEÓRICA Evaluación de los cambios en la espirometría Pellicer C. Aportación del test broncodilatador al estudio de la reversibilidad bronquial. Arch Bronconeumol. 1994;30: Global Initiative for Asthma. National Institutes of Health. National Heart, Lung, and Blood Institute Publication Number Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests. Eur Respir J. 2005;26: Wang JW, McFadden ER, Ingram RH Jr. Effects of increasing doses of β-agonists on airway and parenchymal hysteresis. J Appl Physiol. 1990;68: Pellegrino R, Brusasco V. Lung hyperinflation and flow limitation in chronic airway obstruction. Eur Respir J. 1997;10: O Donnell DE. Assessment of bronchodilator efficacy in symptomatic COPD. Is spirometry useful? Chest. 2000;117:S Hansen EF, Phanareth K, Laursen LC, et al. Reversible and irreversible airflow obstruction as predictor of overall mortality in asthma and chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1999;159: O Donnell DE, Fitzpatrick MF. Physiological of interstitial lung disease. En: Schwarz MI, Talmadge KE, eds. Interstitial lung disease. London: BC Decker; p
63 54 Módulo 3 Espirometría y otras pruebas funcionales respiratorias La espirometría en atención primaria Jesús Molina París Especialista en Medicina Familiar y Comunitaria Centro de Salud «Francia». Fuenlabrada. Madrid Manejo de pacientes respiratorios en atención primaria. Papel de la espirometría Muchos pacientes acuden cada día a la consulta de un centro de salud con síntomas respiratorios, hasta el punto de representar actualmente el motivo más frecuente de visita al médico de familia. La mayoría, afortunadamente, son procesos banales; pero otros no y, precisamente, éstos ocasionan un elevado consumo de recursos personales, sanitarios, económicos y sociales. Suponen, además, una importante causa de mortalidad y morbilidad. En concreto, las enfermedades que cursan con una obstrucción del flujo aéreo, especialmente el asma y la enfermedad pulmonar obstructiva crónica (EPOC), son en este momento problemas de salud de gran relevancia en este nivel asistencial, lo que obliga a una alerta continua para diagnosticar a todos los pacientes que sufren estos padecimientos. La cifra de afectados varía de forma importante según la zona geográfica que se estudia, pero siempre con unos datos de prevalencia muy elevados, entre los más altos de todas las enfermedades atendidas en atención primaria (AP). Se sabe que su incidencia aumenta progresivamente [1], de la misma forma que lo hace la morbilidad hospitalaria y la atendida en AP. Pero, a pesar de todo ello, también se sabe que estos dos problemas de salud están ampliamente infradiagnosticados en todo el mundo, con unas cifras que obligadamente merecen, cuando menos, una profunda reflexión sobre nuestra práctica clínica habitual. Qué está ocurriendo? Qué estamos haciendo mal? Podemos solucionarlo? Cómo? Estas preguntas se plantean en un contexto de medicina basada en evidencias y de la existencia de múltiples consensos nacionales e internacionales que pretenden alertar de la creciente importancia de las enfermedades respiratorias y que intentan orientar sobre cómo realizar adecuadamente el cuidado de los pacientes con ambas enfermedades, también desde AP. Pero es evidente que estas recomendaciones no llegan a nuestro nivel asistencial. Todos ellos hacen especial hincapié en la sospecha diagnóstica y en la realización de las pertinentes pruebas complementarias para confirmar esa sospecha. Y cómo? Cuál es la prueba imprescindible para conseguirlo? Sin duda, la espirometría. Las pruebas para el estudio de la función pulmonar constituyen, junto con el examen clínico (historia y exploración física), la base para el diagnóstico de todo paciente en el que se sospecha una enfermedad del aparato respiratorio.
64 Parte TEÓRICA La espirometría en atención primaria La realidad es bien distinta. Entre los primeros datos encontramos una encuesta realizada en Barcelona [2] en el año 1994, en la que se observó que únicamente el 36% de los médicos utilizaba la espirometría en el manejo de los pacientes con obstrucción pulmonar. Nueve años más tarde, se efectuó el estudio IDENTEPOC [3], que mostró que el 61,6% de los incluidos en las bases de datos de AP de toda España como pacientes con EPOC no tenían realizada una espirometría: habían sido diagnosticados mediante criterios clínicos y radiológicos, cuando es conocido que éstos no diagnostican la enfermedad. Está claro que la espirometría, que debería ser parte fundamental e inseparable del quehacer habitual del médico de familia, sigue sin estar presente en AP. Quizá la razón más importante es que poco más de la mitad de los centros de salud de España disponen de espirómetro (57,8%) [2]; incluso hay áreas sanitarias que no tienen ninguno, si bien tan sólo 3 años antes esta cifra no llegaba al 50% [3,4] o al 27,8% de los 353 centros de salud existentes en Andalucía años antes [5]. Pero también puede ser que se haya considerado como una prueba diagnóstica mágica, de difícil interpretación y de imposible realización si no es por personal dedicado exclusivamente a ello. Estas dificultades se han conseguido superar, aunque con retraso respecto a otros países, gracias al esfuerzo conjunto de neumólogos y de médicos de familia, y que ya se plasmó en la Conferencia de Consenso sobre EPOC [6], realizada en noviembre de 2002, donde se dice textualmente, en el apartado de diagnóstico, que «...este procedimiento debe poder realizarse en los centros de atención primaria y practicarse, de acuerdo con las normativas establecidas, por personal convenientemente formado». 55 El mensaje es claro: la espirometría puede y debe realizarse en AP. Pero es preciso hacerla correctamente (como toda técnica). Hoy se sabe que menos del 30% de los centros tienen personal específico encargado de su realización [3]. Pero, también, que formarse en esta técnica no es complicado, y que, además, cuando el personal de enfermería se implica decididamente en su ejecución, el nivel de calidad y el de satisfacción del profesional son muy altos. Y también hay que tener en cuenta que los pacientes respiratorios en los que se utilizan pruebas de función pulmonar para el seguimiento habitual [7] presentan menos agudizaciones, menos visitas a urgencias y a su médico habitual que aquellos en los que no se utilizan, y reciben un perfil de tratamiento más adecuado. Además, retrasar el diagnóstico implica en muchos casos un irreversible deterioro de la función pulmonar, con la consiguiente disminución de la calidad de vida y el aumento de los costes, que podría ser evitado con un diagnóstico precoz y un adecuado tratamiento, y cuya responsabilidad debe asumirse en AP. Para conseguir un diagnóstico precoz de las enfermedades respiratorias debe realizarse una espirometría de calidad en este nivel asistencial, insistiendo en que esta idea ya está claramente establecida desde hace tiempo en diferentes foros y publicaciones (GINA, 2002 [8]; GEMA, 2009 [9]; GOLD, 2003 [10]; Burgos F, 2006 [11]). Pero la calidad de la prueba debe estar fuera de toda duda, y ésta no es la situación actual ni en España ni fuera de ella. En esta línea, la aparición de nuevos espirómetros, que incorporan mejoras técnicas para facilitar la detección de errores, posiblemente permitirá solucionar algunos de los problemas existentes en el momento actual. De la misma forma, son necesarios programas de mejora de la calidad que incluyan formación y supervisión de la correcta realización de esta técnica. Estos programas, una
65 56 Módulo 3 Espirometría y otras pruebas funcionales respiratorias vez conocido el problema, se vienen realizando en AP. Algunos ejemplos pueden ser los de Navarra, País Vasco, Aragón o Baleares. En Navarra [12], se detectó que el 90,9% de los centros tenían espirómetro, pero el 22% de ellos no lo utilizaba nunca y el 56,3% realizaba menos de 5 espirometrías semanales. En cuanto a la calidad de la técnica, el 96% no calibraba de forma reglada el espirómetro y se observó un alto porcentaje de incumplimiento de los criterios de reproducibilidad para los valores de la capacidad vital forzada (FVC) (76%) y del flujo espiratorio máximo en el primer segundo (FEV1) (39,7%), lo que se traducía en un diagnóstico funcional erróneo, con tendencia a diagnosticar patrones falsamente restrictivos y a clasificar erróneamente la gravedad de la obstrucción. Estos datos han llevado a realizar intensos programas de formación en espirometría en diferentes comunidades autónomas. Siguiendo con Navarra, los datos de este plan de mejora se publicarán en breve. En el mismo año [13] se publicó otro trabajo realizado con 839 médicos de AP en el que se evaluaban las deficiencias y las necesidades para la utilización correcta de la espirometría en el diagnóstico y seguimiento del paciente con EPOC. Destaca que sólo el 59,2% de los centros que tenían espirómetro realizaban espirometrías regularmente. El argumento principal para no hacerlas era la falta de formación (35%) y la falta de tiempo (20%) y de personal (21%). De hecho, más del 30% de los profesionales de enfermería no había recibido formación específica, lo que se traducía en un escaso seguimiento de las normativas en cuanto a calibración (el 10,9% de los centros lo hacía diariamente), limpieza (el 14% no lo hacía nunca) o instrucciones previas al paciente (el 30% no las entregaba el día anterior). Afortunadamente, con respecto al trabajo de este mismo autor 12 años antes, la correcta indicación para realizar espirometría se seguía en el 63,7% de los casos (36% en 1994). La espirometría como herramienta de detección (screening) Este tema es un aspecto controvertido a la vez que apasionante. La realidad en este momento es que todavía no se puede recomendar la utilización sistemática de la espirometría para la detección de enfermedades respiratorias [14] (nivel de evidencia D), si bien es cierto que cada día conocemos nuevas publicaciones que sugieren que su utilización, especialmente en pacientes fumadores para detectar precozmente EPOC, puede contribuir a resolver el enorme problema del infradiagnóstico, lo que comporta la imposibilidad de realizar una intervención precoz. El criterio del U.S. Preventive Services Task Force y de otros organismos internacionales de salud [15] se basa en que, si bien la detección precoz podría suponer un estímulo positivo para dejar de fumar, y que los pacientes encontrados pudieran beneficiarse de un tratamiento precoz y de un adecuado seguimiento de la enfermedad, los grandes estudios publicados en su mayoría tratan de pacientes graves, por lo que el escaso número de pacientes leves y moderados impide sacar conclusiones acerca de la utilidad de la espirometría, por sí sola, para el diagnóstico y como herramienta motivacional para dejar de fumar. El grupo de enfermedades respiratorias de la Sociedad Andaluza de Medicina de Familia concluye también que la detección con espirometría, a pesar de lo que sugiere la lógica, no ha demostrado una disminución estadísticamente significativa del tabaquismo entre los pacientes identificados como EPOC asintomáticos [16]. Ésta es una realidad difícil de rebatir, pero es cierto que se han desarrollado interesantes experiencias en España. En cuanto al abandono del tabaquismo utilizando espirometría, un magnífico trabajo realizado en AP [17]
66 Parte TEÓRICA La espirometría en atención primaria intentaba mostrar la efectividad de un plan de detección y seguimiento de fumadores de alto riesgo durante 3 años. Se incluyeron a 164 fumadores de alto riesgo entre 40 y 76 años y se observó que, al final, el 30,3% de los pacientes que fueron diagnosticados de EPOC y el 20,5% de los fumadores que no desarrollaron la enfermedad en el periodo de estudio, dejaron de fumar, resultados más que interesantes. Pero este estudio iba más allá, al abordar también la efectividad de la detección selectiva mediante espirometría para diagnosticar EPOC. Se seleccionaron a fumadores activos desde, al menos, 10 años (media de 28,1 paquetes-año en los que no tenían EPOC y 31,7% en los que resultaron padecerla), con mínima o nula sintomatología respiratoria, a los que se les realizó una espirometría, se les informó del diagnóstico y se les dio un consejo breve para dejar de fumar. A los 3 años se realizó una nueva evaluación mediante espirometría. Al inicio se detectó un 22% de casos de EPOC (utilizando para el diagnóstico un cociente FEV1/FVC < 70% y un FEV1 < 80%), lo que supone un alto rendimiento del screening. A los 3 años se observó un 16,3% de casos nuevos (la mayoría leves), el 38,8% de los conocidos empeoraron, el 18,1% de los pacientes tuvo una pérdida acelerada de función pulmonar ( 150 ml/año) y el 44,8% de los fumadores con FEV1 < 90% evolucionaron a EPOC. Las conclusiones resultan muy interesantes: el FEV1 tiene una buena capacidad predictiva para seleccionar a los fumadores de alto riesgo; la caída del FEV1 no es igual en todos los fumadores (es más rápida en pacientes leves que en los graves), y el hecho de realizar la espirometría ha supuesto un alto índice de abandono del tabaco. El proyecto PADOC [18] intentaba también conocer la efectividad de un programa de cribado de la EPOC en AP. En este estudio, 194 médicos de AP incluyeron espirometrías consideradas válidas. Se detectó un 57 22,5% de posibles casos de EPOC en población fumadora de, al menos, 10 paquetesaño y mayor de 35 años que consulta por otros motivos (porcentaje similar a los obtenidos, p. ej., por grupos americanos y holandeses). De ellos, se pudo confirmar desde neumología un 55% de casos de EPOC, y al 10% se les diagnosticó asma. Un dato muy importante de este trabajo fue conocer que el mayor rendimiento del cribado se obtuvo en fumadores de más de 40 paquetes-año y mayores de 55 años. Se ha ido publicando un gran número de estrategias similares. Entre ellas, un cribado orientado a diagnosticar a pacientes con EPOC en AP mediante invitación a fumadores de años con carteles y anuncios en prensa [19]. De los 512 fumadores captados, el 29% presentaban EPOC según criterios GOLD, y el tabaquismo se asociaba de forma independiente con EPOC, hasta el punto de encontrar una odds ratio de 3,05 en los que fumaban entre 31 y 40 paquetes-año frente 4,58 en los que fumaban más de 40. En otro estudio de detección de casos realizado en AP en 651 fumadores entre 35 y 70 años [20], se encontró un 18% de pacientes con obstrucción al flujo aéreo que desconocía este problema. El porcentaje aumentaba hasta el 27% cuando se filtraba por pacientes con tos crónica. Lo que también se determinaba en este estudio eran los costes que este diagnóstico supone para el sistema de salud: se calcula que diagnosticar una EPOC cuesta 10 y supone 23 minutos del trabajo del profesional sanitario que lo realiza. Son datos concluyentes para meditar sobre el coste de las intervenciones que priorizamos desde AP. Una aproximación diferente a esta cuestión es la sugerida en un ensayo clínico realizado en 561 pacientes fumadores no diagnosticados de enfermedad respiratoria [21]. Se realizó una espirometría a todos y se dividieron
67 58 Módulo 3 Espirometría y otras pruebas funcionales respiratorias en dos grupos, uno control, al que se le informaba de sus resultados funcionales (en base al FEV1), y otro de intervención, en los que se relacionaba ese resultado con la edad pulmonar que traducía. Al final, 89 pacientes (16%) evidenciaron una obstrucción bronquial (alto rendimiento del cribado, pero, además, los del grupo intervención (edad pulmonar) dejaron de fumar de forma significativamente más importante (13,6 frente a 6,4%) que el grupo que recibió únicamente información sobre su FEV1. Esto sugiere que las estrategias para conseguir que el paciente abandone el tabaquismo no pueden basarse únicamente en el resultado de la función pulmonar. Resumiendo, parece claro que todavía no se puede recomendar la espirometría de forma sistemática en pacientes fumadores para conseguir que abandonen su dependencia y, posiblemente, tendrá que acompañarse de otros parámetros ( edad pulmonar?). Pero sí existe una clara relación entre la cantidad de tabaco fumado y la posibilidad de padecer EPOC, lo que orientaría a priorizar el cribado de esta enfermedad mediante espirometría, inicialmente en los pacientes que más fuman o han fumado a partir de una edad que estaría por determinar. No es un método costoso, no conlleva excesivo tiempo de realización y puede permitir el diagnóstico precoz de enfermedades respiratorias. Pero también podríamos decir que resulta más rentable la búsqueda oportunista que el cribado en todo paciente fumador. Éste es un aspecto crucial si pretendemos cambiar los datos epidemiológicos que en este momento preocupan en el mundo entero. De hecho, la Estrategia Nacional en EPOC del Sistema Nacional de Salud (2009) [22], propone la necesaria realización de experiencias piloto para evaluar la eficiencia de los programas de detección precoz en personas fumadoras, incluso aunque no presenten síntomas respiratorios. Muchos pacientes no demandan atención por ellos, pero ya los padecen, y adaptan su ritmo de vida a la limitación que les produce. La mayoría acude por otro problema de salud no relacionado con patología respiratoria, entre otras razones porque es una enfermedad prácticamente desconocida entre la población, hasta el punto de que el 91,4% de la población encuestada en el estudio SPIRIPOC [23] no conoce la EPOC de forma espontánea. Por ello, las actividades preventivas que se realizan en atención primaria de forma rutinaria son tan importantes, y la espirometría debería formar parte de ellas. Variables a considerar en la espirometría en atención primaria. Papel del FEV6 La calidad de la espirometría es un objetivo incuestionable. Y uno de los aspectos que con frecuencia la limitan es la adecuada consecución de una correcta maniobra que traduzca la FVC que el paciente tiene realmente. Éste es un problema descrito en incontables artículos publicados en todo el mundo. Desde el proyecto PADOC, sabemos que este problema se da también en las espirometrías que se realizan en AP. La concordancia existente entre neumólogos y médicos de familia en cuanto al FEV1 suele ser alta, no así en la FVC. En PADOC [18], los coeficientes de correlación intraclase son buenos para el FEV1 (0,78) y para el % de FEV1 (0,67), pero bajos para la FVC (0,38) y para el % de FVC (0,45). En los últimos años se viene hablando de una modalidad ligeramente diferente de espirometría forzada, conocida como «office spirometry», que emplea, en lugar de todo el aire que el paciente es capaz de exhalar durante todo el tiempo posible (FVC), sólo el aire expulsado durante los 6 primeros segundos (FEV6); el cociente pasa a ser en ese caso FEV1/FEV6. Sin embargo, no puede concluirse que la office spirometry sea la panacea [24].
68 Parte TEÓRICA La espirometría en atención primaria Uno de los estudios más importante en esta línea ( espirometrías en pacientes de ambos sexos entre 20 y 80 años) ha determinado puntos de corte para estos nuevos parámetros [25,26], con una sensibilidad y especificidad muy elevadas, tanto para el diagnóstico de obstrucción (94 y 93,1%, respectivamente, con valor predictivo positivo del 89,8% y negativo del 96%), como de restricción (83,2 y 99,6%, respectivamente). El FEV1/FEV6 podría usarse como una alternativa válida al FEV1/FVC en el diagnóstico de obstrucción de las vías aéreas, especialmente en AP, en pacientes de alto riesgo de padecer procesos obstructivos, como EPOC o asma, y especialmente con propósitos de cribado. Por tanto, el FEV1/FEV6 < 73% y el FEV6 < 82% del predicho son una alternativa válida al FEV1/FVC < 70% y a la FVC < 80% del predicho en la detección de obstrucción y de restricción en adultos. La utilización del FEV6 en lugar de la FVC tiene la ventaja de que la finalización de la espirometría se define con más claridad y es más fácil de conseguir. La generalización de esta nueva modalidad está todavía en expectativa, pero se considera que es un buen sistema, básicamente para el cribado de la población de una manera más sencilla, algo que venía publicándose tiempo atrás [27,28]. Posteriormente se han publicado diferentes estudios, de alta calidad, utilizando también este parámetro, con prácticamente idénticos resultados al compararlo con los obtenidos mediante el FEV1/FVC [29,30]. Ha sido también motivo de metaanálisis [31], y de estudios en poblaciones ancianas [32], así como en diferentes etnias. 59 Podríamos concluir este apartado diciendo que hay grandes avances intentando superar las dificultades de la técnica como ahora la conocemos, pero es necesario esperar más estudios que permitan tomar decisiones diagnósticas claras utilizando parámetros nuevos [33]. Organización de la espirometría en atención primaria Los problemas de AP con la espirometría no son propios de España. Desde hace años se vienen publicando multitud de artículos poniendo sobre la mesa esta cuestión e intentando buscar soluciones a ello [34,35]; y no todo pasa por la formación de los profesionales, también las administraciones tienen mucho que decir, al igual que los mismos profesionales, que en algunos casos han objetivado los problemas sin la más mínima intención de solucionarlos. Un reconocido neumólogo especializado en pruebas funcionales respiratorias escribía: «Es posible que un exceso de rigor metodológico y un mal sentido de propiedad de la técnica contribuyan a crear una imagen de exploración engorrosa, difícil de realizar y poco útil en la práctica clínica general». Afortunadamente, esta situación ha quedado atrás, y tanto desde AP como desde la atención especializada se mira al futuro. En España se vienen desarrollando desde hace tiempo planes de mejora que dependen, desgraciadamente, de la priorización realizada en cada comunidad autónoma. La Estrategia Nacional en EPOC pretende solucionar esta situación, claramente mejorable. Según los datos de este documento, todas las comunidades autónomas consideran la EPOC como un área prioritaria de intervención en salud, pero, salvo en 5 de ellas, no existe plan activo de actuación. Sólo 4 utilizan documentación específica o herramientas para la atención a esta enfermedad y en 7 existen documentos o planes de acción consensuados entre niveles asistenciales para el tratamiento del paciente con EPOC. De todos estos datos, obtenidos de la encuesta realizada por el Ministerio para elaborar esta
69 60 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Estrategia, 16 comunidades autónomas han dotado a la mayoría de sus centros de salud de espirómetro, pero sólo en 6 se utilizan rutinariamente y únicamente 3 disponen de planes de cribado para la detección precoz de pacientes con riesgo de EPOC. Para ser positivos, varias experiencias resultan interesantes. Los resultados preliminares del comentado plan de mejora de Navarra son muy esperanzadores. En Baleares se comenzaron hace unos años varios estudios en diferentes procesos respiratorios. En concreto, se intentó también la detección oportunista mediante espirometría de pacientes con EPOC en sujetos fumadores [36], encontrando, entre 212 pacientes (con 179 espirometrías aceptables, más del 80%), un 22,5% de nuevos diagnósticos de EPOC, 48,7% en estadio I y 41% en estadio II. Son datos muy interesantes, puesto que son pacientes en los que se puede intervenir precozmente para evitar su deterioro. Pero lo más interesante es que hace 10 años se puso en marcha un ambicioso proyecto formativo en enfermedades respiratorias, y uno de sus ejes principales (además de la prevención del tabaquismo) era buscar la máxima calidad de las espirometrías [37]. Textualmente (con permiso de los autores): «A partir de la introducción de espirómetros en la totalidad de los centros de salud de Baleares en el marco del Plan de Asma Infantil de las Baleares durante el año 2007, y como continuación al plan de implantación de espirometría en atención primaria en vigor desde el año 2001, se diseñó un plan de evaluación y control para asegurar la calidad de las espirometrías realizadas según las normativas vigentes y el mantenimiento de las actividades de manera eficiente. Este plan intenta garantizar la formación continuada de médicos y enfermeras y el mantenimiento de técnicos expertos en la realización de espirometrías en atención primaria, así como el mantenimiento de los aparatos y la facilitación de recursos necesarios para el desarrollo de la actividad». Como puede verse, el plan de mejora se sigue desde hace años, pero debe ser periódicamente revisado para mantener los mejores resultados posibles. Su nivel es avanzado, de forma que actualmente dicen: «La evaluación realizada por nuestro grupo [el de respiratorio de Baleares, grupo integrado en semfyc], los distintos indicadores diseñados, el análisis de incidentes críticos y otros métodos de control nos permiten detectar que las necesidades relacionadas con esta actividad en los centros de salud de nuestra comunidad autónoma son continuadas y precisan un acercamiento personalizado en cada uno de los centros, dependiendo del nivel de formación y el grado de implicación de sus profesionales, del mantenimiento de los aparatos, de la organización de las agendas y de las actividades de autoevaluación y formación que se desarrollan en cada uno, entre otras». «Los objetivos que se marcan el año 2010 para realizar durante el 2011 (con su correspondiente cronograma) son: 1. Realización de espirometrías en todos los centros de salud de la comunidad por técnicos formados adecuadamente según el modelo formativo propuesto en nuestro plan, tanto en población adulta como en población pediátrica. 2. Aumentar el número total de espirometrías realizadas en el ámbito de estudio. 3. Mejorar la calidad media de las espirometrías realizadas en el ámbito de estudio. Y las actividades a realizar para conseguir estos objetivos serían: 1. Talleres de formación de técnicos en espirometría que garanticen la correcta realización de espirometrías de calidad en cada uno de los centros de nuestro ámbito.
70 Parte TEÓRICA La espirometría en atención primaria 2. Talleres de formación de formadores en interpretación de espirometría. 3. Identificación de un responsable médico y otro de enfermería responsables del mantenimiento de los aparatos y la organización de las agendas en cada uno de los centros y que permita mejorar el nivel de formación y el grado de implicación de sus profesionales, así como mejorar la autoevaluación de las pruebas realizadas y las actividades de formación interna. 4. Ajuste a las necesidades detectadas en cada uno de los centros, teniendo en cuenta las peculiaridades existentes y los recursos.» Todo ello con sus indicadores correspondientes, necesarios para la posterior evaluación, obligada para mantener el ciclo de mejora de la calidad. Fruto de sus buenos resultados, el plan puede avanzar en sus objetivos, esta vez para «Este plan intenta garantizar los siguientes puntos: La formación continuada de médicos y enfermeras de atención primaria. El mantenimiento de técnicos expertos en la realización de espirometrías en todos y cada uno de los centros de salud. El mantenimiento de los aparatos. La evaluación continuada de la calidad de las pruebas en el marco de un proceso continuado de control de calidad. Situación actual en las Islas Baleares 61 Para mejorar este proceso, durante el año 2010 se llevó a cabo un programa formativo que además permitió identificar a los profesionales (médicos y enfermeras) responsables de la actividad en cada centro de salud. Los recursos necesarios para la consecución de dicho programa formativo y de selección de responsables se efectuó mediante financiación específica otorgado por el consejo interterritorial del SNS a la estrategia EPOC. Los resultados de nuestro proyecto cumplieron los indicadores diseñados para su evaluación. No obstante, la presentación de las pruebas realizadas en los centros de salud en un formato analógico, con escasas posibilidades de monitorización, provoca serias dificultades para evaluar de manera efectiva el cumplimiento de nuestro objetivo final y prioritario: la realización de espirometrías de calidad en nuestro ámbito. La ventana de oportunidad La estrategia en EPOC de las Islas Baleares surge en el marco de desarrollo de la Estrategia de EPOC del Sistema Nacional de Salud y establece entre los objetivos prioritarios dentro del apartado de prevención y detección precoz de la enfermedad el siguiente: Definir el proceso común de detección precoz mediante espirometría en atención primaria y su integración en la historia clínica. Se establecerá de forma común para todos los centros de salud un protocolo específico que defina: Los criterios básicos para la estandarización de la espirometría, que incluirán aspectos como la calibración, criterios de aceptabilidad de la prueba, número de intentos, o criterios de reproducibilidad. Criterios organizativos incluyendo circuitos, modo de citación, agendas o capacitación de los profesionales para la realización de la prueba y su interpretación. Se desarrollará la integración de señales procedentes de espirómetros en la historia clínica electrónica. Se desarrollará, en el proyecto historia de salud, dentro de la gestión integrada de proceso EPOC, una aplicación por la que se recogerán todas las espirometrías. Además de permitir el desarrollo de los objetivos de detección precoz de EPOC elaborados
71 62 Módulo 3 Espirometría y otras pruebas funcionales respiratorias en la Estrategia EPOC, este proyecto desarrolla también objetivos vinculados al desarrollo de nuevas tecnologías en el tratamiento de la EPOC, que son por sí mismos uno de los objetivos prioritarios de la Estrategia y que permiten a su vez la posibilidad de alcanzar otras metas en el manejo de los pacientes con EPOC estable, en las exacerbaciones y en fases avanzadas de la enfermedad, mediante la interoperabilidad y el trabajo en plataformas comunes de todos los implicados en el cuidado de estos pacientes.» De esta forma, en Baleares todos los profesionales se han formado en la realización de espirometrías, en todos los centros existe un responsable médico y otro de enfermería encargados del control de calidad, con sus funciones específicas, cada mañana se calibran los espirómetros (Datospir 120 ), la mayoría de los centros realizan espirometrías de calidad cada día, y todo ello está permitiendo aumentar el número de diagnósticos realizados correctamente. La relación de los proyectos en marcha sería demasiado amplia para la extensión de este capítulo. Pero es útil conocer que experiencias similares se están realizando en Aragón, Asturias, Galicia, Valencia (pionera en la puesta en marcha de un programa integral para el tratamiento del paciente con EPOC fruto de las recomendaciones de la Estrategia Nacional), Andalucía o País Vasco. Precisamente en el País Vasco se han realizado varios trabajos que evalúan la eficacia y los costes de un programa para garantizar la calidad de la espirometría forzada en AP y analizar el impacto de la herramienta de teletrabajo para potenciar la atención sanitaria en las fases iniciales de la EPOC. Se analizaron exploraciones durante el periodo de observación (beca FIS), de intervención y de control. Se controla la calidad de la espirometría según criterios de la European Respiratory Society y de la American Thoracity Society (ERS/ATS), los parámetros espirométricos (FVC, FEV1, flujo espiratorio pico [PEF], tiempo espirado, etc.), los costes asociados y el impacto sanitario en cuanto a flujo de pacientes y potencialidad de la telemedicina. Datos preliminares iniciales demuestran la efectividad de la aplicación de la telemedicina para mejorar el entrenamiento de los profesionales de AP y el mantenimiento de los resultados de calidad, constituyendo una herramienta importante para el soporte de la continuidad asistencial. Entre los datos de calidad de las espirometrías (valoradas por dos personas del grupo vasco de enfermedades respiratorias de semfyc, con una concordancia interobservador entre ellos muy buena para la reproducibilidad y diagnóstico del patrón y buena para la aceptabilidad índice de Kappa de 0,948, 0,87 y 0,77, respectivamente ), entre las catalogadas como «deficiente maniobra» destaca el elevado número de curvas cuyo tiempo de espiración era corto (42%), lo que provocaba un alto número de diagnósticos de restricción pulmonar. Estudio multicéntrico Fruto de estas experiencias está en marcha el «Estudio multicéntrico para el análisis de la efectividad de la telemedicina en programas para asegurar la calidad de las espirometrías», que se realiza entre el Hospital de Cruces (Bilbao) y 15 centros de salud con los objetivos específicos de evaluación siguientes: Eficacia y utilidad de la aplicación de telemedicina en control de calidad de la espirometría forzada en atención primaria. Potencialidades de la aplicación de la telemedicina a nivel de formación continuada y en el desarrollo de atención integrada de los pacientes con enfermedades respiratorias. Grado de satisfacción de los técnicos profesionales.
72 Parte TEÓRICA La espirometría en atención primaria Grado de satisfacción de los médicos de atención primaria en la calidad de espirometrías forzadas realizadas en sus centros de atención primaria. Incluye distintas fases: a) periodo de formación; b) periodo de instalación y puesta en marcha de la aplicación informática definitiva; c) periodo de implementación; d) periodo de consolidación; e) funcionalidad de la aplicación y los equipos de medición; f) variables espirométricas; g) esquema de control de calidad de las mediciones de la función pulmonar; h) evaluación del grado de satisfacción de los usuarios de la aplicación, e i) evaluación de la integración global del proyecto. Entre los datos ya valorados de formación de los profesionales de los centros de salud destaca que al entrar en el proyecto el porcentaje de espirometrías correctas fue del 56,8%. Nueve meses después de la intervención formativa, este porcentaje aumentó hasta el 83,3%. Conclusión Podemos concluir diciendo que, una vez conseguida la colaboración de las instituciones correspondientes, la mayoría de las actuaciones en AP giran en torno a los objetivos perseguidos por estos proyectos: mejorar la formación de los profesionales, tanto médicos como diplomados en enfermería, organizar el circuito y clarificar los responsables del control de calidad de las espirometrías en cada centro de salud y avanzar en su registro informatizado. Es más que probable que todas estas actuaciones llevarán, en no demasiado tiempo, al fin deseado por todos, mejorar la situación actual de la espirometría en AP en España. Bibliografía 1. Murray CJL, López AD. Alternative projections of mortality and disability by cause : Global Burden of Disease Study. Lancet. 1997;349: Naberán K. Encuesta de la actitud terapéutica y de control de los médicos generales de las ABS de Barcelona, respecto a enfermedades obstructivas respiratorias. Aten Primaria. 1994;13: De Miguel Díez J, Izquierdo Alonso JL, Molina París J, et al. Fiabilidad del diagnóstico de la EPOC en atención primaria y neumología en España. Factores predictivos. Arch Bronconeumol. 2003;39(5): López-Viña A, Cimas JE, Díaz C, et al. A comparison of primary care physician and pneumologists in the management of asthma in Spain: ASES study. Respir Med. 2003;97: Martín Olmedo P. Jornadas andaluzas de la SAMFyC. Nerja, Rodríguez Roisin R, Barberá JA, Sánchez Agudo L, et al. Jurado de Consenso. Documento de consenso sobre Enfermedad Pulmonar Obstructiva Crónica. Arch Bronconeumol. 2003;39 Supl 3: Miravitlles M, Murio C, Guerrero T, Segú JL. Tratamiento de la bronquitis crónica y la EPOC en atención primaria. Arch Bronconeumol. 1999;35: Global Strategy for Asthma Management and Prevention. NHLBI/WHO Disponible en: www. ginasthma.com 9. GEMA. Guía española para el manejo del asma. Disponible en: Fabbri LM, Hurd SS; the GOLD Scientific Committee. Global strategy for the diagnosis, management and prevention of COPD: 2003 update. Eur Respir J. 2003;22: Burgos F. Son compatibles la calidad y el uso extensivo de la espirometría? Arch Bronconeumol. 2006; 42(7): Hueto J, Cebollero P, Pascal I, et al. La espirometría en atención primaria en Navarra. Arch Bronconeumol. 2006;42(7): Naberan K, De la Roza C, Lambán M, et al. Utilización de la espirometría en el diagnóstico y tratamiento de la EPOC en atención primaria. Arch Bronconeumol. 2006;42(12): Lin K, Watkins B, Johnson T, et al. Screening for chronic obstructive pulmonary disease using spirometry: summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med. 2008;148: New Zealand Guidelines Group. Guidelines to best practice for management of stable COPD. Mayo, EPOC en atención primaria. Guía de práctica clínica basada en la evidencia. GdT Respiratorio de la SAMFyC, Clotet J, Gómez-Arbonés X, Ciria C, Albalad JM. La espirometría es un buen método para la detección y el seguimiento de la EPOC en fumadores de alto riesgo en atención primaria. Arch Bronconeumol. 2004;40(4): Miravitlles M, Fernández I, Guerrero T, Murio C. Desarrollo y resultados de un programa de cribado de la EPOC
73 64 Módulo 3 Espirometría y otras pruebas funcionales respiratorias en atención primaria. El proyecto PADOC. Arch Bronconeumol. 2000;36: Stratelis G, Jakobsson P, Molstad S, Zetterstrom O. Early detection of COPD in primary care: screening by invitation of smokers aged 40 to 55 years. Br J Gen Pract. 2004;54(500): Van Schayck CP, Loozen JMC, Wagena E, et al. Detecting patients at a high risk of developing chronic obstructive pulmonary disease in general practice: cross sectional case finding study. BMJ. 2002;324: Parkes G, Greenhalgh T, Griffin M, Dent R. Effect on smoking quit rate of telling patients their lung age: the Step2quit randomised controlled trial. BMJ. 2008; 336(7644): Estrategia en EPOC del Sistema Nacional de Salud Disponible en: Miravitlles M, De la Roza C, Morera Montemayor T, et al. Chronic respiratory symptoms, spirometry and knowledge of COPD among general population. Respir Med. 2006;100(11): Enright PL, Studnicka M, Zielinski J. Spirometry to detect and manage chronic obstructive pulmonary disease and asthma in the primary care setting. Lung Function Testing. 2010;28: Vandevoorde J, Verbanck S, Schuermans D, et al. FEV1/FEV6 and FEV6 as an alternative for FEV1/FVC and FVC in the spirometric detection of airway obstruction and restriction. Chest. 2005;127: Vandevoorde J, Verbanck S, Schuermans D, et al. Obstructive and restrictive spirometric patterns: fixed cut-offs for FEV1/FVC and FEV6. Eur Respir J. 2006;27: Hankinson JL, Odencrantz R, Fedan KB. Spirometric reference values from a sample of the U.S. general population. Am Respir Crit Care Med. 1999;159: Swanney MP, Ensen RL, Crichton DA, et al. FEV6 is an acceptable surrogate for FVC in the espirometric diagnosis of airway obstruction and restriction. Am J Respir Crit Care Med. 2000;162: Akpinar-Elci M, Fedan KB, Enright PL. FEV6 as a surrogate for FVC in detecting airways obstruction and restriction in the workplace. Eur Respir J. 2006;27: Vollmer WM, Gislason T, Burney P, et al. Comparison of spirometry criteria for the diagnosis of COPD: results from de BOLD study. Eur Respir J. 2009;34(3): Jing JY, Huang TC, Cui W, et al. Should FEV1/FEV6 replace FEV1/FVC ratio to detect airway obstruction? A metaanalysis. Chest. 2009;135(4): Bellia V, Sorino C, Catalano F, et al. Validation of FEV6 in the elderly: correlates of performance and repeatability. Thorax. 2008;63(1): Enright PL. The use and abuse of office spirometry. Prim Care Respir J. 2008;17(4): Eaton T. Spirometry in primary care practice. Chest. 1999;116: Buffels J, Degryse J, Heyrman J, Decramer M. Office spirometry significantly improves early detection of COPD in general practice; the DIDASCO study. Chest. 2004;125: Canals Borrajo G, Martínez Andión B, Cigüenza Fuster ML, et al. Spirometry for detection of underdiagnosed chronic obstructive pulmonary disease in primary care. Eur J Gen Pract. 2010;16(4): Estrategia en EPOC de las Islas Baleares.
74 Parte TEÓRICA Otras pruebas funcionales Otras pruebas funcionales 65 Luis Puente Maestu*, Rosa Gómez García**, Julio Vargas Espinal***, Jorge Chancafe Morgan*** * Jefe de Sección de Pruebas Funcionales y Broncoscopias ** Médico Adjunto. *** Médico Residente Servicio de Neumología. Hospital General Universitario Gregorio Marañón. Madrid Universidad Complutense de Madrid Introducción El estudio de la función pulmonar es uno de los elementos básicos en la evaluación diagnóstica de los pacientes con sospecha de enfermedades respiratorias, así como de su seguimiento. Además, tiene otras aplicaciones clínicas muy importantes, como son la evaluación del riesgo quirúrgico, la discapacidad y el pronóstico [1]. La información que proporcionan es objetiva, precisa, reproducible y fiable. Aparte de la espirometría y de la curva flujovolumen basales y tras la broncodilatadora, existen otras pruebas de función pulmonar útiles, como la medición del flujo máximo espiratorio (PEF), la gasometría arterial basal (GAB), la prueba de difusión pulmonar, las presiones respiratorias máximas, los volúmenes pulmonares, las pruebas de provocación bronquial y las pruebas de ejercicio. El PEF, también llamado ápice de flujo espiratorio, es el pico que alcanza el flujo durante un breve esfuerzo espiratorio máximo después de una inspiración completa. Se mide con un medidor de flujo máximo (peak-flow meter), un pequeño dispositivo portátil, fiable y barato (fig. 1). El PEF se puede medir en menos de 1 minuto. Los valores normales dependen del sexo, la altura y la edad [2]. En los pacientes con asma, el PEF se correlaciona con el flujo espiratorio máximo en el primer segundo (FEV1), pero no debe usarse como su sustituto [3-5]. Para ser útil, lo primero es enseñar al paciente a usar correctamente el medidor de flujo máximo [6] y luego determinar el mejor valor personal, para lo que se harán mediciones durante 15 días en una fase de estabilidad clínica y máximo tratamiento. Esta referencia será la que se utilice como criterio para los planes de acción [7]. Al menos una vez al año, y siempre que haya dudas sobre el resultado, se debe verificar la concordancia entre el mejor valor personal de PEF y el FEV1 medido por espirometría [4,5] y comprobar que la técnica sigue siendo correcta [6]. Tiene las siguientes utilidades. Figura 1. Aparato de medición de flujo espiratorio máximo Flujo máximo espiratorio
75 66 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Diagnóstico: variaciones superiores al 20% son diagnósticas de asma en el contexto adecuado [8]; además, permite observar la variabilidad en relación con ciertas exposiciones, como mejoría en vacaciones o empeoramiento al exponerse a ciertos ambientes, lo que, si tiene implicaciones económicas o legales, debe comprobarse fehacientemente. Control de la enfermedad. La medición del PEF no es popular, porque el sistema público de salud no la financia, es necesario hacer al menos 2 mediciones al día (lo que con el tiempo se vuelve tedioso) [3] y, además, su eficacia en el control de la enfermedad es objeto de controversia [9,10]; sin embargo, puede ser particularmente útil en los pacientes que tienen una percepción pobre de sus síntomas. Son significativas las variaciones diarias o entre días superiores al 20% y requieren ajuste de la medicación; las variaciones mayores del 50% suelen requerir además contacto con el médico [8]. Manejo de los ataques agudos de asma en la unidad de urgencias. La medición del PEF permite la evaluación objetiva de la gravedad de una crisis asmática. Valores inferiores al 40% del de referencia o del mejor valor personal del paciente, o valores absolutos de PEF en adultos menores de 200 l/min 1 (salvo sujetos inusualmente pequeños), indican gravedad [2]. El PEF también es un índice predictivo de hipercapnia, lo que permite obviar hacer gasometría arterial de rutina, pues, en ausencia de factores distintos del asma, la hipercapnia se presenta cuando el PEF cae por debajo de 25% del valor normal [11]. Finalmente, sirve para guiar las decisiones de alta. Un paciente con un PEF < 25% del valor de referencia tiene una crisis muy grave y puede necesitar ingreso en la unidad de cuidados intensivos (UCI). Un paciente con un PEF < 40% del valor de referencia sigue requiriendo atención médica supervisada. Un paciente con un PEF entre 40 y 70% del valor de referencia puede ser dado de alta si ha respondido significativamente al tratamiento broncodilatador, demuestra capacidad para autocuidarse, tiene apoyo familiar, unas condiciones adecuadas en su domicilio y accesibilidad suficientemente rápida al hospital. La mayoría de los pacientes con un PEF > 70% de lo normal o su mejor valor pueden continuar con su cuidado en el domicilio [12]. Gasometría arterial Consiste en la medición de las presiones de los gases que se intercambian en los pulmones y del ph en la sangre arterial. La solubilidad del anhídrido carbónico (CO2) en la sangre es lineal en el rango fisiológico, por lo que la presión arterial de CO2 (PaCO2) nos da una medida del contenido sanguíneo. Por el contrario, la curva de saturación de la hemoglobina tiene una forma curvilínea (fig. 2), y para interpretar la gasometría necesitamos, aparte de la presión arterial de oxígeno (PaO2), medir o estimar la saturación de oxígeno (SatO2). La GAB es una prueba dolorosa y su empleo no debiera ser rutinario; sólo está indicada en los pacientes que tienen una SatO2 baja, por pulsioximetría, o una sospecha razonable de Figura 2. Curva de disociación de la hemoglobina Porcentaje de saturación Hemoglobina PO1 (mmhg)
76 Parte TEÓRICA Otras pruebas funcionales hipercarbia. Sus aplicaciones clínicas son las siguientes: Sirve para valorar el intercambio de gases mediante el cálculo del gradiente alveoloarterial (DA-a)O2 PA,02 = (PB 47) FI,02 PaCO2 (1) R D (A a) O2 = PA,02 PaO2 (2) donde PA,02 es la presión alveolar de oxígeno, PB es la presión barométrica en mmhg, 47 (6,3 kpa) es la presión de vapor de agua a 37 C cuando el aire está saturado y R es el equivalente respiratorio que, si no se mide, se suele aplicar 0,8 en condiciones basales, por lo que el término PaCO2/R = 1,25 PaCO2. La (DA-a)O2 debe ser inferior a 15 mmhg (2 kpa) en reposo respirando aire ambiente, pero cambia con las variaciones de la FI,02, particularmente con las superiores al 50%; por ejemplo, en individuos jóvenes sanos la D(A-a)O2 se incrementa de 50 a 100 mmhg cuando la FI,02 aumenta a 1 [13]. Por tanto, es difícil comparar la (DA-a)O2 a diferentes niveles de FI,02. En entornos donde se manejan FI,02 elevadas se tiende a preferir la relación PaO2/FI,02 para evaluar el deterioro de intercambio gaseoso. Una relación PaO2/ FI,02 < 300 mmhg (40 kpa) indica una alteración grave del intercambio gaseoso. Permite estimar la presión arterial en altura conociendo el gradiente alveoloarterial (DA-a)O2 PB = 760e a/7924 (3) El diagnóstico de insuficiencia respiratoria hipoxémica (PaO2 < 60 mmhg u 8 kpa) o hipercárbica (PaCO2 > 50 mmhg o 6,7 kpa). También sirve para confirmar la hipoxemia crónica, proporcionar una evaluación más detallada de su gravedad y ser la base de la indicación de oxigenoterapia crónica. Dicha terapia se considera indicada en la 67 enfermedad pulmonar obstructiva crónica (EPOC) estable u otras patologías causantes de hipoxemia crónica con una PaO2 < 55 mmhg (7,3 kpa) respirando aire ambiente, o con PaO2 entre 55 y 60 mmhg (7,3-8 kpa) asociada a hipertensión arterial pulmonar, poliglobulia (hematocrito > 55%), cor pulmonale crónico o trastornos del ritmo cardiaco. Difusión de monóxido de carbono por respiración única La función primordial del pulmón es el intercambio de oxígeno y dióxido de carbono en cantidades adecuadas para satisfacer las demandas del metabolismo energético y la homeostasis ácido-base. La difusión de gases a través del pulmón es pasiva y, por tanto, se puede describir mediante la ley de Fick: x = PAx Pcx (4) RM x es la cantidad de gas transferida en una unidad de tiempo, PAx la presión del gas en el alveolo, Pcx las presiones del gas «x» en el capilar pulmonar y RM la resistencia que opone la membrana al paso del gas. Si definimos DM, capacidad de difusión de la membrana alveolocapilar, como 1/RM, entonces DM = X (5) PAx Pcx pero, si el gas se combina con la hemoglobina a una velocidad finita y en una cantidad muy superior a la que se disuelve en la sangre, la cantidad de gas que se combina por unidad de tiempo se puede describir así: x = θ Vc Pcx (6) donde θ es la afinidad del gas por la hemoglobina, Vc el volumen de hemoglobina pasando por los capilares en una unidad de tiempo y
77 68 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Pcx la presión parcial del gas «x» en el capilar. En gases con gran afinidad por hemoglobina se puede demostrar que la difusión global desde el alveolo hasta la hemoglobina, también conocida como «difusión pulmonar» (DL) o «transferencia pulmonar» (TL), es 1 = (7) DL DM θvc es decir, la transferencia del gas a través de la membrana y la combinación química con la hemoglobina funcionan como conductancias (inversa de la resistencia) en serie (fig. 3). La medición de la DL,O2 requiere conocer los valores de la presión de oxígeno en sangre venosa mixta y capilar pulmonar, lo que es invasor y complejo. En la práctica lo que hacemos es medir la difusión de monóxido de carbono (CO), molécula que tiene un tamaño similar a la de oxígeno y difunde de forma similar a través de la membrana; su afinidad por la hemoglobina es 210 veces mayor que la del oxígeno y, en consecuencia, tanto la presión al principio como la final del capilar pulmonar pueden considerarse próximas a 0, lo que simplifica mucho el cálculo y la técnica. La utilización de CO para estimar la difusión de oxígeno tiene dos limitaciones: la primera es que, mientras la difusión de oxígeno está dominada fundamentalmente por la velocidad de la combinación con la hemoglobina [14], con el monóxido de carbono este factor supone tan sólo aproximadamente el 50% de la resistencia; la segunda es que las desigualdades / y, en particular, las desigualdades A/DL y DL/, tienen diferentes efectos en la DL,O2 que en la DL,CO, debido a la mayor solubilidad del CO en la sangre. La solución de ecuación de difusión en respiración única para el CO es: 60 t VA DL,CO = (PB 6,26) [FA,Tr][FI,CO] [Fl,Tr][FA,CO] (8) siendo t el tiempo de apnea, VA el volumen alveolar, PB la presión barométrica en kpa, 6,26 es la presión parcial del vapor de agua a 37 C en kpa, [Fl,Tr] y [Fl,CO] son las fracciones inhaladas y [FA,Tr] y [FA,CO] las fracciones alveolares del gas trazador y el CO, respectivamente. Se suele expresar en ml/min 1, mmhg 1 (Estados Unidos) o mmol/min 1 / kp 1 (unidades del SI). Las conversiones son Figura 3. La capacidad de difusión del pulmón DL depende de dos componentes: el primero es la difusión a través de la membrana y, el segundo, de la velocidad de la reacción química con la hemoglobina Pared alveolar Eritrocito Alveolo O2 + Hb HbO2 O2 Dm θ Vc 1 DL 1 = + DM 1 θ VC
78 Parte TEÓRICA Otras pruebas funcionales aproximadamente de 3:1. El volumen alveolar se calcula del volumen inspirado (Vl): VA = Fl,Tr (Vl VD) FA,Tr (9) La Fl,02 [15]: DL,CO = (corregida por PA,O2 elevada) 69 DL,CO (12) (1 + 0,26 [PA,O2 13,3]) siendo VD el espacio muerto del sujeto y del equipo. La DL,CO varía con el sexo, edad y talla, y debe interpretarse con respecto a los valores de referencia de forma similar a la espirometría (percentil 5 del intervalo de confianza); como la variabilidad de la medición es mayor, el intervalo de confianza viene a estar entre 75 y 125% (tabla 1) [15,16]. Para interpretar la difusión también hay que tener en cuenta otra serie de factores como los que aquí se indican: La concentración de hemoglobina en sangre [15]: DL,CO = DL,CO (corregida por Hb) siendo [Hb] la concentración de hemoglobina en mg/dl 1. Para mujeres y niños menores de 15 años la compensación es [15]: DL,CO = DL,CO (corregida por Hb) Tabla 1. Gravedad de las alteraciones de la transferencia de monóxido de carbono Leve > 60% y < LIN (o 75%) Moderada 40-60% Severa 40 % = % predicho. LIN: límite inferior de la normalidad. 1,7 [Hb] (10,22 + [Hb]) (10) 1,7 [Hb] (9,38 + [Hb]) (11) en la que PA,O2 es la presión alveolar de oxígeno calculada de la ecuación del gas alveolar, conociendo la presión arterial de dióxido de carbono por gasometría arterial. Esta fórmula asume que la DL,CO varía 0,23% por cada kpa (= 7,5 mmhg) de aumento en la PA,O2, que, con aire ambiente al nivel del mar, es 13,3 kpa. La altitud [15]: DL,CO = (corregida por altitud) DL,CO (13) (1 + 0,26 [P-I,O2 20]) Esta fórmula asume que la DL,CO varía 0,26% por cada kpa (= 7,5 mmhg) de aumento en la PI,O2, que, con aire ambiente al nivel del mar, es 20 kpa. También hay que tener en cuenta la concentración de carboxihemoglobina [15]: DL,CO = (corregida por carboxihemoglobina) DL,CO (102% [COHb]) (14) siendo [COHb] la cantidad de hemoglobina combinada con CO en porcentaje. La fórmula [COHb] asume que la basal es 2%. El volumen alveolar. La relación DL,co/VA, también conocida como constante de difusión Kco, permitiría diferenciar en teoría los procesos que reducen el volumen alveolar (VA) porque limitan la expansión normal o porque los gases usados para medir DL,co no se diluyen completamente por todo el espacio alveolar de otras enfermedades que reducen la DL,co, porque afectan cualitativamente al intercambio; sin embargo, la relación DL,co/VA no es lineal [15,17]:
79 70 Módulo 3 Espirometría y otras pruebas funcionales respiratorias DL,CO (corregida por VAm) = VAm DL,CO (VAp) (0,58 + 0,42 ) VAp KCO (corregida por VAm) = VAm KCO (VAp) (0,42 + 0,58 ) VAp (15) (16) donde VAm es el volumen alveolar medido y VAp es el volumen alveolar predicho de la TLC. Como vemos de las ecuaciones 15 y 16, la reducción entre la DLCO y la reducción de la KCO por efecto de un VA menor no es 1:1 (fig. 4) [15,17] y, por tanto, su comparación con los valores teóricos habituales que no tienen en cuenta este efecto puede llevar a errores cuando el VA sea bajo [18]. Además, las fórmulas 15 y 16 se han desarrollado en personas normales con distintos VI submáximos, pero no se han validado en pacientes con enfermedades respiratorias y, algunos datos, sugieren que en ciertos procesos, como la resección pulmonar (sobre todo la neumonectomía) DL,CO/VA es mayor de lo esperado por esta fórmula, mientras que en enfermedades vasculares pulmonares DL,CO/VA es menor. Por ello, no se deben sacar conclusiones clínicas de la KCO, particularmente que una KCO normal en presencia de un DLCO baja significa un intercambio gaseoso normal en el pulmón. Otros factores menos importantes de variabilidad son el ritmo circadiano, la postura, el espacio muerto, la presión alveolar durante la oclusión, el tiempo de apnea y el ejercicio reciente. Todos estos factores deben estandarizarse de acuerdo con las normativas [15]. La DL,CO es útil en la evaluación de la enfermedad, tanto restrictivas y obstructivas [19]: Junto con la gasometría en sangre arterial, permite el análisis del intercambio pulmonar de gases. Figura 4. Relación difusión-volumen alveolar DLco: transferencia pulmonar de monóxido de carbono por respiración única. VA: volumen alveolar. Tomado de Frans et al. [17]. 3,5 DLCO/VA (mmol min 1 kpa 1 l 1 3,0 2,5 2,0 1,5 r = 0,69 1, VA (1)
80 Parte TEÓRICA Otras pruebas funcionales Es un marcador cuantitativo de la integridad anatómica de la membrana alveolocapilar y, por extensión, de la microcirculación pulmonar y el intersticio. Una disminución de la DLCO con una espirometría normal sugiere trastornos vasculares pulmonares, pero también se puede dar en enfermedades pulmonares intersticiales difusas (EPID) o enfisema incipientes [16]. Una DLCO disminuida en presencia de restricción sugiere EPID [20,21], aunque algunas veces se ve restricción en las enfermedades vasculares pulmonares [22]. La DLCO disminuida en presencia de obstrucción sugiere enfisema [23], pero se puede ver también en otras enfermedades mucho más raras, como la histiocitosis X, la linfangioleiomiomatosis y la esclerosis tuberosa con afectación pulmonar [24,25]. En la insuficiencia cardiaca por insuficiencia ventricular izquierda se puede observar una DLCO baja, que guarda relación directa con la gravedad y es un potente factor pronóstico de la enfermedad [15]. Una DLCO alta se puede ver en el asma [26], la obesidad [27] y la hemorragia intrapulmonar [28]. La DLCO se puede emplear también para categorizar la gravedad de las enfermedades respiratorias [16] y permite estratificar el riesgo de la cirugía con resección pulmonar [29]. 71 Mariotte al gas alveolar. El pletismógrafo de volumen constante (fig. 5) el más habitual consiste en una cabina de volumen conocido, hermética e indeformable, dentro de la cual los cambios de volumen alveolar (ΔVA) producen, al desplazarse el tórax, cambios idénticos de volumen en el pletismógrafo (ΔVbox o volume shift) y, en consecuencia, cambios proporcionales de presión dentro de la cabina (ΔPbox). En el sistema por el que respira el paciente hay un manómetro para medir la presión en la boca (Pboca) cuando una válvula Figura 5. Pletismógrafo de volumen constante Determinación de los volúmenes estáticos Con la espirometría no podemos ver el gas que queda en los pulmones al final de una espiración forzada, es decir, el volumen residual (VR) que es necesario para determinar la capacidad residual funcional (FRC) y la capacidad pulmonar total (TLC). Los métodos más utilizados para medir la FRC son el de dilución y la pletismografía corporal total, la cual se basa en la aplicación de la ley de Boyle-
81 72 Módulo 3 Espirometría y otras pruebas funcionales respiratorias en dicho sistema interrumpe el flujo de aire, circunstancia en la que la Pboca es igual a la presión en el alveolo (PA). Cuando la válvula se cierra y ocluye la respiración, se puede medir la relación ΔPbox/ΔPboca y, como hemos visto que ΔVA es proporcional a ΔPbox, podemos estimar la relación ΔVA /ΔPA: VA = PA Vbox Pbox Pbox Pboca que permite calcular FRCplet. FRCplet = (PB 47) Vbox Pboca (18) El sistema tiene un neumotacógrafo que permite medir, cuando la válvula está abierta, capacidad vital (VC), volumen de reserva espiratoria (ERV) y capacidad inspiratoria (IC) para calcular todos los volúmenes. El método de dilución consiste en la inhalación de un volumen de gas conocido (V1) que contiene una concentración conocida (C1) de un gas inerte (generalmente helio), que no es soluble en los tejidos. V1 es el volumen total respirado hasta que se completa la dilución y la concentración final (C2) del gas se estabiliza: Las ventajas del método de dilución es que FRC = = V1 (C1 C2) C2 Vbox Pboca = (17) (19) el equipo empleado para la medir la difusión de monóxido de carbono permite medir volúmenes con el software necesario. La pletismografía da resultados algo mayores que la dilución, pero es más rápida, precisa y reproducible [16]. Hay que señalar que, en presencia de obstrucción muy intensa, la pletismografía tiende a sobrestimar los volúmenes, probablemente debido a que las variaciones de presión generadas durante el cierre del obturador no se transmiten completamente a la boca [30]. La medición de los volúmenes pulmonares tiene el siguiente uso clínico: Restricción. El concepto de restricción pulmonar viene definido por una TLC inferior al percentil 5 de los valores de referencia (85% del valor de referencia). Son excepcionales los casos de TLC baja con VC normal [16,31-35], por lo que medir volúmenes es, en general, poco útil en sujetos con VC normal (veáse más abajo, hiperinsuflación). La indicación principal de la medición de volúmenes es la confirmación de restricción en pacientes con VC baja; sin embargo, en los casos de espirometrías «restrictivas típicas», es decir, cuando la VC está reducida, el FEV1/VC aumentado (85-90%) y la curva flujo-volumen tiene el patrón convexo característica [16]; si el cuadro clínico es compatible con una enfermedad restrictiva (p. ej., fibrosis pulmonar), probablemente la confirmación de la restricción con una TLC no aporta mucho al diagnóstico del paciente. En los casos de espirometrías con VC baja acompañadas de un FEV1/VC normal o sólo ligeramente aumentado (curva flujo-volumen de morfología normal, pero pequeña), es bastante frecuente que la maniobra de inspiración o la espiración no hayan sido máximas; de hecho, hasta en un 50% de estos pacientes se demuestra que el sujeto es normal al repetir la espirometría [16,31,33]. En tales casos estaría indicada la medición de volúmenes si la VC sigue baja tras repetir la espirometría. La mayoría de los casos de patrón mixto son pacientes obstructivos; tan sólo un 10%, más o menos, tienen la TLC baja y la gran mayoría de ellos tiene un FEV1/VC > 60% y un FEV1 > 40% [31], por lo que ésta sería la población diana para medir volúmenes pulmonares en caso de patrón mixto. Hiperinsuflación. El concepto de hiperinsuflación viene definido por una FRC (%) o una relación VR/TLC superior al percentil 5 de los valores de referencia (o 120%) y se considera que la relación VR/TLC por encima del percentil 95 (o 120%) pero,
82 Parte TEÓRICA Otras pruebas funcionales por debajo del 140% predicho, son indicativos de hiperinsuflación leve, entre 140 y 170% del valor de hiperinsuflación leve y valores por encima de 170% de hiperinsuflación severa [30,36]. La confirmación de hiperinsuflación está indicada en la selección de candidatos a reducción de volumen, exigiéndose más de 100% de TLC y 135% de FRC [37]. Aunque en general hay correlación entre la disminución del FEV1 y el aumento del VR [32,38], hasta en un 15% de pacientes la concordancia no es buena [30,32,38], por lo que la medición de volúmenes podría ayudar a interpretar algunos casos de disnea no justificada en pacientes obstructivos al detectar hiperinsuflación no esperada. Estas indicaciones serían independientes de si la VC está o no está baja. En las enfermedades restrictivas, la TLC tiene un valor pronóstico [21]. No hay datos que documenten el empleo de categorías de VR o la FRC en la obstrucción al flujo aéreo o la TLC en la restricción pulmonar para clasificar la gravedad como se hace en la espirometría; por otra parte, casi siempre se usa la VC, más fácil de medir para definir la gravedad de las enfermedades restrictivas y para su seguimiento. No se ha demostrado la utilidad de los volúmenes en el diagnóstico diferencial del enfisema y la bronquitis crónica o entre la EPOC y el asma, salvo en casos de hiperinsuflación severa [30,32,38]. Hay evidencia que sugiere que la evaluación de la respuesta a broncodilatadores con el FEV1 o la FVC subestiman de forma impredecible el efecto de los broncodilatadores en muchos pacientes con limitación al flujo aéreo [39], en los que, aunque no mejore significativamente el FEV1 o la FVC, se observa una reducción relevante de la FRC. Sin embargo, los cambios en FRC e IC son recíprocos [30,39] y la IC se puede medir con un espirómetro. Resistencias de la vía aérea 73 La resistencia de la vía aérea (Raw) se mide habitualmente con un pletismógrafo, aunque existen otros procedimientos como la oscilometría forzado o la oclusión de la vía aérea, de los que no hablaremos en este texto. Cuando el flujo es laminar, las resistencias de la vía aérea (Raw) vienen determinadas por la fórmula Raw = (20) en la que es el flujo. Para medir las resistencias, el paciente ha de respirar a través del neumotacógrafo para poder medir el flujo y, por tanto, no se puede medir Palv directamente, pues en esta situación Pboca PA; no obstante, se puede llegar a una buena aproximación de forma indirecta. Cuando iniciamos una inspiración o una espiración, el volumen del tórax cambia; sin embargo, esto no se traduce inmediatamente en la entrada o salida de aire por la boca, ya que primero se tiene que deformar el tórax lo suficiente para generar la presión que aspire o empuje el aire. Este desfase se mantiene mientras haya movimiento de aire por la boca, de forma que los cambios de volumen pulmonar son ligeramente mayores que el volumen de aire que está entrando o saliendo por la boca. Esta pequeña diferencia ( VA) que corresponde a la compresión o la descompresión del tórax necesaria para generar la presión suficiente para mover el aire produce un cambio en el Vbox, idéntico al cambio en el VA, y en consecuencia un cambio en Pbox si la cabina está cerrada. Por tanto, en realidad lo que medimos es: Raw = PA PB Pbox (21) Como Pbox y Vbox son directamente proporcionales y conocidos ( Pbox/ Vbox se ha medi-
83 74 Módulo 3 Espirometría y otras pruebas funcionales respiratorias do al calibrar la cabina), el pletismógrafo nos muestra un gráfico de en relación con Vbox (fig. 6) producido durante la respiración-descompresión torácica. Como el aire de la cabina se calienta y enfría con la compresión y descompresión, es imprescindible que el aparato compense los efectos térmicos y de la humedad durante la inspiración y la espiración. Dicha compensación suele hacerse de forma electrónica [40]. Hay que tener en cuenta que el bucle obtenido por este procedimiento es en realidad un bucle de resistencia específica (SRaw), que depende tanto de la Raw como del volumen al que se ha medido, puesto que, cuanto mayor sea el volumen pulmonar (FRC + VT/2) mayor será el cambio de VA (= Vbox) que hay que generar para obtener el mismo Pbox y, por tanto, SRaw será mayor aunque las Raw sean las mismas [41]. Raw se calcula dividiendo SRaw entre FRC + VT/2. Cuando el bucle no es una línea recta, como ocurre en los pacientes con obstrucción (fig. 7), diferentes métodos dan diferentes resultados de resistencia: Resistencia específica total (srtot) [36,41]: se calcula de la línea recta entre desplazamiento máximo de volumen inspiratorio y el mínimo volumen espiratorio (fig. 6). Es más sensible la enfermedad de las vías Figura 6. Bucle de resistencia específica de las vías respiratorias (sraw) durante la respiración corriente en un paciente con limitación crónica del flujo aéreo. Shift volume es el término como suele aparecer el cambio de volumen de la cabina en los gráficos de los pletismógrafos comerciales Flow l s ,5 l s ,5 l s 1 Shift Volume ml respiratorias periféricas, pero también es más variable [41]. Resistencia específica efectiva (sreff) [36] de la vía aérea (fig. 7): se calcula dividiendo el área del bucle de trabajo respiratorio específico (bucle VT frente a Pbox) por el área de la curva flujo-volumen corriente. Figura 7. Cálculo de las resistencias Rtot R 0,5 Trabajo respiratorio Reff* + 0,5 l/s 0,5 l/s Flujo-volumen * Se calcula de las áreas del bucle de trabajo respiratorio y de la curva flujo-volumen.
84 Parte TEÓRICA Otras pruebas funcionales Equivale a una línea de regresión que se ajusta a todos los puntos del bucle de resistencias (Δ /ΔVbox). Resistencia específica 0,5 (SR0.5) [36]: es la resistencia medida entre el desplazamiento de volumen inspiratorio a un flujo de 0,5 l/s 1 (fig. 6) y el desplazamiento espiratorio de 0,5 l/s 1. A este flujo, seguro que el flujo es laminar y que se cumplen las asunciones del cálculo de resistencias, aunque éstas son relativamente insensibles al comportamiento de las vías aéreas periféricas. En los laboratorios europeos se utiliza la srtot y sreff y, en Estados Unidos, tienden a preferir SR0.5. Como la relación entre la Raw y el volumen pulmonar es aproximadamente hiperbólica, la conductancia de la vía aérea (Gaw), es decir, la inversa a la resistencia, disminuye linealmente al disminuir el volumen pulmonar y la conductancia específica (SGaw = 1 SRaw = SRaw (FRC + es aproximadamente una constante. De esta forma, para estudios o comparaciones en los cuales el volumen pulmonar cambie o se realicen mediciones a diferentes volúmenes pulmonares, la SGaw es más informativa que la Raw. Hay distintas fuentes de valores de referencia para estas mediciones [16,30,36]. Las variaciones debidas a la edad son relativamente poco importantes. Los valores medios comunicados en la literatura médica para Rtot son de 0,20-0,22 kpa/s/l 1, con un límite superior de lo normal de 0,30-0,35 kpa/s/l 1. Para Reff son de 0,15-0,2 kpa/s/l 1, con un límite superior de 0,25-0,30 kpa/s 1 /l 1 y para R0,5 y 0,13-0,15 kpa/s 1 /l 1 con un límite superior de 0.25 kpa/s 1 /l 1. Se considera que un valor de Rtot, Reff, R0,5 entre % está elevado y > 250%, muy elevado. VT 2 ) (22) 75 Debemos fijarnos siempre tanto en las Raw que hayamos elegido en nuestro laboratorio (Rtot, Reff, R0,5) como en las sraw, pues en pacientes hipersuflados puede ocurrir que sólo haya una moderada elevación de las Raw, mientras que sraw está mucho más alterado por el aumento de FRC [30,36]. El análisis de los bucles proporciona información fisiopatológica relevante. A simple vista, un bucle con una pendiente excluye una obstrucción relevante del flujo aéreo (excepto si los volúmenes pulmonares son muy bajos); por el contrario, una curva aplanada indica obstrucción, que puede ser diferente en la inspiración que en la espiración. Si el procedimiento se realiza correctamente, un bucle en «raqueta» (fig. 6) indica una falta de homogeneidad de la ventilación y atrapamiento aéreo. Uso clínico La medición de resistencias en la prueba de broncodilatadores se recomienda sólo en pacientes en los que las maniobras forzadas produzcan broncoespasmo y en pacientes que no sean capaces de realizar correctamente la espirometría, ya que las SRaw y SGaw se obtienen con maniobras de respiración corriente y requieren menos colaboración. Se considera positivo un aumento de la SGaw del 40% o una reducción de la SRaw del 50% [30,36]. También se pueden realizar pruebas de provocación bronquial en pacientes que no hacen bien la espirometría. En las pruebas de provocación bronquial se considera como positivo cuando la Raw o SRaw aumentan un 70% o la SGaw disminuye un 40% [30,36]. Presiones respiratorias máximas La presión inspiratoria máxima (PIM) es la máxima presión que el paciente puede producir tratando de inhalar a través de una boquilla bloqueada después de una espiración
85 76 Módulo 3 Espirometría y otras pruebas funcionales respiratorias máxima (desde VR). La presión PIM puede medirse en la nariz, insertando una oliva conectada y esnifando con la otra fosa nasal abierta; a este procedimiento lo llamamos «SNIP», y tiene las mismas indicaciones que la PIM; su ventaja es que permite medir presiones en pacientes con enfermedades neuromusculares que no pueden cerrar bien la boca; además, esnifar es una maniobra natural más fácil de entender por el paciente. Habitualmente se miden las dos, PIM y SNIP, y se considera más representativa la mejor, que es la que luego se usa en el seguimiento. La presión espiratoria máxima (PEM) es la presión máxima ejercida sobre una boquilla bloqueada, medida durante la espiración forzada tras una inhalación completa (desde TLC), con los carrillos inflados. Son fáciles de medir. La PIM/SNIP y la PEM son determinaciones de la capacidad para generar fuerza de los músculos inspiratorios y espiratorios y, por tanto, pueden verse afectadas por la configuración del tórax, particularmente del diafragma, sin que haya alteraciones propiamente musculares, como ocurre en EPOC y está hiperisuflado. Las PIM/SNIP y PEM promedio para los varones adultos son 100 cmh2o ( 98 hpa) y 170 cmh2o (167 hpa), respectivamente, mientras que los valores correspondientes para las mujeres adultas son aproximadamente 70 cmh2o ( 69 hpa) y 110 cmh2o (108 hpa), respectivamente [42,43]. El límite inferior del rango normal es de alrededor de dos tercios de estos valores [16]. Están indicadas siempre que exista una disminución inexplicable de la VC o se sospeche clínicamente debilidad de los músculos respiratorios (tabla 2). La monitorización de la PIM/SNIP y PEM es útil, junto a la VC, en el seguimiento de la evolución de los pacientes con trastornos neuromusculares, aunque sólo permiten constatar la gravedad en el momento de la medición, ya que algunas enfermedades neuromusculares Tabla 2. Procesos en los que puede ser útil medir las presiones respiratorias Procesos Enfermedades del SNC Ejemplos Enfermedades de las motoneuronas (ELA) Poliomielitis Lesiones de la médula cervical Neuropatías Síndrome de Guillain-Barré Parálisis diafragmática bilateral Neuropatía de las enfermedades críticas Trastornos de la placa neuromuscular Miastenia gravis Botulismo Enfermedad muscular Polimiositis SNC: sistema nervioso central. ELA: esclerosis lateral amiotrófica. Distrofias (Duchenne, Steinert, etc.) Miopatías, en especial la miopatía por déficit de maltasa (Pompe) y las miopatías mitocondriales
86 Parte TEÓRICA Otras pruebas funcionales (que evolucionan a brotes) y la función muscular pueden empeorar en cualquier momento de forma impredecible. Pruebas de provocación bronquial La hiperreactividad bronquial (HRB) consiste en el aumento de las resistencias espiratorias tras la exposición a estímulos de diversa naturaleza que producen poco o ningún efecto a personas sanas. Se presenta de forma casi universal en el asma, pero también puede encontrarse en enfermedades como la EPOC, la sarcoidosis, las bronquiectasias, la rinitis, la atopia, la fibrosis quística o la insuficiencia cardiaca. Las pruebas de provocación bronquial (PPB) son protocolos estandarizados de medición de la respuesta bronquial (curvas dosis-respuesta) a distintos agentes. Aunque los estímulos usados en la PPB inespecífica producen básicamente contracción muscular, el diámetro inicial de la vía aérea también influye en el aumento de la resistencia, que provoca una determinada contracción del musculo. El grado de HRB se correlaciona con la gravedad clínica del asma y con marcadores de inflamación, aunque no de forma muy estrecha [44,45]. Las PPB inespecíficas con agentes químicos, como la metacolina o el manitol, son seguras (tabla 3) y fáciles de realizar, pero deben realizarse en laboratorios con experiencia y bajo la supervisión de un médico [46]. Es imprescindible contar con un equipo de soporte vital avanzado y medicación broncodilatadora. El paciente debe ser informado de la naturaleza de la prueba en el momento de su solicitud y otorgar su consentimiento por escrito; previamente a la realización de la prueba, se debe retirar la medicación broncodilatadora [46]. Con anticipación suficiente, se darán al enfermo instrucciones verbales y escritas de los medicamentos (especialmente broncodilatadores y antihistamínicos) y las circunstancias (infecciones de las vías aéreas, exposiciones a irritantes inhalados, etc.) que pueden alterar el resultado [46]. 77 En general, no se retiran los corticoides inhalados porque se necesitan 3 semanas para que desaparezcan sus efectos. Un resultado negativo en un paciente que está tomando corticoides inhalados indica que los síntomas que el paciente refiere no se deben al asma, aunque no descarta asma subyacente. Para excluir totalmente la HRB, la prueba tendría que ser repetida al menos 3 semanas después de la interrupción de los corticoides. Existen varios tipos de PPB que se pueden usar ante diferentes problemas clínicos, incluyendo pruebas farmacológicas, ejercicio, hiperpnea isocápnica, alimentos y antígenos. Pruebas farmacológicas Consisten en determinar la curva dosis-respuesta al fármaco dado (p. ej., metacolina, histamina, adenosina, manitol, etc.) [12,46]. El protocolo de administración debe estar estandarizado y, preferiblemente, correspon- Tabla 3. Contraindicaciones de las pruebas de provocación bronquial Absolutas Limitación del flujo aéreo grave (FEV1 < 50% previsto) Infarto de miocardio o un accidente cerebrovascular en los últimos 3 meses Hipertensión arterial no controlada (PAS > 200 mmhg o PAD > 100 mmhg) Aneurisma aórtico conocido Relativas Limitación del flujo aéreo moderada (FEV1 < 60% previsto) Incapacidad para realizar espirometría de calidad aceptable Embarazo Lactancia PAS: presión arterial sistólica. PAD: presión arterial diastólica.
87 78 Módulo 3 Espirometría y otras pruebas funcionales respiratorias der a alguno de los protocolos ampliamente difundidos [46,47]. Los agentes empleados en las PPB se clasifican según el mecanismo de acción considerado como directos o indirectos. Se cree que los agentes directos, como metacolina o histamina, causan broncoconstricción estimulando directamente a receptores del músculo liso bronquial, mientras que los estímulos indirectos (p. ej., manitol o monofosfato de adenosina) producen la broncoconstricción a través de una o más vías intermedias normalmente asociadas a la liberación de mediadores de la inflamación [48]. Sin embargo, esta distinción no es tan nítida como pudiera parecer, pues los estímulos directos afectan también a los nervios y a las células secretoras. Metacolina. Es un derivado de la acetilcolina. Es el agente más comúnmente empleado para las PPB, por ser la sustancia con la que se tiene más experiencia y porque tiene menos efectos adversos que la histamina [46]. En general, la metacolina es más sensible, aunque menos específica, que las pruebas indirectas para detectar asma [46,49]. Se considera positiva una disminución del FEV1 20% (40% si se usa la Gaw) a una concentración < 16 mg/ ml (PC20) o una dosis < 7,8 µmol (PD20). Estos puntos de corte elevados se han elegido basándose en el concepto de que la HRB no es diagnóstica (específica) del asma y, por tanto, sólo vale para descartar la enfermedad, para lo que el punto de corte de la prueba debe maximizar la sensibilidad y el valor predictivo negativo a expensas de la especificidad. Histamina. Es equivalente a la metacolina, pero cada vez se emplea menos, debido a que produce rubor facial y dolor de cabeza con cierta frecuencia [50]. Además, la histamina no está disponible como producto farmacéutico. Las pruebas indirectas tienen en general mayor especificidad, pero no está clara cuál el su sensibilidad y, por tanto, su papel sigue sin estar bien definido [48]. Manitol. Es una prueba que ha despertado gran interés, por ser sencilla de realizar y no requerir diluciones ni calibraciones de los equipos de nebulización, por lo que puede resultar más accesible y práctica para muchos laboratorios que la prueba de metacolina. Se cree que el manitol actúa aumentando la osmolaridad en la superficie de las vías aéreas, lo que induce la liberación de mediadores por los mastocitos, que sería la causa última de la broncoconstricción. El manitol se comercializa como polvo seco en cápsulas que contienen dosis progresivamente crecientes (0, 5, 10, 20, 40, 80, 160, 160, 160 mg) y se administran con un inhalador de polvo seco (Osmohale ), por lo que la estandarización es muy fácil, basta con seguir las instrucciones del prospecto [48]. Se considera una respuesta positiva una caída del FEV1 15% (PD15), con una dosis total acumulada 635 mg. La prueba de manitol es segura, aunque con frecuencia produce tos [51]. Monofosfato de adenosina (AMP). La provocación con AMP podría estar más relacionada con la inflamación de la vía aérea; sin embargo, la experiencia clínica es relativamente escasa y se carece de datos suficientes sobre la respuesta normal al AMP en sujetos sanos [52]. Tampoco está disponible como producto farmacéutico. Provocación con el ejercicio o mediante hiperpnea isocápnica. El ejercicio es un desencadenante indirecto de broncoconstricción en prácticamente todos los pacientes con vías respiratorias hiperactivas y puede ser el único desencadenante en un subgrupo de pacientes con asma [53]. La provocación con ejercicio está indicada sobre todo en niños y también en adultos en los que tenga relevancia profesional (bomberos, buceadores, militares, atletas) [54]. Se considera que el estímulo es la deshidratación de la vía aérea producida por el aumento de la ventilación/ minuto durante el ejercicio; por lo tanto, para garantizar la fiabilidad de la prueba, los pa-
88 Parte TEÓRICA Otras pruebas funcionales cientes deben mantener de un 40 a un 60% de su ventilación voluntaria máxima durante 6-8 minutos, y es necesario el control cuidadoso de la temperatura y la humedad del aire inhalado. Se realizan espirometrías 5, 10, 15, 20, y 30 minutos después [54]. La prueba se considera positiva si el FEV1 disminuye un 10%. La principal limitación de esta prueba es que el estímulo (pérdida de humedad por hiperventilación) puede ser inadecuado, dando lugar a falsos negativos. Esto se puede minimizar empleando aire sin humedad (aire sintético), enfriando el aire inhalado o mediante la hiperpnea voluntaria eucápnica o hiperventilación voluntaria isocápnica, que se basa en el mismo principio que la prueba de esfuerzo, pero produciendo una hiperpnea al paciente con una gas sintético (sin humedad) con 21% de O2, 5% de CO2 y nitrógeno, enfriado o no, durante 6 minutos. Luego se hacen espirometrías a los 5, 10 y 15 minutos. La prueba se considera positiva igualmente si el FEV1 disminuye un 10%. Es la prueba recomendada en atletas (aunque también se acepta la prueba de la metacolina) [55]. Hay varias razones por las que puede ser relevante saber si un paciente presenta HRB: La principal indicación de las PPB es la sospecha de asma, cuando el diagnóstico está en cuestión (síntomas atípicos, espirometría normal), cuando un paciente es sospechoso de padecer asma ocupacional, asma inducida por irritantes (disfunción reactiva de las vías respiratoria) y cuando se requiere un prueba que confirme o descarte el asma en buceadores, deportistas, personal militar u otros individuos en los cuales el broncoespasmo supondría un peligro inaceptable para ellos u otras personas o es requerido por las normas para poder usar medicación antiasmática (deportistas) [46] y no esté contraindicada (tabla 3). Un caso especial, por su frecuencia, es el de la tos crónica, que puede suponer hasta el 40% de las 79 consultas externas de neumología [56]. Antes de pedir una prueba de hiperreactividad hay que verificar que el paciente tiene tos persistente (más de 8 semanas), que no toma medicación que produzca tos (inhibidores de la enzima convertidora de la angiotensina) o que tenga otras causas de tos (radiografía normal), que no tiene una probabilidad clínica muy alta de asma, reflujo gastroesofágico o rinitis, en cuyo caso es preferible un ensayo terapéutico individual previo [56,57]. Una prueba de metacolina (o histamina) negativa descarta casi absolutamente el asma, salvo en raros casos de asma alérgica en los que la prueba se ha realizado tiempo después de la exposición y de los síntomas [46,58]. Si el paciente está sintomático con un cuadro clínico sugestivo de asma, una prueba de metacolina negativa obliga a pensar en diagnósticos alternativos, como en disfunción de cuerdas vocales o patología obstructiva de vías aéreas centrales. Una prueba de metacolina (o histamina) positiva no es diagnóstica de asma, pues del 1 al 7% de la población general asintomática tiene hiperreactividad bronquial (hasta un 26% si se incluyen los fumadores o atópicos) [59], aunque hay quien piensa que estos pacientes son asmáticos leves que no perciben sus sintomas [46,60]; por tanto, la PPB no es por sí sola diagnóstica de asma y se requiere una confirmación clínica de que los síntomas del paciente desaparecen con el tratamiento. En los casos en que el asma se desencadene sólo por el ejercicio y el motivo sea profesional o la persistencia de síntomas con ejercicio en un asmático correctamente tratado, pueden estar indicadas PPB con ejercicio o hipepnea isocápnica [46]. En ciertos momentos de la enfermedad, la HRB puede ser la única evidencia objetiva de disfunción de las vías áreas [60]. La HRB se relaciona con la gravedad de la enfermedad, y puede tener implicaciones
89 80 Módulo 3 Espirometría y otras pruebas funcionales respiratorias pronósticas y terapéuticas [44,45,60-62]; sin embargo, no se emplean habitualmente en la clínica para este fin ni tampoco para controlar el tratamiento [46]. La presencia de HRB en una persona asintomática es un factor de riesgo de desarrollar asma en el futuro. Otras pruebas son la provocación específica con antígenos, agentes ocupacionales o alimentos, pruebas que deben realizarse en centros hospitalarios (a veces los pacientes tienen reacciones graves y requieren ingreso o vigilancia 24 horas) con los medios adecuados o la provocación con aspirina, cuando no existen alternativas al empleo de aspirina o antiinflamatorios no esteroideos y se necesita aclarar una sospecha de asma inducida por este fármaco. Medición del óxido nítrico exhalado En los últimos años se ha despertado mucho interés en la determinación de la fracción de óxido nítrico en el aire exhalado (FENO) y se ha vuelto una prueba rutinaria después de la aparición de normas para su estandarización [63]. Es un método cuantitativo, simple, no invasor y seguro de medir la inflamación de las vías aéreas, que proporciona una herramienta complementaria a otras PFR para evaluar las enfermedades bronquiales como el asma (tabla 4). Aunque su papel todavía no está exento de controversia, debido a que la evidencia en la que se apoyan las recomendaciones no está basada en ensayos clínicos, la medición del FENO puede servir para [64]: La detección de la inflamación eosinofílica de las vías respiratorias (tabla 4) [45,64], que en presencia de clínica compatible o de obstrucción al flujo aéreo (FEV1/VC) < 70% permite hacer un diagnóstico de presunción de asma (o, al menos, de presunción de respuesta al tratamiento con corticoides inhalados de forma similar al asma), que obligatoriamente deberá ser confirmado mediante la demostración de reversibilidad aguda o un ensayo terapéutico individual con corticoesteroides inhalados u orales que mejore la función o al menos mejore los síntomas [45]. También Tabla 4. Interpretación del óxido nítrico (NO) exhalado NO exhalado Posible interpretación diagnóstica < 25 ppb Bajo Inflamación eosinofílica de las vías respiratorias improbable. Es de esperar escasa respuesta a corticoesteroides ppb Dudoso: interpretar con precaución en el contexto clínico ppb Anormal: inflamación eosinofílica de las vías respiratorias significativa. Interpretar en el contexto clínico Es posible inflamación eosinofílica de las vías respiratorias (aunque leve) Se produce en el paciente atópico asintomático Compatible con el diagnóstico de asma atópica si la historia es compatible y FEV1/FVC < 70% Otras posibilidades incluyen: bronquitis eosinofilica y síndrome de Churg-Strauss > 50 ppb Claro Igual que para el ppb, pero, además, es mucho más una respuesta positiva a corticoesteroides ppb: partes por billón.
90 Parte TEÓRICA Otras pruebas funcionales permitiría identificar al fenotipo asmático eosinofílico [64]. La determinación de la probabilidad de respuesta con corticoesteroides en pacientes con síntomas respiratorios crónicos. La recomendación es fijar un punto de corte de 25 ppb (partes por billón) para considerar a un sujeto como poco probable respondedor y emplear un punto de corte de más de 50 ppb para considerarlo como probable respondedor. En los niveles intermedios (< 25 ppb y 50), valorar en función de la clínica (tabla 4) [64]. Controlar la inflamación de las vías respiratorias para ajustar las dosis de los corticoesteroides inhalados. La recomendación, basada en la opinión de expertos, es considerar significativos incrementos (falta de respuesta) o descensos (respuesta) del FENO > 20% para valores > 50 ppb o > 10 ppb para valores < 50 ppb de una visita a la siguiente [4]. Antes de hacer ajustes de dosis es necesario comprobar que el paciente no siga expuesto a los alérgenos sospechosos de ser causantes de la inflamación de la vía aérea y la falta de cumplimiento del tratamiento con corticoesteroides [64]. Prueba de marcha de 6 minutos y desaturación de oxígeno durante el ejercicio La distancia caminada en 6 minutos (PM6M) es un buen índice de la función física [65-67], y tiene además valor pronóstico en muchas enfermedades respiratorias crónicas [65,68,69]. Por lo general, las personas sanas puede caminar de 400 a 700 m, dependiendo de la edad, estatura y sexo [66,70]. La desaturación durante el ejercicio, generalmente medida en una prueba de marcha, es un índice con valor pronóstico en las enfermedades vasculares pulmonares, en las enfermedades intersticiales y en la EPOC [71]. Una caída en la pulsioximetría (SpO2) > 81 4% (que termina por debajo del 93%) sugiere desaturación importante y se utiliza para valorar la necesidad y titular el empleo de oxígeno en pacientes con enfermedades pulmonares crónicas [71-73] Ergoespirometría Las aplicaciones de las pruebas de ejercicio cardiopulmonar en neumología son múltiples (tabla 5). Está fuera del propósito de este artículo su revisión detallada; al lector interesado se recomiendan lecturas más avanzadas [29,71,74-80]. El consumo máximo de oxígeno tiene un valor pronóstico en las enfermedades respiratorias (fig. 8) [71,77,79-81]. Tabla 5. Indicaciones de la prueba de esfuerzo en neumología Valoración de la tolerancia al ejercicio y de sus factores limitantes Objetivación de la limitación de la capacidad de esfuerzo Análisis de los factores limitantes de la capacidad de esfuerzo Distinción entre disnea de origen respiratorio o cardiaco Estudio de la disnea no explicable por las pruebas en reposo Valoración funcional y pronóstica y detección de alteraciones que se producen o empeoran de manera acusada con el ejercicio en enfermedades pulmonares crónicas Valoración de la discapacidad en enfermedades respiratorias Prescripción de ejercicio en rehabilitación Diagnóstico de broncoespasmo inducido por esfuerzo Valoración de los efectos de intervenciones terapéuticas Valoración preoperatoria en la cirugía resectiva pulmonar
91 82 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Figura 8. Algoritmo para la evaluación de la capacidad funcional para la resección pulmonar FEV1, DLCO Ambos > 80 pp Uno de ellos < 80 pp < 40% pp o CPET > 75 pp o < 10 ml/kg/min 1 VO2máx > 20 ml/kg/min pp o ml/kg 1 /min 1 Ambos < 30 pp Función estimada (#) FEV1 ppo DLCO ppo Ambos > 40 pp Al menos uno > 40 pp o ambos > 30 y < 40 pp < 10 ml/kg 1 /min 1 VO2máx-ppo No adecuado para resección anatómica > 40 pp o > 10 ml/kg 1 /min 1 A A B Resección hasta lo calculado Resección hasta neumonectomía Basado en el número de segmentos, a menos que se espere una neumonectomía o bien la estimación del FEV1-ppo o Dlco-ppo por número de segmentos fuese < 30%. CPET: pruebas de ejercicio cardiopulmonar. DLCO, capacidad de difusión pulmonar para el monóxido de carbono. FEV1: volumen espiratorio forzado en el primer segundo. O2máx: consumo máximo de oxígeno. pp: porcentaje del valor de referencia. ppo: predicho postoperatorio. Tomado de Puente Maestu et al. [29]. Bibliografía 1. Crapo RO. Pulmonary-function testing. N Engl J Med. 1994;331: Leiner GC, Bramowitz S, Small MJ, et al. Expiratory peak flow rate. Standard values for normal subjects. Use as a clinical test of ventilatory function. Am Rev Respir Dis. 1963;88: Gibson PG. Monitoring the patient with asthma: an evidence-based approach. J Allergy Clin Immunol. 2000;106: Llewellin P, Sawyer G, Lewis S, et al. The relationship between FEV1 and PEF in the assessment of the severity of airways obstruction. Respirology. 2002;7: Gautrin D, D Aquino LC, Gagnon G, et al. Comparison between peak expiratory flow rates (PEFR) and FEV1 in the monitoring of asthmatic subjects at an outpatient clinic. Chest. 1994;106: Gannon PF, Belcher J, Pantin CF, Burge PS. The effect of patient technique and training on the accuracy of self-recorded peak expiratory flow. Eur Respir J. 1999;4:
92 Parte TEÓRICA Otras pruebas funcionales 7. Reddel HK, Marks GB, Jenkins CR. When can personal best peak flow be determined for asthma action plans? Thorax. 2004;59: Boezen HM, Schouten JP, Postma DS, Rijcken B. Distribution of peak expiratory flow variability by age, gender and smoking habits in a random population sample aged yrs. Eur Respir J. 1994;7: Tierney WM, Roesner JF, Seshadri R, et al. Assessing symptoms and peak expiratory flow rate as predictors of asthma exacerbations. J Gen Intern Med. 2004;19: Janson SL, McGrath KW, Covington JK, et al. Objective airway monitoring improves asthma control in the cold and flu season: a cluster randomized trial. Chest. 2010;138: Martin TG, Elenbaas RM, Pingleton SH. Use of peak expiratory flow rates to eliminate unnecessary arterial blood gases in acute asthma. Ann Emerg Med. 1982;11: National Heart, Lung and Blood Institute. National Asthma Education and Prevention Program. Expert panel report III: Guidelines for diagnosis and management of asthma. NIH Bethesda (MD). NIH publication West JB. State of the art: ventilation-perfusion relationships. Am Rev Respir Dis. 1977;116: Wagner PD. Diffusion and chemical reaction in pulmonary gas exchange. Physiol Rev. 1977;57: MacIntyre N, Crapo RO, Viegi G, et al. Standardization of the single-breath determination of carbon monoxide uptake in the lung. Eur Respir J. 2005;26: Pellegrino R, Viegi G, Brusasco V, et al. Interpretative strategies for lung function tests. Eur Respir J. 2005;26: Frans A, Nemery B, Veriter C, et al. Effect of alveolar volume on the interpretation of single breath DLCO. Respir Med. 1997;91: González MN, Viles Inglés MJ, Peces-Barba G, et al. A simple method of correcting diffusing capacity for alveolar volume reduction in restrictive lung diseases. Respiration. 1987;52: Kiakouama L, Cottin V, Glerant JC, et al. Conditions associated with severe carbon monoxide diffusion coefficient reduction. Respir Med. 2011;105: Collard HR, King TE Jr, Bartelson BB, et al. Changes in clinical and physiologic variables predict survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med. 2003;168: Wells AU, Desai SR, Rubens MB, et al. Idiopathic pulmonary fibrosis: a composite physiologic index derived from disease extent observed by computed tomography. Am J Respir Crit Care Med. 2003;167: Horn M, Ries A, Neveu C, Moser K. Restrictive ventilatory pattern in precapillary pulmonary hypertension. Am Rev Respir Dis. 1983;128: McLean A, Warren PM, Gillooly M, et al. Microscopic and macroscopic measurements of emphysema: relation to carbon monoxide gas transfer. Thorax. 1992;47: Kitaichi M, Nishimura K, Itoh H, Izumi T. Pulmonary lymphangioleiomyomatosis: a report of 46 patients including a clinic pathologic study of prognostic factors. Am J Respir Crit Care Med. 1995;51: Crausman RS, Jennings CA, Tuder RM, et al. Pulmonary histiocytosis X: pulmonary function and exercise pathophysiology. Am J Respir Crit Care Med. 1996;153: Collard P, Njinou B, Nejadnik B, et al. Single breath diffusing capacity for carbon monoxide in stable asthma. Chest. 1994;105: Collard P, Wilputte JY, Aubert G, et al. The single-breath diffusing capacity for carbon monoxide in obstructive sleep apnea and obesity. Chest. 1996;110: Greening AP, Hughes JM. Serial estimations of carbon monoxide diffusing capacity in intrapulmonary haemorrhage. Clin Sci (Lond). 1981;60: Puente Maestu L, Villar F, González Casurran GN, et al. Early and long-term validation of an algorithm assessing fitness for surgery in patients with postoperative FEV and diffusing capacity of the lung for carbon monoxide < 40%. Chest. 2011;139: Criee CP, Sorichter S, Smith HJ, et al. Body plethysmography its principles and clinical use. Respir Med. 2011;105: Aaron SD, Dales RE, Cardinal P. How accurate is spirometry at predicting restrictive pulmonary impairment? Chest. 1999;115: Dykstra BJ, Scanlon PD, Kester MM, et al. Lung volumes in 4,774 patients with obstructive lung disease. Chest. 1999;115: Glady CA, Aaron SD, Lunau M, et al. A spirometrybased algorithm to direct lung function testing in the pulmonary function laboratory. Chest. 2003;123: Ries AL. Measurement of lung volumes. Clin Chest Med. 1989;10: Swanney MP, Beckert LE, Frampton CM, et al. Validity of the American Thoracic Society and other spirometric algorithms using FVC and forced expiratory volume at 6 s for predicting a reduced total lung capacity. Chest. 2004;126: Goldman MD, Smith HJ, Ulmer WT. Whole-body plethysmography. En: Gosselink R, Stam H, eds. Long function testing. Sheffield (UK): Eur Resp Mon ERS Journals; p Fishman A, Martínez F, Naunheim K, et al. A randomized trial comparing lung-volume-reduction surgery with medical therapy for severe emphysema. N Engl J Med. 2003;348: Clausen JL. The diagnosis of emphysema, chronic bronchitis, and asthma. Clin Chest Med. 1990;11:
93 84 Módulo 3 Espirometría y otras pruebas funcionales respiratorias 39. Pellegrino R, Rodarte JR, Brusasco V. Assessing the reversibility of airway obstruction. Chest : Bock WJ. Contribution to respiration control in the intensive care unit using electromyography. Biomed Tech (Berl). 1971;16: Islam MS, Ulmer WT. Diagnostic value of «closing volume» in comparison to «airway resistance-lung volume plot». Respiration. 1974;31: Bruschi C, Cerveri I, Zoia MC, et al. Reference values of maximal respiratory mouth pressures: a populationbased study. Am Rev Respir Dis. 1992;146: Enright PL, Kronmal RA, Manolio TA, et al.; Cardiovascular Health Study Research Group. Respiratory muscle strength in the elderly. Correlates and reference values. Am J Respir Crit Care Med. 1994;149: Global strategy for asthma management and prevention. Global INitiative for Asthma (GINA). Disponible en: Sept Guía Española para el Manejo del Asma. Disponible en: Sept Crapo RO, Casaburi R, Coates AL, et al. Guidelines for methacholine and exercise challenge testing This official statement of the American Thoracic Society was adopted by the ATS Board of Directors, July Am J Respir Crit Care Med. 2000;161: Burney PG, Jarvis D. Protocol for the European Community respiratory health survey II London, Medical Research Council Ref. Type: Report 48. Anderson SD. Indirect challenge tests: airway hyperresponsiveness in asthma: its measurement and clinical significance. Chest. 2010;138:S Cockcroft DW. Direct challenge tests: airway hyperresponsiveness in asthma: its measurement and clinical significance. Chest. 2010;138:S Toelle BG, Li J, Dalton M, Devadason SG. Subject discomfort associated with the histamine challenge in a population study. Respir Med. 2002;96: Brannan JD, Anderson SD, Perry CP, et al. The safety and efficacy of inhaled dry powder mannitol as a bronchial provocation test for airway hyperresponsiveness: a phase 3 comparison study with hypertonic (4.5%) saline. Respir Res. 2005;6: Ramsdell JW. Adenosine airways responsiveness: what does it mean? Chest. 2003;123: Chatham M, Bleecker ER, Smith PL, et al. A comparison of histamine, methacholine, and exercise airway reactivity in normal and asthmatic subjects. Am Rev Respir Dis. 1982;126: Rundell KW, Slee JB. Exercise and other indirect challenges to demonstrate asthma or exercise-induced bronchoconstriction in athletes. J Allergy Clin Immunol. 2008;122: Anderson SD, Sue-Chu M, Perry CP, et al. Bronchial challenges in athletes applying to inhale a beta 2-agonist at the 2004 Summer Olympics. J Allergy Clin Immunol. 2006;117: Irwin RS, Baumann MH, Bolser DC, et al. Diagnosis and management of cough executive summary: ACCP evidence-based clinical practice guidelines. Chest. 2006;129: S Kastelik JA, Aziz I, Ojoo JC, et al. Investigation and management of chronic cough using a probability-based algorithm. Eur Respir J. 2005;25: Cockcroft DW,.Ruffin RE, Dolovich J, Hargreave FE. Allergen-induced increase in non-allergic bronchial reactivity. Clin Allergy. 1977;7: Paoletti P, Carrozzi L, Viegi G, et al. Distribution of bronchial responsiveness in a general population: effect of sex, age, smoking, and level of pulmonary function. Am J Respir Crit Care Med. 1995;151: Laprise C, Laviolette M, Boutet M, Boulet LP. Asymptomatic airway hyperresponsiveness: relationships with airway inflammation and remodelling. Eur Respir J. 1999;14: Dixon AE, Pratley RE, Forgione PM, et al. Effects of obesity and bariatric surgery on airway hyperresponsiveness, asthma control, and inflammation. J Allergy Clin Immunol. 2011;128: Lee P, Abisheganaden J, Chee CB, Wang YT. A new asthma severity index: a predictor of near-fatal asthma? Eur Respir J. 2001;18: ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide, Am J Respir Crit Care Med. 2005;171: Dweik RA, Boggs PB, Erzurum SC, et al. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med. 2011;184: ATS statement: guidelines for the six-minute walk test. Am J Respir Crit Care Med. 2002;166: Enright PL. The six-minute walk test. Respir Care. 2003; 48: Swigris JJ, Wamboldt FS, Behr J, et al. The 6 minute walk in idiopathic pulmonary fibrosis: longitudinal changes and minimum important difference. Thorax. 2010;65: Badesch DB, Abman SH, Ahearn GS, et al. Medical therapy for pulmonary arterial hypertension: ACCP evidence-based clinical practice guidelines. Chest. 2004;126: S Lama VN, Flaherty KR, Toews GB, et al. Prognostic value of desaturation during a 6-minute walk test in idiopathic interstitial pneumonia. Am J Respir Crit Care Med. 2003;168: Casanova C, Celli BR, Barria P, et al. The 6-min walk distance in healthy subjects: reference standards from seven countries. Eur Respir J. 2011;37:150-6.
94 Parte TEÓRICA Otras pruebas funcionales 71. Palange P, Ward SA, Carlsen KH, et al. Recommendations on the use of exercise testing in clinical practice. Eur Respir J. 2007;29: Leggett RJ, Flenley DC. Portable oxygen and exercise tolerance in patients with chronic hypoxic cor pulmonale. Br Med J. 1977;2: Morante F, Guell R, Mayos M. Efficacy of the 6-minute walk test in evaluating ambulatory oxygen therapy. Arch Bronconeumol. 2005;41: Ortega F, Montemayor T, Sánchez A, et al. Role of cardiopulmonary exercise testing and the criteria used to determine disability in patients with severe chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1994;150: Wasserman K, Hansen JE, Sue DY, et al. Clincal applications of cardiopulmonary exercise testing. En: Wasserman K, Hansen JE, Sue DY, et al., eds. Principles of exercise testing and interpretation. 4. a ed. Philadelphia: Lippincott Williams & Wilkins; p ATS/ACCP statement on cardiopulmonary exercise testing. Am J Respir Crit Care Med. 2003;67: Cote CG, Pinto-Plata VM, Marin JM, et al. The modified BODE index: validation with mortality in COPD. Eur Respir J. 2008;32: Wensel R, Opitz CF, Anker SD, et al. Assessment of survival in patients with primary pulmonary hypertension: importance of cardiopulmonary exercise testing. Circulation. 2002;106: Oga T, Nishimura K, Tsukino M, et al. Analysis of the factors related to mortality in chronic obstructive pulmonary disease: role of exercise capacity and health status. Am J Respir Crit Care Med. 2003;167: Tojo N, Ichioka M, Chida M, et al. Pulmonary exercise testing predicts prognosis in patients with chronic obstructive pulmonary disease. Intern Med. 2005;44: Myers J, Prakash M, Froelicher V, et al. Exercise capacity and mortality among men referred for exercise testing. N Engl J Med. 2002;346:
95
96 87 Test de evaluación 1. La espirometría: A. Puede medir todos los volúmenes pulmonares B. Consiste en medir el volumen de aire que un sujeto puede movilizar en función del tiempo C. Se puede realizar con un aparato de peakflow D. Es reproducible E. Las respuestas B y D son correctas 2. Cuál de los siguientes parámetros no se puede medir en una espirometría? A. Volumen espiratorio forzado en el primer segundo B. Capacidad vital forzada C. Flujo mesoespiratorio D. Capacidad residual funcional 3. El flujo mesoespiratorio (FEF25-75%) en un paciente con obstrucción en la vía aérea estará: A. Aumentado B. Disminuido C. Normal D. No se puede estimar 4. La espirometría no está indicada en: A. Estudio de un paciente con disnea B. Diagnóstico de EPOC C. Evaluación del atrapamiento aéreo D. Estudio preoperatorio en la resección pulmonar 5. En una curva flujo-volumen podemos analizar los siguientes errores, en cuanto a considerar que una maniobra de espirometría es aceptable: A. Interferencias producidas por la tos B. Cierre de glotis C. Inicio correcto de la maniobra D. Error en la finalización de la maniobra (meseta en el volumen) E. La respuesta D no es correcta 6. Para evaluar correctamente la espirometría forzada: A. Debemos ver si los valores de FEV1 y FVC están bien medidos B. La calidad del FEV1 debe ser alta en relación con los otros parámetros C. Debemos evaluar las curvas volumentiempo y flujo-volumen D. Inspeccionar si el inicio de la maniobra es correcto 7. La finalización de la maniobra: A. Debe permitir observar correctamente el FEV1 B. Debe tener, como mínimo, de una duración de 6 s C. Debe ser lenta y progresiva hasta que la FVC tenga diferencias inferiores a 0,15 l D. No debe ser rápida 8. Debemos repetir una maniobra más si: A. Observamos en las maniobras una zona meseta (plateau) en la curva volumentiempo B. Tenemos 3 buenas maniobras y dos de ellas con diferencias en el FEV1 y la FVC inferiores a 0,15 l C. Cuando tenemos dos buenas maniobras y tienen diferencias en el FEV1 y la FVC inferiores a 0,15 l D. El paciente ha realizado ocho maniobras y no hemos conseguido la repetibilidad
97 88 Módulo 3 Espirometría y otras pruebas funcionales respiratorias 9. Para evaluar correctamente la finalización de la maniobra debemos observar: A. Que el FEV1 sea normal B. La gráfica de flujo-volumen C. Observar una zona meseta (plateau) en la curva flujo-volumen D. Observar una zona meseta (plateau) en la curva volumen-tiempo 10. La calibración del espirómetro con una jeringa de 3 l debe realizarse: A. Antes de cada paciente B. Cada día que se realizan espirometrías C. Una vez a la semana D. Una vez al mes E. Antes de cada paciente y al finalizar la prueba 11. Todos los siguientes son criterios de aceptabilidad de la espirometría excepto uno: A. Sin tos en el primer segundo B. Sin terminación temprana de la maniobra C. Inicio rápido de la maniobra D. Maniobras reproducibles E. Que la relación FEV1/FVC esté entre el 70 y el 80% 13. Las diferencias entre dos maniobras, según las recomendaciones de la ATS/ ERS 2005, deben ser: A. Inferiores al 10% B. Para la FVC inferiores al 10% y para el FEV1 inferiores al 5% C. Inferiores a 150 ml (100 ml si la FVC es inferior a 1 l) D. Se aceptan diferencias inferiores a 250 ml E. Inferiores al 3% 14. Para la valoración correcta de una espirometría: A. Se ha de valorar la repetitividad de la FVC y el FEV1 B. Se deben valorar las gráficas de flujovolumen y volumen-tiempo C. Se debe valorar si las maniobras tienen errores D. Se debe valorar la colaboración del paciente E. Todas son ciertas 15. Una buena manera de valorar la espirometría de forma global es: A. Que las maniobras no tengan errores B. Que las maniobras sean repetitivas C. Que el paciente colabore en su realización D. El «grado de calidad de las maniobras» E. Que el paciente no haya tomado medicación previamente a su realización 12. De acuerdo con las recomendaciones de la ATS/ERS 2005, el volumen extrapolado debe ser inferior a: A. 200 ml B. 150 ml o el 5% de la FVC C. 5% de la FVC D. 10% de la FVC E. 100 ml o el 3% de la FVC 16. Qué parámetro ventilatorio no podemos medir mediante espirometría? A. El volumen espiratorio forzado en el primer segundo B. El volumen residual C. La capacidad residual funcional D. La capacidad vital forzada E. Ni B ni C
98 Parte TEÓRICA Test de evaluación 17. Los valores de normalidad de una espirometría son: A. Volumen espiratorio forzado en el primer segundo (FEV1) mayor del 80% del valor de referencia B. FVC superior al 80% del valor de referencia C. Relación FEV1/FVC superior al 70% D. FEV1, FVC y FEV1/FVC superior al límite inferior de la normalidad E. Todas son correctas 18. Un patrón espirométrico obstructivo se caracteriza por: A. FEV1 normal con FVC normal y FEV1/FVC por encima del LIN (límite inferior de normalidad) B. FVC inferior al 80%, FEV1 superior al 90% y FEV1/FVC del 75% C. FEV1/FVC inferior al 70% o inferior al LIN D. Por espirometría sólo se diagnostica la obstrucción si está provocada por asma bronquial E. Son ciertas C y D 19. Un patrón espirométrico restrictivo se caracteriza por: A. Disminución de volúmenes pulmonares con relación FEV1/FVC elevado B. Disminución de flujos aéreos con capacidad pulmonar total elevada y cociente FEV1/FVC elevado C. No se puede sospechar restricción por la espirometría D. En las patologías obstructivas nunca hay descenso de la FVC E. Son ciertas A y D 20. Con respecto a la obstrucción variable extratorácica, señale la cierta: A. Se observa una meseta espiratoria, pero sólo al inicio de la espiración 89 B. Se caracteriza por una meseta espiratoria en la maniobra de espiración lenta C. La obstrucción es mayor durante la inspiración, porque se genera una presión más negativa intratraqueal que favorece el colapso de la zona estenosada D. Se caracteriza por una meseta en la rama inspiratoria de la curva flujo-volumen E. Son ciertas C y D 21. Indique cuál de las siguientes es una contraindicación absoluta para realizar una prueba de broncodilatadores: A. Hemiparesia facial B. Hipersensibilidad a los broncodilatadores C. Alteración ventilatoria obstructiva D. No existen contraindicaciones absolutas 22. Cuál es el broncodilatador de primera elección para el estudio de la reversibilidad bronquial? A. Agonistas β2-adrenérgicos de acción rápida B. Agonistas β2-adrenérgicos de acción prolongada C. Anticolinérgicos de acción corta D. Anticolinérgicos de acción prolongada 23. Si se opta por salbutamol, cuál es la dosis recomendada en la actualidad? A. 1 puff (100 µg) B. 2 puffs (200 µg) C. 3 puffs (300 µg) D. 4 puffs (400 µg) 24. Indique cuál de los siguientes parámetros nunca debería ser considerado en la interpretación de una prueba broncodilatadora
99 90 Módulo 3 Espirometría y otras pruebas funcionales respiratorias A. FEV1 B. FVC C. PEF D. Flujos mesoespiratorios 25. Señale cuál es el criterio correcto para interpretar como positiva una prueba broncodilatadora: A. Aumento del FEV1 y de la FVC > 200 ml y > 12% con respecto al previo B. Aumento del FEV1 y de la FVC > 200 ml o > 12% con respecto al previo C. Aumento del FEV1 o de la FVC > 200 ml y > 12% con respecto al previo D. Aumento del FEV1 o de la FVC > 200 ml o > 12% con respecto al previo 26. Seleccione la causa de falsos negativos de la prueba de broncodilatadores en pacientes con asma: A. Estabilidad clínica, con valores normales B. Efecto de un tratamiento broncodilatador administrado con anterioridad o mala técnica de inhalación C. Broncoconstricción producida por remodelado de las vías aéreas D. Todas las anteriores 27. Cuál de las siguientes afirmaciones es verdadera respecto a la espirometría? A. Para asegurar su calidad debe realizarse en centros especializados B. Su interpretación correcta es responsabilidad de los neumólogos C. Es la principal exploración complementaria en el estudio de la patología pulmonar obstructiva D. El resultado del cociente FEV1/FEV6 es menos fiable que el FEV1/FVC 28. De qué manera puede afectar a los resultados de la espirometría una maniobra demasiado breve? Señale la respuesta incorrecta: A. Puede afectar a la FVC B. Puede afectar al FEV1 C. Puede afectar a la relación FEV1/FVC D. Puede hacer pasar por alto una obstrucción 29. En relación con el diagnóstico precoz de la EPOC, señale la respuesta correcta: A. El aspecto que con más frecuencia limita la calidad de la espirometría es la adecuada consecución de una correcta FVC B. Sólo se planteará una espirometría a un paciente fumador en los casos en los que presente síntomas C. La medición del cociente FEV1/FEV6 no se considera una alternativa válida al FEV1/FVC en el diagnóstico de obstrucción bronquial D. El límite de normalidad del FEV1/FEV6 para descartar obstrucción es del 80% 30. Cuál es la actitud más correcta frente a una espirometría, con parámetros dentro de la normalidad, en un paciente habitual de la consulta, fumador de riesgo y asintomático, sin espirometrías previas? A. Dar consejo antitabaco y considerar que el paciente es un fumador no susceptible de desarrollar EPOC B. Solicitar prueba de provocación bronquial para asegurar que «todo está bien» C. Sospechar que no ha realizado correctamente la primera parte de la maniobra espirométrica D. Dar consejo antitabaco y recomendar repetir la prueba 1 o 2 años después
100 Parte TEÓRICA Test de evaluación 31. Cuál de estas afirmaciones es cierta con respecto al flujo máximo espiratorio (PEF)? A. Es el volumen de aire expulsado en el primer segundo en un espiración forzada B. Si se tiene un aparato de PEF no es necesario disponer de espirómetro para el diagnóstico y valoración funcional de las enfermedades respiratorias C. Variaciones superiores al 20% son diagnósticas de asma en el contexto adecuado D. No es útil en la reagudización del asma E. Es un parámetro difícil de medir para la mayoría de los pacientes, por lo que ha caído en desuso 32. Sobre los volúmenes pulmonares, indique la respuesta correcta: A. La capacidad vital es la capacidad pulmonar total B. El volumen residual es la capacidad funcional residual C. El FEF25-75 es igual al FEV6 D. Mediante la espirometría podemos medir la capacidad vital, la capacidad pulmonar total y el volumen residual E. La capacidad pulmonar total es el volumen residual más la capacidad vital 33. Sobre la capacidad de difusión pulmonar (DLCO), indique la respuesta correcta: A. La DLco está elevada en las enfermedades intersticiales B. La DLco alta se puede ver en las hemorragias pulmonares C. La DLco alta es diagnóstica de asma D. La DLco alta no tiene ningún significado patológico E. La DLco alta es característica del edema de pulmón por estenosis mitral 34. La medición de volúmenes estáticos pulmonares: 91 A. Está indicada para el diagnóstico de restricción cuando en la espirometría la capacidad vital está baja B. Está indicada en todos los procesos respiratorios la primera vez C. Es la única prueba funcional sensible al enfisema D. Es preferible hacerla con el paciente en ayunas E. Es una prueba necesaria para la valoración preoperatoria 35. La medición de la PIM y la PEM: A. Están indicadas siempre que exista una disminución inexplicable de la capacidad vital B. Está indicada cuando hay sospecha clínica de debilidad de los músculos respiratorios C. La monitorización de la PIM, PEM es útil, junto a la VC, en el seguimiento de la evolución de los pacientes con trastornos neuromusculares D. Las PIM/SNIP promedio para los hombres adultos son 100 cmh2o E. Todas son ciertas 36. La principal indicación de una prueba de hiperreactividad bronquial es: A. La sospecha de asma, cuando el diagnóstico está en cuestión B. Una prueba de metacolina positiva es diagnóstica de asma C. En la monitorización del asma grave D. Determinar si son necesarios los corticoides inhalados en el asma E. En la EPOC leve
101
102 Parte PRÁCTICA
103
104 El sistema respiratorio 95 Generalidades de la espirometría María Jesús Rodríguez Nieto Caso 1. Mujer de 37 años, sin antecedentes de interés, fumadora esporádica (2-3 cigarrillos al mes desde la juventud). Consulta por tos, de 3 meses de evolución, sobre todo diurna, en accesos, con molestias en la larínge con afonía intermitente. Sin disnea, dolor torácico, expectoración o fiebre. Sin síntomas nocturnos. Vida activa. Síntomas ocasionales de reflujo gastroesofágico relacionado con comidas copiosas y abundantes. Exploración física con saturación de O2 basal del 98%, FC 65 lpm, auscultación cardiaca rítmica sin soplos, auscultación pulmonar con murmullo vesicular conservado, sin ruidos sobreañadidos. Abdomen y extremidades inferiores normales. Se realiza analítica, que es normal; la radiografía de tórax no muestra alteraciones y la espirometría con prueba broncodiladora presenta el siguiente resultado: Flujo [l/s] F/V es Vol%VCmáx Vol [l] Volumen [l] VCmáx F/V in Tiempo [s] Basal Teor Basal % (B/T) BD % (BD/T) % cambio FVC [l] FEV [l] FEV 1 % FVC [%] FEV 1 % VC max [%] PEF [l/s] MMEF 75/ [l/s] PIF [l/s] FIF [l/s] FEV [l] FVC IN [l] PIF [l/s] 2,97 2,56 82,07 6,25 3,59 3,01 3,62 3,04 83,90 78,61 7,42 2,10 4,41 4,36 3,52 3,87 4,41 121,9 118,8 95,8 118,7 58,6 128,5 3,77 3,27 86,71 84,13 7,62 3,71 4,51 4,46 3,89 4,51 127,1 127,9 102,5 121,9 103,6 129,3 4,2 7,7 3,3 7,0 2,7 76,8 2,3 2,3 0,6 2,3
105 96 Módulo 3 Espirometría y otras pruebas funcionales respiratorias 1. La espirometría basal: A. Es una prueba correcta B. Es una prueba no válida C. Muestra valores dentro de la normalidad D. Muestra un patrón obstructivo ligero E. Las respuestas A y C son correctas 2. La espirometría realizada tras la administración de broncodilatadores (trazado en rojo): A. Es una prueba correcta B. Es una prueba no valida C. Muestra valores dentro de los límites de la normalidad D. Muestra que no existe una respuesta positiva a la administración de broncodilatadores 3. Con el resultado de la espirometría con prueba broncodilatadora en esta paciente, podemos afirmar: A. Que hay una alta sospecha de asma bronquial B. Que no se puede descartar el asma bronquial C. Que la espirometría realizada en condiciones basales no muestra un patrón patológico D. Todas son válidas E. Las respuestas B y C son correctas
106 Parte El sistema PRÁCTICA respiratorio 97 Espirometría de calidad Felip Burgos Rincón Caso 1. Las maniobras de esta espirometría forzada cumplen con los criterios de calidad ERS/ATS. A. Las maniobras están amputadas por observarse un tiempo inferior a 6 s B. Presentan una salida incorrecta C. Se observan 4 buenas maniobras tanto en la gráfica flujo-volumen como volumen-tiempo y presenta 3 maniobras que cumplen los criterios de repetibilidad D. La diferencia en el PEF es superior al 5%
107 98 Módulo 3 Espirometría y otras pruebas funcionales respiratorias Caso 2. La calibración cumple los criterios de calidad de la estandarización de la ERS-ATS. A. Calibración correcta, los valores están dentro del ± 3,5% B. Presenta un error superior a ± 3,5%, tanto en los volúmenes inspiratorios como en los espiratorios C. Presenta un error en la parte espiratoria D. Solo se han efectuado 2 tipos de flujo y se deberían hacer 3
FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA
 FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA PRINCIPIOS BASICOS: FÍSICA DE LOS GASES La ventilación y la perfusión pulmonares y la transferencia de los gases obedecen estrictamente a fuerzas
FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA PRINCIPIOS BASICOS: FÍSICA DE LOS GASES La ventilación y la perfusión pulmonares y la transferencia de los gases obedecen estrictamente a fuerzas
El sistema respiratorio
 El sistema respiratorio 1 El sistema respiratorio Luis Puente Maestu Jefe de Sección de Pruebas Funcionales y Broncoscopia. Servicio de Neumología Hospital General Universitario Gregorio Marañón. Madrid
El sistema respiratorio 1 El sistema respiratorio Luis Puente Maestu Jefe de Sección de Pruebas Funcionales y Broncoscopia. Servicio de Neumología Hospital General Universitario Gregorio Marañón. Madrid
Mecánica Estática DURANTE LA RESPIRACIÓN NORMAL Y EN REPOSO.
 ES EL ESTUDIO DE LAS FUERZAS QUE SOSTIENEN Y MUEVEN EL PULMON Y LA PARED TORACICA, DE LAS RESISTENCIAS QUE DEBEN SUPERARSE Y LOS CAUDALES RESULTANTES. Mecánica Estática DURANTE LA RESPIRACIÓN NORMAL Y
ES EL ESTUDIO DE LAS FUERZAS QUE SOSTIENEN Y MUEVEN EL PULMON Y LA PARED TORACICA, DE LAS RESISTENCIAS QUE DEBEN SUPERARSE Y LOS CAUDALES RESULTANTES. Mecánica Estática DURANTE LA RESPIRACIÓN NORMAL Y
Tema 28 Funciones pulmonares. Mecánica respiratoria. Elasticidad. El surfactante pulmonar.
 Tema 28 Funciones pulmonares. Mecánica respiratoria. Elasticidad. El surfactante pulmonar. 1. Introducción. 2. Anatomía del aparato respiratorio. 3. Mecánica respiratoria. 4. Propiedades elásticas del
Tema 28 Funciones pulmonares. Mecánica respiratoria. Elasticidad. El surfactante pulmonar. 1. Introducción. 2. Anatomía del aparato respiratorio. 3. Mecánica respiratoria. 4. Propiedades elásticas del
Aparato respiratorio Anatomía y fisiología
 Aparato respiratorio Anatomía y fisiología El aparato respiratorio cumple varias funciones fundamentales para el mantenimiento de la vida. Si el, sería imposible aprovechar el oxígeno de la atmosfera.
Aparato respiratorio Anatomía y fisiología El aparato respiratorio cumple varias funciones fundamentales para el mantenimiento de la vida. Si el, sería imposible aprovechar el oxígeno de la atmosfera.
EL APARATO RESPIRATORIO
 EL APARATO RESPIRATORIO El aparato respiratorio nos permite obtener el oxígeno del aire y expulsar el dióxido de carbono, procedente del metabolismo celular. Las partes de las que se compone el aparato
EL APARATO RESPIRATORIO El aparato respiratorio nos permite obtener el oxígeno del aire y expulsar el dióxido de carbono, procedente del metabolismo celular. Las partes de las que se compone el aparato
PRINCIPIOS FISICOS APLICABLES EN VENTILACION MECANICA. Julio Lloréns
 PRINCIPIOS FISICOS APLICABLES EN VENTILACION MECANICA Julio Lloréns No se puede negar que los procesos vitales desempeñan un papel esencial en la función y mantenimiento de la integridad estructural del
PRINCIPIOS FISICOS APLICABLES EN VENTILACION MECANICA Julio Lloréns No se puede negar que los procesos vitales desempeñan un papel esencial en la función y mantenimiento de la integridad estructural del
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.
 Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
2. Sobre los valores de las diferentes presiones parciales de los gases, marca con una cruz (X) la respuesta correcta según corresponda.
 Semana 7 Consolidación 7. 1. Acerca de la mecánica de la ventilación pulmonar, escribe en el espacio en blanco (V) si son verdaderos o (F) si son falsos los siguientes planteamientos: a) _F_ Los intercostales
Semana 7 Consolidación 7. 1. Acerca de la mecánica de la ventilación pulmonar, escribe en el espacio en blanco (V) si son verdaderos o (F) si son falsos los siguientes planteamientos: a) _F_ Los intercostales
LABORATORIO PULMONAR. 1. Conocer los principales estudios que se realizan en el laboratorio de función pulmonar.
 LABORATORIO PULMONAR Objetivos 1. Conocer los principales estudios que se realizan en el laboratorio de función pulmonar. 2. Valorar la importancia práctica de los estudios de función pulmonar en el manejo
LABORATORIO PULMONAR Objetivos 1. Conocer los principales estudios que se realizan en el laboratorio de función pulmonar. 2. Valorar la importancia práctica de los estudios de función pulmonar en el manejo
Mecanica Ventilatoria. Fisiologia Respiratoria
 Mecanica Ventilatoria Fisiologia Respiratoria Mecanica Ventilatoria Músculos de la respiración Presiones: trnasmural, pleural, alveolar, atmosférica, transpulmonar Distensibilidad - retroceso elático Curva
Mecanica Ventilatoria Fisiologia Respiratoria Mecanica Ventilatoria Músculos de la respiración Presiones: trnasmural, pleural, alveolar, atmosférica, transpulmonar Distensibilidad - retroceso elático Curva
Sistema Respiratorio
 Sistema Respiratorio ESQUEMA APARATO RESPIRATORIO FARINGE BRONQUIO BRONQUÍOLO CAVIDAD NASAL NARIZ LARINGE TRÁQUEA PULMÓN IZQUIERDO ALVÉOLOS DIAFRAGMA COSTILLAS FUNCIÓN DEL APARATO RESPIRATORIO NUTRIENTES
Sistema Respiratorio ESQUEMA APARATO RESPIRATORIO FARINGE BRONQUIO BRONQUÍOLO CAVIDAD NASAL NARIZ LARINGE TRÁQUEA PULMÓN IZQUIERDO ALVÉOLOS DIAFRAGMA COSTILLAS FUNCIÓN DEL APARATO RESPIRATORIO NUTRIENTES
PULMONES. Millán López Naomi Pérez Salgado Diana. Anatomía y Fisiología
 PULMONES Millán López Naomi Pérez Salgado Diana Anatomía y Fisiología Cuestionario Cuál es la función de los pulmones? Cuáles son las partes de los pulmones? Qué es el hilio pulmonar? Qué es el pedículo
PULMONES Millán López Naomi Pérez Salgado Diana Anatomía y Fisiología Cuestionario Cuál es la función de los pulmones? Cuáles son las partes de los pulmones? Qué es el hilio pulmonar? Qué es el pedículo
La creación de la corriente de aire
 12 2.2.1. La creación de la corriente de aire Es la fase inicial en la producción de los sonidos del habla. Está relacionada con la respiración. Ocurre principalmente en las cavidades infraglóticas. Se
12 2.2.1. La creación de la corriente de aire Es la fase inicial en la producción de los sonidos del habla. Está relacionada con la respiración. Ocurre principalmente en las cavidades infraglóticas. Se
Asma. Introducción El asma es una enfermedad común de los pulmones que afecta a millones de estadounidenses.
 Asma Introducción El asma es una enfermedad común de los pulmones que afecta a millones de estadounidenses. Este sumario le ayuda a entender mejor las causas, los síntomas y las opciones de tratamiento
Asma Introducción El asma es una enfermedad común de los pulmones que afecta a millones de estadounidenses. Este sumario le ayuda a entender mejor las causas, los síntomas y las opciones de tratamiento
Biología y Geología 3º ESO
 TEMA 2: ALIMENTOS Y NUTRIENTES. SISTEMAS DIGESTIVO Y RESPIRATORIO -Ficha con actividades de introducción, esquema general de la función de nutrición y concepto de alimentos, digestión, nutrientes, alimentación
TEMA 2: ALIMENTOS Y NUTRIENTES. SISTEMAS DIGESTIVO Y RESPIRATORIO -Ficha con actividades de introducción, esquema general de la función de nutrición y concepto de alimentos, digestión, nutrientes, alimentación
Proceso de liberación de energía, requiere aporte continuo de oxigeno(o2) y eliminación de bióxido de carbono(co2) principal función del aparato
 Proceso de liberación de energía, requiere aporte continuo de oxigeno(o2) y eliminación de bióxido de carbono(co2) principal función del aparato respiratorio. En condiciones normales la respiración es
Proceso de liberación de energía, requiere aporte continuo de oxigeno(o2) y eliminación de bióxido de carbono(co2) principal función del aparato respiratorio. En condiciones normales la respiración es
La importancia de la Fisioterapia respiratoria en DMD/ DMB
 La importancia de la Fisioterapia respiratoria en DMD/ DMB Silvia González Zapata Fisioterapeuta especialista en Fisioterapia Neurológica Centro Creer, Burgos. 9-11 de agosto de 2013 Distrofias musculares
La importancia de la Fisioterapia respiratoria en DMD/ DMB Silvia González Zapata Fisioterapeuta especialista en Fisioterapia Neurológica Centro Creer, Burgos. 9-11 de agosto de 2013 Distrofias musculares
Ventilación Pulmonar. -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón
 Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
DEBERA LEER, COMPRENDER Y ANALIZAR ESTE DOCUMENTO PARA PODER REALIZAR EL LABORATORIO EL LABORATORIO INICIARA A LAS 8:00 HRS CON LOS GRUPOS 5 AL
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO DE OCCIDENTE DIVISION CIENCIAS DE LA SALUD CARRERA MEDICO Y CIRUJANO FISIOLOGIA DEBERA LEER, COMPRENDER Y ANALIZAR ESTE DOCUMENTO PARA PODER
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO DE OCCIDENTE DIVISION CIENCIAS DE LA SALUD CARRERA MEDICO Y CIRUJANO FISIOLOGIA DEBERA LEER, COMPRENDER Y ANALIZAR ESTE DOCUMENTO PARA PODER
UNIDAD 8: LA RESPIRACIÓN DE LOS SERES VIVOS
 UNIDAD 8: LA RESPIRACIÓN DE LOS SERES VIVOS Lee con atención. 1. LA RESPIRACIÓN DE LOS ANIMALES Los animales necesitan toma el gas oxígeno (O 2 ) presente en el medio que les rodea y expulsar el gas dióxido
UNIDAD 8: LA RESPIRACIÓN DE LOS SERES VIVOS Lee con atención. 1. LA RESPIRACIÓN DE LOS ANIMALES Los animales necesitan toma el gas oxígeno (O 2 ) presente en el medio que les rodea y expulsar el gas dióxido
Dr. Miguel Ángel González Sosa
 Dr. Miguel Ángel González Sosa Presentación realizada en el curso de Clinopatología del Aparato Respiratorio dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina en el semestre Julio
Dr. Miguel Ángel González Sosa Presentación realizada en el curso de Clinopatología del Aparato Respiratorio dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina en el semestre Julio
Sistema respiratorio CLASE 1
 Sistema respiratorio CLASE 1 En la respiración celular se libera dióxido de carbono y, para obtener energía, las células oxidan compuestos que contienen carbono, en reacciones químicas que requieren oxígeno.
Sistema respiratorio CLASE 1 En la respiración celular se libera dióxido de carbono y, para obtener energía, las células oxidan compuestos que contienen carbono, en reacciones químicas que requieren oxígeno.
Las capacidades pulmonares son la suma de dos o más volúmenes pulmonares
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO DE OCCIDENTE DIVISION CIENCIAS DE LA SALUD CARRERA MEDICO Y CIRUJANO SEGUNDO AÑO FISIOLOGIA ESPIROMETRIA El sistema respiratorio tiene dos funciones
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA CENTRO UNIVERSITARIO DE OCCIDENTE DIVISION CIENCIAS DE LA SALUD CARRERA MEDICO Y CIRUJANO SEGUNDO AÑO FISIOLOGIA ESPIROMETRIA El sistema respiratorio tiene dos funciones
El sistema respiratorio
 El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Guía para el docente. - 2.º Medio: No hay. - 3.º Medio: Drogas y toxicomanía
 Guía para el docente Descripción curricular: - Nivel: 1.º Medio - Subsector: Biología - Unidad temática: - Palabras claves: fosas nasales, laringe, tráquea, bronquios, bronquíolos, alvéolos, músculos intercostales,
Guía para el docente Descripción curricular: - Nivel: 1.º Medio - Subsector: Biología - Unidad temática: - Palabras claves: fosas nasales, laringe, tráquea, bronquios, bronquíolos, alvéolos, músculos intercostales,
Neumologí a Iº SECCIÓN : CIENCIAS BÁSICAS (RESUMEN) ANATOMÍA DEL APARATO RESPIRATORIO. www. PLUS -medica.com
 Neumologí a Iº SECCIÓN : CIENCIAS BÁSICAS (RESUMEN) ANATOMÍA DEL APARATO RESPIRATORIO VIAS AÉREAS 4 Las células de Kultchitsky Se encuentran en el epitelio de la mucosa de tráquea y bronquios. Es una célula
Neumologí a Iº SECCIÓN : CIENCIAS BÁSICAS (RESUMEN) ANATOMÍA DEL APARATO RESPIRATORIO VIAS AÉREAS 4 Las células de Kultchitsky Se encuentran en el epitelio de la mucosa de tráquea y bronquios. Es una célula
Aparatos que intervienen en la nutrición
 Aparatos que intervienen en la nutrición El ser humano necesita ingerir alimentos y agua diariamente, para el mantenimiento de sus constantes vitales. De los alimentos se utilizan distintos nutrientes,
Aparatos que intervienen en la nutrición El ser humano necesita ingerir alimentos y agua diariamente, para el mantenimiento de sus constantes vitales. De los alimentos se utilizan distintos nutrientes,
Opción Mecánica respiratoria
 ANEXO Opción Mecánica respiratoria Introducción Indicaciones La opción Mecánica respiratoria (RM) para el ventilador 840 proporciona maniobras respiratorias preparadas, incluidas Fuerza inspiratoria negativa
ANEXO Opción Mecánica respiratoria Introducción Indicaciones La opción Mecánica respiratoria (RM) para el ventilador 840 proporciona maniobras respiratorias preparadas, incluidas Fuerza inspiratoria negativa
FASES DE LA INTERVIENE Digestión.de alimentos en sustancias más utilizables por el animal. Captación del..para el metabolismo y.
 FUNCIONES VITALES TIPOS DE FUNCIONES VITALES NUTRICIÓN DEFINICIÓN mediante el cual los seres vivos toman del exterior y las transforman en.propia y (obtención de materia y energía) Captar estímulos (cambios
FUNCIONES VITALES TIPOS DE FUNCIONES VITALES NUTRICIÓN DEFINICIÓN mediante el cual los seres vivos toman del exterior y las transforman en.propia y (obtención de materia y energía) Captar estímulos (cambios
EL APARATO RESPIRATORIO
 LA RESPIRACIÓN es un intercambio de gases que se lleva a cabo en el aparato o sistema respiratorio. Respiramos para tomar el oxígeno que necesitamos y expulsamos el dióxido de carbono que ya no necesitamos.
LA RESPIRACIÓN es un intercambio de gases que se lleva a cabo en el aparato o sistema respiratorio. Respiramos para tomar el oxígeno que necesitamos y expulsamos el dióxido de carbono que ya no necesitamos.
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica.
 capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
Aparato Respiratorio. Alumno: Jesús Alán Rodríguez Meraz. 2 MD
 Aparato Respiratorio Alumno: Jesús Alán Rodríguez Meraz. 2 MD Medicina Humana Partes del Aparato Respiratorio Parte Conductora Parte Respiratoria Mecanismo de Ventilación Mucosa Nasal, Región Respiratoria
Aparato Respiratorio Alumno: Jesús Alán Rodríguez Meraz. 2 MD Medicina Humana Partes del Aparato Respiratorio Parte Conductora Parte Respiratoria Mecanismo de Ventilación Mucosa Nasal, Región Respiratoria
C. Queipo Corona. Santander, Octubre 2009
 C. Queipo Corona Santander, Octubre 2009 Conceptos de fisiología respiratoria Indicaciones de la ventilación mecánica Mecanismos de acción de la ventilación mecánica Anatomía del sistema respiratorio Zona
C. Queipo Corona Santander, Octubre 2009 Conceptos de fisiología respiratoria Indicaciones de la ventilación mecánica Mecanismos de acción de la ventilación mecánica Anatomía del sistema respiratorio Zona
Espirometría en niños mayores
 Aplicación práctica de las pruebas de función pulmonar Espirometría en niños mayores 6º Congreso Argentino de Neumonología Pediátrica, Jornada de Enfermería en Enfermedades Respiratorias Pediátricas y
Aplicación práctica de las pruebas de función pulmonar Espirometría en niños mayores 6º Congreso Argentino de Neumonología Pediátrica, Jornada de Enfermería en Enfermedades Respiratorias Pediátricas y
APARATO RESPIRATORIO
 APARATO RESPIRATORIO Constituido por tres porciones fundamentales con distintas funciones. 1.Una porción conductora de aire (cavidades nasales y senos asociados, nasofaringe, bucofaringe, laringe, tráquea,
APARATO RESPIRATORIO Constituido por tres porciones fundamentales con distintas funciones. 1.Una porción conductora de aire (cavidades nasales y senos asociados, nasofaringe, bucofaringe, laringe, tráquea,
Espirometría forzada
 Técnicas en AP: Espirometría forzada 1/1 Espirometría forzada Autores: Grupo MBE Galicia, integrado en la Red Temática de Investigación sobre Medicina Basada en la Evidencia (Expte. FIS: G03/090) y Núñez
Técnicas en AP: Espirometría forzada 1/1 Espirometría forzada Autores: Grupo MBE Galicia, integrado en la Red Temática de Investigación sobre Medicina Basada en la Evidencia (Expte. FIS: G03/090) y Núñez
Terapia Inhalatoria en la EPOC. D.U.E. Jose Luis Valera Enfermero del Gabinete de Función Respiratoria Hospital Son Espases
 Terapia Inhalatoria en la EPOC D.U.E. Jose Luis Valera Enfermero del Gabinete de Función Respiratoria Hospital Son Espases Definición de EPOC La Enfermedad Pulmonar Obstructiva Crónica (EPOC) se define
Terapia Inhalatoria en la EPOC D.U.E. Jose Luis Valera Enfermero del Gabinete de Función Respiratoria Hospital Son Espases Definición de EPOC La Enfermedad Pulmonar Obstructiva Crónica (EPOC) se define
INTRODUCCIÓN. adaptación, que pueden ser fisiológicas y/o anatómicas. A medida que aumenta la
 INTRODUCCIÓN El ser humano ante los cambios climáticos y de altitud, presenta respuestas de adaptación, que pueden ser fisiológicas y/o anatómicas. A medida que aumenta la altitud y la permanencia en la
INTRODUCCIÓN El ser humano ante los cambios climáticos y de altitud, presenta respuestas de adaptación, que pueden ser fisiológicas y/o anatómicas. A medida que aumenta la altitud y la permanencia en la
CUIDADOS DE ENFERMERIA EN LA CONSULTA DE FISIOLOGIA RESPIRATORIA. (I.N.S. 3ªPta).- ANEXO
 CUIDADOS DE ENFERMERIA EN LA CONSULTA DE FISIOLOGIA RESPIRATORIA. (I.N.S. 3ªPta).- ANEXO DESCRIPCION DE LAS TECNICAS: - TECNICA DE LA ESPIROMETRIA FORZADA - TEST BRONCODILATADOR - TEST DE DIFUSION (DLCO)
CUIDADOS DE ENFERMERIA EN LA CONSULTA DE FISIOLOGIA RESPIRATORIA. (I.N.S. 3ªPta).- ANEXO DESCRIPCION DE LAS TECNICAS: - TECNICA DE LA ESPIROMETRIA FORZADA - TEST BRONCODILATADOR - TEST DE DIFUSION (DLCO)
UNIDAD 1: REVISIÓN DE LA ANATOMÍA Y FISIOLOGÍA PULMONAR
 UNIDAD 1: REVISIÓN DE LA ANATOMÍA Y FISIOLOGÍA PULMONAR A. El sistema respiratorio. Una persona puede vivir por varias semanas sin alimento y varios días sin agua, pero solamente unos pocos minutos sin
UNIDAD 1: REVISIÓN DE LA ANATOMÍA Y FISIOLOGÍA PULMONAR A. El sistema respiratorio. Una persona puede vivir por varias semanas sin alimento y varios días sin agua, pero solamente unos pocos minutos sin
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.
 Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.el oxígeno proporciona energía para realizar las funciones vitales, y el
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.el oxígeno proporciona energía para realizar las funciones vitales, y el
INTERACCIÓN CORAZÓN- PULMÓN
 INTERACCIÓN CORAZÓN- PULMÓN Dr. Gabriel Cassalett B Intensivista Pediatra Clínica Shaio X Congreso de la Sociedad Latinoamericana de Cuidado Intensivo Pediátrico (SLACIP) Ciudad de Guatemala Abril 27 al
INTERACCIÓN CORAZÓN- PULMÓN Dr. Gabriel Cassalett B Intensivista Pediatra Clínica Shaio X Congreso de la Sociedad Latinoamericana de Cuidado Intensivo Pediátrico (SLACIP) Ciudad de Guatemala Abril 27 al
Asma. Introducción El asma es una enfermedad común de los pulmones que afecta a millones de personas.
 Asma Introducción El asma es una enfermedad común de los pulmones que afecta a millones de personas. Este sumario le ayuda a entender mejor las causas, los síntomas y las opciones de tratamiento para el
Asma Introducción El asma es una enfermedad común de los pulmones que afecta a millones de personas. Este sumario le ayuda a entender mejor las causas, los síntomas y las opciones de tratamiento para el
FISIOLOGÍA RESPIRATORIA. J. Canet
 FISIOLOGÍA RESPIRATORIA J. Canet VENTILACIÓN Y MECÁNICA RESPIRATORIA La ventilación pulmonar es el proceso funcional por el que el gas es transportado desde el entorno del sujeto hasta los alveolos pulmonares
FISIOLOGÍA RESPIRATORIA J. Canet VENTILACIÓN Y MECÁNICA RESPIRATORIA La ventilación pulmonar es el proceso funcional por el que el gas es transportado desde el entorno del sujeto hasta los alveolos pulmonares
REGULACIÓN DE LA RESPIRACIÓN
 Departamento de Fisiología Facultad de Veterinaria Objetivos REGULACIÓN DE LA RESPIRACIÓN Conocer las estructuras que intervienen en el control de la respiración. Comprender la regulación nerviosa del
Departamento de Fisiología Facultad de Veterinaria Objetivos REGULACIÓN DE LA RESPIRACIÓN Conocer las estructuras que intervienen en el control de la respiración. Comprender la regulación nerviosa del
Avaluació funcional del pacient candidat a ventilació mecànica domiciliària.
 Avaluació funcional del pacient candidat a ventilació mecànica domiciliària. Juana Martínez Llorens Servei de Pneumologia Hospital del Mar. Parc de Salut Mar Sumario Indicaciones VMD Valoración funcional
Avaluació funcional del pacient candidat a ventilació mecànica domiciliària. Juana Martínez Llorens Servei de Pneumologia Hospital del Mar. Parc de Salut Mar Sumario Indicaciones VMD Valoración funcional
Aparato Respiratorio
 Aparato Respiratorio Intestino Proximal Faringe primitiva: Cavidad oral, lengua, amígdalas, glándulas salivales y AR superior. Aparato Respiratorio Inferior (traquea, bronquios y pulmones). Esófago y estomago*
Aparato Respiratorio Intestino Proximal Faringe primitiva: Cavidad oral, lengua, amígdalas, glándulas salivales y AR superior. Aparato Respiratorio Inferior (traquea, bronquios y pulmones). Esófago y estomago*
Tarjeta pedagógica EL SISTEMA RESPIRATORIO. Biología. Cómo obtienen los seres vivos la energía de las moléculas? RECOMENDACIONES:
 Así como es indispensable incorporar materia del medio, también es EL SISTEMA RESPIRATORIO importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Así como es indispensable incorporar materia del medio, también es EL SISTEMA RESPIRATORIO importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Función Sistema Respiratorio. La principal función es la de aportar el oxigeno a las células y eliminar el dióxido de carbono
 Función Sistema Respiratorio La principal función es la de aportar el oxigeno a las células y eliminar el dióxido de carbono ARBOL BRONQUIAL La traquea y bronquios están compuestos por cartilagos y se
Función Sistema Respiratorio La principal función es la de aportar el oxigeno a las células y eliminar el dióxido de carbono ARBOL BRONQUIAL La traquea y bronquios están compuestos por cartilagos y se
Objetivos. Introducción a la fisiología respiratoria. Plan de clase. Plan de clase. Plan de clase 01/04/2014. Definición de respiración
 Departamento de Fisiología Facultad de Veterinaria Introducción a la fisiología respiratoria Objetivos Conocer la función de la fisiología respiratoria. Conocer la estructura del aparato respiratorio.
Departamento de Fisiología Facultad de Veterinaria Introducción a la fisiología respiratoria Objetivos Conocer la función de la fisiología respiratoria. Conocer la estructura del aparato respiratorio.
El aparato respiratorio humano está constituido por las fosas nasales, la faringe, la laringe, la tráquea, los bronquios y los pulmones.
 RESPIRATORI O Y LA FUNCI Ó N RESPIRATORI A El aparato respiratorio humano está constituido por las fosas nasales, la faringe, la laringe, la tráquea, los bronquios y los pulmones. Las fosas nasales Las
RESPIRATORI O Y LA FUNCI Ó N RESPIRATORI A El aparato respiratorio humano está constituido por las fosas nasales, la faringe, la laringe, la tráquea, los bronquios y los pulmones. Las fosas nasales Las
Finalmente se adjuntan tablas con valores normales de función respiratoria.
 En este capítulo se proporcionan criterios para la valoración de la discapacidad producida por deficiencias del aparato respiratorio, consideradas desde el punto de vista de la alteración de la función
En este capítulo se proporcionan criterios para la valoración de la discapacidad producida por deficiencias del aparato respiratorio, consideradas desde el punto de vista de la alteración de la función
Fracciones Inhalable, Torácica y Respirable. Encarnación Sousa Rodríguez, CNNT
 Fracciones Inhalable, Torácica y Respirable Encarnación Sousa Rodríguez, CNNT EL PROTAGONISTA AGENTES QUÍMICOS GAS VAPOR NIEBLA POLVO HUMO FIBRAS 100 Ǻ 2 Ǻ DIÁMETRO AERODINÁMICO Diámetro de una esfera
Fracciones Inhalable, Torácica y Respirable Encarnación Sousa Rodríguez, CNNT EL PROTAGONISTA AGENTES QUÍMICOS GAS VAPOR NIEBLA POLVO HUMO FIBRAS 100 Ǻ 2 Ǻ DIÁMETRO AERODINÁMICO Diámetro de una esfera
TEMA 7. EL SISTEMA CARDIO-RESPIRATORIO
 TEMA 7. EL SISTEMA CARDIO-RESPIRATORIO EL SISTEMA CARDIO-CIRCULATORIO. Es un sistema relacionado íntimamente con el sistema respiratorio. Ambos, junto con otros sistemas (renal, digestivo...), se encargan
TEMA 7. EL SISTEMA CARDIO-RESPIRATORIO EL SISTEMA CARDIO-CIRCULATORIO. Es un sistema relacionado íntimamente con el sistema respiratorio. Ambos, junto con otros sistemas (renal, digestivo...), se encargan
Sistema Respiratorio. to cuarto cuarto cuarto cuarto 107 APRENDO JUGANDO
 11 Lección Apertura Sistema Respiratorio Consejo Muy importante! para esta lección se pide trabajo en casa con ayuda de los padres. Es indispensable para la realización de la actividad de aprendo con las
11 Lección Apertura Sistema Respiratorio Consejo Muy importante! para esta lección se pide trabajo en casa con ayuda de los padres. Es indispensable para la realización de la actividad de aprendo con las
Cómo se produce la respiración y por qué es fundamental para la vida.
 www.altamar.es Unidad didáctica 6 Qué aprenderás? Cómo se produce la respiración y por qué es fundamental para la vida. Qué órganos forman el aparato respiratorio y qué funciones tiene cada uno. Cuáles
www.altamar.es Unidad didáctica 6 Qué aprenderás? Cómo se produce la respiración y por qué es fundamental para la vida. Qué órganos forman el aparato respiratorio y qué funciones tiene cada uno. Cuáles
Anatomía y Fisiología. de Vía aérea inferior. Dra. Ana M. Koatz
 Anatomía y Fisiología de Vía aérea inferior Dra. Ana M. Koatz Gersdorff, Hans von (d. 1529). Título: Feldtbůch der Wundartzney : newlich getruckt und gebessert. Anatomía a Respiratoria ESTRUCTURAS BÁSICASB
Anatomía y Fisiología de Vía aérea inferior Dra. Ana M. Koatz Gersdorff, Hans von (d. 1529). Título: Feldtbůch der Wundartzney : newlich getruckt und gebessert. Anatomía a Respiratoria ESTRUCTURAS BÁSICASB
Ventilación sincronizada. Dr. S. Navarro-Psihas Department of Neonatology University clinic Innsbruck 1
 Ventilación sincronizada Dr. S. Navarro-Psihas Department of Neonatology University clinic Innsbruck 1 Van Kaam: Journal of Pediatrics 2010 173 centros europeos con cuidados neonatales Table IV. Ventilation
Ventilación sincronizada Dr. S. Navarro-Psihas Department of Neonatology University clinic Innsbruck 1 Van Kaam: Journal of Pediatrics 2010 173 centros europeos con cuidados neonatales Table IV. Ventilation
Recomendaciones ergonómicas
 Pág. 1 de 5 Profesionaliza la voz si ésta es tu herramienta de trabajo LA VOZ Y LAS CUALIDADES ACÚSTICAS DEL SONIDO La voz está dotada de diferentes cualidades acústicas. Éstas están directamente relacionadas
Pág. 1 de 5 Profesionaliza la voz si ésta es tu herramienta de trabajo LA VOZ Y LAS CUALIDADES ACÚSTICAS DEL SONIDO La voz está dotada de diferentes cualidades acústicas. Éstas están directamente relacionadas
EJERCICIOS. UNIDAD 2. La nutrición humana.
 EJERCICIOS. UNIDAD 2. La nutrición humana. 1. El intercambio de materia y energía que todo ser vivo realiza con su medio, corresponde a la función de: a) Nutrición b) Relación c) Reproducción d) Adaptación
EJERCICIOS. UNIDAD 2. La nutrición humana. 1. El intercambio de materia y energía que todo ser vivo realiza con su medio, corresponde a la función de: a) Nutrición b) Relación c) Reproducción d) Adaptación
INSTITUCION EDUCATIVA LA PRESENTACION
 INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES DOCENTE: MARA CELINA MAZO TAPIAS TIPO DE GUIA: CONCEPTUAL Y DE EJECUCION
INSTITUCION EDUCATIVA LA PRESENTACION NOMBRE ALUMNA: AREA : CIENCIAS NATURALES Y EDUCACION AMBIENTAL ASIGNATURA: CIENCIAS NATURALES DOCENTE: MARA CELINA MAZO TAPIAS TIPO DE GUIA: CONCEPTUAL Y DE EJECUCION
Lidia Belkis Archbold Ministerios de Salud División Interamericana. Anatomía y Fisiología del Aparato Respiratorio
 Lidia Belkis Archbold Ministerios de Salud División Interamericana Anatomía y Fisiología del Aparato Respiratorio Objetivos: 1. Proporcionar al estudiante un conocimiento de la forma en que el aparato
Lidia Belkis Archbold Ministerios de Salud División Interamericana Anatomía y Fisiología del Aparato Respiratorio Objetivos: 1. Proporcionar al estudiante un conocimiento de la forma en que el aparato
Espirometría: Principales parámetros respiratorios A. Definición e indicaciones
 Espirometría: Principales parámetros respiratorios A. Definición e indicaciones La espirometría es una prueba que estudia el funcionamiento pulmonar analizando, en circunstancias controladas, la magnitud
Espirometría: Principales parámetros respiratorios A. Definición e indicaciones La espirometría es una prueba que estudia el funcionamiento pulmonar analizando, en circunstancias controladas, la magnitud
Sistema cardiorrespiratorio
 6 6.procedimientos clínicos Sistema cardiorrespiratorio Hablamos en este número del Sistema Cardiorrespiratorio y de algunas cosas que el auxiliar debe saber sobre este sistema. Dentro de la serie de artículos
6 6.procedimientos clínicos Sistema cardiorrespiratorio Hablamos en este número del Sistema Cardiorrespiratorio y de algunas cosas que el auxiliar debe saber sobre este sistema. Dentro de la serie de artículos
Guía Práctica de. curvas de flujo/volumen. Juan Enrique Cimas Hernando Javier Pérez Fernández
 Guía Práctica de ESPIROMETRÍA FORZADA Es una técnica que permite realizar mediciones de la capacidad ventilatoria y de los flujos aéreos que se generan en el aparato respiratorio. Analiza la espiración
Guía Práctica de ESPIROMETRÍA FORZADA Es una técnica que permite realizar mediciones de la capacidad ventilatoria y de los flujos aéreos que se generan en el aparato respiratorio. Analiza la espiración
APARATO RESPIRATORIO. para NUTRIENTES LIBERAR ENERGIA. La función es Incorporar oxígeno al organismo. Que al llegar a la célula
 APARATO RESPIRATORIO La función es Incorporar oxígeno al organismo para DIOXIDO DE CARBONO, que es devuelto al desechos Que al llegar a la célula Se produzca NUTRIENTES La COMBUSTION Y poder LIBERAR ENERGIA
APARATO RESPIRATORIO La función es Incorporar oxígeno al organismo para DIOXIDO DE CARBONO, que es devuelto al desechos Que al llegar a la célula Se produzca NUTRIENTES La COMBUSTION Y poder LIBERAR ENERGIA
Enfermedad De Obstrucción Pulmonar Crónica (EOPC)
 Enfermedad De Obstrucción Pulmonar Crónica (EOPC) Introducción La enfermedad pulmonar obstructiva crónica (EPOC) y el enfisema son enfermedades comunes de los pulmones que afectan a millones de norteamericanos.
Enfermedad De Obstrucción Pulmonar Crónica (EOPC) Introducción La enfermedad pulmonar obstructiva crónica (EPOC) y el enfisema son enfermedades comunes de los pulmones que afectan a millones de norteamericanos.
FORMACIÓN EN VÁLVULAS DE CONTROL: CRITERIOS DE SELECCIÓN Y DISEÑOS SEGÚN CONDICIONES DE PROCESO
 FORMACIÓN EN VÁLVULAS DE CONTROL: CRITERIOS DE SELECCIÓN Y DISEÑOS SEGÚN CONDICIONES DE PROCESO. Alberto Argilés Ringo Válvulas S.L. 1.- Introducción La válvula de control manipula el fluido que pasa por
FORMACIÓN EN VÁLVULAS DE CONTROL: CRITERIOS DE SELECCIÓN Y DISEÑOS SEGÚN CONDICIONES DE PROCESO. Alberto Argilés Ringo Válvulas S.L. 1.- Introducción La válvula de control manipula el fluido que pasa por
Exploración funcional II. Volúmenes. resistencias, difusión, presiones musculares y distensibilidad.
 7 Exploración funcional II. Volúmenes pulmonares, resistencias, difusión, presiones musculares, distensibilidad J.L. López-Campos Bodineau, A. Arnedillo Muñoz, C. García Polo INTRODUCCIÓN La evaluación
7 Exploración funcional II. Volúmenes pulmonares, resistencias, difusión, presiones musculares, distensibilidad J.L. López-Campos Bodineau, A. Arnedillo Muñoz, C. García Polo INTRODUCCIÓN La evaluación
Capítulo 6. Valoración respiratoria
 498 Capítulo 6. Valoración respiratoria 6.19. La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 6.19 La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 499
498 Capítulo 6. Valoración respiratoria 6.19. La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 6.19 La respiración. Intercambio gaseoso y modificaciones durante el esfuerzo 499
LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO?
 LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO? En el tema anterior estudiamos que las sustancias nutritivas pasaban a la sangre desde el intestino delgado y el oxígeno
LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO? En el tema anterior estudiamos que las sustancias nutritivas pasaban a la sangre desde el intestino delgado y el oxígeno
Capítulo 10. Efectos de superficie. Sistema respiratorio
 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Semestre al que corresponde: Segundo semestre del tercer año de la Carrera. Día y Horario del dictado: Lunes, Miércoles y Viernes de 8 y 30 a 11 y 30.
 Carrera: LICENCIATURA EN NEUMOCARDIOLOGÍA Nombre de la Asignatura: UNIDAD TEMÁRTICA V ESPIROMETRIA-LOOP FLUJO VOLUMEN- VOLUMEN PULMONARES Semestre al que corresponde: Segundo semestre del tercer año de
Carrera: LICENCIATURA EN NEUMOCARDIOLOGÍA Nombre de la Asignatura: UNIDAD TEMÁRTICA V ESPIROMETRIA-LOOP FLUJO VOLUMEN- VOLUMEN PULMONARES Semestre al que corresponde: Segundo semestre del tercer año de
FISIOLOGÍA HUMANA BLOQUE 5. APARATO RESPIRATORIO
 Facultad de Medicina Departamento de Fisiología FISIOLOGÍA HUMANA BLOQUE 5. APARATO RESPIRATORIO Tema 18. Ventilación Pulmonar Dr. Bernardo LÓPEZ CANO Profesor Titular de la Universidad de Murcia Contenidos
Facultad de Medicina Departamento de Fisiología FISIOLOGÍA HUMANA BLOQUE 5. APARATO RESPIRATORIO Tema 18. Ventilación Pulmonar Dr. Bernardo LÓPEZ CANO Profesor Titular de la Universidad de Murcia Contenidos
TEMA 2: LA NUTRICIÓN
 TEMA 2: LA NUTRICIÓN 1 1. Cómo nos nutrimos los seres vivos? Algunos seres vivos, cómo las plantas, pueden vivir, sin tener que tomar sustancias orgánicas. Otros seres vivos, cómo los animales, necesitamos
TEMA 2: LA NUTRICIÓN 1 1. Cómo nos nutrimos los seres vivos? Algunos seres vivos, cómo las plantas, pueden vivir, sin tener que tomar sustancias orgánicas. Otros seres vivos, cómo los animales, necesitamos
TEMA 2. LA NUTRICIÓN
 TEMA 2. LA NUTRICIÓN La nutrición sirve para darnos energía, fuerza para poder jugar, estudiar, correr y esta energía nos la dan los alimentos. El organismo toma oxígeno del aire y cambia los alimentos
TEMA 2. LA NUTRICIÓN La nutrición sirve para darnos energía, fuerza para poder jugar, estudiar, correr y esta energía nos la dan los alimentos. El organismo toma oxígeno del aire y cambia los alimentos
El aparato respiratorio lo forman las vías respiratorias y los pulmones.
 El aparato respiratorio lo forman las vías respiratorias y los pulmones. Fosas nasales: cavidades separadas por el tabique nasal y posteriormente se unen a la rinofaringe. Faringe: tubo común al aparato
El aparato respiratorio lo forman las vías respiratorias y los pulmones. Fosas nasales: cavidades separadas por el tabique nasal y posteriormente se unen a la rinofaringe. Faringe: tubo común al aparato
SISTEMA RESPIRATORIO. Lic. Dolores Luna
 SISTEMA RESPIRATORIO Lic. Dolores Luna Sistema Respiratorio Función: Asegurar los cambios gaseosos entre el aire atmosférico y la sangre, a través de la membrana alveolar de los pulmones Órgano respiratorio
SISTEMA RESPIRATORIO Lic. Dolores Luna Sistema Respiratorio Función: Asegurar los cambios gaseosos entre el aire atmosférico y la sangre, a través de la membrana alveolar de los pulmones Órgano respiratorio
TEST APARATO RESPIRATORIO BIR 2015-2016
 1.- Cuál de los siguientes es el estímulo directo para las neuronas del área quimiosensible de la zona bulbar reguladora de la respiración?: 1. po 2. 2. pco 2. 3. CO 3 H 2. 4. CO 3 H -. 5. Concentración
1.- Cuál de los siguientes es el estímulo directo para las neuronas del área quimiosensible de la zona bulbar reguladora de la respiración?: 1. po 2. 2. pco 2. 3. CO 3 H 2. 4. CO 3 H -. 5. Concentración
Exámenes de función pulmonar. Dra. Gisella Borzone Departamento de Enfermedades Respiratorias Pontificia Universidad Católica de Chile
 Exámenes de función pulmonar Dra. Gisella Borzone Departamento de Enfermedades Respiratorias Pontificia Universidad Católica de Chile Objetivos Revisar los exámenes de función pulmonar más frecuentemente
Exámenes de función pulmonar Dra. Gisella Borzone Departamento de Enfermedades Respiratorias Pontificia Universidad Católica de Chile Objetivos Revisar los exámenes de función pulmonar más frecuentemente
FISIOLOGIA RESPIRATORIA
 FISIOLOGIA RESPIRATORIA LA RESPIRACION TIENE COMO FUNCION PROPORCIONAR O 2 A LAS CELULAS Y EXTRAER EL EXCESO DE CO 2 PRODUCIDO POR ELLAS Componentes de las vías aéreas TRÁQUEA BRONQUIOS BRONQUÍOLOS ZONA
FISIOLOGIA RESPIRATORIA LA RESPIRACION TIENE COMO FUNCION PROPORCIONAR O 2 A LAS CELULAS Y EXTRAER EL EXCESO DE CO 2 PRODUCIDO POR ELLAS Componentes de las vías aéreas TRÁQUEA BRONQUIOS BRONQUÍOLOS ZONA
CÁTEDRA DE ANATOMÍA Y FISIOLOGÍA HUMANA. Trabajo Práctico de Respiratorio: Volúmenes y Capacidades pulmonares
 CÁTEDRA DE ANATOMÍA Y FISIOLOGÍA HUMANA Trabajo Práctico de Respiratorio: Volúmenes y Capacidades pulmonares Introducción: Los volúmenes de aire que se desplazan durante los movimientos respiratorios se
CÁTEDRA DE ANATOMÍA Y FISIOLOGÍA HUMANA Trabajo Práctico de Respiratorio: Volúmenes y Capacidades pulmonares Introducción: Los volúmenes de aire que se desplazan durante los movimientos respiratorios se
Dr. Miguel Ángel González Sosa
 Dr. Miguel Ángel González Sosa Presentación realizada en el curso de Clinopatología del Aparato Respiratorio dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina en el semestre Julio
Dr. Miguel Ángel González Sosa Presentación realizada en el curso de Clinopatología del Aparato Respiratorio dentro de la Licenciatura de Médico Cirujano del Área Académica de Medicina en el semestre Julio
Tema 5. EL ASMA BRONQUIAL INFANTIL Y JUVENIL 2. Definición, Factores de riesgo, Síntomatología
 OPEN COURSE WARE 2012º/2012 PSICOLOGÍA DE LA SALUD EN POBLACIÓN INFANTIL Y JUVENIL Tema 5. EL ASMA BRONQUIAL INFANTIL Y JUVENIL 2. Definición, Factores de riesgo, Síntomatología Profesores: Ana Isabel
OPEN COURSE WARE 2012º/2012 PSICOLOGÍA DE LA SALUD EN POBLACIÓN INFANTIL Y JUVENIL Tema 5. EL ASMA BRONQUIAL INFANTIL Y JUVENIL 2. Definición, Factores de riesgo, Síntomatología Profesores: Ana Isabel
Aparato Respiratorio
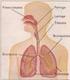 SEXTA SESIÓN Aparato Respiratorio Dr. Ricardo Nava Larraguivel Anatomía a y Fisiología a General del Sistema Respiratorio 1 Componentes Estructurales del Sistema Respiratorio El sistema respiratorio lo
SEXTA SESIÓN Aparato Respiratorio Dr. Ricardo Nava Larraguivel Anatomía a y Fisiología a General del Sistema Respiratorio 1 Componentes Estructurales del Sistema Respiratorio El sistema respiratorio lo
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS INFORMACIÓN REQUERIDA POR ASIGNATURA
 HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS INFORMACIÓN REQUERIDA POR ASIGNATURA. NOMBRE DE LA ASIGNATURA: ANATOMÍA Y FISIOLOGÍA HUMANA I. CARRERA: T.S.U. PARAMÉDICO. NIVEL DEL : ESPECÍFICO 4.
HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS INFORMACIÓN REQUERIDA POR ASIGNATURA. NOMBRE DE LA ASIGNATURA: ANATOMÍA Y FISIOLOGÍA HUMANA I. CARRERA: T.S.U. PARAMÉDICO. NIVEL DEL : ESPECÍFICO 4.
Actualización de temas GINA Dra. Patricia Arizmendi Agosto 2014
 Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
Actualización de temas GINA 2014 Dra. Patricia Arizmendi Agosto 2014 Definición Enfermedad caracterizada por la inflamación crónica de la vía aérea. Definida por la presencia de síntomas de la esfera respiratoria
Biofísica de la Respiración. Matías Enrique Puello Chamorro
 Biofísica de la Respiración Matías Enrique Puello Chamorro www.matiaspuello.wordpress.com 10 de octubre de 2014 Índice 1. INTRODUCCIÓN 4 2. BREVE RESEÑA ANATOMICA 5 2.1. Vias respiratorias...............................................
Biofísica de la Respiración Matías Enrique Puello Chamorro www.matiaspuello.wordpress.com 10 de octubre de 2014 Índice 1. INTRODUCCIÓN 4 2. BREVE RESEÑA ANATOMICA 5 2.1. Vias respiratorias...............................................
JOSÉ ANTONIO GUTIÉRREZ LARA F.E.A. NEUMOLOGÍA HOSPITAL INFANTA CRISTINA
 JOSÉ ANTONIO GUTIÉRREZ LARA F.E.A. NEUMOLOGÍA HOSPITAL INFANTA CRISTINA Desde un punto de vista funcional, podemos dividir los volúmenes pulmonares: Dinámicos: Aquellos que se movilizan con la respiración
JOSÉ ANTONIO GUTIÉRREZ LARA F.E.A. NEUMOLOGÍA HOSPITAL INFANTA CRISTINA Desde un punto de vista funcional, podemos dividir los volúmenes pulmonares: Dinámicos: Aquellos que se movilizan con la respiración
LA RESISTENCIA 2º E.S.O. DEPARTAMENTO EDUCACIÓN FÍSICA I.E.S. Valdehierro (Madridejos)
 LA RESISTENCIA 2º E.S.O. DEPARTAMENTO EDUCACIÓN FÍSICA I.E.S. Valdehierro (Madridejos) 1.- QUÉ ES LA RESISTENCIA?. Es la capacidad física y psíquica de soportar la fatiga al realizar un trabajo durante
LA RESISTENCIA 2º E.S.O. DEPARTAMENTO EDUCACIÓN FÍSICA I.E.S. Valdehierro (Madridejos) 1.- QUÉ ES LA RESISTENCIA?. Es la capacidad física y psíquica de soportar la fatiga al realizar un trabajo durante
Partes del Sistema Respiratorio Humano
 Partes del Sistema Respiratorio Humano La respiración es el proceso por el cual ingresamos aire (que contiene oxígeno) a nuestro organismo y sacamos de él aire rico en dióxido de carbono. Un ser vivo puede
Partes del Sistema Respiratorio Humano La respiración es el proceso por el cual ingresamos aire (que contiene oxígeno) a nuestro organismo y sacamos de él aire rico en dióxido de carbono. Un ser vivo puede
Qué son las enfermedades pulmonares?
 Qué son las enfermedades pulmonares? INTRODUCCIÓN Para comprender el funcionamiento del cuerpo humano, solemos explicar que está compuesto por varias partes o sistemas corporales. Algunos ejemplos son
Qué son las enfermedades pulmonares? INTRODUCCIÓN Para comprender el funcionamiento del cuerpo humano, solemos explicar que está compuesto por varias partes o sistemas corporales. Algunos ejemplos son
ESTRUCTURA Y FUNCIÓN DE LOS SISTEMAS CARDIOCIRCULATORIO, RESPIRATORIO Y RENAL
 ASIGNATURA: ESTRUCTURA Y FUNCIÓN DE LOS SISTEMAS CARDIOCIRCULATORIO, RESPIRATORIO Y RENAL CRÉDITOS: Totales: 13 Teóricos: 6,5 Prácticos: 6,5 OBJETIVOS ESPECÍFICOS Desarrollar capacidades de comunicación
ASIGNATURA: ESTRUCTURA Y FUNCIÓN DE LOS SISTEMAS CARDIOCIRCULATORIO, RESPIRATORIO Y RENAL CRÉDITOS: Totales: 13 Teóricos: 6,5 Prácticos: 6,5 OBJETIVOS ESPECÍFICOS Desarrollar capacidades de comunicación
Ciclo Cardiaco -Guía de Estudio PARTE II - Presión arterial.
 Area de Fisiología Cardiovascular, Renal y Respiratoria. - 2016 - TRABAJO PRACTICO Nº 3 - CICLO CARDIACO II Ciclo Cardiaco -Guía de Estudio PARTE II - Presión arterial. I. Defina 1) Presión Sistólica 2)
Area de Fisiología Cardiovascular, Renal y Respiratoria. - 2016 - TRABAJO PRACTICO Nº 3 - CICLO CARDIACO II Ciclo Cardiaco -Guía de Estudio PARTE II - Presión arterial. I. Defina 1) Presión Sistólica 2)
NUESTRO CUERPO EN MOVIMIENTO
 NUESTRO CUERPO EN MOVIMIENTO 1. CAMBIOS CORPORALES EN LA ADOLESCENCIA Desde que nacemos nuestro cuerpo está sometido a continuos cambios, especialmente en la adolescencia, desde los 12 hasta los 18 o 20
NUESTRO CUERPO EN MOVIMIENTO 1. CAMBIOS CORPORALES EN LA ADOLESCENCIA Desde que nacemos nuestro cuerpo está sometido a continuos cambios, especialmente en la adolescencia, desde los 12 hasta los 18 o 20
Salud y Fisiología Humanas I 3ª Parte: Intercambio de gases. Tema 2 de Biología NS Diploma BI Curso 2012-2014
 Salud y Fisiología Humanas I 3ª Parte: Intercambio de gases Tema 2 de Biología NS Diploma BI Curso 2012-2014 Estructura del sistema respiratorio Tráquea Sistema respiratorio Bronquios Bronquiolos Pulmones
Salud y Fisiología Humanas I 3ª Parte: Intercambio de gases Tema 2 de Biología NS Diploma BI Curso 2012-2014 Estructura del sistema respiratorio Tráquea Sistema respiratorio Bronquios Bronquiolos Pulmones
1.1. N º Camas comunes con otras especialidades: Nº de camas especificas para registros de sueño 4
 PROVINCIAL REGIONAL PRESTACIÓN ASISTENCIAL 1. Hospitalización 1.1. N º Camas comunes con otras especialidades: 0 1.2. Nº Camas asignadas a Neumología 28 1.3. Nº de camas especificas para registros de sueño
PROVINCIAL REGIONAL PRESTACIÓN ASISTENCIAL 1. Hospitalización 1.1. N º Camas comunes con otras especialidades: 0 1.2. Nº Camas asignadas a Neumología 28 1.3. Nº de camas especificas para registros de sueño
Anatomía Aplicada. Sistema cardiopulmonar
 Anatomía Aplicada Sistema cardiopulmonar Unidad 6. Aparato respiratorio Unidad 7. Aparato circulatorio. Aparato excretor. Contenidos: UNIDAD 6. APARATO RESPIRATORIO. I. APARATO RESPIRATORIO HUMANO II.
Anatomía Aplicada Sistema cardiopulmonar Unidad 6. Aparato respiratorio Unidad 7. Aparato circulatorio. Aparato excretor. Contenidos: UNIDAD 6. APARATO RESPIRATORIO. I. APARATO RESPIRATORIO HUMANO II.
