Actividad Superficial de Mezclas de Soluciones de Surfactantes No- Iónicos Tween 20 y Tween 80 en Interfaz Líquido-Aire
|
|
|
- Juan Antonio Esteban Ponce Zúñiga
- hace 7 años
- Vistas:
Transcripción
1 UNIVERSIDAD DE CARABOBO FACULTAD EXPERIMENTAL DE CIENCIAS Y TECNOLOGIA DEPARTAMENTO DE QUIMICA PASANTIAS Actividad Superficial de Mezclas de Soluciones de Surfactantes No- Iónicos Tween 20 y Tween 80 en Interfaz Líquido-Aire Tutor Académico: Prof. José Guaregua. Tutor Industrial: Estudiante: Br. Luís F. Ruiz C.I v Dr. Aly Castellanos. Valencia, Enero del
2 Actividad Superficial de Mezclas de Soluciones de Surfactantes No- Iónicos Tween 20 y Tween 80 en Interfaz Líquido-Aire Ruiz Ch. Luís F. Instituto Venezolano de Investigaciones Científicas. Centro de Física. Laboratorio de Fisicoquímica de Coloides. Altos de Pipe Km 11 Carretera Panamericana. Edo Miranda. Enero RESUMEN Los surfactantes no iónicos conocidos como Tween 20 y Tween 80 se utilizan en la formulación de productos bioterapéuticos por sus excelentes propiedades superficiales y como estabilizadores contra la agregación de proteínas (1). El estudio del comportamiento superficial de las mezclas de tales surfactantes busca comprobar si existe o no un sinergismo y las razones, en función de sus estructuras, de posibles interacciones entre moléculas de surfactante distintos en la interfaz líquido- aire. Para estos fines se aplica un modelo termodinámico el cual deriva de la descripción del comportamiento de la adsorción de los sistemas mixtos de surfactante, y el cual no asume parámetros extras de interacción entre los diferentes compuestos. El modelo requiere de las tensiones superficiales de los sistemas de cada surfactante por separado. Palabras Claves: Surfactante, Interfaz, Tensión Superficial, Adsorción. INTRODUCCION El termino surfactante normalmente se utiliza para designar en forma simple los compuestos con cierta propiedad o actividad superficial. Los surfactantes se caracterizan por tener una estructura química que contiene un grupo que posee afinidad con el solvente, conocido como grupo liofilico, y otro que posee poca afinidad o antipatía por el solvente conocido como grupo liofóbico. Si el solvente es el agua, estos grupos se conocen como las porciones hidrofilica e hidrofóbica del surfactante respectivamente. Normalmente, el grupo hidrofóbico es una cadena de carbonos lineal o ramificada, mientras que la porción hidrofílica es un grupo con cierto carácter polar. Cuando los surfactantes están presentes a bajas concentraciones en un sistema, se adsorben en las superficies o 2
3 interfases, modificando la energía superficial o interfacial de tales sistemas. Así pues, cuando un surfactante se disuelve en agua, se produce una adsorción de las moléculas de dicho surfactante en la superficie del agua, disminuyendo la tensión superficial de esta, lo cual es una medida de la disminución de la energía libre superficial del sistema: W =γ ΔA (Ec 1) donde W es el trabajo realizado, o sea, el incremento de la energía libre superficial expresada en ergios, γ la tensión superficial en dinas/cm y ΔA es el incremento del área en cm 2. Eventualmente, se alcanza una concentración de surfactante, a la cual existen suficientes moléculas para saturar la interfase. Si la interfase se satura a una dada concentración de surfactante, la tensión superficial permanece constante, a pesar de que se produzcan aumentos posteriores en dicha concentración. A partir de esta concentración, las moléculas que no tienen cabida en la interfase, comienzan a formar en el seno de la solución estructuras en forma de agregados. Estos agregados están formados por un numero determinado de moléculas de surfactante y se conocen como micelas y la concentración a la cual comienzan a formarse, se conoce como concentración micelar crítica (CMC). El comportamiento de adsorción de mezclas de surfactantes en interfaces liquido-liquido y liquido-aire ha sido ampliamente estudiado. En la mayoría de los casos se proponen procedimientos o modelos que buscan predecir el comportamiento de adsorción (en particular la tensión superficial e interfacial) de una mezcla de surfactante a partir de las características de superficie conocidas para cada compuesto por separado. La finalidad de aplicar el modelo propuesto es poder evaluar la idealidad en el comportamiento de las mezclas de surfactantes no-iónicos y correlacionar los resultados aquí presentados con un efecto de sinergismo y/o con la posible interacción de los compuestos en el sistema de la interfaz líquido-aire. Los datos de los estudios realizados a mezclas conteniendo dos surfactantes distintos, indican que en general, las interacciones atractivas entre los dos surfactantes se deben principalmente a fuerzas del tipo electrostáticas. 3
4 La fuerza de interacción electrostática decrece en el siguiente orden: aniónicocatiónico > aniónico-anfotérico > iónico (aniónico, catiónico)-no iónico > no iónico-o iónico. (5) Debido a que la probabilidad de sinergismo se incrementa con la fuerza de la interacción, es de esperar, que la mayor probabilidad de sinergismo exista entre una mezcla de un aniónicocatiónico o un aniónico-anfotérico. METODO EXPERIMENTAL es la fracción molar del Tween 20 y (1-x 1 ) la fracción molar del Tween 80. Para la medida de las tensiones superficiales para cada solución de surfactante individual y para las mezclas, se empleo un tensiómetro digital modelo K10ST, utilizando el método estático de la placa de Wilhelmy, con una incertidumbre en la medición de (±0,01mN/m). Todas las mediciones de la tensión superficial se realizaron a una temperatura de 25,0 (±0,1) ºC. Las soluciones de Tween 20 y Tween 80 se prepararon por separado mediante diluciones sucesivas en un rango de concentración que permitiera evaluar la concentración micelar crítica (CMC) experimental de cada surfactante. La concentración micelar crítica para el Tween 20 reportada es de 60 mg/l (4,885x10-5 mol/l), y para el Tween 80 esta entre mg/l (9,923x10-6 1,145x10-5 mol/l). A si mismo se prepararon mezclas de las soluciones anteriores a una determinada fracción molar de cada uno de los surfactante en la mezcla (x 1 =0,25; x 1 =0,5; y x 1 =0,75) donde x 1 TEORIA (2) Las ecuaciones de estado y las isotermas de adsorción para una mezcla ideal de dos surfactantes, parecidos entre si, se puede presentar de la forma: RT Π = ln (1 θ 1 θ 2 ) (Ec 2) ω = θ i b i c i (Ec 3) ( 1 θ 1 θ 2 ) donde b es una constante, c es la concentración del surfactante en la solución, R es la constante de la ley de 4
5 gases, T es la temperatura, θ = Γω es el grado de recubrimiento de la monocapa, Γ es la adsorción, Π = γ0 - γ es la presión superficial, γ0 y γ son las tensiones superficiales del solvente y de la solución, respectivamente. La ecuación 2 combinada con la ecuación 3 puede ser re-escrita en forma de la ecuación generalizada de Szyszkowski: RT θ1 + θ 2 Π = ln 1+ 1 ω θ1 θ 2 RT = ln ω ( b c + b c + 1) (Ec 4) b i c i θ 0i = (Ec 6) ( 1 θ ) 0i La ecuación 5 es esencial ya que permite calcular la presión superficial de cada uno de los surfactantes por separado. El único parámetro de la isoterma por determinar y sustituir en la ecuación 5, es el área molar, ω, la cual puede determinarse experimentalmente a partir del límite de la pendiente (cerca de la CMC) de la curva γ vs ln c para los surfactantes por separado utilizando la ecuación de Gibbs: ω = RT (Ec 7) dγ d ln c c CMC De esta manera usando las correspondientes ecuaciones para las soluciones individuales de los surfactantes 1 y 2 (el subíndice 0 hace referencia al valor de la solución individual), nos queda que: RT Πi = ln 0i ω RT = ln ω ( 1 θ ) ( 1+ b c ) i i (Ec 5) De esta manera, una vez conocidos todos los parámetros de la isoterma de adsorción, se puede determinar mediante la ecuación 5, el valor teórico para la presión superficial de cada surfactante y correlacionarlo con el valor experimental y determinar mediante este modelo si la mezcla sigue la idealidad o es posible una interacción entre las moléculas de los diferentes compuestos en la interfase. 5
6 ESTRUCTURA DEL TWEEN 20 Y TWEEN 80 (1) Los surfactantes no-iónicos Tween 20 y Tween 80 son moléculas anfipáticas compuestas por ésteres de ácidos grasos de sorbitan polioxietilenado. El Tween 20 es químicamente conocido como monolaurato de sorbitán polioxietilen y el Tween 80 como monooleato de sorbitán polioxietilen. Ambos tipos de surfactantes tienen el mismo grupo polar y sólo difieren en las estructuras de los ácidos grasos de cadenas laterales. Los hidrocarburos proporcionan las cadenas de naturaleza hidrofóbica, mientras que el carácter hidrofílico lo proporcionan las subunidades de óxido de etileno. La columna vertebral es una estructura de anillo sorbitán con polímeros de óxido de etileno en tres diferentes posiciones en las que se ubican los grupos hidroxilo. Mientras que, el número de repetición de las subunidades de óxido de etileno varía en cada posición siendo su número total (w+x+y+z) igual a 20 y es constante para cada uno de estos surfactantes. Las fracciones de los ácidos grasos se adjuntan a la molécula del surfactante a través de un enlace éster con el oxígeno del óxido de etileno en posición z. La fracción laurato del Tween 20 es una cadena de hidrocarburos y la fracción oleato en la estructura del Tween 80, contiene un doble enlace formando un pliegue en la cadena del hidrocarburo. Los Tween 20 y Tween 80 generalmente se venden como mezclas de ésteres de ácidos grasos. La composición del acido láurico en el Tween 20 es de 40-60% de la composición total de las especies de ácidos grasos presentes. Mientras que el ácido oleico que contiene el Tween 80 es 58% de su total. El resto de los ácidos grasos es una mezcla tanto de ácidos grasos saturados como insaturados. 6
7 Fig. 1 Estructura química del Tween 20 y Tween 80. w+x+y+z refiere el numero total de subunidades de oxietileno en cada molécula de surfactante y el cual no excede de 20. RESULTADOS Y DISCUSION Las Fig. 2 y 3 indican la variación característica de la tensión superfial en función del logaritmo de la concentración para cada surfactante, usando los datos experimentales obtenidos. A partir del valor que corresponde al agua pura (72,2 mn/m), se puede observar una disminución de la tensión superficial con el aumento de la concentración del surfactante (4). Tension Superficial (mn/m) Ln C (mol/l) Fig. 2 Isoterma de Gibbs para el surfactante Tween 20 para la interfaz líquido-aire a 25º C 7
8 Al principio la gran mayoría de las moléculas de surfactante se adsorben en la superficie líquido-aire y la concentración superficial crece de manera progresiva a medida que se aumenta la concentración de surfactante en el sistema. De esta manera se llega a un punto en que la tensión superficial sufre un cambio brusco con el aumento de concentración debido a que más moléculas son adsorbidas y la superficie se encuentra ocupada por una capa monomolecular de surfactante. Tension Superficial (mn /m) Ln C (mol/l) A partir de cierta concentración, conocida como concentración micelar crítica (CMC) se observa un cambio (extremo inferior de la curva) en la isoterma donde la tensión superficial se va haciendo constante. En este punto cualquier molécula adicional se encuentra por encima de su límite de saturación en fase acuosa, y su solubilización es poco favorable desde el punto de vista energético por la presencia del grupo no polar, por lo que las moléculas adicionales forman micelas. Esto ocurre porque a partir de la CMC las interacciones hidrófobas entre moléculas de surfactantes se tornan suficientemente importantes en comparación con las interacciones hidrofílicas surfactante-agua para que se forme de manera espontánea una asociación. La concentración micelar critica experimental para los surfactantes se determino por el intercepto de las dos semirrectas formadas muy cerca de la CMC como se muestra en las Fig. 4 y 5: Fig.3 Isoterma de Gibbs para el surfactante Tween 80 para la interfaz líquido-aire a 25º C 8
9 Los valores obtenidos para la CMC Tension S uperficial (m N /m ) y = -10,563x - 77,21 R 2 = 0,9884 y = -0,4448x + 25,919 R 2 = 0, Ln C (mol/l) Fig. 4 Determinación de la concentración micelar crítica para el surfactante Tween 20 a 25º C. La flecha indica el valor aproximado de la CMC. El intercepto de las dos semirrectas formadas, da un valor aproximado de la concentración micelar crítica para cada surfactante. Tension Superficial (mn/m) y = -7,2444x - 39,542 R 2 = 0,9881 y = -0,5464x + 30,853 R 2 = 0, Ln C (mol/l) experimental del Tween 20 y Tween 80 corresponden a 3,745x10-5 mol/l y 2,727x10-5 mol/l respectivamente. Hay que recordar que la concentración micelar critica no es un valor exacto sino un cierto rango de concentración, el cual puede ser relativamente amplio si el surfactante es una mezcla de especies químicas, lo que sucede en este caso, como se menciono anteriormente, con los ésteres de los ácidos grasos que conforman la parte hidrofóbica de los surfactantes. Así mismo se determino el área molar ω de cada uno de los surfactantes empleando la ecuación 7 con los valores mas cercanos a la CMC de las correspondientes curvas de las isotermas de adsorción para cada surfactante. Mediante la ecuación 7 se encontró que el área molar del Tween 20 fue de ,92 m 2 /mol y el área molar del Tween 80 de ,62 m 2 /mol. Fig. 5 Determinación de la concentración micelar crítica para el surfactante Tween 80 a 25º C. La flecha indica el valor aproximado de la CMC. Tomando en cuenta que por la ecuación de la isoterma de Gibbs: dγ = RT Γd ln C (Ec 8) 9
10 80 es mayor que para el otro y como θ = Γ ω, de esto se deduce que muy cerca y/o por encima del valor de la CMC, para una capa monomolecular compacta, donde la superficie esta completamente saturada por moléculas de surfactante, el grado de recubrimiento es θ =1, por lo que la adsorción es inversamente proporcional al área molar del surfactante Γ = 1/ω. Para el surfactante Tween 80, es posible que la adsorción Γ se de con mayor rapidez que para el Tween 20, por la longitud de la cadena hidrocarbonada del grupo hidrofóbico de los dos surfactantes. Mientras que en el Tween 20 la cadena hidrocarbonada es mas corta y pequeña, esta tendrá menor aporte hidrófobo que el Tween 80 el cual posee una cadena mas larga y mayor efecto hidrófobo por lo que le será mas fácil irse a la interfaz liquido/aire. Como se esperaba, los valores experimentales y teóricos de la CMC para el Tween 80 son mas pequeños que para el Tween 20, en vista de que, como ya se menciono, el aporte hidrofóbico de la cadena para el Tween surfactante, lo que permite que la formación de las micelas se vea mas favorecido para el surfactante que posee la cadena mas grande, y por ende su CMC será mas pequeña. Ahora bien, es de esperar que el area molar del Tween 80 sea mayor que el area molar correspondiente al Tween 20 de acuerdo a los valores de las áreas molares determinadas por la ecuación 7. En la Fig. 1 se puede comparar el tamaño entre una molécula de surfactante y otra, por lo que es de esperar que mientras más grande sea una molécula, mayor será el area molar de la misma. En la bibliografía se ha encontrado que el acido oleico (principal componente del éster del acido graso del Tween 80 ) da una monocapa mucho mas extendida que el acido correspondiente saturado, que es el esteárico (3). Debido al doble enlace es posible que la cohesión entre las cadenas hidrocarbonadas sea menor que en el acido esteárico y, además por otra parte, para áreas grandes, las cadenas de acido oleico se separan entre si, ya que las cadenas hidrocarbonadas tienden a permanecer independientes 10
11 una de la otra y sobre la superficie con los dobles enlaces hidrofílicos en contacto con la superficie de la solución. A medida que la capa comienza a comprimirse se fuerzan a los dobles enlaces a abandonar la superficie de la solución y finalmente las cadenas hidrocarbonadas se orientan verticalmente. Para comprobar el modelo teórico (Ec 5) Presion Superficial (mn/m) Ln C con los resultados para las isotermas de los surfactantes individuales se graficaron las presiones superficiales experimentales para cada surfactante en función del logaritmo de la concentración de surfactante (Fig. 6 y 7). 54 Fig. 7 Representación grafica de la presión superficial experimental ( ) y presión superficial teórica ( ) en función del logaritmo de la concentración de surfactante Tween 80 a 25ºC. Según las Fig. 6 y 7, las presiones superficiales experimentales y teóricas Presion Superficial (mn/m) Ln C para las soluciones de los surfactantes puros, coinciden muy bien, por lo que el modelo propuesto (Ec. 5) para determinar la presión superficial teórica para una solución de surfactante individual es bueno. Sin embargo no hay modelo matemático que describa y cuantifique la formación de micelas a Fig. 6 Representación grafica de la presión superficial experimental ( ) y presión superficial teórica ( ) en función del logaritmo de la concentración de surfactante Tween 20 a 25 ºC. partir de la CMC, por lo que es una limitación tanto para este, como para otros modelos que permiten predecir el comportamiento de adsorción de un surfactante en una interfaz por debajo de la CMC. 11
12 Tension Superficial (mn/m) Ln Cm Tension Superficial (mn/m) Ln Cm Fig. 8 Isoterma de Gibbs para la mezcla de surfactantes Tween 20 y Tween 80 con x 1 =0,25 y x 2 = 0,75 a 25 ºC Fig. 10 Isoterma de Gibbs para la mezcla de surfactantes Tween 20 y Tween 80 con x 1 =0,75 y x 2 = 0,25 a 25 ºC. Tension Superficial (mn/m) Ln Cm Fig. 9 Isoterma de Gibbs para la mezcla de surfactantes Tween 20 y Tween 80 con x 1 =0,50 y x 2 = 0,50 a 25 ºC. Las isotermas de las mezclas muestran la tendencia característica de la isoterma de Gibbs, donde una vez mas la tensión superficial decrece con el aumento de la concentración de surfactante, solo que el sistema ahora es mixto, formado con dos surfactantes no-iónicos de estructura química muy parecida, donde es posible encontrar un sinergismo que permita un efecto mas notable en la variación de la tensión que el que se pudiera tener con los surfactantes por separado. Las Fig. 8, 9 y 10 muestran las isotermas de adsorción de las tres mezclas de surfactantes a diferentes fracciones molares, donde se puede apreciar la tendencia característica de la isoterma de Gibbs. A simple vista no es posible notar un efecto de sinergismo o algún cambio en el comportamiento de la mezcla. En la mayoría de las mezclas analizadas se ha encontrado que existe una posible interacción entre moléculas de surfactante 12
13 diferentes, y que esta es de naturaleza atractiva (6). Esto se infiere porque al graficar las presiones superficiales experimentales y las presiones superficiales de la solución ideal (Ec 9), es posible notar una desviación negativa en el comportamiento de la mezcla. La presión superficial para una mezcla de surfactante ideal puede expresarse como: Presion Superficial (mn/m) Ln Cm Π m id = x1 Π1 + ( 1 x1) Π 2 (Ec 9) donde Π m id es el valor de la presión superficial para una mezcla ideal, x 1 y (1- x 1 ) son las fracciones molares del Tween 20 y Tween 80 respectivamente, Π 1 y Π 2 son las presiones superficiales teóricas para los surfactantes a la concentración de la mezcla. El procedimiento es el mismo que el empleado para las soluciones individuales por separado. Las Fig 11,12 y 13 indican que existe una desviación negativa con respecto al valor de la presión superficial que tendría la mezcla si el comportamiento fuera el de una mezcla ideal: Fig. 11 Representación grafica de la presión superficial experimental ( ) y presión superficial teórica ( ) en función del logaritmo de la concentración, y CMC ( ) para la mezcla A (x 1 =0,25 y x 2 = 0,75) a 25ºC. De la misma manera se determinaron las concentraciones micelares críticas correspondientes para cada mezcla por el mismo procedimiento usado para las soluciones de los surfactantes individuales y se graficaron en función de las CMC ideales que tendría cada mezcla de no existir una posible interacción entre las moléculas de surfactante. El resultado se muestra en la Fig. 14: 13
14 Presion Superficial (mn/m) Ln Cm Fig. 12 Representación grafica de la presión superficial experimental ( ) y presión superficial teórica ( ) en función del logaritmo de la concentración, y CMC ( ) para la mezcla B (x 1 =0,50 y x 2 = 0,50) a 25ºC. Presion Superficial (mn/m) Ln Cm Fig. 13 Representación grafica de la presión superficial experimental ( ) y presión superficial teórica ( ) en función del logaritmo de la concentración, y CMC ( ) para la mezcla C (x 1 =0,75 y x 2 = 0,25) a 25ºC. De la Fig. 14 se puede interpretar que la causa de la desviación negativa de la idealidad de la mezcla se debe a una posible interacción entre las moléculas son menores, dentro de un rango considerable, a los valores de CMC correspondientes a los surfactantes puros. de surfactante Tween 20 y Tween 80 en la interfaz liquido-aire, y que existe un posible sinergismo en vista de que los valores de la CMC de las mezclas 4,0E-05 Concentracion Micelar Crítica (mol/l) 3,5E-05 3,0E-05 2,5E-05 2,0E-05 MEZCLA MEZCLA IDEAL 1,5E-05 0,00 0,25 0,50 0,75 1,00 X1 Fig. 14 Representación gráfica de la Concentración Micelar Critica para la mezcla ideal y para las mezclas del sistema estudiado, x 1 es la composición o fracción molar del Tween 20 en la mezcla 14
15 CONCLUSIONES Las mezclas de surfactantes noiónicos Tween 20 y Tween 80 presentaron un sinergismo en las propiedades superficiales y en el comportamiento de adsorción de la mezcla a diferentes fracciones molares, siendo el mas notable la disminución de la CMC de las mezclas. Los valores teóricos calculados para las presiones superficiales de sistemas conteniendo surfactantes puros coinciden, en un rango importante, con los REFERENCIAS (1) Kerwin B.A Polysorbates 20 and 80 used in the formulation of protein biotherapeutics: Structure and degradation pathways. J Pharm Sci 97: (2) Miller R., Fainerman V. B Simple Method to Estimate Surface Tension of Mixed Surfactant Solutions. J. Phys. Chem. B, 46: (3) Shaw D. J Introducción a la química de superficies y coloides. 2 da Edición. Editorial Alambra. España 1977.Pág (4) Salager J L. Surfactantes en solución acuosa. Cuaderno FIRP 201.Mérida Pág (5) Gutierrez X., Rivas H Los surfactantes: Comportamiento y algunas de sus aplicaciones en la industria petrolera. Acta Científica Venezolana, Vol. 50 Suplemento Nº 1, (6) Rosen, J. M., Surfactant and Interfacial Phenomena, Jonh Wiley and Sons, (1989). obtenidos experimentalmente, lo que comprueba la eficacia del modelo propuesto para predecir el comportamiento de adsorción de una solución conteniendo un tipo de surfactante. Como se esperaba el área molar del Tween 80 es mayor que la correspondiente al Tween 20, de acuerdo a los valores experimentales obtenidos. 15
Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad
 Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad OBJETIVO: Determinación de la concentración micelar crítica
Determinación de la concentración micelar crítica (cmc) y grado de disociación (α) de un tensioactivo iónico mediante medidas de conductividad OBJETIVO: Determinación de la concentración micelar crítica
SUSTANCIA QUÍMICA mercurio oxígeno
 ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
ELEMENTO O SUSTANCIA ELEMENTAL: Sustancia formada por un mismo tipo de átomos, por ejemplo: Hg, H 2, Cu, O 2 SUSTANCIA QUÍMICA mercurio oxígeno COMPUESTO O SUSTANCIA COMPUESTA: Sustancia formada por dos
INGENIERO. JOSMERY SÁNCHEZ
 UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
UNIVERSIDAD NACIONAL EXPERIMENTAL FRANCISCO DE MIRANDA COMPLEJO ACADÉMICO "EL SABINO" PROGRAMA DE INGENIERÍA MECÁNICA AREA DE TECNOLOGÍA UNIDAD CURRICULAR: TERMODINÁMICA APLICADA REALIZADO POR: INGENIERO.
líquido sólido Interfase sólido-líquido
 INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
INTERFASES La mayoría de los procesos fisicoquímicos naturales y artificiales ocurren en sistemas heterogéneos en donde las diferentes fases que las componen están separadas por una interfase, definida
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
ESTIMACION DE LA PRESION DE CONVERGENCIA, CONSTANTE DE EQUILIBRIO Y FASES DEL GAS NATURAL
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación Superior Universidad Nacional Experimental Rafael María Baralt Programa: Ingeniería y Tecnología Proyecto: Ingeniería en
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación Superior Universidad Nacional Experimental Rafael María Baralt Programa: Ingeniería y Tecnología Proyecto: Ingeniería en
Fundamentos de Química. Horario de Tutorías
 Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
Fundamentos de Química Segundo Cuatrimestre Horario de Tutorías Martes 12:00-14:00 16:00-19:00 Edificio 24B.Tercera Planta 14/02/2006 Tema 11: Propiedades de las disoluciones 11.1 Definición de disolución
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico.
 FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FÍSICA Y QUÍMICA 3º ESO. OBJETIVOS, CONTENIDOS Y CRITERIOS DE EVALUACIÓN 1ª Evaluación: Unidad 1. La medida y el método científico. OBJETIVOS 1. Reconocer las etapas del trabajo científico y elaborar informes
FISICOQUÍMICA APLICADA
 UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
UNIVERSIDAD NACIONAL DE TUCUMAN FACULTAD DE BIOQUIMICA QUIMICA Y FARMACIA INSTITUTO DE QUIMICA FISICA San Miguel de Tucumán República Argentina FISICOQUÍMICA APLICADA Cambio de fase. Superficies. Coloides
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Diferentes aplicaciones de la calorimetría diferencial de barrido (DSC) en aceites y grasas. Maria A. Grompone
 Diferentes aplicaciones de la calorimetría diferencial de barrido (DSC) en aceites y grasas. Maria A. Grompone II Simpósio Internacional: Tendências e Inovações em Tecnologia de Óleos e Gorduras Florianópolis,
Diferentes aplicaciones de la calorimetría diferencial de barrido (DSC) en aceites y grasas. Maria A. Grompone II Simpósio Internacional: Tendências e Inovações em Tecnologia de Óleos e Gorduras Florianópolis,
Campo Magnético en un alambre recto.
 Campo Magnético en un alambre recto. A.M. Velasco (133384) J.P. Soler (133380) O.A. Botina (133268) Departamento de física, facultad de ciencias, Universidad Nacional de Colombia Resumen. Se hizo pasar
Campo Magnético en un alambre recto. A.M. Velasco (133384) J.P. Soler (133380) O.A. Botina (133268) Departamento de física, facultad de ciencias, Universidad Nacional de Colombia Resumen. Se hizo pasar
DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4
 Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
Universidad Tecnológica Nacional Facultad Regional La Plata DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE FISICOQUÍMICA TRABAJO PRÁCTICO DE LABORATORIO Nº 4 Descenso crioscópico Objeto de la experiencia:
QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos.
 QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de 2011 Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos. 1. Qué significado tienen los parámetros termodinámicos
QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de 2011 Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos. 1. Qué significado tienen los parámetros termodinámicos
ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO. Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara
 ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara 1. Objetivos 1.- Verificar la adsorción de las moléculas de un soluto en una disolución líquida
ISOTERMA DE ADSORCIÓN DE ÁCIDO OXÁLICO SOBRE CARBÓN ACTIVO Eva Mª Talavera Rodríguez y Francisco A. Ocaña Lara 1. Objetivos 1.- Verificar la adsorción de las moléculas de un soluto en una disolución líquida
QUIMICA UNIVERSIDAD DE BURGOS QUÍMICA GUÍA DOCENTE Denominación de la asignatura: QUIMICA. Titulación
 GUÍA DOCENTE 2012-2013 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
GUÍA DOCENTE 2012-2013 QUIMICA 1. Denominación de la asignatura: QUIMICA Titulación Ingeniería Electrónica Industrial y Automática Código 6400 2. Materia o módulo a la que pertenece la asignatura: Química
APÉNDICE I. Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario
 APÉNDICE I Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario En este apéndice se muestra la información correspondiente a la elaboración de las diferentes curvas
APÉNDICE I Calibración de la señal cromatográfica como función de la concentración: Sistema Ternario En este apéndice se muestra la información correspondiente a la elaboración de las diferentes curvas
Contenidos mínimos Física y Química 3º ESO
 Contenidos mínimos Física y Química 3º ESO EL TRABAJO CIENTÍFICO Etapas del método científico. Magnitudes y unidades. Cambio de unidades. Sistema Internacional de Unidades (SI). Representación de gráficas
Contenidos mínimos Física y Química 3º ESO EL TRABAJO CIENTÍFICO Etapas del método científico. Magnitudes y unidades. Cambio de unidades. Sistema Internacional de Unidades (SI). Representación de gráficas
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
CAPITULO 6. Análisis Dimensional y Semejanza Dinámica
 CAPITULO 6. Análisis Dimensional y Semejanza Dinámica Debido a que son pocos los flujos reales que pueden ser resueltos con exactitud sólo mediante métodos analíticos, el desarrollo de la mecánica de fluidos
CAPITULO 6. Análisis Dimensional y Semejanza Dinámica Debido a que son pocos los flujos reales que pueden ser resueltos con exactitud sólo mediante métodos analíticos, el desarrollo de la mecánica de fluidos
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos
 TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
Capítulo 10. Efectos de superficie. Sistema respiratorio
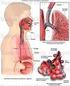 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo.
 ! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
! " # $ %& ' () ) Objetivos: Principal: Investigar las propiedades de un gas a presión constante. Secundario: Determinar la tasa de enfriamiento de un cuerpo. Conceptos a afianzar: Descripción termodinámica
1. FLUIDOS (1 punto) Enuncie la ecuación de Bernoulli y describa cada uno de los términos.
 Física Forestales. Examen A. 7-0-0 Instrucciones. La parte de teoría se contestará en primer lugar utilizando la hoja de color, sin consultar libros ni apuntes, durante el tiempo que el estudiante considere
Física Forestales. Examen A. 7-0-0 Instrucciones. La parte de teoría se contestará en primer lugar utilizando la hoja de color, sin consultar libros ni apuntes, durante el tiempo que el estudiante considere
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA
 CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERIAS DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA NOMBRE DE MATERIA TERMODINÁMICA QUÍMICA CLAVE DE MATERIA DEPARTAMENTO
CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERIAS DIVISIÓN DE INGENIERIAS DEPARTAMENTO DE INGENIERÍA QUÍMICA PROGRAMA DE ASIGNATURA NOMBRE DE MATERIA TERMODINÁMICA QUÍMICA CLAVE DE MATERIA DEPARTAMENTO
Equilibrio Líquido-Vapor de soluciones binarias, en el sentido de la Ley de Raoult
 Equilibrio Líquido-Vapor de soluciones binarias, en el sentido de la Ley de Raoult La representación tridimensional de los sistemas de equilibrio binario puede ser difícil de analizar por lo que podemos
Equilibrio Líquido-Vapor de soluciones binarias, en el sentido de la Ley de Raoult La representación tridimensional de los sistemas de equilibrio binario puede ser difícil de analizar por lo que podemos
TEMA 2: LEYES Y CONCEPTOS BÁSICOS EN QUÍMICA
 1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
1. SUSTANCIAS PURAS Y MEZCLAS 2. LEYES PONDERALES DE LAS COMBINACIONES QUÍMICAS 2.1. LEY DE CONSERVACIÓN DE LA MATERIA Enunciada en 1783 por Lavoisier: La materia ni se crea ni se destruye, únicamente
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 8. Equilibrio de fases en sistemas multicomponentes II
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 8 Equilibrio de fases en sistemas multicomponentes II Esquema Tema 8. Equilibrios de fases en sistemas multicomponentes
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 8 Equilibrio de fases en sistemas multicomponentes II Esquema Tema 8. Equilibrios de fases en sistemas multicomponentes
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo.
 Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
Un sistema se encuentra en un estado de equilibrio químico cuando su composición no varía con el tiempo. N 2 g 3 H 2 g 2 NH 3 g 2 NH 3 g N 2 g 3 H 2 g concentración H 2 N 2 NH 3 concentración NH 3 H 2
-aproximadamente 60% del organismo humano. -componente mas abundante en la mayoría de los alimentos
 EL AGUA -aproximadamente 60% del organismo humano -componente mas abundante en la mayoría de los alimentos -responsable del carácter apetecible de muchos alimentos y también de la aptitud al deterioro
EL AGUA -aproximadamente 60% del organismo humano -componente mas abundante en la mayoría de los alimentos -responsable del carácter apetecible de muchos alimentos y también de la aptitud al deterioro
Electricidad y calor. Dr. Roberto Pedro Duarte Zamorano. Departamento de Física
 Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Electricidad y calor Dr. Roberto Pedro Duarte Zamorano Departamento de Física 2011 A. Termodinámica Temario 1. Temperatura y Ley Cero. (3horas) 2. Calor y transferencia de calor. (5horas) 3. Gases ideales
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Teoría de errores -Hitogramas
 FÍSICA I Teoría de errores -Hitogramas Autores: Pablo Iván ikel - e-mail: pinikel@hotmail.com Ma. Florencia Kronberg - e-mail:sil_simba@hotmail.com Silvina Poncelas - e-mail:flo_kron@hotmail.com Introducción:
FÍSICA I Teoría de errores -Hitogramas Autores: Pablo Iván ikel - e-mail: pinikel@hotmail.com Ma. Florencia Kronberg - e-mail:sil_simba@hotmail.com Silvina Poncelas - e-mail:flo_kron@hotmail.com Introducción:
Operaciones Básicas de Transferencia de Materia Problemas Tema 6
 1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
1º.- En una torre de relleno, se va a absorber acetona de una corriente de aire. La sección de la torre es de 0.186 m 2, la temperatura de trabajo es 293 K y la presión total es de 101.32 kpa. La corriente
LEY DE OHM Y PUENTE DE WHEATSTONE
 uned de Consorci Centre Associat la UNED de Terrassa Laboratori d Electricitat i Magnetisme (UPC) LEY DE OHM Y PUENTE DE WHEATSTONE Objetivo Comprobar experimentalmente la ley de Ohm. Determinar el valor
uned de Consorci Centre Associat la UNED de Terrassa Laboratori d Electricitat i Magnetisme (UPC) LEY DE OHM Y PUENTE DE WHEATSTONE Objetivo Comprobar experimentalmente la ley de Ohm. Determinar el valor
FLOTACIÓN. La flotación es uno de los procesos más selectivos para la separación de especies sulfurosas, y de Plomo- zinc y cobre zinc.
 La flotación es uno de los procesos más selectivos para la separación de especies sulfurosas, y de Plomo- zinc y cobre zinc. La separación de las especies a través del proceso de flotación, se produce
La flotación es uno de los procesos más selectivos para la separación de especies sulfurosas, y de Plomo- zinc y cobre zinc. La separación de las especies a través del proceso de flotación, se produce
- Leyes ponderales: Las leyes ponderales relacionan las masas de las sustancias que intervienen en una reacción química.
 FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
FÍSICA Y QUÍMICA 4ºESO COLEGIO GIBRALJAIRE CÁLCULOS QUÍMICOS 1.- LA REACCIÓN QUÍMICA. LEYES PONDERALES Una reacción química es el proceso en el que, mediante una reorganización de enlaces y átomos, una
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Laboratorio de Electricidad PRACTICA - 3 LEY DE OHM. PROPIEDADES DE LOS CIRCUITOS DE RESISTENCIAS SERIE Y PARALELO
 Laboratorio de lectricidad PCIC - 3 LY D OHM. POPIDDS D LOS CICUIOS D SISNCIS SI Y PLLO I - Finalidades 1.- Comprobar experimentalmente la ley de Ohm. 2.- Comprobar experimentalmente que en un circuito
Laboratorio de lectricidad PCIC - 3 LY D OHM. POPIDDS D LOS CICUIOS D SISNCIS SI Y PLLO I - Finalidades 1.- Comprobar experimentalmente la ley de Ohm. 2.- Comprobar experimentalmente que en un circuito
INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO
 INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO ASIGNATURA 9555 M85 MECÁNICA DE FLUIDOS NIVEL 03 EXPERIENCIA E-6 PÉRDIDA DE CARGA EN SINGULARIDADES HORARIO:
INGENIERIA DE EJECUCIÓN EN MECANICA PROGRAMA PROSECUCION DE ESTUDIOS VESPERTINO GUIA DE LABORATORIO ASIGNATURA 9555 M85 MECÁNICA DE FLUIDOS NIVEL 03 EXPERIENCIA E-6 PÉRDIDA DE CARGA EN SINGULARIDADES HORARIO:
Guía Temática de Química
 Guía Temática de Química Introducción a la Química Definición de química y de ciencias afines a ella Diferenciación de las ciencias afines a la química 1 Conceptos básicos de química y el método científico
Guía Temática de Química Introducción a la Química Definición de química y de ciencias afines a ella Diferenciación de las ciencias afines a la química 1 Conceptos básicos de química y el método científico
La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica.
 SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
SISTEMA PERIÓDICO DE LOS ELEMENTOS La tabla periódica es la estrella orientadora para la exploración en el capo de la química, la física, la mineralogía y la técnica. Niels Bohr Principio de exclusión
TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL
 1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
MODELOS DE SOLUCIÓN. Coeficientes de Actividad a partir de propiedades en exceso
 MODELOS DE SOLUCIÓN Coeficientes de Actividad a partir de propiedades en exceso MODELOS DE SOLUCIÓN Margules 2 sufijos MODELOS DE SOLUCIÓN Margules 3 sufijos MODELOS DE SOLUCIÓN Van Laar MODELOS DE SOLUCIÓN
MODELOS DE SOLUCIÓN Coeficientes de Actividad a partir de propiedades en exceso MODELOS DE SOLUCIÓN Margules 2 sufijos MODELOS DE SOLUCIÓN Margules 3 sufijos MODELOS DE SOLUCIÓN Van Laar MODELOS DE SOLUCIÓN
Universidad Nacional de Córdoba. Facultad de Ciencias Exactas Físicas y Naturales. Cátedra de Mecánica de los Fluidos. Carrea de Ingeniería Civil
 Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
Universidad Nacional de Córdoba Facultad de Ciencias Exactas Físicas y Naturales Cátedra de Mecánica de los Fluidos Carrea de Ingeniería Civil FLUJO COMPRESIBLE DR. ING. CARLOS MARCELO GARCÍA 2011 A modo
PROGRAMA INSTRUCCIONAL
 UNIVERSIDAD FERMÍN TORO VICE RECTORADO ACADÉMICO FACULTAD DE INGENIERIA PROGRAMA AL DATOS BÁSICOS DE LA ASIGNATURA Nombre de la asignatura: Código Semestre U.C. Pre- Requisito QUÍMICA QUI-422 IV 2 S/P
UNIVERSIDAD FERMÍN TORO VICE RECTORADO ACADÉMICO FACULTAD DE INGENIERIA PROGRAMA AL DATOS BÁSICOS DE LA ASIGNATURA Nombre de la asignatura: Código Semestre U.C. Pre- Requisito QUÍMICA QUI-422 IV 2 S/P
COLEGIO SAN FRANCISCO JAVIER GUIAS
 COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
UNIVERSIDAD NACIONAL DEL SUR 1
 UNIVERSIDAD NACIONAL DEL SUR 1 PROGRAMA DE: Termodinámica Química para Ingeniería CODIGO: 6479 H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R I C A S P R A C T I C A S Dra. Susana
UNIVERSIDAD NACIONAL DEL SUR 1 PROGRAMA DE: Termodinámica Química para Ingeniería CODIGO: 6479 H O R A S D E C L A S E P R O F E S O R R E S P O N S A B L E T E O R I C A S P R A C T I C A S Dra. Susana
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
LABORATORIO #6 DEMOSTRACIÓN DEL TOREMA DE BERNOULLI LUIS CARLOS DE LA CRUZ TORRES GILDARDO DIAZ CARLOS ROJAS PRESENTADO EN LA CÁTEDRA:
 LABORATORIO #6 DEMOSTRACIÓN DEL TOREMA DE BERNOULLI LUIS CARLOS DE LA CRUZ TORRES GILDARDO DIAZ CARLOS ROJAS PRESENTADO EN LA CÁTEDRA: LABORATORIO DE MECÁNICA DE FLUIDOS PRESENTADO A: ING. VLADIMIR QUIROZ
LABORATORIO #6 DEMOSTRACIÓN DEL TOREMA DE BERNOULLI LUIS CARLOS DE LA CRUZ TORRES GILDARDO DIAZ CARLOS ROJAS PRESENTADO EN LA CÁTEDRA: LABORATORIO DE MECÁNICA DE FLUIDOS PRESENTADO A: ING. VLADIMIR QUIROZ
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1)
 PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
PREGUNTAS DE SELECCIÓN MÚLTIPLE CON ÚNICA RESPUESTA (TIPO 1) Un gas es sometido a tres procesos identificados con las letras X, Y y Z. Estos procesos son esquematizados en los gráficos que se presentan
LABORATORIO 6. TITULO : Propiedades de los Gases
 37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
37 LABORATORIO 6. TITULO : Propiedades de los Gases OBJETIVOS: Demostrar la ley de difusión de los gases (ley de Graham) Comparar la velocidad de difusión de los gases con la de los líquidos. MATERIALES
Determinación de constantes de ionización
 Capítulo 5. Determinación de constantes de ionización Se determinaron las constantes de ionización de diversos compuestos mediante curvas de titulación ácido-base empleando métodos espectrofotométricos
Capítulo 5. Determinación de constantes de ionización Se determinaron las constantes de ionización de diversos compuestos mediante curvas de titulación ácido-base empleando métodos espectrofotométricos
Biopolímero s (4831)
 Biopolímero s (4831) 5.4. Factores que determinan la estructura de los ácidos nucleicos. 5.4.4 Apilamiento de bases Cuando se examinan los cristales de ácidos nucleicos helicoidales se observa que los
Biopolímero s (4831) 5.4. Factores que determinan la estructura de los ácidos nucleicos. 5.4.4 Apilamiento de bases Cuando se examinan los cristales de ácidos nucleicos helicoidales se observa que los
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
TESIS DOCTORAL REOLOGÍA DE ESPESANTES CELULÓSICOS PARA PINTURAS AL AGUA: MODELIZACIÓN Y MECANISMO DE ESPESAMIENTO ASOCIATIVO
 FACULTAT DE QUÍMICA DEPARTAMENT D'ENGINYERIA QUÍMICA I METAL LÚRGIA TESIS DOCTORAL REOLOGÍA DE ESPESANTES CELULÓSICOS PARA PINTURAS AL AGUA: MODELIZACIÓN Y MECANISMO DE ESPESAMIENTO ASOCIATIVO Alicia Maestro
FACULTAT DE QUÍMICA DEPARTAMENT D'ENGINYERIA QUÍMICA I METAL LÚRGIA TESIS DOCTORAL REOLOGÍA DE ESPESANTES CELULÓSICOS PARA PINTURAS AL AGUA: MODELIZACIÓN Y MECANISMO DE ESPESAMIENTO ASOCIATIVO Alicia Maestro
Clase 2: Sustancias puras
 Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Tema 6. Termodinámica y cinética
 Tema 6. Termodinámica y cinética A) Termodinámica Por qué algunas reacciones químicas son espontáneas a ciertas temperaturas? Existe alguna forma de predecir si una reacción va a producirse en unas condiciones
Tema 6. Termodinámica y cinética A) Termodinámica Por qué algunas reacciones químicas son espontáneas a ciertas temperaturas? Existe alguna forma de predecir si una reacción va a producirse en unas condiciones
Resultado de aprendizaje:
 Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
RESISTORES Tipos de Resistores:
 RESISTORES 2016 Tipos de Resistores: Teoría de Circuitos Por su composición o fabricación: De hilo bobinado (wirewound) Carbón prensado (carbon composition) Película de carbón (carbon film) Película óxido
RESISTORES 2016 Tipos de Resistores: Teoría de Circuitos Por su composición o fabricación: De hilo bobinado (wirewound) Carbón prensado (carbon composition) Película de carbón (carbon film) Película óxido
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1
 TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
TEMA 3: CINÉTICA HOMOGÉNEA. REACCIONES SIMPLES CQA-3/1 CARACTERÍSTICAS DE LAS REACCIONES HOMOGÉNEAS Todas las sustancias reaccionantes se encuentran en una sola fase Velocidad de reacción: Objetivo principal
Carlos Martínez B. Ley de Boyle. Carlos Javier Bernal Avila. Viernes, 29 de enero de 2010
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS LABORATORIO DE FISICA B Profesor: Carlos Martínez B. Título de la práctica: Ley de Boyle Nombre: Carlos Javier Bernal Avila Grupo
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
ANDALUCÍA / JUNIO 2000 LOGSE / QUÍMICA / OPCIÓN A /EXAMEN COMPLETO OPCIÓN A
 OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
OPCIÓN A 1. ormule o nombre los siguientes compuestos: a) Óxido de cromo (III) b) osfato de calcio c) Ácido benzoico d) BaSO 4 e) KNO 3 f) CH 3 CH 2 OH 2. Razone qué cantidad de las siguientes sustancias
QUÍMICA. La MATERIA REPRESENTACIÓN. Observación Datos Ley Hipótesis Teoría DEFINICIONES BÁSICAS. Propiedades
 QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
QUÍMICA La MATERIA Relación constante TEORÍA EXPERIMENTACIÓN Ciencia básica - Estructura - Composición - Propiedades - Transformaciones REPRESENTACIÓN OBSERVACIÓN mundo macroscópico Técnica sistemática
Nombre de la materia Química General Departamento Nanotecnología Academia Química
 Nombre de la materia Química General Departamento Nanotecnología Academia Química Clave Horas-teoría Horas-práctica Horas-AI Total-horas Créditos I4225 4 4 9 Nivel Carrera Tipo Prerrequisitos 1 Nanotecnología
Nombre de la materia Química General Departamento Nanotecnología Academia Química Clave Horas-teoría Horas-práctica Horas-AI Total-horas Créditos I4225 4 4 9 Nivel Carrera Tipo Prerrequisitos 1 Nanotecnología
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS.
 ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
ESTRUCTURA, VALORACIÓN Y CONTENIDOS DEL EXAMEN DE QUÍMICA DE LAS PRUEBAS DE ACCESO A LA UNIVERSIDAD POLITÉCNICA DE CARTAGENA PARA MAYORES DE 25 AÑOS. ESTRUCTURA La prueba constará de cuatro bloques, existiendo
1. Caso no lineal: ajuste de una función potencial
 1. Caso no lineal: ajuste de una función potencial La presión (P) y el volumen (V ) en un tipo de gas están ligados por una ecuación del tipo PV b = a, siendo a y b dos parámetros desconocidos. A partir
1. Caso no lineal: ajuste de una función potencial La presión (P) y el volumen (V ) en un tipo de gas están ligados por una ecuación del tipo PV b = a, siendo a y b dos parámetros desconocidos. A partir
[ A ], [ B ]...: concentraciones molares de los reactivos en un momento dado.
![[ A ], [ B ]...: concentraciones molares de los reactivos en un momento dado. [ A ], [ B ]...: concentraciones molares de los reactivos en un momento dado.](/thumbs/49/25484895.jpg) VELOCIDAD MEDIA DE UNA REACCIÓN aa + b B c C + d D [ A] [ B] [ C] [ D] Vmedia = = = = a b c d A Velocidad de disminución de los reactivos: a Velocidad de aumento de los productos: ECUACIÓN DE VELOCIDAD
VELOCIDAD MEDIA DE UNA REACCIÓN aa + b B c C + d D [ A] [ B] [ C] [ D] Vmedia = = = = a b c d A Velocidad de disminución de los reactivos: a Velocidad de aumento de los productos: ECUACIÓN DE VELOCIDAD
Sustancias puras, procesos de cambios de fase, diagramas de fase. Estado 3 Estado 4 Estado 5. P =1 atm T= 100 o C. Estado 3 Estado 4.
 TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
TERMODINÁMICA Departamento de Física Carreras: Ing. Industrial y Mecánica Trabajo Práctico N 2: PROPIEDADES DE LAS SUSTANCIAS PURAS La preocupación por el hombre y su destino debe ser el interés primordial
ANEXO 1. CALIBRADO DE LOS SENSORES.
 ANEXO 1. CALIBRADO DE LOS SENSORES. Las resistencias dependientes de la luz (LDR) varían su resistencia en función de la luz que reciben. Un incremento de la luz que reciben produce una disminución de
ANEXO 1. CALIBRADO DE LOS SENSORES. Las resistencias dependientes de la luz (LDR) varían su resistencia en función de la luz que reciben. Un incremento de la luz que reciben produce una disminución de
ANEXO 1 EJEMPLO DE CALCULO DE RESISTIVIDAD APARENTE. Subestaciones de Media Tensión Curso Fernando Berrutti Staino
 ANEXO 1 EJEMPLO DE CALCULO DE RESISTIVIDAD APARENTE Subestaciones de Media Tensión Curso 015 Fernando Berrutti Staino Planteo del problema Se realizan mediciones con un telurímetro en el terreno de una
ANEXO 1 EJEMPLO DE CALCULO DE RESISTIVIDAD APARENTE Subestaciones de Media Tensión Curso 015 Fernando Berrutti Staino Planteo del problema Se realizan mediciones con un telurímetro en el terreno de una
Determinación de entalpías de vaporización
 Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Prácticas de Química. Determinación de entalpías de vaporización I. Introducción teórica y objetivos........................................ 2 II. Desarrollo experimental...............................................
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Glúcidos o hidratos de carbono.
 Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Estequiometría y Leyes Ponderales
 Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Estequiometría y Leyes Ponderales Equipo de Educación en Química Verde Centro Interdisciplinario de Líquidos Iónicos Programa de Educación Continua para el Magisterio Introducción Leyes fundamentales de
Apuntes de Electroquímica
 En la región donde interaccionan electrodo y disolución pueden ocurrir dos tipos de reacciones: de oxidación o de reducción. La velocidad de una reacción elemental depende de la concentración de las especies
En la región donde interaccionan electrodo y disolución pueden ocurrir dos tipos de reacciones: de oxidación o de reducción. La velocidad de una reacción elemental depende de la concentración de las especies
REVISTA COLOMBIANA DE FISICA, VOL. 33, No
 CÁLCULO DE LA CONSTANTE DE BOLTZMAN A PARTIR DE MEDIDAS DE LA CARACTERÍSTICA IV DE UNA CELDA SOLAR. M. Grizález*, C. Quiñones y G. Gordillo Departamento de Física, Universidad Nacional de Colombia, Bogotá,
CÁLCULO DE LA CONSTANTE DE BOLTZMAN A PARTIR DE MEDIDAS DE LA CARACTERÍSTICA IV DE UNA CELDA SOLAR. M. Grizález*, C. Quiñones y G. Gordillo Departamento de Física, Universidad Nacional de Colombia, Bogotá,
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
FLUJO DE AGUA EN EL SUELO Y ZONA NO SATURADA
 Lección 7. Flujo de agua en el suelo. Ley de Darcy. Conductividad hidráulica. Relación entre conductividad hidráulica y tensión. Ecuaciones que rigen la infiltración vertical. Ecuación de Richards. Capacidad
Lección 7. Flujo de agua en el suelo. Ley de Darcy. Conductividad hidráulica. Relación entre conductividad hidráulica y tensión. Ecuaciones que rigen la infiltración vertical. Ecuación de Richards. Capacidad
TEMA 6 MEZCLAS Y DISOLUCIONES
 TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
TEMA 6 MEZCLAS Y DISOLUCIONES 1 Contenidos: 1. Tipos de disoluciones 2. El proceso de disolución 3. Formas de expresar la concentración. 4. Solubilidad. Factores que afectan a la solubilidad 5. Propiedades
1.- La materia y clasificación. La materia es cualquier cosa que ocupa un espacio y tiene masas Estados: sólido, líquido, gaseoso
 La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
La Química La Química se encarga del estudio de las propiedades de la materia y de los cambios que en ella se producen. La Química es una ciencia cuantitativa y requiere el uso de mediciones. Las cantidades
Actividad: Cómo son las configuraciones electrónicas?
 Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Tema 1.- Correlación Lineal
 Tema 1.- Correlación Lineal 3.1.1. Definición El término correlación literalmente significa relación mutua; de este modo, el análisis de correlación mide e indica el grado en el que los valores de una
Tema 1.- Correlación Lineal 3.1.1. Definición El término correlación literalmente significa relación mutua; de este modo, el análisis de correlación mide e indica el grado en el que los valores de una
y 2 Considere que el viento no sopla en la dirección AB sino que lo hace de forma que v r
 P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
P1. Anemometría sónica. Hoy en día, los Centros Meteorológicos disponen de aparatos muy sofisticados para medir la velocidad del viento que, además y simultáneamente, miden la temperatura del aire. El
CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA
 CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA R. Domínguez 3,1, J.M. Fraga 1,2, J.A. Cocho 1,2, P. Bermejo 3, A. Bermejo
CONTENIDO DE HIERRO EN LAS LECHES DE FORMULA EMPLEADAS EN LA ALIMENTACIÓN INFANTIL: DISTRIBUCION EN EL SUERO LACTEO Y EN LA GRASA R. Domínguez 3,1, J.M. Fraga 1,2, J.A. Cocho 1,2, P. Bermejo 3, A. Bermejo
CIENCIAS DE LA TIERRA Y MEDIOAMBIENTALES Ejercicios Bloque 2: La atmósfera. Preguntas de aplicación:
 CIENCIAS DE LA TIERRA Y MEDIOAMBIENTALES Ejercicios Bloque 2: La atmósfera Preguntas de aplicación: 1 2 Una masa de aire a 20 ºC y 12,5 g/m3 de humedad, situada a 100 m de altura sobre el nivel del mar,
CIENCIAS DE LA TIERRA Y MEDIOAMBIENTALES Ejercicios Bloque 2: La atmósfera Preguntas de aplicación: 1 2 Una masa de aire a 20 ºC y 12,5 g/m3 de humedad, situada a 100 m de altura sobre el nivel del mar,
UNIDAD 2. CINÉTICA QUÍMICA
 UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
Química 2º Bach. Recuperación 1ª Evaluación 13/01/05
 Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Química º Bach. Recuperación 1ª Evaluación 13/1/5 DEPARTAMENT DE FÍSIA E QUÍMIA Nombre: 1. alcula a partir de qué temperatura será espontánea la reacción de descomposición del tetraóxido de dinitrógeno
Marzo 2012
 Marzo 2012 http:///wpmu/gispud/ Para determinar la carga transferida a través del tiempo a un elemento, es posible hacerlo de varias formas: 1. Utilizando la ecuación de carga, evaluando en los tiempos
Marzo 2012 http:///wpmu/gispud/ Para determinar la carga transferida a través del tiempo a un elemento, es posible hacerlo de varias formas: 1. Utilizando la ecuación de carga, evaluando en los tiempos
