Pfizer Venezuela S.A. Documento de Producto Local
|
|
|
- Agustín Espinoza Castillo
- hace 6 años
- Vistas:
Transcripción
1 Pfizer Venezuela S.A. Documento de Producto Local Título del Documento del Producto: Medroxiprogesterona Fecha de Última Revisión: 16 de enero de 2010 Fecha de Última Revisión de Farmacovigilancia: 22 de septiembre de NOMBRE DEL PRODUCTO SAYANA 104 mg/0,65ml Suspensión Inyectable. 2. DENOMINACIÓN GENÉRICA SAYANA 104 mg/0,65 ml 3. FORMA FARMACÉUTICA Suspensión inyectable. 4. DATOS CLÍNICOS 4.1. INDICACIONES TERAPÉUTICAS Prevención del embarazo (Anticonceptivo femenino a largo plazo) POSOLOGÍA Y MÉTODO DE ADMINISTRACIÓN La jeringa pre-llenada de SAYANA se debe agitar vigorosamente inmediatamente antes de usar para asegurar que la dosis administrada representa una suspensión uniforme. EI tratamiento lo debe iniciar un médico a asistente de salud y administrar como inyección subcutánea (SC) en la parte anterior del muslo ó el abdomen. Adultos Primera inyección: Para proporcionar cobertura anticonceptiva en el primer ciclo de uso, se deberá administrar una inyección SC de 104 mg durante los primeros cinco días de un ciclo menstrual normal. Si la inyección se efectúa de acuerdo con estas instrucciones, no se necesitara ninguna otra medida anticonceptiva. 1
2 Posparto: Para aumentar la seguridad de que la paciente no está embarazada al momento de la primera administración, esta inyección se deberá administrar en los primeros 5 días posparto si la paciente no está amamantando. Dosis posteriores: La segunda inyección y las siguientes se deberán administrar a intervalos de 13 semanas, en tanto la inyección no se dé después de siete días después de este momento, no se necesitaran medidas anticonceptivas adicionales (por ejemplo, de barrera). Si el intervalo entre la inyección anterior es mayor que 14 semanas (13 semanas más 7 días) por alguna razón, entonces se deberá descartar la posibilidad de embarazo antes de administrar la siguiente inyección. La eficacia de SAYANA depende del seguimiento del calendario de administración recomendado. Cambio desde otros métodos anticonceptivos: Cuando se cambia de otros métodos anticonceptivos, SAYANA se deberá administrar de manera que asegure una cobertura anticonceptiva continua con base en el mecanismo de acción de ambos métodos, (por ejemplo, las pacientes que cambian de anticonceptivos orales deberán recibir su primera inyección de SAYANA en los primeros 7 días después de su última píldora activa). Insuficiencia hepática: No hay estudios formales que hayan evaluado el efecto de enfermedades hepáticas sobre la eliminación de SAYANA. Sin embargo, las hormonas esteroides se pueden metabolizar mal en pacientes can insuficiencia hepática grave (ver la Sección Contraindicaciones). Insuficiencia renal: No hay estudios formales que hayan evaluado el efecto de enfermedades renales sobre la farmacocinética de SAYANA. Sin embargo, dado que el SAYANA se elimina casi exclusivamente a través del metabolismo hepático, no se consideran necesarios ajustes de la dosis para mujeres con disfunción renal. Pacientes Adolecentes SAYANA no se recomienda antes de la menarquía. Hay datos disponibles en mujeres adolescentes (12 a 18 años) para la administración SC de MPA. Subcutánea VÍA DE ADMINISTRACIÓN 4.4. CONTRAINDICACIONES SAYANA está contraindicado en pacientes con antecedentes de hipersensibilidad a SAYANA a cualquiera de sus excipientes. SAYANA está contraindicado en casos de embarazo presunto ó confirmado. 2
3 SAYANA está contraindicado en mujeres con tumores malignos de mama ó genitales, sean presuntos ó confirmados. SAYANA está contraindicado en pacientes con hemorragia vaginal no diagnosticada. SAYANA está contraindicado en pacientes disfunción hepática grave. SAYANA está contraindicado en pacientes con enfermedad metabólica ósea. SAYANA está contraindicado en pacientes con enfermedad tromboembólica activa y en pacientes con enfermedad cerebro vascular pasada ó presente. Hipersensibilidad a los componentes de la fórmula. 4.5 ADVERTENCIAS Y PRECAUCIONES DE USO General El sangrado vaginal inesperado durante el tratamiento con SAYANA debe ser investigado. [31] SAYANA puede causar algún grado de retención de fluidos, por lo tanto, debemos tener precaución al tratar a cualquier paciente con condiciones médicas pre-existentes que podría ser afectado adversamente por una retención de fluidos. Los pacientes con historia de tratamiento de depresión clínica deben ser monitoreados cuidadosamente mientras reciban tratamiento con SAYANA. Algunos pacientes que reciben SAYANA pueden presentar menor tolerancia a la glucosa. Los pacientes diabéticos deben ser observados cuidadosamente mientras reciban dicha terapia. El patólogo (laboratorio) debe ser notificado del uso del paciente de SAYANA si se somete tejido endometrial o endocervical a análisis. [34] El médico/laboratorio debe ser notificado de que el uso de SAYANA puede disminuir los niveles de los siguientes biomarcadores endócrinos: a. Esteroides urinarios/plasma (por ejemplo: cortisol, estrógeno, pregnanediol, progesterona, testosterona) [35,36] b. Gonadotrofinas urinarias/plasma (por ejemplo: LH y FSH) [36,37] c. Globulina ligada a la hormona sexual [38,39] El medicamento no debe ser administrado de nuevo hasta realizar el análisis para confirmar si existe una pérdida súbita parcial o total de visión o si existe un inicio repentino de proptosis, diplopia, o migraña. Si el examen revela papiledema o lesiones retinales vasculares, el medicamento no debe ser administrado de nuevo. [40] 3
4 No se ha asociado SAYANA con la inducción de trastornos trombóticos o tromboembólicos [41,42,43], sin embargo no se recomienda SAYANA en pacientes con historia de tromboembolismo venoso (VTE por sus siglas en inglés). Se recomienda descontinuar SAYANA en pacientes que desarrollan VTE al ser tratados con MPA. En pacientes con insuficiencia renal, asma, epilepsia y otras condiciones que agraven la retención de líquido. Advertencias y Precauciones Adicionales para Formulación o Uso Específico Pérdida de Densidad mineral Ósea (DMO) El uso de SAYANA reduce los niveles de estrógeno y se asocia a una pérdida significativa de DMO debido a que el metabolismo óseo se adapta a un menor nivel de estrógeno. Esta pérdida de DMO es de particular preocupación durante la adolescencia e inicio de la edad adulta, un periodo crítico de calcificación de los huesos.. La pérdida ósea es mayor al aumentar la duración de uso y puede no ser totalmente reversible. Se desconoce si el uso de SAYANA en mujeres más jóvenes reducirá la masa ósea máxima y aumentará el riesgo de fracturas por osteoporosis en el futuro. Tanto en mujeres adultas [105, 121] como adolescentes, [106, 121] la disminución de DMO durante el tratamiento parece ser sustancialmente reversible cuando se descontinúa el uso de SAYANA. Durante el uso prolongado de SAYANA se debe realizar control periódico de la DMO. Cáncer de Seno Se ha reportado que el uso de progesterona/estrógeno oral por mujeres menopáusicas aumenta el riesgo de Cáncer de Seno. [84] Resultados de un estudio aleatorizado controlado con placebo, el estudio WHI, y estudios epidemiológicos han reportado mayor riesgo de Cáncer de Seno en mujeres que toman combinaciones de estrógeno/progesterona como HT durante varios años. En el estudio WHI de estrógenos equinos conjugados (CEE) más SAYANA y estudios de observación, el riesgo relativo aumentó con la duración del uso. [54, 84-89] Se ha reportado que el uso de estrógeno más progesterona produjo un aumento de mamografías anormales que requieren evaluación más profunda. [87] En varios estudios epidemiológicos no se reportó mayor riesgo general de Cáncer de Mama entre las usuarias de progestágenos inyectables en depósito en comparación con las no-usuarias. [108, 109, 111, 123] Sin embargo, se reportó un mayor riesgo relativo (por ejemplo: 2.0 en un estudio) en mujeres que usaban en ese momento progestágenos inyectables en depósito o que los habían usado unos años antes. [44] No podemos inferir a partir de estos datos si este mayor índice de diagnósticos de cáncer de mama entre usuarias actuales se debe a una mayor supervisión entre dichas usuarias 4
5 actuales a los efectos biológicos de los progestágenos inyectables, o a una combinación de razones. [108, 109, 111, 121, 123] Trastornos Cardiovasculares Los estrógenos con o sin progesterona no deben ser usados para la prevención de enfermedad cardiovascular. [84,90] Varios estudios aleatorizados prospectivos sobre los efectos a largo plazo, de un régimen combinado de Estrógeno/Progesterona en mujeres menopáusicas reportaron un aumento en el riesgo de eventos cardiovasculares como infarto al miocardio, cardiopatía isquémica, accidente cardiovascular, y tromboembolismo venoso. [54,58,59] Cardiopatía Isquémica: No existe evidencia con base en estudios aleatorizados controlados, de beneficio cardiovascular con estrógeno conjugado y Acetato de Medroxiprogesterona (MPA) combinados continuos. [54,58,59] Dos estudios clínicos extensos [WHI CEE/MPA y Estudio del Corazón y el Reemplazo de Estrógeno/Progesterona (HERS), reportó un posible mayor riesgo de morbilidad cardiovascular en el primer año de uso sin beneficios generales. [54,58,59,92] En el estudio WHI CEE/MPA, un mayor riesgo de eventos de Cardiopatía Isquémica (CHD) (definidos como infarto al miocardio no fatal y muerte CHD) fue reportado en mujeres que recibían CEE/MPA en comparación con las mujeres que recibieron placebo (37 vs. 30 por 10,000 persona-años). El aumento en el riesgo VTE fue observado en el año uno y persistió durante el periodo de observación. [54, 92] Accidente cardiovascular: En el estudio WHI CEE/MPA, se reportó un mayor riesgo de accidente cardiovascular en las mujeres que recibían CEE/MPA en comparación con las mujeres que recibían placebo (29 vs. 21 por 10,000 persona-años). El mayor riesgo fue observado en el año uno y persistió durante el periodo de observación. [54,93] Tromboembolismo venoso / Embolismo pulmonar: La Terapia hormonal (HT) está asociada con un mayor riesgo relativo de desarrollar tromboembolismo venoso (VTE), es decir, trombosis venosa profunda o embolismo pulmonar. En el estudio WHI CEE/MPA, se reportó una tasa del doble de casos de VTE, incluyendo trombosis venosa profunda y embolismo pulmonar en mujeres que tomaban CEE/SAYANA en comparación con las mujeres que recibieron un placebo. El mayor riesgo fue observado en el año uno y persistió durante el periodo de observación. [54,94] Demencia El Estudio sobre la Memoria de la Iniciativa de Salud de la Mujer (WHIMS), un estudio secundario de WHI, CEE/MPA reportó un mayor riesgo de probable demencia en mujeres menopáusicas de 65 años de edad o mayores. [95,96] Además, el tratamiento CEE/MPA no previno el deterioro cognitivo leve 5
6 (MCI) en estas mujeres. No se recomienda el uso de la terapia hormonal (HT) para prevenir demencia o MCI en mujeres de 65 años o mayores [97, 112, 121] Cáncer Ovárico El uso actual de estrógeno sólo o de estrógeno con productos de progesterona en mujeres postmenopáusicas por cinco años o más, ha sido asociado con mayor riesgo de Cáncer Ovárico en algunos estudios epidemiológicos. [113] Usuarios previos de estrógeno solo o de estrógeno con productos de progesterona no reportaron mayor riesgo de Cáncer Ovárico. [113] Otros estudios no reportaron una asociación significativa. [ ] El estudio WHI CEE/MPA reportó que el estrógeno junto con la progesterona aumentó el riesgo de Cáncer Ovárico, pero este riesgo no fue estadísticamente significativo. [114] En un estudio, mujeres que usan HRT reportan mayor riesgo de Cáncer Ovárico fatal. [113] Recomendación de Historia y Examen Físico Debemos realizar una historia médica y familiar completa antes de iniciar cualquier terapia hormonal. El pre-tratamiento y exámenes físicos periódicos deben incluir una referencia especial a la presión sanguínea, los senos, el abdomen, y los órganos pélvicos, incluyendo citología cervical. [84] 4.6. INTERACCIONES MEDICAMENTOSAS Y OTRAS FORMAS DE INTERACCIÓN La aminoglutetimida, administrada simultáneamente con altas dosis de SAYANA oral puede disminuir considerablemente las concentraciones de acetato de SAYANA en el suero. [72] Los usuarios de altas dosis de SAYANA oral deben ser informados sobre la posibilidad de una disminución de la eficacia con el uso de aminoglutetimida EMBARAZO Y LACTANCIA Embarazo SAYANA está contraindicado en mujeres embarazadas. 6
7 Algunos reportes sugieren, bajo ciertas circunstancias, una asociación entre la exposición intrauterina a medicamentos progestacionales en el primer trimestre de gestación y anormalidades genitales en los fetos. [66,67] Los hijos de embarazos involuntarios que ocurren 1 a 2 meses después de la inyección de la suspensión inyectable de SAYANA pueden presentar mayor riesgo de bajo peso al nacer que eventualmente se asocia con mayor riesgo de muerte neonatal. El riesgo atribuible es bajo debido a que los embarazos durante el tratamiento con SAYANA son poco comunes. [67,68,69] No existe información definitiva sobre las demás formulaciones de SAYANA. Si la paciente se embaraza al estar usando este medicamento, esa paciente debe ser notificada de inmediato sobre el peligro potencial al feto. Lactancia SAYANA y sus metabolitos son excretados en la leche materna. No existe evidencia que sugiera que esto representa un riesgo para el niño lactante. [70] 4.8. EFECTOS EN LA CAPACIDAD PARA CONDUCIR Y USO DE MAQUINARIA El efecto del acetato de SAYANA en la habilidad para manejar y usar maquinaria no ha sido evaluado sistemáticamente EFECTOS ADVERSOS ANTICONCEPCIÓN - Formulación Subcutánea (SC): [115, 116] MEDDRA SOC Infecciones e Infestaciones Trastornos de nutrición y metabolismo Trastornos psiquiátricos Trastornos del sistema nervioso Trastornos de oído y laberinto Trastornos vasculares Trastornos gastrointestinales Trastornos de piel y tejido subcutáneo Trastornos músculo esqueléticos y de tejido conectivo EVENTO Vaginitis Disminución del apetito, aumento de apetito, retención de fluidos, cambios de peso Ansiedad [121], insomnio, anorgasmia, depresión, Trastornos emocionales, disminución de libido, trastornos del estado de ánimo Dolor de cabeza, mareo, migraña Vértigo Sofocos, hipertensión, venas varicosas Dolor abdominal, distención abdominal, náusea Hirsutismo, acné, cloasma, dermatitis, equimosis, salpullido, alopecia Dolor de espalda, calambres musculares, dolor en miembros 7
8 Trastornos de sistema reproductivo y senos Trastornos generales y condiciones en el sitio de administración Investigaciones Amenorrea, dolor/sensibilidad en senos, sangrado intermenstrual, menometrorragia, menorragia, descarga vaginal, sequedad vulvovaginal [121], dismenorrea, cambio en el tamaño de los senos, dispareunia [121], quiste ovárico, dolor pélvico, síndrome premenstrual Fatiga, reacciones en el sitio de la inyección, irritabilidad [121] Enzimas hepáticas anormales, frotis cervical anormal SOBREDOSIS No se necesita ninguna acción excepto la interrupción de la terapia. 5. PROPIEDADES FARMACOLÓGICAS 5.1. PROPIEDADES FARMACODINÁMICAS La Medroxiprogesterona es un derivado de la progesterona. Mecanismo de Acción SAYANA es una Progestina sintética (estructuralmente relacionada con la hormona progesterona endógena) que ha demostrado tener varias acciones farmacológicas en el sistema endócrino: Inhibición de gonadotropinas de la pituitaria (FSH y LH); Disminución de los niveles sanguíneos de hidrocortisona y ACTH; Disminución de la testosterona circulante; Disminución de los niveles de estrógeno circulante (como resultado de la inhibición de FSH y la inducción enzimática de reductasa hepática que produce mayor depuración de testosterona y menor conversión de andrógenos a estrógenos). 8
9 5.2. PROPIEDADES FARMACOCINÉTICAS [101,104, , 121] Absorción: La absorción de MPA, desde el sitio de inyección SC, para alcanzar niveles terapéuticos es relativamente rápida. La Tmax promedio es alcanzada aproximadamente una semana después de la inyección. Las concentraciones máximas de SAYANA (Cmax) generalmente se encuentran entre 0.5 a 3.0 ng/ml con un Cmax promedio de 1.5 ng/ml después de una sola inyección SC. Efecto del Sitio de la Inyección: La MPA subcutánea fue administrada en la cara anterior del muslo o en el abdomen para evaluar los efectos del perfil concentración-tiempo de MPA. Las concentraciones valle de SAYANA (Cmin; Día 91) fueron similares para los dos sitios de la inyección, sugiriendo que el sitio de la inyección no afecta negativamente la eficacia contraceptiva. Distribución: La liga de la proteína del plasma de MPA es en promedio de 86%. La liga de MPA ocurre principalmente con la albúmina del suero; no ocurre liga de MPA con SHBG. Metabolismo: MPA es extensamente metabolizado en el hígado. Eliminación: Las concentraciones residuales de MPA al final del intervalo de la dosis (3 meses) de MPA subcutánea están generalmente por debajo de 0.5 ng/ml, congruente con su vida media terminal aparente de 40 días después de la administración SC. La mayoría de los metabolitos de MPA son excretados en la orina como conjugados glucurónidos donde sólo pequeñas cantidades son excretadas como sulfatos. Poblaciones especiales: Raza: No se reportaron diferencias aparentes en la farmacocinética y/o dinámica de SAYANA después de la administración SC de MPA entre mujeres de todos los orígenes étnicos estudiados. La farmacocinética/dinámica de MPA ha sido evaluada en mujeres asiáticas en un estudio separado. Efecto del Peso Corporal: No es necesario ajustar la dosis de MPA subcutánea con base al peso corporal. El efecto del peso corporal en la farmacocinética de SAYANA fue evaluado en un sub-grupo de mujeres (n = 42, índice de masa corporal [BMI] se ubicó entre 18.2 a 46.0 Kg/m 2 ). Los valores AUC0-91 de SAYANA fueron 68.5, 74.8, y 61.8 ng -día/ml en mujeres con categorías BMI de Kg/m 2, >25 a 30 Kg/m 2, y >30 Kg/m 2, respectivamente. El Cmax promedio de SAYANA fue 1.65 ng/ml en mujeres con 2, 1.76 ng/ml en mujeres con BMI >25 a 30 kg/m 2, y 1.40 ng/ml en mujeres con BMI > 30 kg/m 2, respectivamente. El rango de concentraciones valle (Cmin) de SAYANA y las vidas medias fueron comparables en los 3 grupos BMI. 9
10 5.3. INFORMACIÓN PRECLÍNICA DE SEGURIDAD Carcinogénesis, Mutagénesis, Deterioro de la Fertilidad Se ha demostrado que la administración intramuscular a largo-plazo de acetato de SAYANA (MPA) produce tumores mamarios en perros beagle. No se reportó evidencia de efecto carcinogénico asociado con la administración oral de SAYANA oral a ratas y ratones. El acetato de SAYANA no fue mutagénico en una batería de estudios de toxicidad genética in vitro o in vivo. El acetato de SAYANA a altas dosis es un medicamento anti-fertilidad y se esperaría que altas dosis alteren la fertilidad hasta suspender el tratamiento. 6. CARACTERÍSTICAS FARMACÉUTICAS 6.1. LISTA DE EXCIPIENTES Polientilenglicol 3350 Agua para inyección c.s.p INCOMPATIBILIDADES No deben mezclarse con otros agentes. 24 meses PERIODO DE VALIDEZ 6.4. PRECAUCIONES ESPECIALES DE ALMACENAMIENTO No refrigerar ni congelar. Almacenar a temperaturas inferiores a 30 C SISTEMA ENVASE - CIERRE Jeringa de vidrio Tipo I con tapón émbolo de caucho bromobutílico con revestimiento fluorado y tapón de caucho bromobutílico en la punta, contentiva de 0,65 ml en estuche de cartón PRECAUCIONES ESPECIALES PARA DESECHO DE UN PRODUCTO MEDICINAL USADO O MATERIALES DE DESECHO DERIVADOS DE DICHO PRODUCTO MEDICINAL Y OTROS MANEJOS DEL PRODUCTO No disponible PRESENTACIONES APROBADAS Una Jeringa de vidrio Tipo I con tapón émbolo de caucho bromobutílico con revestimiento fluorado y 1 0
11 tapón de caucho bromobutílico en la punta, contentiva de 0,65 ml en estuche de cartón. 7. INFORMACIÓN LEGAL 7.1. REPRESENTANTE Pfizer Venezuela S.A FABRICANTE Pfizer Manufacturing Belgium NV, Bélgica FABRICANTE ENVASADOR Pfizer Manufacturing Belgium NV, Bélgica PROPIETARIO Pfizer Inc., U.S.A. E.F / NÚMERO DE REGISTRO SANITARIO 7.6. FECHA DE AUTORIZACIÓN DE REGISTRO SANITARIO 14 de Marzo de Elaborado por Analista de Asuntos Regulatorios Revisado por Gerente de Asuntos Regulatorio y el Médico de Producto Aprobado por Director Médico Natalia Correia Fecha: Dra. Carmen Villarroel Dra. Argelia Paez Fecha: Dra. Rodriguez Ariadna Fecha: Firma: Firma: Firma: 1 1
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
Taller de actualización en anticoncepción 2016 ANTICONCEPCIÓN CON SOLO. atención primaria GESTÁGENOS. Raquel Rodríguez Rodríguez
 Curso de actualización en Taller de actualización en anticoncepción 2016 ginecología y anticoncepción en ANTICONCEPCIÓN CON SOLO atención primaria GESTÁGENOS Raquel Rodríguez Rodríguez Supresión del pico
Curso de actualización en Taller de actualización en anticoncepción 2016 ginecología y anticoncepción en ANTICONCEPCIÓN CON SOLO atención primaria GESTÁGENOS Raquel Rodríguez Rodríguez Supresión del pico
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 POSTINOR 750 microgramos comprimidos. 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos.
POSTINOR 750 microgramos comprimidos. 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos.
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
DEPO-PROVERA Acetato de medroxiprogesterona 150 mg/ml Suspensión inyectable Vía de administración Intramuscular
 DEPO-PROVERA Acetato de medroxiprogesterona 150 mg/ml Suspensión inyectable Vía de administración Intramuscular 1. INDICACIONES Y USO DEPO-PROVERA está indicado solamente para la prevención del embarazo.
DEPO-PROVERA Acetato de medroxiprogesterona 150 mg/ml Suspensión inyectable Vía de administración Intramuscular 1. INDICACIONES Y USO DEPO-PROVERA está indicado solamente para la prevención del embarazo.
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FARMACOS QUE ACTUAN EN EL SISTEMA REPRODUCTOR
 FARMACOS QUE ACTUAN EN EL SISTEMA REPRODUCTOR CLASE DE FARMACOS Durante la adolescencia inicias la toma de decisiones importantes, algunas de las cuales pueden influir a todo lo largo de tu vida. La elección
FARMACOS QUE ACTUAN EN EL SISTEMA REPRODUCTOR CLASE DE FARMACOS Durante la adolescencia inicias la toma de decisiones importantes, algunas de las cuales pueden influir a todo lo largo de tu vida. La elección
FICHA TÉCNICA. KETOISDIN 400 mg óvulos está indicado en adultos para el tratamiento local de
 1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
1. NOMBRE DEL MEDICAMENTO KETOISDIN 400 mg óvulos FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada óvulo contiene: 400 mg de ketoconazol Excipientes con efecto conocido: Butilhidroxianisol
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg TABLETA VAGINAL ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Tableta Vaginal
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MAGNESIUM PYRE 64 mg comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 64 mg de magnesio (en forma de 550 mg de cloruro de magnesio,
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
DOCUMENTO DE PRODUCTO LOCAL PFIZER VENEZUELA, S.A. Preparado por Pfizer Inc. Fecha efectiva de CDS: 28 DIC Fecha CDS que reemplaza: 25 JUN 2014
 MALEATO DE TRIMEBUTINA 28 DIC 2015 DOCUMENTO DE PRODUCTO LOCAL PFIZER VENEZUELA, S.A. Preparado por Pfizer Inc. Fecha efectiva de CDS: 28 DIC 2015 Fecha CDS que reemplaza: 25 JUN 2014 MALEATO DE TRIMEBUTINA
MALEATO DE TRIMEBUTINA 28 DIC 2015 DOCUMENTO DE PRODUCTO LOCAL PFIZER VENEZUELA, S.A. Preparado por Pfizer Inc. Fecha efectiva de CDS: 28 DIC 2015 Fecha CDS que reemplaza: 25 JUN 2014 MALEATO DE TRIMEBUTINA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RIMADYL SOLUCIÓN INYECTABLE PARA BOVIN0 50 mg/ml 2. COMPOSICIÓN CUALITATIVA
LABORATORIOS NORMON, S.A.
 1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
1. NOMBRE DEL MEDICAMENTO normoval 250 mg comprimidos recubiertos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto de normoval contiene: 250 mg de extracto hidroalcohólico seco de raíz
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO ZOLADEX LA 10,8 mg (Goserelina) Implante SC
 Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO ZOLADEX LA 10,8 mg (Goserelina) Forma farmacéutica: Fortaleza: Presentación: Titular del Registro Sanitario, país: Fabricante, país: Implante
Nombre del producto: RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO ZOLADEX LA 10,8 mg (Goserelina) Forma farmacéutica: Fortaleza: Presentación: Titular del Registro Sanitario, país: Fabricante, país: Implante
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TÉCNICA. Tratamiento de la incontinencia urinaria asociada a la insuficiencia del esfínter uretral en la perra.
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CONTINENZA 40 mg/ml jarabe 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
Anticoncepción en mujeres con antecedentes de tromboembolismo venoso
 Anticoncepción en mujeres con antecedentes de tromboembolismo venoso Asesoramiento para las mujeres con antecedentes de tromboembolismo venoso que requieren anticonceptivos o terapia de reemplazo hormonal.
Anticoncepción en mujeres con antecedentes de tromboembolismo venoso Asesoramiento para las mujeres con antecedentes de tromboembolismo venoso que requieren anticonceptivos o terapia de reemplazo hormonal.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
AMENORREA SECUNDARIA. Dra. Ma. Susana Apablaza H. Gíneco-Obstetra Ginecóloga Infanto-Juvenil Unidad Adolescencia Clínica Alemana Temuco
 AMENORREA SECUNDARIA Dra. Ma. Susana Apablaza H. Gíneco-Obstetra Ginecóloga Infanto-Juvenil Unidad Adolescencia Clínica Alemana Temuco Definición: Ausencia de menstruación en una mujer que ya ha menstruado
AMENORREA SECUNDARIA Dra. Ma. Susana Apablaza H. Gíneco-Obstetra Ginecóloga Infanto-Juvenil Unidad Adolescencia Clínica Alemana Temuco Definición: Ausencia de menstruación en una mujer que ya ha menstruado
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Documento local de Producto
 1 Documento local de Producto Título del Documento de Producto: Acetato de Medroxiprogesterona Fecha del CDS reemplazado: Octubre 18 de 2010 Fecha efectiva: Septiembre 6 de 2013 Versión CDS: 14.0 1. NOMBRE(S)
1 Documento local de Producto Título del Documento de Producto: Acetato de Medroxiprogesterona Fecha del CDS reemplazado: Octubre 18 de 2010 Fecha efectiva: Septiembre 6 de 2013 Versión CDS: 14.0 1. NOMBRE(S)
Anticoncepción de emergencia. Nota descriptiva N 244 Febrero de 2016
 Nota descriptiva N 244 Febrero de 2016 Datos y cifras La anticoncepción de emergencia puede prevenir la mayoría de los embarazos cuando se usa después de una relación sexual. Se puede recurrir a la anticoncepción
Nota descriptiva N 244 Febrero de 2016 Datos y cifras La anticoncepción de emergencia puede prevenir la mayoría de los embarazos cuando se usa después de una relación sexual. Se puede recurrir a la anticoncepción
Para la lista completa de excipientes, véase la sección Indicaciones de uso, especificando las especies de destino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Metacam 2 mg/ml solución inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam Excipientes: Etanol 2 mg
Píldoras anticonceptivas:
 Píldoras anticonceptivas: Es uno de los métodos anticonceptivos más populares. La píldora, como también se le conoce, contiene una o dos hormonas (estrógenos y progesterona) que actúan impidiendo la ovulación
Píldoras anticonceptivas: Es uno de los métodos anticonceptivos más populares. La píldora, como también se le conoce, contiene una o dos hormonas (estrógenos y progesterona) que actúan impidiendo la ovulación
4.2 Indicaciones de uso, especificando las especies a las que va destinado
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 5 mg/ml solución inyectable para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Principio activo: Meloxicam Excipientes:
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 METRONIDAZOL 500 mg COMPRIMIDOS RECUBIERTOS ANTIPARASITARIO - ANTIPROTOZOARIO Página 1 METRONIDAZOL 500 mg Comprimidos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Glucosamina KERN PHARMA 1.500 mg polvo para solución oral EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
PROSPECTO. NOVARTIS FARMACEUTICA, S.A. Ronda Santa Maria, 158. Barbera del Valles 08210 (Barcelona) España
 PROSPECTO Lea todo el prospecto detenidamente antes de que a usted o a su hijo le sea administrado Lioresal por vía intratecal, ya que contiene información importante. Conserve este prospecto. Puede tener
PROSPECTO Lea todo el prospecto detenidamente antes de que a usted o a su hijo le sea administrado Lioresal por vía intratecal, ya que contiene información importante. Conserve este prospecto. Puede tener
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 BROMHEXINA 4 mg/5 ml JARABE MUCOLÍTICO, EXPECTORANTE Página 1 BROMHEXINA 4 mg/5 ml Jarabe Principio Activo Bromhexina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
Evaluación y consejería en anticoncepción: seguridad en la prescripción y criterios de elegibilidad
 Evaluación y consejería en anticoncepción: seguridad en la prescripción y criterios de elegibilidad Dra. Cristina irribarra Ávila Ginecóloga obstetra Prof. agregado Universidad de Chile Residente maternidad
Evaluación y consejería en anticoncepción: seguridad en la prescripción y criterios de elegibilidad Dra. Cristina irribarra Ávila Ginecóloga obstetra Prof. agregado Universidad de Chile Residente maternidad
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Zidoval 7,5 mg/g gel vaginal. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Metronidazol 0,75% p/p, 7,5 mg/g Ver excipientes sección 6.1.
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Zidoval 7,5 mg/g gel vaginal. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Metronidazol 0,75% p/p, 7,5 mg/g Ver excipientes sección 6.1.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Emeprid 1 mg/ml solución oral para perros y gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Documento Local del Producto
 1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
INFORMACIÓN DE PRESCRIPCIÓN COMPLETA: CONTENIDO* 1 INDICACIONES Y USO 2 DOSIFICACIÓN Y ADMINISTRACIÓN
 202-1269601 VERSIÓN MAESTRA EN ESPAÑOL Revisado: 06/2013 (Leuprolide acetate para suspensión depot) Lupron Depot-PED 7.5 mg Lupron Depot-PED 11.25 mg Uno y tres meses Lupron Depot-PED 15 mg Lupron Depot-PED
202-1269601 VERSIÓN MAESTRA EN ESPAÑOL Revisado: 06/2013 (Leuprolide acetate para suspensión depot) Lupron Depot-PED 7.5 mg Lupron Depot-PED 11.25 mg Uno y tres meses Lupron Depot-PED 15 mg Lupron Depot-PED
Cada ml de suspensión contiene 150 mg de acetato de medroxiprogesterona F. Eur. Depo-Progevera 150 mg/ml suspensión inyectable está indicada en:
 1. DENOMINACIÓN DEL MEDICAMENTO Depo-Progevera 150 mg/ml suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de suspensión contiene 150 mg de acetato de medroxiprogesterona F. Eur.
1. DENOMINACIÓN DEL MEDICAMENTO Depo-Progevera 150 mg/ml suspensión inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de suspensión contiene 150 mg de acetato de medroxiprogesterona F. Eur.
FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg
 FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg 1. DENOMINACIÓN Denominación Internacional MIRION Denominación del producto 17 B-Estradiol Valerato Micronizado 2. FÓRMULA QUÍMICA DEL PRINCIPIO
FOLLETO DE INFORMACIÓN AL PROFESIONAL MIRION COMPRIMIDOS 2 mg 1. DENOMINACIÓN Denominación Internacional MIRION Denominación del producto 17 B-Estradiol Valerato Micronizado 2. FÓRMULA QUÍMICA DEL PRINCIPIO
MENOPAUSIA Y SÍNDROME CLIMATERICO. Álex Pujol Sánchez Obstetricia y Ginecología Hospital Universitario Infanta Elena - Noviembre 2014
 MENOPAUSIA Y SÍNDROME CLIMATERICO Álex Pujol Sánchez Obstetricia y Ginecología Hospital Universitario Infanta Elena - Noviembre 2014 Caso clínico: Carmen, 47 años. Preocupada porque desde hace unos 6 meses
MENOPAUSIA Y SÍNDROME CLIMATERICO Álex Pujol Sánchez Obstetricia y Ginecología Hospital Universitario Infanta Elena - Noviembre 2014 Caso clínico: Carmen, 47 años. Preocupada porque desde hace unos 6 meses
Taller de capacitación en las Normas de Atención en Planificación Familiar
 Taller de capacitación en las Normas de Atención en Planificación Familiar METODOS HORMONALES Anticonceptivos Orales Combinados. Anticonceptivos Orales de Progestina sola. Inyectable Mensual Inyectable
Taller de capacitación en las Normas de Atención en Planificación Familiar METODOS HORMONALES Anticonceptivos Orales Combinados. Anticonceptivos Orales de Progestina sola. Inyectable Mensual Inyectable
FICHA TÉCNICA. Suspensión de color blanco o crema de aspecto lechoso que se dispersa fácilmente por agitación.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Maygace Altas Dosis 40 mg/ml suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de suspensión contiene 40 mg de acetato de megestrol micronizado Excipiente(s)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Maygace Altas Dosis 40 mg/ml suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de suspensión contiene 40 mg de acetato de megestrol micronizado Excipiente(s)
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
Plan de Estudios: 509 Licenciado/a en Medicina. Asignatura: Farmacología clínica. Itinerario de la asignatura: Quinto curso
 Licenciatura en Medicina - Facultad de Medicina Plan de Estudios: 509 Licenciado/a en Medicina Asignatura: 29098 Farmacología clínica Itinerario de la asignatura: Quinto curso Curso académico: 2010 2011
Licenciatura en Medicina - Facultad de Medicina Plan de Estudios: 509 Licenciado/a en Medicina Asignatura: 29098 Farmacología clínica Itinerario de la asignatura: Quinto curso Curso académico: 2010 2011
FICHA TÉCNICA. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada comprimido contiene: Acido ursodeoxicólico, 150 mg Excipientes: Ver 6.1.
 FICHA TÉCNICA URSOCHOL 1. NOMBRE DEL MEDICAMENTO URSOCHOL comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada comprimido contiene: Acido ursodeoxicólico, 150 mg Excipientes: Ver 6.1. 3. FORMA FARMACÉUTICA:
FICHA TÉCNICA URSOCHOL 1. NOMBRE DEL MEDICAMENTO URSOCHOL comprimidos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: Cada comprimido contiene: Acido ursodeoxicólico, 150 mg Excipientes: Ver 6.1. 3. FORMA FARMACÉUTICA:
PROSPECTO : INFORMACIÓN PARA EL USUARIO. Depo-Progevera 150 mg/ml suspensión inyectable Medroxiprogesterona
 PROSPECTO : INFORMACIÓN PARA EL USUARIO Depo-Progevera 150 mg/ml suspensión inyectable Medroxiprogesterona Lea todo el prospecto detenidamente antes de empezar a usar Depo-Progevera 150 mg/ml suspensión
PROSPECTO : INFORMACIÓN PARA EL USUARIO Depo-Progevera 150 mg/ml suspensión inyectable Medroxiprogesterona Lea todo el prospecto detenidamente antes de empezar a usar Depo-Progevera 150 mg/ml suspensión
SÍNDROME DE OVARIOS POLIQUÍSTICOS
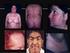 SÍNDROME DE OVARIOS POLIQUÍSTICOS Dr. Eric Saucedo de la Llata El Síndrome de Ovarios Poliquísticos (SOP) es la enfermedad endocrina (glandular) más común de las mujeres. Tiene una frecuencia del 5 al
SÍNDROME DE OVARIOS POLIQUÍSTICOS Dr. Eric Saucedo de la Llata El Síndrome de Ovarios Poliquísticos (SOP) es la enfermedad endocrina (glandular) más común de las mujeres. Tiene una frecuencia del 5 al
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
INFORMACION PARA PRESCRIBIR AMPLIA
 INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: TEALEP 2. Nombre Genérico: FINASTERIDA 3. Forma Farmacéutica y Formulación: Comprimidos. Cada comprimido contiene: Finasterida... 5 mg Excipiente
INFORMACION PARA PRESCRIBIR AMPLIA 1. Nombre Comercial: TEALEP 2. Nombre Genérico: FINASTERIDA 3. Forma Farmacéutica y Formulación: Comprimidos. Cada comprimido contiene: Finasterida... 5 mg Excipiente
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO Hodernal 800 mg/ml solución oral Parafina líquida 1. NOMBRE DEL MEDICAMENTO Hodernal 800 mg/ml solución oral. 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA. ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO ANASTROZOL NORMON 1 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 1 mg de anastrozol. Excipientes:
FICHA TÉCNICA. Sobres de granulado y comprimidos para administración oral.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MEGEFREN Sobres MEGEFREN 160 mg Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Un sobre contiene: Principio activo Megestrol acetato... 160 mg Excipientes(ver
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MEGEFREN Sobres MEGEFREN 160 mg Comprimidos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Un sobre contiene: Principio activo Megestrol acetato... 160 mg Excipientes(ver
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
PROSPECTO: INFORMACIÓN PARA EL USUARIO FARLUTAL 100 mg comprimidos Acetato de medroxiprogesterona
 PROSPECTO: INFORMACIÓN PARA EL USUARIO FARLUTAL 100 mg comprimidos Acetato de medroxiprogesterona Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
PROSPECTO: INFORMACIÓN PARA EL USUARIO FARLUTAL 100 mg comprimidos Acetato de medroxiprogesterona Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto,
CUESTIONARIO PREVIO DE LA PRACTICA No.6 EFECTOS TERAPEUTICOS Y ADVERSOS PRODUCIDOS DE LOS ANTICONCEPTIVOS " Profesoras : Semestre:
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN DEPARTAMENO DE CIENCIAS BIOLÓGICAS SECCIÓN BIOQUIMICA Y FARMACOLOGIA HUMANA LABORATORIO DE FARMACOLOGIA ESPECIAL CUESTIONARIO
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN DEPARTAMENO DE CIENCIAS BIOLÓGICAS SECCIÓN BIOQUIMICA Y FARMACOLOGIA HUMANA LABORATORIO DE FARMACOLOGIA ESPECIAL CUESTIONARIO
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca:
 Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
FICHA TÉCNICA. Por sobre: Acetato de calcio, 2,5 g (equivale a 635 mg de calcio), almidón de maíz, manitol (E421)
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO ROYEN 500 mg cápsula dura. ROYEN 2,5 g polvo para suspensión oral. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ROYEN 500 mg cápsula dura. Por cápsula: Acetato de
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Grupo Nº 19: Planificación Familiar
 Grupo Nº 19: Planificación Familiar Contenido TABLA Grupo Nº 19: Planificación Familiar... 2 CETROELIX... 2 DESOGESTREL Y ETINILESTRADIOL... 2 ETONOGESTREL... 3 LEVONORGESTREL... 3 LEVONORGESTREL Y ETINILESTRADIOL...
Grupo Nº 19: Planificación Familiar Contenido TABLA Grupo Nº 19: Planificación Familiar... 2 CETROELIX... 2 DESOGESTREL Y ETINILESTRADIOL... 2 ETONOGESTREL... 3 LEVONORGESTREL... 3 LEVONORGESTREL Y ETINILESTRADIOL...
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO. 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
FICHA TÉCNICA O RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Dextrometorfano Hidrobromuro Farmalider 15 mg cápsulas blandas 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextrometorfano
Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina.
 1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
1. NOMBRE DEL MEDICAMENTO Bilina 0,5 mg/ml colirio en suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene levocabastina (como hidrocloruro) equivalente a 0,5 mg de levocabastina. Excipiente
La cafeína también se puede usar para otras condiciones según lo determine su médico.
 Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg
 INFORMACIÓN PARA PRESCRIBIR AMPLIA Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg 1. DENOMINACIÓN DISTINTIVA BONADOXINA 2. DENOMINACIÓN GENÉRICA Meclozina/Piridoxina 3. FORMA FARMACÉUTICA Y FORMULACIÓN
INFORMACIÓN PARA PRESCRIBIR AMPLIA Bonadoxina Meclozina/Piridoxina Tableta 25mg / 50mg 1. DENOMINACIÓN DISTINTIVA BONADOXINA 2. DENOMINACIÓN GENÉRICA Meclozina/Piridoxina 3. FORMA FARMACÉUTICA Y FORMULACIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. ANTISHMANIA 300 mg/ml solución inyectable para perros
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMACIÓN DEL MEDICAMENTO VETERINARIO ANTISHMANIA 300 mg/ml solución inyectable para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA (ES,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMACIÓN DEL MEDICAMENTO VETERINARIO ANTISHMANIA 300 mg/ml solución inyectable para perros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA (ES,
LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe
 LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe LEXATUSSIN (Dextrometorfano Bromhidrato 15 mg/5 ml) Jarabe COMPOSICIÓN: Cada 100 ml de Jarabe contiene: Dextrometorfano Bromhidrato monohidrato...
LEXATUSSIN Dextrometorfano Bromhidrato 15 mg / 5 ml Jarabe LEXATUSSIN (Dextrometorfano Bromhidrato 15 mg/5 ml) Jarabe COMPOSICIÓN: Cada 100 ml de Jarabe contiene: Dextrometorfano Bromhidrato monohidrato...
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMIZOL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO IMIZOL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia
FICHA TÉCNICA. Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Sandoz 50 mg/g crema EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema de Aciclovir Sandoz 50 mg/g crema contiene 50 mg de aciclovir. Excipientes
Hipersensibilidad a cualquiera de los componentes de este producto.
 PROSCAR 5 mg TABLETAS RECUBIERTAS (Finasteride) PROSCAR (Finasteride) un compuesto sintético 4 azasteroide, es un inhibidor específico de la 5α - reductasa Tipo II, una enzima intracelular que metaboliza
PROSCAR 5 mg TABLETAS RECUBIERTAS (Finasteride) PROSCAR (Finasteride) un compuesto sintético 4 azasteroide, es un inhibidor específico de la 5α - reductasa Tipo II, una enzima intracelular que metaboliza
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO MILTEFORAN 20 mg/ml SOLUCIÓN ORAL PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO MILTEFORAN 20 mg/ml SOLUCIÓN ORAL PARA PERROS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Sustancia activa:
ANTICONCEPCIÓN HORMONAL
 ANTICONCEPCIÓN HORMONAL Autor: Dr. Julian Matías as Rodríguez Anticonceptivos orales combinados. Píldoras de progestágeno geno solo inyectables de progestágeno geno solo anticonceptivos inyectables combinados.
ANTICONCEPCIÓN HORMONAL Autor: Dr. Julian Matías as Rodríguez Anticonceptivos orales combinados. Píldoras de progestágeno geno solo inyectables de progestágeno geno solo anticonceptivos inyectables combinados.
PÍLDORA DEL DÍA DESPUÉS
 Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
2012 GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y LACTANCIA. Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE
 GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y CLASIFI FDA SEGÚN RIESGO EMBARAZO A Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE B C D Sin riesgos aparentes No existen pruebas de riesgo
GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y CLASIFI FDA SEGÚN RIESGO EMBARAZO A Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE B C D Sin riesgos aparentes No existen pruebas de riesgo
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HALOCUR 0,5 mg/ml solución oral para terneros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HALOCUR 0,5 mg/ml solución oral para terneros 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PROSPECTO: INFORMACIÓN PARA EL USUARIO. CITICOLINA Normon 1000 mg solución inyectable EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
PROSPECTO: INFORMACIÓN PARA EL USUARIO CITICOLINA Normon 1000 mg solución inyectable EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento, porque contiene información importante
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GastroGard 37% p/p pasta oral para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GastroGard 37% p/p pasta oral para caballos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo
1. NOMBRE DEL MEDICAMENTO. PREMELLE Cíclico 5 PREMELLE Cíclico COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 1. NOMBRE DEL MEDICAMENTO PREMELLE Cíclico 5 PREMELLE Cíclico 10 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA PREMELLE Cíclico 5 mg: Grageas de estrógenos conjugados (D.C.I.) USP* 0,625 mg y comprimidos de
1. NOMBRE DEL MEDICAMENTO PREMELLE Cíclico 5 PREMELLE Cíclico 10 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA PREMELLE Cíclico 5 mg: Grageas de estrógenos conjugados (D.C.I.) USP* 0,625 mg y comprimidos de
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
DANATROL Danazol (D.C.I.) Cápsulas
 agencia española de medicamentos y productos sanitarios DANATROL Danazol (D.C.I.) Cápsulas 1. DENOMINACIÓN DEL MEDICAMENTO Danatrol 50 cápsulas. Danatrol 100 cápsulas. Danatrol 200 cápsulas. 2. COMPOSICIÓN
agencia española de medicamentos y productos sanitarios DANATROL Danazol (D.C.I.) Cápsulas 1. DENOMINACIÓN DEL MEDICAMENTO Danatrol 50 cápsulas. Danatrol 100 cápsulas. Danatrol 200 cápsulas. 2. COMPOSICIÓN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO radio salil antiinflamatorio crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Salicilato
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO radio salil antiinflamatorio crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Salicilato
FICHA TÉCNICA. Cada vial (1,119 ml) contiene 25 mg de progesterona (concentración teórica de 22,35 mg/ml).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Prolutex 25 mg solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial (1,119 ml) contiene 25 mg de progesterona (concentración teórica de 22,35
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Prolutex 25 mg solución inyectable. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial (1,119 ml) contiene 25 mg de progesterona (concentración teórica de 22,35
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO REACTINE Levocabastina 0,5mg/ml colirio en suspensión. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml contiene: Levocabastina (como hidrocloruro) equivalente
PRINCIPIO Y FIN DE LA VIDA REPRODUCTIVA. Cambios puberales y menopausia.
 PRINCIPIO Y FIN DE LA VIDA REPRODUCTIVA Cambios puberales y menopausia. Definiciones Adrenarquia: Incremento de la secreción de andrógenos por las glándulas adrenales. Ocurre entre los 5 y los 20 años.
PRINCIPIO Y FIN DE LA VIDA REPRODUCTIVA Cambios puberales y menopausia. Definiciones Adrenarquia: Incremento de la secreción de andrógenos por las glándulas adrenales. Ocurre entre los 5 y los 20 años.
