Elementos de Fìsico-Química. UNEXPO Barquisimeto Octubre 2008.
|
|
|
- Roberto Montero Jiménez
- hace 6 años
- Vistas:
Transcripción
1 Capítulo 1 LIQUIDOS COMPARACIÓN ENTRE LOS ESTADOS GASEOSO, SÓLIDO Y LÍQUIDO Tabla 1 Propiedades de gases, líquidos y sólidos. Propiedad Gases Líquidos Sólidos Forma Adoptan la forma del Adoptan la forma del recipiente recipiente Forma propia Volumen Depende del recipiente Volumen propio. No que lo contenga depende del recipiente. Volumen propio Compresibilidad Muy compresibles Casi no se pueden comprimir No son compresibles Capacidad de fluir Fluyen muy fácilmente Fluyen No fluyen Alta densidad en Densidad relativa entre los Mayor que los gases, pero Muy baja densidad comparación con gases y estados menor que los sólidos líquidos Fuerzas intermoleculares Separación entre las moléculas Organización de las moléculas Movimiento de las moléculas Casi no existen Muy separadas Moléculas muy desorganizadas Se mueven constantemente en forma aleatoria Mayores que en los gases, pero menores que en los sólidos Más separadas que en los sólidos, mucho menos separadas que en los gases Más organizadas que los gases pero menos que los sólidos Se deslizan unas sobre otras Más fuertes que en gases y líquidos Muy juntas Muy organizadas (en los cristales) No se mueven, sólo vibran alrededor de posiciones fijas PROPIEDADES DE LOS LÍQUIDOS FUERZAS INTERMOLECULARES. Las fuerzas intermoleculares son fuerzas de atracción entre las moléculas. En un líquido estas fuerzas mantienen unidas a las moléculas tanto en el interior de un líquido, como en la superficie. Algunas propiedades características de sustancias en estado líquido se pueden explicar por la mayor o menor magnitud de las fuerzas intermoleculares. Por ejemplo, la temperatura de ebullición es más alta en aquellos líquidos con fuerzas intermoleculares de mayor magnitud. Otras propiedades como la tensión superficial, la viscosidad y la presión de vapor también dependen de las fuerzas intermoleculares. Prof. Marisela Luzardo 1 Capítulo 1 Líquidos
2 Figura 1 Atracción entre las moléculas de un líquido FUERZAS DE COHESIÓN Y ADHESIÓN. Las fuerzas intermoleculares que mantienen unidas las moléculas de una sustancia se denominan fuerzas de cohesión. Las fuerzas que unen esas moléculas a una superficie, se denominan fuerzas de adhesión. Un líquido contenido en un recipiente experimenta fuerzas de cohesión entre sus moléculas y fuerzas de adhesión a las paredes internas del recipiente donde se encuentra. Si las fuerzas de adhesión son mayores que las de cohesión, como sucede con el agua cuando está en un recipiente de vidrio, el líquido se pega al recipiente y tiende a subir por las paredes del recipiente, formando una curvatura (en forma de sonrisa) en la superficie del líquido. Por el contrario si las fuerzas de adhesión son menores que las fuerzas de cohesión, el líquido tiende a separarse del recipiente formando una curvatura contraria a la anterior, como sucede con el mercurio y el vidrio. En este caso se dice que el líquido no moja el recipiente. La curvatura que se forma en la superficie del líquido, por efecto de las diferencias de magnitud entre las fuerzas de cohesión y de adhesión, se denomina menisco y se observa con mayor intensidad cuando el líquido se encuentra dentro de un tubo delgado. La figura 2 muestra la forma del menisco del agua y del mercurio, cuando se encuentran en un recipiente de vidrio. Prof. Marisela Luzardo 2 Capítulo 1 Líquidos
3 Figura 2 Meniscos Agua Mercurio Fuerzas de adhesión > Fuerzas de cohesión Fuerzas de adhesión < Fuerzas de cohesión La capilaridad es una consecuencia del desbalance entre las fuerzas de adhesión y las de cohesión. Cuando la fuerza de adhesión es mayor que la de cohesión (agua en un tubo de vidrio) el líquido puede trepar por el interior de un tubo capilar, venciendo la fuerza de gravedad. Mientras más delgado el tubo, mayor altura alcanza el líquido. Esta propiedad permite a las plantas absorber agua y nutrientes por la raíz y llevarlos hasta las ramas y hojas. En el caso del mercurio, el líquido en lugar de trepar, desciende dentro de un tubo capilar que se introduzca en el líquido. Mientras más delgado el tubo más desciende. Figura 3 Capilaridad del agua y del mercurio Agua Mercurio Prof. Marisela Luzardo 3 Capítulo 1 Líquidos
4 TENSIÓN SUPERFICIAL. Es la energía necesaria para estirar o aumentar la superficie de un líquido por unidad de área. Las moléculas de la superficie son atraídas hacia el interior, formando una especie de piel. Los líquidos que presentan valores altos de tensión superficial poseen fuerzas intermoleculares grandes. En el caso del agua, posee fuerzas intermoleculares de considerable magnitud, lo que permite a algunos mosquitos pararse sobre la superficie y permanecer allí sin hundirse. De igual forma es posible colocar una aguja en forma horizontal sobre la superficie del agua, sin que se hunda. Las gotas de lluvia al caer tienen una forma esférica por efecto de las mismas fuerzas intermoleculares. La tensión superficial de los líquidos disminuye a medida que aumenta la temperatura, hasta que se alcanza la temperatura crítica, es a esa temperatura que la tensión superficial se hace cero. Uno de los métodos para determinar la tensión superficial, se basa en el ascenso (o descenso) del líquido dentro de un tubo capilar. Los datos necesarios para realizar la determinación incluyen el radio interno del tubo capilar, la densidad del líquido y la altura que alcanza el nivel dentro del capilar, medido desde la superficie del líquido que se encuentra fuera del tubo capilar. La fórmula a utilizar es la siguiente: γ = r h ρ g 2 γ Tensión superficial (dina/cm) r Radio interno del tubo capilar (cm) h Diferencia de altura del líquido dentro y fuera del capilar (cm) ρ Densidad del líquido (g/cm 3 ) g Aceleración de gravedad (980 cm/s 2 ) En caso de líquidos que no mojan el recipiente, la altura h se mide por debajo de la superficie del líquido externo al capilar. Prof. Marisela Luzardo 4 Capítulo 1 Líquidos
5 Ejercicio 1. Un líquido cuya densidad es 0,800 g/cm 3 asciende dentro de un tubo capilar de vidrio hasta alcanzar una altura de 6,25 cm sobre la superficie del líquido fuera del capilar. Si el diámetro interno del capilar es 0,210 mm, determine la tensión superficial del líquido. Respuesta: 25,7 dina/cm Ejercicio 2 La tensión superficial del mercurio es 480,3 dina/cm y su densidad es 13,595 g/cm 3. Si se desea que la altura dentro del capilar descienda 5,00 cm, Cuál es el diámetro interno del capilar de vidrio que se debe utilizar? Respuesta: 0,0144 cm VISCOSIDAD. Es una medida de la resistencia de un líquido a fluir. Esta propiedad tiene relación con la facilidad con que las moléculas individuales del líquido pueden moverse unas respecto a otras; depende de las fuerzas intermoleculares y de la existencia de características estructurales que pudieran hacer que las moléculas se enreden. La viscosidad disminuye al aumentar la temperatura, ya que al aumentar la energía cinética, las moléculas pueden vencer más fácilmente las fuerzas de cohesión. Si se imagina que el fluido está constituido por capas o planos de moléculas, una capa de fluido ofrece resistencia al movimiento o desplazamiento de las capas vecinas. Es un movimiento de láminas o capas de moléculas (fluido laminar) que están adyacentes. A ν 1 dy Flujo Laminar A ν 2 La fuerza requerida para mantener una diferencia de velocidad estacionaria (dν) entre dos planos paralelos, es directamente proporcional al área del plano (A) y a la diferencia de velocidades (dν) y es inversamente proporcional a la separación entre los planos (dy) Esa fuerza es igual a: f = η A ( dν dy ) Si se despeja η se obtiene : η = ( f A dν dy ) Prof. Marisela Luzardo 5 Capítulo 1 Líquidos
6 Donde: η f A dν dy Constante de proporcionalidad llamada coeficiente de viscosidad del fluido Fuerza por unidad de área, denominada fuerza de corte (F) Velocidad de corte (G) De lo anterior se obtiene que la viscosidad es la relación entre la fuerza de corte y la velocidad de corte: η = Fuerza de corte Velocidad de corte = F G El coeficiente de viscosidad es la fuerza requerida para mover una capa de fluido con una diferencia de velocidad de 1 cm/s respecto a otra capa situada a 1 cm de separación. Este coeficiente es una cantidad física característica de cada fluido y se expresa en poise o centipoise (10 2 poise) para los líquidos y en micropoise (10 6 poise) para los gases. 1 poise (P) equivale a 1 dina s /cm 2 Un fluido newtoniano es aquel en que la viscosidad es independiente de (dν / dy) Para un fluido no newtoniano la viscosidad varía a medida que lo hace (dν / dy) Las fuertes atracciones intermoleculares en un líquido impiden que fluya y hacen que la viscosidad η sea grande. Por lo tanto, los líquidos de elevada viscosidad tienen puntos de ebullición y calores de vaporización elevados. En los gases, la viscosidad se incrementa con la temperatura, mientras que en los líquidos sucede lo contrario: disminuye al aumentar la temperatura. En los líquidos la viscosidad aumenta cuando se aumenta la presión. La viscosidad de los líquidos también depende de la forma de las moléculas: las cadenas largas de los polímeros líquidos se enredan unas con otras dificultando el flujo, por lo tanto son altamente viscosos. Para determinar la viscosidad se puede utilizar la ecuación de Poiseville: η = π P r 4 8 L V t Prof. Marisela Luzardo 6 Capítulo 1 Líquidos
7 En esta ecuación V es el volumen del líquido de viscosidad η que fluye en un tiempo t por un tubo capilar de radio r y longitud L bajo una presión P Si se tiene un líquido de referencia cuya viscosidad se conozca y se usa un mismo tubo capilar, se puede determinar la relación de viscosidades: η1 = π P 1 r 4 t 1 8 L V P 1 t 1 η2 π P 2 r 4 t 2 P 2 t 2 8 L V = P1 y P2 son proporcionales a las densidades ( ρ ) de los líquidos, por lo tanto la ecuación anterior se transforma en: η1 P 1 t 1 = = ρ 1 t 1 η2 P 2 t 2 ρ 2 t 2 Si se conocen las densidades de dos líquidos y la viscosidad de uno de ellos (líquido de referencia) se pueden medir los tiempos y así determinar la viscosidad del otro líquido. El viscosímetro de Oswald permite determinar t1 y t2 Para medir la viscosidad se introduce el líquido de referencia en el viscosímetro y se hace subir el nivel hasta que alcance el punto a, se deja fluir y se mide el tiempo que demora en llegar hasta el punto b. Se lava bien el equipo y se repite la experiencia con el otro líquido que se desea evaluar. Conociendo las densidades de ambos líquidos, el tiempo que demora cada uno en vaciar el volumen especificado y la viscosidad de uno de ellos, se puede determinar la viscosidad del otro. Este procedimiento debe realizarse manteniendo el viscosímetro a temperatura constante en un baño. Prof. Marisela Luzardo 7 Capítulo 1 Líquidos
8 En el laboratorio se puede encontrar un viscosímetro de Oswald modificado, como el que se muestra en la figura 4. Otro de los métodos para determinar la viscosidad está relacionado con la caída libre de los cuerpos a través de un fluido y se basa en la ley de Stokes. El procedimiento consiste en dejar caer una bola de acero de densidad ρ conocida y se mide con un cronómetro el tiempo de caída entre dos marcas. Se repite el procedimiento con un líquido de referencia y se utiliza la siguiente ecuación: η1 = (ρ - ρ 1 ) t 1 η2 (ρ - ρ 2 ) t 2 Prof. Marisela Luzardo 8 Capítulo 1 Líquidos
9 A continuación la tabla 2 muestra las viscosidades de algunos líquidos comunes. Tabla 2 Viscosidad de algunos líquidos Líquido η 10-2 kg/(ms) Aceite de ricino 120 Agua Alcohol etílico Glicerina Mercurio En las industrias donde se utilizan tintas o pinturas, para evaluar la viscosidad se utiliza un equipo muy sencillo, como el que se muestra en la figura 5. La determinación consiste en medir el tiempo que demora un fluido (pintura) en salir de una pequeña copa que tiene un orificio en la base. Se compara con una pintura o tinta de referencia y así se determina si hay diferencia de viscosidades y si es necesario, agregar solvente (para disminuir viscosidad) o pigmento (para aumentarla). Figura 5. Viscosímetro para pinturas y tintas Prof. Marisela Luzardo 9 Capítulo 1 Líquidos
10 PROPIEDADES DEL AGUA En casi todas las sustancias conocidas, el estado líquido presenta una densidad intermedia entre el estado sólido (más denso) y el estado gaseoso (menos denso). Sin embargo, el hielo es menos denso que el agua líquida y por eso flota. Esto se debe a que las moléculas de agua se unen fuertemente entre sí por puentes de hidrógeno. El oxígeno de cada molécula de agua atrae a los hidrógenos de las moléculas vecinas. En estado líquido, los puentes de hidrógeno se forman y se rompen permitiendo el deslizamiento de unas moléculas sobre otras. Cuando la temperatura del agua disminuye y se acerca a 0ºC los puentes de hidrógeno obligan a las moléculas a acomodarse en una estructura tridimensional que permita la mínima repulsión y la máxima atracción; esta estructura ocupa un mayor volumen que el agua líquida, ya que los átomos de oxígeno deben rodearse de hidrógenos (atracción por puentes de hidrógeno) y no deben existir otros átomos de oxígeno cercanos (repulsión). Esta estructura molecular se evidencia en los cristales de nieve vistos al microscopio, que tienen forma hexagonal. Figura 6 Estructura del hielo H H Puentes de hidrógeno H H H H Prof. Marisela Luzardo 10 Capítulo 1 Líquidos
11 CAMBIOS DE FASE Se denomina cambio de fase al paso de una sustancia de un estado físico a otro: sólido, líquido o gas. La figura 7 muestra los cambios de fase que puede experimentar una sustancia y los nombres que reciben esos cambios. Figura 7 Cambios de fase. Gas Sublimación Evaporación Deposición Condensación Solidificación Fusión Sólido Líquido Cada cambio de fase va acompañado de un cambio de energía. El cambio de entalpía (energía) asociado a la fusión de un sólido se denomina calor de fusión ( Hfus). El calor necesario para evaporar un líquido a determinada temperatura, se denomina calor de vaporización ( Hvap). No es necesario que un líquido hierva para que se evapore: cuando la ropa mojada se tiende, el calor suministrado por el ambiente es suficiente para que el agua se evapore y así la ropa se seca. Se puede realizar el siguiente experimento: se toma un trozo de hielo y se le suministra calor, lentamente, en forma constante y se mide su temperatura. Al principio el hielo comienza a aumentar su temperatura hasta que llega a 0ºC. En ese momento comienza a fundirse, pero la temperatura no cambia hasta que todo el hielo se ha fundido. Luego el agua comienza a aumentar su temperatura hasta que alcanza 100 ºC y comienza a hervir; esa temperatura se mantiene constante hasta que toda el agua ha pasado a la fase de vapor. Luego el vapor aumenta su temperatura. Si se elabora un gráfico del experimento se obtendrá algo similar a lo que se muestra en la figura 8 Prof. Marisela Luzardo 11 Capítulo 1 Líquidos
12 Figura 8 Gráfica de calentamiento del agua. Temperatura (ºC) Ebullición Fusión tiempo Durante la fusión todo el calor suministrado se utiliza para vencer las fuerzas intermoleculares del sólido y pasar al estado líquido, por eso no aumenta la temperatura hasta que todo el hielo se ha derretido. Durante la ebullición ocurre algo similar, no hay aumento de temperatura hasta que toda el agua ha logrado vencer las fuerzas intermoleculares que las mantienen en estado líquido, para pasar a la fase de vapor. Esta propiedad permite cocinar en agua a una temperatura constante: la de ebullición del agua. Durante el calentamiento de una fase, el calor suministrado se puede calcular por la siguiente ecuación: q = masa de la sustancia x calor específico x T Durante un cambio de fase, el calor suministrado se puede calcular por la ecuación: q = cantidad de la sustancia (mol) x entalpía del cambio de fase ( Η) La tabla 3 de fase para el agua. muestra los valores (promedio) de calor específico y entalpías asociadas a los cambios Prof. Marisela Luzardo 12 Capítulo 1 Líquidos
13 Tabla 3 Datos de Calor específico y entalpía para el agua Calor específico (promedio) Hielo 2,09 J/g ºC Agua líquida 4,18 J/g ºC Vapor de agua 2,03 J/g ºC H de fusión del hielo 6,01 kj/mol (a 0ºC) H de vaporización del agua líquida 40,67 kj/mol (a 100 ºC) H de solidificación del agua 6,01 kj/mol (a 0ºC) H de condensación vaporización del vapor de agua 40,67 kj/mol (a 100 ºC) Ejemplo: Determine la cantidad de energía (kj) necesaria para calentar 360 g de hielo a 10ºC hasta llevarlo a vapor de agua a 110 ºC. Para resolver el problema hay que dividirlo en varias etapas: Etapa 1: Calentamiento del hielo desde 10ºC hasta 0ºC. q1 = 360 g de hielo x calor específico del hielo x T q1 = 360 g x 2,09 J/g ºC x [0 ºC (-10 ºC)] = 7,52 x 10 3 J = 7,52 kj Etapa 2: Fusión del hielo a 0ºC q2 = mol de hielo x H fusión q2 = 360 g de hielo x 1 mol H2O 18 g H2O x 6,01 kj/mol = 120 kj Etapa 3: Calentamiento del agua desde 0 ºC hasta 100 ºC. q3 = 360 g de agua x calor específico del agua líquida x T q3 = 360 g x 4,18 J/g ºC x (100 ºC 0 ºC) = 150 kj Etapa 4: Ebullición del agua. q4 = mol de agua x H vaporización q2 = 360 g de agua x 1 mol H2O 18 g H 2 O x 40,67 kj/mol = 813 kj Etapa 5: calentamiento del vapor de agua desde 100 hasta 110 ºC q 5 = 360 g de vapor x calor específico del vapor de agua x T q 5 = 360 g x 2,03 J/g ºC x (110 ºC 100 ºC) = 7,31 kj El calor total es la suma de todos ellos: q total = q1 + q2 + q3 + q4 + q5 = 1098 kj Prof. Marisela Luzardo 13 Capítulo 1 Líquidos
14 PRESIÓN DE VAPOR Si se coloca un líquido dentro de un recipiente vacío, se tapa herméticamente y se mantiene constante la temperatura, algunas moléculas de la superficie del líquido pueden vencer las fuerzas intermoleculares y saltar a la fase de vapor. Luego de un cierto tiempo, algunas de las moléculas que están en fase de vapor pueden condensarse y pasar al estado líquido. De esta forma se establece un equilibrio cuando la cantidad de moléculas en fase de vapor permanezca invariable, ya que por cada molécula que se evapora, una molécula se condensa. Las moléculas en fase de vapor ejercen presión dentro del recipiente, denominada presión de vapor. Esta presión es constante siempre que la temperatura permanezca constante. Si la temperatura aumenta, la cantidad de moléculas que se evaporan será mayor que las que se condensan, por lo tanto la presión de vapor aumentará. Existen líquidos que se evaporan muy fácilmente, son los líquidos volátiles (acetona, alcohol, gasolina, colonia). Tienen una presión de vapor alta, al contrario de los líquidos no volátiles cuyos valores de presión de vapor son bajos. líquidos. La figura 9 muestra la variación de la presión de vapor en función de la temperatura para varios Figura 9 Presión de vapor vs temperatura 2000 Pvap (mmhg) mmhg Agua Benceno Metanol Temperatura (ºC) La evaporación de un líquido a temperatura ambiente no es visible. Sin embargo, sí se puede ver cuando un líquido hierve. La evaporación no es lo mismo que la ebullición. La evaporación ocurre en un amplio rango de temperatura (entre el punto de fusión y el de ebullición), mientras la ebullición ocurre sólo cuando se alcanza el punto e ebullición. Prof. Marisela Luzardo 14 Capítulo 1 Líquidos
15 Se denomina punto de ebullición a la temperatura a la cual la presión de vapor del líquido se hace igual a la presión del ambiente. El punto de ebullición normal es la temperatura a la cual la presión de vapor se hace igual a 1,00 atmósfera. El punto de ebullición normal del agua es 100 ºC. De la figura se pueden obtener los valores para el benceno y el metanol, en el corte de las curvas con el valor de presión de 760 mmhg (1,00 atm). Si la presión del ambiente es menor de 1,00 atm, el agua hervirá a una temperatura menor a 100 ºC. Esto ocurre en lo alto de una montaña. En una olla de presión el agua hierve a más de 100 ºC, ya que la presión del ambiente dentro de la olla tapada, es mayor de 1,00 atm. PRESIÓN DE VAPOR Y TEMPERATURA La relación matemática entre los valores de presión de vapor de un líquido y la temperatura está dada por la ecuación de Clausius-Clapeyron: l n P1 P2 H vap = R 1 T2 1 T1 ó P1 log P2 H vap = 2,303 R 1 T2 1 T1 Donde: P1 y P2 son los valores de presión de vapor a las temperaturas absolutas T1 y T2. R es la constante de los gases, en unidades de energía: 8,314 J / mol K Ejemplo Determine la presión de vapor del etanol a 60 ºC si se sabe que a 34,9 ºC la presión de vapor es 100 mmhg y el H de vaporización del etanol es 39,3 kj/mol. Para resolver este problema se utiliza la ecuación de Clausius-Clapeyron: P1 = 100 mmhg T1 = 34,9 ºC = 307,9 K P2 =? T2 = 60,0 ºC = 333,0 K Hvap = 39,3 kj/mol = 39,3 x 10 3 J/mol l n P1 P2 = Hvap R 1 T2 1 T1 ln 100 mmhg P 2 3 J 39,3 x 10 = mol J 8,314 mol x K 1 333,0 K 1 307,9 = 1,202 K 100 mmhg = e P 2 1,202 = 0,301 P 2 = 100 mmhg 0,301 = 333 mmhg Prof. Marisela Luzardo 15 Capítulo 1 Líquidos
16 DIAGRAMA DE FASES El diagrama de fases de una sustancia describe en forma gráfica las relaciones entre las fases sólida, líquida y gas de una sustancia. La figura 10 muestra el diagrama de fases del agua (no está a escala). La gráfica se divide en tres zonas; cada una representa una fase pura. Cada línea indica las condiciones en que las fases adyacentes están en equilibrio. El punto en que se cruzan las tres líneas se denomina punto triple: única condición (temperatura y presión) en que pueden coexistir en equilibrio las tres fases. Para el agua este punto se encuentra a 0,01 ºC y 0,006 atmósferas. Los diagramas de fases permiten predecir los cambios que experimentan el punto de fusión el de ebullición cuando la presión varía. Para el agua a una presión de 1,00 atm el punto de fusión es 0,00 ºC y el de ebullición 100,0 ºC. Si la presión externa disminuye por debajo de 1,00 atm, el punto de fusión aumenta (ligeramente) y el de ebullición disminuye. Por ejemplo, en una montaña donde la presión atmosférica sea 0,54 atm, el punto de ebullición será 83 ºC y el punto de fusión tendrá un valor entre 0,00 y 0,01 ºC. Figura 10 Diagrama de fases del agua (No está a escala) 1,00 Presión (atm) 0,005 Sólido Líquido Gas 0 0, Temperatura (ºC) La figura 11 muestra el diagrama de fases del CO2. El punto triple se encuentra a 5,2 atm y 57 ºC. Se observa que la línea de equilibrio sólido-líquido se encuentra inclinada hacia la derecha, a diferencia de la del agua que se inclina hacia la izquierda. Este se debe a las propiedades del agua, fundamentalmente al hecho de que el hielo es menos denso que el agua líquida, mientras que en las demás sustancias el sólido es más denso que el líquido. La fase líquida del CO2 se encuentra a presiones mayores de 5,2 atm. Por lo tanto, a la presión de 1,00 atm o menos, el CO2 no puede existir en forma líquida. El hielo seco es CO2 sólido, cambia directamente de sólido a gas sin pasar por el estado líquido, por eso no moja. Prof. Marisela Luzardo 16 Capítulo 1 Líquidos
17 Figura 11 Diagrama de fases del CO2 (No está a escala) Presión (atm) 5,2 Sólido Líquido Gas 1, Temperatura (ºC) TEMPERATURA Y PRESION CRÍTICAS Si se coloca agua en un recipiente COMPLETAMENTE sellado y se aumenta lentamente la temperatura, la presión de vapor va aumentando. Se observa el menisco que separa la fase líquida de la fase de vapor. Al alcanzar determinada temperatura (374º C en el caso del agua) el menisco comienza a hacerse indefinido hasta que desaparece. Bajo estas condiciones, las propiedades del líquido y del vapor se hacen idénticas y no hay distinción entre ambas fases. Un líquido en esta condición se encuentra en su punto crítico. Prof. Marisela Luzardo 17 Capítulo 1 Líquidos
18 Para cada sustancia existe un valor de temperatura y de presión críticas. temperatura crítica, la sustancia no puede existir como líquido a ninguna presión. Por encima de la Por encima de la temperatura crítica la sustancia no es líquido ni es gas, se habla de un fluido super crítico. Estos fluidos tienen propiedades de líquidos y de gases SIMULTANEAMENTE. Pueden disolver sustancias. Una de las aplicaciones del CO2 super crítico es como solvente para extraer la cafeína del café y así obtener café descafeinado, que mantiene características de olor y sabor. Otra aplicación es la extracción de aceite de plantas oleaginosas, con la ventaja que el CO2 super crítico no es tóxico, como sí lo es el solvente que se utiliza normalmente en dicho proceso. Prof. Marisela Luzardo 18 Capítulo 1 Líquidos
UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO
 UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO 1. LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. CAMBIOS DE ESTADO Una misma sustancia
UNIDAD DIDÁCTICA 2. EL MODELO DE PARTÍCULAS DE LA MATERIA PROPUESTA DIDÁCTICA. LA MATERIA Y EL MODELO DOCUMENTO PARA EL ALUMNO 1. LOS ESTADOS DE AGREGACIÓN DE LA MATERIA. CAMBIOS DE ESTADO Una misma sustancia
Descripción de los 3 estados de la materia. Química General II Estados líquido y sólido. Diagrama de Fases
 Descripción de los 3 estados de la materia Química General II Estados líquido y sólido. Diagrama de Fases Estado Líquido El estado líquido se caracteriza por: Retener su volumen pero no su forma. No poder
Descripción de los 3 estados de la materia Química General II Estados líquido y sólido. Diagrama de Fases Estado Líquido El estado líquido se caracteriza por: Retener su volumen pero no su forma. No poder
UNIDAD 1 La materia y sus cambios
 UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias Organolépticas
Física y Química. 2º ESO. LA MATERIA Y SUS PROPIEDADES La materia. La materia es todo aquello que tiene masa y ocupa un espacio.
 La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La materia es todo aquello que tiene masa y ocupa un espacio. Es materia por tanto el plástico, el carbón, la madera, el aire, el agua, el hierro, etc. y no lo es la alegría, la tristeza, la velocidad,
La infinidad de cosas que nos rodean están constituidas de pequeñas partículas en movimiento.
 La infinidad de cosas que nos rodean están constituidas de pequeñas partículas en movimiento. Estas partículas no las podemos ver con nuestros ojos, pero las podemos imaginar así De los materiales que
La infinidad de cosas que nos rodean están constituidas de pequeñas partículas en movimiento. Estas partículas no las podemos ver con nuestros ojos, pero las podemos imaginar así De los materiales que
GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS
 A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
A FUERZAS INTERMOLECULARES GUÍA DE ESTUDIO N 4 SOLIDOS Y LÍQUIDOS 1. Menciona y describe las propiedades macroscópicas de los estados de agregación más comunes en que se presenta la materia. 2. Para cada
Líquidos. Unidad I. Elementos de Fisicoquímica Prof. Leadina Sánchez UNEXPO
 Líquidos. Unidad I Elementos de Fisicoquímica Prof. Leadina Sánchez UNEXPO Líquidos Fase de la materia entre sólidos y gases Fluidos cuyo volumenes constantes a Temperatura y Presión constantes Propiedades
Líquidos. Unidad I Elementos de Fisicoquímica Prof. Leadina Sánchez UNEXPO Líquidos Fase de la materia entre sólidos y gases Fluidos cuyo volumenes constantes a Temperatura y Presión constantes Propiedades
Líquido. Sólido. Gas Plasma. educacionsanitariaymas.blogspot.com.
 Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
Líquido Sólido www.juntadeandalucia.es educacionsanitariaymas.blogspot.com Gas Plasma www.palimpalem.com En el estado sólido las moléculas se encuentran muy juntas, tienen mucha cohesión. Las partículas
ESTADOS DE LA MATERIA
 ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
ESTADOS DE LA MATERIA M en C Alicia Cea Bonilla 1 Existen tres estados de la materia: sólido, líquido y gaseoso, dependiendo de la distancia entre sus partículas, de las fuerzas de atracción entre éstas
Capítulo 10. Efectos de superficie. Sistema respiratorio
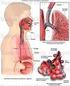 Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
Capítulo 10 Efectos de superficie. Sistema respiratorio 1 Tensión superficial El coeficiente de tensión superficial γ es la fuerza por unidad de longitud que hay que realizar para aumentar una superficie:
NOMBRE: CURSO: HOJAS DE ACTIVIDADES FÍSICA Y QUÍMICA 3º DE ESO
 NOMBRE: CURSO: HOJAS DE ACTIVIDADES FÍSICA Y QUÍMICA 3º DE ESO Tema 2 LOS SISTEMAS MATERIALES ACTIVIDAD 1: La materia 1- Qué es la materia? 2- Qué diferencia hay entre materia y sustancia? 3-Diferencia
NOMBRE: CURSO: HOJAS DE ACTIVIDADES FÍSICA Y QUÍMICA 3º DE ESO Tema 2 LOS SISTEMAS MATERIALES ACTIVIDAD 1: La materia 1- Qué es la materia? 2- Qué diferencia hay entre materia y sustancia? 3-Diferencia
EFECTO DEL CALOR SOBRE LA MATERIA
 EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
EFECTO DEL CALOR SOBRE LA MATERIA MATERIA: es todo aquello que ocupa un lugar en el espacio y tiene masa LOS EFECTOS QUE PRODUCE EL CALOR SOBRE LA MATERIA SE PUEDEN CLASIFICAR EN: * CAMBIOS FÍSICOS. *
QUÉ ES LA TEMPERATURA?
 1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
1 QUÉ ES LA TEMPERATURA? Nosotros experimentamos la temperatura todos los días. Cuando estamos en verano, generalmente decimos Hace calor! y en invierno Hace mucho frío!. Los términos que frecuentemente
Los estados de la materia.
 Los estados de la materia. Cómo se presenta la materia? Vamos a comenzar por recapitular todo lo aprendido hasta ahora: La materia es todo aquello de lo que están hechas las cosas. La materia tiene dos
Los estados de la materia. Cómo se presenta la materia? Vamos a comenzar por recapitular todo lo aprendido hasta ahora: La materia es todo aquello de lo que están hechas las cosas. La materia tiene dos
COLEGIO DE BACHILLERES DEL ESTADO DE QUERÉTARO Plantel No. 7 El Marqués GUIA DE REGULARIZACIÓN DE FÍSICA II UNIDAD 1
 UNIDAD 1 I. INTRODUCCIÓN 1. Investiga y resume los siguientes conceptos: a. HIDRODINÁMICA: b. HIDROSTÁTICA: c. HIDRÁULICA 2. Investiga y resume en qué consiste cada una de las características de los fluidos
UNIDAD 1 I. INTRODUCCIÓN 1. Investiga y resume los siguientes conceptos: a. HIDRODINÁMICA: b. HIDROSTÁTICA: c. HIDRÁULICA 2. Investiga y resume en qué consiste cada una de las características de los fluidos
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
2..folleto 1 Propiedades de los Líquidos: Los líquidos retienen su volumen, pero no retienen su forma Los líquidos no se pueden comprimir
 2..folleto 1 Propiedades de los Líquidos: Las distancias relativamente pequeñas que existen entre las moléculas de los líquidos dan origen a las siguientes propiedades: Los líquidos retienen su volumen,
2..folleto 1 Propiedades de los Líquidos: Las distancias relativamente pequeñas que existen entre las moléculas de los líquidos dan origen a las siguientes propiedades: Los líquidos retienen su volumen,
Ejercicios relacionados con líquidos y sólidos
 Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Ejercicios relacionados con líquidos y sólidos. La presión de vapor del etanol es de 35,3 mmhg a 40 o C y 542,5 mmhg a 70 o C. Calcular el calor molar de vaporización y la presión del etanol a 50 o C.
Dinámica de Fluidos. Mecánica y Fluidos VERANO
 Dinámica de Fluidos Mecánica y Fluidos VERANO 1 Temas Tipos de Movimiento Ecuación de Continuidad Ecuación de Bernouilli Circulación de Fluidos Viscosos 2 TIPOS DE MOVIMIENTO Régimen Laminar: El flujo
Dinámica de Fluidos Mecánica y Fluidos VERANO 1 Temas Tipos de Movimiento Ecuación de Continuidad Ecuación de Bernouilli Circulación de Fluidos Viscosos 2 TIPOS DE MOVIMIENTO Régimen Laminar: El flujo
8 Equilibrios entre sólido, líquido y gas
 82 Química General. Grupo B. Curso 1993/94 8 Equilibrios entre sólido, líquido y gas 8.1 Equilibrio líquido gas 8.2 El punto crítico 8.3 Equilibrio sólido gas 8.4 Equilibrio sólido líquido gas, diagrama
82 Química General. Grupo B. Curso 1993/94 8 Equilibrios entre sólido, líquido y gas 8.1 Equilibrio líquido gas 8.2 El punto crítico 8.3 Equilibrio sólido gas 8.4 Equilibrio sólido líquido gas, diagrama
Práctica No 12. Determinación experimental de la Presión de vapor de un líquido puro
 Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
Práctica No 12 Determinación experimental de la Presión de vapor de un líquido puro 1. Objetivo general: Evaluar la entalpía de vaporización mediante el modelo de Clausius y Clapeyron. 2. Marco teórico:
7. EQUILIBRIO DE FASES EN SUSTANCIAS PURAS
 - 130-7. EQUILIBRIO DE FASES EN SUSTANCIAS PURAS Una sustancia pura puede tener una sola fase (sólida, líquida o gaseosa) o dos o tres fases en equilibrio, dependiendo de las condiciones de presión y temperatura.
- 130-7. EQUILIBRIO DE FASES EN SUSTANCIAS PURAS Una sustancia pura puede tener una sola fase (sólida, líquida o gaseosa) o dos o tres fases en equilibrio, dependiendo de las condiciones de presión y temperatura.
menisco. volumen de un líquido
 La determinación del volumen de un material se puede hacer con el uso de un instrumento volumétrico como el cilindro graduado la pipeta, la bureta u otro similar. La lectura correcta del volumen en el
La determinación del volumen de un material se puede hacer con el uso de un instrumento volumétrico como el cilindro graduado la pipeta, la bureta u otro similar. La lectura correcta del volumen en el
Gases...1. Características: Volumen:...1. Temperatura:
 Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
Índice de contenido Gases......1 Características:......1 Volumen:......1 Temperatura:......1 Presión:......2 Medición de presiones:......2 Ley de Boyle (relación presión volumen):......2 Ley de Charles
LA MATERIA: ESTADOS DE AGREGACIÓN
 LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
LA MATERIA: ESTADOS DE AGREGACIÓN 1. PROPIEDADES DE LA MATERIA Materia: es todo aquello que existe, tiene masa y ocupa un volumen, los distintos tipos de materia se llaman sustancias. El sistema material
Práctica No 13. Determinación de la calidad de vapor
 Práctica No 13 Determinación de la calidad de vapor 1. Objetivo general: Determinar la cantidad de vapor húmedo generado a presión atmosférica. 2. Marco teórico: Entalpía del sistema: Si un sistema consiste
Práctica No 13 Determinación de la calidad de vapor 1. Objetivo general: Determinar la cantidad de vapor húmedo generado a presión atmosférica. 2. Marco teórico: Entalpía del sistema: Si un sistema consiste
Profesora: Rocío Fuenzalida Díaz CURSO: 7 Básico FECHA PRUEBA: 22 /06/ NOMBRE APELLIDO PATERNO APELLIDO MATERNO
 TEMARIO-GUÍA SEMESTRAL FISICA N L: Profesora: Rocío Fuenzalida Díaz CURSO: 7 Básico FECHA PRUEBA: 22 /06/ 2016. NOMBRE APELLIDO PATERNO APELLIDO MATERNO A.- TEMARIO Fecha asignatura Contenido 22/06 Física
TEMARIO-GUÍA SEMESTRAL FISICA N L: Profesora: Rocío Fuenzalida Díaz CURSO: 7 Básico FECHA PRUEBA: 22 /06/ 2016. NOMBRE APELLIDO PATERNO APELLIDO MATERNO A.- TEMARIO Fecha asignatura Contenido 22/06 Física
La masa del cubo se mediría con una balanza. Para medir su volumen, mediríamos la 3
 CIENCIAS DE LA NATURALEZA SOLUCIONES DE LA PÁGINA 7 La masa del cubo se mediría con una balanza. Para medir su volumen, mediríamos la 3 longitud de la arista y la elevaríamos al cubo (l ). Si el cubo de
CIENCIAS DE LA NATURALEZA SOLUCIONES DE LA PÁGINA 7 La masa del cubo se mediría con una balanza. Para medir su volumen, mediríamos la 3 longitud de la arista y la elevaríamos al cubo (l ). Si el cubo de
Diagrama de fases de una sustancia pura: el agua
 Diagrama de fases de una sustancia pura: el agua Apellidos, nombre Departamento Centro Lorena Atarés Huerta (loathue@tal.upv.es) Tecnología de Alimentos Escuela Técnica Superior de Ingeniería Agronómica
Diagrama de fases de una sustancia pura: el agua Apellidos, nombre Departamento Centro Lorena Atarés Huerta (loathue@tal.upv.es) Tecnología de Alimentos Escuela Técnica Superior de Ingeniería Agronómica
TEMA 2: PROPIEDADES FÍSICAS DE LOS FLUIDOS
 Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
Manual para el diseño de una red hidráulica de climatización 3 A ntes de comenzar a estudiar cualquier problema de flujo, es necesario conocer algunas características y propiedades físicas de los fluidos,
MATERIAL DE APOYO DE USO ESCLUSIVO DEL CENTRO DE ESTUDIOS MATEMÁTICOS. C.E.M.
 1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
1-. Una cubeta con hielo recibe constantemente calor de un B. mechero como se aprecia en la figura. C. D. De la gráfica de temperatura como función del tiempo, para la muestra, se concluye que entre A.
HIDRODINÁMICA. Profesor: Robinson Pino H.
 HIDRODINÁMICA Profesor: Robinson Pino H. 1 CARACTERÍSTICAS DEL MOVIMIENTO DE LOS FLUIDOS Flujo laminar: Ocurre cuando las moléculas de un fluido en movimiento siguen trayectorias paralelas. Flujo turbulento:
HIDRODINÁMICA Profesor: Robinson Pino H. 1 CARACTERÍSTICAS DEL MOVIMIENTO DE LOS FLUIDOS Flujo laminar: Ocurre cuando las moléculas de un fluido en movimiento siguen trayectorias paralelas. Flujo turbulento:
FUNDAMENTOS DE FÍSICA TEMA II GRADIENTE DE PRESIÓN
 FUNDAMENTOS DE FÍSICA TEMA II GRADIENTE DE PRESIÓN 1. Se tiene un manómetro diferencial que está cerrado en una de sus ramas como lo muestra la figura. Con base en ello, determine: a) La presión absoluta
FUNDAMENTOS DE FÍSICA TEMA II GRADIENTE DE PRESIÓN 1. Se tiene un manómetro diferencial que está cerrado en una de sus ramas como lo muestra la figura. Con base en ello, determine: a) La presión absoluta
Profesora: Teresa Esparza Araña ASPECTOS CUANTITATIVOS DE LA QUÍMICA. UNIDAD 2: Los gases ideales
 Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Departamento de Física y Química Profesora: Teresa Esparza Araña CEAD P. Félix Pérez Parrilla ASPECTOS CUANTITATIVOS DE LA QUÍMICA UNIDAD 2: Los gases ideales ÍNDICE 1. LOS GASES SEGÚN LA TEORÍA CINÉTICA
Saint Gaspar College MISIONEROS DE LA PRECIOSA SANGRE Formando Personas Integras
 DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA MISS YORMA RIVERA M. PROF. JONATHAN CASTRO F. Estados de la materia Saint Gaspar College MISIONEROS DE LA PRECIOSA SANGRE Formando Personas Integras H i d r o s t
DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA MISS YORMA RIVERA M. PROF. JONATHAN CASTRO F. Estados de la materia Saint Gaspar College MISIONEROS DE LA PRECIOSA SANGRE Formando Personas Integras H i d r o s t
La materia. Los gases
 1 La materia. Los gases 1 La materia y sus estados de agregación Características de los estados de la materia La materia se puede presentar en varios estados de agregación: sólido, líquido y gas, que tienen
1 La materia. Los gases 1 La materia y sus estados de agregación Características de los estados de la materia La materia se puede presentar en varios estados de agregación: sólido, líquido y gas, que tienen
UNIDAD 6 - LA MATERIA
 UNIDAD 6 - LA MATERIA La materia es todo lo que pesa y ocupa un lugar en el espacio. A través de los sentidos (vista, oído, tacto, gusto y olfato) recibimos y percibimos información sobre todo lo que nos
UNIDAD 6 - LA MATERIA La materia es todo lo que pesa y ocupa un lugar en el espacio. A través de los sentidos (vista, oído, tacto, gusto y olfato) recibimos y percibimos información sobre todo lo que nos
EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA
 EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA I. OBJETIVO GENERAL Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de
EQUILIBRIO LÍQUIDO-VAPOR PRESIÓN DE VAPOR Y ENTALPÍA DE VAPORIZACIÓN DEL AGUA I. OBJETIVO GENERAL Comprender e interpretar el significado de las variables termodinámicas involucradas en la ecuación de
Conductividad en presencia de campo eléctrico
 6. Fenómenos de transporte Fenómenos de transporte Conductividad térmicat Viscosidad Difusión n sedimentación Conductividad en presencia de campo eléctrico UAM 01-13. Química Física. Transporte CT V 1
6. Fenómenos de transporte Fenómenos de transporte Conductividad térmicat Viscosidad Difusión n sedimentación Conductividad en presencia de campo eléctrico UAM 01-13. Química Física. Transporte CT V 1
FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN
 1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
1 Física y Química 3º Curso Educación Secundaria Obligatoria Curso académico 2015/2016 FÍSICA Y QUÍMICA TEMA 2: LA MATERIA Y SUS ESTADOS DE AGREGACIÓN 2 Física y Química 3º Curso Educación Secundaria Obligatoria
La energía interna. Nombre Curso Fecha
 Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
Ciencias de la Naturaleza 2.º ESO Unidad 10 Ficha 1 La energía interna La energía interna de una sustancia está directamente relacionada con la agitación o energía cinética de las partículas que la componen.
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS
 DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
DIFERENCIA ENTRE FLUIDOS Y SÓLIDOS Se le llama fluido a toda aquella sustancia continua que puede fluir. Los fluidos pueden ser gaseosos y líquidos. Esta es la diferencia fundamental entre un sólido, cuya
3. PROPIEDADES Y ESTADOS
 3. PROPIEDADES Y ESTADOS 3.1 LOS CONCEPTOS DE PROPIEDAD Y ESTADO La propiedad es cualquier característica o atributo que se puede evaluar cuantitativamente El volumen La masa La energía La temperatura
3. PROPIEDADES Y ESTADOS 3.1 LOS CONCEPTOS DE PROPIEDAD Y ESTADO La propiedad es cualquier característica o atributo que se puede evaluar cuantitativamente El volumen La masa La energía La temperatura
FÍSICA CICLO 5 CAPACITACIÓN La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades.
 UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
UNIDAD 5 TERMODINÁMICA - HIDRAULICA TERMODINÁMICA La Termodinámica es el estudio de las propiedades de la energia térmica y de sus propiedades. ENERGIA TERMICA: Todos los cuerpos se componen de pequeñas
La presión y sus efectos Presión en sólidos Actividad:
 La presión y sus efectos Presión en sólidos Por ejemplo, si una persona desea clavar sobre una viga de madera, le resultará mucho más fácil utilizar un clavo cuya punta es fina que otro cuya punta se encuentra
La presión y sus efectos Presión en sólidos Por ejemplo, si una persona desea clavar sobre una viga de madera, le resultará mucho más fácil utilizar un clavo cuya punta es fina que otro cuya punta se encuentra
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
CARÁCTERÍSTICAS DE LOS GASES
 DILATACIÓN EN LOS GASES - CARACTERÍSTICAS DE LOS GASES - PRESIÓN EN LOS GASES: CAUSAS Y CARACTERÍSTICAS - MEDIDA DE LA PRESIÓN DE UN GAS: MANÓMETROS - GAS EN CONDICIONES NORMALES - DILATACIÓN DE LOS GASES
DILATACIÓN EN LOS GASES - CARACTERÍSTICAS DE LOS GASES - PRESIÓN EN LOS GASES: CAUSAS Y CARACTERÍSTICAS - MEDIDA DE LA PRESIÓN DE UN GAS: MANÓMETROS - GAS EN CONDICIONES NORMALES - DILATACIÓN DE LOS GASES
P V = n R T LEYES DE LOS GASES
 P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
P V = n R T LEYES DE LOS GASES Estado gaseoso Medidas en gases Leyes de los gases Ley de Avogadro Leyes de los gases Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea.
 Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
Sustancia que tiene una composición química fija. Una sustancia pura no tiene que ser de un solo elemento, puede ser mezcla homogénea. Mezcla de aceite y agua Mezcla de hielo y agua Las sustancias existen
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
LOS GASES Y LAS DISOLUCIONES. Departamento de Física y Química 3º ESO
 LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
LOS GASES Y LAS DISOLUCIONES Departamento de Física y Química 3º ESO 0. Mapa conceptual SÓLIDO ESTADOS DE LA MATERIA LÍQUIDO Presión atmosférica GAS Solubilidad Disolución saturada Disoluciones Soluto
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
Propiedades de la materia. Características de sólidos, líquidos y gases
 Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Propiedades de la materia Características de sólidos, líquidos y gases Fluidos Líquidos Ej: H 2 O Estados de la materia Gases Ej: O 2 Amorfos Ej: caucho Cristalinos Ej: sal, azúcar Sólidos Metálicos Enlace
Picnómetro: Medidas de Densidad.
 1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
GASES IDEALES. Contiene una mezcla de gases CP + O 2. Volumen = 1 litro Temperatura = 23 C = ,15 = 298,15K =585 = 0,7697 =250 = 0,3289
 GASES IDEALES PROBLEMA 10 Mezclas de los gases ciclopropano (C 3H 8) y oxígeno se utilizan mucho como anestésicos. a) Cuántos moles de cada gas están presentes en un recipiente de 1 litro a 23 C, si la
GASES IDEALES PROBLEMA 10 Mezclas de los gases ciclopropano (C 3H 8) y oxígeno se utilizan mucho como anestésicos. a) Cuántos moles de cada gas están presentes en un recipiente de 1 litro a 23 C, si la
FISICOQUIMICA. La energía total de un sistema puede ser: externa, interna o de tránsito. CLASIFICACION TIPOS DETERMINACION Energía Potencial:
 FISICOQUIMICA ENERGIA: No puede definirse de forma precisa y general, sin embargo, puede decirse que es la capacidad para realizar trabajo. No se puede determinar de manera absoluta, solo evaluar los cambios.
FISICOQUIMICA ENERGIA: No puede definirse de forma precisa y general, sin embargo, puede decirse que es la capacidad para realizar trabajo. No se puede determinar de manera absoluta, solo evaluar los cambios.
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES
 PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
PROPIEDADES COLIGATIVAS DE LAS SOLUCIONES Los estudios teóricos y experimentales han permitido establecer, que los líquidos poseen propiedades físicas características. Entre ellas cabe mencionar: la densidad,
2/17/2013. La fuerza que mantiene unidos a los átomos de unamolécula. Es una fuerza química o intramolecular.
 FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
FUERZAS INTERMOLECULARES Comparación molecular de gases, líquidos y sólidos Viscosidad y tensión superficial Cambios de fase Volatilidad, presión de vapor y punto de ebullición Fuerzas intramoleculares
GUIA: GASES y LEYES QUE LOS RIGEN
 DEPARTAMENTO DE CIENCIAS QUÍMICA Sèptimo Básico GUIA: GASES y LEYES QUE LOS RIGEN 1_ La ley de Gay-Lussac nos dice que, a volumen constante, la presión y la temperatura de un gas son directamente proporcionales
DEPARTAMENTO DE CIENCIAS QUÍMICA Sèptimo Básico GUIA: GASES y LEYES QUE LOS RIGEN 1_ La ley de Gay-Lussac nos dice que, a volumen constante, la presión y la temperatura de un gas son directamente proporcionales
Ciencias III, énfasis en Química
 ASIGNATURA: GRADO: BLOQUE APRENDIZAJE ESPERADO CONTENIDO PROGRAMÁTICO Ciencias III, énfasis en Química Tercero I.- Las características de los materiales. Identifica las propiedades extensivas (masa y volumen)
ASIGNATURA: GRADO: BLOQUE APRENDIZAJE ESPERADO CONTENIDO PROGRAMÁTICO Ciencias III, énfasis en Química Tercero I.- Las características de los materiales. Identifica las propiedades extensivas (masa y volumen)
Mecánica de fluidos. Fis 018- Ref. Capitulo 10 Giancoli Vol II. 6ta ed. 23 de octubre de 2016
 Mecánica de fluidos Fis 018- Ref. Capitulo 10 Giancoli Vol II. 6ta ed. 23 de octubre de 2016 ESTATICA DE FLUIDOS 1. Estados de la materia 2. Propiedades de los fluidos 3. Volumen, densidad y peso específico,
Mecánica de fluidos Fis 018- Ref. Capitulo 10 Giancoli Vol II. 6ta ed. 23 de octubre de 2016 ESTATICA DE FLUIDOS 1. Estados de la materia 2. Propiedades de los fluidos 3. Volumen, densidad y peso específico,
HIDRAULICA DE POTENCIA. Unidad 1. Bases físicas de la hidráulica
 HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
HIDRAULICA DE POTENCIA Unidad 1. Bases físicas de la hidráulica Presión Este término se refiere a los efectos de una fuerza que actúa distribuida sobre una superficie. La fuerza causante de la presión
ESTO NO ES UN EXAMEN, ES UNA HOJA DEL CUADERNILLO DE EJERCICIOS. Heroica Escuela Naval
 CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
CUADERNILLO DE FÍSICA. TERCER GRADO. I.- SUBRAYE LA RESPUESTA CORRECTA EN LOS SIGUIENTES ENUNCIADOS. 1.- CUANDO DOS CUERPOS CON DIFERENTE TEMPERATURA SE PONEN EN CONTACTO, HAY TRANSMISIÓN DE: A) FUERZA.
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
convección (4.1) 4.1. fundamentos de la convección Planteamiento de un problema de convección
 convección El modo de transferencia de calor por convección se compone de dos mecanismos de transporte, que son, la transferencia de energía debido al movimiento aleatorio de las moléculas (difusión térmica)
convección El modo de transferencia de calor por convección se compone de dos mecanismos de transporte, que son, la transferencia de energía debido al movimiento aleatorio de las moléculas (difusión térmica)
MECANICA DE FLUIDOS [ ] kg m
![MECANICA DE FLUIDOS [ ] kg m MECANICA DE FLUIDOS [ ] kg m](/thumbs/52/29499799.jpg) MECANICA DE FLUIDOS DEFINICIÓN.- Es parte de la física clásica que tiene por objeto el estudio de los fluidos, sus principios y las leyes que lo establecen; la materia se clasifica en sólidos y fluidos,
MECANICA DE FLUIDOS DEFINICIÓN.- Es parte de la física clásica que tiene por objeto el estudio de los fluidos, sus principios y las leyes que lo establecen; la materia se clasifica en sólidos y fluidos,
Módulo 3: Fluidos reales
 Módulo 3: Fluidos reales 1 Fluidos reales Según la ecuación de Bernouilli, si un fluido fluye estacionariamente (velocidad constante) por una tubería horizontal estrecha y de sección transversal constante,
Módulo 3: Fluidos reales 1 Fluidos reales Según la ecuación de Bernouilli, si un fluido fluye estacionariamente (velocidad constante) por una tubería horizontal estrecha y de sección transversal constante,
M E C Á N I C A. El Torbellino. El Torbellino
 M E C Á N I C A M E C Á N I C A Los torbellinos o vórtices se forman en fluidos (gases y líquidos) en movimiento. Para describir el movimiento de un fluido (según Euler) se necesita determinar en cada
M E C Á N I C A M E C Á N I C A Los torbellinos o vórtices se forman en fluidos (gases y líquidos) en movimiento. Para describir el movimiento de un fluido (según Euler) se necesita determinar en cada
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA
 BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
BLOQUE 1: ASPECTOS CUANTATIVOS DE LA QUÍMICA Unidad 2: Los gases ideales Teresa Esparza araña 1 Índice 1. Los estados de agregación de la materia a. Los estados de la materia b. Explicación según la teoría
Comportamiento de las partículas que conforman la materia (estados solido, liquido y gaseoso)
 Comportamiento de las partículas que conforman la materia (estados solido, liquido y gaseoso) Objetivo: Describir y comunicar el comportamiento de las partículas en sus diferentes estados. Situación problema:
Comportamiento de las partículas que conforman la materia (estados solido, liquido y gaseoso) Objetivo: Describir y comunicar el comportamiento de las partículas en sus diferentes estados. Situación problema:
GASES. Contenidos. Leyes de los gases y su aplicación en la resolución de problemas numéricos.
 GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
GASES Contenidos Postulados de la teoría cinética de los gases y su relación con las características (expansión, comprensión y difusión) y las propiedades ( presión, volumen y temperatura) que los definen.
Tema 1.5 Propiedades físicas de la materia. Tema 1.6 Cambios de estado
 Tema 1.5 Propiedades físicas de la materia Tema 1.6 Cambios de estado 1 Propiedades organolépticas Propiedades físicas Propiedades químicas Propiedades intensivas Propiedades extensivas 2 Las propiedades
Tema 1.5 Propiedades físicas de la materia Tema 1.6 Cambios de estado 1 Propiedades organolépticas Propiedades físicas Propiedades químicas Propiedades intensivas Propiedades extensivas 2 Las propiedades
TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL
 1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
1 TEMA 7: POROSIDAD Y ÁREA SUPERFICIAL 1.- Clasificación de los poros de acuerdo a su tamaño Los materiales porosos se clasifican como microporosos con un tamaño de poro de 0.3-2 nm, mesoporosos de 2-50
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA
 PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
NOCIONES BASICAS ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS.
 SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
SUSTANCIA: ES LA MATERIA QUE INTEGRA UN CUERPO SÓLIDO, UN LIQUIDO O UN GAS. SUSTANCIA DE TRABAJO: ES LA PORCIÓN DE MATERIA QUE ACTUANDO EN UN SISTEMA ES CAPAZ DE ABSORBER O CEDER ENERGÍA. EN ESE PROCESO
Práctica No 9. Ley Cero de la Termodinámica y su aplicación en El establecimiento de una escala empírica de temperatura.
 Práctica No 9 Ley Cero de la Termodinámica y su aplicación en El establecimiento de una escala empírica de temperatura. 1. Objetivo general: Establecer empíricamente una escala de temperatura, aplicándose
Práctica No 9 Ley Cero de la Termodinámica y su aplicación en El establecimiento de una escala empírica de temperatura. 1. Objetivo general: Establecer empíricamente una escala de temperatura, aplicándose
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES. Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile
 Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
Mecánica II GONZALO GUTÍERREZ FRANCISCA GUZMÁN GIANINA MENESES Universidad de Chile, Facultad de Ciencias, Departamento de Física, Santiago, Chile Guía 4: Mecánica de fluidos Martes 25 de Septiembre, 2007
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas.
 LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
LA MATERIA 1. Teoría atómica de Dalton. 2. La materia. 3. Leyes químicas. 4. El mol. 5. Leyes de los gases ideales. 6. Símbolos y fórmulas. Química 1º bachillerato La materia 1 1. TEORÍA ATÓMICA DE DALTON
FÍSICA APLICADA Y FISICOQUÍMICA I. Tema 2. El Primer Principio de la Termodinámica
 María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 2 El Primer Principio de la Termodinámica Esquema Tema 2. Primer Principio de la Termodinámica 2.1 Primer Principio
María del Pilar García Santos GRADO EN FARMACIA FÍSICA APLICADA Y FISICOQUÍMICA I Tema 2 El Primer Principio de la Termodinámica Esquema Tema 2. Primer Principio de la Termodinámica 2.1 Primer Principio
LEYES DE LOS GASES. Leyes de los gases. Leyes de los gases
 LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
LEYES DE LOS GASES Estado gaseoso Medidas en gases Ley de Avogadro Ley de Boyle y Mariotte Ley de Charles y Gay-Lussac (1ª) Ley de Charles y Gay-Lussac (2ª) Ecuación n general de los gases ideales Teoría
MECÁNICA DE FLUIDOS. Docente: Ing. Alba Díaz Corrales
 MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
MECÁNICA DE FLUIDOS Docente: Ing. Alba Díaz Corrales Fecha: 1 de septiembre 2010 Mecánica de Fluidos Tipo de asignatura: Básica Específica Total de horas semanales: 6 Total de horas semestrales: 84 Asignatura
Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS
 Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS (1 er Q.:prob pares, 2 ndo Q.:prob impares) 1. En el esquema adjunto las secciones de la tubería son 40 y 12 cm 2, y la velocidad del agua en la primera
Problemas de Estática y Dinámica DINÁMICA DE FLUIDOS (1 er Q.:prob pares, 2 ndo Q.:prob impares) 1. En el esquema adjunto las secciones de la tubería son 40 y 12 cm 2, y la velocidad del agua en la primera
Es la medida de la cantidad de materia contenida en un objeto. La unidad SI para masa es el kilogramo (kg)
 Es la medida de la cantidad de materia contenida en un objeto. La unidad SI para masa es el kilogramo (kg) En laboratorio se usa generalmente la unidad de gramo (g). FÓRMULA QUIMICA m = d x v Las unidades
Es la medida de la cantidad de materia contenida en un objeto. La unidad SI para masa es el kilogramo (kg) En laboratorio se usa generalmente la unidad de gramo (g). FÓRMULA QUIMICA m = d x v Las unidades
Guía de estudio y prueba de conocimientos sobre: CAPITULO 4: Fluidos Hidrostáticos
 Guía de estudio y prueba de conocimientos sobre: CAPITULO 4: Fluidos Hidrostáticos Sección 901. Nombre: Cuenta: Nombre: Cuenta: Instrucciones: Contesta lo que se te pide clara y ordenadamente, si necesitas
Guía de estudio y prueba de conocimientos sobre: CAPITULO 4: Fluidos Hidrostáticos Sección 901. Nombre: Cuenta: Nombre: Cuenta: Instrucciones: Contesta lo que se te pide clara y ordenadamente, si necesitas
Unidad 16: Temperatura y gases ideales
 Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
Apoyo para la preparación de los estudios de Ingeniería y Arquitectura Física (Preparación a la Universidad) Unidad 16: Temperatura y gases ideales Universidad Politécnica de Madrid 14 de abril de 2010
GUÍA DE CIENCIAS II (FÍSICA)
 ESCUELA SECUNDARIA No. 765 JOSÉ VASCONCELOS GUÍA DE CIENCIAS II (FÍSICA) PROFESORA: PAULINA BARRIOS ALUMNO: 15 NOTA: ENTREGAR EN ESTE MISMO DOCUMENTO IMPRESO Y CONTESTADO A TINTA Y LÁPIZ COMPLETO (NO DEJAR
ESCUELA SECUNDARIA No. 765 JOSÉ VASCONCELOS GUÍA DE CIENCIAS II (FÍSICA) PROFESORA: PAULINA BARRIOS ALUMNO: 15 NOTA: ENTREGAR EN ESTE MISMO DOCUMENTO IMPRESO Y CONTESTADO A TINTA Y LÁPIZ COMPLETO (NO DEJAR
Ing. Sol de María Jiménez González
 Ing. Sol de María Jiménez González 1 02 de junio I Tutoría Presencial 16 de junio II Tutoría Presencial Entrega de Tarea 30 de junio: I Examen Ordinario 14 de julio III Tutoría Presencial Entrega de proyecto
Ing. Sol de María Jiménez González 1 02 de junio I Tutoría Presencial 16 de junio II Tutoría Presencial Entrega de Tarea 30 de junio: I Examen Ordinario 14 de julio III Tutoría Presencial Entrega de proyecto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERMINACIÓN DE LA MASA MOLECULAR DE UN SOLUTO PROBLEMA POR CRIOSCOPIA
 PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
PRÁCTICA Nº 3 PROPIEDADES COLIGATIVAS: DETERINACIÓN DE LA ASA OLECULAR DE UN SOLUTO PROBLEA POR CRIOSCOPIA OBJETIVOS: El objetivo de la práctica es el estudio del efecto que produce la adición de un soluto
Estado Características Cambio físico
 Materia Todas las sustancias pueden existir, al menos en principio, en los tres estados: sólido, líquido y gaseoso, tal como lo muestra la figura, los gases difieren de los sólidos y de los líquidos en
Materia Todas las sustancias pueden existir, al menos en principio, en los tres estados: sólido, líquido y gaseoso, tal como lo muestra la figura, los gases difieren de los sólidos y de los líquidos en
Clase 2: Sustancias puras
 Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Teórico Física Térmica 2012 02 de Marzo de 2012 Agenda... 1 Referencias 2 Sustancias puras Intro Propiedades independientes 3 Fases Definiciones Cambios (o transiciones) de fase Mezcla Superficies P-v-T
Propiedades físicas de la materia
 Propiedades físicas de la materia CENTRO DE BACHILLERATO TECNOLOGICO industrial y de servicios no. 172 Materia: Física 2 Autores: Karol Camargo Gutiérrez Karla Cantador Jamaica Luis Gasca Prieto José Eduardo
Propiedades físicas de la materia CENTRO DE BACHILLERATO TECNOLOGICO industrial y de servicios no. 172 Materia: Física 2 Autores: Karol Camargo Gutiérrez Karla Cantador Jamaica Luis Gasca Prieto José Eduardo
LA MATERIA: ESTADOS FÍSICOS ACTIVIDADES DE REFUERZO ACTIVIDADES FICHA 1
 FICHA 1 DE REFUERZO 1. Justifica, aplicando la teoría cinética: «Los sólidos tienen forma propia, mientras que los líquidos adoptan la forma del recipiente que los contiene». 2. Expresa la presión de 780
FICHA 1 DE REFUERZO 1. Justifica, aplicando la teoría cinética: «Los sólidos tienen forma propia, mientras que los líquidos adoptan la forma del recipiente que los contiene». 2. Expresa la presión de 780
Ecuación de estado del gas ideal
 Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
Prácticas de laboratorio de Física I Ecuación de estado del gas ideal Curso 2010/11 1 Objetivos Comprobación de la ecuación de estado del gas ideal experimentalmente Construcción de curvas a presión, temperatura
III. ESTADOS DE LA MATERIA
 III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
III. ESTADOS DE LA MATERIA Fuerzas Intermoleculares Las fuerzas intermoleculares Son fuerzas de atracción entre las moléculas y son mas débiles que las fuerzas intramoleculares (enlaces químicos). Ejercen
C: GASES Y PRESIÓN DE VAPOR DEL AGUA
 hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
hecho el vacío. Calcula a) Cantidad de gas que se tiene ; b) la presión en los dos recipientes después de abrir la llave de paso y fluir el gas de A a B, si no varía la temperatura. C) Qué cantidad de
UNIDAD 3: LAS C APA P S F LU L IDA D S DE L A T I T ERRA
 UNIDAD 3: LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas
UNIDAD 3: LAS CAPAS FLUIDAS DE LA TIERRA LA ATMÓSFERA La atmósfera es la capa gaseosa que rodea la Tierra. Es fundamental para la vida porque contiene los gases que respiramos y porque nos protege de algunas
LIQUIDOS. Propiedades:
 LIQUIDOS Los líquidos se caracterizan por su volumen fijo y forma variable. Las fuerzas intermoleculares son mayores que en los gases, pero al igual que en estos, sus partículas están en movimiento constante.
LIQUIDOS Los líquidos se caracterizan por su volumen fijo y forma variable. Las fuerzas intermoleculares son mayores que en los gases, pero al igual que en estos, sus partículas están en movimiento constante.
Humectación y Rendimiento
 Humectación y Rendimiento Adhesivos Sintéticos de Baja Tensión Superficial Serie Coltec HUMECTACIÓN TENSIÓN SUPERFICIAL Y ENERGÍA SUPERFICIAL La energía superficial se define como la suma de todas las
Humectación y Rendimiento Adhesivos Sintéticos de Baja Tensión Superficial Serie Coltec HUMECTACIÓN TENSIÓN SUPERFICIAL Y ENERGÍA SUPERFICIAL La energía superficial se define como la suma de todas las
CLASIFICACIÓN DE LA MATERIA
 1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
1. Clasificación de la materia por su aspecto CLASIFICACIÓN DE LA MATERIA La materia homogénea es la que presenta un aspecto uniforme, en la cual no se pueden distinguir a simple vista sus componentes.
