FACULTAD DE CIENCIAS BIOLÓGICAS. EVALUACIÓN in vitro DEL POTENCIAL ANTAGÓNICO DE Trichoderma spp. SOBRE Fusarium oxysporum EN NOCHEBUENA DE INTERIOR
|
|
|
- Eva Piñeiro San Segundo
- hace 6 años
- Vistas:
Transcripción
1 UNIVERSIDAD AUTÓNOMA DEL ESTADO DE MORELOS FACULTAD DE CIENCIAS BIOLÓGICAS EVALUACIÓN in vitro DEL POTENCIAL ANTAGÓNICO DE Trichoderma spp. SOBRE Fusarium oxysporum EN NOCHEBUENA DE INTERIOR TESIS PROFESIONAL QUE PARA OBTENER EL TITULO DE: B I O L O G O P R E S E N T A: LUCERO MARGORIET PATRICIO PAREDES DIRECTOR FELIPE DE JESÚS OSUNA CANIZALEZ CUERNAVACA, MORELOS OCTUBRE, 2013
2 AGRADECIMIENTOS Agradezco a todas las personas e instituciones que colaboraron en la realización de esta tesis. Al proyecto Estudios Epidemiológicos de Enfermedades y Bioecología de Plagas en Cultivos de Importancia Económica en el Estado de Morelos, con clave: MOR-2010-CO , por la beca proporcionada para apoyar el presente trabajo. Al Dr. Felipe de Jesús Osuna Canizalez, por abrirme las puertas del Laboratorio de Sustratos y darme la oportunidad de realizar este proyecto. Por su asesoría, apoyo y disposición en todo momento. A los miembros del comité tutorial, por sus observaciones, correcciones y el tiempo que me dedicaron para terminar este proyecto: Dr. Jesús Telesforo Hernández Abarca, Dr. Sergio Ramírez Rojas, Mtra. Adriana Gabriela Trejo Loyo, en especial al Dr. Edgar Martínez Fernández por la asesoría y el apoyo brindado en la realización de la identificación morfológica de Fusarium sp. A la Ing. María Félix Moreno López por la ayuda y el apoyo brindado durante todo el desarrollo del proyecto. Al personal de los laboratorios de Micología de la UAEM y Fitopatología del INIFAP, por su ayuda y compañerismo. A mis amigas Mirna, Rebeca, Elizabeth, Magui, Tere, Natyelli y Cyndi por demostrarme siempre su sinceridad, confianza y apoyo. A cada una, muchas gracias por su compañía durante los buenos y malos momentos. I
3 DEDICATORIA A dios : Por protegerme, guiarme y darme la fuerza para superar las dificultades que se presentaban. Por haber puesto en mi camino a aquellas personas que han sido mi apoyo y compañía durante esta etapa. A mis padres: Juan Patricio y Alfreda Paredes, por su apoyo, confianza, comprensión y el todo esfuerzo que hicieron para que terminara mi carrera profesional. Por creer en mí, hoy pude alcanzar mi meta. A mis Hermanos: Mayra Johana y Juan Francisco, por estar siempre presentes y apoyarme en todo momento. Porque son mi motivo para seguir adelante, les dedico esta tesis con cariño. II
4 CONTENIDO ÍNDICE DE CUADROS... VI ÍNDICE DE FIGURAS...VII RESUMEN... IX 1. INTRODUCCIÓN MARCO TEÓRICO Generalidades de la nochebuena Importancia económica del cultivo de la nochebuena Problemas fitosanitarios Enfermedades de la nochebuena Pudrición de la raíz Generalidades de Fusarium sp Clasificación taxonómica (Barnett y Hunter, 1978) Biología de Fusarium sp Micelio Macroconidios Microconidios Clamidosporas Control químico Control biológico Trichoderma spp Generalidades de Trichoderma spp Clasificación taxonómica (Samuels y Chaverri, 2003) Biología de Trichoderma spp Conidióforo Fiálides Conidios Micelio Mecanismos de acción Competencia por nutrientes y sustrato III
5 Antibiosis Micoparasitismo Crecimiento quimiotrófico Reconocimiento Adhesión y enrollamiento Actividad lítica Usos y aplicaciones Trichoderma spp., como agente de control biológico JUSTIFICACIÓN OBJETIVOS Objetivo general Objetivos particulares HIPÓTESIS MATERIALES Y MÉTODOS Ubicación del área de estudio Obtención de muestras Aislamiento e identificación de Trichoderma spp Aislamiento de Fusarium sp., de la raíz de nochebuena de interior Cultivos monospóricos de Trichoderma spp. y Fusarium sp Identificación morfológica de las cepas nativas de Fusarium sp Selección de cepas nativas de Trichoderma spp Pruebas de antagonismo in vitro Cinética de crecimiento de Trichoderma spp. y Fusarium sp. en cultivos duales Selección de cepas nativas de Trichoderma spp., con mayor potencial antagónico RESULTADOS Y DISCUSIÓN Aislamiento de Trichoderma spp Identificación de Trichoderma spp Aislamientos de Fusarium sp Identificación morfológica de Fusarium sp IV
6 7.3. Selección de cepas nativas de Trichoderma spp. y Fusarium sp., para las pruebas de antagonismo Trichoderma spp Fusarium oxysporum Pruebas de antagonismo Determinación del porcentaje de inhibición del crecimiento radial (PICR) Cinética de crecimiento Trichoderma spp. vs Fusarium sp. (cepa A3A) Trichoderma spp. vs Fusarium sp. (cepa B1A) Trichoderma spp. vs Fusarium sp. (cepa C2C) Trichoderma spp. vs Fusarium sp. (cepa X3B) Trichoderma spp. vs Fusarium sp. (cepa C2B) Micoparasitismo Antibiosis Selección de cepas nativas de Trichoderma spp., con mayor potencial antagónico CONCLUSIÓN PERSPECTIVAS BIBLIOGRAFÍA V
7 ÍNDICE DE CUADROS Cuadro 1. Datos de producción de nochebuena en el estado de Morelos en Cuadro 2. Escala para determinar el grado de micoparasitismo de Trichoderma spp. sobre Fusarium sp Cuadro 3. Denominación y procedencia de los aislamientos de Trichoderma spp Cuadro 4. Denominación y procedencia de los aislamientos de Fusarium sp Cuadro 5. Crecimiento radial de los antagonistas al quinto de día evaluación Cuadro 6. Crecimiento radial de los patógenos al quinto día de evaluación Cuadro 7. Tratamientos de interacción entre Trichoderma spp. vs Fusarium sp Cuadro 8. Porcentaje de inhibición del crecimiento radial de las cepas A3A, B1A, C2C, X3B y C2B por las cepas de Trichoderma spp. al quinto día de evaluación Cuadro 9. Grado de micoparasitismo de los tratamientos correspondientes a los cultivos duales de Trichoderma spp. y Fusarium sp. al décimo día de evaluación VI
8 ÍNDICE DE FIGURAS Figura 1. Flor de nochebuena (Euphorbia pulcherrima Willd.ex Klotzsch)... 3 Figura 2. Necrosis de la raíz y hojas marchitas en la nochebuena Figura 3. Micoparasitismo de Trichoderma spp.; enrrollamiento y penetración de las hifas de Trichoderma spp. sobre el hongo fitopatógeno Figura 4. Localización del área de estudio, el Campo Experimental de Zacatepec del INIFAP Figura 5. Peso de los materiales orgánicos y siembra en medio de cultivo PDA Figura 6. Observación al microscopio para la identificación de Trichoderma spp Figura 7. Obtención y siembra de raíces con síntomas de pudrición en medio de cultivo PDA Figura 8. a) Obtención de la solución para cultivos monospóricos, b) Ubicación de las esporas individuales germinadas Figura 9. Resiembra en medios de cultivo: PDA, SNA y HCA para la identificación morfológica de Fusarium sp Figura 10. a) Obtención de discos de micelio con la ayuda de un sacabocado, b) Crecimiento radial de Trichoderma spp Figura 11. a) Obtención de discos de micelio con la ayuda de un sacabocado, b) Discos de micelio de Trichoderma spp. vs Fusarium sp Figura 12. Características macroscópicas de las colonias de Trichoderma spp. en medio de cultivo PDA con y sin rosa de bengala Figura 13. Características microscópicas de Trichoderma spp.; a) Hifas hialinas y fiálides en forma de matraz; b) Conidios elipsoidales, observados en un objetivo de 40 x Figura 14. Características macroscópicas de las colonias de Fusarium sp. en medio de cultivo PDA Figura 15. Características macroscópicas de las cepas A3A, B1A, C2B y X3B de Fusarium sp. en los medios de cultivo PDA, SNA y HCA Figura 16. Características morfológicas de Fusarium oxysporum, a) Clamidosporas, b) Macroconidios con 3 septos observados en objetivo de 40x VII
9 Figura 17. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa A3A de Fusarium sp Figura 18. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa B1A de Fusarium sp Figura 19. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa C2C de Fusarium sp Figura 20. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa X3B de Fuarium sp Figura 21. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa C2B de Fusarium sp Figura 22. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa A3A de Fusarium sp Figura 23. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa B1A de Fusarium sp Figura 24. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa de C2C de Fusarium sp Figura 25. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa X3B de Fusarium sp Figura 26. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa C2B de Fusarium sp Figura 27. Antibiosis en la cepa Trich20 frente a las cinco cepas de Fusarium sp VIII
10 RESUMEN Palabras clave: Euphorbia pulcherrima, Trichoderma spp., Biocontrol, Mecanismos de acción, Fusarium sp. El cultivo de la nochebuena en Morelos tiene como principal problema fitosanitario a la pudrición de la raíz, causado por Fusarium sp. El cual se presenta durante cualquier etapa del ciclo biológico de la planta y hasta el momento solamente se controla con fungicidas sintéticos. En el presente trabajo se evaluó en condiciones in vitro, el potencial antagónico de diferentes cepas de Trichoderma spp., aisladas de diferentes materiales orgánicos locales, sobre Fusarium sp., aislado de la raíz de la nochebuena de interior. Se obtuvieron 18 aislamientos de Trichoderma spp., provenientes de tres municipios del estado de Morelos: Mazatepec, Zacatepec y Tetela del Monte. De los nueve aislamientos de Fusarium sp., se identificaron cuatro cepas (A3A, B1A, X3B y C2B) que corresponden a la especie Fusarium oxysporum. La selección de las cepas nativas de Trichoderma spp., se basó en los valores de las pendientes de las curvas en los modelos de regresión, el PICR (Porcentaje de inhibición del crecimiento radial) y el grado de micoparasitismo sobre Fusarium sp. El crecimiento de las diferentes cepas de Trichoderma spp., se explicó con el modelo de regresión: a * b (1/x) *x c, con alto nivel de ajuste (r² 0.92); en el caso de las cepas de Fusarium sp. el modelo de regresión fue: (a * b+c * x d ) / (b+x d ) con nivel de ajuste (r² 0.96). Se seleccionaron 7 cepas de Trichoderma spp., incluida la cepa comercial; con mayor potencial antagónico: Trich21, Trich24, Trich25 por presentar los mayores porcentajes de inhibición (41 a 54 %). Mientras que las cepas Trich11, Trich16, Trich18 y Trich20 por alcanzar grados de micoparasitismo 1, 2, 3 y 4 y antibiosis para esta última. Estas cepas ofrecen una alternativa eficaz para el control biológico de la pudrición de la raíz en nochebuena de interior causada por Fusarium sp. IX
11 1. INTRODUCCIÓN La nochebuena (Euphorbia pulcherrima Willd.ex Klotzsch) es una planta de origen mexicano, su nombre en náhuatl es Cuetlaxochitl que significa: "flor de pétalos resistentes como el cuero" o "flor que se marchita. El cultivo de la nochebuena tiene una gran relevancia en época decembrina, ya que es una de las especies de plantas ornamentales que más se cultiva en maceta. A nivel nacional, en 2011 se reportó una producción de 20 millones de plantas terminadas con un valor de 700 millones de pesos. Los principales estados productores son: Morelos, Michoacán, Distrito Federal, Puebla y el Estado de México (SAGARPA, 2011; Vázquez et al., 2012). México ocupa el cuarto lugar a nivel mundial en superficie cultivada, con 320 hectáreas, y ha registrado un incremento de 40 por ciento en los últimos cinco años; el estado de Morelos, ocupa el primer lugar a nivel nacional en producción de nochebuena. Las zonas con mayor producción se ubican en Cuautla, Jiutepec, Cuernavaca, Emiliano Zapata, Tepoztlán y Puente de Ixtla (SAGARPA, 2011; Vázquez et al., 2012). Existe una gran diversidad de variedades como: Freedom Red, Subjibi Red, Sonora White, Freedom Marble, Sonora Pink, Monet, entre otros, con diversos colores y tonalidades disponibles en el mercado (Cabrera et al., 2006; Osuna et al., 2011). Sin embargo, uno de los principales problemas fitosanitarios a los que se enfrentan los productores son las enfermedades producidas por hongos fitopatógenos. Dentro de ellos, se encuentran los géneros Pythium, Rhizoctonia, Phytophtora y Fusarium (Benítez et al., 2004). Investigaciones previas permitieron identificar al hongo Fusarium sp., como el principal agente causal de la pudrición de raíz de nochebuena en Morelos (García et al., 2009). Estos hongos se encuentran naturalmente en el suelo y están relacionados con pudriciones de raíz y tallos de muchas plantas (Figueroa-Rivera et al., 2010). En el estado de Morelos, uno de los principales problemas fitosanitarios en el cultivo de la nochebuena, es la marchitez de la planta causada por la pudrición de la raíz (Osuna et al., 2011). De manera tradicional, esta enfermedad se controla con productos químicos, pero el uso irracional de estos, genera altos costos de producción, afectaciones a la salud humana y la acumulación de residuos en el medio ambiente (Jiménez, 1998; Molina, 2006). En este entorno, se ha implementado la búsqueda de métodos alternativos, ecológicos, fáciles y 1
12 económicamente sustentables que permitan disminuir o controlar las poblaciones de hongos fitopatógenos presentes en los cultivos ornamentales (García et al., 2009). El control biológico de fitopatógenos constituye una alternativa eficaz, ya que regula el número de microorganismos perjudiciales por medio de enemigos naturales (Riquelme, 2006). Dentro de los microorganismos más utilizados, están los del género Trichoderma; este hongo se encuentra en el suelo, sobre la madera en descomposición y ecosistemas de raíz (Zimand et al., 1996). Este género presenta diferentes mecanismos de acción, que le permite atacar directamente al hongo, degradarlo y asimilarlo. Este potencial antagónico involucra mecanismos de acción, como la competencia por sustrato y nutrientes, micoparasitismo, producción de antibióticos y enzimas hidrolíticas que alteran la integridad de las paredes celulares de los hongos; además de la producción de sustancias promotoras del crecimiento vegetal (Harman, 2000; Howell, 2003). El género ha sido motivo de estudio frente un amplio rango de hongos fitopatógenos de gran importancia agrícola, tales como: Sclerotium, Rhizoctonia, Phytophthora, Pythium y Fusarium (Papavizas, 1985). En este contexto, el presente trabajo evaluará bajo condiciones in vitro, el potencial antagónico de diferentes cepas de Trichoderma spp., aisladas de diferentes materiales orgánicos locales, sobre el hongo fitopatógeno Fusarium sp. Los resultados de esta investigación ayudarán a la selección de cepas de Trichoderma spp., con alto potencial antagónico contra Fusarium sp., las cuales serán evaluadas in vivo en una investigación posterior. 2
13 2. MARCO TEÓRICO 2.1. Generalidades de la nochebuena La nochebuena es una de las especies del género Euphorbia más cultivadas en macetas a nivel mundial, debido a su alta demanda, sobre todo en las fiestas decembrina. En estado silvestre, la planta de nochebuena alcanza alturas de hasta 3 m, presenta hojas lanceoladas u ovaladas-elípticas, pandurada, entera a dentada lobulada, estípite largo; brácteas parecidas a una hoja escarlata; glándulas amarillas. Muchas de la variedades presentan tallos comúnmente largos; brácteas pequeñas, estrechas planas y arrugadas en colores rojo, blanco, rosa (Cabrera et al., 2006) (Figura 1). Por su parte la nochebuena de interior se cultiva en contenedores o macetas de diversas capacidades. Los sustratos más empleados incluyen como componente orgánico a la tierra de hoja y al ocochal, en mezcla con componentes inorgánicos como el tezontle, el tepojal y la agrolita. Existe una gran diversidad de variedades, como: Freedom Red, Subjibi Red, Sonora White, Freedom Marble, Sonora Pink, Monet, entre otros, con distintos colores y tonalidades disponibles en el mercado (Cabrera et al., 2006; Osuna et al., 2011). Figura 1. Flor de nochebuena (Euphorbia pulcherrima Willd. ex. Klotzsch) Importancia económica del cultivo de la nochebuena La nochebuena representa un producto rentable y exclusivo en flores en temporada navideña, por lo que su demanda es muy alta. A nivel nacional, de acuerdo con información 3
14 de SAGARPA (2010) la nochebuena se cultiva en 320 hectáreas, la mayoría en invernaderos, generando 3200 empleos directos y alrededor de 9600 indirectos. A nivel nacional, se estimó una producción de más de 20 millones de plantas terminadas en sus diferentes presentaciones, adquiriendo un valor de 700 millones de pesos (SAGARPA, 2011). México ocupa el cuarto lugar a nivel mundial en superficie cultivada, con 320 hectáreas, y ha registrado un incremento de 40 por ciento en los últimos cinco años (SAGARPA, 2011). El 90% de la producción y consumo de la nochebuena corresponde a variedades con brácteas de color rojo, el 5% son de color blanco o amarillo y el resto son de color rosa, moradas o marmoleadas; todas en diferentes presentaciones (SAGARPA, 2011). Morelos ocupa el primer lugar nacional en producción de nochebuena. Se cultivan más de5 millones de plantas terminadas en diferentes presentaciones y colores, así como alrededor de 10 millones de esquejes o plántulas, tallos de la planta con finalidades reproductivas, para el abasto de los mercados internacionales de Estados Unidos, Canadá, China, Kenia, Japón, Holanda, Vietnam, Francia, Alemania y Suecia (Vázquez et al., 2012). Las zonas con mayor producción se ubican en Cuautla, Jiutepec, Cuernavaca, Emiliano Zapata, Tepoztlán y Puente de Ixtla (SIAP, 2011) (Cuadro. 1). Cuadro 1. Datos de producción de nochebuena en el estado de Morelos en Municipio Producción de Plantas Valor Producción (Miles de Pesos) Cuautla 690, , Cuernavaca 1,806, , Emiliano Zapata 372, , Jiutepec 330, , Puente de Ixtla 376, , Tepoztlán 979, , Yautepec 1,240, , Totales 5,793, , SIAP,
15 Las variedades de mayor importancia en México y para Morelos son Freedom y Subjibi, seguidas de otras variedades como: Festival, Monet twligth, Marble, Prestige, Joypink, Red Angel y Nutcracker, con variedades que van desde el tradicional rojo, pasando por el rosa, amarillo, guinda, salmón y veteadas (Vázquez et al., 2012). El Sistema producto ornamentales y SAGARPA (2011) impulsaron un plan promocional, para institucionalizar el 8 de diciembre como Día Nacional de la nochebuena Cuetlaxochitl Problemas fitosanitarios Para el productor, la calidad de la flor incluye la cantidad de hojas, tamaño de las flores, obtención de colores fijos y un buen desarrollo del sistema radical. El cultivo de la nochebuena se ha convertido en una actividad importante, debido a esto, es necesario verificar los factores que intervienen en su producción, tales como la selección de un buen sustrato y la fertilización, que influyen en la nutrición de la planta. Sin embargo, uno de los principales problemas a los que se enfrentan los productores, son las enfermedades producidas por hongos fitopatógenos (Pineda-Pineda et al., 2008). Continuamente, la producción del sector ornamental se ve afectado por enfermedades del sistema radicular, limitando la producción de plantas. Entre los agentes causales, se encuentran las bacterias, nematodos, insectos y hongos fitopatógenos. Dentro de estos últimos, diversas especies de Pythium sp., Rhizoctonia sp., Phytophtora sp. y Fusarium sp., logran afectar a las plantas durante su propagación, proceso productivo e incluso en la postcosecha, afectando así la calidad del producto (Benítez et al., 2004). En el estado de Morelos, uno de los problemas fitosanitarios más importantes en el cultivo de la nochebuena, es la marchitez de la planta causada por la pudrición de la raíz (Osuna et al., 2011). Esta enfermedad se presenta en cualquier etapa del ciclo de desarrollo, al inicio del proceso de pigmentación o en etapas más avanzadas. Investigaciones anteriores permitieron identificar a Fusarium sp., como la principal causa de la pudrición de la raíz de nochebuena (García et al., 2009). 5
16 2.2. Enfermedades de la nochebuena Pudrición de la raíz La enfermedad causada por Fusarium sp., origina una necrosis en las raíces, las cuales se tornan oscuras y la planta empieza a marchitarse hasta que muere (Figura 2). Los síntomas pueden presentarse en cualquier etapa de su desarrollo, desde la colocación de la planta en la maceta definitiva, hasta en la etapa de pigmentación; en este periodo se logra observar que el follaje se empieza a marchitar. Las hojas o partes infectadas pierden turgencia, comienzan a debilitarse y obtienen un tono que va del verde claro al amarillo verdoso. Las hojas marchitas pueden extenderse o enrollarse, mientras que los retoños tiernos o jóvenes también se marchitan y mueren (García et al., 2009). Figura 2. Necrosis de la raíz y hojas marchitas en la nochebuena. Fusarium sp. se mantiene latente en el suelo en forma de micelio, y se propaga de varias formas, con mayor frecuencia mediante clamidosporas. Esta propagación puede darse a cortas distancias, a través del agua o el equipo agrícola contaminado, mientras que a largas distancias, se da principalmente por plántulas infectadas o por el suelo que va unido a ellos (García et al., 2009) Generalidades de Fusarium sp. Es un hongo saprofito, que se encuentran naturalmente en el suelo. Está relacionado con pudrición de raíz y tallo de muchas plantas (Figueroa-Rivera et al., 2010). 6
17 Clasificación taxonómica (Barnett y Hunter, 1978). Reino: Fungi División: Eumycota Clase: Deuteromycetes Orden: Moniliales Familia: Moniliaceae Género: Fusarium Especie: F. oxysporum El género Fusarium fue descrito por Link en 1809; desde entonces la taxonomía ha sido muy complicada. Se considera que este género exhibe un grado de variación con respecto a la morfología microscópica y a sus características fisiológicas, debido a su gran habilidad para colonizar diversos hábitats ecológicos (Nelson et al., 1994). La correcta identificación de las especies de Fusarium requiere de una observación detallada del cultivo, ya que el género se caracteriza por una gran variabilidad morfológica bajo diferentes condiciones de cultivo. Las características que permiten la identificación del género Fusarium se determinan macroscópicamente y microscópicamente. Estas son agrupadas en características primarias y secundarias, utilizadas para separar las especies. Las características primarias incluyen: la forma de los macroconidios, origen y forma de los microconidios, tipo de conidióforo, y la presencia o ausencia de clamidosporas, mientras que en las secundarias se encuentran: la presencia o ausencia de esporodoquios, así como morfología y pigmentación de la colonia (Nelson et al., 1994; Figueroa-Rivera et al., 2010) Biología de Fusarium sp Micelio Las colonias de las distintas especies de Fusarium crecen moderada a profusamente, tienen diversos colores (blanco, rosado pálido, rojo, anaranjado, púrpura, celeste, verde aceituna), especialmente en el reverso de la colonia. El micelio es ralo o denso, ya sea algodonoso, como un fieltro o zona central de funículos, pero en algunos casos es limoso. Los pigmentos que se difunden en el agar suelen variar de color o tono conforme al ph. 7
18 Algunas especies presentan zonas concéntricas de distinta morfología macroscópica debido a la secuencia luz oscuridad (Seifert, 2002) Macroconidios Hialinos, fusiformes, a veces pedicelados, con una célula apical más o menos puntiaguda y una célula basal en forma de pie que constituye la base para la identificación; presenta entre 1-7 septos. Es la estructura más importante para la identificación de especies de Fusarium. (Leslie y Summerell, 2006) Microconidios No son producidos por todas las especies de Fusarium; debido a esto, su presencia también representa un carácter muy importante. Comúnmente unicelulares, elipsoidales, fusiformes, piriformes o subglobosos (Mendoza y Pinto, 1985) Clamidosporas La presencia de clamidosporas también es un carácter muy importante en la descripción de varias especies de Fusarium. Pueden ser sencillas, dobles, en masas o cadenas. Las clamidosporas pueden encontrarse en el micelio aéreo (Leslie y Summerell, 2006). El conidióforo es una parte de la hifa que soporta a la célula conidiogena, que puede ser monofialides o polifialides, ramificados o simples; en ocasiones formando grupos de esporodoquios (Mendoza y Pinto, 1985). Su crecimiento y reproducción en el suelo se da a temperaturas entre C; generalmente las plantas mueren de 2-4 semanas después de la infección. Existen diferentes condiciones que favorecen su desarrollo, tales como: una alta humedad en el suelo o el sustrato y alto contenido de nitrógeno combinado con un bajo contenido en potasio. El inóculo se propaga a través del suelo contaminado, agua de lluvia, implementos agrícolas, trasplantes y en ciertas ocasiones por la semilla (Mendoza y Pinto, 1985). Fusarium se comporta como fitopatógeno al penetrar las diferentes capas de la corteza de la raíz, hasta encontrar el sistema vascular. Una vez establecido, la colonización de la planta es llevaba a cabo rápidamente a través del xilema que conlleva a la sintomatología de la 8
19 marchitez (Agrios, 1998). Estos hongos generalmente provocan necrosis o muerte a los tejidos de las plantas; los síntomas más frecuentes son la pudrición basal del tallo, cánceres, roña, tizón y pudriciones de la raíz, entre otros (Mendoza y Pinto, 1985). Para contrarrestar estos problemas, se ha recurrido al uso de productos químicos en los cultivos de ornamentales (Molina, 2006) Control químico De manera tradicional, se emplea el uso de productos químicos en el cultivo de plantas ornamentales. El control de esta enfermedad, se basa en la aplicación de fungicidas comerciales como Captan, Phyton 27, Folpan, Ridomil, Terrazan, Cercobin y Previcur N, solos o mezclados en dosis de 1 a 4 ml/l de agua, cada 8 días (García et al., 2009). Estos productos incrementan el costo de producción y también afectan la salud humana de quienes los aplican. Además, generan resistencia de especies inmunes a la acción de estos productos, dan origen a nuevos organismos secundarios que provocan la eliminación de los enemigos naturales, generan acumulaciones de residuos en el medio ambiente, causan la destrucción de la flora y fauna, entre otros efectos colaterales negativos (Jiménez, 1998). En este conjunto de circunstancias, se ha promovido la búsqueda de nuevas alternativas sencillas, ecológicas y económicamente sustentables que disminuyan el uso irracional de plaguicidas; este enfoque se ha dirigido hacia la investigación de diversos microorganismos, que pueden ser utilizados como agentes de control biológico de hongos fitopatógenos (Pineda- Pineda et al., 2008) Control biológico Se define como el control de una enfermedad o plaga mediante el uso de microorganismos u otros componentes naturales del medio. Consiste en la regulación del número de microorganismos perjudiciales por medio de enemigos naturales (Riquelme, 2006). Los agentes de control biológico interfieren en el ciclo biológico del patógeno (por una destrucción directa o por competencia al utilizar sus recursos vitales para sobrevivir) favoreciendo la creación de barreras físico-químicas, las cuales alcanzan niveles suficientes para retrasar o disminuir el desarrollo del patógeno (Riquelme, 2006). El control biológico mediante el uso de organismos antagónicos representa una importante herramienta para la protección de cultivos contra hongos fitopatógenos. Para ello, es necesario conocer a los 9
20 organismos benéficos, identificar la función que tienen para regular las poblaciones de patógenos y reducir el uso de plaguicidas (Michael-Aceves et al., 2009). Dentro de los microorganismos más utilizados en el control biológico están los hongos del género Trichoderma, que aún siguen siendo objeto de investigación en muchos países. Muchas especies de este género, se han reportado como hiperparásitos de un amplio número de hongos fitopatógenos, produciendo lisis celular. Los resultados de Lima y colaboradores (1997), demostraron la acción de una quitinasa en la pared celular de Sclerotium rolfsii y de Rhizoctonia solani. La efectividad para el control de un hongo fitopatógeno puede variar en un aislamiento del antagonista, en la medida de sus características de adaptación a condiciones bióticas y abióticas específicas (Dennis y Webster, 1971) Trichoderma spp Generalidades de Trichoderma spp. Constituye un grupo diverso de hongos saprofitos, generalmente establecidos en el suelo, sobre la madera en descomposición y ecosistemas de raíz. Las diferentes especies de Trichoderma, se destacan por tener un crecimiento micelial rápido, producción abundante de esporas y su facilidad de colonizar varios tipos de sustratos (Zimand et al., 1996) Clasificación taxonómica (Samuels y Chaverri, 2003). Reino: Fungi División: Eumycota Subdivisión: Ascomycotina Clase: Euascomycetes Orden: Hypocreales Familia: Hypocraceae Género: Trichoderma Especie: T. harzianum, T. hamatum, T. viride, entre otras. El género Trichoderma, fue propuesto por Pearson; para su identificación y caracterización a nivel género se emplean diversas pruebas bioquímicas, técnicas moleculares, métodos que 10
21 se basan en su morfología y su actividad fúngica (Bisset et al., 2003). Este género tiene una gran variabilidad genética, lo que le permite a cada especie tener características diferentes; debido a esto, la taxonomía de este género es aun confusa, ya que las primeras clasificaciones se basaron fundamentalmente en las características morfológicas de las especies como: velocidad de crecimiento, características de la esporulación, así como características de los conidios y conidióforos. Actualmente, se han realizado análisis de isoenzimas, secuenciación de DNA, técnicas bioquímicas y fisiológicas, con el fin de aclarar la clasificación taxonómica del género (Bisset et al., 2003; Samuels, 1996) Biología de Trichoderma spp. Microscópicamente, la morfología que presenta este género son conidióforos, hifas hialinas septadas, fialides y conidios (Kubicek y Harman, 1998) Conidióforo Son hialinos, generalmente ramificados, la formación de las hifas se da en un ángulo de 90º y en ocasiones llegan a tener una disposición en forma piramidal (Kubicek y Harman, 1998) Fiálides Son hialinas, en forma de matraz, se adhieren a los conidióforos por la parte más amplia, pueden ser solitarias o dispuestas en racimos, produciendo los conidios en el extremo (Kubicek y Harman, 1998) Conidios Son unicelulares de forma elipsoidal con aproximadamente 3 µm de diámetro, son de color verde (Kubicek y Harman, 1998) Micelio En el medio de cultivo PDA, Trichoderma spp., presenta un crecimiento y desarrollo colonial rápido de 5 días. En este medio las colonias tienen un aspecto algodonoso que se van compactando conforme pasa el tiempo. Cuando su desarrollo es alternado en periodos de luz y oscuridad, se logran apreciar las zonas de crecimiento correspondiente a cada 11
22 periodo. En ausencia de luz se puede apreciar un micelio algodonoso de color blanco y en presencia de luz se observa la esporulación con tonalidades verdosas, dando un aspecto de anillos en forma concéntrica. Al reverso de la caja, se puede ver un color pálido y en ocasiones adquiere una coloración amarilla (Windham et al., 1986). Algunas especies de Trichoderma sp., cuando se desarrollan en medios de cultivo que presentan condiciones restringidas de ph, humedad, fuente de carbono o nutrimentos, son capaces de producir clamidosporas (Kubicek y Harman, 1998). Las condiciones de crecimiento para este hongo son: Temperatura (ºC): su desarrollo y crecimiento se da en un intervalo de 15 a 35ºC, siendo 25ºC la óptima. Humedad relativa (HR): capaz de crecer entre el 20% y 80%, siendo el 70% la excelente. ph: entre 6 a 6.5, se consideran valores adecuados para su desarrollo, pero también puede sobrevivir a valores mayores, debido a su capacidad de acidificar el medio en el que se encuentra. Carbono(C): la fuente principal que asimila es la celulosa (Kubicek y Harman, 1998). Trichoderma spp., presenta características satisfactorias como agente de control biológico sobre hongos fitopatógenos, al tener la capacidad de competir por nutrientes o producir compuestos que resultan tóxicos para este tipo de hongos (Michael-Aceves et al., 2009) Mecanismos de acción Los principales mecanismos que ejercen las especies del género Trichoderma, para llevar a cabo su antagonismo contra hongos fitopatógenos incluyen desde la degradación y consecuente asimilación de estos. Este potencial antagónico involucra el micoparasitismo, competencia por sustrato y nutrientes, la producción de antibióticos y enzimas hidrolíticas que alteran la integridad de las paredes celulares de los hongos; además de la producción de sustancias promotoras del crecimiento vegetal. Tales mecanismos pueden operar de manera independiente o simultáneamente en las interacciones microbianas (Howell, 2003). 12
23 Diferentes especies de Trichoderma, promueven el crecimiento radical y desarrollo de las plantas, tolerancia al estrés, inducción de resistencia, solubilización de nutrientes orgánicos e inactivación de las enzimas de los hongos fitopatógenos (Harman, 2000) Competencia por nutrientes y sustrato La competencia es un mecanismo antagónico importante; se define como el comportamiento desigual de dos o más organismos ante un mismo requerimiento (sustrato o nutrientes), siempre y cuando la utilización de este, por uno de los organismos, reduzca la cantidad o espacio disponible para los demás (Infante et al., 2009). Trichoderma spp., es un hongo saprófito que al competir con otros microorganismos, impide que se desarrollen; una manera de lograrlo es a través de la excreción de moléculas denominadas sideróforos, que son quelantes del hierro en el medio ambiente; este micronutrimento es necesario para la viabilidad de diversos hongos filamentosos, y al ser quelatado por los sideróforos se reduce su disponibilidad para el hongo fitopatógeno, disminuyendo de esta manera su desarrollo (Chet y Inbar, 1994) Antibiosis Es el mecanismo en el cual un hongo antagonista inhibe o destruye a un organismo a través de la producción metabólica de compuestos difusibles de bajo peso molecular o antibióticos. Las especies de este género tienen la capacidad de producir metabolitos tóxicos volátiles o no volátiles, enzimas líticas, que desintegran los polímeros estructurales como la quitina y β-1-3 glucanos de la pared celular de la mayoría de los hongos fitopatógenos, reduciendo su desarrollo y crecimiento (Michael-Aceves et al., 2005). Entre las enzimas líticas que producen las especies de Trichoderma., se encuentran quitinasas, glucanasas, proteasas y celulasas. Entre los metabolitos están el ácido harziánico, tricholinas, peptaiboiles; antibióticos como la viridina, gliotoxina, glisosperonas, se relacionan con el mecanismo de antibiosis y micoparasitismo al participar en la degradación de la pared celular del hongo fitopatógeno (Michael-Aceves et al., 2005). Algunas de las especies de este género se caracterizan por presentar una gran producción de sustancias volátiles de naturaleza antibiótica con un característico olor a coco (Stefanova et al., 1999). Los antibióticos volátiles ejercen un efecto fungistático, debilitando al patógeno 13
24 y lo vuelven más sensible a los antibióticos no volátiles, conocido como un hiperparasitismo de origen enzimático (Infante et al., 2009) Micoparasitismo Es definido como una simbiosis antagónica entre organismos, en donde están implicadas enzimas extracelulares (Infante et al., 2009). Es un mecanismo complejo que involucra varias etapas consecutivas. Inicia con el crecimiento quimiotrófico, reconocimiento, adhesión y enrollamiento, y muerte del hongo fitopatógeno (Benítez et al., 2004) Crecimiento quimiotrófico El quimiotropismo es el crecimiento directo hacia un estímulo químico. En esta primera etapa, Trichoderma spp., ha demostrado que puede detectar la localización de su hospedante a distancia y sus hifas crecen en dirección al hongo como resultado de un estímulo químico (Infante et al., 2009) Reconocimiento Se efectúa a través de interacciones lectinas-carbohidratos. Trichoderma spp., se adhiere con carbohidratos que se unen a lectinas en la pared celular del hongo fitopatógeno (Howell, 2003) Adhesión y enrollamiento Las hifas de Trichoderma spp., se adhieren al hospedante mediante la formación de ganchos. Se enrolla al patógeno y forma estructuras denominadas apresorios (Howell, 2003) (Figura 3) Actividad lítica La lisis celular es el mecanismo en donde intervienen las enzimas hidrolíticas producidas por los antagonistas. En esta etapa, la producción de enzimas líticas degrada las paredes celulares del hospedante y facilita la penetración de las hifas del antagonista. (Haram et al., 1996). Trichoderma spp., produce muchas enzimas (celulosas, glucanasas, lipasas, proteasas y quitinasas) que participan en la lisis de la pared celular de las hifas del hospedante, permitiendo la inserción de estructuras especializadas (gancho y apresorios) 14
25 que absorben el contenido de la pared celular del hongo fitopatógeno. El contenido restante queda principalmente rodeado de hifas invasoras, mostrando signos de dispersión y disminución de la actividad patogénica del hongo (Benítez et al., 2004).. Figura 3. Micoparasitismo de Trichoderma spp.; enrrollamiento y penetración de las hifas de Trichoderma spp. sobre el hongo fitopatógeno. La producción metabólica de los aislamientos de Trichoderma spp., al igual que el micoparasitismo, presenta una determinada especificidad. Samuels (1996), detalla un grupo de cepas de Trichoderma spp., denominadas Q, que produjeron gliotoxina y lograron ser efectivas contra R. solani, pero no fueron efectivas a Pythium ultimum Trow; mientras que otro grupo de cepas P, que produjeron gliotoxina mostraron resultados opuestos. Martínez y colaboradores (2008), observaron que al evaluar la competencia por el sustrato, micoparasitismo y antibiosis en 59 aislamientos de Trichoderma spp., se logró determinar al menos un tipo de interacción hifal definida y algunos de ellos presentaron hasta cuatro tipos de interacción sobre R. solani (Infante et al., 2009). Los mecanismos mencionados anteriormente, pueden actuar de manera independiente o sinérgica en el control de hongos fitopatógenos, aunque la importancia de cada uno de ellos va a depender de la interacción planta-patógeno-antagonista y de las condiciones ambientales que prevalezcan (Harman, 2000). 15
26 Por otra parte, se conoce que el género induce resistencia a la planta, incrementando la respuesta de crecimiento y la tolerancia al estrés, que son ocasionados por factores adversos, en este caso, la presencia de hongos fitopatógenos. Al inducir resistencia en la planta, se estimulan los mecanismos naturales de defensa, como la producción de hormonas, peroxidasas y compuestos fenólicos que provocan cambios bioquímicos y la formación de barreras físicas (Harman, 2000; Howell, 2003) Usos y aplicaciones Las propiedades de este género, lo han convertido de mayor importancia económica para la industria, como biofungicida comercial, también se usa para la degradación de xenobioticos y como estimulante del crecimiento vegetal (Howell, 2003; Hanson y Howell, 2004) Trichoderma spp., como agente de control biológico El potencial antagónico de Trichoderma spp., fue descubierto desde 1930 y hasta la fecha se usa para el control de enfermedades de las plantas; sin embargo, el empleo a nivel comercial de este género es reciente. El género ha sido motivo de estudio frente un amplio rango de hongos fitopatógenos de gran importancia agrícola, principalmente, contra los géneros de Sclerotium, Rhizoctonia, Phytophthora, Pythium y Fusarium (Papavizas, 1985). Los primeros estudios a nivel mundial sobre la producción de metabolitos tóxicos producidos por Trichoderma spp., proceden del año 1934, cuando Weindling, al realizar filtrados de cultivos de T. lignorum, aisló un metabolito orgánico de forma cristalina que resultó ser tóxico en altas diluciones sobre R. solani. Este metabolito recibió el nombre común de Gliotoxina. Posteriormente, se reportaron otros metabolitos secundarios producidos por Trichoderma, como Viridina por T. viride, y Trichodermin en T. viride y T. polysporum (Dennis y Wester, 1971). Posteriores investigaciones, demuestran que cepas nativas de Trichoderma spp., son eficientes en el control in vitro de las dos especies de Fusarium asociados con la escoba de bruja del mango (Michael-Aceves et al., 2001; Michael-Aceves et al., 2005). Es el microorganismo más utilizado como agente de control biológico, debido a que es tolerante a la aplicación de agroquímicos, ayudando a la reducción de plaguicidas que generan un efecto negativo en el medio ambiente y la salud humana (Vinale et al., 2008). 16
27 Por lo anterior, el control biológico de hongos fitopatógenos y el uso de Trichoderma spp., es una alternativa utilizada en diferentes partes del mundo; sin embargo, el uso de cepas comerciales llega a presentar dificultades con su persistencia en el suelo, debido a factores como la variabilidad genética de los aislamientos, las condiciones del medio ambiente, y otros. Debido a esto, es importante seleccionar aislamientos nativos, que estarán mejor adaptados a las condiciones climáticas de la zona donde serán utilizados (González et al., 1999). 17
28 3. JUSTIFICACIÓN Durante varias décadas se ha utilizado la aplicación de productos químicos en el control de enfermedades del sector ornamental. Los residuos liberados de estos productos atentan contra la salud humana y promueven el deterioro del medio ambiente. Ante la necesidad de reducir el uso irracional de estos productos, se ha implementado la búsqueda de fuentes alternativas que minimicen estos problemas. El control biológico se presenta como una alternativa económica, fácil y eficaz contra los numerosos problemas generados por hongos fitopatógenos. Los agentes de control biológico más empleados pertenecen al género Trichoderma. Este hongo ofrece buenas posibilidades como antagonista de hongos fitopatógenos, al presentar diversos mecanismos de acción que le permiten controlar o inhibir el crecimiento de diferentes especies de hongos fitopatógenos. Su facilidad de aislamiento y cultivo, se debe al rápido crecimiento que presenta en diferentes sustratos. Este género promueve el continuo desarrollo de investigaciones básicas y aplicadas al control biológico de enfermedades en plantas. En este contexto, en el presente trabajo se evaluó bajo condiciones in vitro, el potencial antagónico de diferentes cepas de Trichoderma spp., aisladas de diferentes materiales orgánicos locales, sobre el hongo fitopatógeno Fusarium, en nochebuena de interior. Los resultados de esta investigación ayudarón a la selección preliminar de cepas de Trichoderma spp., con alto potencial antagónico contra Fusarium sp., las cuales se evaluarón in vivo en una investigación posterior. 18
29 4. OBJETIVOS 4.1. Objetivo general Seleccionar cepas nativas de Trichoderma spp., con alto potencial antagónico para el control biológico de Fusarium sp., en nochebuena de interior Objetivos particulares a) Aislar e identificar cepas nativas de Trichoderma spp. a partir de diferentes sustratos. b) Aislar el hongo fitopatógeno Fusarium sp. de la raíz de la nochebuena de interior. c) Realizar pruebas de antagonismo entre las cepas nativas seleccionadas de Trichoderma spp. hacia los aislamientos de Fusarium sp. nativas. d) Seleccionar las cepas de Trichoderma spp., con mayor potencial antagónico. 5. HIPÓTESIS El crecimiento micelial de Fusarium sp., se verá afectado por el potencial antagónico de las cepas nativas de Trichoderma spp. 19
30 6. MATERIALES Y MÉTODOS 6.1. Ubicación del área de estudio El presente trabajo de investigación se realizó en el Laboratorio de Sustratos del Campo Experimental Zacatepec, perteneciente al Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), ubicado en el Km. 0.5 carretera Zacatepec-Galeana (Figura 4).. Figura 4. Localización del área de estudio, el Campo Experimental de Zacatepec del INIFAP Obtención de muestras Se tomaron muestras de materiales orgánicos de origen diverso, utilizados en la preparación de sustratos para el cultivo de nochebuena, como los siguientes: ocochal ; lixiviados del proceso de lombricompostaje de estiércol vacuno + residuos vegetales, lombricomposta de estiércol de ganado vacuno + 50% de residuos vegetales, así como de un sustrato común en nochebuena compuesto por 70% de ocochal tierra de hoja + 30% tepojal (V/V). 20
31 6.2. Aislamiento e identificación de Trichoderma spp. Para realizar los aislamientos, se utilizó la técnica de dilución en placa, en donde se pesaron 10 g de cada muestra y fueron depositados en un matraz erlenmeyer con 90 ml de agua destilada estéril (10 - ¹), enseguida se agitaron en un vortex por 20 minutos. Después se tomó una alícuota de 1 ml del matraz y se depositó en un tubo de ensaye que contenía 9 ml de agua destilada estéril (10-2 ), se volvió a tomar una alícuota de 1 ml de ese tubo y se colocó en otro tubo de ensaye (10-3 ); se repitió el mismo procedimiento hasta obtener diluciones de (10-5 ). De las tres últimas diluciones se tomó una alícuota de 0.1 ml que fue plaqueada de manera homogénea sobre una caja petri (9.0 cm de diámetro) que contenía medio de cultivo agar papa dextrosa (PDA), rosa de bengala y ácido láctico al 10%; las cantidades de cada componente por litro de medio de cultivo fueron 39 g de PDA, 0.5 g de rosa de bengala y 10 ml de ácido láctico al 10% (Figura 5). El aislamiento se realizó en una cámara de flujo laminar en condiciones asépticas. Las cajas sembradas se incubaron a 24 C ± 1 C durante 5-7 días en la oscuridad. Figura 5. Peso de los materiales orgánicos y siembra en medio de cultivo PDA. Posteriormente, se realizaron montajes temporales con azul de lactofenol bajo el microscopio compuesto, para identificar la presencia del hongo Trichoderma spp., basándose en las descripciones de Barnet y Hunter (1978) (Figura 6). 21
32 Figura 6. Observación al microscopio para la identificación de Trichoderma spp. En los ensayos se incluyó una cepa comercial de Trichoderma spp. (Fithan), que ha mostrado buena capacidad antagónica contra hongos fitopatógenos que causan secadera de plántulas de jitomate de invernadero en Morelos (Osuna et al., 2010). Se utilizó la misma metodología descrita anteriormente para preparar diluciones del producto comercial de 10-1 hasta Aislamiento de Fusarium sp., de la raíz de nochebuena de interior Se realizó una colecta de plantas de nochebuena de interior que presentaron los síntomas de pudrición de raíz descritos por Cabrera et al., (2006). Las plantas colectadas se trasladaron al laboratorio para su posterior procesamiento. Primero se cortaron las raíces con la ayuda de un bisturí para ser retiradas de la planta, se lavaron con agua de la llave para retirar restos de sustrato. Enseguida se desinfectaron mediante inmersión por un minuto en una solución de hipoclorito de sodio comercial al 2%, posteriormente, se lavaron con agua destilada estéril y se dejaron secar en papel filtro. Las muestras de raíces obtenidas fueron sembradas en cajas petri (9 cm de diámetro) con medio de cultivo PDA adicionado con ácido láctico al 10%; las cantidades de cada componente por litro de medio de cultivo fueron 39 g de PDA y 10 ml de ácido láctico al 10% (Figura 7). El aislamiento se realizó en una cámara de flujo laminar en condiciones asépticas. Las cajas sembradas fueron incubadas a 24 C ± 1 C durante 5-7 días en la oscuridad. 22
33 Figura 7. Obtención y siembra de raíces con síntomas de pudrición en medio de cultivo PDA. Para la identificación de los hongos fitopatógenos, se tomaron en cuenta las características macroscópicas de la colonia en base a claves de Barnet y Hunter (1978) Cultivos monospóricos de Trichoderma spp. y Fusarium sp. Para la obtención de cultivos monospóricos se sembró una asada de esporas de los aislamientos puros de Trichoderma spp. y de Fusarium sp. Se colocaron 10 ml de agua estéril sobre el aislamiento puro y se realizaron pequeños movimientos circulares a la caja petri para poder dispersar los conidios, enseguida se tomó una alícuota de 10 µl (microlitros) de esa solución y fueron plaqueados de manera homogénea en una caja petri con medio de cultivo PDA, rosa de bengala y ácido láctico en las proporciones indicadas en el apartado 6.2 para Trichoderma spp. y las mismas proporciones de PDA y ácido láctico, en las proporciones indicadas en el apartado 6.3 pero sin rosa de bengala, para el caso de Fusarium sp. Las cajas sembradas se incubaron por 24 horas a 24ºC en la oscuridad. Pasadas las 24 horas, los aislamientos se observaron al microscopio compuesto para poder ubicar esporas individuales germinadas, se inició marcando el sitio utilizando un micro gancho sobre el agar. Posteriormente se transfirió un fragmento de agar con la espora seleccionada a una nueva caja petri con PDA, rosa de bengala y ácido láctico al 10% para Trichoderma spp., en el caso de Fusarium sp., el medio de cultivo no lleva rosa de bengala (Figura 8).Los aislamientos se realizaron en la cámara de flujo laminar en condiciones asépticas. Las cajas sembradas se incubaron a 24 C ± 1 C durante 5-7 días en la oscuridad. 23
34 Figura 8. a) Obtención de la solución para cultivos monospóricos, b) Ubicación de las esporas individuales germinadas Identificación morfológica de las cepas nativas de Fusarium sp. La identificación se realizó en el laboratorio del Dr. Edgar Martínez Fernández, investigador en Micología en el Centro de Investigaciones Biológicas de la Universidad Autónoma del Estado de Morelos (CIB-UAEM). Para la identificación, se emplearon tres medios de cultivo: *Medio Agar papa dextrosa (PDA) y ácido láctico. Tal como se describe en el apartado 6.2. *Medio Spezieller Nährstoffmmarmer Agar (SNA). Este medio de crecimiento contiene los siguientes ingredientes L -1 : 0.1 g KH 2 PO 4, 1.0 g KNO 3, 0.5 g Mg SO. 4 7H 2 O, 0.5 g KCl 0.2 g, Glucosa, 0.2 g Sacarosa, y 2.0 g agar bacteriológico. El medio se vació en cajas petri y se dejó gelificar. *Medio Agar hojas de clavel (HCA). Se preparó de manera similar al PDA solo que antes de vaciar el medio, se agregaron piezas de hoja de clavel (esterilizadas por radiación gama) en las cajas petri. La resiembra en estos medios se realizó a partir de los cultivos monospóricos obtenidos de Fusarium sp. Se tomó un fragmento de micelio que se transfirió con la ayuda de un micro gancho en cajas petri que contenían los diferentes medios de cultivo. Se realizó una réplica para cada cepa en cada medio de cultivo (Figura 9). Las resiembras se realizaron en una 24
35 cámara de flujo laminar en condiciones asépticas, las cuales se incubaron a C en condiciones de luz diaria, durante 7-8 días. Posteriormente, se realizaron montajes temporales con lactofenol + azul de algodón bajo el microscopio compuesto en un objetivo de 40x, la identificación de las especies de Fusarium se basó en las claves de Booth (1971), y Leslie y Summerell (2006). Figura 9. Resiembra en medios de cultivo: PDA, SNA y HCA para la identificación morfológica de Fusarium sp Selección de cepas nativas de Trichoderma spp. Antes de proceder a realizar las pruebas de antagonismo, se escogieron las cepas nativas de Trichoderma spp., y Fusarium sp., con mayor crecimiento radial (mm), para lo cual se procedió de la siguiente manera: con la ayuda de un sacabocado, se colocó un disco de micelio de 5 mm a 1cm del borde de la caja petri (9 cm de diámetro) con medio PDA, rosa de bengala y ácido láctico al 10% para Trichoderma spp., en las proporciones indicadas en el apartado 6.2; para el caso de Fusarium sp., el medio de cultivo no incluyó rosa de bengala (Figura 10). Las cajas sembradas fueron incubadas a 24 C ± 1 C durante 5 días en la oscuridad. Se tomaron lecturas cada 24 horas por 5 días con la ayuda de un vernier digital. Para cada cepa se tuvieron tres repeticiones. 25
36 Figura 10. a) Obtención de discos de micelio con la ayuda de un sacabocado, b) Crecimiento radial de Trichoderma spp. Las cepas nativas de Trichoderma spp. y Fusarium sp., que presentaron mayor crecimiento radial (mm) fueron empleadas para las pruebas de antagonismo posteriores Pruebas de antagonismo in vitro Se realizaron confrontaciones mediante cultivos duales de ambos organismos en cajas petri (9 cm de diámetro) con medio de cultivo PDA y ácido láctico al 10% (apartado 6.3), empleando la metodología utilizada por Bell et al. (1982). Para esto, se tomaron discos de micelio de 5 mm de diámetro tanto del antagonista como del fitopatógeno, los cuales se colocaron a 1 cm del borde de la caja petri, con una distancia de aproximadamente 6 cm uno de otro, incubándolos a 24 ± 1 C durante 3-5 días en condiciones de oscuridad (Figura 11). Para cada tratamiento se tuvieron 5 repeticiones con sus respectivos testigos (antagonista y patógeno cultivados individualmente). Con la ayuda de un vernier digital se midió el crecimiento radial (mm) de las colonias cada 24 horas. Figura 11. a) Obtención de discos de micelio con la ayuda de un sacabocado, b) Discos de micelio de Trichoderma spp. vs Fusarium sp. 26
37 La inhibición del crecimiento radial de Fusarium sp. se calculó mediante la fórmula: PICR = (R1 R2) / R1 x 100 En donde: PICR = Porcentaje de inhibición del crecimiento radial. R1= Radio mayor (radio de la colonia del patógeno en el testigo, en mm). R2=Radio menor (radio de la colonia del patógeno en enfrentamiento con el antagonista en mm). Para evaluar el grado de micoparasitismo de la cepas seleccionadas de Trichoderma spp., sobre Fusarium sp., los diferentes cultivos duales se evaluaron 10 días después de la siembra. Se determinó el grado de micoparasitismo con base en la escala propuesta por Ezziyyani et al., (2004) (Cuadro 2). Cuadro 2. Escala para determinar el grado de micoparasitismo de Trichoderma spp. sobre Fusarium sp. Escala Grado de micoparasitismo 0 Ninguna invasión de la superficie de la colonia del hongo patógeno. 1 Invasión de ¼ de la superficie de la colonia del hongo patógeno. 2 Invasión de ½ de la superficie de la colonia hongo patógeno. 3 Invasión total de la superficie de la colonia del hongo patógeno. 4 Invasión total de la superficie de la colonia del hongo patógeno y esporulación sobre ella Cinética de crecimiento de Trichoderma spp. y Fusarium sp. en cultivos duales Se utilizaron los datos de crecimiento radial registrados durante los cinco días de evaluación en los cultivos duales (Trichoderma spp., contra Fusarium sp., en PDA), a los 27
38 cuales se les sumaron dos días adicionales de evaluación (días 6 y 7). Los valores de crecimiento radial (variable dependiente) a través del tiempo (variable independiente) de cada antagonista y fitopatógeno durante los siete días, se analizaron en el programa Curve Expert Professional, para obtener el modelo de regresión que explicara mejor la respuesta en crecimiento de la colonia a lo largo del periodo de evaluación; los parámetros considerados fueron el mayor valor de r 2 y menor cuadrado medio del error del modelo. Las curvas de crecimiento de las colonias de ambos microorganismos se realizaron con el programa G-numeric Spreadsheet Selección de cepas nativas de Trichoderma spp., con mayor potencial antagónico Para la selección de las cepas nativas de Trichoderma spp., se tomaron en cuenta los valores de las pendientes de las curvas en los modelos de regresión, el PICR (Porcentaje de inhibición del crecimiento radial) sobre el hongo Fusarium sp., y el grado de micoparasitismo de Trichoderma spp., en cada confrontación antagonista-patógeno. 28
39 7. RESULTADOS Y DISCUSIÓN 7.1. Aislamiento de Trichoderma spp. Del total de muestras de materiales orgánicos utilizados en la preparación de sustratos para el cultivo de la nochebuena de interior, se obtuvieron 18 aislamientos de Trichoderma spp., provenientes de tres municipios del estado de Morelos: Mazatepec, Zacatepec y Tetela del Monte. Las muestras y sitios de procedencia se presentan en el Cuadro 3. Cuadro 3. Denominación y procedencia de los aislamientos de Trichoderma spp. Denominación Muestra Procedencia Trich11 100% Ocochal Zacatepec** Trich12 100% Ocochal Zacatepec Trich13 100% Ocochal Zacatepec Trich14 100% Ocochal Zacatepec Trich15 100% Ocochal Zacatepec Trich16 100% Ocochal Zacatepec Trich17 100% Ocochal Zacatepec Trich18 Producto comercial * Trich19 Producto comercial * Trich20 Trich21 Trich22 Trich23 Trich24 Trich25 Trich26 Trich27 Trich28 Lixiviado de Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. Lombricomposta estiércol ganado vacuno +50% residuos vegetales. 70% Ocochal + 30% tepojal. Mazatepec Mazatepec Mazatepec Mazatepec Mazatepec Mazatepec Mazatepec Mazatepec Tetela del Monte * Producto comercial: Fithan **Colectada en el Campo experimental Zacatepec del INIFAP, pero proveniente de Villa del Carbón, Estado de México. de Villa del Carbón, Estado de México 29
40 Del total de muestras, ocho aislamientos (Trich20, Trich21, Trich22, Trich23, Trich24, Trich25, Trich26, Trich27) provinieron del municipio de Mazatepec, siete aislamientos (Trich11, Trich12, Trich13, Trich14, Trich15, Trich16, Trich17) del Campo Experimental Zacatepec del INIFAP y un aislamiento (T28) de Tetela del Monte. Guilcapi (2009), menciona que Trichoderma spp. es un hongo que se encuentra en diversos suelos agrícolas, especialmente los que contienen una mayor cantidad de materia orgánica o desechos vegetales en descomposición, donde su desarrollo se ve favorecido por la presencia de grandes densidades de raíces, las cuales son colonizadas rápidamente por estos hongos. En el presente estudio, todas las muestras se aislaron de materiales orgánicos que presentaron alto contenido de carbono. Al respecto, Cholango (2009), mencionan que Trichoderma spp., es capaz de utilizar fuentes de carbono y nitrógeno que le permiten colonizar diversos sustratos Identificación de Trichoderma spp. Los aislamientos que crecieron en medio de cultivo PDA, presentaron un micelio algodonoso de color blanco que fue adquiriendo tonalidades verdosas, y en ocasiones un aspecto de anillos en forma concéntrica. Las características macroscópicas de las colonias de los diferentes aislamientos se muestran enseguida en la Figura 12, agrupadas por características similares. Grupo 1. Trich11 y Trich14. Se caracterizaron por la producción de un micelio algodonoso de color blanco que adquirió una tonalidad verde en el centro. Grupo 2. Trich12 y Trich13. Presentaron micelio con tonalidades verdes en toda la colonia. Grupo 3. Trich15 y Trich17. Presentaron micelio algodonoso de color blanco. Grupo 4. Trich16 y Trich20. Mostraron un micelio algodonoso de color blanco. Grupo 5. Trich18 y Trich19. El micelio adquirió tonalidades verdes. 30
41 Grupo 6. Trich21, Trich22, Trich23, Trich24 y Trich25. El micelio adquirió tonalidades verdes y dando un aspecto de anillos en forma concéntrica. Figura 12. Características macroscópicas de las colonias de Trichoderma spp. en medio de cultivo PDA con y sin rosa de bengala. De cada aislado de Trichoderma spp., se prepararon muestras de micelio sobre un portaobjetos con una gota de azul de lactonefol y se observaron al microscopio con una resolución de 40x. Se pudieron apreciar hifas hialinas, fiálides en forma de matraz y conidios de diversas formas con tonalidades verdes (Figura 13). Todas las características macroscópicas y microscópicas mencionadas, concuerdan con lo descrito por Barnet y Hunter (1978) para el género Trichoderma. 31
42 Figura 13. Características microscópicas de Trichoderma spp.; a) Hifas hialinas y fiálides en forma de matraz; b) Conidios elipsoidales, observados en un objetivo de 40 x Aislamientos de Fusarium sp. Se obtuvieron nueve aislamientos de Fusarium sp., del tejido de raíz de plantas de nochebuena con síntomas de pudrición atribuida al ataque de Fusarium sp. (García et al. 2009), provenientes de diferentes viveros del Campo Experimental de Zacatepec. Los detalles se presentan en el (Cuadro 4). Cuadro 4. Denominación y procedencia de los aislamientos de Fusarium sp. Denominación A3A A3B B1A B1B C2A C2B C2C X3A X3B Procedencia Zacatepec Zacatepec Zacatepec Zacatepec Zacatepec Zacatepec Zacatepec Zacatepec Zacatepec 32
43 Los aislamientos que crecieron en medio de cultivo PDA presentaron las siguientes características macroscópicas: tonalidades que van de blanco, rosado pálido, anaranjado, púrpura y micelio algodonoso, pero en algunos casos limoso (Figura 14). Los aislamientos se agruparon en función de las características similares que presentaron. Grupo 1. En el aislamiento A3A y A3B se observó un micelio algodonoso con una coloración rosa y púrpura al centro. Grupo 2. B1A y la B1B presentaron un micelio algodonoso de color púrpura. Grupo 3. C2A presentó un micelio color rosa pálido. Grupo 4. C2B y la C2C un micelio limoso color rosa. Grupo 5. X3A y X3B el micelio fue limoso y adquirió tonalidades rosa pálido. Figura 14. Características macroscópicas de las colonias de Fusarium sp. en medio de cultivo PDA. 33
44 Estas características macroscópicas concuerdan con lo descrito por Seifert (2002), para colonias de Fusarium sp. De cada uno de los aislamientos se obtuvieron cultivos monospóricos siguiendo el procedimiento descrito en el apartado (6.3.1) del capítulo de Materiales y Métodos Identificación morfológica de Fusarium sp. De las nueve cepas de Fusarium sp. descritas en el apartado (7.3.2), se seleccionaron cuatro (A3A, B1A, X3B y C2B) para su identificación morfológica; las primeras tres se eligieron en función del crecimiento radial (mm) presentado, mientras que la última se seleccionó en base a la alta patogenicidad, detectada en bioensayos paralelos. Las cuatro cepas seleccionadas que fueron resembradas en los tres medios de cultivo descritos en materiales y métodos (apartado 6.3.1), presentaron las siguientes características macroscópicas en los diferentes medios de cultivo (Figura 15). PDA. (Agar papa dextrosa). Las cepas A3A, B1A, X3B presentaron una tonalidad rosa y violeta al centro, mientras que la C2B mostró una coloración rosa. En este medio de cultivo fue muy notable la intensidad de pigmentación del micelio de todas las cepas. SNA. (Medio Spezieller Nährstoffmmarmer Agar). Las cuatro cepas presentaron un micelio algodonoso sin coloración. HCA. (Agar hoja clavel). Las cuatro cepas también presentaron un micelio algodonoso sin coloración. 34
45 Figura 15. Características macroscópicas de las cepas A3A, B1A, C2B y X3B de Fusarium sp. en los medios de cultivo PDA, SNA y HCA. En cuanto a las características microscópicas, en las cuatro cepas se presentaron macroconidios de diferente tamaño en el medio de cultivo SNA, en comparación con lo observado en el medio de cultivo HCA, en donde se apreciaron macroconidios más uniformes, así como la presencia de 3 septos y clamidosporas (Figura 16). En PDA, solo se observó la pigmentación que adquiere el medio de cultivo. El micelio fue abundante con una pigmentación de rosa a violeta. Con base en estas observaciones se determinó que las cuatro cepas (A3A, B1A, C2B y X3B) corresponden a la especie de Fusarium oxysporum. Las características macroscópicas 35
46 y microscópicas descritas, concuerdan con las claves de Booth (1971), y Leslie y Summerell (2006), para la identificación de las especies de Fusarium.. Figura 16. Características morfológicas de Fusarium oxysporum, a) Clamidosporas, b) Macroconidios con 3 septos observados en objetivo de 40x. En relación con lo anterior, López y López (2004), demostraron que la mejor expresión de los caracteres morfológicos útiles para la identificación de las especies de Fusarium, se logra en el medio HCA ya que se observa una mayor producción de clamidosporas y macroconidios bien definidos; seguido del SNA donde se aprecian macroconidios diferentes en longitud, y con poca diferenciación en la célula basal y apical en comparación con el medio HCA. Finalmente, en el medio de cultivo PDA resulta más adecuado el estudio de caracteres culturales Selección de cepas nativas de Trichoderma spp. y Fusarium sp., para las pruebas de antagonismo Trichoderma spp. Se seleccionaron nueve cepas de Trichoderma spp., de las 18 obtenidas, tomando como base las que presentaron mayor crecimiento radial (mm) (Cuadro. 5). 36
47 Cuadro 5. Crecimiento radial de los antagonistas al quinto de día evaluación. Cepa Crecimiento radial (mm) *Trich *Trich *Trich *Trich *Trich *Trich *Trich *Trich **Trich18 (producto comercial) 7.61 Trich Trich Trich Trich Trich Trich Trich Trich ** Trich19 (producto comercial) 0.21 *Cepas seleccionadas **Producto comercial (Fithan ) Todas la cepas de Trichoderma spp. tuvieron radios de crecimiento superior al de los aislamientos del patógeno, a excepción de la Trich19 (cepa comercial) que presentó un valor de 0.21 mm. Sin embargo, las cepas Trich 24, Trich21, Trich20, Trich11, Trich16, Trich28, Trich25, Trich12, Trich18 fueron las que presentaron un mayor crecimiento radial (mm) con valores de 8.48, 8.44, 8.28, 8.21, 8.19, 8.11, 7.81, 7.75, respectivamente. Se seleccionaron tres cepas (Trich11, Trich12, Trich16) provenientes del Campo Experimental Zacatepec, cuatro cepas (Trich20, Trich21, Trich24, Trich25) provenientes de Mazatepec y una cepa (Trich28) de Tetela del Monte. Cabe resaltar que no hubo diferencias entre las medias de las cepas seleccionadas de Trichoderma spp, ya que la selección se dio en un rango de 8.48 y 7.61 mm., debido a que 37
48 la mayoría de las cepas de Trichoderma spp., mostraron un crecimiento micelial radial rápido Fusarium oxysporum. Inicialmente se seleccionaron cuatro cepas que presentaron mayor crecimiento radial (mm), pero después se incluyó la cepa C2B, ya que se detectó alta patogenicidad en bioensayos paralelos. Todas las cepas del patógeno presentaron radios de crecimiento inferiores al de los aislamientos de los antagonistas, a excepción de la cepa C2A que presentó un valor significativo de 0.95 mm, mayor al de la cepa Trich19 (producto comercial) que creció 0.21 mm radialmente (Cuadro 6). Cuadro 6. Crecimiento radial de los patógenos al quinto día de evaluación. Cepa Crecimiento radial (mm) *X3B 2.8 *A3A 2.65 *B1A 2.4 *C2C 1.98 **C2B 1.88 A3B 1.84 B1B 1.41 X3A 1.3 C2A 0.95 *Cepas seleccionadas **Cepa incluida por mostrar alta patogenicidad en bioensayos paralelos. Cabe resaltar que no hubo muchas diferencias significativas entre la media de cada cepa de Fusarium sp., ya que la selección se dio en un rango de 2.80 a 1.88 mm, debido al lento crecimiento que presenta Fusarium sp. 38
49 7.4. Pruebas de antagonismo Los tratamientos que corresponden a las confrontaciones entre las nueve cepas de Trichoderma spp. contra las cinco cepas de Fusarium sp. se muestran en el Cuadro 7. Cuadro 7. Tratamientos de interacción entre Trichoderma spp. vs Fusarium sp. Tratamiento Trichoderma spp. Fusarium sp. Tratamiento Trichoderma spp. Fusarium sp. 1 Trich11 A3A 24 Trich21 C2C 2 Trich12 A3A 25 Trich24 C2C 3 Trich16 A3A 26 Trich25 C2C 4 Trich18 A3A 27 Trich28 C2C 5 Trich20 A3A 28 Trich11 X3B 6 Trich21 A3A 29 Trich12 X3B 7 Trich24 A3A 30 Trich16 X3B 8 Trich25 A3A 31 Trich18 X3B 9 Trich28 A3A 32 Trich20 X3B 10 Trich11 B1A 33 Trich21 X3B 11 Trich12 B1A 34 Trich24 X3B 12 Trich16 B1A 35 Trich25 X3B 13 Trich18 B1A 36 Trich28 X3B 14 Trich20 B1A 37 Trich11 C2B 15 Trich21 B1A 38 Trich12 C2B 16 Trich24 B1A 39 Trich16 C2B 17 Trich25 B1A 40 Trich18 C2B 18 Trich28 B1A 41 Trich20 C2B 19 Trich11 C2C 42 Trich21 C2B 20 Trich12 C2C 43 Trich24 C2B 21 Trich16 C2C 44 Trich25 C2B 22 Trich18 C2C 45 Trich28 C2B 23 Trich20 C2C Determinación del porcentaje de inhibición del crecimiento radial (PICR). El porcentaje de inhibición del crecimiento radial (PICR) en las cinco cepas de Fusarium oxysporum fue diferente en cada combinación con las cepas antagonistas (Cuadro 8). En la cepa A3A vario de un 17.5 a 47.1%, en la cepa B1A de un 20.9 a 55%, para la cepa C2C de 19 a 53.8%, en la X3B de un 14.1 a 52.6% y para la C2B de un 15.1 a 44.2%. 39
50 Cuadro 8. Porcentaje de inhibición del crecimiento radial de las cepas A3A, B1A, C2C, X3B y C2B por las cepas de Trichoderma spp. al quinto día de evaluación. Día 5 de evaluación A3A B1A C2C X3B C2B Trat.* (%)** Trat. (%) Trat. (%) Trat. (%) Trat. (%) Media * Tratamiento **Porcentaje de inhibición del crecimiento radial (PICR). Los mayores porcentajes de inhibición en el crecimiento radial (mm) en la cepa A3A, se obtuvieron con la cepa Trich25 (tratamiento 8) con 47.1% y la Trich24 (tratamiento 7) con 41.9%. Para la cepa B1A, la Trich24 (tratamiento 16) con 55% y la cepa Trich25 (tratamiento 17) con 51%. En la cepa C2C nuevamente se presenta la Trich24 (tratamiento 25) alcanzando 53.8% y la Trich21 (tratamiento 24) con un 47.4%. En la X3B, la Trich21 (tratamiento 33) con 52.6%. Finalmente en la C2B, la Trich 24 alcanzo un porcentaje del 44.2% (tratamiento 43) y en la cepa Trich21 (tratamiento 42) alcanzó un 41.7%. Las cepas Trich21, Trich24 y la Trich25 sobresalieron en cada confrontación, ya que lograron inhibir de 41.7 a 55% en el crecimiento radial (mm) de las cepas de Fusarium sp. (A3A, B1A, C2B, X3B y C2B). En un trabajo similar, Michael-Aceves y colaboradores (2009), reportan porcentajes que varían de 5.3 a 42% para Fusarium subglutinans y de 41.9 a 62.9% en Fusarium oxysporum. Las diferencias entre ambos estudios pueden deberse, a la especie de Trichoderma al sitio de procedencia y a la capacidad de inhibir el crecimiento del fitopatógeno. 40
51 En relación a la capacidad de inhibir, esta habilidad se debe a la excreción de metabolitos al medio de cultivo, siendo diferente en cada especie de Trichoderma spp. Cooneg y colaboradores (1997), señalan que cada cepa en particular, puede producir diferentes metabolitos con efectos fungistáticos y enzimas líticas que le permite al antagonista delimitar el crecimiento del fitopatógeno. Entre mayor sea la cantidad de producción de metabolitos o enzimas líticas por las cepas de Trichoderma, se incrementa de la posibilidad de inhibir el crecimiento del micelio de las cepas de Fusarium sp. En el caso de las cepas Trich21, Trich24, Trich 25, la producción fue mayor en comparación con las otras cepas de Trichoderma spp. que presentaron porcentajes menores. En la mayoría de los tratamientos se pudo observar un tipo de halo que limita el crecimiento del hongo fitopatógeno. El promedio de los PICR de todas la cepas de Trichoderma spp., frente a cada cepa de Fusarium sp. correspondiente, arrojó datos que demostraron que la X3B fue la menos inhibida con 30.6%, seguido de la A3A con 30.9% y finalmente la cepa C2B con 32.7%. La última cepa mostró alta patogenicidad en bioensayos paralelos y este resultado demuestra que también fue de las menos inhibidas. Estos resultados pudieran deberse a que en la pared de Fusarium, se encuentra una capa externa de glicoproteínas que cubren a la capa interna, compuesta de quitina y glucanos; de esta forma es un poco más resistente a la actividad de las quitinasas de Trichoderma (Shoffelmeer et al.,1999) Cinética de crecimiento A través del análisis de regresión se obtuvieron modelos con alto grado de ajuste. El análisis de regresión permitió proyectar la ecuación más confiable. Los parámetros considerados fueron el valor de r 2 y cuadrado medio del error del modelo (CME). El coeficiente de determinación (r 2 ) calculado a partir de la regresión, indica la respuesta del crecimiento de la colonia a lo largo del periodo. A medida que el r 2 se acercó a 1 y el CME fue más pequeño, la ecuación fue más confiable Trichoderma spp. vs Fusarium sp. (cepa A3A). Todas las cepas de Trichoderma spp., y la cepa de Fusarium sp., mostraron un r , indicando que la respuesta en crecimiento es explicada en gran medida por el tiempo de incubación; demostrando que estas ecuaciones son confiables para cada antagonista y el 41
52 fitopatógeno. La ecuación que se presentó para todas las cepas de Trichoderma spp. fue: a * b x *x c mientras que para la cepa de Fusarium sp. fue: (a * b+c * x d ) / (b+x d ). En la Figura 17 se muestra la velocidad de crecimiento de Trichoderma spp., en presencia de la cepa A3A de Fusarium sp. Las nueve cepas de Trichoderma spp., presentaron un crecimiento exponencial desde el día 1, en comparación con la cepa A3A, que mostró un crecimiento lento, con datos inferiores a los obtenidos por las cepas de Trichoderma spp. La dispersión de los datos fue diferente en cada cepa de Trichoderma spp., durante los siete días de evaluación; en la Trich11, Trich16, Trich18 y Trich20 fue en los últimos tres días, ya que el crecimiento del fitopatógeno aumentó significativamente en dirección hacia las cepas de Trichoderma spp. En las cepas Trich21, Trich24 y Trich25 se presenta una mayor dispersión de los datos entre el día 4 y 5 de evaluación; se observó un incremento en el desarrollo de estas cepas en dirección hacia el fitopatógeno. Este acelerado crecimiento, influyó en el crecimiento de la A3A; disminuyendo su desarrollo en comparación con las otras cepas de Trichoderma spp.; este mismo resultado también lo presentó la cepa Trich12. El mayor crecimiento de la A3A lo alcanzó en la cepa Trich28; esta cepa mostró un crecimiento lento en comparación con la otras cepas de Trichoderma spp., lo que permitió un mayor desarrollo del fitopatógeno a los obtenidos frente a todas la cepas de Trichoderma spp Trichoderma spp. vs Fusarium sp. (cepa B1A). Al igual que en el enfrentamiento de Trichoderma spp., contra la A3A, todas las cepas de Trichoderma spp., y la de Fusarium sp., mostraron un r , probando que la varianza del crecimiento es explicada por el tiempo de incubación y demostrando la confiabilidad de la ecuación. Para las cepas de Trichoderma spp., la ecuación más sobresaliente fue: a * b (1/x) *x c ; mientras que para B1A fue: (a * b+c * x d ) / (b+x d ). En la Figura 18 se muestra la velocidad de crecimiento de Trichoderma spp., en presencia de la cepa B1A de Fusarium sp. Todas las cepas de Trichoderma spp., presentaron un crecimiento exponencial desde el primer día de evaluación, en comparación con la cepa B1A de Fusarium sp., que mostro un crecimiento lento con datos menores a los alcanzados por las cepas de Trichoderma spp., 42
53 durante los siete días de evaluación en los cultivos duales. La dispersión de los datos fue diferente en cada cepa de Trichoderma spp., durante los siete días de evaluación. Fue mayor en los últimos tres días para la Trich16, ya que el crecimiento del fitopatógeno aumentó significativamente en dirección hacia las cepas de Trichoderma spp., y en la Trich24 y Trich28 durante los primeros días. El mayor crecimiento de la B1A lo alcanzo en la Trich28; esta cepa mostro un crecimiento lento en comparación con la otras cepas de Trichoderma spp., lo que permitió un mayor desarrollo del fitopatógeno a los obtenidos frente a todas la cepas de Trichoderma spp Trichoderma spp. vs Fusarium sp. (cepa C2C). Como en los enfrentamientos anteriores, las cepas de Trichoderma spp. y la de Fusarium sp., mostraron un r , indicando que la varianza del crecimiento es explicada por el tiempo de incubación; demostrando que estas ecuaciones son confiables para cada antagonista y el fitopatógeno. La ecuación más destacada en Trichoderma spp., fue: a * b (1/x) *x c, mientras que la C2C fue: (a * b+c * x d ) / (b+x d ). En la Figura 19 se muestra la velocidad de crecimiento de Trichoderma spp., en presencia de la cepa C2C de Fusarium sp. Todas las cepas del antagonista presentaron un crecimiento exponencial desde el día 1 en que fueron incubadas, en comparación con la C2C que mostró un crecimiento lento durante la evaluación. La dispersión de los datos fue diferente en cada cepa de Trichoderma spp. En las cepas Trich11, Trich20, Trich21, Trich24 y Trich25 la dispersión de los datos fue menor y el crecimiento del fitopatógeno aumentó significativamente en dirección hacia las cepas de Trichoderma spp. En la Trich12 y Trich18 se empezó a mostrar una menor dispersión a partir del cuarto día. En la Trich16 la dispersión aumento desde el día 3. El mayor crecimiento de la C2C fue nuevamente frente a Trich28. 43
54 Figura 17. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa A3A de Fusarium sp. 44
55 Continuación de Figura
56 Figura 18. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa B1A de Fusarium sp. 46
57 Continuacion de Figura
58 Figura 19. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa C2C de Fusarium sp. 48
59 Continuacion de Figura
60 Trichoderma spp. vs Fusarium sp. (cepa X3B). Las nueve cepas de Trichoderma spp., y la de Fusarium sp. (X3B) mostraron un r , indicando que la varianza del crecimiento es explicada por el tiempo de incubación y señalando que estas ecuaciones son confiables para cada antagonista y el fitopatógeno. La ecuación más sobresaliente para Trichoderma spp., fue: a * b (1/x) *x c, mientras que para la X3B fue: 1/(a+b * x c ). En la Figura 20 se muestra la velocidad de crecimiento de Trichoderma spp., en presencia de la cepa X3B de Fusarium sp. Todas las cepas de Trichoderma spp., presentaron un crecimiento exponencial desde el primer día de evaluación, a diferencia de la X3B, al mostrar un crecimiento lento durante toda la evaluación. La dispersión de los datos fue diferente en cada cepa de Trichoderma spp. Las cepas Trich12, Trich20, Trich21, Trich24 y Trich25 presentan un mayor crecimiento radial (mm) a partir del segundo día. Mientras que la X3B de Fusarium sp., obtuvo un mayor crecimiento en la Trich28, a partir de ahí su crecimiento aumento significativamente en comparación con la otras cepas de Trichoderma spp Trichoderma spp. vs Fusarium sp. (cepa C2B). En esta cepa, el crecimiento radial (mm) se evaluó durante cinco días. De la misma forma que en los enfrentamientos anteriores, todas las cepas de Trichoderma spp. y la de Fusarium sp., mostraron un r , indicando que la varianza del crecimiento es explicada por el tiempo de incubación; demostrando que estas ecuaciones son confiables para cada antagonista y el fitopatógeno. La ecuación más sobresaliente para Trichoderma spp., fue: a * b x *x c y para la C2B fueron: (a * b+c * x d ) / (b+x d ) y a * exp (b/x). En la Figura 21 se muestra la velocidad de crecimiento de Trichoderma spp., en presencia de la cepa C2B de Fusarium sp. Todas las cepas del antagonista presentaron un crecimiento exponencial desde el primer día, en comparación con la C2B en los cultivos duales. La dispersión de los datos fue diferente en cada cepa de Trichoderma spp., durante los cinco días de evaluación. En las cepas Trich18 y Trich28 la dispersión es mayor desde el segundo día, los datos son menores a medida que pasa el tiempo, a diferencia de las otras cepas. Las demás cepas (Trich11, Trich12, Trich16, Trich20, Trich21, Trich24 y la Trich25) muestran menor 50
61 dispersión en sus datos y el crecimiento de la cepa C2B en cada una de ellas aumenta de manera significativa. De manera general, el análisis de regresión demostró que la ecuación más sobresaliente para Trichoderma spp. fue: a * b (1/x) *x c con un r y para Fusarium sp., fue: (a * b+c * x d ) / (b+x d ) con un r Los diferentes modelos que presentaron tanto Trichoderma spp. como Fusarium sp., se le puede atribuir al diferente crecimiento de cada cepa del antagonista frente a los fitopatógenos y viceversa. Se puede observar que el crecimiento radial (mm) aumenta a medida que pasa el tiempo de evaluación, dicho aumento, va acompañado de la destrucción del micelio del fitopatógeno y la producción de esporas. La actividad de los antagonistas frente a las cepas de Fusarium (A3A, B1A, C2C, X3B y C2B) es el resultado de la competencia por sustrato y nutrientes que impiden el desarrollo de los fitopatógenos. La presencia de otro hongo frente a Trichoderma spp., en algunas ocasiones, acelera su crecimiento, como en el caso de las cepas Trich12, Trich21, Trich24 y Trich25. Este aceleramiento probablemente se debe a la estimulación que recibe el antagonista al reconocer las lectinas unidas al fitopatógeno (Rocha-Ramírez et al., 2002). 51
62 Figura 20. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa X3B de Fuarium sp. 52
63 Continuación de Figura
64 Figura 21. Crecimiento radial de las nueve cepas de Trichoderma spp. en competencia con la cepa C2B de Fusarium sp. 54
65 Continuación de Figura
66 7.6. Micoparasitismo Las cepas de Trichoderma spp., fueron clasificadas de acuerdo al grado de micoparasitismo que obtuvieron a los 10 días después de la siembra frente a las cepas de Fusarium sp. (A3A, B1A, C2C, X3B y C2B) en los cultivos duales (Cuadro 9). Cuadro 9. Grado de micoparasitismo de los tratamientos correspondientes a los cultivos duales de Trichoderma spp. y Fusarium sp. al décimo día de evaluación. *Tratamiento Día 10 de evaluación A3A B1A C2C X3B C2B Trat.* Escala Trat. Escala Trat. Escala Trat. Escala Trat. Escala Se utilizó la escala de Ezziyyani et al., (2004), que establece el grado de micoparasitismo de Trichoderma spp. sobre Fusarium sp. Se determinó que la cepa comercial Trich18 (tratamientos 4, 13, 22, 31 y 40) obtuvo el grado de micoparasitismo 4, el más alto, frente a las cinco cepas de Fusarium sp., al igual que la cepa Trich20 (tratamiento 32 y 41) frente a las cepa X3B y C2B. Estas cepas cubrieron totalmente la superficie del micelio de Fusarium sp. y además esporulan sobre él. Entre las cepas que alcanzaron el grado de micoparasitismo 3, se encuentran la cepa Trich20 (tratamiento 5,14 y 23) frente A3A, B1A y C2C; al igual que la cepa Trich16 (tratamiento 21, 28 y 37) frente a la C2C, X3B y C2B. Estas cepas lograron cubrir la superficie del hongo, pero no esporular sobre él. Solo dos cepas (Trich11 y Trich16) lograron presentar un grado de micoparasitismo 2 (tratamiento 1 y 3) sobre la A3A, al cubrir la mitad de la superficie. Las cepas que presentaron grado de micoparasitismo 1 fueron la cepa Trich11 (tratamiento 10 y 19) frente a B1A y C2C; al 56
67 igual que la cepa Trich12 (tratamiento 11 y 29) frente a B1A y X3B y la cepa Trich28 (Tratamiento 36 y 45) frente a C2B y X3B. Estas cepas llegaron a cubrir el 25% de la superficie de Fusarium sp. (Figura 22 a la 26). Los resultados obtenidos demostraron que la cepa comercial Trich18 presentó un grado de micoparasitismo 4 frente a todas las cepas de Fusarium sp. (A3A, B1A, C2C, X3B y C2B), pero la Trich20 obtuvo grados de micoparasitismo 4 y 3 frente a todas las cepas de Fusarium sp. La cepa Trich16 alcanzó diferentes grados de micoparasitismo 1, 2, 3 contra todas las cepas de Fusarium sp., al igual que la cepa Trich11. Resultados similares son reportados por Solano (2004), al evaluar 3 cepas de Trichoderma spp. en cultivos duales contra Fusarium oxysporum y Fusarium subglutinans; en ambas evaluaciones se obtuvo un grado de micoparasitismo 2, mientras que Michael-Aceves et al.,(2001), reportaron diferentes grados de micoparasitismo 1, 2 y 3 en estas dos especies con buenas perspectivas para ser utilizados en campo. De esta manera se observó el proceso de control de cada cepa de Trichoderma spp., sobre el desarrollo de las cinco cepas de Fusarium sp. Con el transcurso del tiempo se observó un ataque del antagonista al fitopatógeno. Las cepas de Trichoderma spp., continuaron creciendo hasta invadir totalmente la superficie del fitopatógeno e incluso esporular sobre él; estos efectos pueden estar relacionados con la abundante producción de enzimas como quitinasas, glucanasas, celulasas y proteasas por parte de las cepas de Trichoderma, y que son un componente importante en el proceso del micoparasitismo (De la Cruz et al., 1992; Goldman et al., 1994). 57
68 Figura 22. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa A3A de Fusarium sp. 58
69 . Figura 23. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa B1A de Fusarium sp. 59
70 Figura 24. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa de C2C de Fusarium sp. 60
71 Figura 25. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa X3B de Fusarium sp. 61
72 Figura 26. Cultivos duales de las 9 cepas de Trichoderma spp. sobre la cepa C2B de Fusarium sp. 62
73 7.7. Antibiosis Trichoderma spp., secreta metabolitos secundarios que al entrar en contacto con Fusarium sp. detienen su crecimiento. Este mecanismo se pudo observar en la cepa Trich20 frente a las cinco cepas de Fusarium sp. (A3A, B1A, C2C, X3B y C2B), observándose un cambio de pigmentación del medio de cultivo PDA por un color amarillento (Figura 27). Elad y Kapat (1999), y Fravel (1998), señalan que algunos metabolitos producidos por Trichoderma spp. son la viridina o gliotoxina; estos degradan la pared celular del fitopatógeno y disminuyen los niveles de enfermedad. Figura 27. Antibiosis en la cepa Trich20 frente a las cinco cepas de Fusarium sp Selección de cepas nativas de Trichoderma spp., con mayor potencial antagónico. Como se observó anteriormente en la cinética de crecimiento de Trichoderma spp., las nueve cepas mostraron un crecimiento radial (mm) rápido durante los siete días de evaluación en cultivos duales. Las cepas Trich12, Trich21, Trich24 y Trich25 mostraron un acelerado crecimiento radial (mm) frente a las 5 cepas del fitopatógeno (A3A, B1A, C2C, X3B y C2B); estas tres últimas que pertenecen al municipio de Mazatepec, fueron capaces de inhibir de un 41 a 54% el crecimiento del micelio de las cinco cepas de Fusarium., pero mostraron grado 0 de micoparasitismo al décimo día de evaluación, al no cubrir la superficie del fitopatógeno. Si bien no logran crecer sobre el fitopatógeno, consiguen 63
Control químico y biológico en árboles con síntoma de tristeza del aguacate en Matanguaran Mpio. de Uruapan Michoacán, México
 Control químico y biológico en árboles con síntoma de tristeza del aguacate en Matanguaran Mpio. de Uruapan Michoacán, México R. Martínez 1, J. Ledesma 1, J. Morales 1, M. Pedraza 1, A. Chávez 1, K. Morales
Control químico y biológico en árboles con síntoma de tristeza del aguacate en Matanguaran Mpio. de Uruapan Michoacán, México R. Martínez 1, J. Ledesma 1, J. Morales 1, M. Pedraza 1, A. Chávez 1, K. Morales
INTRODUCCIÓN AL ESTUDIO DE HONGOS
 UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN FACULTAD DE CIENCIAS QUÍMICAS INTRODUCCIÓN AL ESTUDIO DE HONGOS M.C. Francisco Javier Gómez Vega Mayo del 2005 H O N G O S No existe un acuerdo general sobre los límites
UNIVERSIDAD AUTÓNOMA DE NUEVO LEÓN FACULTAD DE CIENCIAS QUÍMICAS INTRODUCCIÓN AL ESTUDIO DE HONGOS M.C. Francisco Javier Gómez Vega Mayo del 2005 H O N G O S No existe un acuerdo general sobre los límites
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR
 UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
Métodos de aislamiento
 Métodos de aislamiento Aislamiento de hongos y bacterias Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Métodos de aislamiento Técnicas de Aislamiento de hongos
Métodos de aislamiento Aislamiento de hongos y bacterias Unidad de Fitopatología Dto. de Protección Vegetal Facultad de Agronomía. Dr. Pedro Mondino Métodos de aislamiento Técnicas de Aislamiento de hongos
Patologías del suelo en alcachofa Marchitez vascular en lechuga
 JORNADA TÉCNICA: Manejo de enfermedades del suelo y patógenos emergentes en cultivos hortícolas: pimiento, alcachofa, lechuga y brasicas La Alberca, 15-noviembre-2016 Patologías del suelo en alcachofa
JORNADA TÉCNICA: Manejo de enfermedades del suelo y patógenos emergentes en cultivos hortícolas: pimiento, alcachofa, lechuga y brasicas La Alberca, 15-noviembre-2016 Patologías del suelo en alcachofa
Objetivos: Objetivos: Bibliografía obligatoria. Interacción huésped patógeno. Mecanismos de defensa de las plantas
 Objetivos: MECANISMOS DE DEFENSA e INFLUENCIA DEL AMBIENTE Ing. Agr. MSc. Vivienne Gepp Curso de Fitopatología Mecanismos de defensa: - Comprender de manera general cómo las plantas se defienden de los
Objetivos: MECANISMOS DE DEFENSA e INFLUENCIA DEL AMBIENTE Ing. Agr. MSc. Vivienne Gepp Curso de Fitopatología Mecanismos de defensa: - Comprender de manera general cómo las plantas se defienden de los
el amarillamiento en el cultivo de tomate de cáscara
 1 CONTENIDO Página INTRODUCCIÓN ENFERMEDADES DE ORIGEN VIRAL ENFERMEDADES DE ORIGEN FUNGOSO PLAGAS QUE CONTRIBUYEN A ACENTUAR EL AMARILLAMIENTO MEDIDAS PARA PREVENIR EL AMARILLAMIENTO EN EL CULTIVO DE
1 CONTENIDO Página INTRODUCCIÓN ENFERMEDADES DE ORIGEN VIRAL ENFERMEDADES DE ORIGEN FUNGOSO PLAGAS QUE CONTRIBUYEN A ACENTUAR EL AMARILLAMIENTO MEDIDAS PARA PREVENIR EL AMARILLAMIENTO EN EL CULTIVO DE
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
PROGRAMA DE ESTÍMULOS A LA INNOVACIÓN
 TÍTULO DEL PROYECTO: EVALUACIÓN DE EXTRACTOS DE Aloe vera EN LA BIORREMEDIACIÓN DE SUELOS CONTAMINADOS POR PESTICIDAS EMPRESA BENEFICIADA: Mezclas y Fertilizantes S.A. de C.V. MODALIDAD: PROINNOVA MONTO
TÍTULO DEL PROYECTO: EVALUACIÓN DE EXTRACTOS DE Aloe vera EN LA BIORREMEDIACIÓN DE SUELOS CONTAMINADOS POR PESTICIDAS EMPRESA BENEFICIADA: Mezclas y Fertilizantes S.A. de C.V. MODALIDAD: PROINNOVA MONTO
METODOLOGIA PARA LA CONSTRUCCION Y APLICACION DE MODELOS DE SIMULACION DINAMICA A PROCESOS DE IMPORTANCIA AGRÍCOLA
 METODOLOGIA PARA LA CONSTRUCCION Y APLICACION DE MODELOS DE SIMULACION DINAMICA A PROCESOS DE IMPORTANCIA AGRÍCOLA Resumen ejecutivo La construcción de modelos de simulación dinámica es la herramienta
METODOLOGIA PARA LA CONSTRUCCION Y APLICACION DE MODELOS DE SIMULACION DINAMICA A PROCESOS DE IMPORTANCIA AGRÍCOLA Resumen ejecutivo La construcción de modelos de simulación dinámica es la herramienta
Historia de la Ecofisiología
 Historia de la Ecofisiología Años 1895 Geografos Distribución global de las plantas Observaciones consistentes de patrones de morfología asociados con diferentes tipos de ambientes. Geografía de plantas
Historia de la Ecofisiología Años 1895 Geografos Distribución global de las plantas Observaciones consistentes de patrones de morfología asociados con diferentes tipos de ambientes. Geografía de plantas
LAURA DANIELA VARGAS RAYO ANA MARIA VICTORINO MANRIQUE
 LAURA DANIELA VARGAS RAYO ANA MARIA VICTORINO MANRIQUE Director Cesar Alfonso Ariza Castillo Ing. agrónomo M.sc ciencias agrarias con énfasis en fitomejoramiento INGENIERÍA AGRONÓMICA GRUPO DE INVESTIGACIÓN
LAURA DANIELA VARGAS RAYO ANA MARIA VICTORINO MANRIQUE Director Cesar Alfonso Ariza Castillo Ing. agrónomo M.sc ciencias agrarias con énfasis en fitomejoramiento INGENIERÍA AGRONÓMICA GRUPO DE INVESTIGACIÓN
GUÍA DE TRABAJOS PRÁCTICOS MICROBIOLOGÍA FARMACIA
 1 GUÍA DE TRABAJOS PRÁCTICOS MICROBIOLOGÍA FARMACIA ÁREA MICOLOGÍA AÑO 2014 2 TRABAJO PRÁCTICO N 1 Tema: - Macromorfología de las colonias fúngicas - Micromorfología del desarrollo fúngico vegetativo -
1 GUÍA DE TRABAJOS PRÁCTICOS MICROBIOLOGÍA FARMACIA ÁREA MICOLOGÍA AÑO 2014 2 TRABAJO PRÁCTICO N 1 Tema: - Macromorfología de las colonias fúngicas - Micromorfología del desarrollo fúngico vegetativo -
Programa BIO 252 Biología de Microorganismos
 Programa BIO 252 Biología de Microorganismos 1. Identificación 1.- Profesor : Dr. Victoriano Campos 2.- Sigla : BIO 252 3.- Créditos : 4 4.- Pre-requisitos : BIO 240 5.- Horas Teóricas : 4 6.- Horas Prácticas
Programa BIO 252 Biología de Microorganismos 1. Identificación 1.- Profesor : Dr. Victoriano Campos 2.- Sigla : BIO 252 3.- Créditos : 4 4.- Pre-requisitos : BIO 240 5.- Horas Teóricas : 4 6.- Horas Prácticas
LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN
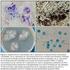 LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN Levaduras de Importancia Médica Levaduras del género Candida Levaduras del género Cryptococcus Levaduras del género Malassezia Levaduras del género
LEVADURAS DE INTERÉS MÉDICO PRUEBAS DE IDENTIFICACIÓN Levaduras de Importancia Médica Levaduras del género Candida Levaduras del género Cryptococcus Levaduras del género Malassezia Levaduras del género
III. RESULTADOS. TABLA N 1 Forma e intensidad de Antagonismo in vitro por el método directo. R. Solani R + T
 Efecto Antagónico Y Biocontrolador De Algunos Microorganismos Saprofíticos Contra Rhizoctonia Solani Un Fitopatogeno Causante Del (Damping Off) En Plantas De Tomate.Rodríguez Limach, Verónica Julia. III.
Efecto Antagónico Y Biocontrolador De Algunos Microorganismos Saprofíticos Contra Rhizoctonia Solani Un Fitopatogeno Causante Del (Damping Off) En Plantas De Tomate.Rodríguez Limach, Verónica Julia. III.
Flor de Liana Carolina Torres Medina
 UNIVERSIDAD NACIONAL AGRARIA LA MOLINA Facultad de Ciencias Forestales Evaluación de las propiedades físico mecánicas de la especie Pino chuncho (Schizolobium amazonicum Huber ex Ducke) proveniente de
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA Facultad de Ciencias Forestales Evaluación de las propiedades físico mecánicas de la especie Pino chuncho (Schizolobium amazonicum Huber ex Ducke) proveniente de
Detección de cuatro enfermedades foliares en rama negra (Conyza bonariensis) en Entre Ríos
 Área Investigación Grupo Protección Vegetal y Factores Bióticos Centro Regional Entre Ríos Estación Experimental Agropecuaria Paraná Detección de cuatro enfermedades foliares en rama negra (Conyza bonariensis)
Área Investigación Grupo Protección Vegetal y Factores Bióticos Centro Regional Entre Ríos Estación Experimental Agropecuaria Paraná Detección de cuatro enfermedades foliares en rama negra (Conyza bonariensis)
Hongos fitopatógenos II
 Hongos fitopatógenos II 1. Introducción. Definición. 2. Principales grupos taxonómicos. 4. Desarrollo de un enfermedad fúngica 3. Sintomatología y diagnóstico II 4. Ciclo de una enfermedad fúngica 5. Manejo
Hongos fitopatógenos II 1. Introducción. Definición. 2. Principales grupos taxonómicos. 4. Desarrollo de un enfermedad fúngica 3. Sintomatología y diagnóstico II 4. Ciclo de una enfermedad fúngica 5. Manejo
Concepto de enfermedad
 CONTENIDO Concepto de enfermedad Curso de Fitopatología Ing. Agr. Vivienne Gepp Complejo causal de la enfermedad. Concepto de patógeno. Conceptos de inóculo y fuente de inóculo. Patogénesis. Ciclo de la
CONTENIDO Concepto de enfermedad Curso de Fitopatología Ing. Agr. Vivienne Gepp Complejo causal de la enfermedad. Concepto de patógeno. Conceptos de inóculo y fuente de inóculo. Patogénesis. Ciclo de la
PRUEBAS DE COMPATIBILIDAD DE HONGOS ENTOMOPATÓGENOS Y ANTAGONISTAS. VS FUNGICIDAS QUIMICOS REALIZADAS EN BIOQUIRAMA S.A.S.
 PRUEBAS DE COMPATIBILIDAD DE HONGOS ENTOMOPATÓGENOS Y ANTAGONISTAS. VS FUNGICIDAS QUIMICOS REALIZADAS EN BIOQUIRAMA S.A.S. INTRODUCCION En los nuevos esquemas del manejo inteligente de plagas y enfermedades
PRUEBAS DE COMPATIBILIDAD DE HONGOS ENTOMOPATÓGENOS Y ANTAGONISTAS. VS FUNGICIDAS QUIMICOS REALIZADAS EN BIOQUIRAMA S.A.S. INTRODUCCION En los nuevos esquemas del manejo inteligente de plagas y enfermedades
USO DE LEVADURAS COMO PRODUCTORES DE PROTEINAS DE INTERES FARMACEUTICO
 USO DE LEVADURAS COMO PRODUCTORES DE PROTEINAS DE INTERES FARMACEUTICO INTRODUCCION Un microoganismo de uso industrial debe producir la sustancia de interés; estar disponible en cultivo puro; debe ser
USO DE LEVADURAS COMO PRODUCTORES DE PROTEINAS DE INTERES FARMACEUTICO INTRODUCCION Un microoganismo de uso industrial debe producir la sustancia de interés; estar disponible en cultivo puro; debe ser
Producción de plántulas de Lechuga en
 Boletín Técnico Producción de plántulas de Lechuga en La lechuga (Lactuca sativa L.) es una planta anual, propia de las regiones semi-templadas, que se cultiva con fines alimentarios. Debido a las muchas
Boletín Técnico Producción de plántulas de Lechuga en La lechuga (Lactuca sativa L.) es una planta anual, propia de las regiones semi-templadas, que se cultiva con fines alimentarios. Debido a las muchas
Estimulación de suelos e hidropónicos supresores de enfermedades, mediante su enriquecimiento biológico
 III JORNADAS INTERNACIONALES SOBRE FEROMONAS, ATRAYENTES, TRAMPAS Y CONTROL BIOLOGICO: HERRAMIENTAS PARA LA GESTIÓN INTEGRADA MURCIA, 19 Y 20 DE NOVIEMBRE DE 2013 Estimulación de suelos e hidropónicos
III JORNADAS INTERNACIONALES SOBRE FEROMONAS, ATRAYENTES, TRAMPAS Y CONTROL BIOLOGICO: HERRAMIENTAS PARA LA GESTIÓN INTEGRADA MURCIA, 19 Y 20 DE NOVIEMBRE DE 2013 Estimulación de suelos e hidropónicos
Conclusiones. V. CONCLUSIONES.
 V. CONCLUSIONES. Visualmente no ha habido ninguna planta que haya presentado síntomas de deficiencia o toxicidad, aunque en muchas ocasiones estos síntomas no se aprecien a no ser a niveles muy altos de
V. CONCLUSIONES. Visualmente no ha habido ninguna planta que haya presentado síntomas de deficiencia o toxicidad, aunque en muchas ocasiones estos síntomas no se aprecien a no ser a niveles muy altos de
PADIUM CONTROL DE OIDIO MEDIANTE EL USO DE ENZIMAS NATURALES Y EXTRACTOS VEGETALES
 PADIUM CONTROL DE OIDIO MEDIANTE EL USO DE ENZIMAS NATURALES Y EXTRACTOS VEGETALES 1. Introducción Los oídios son probablemente el grupo más numeroso de patógenos fúngicos de plantas que permanecen sin
PADIUM CONTROL DE OIDIO MEDIANTE EL USO DE ENZIMAS NATURALES Y EXTRACTOS VEGETALES 1. Introducción Los oídios son probablemente el grupo más numeroso de patógenos fúngicos de plantas que permanecen sin
Índice. viii. Prólogo
 Editor viii Índice Prólogo vii Capítulo 1. Panorama de la Horticultura Protegida en México 1 Introducción 1 El desarrollo de la horticultura protegida en el país 2 Polos de desarrollo de la horticultura
Editor viii Índice Prólogo vii Capítulo 1. Panorama de la Horticultura Protegida en México 1 Introducción 1 El desarrollo de la horticultura protegida en el país 2 Polos de desarrollo de la horticultura
CURSO DE CONTROL BIOLÓGICO DE PATÓGENOS DE PLANTAS
 CURSO DE CONTROL BIOLÓGICO DE PATÓGENOS DE PLANTAS Introducción: Se considera que en la actualidad el Control Biológico de las enfermedades de plantas ha tomado una trascendental importancia. Esto es debido
CURSO DE CONTROL BIOLÓGICO DE PATÓGENOS DE PLANTAS Introducción: Se considera que en la actualidad el Control Biológico de las enfermedades de plantas ha tomado una trascendental importancia. Esto es debido
Biología 2 Segundo de Media. Proyecto 1 Agosto/Sept Prof.: Lic. Manuel B. Noboa G.
 Biología 2 Segundo de Media. Proyecto 1 Agosto/Sept. 2016. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 1: Las funciones vitales: Nutrición Animal y Vegetal. Cómo puedes describir las funciones vitales de
Biología 2 Segundo de Media. Proyecto 1 Agosto/Sept. 2016. Prof.: Lic. Manuel B. Noboa G. Unidad Nº 1: Las funciones vitales: Nutrición Animal y Vegetal. Cómo puedes describir las funciones vitales de
Producción de lombriz roja californiana (eisenia foetida) a nivel de traspatio en tres tipos de sustrato
 Producción de lombriz roja californiana (eisenia foetida) a nivel de traspatio en tres tipos de sustrato Introducción Ing. Gutiérrez-García. Minerva, * Biol. Ruiz-Acosta Silvia del Carmen,* Dr. Galindo-Alcántara
Producción de lombriz roja californiana (eisenia foetida) a nivel de traspatio en tres tipos de sustrato Introducción Ing. Gutiérrez-García. Minerva, * Biol. Ruiz-Acosta Silvia del Carmen,* Dr. Galindo-Alcántara
Logros. Crecimiento bacteriano. Crecimiento. Finalidad de las bacterias
 Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
Fisiología bacteriana Dr. Juan C. Salazar jcsalazar@med.uchile.cl Programa de Microbiología y Micología ICBM, Facultad de Medicina Finalidad de las bacterias Logros Crecimiento Cómo lo hacen? Herramientas
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
SECADO DE LA MADERA. Ing. José Ricardo Morris Carreño Ingeniero Forestal Universidad Distrital. Febrero de 2008
 SECADO DE LA MADERA Ing. José Ricardo Morris Carreño Ingeniero Forestal Universidad Distrital Febrero de 2008 Definición El secado de la madera consiste en obtener un contenido de humedad que quede en
SECADO DE LA MADERA Ing. José Ricardo Morris Carreño Ingeniero Forestal Universidad Distrital Febrero de 2008 Definición El secado de la madera consiste en obtener un contenido de humedad que quede en
Producción de plántulas de Stevia en
 Boletín Técnico Producción de plántulas de Stevia en La Stevia, Stevia rebaudiana (Bertoni), es un arbusto descubierto y utilizado inicialmente por los guaraníes de Paraguay, que lo cultivan desde tiempos
Boletín Técnico Producción de plántulas de Stevia en La Stevia, Stevia rebaudiana (Bertoni), es un arbusto descubierto y utilizado inicialmente por los guaraníes de Paraguay, que lo cultivan desde tiempos
Interacciones antagónicas y sinérgicas en consorcios microbianos:
 Interacciones antagónicas y sinérgicas en consorcios microbianos: influencia en el crecimiento de plantas Dra. Maribel Plascencia Jatomea Introducción Las comunidades microbianas interactúan de varias
Interacciones antagónicas y sinérgicas en consorcios microbianos: influencia en el crecimiento de plantas Dra. Maribel Plascencia Jatomea Introducción Las comunidades microbianas interactúan de varias
EMPRESA BENEFICIADA: Tecnologías AgriBest S.A. de C.V.
 NUMERO DE PROYECTO: 217595 EMPRESA BENEFICIADA: Tecnologías AgriBest S.A. de C.V. TÍTULO DEL PROYECTO: Desarrollo de un prototipo a base de micro y nano encapsulados de un producto para la nutrición y
NUMERO DE PROYECTO: 217595 EMPRESA BENEFICIADA: Tecnologías AgriBest S.A. de C.V. TÍTULO DEL PROYECTO: Desarrollo de un prototipo a base de micro y nano encapsulados de un producto para la nutrición y
HONGOS ENTOMOPATÓGENOS PARA EL CONTROL DE HORMIGAS CORTADORAS
 HONGOS ENTOMOPATÓGENOS PARA EL CONTROL DE HORMIGAS CORTADORAS Laboratorio de Micología Facultad de Ciencias/Facultad de Ingeniería Sandra Lupo Lina Bettucci Susana Tiscornia Belen Corallo Alicia Sanchez
HONGOS ENTOMOPATÓGENOS PARA EL CONTROL DE HORMIGAS CORTADORAS Laboratorio de Micología Facultad de Ciencias/Facultad de Ingeniería Sandra Lupo Lina Bettucci Susana Tiscornia Belen Corallo Alicia Sanchez
Conservación y actividad probiótica de biomasa cultivada en sustratos naturales
 Conservación y actividad probiótica de biomasa cultivada en sustratos naturales Resumen M. en C. Román Jiménez Vera M. en C. Nicolás González Cortés M. A. E. S. Arturo Magaña Contreras Est. IA. Cristina
Conservación y actividad probiótica de biomasa cultivada en sustratos naturales Resumen M. en C. Román Jiménez Vera M. en C. Nicolás González Cortés M. A. E. S. Arturo Magaña Contreras Est. IA. Cristina
Tema 7. La clasificación de los seres vivos. Microorganismos
 La clasificación de los seres vivos Tema 7 La clasificación de los seres vivos. Microorganismos Biología y Geología Número de especies Número de grupos La clasificación de los seres vivos Los criterios
La clasificación de los seres vivos Tema 7 La clasificación de los seres vivos. Microorganismos Biología y Geología Número de especies Número de grupos La clasificación de los seres vivos Los criterios
ENSAYO UNIFORME DE RENDIMIENTO DE HIBRIDOS COMERCIALES DE MAIZ (Zea mays) EN EL VALLE DEL SANTA
 UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA DEPARTAMENTO ACADEMICO DE AGROINDUSTRIA E.A.P. INGENIERIA AGRONOMA INFORME DE INVESTIGACION 2011 ENSAYO UNIFORME DE RENDIMIENTO DE HIBRIDOS COMERCIALES
UNIVERSIDAD NACIONAL DEL SANTA FACULTAD DE INGENIERIA DEPARTAMENTO ACADEMICO DE AGROINDUSTRIA E.A.P. INGENIERIA AGRONOMA INFORME DE INVESTIGACION 2011 ENSAYO UNIFORME DE RENDIMIENTO DE HIBRIDOS COMERCIALES
Evaluación histopatológica de la proliferación vegetativa y floral (Fusarium spp.) en dos cultivares de mango (Mangifera indica L.
 INSTITUTO DE FITOSANIDAD FITOPATOLOGIA Evaluación histopatológica de la proliferación vegetativa y floral (Fusarium spp.) en dos cultivares de mango (Mangifera indica L.) en México Elvis García López 25
INSTITUTO DE FITOSANIDAD FITOPATOLOGIA Evaluación histopatológica de la proliferación vegetativa y floral (Fusarium spp.) en dos cultivares de mango (Mangifera indica L.) en México Elvis García López 25
Hongos. Hongos ornamentales. Psilocybes Amanita muscaria Cortinarius violaceus
 Hongos Hongos ornamentales Psilocybes Amanita muscaria Cortinarius violaceus Hongos alimenticios Ustilago maydis (zeae) Amanita cesarea Boletus edulis Agaricus campestris Rossula brevipes (stuntzii) Candida
Hongos Hongos ornamentales Psilocybes Amanita muscaria Cortinarius violaceus Hongos alimenticios Ustilago maydis (zeae) Amanita cesarea Boletus edulis Agaricus campestris Rossula brevipes (stuntzii) Candida
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Introducción
 PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
Concepto de enfermedad. Curso de Fitopatología 2005 Ing. Agr. Vivienne Gepp
 Concepto de enfermedad Curso de Fitopatología 2005 Ing. Agr. Vivienne Gepp CONTENIDO Concepto de enfermedad. Patogenicidad y parasitismo. Niveles de parasitismo. Clasificación etiológica de las enfermedades.
Concepto de enfermedad Curso de Fitopatología 2005 Ing. Agr. Vivienne Gepp CONTENIDO Concepto de enfermedad. Patogenicidad y parasitismo. Niveles de parasitismo. Clasificación etiológica de las enfermedades.
Clínica al Día. Enfermedades del Cilantrillo
 Universidad de Puerto Rico Recinto Universitario de Mayagüez Colegio de Ciencias Agrícolas Departamento de Protección de Cultivos Clínica al Día Enfermedades del Cilantrillo La producción de cilantrillo
Universidad de Puerto Rico Recinto Universitario de Mayagüez Colegio de Ciencias Agrícolas Departamento de Protección de Cultivos Clínica al Día Enfermedades del Cilantrillo La producción de cilantrillo
Sistemas de Producción de Frutales: estrategias para su implementación en mora (Rubus glaucus Benth)
 Sistemas de Producción de Frutales: estrategias para su implementación en mora (Rubus glaucus Benth) Wilson Vásquez Castillo Quito, Mayo-2016 Contenido Generalidades Objetivos Resultados Conclusiones Organización
Sistemas de Producción de Frutales: estrategias para su implementación en mora (Rubus glaucus Benth) Wilson Vásquez Castillo Quito, Mayo-2016 Contenido Generalidades Objetivos Resultados Conclusiones Organización
Controladores biológicos de enfermedades en Chile: todos conocen sus beneficios, pero pocos los emplean.
 Controladores biológicos de enfermedades en Chile: todos conocen sus beneficios, pero pocos los emplean. Daniel Torres Ingeniero Agrónomo mención en Fruticultura Colaborador de Universidad de Las Américas
Controladores biológicos de enfermedades en Chile: todos conocen sus beneficios, pero pocos los emplean. Daniel Torres Ingeniero Agrónomo mención en Fruticultura Colaborador de Universidad de Las Américas
EFECTO DE LA VARIABILIDAD CLIMÁTICA EN EL CULTIVO DE HABAS
 RECOMENDACIONES: El periodo de crecimiento para la zona del valle de Chumbao establece que las condiciones de humedad y temperaturas favorables se registran en el periodo diciembre - abril. Sin embargo,
RECOMENDACIONES: El periodo de crecimiento para la zona del valle de Chumbao establece que las condiciones de humedad y temperaturas favorables se registran en el periodo diciembre - abril. Sin embargo,
Patogenicidad y Hospederos de Fusarium oxysporum f. sp. en República Dominicana.
 Patogenicidad y Hospederos de Fusarium oxysporum f. sp. en República Dominicana. Rosa María Méndez B. MSc Fitopatologas -Investigadoras IDIAF rmendez@idiaf.gov.do VI Congreso SODIAF 2013 Juan Dolio, San
Patogenicidad y Hospederos de Fusarium oxysporum f. sp. en República Dominicana. Rosa María Méndez B. MSc Fitopatologas -Investigadoras IDIAF rmendez@idiaf.gov.do VI Congreso SODIAF 2013 Juan Dolio, San
Informe Alerta Sanidad Soja - Maíz
 SOJA La soja de primera en la zona núcleo se encuentra en pleno llenado de grano, estado R5; y la soja de segunda se encuentra en general en R2. Sin duda que las abundantes lluvias de esta semana, favorecerán
SOJA La soja de primera en la zona núcleo se encuentra en pleno llenado de grano, estado R5; y la soja de segunda se encuentra en general en R2. Sin duda que las abundantes lluvias de esta semana, favorecerán
CNA-1ºESO Curso 2014/15
 CIENCIAS DE LA NATURALEZA 1º ESO 2014-2015 La referencia de los aprendizajes necesarios quedan recogidos en el trabajo realizado en el cuaderno del alumno. CRITERIOS DE EVALUACIÓN.- 1. Reconocer las diferentes
CIENCIAS DE LA NATURALEZA 1º ESO 2014-2015 La referencia de los aprendizajes necesarios quedan recogidos en el trabajo realizado en el cuaderno del alumno. CRITERIOS DE EVALUACIÓN.- 1. Reconocer las diferentes
AGRICULTRA ECOLÓGICA. PRINCIPIOS BÁSICOS QUE RIGEN LA AGRICULTURA ECOLÓGICA EL SUELO ES UN MEDIO VIVO Y DINÁMICO.
 AGRICULTRA ECOLÓGICA. PRINCIPIOS BÁSICOS QUE RIGEN LA AGRICULTURA ECOLÓGICA EL SUELO ES UN MEDIO VIVO Y DINÁMICO. Para la agricultura ecológica, el suelo es un organismo vivo y su elemento más importante.
AGRICULTRA ECOLÓGICA. PRINCIPIOS BÁSICOS QUE RIGEN LA AGRICULTURA ECOLÓGICA EL SUELO ES UN MEDIO VIVO Y DINÁMICO. Para la agricultura ecológica, el suelo es un organismo vivo y su elemento más importante.
CUADERNO DE TAREAS TAREA # 12 DE BIOLOGÍA PROFESOR CRISTIAN MARRERO SOLANO VALOR 5% PUNTOS OBTENIDOS PORCENTAJE OBTENIDO
 CUADERNO DE TAREAS TAREA # 12 DE BIOLOGÍA CENTRO EDUCATIVO NOMBRE COMPLETO SECCIÓN FECHA DE ENTREGA PROFESOR CRISTIAN MARRERO SOLANO VALOR 5% REINOS BIOLÓGICOS RUBROS A CALIFICAR 1. Reconocer en forma
CUADERNO DE TAREAS TAREA # 12 DE BIOLOGÍA CENTRO EDUCATIVO NOMBRE COMPLETO SECCIÓN FECHA DE ENTREGA PROFESOR CRISTIAN MARRERO SOLANO VALOR 5% REINOS BIOLÓGICOS RUBROS A CALIFICAR 1. Reconocer en forma
GENERACIÓN DE ENERGIAS RENOVABLES A PARTIR DEL USO DE LA BIOMASA DE NOPAL
 Informe Final Junio 2013 Mayo 2014 PROYECTO: GENERACIÓN DE ENERGIAS RENOVABLES A PARTIR DEL USO DE LA BIOMASA DE NOPAL MC Miguel Angel Perales de la Cruz Pabellón de Arteaga, Ags. Junio del 2014 Informe
Informe Final Junio 2013 Mayo 2014 PROYECTO: GENERACIÓN DE ENERGIAS RENOVABLES A PARTIR DEL USO DE LA BIOMASA DE NOPAL MC Miguel Angel Perales de la Cruz Pabellón de Arteaga, Ags. Junio del 2014 Informe
PERFIL PROFESIONAL INGENIERÍA EN TECNOLOGÍA AMBIENTAL. Universidad Politécnica de Durango
 PERFIL PROFESIONAL INGENIERÍA EN TECNOLOGÍA AMBIENTAL Universidad Politécnica de Durango I. Programa Educativo II. Requerimientos del Sector Productivo Ingeniería en Tecnología Ambiental Evaluación de
PERFIL PROFESIONAL INGENIERÍA EN TECNOLOGÍA AMBIENTAL Universidad Politécnica de Durango I. Programa Educativo II. Requerimientos del Sector Productivo Ingeniería en Tecnología Ambiental Evaluación de
CAPITULO II REVISIÓN DE LITERATURA
 CAPITULO I 1. INTRODUCCIÓN... 1 1.1 EL PROBLEMA... 2 1.2 JUSTIFICACIÓN... 3 1.3 OBJETIVOS... 4 1.3.1 GENERAL... 4 1.3.2 ESPECÍFICOS... 4 1.4. PREGUNTA DIRECTRIZ... 4 CAPITULO II REVISIÓN DE LITERATURA
CAPITULO I 1. INTRODUCCIÓN... 1 1.1 EL PROBLEMA... 2 1.2 JUSTIFICACIÓN... 3 1.3 OBJETIVOS... 4 1.3.1 GENERAL... 4 1.3.2 ESPECÍFICOS... 4 1.4. PREGUNTA DIRECTRIZ... 4 CAPITULO II REVISIÓN DE LITERATURA
TEMA 9 LAS FUNCIONES VITALES Y LA NUTRICIÓN VEGETAL. Asignatura: Ciencias de la Naturaleza de 2º ESO Profesor: David Leunda San Miguel
 TEMA 9 LAS FUNCIONES VITALES Y LA NUTRICIÓN VEGETAL Asignatura: Ciencias de la Naturaleza de 2º ESO Profesor: David Leunda San Miguel 1-.Las funciones vitales: introducción Existen 1.800.000 especies de
TEMA 9 LAS FUNCIONES VITALES Y LA NUTRICIÓN VEGETAL Asignatura: Ciencias de la Naturaleza de 2º ESO Profesor: David Leunda San Miguel 1-.Las funciones vitales: introducción Existen 1.800.000 especies de
Fecha de elaboración: Mayo de 2010 Fecha de última actualización: Asignatura Subsecuente
 Programa elaborado por: PROGRAMA DE ESTUDIO PROTOZOARIOS Programa Educativo: Licenciatura en Biología Área de Formación : Sustantiva Profesional Horas teóricas: 2 Horas prácticas: 4 Total de Horas: 6 Total
Programa elaborado por: PROGRAMA DE ESTUDIO PROTOZOARIOS Programa Educativo: Licenciatura en Biología Área de Formación : Sustantiva Profesional Horas teóricas: 2 Horas prácticas: 4 Total de Horas: 6 Total
Biotecnología y su aplicación a las ciencias agropecuarias. Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales
 Biotecnología y su aplicación a las ciencias agropecuarias Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales Niveles de organización en seres vivos Organismo Organo Tejido Celula La Célula:
Biotecnología y su aplicación a las ciencias agropecuarias Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales Niveles de organización en seres vivos Organismo Organo Tejido Celula La Célula:
Tecnología EM: Una alternativa para el control de Sigatoka Negra en los Trópicos. El caso de la Finca Bananera de la Universidad EARTH Costa Rica
 Tecnología EM: Una alternativa para el control de Sigatoka Negra en los Trópicos El caso de la Finca Bananera de la Universidad EARTH Costa Rica Ubicación Campus Universidad EARTH Costa Rica Impacto Ambiental,
Tecnología EM: Una alternativa para el control de Sigatoka Negra en los Trópicos El caso de la Finca Bananera de la Universidad EARTH Costa Rica Ubicación Campus Universidad EARTH Costa Rica Impacto Ambiental,
Nutrición. Patógenos biotróficos y necrotróficos
 Nutrición. Patógenos biotróficos y necrotróficos NECROTRÓFICOS Matan a las células y luego extraen nutrientes Continúan nutriéndose aun después de la muerte del hospedante. Ppal. oportunidad de supervivencia
Nutrición. Patógenos biotróficos y necrotróficos NECROTRÓFICOS Matan a las células y luego extraen nutrientes Continúan nutriéndose aun después de la muerte del hospedante. Ppal. oportunidad de supervivencia
CARTA DESCRIPTIVA (FORMATO Modelo Educativo UACJ Visión 2020)
 CARTA DESCRIPTIVA (FORMATO Modelo Educativo UACJ Visión 2020) I. Identificadores de la asignatura Clave: Créditos: 10 Materia: Manejo y aprovechamiento de recursos naturales Departamento: Ciencias Veterinarias.
CARTA DESCRIPTIVA (FORMATO Modelo Educativo UACJ Visión 2020) I. Identificadores de la asignatura Clave: Créditos: 10 Materia: Manejo y aprovechamiento de recursos naturales Departamento: Ciencias Veterinarias.
Basidiomycetes degradadores de madera de Eucalyptus en Uruguay
 Basidiomycetes degradadores de madera de Eucalyptus en Uruguay Sebastián Martínez, Sandra Lupo, Lina Bettucci Laboratorio de Micología. Facultad de Ciencias-Ingeniería, UdelaR, Uruguay HONGOS DESCOMPONEDORES
Basidiomycetes degradadores de madera de Eucalyptus en Uruguay Sebastián Martínez, Sandra Lupo, Lina Bettucci Laboratorio de Micología. Facultad de Ciencias-Ingeniería, UdelaR, Uruguay HONGOS DESCOMPONEDORES
ACTIVIDADES DE REPASO BIOLOGÍA Y GEOLOGÍA (1º ESO)
 ACTIVIDADES DE REPASO BIOLOGÍA Y GEOLOGÍA (1º ESO) 1, Una planta es un ser vivo. Como todos los seres vivos, presenta una serie de características que la diferencian de la materia inerte Cuáles son? a.
ACTIVIDADES DE REPASO BIOLOGÍA Y GEOLOGÍA (1º ESO) 1, Una planta es un ser vivo. Como todos los seres vivos, presenta una serie de características que la diferencian de la materia inerte Cuáles son? a.
EL ARBOL DE CACAO NOCIONES DE FISIOLOGÍA Y ECOLOGÍA. Pablo Fernando Ramos C.
 EL ARBOL DE CACAO NOCIONES DE FISIOLOGÍA Y ECOLOGÍA Pablo Fernando Ramos C. Asesor Técnico CHOCAGUAN El componente central de cualquier sistema de producción agrícola son las plantas. Como cualquier organismo
EL ARBOL DE CACAO NOCIONES DE FISIOLOGÍA Y ECOLOGÍA Pablo Fernando Ramos C. Asesor Técnico CHOCAGUAN El componente central de cualquier sistema de producción agrícola son las plantas. Como cualquier organismo
La Chupadera Fungosa de los Pinos en Almácigos Peruanos (1) C. Bazán de Segura (2)
 Resumen La Chupadera Fungosa de los Pinos en Almácigos Peruanos (1) C. Bazán de Segura (2) La chupadera fungosa de los almácigos, es una enfermedad muy importante en especies forestales, siendo el género
Resumen La Chupadera Fungosa de los Pinos en Almácigos Peruanos (1) C. Bazán de Segura (2) La chupadera fungosa de los almácigos, es una enfermedad muy importante en especies forestales, siendo el género
Deterioro microbiano de alimentos. Edgar E. Ugarte
 Deterioro microbiano de alimentos Edgar E. Ugarte Que es deterioro alimenticio Un alimento dice estar deteriorado cuando ha cambiado al grado de no ser aceptable por un consumidor medio. Definición general
Deterioro microbiano de alimentos Edgar E. Ugarte Que es deterioro alimenticio Un alimento dice estar deteriorado cuando ha cambiado al grado de no ser aceptable por un consumidor medio. Definición general
Bioquímica. Carrera: IAC Participantes. Representantes de las academias de Ingeniería Ambiental. Academia de Ingeniería
 1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Bioquímica Ingeniería Ambiental IAC - 0405 4-2-10 2.- HISTORIA DEL PROGRAMA Lugar
1.- DATOS DE LA ASIGNATURA Nombre de la asignatura: Carrera: Clave de la asignatura: Horas teoría-horas práctica-créditos Bioquímica Ingeniería Ambiental IAC - 0405 4-2-10 2.- HISTORIA DEL PROGRAMA Lugar
Aplicación del producto AliBio WA3 para incrementar la eficiencia de remoción de la materia orgánica en fosas sépticas
 Aplicación del producto AliBio WA3 para incrementar la eficiencia de remoción de la materia orgánica en fosas sépticas Expositor: Ing. Carlos R. Martínez Cruz, MIA Nosotros Alianza con la Biosfera es una
Aplicación del producto AliBio WA3 para incrementar la eficiencia de remoción de la materia orgánica en fosas sépticas Expositor: Ing. Carlos R. Martínez Cruz, MIA Nosotros Alianza con la Biosfera es una
El cultivo de CRISANTEMO
 El cultivo de CRISANTEMO SISTEMÁTICA Origen: China Familia: Asteráceas o Compuestas Género: Chrysanthemum Especie: morifolium MSc Ing. Agr. Patricia Occhiuto CARACTERISTICAS MORFOLÓGICAS - Planta herbácea
El cultivo de CRISANTEMO SISTEMÁTICA Origen: China Familia: Asteráceas o Compuestas Género: Chrysanthemum Especie: morifolium MSc Ing. Agr. Patricia Occhiuto CARACTERISTICAS MORFOLÓGICAS - Planta herbácea
UNIVERSIDAD DE ANTIOQUIA FACULTAD DE QUÍMICA FARMACÉUTICA
 APROBADO POR CONSEJO DE FACULTAD DE QUIMICA FARMACÉUTICA ACTA 697 DEL 16 DE OCTUBRE DE 2011. PROGRAMA DE INGENIERIA DE ALIMENTOS NOMBRE DE LA MATERIA PROFESOR OFICINA HORARIO DE CLASE HORARIO DE ATENCION
APROBADO POR CONSEJO DE FACULTAD DE QUIMICA FARMACÉUTICA ACTA 697 DEL 16 DE OCTUBRE DE 2011. PROGRAMA DE INGENIERIA DE ALIMENTOS NOMBRE DE LA MATERIA PROFESOR OFICINA HORARIO DE CLASE HORARIO DE ATENCION
Universidad Nacional del Nordeste Facultad de Humanidades
 Universidad Nacional del Nordeste Facultad de Humanidades CARRERA DE POSGRADO ESPECIALIZACIÓN EN TECNOLOGÍAS DE LA INFORMACIÓN GEOGRÁFICA (TIG) MODULO III - ANÁLISIS DE LA INFORMACIÓN GEOGRÁFICA Tema 5:
Universidad Nacional del Nordeste Facultad de Humanidades CARRERA DE POSGRADO ESPECIALIZACIÓN EN TECNOLOGÍAS DE LA INFORMACIÓN GEOGRÁFICA (TIG) MODULO III - ANÁLISIS DE LA INFORMACIÓN GEOGRÁFICA Tema 5:
ENSAYO DE CULTIVARES DE PIMIENTO SWEET BITE DAVID ERIK MECA ABAD ESTACIÓN EXPERIMENTAL DE CAJAMAR
 ENSAYO DE CULTIVARES DE PIMIENTO SWEET BITE DAVID ERIK MECA ABAD ESTACIÓN EXPERIMENTAL DE CAJAMAR 2. Fruttimanía, su línea de snacks de fruta liofilizada 7. Ready, Veggi, Go: Un snack saludable de mini
ENSAYO DE CULTIVARES DE PIMIENTO SWEET BITE DAVID ERIK MECA ABAD ESTACIÓN EXPERIMENTAL DE CAJAMAR 2. Fruttimanía, su línea de snacks de fruta liofilizada 7. Ready, Veggi, Go: Un snack saludable de mini
FONTAGRO PRODUCTORES DE LULO Y MORA COMPETITIVOS MEDIANTE SELECCIÓN PARTICIPATIVA DE CLONES ELITE, MIC Y FORTALECIMIENTO DE CADENAS DE VALOR
 III Taller de Seguimiento Técnico de Proyectos FONTAGRO Proyecto FTG-0616/06 PRODUCTORES DE LULO Y MORA COMPETITIVOS MEDIANTE SELECCIÓN PARTICIPATIVA DE CLONES ELITE, MIC Y FORTALECIMIENTO DE CADENAS DE
III Taller de Seguimiento Técnico de Proyectos FONTAGRO Proyecto FTG-0616/06 PRODUCTORES DE LULO Y MORA COMPETITIVOS MEDIANTE SELECCIÓN PARTICIPATIVA DE CLONES ELITE, MIC Y FORTALECIMIENTO DE CADENAS DE
Doctorado en Ciencias Listado de cursos optativos* (2016)
 Doctorado en Ciencias Listado de cursos optativos* (2016) HORAS SEMANALES LISTA DE ASIGNATURAS OPTATIVAS CLAVE SERIACIÓN TEORIA PRÁCTICA TOTAL CRÉDITOS CONCEPTUALES Y METODOLÓGICAS Métodos estadísticos
Doctorado en Ciencias Listado de cursos optativos* (2016) HORAS SEMANALES LISTA DE ASIGNATURAS OPTATIVAS CLAVE SERIACIÓN TEORIA PRÁCTICA TOTAL CRÉDITOS CONCEPTUALES Y METODOLÓGICAS Métodos estadísticos
DOCUMENTO QUE APOYA LA PROGRAMACIÓN DE ASIGNATURAS POR PERIODO ESCOLAR PARA UN TRÁNSITO NORMAL POR LA MALLA CURRICULAR
 DOCUMENTO QUE APOYA LA PROGRAMACIÓN DE ASIGNATURAS POR PERIODO ESCOLAR PARA UN TRÁNSITO NORMAL POR LA MALLA CURRICULAR Modelo Educativo ENFACE Octubre del 2008 El presente documento tiene el objetivo de
DOCUMENTO QUE APOYA LA PROGRAMACIÓN DE ASIGNATURAS POR PERIODO ESCOLAR PARA UN TRÁNSITO NORMAL POR LA MALLA CURRICULAR Modelo Educativo ENFACE Octubre del 2008 El presente documento tiene el objetivo de
LA FUNCIÓN DE NUTRICIÓN EN LOS VEGETALES
 LA FUNCIÓN DE NUTRICIÓN EN LOS VEGETALES La nutrición es el conjunto de procesos mediante los cuales los seres vivos toman sustancias del exterior y las transforman en materia propia y en energía. Autótrofos.
LA FUNCIÓN DE NUTRICIÓN EN LOS VEGETALES La nutrición es el conjunto de procesos mediante los cuales los seres vivos toman sustancias del exterior y las transforman en materia propia y en energía. Autótrofos.
LA LUNA Y SU INFLUENCIA EN EL CULTIVO DE HORTALIZAS
 LA LUNA Y SU INFLUENCIA EN EL CULTIVO DE HORTALIZAS Desde tiempos antiguos los agricultores observaron que las fases de la luna influyen en la producción de los cultivos, estimulando la rápida germinación
LA LUNA Y SU INFLUENCIA EN EL CULTIVO DE HORTALIZAS Desde tiempos antiguos los agricultores observaron que las fases de la luna influyen en la producción de los cultivos, estimulando la rápida germinación
Lombricultura SCIC Centro de Investigación y Desarrollo - Ecuador
 Lombricultura SCIC Centro de Investigación y Desarrollo - Ecuador USO DE HUMUS DE LOMBRIZ EN MEZCLA CON TIERRA NEGRA DE PÁRAMO, ARENA Y TIERRA SIMPLE; EN CULTIVOS DE ARVEJA, VAINITA Y FRÉJOL APOLO OBJETIVOS
Lombricultura SCIC Centro de Investigación y Desarrollo - Ecuador USO DE HUMUS DE LOMBRIZ EN MEZCLA CON TIERRA NEGRA DE PÁRAMO, ARENA Y TIERRA SIMPLE; EN CULTIVOS DE ARVEJA, VAINITA Y FRÉJOL APOLO OBJETIVOS
APLICACIÓN DE PLAGUICIDAS (NIVEL CUALIFICADO) Duración en horas: 60
 APLICACIÓN DE PLAGUICIDAS (NIVEL CUALIFICADO) Duración en horas: 60 OBJETIVOS DEL CURSO Este curso responde a la gran demanda de formación específica y adaptada a las necesidades concretas de los agricultores
APLICACIÓN DE PLAGUICIDAS (NIVEL CUALIFICADO) Duración en horas: 60 OBJETIVOS DEL CURSO Este curso responde a la gran demanda de formación específica y adaptada a las necesidades concretas de los agricultores
SESIÓN 3. Describir las características distintivas de los seres vivos a partir de modelos naturales.
 SESIÓN 3. Características distintivas de los seres vivos OBJETIVO DE LA SESIÓN Describir las características distintivas de los seres vivos a partir de modelos naturales. INTRODUCCIÓN Independientemente
SESIÓN 3. Características distintivas de los seres vivos OBJETIVO DE LA SESIÓN Describir las características distintivas de los seres vivos a partir de modelos naturales. INTRODUCCIÓN Independientemente
Respuesta del cultivo de Maíz (Zea mays L.) a la aplicación de promotores de crecimiento y fertilización nitrogenada.
 Respuesta del cultivo de Maíz (Zea mays L.) a la aplicación de promotores de crecimiento y fertilización nitrogenada. Autores: Ing. Agr. Grande, Héctor Ariel, Ing. Agr. Raúl Druetta. INTRODUCCIÓN La inoculación
Respuesta del cultivo de Maíz (Zea mays L.) a la aplicación de promotores de crecimiento y fertilización nitrogenada. Autores: Ing. Agr. Grande, Héctor Ariel, Ing. Agr. Raúl Druetta. INTRODUCCIÓN La inoculación
Importancia del origen (genético) en un programa de mejoramiento. Fco. Zamudio (PhD)
 Importancia del origen (genético) en un programa de mejoramiento Prólogo El éxito en el establecimiento y productividad de las plantaciones con árboles forestales depende en gran medida de: 1. La especie
Importancia del origen (genético) en un programa de mejoramiento Prólogo El éxito en el establecimiento y productividad de las plantaciones con árboles forestales depende en gran medida de: 1. La especie
Corpoica V-159 Variedades de maíz de grano blanco para la Región Caribe de Colombia
 Corpoica V-159 Variedades de maíz de grano blanco para la Región Caribe de Colombia L ib ertad y O rd e n Variedades de maíz de grano blanco para la Región Caribe de Colombia 3 Variedad de grano blanco
Corpoica V-159 Variedades de maíz de grano blanco para la Región Caribe de Colombia L ib ertad y O rd e n Variedades de maíz de grano blanco para la Región Caribe de Colombia 3 Variedad de grano blanco
Cómo Fabrican su Alimento las Plantas?
 2do Medio> Biología Fotosíntesis Fotosíntesis Cómo Fabrican su Alimento las Plantas? Martín estudiaba el proceso de fotosíntesis, por lo que diseñó el siguiente experimento: 1. Tomó tres tubos de ensayo,
2do Medio> Biología Fotosíntesis Fotosíntesis Cómo Fabrican su Alimento las Plantas? Martín estudiaba el proceso de fotosíntesis, por lo que diseñó el siguiente experimento: 1. Tomó tres tubos de ensayo,
Laboratorio de Protistas. RECONOCIMIENTO TAXONOMICO Y MORFOLOGICO DE LAS CLOROPHYTAS (Niveles de organización)
 Laboratorio de Protistas RECONOCIMIENTO TAXONOMICO Y MORFOLOGICO DE LAS CLOROPHYTAS (Niveles de organización) INTRODUCCIÓN Las algas pueden definirse como el grupo de organismos que carecen de raíz, tallo
Laboratorio de Protistas RECONOCIMIENTO TAXONOMICO Y MORFOLOGICO DE LAS CLOROPHYTAS (Niveles de organización) INTRODUCCIÓN Las algas pueden definirse como el grupo de organismos que carecen de raíz, tallo
Guía Visual de Problemas de Calidad en Semillas y Granos de Soja
 Roque M. Craviotto, Miriam R. Arango, Marta S. Montero -Tecnología de Semillas - EEA Oliveros Los problemas de calidad en semillas y/o granos de soja son provocados por condiciones ambientales, patógenos
Roque M. Craviotto, Miriam R. Arango, Marta S. Montero -Tecnología de Semillas - EEA Oliveros Los problemas de calidad en semillas y/o granos de soja son provocados por condiciones ambientales, patógenos
ENERGÉTICA - RESPIRACIÓN
 - 6 - BIOLOGIA GENERAL Y METODOLOGIA DE LAS CIENCIAS Trabajo Práctico Nº 2: ENERGÉTICA - RESPIRACIÓN Objetivos: - Comprender la importancia de la respiración celular como la principal vía de obtención
- 6 - BIOLOGIA GENERAL Y METODOLOGIA DE LAS CIENCIAS Trabajo Práctico Nº 2: ENERGÉTICA - RESPIRACIÓN Objetivos: - Comprender la importancia de la respiración celular como la principal vía de obtención
MALEZAS y Estrategias de Control. Ing. Agr. M.Sc. García Stepien, L. E.
 MALEZAS y Estrategias de Control Ing. Agr. M.Sc. García Stepien, L. E. Maleza Cualquier especie vegetal que crece indeseablemente de forma silvestre en un área cultivada. Competencia Luz Agua Nutrientes
MALEZAS y Estrategias de Control Ing. Agr. M.Sc. García Stepien, L. E. Maleza Cualquier especie vegetal que crece indeseablemente de forma silvestre en un área cultivada. Competencia Luz Agua Nutrientes
CAPÍTULO 1 IDENTIFICACIÓN DEL PROBLEMA
 CAPÍTULO 1 IDENTIFICACIÓN DEL PROBLEMA A través de este primer capítulo se describe el problema que se plantea en la presente tesis. De la misma manera se determina el objetivo general y los objetivos
CAPÍTULO 1 IDENTIFICACIÓN DEL PROBLEMA A través de este primer capítulo se describe el problema que se plantea en la presente tesis. De la misma manera se determina el objetivo general y los objetivos
CLASIFICACIÓN ECOLÓGICA DE LOS ORGANISMOS DE AGUA DULCE
 CLASIFICACIÓN ECOLÓGICA DE LOS ORGANISMOS DE AGUA DULCE seston tripton epilitica epifitas CARACTERÍSTICAS DEL NECTON El tamaño de los organismos oscila desde unos pocos centímetros hasta 40 o 50 cm. Son
CLASIFICACIÓN ECOLÓGICA DE LOS ORGANISMOS DE AGUA DULCE seston tripton epilitica epifitas CARACTERÍSTICAS DEL NECTON El tamaño de los organismos oscila desde unos pocos centímetros hasta 40 o 50 cm. Son
Mercedes González Rodríguez 1, Leónides Castellanos González 1, María Ramos Fernández 1, Grisell Pérez González 2.
 Centro Agrícola, 35(1): 5-10; ene.-marz., 2008 ISSN:0253-5785 CE: 49,05 CF: cag021081583 Efecto antagónico in vitro de diferentes cepas de Trichoderma spp. sobre agentes patógenos de semilla y suelo en
Centro Agrícola, 35(1): 5-10; ene.-marz., 2008 ISSN:0253-5785 CE: 49,05 CF: cag021081583 Efecto antagónico in vitro de diferentes cepas de Trichoderma spp. sobre agentes patógenos de semilla y suelo en
COMPETENCIA INTRAESPECÍFICA
 COMPETENCIA INTRAESPECÍFICA UN ESTUDIO EXPERIMENTAL La competencia entre los individuos de una población aparece cuando un recurso ambiental que es indispensable para todos se encuentra en disponibilidad
COMPETENCIA INTRAESPECÍFICA UN ESTUDIO EXPERIMENTAL La competencia entre los individuos de una población aparece cuando un recurso ambiental que es indispensable para todos se encuentra en disponibilidad
TABLA DE CONTENIDOS DEDICATORIA... AGRADECIMIENTO... TABLA DE CONTENIDOS... LISTA DE CUADROS... LISTA DE GRÁFICOS... LISTA DE ANEXOS...
 TABLA DE CONTENIDOS DEDICATORIA... AGRADECIMIENTO... TABLA DE CONTENIDOS... LISTA DE CUADROS... LISTA DE GRÁFICOS... LISTA DE ANEXOS... iii iv v ix xi xiii CAPÍTULO I EL PROBLEMA INTRODUCCIÓN... 2. JUSTIFICACIÓN...
TABLA DE CONTENIDOS DEDICATORIA... AGRADECIMIENTO... TABLA DE CONTENIDOS... LISTA DE CUADROS... LISTA DE GRÁFICOS... LISTA DE ANEXOS... iii iv v ix xi xiii CAPÍTULO I EL PROBLEMA INTRODUCCIÓN... 2. JUSTIFICACIÓN...
CONTENIDO DEL CURSO DE NUTRICION VEGETAL UNIDAD 1. Nutrición Vegetal
 CONTENIDO DEL CURSO DE NUTRICION VEGETAL UNIDAD 1 Nutrición Vegetal CONTENIDO DEL CURSO DE NUTRICION VEGETAL UNIDAD 1. TEMA: Fisiología Disponibilidad E Interacción De Nutrientes. Subtemas: La Nutrición
CONTENIDO DEL CURSO DE NUTRICION VEGETAL UNIDAD 1 Nutrición Vegetal CONTENIDO DEL CURSO DE NUTRICION VEGETAL UNIDAD 1. TEMA: Fisiología Disponibilidad E Interacción De Nutrientes. Subtemas: La Nutrición
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Aplicaciones de los radisótopos a la industria
 Aplicaciones de los radisótopos a la industria Las aplicaciones de radisótopos se basan en la interacción de la radiación con la materia y su comportamiento en ésta. De acuerdo con la propiedad en la que
Aplicaciones de los radisótopos a la industria Las aplicaciones de radisótopos se basan en la interacción de la radiación con la materia y su comportamiento en ésta. De acuerdo con la propiedad en la que
Manejo y control de maíz guacho tolerante a glifosato
 Ing. Agr. Luis Allieri Asesor privado Manejo y control de maíz guacho tolerante a glifosato A partir de la introducción y utilización masiva de híbridos de maíz tolerantes a glifosato se generó una nueva
Ing. Agr. Luis Allieri Asesor privado Manejo y control de maíz guacho tolerante a glifosato A partir de la introducción y utilización masiva de híbridos de maíz tolerantes a glifosato se generó una nueva
FICHAS TÉCNICAS DE CULTIVOS DE LANZAROTE
 FICHAS TECNICAS NOMBRE COMÚN: Espárrago NOMBRE CIENTIFICO: Asparagus officinalis L. FAMILIA: Liliáceas ORIGEN : El origen de los espárragos parece situarse en la cuenca mediterránea, hace más de 5.000
FICHAS TECNICAS NOMBRE COMÚN: Espárrago NOMBRE CIENTIFICO: Asparagus officinalis L. FAMILIA: Liliáceas ORIGEN : El origen de los espárragos parece situarse en la cuenca mediterránea, hace más de 5.000
