es seguro y efectivo en personas menores de 18 años de edad.
|
|
|
- María del Pilar Ortiz Romero
- hace 6 años
- Vistas:
Transcripción
1 HEMALEN LENALIDOMIDA Cápsulas duras Industria Argentina INFORMACION PARA EL PACIENTE: Lea este prospecto cuidadosamente antes de comenzar a tomar este medicamento ya que contiene información importante para usted. - Conserve este prospecto. Puede necesitar leerlo nuevamente. - Si surgen preguntas, consulte a su médico o farmacéutico. - Este medicamento fue prescripto para usted exclusivamente. No entregue este medicamento a otros. Esto puede dañarlos, incluso si los signos de enfermedad son iguales a los suyos. - Si alguno de los efectos indeseables se torna importante, o si usted nota cualquier efecto secundario que no está listado en este prospecto, por favor INFORME A SU MEDICO. Qué contiene este prospecto? 1- Qué es HEMALEN y para qué se usa? 2- Qué necesita saber antes de tomar HEMALEN? 3- Cómo usar HEMALEN? 4- Posibles efectos adversos. 5- Cómo almacenar HEMALEN? 6- Contenido del envase y otra información. 1- Qué es HEMALEN y para qué se usa? Qué es HEMALEN? HEMALEN contiene la sustancia activa Lenalidomida. Este medicamento pertenece al grupo de medicamentos que afecta el funcionamiento del sistema inmune. Para qué se usa HEMALEN? es usado junto a otro medicamento llamado dexametasona (un corticoide con acción antiinflamatoria) para tratar a adultos con un tipo de cáncer llamado MIELOMA MULTIPLE. es útil para el tipo de SMD con un problema cromosómico en donde falta parte del cromosoma 5. Este tipo de SMD es conocido como SMD con deleción del 5q. Los pacientes con este tipo de SMD pueden tener recuentos bajos de glóbulos rojos que requieren tratamiento con transfusiones de sangre. cuales incluye el medicamento bortezomib. El linfoma de células de manto es un cáncer de un tipo de glóbulo blanco (linfocitos) que están en los ganglios linfáticos. es seguro y efectivo en personas menores de 18 años de edad. 2- Qué necesita saber antes de tomar HEMALEN? No tome HEMALEN : - Si usted está embarazada o piensa que puede estarlo o está planeando un embarazo, ya que HEMALEN será perjudicial para el feto. - Si usted es alérgico a Lenalidomida o cualquier otro de los ingredientes de este medicamento, indicados en la sección 6. Si usted piensa que puede ser alérgico, consulte a su médico. - Antes de comenzar a tomar HEMALEN debe leer y estar de acuerdo con todas las instrucciones del Programa de Minimización de Riesgos.
2 - HEMALEN puede provocar efectos colaterales graves incluso: Posibles defectos congénitos (bebés deformes) o muerte del feto. Las pacientes femeninas que están embarazadas o que planean quedar embarazadas no deben tomar HEMALEN. - HEMALEN es similar al medicamento talidomida. Sabemos que talidomida provoca defectos congénitos con riesgo de muerte. HEMALEN daños a fetos animales en pruebas con animales. Las pacientes femeninas no deben quedar embarazadas: por 4 semanas antes de comenzar con HEMALEN ; mientras toman HEMALEN ; durante interrupciones en el tratamiento con HEMALEN ; por 4 semanas después de dejar HEMALEN. Si queda embarazada mientras toma HEMALEN, deje de tomarlo de inmediato y llame a su profesional de la salud. Si el profesional de la salud no se encuentra, puede llamar a la Autoridad Sanitaria (ANMAT) si corresponde, a fin de obtener información médica. Los profesionales de la salud y los pacientes deben informar todos los casos de embarazo. HEMALEN puede pasar al semen, por lo tanto: de látex durante todo contacto sexual con una mujer embarazada o con una mujer que puede quedar embarazada mientras está tomando HEMALEN, durante cualquier interrupción del tratamiento con HEMALEN y por 4 semanas después de dejar HEMALEN. profesional de la salud. - No done esperma mientras toma HEMALEN durante cualquier interrupción de su tratamiento ni durante 4 semanas después de dejar de tomarlo. Si una mujer queda embarazada con su esperma, el bebé puede estar expuesto a HEMALEN y puede nacer con defectos congénitos. Bajo recuento de glóbulos blancos (neutropenia) y de plaquetas (trombocitopenia): HEMALEN causa un controlado durante los primeros meses de tratamiento y luego mensualmente. Coágulos de sangre: los coágulos de sangre en venas, arterias y pulmones ocurren con mayor frecuencia en pacientes que toman HEMALEN y el riesgo es aún mayor en pacientes tomando HEMALEN con tomando HEMALEN más dexametasona. Antes de tomar HEMALEN pasado, si tiene presión alta, si fuma, si tiene colesterol en sangre elevado y todas las medicinas que tome. Llame al profesional de la salud o consiga asistencia médica de emergencia de inmediato si manifiesta espalda, abdomen, falta de aire, sudoración, vómitos. Infórmele a su profesional de la salud acerca de todas sus patologías médicas, incluyendo si usted: contiene lactosa. no debe ser utilizado por mujeres que están embarazadas o amamantando. Infórmele al profesional de la salud acerca de todos los medicamentos que toma, incluso medicamentos y otros medicamentos se afecten unos a otros provocando serios efectos colaterales. Conozca los medicamentos que toma. Conserve una lista de los mismos para mostrarle al profesional de la salud.
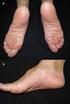
3 3. Cómo usar HEMALEN? exactamente como se le prescribe y siga las instrucciones del Programa de Minimización de Riesgos. el profesional de la salud: - Le explicará el Programa de Minimización de Riesgos; No rompa, mastique o abra las cápsulas. ni las manipule más de lo necesario. Si toca una cápsula rota o el fármaco de la cápsula, lave la zona del cuerpo que estuvo en contacto con la cápsula con agua y jabón. Tome HEMALEN o una sobredosis, llame a su profesional de la salud o al centro de control de intoxicaciones de inmediato. Las mujeres que pueden quedar embarazadas: tendrán pruebas semanales de embarazo durante 4 semanas, Deben acordar usar 2 métodos anticonceptivos diferentes al mismo tiempo durante 4 semanas antes de comenzar el tratamiento, mientras está tomando el medicamento, durante cualquier interrupción del tratamiento y por 4 semanas después de dejar HEMALEN. Los pacientes masculinos que toman HEMALEN, deben acordar usar un condón de látex durante el contacto sexual con una mujer embarazada o con una mujer que puede quedar embarazada. (Si usted o su pareja son alérgicos al látex, consulte a su profesional de la salud). 4-Posibles efectos adversos: puede causar efectos colaterales graves. Aumento del riesgo de muerte en personas que tienen leucemia linfocítica crónica (LLC). Los pacientes con LLC que toman HEMALEN tienen un riesgo aumentado de muerte en comparación con personas que toman clorambucilo. HEMALEN si tiene Problemas hepáticos severos, incluida la insuficiencia hepática y la muerte. Hable de inmediato con su -Si su piel o la parte blanca de sus ojos se torna amarillenta (ictericia). -Orina oscura o marrón (de color té). -Se siente muy cansado. Reacciones alérgicas y/o cutáneas serias: pueden producirse reacciones alérgicas y cutáneas graves que pueden causar la muerte. Llame a su profesional de la salud de inmediato si desarrolla algunos de los Empeoramiento del tumor (reacción de llamarada en el tumor): : ganglios linfáticos Síndrome de lisis tumoral: es provocado por la rápida descomposición de las células cancerosas. los pacientes con mieloma múltiple que reciben melfalan (un tipo de quimioterapia) y trasplante de células madre con el agregado de HEMALEN tuvieron una mayor incidencia de desarrollar nuevos tumores malignos que incluyen ciertos cáncer de la sangre, (leucemia linfomas llamados linfoma de Hodgkin. Hable con su médico acerca del riesgo de desarrollar nuevos tumores malignos si está tomando HEMALEN. Su profesional de la salud lo seguirá de cerca a fin de detectar el desarrollo de nuevos tumores malignos durante su tratamiento con HEMALEN.
4 Los efectos colaterales frecuentes de HEMALEN son: Si usted presenta cualquiera de estos efectos adversos, infórmelo a su médico. Esta indicación incluye cualquier posible efecto adverso que no este listado en este prospecto de información para el paciente. 5- Cómo almacenar HEMALEN? - Conserve este medicamento fuera del alcance de los niños. - Conservar en su envase original a temperatura entre 15 C y 30 C y protegido de la luz. 6-Contenido del envase y otra información: Qué contiene HEMALEN? HEMALEN 5 mg cápsulas duras: - La sustancia activa es Lenalidomida. Cada cápsula contiene 5 mg de Lenalidomida. - magnesio, capsula dura de gelatina. HEMALEN 10 mg cápsulas duras: - La sustancia activa es Lenalidomida. Cada cápsula contiene 10 mg de Lenalidomida. - magnesio, capsula dura de gelatina. HEMALEN 15 mg cápsulas duras: - La sustancia activa es Lenalidomida. Cada cápsula contiene 15 mg de Lenalidomida. - magnesio, capsula dura de gelatina. HEMALEN 25 mg cápsulas duras: - La sustancia activa es Lenalidomida. Cada cápsula contiene 25 mg de Lenalidomida. - magnesio, capsula dura de gelatina. Este medicamento ha sido prescripto sólo para su problema médico actual. No lo recomiende a otras personas. PRESENTACIONES: HEMALEN 5 mg, 10 mg, 15 mg y 25 mg: envases con 21 cápsulas duras. Especialidad Medicinal autorizada por el Ministerio de Salud. Certificado No (C1008AAW) Ciudad Autónoma de Buenos Aires Directora Técnica: Rosana B. Colombo (Farmacéutica) Informes: Dpto. Médico ( ) - Ante cualquier inconveniente con el producto usted puede llenar la ficha que está en la página web de la ANMAT: ó llamar a ANMAT responde IVAX Argentina S.A., MANTENGA LOS MEDICAMENTOS FUERA DEL ALCANCE DE LOS NIÑOS Este medicamento debe ser usado exclusivamente bajo prescripción y vigilancia médica y no puede repetirse sin nueva receta médica o
5 HEMALEN LENALIDOMIDA Cápsulas Industria Argentina Venta bajo receta archivada FORMULAS: HEMALEN 5 mg cápsulas duras: Cada cápsula contiene: Lenalidomida 5 mg HEMALEN 10 mg cápsulas duras: Cada cápsula contiene: Lenalidomida 10 mg HEMALEN 15 mg cápsulas duras: Cada cápsula contiene: Lenalidomida 15 mg HEMALEN 25 mg cápsulas duras: Cada cápsula contiene: Lenalidomida 25 mg Excipientes: lactosa anhidra, celulosa microcristalina, croscarmelosa sódica, estearato de magnesio c.s. ADVERTENCIAS: POTENCIAL DE DEFECTOS CONGENITOS. TOXICIDAD HEMATOLOGICA (NEUTROPENIA Y TROMBOCITOPENIA) TROMBOSIS VENOSA PROFUNDA Y EMBOLIA PULMONAR. ADVERTENCIA: POTENCIAL DE DEFECTOS CONGENITOS. LENALIDOMIDA ES UN ANALOGO DE TALIDOMIDA. TALIDOMIDA ES UN CONOCIDO TERATOGENO HUMANO QUE PROVOCA GRAVES DAÑOS CONGENITOS CON RIESGO DE MUERTE. SI SE TOMA LENALIDOMIDA DURANTE EL EMBARAZO, PUEDE PROVOCAR DEFECTOS CONGENITOS O LA MUERTE DEL FETO. SE DEBE ACONSEJAR A LAS MUJERES QUE EVITEN LOS EMBARAZOS MIENTRAS ESTEN BAJO TRATAMIENTO CON HEMALEN. REQUISITOS ESPECIALES PARA LA PRESCRIPCION: DEBIDO A ESTA POTENCIAL TOXICIDAD Y PARA EVITAR EXPONER EL FETO A HEMALEN (Lenalidomida), HEMALEN (Lenalidomida) SOLO ESTA DISPONIBLE BAJO UN PROGRAMA DE DISTRIBUCION ESPECIAL RESTRINGIDO. ESTE PROGRAMA DE GESTION DE RIESGO DETERMINA QUE SOLO LOS MEDICOS Y FARMACEUTICOS REGISTRADOS DENTRO DEL PROGRAMA PUEDEN PRESCRIBIR Y DISPENSAR EL PRODUCTO. ADEMAS, HEMALEN (Lenalidomida) SOLO DEBE SER DISPENSADO A PACIENTES QUE ESTEN REGISTRADOS Y QUE SATISFAGAN TODAS LAS CONDICIONES DEL PROGRAMA DE GESTION DE RIESGO. VER LA INFORMACION A CONTINUACION PARA MEDICOS, PACIENTES FEMENINAS Y PACIENTES MASCULINOS, ACERCA DEL PROGRAMA DE DISTRIBUCION RESTRINGIDO. DESCRIPCION DEL PROGRAMA DE GESTION DE RIESGO: Prescriptores: HEMALEN (Lenalidomida) puede ser prescripto sólo por médicos habilitados que estén registrados en el Programa de Gestión de Riesgos y comprendan el riesgo potencial de teratogenicidad si se utiliza Lenalidomida durante el embarazo. Las mujeres en edad fértil deben usar métodos anticonceptivos efectivos por al menos 4 semanas antes de comenzar la terapia de Lenalidomida, durante la terapia de Lenalidomida, durante las interrupciones de la dosis y por 4 semanas luego de la discontinuación de a terapia de Lenalidomida. Se indican anticonceptivos confiables incluso si ha habido antecedentes de infertilidad, salvo que la misma se deba a histerectomía o porque la paciente ha estado posmenopáusica de forma natural por al menos 24 meses consecutivos. Se deben utilizar dos formas anticonceptivas confiables en forma simultánea, salvo que el método elegido sea abstinencia continua de contacto sexual heterosexual, implantes, sistema intrauterino liberador de levonogestrel, acetato de medroxiprogesterona depot, ligaduras de trompas, píldora inhibitoria de la ovulación solo de progesterona (desogestrel), preservativo/condón para su pareja. Las mujeres en edad fértil deben ser derivadas a un especialista en métodos anticonceptivos, si es necesario. Las mujeres sexualmente maduras que no se han sometido a una histerectomía, no se les ha realizado
6 una ooforectomía bilateral o que no han estado posmenopáusicas de forma natural por al menos 24 meses consecutivos (es decir, que han tenido menstruaciones alguna vez en los 24 meses consecutivos anteriores) se consideran mujeres en edad fértil. Antes de prescribir HEMALEN, las mujeres en edad fértil deben tener 2 pruebas de embarazo negativas (sensibilidad de por lo menos 50 miu/ml). La primera prueba debe realizarse dentro de los días, y la segunda prueba dentro de las 24 horas antes de prescribir Lenalidomida. El médico no debe prescribir Lenalidomida a una mujer en edad fértil hasta que haya verificado las pruebas de embarazo negativas. Pacientes masculinos: Se desconoce si Lenalidomida está presente en el semen de pacientes que reciben el fármaco. Por lo tanto, los hombres que reciben Lenalidomida deben usar siempre un condón de látex durante cualquier contacto sexual con mujeres en edad fértil mientras reciben Lenalidomida, durante las interrupciones de las dosis y hasta 28 días después de haber interrumpido el tratamiento, incluso si se han sometido a una vasectomía exitosa. Una vez que ha comenzado el tratamiento y durante las interrupciones de las dosis, deben realizarse pruebas de embarazo para las mujeres en edad fértil de forma semanal durante las primeras 4 semanas de uso; luego, las pruebas de embarazo deben repetirse cada 4 semanas en las mujeres con ciclos menstruales regulares. Si los ciclos menstruales son irregulares, la prueba de embarazo debe realizarse cada 2 semanas. Debe llevarse a cabo una prueba de embarazo y asesoramiento si una paciente no tiene su período o si hay alguna anormalidad en su prueba de embarazo o en su sangrado menstrual. Debe discontinuarse el tratamiento de Lenalidomida durante esta evaluación. Los resultados de la prueba de embarazo deben ser verificados por el médico y el farmacéutico antes de dispensar cualquier prescripción. Si ocurre un embarazo durante el tratamiento de Lenalidomida, debe discontinuarse de inmediato el tratamiento. Toda sospecha de exposición del feto a Lenalidomida debe ser informada a la Autoridad Sanitaria y al laboratorio farmacéutico. El paciente debe ser referido a un obstetra/ginecólogo experimentado en toxicidad reproductiva para una posterior evaluación y asesoramiento. Pacientes femeninos: HEMALEN debe utilizarse en mujeres en edad fértil sólo cuando la paciente reúne todas las condiciones siguientes: Comprende y puede llevar a cabo instrucciones con seguridad. Es capaz de cumplir con las medidas anticonceptivas obligatorias, pruebas de embarazo, registro de pacientes, y encuesta para pacientes tal como se describe en el Programa de Gestión de Riesgo. Ha recibido y comprende las advertencias tanto verbales como escritas de los riesgos potenciales de tomar Lenalidomida durante el embarazo y de exponer el feto al fármaco. Ha recibido las advertencias tanto verbales como escritas del riesgo de posible falla del método anticonceptivo y de la necesidad de usar dos formas anticonceptivas confiables simultáneamente, salvo que el método elegido sea abstinencia continua de contacto sexual heterosexual. Las mujeres sexualmente maduras que no se han sometido a una histerectomía o que no han estado posmenopáusicas por al menos 24 meses consecutivos (es decir, que han tenido menstruaciones alguna vez en los 24 meses consecutivos anteriores), o no se les ha realizado una ooforectomía bilateral, son consideradas mujeres en edad fértil. Reconoce, por escrito, su comprensión de estas advertencias y de la necesidad de utilizar dos métodos confiables anticonceptivos por 4 semanas antes de comenzar la terapia de Lenalidomida, durante la terapia de Lenalidomida, durante las interrupciones de la dosis y por 4 semanas luego de la discontinuación de la terapia de Lenalidomida. Ha tenido dos pruebas de embarazo negativas con una sensibilidad de por lo menos 50 miu/ml, dentro de días y 24 horas antes de comenzar la terapia. Si la paciente tiene entre 12 y 18 años de edad, su padre o tutor legal debe haber leído el material educativo y haber acordado asegurar el cumplimiento de lo expuesto arriba. Pacientes masculinos: HEMALEN (Lenalidomida) debe utilizarse en hombres sexualmente activos cuando el paciente reúne todas las condiciones siguientes: Comprende y puede llevar a cabo instrucciones con seguridad. Es capaz de cumplir con las medidas anticonceptivas obligatorias apropiadas para hombres, registro
7 de pacientes, y encuesta para pacientes tal como se describe en el Programa de Gestión de Riesgo. Ha recibido y comprende las advertencias tanto verbales como escritas de los riesgos potenciales de tomar Lenalidomida y exponer el feto al fármaco. Ha recibido las advertencias tanto verbales como escritas del riesgo de posible falla del método anticonceptivo y de que se desconoce si Lenalidomida está presente en el semen. Se le ha indicado que siempre debe usar un condón de látex durante cualquier contacto sexual con mujeres en edad fértil, incluso si se ha sometido a una vasectomía exitosa. Se considera mujeres en edad fértil a las mujeres sexualmente maduras que no se han sometido a una histerectomía, no se les ha realizado una ooforectomía bilateral o que no han estado posmenopáusicas por al menos 24 meses consecutivos (es decir, que han tenido menstruaciones alguna vez en los 24 meses consecutivos anteriores). Si el paciente tiene entre 12 y 18 años de edad, su padre o tutor legal debe haber leído el material educativo y haber acordado asegurar el cumplimiento de lo expuesto arriba. TOXICIDAD HEMATOLOGICA (NEUTROPENIA Y TROMBOCITOPENIA: Este fármaco está significativamente asociado a la neutropenia y trombocitopenia. Se debe realizar un hemograma completo en la evaluación basal y todas las semanas durante las 8 primeras semanas de tratamiento y posteriormente una vez al mes en los pacientes en tratamiento para síndromes mielodisplásicos 5q. Los pacientes pueden requerir una interrupción o suspensión de Lenalidomida, transfusiones y/o tratamiento con factores estimulantes de colonias (ver DOSIFICACION Y ADMINISTRACION). TROMBOSIS VENOSA PROFUNDA Y EMBOLIA PULMONAR: Este fármaco ha demostrado un riesgo significativamente mayor de trombosis venosa profunda (TVP) y embolia pulmonar (EP) en pacientes con mieloma múltiple que fueron tratados con terapia de combinación (dexametasona) de Lenalidomida. Se aconseja a los pacientes y a los médicos prestar atención a los signos y síntomas de tromboembolismo. Se les debe dar instrucciones a los pacientes de buscar asistencia médica si manifiestan síntomas tales como respiración entrecortada, dolor en el tórax, o hinchazón en el brazo o en la pierna. Se desconoce si la anti-coagulación profiláctica o la terapia antiplaquetaria prescriptas en conjunto con Lenalidomida pueden disminuir el potencial para eventos tromboembólicos venosos. La decisión de tomar medidas profilácticas debe realizarse cuidadosamente luego de una evaluación de los factores de riesgo subyacentes de un paciente particular. ACCION TERAPEUTICA: Inmunomodulador (Código ATC: L04AX04). INDICACIONES Y USO: Lenalidomida está indicado para el tratamiento de pacientes con anemia dependiente de transfusión debido a síndromes mielodisplásicos (SMD) de riesgo bajo o Intermedio-1 vinculados a una anormalidad citogenética de deleción 5q con o sin anormalidades citogenéticas adicionales. Lenalidomida en combinación con dexametasona está indicado para el tratamiento de pacientes con mieloma múltiple (MM). Lenalidomida está indicado para linfoma de células del manto (LCM) cuya enfermedad ha recaído o progresado después de dos tratamientos previos, uno de los cuales incluye bortezomib. FARMACOLOGIA CLINICA: MECANISMO DE ACCION: el mecanismo de acción de Lenalidomida no ha sido completamente descripto. Lenalidomida es un análogo de talidomida con propiedades antineoplásicas, inmunomoduladoras y antiangiogénicas. Lenalidomida inhibe la secreción de citocinas pro-inflamatorias y aumenta la secreción de citocinas antiinflamatorias de células mononucleares de sangre periférica. Lenalidomida inhibe la proliferación celular con efectividad variada (IC50) en algunas pero no en todas las líneas celulares. Lenalidomida es efectiva para inhibir el crecimiento de células Namalwa (una línea celular de linfoma de célula B humana con deleción de un cromosoma 5) pero es mucho menos efectiva para inhibir el crecimiento de células KG-1 (línea celular mieloblástica humana, también con deleción de un cromosoma 5) y otras líneas celulares sin deleciones de cromosoma 5. Lenalidomida inhibe el crecimiento de células de mieloma múltiple de pacientes, así como de células MM.1S (una línea celular de mieloma múltiple humano), al inducir la interrupción del ciclo celular y la apoptosis. Lenalidomida inhibe la expresión de ciclooxigenasa-2 (COX-2), pero no de ciclooxigenasa-1 (COX-1) in vitro.
8 Lenalidomida inhibe la proliferación e induce la apoptosis de ciertas células tumorales hematopoyéticas incluyendo mieloma múltiple y síndromes mielodisplásicos 5q in vitro. Lenalidomida provoca un retraso en el crecimiento del tumor en algunos modelos no clínicos, in vivo, de tumores hematopoyéticos incluyendo mieloma múltiple. Las propiedades inmunomoduladoras de Lenalidomida incluyen la activación de células T y células asesinas naturales (NK), aumento del número de células NKT y la inhibición de citocinas proinflamatorias (por ejemplo, TNF- e IL-6) por monocitos. En células de mieloma múltiple, la combinación de Lenalidomida y dexametasona, sinergiza la inhibición de la proliferación celular y la inducción de la apoptosis. En el SMD Del (5q), Lenalidomida ha demostrado inhibir selectivamente el clon anormal mediante el aumento de la apoptosis de Del (5q). Farmacocinética y Metabolismo del Fármaco: ABSORCION: Lenalidomida se absorbe rápidamente luego de la administración oral con concentraciones plasmáticas máximas entre las 0,625 y 1,5 horas post-dosis. La coadministración con alimentos no altera el alcance de la absorción (AUC) pero reduce la concentración plasmática máxima (Cmáx) en un 36%. La disposición farmacocinética de Lenalidomida es lineal. Cmáx y AUC aumentan proporcionalmente a los aumentos de la dosis. La dosificación múltiple en el régimen de dosis recomendado no tiene como resultado la acumulación del fármaco. No se realizó muestreo farmacocinético en pacientes con síndromes mielodisplásicos (SMD). En pacientes con mieloma múltiple, las concentraciones plasmáticas máximas tuvieron lugar entre 0,5 y 4,0 horas post-dosis tanto en el Día 1 como el Día 28. Los valores de AUC y Cmáx aumentan proporcionalmente a la dosis luego de dosis únicas y múltiples. La exposición (AUC) en pacientes con mieloma múltiple es 57% mayor que en voluntarios hombres sanos. Lenalidomida se absorbe rápidamente tras la administración oral en voluntarios sanos, en ayunas, con concentraciones plasmáticas máximas entre 0,5 y 2 horas después de la dosis. En los pacientes y en voluntarios sanos, la concentración máxima (Cmáx) y la curva de tiempo del área bajo la curva (AUC), aumentan proporcionalmente con el aumento de dosis. La dosificación múltiple no causa la acumulación del fármaco marcado. En el plasma, las exposiciones relativas de los S- y R-enantiómeros de Lenalidomida se aproximan al 56% y 44%, respectivamente. La coadministración con una comida rica en grasas y alta en calorías en voluntarios sanos, reduce el grado de absorción lo que resulta en una disminución de aproximadamente 20% en el área bajo la curva de concentración frente al tiempo (AUC) y un 50% de disminución en Cmáx plasmática. Sin embargo, en mieloma múltiple y en los ensayos clínicos de registro para SMD donde se establecieron la eficacia y seguridad de Lenalidomida, el fármaco se administró independientemente de la ingesta de alimentos. Por lo tanto, Lenalidomida se puede administrar con o sin alimentos. Parámetros farmacocinéticos: DISTRIBUCION: la unión in vitro de (14C)-Lenalidomida a las proteínas plasmáticas es de aproximadamente un 30%. METABOLISMO: no se ha estudiado el perfil metabólico de Lenalidomida en humanos. En voluntarios sanos, aproximadamente dos tercios de Lenalidomida se elimina inalterada a través de la excreción urinaria. El proceso excede la velocidad de filtración glomerular y, por lo tanto, es parcial o completamente activa. La vida media de eliminación es de aproximadamente 3 horas. Lenalidomida sufre un metabolismo limitado (el 82% de la dosis es excretada en orina sin cambios). Lenalidomida inalterado es el componente predominante en circulación en los seres humanos. Se han identificado dos metabolitos: hidroxi-lenalidomida y N-acetil-lenalidomida, cada uno constituye menos del 5% de los niveles de Lenalidomida en la circulación. EXCRECION: la eliminación es principalmente renal. Después de una única administración oral de [ 14 C]- lenalidomida (25 mg) a sujetos sanos, aproximadamente el 90% y el 4% de la dosis radiactiva se elimina dentro de diez días en la orina y las heces, respectivamente. Aproximadamente el 82% de la dosis radiactiva se excreta como Lenalidomida en la orina dentro de las 24 horas. Hidroxi-lenalidomida y N-acetil-lenalidomida representan 4,59% y 1,83% de la dosis excretada, respectivamente. El clearence renal de Lenalidomida supera la tasa de filtración glomerular. En dosis de 5 a 25 mg/d, la vida media de Lenalidomida es de 3 horas en sujetos sanos y de 3 a 5 horas en pacientes con SMD, MM o LCM. EFECTO DE DEXAMETASONA: la co-administración de dosis únicas o múltiples de dexametasona (40 mg) no tiene ningún efecto clínicamente relevante sobre la farmacocinética de dosis múltiples de Lenalidomida (25 mg).
9 Poblaciones especiales: EMBARAZO: categoría X: (Ver ADVERTENCIAS Y PRECAUCIONES y CONTRAINDICACIONES) Debido a la semejanza estructural con talidomida, un teratógeno humano conocido, y la falta de información suficiente con respecto al potencial teratogénico de Lenalidomida, está contraindicado en mujeres que están o pueden quedar embarazadas y que no están usando los dos tipos de control de la natalidad requeridos o que no se están absteniendo de tener relaciones sexuales heterosexuales reproductivas en forma continua. Lenalidomida no debe ser usado por mujeres que están embarazadas o que podrían quedar embarazadas mientras están tomando el medicamento. Si ocurre un embarazo durante el tratamiento, el fármaco debe discontinuarse de inmediato. Bajo estas condiciones, la paciente debe ser derivada a un obstetra/ginecólogo experimentado en toxicidad reproductiva para una mayor evaluación y asesoramiento. Toda sospecha de exposición del feto a Lenalidomida debe ser informada a las Autoridades Sanitarias y al laboratorio farmacéutico. Lenalidomida está presente en el semen humano a niveles sumamente bajos durante el tratamiento y es indetectable en el semen humano 3 días después de suspender el fármaco en sujetos sanos. Como medida de precaución, y teniendo en cuenta las poblaciones especiales (pacientes con insuficiencia renal), los pacientes varones que toman Lenalidomida deben usar preservativos durante todo el tratamiento, durante la interrupción del tratamiento, y por hasta 28 días luego de discontinuar HEMALEN, si su pareja está embarazada o está en edad fértil y no adopta medidas anti-conceptivas. Los hombres que toman HEMALEN no pueden donar esperma. USO EN MUJERES EN PERIODO DE LACTANCIA: se desconoce si el fármaco se excreta en la leche materna. Debido a que muchos fármacos se excretan en leche humana y debido al potencial de reacciones adversas en lactante por Lenalidomida, debe tomarse una decisión en cuanto a discontinuar la lactancia o discontinuar el fármaco, teniendo en cuenta la importancia del fármaco para la madre. USO PEDIATRICO: no se establecido la efectividad y seguridad en pacientes pediátricos menores de 18 años de edad. USO GERIATRICO: se sabe que este fármaco es excretado sustancialmente mediante el riñón, y el riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con función renal deteriorada. Debido a que los pacientes ancianos son más propensos a tener una función renal disminuida, se debe tener cuidado en la selección de la dosis, y sería prudente monitorear la función renal. PACIENTES CON INSUFICIENCIA RENAL: la farmacocinética de Lenalidomida se estudió en pacientes con insuficiencia renal debido a condiciones no malignas. No se ha determinado la farmacocinética de Lenalidomida en pacientes con SMD con disfunción renal. Los pacientes con MM y deterioro renal leve tuvieron un AUC 56% mayor que aquellos con función renal normal. Lenalidomida se excreta principalmente por el riñón, por lo tanto, se debe tener cuidado al seleccionar la dosis y se recomienda monitorizar la función renal. No se requieren ajustes de dosis en pacientes con insuficiencia renal leve. Los siguientes ajustes de dosis se recomiendan en el inicio de la terapia para los pacientes con insuficiencia renal moderada o grave o enfermedad renal en etapa terminal (Ver ADVERTENCIAS Y PRECAUCIONES). PACIENTES CON ENFERMEDAD HEPATICA: los análisis farmacocinéticos de la población incluyeron pacientes con deterioro hepático leve (N = 16, bilirrubina total >1 a 1,5 x ULN o AST > ULN) y muestran que el deterioro hepático leve no tiene influencia en la disposición de Lenalidomida. No hay datos disponibles de pacientes con deterioro hepático moderado a severo. OTROS FACTORES INTRINSECOS: los análisis farmacocinéticos muestran que el peso corporal (33 a 135 kg), el género, la raza y el tipo de neoplasias hematológicas (SMD, MM o LCM) no tienen un efecto clínicamente relevante en el aclaramiento de Lenalidomida en pacientes adultos. DOSIFICACION Y ADMINISTRACION: HEMALEN debe tomarse por vía oral a aproximadamente la misma hora todos los días, con o sin la ingesta de alimentos. Las cápsulas deben tragarse enteras con agua. Las cápsulas no deben abrirse, romperse o masticarse. Se sabe que este fármaco se excreta considerablemente por medio del riñón, y el riesgo de reacciones tóxicas a este fármaco puede ser mayor en pacientes con función renal deteriorada. Debido a que los pacientes ancianos son más propensos a tener una función renal disminuida, se debe tener cuidado en la selección de la dosis, y sería prudente monitorear la función renal.
10 Mieloma múltiple: La dosis inicial recomendada de HEMALEN 25 mg diarios los días 1-21 de ciclos repetidos cada 28 días. La dosis recomendada de dexametasona es 40 mg diarios los días 1-4, 9-12 y de ciclos de 28 días para los primeros 4 ciclos de tratamiento y luego 40 mg diarios los días 1-4 cada 28 días. Para pacientes mayores a 75 años de edad la dosis inicial de dexametasona debería ser reducida. El tratamiento deberá continuarse hasta progresión de enfermedad o toxicidad inaceptable. En pacientes no candidatos a ASCT (Trasplante autologo de Células madres) el tratamiento debería continuarse hasta progresión de enfermedad o toxicidad inaceptable. Para pacientes candidatos a ASCT la movilización de Células madre hematopoyéticas debería ocurrir dentro de los 4 ciclos de tratamiento con Lenalidomida. AJUSTES DE DOSIS DURANTE EL TRATAMIENTO Y REINICIO DEL TRATAMIENTO: los ajustes de dosis resumidos debajo son los recomendados para manejar neutropenia de grado 3 ó 4 o trombocitopenia u otra toxicidad de grado 3 ó 4 relacionada con Lenalidomida. Trombocitopenia en MM Caen a < 30 x 10 9 /l Regresan a 30 x 10 9 /l Cuando las plaquetas: Para cada descenso subsiguiente debajo de 30 x 10 9 /l Regresan a 30 x 10 9 /l Acción recomendada: Interrumpir tratamiento con HEMALEN seguir un CBC semanal Reanudar HEMALEN al siguiente nivel de dosis más bajo. No dosificar por debajo de 2,5 mg diarios. Interrumpir tratamiento con HEMALEN Reanudar HEMALEN al nivel de dosis inmediatamente inferior. No dosificar por debajo de 2,5 mg diarios. Neutropenia en MM Caen a <1000/mcl Cuando los neutrófilos: Regresan a 1000/mcl y neutropenia es la única toxicidad Regresan a 1000/mcl y hay otra toxicidad Acción recomendada: Interrumpir tratamiento con HEMALEN seguir un CBC semanal Reanudar HEMALEN con la dosis inicial diaria de inicio o a 25 mg diarios Reanudar HEMALEN al siguiente nivel de dosis mas bajo. No dosificar por debajo de 2,5 mg diarios. Para cada caída posterior <1000/mcl Interrumpir tratamiento con HEMALEN Regresan a 1000/mcl Reanudar HEMALEN al siguiente nivel de dosis mas bajo. No dosificar por debajo de 2,5 mg diarios. En caso de neutropenia, el médico debería considerar el agregado de factores estimulantes de colonia. Otras toxicidades grados 3/4 en MM: En cuanto a otras toxicidades grados 3/4 que se consideran relacionadas con HEMALEN, suspender el tratamiento y reiniciar, según el criterio del médico, en el próximo nivel de dosis más bajo cuando se resuelva la toxicidad a grado 2. Síndrome mielodisplásico: La dosis inicial recomendada de HEMALEN es 10 mg diarios los días 1-21 de ciclos repetidos cada 28 días. La dosis se continúa o se modifica en base a hallazgos clínicos o de laboratorio. AJUSTES DE DOSIS DURANTE EL TRATAMIENTO Y REINICIO DEL TRATAMIENTO: Los ajustes de dosis resumidos debajo son los recomendados para manejar neutropenia de grado 3 ó 4 o trombocitopenia u otra toxicidad de grado 3 ó 4 relacionada con Lenalidomida.
11 Los pacientes que reciben una dosis inicial de 10 mg y que experimentan trombocitopenia deben tener un ajuste de dosis de la siguiente manera: Si se manifiesta trombocitopenia DENTRO de las 4 semanas de iniciar el tratamiento con 10 mg diarios en SMD: Si el basal es /mcl Cuando las plaqueta caen a <50.000/mcl Cuando las plaquetas regresan a /mcl Si el basal es < /mcl Cuando las plaquetas caen al 50% del valor basal Si el basal es /mcl y regresa a /mcl Si el basal es <60.000/mcl y regresa a /mcl Acción recomendada: Interrumpir tratamiento con HEMALEN Reanudar HEMALEN a 5 mg diarios Acción recomendada: Interrumpir tratamiento con HEMALEN Reanudar HEMALEN en 5 mg diarios Reanudar HEMALEN en 5 mg diarios Si se manifiesta trombocitopenia DESPUES de 4 semanas de iniciar el tratamiento en 10 mg diarios en SMD: Cuando las plaquetas <30.000/mcl ó <50.000/mcl y transfusiones plaquetarias Regresan a /mcl (sin insuficiencia hemostática) Acción recomendada Interrumpir tratamiento con HEMALEN Reanudar tratamiento con HEMALEN en 5 mg diarios Los pacientes que experimentan trombocitopenia con 5 mg diarios deben tener un ajuste de dosis de la siguiente manera: Cuando las plaquetas Acción recomendada <30.000/mcl ó <50.000/mcl y transfusiones plaquetarias Regresan a /mcl (sin insuficiencia hemostática) Interrumpir tratamiento con HEMALEN Reanudar tratamiento con HEMALEN en 2,5 mg/día. Los pacientes que reciben una dosis inicial de 10 mg y que experimentan neutropenia deben tener un ajuste de dosis de la siguiente manera: Recuento Absoluto de Neutrófilos (ANC) Si se manifiesta neutropenia DENTRO de las 4 semanas de iniciar el tratamiento en 10 mg diarios: Si el ANC basal es 1000/mcl Cuando los Neutrófilos: Acción recomendada: Caen a <750/mcl Regresan a 1000/mcl Si el ANC basal es 1000/mcl Cuando los Neutrófilos: Caen a <500/mcl Regresan a 500/mcl Interrumpir tratamiento con HEMALEN Reanudar HEMALEM en 5 mg diarios Acción recomendada: Interrumpir tratamiento con HEMALEN Reanudar HEMALEN en 5 mg diarios Si se manifiesta neutropenia DESPUES de 4 semanas de iniciar tratamiento en 10 mg Cuando los neutrófilos: Acción recomendada <500/mcl por 7 días ó <500/mcl asociado con fiebre ( 38,5ºC) Regresan a 500/mcl Interrumpir tratamiento con HEMALEN Reaundar HEMALEN en 5 mg diarios
12 Los pacientes que experimentan neutropenia en 5 mg diarios deben tener un ajuste de dosis de la siguiente manera: Si se manifiesta neutropenia durante el tratamiento con 5 mg diarios en SMD Cuando los neutrófilos: Acción recomendada: <500/mcl por 7 días ó <500/mcl asociado con fiebre ( 38,5ºC) Regresan a 500/mcl Interrumpir tratamiento con HEMALEN Reanudar HEMALEN en 2,5 mg diarios Otras toxicidades grados 3/4 en SMD: Para otras toxicidades grado 3 ó 4 relacionadas con Lenalidomida, interrumpir el tratamiento y reiniciar al nivel de dosis inmediatamente inferior cuando la toxicidad remite a un grado 2, según criterio del médico. Se debe considerar la interrupción o discontinuación de Lenalidomida para un exantema de piel grado 2 ó 3. Se debe discontinuar definitivamente Lenalidomida si aparece angioedema, exantema grado 4, exantema exfoliativo o ampollar, o si se sospecha un síndrome de Stevens Johnson y necrólisis tóxica epidérmica. Linfoma de células de manto: La dosis inicial recomendada de HEMALEN es de 25 mg/día por vía oral en los días 1-21 de ciclos repetidos de 28 días para el linfoma de células de manto refractario o recaído. El tratamiento debe continuar hasta la progresión de la enfermedad o hasta que se manifieste una toxicidad inaceptable. El tratamiento continúa, se modifica o se discontinúa sobre la base de los hallazgos clínicos o de laboratorio. Ajustes de dosis para toxicidades hematológicas durante el tratamiento de LCM: Se recomiendan los lineamientos de modificación de dosis, tal como se resumen a continuación, para manejar la neutropenia o trombocitopenia grados 3 ó 4 u otras toxicidades grado 3 ó 4 que se consideren en relación con HEMALEN. Recuento de plaquetas Si se manifiesta trombocitopenia durante el tratamiento en LCM: Cuando las plaquetas: Acción recomendada: Caen a <50.000/mcl Regresan a /mcl Recuento absoluto de neutrófilos (ANC) Neutropenia durante el tratamiento en LCM: Cuando los neutrófilos: Caen a <1000/mcl por al menos 7 días ó caen a <1.000/mcl con una temperatura asociada 38,5ºC ó caen a <500/mcl Regresan a 1.000/mcl Interrumpir tratamiento con HEMALEN y realizar un hemograma de forma semanal. Reanudar HEMALEN a 5 mg menos de la dosis anterior. No dosificar menos de 5 mg diarios. Acción recomendada: Interrumpir tratamiento con HEMALEN y realizar un hemograma de forma semanal. Reanudar HEMALEN en 5 mg menos de la dosis anterior. No dosificar menos de 5 mg diarios. Otras toxicidades grados 3/4 en LCM: En cuanto a otras toxicidades grados 3/4 que se consideran relacionadas con HEMALEN, suspender el tratamiento y reiniciar, según el criterio del médico, en el próximo nivel de dosis más bajo cuando la toxicidad se resolvió a grado 2. AJUSTE DE DOSIS EN INSUFICIENCIA RENAL: Dosis inicial para insuficiencia renal en MM, SMD o LCM Como HEMALEN se excreta principalmente por el riñón sin metabolizar, se recomiendan ajustes a la dosis inicial para proporcionar una exposición adecuada al fármaco en pacientes con insuficiencia renal moderada o severa y en pacientes sometidos a diálisis.
13 Ajuste de dosis inicial para insuficiencia renal en MM, SMD o LCM Categoría Función renal (Cockcroft-Gault) Dosis en MM ó LCM Dosis en SMD Insuficiencia renal moderada CLcr ml/min 10 mg Cada 24 horas 5 mg Cada 24 horas Insuficiencia renal severa CLcr < 30 ml/min (no requiere diálisis) 15 mg Cada 48 horas 2,5 mg Cada 24 horas Enfermedad renal en etapa terminal CLcr < 30 ml/min (requiere diálisis) 5 mg Una vez por día. Los días de diálisis, administrar la dosis después de la diálisis. 2,5 mg Una vez por día, los días de diálisis administrar la dosis después de la diálisis Insuficiencia Renal Moderada en MM: considerar escalar la dosis a 15 mg después de 2 ciclos si el paciente tolera la dosis de 10 mg de Lenalidomida sin toxicidad limitante de dosis. Tras el inicio de la terapia con HEMALEN, la modificación subsiguiente de la dosis debería basarse en la tolerancia al tratamiento de cada paciente, como se describe en otra parte en esta sección. CONTRAINDICACIONES: EMBARAZO: Categoría X: (Ver ADVERTENCIAS Y PRECAUCIONES) Debido a sus semejanzas estructurales con talidomida, un teratógeno humano conocido, Lenalidomida está contraindicado en mujeres embarazadas y mujeres capaces de quedar embarazadas. REACCIONES ALERGICAS: HEMALEN está contraindicado en pacientes con hipersensibilidad (por ejemplo, angioedema, síndrome de Steven-Johnson, necrólisis epidérmica tóxica) a Lenalidomida o a cualquiera de los excipientes. ADVERTENCIAS Y PRECAUCIONES: EMBARAZO: Categoría X: Lenalidomida es un análogo de talidomida. Talidomida es una conocido teratógeno humano que provoca graves daños de nacimiento con riesgo de muerte. Lenalidomida puede provocar daños al feto si se administra a una mujer embarazada. Se debe aconsejar a las mujeres en edad fértil que eviten los embarazos mientras estén bajo tratamiento con HEMALEN. Deben usarse dos métodos anticonceptivos efectivos durante el tratamiento. No hay estudios adecuados y bien controlados en mujeres embarazadas. Debido a esta potencial toxicidad y para evitar exponer al feto a Lenalidomida solo está disponible bajo un programa de distribución especial restringido. Este programa se llama Programa de Gestión de Riesgo. Cuando no hay alternativa, las mujeres en edad fértil pueden ser tratadas con Lenalidomida siempre que se tomen las precauciones adecuadas para evitar el embarazo. Las mujeres deben comprometerse ya sea a abstenerse de forma continua de tener relaciones sexuales heterosexuales o a usar dos métodos de control de la natalidad confiables, incluyendo por lo menos un método altamente efectivo (es decir, DIU, anticoncepción hormonal, ligadura de trompas, o vasectomía de la pareja) y un método efectivo adicional (por ej., condón de látex, diafragma, o capuchón cervical), comenzando 4 semanas antes de iniciar el tratamiento con Lenalidomida, durante la terapia con Lenalidomida, durante la interrupción de la terapia, y durante 4 semanas luego de la discontinuación de la terapia de Lenalidomida. Si la anticoncepción hormonal o por medio de DIU está médicamente contraindicada, pueden usarse otros dos métodos efectivos o altamente efectivos. Las mujeres en edad fértil que son tratadas con Lenalidomida deben realizarse pruebas de embarazo (sensibilidad de por lo menos 50 miu/ml). La primera prueba debe realizarse dentro de los días y la segunda prueba dentro de las 24 horas antes de comenzar la terapia de Lenalidomida y luego en forma semanal durante el primer mes de Lenalidomida. Luego en forma mensual (de ahí en adelante) en mujeres con ciclos menstruales regulares o cada 2 semanas en mujeres con ciclos menstruales irregulares. Se debe llevar a cabo una prueba de embarazo y asesoramiento si una paciente no tiene su período o si hay alguna anormalidad en el sangrado menstrual. Si ocurre un embarazo, Lenalidomida debe discontinuarse de inmediato. Bajo estas condiciones, la paciente debe ser derivada a un obstetra/ginecólogo experimentado en toxicidad reproductiva para una mayor evaluación y asesoramiento. Lenalidomida está contraindicado en todo paciente que haya demostrado hipersensibilidad al fármaco o a sus componentes.
14 Pacientes masculinos: Lenalidomida está presente en el semen de los pacientes que recibieron el fármaco. Por lo tanto, los hombres siempre deben utilizar un condón de látex o sintético durante el contacto sexual con las mujeres con capacidad de reproducción, mientras permanezcan en tratamiento con HEMALEN y hasta por 28 días después de descontinuarlo, incluso si se han sometido a una vasectomía exitosa. Los pacientes varones que toman HEMALEN no deben donar esperma. Donación de sangre: los pacientes no deben donar sangre durante el tratamiento con HEMALEN y durante 1 mes después de la discontinuación de la droga debido a que la sangre podría ser transfundida a una paciente embarazada cuyo feto no debe ser expuesto a HEMALEN TOXICIDAD HEMATOLOGICA (neutropenia y trombocitopenia): este fármaco está significativamente asociado a la neutropenia y trombocitopenia. Se debe monitorear los pacientes con neutropenia por probables signos de infección. Alertar a los pacientes sobre posibles sangrados o signos de sangrado especialmente aquellos que utilizan medicación concomitante que pueda incrementar el riesgo de sangrado. Los pacientes bajo terapia para los SMD con deleción 5q deben tener un monitoreo de hemograma completo semanalmente durante las primeras 8 semanas de terapia y por lo menos de forma mensual de ahí en adelante. Se observó toxicidad hematológica grado 3 ó 4 en el 80% de los pacientes inscriptos en el estudio sobre síndrome mielodisplásico. En el 48% de los pacientes que desarrollaron neutropenia grado 3 ó 4. Los pacientes pueden necesitar una interrupción y/o reducción de la dosis. Los pacientes pueden necesitar el uso de un producto de soporte sanguíneo y/o factores de crecimiento (Ver DOSIFICACION Y ADMINISTRACION). Los pacientes deben ser advertidos de informar rápidamente episodios febriles. En los estudios combinados de MM, las toxicidades hematológicas de grado 3 ó 4 fueron más frecuentes en los pacientes tratados con la combinación de Lenalidomida y dexametasona que en los pacientes tratados con dexametasona sola (Ver REACCIONES ADVERSAS). Los pacientes con MM bajo tratamiento combinado con dexametasona deben tener un monitoreo de hemograma completo semanal por los primeros 2 ciclos, en los días 1 y 15 del ciclo 3 y luego de forma mensual de ahí en adelante. Los pacientes pueden necesitar interrupción y/o reducción de la dosis (Ver DOSIFICACION Y ADMINISTRACION). Los pacientes con LCM deben realizarse recuentos sanguíneos completos semanalmente durante el primer ciclo (28 días), cada 2 semanas durante los ciclos 2-4, y luego mensualmente de ahí en adelante. Los pacientes pueden requerir la interrupción de la dosis y/o la reducción de la dosis. En los estudios de LCM, se reportaron neutropenias de grado 3 ó 4 en el 43% de los pacientes. La trombocitopenia de grado 3 ó 4 fue reportada en el 28% de los pacientes. EVENTOS TROMBOEMBOLICOS VENOSOS Y ARTERIALES: este fármaco ha demostrado un riesgo significativamente mayor de tromboembolismo venoso (predominantemente Trombosis Venosa Profunda TVP- y Embolia Pulmonar EP-) y tromboembolismo arterial (predominantemente infarto de miocardio y eventos cerebrovasculares) en pacientes con MM que fueron tratados con terapia de combinación de Lenalidomida. En pacientes con SMD y LCM, el tratamiento con monoterapia con Lenalidomida, también se asoció con un riesgo de tromboembolismo venoso (predominantemente TVP y EP), pero en menor medida que en los pacientes con MM. En consecuencia, los pacientes con factores de riesgo de tromboembolismo -incluso trombosis previadeben ser estrechamente monitorizados. Se deben tomar medidas para intentar minimizar todos los factores de riesgo modificables (por ejemplo, tabaquismo, hipertensión e hiperlipidemia). La administración concomitante de agentes eritropoyéticos u otros agentes que puedan aumentar el riesgo de trombosis, como la terapia de reemplazo hormonal, se debe utilizar con precaución en pacientes con MM tratados con Lenalidomida y dexametasona. Si la concentración de hemoglobina está por encima de 12 g/dl se debe interrumpir el tratamiento con agentes eritropoyéticos. Se aconseja a los pacientes y a los médicos prestar atención a los signos y síntomas de tromboembolismo. Se les debe dar instrucciones a los pacientes de buscar asistencia médica si manifiestan síntomas tales como respiración entrecortada, dolor en el tórax, o hinchazón en el brazo o en la pierna. Se desconoce si la anti-coagulación profiláctica o la terapia antiplaquetaria prescriptas en conjunto con Lenalidomida pueden disminuir el potencial para eventos tromboembólicos venosos. La decisión de tomar medidas profilácticas debe realizarse cuidadosamente luego de una evaluación de los factores de riesgo subyacentes de un paciente particular (Ver REACCIONES ADVERSAS). INFARTO DE MIOCARDIO: se ha informado infarto de miocardio en pacientes tratados con Lenalidomida, especialmente en aquellos con factores de riesgo conocidos. Los pacientes con factores de riesgo conocido, incluyendo trombosis previa, deben ser estrechamente vigilados y deben tomarse medidas para intentar
15 minimizar todos los factores de riesgo modificables (por ejemplo, tabaquismo, hipertensión e hiperlipidemia). INSUFICIENCIA RENAL: Lenalidomida se excreta principalmente por el riñón. Por lo tanto se debe tener cuidado al seleccionar la dosis y monitorización de la función renal se recomienda en pacientes con insuficiencia renal. Las recomendaciones para las dosis de inicio para pacientes con MM, SMD o LCM se detallan en DOSIFICACION Y ADMINISTRACION. AUMENTO DE MORTALIDAD EN PACIENTES CON LLC: HEMALEN no está indicado y no está recomendado para el tratamiento de pacientes con leucemia linfocítica crónica (LLC) por fuera de los estudios clínicos controlados. TRASTORNOS DE LA TIROIDES: se han reportado casos de hipo e hipertiroidismo. Se recomienda un control óptimo de las condiciones co-mórbidas que influyen en la función tiroidea antes de iniciar el tratamiento. Se recomienda monitoreo de la función tiroidea al iniciar el tratamiento en forma permanente durante el mismo. NEUROPATIA PERIFERICA: Lenalidomida está relacionada estructuralmente con talidomida, que se sabe, induce la neuropatía periférica grave. En este momento, el potencial neurotóxico de Lenalidomida asociado con el uso prolongado, no se puede descartar. SINDROME DE LISIS TUMORAL: debido a que Lenalidomida tiene actividad antineoplásica pueden ocurrir las complicaciones del síndrome de lisis tumoral en los pacientes que tienen una alta carga tumoral antes del tratamiento. Estos pacientes deben ser estrechamente vigilados y se deben adoptar adecuadas precauciones. Reacción de llamarada en el tumor: Se produjo la reacción de llamarada en el tumor durante el uso de Lenalidomida en la fase de investigación para tratar la leucemia linfocítica crónica (CCL, Chronic Lymphocytic Leukemia) y linfoma, y se caracteriza por una inflamación de los ganglios linfáticos, febrícula, dolor y erupción cutánea. HEMALEN no está indicado ni tampoco recomendado para LLC fuera de los ensayos clínicos controlados. Se recomienda el control y la evaluación de las reacciones de llamarada en el tumor en pacientes con LCM. La reacción de llamarada en el tumor puede imitar la progresión de la enfermedad (PE). En pacientes con reacción de llamarada de grado 3 ó 4, se recomienda detener el tratamiento con Lenalidomida hasta la resolución de la reacción de llamarada hasta un grado 1. Se puede continuar la administración de Lenalidomida en pacientes con reacciones de llamarada de grados 1 y 2 sin interrupción o modificación, según el criterio del médico. Los pacientes con reacciones de llamarada de grado 1 ó 2 también pueden recibir tratamiento con corticoides, antiinflamatorios no esteroides (AINE) y/o analgésicos narcóticos para el manejo de los síntomas de la reacción de llamarada. Los pacientes con reacciones de llamarada de grado 3 ó 4 pueden recibir tratamiento para el manejo de los síntomas según las directrices para el tratamiento de las reacciones de llamarada de grados 1 y 2. REACCIONES ALERGICAS: se han notificado casos de reacciones de hipersensibilidad /alérgicas. Los pacientes que tuvieron reacciones alérgicas previas mientras recibían tratamiento con talidomida deben ser vigilados de cerca ante una posible reacción cruzada entre Lenalidomida y talidomida (reportada en la literatura). REACCIONES CUTANEAS GRAVES: se han reportado síndrome de Stevens-Johnson (SSJ) y necrólisis epidérmica tóxica (NET). Lenalidomida debe interrumpirse si aparece una erupción exfoliativa o ampollar, o si se sospecha SSJ o NET y no debe ser reanudado después de la suspensión de estas reacciones. Se debe considerar la interrupción o suspensión de Lenalidomida para otras formas de reacciones cutáneas dependiendo de la gravedad. Los pacientes con antecedentes de erupción grave asociada con el tratamiento con talidomida no deberán recibir Lenalidomida. INTOLERANCIA A LA LACTOSA: las cápsulas de HEMALEN contienen lactosa. Los pacientes con problemas hereditarios poco frecuentes de intolerancia a la galactosa, deficiencia de lactasa Lapp o problemas de absorción de glucosa o galactosa, no deben tomar este medicamento. SEGUNDAS NEOPLASIAS MALIGNAS: se ha observado un aumento de segundas neoplasias malignas (SNM) en los ensayos clínicos en pacientes con MM tratados previamente con Lenalidomida/dexametasona, en comparación con los controles. Las SNM no invasivas comprenden cáncer de piel de células basales o de células escamosas. La mayor parte de las SNM invasivas fueron neoplasias malignas de tumores sólidos.
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
Información para pacientes
 Información para pacientes. ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede consultar la forma de hacerlo en el prospecto
Información para pacientes. ( ) Este medicamento está sujeto a seguimiento adicional, es importante comunicar los efectos adversos que pudiera usted tener. Puede consultar la forma de hacerlo en el prospecto
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
PILDORAS ANTICONCEPTIVAS FORMAS DE PRESENTACION
 PILDORAS ANTICONCEPTIVAS FORMAS DE PRESENTACION Dra Elina Coccio Las píldoras anticonceptivas son un método anticonceptivo hormonal oral para evitar el embarazo, altamente eficaz. La mayoría de las píldoras
PILDORAS ANTICONCEPTIVAS FORMAS DE PRESENTACION Dra Elina Coccio Las píldoras anticonceptivas son un método anticonceptivo hormonal oral para evitar el embarazo, altamente eficaz. La mayoría de las píldoras
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
Los métodos anticonceptivos
 Los métodos anticonceptivos Los métodos anticonceptivos o de control de la natalidad sirven para evitar un embarazo no planeado y/o prevenir enfermedades de transmisión sexual (ETS), como en el caso de
Los métodos anticonceptivos Los métodos anticonceptivos o de control de la natalidad sirven para evitar un embarazo no planeado y/o prevenir enfermedades de transmisión sexual (ETS), como en el caso de
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Además, la riboflavina puede administrarse a los infantes que presentan niveles altos de bilirrubina (hiperbilirrubinemia).
 Riboflavina (Vitamina B2) (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las vitaminas
Riboflavina (Vitamina B2) (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las vitaminas
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)_Agosto_2016
 KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
KEYTRUDA (pembrolizumab) Información para pacientes Keytruda es un medicamento biológico Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
Guía práctica. Aprendiendo. sobre la Píldora de Solo Gestágeno (POP)
 Guía práctica Aprendiendo sobre la Píldora de Solo Gestágeno (POP) Sabías que?... 3 Qué es la píldora de solo gestágeno?... 4 Cómo actúa la píldora?... 5 Cómo tomarla?... 6 Qué ocurre si me olvido de tomarla?...
Guía práctica Aprendiendo sobre la Píldora de Solo Gestágeno (POP) Sabías que?... 3 Qué es la píldora de solo gestágeno?... 4 Cómo actúa la píldora?... 5 Cómo tomarla?... 6 Qué ocurre si me olvido de tomarla?...
Consejería sobre aborto con medicamentos
 Consejería sobre aborto con medicamentos Consejería sobre aborto con medicamentos Un recurso para profesionales de la salud Protegiendo la salud de las mujeres Promoviendo el respeto a sus derechos reproductivos
Consejería sobre aborto con medicamentos Consejería sobre aborto con medicamentos Un recurso para profesionales de la salud Protegiendo la salud de las mujeres Promoviendo el respeto a sus derechos reproductivos
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Restricciones de dispensación para isotretinoína
 Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Introducción La isotretinoína tiene una elevada capacidad teratógena, pudiendo causar malformaciones congénitas potencialmente fatales. Por este motivo el embarazo representa una contraindicación absoluta
Toctino (alitretinoína)
 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
CONSENTIMIENTO INFORMADO PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS),
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
La cafeína también se puede usar para otras condiciones según lo determine su médico.
 Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
Cafeína (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La cafeína corresponde al grupo
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
PROSPECTO: INFORMACIÓN PARA EL USUARIO. IRBESARTÁN KERN PHARMA 150 mg COMPRIMIDOS RECUBIERTOS EFG
 PROSPECTO: INFORMACIÓN PARA EL USUARIO IRBESARTÁN KERN PHARMA 150 mg COMPRIMIDOS RECUBIERTOS EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
PROSPECTO: INFORMACIÓN PARA EL USUARIO IRBESARTÁN KERN PHARMA 150 mg COMPRIMIDOS RECUBIERTOS EFG Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya
Guía para el paciente de
 Guía para el paciente de REMS Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
Guía para el paciente de REMS Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
REMS. Guía para el paciente de. Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy)
 Guía para el paciente de REMS Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
Guía para el paciente de REMS Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
PÍLDORA DEL DÍA DESPUÉS
 Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
Programa Nacional de Salud Sexual y Procreación Responsable PÍLDORA DEL DÍA DESPUÉS Anticoncepción Hormonal de Emergencia AHE Guía de Usuarias MÉTODOS ANTICONCEPTIVOS La salud sexual y reproductiva es
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6. Mieloma múltiple resistente o refractario al tratamiento estándar. La Sociedad
 MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6 1. DENOMINACIÓN DEL ESQUEMA (1) : TACIDEX o THACYDEX (Talidomida + Ciclofosfamida + Dexametasona). 2. INDICACIÓN. Mieloma múltiple resistente o refractario al tratamiento
MIELOMA MÚLTIPLE: Tacidex o ThaCyDex 1/6 1. DENOMINACIÓN DEL ESQUEMA (1) : TACIDEX o THACYDEX (Talidomida + Ciclofosfamida + Dexametasona). 2. INDICACIÓN. Mieloma múltiple resistente o refractario al tratamiento
Píldoras anticonceptivas:
 Píldoras anticonceptivas: Es uno de los métodos anticonceptivos más populares. La píldora, como también se le conoce, contiene una o dos hormonas (estrógenos y progesterona) que actúan impidiendo la ovulación
Píldoras anticonceptivas: Es uno de los métodos anticonceptivos más populares. La píldora, como también se le conoce, contiene una o dos hormonas (estrógenos y progesterona) que actúan impidiendo la ovulación
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca:
 Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
Nombre: Lincomicina Condición de venta: con receta médica Clasificación: antibiotico Disponible en: Nombres de marca: Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
Qué es la tensión arterial?
 Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
Prospecto: información para el usuario. Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro
 Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
Prospecto: información para el usuario Memantina Cinfa 10 mg comprimidos recubiertos con película EFG Memantina hidrocloruro Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento,
Prospecto: información para el usuario. PENTASA 500 miligramos comprimidos de liberación prolongada Mesalazina
 Prospecto: información para el usuario PENTASA 500 miligramos comprimidos de liberación prolongada Mesalazina Lea todo el prospecto detenidamente antes de empezar a tomareste medicamento, porque contiene
Prospecto: información para el usuario PENTASA 500 miligramos comprimidos de liberación prolongada Mesalazina Lea todo el prospecto detenidamente antes de empezar a tomareste medicamento, porque contiene
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral)
 Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
Subsalicilato de Bismuto, Metronidazol y Tetraciclina (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN
PROSPECTO: INFORMACIÓN PARA EL USUARIO. flutamida cinfa 250 mg comprimidos EFG flutamida
 PROSPECTO: INFORMACIÓN PARA EL USUARIO flutamida cinfa 250 mg comprimidos EFG flutamida Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO flutamida cinfa 250 mg comprimidos EFG flutamida Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. - Conserve este prospecto, ya que puede
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
1. NOMBRE DEL MEDICAMENTO POSTINOR 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada comprimido contiene 750 microgramos de levonorgestrel. Excipientes en el apartado 6.1. Comprimidos. Los comprimidos son
Taller de capacitación en las Normas de Atención en Planificación Familiar
 Taller de capacitación en las Normas de Atención en Planificación Familiar METODOS HORMONALES Anticonceptivos Orales Combinados. Anticonceptivos Orales de Progestina sola. Inyectable Mensual Inyectable
Taller de capacitación en las Normas de Atención en Planificación Familiar METODOS HORMONALES Anticonceptivos Orales Combinados. Anticonceptivos Orales de Progestina sola. Inyectable Mensual Inyectable
10 de marzo del 2016
 10 de marzo del 2016 Qué es el Día Mundial del Riñón? El Día Mundial del Riñón es una campaña mundial dirigida a crear conciencia sobre la importancia de nuestros riñones. Pretende concientizar sobre la
10 de marzo del 2016 Qué es el Día Mundial del Riñón? El Día Mundial del Riñón es una campaña mundial dirigida a crear conciencia sobre la importancia de nuestros riñones. Pretende concientizar sobre la
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA. Cada cápsula dura contiene:
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO GLIZOLAN 50 mg cápsulas. 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene: Diacereína,
INFORMACIÓN PARA EL PACIENTE
 Novartis INFORMACIÓN PARA EL PACIENTE EXJADE DEFERASIROX Comprimidos dispersables Venta bajo receta Industria Suiza Este prospecto contiene información útil para su tratamiento. Por favor, léalo cuidadosamente
Novartis INFORMACIÓN PARA EL PACIENTE EXJADE DEFERASIROX Comprimidos dispersables Venta bajo receta Industria Suiza Este prospecto contiene información útil para su tratamiento. Por favor, léalo cuidadosamente
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Manejo de Lenalidomida - Dexametasona en el Tratamiento del. Autora M.V. Mateos
 Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Autora M.V. Mateos Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Dra. María Victoria Mateos
Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Autora M.V. Mateos Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Dra. María Victoria Mateos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CALCIO-500 D COMPRIMIDOS RECUBIERTOS SUPLEMENTO MINERAL Página 1 CALCIO-500 D Comprimidos Recubiertos Principio
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS
 INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
INTRODUCCIÓN: SEGURIDAD Y MEDICAMENTOS Qué es un medicamento? Una sustancia que pueden consumir las personas con distintos fines 1) Prevenir o tratar enfermedades 2) Aliviar síntomas 3) Realizar un diagnóstico
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 SUPOSITORIO BRONQUIAL LACTANTE SUPOSITORIO ANALGÉSICO, EXPECTORANTE BALSÁMICO Página 1 SUPOSITORIO BRONQUIAL LACTANTE
Pomalyst. Guía para el paciente de. Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy)
 Guía para el paciente de Pomalyst TM Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
Guía para el paciente de Pomalyst TM Programa de Estrategia de Evaluación y Mitigación de Riesgos (REMS) (Risk Evaluation and Mitigation Strategy) Esta guía le brinda información importante sobre lo siguiente:
2012 GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y LACTANCIA. Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE
 GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y CLASIFI FDA SEGÚN RIESGO EMBARAZO A Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE B C D Sin riesgos aparentes No existen pruebas de riesgo
GUIA DE USO DE MEDICAMENTOS EN EMBARAZO Y CLASIFI FDA SEGÚN RIESGO EMBARAZO A Sin riesgos aparentes No hay evidencia de riesgo fetal.pueden EMPLEARSE B C D Sin riesgos aparentes No existen pruebas de riesgo
INFORMACIÓN PARA EL PACIENTE. GALVUS VILDAGLIPTIN Comprimidos
 Novartis INFORMACIÓN PARA EL PACIENTE GALVUS VILDAGLIPTIN Comprimidos Venta bajo receta Industria Suiza Lea este prospecto detenidamente antes de administrar GALVUS Conserve este prospecto. Es posible
Novartis INFORMACIÓN PARA EL PACIENTE GALVUS VILDAGLIPTIN Comprimidos Venta bajo receta Industria Suiza Lea este prospecto detenidamente antes de administrar GALVUS Conserve este prospecto. Es posible
Que Son Pastillas Anticonceptivas Wikipedia - Método Anticonceptivo Послан globa :21
 Que Son Pastillas Anticonceptivas Wikipedia - Método Anticonceptivo 918732 Послан globa - 20.06.2016 02:21 Confiable Farmacia Online! «Clic Aquí Para Ordenar En Línea Ahora Mismo!» http://elikazhu.ru/bablo.jpg
Que Son Pastillas Anticonceptivas Wikipedia - Método Anticonceptivo 918732 Послан globa - 20.06.2016 02:21 Confiable Farmacia Online! «Clic Aquí Para Ordenar En Línea Ahora Mismo!» http://elikazhu.ru/bablo.jpg
Lenalidomida en Sindromes Mielodisplásicos
 1 Lenalidomida HEMATOLOGÍA en Sindromes Mielodisplásicos 2013 Lenalidomida en Sindromes Mielodisplásicos Recomendaciones para su uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Alejandro Flores, Dra.
1 Lenalidomida HEMATOLOGÍA en Sindromes Mielodisplásicos 2013 Lenalidomida en Sindromes Mielodisplásicos Recomendaciones para su uso Coordinador: Dr. Esteban Lifschitz Autores: Dr. Alejandro Flores, Dra.
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Anticoagulantes (Por vía oral)
 Anticoagulantes (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los anticoagulantes orales
Anticoagulantes (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Los anticoagulantes orales
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
Usos de fármacos durante el embarazo y la lactancia
 Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Proyecto: uso racional de analgésicos y antiinflamatorios
 Proyecto: uso racional de analgésicos y antiinflamatorios OBJETIVO -Concientizar a la población sobre el uso responsable de los medicamentos, en este caso AINES. -Revalorizar el rol del farmacéutico en
Proyecto: uso racional de analgésicos y antiinflamatorios OBJETIVO -Concientizar a la población sobre el uso responsable de los medicamentos, en este caso AINES. -Revalorizar el rol del farmacéutico en
Prospecto: Información para el paciente. Fenofibrato Kern Pharma 145 mg comprimidos EFG
 Prospecto: Información para el paciente Fenofibrato Kern Pharma 145 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
Prospecto: Información para el paciente Fenofibrato Kern Pharma 145 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
OPCIONES COMPLEMENTARIAS DE PLANIFICACION FAMILIAR PARA MUJERES LACTANTES
 M E L A OPCIONES COMPLEMENTARIAS DE PLANIFICACION FAMILIAR PARA MUJERES LACTANTES 1ª Opción Métodos Hormonales/Barrera/naturales MELA Preservativos Diafragmas Espermicidas Dispositivos intrauterinos. Planificación
M E L A OPCIONES COMPLEMENTARIAS DE PLANIFICACION FAMILIAR PARA MUJERES LACTANTES 1ª Opción Métodos Hormonales/Barrera/naturales MELA Preservativos Diafragmas Espermicidas Dispositivos intrauterinos. Planificación
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Valsartán KERN PHARMA 160 mg comprimidos recubiertos con película EFG Valsartán
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Valsartán KERN PHARMA 160 mg comprimidos recubiertos con película EFG Valsartán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Valsartán KERN PHARMA 160 mg comprimidos recubiertos con película EFG Valsartán Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Secalip 200 mg cápsulas duras Fenofibrato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Secalip 200 mg cápsulas duras Fenofibrato Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
PROSPECTO: INFORMACIÓN PARA EL USUARIO Secalip 200 mg cápsulas duras Fenofibrato Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS PROSPECTO PARA el liberador del lote Ecuphar NV: ACTIMARBO 80 MG COMPRIMIDOS SABOR PARA PERROS 1. NOMBRE O RAZÓN SOCIAL Y DOMICILIO O SEDE SOCIAL DEL TITULAR DE
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento.
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
1. Qué es ESTE PRODUCTO?... 2. 2. Cuándo no deberá utilizar ESTE PRODUCTO?... 2
 TEXTO FOLLETO DE INFORMACION AL PACIENTE Lea cuidadosamente este prospecto en su totalidad antes de comenzar a usar este medicamento. Conserve este prospecto. Puede necesitar leerlo nuevamente. Este prospecto
TEXTO FOLLETO DE INFORMACION AL PACIENTE Lea cuidadosamente este prospecto en su totalidad antes de comenzar a usar este medicamento. Conserve este prospecto. Puede necesitar leerlo nuevamente. Este prospecto
Adolescentes entrevistados de acuerdo a si han oído hablar de los condones o preservativos masculinos
 Adolescentes entrevistados de acuerdo a si han oído hablar de los condones o preservativos masculinos Has oído hablar de los condones o preservativos masculinos Si 247 193 90.1 88.5 No 27 25 9.9 11.5 Total
Adolescentes entrevistados de acuerdo a si han oído hablar de los condones o preservativos masculinos Has oído hablar de los condones o preservativos masculinos Si 247 193 90.1 88.5 No 27 25 9.9 11.5 Total
Capítulo II: Aspectos clínicos y Organización de los servicios para la atención del dengue
 Capítulo II: Aspectos clínicos y Organización de los servicios para la atención del dengue Tema 3 : Organización de los servicios para la atención del dengue Contenido: La Organización de los servicios
Capítulo II: Aspectos clínicos y Organización de los servicios para la atención del dengue Tema 3 : Organización de los servicios para la atención del dengue Contenido: La Organización de los servicios
140220_v28.0_Rev_EU_MM_PIL_ES
 Prospecto: información para el paciente Revlimid 15 mg cápsulas duras Revlimid 25 mg cápsulas duras Lenalidomida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Prospecto: información para el paciente Revlimid 15 mg cápsulas duras Revlimid 25 mg cápsulas duras Lenalidomida Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
Prospecto: información para el usuario
 Prospecto: información para el usuario Valsartán Almus 160 mg comprimidos recubiertos con película EFG Valsartán Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
Prospecto: información para el usuario Valsartán Almus 160 mg comprimidos recubiertos con película EFG Valsartán Lea todo el prospecto detenidamente antes de empezar a usar el medicamento: - Conserve este
sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se
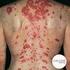 LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
LUPUS El sistema inmunitario está diseñado para combatir las substancias ajenas o extrañas al cuerpo. En las personas con lupus, el sistema inmunitario se afecta y ataca a las células y tejidos sanos.
1. Es importante dejar de fumar? 2. Cuáles son los beneficios de dejar de fumar?
 1. Es importante dejar de fumar? Si, es muy importante. El consumo de tabaco es la mayor causa de muerte prevenible en nuestro país y en el mundo (o sea EVITABLE). Cada año, 40.000 argentinos mueren por
1. Es importante dejar de fumar? Si, es muy importante. El consumo de tabaco es la mayor causa de muerte prevenible en nuestro país y en el mundo (o sea EVITABLE). Cada año, 40.000 argentinos mueren por
LOSARTAN POTASICO 50 mg Tabletas
 LOSARTAN POTASICO 50 mg Tabletas LOSARTAN POTASICO 50 mg - Tabletas Antihipertensivo COMPOSICION: Cada tableta contiene : Losartán potásico Excipientes c.s.p. 50 mg INDICACIONES TERAPEUTICAS: LOSARTAN
LOSARTAN POTASICO 50 mg Tabletas LOSARTAN POTASICO 50 mg - Tabletas Antihipertensivo COMPOSICION: Cada tableta contiene : Losartán potásico Excipientes c.s.p. 50 mg INDICACIONES TERAPEUTICAS: LOSARTAN
Día Mundial de la Trombosis DÍA MUNDIAL DE LA TROMBOSIS 13 DE OCTUBRE
 Día Mundial de la Trombosis Qué es la Trombosis? La TROMBOSIS es un coágulo sanguíneo que se forma en las arterias o venas y bloquea la llegada de sangre y oxígeno. Constituye el principal factor responsable
Día Mundial de la Trombosis Qué es la Trombosis? La TROMBOSIS es un coágulo sanguíneo que se forma en las arterias o venas y bloquea la llegada de sangre y oxígeno. Constituye el principal factor responsable
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
Prospecto: Información para el usuario. Aciclovir STADA 200 mg comprimidos EFG
 Prospecto: Información para el usuario Aciclovir STADA 200 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Prospecto: Información para el usuario Aciclovir STADA 200 mg comprimidos EFG Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
INTRODUCCIÓN. Otras investigaciones mostraron que el incremento de la glicemia basal en ayunas en hipertiroideos fue más alta que en normales (4,5,6).
 INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
NUEVO ESQUEMA DE ASIGNACIÓN DE PAUTAS DE TRATAMIENTO Enero-2009 (Ver Diagrama Básico de asignación de protocolo de asignación de IS)
 NUEVO ESQUEMA DE ASIGNACIÓN DE PAUTAS DE TRATAMIENTO Enero-2009 (Ver Diagrama Básico de asignación de protocolo de asignación de IS) A) BASE: TRIPLE con PREDNISONA+ + MICOFENOLATO Pacientes sin características
NUEVO ESQUEMA DE ASIGNACIÓN DE PAUTAS DE TRATAMIENTO Enero-2009 (Ver Diagrama Básico de asignación de protocolo de asignación de IS) A) BASE: TRIPLE con PREDNISONA+ + MICOFENOLATO Pacientes sin características
ibufén 400 mg comprimidos recubiertos con película ibuprofeno
 ibufén 400 mg comprimidos recubiertos con película ibuprofeno Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. Siga exactamente
ibufén 400 mg comprimidos recubiertos con película ibuprofeno Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para usted. Siga exactamente
Enfermedad renal crónica
 Enfermedad renal crónica Introducción La médula ósea es el tejido esponjoso dentro de todos sus huesos, incluidos la cadera y los huesos del muslo. La médula ósea es como una fábrica que produce diferentes
Enfermedad renal crónica Introducción La médula ósea es el tejido esponjoso dentro de todos sus huesos, incluidos la cadera y los huesos del muslo. La médula ósea es como una fábrica que produce diferentes
Ministerio de Salud Secretaría de Políticas, Regulación y Relaciones Sanitarias A.N.M.A.T.
 BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
BUENOS AIRES, 24 Oct 2007 VISTO la Resolución del ex y Acción Social Nº 706/93, la Disposición Nº 5904/96, la Disposición Nº 3855/98, el Expediente Nº 1-0047- 0000-016483-07-1 del registro de esta Administración
Perenterol 50 mg cápsulas
 Traducción no oficial y para uso interno del prospecto en alemán Prospecto: información para el paciente Información para usuarios Perenterol 50 mg cápsulas Para niños a partir de los 2 años de edad y
Traducción no oficial y para uso interno del prospecto en alemán Prospecto: información para el paciente Información para usuarios Perenterol 50 mg cápsulas Para niños a partir de los 2 años de edad y
Perpetuum mobile: Nuevos anticoagulantes orales CASO CLINICO 1. María Pereiro Sánchez MIR III Hematología y hemoterapia.
 Perpetuum mobile: Nuevos anticoagulantes orales CASO CLINICO 1 María Pereiro Sánchez MIR III Hematología y hemoterapia. Paciente de 60 años FA persistente Solicitan anticoagulación indefinida. NECESITAMOS
Perpetuum mobile: Nuevos anticoagulantes orales CASO CLINICO 1 María Pereiro Sánchez MIR III Hematología y hemoterapia. Paciente de 60 años FA persistente Solicitan anticoagulación indefinida. NECESITAMOS
RESIDUOS CITOTOXICOS. Farm. Andrea Imhoff Hospital Dr. O. Alassia
 RESIDUOS CITOTOXICOS Farm. Andrea Imhoff Hospital Dr. O. Alassia RESIDUOS CITOTOXICOS Son aquellos que por sus características y grado de contaminación química o biológica requieren un tratamiento específico
RESIDUOS CITOTOXICOS Farm. Andrea Imhoff Hospital Dr. O. Alassia RESIDUOS CITOTOXICOS Son aquellos que por sus características y grado de contaminación química o biológica requieren un tratamiento específico
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
