Proteasas. Bioquímica de Proteínas 2018
|
|
|
- Domingo Gutiérrez Martin
- hace 5 años
- Vistas:
Transcripción
1 Proteasas Bioquímica de Proteínas
2 Reacción no catalizada La reacción no catalizada consiste en un ataque nucleofílico por el átomo de O del H2O sobre el carbono carbonílico del enlace peptídico formando un intermediario tetraédrico. El carácter parcial de doble enlace del enlace peptídico hace que el carbono carbonílico sea mucho menos reactivo que los carbonos carbonílicos en los ésteres. La tarea catalítica de las proteasas consiste en transformar al carbono carbonílico, normalmente no reactivo, en mucho más susceptible al ataque nucleofílico por el agua. 2
3 1) Función digestiva. a) Extracelular. b) Intracelular. 2) Turnover proteico. FUNCIONES DE LAS PROTEINASAS. 3) Procesamiento post-traduccional de proteínas. a) Proteasas del péptido señal. b) Proteasas de procesamiento de pro-hormonas y otras proteínas. c) Dominio pro- en muchas proteinasas. 4) Invasión de tejidos (parásitos, metástasis tumorales).
4 Proteasas: Endo y exo Las endopeptidasas hidrolizan uniones peptídicas internas en una cadena polipeptídica, tendiendo a actuar lejos del N- terminal o del C-terminal. Las exopeptidasas requieren un amino terminal, un carboxilo terminal, o ambos, libres, e hidrolizan una unión peptídica a no mas de tres residuos desde el N terminal o del C terminal. Según el extremo que cortan, serán aminopeptidasas o carboxipeptidasas.
5 Clasificación de Proteasas Por la reacción catalizada: son pocos los casos en que se conoce exactamente la reacción catalizada, en términos de qué unión es hidrolizada en el substrato. Se aplica sobre todo a exopeptidasas. Por el mecanismo catalítico: es la más usada, desde su propuesta por Brian Hartley hace más de 50 años. Se basa en cuáles son los grupos que intervienen en la catálisis y en cómo actúan. Por su secuencia y estructura: es la clasificación más moderna, propuesta por Alan Barrett, y complementa a la anterior. 5
6 Exopeptidasas: clasificación por el tipo de reacción catalizada Aminopeptidasa: libera un único residuo desde el N-t no bloqueado de su sustrato. Dipeptidil-peptidasa: hidroliza un dipéptido desde el N-t de su sustrato. Tripeptidil-peptidasa: hidroliza un tripéptido desde el N-t de su sustrato. Carboxipeptidasa: libera un único residuo desde el C-t no bloqueado de su sustrato. Peptidil-dipeptidasa: hidroliza un dipéptido desde el C-t de su sustrato. Dipeptidasa: hidroliza un dipéptido, y típicamente requiere que ambos extremos estén libres. Omega-peptidasas: no requieren un N-t o un C-t libre en el sustrato. Frecuentemente actúan cerca de uno u otro extremo del péptido. Algunas hidrolizan uniones peptídicas que no son uniones alfa, como las ubiquitin hidrolasas, las piroglutamil peptidasas y la gama-glutamil hidrolasa. 6
7 Peptidasas específicas para uniones peptídicas con Prolina 7
8 Endopeptidasas: clasificación por el tipo de reacción catalizada Pueden ser denominadas en base a la preferencia por un determinado residuo en P1 o en P1 (por ejemplo, glicil-endopeptidasa; peptidil-lisil endopeptidasa). Si hay varias enzimas con igual especificidad, hay que distinguirlas (glutamil endopeptidasas I y II). En la gran mayoría de los casos, la especificidad es demasiado compleja, y se usan nombres triviales (pepsina, tripsina, quimotripsina, papaína, termolisina) 8
9 Proteasas: Clases mecanísticas Serín Proteasas Cisteín proteasas Treonin proteasas Asn proteasas Asp/Asn Glu proteasas Aspartil proteasas Metaloproteasas Glu/Gln 9
10 Proteasas: Clasificación por relación evolutiva Propuesta en 1993 por Alan J. Barrett y N.D. Rawlings (Cambridge, UK). Comparación de secuencias proteicas y clasificación en: Familias, cuyos miembros derivarían de una misma proteína ancestral por evolución divergente. Tienen homología estadísticamente significativa, al menos en el dominio catalítico (es decir, en el que tiene actividad de proteasa). Clanes, grupos de familias con una proteína ancestral común. La homología de secuencia entre ellas es mucho más baja, pero se conservan el orden lineal de los residuos del sitio activo y los pequeños grupos de residuos que los rodean; además, tienen una estructura terciaria similar. La información, que se mantiene actualizada, está contenida en la base de datos MEROPS (merops.sanger.ac.uk). Se complementa con la nomenclatura de enzimas de la IUBMB (peptidasas, EC 3.4; la cruzipaína es EC y C en MEROPS). 10
11 Al 4/5/2017: 5 clanes A, 10 C, 2 G, 15 M, 5 N, 5 P y 12 S. 16 familias A, 71 C, 2 G, 72 M, 7 N, 44 P (incluyen 4 familias T), 36 S y desconocidas
12 DETERMINACIÓN DE LA ACTIVIDAD PROTEOLÍTICA. 1.SUSTRATOS PROTEICOS. 1) Proteínas naturales como sustratos generales (hemoglobina, caseína) a) Precipitación de proteína no digerida y determinación de A 280 nm en el sobrenadante. b) Precipitación y reacción de Folin en el sobrenadante. 2) Derivados cromogénicos de proteínas naturales (azocaseína, azoalbúmina) Precipitación y lectura de la A 440 nm de los azopéptidos. 3) Derivados fluorogénicos de proteínas naturales: Caseína ligada a isotiocianato de fluoresceína (FITC-caseína). Excitación a 490 nm y emisión a 525 nm. 4) Proteínas específicas. a)colágenos para colagenasas. b) Pre-proteínas radioactivas (sintetizadas por traducción in vitro de su mrna), para las proteinasas del péptido señal.
13 5) Proteínas naturales marcadas con radioisótopos ( 125 I en Tyr). Precipitación y determinación de radioactividad en el sobrenadante. 6) Separación de fragmentos grandes después de proteólisis limitada. a) HPLC en fase reversa. b) SDS-PAGE. c) Filtración por gel. 7) Determinaciónes en fase sólida (proteinasa, o sustrato, o ambos, inmovilizados). a) Electroforesis en gel de poliacrilamida. Actividad determinada in situ después de la electroforesis. - Métodos histoquímicos: b-naftilamidas y Fast Garnet. - Proteína copolimerizada: Gelatina, fibrinógeno. Gel lavado para eliminar el SDS, incubado al ph adecuado, teñido con Coomassie Blue. Actividad detectada como zonas incoloras sobre fondo azul. b) Ensayos de ELISA Determinación de colagenasa. Ab anti-colágeno, revelado con Ab contra la IgG usada conteniendo un cromóforo adecuado.
14 2. SUSTRATOS SINTETICOS: Péptidos cromogénicos o fluorogénicos. a) Sustratos de endopeptidasas (sin amino ni carboxilo libres). Bz-L-Arg-NHNan, 400 nm. b) Sustratos de aminopeptidasas (sólo el carboxilo bloqueado). L-Arg-NHNan, 400 nm. c) Sustratos de carboxipeptidasas (sólo el amino bloqueado). {N-(3-[2-furyl]acryloyl)}-Ala-Lys (FA-Ala- Lys), 340 nm. Grupos bloqueantes del amino: Benzoil (Bz); Benzoiloxicarbonil (Z); O-Aminobenzoil (Abz); Acetil (Ac); Succinil (Suc); Furil-acriloil (FA).
15 Ensayos espectrofotométricos: a) 4-nitroanilidas (NH-Nan): Derivados N-acilados de la 4-nitroanilina. La A 400 nm difiere en aprox M -1 cm -1 entre las 4-nitroanilidas y la 4-nitroanilina a ph 8.0. Utilizables en determinaciones espectrofotométricas continuas. b) 2-naftilamidas (NH-Nap): La 2-naftilamina tiene su máximo de absorción a 340 nm, y difiere de las 2-naftilamidas en aprox M -1 cm -1. Esto depende del ph: por debajo de 5.5 no hay diferencia. Se puede aumentar la sensibilidad por diazotación de la naftilamina libre con N(1-naftil) etilendiamina diclorhidrato, o por reacción con una sal de diazonio estable, el Fast Garnet, que da un producto insoluble (requiere un detergente para mantenerse en solución). c) Amidas y ésteres: La hidrólisis de amidas puede seguirse a 230 nm, o siguiendo la liberación de aminoácidos con ninhidrina. Baja sensibilidad.
16 Ensayos fluorimétricos: a) 2-naftilamidas: 3 ordenes de magnitud más sensible que la diazotación. Sensible al ph. Excitación a 335 nm y emisión de 410 nm. b) 7-amino-4-metil cumarilamidas (NH-Mec): Fluoróforo libre, 500 a 700 veces más fluorescente que el conjugado. Excitación a 380 nm, emisión a 460 nm. c) Sustratos fluorogénicos apagados intramolecularmente ( quenching ): Abz-gly-Phe(NO 2 )-Pro (sustrato de ACE). La proteólisis libera Abz-Gly, fluorescente. Excitación a 310 nm, emisión a 410 nm.
17 ESPECIFICIDAD DE SUSTRATO Nomenclatura de Schechter y Berger (1967)
18 Determinación de la especificidad de sustrato
19
20 La tríada catalítica Serín Proteasas 20
21 Estructura de la quimotripsina (D. Blow, 1967)
22 Mecanismo de reacción 22
23
24 Uniones que intervienen en la estabilización del intermediario tetraédrico.
25 Especificidad de sustrato: el subsitio S1 25
26 Subtilisina: una proteasa bacteriana Sin relación evolutiva aparente con la familia de la quimotripsina/tripsina de mamíferos (sin semejanza en su estructura primaria o terciaria). Igual mecanismo catalítico que las serin proteasas de mamífero: una Ser catalítica asistida por una His y un Asp (tríada catalítica), en la misma orientación, y un agujero del oxianión para estabilizar intermediarios oxianión (estados de transición) Ejemplo de evolución convergente: evolución independiente de la misma estrategia catalítica. 26
27
28
29
30 Activación del tripsinógeno Varias proteasas digestivas son sintetizadas en el páncreas como proenzimas inactivas (zimógenos), de modo que no comiencen a atacar a las células que las producen. Estas proenzimas digestivas se almacenan en las células pancreáticas como gránulos secretorios, y se vierten en el duodeno por el conducto pancreático. El tripsinógeno es activado por clivaje proteolítico de la unión peptídica entre Lys 6 y la Ile 7. El oligopéptido con los primeros 6 residuos de aminoácidos se pierde y la Ile 7 pasa a ser el N-terminal. La carga positiva asociada con el N-terminal está ahora en una nueva posición y permite la correcta organización del sitio catalítico. La reaccción que activa al tripsinógeno es catalizada por la proteasa enteropeptidasa, que es una proteína de membrana expuesta sobre la superficie externa de las células de la mucosa que tapiza el duodeno. La enteropeptidasa es específica para la secuencia Lys-Ile presente en el tripsinógeno. La cantidad de enteropeptidasa presente es muy pequeña, y puede activar sólo una pequeña fracción del tripsinógeno total. 30
31 La tripsina es el activador común de las proenzimas pancreáticas K I R I 31
32 Inhibidores de emergencia El trauma a órganos internos que daña el páncreas puede causar pancreatitis, una condición dolorosa y muy peligrosa en la cual trazas de tripsina escapan y atacan células, activando sus granos de zimógeno almacenados. El resultado es una tendencia acelerada del páncreas para digerirse a sí mismo y a los órganos próximos. Para prevenir la activación prematura del tripsinógeno, el páncreas produce tambien pequeñas cantidades del inhibidor secretorio pancreático de la tripsina. Este es una proteína pequeña que expone una región similar a un sustrato, que es atacada por la tripsina. Sin embargo, el inhibidor está diseñado para unirse a la tripsina extremadamente fuerte (Ki=10 13 M),de modo que el producto de la reacción no se libera fácilmente y continúa ocupando el sitio catalítico. Hay inhibidor suficiente para controlar trazas de tripsina que pudieran desarrollarse accidentalmente, y es capaz de impedir que se gatille la activación del tripsinógeno remanente dentro del páncreas. Una vez que el tripsinógeno es secretado en el duodeno, la enteropeptidasa puede producir tripsina en cantidad suficiente para neutralizar las trazas de inhibidor, y la autoactivación puede tener lugar. 32
33 SERPINAS SERPINS: Serine proteinase inhibitors. Representan la familia de inhibidores más grande y funcionalmente más diversa (aprox secuencias de serpinas se han identificado en los 5 reinos, 36 genes en humanos, 60 en ratones). Proteínas en general monoméricas, MW kda. Incluyen proteínas como: α1-antitripsina, α1-antiquimotripsina, antitrombina III, cofactor II de la heparina, inhibidor de C1, α2-antiplasmina, inhibidores I y II del activador del plasminógeno, inhibidor de la proteína C, y proteasa nexina-1. Tienen una estructura secundaria conservada con un loop reactivo (RCL) que interacciona con el sitio activo de la proteasa inhibiéndola. 33
34 En muchos casos se forma un complejo tetraédrico con el inhibidor, que es clivado por la proteinasa y se forman complejos covalentes. Las serpinas clivadas tienen estructuras conformacionalmente mas estables que las nativas. El clivaje induce un cambio conformacional mayor, y los dos residuos que formaban la unión reactiva quedan en sitios opuestos de la molécula. 34
35
36 Serpinas asociadas con enfermedades en humanos La Alfa 1-antitripsina protege a los tejidos de las proteasas presentes principalmente en las células inflamatorias, en especial la elastasa. La deficiencia de alfa-1 antitripsina (trastorno hereditario) lleva a una degradación tisular durante la inflamación. Esto causa enfisema pulmonar y lleva a la cirrosis hepática en casos severos. La deficiencia de antitrombina es una enfermedad genética rara que generalmente sale a la luz cuando el paciente sufre trombosis venosas recurrentes y embolismo pulmonar 36
37
38 Ovomucoide: Inhibidor tipo Kazal
39 Inhibidores de serín peptidasas Diisopropil fluorofosfato (DIPF). Simula el estado de transición tetraédrico. Se combina con el residuo de serina en el sitio activo de la enzima acetilcolinesterasa, que desactiva al neurotransmisor acetilcolina. Si la enzima es inhibida, la acetilcolina se acumula y los impulsos nerviosos no pueden ser detenidos, causando contracción muscular prolongada. Esto produce parálisis que puede llevar a la muerte, dado que los músculos respiratorios están afectados. 39
40 Fenil-metil-sulfonil fluoruro 40
Proteasas. Bioquímica de Proteínas 2017
 Proteasas Bioquímica de Proteínas 2017 1 Reacción no catalizada La reacción no catalizada consiste en un ataque nucleofílico por el átomo de O del H2O sobre el carbono carbonílico del enlace peptídico
Proteasas Bioquímica de Proteínas 2017 1 Reacción no catalizada La reacción no catalizada consiste en un ataque nucleofílico por el átomo de O del H2O sobre el carbono carbonílico del enlace peptídico
PEPTIDASAS. Peptidasas: Hidrolizan la unión entre el carboxilo de un aminoácido y el α-amino del siguiente (unión peptídica) en una proteína.
 PEPTIDASAS Peptidasas: Hidrolizan la unión entre el carboxilo de un aminoácido y el α-amino del siguiente (unión peptídica) en una proteína. Pueden ser exopeptidasas, si hidrolizan a partir del extremo
PEPTIDASAS Peptidasas: Hidrolizan la unión entre el carboxilo de un aminoácido y el α-amino del siguiente (unión peptídica) en una proteína. Pueden ser exopeptidasas, si hidrolizan a partir del extremo
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS. Marijose Artolozaga Sustacha, MSc
 Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
Digestión y absorción de PROTEÍNAS Marijose Artolozaga Sustacha, MSc Digestión de proteínas de la dieta La mayor fuente de N de la dieta son las proteínas Unos 100g de proteína al día No se pueden absorber
METABOLISMO DE AMINOACIDOS
 METABOLISMO DE AMINOACIDOS BIOSÍNTESIS DE AMINOÁCIDOS El ion amonio se incorpora a los aminoácidos a través de glutamato y de glutamina El glutamato y la glutamina desempeñan un papel crucial en la la
METABOLISMO DE AMINOACIDOS BIOSÍNTESIS DE AMINOÁCIDOS El ion amonio se incorpora a los aminoácidos a través de glutamato y de glutamina El glutamato y la glutamina desempeñan un papel crucial en la la
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Proteínas Dr. Mynor A. Leiva Enríquez 1 PROTEÍNAS: Las proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Proteínas Dr. Mynor A. Leiva Enríquez 1 PROTEÍNAS: Las proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
Degradación de Proteínas
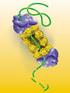 Degradación de Proteínas La degradación de las proteínas desempeña importantes funciones, ya sea por la modulación de los niveles intracelulares de proteínas específicas (proteólisis limitada), como por
Degradación de Proteínas La degradación de las proteínas desempeña importantes funciones, ya sea por la modulación de los niveles intracelulares de proteínas específicas (proteólisis limitada), como por
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Proteólisis Limitada MODIFICACIONES PROTEICAS POSTRADUCCIONALES. Procesamiento de POMC. Proteólisis limitada. Recambio proteico ENZIMAS PROTEOLÍTICAS
 Proteólisis Limitada Probablemente todas las proteínas maduras deben ser modificadas de esta manera, a todas debe removérsele su metionina líder (o fmet), después de que emergen del ribosoma Proteólisis
Proteólisis Limitada Probablemente todas las proteínas maduras deben ser modificadas de esta manera, a todas debe removérsele su metionina líder (o fmet), después de que emergen del ribosoma Proteólisis
PÉPTIDOS Y PROTEÍNAS
 PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO:
 LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos
LAS PROTEINASAS COMO UN PROBLEMA EN PURIFICACION DE PROTEÍNAS. SINTOMAS QUE SUGIEREN UN PROBLEMA PROTEOLITICO: 1) Ausencia de una proteína específica (por actividad o inmunorreactividad). 2) Bajos rendimientos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez 1 Las proteínas
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,012 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez 1 Las proteínas
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
introducción Propiedades que las diferencian de otros tipos de reordenamientos en proteínas:
 introducción En 1990 se descubre la primera inteína Propiedades que las diferencian de otros tipos de reordenamientos en proteínas: Secuencia característica de la inteína. Reacción autocatalítica en ausencia
introducción En 1990 se descubre la primera inteína Propiedades que las diferencian de otros tipos de reordenamientos en proteínas: Secuencia característica de la inteína. Reacción autocatalítica en ausencia
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,013
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,013 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,013 Proteínas Dr. Dr. Mynor A. A. Leiva Enríquez Las proteínas son
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
TEMA 7: ENZIMAS HIDROLÍTICAS. Estructura, sitios activos y mecanismos catalíticos de algunas enzimas hidrolíticas
 TEMA 7: ENZIMAS HIDROLÍTICAS Estructura, sitios activos y mecanismos catalíticos de algunas enzimas hidrolíticas Mecanismo general de catálisis en una proteasa Aminoácidos frecuentemente presentes en sitios
TEMA 7: ENZIMAS HIDROLÍTICAS Estructura, sitios activos y mecanismos catalíticos de algunas enzimas hidrolíticas Mecanismo general de catálisis en una proteasa Aminoácidos frecuentemente presentes en sitios
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Proteínas y su Papel Biológico
 Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
UNIVERSIDAD AUTÓNOMA DE CHIAPAS FACULTAD DE CIENCIAS QUÍMICAS EXTENSION OCOZOCOAUTLA DE ESPINOZA
 INTEGRANTES: ERIKA VANESSA MOLINA MURILLO KARLA AYDE SANCHEZ GUILLEN YATZENY GPE. RUIZ MOLINA TOMAS ALEJANDRO LOPEZ ESCOBAR OBET MAZA NAFATE UNIVERSIDAD AUTÓNOMA DE CHIAPAS FACULTAD DE CIENCIAS QUÍMICAS
INTEGRANTES: ERIKA VANESSA MOLINA MURILLO KARLA AYDE SANCHEZ GUILLEN YATZENY GPE. RUIZ MOLINA TOMAS ALEJANDRO LOPEZ ESCOBAR OBET MAZA NAFATE UNIVERSIDAD AUTÓNOMA DE CHIAPAS FACULTAD DE CIENCIAS QUÍMICAS
FUNCIONES DE LOS AA???
 1 Unidades básicas para Péptidos Proteínas Precursores de Oxoácidos Aminas biógenas Glucosa Nucleótidos Hemo, creatina FUNCIONES DE LOS AA??? Neurotransmisores Glutamato Aspartato Glicina Molécs. de transporte
1 Unidades básicas para Péptidos Proteínas Precursores de Oxoácidos Aminas biógenas Glucosa Nucleótidos Hemo, creatina FUNCIONES DE LOS AA??? Neurotransmisores Glutamato Aspartato Glicina Molécs. de transporte
Introducción I.1. Las proteasas y su clasificación
 I. Introducción I.1. Las proteasas y su clasificación Las enzimas proteolíticas o proteasas catalizan la hidrólisis de los enlaces peptídicos de las proteínas. Una de las características más importantes
I. Introducción I.1. Las proteasas y su clasificación Las enzimas proteolíticas o proteasas catalizan la hidrólisis de los enlaces peptídicos de las proteínas. Una de las características más importantes
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Métodos para Inmunidad Viral
 Métodos para Inmunidad Viral Radioinmunoensayo (RIA) Técnica muy sensible basada en la competencia de unión al anticuerpo específico entre el antígeno a cuantificar y cantidades conocidas del antígeno
Métodos para Inmunidad Viral Radioinmunoensayo (RIA) Técnica muy sensible basada en la competencia de unión al anticuerpo específico entre el antígeno a cuantificar y cantidades conocidas del antígeno
1. QUIMOTRIPSINA 2. PROTEASA DE VIH 3. HEXOKINASA 4. ENOLASA 5. LISOZIMA 6. TRANSPEPTIDASA
 TAREA PARA EL LUNES CONVERTIRSE EN EXPERTOS SECCIÓN 6.4 DEL LIBRO (FINAL DE 6.2) 1. QUIMOTRIPSINA 2. PROTEASA DE VIH 3. HEXOKINASA 4. ENOLASA 5. LISOZIMA 6. TRANSPEPTIDASA INHIBICIÓN http://upload.wikimedia.org/wikipedia/commons/4/42/cox-2_inhibited_by_aspirin.png
TAREA PARA EL LUNES CONVERTIRSE EN EXPERTOS SECCIÓN 6.4 DEL LIBRO (FINAL DE 6.2) 1. QUIMOTRIPSINA 2. PROTEASA DE VIH 3. HEXOKINASA 4. ENOLASA 5. LISOZIMA 6. TRANSPEPTIDASA INHIBICIÓN http://upload.wikimedia.org/wikipedia/commons/4/42/cox-2_inhibited_by_aspirin.png
6. Cuál de las siguientes afirmaciones es cierta con relación a la composición de aminoácidos de las proteínas?
 Péptidos y proteínas 1. Un octapéptido compuesto de cuatro unidades repetidas de glicilalanilo tiene: a) Dos grupos aminos libres y dos grupos carboxilos libres. b) Un solo grupo amino libre en el residuo
Péptidos y proteínas 1. Un octapéptido compuesto de cuatro unidades repetidas de glicilalanilo tiene: a) Dos grupos aminos libres y dos grupos carboxilos libres. b) Un solo grupo amino libre en el residuo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
Incorporación de nitrógeno. Prots. vegetales DIETA HUMANA. AA en intestino. AA en sangre. AA en células. Proteínas celulares
 Tema 25. Panorámica general del metabolismo de los aminoácidos. Panorámica general del metabolismo de los aminoácidos. Origen de los aminoácidos corporales. Aminoácidos esenciales. Enzimas proteolíticas
Tema 25. Panorámica general del metabolismo de los aminoácidos. Panorámica general del metabolismo de los aminoácidos. Origen de los aminoácidos corporales. Aminoácidos esenciales. Enzimas proteolíticas
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Bioquímica Estructural y Metabólica. Tema 2. Aminoácidos
 TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
PRÁCTICA 3A. AMINOÁCIDOS Y PÉPTIDOS. REACCIÓN DE PSEUDO SANGER/ IDENTIFICACIÓN DE AMINOÁCIDOS.
 PRÁCTICA 3A. AMINOÁCIDOS Y PÉPTIDOS. REACCIÓN DE PSEUDO SANGER/ IDENTIFICACIÓN DE AMINOÁCIDOS. Presentan: Cruz Rodríguez Meyli Joanna Garrido Santos Monserrat Yesenia 15. Marzo.2018 OBJETIVOS: Ejemplificar
PRÁCTICA 3A. AMINOÁCIDOS Y PÉPTIDOS. REACCIÓN DE PSEUDO SANGER/ IDENTIFICACIÓN DE AMINOÁCIDOS. Presentan: Cruz Rodríguez Meyli Joanna Garrido Santos Monserrat Yesenia 15. Marzo.2018 OBJETIVOS: Ejemplificar
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Problema 1.- Escriba la estructura de la (L)-leucina: a) A ph bajo. b) En el ph isoeléctrico. c) A ph alto. Solución: Zwitterión CH 3 H 3 C H O H 3 N
 Problema 1.- Escriba la estructura de la (L)-leucina: a) A ph bajo. b) En el ph isoeléctrico. c) A ph alto. CH 3 CH 3 CH 3 H 3 C H 3 N H H 3 C H 3 N H 3 C H 2 N ph bajo ph = 6 ph alto Zwitterión Problema
Problema 1.- Escriba la estructura de la (L)-leucina: a) A ph bajo. b) En el ph isoeléctrico. c) A ph alto. CH 3 CH 3 CH 3 H 3 C H 3 N H H 3 C H 3 N H 3 C H 2 N ph bajo ph = 6 ph alto Zwitterión Problema
Metabolismo de AA. Contenidos de tema:
 Metabolismo de AA Contenidos de tema: Las proteínas de la dieta común. Digestión de las proteínas. Enzimas proteolíticas. El pool de aminoácidos. Procesos que aportan y sustraen aminoácidos al pool. Aminoácidos
Metabolismo de AA Contenidos de tema: Las proteínas de la dieta común. Digestión de las proteínas. Enzimas proteolíticas. El pool de aminoácidos. Procesos que aportan y sustraen aminoácidos al pool. Aminoácidos
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS.
 Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
CURSO BIOQUÍMICA Y FITOQUÍMICA. FACULTAD DE CIENCIAS AGRARIAS Y FORESTALES UNLP. Primer cuatrimestre 2011 UNIDAD Nº 3
 CURSO BIOQUÍMICA Y FITOQUÍMICA. FACULTAD DE CIENCIAS AGRARIAS Y FORESTALES UNLP. Primer cuatrimestre 2011 UNIDAD Nº 3 FACTORES QUE INCIDEN EN LA ACTIVIDAD ENZIMÁTICA: PRESENCIA DE INHIBIDORES. Dentro de
CURSO BIOQUÍMICA Y FITOQUÍMICA. FACULTAD DE CIENCIAS AGRARIAS Y FORESTALES UNLP. Primer cuatrimestre 2011 UNIDAD Nº 3 FACTORES QUE INCIDEN EN LA ACTIVIDAD ENZIMÁTICA: PRESENCIA DE INHIBIDORES. Dentro de
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS.
 Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
DIGESTIÓN GÁSTRICA E INTESTINAL
 DIGESTIÓN GÁSTRICA E INTESTINAL Curso Anatomía y Fisiología Animal 2010 Ing. Agr. ugo Petrocelli Profesor Agregado Dpto. Producción Animal y Pasturas Fisiología y Reproducción Desarrollo Definición Donde
DIGESTIÓN GÁSTRICA E INTESTINAL Curso Anatomía y Fisiología Animal 2010 Ing. Agr. ugo Petrocelli Profesor Agregado Dpto. Producción Animal y Pasturas Fisiología y Reproducción Desarrollo Definición Donde
TEMA 16. La base química de la herencia: Genética molecular
 TEMA 16. La base química de la herencia: Genética molecular A.- Los ácidos nucleicos y su papel en la transmisión y expresión de la información genética. - Concepto molecular de gen B.- La replicación
TEMA 16. La base química de la herencia: Genética molecular A.- Los ácidos nucleicos y su papel en la transmisión y expresión de la información genética. - Concepto molecular de gen B.- La replicación
Enzimas de origen marino. Dr. José Luis Cárdenas López
 Enzimas de origen marino Dr. José Luis Cárdenas López Enzimas endógenas de importancia en los productos marinos Proteinasas digestivas Lipasas y fosfolipasas Enzimas que degradan el TMAO Polifenoloxidasa
Enzimas de origen marino Dr. José Luis Cárdenas López Enzimas endógenas de importancia en los productos marinos Proteinasas digestivas Lipasas y fosfolipasas Enzimas que degradan el TMAO Polifenoloxidasa
Metabolismo de los aminoácidos
 Metabolismo de los aminoácidos Introducción Aminoácidos Función más conocida: parte de las proteínas Precursores de neurotransmisores y hormonas Combustible à Gluconeogénesis Combustible à Cuerpos cetónicos
Metabolismo de los aminoácidos Introducción Aminoácidos Función más conocida: parte de las proteínas Precursores de neurotransmisores y hormonas Combustible à Gluconeogénesis Combustible à Cuerpos cetónicos
Fisiología del tubo digestivo. Metabolismo intermedio
 Fisiología de la Nutrición Fisiología del tubo digestivo Metabolismo intermedio Nutrición PROTEÍNAS AGUA LÍPIDOS CARBOHIDRATOS Á. NUCLEICOS VITAMINAS MINERALES Qué cosas entran y cuáles salen de la
Fisiología de la Nutrición Fisiología del tubo digestivo Metabolismo intermedio Nutrición PROTEÍNAS AGUA LÍPIDOS CARBOHIDRATOS Á. NUCLEICOS VITAMINAS MINERALES Qué cosas entran y cuáles salen de la
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
PROTEÍNAS. https://www.youtube.com/watch?v=ff4wchvlw9u
 PROTEÍNAS https://www.youtube.com/watch?v=ff4wchvlw9u QUÉ SON LAS PROTEÍNAS? Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno polímeros lineales construidos a partir de
PROTEÍNAS https://www.youtube.com/watch?v=ff4wchvlw9u QUÉ SON LAS PROTEÍNAS? Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno polímeros lineales construidos a partir de
ácidos orgánicos con un grupo amino en posición alfa
 AMINOÁIDOS ASPETOS GENERALES Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa. Según esta definición, los cuatro sustituyentes del carbono
AMINOÁIDOS ASPETOS GENERALES Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa. Según esta definición, los cuatro sustituyentes del carbono
Secuencia de Aminoácidos en las Proteínas. Tema 7 SECUENCIACIÓN PEPTÍDICA. Etapas para el conocimiento de una secuencia peptídica (I)
 Secuencia de Aminoácidos en las Proteínas Es característica para cada proteína Tema 7 SECUENCIACIÓN PEPTÍDICA Es codificada por una secuencia de nucleótidos del DNA Por lo tanto, es una forma de información
Secuencia de Aminoácidos en las Proteínas Es característica para cada proteína Tema 7 SECUENCIACIÓN PEPTÍDICA Es codificada por una secuencia de nucleótidos del DNA Por lo tanto, es una forma de información
FUNCIÓN DE LAS PR DE L O AS PR TE O ÍNAS
 FUNCIÓN DE LAS PROTEÍNAS PROTEÍNAS.- PUEDEN DESEMPEÑAR DIVERSAS FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos Reconocimiento específico d) Receptores en membranas e)
FUNCIÓN DE LAS PROTEÍNAS PROTEÍNAS.- PUEDEN DESEMPEÑAR DIVERSAS FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos Reconocimiento específico d) Receptores en membranas e)
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
de aas grupo hemo asociado Citocromo C (humano) grupo hemo unido covalentemente Albúmina (humana) 550 Apolipoproteína B (humana) 4536
 Proteínas. Formadas por una o más cadenas polipeptídicas de más de 100 aminoácidos. La estructura primaria de las proteínas es la secuencia de aminoácidos, que está codificada por los genes correspondientes;
Proteínas. Formadas por una o más cadenas polipeptídicas de más de 100 aminoácidos. La estructura primaria de las proteínas es la secuencia de aminoácidos, que está codificada por los genes correspondientes;
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Las proteínas. Dra. Nardy Diez García Investigadora
 Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
Cuantificación y análisis químico de proteínas
 Cuantificación y análisis químico de proteínas Enlace peptídico R 1 R 2 Secuencia: AlaGluGlyLys o AEGK Puentes disulfuro COO- COO- COO- NH 2 NH 2 NH 2 Modificaciones Post-traduccionales I Análisis químico
Cuantificación y análisis químico de proteínas Enlace peptídico R 1 R 2 Secuencia: AlaGluGlyLys o AEGK Puentes disulfuro COO- COO- COO- NH 2 NH 2 NH 2 Modificaciones Post-traduccionales I Análisis químico
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
ESTRUCTURA DE LA TRIOSAFOSFATO ISOMERASA esta proteína es una eficiente enzima involucrada en la vía glucolítica.
 ESTRUCTURA DE LA TRIOSAFOSFATO ISOMERASA esta proteína es una eficiente enzima involucrada en la vía glucolítica. Características generales Cinética química Nomenclatura Centro activo Cofactores Factores
ESTRUCTURA DE LA TRIOSAFOSFATO ISOMERASA esta proteína es una eficiente enzima involucrada en la vía glucolítica. Características generales Cinética química Nomenclatura Centro activo Cofactores Factores
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
IV electivo. Unidad 1: Integración célula organismo Genes, proteínas y enzimas
 IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
Introducción: definición, composición y estructura Clasificación de aminoácidos y proteínas. Funciones en el ser humano de aminoácidos y proteínas
 Nutrición y Dietética Dr. Alfredo Fernández Quintela Dpto. Farmacia y Ciencias de los Alimentos Universidad del País Vasco (UPV/EHU) Introducción: definición, composición y estructura Clasificación de
Nutrición y Dietética Dr. Alfredo Fernández Quintela Dpto. Farmacia y Ciencias de los Alimentos Universidad del País Vasco (UPV/EHU) Introducción: definición, composición y estructura Clasificación de
Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas.
 AMINÁCIDS Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas. Un aminoácido, posee dos grupos funcionales característicos
AMINÁCIDS Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas. Un aminoácido, posee dos grupos funcionales característicos
TEMA 7: ENZIMAS HIDROLÍTICAS. Estructura, sitios activos y mecanismos catalíticos de algunas enzimas hidrolíticas
 TEMA 7: ENZIMAS HIDRLÍTICAS Estructura, sitios activos y mecanismos catalíticos de algunas enzimas hidrolíticas Mecanismo general de catálisis en una proteasa Aminoácidos frecuentemente presentes en sitios
TEMA 7: ENZIMAS HIDRLÍTICAS Estructura, sitios activos y mecanismos catalíticos de algunas enzimas hidrolíticas Mecanismo general de catálisis en una proteasa Aminoácidos frecuentemente presentes en sitios
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
METABOLISMO DE LAS PROTEINAS
 METABOLISMO DE LAS PROTEINAS 1 DIGESTION DE LAS PROTEINAS: ETAPAS: Física Química Cocción y masticación Rompen estructura terciara y cuaternaria Digestión enzimática: Luminal Superficie Intracitosólica
METABOLISMO DE LAS PROTEINAS 1 DIGESTION DE LAS PROTEINAS: ETAPAS: Física Química Cocción y masticación Rompen estructura terciara y cuaternaria Digestión enzimática: Luminal Superficie Intracitosólica
ELISA y Western Blot
 Universidad Central de Venezuela Facultad de Medicina Escuela de Medicina José María Vargas Cátedra de Inmunología ELISA y Western Blot Práctica 1 2018 Prof. Edwin Escobar edscobar@gmail.com Aplicaciones
Universidad Central de Venezuela Facultad de Medicina Escuela de Medicina José María Vargas Cátedra de Inmunología ELISA y Western Blot Práctica 1 2018 Prof. Edwin Escobar edscobar@gmail.com Aplicaciones
11 Número de publicación: Int. Cl. 7 : C12N 15/12, C12N 15/ Agente: Tavira Montes-Jovellar, Antonio
 9 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA Número de publicación: 2 24 97 Int. Cl. 7 : C2N /2, C2N / C07K 4/8, C07K 6/38 A6K 3/70, A6K 38/7 A6K 48/00, G0N 33/68 C07H 2/04 2 TRADUCCIÓN DE PATENTE EUROPEA
9 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA Número de publicación: 2 24 97 Int. Cl. 7 : C2N /2, C2N / C07K 4/8, C07K 6/38 A6K 3/70, A6K 38/7 A6K 48/00, G0N 33/68 C07H 2/04 2 TRADUCCIÓN DE PATENTE EUROPEA
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI QUÍMICA BIOLÓGICA
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 QUÍMICA BIOLÓGICA Docente a cargo: Dra. Laura Matković CEBI_A1_1 : Proteínas QUÍMICA BIOLÓGICA La Química
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 QUÍMICA BIOLÓGICA Docente a cargo: Dra. Laura Matković CEBI_A1_1 : Proteínas QUÍMICA BIOLÓGICA La Química
Modificaciones post-traduccionales
 Facultad de Química, UNAM 1630 Genética y Biología Molecular Modificaciones post-traduccionales Modificaciones post-traduccionales No siempre un polipéptido recién sintetizado es una proteína funcional.
Facultad de Química, UNAM 1630 Genética y Biología Molecular Modificaciones post-traduccionales Modificaciones post-traduccionales No siempre un polipéptido recién sintetizado es una proteína funcional.
1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina.
 1521 Química rgánica III TAEA 2 1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina. 2. Cómo prepararías los siguientes aminoácidos empleando
1521 Química rgánica III TAEA 2 1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina. 2. Cómo prepararías los siguientes aminoácidos empleando
Modificaciones de Proteínas
 Modificaciones de Proteínas Bibliografía: M. en C. Elva Carolina Chávez Hernández Alberts Molecular Biology of the Cell. 4a Ed disponible online. (2002, 2008). Lehninger Principles of Biochemistry 4ª,
Modificaciones de Proteínas Bibliografía: M. en C. Elva Carolina Chávez Hernández Alberts Molecular Biology of the Cell. 4a Ed disponible online. (2002, 2008). Lehninger Principles of Biochemistry 4ª,
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO
 FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2006 Ximena Páez TEMA 9 I. DIGESTIÓN PEPSINA DIGESTIÓN II. D. CARBOHIDRATOS III. D. PROTEÍNAS IV. D. GRASAS V. D. ÁCIDOS NUCLÉICOS corta polímeros en
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2006 Ximena Páez TEMA 9 I. DIGESTIÓN PEPSINA DIGESTIÓN II. D. CARBOHIDRATOS III. D. PROTEÍNAS IV. D. GRASAS V. D. ÁCIDOS NUCLÉICOS corta polímeros en
Proteínas como blancos farmacológicos. Dra. Jenny Fiedler.
 Proteínas como blancos farmacológicos. Enzimas Dra. Jenny Fiedler. Estructura de proteínas Estructura primaria Secuencia de aminoácidos en una proteína 1 2 3 4 5 126 127 128 129 Lys-Val-Phe-Gly-Arg...Gly-Cys-Arg-Leu
Proteínas como blancos farmacológicos. Enzimas Dra. Jenny Fiedler. Estructura de proteínas Estructura primaria Secuencia de aminoácidos en una proteína 1 2 3 4 5 126 127 128 129 Lys-Val-Phe-Gly-Arg...Gly-Cys-Arg-Leu
Tema 11: Proteínas. Estructura primaria. Síntesis de péptidos
 Tema 11: Proteínas. Estructura primaria. Síntesis de péptidos 1 idrólisis química total y análisis cuali-cuantitativo de aminoácidos 2 Determinación de grupos terminales 3 Reducción u oxidación de puentes
Tema 11: Proteínas. Estructura primaria. Síntesis de péptidos 1 idrólisis química total y análisis cuali-cuantitativo de aminoácidos 2 Determinación de grupos terminales 3 Reducción u oxidación de puentes
Actividad Nº 10 AMINOÁCIDOS Y PROTEÍNAS
 Actividad Nº 10 FCAyF - UNLP QUÍMICA ORGÁNICA AMINOÁCIDOS Y PROTEÍNAS Bibliografía para la Actividad: Autino, J.C.; Romanelli, G.P.; Ruiz, D.M. Introducción a la Química Orgánica, Edulp, 2013. Capítulo
Actividad Nº 10 FCAyF - UNLP QUÍMICA ORGÁNICA AMINOÁCIDOS Y PROTEÍNAS Bibliografía para la Actividad: Autino, J.C.; Romanelli, G.P.; Ruiz, D.M. Introducción a la Química Orgánica, Edulp, 2013. Capítulo
Formación del enlace peptídico por condensación de dos aminoácidos. Amida
 PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, UNIDAD DIDÁCTICA: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 DIGESTIÓN
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, UNIDAD DIDÁCTICA: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 DIGESTIÓN Dr. Mynor A. Leiva Enríquez DIGESTIÓN a) Digestión
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, UNIDAD DIDÁCTICA: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 DIGESTIÓN Dr. Mynor A. Leiva Enríquez DIGESTIÓN a) Digestión
TEMA PROTEINAS.
 TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
