ESTRUCTURA Y FUNCIÓN DE AMINOÁCIDOS Y PROTEÍNAS
|
|
|
- Felipe Crespo Fuentes
- hace 7 años
- Vistas:
Transcripción
1 ESTRUCTURA Y FUNCIÓN DE AMINOÁCIDOS Y PROTEÍNAS 3.1. AMINOÁCIDOS COMO CONSTITUYENTES DE LAS PROTEÍNAS Las células vivas producen gran variedad de macromoléculas como son las proteínas, ácidos nucleicos y polisacáridos, entre otros. Estas macromoléculas son biopolímeros constituidos por unidades monoméricas o estructurales. Para los ácidos nucleicos, las unidades estructurales son los nucleótidos; para los polisacáridos son los monosacáridos. En virtud de que las proteínas desempeñan una amplia variedad de funciones esenciales en los organismos, las cuales describiremos más adelante, es evidente que para conocer tanto el funcionamiento normal como patológico de un organismo se requiere un conocimiento claro de la estructura y propiedades de las proteínas. Aunque muchas proteínas contienen otras sustancias, además de los aminoácidos, la estructura y muchas de sus propiedades biológicas están determinadas por las clases de aminoácidos presentes y el orden en el que están dispuestos en la cadena polipeptídica. Es asombroso que en una célula existan millares de proteínas con estructura y función diferentes, pero resulta aún más sorprendente que todas ellas estén integradas por sólo 20 aminoácidos comunes. Los aminoácidos comunes son aquéllos para los que existe un codón específico en el código genético del DNA (ver el capítulo Ácidos nucleicos). Los aminoácidos derivados son generados después de su incorporación a la molécula proteínica. Además de ser las unidades estructurales de las proteínas, los aminoácidos tienen otras funciones importantes como la transmisión de impulsos en el sistema nervioso, como material energético, y otros Estructura general Desde el descubrimiento del primer aminoácido, asparagina, en 1806, habrían de pasar más de 130 años para que le llegara el turno a la treonina, con la que se cerró la lista de los 20 aminoácidos. Un aminoácido es un compuesto que contiene dos grupos funcionales: un grupo amino y uno carboxüo. Ambos grupos están unidos al mismo átomo de carbono, designado carbono a. Al carbono a de cada aminoácido también está unido un átomo de hidrógeno y
2 del espárrago, alanina de alantoides) o de alguna propiedad característica (glicina por su sabor dulce). De la denominación trivial ha surgido una abreviatura de tres letras que, dadas las técnicas modernas de secuenciación, han obligado la anotación de los aminoácidos por una sola letra mayúscula (tabla 3.1.). Los aminoácidos presentes en las proteínas pueden clasificarse en dos grandes grupos dependiendo de la polaridad relativa de sus grupos R (tabla 3.2). Tabla 3.2. Clasificación de los L-a-aminoácidos presentes en las proteínas con base a las polaridades relativas de sus grupos R. Un grupo no polar es aquel que tiene poca o ninguna diferencia de carga de una región a otra, en tanto que un grupo polar tiene una diferencia de carga relativamente grande en diferentes regiones Aminoácidos con grupo R no polar Los aminoácidos más hidrofóbicos (no polares) son la fenilalanina, leucina, isoleucina, valina, alanina, metionina y triptofano.
3 La mayoría de las cadenas laterales de los ca, lejos del agua de solvatación de la superaminoácidos más hidrofóbicos están orien- ficie. tadas hacia el interior de la molécula protei-
4 En la prolina el grupo R es único ya que incorpora el grupo amino en la cadena lateral. Realmente la prolina es un iminoácido que tiene consecuencias estructurales importantes para las proteínas como veremos más adelante. La glicina, el más pequeño de los aminoácidos, puede encajar en regiones de la estructura tridimensional de las proteínas inaccesibles para otros aminoácidos Aminoácidos con grupo R polar sin carga A este grupo pertenecen aminoácidos cuya cadena lateral tiene naturaleza polar (hidrofi'licá) como son la serina, treonina, cisteína, asparagina, glutamina y tirosina Aminoácidos con grupo R polar con carga negativa En esta categoría se encuentran los ácidos aspártico y glutámico Aminoácidos con grupo R polar con carga positiva Los aminoácidos que pertenecen a este grupo son la lisina, arginina e histidina. Las cadenas laterales de los aminoácidos polares sin carga se encuentran en proporciones significativas tanto en el interior como en la interfase de la proteína con el disolvente. Por el contrario, los aminoácidos polares glutamina y asparagina y los que tie-
5 nen grupos cargados a ph 7.0 como Usina, arginina, histidina, glutamato y aspartato se hallan predominantemente en la superficie de las proteínas globulares donde la carga se encuentra estabilizada por el disolvente acuoso. La colocación poco usual de una cadena lateral cargada en el interior de una proteína globular se correlaciona con un papel estructural o funcional esencial. Los grupos R con carga de los aminoácidos básicos y acídicos, tienen un papel clave en la estabilización de la conformación proteínica a través de enlaces salinos. Además, funcionan en sistemas enzimáticos que requieren de transmisión de cargas. Ya se ha mencionado el lugar importante de la histidina en la catálisis enzimática en virtud de la carga de su grupo imidazol que le permite funcionar, a ph 7.0, como base o como ácido catalítico Ejemplos de importancia La omitiría funciona como intermediario en el metabolismo de la treonina, aspartato y metionina; junto con la citrulina, es un intermediario en la biosíntesis de la urea Aminoácidos no proteínicos Existen aminoácidos que no forman parte de las proteínas pero que realizan importantes funciones en el metabolismo intermediario, o bien, como hormonas, neurotransmisores y otras. La DOPA (dihidroxifenilalanina) es un aminoácido neurotransmisor, precursor de la melanina y se encuentra en la vía metabólica biosintética de las aminas neurotransmisoras: dopamina, adrenalina y noradrenalina.
6 molécula de agua y formando un tipo de enlace amida conocido como enlace peptídico (fig-3.8) Formación El enlace peptídico posee una serie de interesantes características estructurales. Dada la resonancia del grupo carbonilo (-C-), el II o El ácido gama-aminobutírico (GABA) es un neurotransmisor derivado del glutamato. enlace peptídico tiene naturaleza de doble enlace parcial. H 2 N-CH 2 -CH 2 -CH 2 -COOH GABA 3.2. ENLACE PEPTÍDICO La reacción más importante de los aminoácidos es el enlace peptídico. Este enlace determina la fuerza de unión primaria de una proteína; su estructuración corresponde a una polimerización de aminoácidos, es decir, una proteína es un polipéptido complejo Definición El grupo a -carboxilo de un aminoácido (RO puede unirse covalentemente al grupo a amino de otro aminoácido (R 2 ) eliminando una Estructura del etano Si recordamos la estructura del etano (un enlace C-C) y del etileno (doble enlace C=C) veremos que en el primer caso, los átomos de carbono del etano giran libremente teniendo como eje el enlace sencillo; en cambio, el doble enlace del etileno representa una estructura rígida que impide la libre rotación.
7 3.2.4 Estructura coplanar El enlace peptídico con la característica de ser un doble enlace parcial, determina una estructura rígida entre carbono y nitrógeno y por lo tanto es un enlace coplanar. En un polipéptido, los carbonos a de aminoácidos cercanos están en situación trans respecto al enlace peptídico. 33. PÉPTIDOS Definición Rotación del enlace Así como en el enlace peptídico no puede haber rotación, sí puede haberla en torno a los enlaces C-N y C-C determinando ángulos de conformación (y y <fr) que, en las proteínas naturales, presentan poca variabilidad en sus valores. Esto trae como consecuencia que, en un péptido, los enlaces peptídicos presentan una alternancia que determina una secuencia en zig-zag (fig. 3.10). Cuando los grupos amino y carboxilo de los aminoácidos se combinan para formar un polipéptido. Los aminoácidos constituyentes se denominan residuos de aminoácidos. Un péptido consta de dos o más residuos de aminoácidos unidos por enlaces peptídicos. En la figura 3.10 se muestra un tripéptido en el que hay que hacer notar que es aquel formado con tres residuos, no con tres enlaces peptídicos Clasificación Por convención, las estructuras peptídicas se describen a partir del residuo amino terminal (grupo-nh 2 libre), que se coloca a la izquierda, y termina con el residuo carboxilo
8 terminal (grupo -COOH libre) que se coloca a la derecha. La repetición de este proceso secuencial genera un polipéptido con una secuencia de aminoácidos específica (R r R2-R3-R4... Rp). Aunque existen discrepancias en la literatura, el término oligopéptido se reserva para moléculas con 2 a 20 residuos, polipéptido de 20 a 50 residuos y proteína a las que superan esta cifra Representación de estructuras Las estructuras polipeptídicas pueden representarse colocando el aminoácido inicial (el del extremo amino terminal) y a partir de éste colocar en zig-zag los residuos en el orden secuencial correspondiente (fig. 3.11). Como los polipétidos pueden contener un número de residuos muy elevado, es poco práctico usar las fórmulas estructurales convencionales. En cambio, puede utilizarse la abreviatura de tres letras (o incluso de una sola) para designar el péptido. En nuestro ejemplo (fig. 3.11) se podría escribir: Ala - Ser - Gli - Tre, o bien, A-S-G-T Péptidos de importancia biológica En todos los seres vivos se han aislado péptidos de interés biológico. Uno de los más sencillos es el tripéptido glutatión (y-glutamil-cisteinil-glicina), en el cual el glutamo inicial está unido a la cisteína por medio del carboxilo gama (y) en lugar del alfa ( a ), como ocurre con la gran mayoría de los péptidos. Este tripéptido lleva a cabo funciones oxidorreductoras por su grupo sulfhídrilo (-SH), se requiere para la actividad de varias enzimas y participa en el transporte de aminoácidos. Un grupo importante es el de los péptidos cerebrales con actividad de neurotransmisores, como la sustancia P (decapéptido) o los analgésicos opiáceos como las endorfinas y encefalinas. Tir-Gli-Gli-Fen-Met Encefalina (Metionina) Arg-Pro-Lis-Pro-Gln-Fen- Fen-Gli-Leu-Met Sustancia P. La oxitocina y vasopresina son polipétidos cíclicos. Los antibióticos polipeptídicos a menudo contienen D y L-aminoácidos y otros no presentes en proteínas, por ejemplo, la tirocidina y gramicidina S, que contienen D-fenilalanina y ornitina. Estos polipétidos no son sintetizados en los ribosomas.
9 Otros polipéptidos importantes son las hormonas colecistocinina y gastrina, la insulina y glucagón, la hormona liberadora de tirotropina y otras PROTEÍNAS Definición Las proteínas constituyen sin duda uno de los grupos de moléculas de gran trascendencia en los seres vivos. Todas las proteínas son polipéptidos de peso molecular elevado. Arbitrariamente, como se ha señalado antes, se ha establecido como línea divisoria entre polipétidos y proteínas un peso molecular de 8,000 y 10,000. Una proteína simple es aquélla que contiene sólo aminoácidos; una proteína compleja contiene, además, otras moléculas diferentes como el hemo (de la hemoglobina), vitaminas, lípidos, carbohidratos o elementos minerales (metaloenzimas). el caso de los receptores hormonales situados en la membrana celular o en el citosol. Dentro de las proteínas estructurales se encuentran el colágeno, la elastina y la queratina. Así pues, las proteínas son quizá las macromoléculas más versátiles, que se responsabilizan en gran parte de las funciones metabólicas y de la morfología de los seres vivos. No en vano el término proteína deriva del griego proteos que significa "primero", "primoridat Clasificación En la actualidad no existe un sistema de clasificación de las proteínas universalmente aceptado. Durante mucho tiempo se dividieron en simples y conjugadas. Sin embargo, en todas las proteínas, aun las más simples, casi siempre están asociadas otras moléculas llamadas grupo prostético. En esto se basa la clasificación propuesta en la tabla Importancia biomédica Las proteínas desempeñan una amplia variedad de funciones que pueden agruparse en dos clases: dinámicas y estructurales. De las funciones dinámicas, la más importante es la función catalítica. De hecho, la mayor parte de las reacciones químicas celulares son catalizadas por enzimas, casi todas ellas de naturaleza proteica. En realidad, estas moléculas son tan importantes que merecen un capítulo especial dentro de la bioquímica. Otra función dinámica de las proteínas es el transporte, ejemplos de este grupo son la hemoglobina y mioglobina. Otras proteínas actúan como hormonas. Las proteínas también pueden funcionar con un papel protector como las inmunoglobulinas y el interferón. Algunas participan en los mecanismos contráctiles como la miosina y actina. Otras tienen una función de reconocimiento, como es Basada en su solubilidad Un sistema de clasificación basado en la solubilidad todavía está en uso, en particular en bioquímica clínica (tabla 3.4.). Sin embargo en esta clasificación, no se puede hacer una distinción entre albúminas y globulinas únicamente en base a sus solubilidades en agua o en soluciones salinas. Así, se subdividieron en seudoglobulinas (solubles al agua) y euglobulinas (insolubles en agua exenta de sales) Basada en la forma Otra clasificación se basa en la forma (relación entre longitud y amplitud) y en ésta se consideran Xas proteínas globulares, de forma esférica, solubles en agua, dentro de las cuales se encuentran la insulina, albúmina y
10 Albúminas Solubles en agua y en soluciones salinas. Sin aminoácidos distintivos Globulinas Escasamente solubles en agua pero solubles en soluciones salinas. Sin aminoácidos distintivos Protaminas Solubles en etanol a 70-80% pero insolubles en agua y en alcohol etilíco absoluto. Ricas en arginina Histonas Solubles en soluciones salinas Escleroproteínas Insolubles en agua o en soluciones salinas. Ricas en glicina, alanina y prolina globulinas plasmáticas y numerosas enzimas. Las proteínas fibrosas, son de forma alargada, baja solubilidad en agua, resistentes a la tracción, dentro de las cuales tenemos la queratina, miosina, colágeno y fibrina Basada en sus funciones Las proteínas se pueden clasificar de acuerdo a sus funciones en proteínas estructurales, catalíticas (enzimas), reguladoras, protectoras (inmunoglobulinas), de transporte, etc. (tabla 3.5) Importancia biológica de las proteínas, Genes y proteínas. Diversidad Hemos mencionado el papel tan relevante y versátil de las proteínas con sus múltiples funciones. La diversidad de formas y funciones proteicas que existen en una sola célula, formadas a partir de 20 aminoácidos, nos indica que tal variabilidad depende de la combinación casi infinita de aminoácidos en cada una de las proteínas existentes en un ser vivo. Qué determina tal variabilidad? En los siguientes subcapítulos hablaremos de los niveles de organización de la es-
11
12 una cadena lateral, designada R que es diferente para cada uno de los 20 aminoácidos comunes excepto para la glicina (fig. 3.1) Propiedades generales Asimetría. Estereoisomería Con excepción de la glicina, para la cual R-H, los cuatro grupos unidos al carbono a de los aminoácidos son diferentes. Esta orientación tetraédrica con cuatro grupos diferentes alrededor del carbono a confiere actividad óptica (capacidad de rotar el plano de luz polarizada) a los aminoácidos. En la configuración absoluta, utilizando la proyección de Fisher, el COOH está dirigido hacia arriba y atrás del plano de la página, el grupo R de la cadena lateral se dirige hacia abajo y atrás del mismo plano, el grupo H y el grupo -NH2» en e l carbono a están dirigidos hacia el lector, si por convención el grupo examino está proyectado hacia la izquierda, el aminoácido tiene la configuración absoluta. Su enantiómero óptico, con el grupo a-amino hacia la derecha tiene la configuración absoluta denominada D, como en el D-gliceraldehído (fig. 3.2). En las proteínas de mamífero sólo se encuentran L-a-aminoácidos. La dificultad surgida de intentar denominar familias de isómeros ópticos con dos o más centros asimétricos ha dado lugar al establecimiento de un método más general de desig nación estereoquímica, el sistema RS, donde los grupos unidos a un orden basado en el número atómico: SH>OH>NH 2 >CDOH>CH3>H. En todos los casos el grupo H se encuentra debajo del plano. Si los otros tres grupos se ordenan de mayor a menor prioridad en el sentido de las manecillas del reloj, el centro asimétrico es R (RECTUS en latín) y S (sinisterenel opuesto) (ver fig. 3.3.). Dado que los aminoácidos de las proteínas son asimétricos, las proteínas también tienen propiedades asimétricas Formas iónicas de los aminoácidos Los grupos amino y carboxilo de un aminoácido pueden ionizarse. El pk del grupo amino es 9.8 y el del grupo carboxilo es 2.1. Por tanto, dentro de los límites fisiológicos del ph, ambos grupos están cargados (fig. 3.4), constituyendo un ion dipolar o switterion (en alemán, ion híbrido). Cabe aclarar que la estructura sin carga de un aminoácido indicada en la fig. 3.1 no puede existir a ningún ph, pero es posible usarlo por conveniencia, al describir la química de los aminoácidos. Los aminoácidos tienen carácter anfótero, por comportarse como ácidos o bases debido a sus grupos ionizables. En los aminoácidos neutros, que existen como ion dipolar, es decir, aquella forma en la que la carga positiva es igual a la carga negativa (carga neta
13 tructura proteica. El primer nivel, o estructura primaria, se refiere al orden de los aminoácidos en la cadena polipeptídica. Es decir, cada proteína posee un ordenamiento o secuencia de aminoácidos bien definido pero... qué determina ese ordenamiento? Aquí debemos detenernos y, quizá adelantando un poco, hablar de ese factor particular en cada célula u organismo que determina ese ordenamiento y, por ende, la gran diversidad de estructuras y funciones proteicas. Ese elemento dictador de la secuencia polipeptídica es la unidad transmisora de los caracteres hereditarios, el gene o gen; bioquímicamente, el DNA. La información genética contenida en cada célula o individuo se expresa a través de una proteína, muy frecuentemente de una enzima. En este sentido, las proteínas vienen a ser las ejecutoras de las ordenes dictadas por los genes. Sobre esto se tratará más ampliamente en el capítulo de ácidos nucleicos. La estructura primaria, ya familiar desdé la descripción de los péptidos, se refiere al orden de los aminoácidos en la cadena polipeptídica. La fuerza estabilizadora de esta estructura es el enlace covalente (peptídico). En esta estructura se incluye, además de la secuencia de aminoácidos, la localización de los puentes disulfuro (cistina). La determinación de la estructura primaria de una proteína es actualmente una técnica accesible a la mayor parte de los laboratorios de bioquímica. Esto ha sido posible gracias a los esfuerzos de Sanger, quien en 1953 fue el primero en estudiar y determinar la estructura primaria de una proteína, la insulina. Ahora se conoce la secuencia completa de más de 2,000 proteínas, gracias a los métodos automáticos en el análisis de aminoácidos introducidos por Moore y Stein en El analizador automático de aminoácidos (secuenciador) está cediendo lugar actualmente a sistemas basados en métodos cromatográficos de alta eficacia, que utilizan la técnica de degradación de Edman, y los métodos secuenciales del gen que codifica a la proteína en estudio. La importancia de la estructura primaria es tal que una variación en un solo aminoácido de una cadena polipeptídica puede determinar una falta letal en la proteína completa. El ejemplo clásico es el de la hemoglobina S (HbS) que tiene la sexta posición de la cadena P ocupada por valina en lugar de glutámico como la hemoglobina normal (HbAí). Los individuos que tienen este defecto padecen anemia de células falciformes, con una elevada hemolisis y obstrucción de capilares por los eritrocitos anormales Niveles estructurales de una proteína* Estructura primaria Estructura secundaria Si una proteína estuviera constituida por sólo una disposición polipeptídica lineal, su única conformación posible, fuera la fibrosa. Sin embargo, en virtud de la estructura coplanar del enlace peptídico y los ángulos de rotación y vy que regularmente toman valores de 132 y 123 respectivamente, surge una estructura particularmente estable que es la a-hélice. En este tipo de estructura secundaria, la cadena polipeptídica se pliega adoptando una forma helicoidal con giro a la derecha que contiene 3.6 residuos de aminoácidos por vuelta. Esta estructura fue propuesta inicialmente por Pauling y Corey. La máxima estabilidad de la hélice está determinada por puentes de hidrógeno que se establecen entre el grupo carbonilo (C-0) de un enlace peptídico y el amino (N-H) presente cuatro residuos más adelante en la cadena (fig. 3.12).
14 Figura Representación de un polipéptido en conformación de a-hélice En la conformación de a-hélice las cadenas laterales R se proyectan en forma perpendicular al eje de la hélice y hacia el exterior de la estructura en espiral generada por la cadena peptídica. Si estos grupos R están próximos y tienen carga del mismo signo o están ramificados (valina, isoleucina), sus interacciones desestabilizan la estructura helicoidal. Otro factor que rompe la conformación a-helicoidal es la presencia de prolina, ya que el anillo pirrolidina de su cadena lateral interacciona estéricamente con la cadena lateral del aminoácido precedente y, además, porque no puede ocurrir rotación del enlace N-C. La presencia de prolina entre dos cadenas en a-hélice produce una acodadura de la dirección general de la molécula, lo cual es de gran importancia en la configuración general de una proteína. Otro aminoácido que tiende a desestabilizar la a-hélice es la glicina, por tener un grupo R muy pequeño. Pauling y Corey también propusieron otra estructura secundaria que es la estructura P (P porque fue una segunda estructura, siendo la a-hélice la primera). La conformación p está formada por dos o más cadenas polipep-
15 tídicas que pueden ser paralelas (en el mismo sentido) o antiparalelas (en direcciones opuestas) y se estabilizan también por puentes de hidrógeno (fig. 3.13). En tanto que la hélice es una cadena polipeptídica enrollada, la tira plegada p está extendida y se dispone a la manera de un acordeón con los grupos R proyectados por encima y por debajo de los planos generados por las cadenas polipeptídicas. La estabilidad es mayor en la conformación antiparalela, la más frecuente en las proteínas naturales, incluso más que la a-hélice. En general, estas estructuras laminares se dan en las proteínas fibrosas como la queratina del pelo y la piel, la fibroma de la seda; la sustancia amiloide que se deposita en condiciones patológicas, es un depósito de proteína en forma de tira plegada. Es común que en numerosas proteínas ocurran simultáneamente ambas estructuras, la a-hélice y la hoja plegada p, como se ilustra en la fig Finalmente, dentro de la estructura secundaria, pueden existir algunas regiones de las proteínas que no son a-hélice ni tira plegada, sino que son conformaciones enrolladas al azar. En términos de su función biológica, las regiones de enrollamiento aleatorio son de igual importancia que las de a-hélice o tira plegada. Existen razones sobradas para pensar que gran parte de las proteínas tienden a adoptar forma esférica, globular. Esto sólo puede ocurrir si suponemos que, además del plegamiento secundario, existe un superplegamiento de la proteína que da lugar a una estructura compacta. Es la que se conoce como estructura terciaria de las proteínas. Se trata de un arreglo tridimensional que forma diversos repliegues específicos. Los tipos de enlaces que estabilizan la estructura terciaria son: a) atracción electrostática de tipo salino entre un grupo carboxilato (-COO - ) y un grupo amino (-NH 3 + ) de residuos glutamato o aspartato con Usina o arginina; b) puentes de hidrógeno, entre grupos carboxilato, oxhidrilo (-OH) o los propios grupos carbonilo (-C=0) de las uniones peptídicas; c) interacción de cadenas polares, como los grupos aromáticos de la fenilalanina o los no aromáticos de alanina e isoleucina, etc; d) fuerzas de Van der Waals, cuando los residuos son idénticos como dos metilos de la alanina, hidroximetilos de la serina, etc; e) puentes disulfuro, que se establecen entre los grupos sulfhidrilo (-SH) de la cisteína para dar el enlace covalente disulfuro (-S-S-) entre cadenas vecinas (fig. 3.15). El resultado de las distintas uniones descritas es una estructura terciaria de gran estabilidad. El estudio de la estructura terciaria ha sido posible gracias a la cristalografía de rayos X desarrollada por la escuela de Bragg en Cambridge y a la labor pionera de Kendrew sobre la mioglobina y de Perutz sobre la hemoglobina. Las estructuras terciarias de las proteínas permiten agruparlas en familias y subfamilias; por ejemplo, proteínas fibrosas de forma alargada y proteínas globulares de forma esferoidal Estructura terciaria Estructura cuaternaria Cuando una proteína se compone de más de una cadena polipeptídica, se dice que posee estructura cuaternaria. Las proteínas que poseen este grado de organización estructurai se denominan oligoméricas y las cadenas polipeptídicas individuales que la integran se denominan monómeros, protómeros o subunidades. Cuando una proteína oligomérica contiene dos o cuatro monómeros o subunidades se denomina dímero o tetrámero, respectivamente. El mejor ejemplo estudiado es la hemoglobina que es una proteína tetramérica (fig. 3.16).
16 Figura Conformación p de una proteína con disposición paralela (a) antiparalela (b).
17 Figura Representación esquemática del plegamiento de la cadena principal de la ribonucleasa bovina. La región de a-hélice está encerrada en un óvalo y la región p está sombreada. Otras porciones constituyen un enrollamiento al azar. Figura Tipo de uniones que estabilizan el plegamiento de las proteínas. 1. interacción electrostática; 2 puentes de hidrógeno, entre treonina y serina; 3 interacción dipolo-dipolo entre dos serinas; 4 unión de disulfuro, convalente, entre dos cisternas, y 5. interacción hidrofóbica entre leucina e isoleucina.
18 Figura Estructura cuaternaria de ias proteínas. Esquema de la disposición de cuatro subunidades de una molécula de hemoglobina, formada por dos cadenas a en la parte inferior de la figura y dos cadenas p en la parte superior.
19 Los enlaces que mantienen la estructura cuaternaria son del mismo tipo que los que mantienen la estructura terciaria, excepto enlaces covalentes. Por ejemplo, la ot-quimotripsina contiene tres cadenas polipeptídicas unidas por enlaces disulfuro y no se considera estructura cuaternaria. La mioglobina está compuesta por una sola cadena polipeptídica y no posee estructura cuaternaria. Sin embargo, la hemoglobina contiene 4 subunidades unidas no covalentemente y, por tanto, tiene estructura cuaternaria. La enzima aspartato transcarbamilasa tiene una estructura cuaternaria formada por 12 subunidades. Otros ejemplos incluyen la sintetasa de ácidos grasos, la piruvato deshidrogenasa, a las cuales se les conoce como complejos multier>zimáticos o estructuras supramoleculares. La estructura cuaternaria está íntimamente ligada a las propiedades reguladoras de las proteínas, particularmente en los sistemas llamados alostéricos. En estos sistemas, la respuesta puede estar afectada por la presencia de efectores (inhibidores o activadores) que modulan la acción primaria de la proteína (ver capítulo de Enzimas). Las estructuras secundaria y terciaria de una proteína están determinadas por la estructura primaria. Por lo tanto, no es necesario postular un control genético independiente para los niveles de estructuración superiores al nivel primario, puesto que la estructura primaria determina la secundaria, terciaria y (cuando está presente) la cuaternaria RELACIÓN ENTRE ESTRUCTURA Y FUNCIÓN La actividad biológica de una proteína depende del ordenamiento tridimensional apropiado de sus grupos funcionales. De este modo, las proteínas sólo funcionan cuando están plegadas en su estructura original o conformación nativa. Debido a que las conformaciones nativas de la mayor parte de las proteínas están estabilizadas sólo por enlaces no covalentes, el plegamiento puede ser alterado por condiciones como alta temperatura, ph extremo o presencia de solventes orgánicos que debilitan las interacciones no covalentes L Desnaturalización La alteración de una proteína que modifique su conformación nativa se denomina desnaturalización; este cambio provoca la consiguiente alteración o desaparición de sus funciones. En una proteína se produce la desnaturalización al perder su estructura secundaria, terciaria y cuaternaria, conservándose la primaria (covalente). En el estado desnaturalizado los niveles de estructuración superior de la conformación nativa se encuentran al azar, es decir la proteína altamente ordenada queda reducida a un polimero estadístico formado por una cadena de aminoácidos (fig. 3.17). La existencia de enlaces disulfuro en una proteína aumenta su resistencia a la desnaturalización Agentes desnaturalizantes Todos aquellos agentes capaces de romper o alterar los enlaces que mantienen las estructuras de orden superior de una proteína pueden desnaturalizarla. Un agente desnaturalizante muy común es el calor, esto tiene aplicación cotidiana en el laboratorio de bioquímica. Otros agentes físicos (radiaciones, tensoactividad, altas presiones) o químicos (ácidos, álcalis, urea, detergentes) capaces de alterar las interacciones débiles pueden llegar a desnaturalizar las proteínas. En proteínas cuya estructura tridimensional está determinada por enlaces disulfuro, pueden ser desnaturalizadas por agentes reductores como el mercaptoetanol
20 o el ditiotreitol. En ocasiones esta alteración es reversible cuando se elimina el agente agresivo. En otros casos la desnaturalización es irreversible. Una consecuencia de la desnaturalización es la pérdida drástica de solubilidad. Otras alteraciones incluyen disminución de la viscosidad, velocidad de difusión y facilidad con que cristalizan. Siendo la conformación de la molécula proteínica la base principal de su función, al desnaturalizarse la proteína, se altera su actividad fisiológica. Por ejemplo, las globulinas plasmáticas desnaturalizadas pierden sus funciones de anticuerpos Complementarte dad y capacidad de reconocimiento Existen proteínas capaces de reconocer determinado tipo de moléculas que serán objeto de su actividad. Ese sitio de reconocimiento se debe a la presencia en la proteína de una estructura complementaria a la de la molécula (llámese sustrato, hormona, antígeno, efector, grupo prostético), que permite a la proteína (sea enzima, anticuerpo, receptor membranal) reconocer a la molécula en cuestión y asociarse con ella en forma específica. Para explicar el fenómeno de la especificidad, Emil Fisher propuso en 1894 una analogía similar a la que existe entre llave y cerradura. En las proteínas donde más se ha ejemplificado el fenómeno de la especificidad de reconocimiento molecular es entre las enzimas y su sustrato; de ellas nos ocuparemos más adelante. Otro ejemplo es el de la globina que se une específicamente a su grupo prostético, el grupo hemo, debido a que la proteína tiene un hueco molecular con la forma precisa para el hemo y dado que las cadenas laterales de los aminoácidos en contacto con el anillo son no polares. Clásico ejemplo de reconocimiento es la unión de sustancias llamadas antígenos con su anticuerpo específico. El anticuerpo es una molécula proteínica especial perteneciente al grupo de las inmunoglobulinas. Los receptores membranales de reconocimiento de las hormonas, que representan el primer sitio de acción hormonal, son también proteínas de reconocimiento. Como regla general, un sitio fijador (de reconocimiento) en una proteína se ajusta al
21 compuesto que se va a unir en forma, tamaño y polaridad Alosterismo En algunas enzimas y en la hemoglobina se encuentra, además del sitio activo (para el sustrato), otro sitio de reconocimiento para moléculas llamadas efectores alostéricos; la ocupación de este otro sitio determina una inhibición o una activación de la reacción, mecanismo conocido como alostérico. Un mecanismo alostérico es un proceso común en moléculas proteicas en el que la asociación del sustrato está influenciada por la fijación de otras moléculas que no son sustratos directos de la proteína. En un proceso alostérico debe haber en la proteína centros separados de fijación para el sustrato (por ejemplo, O2 en el caso de la hemoglobina) y el efector (inhibidor o activador) que ejerce el control alostérico MÉTODOS DE SEPARACIÓN Y ANÁLISIS Cromatografía Las experiencias en cromatografía se remontan a 1850, cuando Runge describió un método para el análisis de mezclas de colorantes, aplicando gotas de colorantes en papel y notando la separación en diferentes colores. Sin embargo, el crédito del descubrimiento de'la cromatografía se le dá al botánico Tswett, quien en 1906 efectuó la separación de mezclas de pigmentos vegetales en un tubo conteniendo material adsorbente sólido finamente dividido. La separación cromatográfica se basa en el coeficiente de partición líquido-líquido de los compuestos. La cromatografía en papel, como todas las técnicas simples, ha revolucionado la separación y detección de productos de reacción y la determinación e identificación de compuestos. Desarrollada en 1944 por Martin en Inglaterra, consiste en colocar en tiras de papel como soporte de una fase estacionaria acuosa mientras una fase móvil orgánica se desplaza en la tira, gotas de la sustancia a separar cerca del punto donde partirá el desplazamiento de la fase orgánica (fig. 3.18). La relación de la distancia recorrida por el compuesto entre la distancia que recorre el frente del solvente desde el sitio de aplicación se conoce como valor Rf (relación de frentes) del compuesto. Bajo condiciones estrictamente controladas el Rf es una constante importante para propósitos de identificación. El método descrito es cromatografía unidimensional. La cromatografía bidimensional es una variante de considerable poder de separación, ya que se emplean dos diferentes solventes aplicados secuencialmente para desplazar un solo compuesto (fig. 3.19). La gota del compuesto (generalmente un aminoácido o un péptido) se "revela" como una mancha en el papel. El material usado como revelador es usualmente la ninhidrina mencionada antes. La cromatografía en capa fina utiliza el mismo principio de la cromatografía en papel (cromatografía de adsorción); el soporte utilizado es sílica gel o celulosa colocadas en una hoja de vidrio o plástico en forma de capas muy finas. En este proceso, la separación cromatográfica es muy rápida (fig. 3.20). Las dos primeras técnicas descritas se utilizan generalmente para separar e identificar aminoácidos o péptidos pequeños. A continuación se describirán técnicas para la separación e identificación de proteínas. También utilizando una separación en columna, pero aprovechando las cargas residuales de las proteínas como carácter diferencial, se describe la cromatografía de
22 Figura 3.18 Cromatografía en papel. intercambio iónico. Las resinas de intercambio iónico para preparar la columna cromatográfica, se preparan a partir de materiales insolubles (agarosa, poliacrilamina, celulosa, etc.) que contienen ligandos cargados negativamente (R-CH3-COO--SO5) o ligandos cargados positivamente (dietilamino) unidos a la resina insoluole. Las resinas cargadas negativamente fijan cationes conociéndose como resinas de intercambio catiónico. Igualmente, las resinas cargadas positivamente fijan aniones y se denominan resinas de intercambio aniónico. El grado de retención o retardo de una proteína (o aminoácido) por una resina dependerá del número de cargas (positivas o negativas) de la proteína al ph del experimento (revisar pl de una proteína). Aquellas moléculas proteicas con la misma carga que la resina se eliminarán primero, seguidas por proteínas de carga opuesta, que por atracción de cargas, se retendrán más tiempo en la columna. Cuando es difícil eliminar una molécula fuertemente atraída por la resina, se utilizan cambios de ph o fuerza iónica para debilitar la interacción. Los derivados de celulosa como carboximetil celulosa (CMC) y dietilaminoetil celu-
23 cero), no se desplazan ni hacia el cátodo ni hacia el ánodo en un campo eléctrico. El punto isoeléctrico (pl) de un aminoácido se define como el ph en el cual no tiene carga eléctrica neta; en el caso de los aminoácidos con sólo un grupo amino y uno carboxilo corresponde a la siguiente ecuación: pl = ( P K 1+ pk 2 ) Si consideramos la curva de titulación de un aminoácido sencillo como la glicina, su equilibrio de ionización corresponde a: A ph de 1 la forma iónica predominante tiene una carga de +1 (forma catiónica) y se desplazará hacia el cátodo en un campo eléctrico. La adición de base hasta alcanzar la forma de zwitterión, corresponde al punto isoeléctrico (pl=5.97). La adición de base a la forma dipolar de la glicina, completa la titulación del grupo - NH 3, el ph de la solución es superior a 11.5 y la especie predominante tiene una carga formal de -1 (forma aniónica). Como puede verse en la fíg. 3.5, la glicina y otros aminoácidos con cadena lateral no ionizable y valores de pki próximos a 2.5 y de pk 2 próximos a 9.5, pueden actuar como amortiguadores en dos zonas de ph, donde ninguna les permite actuar como amortiguadores al ph fisiológico del plasma. Precisamente, el ph de 7.4 es un valor cercano al pl de dichos aminoácidos, y éste es el punto de menor solubilidad de aminoácidos y proteínas. Un caso más complejo lo constituyen los aminoácidos con un grupo ionizable en su cadena lateral. Tal es el caso del ácido glutámico y del aspártico que poseen un grupo
24 identificar se pasa a través de una columna empaquetada con pequeñas esferas de resina insoluble. Como en esta técnica la resina es- tá tan densamente empaquetada se requiere losa (DEAE) se han utilizado con éxito en la purificación de proteínas. En la cromatografía líquida de alta resolución, la mezcla de proteínas a separar e
25 de bombeo a elevada presión para forzar el paso de la proteína. En esta técnica la columna es metálica y no de vidrio como la cromatografía a presión normal. Las esferas de resina pueden cubrirse con grupos cargados, como en la cromatografía de intercambio iónico, o con residuos hidrofóbicos con lo que las moléculas no polares se retrasarán al paso por la resina. Las esferas pueden ser porosas y actuar con el mismo principio de la cromatografía de exclusión molecular, separando moléculas grandes de las pequeñas. La cromatografía de afinidad se basa en la alta afinidad que tienen las proteínas por sus sustratos, grupos prostéticos, receptores de membrana, inhibidores no covalentes específicos y anticuerpos específicos. Estos compuestos de alta afinidad se pueden unir en forma covalente a una resina insoluble y utilizarse para purificar una proteína mediante cromatografía en columna. La separación de proteínas de diferente tamaño haciéndolas pasar a través de una columna empaquetada con un gel poroso en forma de pequeñas esferas insoluoles se denomina filtración en gel o cromatografía de exclusión molecular. El polisacárido dextrana es tratado químicamente para que se formen enlaces cruzados que den un retículo o malla por la cual pueden pasar moléculas pequeñas. Esta sustancia queda como pequeñas esferas hidrofílicas, pero insolubles, que al colocarlas en agua se hinchan para formar un gel insoluble. El nombre comercial de este gel es sephadex. Las proteínas pequeñas pueden penetrar por los poros del gel, por lo que tendrán que desplazarse por espacios sinuosos y viajar más a través de la columna, que las proteínas grandes, las cuales, al no poder penetrar por el retículo del gel, son excluidas por motivos estéticos. En consecuencia, una mezcla de proteínas se separa en función del tamaño saliendo primero las proteínas más grandes y a continuación las más pequeñas, las cuales se retardan por tener que viajar por el retículo del gel (fig. 3.21) Filtración en gel Figura 3.21 Filtración en gel o cromatografía de exclusión molecular en columna El bioquímico tiene para elegir varios tipos de sephadex para preparar columnas. Así, el sephadex G-25 excluye compuestos de peso molecular de 3,500-4,500, sephadex G-50 para PM de 8-10,000 y sephadex G-75 para 40-50,000 de PM. Los geles de sephadex G-100 y G-200 se utilizan para separar proteínas de alto peso molecular Electroforesis El movimiento de una partícula cargada en un campo eléctrico externo, hacia el electrodo de carga opuesta se denomina electroforesis. La electroforesis de proteínas se ha llevado a cabo de acuerdo al principio desarrollado por el sueco Tiselius en Según esta técnica, se hace pasar durante un cierto tiempo, una corriente eléctrica a tra-
26 vés de un tubo en U (un electrodo en cada extremo) lleno con una proteína disuelta en un amortiguador con la misma fuerza iónica, ph y conductividad. Durante la electroforesis, las diferentes proteínas migran hacia el electrodo de carga opuesta. El grado de migración depende de las cargas de la proteínas, del P.M. y de la forma. El sitio donde se concentra la proteína en el tubo puede ser determinado por un proceso óptico. La luz refractada nos da un patrón de picos, cada pico representa la separación entre la molécula proteica y el amortiguador (fig. 3.22). El aparato de Tiselius se utilizó para determinar el punto isoeléctrico y la movilidad electroforética de las proteínas. Una modificación altamente simplificada de la técnica electroforética de Tiselius es la llamada eléctroforesis de zona. En ésta, la separación electroforética se realiza sobre un soporte inerte como papel, almidón, agar, acetato de celulosa y, el más reciente gel de poliacrilamida. La medida de la concentración de cada proteína separada se hace por revelado y lectura en un densitómetro. Variantes más desarrolladas de la eléctroforesis simple son la inmunoelectroforesis y el isoelectroenfoque. La primera combina la separación electroforética con la especificidad de las reacciones inmunológicas. Es especialmente útil para separar proteínas y otras sustancias antigénicas con carga, particularmente las proteínas plasmáticas (fig. 3.23). El isoelectroenfoque ofrece una resolución sumamente elevada. En esta técnica se utilizan mezclas de anfolitos formados por ácidos poliamino-policarboxílicos con un intervalo de pl definido para establecer un gradiente de ph a través del campo eléctrico aplicado. Una proteína cargada se desplazará a través del gradiente de ph en el campo eléctrico hasta que alcance una región de ph en el gradiente igual al valor de su pl. En este punto la proteína se mantiene estacionaria en el campo eléctrico y puede visualizarse o eliminarse de la columna (fig. 3.24) PROTEÍNAS DE IMPORTANCIA MÉDICA En esta sección, se estudiarán algunas proteínas con importantes funciones biomédicas. Se han escogido las proteínas de transporte, hemoglobina y mioglobina, proteínas protectoras como las inmunoglobulinas, las proteínas plasmáticas, proteínas estructurales como el colágeno y proteínas contráctiles como la tropomiosina, como ejemplo de proteínas cuya estructura y función es esencial estudiar para una correcta comprensión de sus procesos bioquímicos normales y de su mal funcionamiento en las enfermedades Hemoglobina y mioglobina- Las hemoglobinas son proteínas globulares, presentes en los glóbulos rojos, que fijan oxígeno en los pulmones y lo transportan por la sangre hacia los tejidos; al volver a los pulmones desde los capilares, actúan como transporte de CO2 y de iones hidrógeno. La hemoglobina (Hb) está formada por la proteína globina (una histona) y el grupo prostético hemo. La proteína globina desde el punto de vista de su estructura cuaternaria es un tetrámero, es decir, la constituyen 4 subunidades, cada una de ellas formada por cadenas polipeptídicas con dos estructuras primarias diferentes y cada subunidad con su grupo hemo. En la forma más común de hemoglobina humana adulta, HbAí, las dos subunidades de una clase se denominan cadenas a y los otros dos monómeros de la misma clase se designan como cadenas p. Así, la fórmula tetramérica de la HbAí es 0^2- La hemoglobina fetal (HbF) es 0,272» la hemoglobina de las células falciformes (HbS) es ct2 2 y la hemoglobina menor del adulto (HbA2) es a Se conoce la secuencia completa de aminoácidos de las cadenas a(141 aminoácidos) y de las cadenas p,yy 6
27
28
29 (146) aminoácidos). El PM de la hemoglobina, incluyendo el grupo hemo, es de aproximadamente 67,000. La hemoglobina fue la primera proteína analizada por difracción de rayos X, identificada como una molécula casi esférica con un diámetro de 5.5 nm (fig. 3.25). Su concentración en la sangre humana es de 16 g por 100 mi. La mioglobina (Mb) es una proteína que almacena 0 2 en el tejido muscular rojo. A diferencia de la hemoglobina, la mioglobina está compuesta por una sola cadena polipeptídica (monómero) y un solo centro de fijación de 0 2 (hemo). La cadena polipeptídica consta de 153 aminoácidos y tiene un PM de 17,000. El polipéptido P de la Hb es muy semejante a la mioglobina. Su distribución especial es el de una superficie polar y el interior no polar, patrón característico de las proteínas globulares. El grupo prostético hemo es una molécula de porfirina, un tetrapirrol cíclico, que contiene un átomo de hierro en su centro. El tipo de porfirina de la hemoglobina y la mioglobina corresponde a la protoporfirina IX con dos propionilos, dos vinilos y cuatro metilos como cadenas laterales unidos a los grupos pirrólicos (fig. 3.26). El átomo de hierro, tanto en la hemoglobina como en la mioglobina, se encuentra en estado ferroso (Fe 2 *). El quinto enlace de coordinación del átomo ferroso de los hemos es con el nitrógeno imidazólico de una histidina {histidina proximal de la apoproteína). En las cadenas polipeptídicas con 0 2 ligado, esta molécula
30 Figura 3.25 Estructura cuaternaria de la hemoglobina. forma un sexto enlace coordinado con el Fe 2+ y el segundo imidazol de una histidina distal de la globina. El hemo se sitúa dentro de un espacio hidrofóbico en cada una de las subunidades de globina. De esta manera, las 4 subunidades se disponen en un arreglo espacial tetraédrico preciso, con las cadenas en contacto con las P; los grupos hemo se localizan en la periferia. Cinética de oxigenación de hemoglobina y mioglobina La hemoglobina se combina con el oxígeno y se transforma en oxihemoglobina (Hb0 2 ); en realidad fija ocho átomos de oxígeno por tetrámero (dos por cada subunidad). Esta combinación se lleva a cabo sin alterar la valencia del hierro que sigue como ferroso, es
31 decir, no es una oxidación sino una oxigenación. Cuando la hemoglobina se oxida químicamente, el hierro pasa de ferroso a férrico (Fe 2+ Fe 3+ ) y se denomina metahemoglobina (MHb); en estas condiciones no transporta oxígeno. Normalmente se forma menos del 1 % de MHb, pero puede producirse un exceso si se ingieren sulfonamidas, nitritos, fenacetina u otros oxidantes. La curva de saturación de oxígeno con hemoglobina es sigmoidea. Esto se debe a que una vez fijado el primer átomo de 0 2 facilita la unión del siguiente. Así, la hemoglobina muestra una cinética cooperativa de fijación. En cambio, la mioglobina muestra una curva de saturación de oxígeno de tipo hiperbólica (fig. 3.27), lo que indica que la mioglobina tiene mayor afinidad por el 0 2 que la hemoglobina y es una molécula inadecuada como transportadora de 0 2 pero eficaz para almacenarlo. Bajo condiciones de escasez de oxígeno (como en el ejercicio intenso), la p0 2 del tejido muscular puede disminuir hasta 5 mm Hg. A esta presión, la mioglobina cede con facilidad su oxígeno para apoyar la síntesis oxidativa de ATP en las mitocondrias musculares. La cooperatividad positiva de la hemoglobina depende de la integridad de la estructura cuaternaria; si el tetrámero se disgrega en monómeros, la cooperatividad desaparece y la curva de saturación de oxígeno adquiere forma hiperbólica. Los datos de cristalografía con rayos X indican que la hemoglobina tiene dos estructuras cuaternarias. Las dos formas son de conformación desoxi, llamada "tensa" o estado conformacional T; al fijarse el oxígeno a las subunidades, la conformación pasa del estado T al R ("relajado"). La constante de afinidad del 0 2 es mayor en el estado R que en el estado T (fig. 3.28). T y R se emplean también para describir las estructuras cuaternarias de las enzimas alostéricas, donde el estado T tiene afinidad menor por el sustrato. En la unidad II, sobre equilibrio ácido base, ya habíamos señalado la influencia del oxígeno sobre el pka de la hemoglobina: HHb+40 2 Hb(0 2 ) 4 +H + ; es decir, la forma T es más acida. Por tanto, cuando la Hb oxigenada se encuentra a ph bajo (ácido) y C0 2 alto, tiende a liberar su oxígeno y representa un aumento de oxigenación en tejidos metabólicamente activos. La reducción de la afinidad oxígeno-hemoglobina en un ph bajo se denomina efecto Bohr (fig. 3.29). El efecto Bohr puede encajar en la definición de un mecanismo alostérico, según el cual, en la proteína existe un sitio de fijación para el sustrato y otro para el efector alostérico (positivo o negativo). La fijación del efector en el sitio alostérico influye sobre la conformación del sitio del sustrato (sitio activo). En la hemoglobina el sitio activo es ocupado por el oxígeno y el sitio alostérico es ocupado por el hidrogenión. Al ocupar su sitio el ion H, desplaza a la Hb a la forma T, de afinidad más baja por el oxígeno. El efecto Bohr, por lo tanto, tiene consecuencias fisiológicas importantes. Las células con metabolismo rápido y con requerimientos elevados de 0 2, producen ácido carbónico y ácido láctico que incrementan la concen-
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
Proteínas y su Papel Biológico
 Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
PROTEINAS AMINOACIDOS
 PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS CITOESQUELETO AMINOACIDOS
 PROTEINAS CITOESQUELETO AMINOACIDOS 1 Constituyen, en nuestro estudio de la célula, el 3er. concepto químico funcional. Esta asociado en sus aspectos estructurales: - al citoesqueleto celular - a las fosfolipo-proteínas
PROTEINAS CITOESQUELETO AMINOACIDOS 1 Constituyen, en nuestro estudio de la célula, el 3er. concepto químico funcional. Esta asociado en sus aspectos estructurales: - al citoesqueleto celular - a las fosfolipo-proteínas
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 29 2018 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
29 2018 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Tema 5 Estructura cuaternaria de proteínas
 Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
PROTEINAS AMINOÁCIDOS FUNCIONES DE LOS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
AMINOÁCIDOS 3B EXPLIQUE EL COMPORTAMIENTO DEL ACIDO ASPARTICO A UNA SOLUCION CON PH DE 8
 AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
TEMA 4: LAS PROTEÍNAS
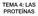 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
PROTEINAS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade
 +UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
+UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
a) Aminoácidos b) Estructura primaria
 Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Proteínas y Ácidos Nucleicos
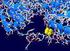 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
TEMA PROTEINAS.
 TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
ESTRUCTURA DE LAS PROTEÍNAS. La conformación de las proteínas viene definida por cuatro estructuras: Enlaces sencillos de rotación libre
 ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
Estructura tridimensional de las proteínas
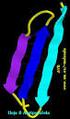 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
IV electivo. Unidad 1: Integración célula organismo Genes, proteínas y enzimas
 IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α-l - AA unidos por Uniones Peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y biosintetizados
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α-l - AA unidos por Uniones Peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y biosintetizados
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
Sesión 27. Tema: Proteínas. Que los alumnos reconozcan la estructura y función de las proteínas
 Sesión 27 Tema: Proteínas I. Objetivos de la sesión Que los alumnos reconozcan la estructura y función de las proteínas II. Temas Aminoácidos y estructura molecular. Si ranqueamos las moléculas de acuerdo
Sesión 27 Tema: Proteínas I. Objetivos de la sesión Que los alumnos reconozcan la estructura y función de las proteínas II. Temas Aminoácidos y estructura molecular. Si ranqueamos las moléculas de acuerdo
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Copyright (c) Marina González, Gabriela Gómez
 PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
HEMOGLOBINA Y MIOGLOBINA
 HEMOGLOBINA Y MIOGLOBINA 1 CARACTERÍSTICAS DE HIERRO Configuración electrónica [Ar] 3d 6 4s 2 Sus complejos mononucleares suelen ser octaédricos y de espín alto Sus momentos magnéticos son prácticamente
HEMOGLOBINA Y MIOGLOBINA 1 CARACTERÍSTICAS DE HIERRO Configuración electrónica [Ar] 3d 6 4s 2 Sus complejos mononucleares suelen ser octaédricos y de espín alto Sus momentos magnéticos son prácticamente
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
COMPOSICIÓN DE LOS SERES VIVOS
 COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
Unidad IV. Sub-Unidad 4.3.
 República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
República Bolivariana de Venezuela Universidad del Zulia Facultad de Medicina Escuela de Nutrición y Dietética Cátedra de Química General para Nutrición Unidad IV. Sub-Unidad 4.3. Prof. Alfonso R. Bravo
Identificación de proteínas, lípidos y carbohidratos. En productos lácteos. Ramírez Gutiérrez Donají Mariana Torres Martínez Jocelyn Astrid
 Identificación de proteínas, lípidos y carbohidratos. En productos lácteos. Ramírez Gutiérrez Donají Mariana Torres Martínez Jocelyn Astrid Objetivos Comprobar de forma sencilla la existencia de proteínas,
Identificación de proteínas, lípidos y carbohidratos. En productos lácteos. Ramírez Gutiérrez Donají Mariana Torres Martínez Jocelyn Astrid Objetivos Comprobar de forma sencilla la existencia de proteínas,
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
PROTEINAS Y ACIDOS NUCLEICOS
 PROTEINAS Y ACIDOS NUCLEICOS PROTEÍNAS Son capaces de formar polímeros siendo sus monómeros los aminoácidos. Como su nombre lo indica tienen un patrón general. Poseen un grupo amino y un grupo carboxilo
PROTEINAS Y ACIDOS NUCLEICOS PROTEÍNAS Son capaces de formar polímeros siendo sus monómeros los aminoácidos. Como su nombre lo indica tienen un patrón general. Poseen un grupo amino y un grupo carboxilo
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
ESTRUCTURA DE PROTEÍNAS
 ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
Sumario: Principales macromoléculas. El Principio de organización de las macromoléculas (POM).
 CONFERENCIA 4 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PRINCIPIOS DE ORGANIZACIÓN DE LAS MACROMOLÉCULAS. POLISACÁRIDOS Autor: Dr. Daniel Sánchez Serrano. Sumario: Principales macromoléculas. El
CONFERENCIA 4 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PRINCIPIOS DE ORGANIZACIÓN DE LAS MACROMOLÉCULAS. POLISACÁRIDOS Autor: Dr. Daniel Sánchez Serrano. Sumario: Principales macromoléculas. El
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
Como transportamos el Oxigeno a los tejidos. A través de proteínas asociadas a metales de transición como el hierro y el cobre.
 Como transportamos el Oxigeno a los tejidos A través de proteínas asociadas a metales de transición como el hierro y el cobre. Grupo Hemo Los anillos pirrol tiene puentes a-metileno y grupos M, V, M,
Como transportamos el Oxigeno a los tejidos A través de proteínas asociadas a metales de transición como el hierro y el cobre. Grupo Hemo Los anillos pirrol tiene puentes a-metileno y grupos M, V, M,
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA. FACULTAD DE AGRONOMÍA. ÁREA DE CIENCIAS. SUBÁREA DE CIENCIAS QUÍMICAS. BIOQUÍMICA DICIEMBRE 2015.
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA. FACULTAD DE AGRONOMÍA. ÁREA DE CIENCIAS. SUBÁREA DE CIENCIAS QUÍMICAS. BIOQUÍMICA DICIEMBRE 2015. GUÍA DE ESTUDIO EXAMEN PARCIAL 1 Serie 1 Responder a los siguientes
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA. FACULTAD DE AGRONOMÍA. ÁREA DE CIENCIAS. SUBÁREA DE CIENCIAS QUÍMICAS. BIOQUÍMICA DICIEMBRE 2015. GUÍA DE ESTUDIO EXAMEN PARCIAL 1 Serie 1 Responder a los siguientes
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
