TABLA IR-I ALCANOS. ν CH δ CH
|
|
|
- Domingo Molina Olivera
- hace 7 años
- Vistas:
Transcripción
1 Grupo º de onda (cm -1 ) Intensidad 1 1 mol l cm c TABLA I-I ALAOS h Origen otas 2970~2950 ch 70 ν as - 3 (1) (ε 15 21) en -Me, ausente en -Et. 2880~2860 m 30 ν s (ε 35 75) en -OMe, ausente en -OEt en metilendioxi. 1470~1450 m < 15 δ as ~1365 ch 15 δ s - 3 Doblete en gem-dimetilos (ver (5)-(7)). Junto a carbonilos ver (11)-(13). 2935~2915 ch 75 ν as ~2845 ch 45 ν s ~1445 m 8 tijera en ciclopentanos, 1450 en ciclohexanos. Se desplaza por hiperconjugación (ver (14)-(16)). (2) ch 3 rocking -( 2 ) n - Presente cuando n 4. Ocasionalmente como doblete en sólidos. Mas alto a menor n. Propilo ; Etilo El también tiene bandas de flexión en 1300 (ε 1). Los espectros de sólidos con cadenas largas y grupos polares terminales (ácidos, ésteres, amidas) muestran una serie de bandas regulares entre (3) débil débil ν δ sin uso práctico sin uso práctico (4) -( 2 ) 4 -O rocking de corresponde a la banda en 720 de (2). (5) 1170 ch, mas débil que esqueleto Un doblete en 1380 sugiere grupos gem-dimetilo; 3 el doblete de 1380 la confirmación se realiza por la vibración del 3 (ε 15). esqueleto (5)-(7). 3 (6) 3 3 (7) cuaternario 3 3 (8) 2 (9) ver tabla XI O () ch " " ombro en 1145 de la de ch " " Posición mas estable que la de la banda en ch " ch " ch " m m " " " ν as 2 esqueleto 3050 ν as 2 ν metino ν as 2 metileno También absorbe en De estas dos la de 1195 es mas estable, la señal en 1215 es un hombro de la primera. Ausente en anillos sin ormalmente obstruido por señales fuertes de otro tipo. Se desplaza hasta al incrementar la tensión del grupo epoxi, p. ej. unido a ciclopentanos. 10) (11) O-O aracterizado por su alta intensidad. Al acetilar la banda en 1380 se vuelve mas intensa que la de Lo mismo ocurre con acetatos de enol y fenol. Ocasionalmente se vuelve doblete. (12) -O Se desplaza a frecuencias menores que la flexión usual de 3 (1380). Señal aguda e intensa. La flexión asimétrica permanece en su posición usual (1460), pero se desplaza en los terpenos ( ). (13) -OO δ as - 3. También con bandas en 1135, 1155, δ s - 3 (14) - 2 -O La flexión de todos los metilenos activos se observa como una serie de bandas intensas y agudas entre las bandas comunes de 1465 a Lo mismo ocurre con - 2 -SO 2 - y otros. La integración de la intensidad pudiera proporcionar el número de metilenos activos. (15) - 2 -= o es muy intensa. Los dobles enlaces pudieran ser de aromáticos. La intensidad disminuye aún mas si el está entre dos enlaces múltiples (dobles o triples). (16) El adyacente al + también se desplaza como los dos anteriores. Si aparecen nuevas bandas al convertir la amina en sal, entonces se sabe que hay grupos
2 TABLA I-II ALQUEOS 1. Frecuencias de estiramiento - (ε entre paréntesis). A) = insaturados =- (alquenos, aromáticos). La banda de , m(30) 3000~2975, m ν as 2 ν s 2 Las bandas por encima de 3000 sugieren la presencia de 2975 se traslapa con los alcanos. B) 3020, m ν - 2. Señales de estiramiento = y de flexión =-, afectadas por el tipo de sustituyente Tipo ν = Sobretono de la Flexión en el plano flexión fuera del δ. plano δ. Flexión fuera del plano δ. ) vinilo terminal -=2 D) metileno terminal ~1620 m (40) 1665~1645 m (35) E) cis, disustituído 1660~1620 m (10) 1 2 F) trans, disustituído 2 1 G) trisustituído ) tetrasustituído ~1660 ancho (2) 1680~1660 ancho~m 1680~1660 ancho, intenso cuando está unido directamente a O ó. 1860~1800 m (30) 1800~1750 m (30) 1420, m (10~20). Se encima con las señales de 2 de alcanos, (14)-(16) 1300, m~ancho 1415, m (10~20). Misma región de tabla I, (14)-(16). 1415, m (10~20) 9, ch (50) y 910 ch (110); Incluye las flexiones simétrica y asimétrica de los 3. 8, ch (~150). Flexión asimétrica. 730~675, m (40). Ocasionalmente dudoso. En cíclicos aparecen varias bandas semejantes entre 800~650 (ε 50 ), difícil asignarlas. 965, ch (). Flexión asimétrica de los. 840~800, ch (40). Los cíclicos dan dos señales entre 850~7. o hay, pero los 2 contiguos (>=- 2 ) se pueden detectar por su flexión (Tabla I, (15)). 3. Dobles enlaces conjugados Grupo ν = δ - (fuera del plano) La conjugación influye poco. En ocasiones la I) Dieno 1650 y 1600 banda trans de 965 sube a 9. La banda cis aparece en 720, a veces como un prupo. J) Trieno 1650 y 1600; en ocasiones solo una banda y en otras la de 1600 aparece como un hombro de K) Polieno Banda ancha en 1650~1580
3 TABLA I-III AOMÁTIOS Posición Intensidad ε Origen otas 1) 3~3000 Menos de 60 Estiram - y En algunos aromáticos la banda principal combinaciones está debajo de 3000 cm -1 2) 2000~1660, Baja, ~5 Sobretono de las Grupo de 2 a 6 bandas pequeñas, varias bandas, flexiones fuera característico del patrón de sustitución, ver figura I-1 del campo - y comparar con fig. I-3, si necesita combinaciones ampliar concentre la muestra. Los 3) 1600~ ~14 Variable, menos de. La señal de 1600 en ocasiones es mas intensa que la correspondiente ( ) de alquenos carbonilos ocultan estas señales. ucleo bencénico Usualmente 1500 es mas intensa que onjugado con dienos da otra señal en Los sistemas condensados absorben en y dos bandas en Flexiones fuera del plano (debajo de 0 cm -1 ) Bandas muy intensas, ε a 500. El número, forma e intensidad relativa depende de los hidrógenos libres, como lo muestra la fig. I-3. Para piridinas y similares se usa la misma tabla, el heteroátomo se considera entonces un sustituyente. Flexiones en el plano (1225~950 cm -1 ) Estas señales son solo complementarias, pues los estiramientos -, - y -O caen en la misma región. Aparecen varias señales en función del número de hidrógenos. Señales débiles, pero agudas, que pueden aumentar significativamente en presencia de grupos polares. Sustituyentes en: ~1125, 1110~1070, 1070~0 1:2-1225~1175, 1070~0 (doblete), 0~960 1:3-1175~1125, 1110~1070, 1070~0 1:4-1225~1175, 1070~0 (doblete) 1:2:3-1175~1125, 1110~1070, 1070~0, 0~960 1:2:4-1225~1175, 1175~1125, 1070~0 (doblete), 0~960 1:3:5-1175~1125, 1070~0
4 Figura I-3 Señales aracterísticas de Sustituciones en Aromáticos o hay señal
5 TABLA I-IV: ELAES X Y, X=Y=Z. Grupo Posición (cm-1) ε otas Acetileno terminal, - Estir. - -: 2230~ Estir. -: 3320~3280 La señal en ~3300 es muy aguda.también hay una flexión del enlace - en 700~600 y ocasionalmente el sobretono en 1300~1200 Acetileno central, ~ Desaparece si la simetría es alta 1335~1325 itrilo - Aislado: 2260~2240 onjugado: 2240~2210 ~1330 causado por flex ~150 Las cianamidas (=- ) dan igual que los conjugados. Los cianuros alcalinos (a, K) producen una señal intensa del carbanión en 2~2050. Sales de diazonio, -( ) ~2240 Medio La posición depende del contraión Diazo -= + = ~2035 >= + = ~2000 Diazocetonas-O- 2 2~20 Alenos >==< -O ~2060 En aromáticos el estiram. del carbonilo se desplaza a 1645, en alifáticos a 1630~ Se divide si el aleno es terminal y tiene grupos electroatrayentes (e.g. acidos, cetonas). 850 (solo si el aleno es terminal, flexión -) 850 mas intensa que 1950, sobretono en Isocianato -==O 2275~ ~2000 Muy intensa, no le afecta conjugación arbodiimida, -==- Alifática: 2140~ ~1580 Mas intensa que carbonilo. Aromática: ~1680 Los aromáticos dan este doblete ~1560 asimétrico. Azida, ~2095 intensa Estiram. asim., en aromáticos se divide 1340~1180 débil Estiram. sim Tiocianato, -S- Alifático 2140 Aromático 2175~2160 Isotiocianato, -==S Alifático 2140~19 y 10 Aromático 2130~2040, 1250 y 930 eteno, >==O ~2150 etenimina, >== ~2000 Bióxido de carbono, O==O, O Mas intensas que isocianatos intensa 2 un poco ancha, dividida o con hombros. Estiram. antisim., estruct. Fina Las tres son señales finas, usadas en la calibración del equipo.
6 TABLA I-V: ALOOLES Y FEOLES. Tabla 5.a: Vibraciones de estiramiento del enlace O-: Estado del alcohol Posición, cm -1 oeficiente ε Forma otas 1) Libre, sin asociar: Agudo Medido en fase vapor o en disolventes Primario, - 2 -O no polares, pero si estos están Secundario, húmedos, también aparece la señal del agua en ' O Terciario, ' O '' Fenoles, φ-o ) idroperóxido: -O-O Puentes de hidrógeno: 3) Dímero 3600~3500 Agudo o se observa normalmente, por O O ocultarlo la banda polimérica. También aquí aparecen otros puentes de 4) Polimérico O O O O O O hidrógeno con éteres, cetonas y aminas 3400~3200 Grande Ancho También aquí aparecen las aminas (3500~3200) y la pequeña señal de sobretono del carbonilo. En muestras húmedas aparece la señal de estiramiento -O- (3600~3), en cuyo caso también se observa la flexión en 1640~1615. Puentes intramoleculares: 5) Alcoholes polivalentes 3600~ Agudo 6) puentes π ) Puente intramolec. con carbonilos, nitro, etc. 3200~2500 Ancho Generalmente se pierde bajo la señal de los estiramientos - Tabla 5.b: Vibraciones de estiramiento del enlace -O: O α β α α Tipo de alcohol Posición, cm -1 Desplazamientos, cm -1 otas Primario 1050 (1075~1025) Secundario 1 (1150~1) Terciario 1125 (1200~1) Fenoles 1200 (1250~1150) amificación en α: -15 Insaturación en α: -30 Anillo en α-α': -50 Insaturación en α y anillo α-α': - Dieno conjugado en α: -140 Tabla 5.c: Vibraciones de torsión del enlace -O: Posición (cm -1 ) Forma otas 660 ± 50 Ancha o es muy útil Las insaturaciones pueden ser alquenos o aromáticos. Sobre β y mas lejos no influyen en la posición. Si tanto en α como en α' y α'' hay ramificaciones, descuente otros 15 cm -1.
7 TABLA I-VII: AMIAS Y SALES DE AMOIO. Tabla 7.a: Vibraciones de estiramiento del enlace -: Tipo de amina Posición, cm -1 oeficiente ε otas Libre: 1) Primaria: - 2 y φ- 2 ~3500 (estiram. asim.) ~3400 (estiram. sim.) Ancha en primarias ε ~30 en φ- 2 La presencia de estas dos señales es característica de aminas prim. 2) Secundaria: --' 3350~3310 ancha Muy pequeña en -heterociclos como la piperidina φ-- y φ--φ' 3450 ε ~30 a 40 Pirroles, indoles, etc. 34 ε ~150 a 300 aracterísticos, ver tabla 10-2 >= 3400~3300 También estiramiento = en 16~1640 cm -1. Asociada: El desplazamiento desde la posición libre es inferior a cm-1, aunque puede llegar hasta 3 cm-1. En general son mas pequeñas, agudas y menos sensibles a los cambios en concentración que las bandas de alcoholes -O. Tabla 7.b: Vibraciones de flexión del enlace -: - 2 Tipo Posición, cm -1 Intensidad otas Primarias, 1640~1560 hica a mediana Flexión de tijera, tanto en aminas alifáticas como aromáticas. Muy característica, corresponde a la torsión, } 0~650 Mediana, ancha presente solo en aminas 1 as y 2 as, no en 3 as. Secundarias, ~14 ancha o es útil por su difícil detección Tabla 7.c: Vibraciones de estiramiento del enlace -: Si bien la posición es casi igual al estiramiento -, la intensidad es mucho mayor, debido a al polaridad del enlace -. Tipo de enlace - Posición (cm -1 ) Intensidad otas () () () 1230~1030 mediana Dos señales en terciarias, en aminas cíclicas la posición esta a menor número de onda. 1360~1250 hica Estiramiento φ-. Se desplaza por el incremento en el carácter del doble enlace. 1280~1180 mediana Estiramiento del enlace alifático -
8 Tabla 7.d: Sales de aminas iónicas: Grupo Posición (cm -1 ) Forma y tamaño otas ~3030 Ancho y chico ~3000 Ancho Los estiram. asim. y sim. de - se traslapan sobre la banda -, se le llama banda de amonio. Amina primaria, ~2500 Varias, medianas Tonos combinados y sobretonos, no siempre aparecen ~2000 mediana Tonos combinados y sobretonos, no siempre aparecen. Amina Secundaria, + > 2 Amina Terciaria, + Ión Amonio cuaternario > + < Aminas insaturadas, (aromáticas): + Guanidinio: Estiram. - de las guanidinas libres en clorhidratos: Mono-substituídas Di-substituídas Tri-substituídas +
9 TABLA I-VIII: GUPO ABOILO. Grupo Posición otas E~300~600 E~50~150 etona, -O-' Estiram =O: 1715 Alifáticos: flexión 1 Aromáticos: flexión 1300 etonas α,β insaturadas 1675 El estiram = se observa claramente a cm-1 y su intensidad resulta comparable a la del =O. Fenonas 16 La posisción se ve afectada por los efectos inductivos (mesoméricos y estéricos) de los sustituyentes. Fenonas 1665 etonas de 7 miembros y mayores 1705 etonas de 6 miembros 1715 Igual que el valor estándar, se desplaza por grupos conjugados e insaturados, igual que las cetonas alifáticas. etonas de 5 miembros 1745 etonas de 4 miembros 1780 Aldehídos Estiram -: 2955, 2720 Estiram. =O: 1725 Aldehídos α,β insaturados 1685 φ-=o 1700
Espectro Electromagnético
 Espectro Electromagnético En las moléculas orgánicas se observan vibraciones moleculares con energías que corresponden a la porción del infrarrojo del espectro electromagnético. Describiendo de la forma
Espectro Electromagnético En las moléculas orgánicas se observan vibraciones moleculares con energías que corresponden a la porción del infrarrojo del espectro electromagnético. Describiendo de la forma
Espectroscopía IR. de compuestos de
 Espectroscopía IR de compuestos de coordinación C. Kremer Facultad de Química Contenido 1 Compuestos de coordinación simples 2 Grupos funcionales típicos 3 Ejemplos de biomoléculas 1 Qué esperamos ver
Espectroscopía IR de compuestos de coordinación C. Kremer Facultad de Química Contenido 1 Compuestos de coordinación simples 2 Grupos funcionales típicos 3 Ejemplos de biomoléculas 1 Qué esperamos ver
TALLER DE ESPECTROSCOPIA
 TALLER DE ESPECTROSCOPIA I. OBJETIVOS a) Conocer los principios fundamentales que rigen la interacción energía-materia (radiación electromagnética-moléculas) en uno de los métodos espectroscópicos más
TALLER DE ESPECTROSCOPIA I. OBJETIVOS a) Conocer los principios fundamentales que rigen la interacción energía-materia (radiación electromagnética-moléculas) en uno de los métodos espectroscópicos más
QUÍMICA ORGÁNICA BÁSICA
 QUÍMICA ORGÁNICA BÁSICA 1. INTRODUCCIÓN: NATURALEZA DE LA QUÍMICA ORGÁNICA Panorama histórico y situación actual El carácter químico especial del carbono Fuentes y transformaciones de los compuestos orgánicos.
QUÍMICA ORGÁNICA BÁSICA 1. INTRODUCCIÓN: NATURALEZA DE LA QUÍMICA ORGÁNICA Panorama histórico y situación actual El carácter químico especial del carbono Fuentes y transformaciones de los compuestos orgánicos.
TEMA 9. DETERMINACIÓN DE ESTRUCTURAS MEDIANTE MÉTODOS FÍSICOS
 TEMA 9. DETERMINACIÓN DE ESTRUCTURAS MEDIANTE MÉTODOS FÍSICOS 1. Interacción de la energía radiante y la materia orgánica. 2. Fundamentos de la espectroscopia infrarroja: regiones del IR y modos fundamentales
TEMA 9. DETERMINACIÓN DE ESTRUCTURAS MEDIANTE MÉTODOS FÍSICOS 1. Interacción de la energía radiante y la materia orgánica. 2. Fundamentos de la espectroscopia infrarroja: regiones del IR y modos fundamentales
Reacciones de adición
 erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
DETERMINACIÓN ESTRUCTURAL (Teoría) CURSO , GRUP A 9 de febrero Apellidos... Nombre...
 DETERMINAIÓN ESTRUTURAL (Teoría) URS 2003-2004, GRUP A 9 de febrero 2004 Apellidos... Nombre... 1.- Que diferencias espera encontrar entre el 3 - y el 3 -D. a) en sus espectros de masas. El ión molecular
DETERMINAIÓN ESTRUTURAL (Teoría) URS 2003-2004, GRUP A 9 de febrero 2004 Apellidos... Nombre... 1.- Que diferencias espera encontrar entre el 3 - y el 3 -D. a) en sus espectros de masas. El ión molecular
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS
 FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
Espectro Electromagnético
 1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS
 CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos
 QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Química orgánica. Cuarto Medio 25/06
 Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
Química orgánica Cuarto Medio 25/06 CARBONO Es el elemento principal de las moléculas orgánicas. Debido a que este átomo, presenta una gran estabilidad. Dado que, tiene una baja tendencia a donar y quitar
QUÍMICA // 2º BACHILLERATO.
 QUÍMICA // 2º BACHILLERATO. FORMULACIÓN Y NOMENCLATURA QUÍMICA ORGANICA. TEMA 2 TEMARIO QUÍMICA.. I.E.S. FERNANDO DE LOS RÍOS (QUINTANAR DEL REY) Temario Química. Tema 2. 2 Índice de Contenido. 1. INTRODUCCIÓN....
QUÍMICA // 2º BACHILLERATO. FORMULACIÓN Y NOMENCLATURA QUÍMICA ORGANICA. TEMA 2 TEMARIO QUÍMICA.. I.E.S. FERNANDO DE LOS RÍOS (QUINTANAR DEL REY) Temario Química. Tema 2. 2 Índice de Contenido. 1. INTRODUCCIÓN....
Las funciones orgánicas se clasifican de la siguiente manera:
 Página 1 APUNTES EJERCICIOS FORMULACIÓN ORGÁNICA Las sustancias orgánicas se clasifican en bloques que se caracterizan por tener un átomo o grupo atómico definido (grupo funcional) que le confiere a la
Página 1 APUNTES EJERCICIOS FORMULACIÓN ORGÁNICA Las sustancias orgánicas se clasifican en bloques que se caracterizan por tener un átomo o grupo atómico definido (grupo funcional) que le confiere a la
Química Orgánica. por átomos de carbono. A diferencia de otros
 Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
FORMULACIÓN BÁSICA QUÍMICA ORGÁNICA
 FORMULACIÓN BÁSICA QUÍMICA ORGÁNICA La fórmula empírica indica los elementos que forman la molécula y la proporción relativa de los mismos. CH (escasa información) La fórmula molecular indica el número
FORMULACIÓN BÁSICA QUÍMICA ORGÁNICA La fórmula empírica indica los elementos que forman la molécula y la proporción relativa de los mismos. CH (escasa información) La fórmula molecular indica el número
TEMA 2 CLASIFICACION Y NOMECLATURA DE LOS COMPUESTOS ORGANICOS
 TEMA LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. oncepto de radical y grupo funcional. Series homólogas.. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. Fundamentos de Química rgánica
TEMA LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. oncepto de radical y grupo funcional. Series homólogas.. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. Fundamentos de Química rgánica
La Espectroscopía de Infrarrojo. Infrarrojo. Los enlaces y el infrarrojo. Espectroscopia de Infrarrojo. Espectroscopia de Infrarrojo
 Los enlaces y el infrarrojo La Espectroscopía de Infrarrojo hν IR d1 d2 Baja energía Alta energía María Font.. Dpto. Química Orgánica y Farmacéutica. Universidad de Navarra 1 María Font.. Dpto. Química
Los enlaces y el infrarrojo La Espectroscopía de Infrarrojo hν IR d1 d2 Baja energía Alta energía María Font.. Dpto. Química Orgánica y Farmacéutica. Universidad de Navarra 1 María Font.. Dpto. Química
NOMENCLATURA Y FORMULACION
 NOMENCLATURA Y FORMULACION RESUMEN NORMAS IUPAC La nomenclatura de compuestos orgánicos puede llegar a ser extraordinariamente compleja. En este seminario sólo se pretende dar unas nociones muy elementales
NOMENCLATURA Y FORMULACION RESUMEN NORMAS IUPAC La nomenclatura de compuestos orgánicos puede llegar a ser extraordinariamente compleja. En este seminario sólo se pretende dar unas nociones muy elementales
Clasificación de acuerdo con el tipo de esqueleto molecular
 TEMA 2.- Tipos de compuestos orgánicos. Tipos de compuestos y clasificación. Compuestos acíclicos, cíclicos y policíclicos. Grupos funcionales. Reglas básicas de nomenclatura. Clasificación de acuerdo
TEMA 2.- Tipos de compuestos orgánicos. Tipos de compuestos y clasificación. Compuestos acíclicos, cíclicos y policíclicos. Grupos funcionales. Reglas básicas de nomenclatura. Clasificación de acuerdo
Química Orgánica: los compuestos del Carbono
 Química Orgánica: los compuestos del Carbono Durante este año estudiaremos la nomenclatura y la formulación de las moléculas orgánicas (compuestas principalmente de C con H, N, O y los halógenos.) El carbono
Química Orgánica: los compuestos del Carbono Durante este año estudiaremos la nomenclatura y la formulación de las moléculas orgánicas (compuestas principalmente de C con H, N, O y los halógenos.) El carbono
Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS)
 Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS) Elucidación Estructural de Compuestos Orgánicos Resonancia Magnética Nuclear (RMN) Espectrometría de Masa (MS) Espectroscopía de Infrarojo
Espectroscopía de Infrarrojo (IR) y espectrometría de masas (MS) Elucidación Estructural de Compuestos Orgánicos Resonancia Magnética Nuclear (RMN) Espectrometría de Masa (MS) Espectroscopía de Infrarojo
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Ejercicios variados resueltos
 Ejercicios variados resueltos Programa de Acceso Inclusivo, Equidad y Permanencia 1. Cuál de los siguientes compuestos es isómero del CH 3 CH 2 COOH? a) CH 3 CO CH 2 OH b) CH 3 CH 2 CHO c) CH 2 =CH COOH
Ejercicios variados resueltos Programa de Acceso Inclusivo, Equidad y Permanencia 1. Cuál de los siguientes compuestos es isómero del CH 3 CH 2 COOH? a) CH 3 CO CH 2 OH b) CH 3 CH 2 CHO c) CH 2 =CH COOH
Formulación orgánica
 Formulación orgánica Orgánico significa que procede de órganos, relacionado con la vida. Lo contrario, inorgánico, se asigna a todo lo que carece de vida. A los compuestos orgánicos se les denominó así
Formulación orgánica Orgánico significa que procede de órganos, relacionado con la vida. Lo contrario, inorgánico, se asigna a todo lo que carece de vida. A los compuestos orgánicos se les denominó así
Conceptos basicos (III)
 erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
erramientas de la Química rgánica erramientas de la Química rgánica ompuestos carbonílicos onceptos basicos (III) δ δ plano 120 º = polar sp 2 Z Z Z Z = ó Ar Z = ó Ar aldehídos cetonas María Font. Dpto.
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN
 CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
Facultad de Farmacia. Departamento de Química Física. Universidad de Granada. OBTENCIÓN N DEL ESPECTRO IR del Ácido acetilsalicílico.
 Facultad de Farmacia Universidad de Granada PRÁCTICA Nº N 4 Departamento de Química Física OBTENCIÓN N DEL ESPECTRO IR del Ácido acetilsalicílico lico OBJETIVO: Obtener el espectro IR del ácido acetilsalicílico
Facultad de Farmacia Universidad de Granada PRÁCTICA Nº N 4 Departamento de Química Física OBTENCIÓN N DEL ESPECTRO IR del Ácido acetilsalicílico lico OBJETIVO: Obtener el espectro IR del ácido acetilsalicílico
Salvo los 4 primeros, que reciben el nombre de metano, etano, propano y butano, los demás se nombran mediante un prefijo
 ALCANOS 1A) ACÍCLICOS Salvo los 4 primeros, que reciben el nombre de metano, etano, propano y butano, los demás se nombran mediante un prefijo griego que indica el número de carbonos, y la terminación
ALCANOS 1A) ACÍCLICOS Salvo los 4 primeros, que reciben el nombre de metano, etano, propano y butano, los demás se nombran mediante un prefijo griego que indica el número de carbonos, y la terminación
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
TEMA 2: Resonancia Magnética Nuclear RMN-1H y 13C Fundamentos
 Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
Análisis de grupos funcionales 25/06/2012
 ITESM, campus qro. 1 La gasolina es una mezcla de hidrocarburos C5 C12 También se les llama parafinas (compuestos de baja afinidad) debido a su baja reactividad frente a muchos reactivos No polares, insolubles
ITESM, campus qro. 1 La gasolina es una mezcla de hidrocarburos C5 C12 También se les llama parafinas (compuestos de baja afinidad) debido a su baja reactividad frente a muchos reactivos No polares, insolubles
γ 13 C = C RMN H = ν = H o H 0 (T) ν 1 H RMN (MHz)* ν 13 C RMN (MHz)
 RMN I = 0 No observable en RMN I = ½ BSERVABLE EN RMN Abundancia natural del =.% Sensibilidad INTENSIDAD DE LAS SEÑALES RMN se basa en los mismos principios que RMN: utilizando una RF adecuada (o un pulso
RMN I = 0 No observable en RMN I = ½ BSERVABLE EN RMN Abundancia natural del =.% Sensibilidad INTENSIDAD DE LAS SEÑALES RMN se basa en los mismos principios que RMN: utilizando una RF adecuada (o un pulso
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
1 Enlace e isomería 6
 Índice vii ÍNDICE Prólogo xvii Al estudiante 1 1 Enlace e isomería 6 1.1 Cómo se encuentran ordenados los electrones en los átomos 7 1.2 Enlace iónico y covalente 8 1.2.a Compuestos iónicos 9 1.2.b Enlace
Índice vii ÍNDICE Prólogo xvii Al estudiante 1 1 Enlace e isomería 6 1.1 Cómo se encuentran ordenados los electrones en los átomos 7 1.2 Enlace iónico y covalente 8 1.2.a Compuestos iónicos 9 1.2.b Enlace
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Carrera: Ingeniero Químico Asignatura: Química Orgánica II. 781114 Licenciatura Ingeniero Químico. 3 (h/sem)
 Carrera: Ingeniero Químico Asignatura: Química Orgánica II Ciencias Básicas Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana): Teoría: Laboratorio:
Carrera: Ingeniero Químico Asignatura: Química Orgánica II Ciencias Básicas Generales de la Asignatura: Nombre de la Asignatura: Clave Asignatura: Nivel: Carrera: Frecuencia (h/semana): Teoría: Laboratorio:
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD NACIONAL DE ASUNCIÓN FACULTAD DE CIENCIAS MÉDICAS
 EXAMEN DE INGRESO 2016 ASIGNATURA: QUÍMICA 1. FUNDAMENTOS GENERALES DE LA QUÍMICA 1.1. Materia: Concepto, características, clasificación, propiedades y cambios. 1.1.1. Clasificación de la materia. Sustancias:
EXAMEN DE INGRESO 2016 ASIGNATURA: QUÍMICA 1. FUNDAMENTOS GENERALES DE LA QUÍMICA 1.1. Materia: Concepto, características, clasificación, propiedades y cambios. 1.1.1. Clasificación de la materia. Sustancias:
Reacciones de reducción
 idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
ÍNDICE DE CONTENIDOS
 ÍNDICE DE CONTENIDOS Presentación... 15 Presentación autoras... 17 UNIDAD DIDÁCTICA I Tema 1. Hidrocarburos I: Alcanos. Alquenos. Dienos y polienos Rosa M. a Claramunt Vallespí... 21 1.1. Introducción...
ÍNDICE DE CONTENIDOS Presentación... 15 Presentación autoras... 17 UNIDAD DIDÁCTICA I Tema 1. Hidrocarburos I: Alcanos. Alquenos. Dienos y polienos Rosa M. a Claramunt Vallespí... 21 1.1. Introducción...
INTRODUCCIÓN A LA QUÍMICA ORGÁNICA
 CONTENIDOS. INTRODUCCIÓN A LA QUÍMICA ORGÁNICA 1.- Primeros pasos de la Química Orgánica. 2.- Características del carbono y de los compuestos orgánicos. 3.- Tipos de enlaces del carbono. 4.- Representación
CONTENIDOS. INTRODUCCIÓN A LA QUÍMICA ORGÁNICA 1.- Primeros pasos de la Química Orgánica. 2.- Características del carbono y de los compuestos orgánicos. 3.- Tipos de enlaces del carbono. 4.- Representación
QUÍMICA DEL CARBONO Formulación y Nomenclatura Orgánica
 1/6 El gran número de compuestos orgánicos y la complejidad de los mismos, hace imposible que cada uno de ellos tenga un nombre específico, por ello fue necesario sistematizar su nomenclatura y formulación.
1/6 El gran número de compuestos orgánicos y la complejidad de los mismos, hace imposible que cada uno de ellos tenga un nombre específico, por ello fue necesario sistematizar su nomenclatura y formulación.
RESUMEN FORMULACIÓN DE QUÍMICA INORGÁNICA
 RESUMEN FORMULACIÓN DE QUÍMICA INORGÁNICA 1- SUSTANCIAS SIMPLES Las sustancias simples están constituidas por una clase única de átomos. En general, los elementos gaseosos suelen encontrarse en forma de
RESUMEN FORMULACIÓN DE QUÍMICA INORGÁNICA 1- SUSTANCIAS SIMPLES Las sustancias simples están constituidas por una clase única de átomos. En general, los elementos gaseosos suelen encontrarse en forma de
CURSO BREVE DE QUÍMICA ORGÁNICA
 CURSO BREVE DE QUÍMICA ORGÁNICA PRÓLOGO INTRODUCCIÓN 1. PRINCIPIOS GENERALES. Estructura atómica. Enlaces electrovalentes o iónicos. Enlaces covalentes. Orbitales híbridos. Enlaces covalentes polares.
CURSO BREVE DE QUÍMICA ORGÁNICA PRÓLOGO INTRODUCCIÓN 1. PRINCIPIOS GENERALES. Estructura atómica. Enlaces electrovalentes o iónicos. Enlaces covalentes. Orbitales híbridos. Enlaces covalentes polares.
Resonancia Magnética Nuclear
 Resonancia Magnética Nuclear Por qué algunas señales aparecen como señales múltiples (multipletes)? Dos átomos que se encuentren contiguos interaccionan modificándose mutuamente. La forma de la señal depende
Resonancia Magnética Nuclear Por qué algunas señales aparecen como señales múltiples (multipletes)? Dos átomos que se encuentren contiguos interaccionan modificándose mutuamente. La forma de la señal depende
TABLAS DE ESPECTROSCOPIA INFRARROJA
 Michelle Alvarez 4to Bioquímica línica TABLAS DE ESPETRSPIA INFRARRJA ALANS Forma sp3-h 2850-3000 intensa estrecha Tijera H2 y -H2 con 1450-1470 media Estrecha H3 Balanceo de H3 Balanceo de cadena de al
Michelle Alvarez 4to Bioquímica línica TABLAS DE ESPETRSPIA INFRARRJA ALANS Forma sp3-h 2850-3000 intensa estrecha Tijera H2 y -H2 con 1450-1470 media Estrecha H3 Balanceo de H3 Balanceo de cadena de al
TUTORIAL PARA LA INTERPRETACIÓN DE ESPECTROS DE RESONANCIA MAGNÉTICA NUCLEAR DE PROTÓN.
 9 8 7 6 5 4 3 1 0 TUTRIAL PARA LA INTERPRETACIÓN DE ESPECTRS DE RESNANCIA MAGNÉTICA NUCLEAR DE PRTÓN. Juan A. Palop Tutorial para la interpretación de espectros de Resonancia Magnética Nuclear de protón
9 8 7 6 5 4 3 1 0 TUTRIAL PARA LA INTERPRETACIÓN DE ESPECTRS DE RESNANCIA MAGNÉTICA NUCLEAR DE PRTÓN. Juan A. Palop Tutorial para la interpretación de espectros de Resonancia Magnética Nuclear de protón
19 Y 20 ALCOHOLES FENOLES, TIOLES Y ETERES. Licda. Lilian Judith Guzmán Melgar ALCOHOLES
 ALCOHOLES FENOLES, TIOLES Y ETERES Licda. Lilian Judith Guzmán Melgar 2016 19 Y 20 ALCOHOLES CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases Los alcoholes pueden considerarse los derivados
ALCOHOLES FENOLES, TIOLES Y ETERES Licda. Lilian Judith Guzmán Melgar 2016 19 Y 20 ALCOHOLES CLASIFICACIÓN Los alcoholes se pueden clasificar en tres clases Los alcoholes pueden considerarse los derivados
Estructura de las moléculas orgánicas
 Estructura de las moléculas orgánicas Francisco García Calvo-Flores Contenidos 11-1 Moléculas orgánicas 11-2 Hibridación 11-3 Representación de las moléculas orgánicas 11-4 Conformaciones 11-5 Grupos funcionales
Estructura de las moléculas orgánicas Francisco García Calvo-Flores Contenidos 11-1 Moléculas orgánicas 11-2 Hibridación 11-3 Representación de las moléculas orgánicas 11-4 Conformaciones 11-5 Grupos funcionales
TEMA 2. CLASIFICACION Y NOMECLATURA DE LOS COMPUESTOS ORGANICOS.
 TEMA 2. LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. 1. oncepto de radical y grupo funcional. Series homólogas. 2. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. 2 Tema 2 TEMA 2.
TEMA 2. LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. 1. oncepto de radical y grupo funcional. Series homólogas. 2. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. 2 Tema 2 TEMA 2.
Singularidad del carbono
 Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
Unidad 2: BIOLOGÍA CELULAR I
 CARRERA: INGENIERÍA BIOMÉDICA ASIGNATURA: INTRODUCCIÓN A LA BIOLOGÍA Unidad 2: BIOLOGÍA CELULAR I CONCEPTOS BÁSICOS DE QUÍMICA INORGÁNICA Y ORGÁNICA (tomados de: Introducción a la Química Biológica del
CARRERA: INGENIERÍA BIOMÉDICA ASIGNATURA: INTRODUCCIÓN A LA BIOLOGÍA Unidad 2: BIOLOGÍA CELULAR I CONCEPTOS BÁSICOS DE QUÍMICA INORGÁNICA Y ORGÁNICA (tomados de: Introducción a la Química Biológica del
Tema 17. AMINAS. Altramuz salvaje
 Tema 17. AMINAS Altramuz salvaje 2.- Principales familias de compuestos orgánicos: - Compuestos halogenados. - Hidrocarburos alifáticos: alcanos,, alquenos y alquinos. - Hidrocarburos aromáticos. - Alcoholes,
Tema 17. AMINAS Altramuz salvaje 2.- Principales familias de compuestos orgánicos: - Compuestos halogenados. - Hidrocarburos alifáticos: alcanos,, alquenos y alquinos. - Hidrocarburos aromáticos. - Alcoholes,
PONTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPTO. DE QUIMICA FUNDAMENTOS DE BIOLOGIA I COMPUESTOS DEL CARBONO
 PNTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPT. DE QUIMICA FUNDAMENTS DE BILGIA I CMPUESTS DEL CARBN Julio A. Pedrozo Pérez 2002 FUNCINES RGANICAS 1. Funciones oxigenadas - Alcoholes, Fenoles y
PNTIFICIA UNIVERSIDAD JAVERIANA FAC. DE CIENCIAS - DPT. DE QUIMICA FUNDAMENTS DE BILGIA I CMPUESTS DEL CARBN Julio A. Pedrozo Pérez 2002 FUNCINES RGANICAS 1. Funciones oxigenadas - Alcoholes, Fenoles y
Regla A-2.3 Si dos o mas cadenas laterales tienen diferente naturaleza, deberán citarse en orden alfabético, como sigue. Véase el ejemplo 17.
 FORMULACIÓN ORGÁNICA Nomenclatura y simbología orgánica Reglas de la IUPAC I (HIDROCARBUROS) Entre los años 60 y 70, la IUPAC. cambió de nombre, intitulándose Comisión en la nomenclatura de Química Orgánica,
FORMULACIÓN ORGÁNICA Nomenclatura y simbología orgánica Reglas de la IUPAC I (HIDROCARBUROS) Entre los años 60 y 70, la IUPAC. cambió de nombre, intitulándose Comisión en la nomenclatura de Química Orgánica,
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
2.2- FENOLES. Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH.
 2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
240232 - Química Orgánica
 Unidad responsable: 240 - ETSEIB - Escuela Técnica Superior de Ingeniería Industrial de Barcelona Unidad que imparte: 713 - EQ - Departamento de Ingeniería Química Curso: Titulación: 2015 GRADO EN INGENIERÍA
Unidad responsable: 240 - ETSEIB - Escuela Técnica Superior de Ingeniería Industrial de Barcelona Unidad que imparte: 713 - EQ - Departamento de Ingeniería Química Curso: Titulación: 2015 GRADO EN INGENIERÍA
TEMA 1 NOMENCLATURA QUÍMICA ORGÁNICA (II). GRUPOS FUNCIONALES
 TEMA 1 NMENLATURA QUÍMIA RGÁNIA (II). GRUPS FUNINALES ÍNDIE 1. onceptos generales 2. Derivados halogenados 3. Alcoholes y fenoles 4. Éteres 5. Aldehídos y cetonas 6. Ácidos carboxílicos 7. Ésteres 8. Aminas
TEMA 1 NMENLATURA QUÍMIA RGÁNIA (II). GRUPS FUNINALES ÍNDIE 1. onceptos generales 2. Derivados halogenados 3. Alcoholes y fenoles 4. Éteres 5. Aldehídos y cetonas 6. Ácidos carboxílicos 7. Ésteres 8. Aminas
ESPECTROSCOPÍA ESPECTROSCOPÍA INFRARROJA INTERPRETACIÓN ESPECTRO IR
 ESPECTROSCOPÍA ESPECTROSCOPÍA INFRARROJA INTERPRETACIÓN ESPECTRO IR Espectroscopia infrarroja (Espectroscopia IR) es la rama de la espectroscopia que trata con la parte infrarroja del espectro electromagnético.
ESPECTROSCOPÍA ESPECTROSCOPÍA INFRARROJA INTERPRETACIÓN ESPECTRO IR Espectroscopia infrarroja (Espectroscopia IR) es la rama de la espectroscopia que trata con la parte infrarroja del espectro electromagnético.
Alcanos. Solo contienen carbono e hidrógeno Solo tienen enlaces sencillos. Todos poseen la formula: C n H 2n+2
 Alcanos Solo contienen carbono e hidrógeno Solo tienen enlaces sencillos Todos poseen la formula: C n H 2n+2 ALCANOS Ubique la cadena de átomos de carbono más larga, coloque la terminación ano Localizar
Alcanos Solo contienen carbono e hidrógeno Solo tienen enlaces sencillos Todos poseen la formula: C n H 2n+2 ALCANOS Ubique la cadena de átomos de carbono más larga, coloque la terminación ano Localizar
FORMULACIÓN y NOMENCLATURA de la QUÍMICA del CARBONO
 FORMULACIÓN y NOMENCLATURA de la QUÍMICA del CARBONO Iniciación a la nomenclatura y formulación de la Química Orgánica 2 INTRODUCCIÓN La Química Orgánica estudia los compuestos orgánicos, es decir, las
FORMULACIÓN y NOMENCLATURA de la QUÍMICA del CARBONO Iniciación a la nomenclatura y formulación de la Química Orgánica 2 INTRODUCCIÓN La Química Orgánica estudia los compuestos orgánicos, es decir, las
Dienos aislados. Dienos conjugados. Dienos acumulados (alenos)
 TEMA 10.- Hidrocarburos poliinsaturados. Clasificación. Dienos conjugados. Reacciones de adición. Cicloadiciones. Reacciones de Diels-Alder. Un dieno es un compuesto orgánico que tiene dos enlaces dobles.
TEMA 10.- Hidrocarburos poliinsaturados. Clasificación. Dienos conjugados. Reacciones de adición. Cicloadiciones. Reacciones de Diels-Alder. Un dieno es un compuesto orgánico que tiene dos enlaces dobles.
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
Ejercicios de Espectroscopía Infrarroja para el curso de Química analítica IV
 Ejercicios de Espectroscopía Infrarroja para el curso de Química analítica IV Fernando de J. Amézquita L. Diana Mendoza O. Universidad de Guanajuato En esta presentación encontrarás once espectros de compuestos
Ejercicios de Espectroscopía Infrarroja para el curso de Química analítica IV Fernando de J. Amézquita L. Diana Mendoza O. Universidad de Guanajuato En esta presentación encontrarás once espectros de compuestos
Ác. Carboxílicos -COOH unido al número necesario de
 FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS ORGÁNICOS. Pág. Nº 1 CONTENIDOS 1.- Compuestos orgánicos. 2.- Compuestos hidrocarburos. 3.- Compuestos halogenados. 4.- Compuestos oxigenados. 5.- Compuestos
FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS ORGÁNICOS. Pág. Nº 1 CONTENIDOS 1.- Compuestos orgánicos. 2.- Compuestos hidrocarburos. 3.- Compuestos halogenados. 4.- Compuestos oxigenados. 5.- Compuestos
Formulación química orgánica.
 Formulación química orgánica. 1. Introducción. La química orgánica estudia las combinaciones con carbono de elementos como H, N, O,... El C Ł Hibridación 1s 2 2s 2 2p 2 El C actúa como un elemento tetravalente.
Formulación química orgánica. 1. Introducción. La química orgánica estudia las combinaciones con carbono de elementos como H, N, O,... El C Ł Hibridación 1s 2 2s 2 2p 2 El C actúa como un elemento tetravalente.
León Felipe Otálvaro Tamayo Química Orgánica I 1 CONCEPTOS BÁSICOS DE NOMENCLATURA
 León Felipe tálvaro Tamayo Química rgánica I 1 EPTS BÁSIS DE MELATUA MELATUA DE ALAS Existen procedimientos que se pueden seguir cuando nombramos un compuesto orgánico, y consideraremos estos casos mirando
León Felipe tálvaro Tamayo Química rgánica I 1 EPTS BÁSIS DE MELATUA MELATUA DE ALAS Existen procedimientos que se pueden seguir cuando nombramos un compuesto orgánico, y consideraremos estos casos mirando
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
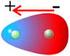 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN
 PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
PRACTICAS DE LABORATORIO QUIMICA 2010 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES ELABORADO POR: LICDA. BÁRBARA TOLEDO DE CHAJÓN I. INTRODUCCIÓN Los compuestos orgánicos que se presentan en la
UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica. Profesora: Gladys Rivera Jerez
 UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica Profesora: Gladys Rivera Jerez Las sencillas combinaciones del carbono con algunos pocos átomos han dado origen a más de 10 millones
UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica Profesora: Gladys Rivera Jerez Las sencillas combinaciones del carbono con algunos pocos átomos han dado origen a más de 10 millones
QUIMICA ORGANICA 1 ALCANOS Y CICLOALCANOS 20/08/2010 ALCANOS
 0/0/00 QUIMICA ORGANICA Y CICLO Son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono carbono, solo poseen carbono e hidrogeno y no tienen grupos funcionales. El enlace
0/0/00 QUIMICA ORGANICA Y CICLO Son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono carbono, solo poseen carbono e hidrogeno y no tienen grupos funcionales. El enlace
19 y20/13 ALCOHOLES, FENOLES, ÉTERES, TIOÉTERES Y
 19 y20/13 ALCOHOLES, FENOLES, ÉTERES, TIOÉTERES Y TIOLES Licda. Lilian Judith Guzmán Melgar ALCOHOLES Los alcoholes pueden considerarse los derivados orgánicos del agua, donde uno de los hidrógenos es
19 y20/13 ALCOHOLES, FENOLES, ÉTERES, TIOÉTERES Y TIOLES Licda. Lilian Judith Guzmán Melgar ALCOHOLES Los alcoholes pueden considerarse los derivados orgánicos del agua, donde uno de los hidrógenos es
Lección 2: NOMENCLATURA Y FÓRMULAS ESTRUCTURALES
 Lección 2: NOMENCLATURA Y FÓRMULAS ESTRUCTURALES 1.Composición centesimal. Fórmula empírica y fórmula molecular. Determinación de la fórmula molecular. 2. Concepto de isomería. 3. Grupos funcionales y
Lección 2: NOMENCLATURA Y FÓRMULAS ESTRUCTURALES 1.Composición centesimal. Fórmula empírica y fórmula molecular. Determinación de la fórmula molecular. 2. Concepto de isomería. 3. Grupos funcionales y
Clasificación de los alquenos. Nomenclatura de los alquenos. Nomenclatura de los alquenos, continuacion
 ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
ALQUENOS Los alquenos son hidrocarburos insaturados que contienen uno o más dobles enlaces C = C. El nombre de los hidrocarburos insaturados se debe a que los carbonos que sostienen el doble enlace todavía
Los principales grupos funcionales son los siguientes:
 GRUPOS FUNCIONALES Qué es un grupo funcional? Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos
GRUPOS FUNCIONALES Qué es un grupo funcional? Hemos visto que los hidrógenos de los hidrocarburos pueden ser sustituidos por átomos de otro metal o por un agrupamiento de átomos para obtener compuestos
Lección 1: GENERALIDADES
 Lección 1: GENERALIDADES 1.Concepto de Química Orgánica. Introducción histórica. 2. Estructuras de Lewis. Estructuras resonantes. 3. Geometría de las moléculas. 4. Representaciones de las moléculas orgánicas
Lección 1: GENERALIDADES 1.Concepto de Química Orgánica. Introducción histórica. 2. Estructuras de Lewis. Estructuras resonantes. 3. Geometría de las moléculas. 4. Representaciones de las moléculas orgánicas
UNIVERSIDAD SANTO TOMÁS SECCIONAL BUCARAMANGA. División de Ingenierías - Facultad de Química Ambiental
 UNIVERSIDAD SANTO TOMÁS SECCIONAL BUCARAMANGA División de Ingenierías Facultad de Química Ambiental Nombre de Asignatura: QUÍMICA ORGÁNICA I Àrea: Créditos: 4 Básicas de Química - Química Orgánica Modalidad:
UNIVERSIDAD SANTO TOMÁS SECCIONAL BUCARAMANGA División de Ingenierías Facultad de Química Ambiental Nombre de Asignatura: QUÍMICA ORGÁNICA I Àrea: Créditos: 4 Básicas de Química - Química Orgánica Modalidad:
Quimica orgánica básica
 Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Fuerzas Intermoleculares. Materia Condensada.
 Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Fuerzas Intermoleculares. Materia Condensada. Contenidos Introducción. Tipos de fuerzas intermoleculares. Fuerzas ion-dipolo Fuerzas ion-dipolo inducido Fuerzas de van der Waals Enlace de hidrógeno Tipos
Gráfica 5.2 Acetato de cobalto 0.01M de 190 a 800nm con una absorbancia de 3.344 y λ 198.8 nm
 5- Resultados 5.1- Espectrofotometría UV/Vis de los reactivos Gráfica 5.1 Peroximonosulfato de potasio 0.01M de 190 a 800nm con una absorbancia de 365 y λ 193 nm Gráfica 5.2 Acetato de cobalto 0.01M de
5- Resultados 5.1- Espectrofotometría UV/Vis de los reactivos Gráfica 5.1 Peroximonosulfato de potasio 0.01M de 190 a 800nm con una absorbancia de 365 y λ 193 nm Gráfica 5.2 Acetato de cobalto 0.01M de
QUÍMICA ORGÁNICA. Física y Química CH 3 CH CH CH 2 CH 3 CH 3 CH 2 CH 2 C CH
 1 QUÍMIA GÁNIA Física y Química 2 La química del carbono o química orgánica, estudia todas aquellas sustancias en cuyas moléculas toma parte el carbono Los átomos de carbono, tienen mucha facilidad para
1 QUÍMIA GÁNIA Física y Química 2 La química del carbono o química orgánica, estudia todas aquellas sustancias en cuyas moléculas toma parte el carbono Los átomos de carbono, tienen mucha facilidad para
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA ORGÁNICA
 FORMULACIÓN Y NOMENCLATURA DE QUÍMICA ORGÁNICA En Química Orgánica a cada compuesto se le solía dar un nombre que generalmente hacía referencia a su procedencia como, por ejemplo, geraniol (presente en
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA ORGÁNICA En Química Orgánica a cada compuesto se le solía dar un nombre que generalmente hacía referencia a su procedencia como, por ejemplo, geraniol (presente en
PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE ENFERMERÍA
 PONTIFIIA UNIVERSIDAD ATÓLIA DEL EUADOR FAULTAD DE ENFERMERÍA 1.- DATOS INFORMATIVOS: MATERIA: QUÍMIA ORGÁNIA ARRERA: Nutrición Humana NIVEL: Segundo No. RÉDITOS: 2 (dos) PROFESOR: Lcda. Gladys Acurio
PONTIFIIA UNIVERSIDAD ATÓLIA DEL EUADOR FAULTAD DE ENFERMERÍA 1.- DATOS INFORMATIVOS: MATERIA: QUÍMIA ORGÁNIA ARRERA: Nutrición Humana NIVEL: Segundo No. RÉDITOS: 2 (dos) PROFESOR: Lcda. Gladys Acurio
Formulación y nomenclatura de química orgánica
 Formulación y nomenclatura de química orgánica Este apéndice se ha realizado teniendo en cuenta las últimas normas y recomendaciones elaboradas entre 99 y 99 por la IUPA para nombrar los compuestos orgánicos.
Formulación y nomenclatura de química orgánica Este apéndice se ha realizado teniendo en cuenta las últimas normas y recomendaciones elaboradas entre 99 y 99 por la IUPA para nombrar los compuestos orgánicos.
QUÍMICA ORGÁNICA. Rafael Jiménez Prieto www.lamanzanadenewtonc.om REGLAS DE FORMULACIÓN
 QUÍMICA ORGÁNICA Rafael Jiménez Prieto www.lamanzanadenewtonc.om REGLAS DE FORMULACIÓN FORMULACIÓN ORGÁNICA Existen millones de compuestos orgánicos, y cada día se registran nuevas incorporaciones a la
QUÍMICA ORGÁNICA Rafael Jiménez Prieto www.lamanzanadenewtonc.om REGLAS DE FORMULACIÓN FORMULACIÓN ORGÁNICA Existen millones de compuestos orgánicos, y cada día se registran nuevas incorporaciones a la
Colegio Santa María del Carmen Alicante Departamento Científico Matemático
 Colegio Santa María del Carmen Científico UNIDAD 16. QUÍMICA ORGÁNICA También conocida como química del carbono, es la rama de la Química que estudia los compuestos de este elemento (el carbono). Los átomos
Colegio Santa María del Carmen Científico UNIDAD 16. QUÍMICA ORGÁNICA También conocida como química del carbono, es la rama de la Química que estudia los compuestos de este elemento (el carbono). Los átomos
Unidad IV: Espectrometría de Masas. Química Orgánica III Primer Semestre 2015 Facultad de CC.QQ. Y Farmacia USAC
 Unidad IV: Espectrometría de Masas Química Orgánica III Primer Semestre 2015 Facultad de CC.QQ. Y Farmacia USAC Identificación de un compuesto Orgánico Determinación de Propiedades Físicas Apariencia Olor
Unidad IV: Espectrometría de Masas Química Orgánica III Primer Semestre 2015 Facultad de CC.QQ. Y Farmacia USAC Identificación de un compuesto Orgánico Determinación de Propiedades Físicas Apariencia Olor
I.- CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 1.- Concepto y origen de la Química Orgánica I.- CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA La Química Orgánica se ocupa del estudio de las propiedades y transformaciones de los compuestos que contienen
1.- Concepto y origen de la Química Orgánica I.- CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA La Química Orgánica se ocupa del estudio de las propiedades y transformaciones de los compuestos que contienen
F O R M U L A C I Ó N O R G Á N I C A
 F O R M U L A C I Ó N O R G Á N I C A Fórmulas de los compuestos orgánicos. La unión de los átomos de carbono por alguno de los tres tipos de enlaces (sencillos, dobles o triples) forman las cadenas carbonadas;
F O R M U L A C I Ó N O R G Á N I C A Fórmulas de los compuestos orgánicos. La unión de los átomos de carbono por alguno de los tres tipos de enlaces (sencillos, dobles o triples) forman las cadenas carbonadas;
Nomenclatura IUPAC. Ácido -oico. Ácido -carboxílico. Ácido butírico. Ácido acético. Ácido cólico Ácido oleico. ácido 3-bromociclohexanocarboxilico
 Ácido acético Ácido butírico Ácido cólico Ácido oleico omenclatura IUPAC Ácido -oico 3 1 2 ácido propanoico 5 4 3 1 2 ácido 4-metilpentanoico 2 1 3 5 7 6 8 4 ácido 3-etil-6-metiloctanodioico Ácido -carboxílico
Ácido acético Ácido butírico Ácido cólico Ácido oleico omenclatura IUPAC Ácido -oico 3 1 2 ácido propanoico 5 4 3 1 2 ácido 4-metilpentanoico 2 1 3 5 7 6 8 4 ácido 3-etil-6-metiloctanodioico Ácido -carboxílico
2. o. QUÍMICA II (Código: 102045) ASIGNATURA: 1. EQUIPO DOCENTE 2. OBJETIVOS 3. CONTENIDOS
 ASIGNATURA: QUÍMICA II (Código: 102045) 1. EQUIPO DOCENTE D. Alfonso Contreras López. Catedrático D. a M. a Rosa Gómez Antón. Profesora Titular D. Mariano Molero Meneses. Profesor Titular D. Jesús Sardá
ASIGNATURA: QUÍMICA II (Código: 102045) 1. EQUIPO DOCENTE D. Alfonso Contreras López. Catedrático D. a M. a Rosa Gómez Antón. Profesora Titular D. Mariano Molero Meneses. Profesor Titular D. Jesús Sardá
