k 11 N. de publicación: ES k 51 Int. Cl. 5 : A61K 35/16
|
|
|
- Rafael Iglesias Ruiz
- hace 8 años
- Vistas:
Transcripción
1 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES Int. Cl. : A61K 3/16 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: Fecha de presentación : Número de publicación de la solicitud: Fecha de publicación de la solicitud: Título: Uso de factor XIII de coagulación de la sangre humana para el tratamiento de la colitis ulcerosa. Prioridad: JP 26387/87 73 Titular/es: Hoechst Japan Limited -16, 8-chome, Aasaa, Minato-u Toyo, JP 4 Fecha de la publicación de la mención BOPI: Inventor/es: Urabe, Miio; Tanaa, Satoshi y Tsumura, Kenichiro 4 Fecha de la publicación del folleto de patente: Agente: Díez de Rivera y Hoces, Alfonso Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. C/Panamá, Madrid
2 DESCRIPCION Esta invención se refiere al uso de factor XIII de coagulación de la sangre humana para el tratamiento de la colitis ulcerosa. La colitis ulcerosa se designa como una enfermedad específica y se define como una inflamación erosivanoespecífica del colon, que afecta principalmente a la mucosa intestinal y que a menudo produce erosión o ulceración. Por lo general, desarrolla diarrea sanguinolenta y una diversidad de síntomas sistémicos. Respecto a su etiología, hay muchas hipótesis, que incluyen las que aseguran la asociación de infección, alergia bacteriana, enzima y siconeurosis. Sin embargo, en los últimos años se ha puesto énfasis en la posible asociación de prostaglandinas y de trastornos inmunológicos. Se ha intentado la terapia inmuno-supresora, o la administración de agentes anti-inmunes, tal como 6-mercaptopurina, como un tratamiento específico para la colitis ulcerosa, considerando que los trastornos inmunológicos son una de las posibles causas de la enfermedad. Sin embargo, esta terapia no ha funcionado como un medio terapéutico radical. En el momento actual, esta enfermedad se está tratando sólo con métodos sintomáticos, tales como la administración oral, intravenosa, tópica e intraintestinal de agentes anti-inflamatorios, tales como hormonas esteroideas. Ninguno de los métodos terapéuticos existentes es capaz de alcanzar una desaparición rápida y completa de los principales síntomas gastrointestinales (por ejemplo, diarrea, heces sanguinolentas, dolor abdominal) en la fase activa de esta enfermedad. Ni puede producir un efecto suficiente para una transición rápida desde la fase activaalafasederemisión. Una terapia de acuerdo con esta invención hace posible lograr la total desaparición de los síntomas principales en un breve período de varios días y dar lugar a una transición más rápida alafasederemisión. Esta invención se refiere a una composición farmacéutica para el tratamiento de la colitis ulcerosa, que contiene factor XIII de coagulación de la sangre humana (en adelante designado como factor XIII) como ingrediente activo. Los preparados de factor XIII se han usado principalmente para tratar alteraciones en la curación de heridas y colitis seudo-membranosa asociada a antibióticos (Biopsed abstr. n y Haemostasis (1982), 11(4), ). En esta invención se ha encontrado que el factor XIII cura la colitis ulcerosa. Este hallazgo ha conducido a la realización de la invención. La existencia del factor XIII fue sugerida por primera vez por Robbins en En los primeros días se le llamótambién factor estabilizante de fibrina, fibrinasa o transglutaminasa del plasma, pero, después de los estudios de Lai y de Lorand et al., se adoptó el nombre de factor XIII como su nombre oficial en el Congreso de la International Society on Thrombosis and Haemostasis en Se observa comúnmente en el plasma, la placenta, etc. Actúa como una transaminasa, que es activada por trombina y Ca 2+, y forma puentes de entrecruzamiento entre las moléculas de fibrina Estos puentes de entrecruzamiento se propagan en un fuerte retículo de fibrina, que es tolerablefrenteanoxasfísicas y a estímulos químicos. Además de este efecto estabilizante de la fibrina, se ha demostrado que el factor XIII desempeña también un papel importante en el proceso de curación de heridas; esto es, forma puentes de entrecruzamiento entre las moléculas de fibrina y de fibronectina, y promueve la proliferación de fibroblastos y la formación de epidermis. Los preparados de factor XIII han tenido ya un amplio uso como agente terapéutico para perturbaciones en la curación de heridas, etc. El número de pacientes tratados con ellos en diversos países ha excedido ya de.000. Esta acumulación de experiencia clínica asegura que están totalmente exentos de efectos colaterales y de toxicidad, si se usan a la dosis usual de a 0 unidades/g de peso corporal. Los siguientes son resultados detallados de ensayos clínicos, que demuestran claramente la efectividad del factor XIII en el tratamiento de la colitis ulcerosa: Caso1(mujer,3años, 43,0 g): esta paciente experimentó heces mucosanguinolentas y dolor abdominal por primera vez en Enero de En Enero de 1984, estos síntomas se presentaron de nuevo con una frecuencia de varias veces al día, y se hizo el diagnóstico de colitis ulcerosa total sobre la base de las observaciones por rayos X y por colonoscopia. Se empezó inmediatamente un tratamiento con g de salazosulfapiridina. Sin embargo, como la paciente desarrolló síntomas alérgicos, el medicamento se sustituyó por un antidiarreico, digestivo, etc., y se observó continuamente su condición. En Diciembre del mismo año, se detectó de nuevo sangre en las heces y se administró Predonine a una dosis de 1 mg por día. Después la paciente presentó uncursoclínico satisfactorio hasta Enero de 1986, cuando experimentó de nuevo heces mucosanguíneas y dolor abdominal. Se incrementó la dosis de Predonine a mg por día, pero esto no fue eficaz para ninguno de los dos síntomas. Por consiguiente, se administrócomo ensayo un concentrado de factor XIII según esta invención, por vía intravenosa, a una dosis diaria de 00 unidades, durante 3 días. El mucus macroscópico, la sangre en las heces y el dolor abdominal comenzaron a aliviarse al día siguiente de la última administración y desaparecieron completamente en la 2 ā semana posterior al tratamiento. La frecuencia cardiaca y la temperatura corporal también comenzaron a volver a la normalidad poco después del tratamiento y se normalizaron por completo una semana después de la última administración. Caso 2 (varón, 31 años, 37, g): alrededor de Mayo de 1984, este paciente comenzó a experimentar heces sanguinolentas y recibió el diagnóstico de colitis ulcerosa del lado izquierdo. Tratado con Predonine a una dosis intra-arterial de mg e hidrocortisona a una dosis intraintestinal de 0 mg por día, esta enfermedad remitió una vez aproximadamente en Abril de Tras esta condición, se mantuvo en observación, con una dosis de mantenimiento de salazosulfapiridina de g. No obstante, en Julio del mismo
3 año, se presentaron heces sueltas con una frecuencia de o 6 veces al día y dolor abdominal, con apreciación macroscópica de mucus y sangre en las heces. El examen colonoscópico reveló erosión y hemorragia por contacto en el recto y un ligero edema en la mucosa rectal. Se le administróporvía intravenosa el concentrado de factor XIII, a una dosis diaria de 00 unidades, durante 3 días consecutivos. El dolor abdominal comenzó a hacerse más ligero durante el período de tratamiento y desapareció porcom- pleto al día siguiente a la última administración. Disminuyó la frecuencia de las deposiciones, y el aspecto macroscópico de las heces cambió delaspecto mucoso anterior al tratamiento a uno normal. En el día 4 después del tratamiento, no se detectó sangre en las heces. El examen colonoscópico realizado el día 14 después del tratamiento demostró que habían desaparecido el edema y la erosión,yquesehabían hecho visibles las imágenes de los vasos sanguíneos, lo que indicaba una mejoría acusada. Caso 3 (mujer, 2 años, 0 g): esta paciente comenzó a quejarse de tendencia a la diarrea, distensión abdominal y dolor abdominal difuso a finales de Agosto de En Octubre del mismo año se diagnosticó colitis ulcerosa del lado izquierdo, sobre la base de las observaciones con rayos X y colonoscopia. En aquel momento, la colonoscopia reveló la desaparición de las imágenes observables de vasos sanguíneos en la región recto-sigmoidea, la presencia de edema erosivo de la mucosa, enrojecimiento y hemorragia, y la formación de pequeñas úlceras poco profundas, de forma irregular, lo que indicaba que la enfermedad estaba en la fase activa. A la paciente se le prohibió tomar alimentos y se llevó a cabo una hiperalimentación por vía intravenosa. El concentrado de factor XIII se administró porvía intravenosa durante 3 días, a una dosis diaria de 0 unidades. Durante este período de tratamiento comenzaron a aliviarse las heces sanguinolentas, la hemorragia siguiente a la defecación y la distensión abdominal. También mejoró el aspecto de las heces. Al día siguiente al tratamiento de 3 días, no se detectó sangre en las heces. Sin embargo, la paciente experimentó de nuevo dolor abdominal y heces sanguinolentas en el 4 día tras el tratamiento. Por consiguiente, se realizó de nuevo la administración intravenosa del concentrado de factor XIII, 0 unidades por día, durante 2 días. Esto condujo a la desaparición del dolor abdominal y de los otros síntomas abdominales en el 4 día tras el tratamiento, y a la no detección de sangre en las heces y la normalización del aspecto de las heces en el día posterior al tratamiento. El examen colonoscópico realizado 4 días después de la primera serie de tratamiento demostró quelosdaños de la mucosa estaban localizados en la parte media del colon sigmoideo y más distalmente, que la hemorragia espontánea se observaba sólo en áreas limitadas, aunque se apreció hemorragia por contacto debida a la succión en algunas regiones, y que la visibilidad de las vasos sanguíneos había mejorado notablemente. Estas observaciones colonoscópicas revelaron una mejoría clara en comparación con las observaciones antes del trata miento, lo que indicaba que la paciente estaba en proceso de curación, aunque hubiera habido una recurrencia de los síntomas clínicos. Caso 4 (varón, 4 años, 68 g): este paciente había estado mostrando tendencia a la diarrea. En Noviembre de 1986, un examen colonoscópico reveló alteraciones en la estructura de la mucosa, que se extendían al colon transverso, asícomoelevaciones similares a seudo-pólipos, hemorragia y enrojecimiento que se extendía por todo el colon sigmoideo. Al sospecharse una colitis ulcerosa, se administró porvía intravenosa el concentrado de factor XIII, a una dosis diaria de 00 unidades, durante 3 días. La diarrea sanguinolenta y el dolor abdominal comenzaron a aliviarse al 2 día de tratamiento y se habían extinguido por completo en el día3después del final del tratamiento. El examen colonoscópico llevado a cabo 1 semana después de la última administración reveló quese habían detenido los espasmos de la mucosa, que se extendían al colon sigmoideo, y la hemorragia, aunque estaba aún presente un pequeño número de seudopólipos. Procedimiento para producir el concentrado de factor XIII Los preparados de factor XIII se producen a partir de placenta o de plasma humanos, por métodos bien conocidos. Un ejemplo de los métodos de preparación, usando placenta humana como materia prima, es como sigue: Se congelan las placentas y se trituran en pequeños trozos. A los trozos pequeños de placentas se les añade una solución de NaCl, se agita y se centrifuga para recoger la fracción sobrenadante I. Después de comprobar por inmunoensayo enzimático que esta fracción sobrenadante I está exentadeantígeno HBs, se le añade una solución de Rivanol y se recoge el precipitado II, quecontieneelfactorxiii.después de lavar el precipitado, se le añade una solución de NaCl que contiene EDTA (ácido etilendiamin-tetracético) y se agita. Se eliminan las sustancias no disueltas (precipitado III) y se obtiene la fracción sobrenadante III. Después se le añade a la fracción sobrenadante III una solución de cloruro de N-cetilpiridinio, para precipitar las proteínas y mucopolisacáridos contaminantes. A la fracción sobrenadante IV asíobtenidaseañade una solución de Rivanol y se genera el precipitado V, que contiene el factor XIII. A este precipitado V se le añade una solución de NaCl que contiene EDTA, se agita y se eliminan las sustancias no disueltas (precipitado VI) para obtener la fracción sobrenadante VI. A la fracción sobrenadante VI se le añade sulfato amónico, para generar el precipitado VII, que contiene el factor XIII. Al precipitado VII se le añade una solución de EDTA y se dializa frente a tampón Tris-HCl que contiene EDTA y azida de sodio. Después de ajustar el ph, se elimina el precipitado VIII y se somete la fracción sobrenadante VIII a filtración sobre gel, para recoger las fracciones activas. A las fracciones se les añade sulfato amónico y se recoge el precipitado IX, que contiene el factor XIII. Se disuelve este precipitado IX en un tampón Tris-HCl que contiene EDTA, se dializa frente al mismo tampón y se ajusta el ph, para recoger un precipitado que contiene el factor XIII en forma de euglobu- 3
4 lina. Se disuelve el precipitado de euglobulina en una solución de NaCl que contiene EDTA y se añaden ácido amino-acético y sacarosa. Después se añade sulfato amónico para generar el precipitado X, que contiene el factor XIII, y este precipitado X se disuelve en una solución de NaCl que contiene EDTA y se dializa frente a la misma solución. Se ajusta la concentración del factor XIII empleando una solución de NaCl que contiene glucosa y albúmina de suero humano. Se somete esta solución a una filtración estéril, se dosifica en viales de vidrio y se liofiliza. Además de por el método de fraccionamiento antes mencionado, el factor XIII se puede producir también por ingeniería genética. Los preparados de factor XIII según esta invención comprenden todos los preparados de factor XIII producidos por cualquier método posible, incluyendo los métodos de fraccionamiento y los métodos de ingeniería genética. Puesto que los preparados de factor XIII obtenidos por métodos de fraccionamiento pueden posiblemente contener virus de hepatitis, virus del SIDA, etc., es deseable inactivar estos virus por tratamiento térmico o por cualquier otro medio. El tratamiento térmicosellevaacabocomosigue: se disuelve el precipitado, que contiene el factor XIII en forma de euglobulina, en una solución de NaCl que contiene EDTA y la solución se deja en reposo a aproximadamente C durante unas horas. Durante esta incubación, se pueden usar como estabilizantes aminoácidos (por ejemplo, glicina), hidrocarbonatos, etc. Un preparado de factor XIII liofilizado se puede usar directamente como una inyección, simplemente disolviéndolo en agua destilada para inyectables (JP, farmacopea japonesa), etc., antes de su uso. La concentración de factor XIII en la inyección debe ser de aproximadamente unidades/4 ml. La inyección se puede administrar por víaintravenosaointramuscular. Nosehainformado de ningún cambio inducido por mezcla con otros agentes. Sin embargo, por lo general se considera que debe evitarse la administración del factor XIII mezclado con otros agentes. Del modo más deseable, el factor XIII se debe administrar por inyección, pero otras formas posibles de dosificación incluyen la vía parenteral, tales como microcápsulas e implantos, vía oral, tales como líquidos, tabletas y cápsulas, y supositorios. Dosis y período de tratamiento La dosis diaria necesaria para promover suficientemente la actividad del factor XIII en pacientes con colitis ulcerosa en fase activa es de aproximadamente 000 unidades o menos. El margen de dosis óptima es de 0 a 00 unidades diarias. La administración se debe continuar hasta que desaparezcan virtualmente los síntomas del paciente, es decir, de 3 a díasenloscasoshabituales. En los casos en que los síntomas recurren, se puede reiniciar la administración en cualquier momento. Ejemplo: factor XIII, dosificado en viales de unidades cada uno y liofilizado, se disolvió en 4 ml de agua destilada para inyectables (JP), para preparar una inyección de factor XIII
5 REIVINDICACIONES 1. Uso del factor XIII de coagulación de la sangre humana para la producción de una composición farmacéutica para el tratamiento de la colitis ulcerosa NOTA INFORMATIVA: Conforme a la reserva del art del Convenio de Patentes Europeas (CPE) y a la Disposición Transitoria del RD 2424/1986, de de octubre, relativo a la aplicación del Convenio de Patente Europea, las patentes europeas que designen a España y solicitadas antes del , no producirán ningún efecto en España en la medida en que confieran protección a productos químicos y farmacéuticos como tales. Esta información no prejuzga que la patente esté o no incluída en la mencionada reserva.
11 knúmero de publicación: 2 150 566. 51 kint. Cl. 7 : A61K 38/26. k 72 Inventor/es: Dupre, John. k 74 Agente: Manresa Val, Manuel
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 150 566 51 kint. Cl. 7 : A61K 38/26 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 95917874.0
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 150 566 51 kint. Cl. 7 : A61K 38/26 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 95917874.0
11 Número de publicación: 2 207 542. 51 Int. Cl. 7 : B23K 9/10. 72 Inventor/es: Mela, Franco. 74 Agente: Ponti Sales, Adelaida
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 207 542 51 Int. Cl. 7 : B23K 9/10 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00954462.8 86 Fecha de
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 207 542 51 Int. Cl. 7 : B23K 9/10 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 00954462.8 86 Fecha de
11 knúmero de publicación: 2 176 384. 51 kint. Cl. 7 : A41G 3/00. k 72 Inventor/es: Ragazzi, Cesare. k 74 Agente: Ponti Sales, Adelaida
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 176 384 1 Int. Cl. 7 : A41G 3/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 96114776.6 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 176 384 1 Int. Cl. 7 : A41G 3/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 96114776.6 86 Fecha de presentación:
11 knúmero de publicación: 2 108 710. 51 kint. Cl. 6 : A61M 1/00. k 72 Inventor/es: Masaki, Nobuyuki. k 74 Agente: Carpintero López, Francisco
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 108 710 51 kint. Cl. 6 : A61M 1/00 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 91900941.5
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 108 710 51 kint. Cl. 6 : A61M 1/00 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 91900941.5
DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett
 DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett Qué es el esófago de Barrett? El esófago de Barrett es un estado precanceroso que afecta al revestimiento del esófago, el tubo que, al tragar, transporta
DISTRIBUIDO POR: FABRICADO POR: Esófago de Barrett Qué es el esófago de Barrett? El esófago de Barrett es un estado precanceroso que afecta al revestimiento del esófago, el tubo que, al tragar, transporta
11 knúmero de publicación: 2 138 197. 51 kint. Cl. 6 : A61K 7/06. k 72 Inventor/es: Navarro, Roger y. k 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 138 197 1 Int. Cl. 6 : A61K 7/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9914382.7 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 138 197 1 Int. Cl. 6 : A61K 7/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9914382.7 86 Fecha de presentación
11 knúmero de publicación: 2 144 127. 51 kint. Cl. 7 : B07C 5/342. k 72 Inventor/es: Wahlquist, Anders. k 74 Agente: Esteban Pérez-Serrano, M ā Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 144 127 1 Int. Cl. 7 : B07C /342 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99331.6 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 144 127 1 Int. Cl. 7 : B07C /342 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99331.6 86 Fecha de presentación
11 knúmero de publicación: 2 164 289. 51 kint. Cl. 7 : A62C 13/66. k 72 Inventor/es: Neumeir, Anton. k 74 Agente: Botella Reyna, Antonio
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 289 1 kint. Cl. 7 : A62C 13/66 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 97119016.0
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 164 289 1 kint. Cl. 7 : A62C 13/66 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 97119016.0
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
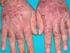 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
Índice de contenidos DESCRIPCIÓN GENERAL. Bicarbonato de Sodio (Por vía oral)
 Bicarbonato de Sodio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El bicarbonato de
Bicarbonato de Sodio (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El bicarbonato de
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
X-Plain La pancreatitis Sumario
 X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
k 11 N. de publicación: ES 2 056 975 k 51 Int. Cl. 5 : C02F 1/66
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 06 97 k 1 Int. Cl. : C02F 1/66 A23L 1/4 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 892771.6 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 06 97 k 1 Int. Cl. : C02F 1/66 A23L 1/4 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 892771.6 86
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA. 2. ANTES DE USAR Minoxidil Viñas 5% solución cutánea
 1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
1. QUÉ ES Minoxidil Viñas 5% solución cutánea Y PARA QUÉ SE UTILIZA Minoxidil Viñas 5% es una solución para uso cutáneo. La solución es transparente, incolora o muy débilmente amarillenta. Se presenta
Aire ambiente: No se recogieron muestras en esta comunidad.
 Ejercicio en grupo: A) Introducción En este ejercicio, los participantes calcularán e interpretarán la exposición a arsénico de los residentes de una comunidad rural en una región que tiene, de forma natural,
Ejercicio en grupo: A) Introducción En este ejercicio, los participantes calcularán e interpretarán la exposición a arsénico de los residentes de una comunidad rural en una región que tiene, de forma natural,
11 knúmero de publicación: 2 187 100. 51 kint. Cl. 7 : A41D 31/00. k 72 Inventor/es: Schäfer, Werner; k 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 187 0 1 Int. Cl. 7 : A41D 31/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99111829.0 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 187 0 1 Int. Cl. 7 : A41D 31/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99111829.0 86 Fecha de presentación:
11 knúmero de publicación: 2 147 278. 51 kint. Cl. 7 : E04D 5/10
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 147 278 1 kint. Cl. 7 : E04D /10 E04D /14 E01D 19/08 B32B 7/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número de solicitud
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 147 278 1 kint. Cl. 7 : E04D /10 E04D /14 E01D 19/08 B32B 7/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número de solicitud
11 kn. de publicación: ES 2 075 192. 51 kint. Cl. 6 : B29C 55/06
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 07 192 1 kint. Cl. 6 : B29C /06 //B29K 27/18 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90890096.2
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 07 192 1 kint. Cl. 6 : B29C /06 //B29K 27/18 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90890096.2
Guía del paciente. Braquiterapia: El mejor modo de tratar el cáncer. Porque la vida es para vivirla
 Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
Guía del paciente Braquiterapia: El mejor modo de tratar el cáncer Porque la vida es para vivirla El objetivo de este folleto es ayudar a aquellas personas que han recibido un diagnóstico de cáncer, así
ENSAYOS CLÍNICOS. Guía para padres y tutores
 ENSAYOS CLÍNICOS Guía para padres y tutores PARA PADRES Y TUTORES Los niños no son pequeños adultos En este folleto encontrará información sobre los ensayos clínicos en general y los ensayos clínicos en
ENSAYOS CLÍNICOS Guía para padres y tutores PARA PADRES Y TUTORES Los niños no son pequeños adultos En este folleto encontrará información sobre los ensayos clínicos en general y los ensayos clínicos en
11 Número de publicación: 2 321 587. 51 Int. Cl.: 72 Inventor/es: Kunigita, Hisayuki. 74 Agente: Elzaburu Márquez, Alberto
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 321 587 51 Int. Cl.: G06T 11/60 (2006.01) G06T 15/00 (2006.01) G06Q 30/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Número
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 321 587 51 Int. Cl.: G06T 11/60 (2006.01) G06T 15/00 (2006.01) G06Q 30/00 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Número
11 knúmero de publicación: 2 141 193. 51 kint. Cl. 6 : B42F 11/02
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 141 193 1 Int. Cl. 6 : B42F 11/02 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 94201617.1 86 Fecha de
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 141 193 1 Int. Cl. 6 : B42F 11/02 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 94201617.1 86 Fecha de
k 11 N. de publicación: ES 2 042 790 k 51 Int. Cl. 5 : A47G 21/04 k 73 Titular/es: SA G.A.D. k 72 Inventor/es: Rambin, Christian
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 042 790 1 Int. Cl. : A47G 21/04 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 88403164.2 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 042 790 1 Int. Cl. : A47G 21/04 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 88403164.2 86 Fecha de presentación
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
11 knúmero de publicación: 2 141 353. 51 kint. Cl. 6 : F16H 37/04. Número de solicitud europea: 95919718.7 86 kfecha de presentación : 12.05.
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 141 33 1 kint. Cl. 6 : F16H 37/04 F16H 7/02 B2J 18/00 B2J 9/ H02K 7/116 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 141 33 1 kint. Cl. 6 : F16H 37/04 F16H 7/02 B2J 18/00 B2J 9/ H02K 7/116 12 k TRADUCCION DE PATENTE EUROPEA T3 86 k Número
VIH. Conozca los Factores. Respuestas a 10 Preguntas Importantes Sobre VIH/SIDA. Departmento de Salud Pública de Illinois
 VIH Conozca los Factores Respuestas a 10 Preguntas Importantes Sobre VIH/SIDA Departmento de Salud Pública de Illinois 1 2 3 4 Qué es el VIH? El VIH se refiere al virus de inmunodeficiencia humano. El
VIH Conozca los Factores Respuestas a 10 Preguntas Importantes Sobre VIH/SIDA Departmento de Salud Pública de Illinois 1 2 3 4 Qué es el VIH? El VIH se refiere al virus de inmunodeficiencia humano. El
11 knúmero de publicación: 2 134 021. 51 kint. Cl. 6 : A61M 5/32. k 73 Titular/es: NOVO NORDISK A/S. k 72 Inventor/es: Smedegaard, Jorgen K.
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 134 021 1 Int. Cl. 6 : A61M /32 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9694196.7 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 134 021 1 Int. Cl. 6 : A61M /32 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9694196.7 86 Fecha de presentación
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. Denominación del medicamento ESTRUMATE 2. Composición cualitativa y cuantitativa Cloprostenol (sódico)...0,0250 g (principio activo)* Ácido cítrico anhidro...0,056
k 11 N. de publicación: ES 2 046 714 k 51 Int. Cl. 5 : B60C 5/08 k 72 Inventor/es: Sicard, Alain k 74 Agente: Esteban Pérez-Serrano, M ā Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 046 714 1 Int. Cl. : BC /08 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 900164.1 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 046 714 1 Int. Cl. : BC /08 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 900164.1 86 Fecha de presentación
Descubrimiento de mineral para el tratamiento del cáncer y numerosas enfermedades
 Descubrimiento de mineral para el tratamiento del cáncer y numerosas enfermedades CONCLUSIONES Las conclusiones de los estudios científicos sorprendentes y las ventajas pueden indicarse como siguen: Modificación
Descubrimiento de mineral para el tratamiento del cáncer y numerosas enfermedades CONCLUSIONES Las conclusiones de los estudios científicos sorprendentes y las ventajas pueden indicarse como siguen: Modificación
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
TRATAMIENTOS DE VANGUARDIA EN GINECOLOGÍA
 TRATAMIENTOS DE VANGUARDIA EN GINECOLOGÍA Histerectomía por videolaparoscopía La histerectomía es la extracción quirúrgica del útero. Es el segundo tipo de cirugía mayor más común entre las mujeres en
TRATAMIENTOS DE VANGUARDIA EN GINECOLOGÍA Histerectomía por videolaparoscopía La histerectomía es la extracción quirúrgica del útero. Es el segundo tipo de cirugía mayor más común entre las mujeres en
LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus
 LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus Lea todo el prospecto detenidamente porque contiene información importante para Usted. Este medicamento puede obtenerse sin receta para el tratamiento
LACTEOL POLVO PARA SUSPENSIÓN ORAL Lactobacillus acidophilus Lea todo el prospecto detenidamente porque contiene información importante para Usted. Este medicamento puede obtenerse sin receta para el tratamiento
ENFERMEDAD DIVERTICULAR
 ENFERMEDAD DIVERTICULAR La enfermedad diverticular es un proceso muy común que afecta aproximadamente al 50% de la población mayor de 60 años, cifra que aumenta con la edad. Afecta por igual a hombres
ENFERMEDAD DIVERTICULAR La enfermedad diverticular es un proceso muy común que afecta aproximadamente al 50% de la población mayor de 60 años, cifra que aumenta con la edad. Afecta por igual a hombres
Revisión del Universo de empresas para la Estimación de los Datos Del Mercado Español de Investigación de Mercados y Opinión.
 Revisión del Universo de empresas para la Estimación de los Datos Del Mercado Español de Investigación de Mercados y Opinión. (Enrique Matesanz y Vicente Castellanos, Año 2011) Según la experiencia acumulada
Revisión del Universo de empresas para la Estimación de los Datos Del Mercado Español de Investigación de Mercados y Opinión. (Enrique Matesanz y Vicente Castellanos, Año 2011) Según la experiencia acumulada
11 Número de publicación: 2 214 889. 51 Int. Cl. 7 : A45C 13/18. 72 Inventor/es: Haller, Hubert. 74 Agente: Lehmann Novo, María Isabel
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 889 51 Int. Cl. 7 : A45C 13/18 E05G 1/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99948973.5 86
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 214 889 51 Int. Cl. 7 : A45C 13/18 E05G 1/00 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 99948973.5 86
11 knúmero de publicación: 2 158 146. 51 kint. Cl. 7 : A61K 31/59
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 18 146 1 kint. Cl. 7 : A61K 31/9 //(A61K 31/9 A61K 31:12) 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 18 146 1 kint. Cl. 7 : A61K 31/9 //(A61K 31/9 A61K 31:12) 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea:
11 knúmero de publicación: 2 163 122. 51 kint. Cl. 7 : B23K 26/12. k 72 Inventor/es: Faerber, Mark. k 74 Agente: Carpintero López, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 163 122 1 Int. Cl. 7 : B23K 26/12 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9790148.9 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 163 122 1 Int. Cl. 7 : B23K 26/12 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9790148.9 86 Fecha de presentación:
11 knúmero de publicación: 2 173 702. 51 kint. Cl. 7 : A01G 25/16
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 173 702 1 Int. Cl. 7 : A01G 2/16 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9973.3 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 173 702 1 Int. Cl. 7 : A01G 2/16 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9973.3 86 Fecha de presentación:
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA
 PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
PROCEDIMIENTO DE ACTUACIÓN PARA EL SEGUIMIENTO DE PERSONAS DESPLAZADAS A LOS PAÍSES DE ÁFRICA OCCIDENTAL AFECTADOS POR EL BROTE DE ÉBOLA 22.05.2015 Este procedimiento de actuación se enmarca en el desarrollo
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Qué es la menopausia y Cuáles son sus etapas
 Qué es la menopausia y Cuáles son sus etapas Nociones básicas que debes conocer Contenido Contenido... 2 Conceptos básicos sobre la menopausia que se deben conocer... 3 Qué es la menopausia?... 3 La menopausia
Qué es la menopausia y Cuáles son sus etapas Nociones básicas que debes conocer Contenido Contenido... 2 Conceptos básicos sobre la menopausia que se deben conocer... 3 Qué es la menopausia?... 3 La menopausia
ENFERMEDAD DE CROHN. Qué es la enfermedad de crohn?
 ENFERMEDAD DE CROHN Qué es la enfermedad de crohn? La enfermedad de Crohn es un proceso inflamatorio que afecta primariamente al tracto intestinal, aunque puede afectar a cualquier parte del aparato digestivo,
ENFERMEDAD DE CROHN Qué es la enfermedad de crohn? La enfermedad de Crohn es un proceso inflamatorio que afecta primariamente al tracto intestinal, aunque puede afectar a cualquier parte del aparato digestivo,
TRATAMIENTO DEL ENVENENAMIENTO POR RODENTICIDAS ANTICOAGULANTES
 TRATAMIENTO DEL ENVENENAMIENTO POR RODENTICIDAS ANTICOAGULANTES TRATAMIENTO DEL ENVENENAMIENTO POR RODENTICIDAS ANTICOAGULANTES G u í a P a r a V e t e r i n a r i o s CONTENIDOS Introducción...... 1 Modos
TRATAMIENTO DEL ENVENENAMIENTO POR RODENTICIDAS ANTICOAGULANTES TRATAMIENTO DEL ENVENENAMIENTO POR RODENTICIDAS ANTICOAGULANTES G u í a P a r a V e t e r i n a r i o s CONTENIDOS Introducción...... 1 Modos
DIARREA Y ESTREÑIMIENTO LIZETH CUCHIGAY DEYSSON GARZÓN JULIETH MONTAÑA SANDRA BERNAL ALEJANDRA CONTRERAS FUNDACION UNIVERSITARIA DE SAN GIL UNISANGIL
 DIARREA Y ESTREÑIMIENTO LIZETH CUCHIGAY DEYSSON GARZÓN JULIETH MONTAÑA SANDRA BERNAL ALEJANDRA CONTRERAS FUNDACION UNIVERSITARIA DE SAN GIL UNISANGIL FACULTAD DE CIENCIAS DE LA SALUD ENFERMERIA YOPAL 2014
DIARREA Y ESTREÑIMIENTO LIZETH CUCHIGAY DEYSSON GARZÓN JULIETH MONTAÑA SANDRA BERNAL ALEJANDRA CONTRERAS FUNDACION UNIVERSITARIA DE SAN GIL UNISANGIL FACULTAD DE CIENCIAS DE LA SALUD ENFERMERIA YOPAL 2014
11 Número de publicación: 2 200 458. 51 Int. Cl. 7 : B42D 15/02. 72 Inventor/es: Ziggel, Carsten. 74 Agente: Roeb Diaz-Álvarez, Maria
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 0 48 1 Int. Cl. 7 : B42D 1/02 G11B 7/24 G11B 23/ 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 991239.2 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 0 48 1 Int. Cl. 7 : B42D 1/02 G11B 7/24 G11B 23/ 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 991239.2 86 Fecha
11 kn. de publicación: ES 2 082 185. 51 kint. Cl. 6 : G06K 7/10. k 72 Inventor/es: Bengtsson, Kjell. k 74 Agente: Alvarez López, Fernando
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 082 18 1 Int. Cl. 6 : G06K 7/ 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9180072.9 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 N. de publicación: ES 2 082 18 1 Int. Cl. 6 : G06K 7/ 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9180072.9 86 Fecha de presentación
Normalización de soluciones de NaOH 0,1N y HCl 0,1N.
 Laboratorio N 1: Normalización de soluciones de NaOH 0,1N y HCl 0,1N. Objetivos: - Determinar la normalidad exacta de una solución de hidróxido de sodio aproximadamente 0,1 N, utilizando biftalato de potasio
Laboratorio N 1: Normalización de soluciones de NaOH 0,1N y HCl 0,1N. Objetivos: - Determinar la normalidad exacta de una solución de hidróxido de sodio aproximadamente 0,1 N, utilizando biftalato de potasio
11 knúmero de publicación: 2 190 546. 51 kint. Cl. 7 : A46B 11/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 190 46 1 kint. Cl. 7 : A46B 11/00 F16K 1/06 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 9794997.
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 190 46 1 kint. Cl. 7 : A46B 11/00 F16K 1/06 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 9794997.
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO. EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
FICHA TÉCNICA 1.- NOMBRE DEL MEDICAMENTO EZOR gotas orales en solución. 2.- COMPOSICION CUALITATIVA Y CUANTITATIVA Cada ml (que equivale aproximadamente a 25 gotas) contiene como principio activo: Picosulfato
23.3.2011 Diario Oficial de la Unión Europea L 77/25
 23.3.2011 Diario Oficial de la Unión Europea L 77/25 REGLAMENTO (UE) N o 284/2011 DE LA COMISIÓN de 22 de marzo de 2011 por el que se establecen condiciones específicas y procedimientos detallados para
23.3.2011 Diario Oficial de la Unión Europea L 77/25 REGLAMENTO (UE) N o 284/2011 DE LA COMISIÓN de 22 de marzo de 2011 por el que se establecen condiciones específicas y procedimientos detallados para
11 knúmero de publicación: 2 123 095. 51 kint. Cl. 6 : A63F 3/06. k 72 Inventor/es: Behm, William Frederick y. k 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 123 09 1 Int. Cl. 6 : A63F 3/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 942827.4 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 123 09 1 Int. Cl. 6 : A63F 3/06 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 942827.4 86 Fecha de presentación
Sistema de Gestión Académica TESEO. Revisión 1.0. Servicio de Informática Área de Gestión (GESTIÓN DE RESÚMENES DE TESIS DOCTORALES)
 Sistema de Gestión Académica TESEO (GESTIÓN DE RESÚMENES DE TESIS DOCTORALES) Revisión 1.0 Servicio de Informática Área de Gestión Mayo de 2004 INDICE INDICE... 1 1 Introducción... 1 2 Procedimiento....
Sistema de Gestión Académica TESEO (GESTIÓN DE RESÚMENES DE TESIS DOCTORALES) Revisión 1.0 Servicio de Informática Área de Gestión Mayo de 2004 INDICE INDICE... 1 1 Introducción... 1 2 Procedimiento....
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Consulte con su especialista si se encuentra en alguno de los siguientes casos:
 Lincomicina (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
Lincomicina (Por via oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL Las lincomicinas corresponden
11 knúmero de publicación: 2 111 939. 51 kint. Cl. 6 : A01K 63/00. k 72 Inventor/es: Tran, Ngoc-Anh. k 74 Agente: Morgades Manonelles, Juan Antonio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 111 939 1 Int. Cl. 6 : A01K 63/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9492018.1 86 Fecha de presentación
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 111 939 1 Int. Cl. 6 : A01K 63/00 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9492018.1 86 Fecha de presentación
11 knúmero de publicación: 2 152 305. 51 kint. Cl. 7 : A61K 31/575. k 72 Inventor/es: Purser, Douglas Barrie y
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 152 305 51 kint. Cl. 7 : A61K 31/575 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 94908213.5
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 knúmero de publicación: 2 152 305 51 kint. Cl. 7 : A61K 31/575 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 94908213.5
Rheomacrodex 10% Salino solución para perfusión
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Rheomacrodex 10% Salino solución para perfusión Dextrano 40 / Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Rheomacrodex 10% Salino solución para perfusión Dextrano 40 / Cloruro de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Aspirina, Bicarbonato de Sodio y Ácido Cítrico para la Inhibición de la Agregación de Plaquetas (Por vía o
 Aspirina, Bicarbonato de Sodio y Ácido Cítrico para la Inhibición de la Agregación de Plaquetas (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS
Aspirina, Bicarbonato de Sodio y Ácido Cítrico para la Inhibición de la Agregación de Plaquetas (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS
Atletas y Medicamentos Preguntas y respuestas
 Atletas y Medicamentos Preguntas y respuestas Qué puedo hacer para evitar un test positivo por tomar un medicamento? Existen dos formas para obtener un medicamento: por prescripción médica o bien, en una
Atletas y Medicamentos Preguntas y respuestas Qué puedo hacer para evitar un test positivo por tomar un medicamento? Existen dos formas para obtener un medicamento: por prescripción médica o bien, en una
Interpretación CINIIF 12 Acuerdos de Concesión de Servicios
 Interpretación CINIIF 12 Acuerdos de Concesión de Servicios Referencias Marco Conceptual para la Preparación y Presentación de Estados Financieros NIIF 1 Adopción por Primera vez de las Normas Internacionales
Interpretación CINIIF 12 Acuerdos de Concesión de Servicios Referencias Marco Conceptual para la Preparación y Presentación de Estados Financieros NIIF 1 Adopción por Primera vez de las Normas Internacionales
Cancer Epitelial de los Ovarios
 Cancer Epitelial de los Ovarios El cáncer epitelial de los ovarios es una afección por la cual se forman células malignas (cancerosas) en el tejido que cubre el ovario. Los ovarios son un par de órganos
Cancer Epitelial de los Ovarios El cáncer epitelial de los ovarios es una afección por la cual se forman células malignas (cancerosas) en el tejido que cubre el ovario. Los ovarios son un par de órganos
ABORTO EN LAS PRÀCTICAS ESPECIALIZADAS
 ABORTO EN LAS PRÀCTICAS ESPECIALIZADAS Lise Helmsøe-Zinck Especialista de Ginecología y Obstetricia Søborg Hovedgade 221, 2860 Søborg Teléfono: 60 42 26 13 ABORTO EN LAS PRÀCTICAS ESPECIALIZADAS Antes
ABORTO EN LAS PRÀCTICAS ESPECIALIZADAS Lise Helmsøe-Zinck Especialista de Ginecología y Obstetricia Søborg Hovedgade 221, 2860 Søborg Teléfono: 60 42 26 13 ABORTO EN LAS PRÀCTICAS ESPECIALIZADAS Antes
Los costos de las prácticas de MIP
 Si se hace una correlación entre el porcentaje de adopción (Tabla 7) y la frecuencia de importancia (Tabla 10), se observa que no existe una asociación significativa, lo cual sugiere que algunas prácticas
Si se hace una correlación entre el porcentaje de adopción (Tabla 7) y la frecuencia de importancia (Tabla 10), se observa que no existe una asociación significativa, lo cual sugiere que algunas prácticas
11 kn. de publicación: ES 2 076 061. 51 kint. Cl. 6 : B65D 1/02
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 076 061 1 kint. Cl. 6 : B6D 1/02 B29C 49/48 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 93917373.8
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 076 061 1 kint. Cl. 6 : B6D 1/02 B29C 49/48 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 93917373.8
El yoduro de sodio I 131 se usa para tratar una glándula tiroidea sobreactiva y ciertos tipos de cáncer de tiroides.
 Yoduro I 131 de Sodio (Terapéutico: Por vía oral) Indice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El
Yoduro I 131 de Sodio (Terapéutico: Por vía oral) Indice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL El
EXTRACCIÓN DE CAFEÍNA DEL CAFÉ
 10-11-2010 EXTRACCIÓN DE CAFEÍNA DEL CAFÉ Colegio de San Francisco de Paula Enrique Jacobo Díaz Montaña José Antonio Vázquez de la Paz Enrique Gómez-Álvarez Hernández 1ºBACHILLERATO-B Índice: Objetivos
10-11-2010 EXTRACCIÓN DE CAFEÍNA DEL CAFÉ Colegio de San Francisco de Paula Enrique Jacobo Díaz Montaña José Antonio Vázquez de la Paz Enrique Gómez-Álvarez Hernández 1ºBACHILLERATO-B Índice: Objetivos
3º Grado Educación Infantil Bilingüe Números. Método Singapur y F. Bravo E R
 MATEMÁTICAS PARA EDUCACIÓN INFANTIL N Enseñamos y aprendemos llos números:: Método Siingapur y Fernández Bravo,, Porr Clarra Garrcí ía,, Marrtta Gonzzál lezz y Crri isstti ina Lattorrrre.. Ú M E R O S
MATEMÁTICAS PARA EDUCACIÓN INFANTIL N Enseñamos y aprendemos llos números:: Método Siingapur y Fernández Bravo,, Porr Clarra Garrcí ía,, Marrtta Gonzzál lezz y Crri isstti ina Lattorrrre.. Ú M E R O S
Certificación de Productos Condiciones de certificación de calidad de playas
 Certificación de Productos Condiciones de Certificación de Calidad de Playas Clave EPPr13 1. OBJETIVO Página 1 de 5 Establecer las condiciones bajo las cuales el IMNC otorga, mantiene, amplia, reduce,
Certificación de Productos Condiciones de Certificación de Calidad de Playas Clave EPPr13 1. OBJETIVO Página 1 de 5 Establecer las condiciones bajo las cuales el IMNC otorga, mantiene, amplia, reduce,
k 11 N. de publicación: ES 2 030 155 k 51 Int. Cl. 5 : A61G 15/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 0 1 k 1 Int. Cl. : A61G 1/00 A61B 19/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 881222.2 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 0 1 k 1 Int. Cl. : A61G 1/00 A61B 19/02 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 881222.2 86
VPH. (Virus del Papiloma Humano) Respuestas a sus preguntas sobre el VPH y cómo se trata
 VPH (Virus del Papiloma Humano) Respuestas a sus preguntas sobre el VPH y cómo se trata Qué es el VPH? VPH significa Virus del Papiloma Humano. Es un virus que está en la piel y en ocasiones produce verrugas.
VPH (Virus del Papiloma Humano) Respuestas a sus preguntas sobre el VPH y cómo se trata Qué es el VPH? VPH significa Virus del Papiloma Humano. Es un virus que está en la piel y en ocasiones produce verrugas.
Información Financiera en Economías Hiperinflacionarias
 NIC 29 Norma Internacional de Contabilidad nº 29 Información Financiera en Economías Hiperinflacionarias Esta versión incluye las modificaciones resultantes de las NIIF nuevas y modificadas emitidas hasta
NIC 29 Norma Internacional de Contabilidad nº 29 Información Financiera en Economías Hiperinflacionarias Esta versión incluye las modificaciones resultantes de las NIIF nuevas y modificadas emitidas hasta
El palacio de la Alhambra: La primera expansión. El favor de los visires
 El palacio de la Alhambra: La primera expansión El favor de los visires Traducido al español por javche Esta expansión contiene cuatro módulos diferentes, que pueden combinarse individualmente o todos
El palacio de la Alhambra: La primera expansión El favor de los visires Traducido al español por javche Esta expansión contiene cuatro módulos diferentes, que pueden combinarse individualmente o todos
Alérgenos y reacciones alérgicas
 UNIDAD DIDÁCTICA 6 Alérgenos y reacciones alérgicas Se producen reacciones anormales del organismo en aquellas personas sensibles a determinadas sustancias. Según los causantes de la reacción, existen
UNIDAD DIDÁCTICA 6 Alérgenos y reacciones alérgicas Se producen reacciones anormales del organismo en aquellas personas sensibles a determinadas sustancias. Según los causantes de la reacción, existen
La cobertura de recetas médicas bajo la Parte A, Parte B y Parte D de Medicare
 RESEÑA Información que pueden usar los socios sobre: La cobertura de recetas médicas bajo la Parte A, Parte B y Parte D de Medicare Revisada en enero 2011 Esta reseña brinda información sobre la cobertura
RESEÑA Información que pueden usar los socios sobre: La cobertura de recetas médicas bajo la Parte A, Parte B y Parte D de Medicare Revisada en enero 2011 Esta reseña brinda información sobre la cobertura
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria
 TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
TERAPIA BIOLÓGICA REMICADE es un anticuerpo monoclonal quimérico que suprime la actividad inflamatoria INDICACIONES ARTRITIS REUMATOIDE ESPONDILITIS ANQUILOSANTE ENFERMEDAD DE CROHN Y COLITIS ULCEROSA
X-Plain Glaucoma Sumario
 X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
X-Plain Glaucoma Sumario El glaucoma es un grupo de enfermedades que afectan al ojo y que pueden llevar a la ceguera si no se recibe tratamiento adecuado. El glaucoma de ángulo abierto, la forma de glaucoma
15 Respuestas Acerca de La Influenza (la gripe)
 15 Respuestas Acerca de La Influenza (la gripe) (Todo lo que necesita saber para participar en la discusión) Compromiso Público Acerca de la Influenza Influenza (la gripe) 1. Qué es la influenza (la gripe)?
15 Respuestas Acerca de La Influenza (la gripe) (Todo lo que necesita saber para participar en la discusión) Compromiso Público Acerca de la Influenza Influenza (la gripe) 1. Qué es la influenza (la gripe)?
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
11 kn. de publicación: ES 2 078 638. 51 kint. Cl. 6 : F02F 11/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 078 638 1 kint. Cl. 6 : F02F 11/00 B23P 11/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 921213.9
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 078 638 1 kint. Cl. 6 : F02F 11/00 B23P 11/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 921213.9
CMT. CARACTERÍSTICAS DE LOS MATERIALES
 LIBRO: PARTE: TÍTULO: CAPÍTULO: CMT. CARACTERÍSTICAS DE LOS MATERIALES 2. MATERIALES PARA ESTRUCTURAS 02. Materiales para Concreto Hidráulico 003. Calidad del Agua para Concreto Hidráulico A. CONTENIDO
LIBRO: PARTE: TÍTULO: CAPÍTULO: CMT. CARACTERÍSTICAS DE LOS MATERIALES 2. MATERIALES PARA ESTRUCTURAS 02. Materiales para Concreto Hidráulico 003. Calidad del Agua para Concreto Hidráulico A. CONTENIDO
11 knúmero de publicación: 2 175 666. 51 kint. Cl. 7 : A61K 35/78. k 72 Inventor/es: Stoica, Felician Titus. k 74 Agente: Curell Suñol, Marcelino
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 17 666 1 Int. Cl. 7 : A61K 3/78 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9890443.2 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 17 666 1 Int. Cl. 7 : A61K 3/78 12 TRADUCCION DE PATENTE EUROPEA T3 86 Número de solicitud europea: 9890443.2 86 Fecha de presentación:
INFORMACION PARA PERSONAS CON DIABETES TIPO2
 INFORMACION PARA PERSONAS CON DIABETES TIPO2 Pag 3 Qué es la retinopatía diabética? Pag 4 Frecuencia Pag 5 Síntomas Pag 6 Diagnóstico Pag 7 Tratamiento Pag 9 Otras enfermedades 2 Qué es la retinopatía
INFORMACION PARA PERSONAS CON DIABETES TIPO2 Pag 3 Qué es la retinopatía diabética? Pag 4 Frecuencia Pag 5 Síntomas Pag 6 Diagnóstico Pag 7 Tratamiento Pag 9 Otras enfermedades 2 Qué es la retinopatía
Reglamento Interno. Programa de Pregrado. Universidad Externado de Colombia Facultad de Administración de Empresas
 Reglamento Interno Programa de Pregrado Universidad Externado de Colombia Facultad de Administración de Empresas C O N T E N I D O CAPÍTULO I De la Organización... 5 CAPÍTULO II Matrícula... 6 CAPÍTULO
Reglamento Interno Programa de Pregrado Universidad Externado de Colombia Facultad de Administración de Empresas C O N T E N I D O CAPÍTULO I De la Organización... 5 CAPÍTULO II Matrícula... 6 CAPÍTULO
Qué son las vacunas y cómo actúan?
 Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
EN BUSCA DE INDICADORES NATURALES
 EN BUSCA DE INDICADORES NATURALES Introducción: Ana Belén Domingo COLEGIO LA PURÍSIMA Torrent Los indicadores son sustancias que, mediante un cambio de color, nos ayudan a identificar si las sustancias
EN BUSCA DE INDICADORES NATURALES Introducción: Ana Belén Domingo COLEGIO LA PURÍSIMA Torrent Los indicadores son sustancias que, mediante un cambio de color, nos ayudan a identificar si las sustancias
11 kn. de publicación: ES 2 099 076. 51 kint. Cl. 6 : A61K 31/40
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 099 076 1 kint. Cl. 6 : A61K 31/ A61K 31/46 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90971.1
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 099 076 1 kint. Cl. 6 : A61K 31/ A61K 31/46 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90971.1
11 Número de publicación: 2 203 094. 51 Int. Cl. 7 : B60N 2/02. 74 Agente: Justo Vázquez, Jorge Miguel de
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 3 094 1 Int. Cl. 7 : BN 2/02 A47C 1/024 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 9991184.0 86 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 3 094 1 Int. Cl. 7 : BN 2/02 A47C 1/024 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud: 9991184.0 86 Fecha de presentación:
1. Observaciones para la cumplimentación de los ficheros XML del Certific@... 3
 OBSERVACIONES A DIVERSOS TRÁMITES QUE TIENEN CAUSA EN PROCEDIMIENTOS O ERE DE SUSPENSIÓN/REDUCCIÓN DE JORNADA: LA CUMPLIMENTACIÓN DE LOS FICHEROS XML DEL Certific@2 EL PAGO Y CONSUMO DE PRESTACIÓN EN SUPUESTOS
OBSERVACIONES A DIVERSOS TRÁMITES QUE TIENEN CAUSA EN PROCEDIMIENTOS O ERE DE SUSPENSIÓN/REDUCCIÓN DE JORNADA: LA CUMPLIMENTACIÓN DE LOS FICHEROS XML DEL Certific@2 EL PAGO Y CONSUMO DE PRESTACIÓN EN SUPUESTOS
11 Número de publicación: 2 198 652. 51 Int. Cl. 7 : G01D 5/353. 74 Agente: Tavira Montes-Jovellar, Antonio
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 198 62 1 Int. Cl. 7 : G01D /33 G01L 1/24 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98304833.1 86 Fecha
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 198 62 1 Int. Cl. 7 : G01D /33 G01L 1/24 12 TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98304833.1 86 Fecha
Índice de contenidos DESCRIPCIÓN GENERAL A TENER EN CUENTA. Clorhexidina (Dental)
 Clorhexidina (Dental) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La clorexidina se usa para tratar
Clorhexidina (Dental) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La clorexidina se usa para tratar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO GENESTRAN 75 microgramos/ml SOLUCION INYECTABLE PARA VACUNO EQUINO Y PORCINO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
CIRUGIA LAPAROSCÓPICA DEL COLON
 CIRUGIA LAPAROSCÓPICA DEL COLON Cada año multitud de pacientes son intervenidos por enfermedades del Colon, por ejemplo Divertículos, Pólipos, tumores malignos y otras enfermedades. Pese a que la Cirugía
CIRUGIA LAPAROSCÓPICA DEL COLON Cada año multitud de pacientes son intervenidos por enfermedades del Colon, por ejemplo Divertículos, Pólipos, tumores malignos y otras enfermedades. Pese a que la Cirugía
Estacionamiento Accesible
 Llámenos gratis al: 1-800-949-4232 Voz/TTY Para identificar su Centro regional acceda a: www.adata.org Estacionamiento Accesible Nuevas Disposiciones sobre las Regulaciones de la Ley ADA El Departamento
Llámenos gratis al: 1-800-949-4232 Voz/TTY Para identificar su Centro regional acceda a: www.adata.org Estacionamiento Accesible Nuevas Disposiciones sobre las Regulaciones de la Ley ADA El Departamento
Información Financiera en Economías Hiperinflacionarias
 NIC 29 Norma Internacional de Contabilidad 29 Información Financiera en Economías Hiperinflacionarias Esta versión incluye las modificaciones resultantes de las NIIF emitidas hasta el 17 de enero de 2008.
NIC 29 Norma Internacional de Contabilidad 29 Información Financiera en Economías Hiperinflacionarias Esta versión incluye las modificaciones resultantes de las NIIF emitidas hasta el 17 de enero de 2008.
k 11 N. de publicación: ES 2 051 708 k 51 Int. Cl. 5 : A61K 31/715 k 72 Inventor/es: Ochi, Takahiro k 74 Agente: Ungría Goiburu, Bernardo
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 01 708 k 1 Int. Cl. : A61K 31/71 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 87732.4 86
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 01 708 k 1 Int. Cl. : A61K 31/71 k 12 TRADUCCION DE PATENTE EUROPEA T3 k k k k 86 Número de solicitud europea: 87732.4 86
Curso Auditor Interno Calidad
 Curso Auditor Interno Calidad 4. Fases de una auditoria OBJETIVOS Fases de una auditoria 1 / 10 OBJETIVOS Al finalizar esta unidad didáctica será capaz: Conocer las fases de una auditoria interna. Conocer
Curso Auditor Interno Calidad 4. Fases de una auditoria OBJETIVOS Fases de una auditoria 1 / 10 OBJETIVOS Al finalizar esta unidad didáctica será capaz: Conocer las fases de una auditoria interna. Conocer
