FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA (Para 3º de E.S.O.) ==============================================
|
|
|
- Irene Montes Ponce
- hace 7 años
- Vistas:
Transcripción
1 José Romero I.E.S. María Bellido (Bailén) 1 FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA (Para 3º de E.S.O.) ============================================== CONCEPTOS FUNDAMENTALES. Antes de proceder al estudio de las reglas de formulación es preciso conocer perfectamente los símbolos y los nombres de los diferentes elementos químicos, base de esta forma de expresión. Una memorización previa de todos ellos resulta, pues, imprescindible. Tabla periódica La tabla periódica está dividida en elementos metálicos (a la izquierda y abajo) y no metálicos (a la derecha y arriba) separados por una escalera. Números de oxidación (valencias) De forma general y a efectos de formulación, a cada elemento dentro de un compuesto se le asigna un número positivo o negativo denominado índice o número de oxidación (también se le suele llamar valencia, aunque es menos correcto). Dicho número sirve para deducir con facilidad las fórmulas de las diferentes combinaciones posibles. En la tabla adjunta se muestran los números de oxidación que se asignan a los elementos de más importancia. Cuando se analiza con detenimiento se advierte la existencia de ciertas relaciones entre el número de oxidación de un elemento y su posición en la tabla periódica de modo que es posible deducir las siguientes reglas básicas: a) Los elementos metálicos tienen números de oxidación positivos. b) Los elementos no metálicos pueden tener números de oxidación tanto positivos como negativos. c) El número de oxidación positivo de un elemento alcanza como máximo el valor del grupo (columna) al que pertenece dentro del sistema periódico. En el caso de que tome otros valores, éstos serán más pequeños, soliendo ser pares o impares según el grupo en cuestión sea par o impar. d) El número de oxidación negativo de un elemento viene dado por la diferencia entre ocho y el número del grupo al que pertenece dentro del sistema periódico.. Al escribir la fórmula de un compuesto binario se coloca a la izquierda el elemento más metálico (electropositivo) y a la derecha el menos metálico (electronegativo). Para fijar el orden de más electronegativo a menos, la I.U.P.A.C. ha tomado como base la siguiente secuencia de elementos: El número de oxidación del primer elemento, prescindiendo de su signo, se coloca como subíndice del símbolo del segundo elemento y viceversa, es decir se intercambian los números de oxidación. Por ejemplo: nº.oxidación del Al = +3 nº.oxidación del O = -2 por tanto se escribirá Al 2 O 3 Si uno de ellos o ambos coinciden con la unidad, es decir vale 1, no se escribe. Ejemplo: K 2 O Está mal si se escribe como K 2 O 1 Si uno es múltiplo del otro se dividen ambos por el menor, es decir se simplifican. Por ejemplo: nº oxid. del C = 4 nº de oxid. del O = 2 por tanto será C 2 O 4 que se simplificará hasta CO 2
2 José Romero I.E.S. María Bellido (Bailén) 2. Para leer una fórmula de un compuesto binario se empieza de derecha a izquierda: primero se lee el menos metal y después el más metal. Por tanto observamos que se lee al contrario que se escribe. Tipos de nomenclatura: a) Sistemática o de composición (I.U.P.A.C.): Mediante ella se expresa la proporción entre los átomos que forman el compuesto. Puede ser de tres tipos (según las últimas normas de 2005): - Con prefijos multiplicadores o estequiométrica. En ella se dice el número de átomos de cada elemento mediante prefijos multiplicativos, de acuerdo a la siguiente tabla: Mono Di Tri Tetra Penta Exa Hepta Octa Nona Deca Se nombra, en primer lugar, el elemento más electronegativo (el de la derecha); para ello se modifica el nombre del elemento añadiendo el sufijo -uro a la raíz del nombre. Seguidamente, tras la palabra de, se nombra el elemento menos electronegativo (el de la izquierda) sin modificar. Delante del nombre de cada elemento, sin espacios ni guiones, se utilizan los prefijos multiplicativos que indican el número de átomos de cada uno. Por ejemplo: Fe 3 N 2 Dinitruro de trihierro Una excepción a esta regla se produce cuando el oxígeno es el elemento más electronegativo; en este caso, se nombra como óxido. Por ejemplo: Fe 2 O 3 Trióxido de dihierro. (No se dice trioxuro de dihierro) También se puede señalar el caso del azufre, cuando actúa como elemento más electronegativo, la terminación -uro se añade a la raíz latina (sulphur), nombrándose como sulfuro y no como azufruro. Por ejemplo: Fe 2 S 3 Trisulfuro de dihierro - Con números romanos o de Stock). De forma general podemos decir que en ella se cita en primer lugar y en forma abreviada el elemento situado a la derecha en la fórmula, terminado en -uro (excepto los óxidos, que se dice óxido), después se cita la palabra de y por último se nombra el elemento de la izquierda. En el caso de que dicho elemento pueda actuar con distintos índices de oxidación, el índice con el que actúa se escribirá a continuación en números romanos y entre paréntesis (sin signo). Por ejemplo: PBr 5 Bromuro de fósforo(v) Fe 2 O 3 Óxido de hierro(iii) Cuando los elementos tienen un único estado de oxidación, no se pone el mismo entre paréntesis, está mal ponerlo. Por ejemplo: CaCl 2 Cloruro de calcio. Estaría mal nombrarlo como cloruro de calcio(ii) - Con números arábigos seguidos de signo. Es igual a la anterior, pero en lugar de indicar el número de oxidación en números romanos se hace en números arábigos seguidos de su signo correspondiente. Por ejemplo: Fe 3 N 2 Nitruro de hierro(2+) Fe 2 O 3 Óxido de hierro(3+) b) Tradicional aceptada: Se utilizan prefijos y sufijos para indicar el número de oxidación del elemento. Está en desuso y se recomienda no utilizarla. Sólo se admite en casos concretos como agua o amoniaco. Nota: Las terminaciones oso e ico para indicar el número de oxidación de los metales no es aceptada ya por la IUPAC. Por ejemplo: Óxido férrico estaría mal. En este curso utilizaremos fundamentalmente la nomenclatura estequiométrica y la Stock.
3 José Romero I.E.S. María Bellido (Bailén) SUSTANCIAS ELEMENTALES O SIMPLES (X n ) Se nombran con los prefijos di-, tri-, tetra-, penta-, hexa-,etc. seguidos del nombre del elemento. Por ejemplo: N 2 : dinitrógeno O 3 : trioxígeno S 8 : octaazufre P 4 : tetrafósforo 2.- ÓXIDOS ( X 2 O x ) Son compuestos formados por la unión del oxígeno con cualquier otro elemento (X) metálico o no, a excepción de los halógenos. En ellos el oxígeno actúa siempre con número de oxidación -2. a) Estequiométrica: (Mono,di,tri,...)-óxido de (di,tri...)-elemento Fe 2 O 3 Trióxido de dihierro P 2 O 5 Pentaóxido de difósforo * Las vocales finales de los prefijos numéricos no deben suprimirse (con la excepción de monóxido ). Ejemplo: pentaóxido de dinitrógeno y no pentóxido de dinitrógeno * El prefijo mono solo se suele utilizar cuando hay confusión, es decir cuando el elemento tiene varios números de oxidación. Por ejemplo: CO se nombra como Monóxido de carbono para diferenciarlo del CO 2 que es Dióxido de carbono. Si al CO lo llamásemos óxido de carbono existiría confusión. * Aclaración: Las combinaciones del oxígeno con flúor, cloro, bromo, yodo y astato antes eran nombradas como óxidos, pero actualmente ya no se consideran óxidos. El oxígeno, que antes se escribía a la derecha, ahora debe ir a la izquierda. Por ejemplo: Antes era Cl 2 O 3 Trióxido de dicloro. Ahora es O 3 Cl 2 Dicloruro de trioxígeno b) De Stock: Óxido de elemento (nº oxid.) Fe 2 O 3 Óxido de hierro(iii) P 2 O 5 Óxido de fósforo(v) * Cuando el elemento tiene un solo número de oxidación éste no se pone (está mal ponerlo), pues no hay ninguna posibilidad de confusión o ambigüedad. Por ejemplo: El CaO se nombra como óxido de calcio y estaría mal llamarlo óxido de calcio(ii). * Hemos de tener cuidado pues el subíndice del oxígeno no siempre indica el número de oxidación del elemento, puesto que la fórmula puede estar simplificada. Por ejemplo: En el SO 2 el número de oxidación del azufre no es 2 sino 4, puesto que antes de simplificarlo sería S 2 O 4 (2 sería el número de oxidación del oxígeno y 4 el del azufre). Por tanto este óxido se nombra como Óxido de azufre(iv) Se escribe a la izquierda el símbolo del elemento y a la derecha el símbolo del oxigeno, a continuación se intercambian los números de oxidación y finalmente se simplifican, si es posible. Por ejemplo: Óxido de azufre(vi) => S 2 O 6 que se simplifica y queda SO 3 Hay que tener en cuenta que cuando el elemento tiene de número de oxidación 1 éste no se escribe. Por ejemplo: Óxido de plata => Ag 2 O (no se pone al oxigeno el subíndice 1 correspondiente a la plata)
4 José Romero I.E.S. María Bellido (Bailén) 4 Ejercícios propuestos: Nombrar: NiO Cu 2 O MgO CO N 2 O N 2 O 5 SeO 3 Cr 2 O 3 Formular: Monóxido de cobre Dióxido de silicio Óxido de mercurio(i) Óxido de cobre (II) Trióxido de diniquel Óxido de oro(iii) Pentaóxido de diarsenico Dióxido de selenio 3.- HIDRUROS ( MH m ó H n N ) Son compuestos formados por la unión de un elemento y el hidrógeno (siempre con nº de oxidación 1). Vamos a distinguir tres tipos de hidruros: HIDRUROS METÁLICOS (MH m ). Están formados por un metal (M) e hidrógeno. a) Estequiométrica: (Mono, di,tri,...)-hidruro de metal PbH 4 Tetrahidruro de plomo BeH 2 Dihidruro de berilio b) De Stock: Hidruro de metal (nº oxid.) PbH 4 Hidruro de plomo(iv) BeH 2 Hidruro de berilio Se escribe a la izquierda el metal y a la derecha el hidrógeno y se pone el número de oxidación del metal como subíndice del hidrógeno. (El número de oxidación del hidrógeno no se pone al metal, pues vale 1). Por ejemplo: Trihidruro de aluminio AlH 3 Hidruro de oro(i) AuH HIDRUROS NO METÁLICOS DE LOS GRUPOS 16 Y 17 (H n N). Están formados por un no metal (S, Se, Te, F, Cl, Br o I) e hidrógeno. También se llaman haluros de hidrógeno. Observamos que en éstos a la izquierda se coloca el hidrógeno y a la derecha el elemento. El no metal actúa siempre con el número de oxidación negativo (que coincide con el menor) a) Estequiométrica: No metal-uro de hidrógeno HI Yoduro de hidrógeno H 2 Te Telururo de hidrógeno * Cuando tiene dos hidrógenos no se dice: de dihidrógeno. Por ejemplo: H 2 S se nombra como sulfuro de hidrógeno y no como sulfuro de dihidrógeno b) Tradicional aceptada: Ácido no metal-hídrico HI Ácido yodhídrico H 2 Te Ácido telurhídrico * A estos hidruros se les denominaba tradicionalmente ácidos hidrácidos, por tener propiedades ácidas cuando se disuelven en agua.
5 José Romero I.E.S. María Bellido (Bailén) 5 Se escribe a la izquierda el hidrógeno y a la derecha el no metal y se pone el número de oxidación del no metal (recuerda que siempre es el negativo) como subíndice del hidrógeno. Por ejemplo: Seleniuro de hidrógeno H 2 Se Àcido bromhídrico HBr HIDRUROS NO METALICOS DE LOS GRUPOS 13, 14 Y 15. Son los hidruros de los elementos B, C, Si, N, P, As, Sb y O. El no metal actúa con el número de oxidación negativo. a) Estequiométrica: (Di,tri,...)-hidruro de no metal CH 4 Tetrahidruro de carbono AsH 3 Trihidruro de arsénico b) Nombres especiales admitidos: H 2 O (agua u oxidano) CH 4 (metano) SiH 4 (silano) BH 3 (borano) NH 3 (amoniaco o azano) PH 3 (fosfano) AsH 3 (arsano) SbH 3 (estibano) Se escribe a la izquierda el no metal y a la derecha el hidrógeno e intercambian los números de oxidación. Por ejemplo: Trihidruro de fósforo PH 3 Ejercicios propuestos: Nombrar: LiH BaH 2 SnH 4 CoH 2 HgH 2 AuH 3 H 2 Se HCl HBr Formular: Dihidruro de calcio Hidruro de potasio Trihidruro de antimonio Hidruro de plomo(ii) Hidruro de cobre(i) Monohidruro de oro Hidruro de platino(iv) Trihidruro de manganeso Tetrahidruro de silicio Fluoruro de hidrógeno Telururo de hidrógeno Yoduro de hidrógeno 4.- OTROS COMPUESTOS BINARIOS (X n N x ) Son los compuestos formados por un no metal (N) con cualquier otro elemento (X) que no sea O ó H. El no metal actúa siempre con el número de oxidación negativo. a) Estequiométrica: (Mono,di,tri...)-no metal-uro de (di,tri...)-elemento FeCl 3 Tricloruro de hierro N 2 S 3 Trisulfuro de dinitrógeno b) De Stock: No metal-uro de elemento (nº oxid.) FeCl 3 Cloruro de hierro(iii) N 2 S 3 Sulfuro de nitrógeno(iii)
6 José Romero I.E.S. María Bellido (Bailén) 6 Se coloca a la izquierda el elemento más metálico y a la derecha el menos metálico y se intercambian sus números de oxidación. Recuerda que el que termina en uro es el que tiene el número de oxidación negativo y es el que va a la derecha. Por ejemplo: Dinitruro de tricobalto Co 3 N 2 Telururo de fósforo(v) P 2 Te 5 Ejercicios propuestos: Nombrar: CaF 2 CuBr Cr 2 S 3 Mg 3 N 2 SF 4 PBr 5 B 2 S 3 SiC NH 4 Cl Formular: Sulfuro de manganeso(ii) Nitruro de litio Bromuro de níquel(iii) Dibromuro de cobre Siliciuro de dihierro Trisulfuro de dihierro Cloruro de yodo(vii) Cloruro de selenio(iv) Sulfuro de amonio 5.- HIDRÓXIDOS [ M(OH) m ] Son los compuestos formados por un metal (M) y tantos grupos hidroxilo (OH ) como indique el número de oxidación con el que actúe dicho metal. El grupo hidroxilo forma una sola unidad y su número de oxidación es -1. Debido a sus propiedades básicas reciben también el nombre de bases. a) Estequiométrica: (Mono,di,tri,...)-hidróxido de metal Sn(OH) 4 Tetrahidróxido de estaño Ba(OH) 2 Dihidróxido de bario b) De Stock: Hidróxido de metal (nº oxid.) Sn(OH) 4 Hidróxido de estaño(iv) Ba(OH) 2 Hidróxido de bario * Cuando el número de oxidación del metal es 1 no se escribe el paréntesis. Por ejemplo: Hidróxido de oro(i) se escribe como AuOH y estaría mal escribir Au(OH) Se coloca a la izquierda el metal y a la derecha el grupo OH. Si el número de oxidación del metal es mayor de 1 se pone paréntesis al grupo OH y se escribe como subíndice del mismo el número de oxidación con el que actúa el metal. Por ejemplo: Trihidróxido de niquel Ni(OH) 3 Hidróxido de platino(iv) Pt(OH) 4 Ejercicios propuestos: Nombrar: Pt(OH) 2 Mn(OH) 3 KOH HgOH Pb(OH) 4 Zn(OH) 2 Formular: Dihidróxido de cobalto Hidróxido de sodio Trihidróxido de aluminio Hidróxido de cromo(ii) Hidróxido de mercurio(ii) Hidróxido de amonio =o-o-o =
7 José Romero I.E.S. María Bellido (Bailén) 7 ÓXIDOS Fórmula estequiométrica de Stock FeO Monóxido de hierro u Óxido de hierro Óxido de hierro(ii) Fe 2O 3 Trióxido de dihierro Óxido de hierro(iii) K 2O Óxido de dipotasio u Óxido de potasio Óxido de potasio Al 2O 3 Trióxido de dialuminio u Óxido de aluminio Óxido de aluminio Cu 2O Monóxido de dicobre u Óxido de dicobre Óxido de cobre(i) CuO Monóxido de cobre u Óxido de cobre Óxido de cobre(ii) CdO Óxido de cadmio Óxido de cadmio MgO Óxido de magnesio Óxido de magnesio CO Monóxido de carbono u Óxido de carbono Óxido de carbono(ii) CO 2 Dióxido de carbono Óxido de carbono(iv) N 2O Monóxido de dinitrógeno u Óxido de dinitrógeno Óxido de nitrógeno(i) NO Monóxido de nitrógeno u Óxido de nitrógeno Óxido de nitrógeno(ii) NO 2 Dióxido de nitrógeno Óxido de nitrógeno(iv) HIDRUROS METÁLICOS Fórmula estequiométrica de Stock SnH 2 Dihidruro de estaño Hidruro de estaño(ii) SnH 4 Tetrahidruro de estaño Hidruro de estaño(iv) LiH Hidruro de litio Hidruro de litio ZnH 2 Dihidruro de cinc o Hidruro de cinc Hidruro de cinc HIDRUROS NO METÁLICOS Fórmula estequiométrica de Stock BH 3 Trihidruro de boro o Hidruro de boro Hidruro de boro PH 3 Trihidruro de fósforo Hidruro de fósforo(iii) PH 5 Pentahidruro de fósforo Hidruro de fósforo(v) Fórmula estequiométrica Tradicional aceptada HF Fluoruro de hidrógeno Ácido fluorhídrico HCl Cloruro de hidrógeno Ácido clorhídrico HBr Bromuro de hidrógeno Ácido bromhídrico HI Yoduro de hidrógeno Ácido yodhídrico H 2S Sulfuro de hidrógeno o Sulfuro de dihidrógeno Ácido sulfhídrico H 2Se Seleniuro de hidrógeno o Seleniuro de dihidrógeno Ácido selenhídrico H 2Te Telururo de hidrógeno o Telururo de dihidrógeno Ácido telurhídrico
8 José Romero I.E.S. María Bellido (Bailén) 8 OTROS COMPUESTOS BINARIOS Fórmula estequiométrica de Stock NaBr Bromuro de sodio Bromuro de sodio FeCl 2 Dicloruro de hierro Cloruro de hierro(ii) FeCl 3 Tricloruro de hierro Cloruro de hierro(iii) Ag 2S Sulfuro de diplata o Sulfuro de plata Sulfuro de plata Al 2Se 3 Triseleniuro de dialuminio o Seleniuro de aluminio Seleniuro de aluminio PtI 4 Tetrayoduro de platino Yoduro de platino(iv) CaF 2 Difluoruro de calcio o fluoruro de calcio Fluoruro de calcio Na 2Te Telururo de disodio o telururo de sodio Telururo de sodio AuI 3 Triyoduro de oro Yoduro de oro(iii) PbBr 2 Dibromuro de plomo Bromuro de plomo(ii) NiS Disulfuro de níquel Sulfuro de níquel(ii) ScAs Arseniuro de escandio Arseniuro de escandio NH 4Cl Cloruro de amonio Cloruro de amonio Fórmula estequiométrica de Stock SF 6 Hexafluoruro de azufre Fluoruro de azufre(vi) PCl 3 Tricloruro de fósforo Cloruro de fósforo(iii) PCl 5 Pentacloruro de fósforo Cloruro de fósforo(v) BN Nitruro de boro Nitruro de boro ICl 7 Heptacloruro de yodo Cloruro de yodo(vii) As 2Se 5 Pentaseleniuro de diarsénico Seleniuro de arsénico(v) CCl 4 Tetracloruro de carbono Cloruro de carbono(iv) HIDRÓXIDOS Fórmula estequiométrica de Stock Ca(OH) 2 Dihidróxido de calcio o Hidróxido de calcio Hidróxido de calcio NaOH Monohidróxido de sodio o Hidróxido de sodio Hidróxido de sodio Sn(OH) 2 Dihidróxido de estaño Hidróxido de estaño(ii) Sn(OH) 4 Tetrahidróxido de estaño Hidróxido de estaño(iv)
9 José Romero I.E.S. María Bellido (Bailén) 9 NÚMEROS DE OXIDACIÓN DE LOS ELEMENTOS MÁS FRECUENTES H ± 1 Li Be B C N O F 1 2 ± 3 2, ± 4 1, ±3, Na Mg Al Si P S Cl ± 4 1, ±3, 5 ±2, 4, 6 ±1,3,5,7 K Ca Cr Mn Fe Co Ni Cu Zn As Se Br 1 2 2, 3 3, 6 2,3 4,6,7 2, 3 2, 3 2, 3 1, 2 2 ± 3, 5 ±2, 4, 6 ±1,3,5,7 Rb Sr Ag Cd Sn Sb Te I , 4 ± 3, 5 ±2, 4, 6 ±1,3,5,7 Cs Ba Ir Pt Au Hg Pb Bi 1 2 2, 4 2, 4 1, 3 1, 2 2, 4 3, 5 Fr Ra 1 2 * El N a veces también actúa con números de oxidación +2 y +4 NH 4 + METAL * El O en los peróxidos actúa con número de oxidación -1 METAL 1 José Romero NO IES Mª Bellido (Bailén)
FORMULACIÓN INORGÁNICA. Departamento de Física y Química 3º ESO
 FORMULACIÓN INORGÁNICA Departamento de Física y Química 3º ESO 1. Tabla periódica de los elementos -1 Valencia: capacidad que posee un elemento para combinarse con otro Número de oxidación: número de electrones
FORMULACIÓN INORGÁNICA Departamento de Física y Química 3º ESO 1. Tabla periódica de los elementos -1 Valencia: capacidad que posee un elemento para combinarse con otro Número de oxidación: número de electrones
TEMA 4: Formulación inorgánica
 TEMA 4: Formulación inorgánica Tema 4: Formulación Inorgánica 1 1.- CMPUESTS BINARIS Son sustancias formadas por la unión de dos elementos químicos, como por ejemplo NaH, Co 3, Li S y PCl 3 1.1.- los En
TEMA 4: Formulación inorgánica Tema 4: Formulación Inorgánica 1 1.- CMPUESTS BINARIS Son sustancias formadas por la unión de dos elementos químicos, como por ejemplo NaH, Co 3, Li S y PCl 3 1.1.- los En
Lo primero que hay que conocer para formular y nombrar los compuestos químicos es el número de oxidación de cada elemento.
 Tema 5. NOMENCLATURA Y FORMULACIÓN DE QUÍMICA INORGÁNICA Introducción La IUPAC (Unión Internacional de Química Pura y Aplicada) es el organismo que coordina y actualiza las normas que permiten formular
Tema 5. NOMENCLATURA Y FORMULACIÓN DE QUÍMICA INORGÁNICA Introducción La IUPAC (Unión Internacional de Química Pura y Aplicada) es el organismo que coordina y actualiza las normas que permiten formular
NOMENCLATURA Y FORMULACIÓN DE QUÍMICA INORGÁNICA. Física y Química 3º de E.S.O. IES Isidra de Guzmán
 NOMENCLATURA Y FORMULACIÓN DE QUÍMICA INORGÁNICA Física y Química 3º de E.S.O. IES Isidra de Guzmán INTRODUCCIÓN La IUPAC ( Unión Internacional de Química Pura y Aplicada) es el organismo que coordina
NOMENCLATURA Y FORMULACIÓN DE QUÍMICA INORGÁNICA Física y Química 3º de E.S.O. IES Isidra de Guzmán INTRODUCCIÓN La IUPAC ( Unión Internacional de Química Pura y Aplicada) es el organismo que coordina
FORMULACIÓN Y NOMENCLATURA
 1. SUSTANCIAS SIMPLES. FORMULACIÓN Y NOMENCLATURA Están constituidas por átomos de un solo elemento. En ellas las moléculas están formadas por átomos idénticos. Su fórmula indica el número de átomos de
1. SUSTANCIAS SIMPLES. FORMULACIÓN Y NOMENCLATURA Están constituidas por átomos de un solo elemento. En ellas las moléculas están formadas por átomos idénticos. Su fórmula indica el número de átomos de
FORMULACIÓN DE QUÍMICA INORGÁNICA.
 FORMULACIÓN DE QUÍMICA INORGÁNICA. 1. VALENCIA. Es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos. La valencia es un número, positivo
FORMULACIÓN DE QUÍMICA INORGÁNICA. 1. VALENCIA. Es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos. La valencia es un número, positivo
NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS (3.º ESO)
 NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS Para qué la nomenclatura química? Cuando estudiamos química nos encontramos con multitud de sustancias a las que debemos de asignar un nombre y una
NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS Para qué la nomenclatura química? Cuando estudiamos química nos encontramos con multitud de sustancias a las que debemos de asignar un nombre y una
La fórmula química expresa la composición de moléculas y compuestos mediante símbolos químicos. 13 millones!!!
 La fórmula química expresa la composición de moléculas y compuestos mediante símbolos químicos El Nº de compuestos químicos conocidos es superior a 13 millones!!! Método sistemático de nombrar los compuestos:
La fórmula química expresa la composición de moléculas y compuestos mediante símbolos químicos El Nº de compuestos químicos conocidos es superior a 13 millones!!! Método sistemático de nombrar los compuestos:
Óxido de hierro(iii)
 ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos numerales indicadores del número
ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos numerales indicadores del número
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA
 FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA Índice de contenido TABLAS DE NÚMEROS DE OXIDACIÓN MÁS COMUNES...2 MECANISMO DE FORMULACIÓN...2 NOMENCLATURAS EN QUÍMICA INORGÁNICA...2 NOMENCLATURA CON
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA Índice de contenido TABLAS DE NÚMEROS DE OXIDACIÓN MÁS COMUNES...2 MECANISMO DE FORMULACIÓN...2 NOMENCLATURAS EN QUÍMICA INORGÁNICA...2 NOMENCLATURA CON
Óxido de hierro (III)
 COMPUESTOS BINARIOS: ÓXIDOS Los óxidos son combinaciones del oxígeno con otro elemento. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos indicadores
COMPUESTOS BINARIOS: ÓXIDOS Los óxidos son combinaciones del oxígeno con otro elemento. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos indicadores
Trióxido de dihierro
 COMBINACIONES BINARIAS (4ª ESO) ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos
COMBINACIONES BINARIAS (4ª ESO) ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos
Trióxido de dihierro
 ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos numerales indicadores del número
ÓXIDOS Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye la palabra óxido que puede estar precedida de prefijos numerales indicadores del número
Química General Básica. Nomenclatura de Compuestos Inorgánicos
 Química General Básica Nomenclatura de Compuestos Inorgánicos Estelí, 11 de marzo de 2011 Formulación y Nomenclatura en Química Inorgánica La fórmula química expresa la composición de moléculas y compuestos
Química General Básica Nomenclatura de Compuestos Inorgánicos Estelí, 11 de marzo de 2011 Formulación y Nomenclatura en Química Inorgánica La fórmula química expresa la composición de moléculas y compuestos
TEMA 4: FORMULACIÓN 1.- CONCEPTOS PREVIOS
 TEMA 4: FORMULACIÓN 1.- CONCEPTOS PREVIOS Compuesto químico: es la unión de varios átomos que no pueden separarse por procedimientos físicos pero sí mediante procedimientos químicos. Ejemplo: dos átomos
TEMA 4: FORMULACIÓN 1.- CONCEPTOS PREVIOS Compuesto químico: es la unión de varios átomos que no pueden separarse por procedimientos físicos pero sí mediante procedimientos químicos. Ejemplo: dos átomos
QUÍMICA INORGÁNICA 3º E.S.O.
 QUÍMICA INORGÁNICA 3º E.S.O. Formulación y nomenclatura. Normas de la IUPAC (2005) 1 2 CONCEPTOS GENERALES 1. NORMAS PARA ESCRIBIR LAS FÓRMULAS Se escriben juntos los símbolos de los átomos, el más electronegativo
QUÍMICA INORGÁNICA 3º E.S.O. Formulación y nomenclatura. Normas de la IUPAC (2005) 1 2 CONCEPTOS GENERALES 1. NORMAS PARA ESCRIBIR LAS FÓRMULAS Se escriben juntos los símbolos de los átomos, el más electronegativo
FORMULACIÓN Y NOMENCLATURA (SISTEMÁTICA)
 FORMULACIÓN Y NOMENCLATURA (SISTEMÁTICA) FORMULACIÓN: el conjunto de reglas que se emplean para la representación simbólica de los compuestos químicos. NOMENCLATURA: la forma de nombrar los compuestos.
FORMULACIÓN Y NOMENCLATURA (SISTEMÁTICA) FORMULACIÓN: el conjunto de reglas que se emplean para la representación simbólica de los compuestos químicos. NOMENCLATURA: la forma de nombrar los compuestos.
Trióxido de dihierro
 Curso 2012-13 FORMULACIÓN QUÍMICA INORGÁNICA COMBINACIONES BINARIAS CPI Conde de Fenosa Ares Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye
Curso 2012-13 FORMULACIÓN QUÍMICA INORGÁNICA COMBINACIONES BINARIAS CPI Conde de Fenosa Ares Los óxidos son combinaciones de los elementos con el oxígeno. El nombre de estos compuestos siempre incluye
1.- CONCEPTOS PREVIOS
 TEMA 6: FORMULACIÓN 1.- CONCEPTOS PREVIOS Compuesto químico: es la unión de varios átomos que no pueden separarse por procedimientos físicos pero sí mediante procedimientos químicos. Ejemplo: dos átomos
TEMA 6: FORMULACIÓN 1.- CONCEPTOS PREVIOS Compuesto químico: es la unión de varios átomos que no pueden separarse por procedimientos físicos pero sí mediante procedimientos químicos. Ejemplo: dos átomos
M m+ + X n- M n X m. Qué es formular un compuesto binario?
 Qué es formular un compuesto binario? Cuando tenemos dos elementos, uno menos electronegativo que otro, es decir uno con tendencia a ceder electrones M m+ (m es número de oxidación o valencia) y otro con
Qué es formular un compuesto binario? Cuando tenemos dos elementos, uno menos electronegativo que otro, es decir uno con tendencia a ceder electrones M m+ (m es número de oxidación o valencia) y otro con
trisulfuro de dialuminio
 NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS Para qué la nomenclatura química? Cuando estudiamos química nos encontramos con multitud de sustancias a las que debemos de asignar un nombre y una
NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS Para qué la nomenclatura química? Cuando estudiamos química nos encontramos con multitud de sustancias a las que debemos de asignar un nombre y una
TEMA 4: FORMULACIÓN 1.- CONCEPTOS PREVIOS
 TEMA 4: FORMULACIÓN 1.- CONCEPTOS PREVIOS Compuesto químico: es la unión de varios átomos que no pueden separarse por procedimientos físicos pero sí mediante procedimientos químicos. Ejemplo: dos átomos
TEMA 4: FORMULACIÓN 1.- CONCEPTOS PREVIOS Compuesto químico: es la unión de varios átomos que no pueden separarse por procedimientos físicos pero sí mediante procedimientos químicos. Ejemplo: dos átomos
FORMULACIÓN DE QUÍMICA INORGÁNICA
 DE QUÍMICA INORGÁNICA Del mismo modo que utilizamos las palabras para comunicarnos, en química recurrimos a las fórmulas para representar los compuestos. Estas fórmulas no son arbitrarias, sino que responden
DE QUÍMICA INORGÁNICA Del mismo modo que utilizamos las palabras para comunicarnos, en química recurrimos a las fórmulas para representar los compuestos. Estas fórmulas no son arbitrarias, sino que responden
NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA. Nivel: Educación Secundaria Obligatoria
 NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA Nivel: Educación Secundaria Obligatoria Conceptos básicos Los elementos químicos se representan mediante símbolos, que consisten en una o dos letras que
NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA Nivel: Educación Secundaria Obligatoria Conceptos básicos Los elementos químicos se representan mediante símbolos, que consisten en una o dos letras que
TEMA 5.- Formulación y nomenclatura
 Tema 5.- Formulación y nomenclatura de compuestos binarios 0.- Introducción. 1.- Óxidos. 2.- Peróxidos. 3.- Combinaciones binarias del hidrógeno. 3.1.- Hidruros. 3.2.- Haluros. 3.3.- Hidruros volátiles.
Tema 5.- Formulación y nomenclatura de compuestos binarios 0.- Introducción. 1.- Óxidos. 2.- Peróxidos. 3.- Combinaciones binarias del hidrógeno. 3.1.- Hidruros. 3.2.- Haluros. 3.3.- Hidruros volátiles.
trisulfuro de dialuminio
 NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS (BACHILLERATO) Para qué la nomenclatura química? Cuando estudiamos química nos encontramos con multitud de sustancias a las que debemos de asignar
NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS (BACHILLERATO) Para qué la nomenclatura química? Cuando estudiamos química nos encontramos con multitud de sustancias a las que debemos de asignar
FORMULACIÓN Y NOMENCLATURA
 FORMULACIÓN Y NOMENCLATURA FORMULACIÓN Una fórmula química es la representación escrita de una molécula o compuesto iónico. Para expresar una fórmula química se utilizan los símbolos de los elementos que
FORMULACIÓN Y NOMENCLATURA FORMULACIÓN Una fórmula química es la representación escrita de una molécula o compuesto iónico. Para expresar una fórmula química se utilizan los símbolos de los elementos que
INSTITUTO EDUCACIÓN SECUNDARIA POLITÉCNICO. CARTAGENA. 3º E.S.O.
 Cartagena-2012 1 FORMULACIÓN Y NOMENCLATURA INORGÁNICA 0. SÍMBOLOS Y VALENCIAS DE LOS ELEMENTOS Los símbolos y valencias de los elementos más comunes vienen recogidos en el ANEXO I. Por último, indicaremos
Cartagena-2012 1 FORMULACIÓN Y NOMENCLATURA INORGÁNICA 0. SÍMBOLOS Y VALENCIAS DE LOS ELEMENTOS Los símbolos y valencias de los elementos más comunes vienen recogidos en el ANEXO I. Por último, indicaremos
EJRCICIOS de FORMULACIÓN DE FÍSICA Y QUÍMICA 3º ESO
 EJRCICIOS de FORMULACIÓN DE FÍSICA Y QUÍMICA 3º ESO Pablo Martín CURSO 2014-2015 1 EJERCICIOS DE FORMULACIÓN DE INORGÁNICA: Escribe el nombre de los siguientes compuestos 1. Cl 2 O 5 2. PbCl 4 3. HCl 4.
EJRCICIOS de FORMULACIÓN DE FÍSICA Y QUÍMICA 3º ESO Pablo Martín CURSO 2014-2015 1 EJERCICIOS DE FORMULACIÓN DE INORGÁNICA: Escribe el nombre de los siguientes compuestos 1. Cl 2 O 5 2. PbCl 4 3. HCl 4.
TEMA 5. SISTEMA PERIÓDICO. FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS
 TEMA 5. SISTEMA PERIÓDICO. FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS SISTEMA PERIÓDICO El sistema periódico actual está formado por más de 100 elementos (114 en la actualidad), los cuales están
TEMA 5. SISTEMA PERIÓDICO. FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS INORGÁNICOS SISTEMA PERIÓDICO El sistema periódico actual está formado por más de 100 elementos (114 en la actualidad), los cuales están
Tema 6 : Nomenclatura y formulación Química Inorgánica
 Tema 6 : Nomenclatura y formulación Química Inorgánica Esquema de trabajo: Introducción Compuestos Binarios 1. Combinaciones binarias del oxígeno: A. Oxidos B. Anhídridos 2. Combinaciones binarias del
Tema 6 : Nomenclatura y formulación Química Inorgánica Esquema de trabajo: Introducción Compuestos Binarios 1. Combinaciones binarias del oxígeno: A. Oxidos B. Anhídridos 2. Combinaciones binarias del
3.5. FORMULACIÓN Y NOMENCLATURA II
 3.5. FORMULACIÓN Y NOMENCLATURA II 3.5.1. HIDRUROS METÁLICOS. Los compuestos binarios son aquellos en los que únicamente intervienen dos tipos de átomos, es decir, que están formados por sólo dos elementos
3.5. FORMULACIÓN Y NOMENCLATURA II 3.5.1. HIDRUROS METÁLICOS. Los compuestos binarios son aquellos en los que únicamente intervienen dos tipos de átomos, es decir, que están formados por sólo dos elementos
NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA
 NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA Adaptado a las normas de la IUPAC 1990 Nivel: 3º ESO 1 0. Introducción Valencia Es la capacidad que posee un elemento de combinarse con otro. Como el hidrógeno
NOMENCLATURA y FORMULACIÓN en QUÍMICA INORGÁNICA Adaptado a las normas de la IUPAC 1990 Nivel: 3º ESO 1 0. Introducción Valencia Es la capacidad que posee un elemento de combinarse con otro. Como el hidrógeno
Colegio Superior de Señoritas Tema: Formación de Compuestos Químicos Septiembre 2010 Prof.: NVM 8vo Nivel Departamento de Ciencias
 COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón;
Boletín de Actividades (VII) INICIACIÓN A LA FORMULACIÓN Y NOMENCLATURA INORGÁNICA. LiH --
 www.colegioelatabal.es/ciencias/ Boletín de Actividades (VII) INICIACIÓN A LA FORMULACIÓN Y NOMENCLATURA INORGÁNICA. 1. Formula y/o nombra las siguientes combinaciones binarias del hidrógeno: Fórmula N.
www.colegioelatabal.es/ciencias/ Boletín de Actividades (VII) INICIACIÓN A LA FORMULACIÓN Y NOMENCLATURA INORGÁNICA. 1. Formula y/o nombra las siguientes combinaciones binarias del hidrógeno: Fórmula N.
PLAN DE REFUERZO ÁREA PENDIENTE DE CIENCIAS NATURALES 3ºESO
 PLAN DE REFUERZO ÁREA PENDIENTE DE CIENCIAS NATURALES 3ºESO Para superar la materia, el alumno deberá realizar las actividades que se indican a continuación. Se realizarán en un cuaderno destinado únicamente
PLAN DE REFUERZO ÁREA PENDIENTE DE CIENCIAS NATURALES 3ºESO Para superar la materia, el alumno deberá realizar las actividades que se indican a continuación. Se realizarán en un cuaderno destinado únicamente
PROGRAMA TOTAL FÓRMULAS QUÍMICAS Y SISTEMAS DE NOMENCLATURA CLASIFICACIÓN DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS
 Departamento de Física y Química FÍSICA Y QUÍMICA ESO FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS PROGRAMA TOTAL INTRODUCCIÓN FÓRMULAS QUÍMICAS Y SISTEMAS DE NOMENCLATURA CLASIFICACIÓN
Departamento de Física y Química FÍSICA Y QUÍMICA ESO FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS PROGRAMA TOTAL INTRODUCCIÓN FÓRMULAS QUÍMICAS Y SISTEMAS DE NOMENCLATURA CLASIFICACIÓN
QUÍMICA INORGÁNICA. Elementos Símbolo Valencia Elemento Símbolo Valencia. Hidrógeno H Oxigeno O -2. Flúor F -1 Nitrógeno N
 QUÍMICA INORGÁNICA VALENCIAS NO METALES Elementos Símbolo Valencia Elemento Símbolo Valencia Hidrógeno H -1 +1 Oxigeno O -2 Flúor F -1 Nitrógeno N -3 +1+3+5 Cloro Cl -1 +1+3+5+7 Fósforo P -3 +1+3+5 Bromo
QUÍMICA INORGÁNICA VALENCIAS NO METALES Elementos Símbolo Valencia Elemento Símbolo Valencia Hidrógeno H -1 +1 Oxigeno O -2 Flúor F -1 Nitrógeno N -3 +1+3+5 Cloro Cl -1 +1+3+5+7 Fósforo P -3 +1+3+5 Bromo
Formulación: Introducción y compuesto binarios. Teoría. Compuestos binarios y ternarios
 Compuestos binarios y ternarios 1. Compuestos binarios son aquellos que están formados por dos elementos diferentes. Ejemplos: - NaH está formado por dos elementos el Na y el H - Cl 2 O está formado por
Compuestos binarios y ternarios 1. Compuestos binarios son aquellos que están formados por dos elementos diferentes. Ejemplos: - NaH está formado por dos elementos el Na y el H - Cl 2 O está formado por
FORMULACIÓN Y NOMENCLATURA INORGÁNICA
 FORMULACIÓN Y NOMENCLATURA INORGÁNICA Número de oxidación (n.o.): es la carga real (si es un ion) o aparente (si no es un ion) que tienen los elementos que forman parte de un compuesto. (Ver la tabla de
FORMULACIÓN Y NOMENCLATURA INORGÁNICA Número de oxidación (n.o.): es la carga real (si es un ion) o aparente (si no es un ion) que tienen los elementos que forman parte de un compuesto. (Ver la tabla de
QUÍMICA INORGÁNICA: INTRODUCCIÓN A LA NOMENCLATURA Y FORMULACIÓN DE COMPUESTOS BINARIOS.
 QUÍMICA INORGÁNICA: INTRODUCCIÓN A LA NOMENCLATURA Y FORMULACIÓN DE COMPUESTOS BINARIOS. En el ámbito de la Química a cada sustancia le corresponde un nombre, que nos permite identificarla, y una fórmula,
QUÍMICA INORGÁNICA: INTRODUCCIÓN A LA NOMENCLATURA Y FORMULACIÓN DE COMPUESTOS BINARIOS. En el ámbito de la Química a cada sustancia le corresponde un nombre, que nos permite identificarla, y una fórmula,
ísica y uímica FORMULACIÓN Y NOMENCLATURA Nombre Óxido de bario Óxido de sodio Óxido de plata Fórmula
 Formula los siguientes compuestos: EJERCICIOS DE RECAPITULACIÓN Óxido de bario Óxido de sodio Óxido de plata BaO Na 2 O Ag 2 O Óxido de aluminio Al 2 O 3 Óxido de níquel (III) Ni 2 O 3 Óxido de cloro (VII)
Formula los siguientes compuestos: EJERCICIOS DE RECAPITULACIÓN Óxido de bario Óxido de sodio Óxido de plata BaO Na 2 O Ag 2 O Óxido de aluminio Al 2 O 3 Óxido de níquel (III) Ni 2 O 3 Óxido de cloro (VII)
11 Dióxido de carbono. 12 Trióxido de monoazufre. 13 Pentaóxido de difósforo. 14 Dióxido de monoselenio. 15 Dióxido de selenio. 16 Óxido de dimercurio
 1 FÍSICA Y QUÍMICA 3º ESO QUÍMICA - FORMULACIÓN Y SISTEMÁTICAMENTE LOS SIGUIENTES ÓXIDOS 1 Cu 2 O 2 Be O 3 I 2 O 5 4 CO 2 5 NiO 6 Ag 2 O 7 Li 2 O 8 N 2 O 3 9 CrO 10 Ni 2 O 3 11 Dióxido de carbono 12 Trióxido
1 FÍSICA Y QUÍMICA 3º ESO QUÍMICA - FORMULACIÓN Y SISTEMÁTICAMENTE LOS SIGUIENTES ÓXIDOS 1 Cu 2 O 2 Be O 3 I 2 O 5 4 CO 2 5 NiO 6 Ag 2 O 7 Li 2 O 8 N 2 O 3 9 CrO 10 Ni 2 O 3 11 Dióxido de carbono 12 Trióxido
M m+ + X n-! M n X m EJERCICIOS/ESTUDIO. Qué es formular un compuesto binario?
 EJERCICIOS/ESTUDIO Materia: Tema: Física y Química 3º ESO Curso: Qué es formular un compuesto binario? Cuando tenemos dos elementos, uno menos electronegativo que otro, es decir uno con tendencia a ceder
EJERCICIOS/ESTUDIO Materia: Tema: Física y Química 3º ESO Curso: Qué es formular un compuesto binario? Cuando tenemos dos elementos, uno menos electronegativo que otro, es decir uno con tendencia a ceder
APUNTES DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA 3º ESO
 APUNTES DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA 3º ESO 1. ELEMENTOS, SÍMBOLOS Y NÚMEROS DE OXIDACIÓN MÁS FRECUENTES EN LA FORMULACIÓN DE QUÍMICA INORGÁNICA Para poder formular y nombrar los
APUNTES DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA 3º ESO 1. ELEMENTOS, SÍMBOLOS Y NÚMEROS DE OXIDACIÓN MÁS FRECUENTES EN LA FORMULACIÓN DE QUÍMICA INORGÁNICA Para poder formular y nombrar los
ACTIVIDADES FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA
 ACTIVIDADES FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA EJERCICIOS PROPUESTOS 1. Indica los diferentes átomos que existen en estos compuestos y el número de oxidación con que actúan. a) FeS b) Mg(OH)
ACTIVIDADES FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA EJERCICIOS PROPUESTOS 1. Indica los diferentes átomos que existen en estos compuestos y el número de oxidación con que actúan. a) FeS b) Mg(OH)
NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS. AMPLIACIÓN (3.º ESO) Nomenclatura de compuestos binarios usando números de oxidación
 NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS. AMPLIACIÓN Nomenclatura de compuestos binarios usando números de oxidación La nomenclatura de composición permite usar los números de oxidación para
NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS. AMPLIACIÓN Nomenclatura de compuestos binarios usando números de oxidación La nomenclatura de composición permite usar los números de oxidación para
NOMENCLATURA INORGÁNICA
 NOMENCLATURA INORGÁNICA Elemento: Se denomina elemento a toda sustancia que no puede descomponerse en otras más sencillas por métodos químicos. Nombre y símbolo de un elemento: Cada elemento se identifica
NOMENCLATURA INORGÁNICA Elemento: Se denomina elemento a toda sustancia que no puede descomponerse en otras más sencillas por métodos químicos. Nombre y símbolo de un elemento: Cada elemento se identifica
Los elementos químicos se caracterizan por un nombre y un símbolo, acordados por la IUPAC (International Union of Pure and Applied Chemistry).
 4. FORMULACIÓN. 4.1. SÍMBOLOS E HIDRUROS. 4.1.1. SÍMBOLOS Y VALENCIAS. Los elementos químicos se caracterizan por un nombre y un símbolo, acordados por la IUPAC (International Union of Pure and Applied
4. FORMULACIÓN. 4.1. SÍMBOLOS E HIDRUROS. 4.1.1. SÍMBOLOS Y VALENCIAS. Los elementos químicos se caracterizan por un nombre y un símbolo, acordados por la IUPAC (International Union of Pure and Applied
EJERCICIOS DE REPASO DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS
 EJERCICIOS DE REPASO DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS No hace falta hacerlos todos, ya os habréis dado cuenta de que si entendéis la lógica que hay detrás de la formulación
EJERCICIOS DE REPASO DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA COMPUESTOS BINARIOS No hace falta hacerlos todos, ya os habréis dado cuenta de que si entendéis la lógica que hay detrás de la formulación
Se conocen como sales binarias a las combinaciones de un metal con un no. metal o de dos no metales entre sí. En los compuestos de un metal y un no
 4.2. COMPUESTOS BINARIOS. 4.2.1. METAL Y NO METAL. Se conocen como sales binarias a las combinaciones de un metal con un no metal o de dos no metales entre sí. En los compuestos de un metal y un no metal,
4.2. COMPUESTOS BINARIOS. 4.2.1. METAL Y NO METAL. Se conocen como sales binarias a las combinaciones de un metal con un no metal o de dos no metales entre sí. En los compuestos de un metal y un no metal,
DEPARTAMENTO DE FÍSICA Y QUÍMICA
 Qué es formular un compuesto binario? Cuando tenemos dos elementos, uno menos electronegativo que otro, es decir uno con tendencia a ceder electrones Mm+ (m es número de oxidación o valencia) y otro con
Qué es formular un compuesto binario? Cuando tenemos dos elementos, uno menos electronegativo que otro, es decir uno con tendencia a ceder electrones Mm+ (m es número de oxidación o valencia) y otro con
FORMULA LOS SIGUIENTES COMPUESTOS. 1) Óxido crómico: CrO 3. 2) Trióxido de difósforo: P 2 O 3. 3) Óxido de cromo (III): Cr 2 O 3
 FORMULA LOS SIGUIENTES COMPUESTOS 1) Óxido crómico: CrO 3 2) Trióxido de difósforo: P 2 O 3 3) Óxido de cromo (III): Cr 2 O 3 4) Óxido de hierro (II): FeO 5) Pentaóxido de dinitrógeno: N 2 O 5 6) Óxido
FORMULA LOS SIGUIENTES COMPUESTOS 1) Óxido crómico: CrO 3 2) Trióxido de difósforo: P 2 O 3 3) Óxido de cromo (III): Cr 2 O 3 4) Óxido de hierro (II): FeO 5) Pentaóxido de dinitrógeno: N 2 O 5 6) Óxido
COMBINACIONES BINARIAS DEL HIDRÓGENO
 COMBINACIONES BINARIAS DEL HIDRÓGENO El Hidrógeno puede actuar con nº de oxidación 1- ó 1+. Cuando se combina con los elementos de los grupos 16,17 (anfígenos, halógenos) actúa con nº de oxidación 1+,
COMBINACIONES BINARIAS DEL HIDRÓGENO El Hidrógeno puede actuar con nº de oxidación 1- ó 1+. Cuando se combina con los elementos de los grupos 16,17 (anfígenos, halógenos) actúa con nº de oxidación 1+,
FORMULACIÓN Y NOMENCLATURA
 FORMULACIÓN Y NOMENCLATURA.- Formulación: Es la representación escrita de una molécula que se rige por unas normas universales establecidas por acuerdo de la comunidad científica..- Nomenclatura: Es el
FORMULACIÓN Y NOMENCLATURA.- Formulación: Es la representación escrita de una molécula que se rige por unas normas universales establecidas por acuerdo de la comunidad científica..- Nomenclatura: Es el
FORMULACIÓN QUÍMICA INORGÁNICA
 FORMULACIÓN QUÍMICA INORGÁNICA 1. VALENCIAS DE LOS ELEMENTOS QUÍMICOS MÁS CONOCIDOS Se entiende que las valencias con signo negativo se dan frente a elementos electropositivos y las valencias con signo
FORMULACIÓN QUÍMICA INORGÁNICA 1. VALENCIAS DE LOS ELEMENTOS QUÍMICOS MÁS CONOCIDOS Se entiende que las valencias con signo negativo se dan frente a elementos electropositivos y las valencias con signo
Número de oxidación. Es un número que da la carga que presentaría un átomo si los electrones de cada enlace se asignaran al átomo más electronegativo
 FORMULACIÓN Número de oxidación Es un número que da la carga que presentaría un átomo si los electrones de cada enlace se asignaran al átomo más electronegativo Las reglas de asignación del número de oxidación
FORMULACIÓN Número de oxidación Es un número que da la carga que presentaría un átomo si los electrones de cada enlace se asignaran al átomo más electronegativo Las reglas de asignación del número de oxidación
REPASO FORMULACIÓN INORGÁNICA 1
 REPASO FORMULACIÓN INORGÁNICA 1 IES TURANIANA Nombre: Fecha: RELACIÓN 1: ÓXIDOS Trióxido de azufre Dióxido de azufre Oxido de cobalto (II) Oxido de magnesio Oxido de estaño (II) Oxido de potasio Oxido
REPASO FORMULACIÓN INORGÁNICA 1 IES TURANIANA Nombre: Fecha: RELACIÓN 1: ÓXIDOS Trióxido de azufre Dióxido de azufre Oxido de cobalto (II) Oxido de magnesio Oxido de estaño (II) Oxido de potasio Oxido
SUMARIO FÓRMULAS QUÍMICAS Y SISTEMAS DE NOMENCLATURA CLASIFICACIÓN DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS INTRODUCCIÓN SUSTANCIAS SIMPLES
 Departamento de Ciencias Naturales IES Benalmádena FÍSICA Y QUÍMICA 3º ESO FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS FORMULACIÓN Y NOMENCLATURA COMBINACIONES BINARIAS INTRODUCCIÓN
Departamento de Ciencias Naturales IES Benalmádena FÍSICA Y QUÍMICA 3º ESO FORMULACIÓN Y NOMENCLATURA DE LOS COMPUESTOS QUÍMICOS INORGÁNICOS FORMULACIÓN Y NOMENCLATURA COMBINACIONES BINARIAS INTRODUCCIÓN
Reglas generales. n Se nombra electronegativo de electropositivo. n Fórmula electropositivo electronegativo
 nomenclatura Reglas generales n Se nombra electronegativo de electropositivo n El electropositivo no se modifica n El electronegativo se modificará según las reglas de n compuestos binarios, n ternarios
nomenclatura Reglas generales n Se nombra electronegativo de electropositivo n El electropositivo no se modifica n El electronegativo se modificará según las reglas de n compuestos binarios, n ternarios
FORMULACIÓN DE QUÍMICA INORGÁNICA.
 FORMULACIÓN DE QUÍMICA INORGÁNICA. A medida que fueron conociéndose los diferentes elementos químicos de la tabla periódica se vio que el número era relativamente pequeño si se compara con la gran variedad
FORMULACIÓN DE QUÍMICA INORGÁNICA. A medida que fueron conociéndose los diferentes elementos químicos de la tabla periódica se vio que el número era relativamente pequeño si se compara con la gran variedad
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA. NORMAS DE LA I.U.P.A.C
 FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA. NORMAS DE LA I.U.P.A.C El aprendizaje de la Química necesita como paso previo conocer su lenguaje. La unificación de éste fue llevada a cabo por la IUPAC
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA. NORMAS DE LA I.U.P.A.C El aprendizaje de la Química necesita como paso previo conocer su lenguaje. La unificación de éste fue llevada a cabo por la IUPAC
APUNTES DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA 3º ESO - CURSO METALES
 CONSEJERÍA DE EDUCACIÓN APUNTES DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA 3º ESO - CURSO 2012-2013 1. ELEMENTOS, SÍMBOLOS Y NÚMEROS DE OXIDACIÓN MÁS FRECUENTES EN LA FORMULACIÓN DE QUÍMICA INORGÁNICA
CONSEJERÍA DE EDUCACIÓN APUNTES DE FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA 3º ESO - CURSO 2012-2013 1. ELEMENTOS, SÍMBOLOS Y NÚMEROS DE OXIDACIÓN MÁS FRECUENTES EN LA FORMULACIÓN DE QUÍMICA INORGÁNICA
Ti: +,+,+ en los hidruros no metálicos. +,+ en los óxidos, hidróxidos, hidruros metálicos. Cr: +,+ en las sales binarias. Mn:
 Número de oxidación de un átomo en un compuesto es un número teórico que indica el número de electrones que el átomo habría perdido o ganado, si el compuesto fuera completamente iónico. El número de oxidación,
Número de oxidación de un átomo en un compuesto es un número teórico que indica el número de electrones que el átomo habría perdido o ganado, si el compuesto fuera completamente iónico. El número de oxidación,
FORMULACIÓN DE QUÍMICA INORGÁNICA 3ºESO
 Euclides Enseñanza Sociedad Cooperativa Andaluza Colegio Privado Concertado Arboleda C/ Reina Victoria 2. 41020 Sevilla Telf. 954 408126 Fax 954 440186 www.colegioarboleda.es arboleda@aces-andalucia.org
Euclides Enseñanza Sociedad Cooperativa Andaluza Colegio Privado Concertado Arboleda C/ Reina Victoria 2. 41020 Sevilla Telf. 954 408126 Fax 954 440186 www.colegioarboleda.es arboleda@aces-andalucia.org
FÍSICA Y QUÍMICA cuaderno de ejercicios
 FÍSICA Y QUÍMICA cuaderno de ejercicios FORMULACIÓN y nomenclatura 1.** Determinen si las siguientes afirmaciones se refieren a metales o a no metales. 1.1. Presentan un brillo característico. 1.2. Los
FÍSICA Y QUÍMICA cuaderno de ejercicios FORMULACIÓN y nomenclatura 1.** Determinen si las siguientes afirmaciones se refieren a metales o a no metales. 1.1. Presentan un brillo característico. 1.2. Los
NOMENCLATURA DE ÁCIDOS Y BASES
 COLEGIO SAN ESTEBAN DIÁCONO Departamento de Ciencias Química IVº Electivo Prof. Juan Pastrián Lisboa NOMENCLATURA DE ÁCIDOS Y BASES Objetivo: - Reconocer y aplicar reglas de nomenclatura tradicional y
COLEGIO SAN ESTEBAN DIÁCONO Departamento de Ciencias Química IVº Electivo Prof. Juan Pastrián Lisboa NOMENCLATURA DE ÁCIDOS Y BASES Objetivo: - Reconocer y aplicar reglas de nomenclatura tradicional y
Nombre: Curso 1. Formula las siguientes combinaciones binarias con el hidrógeno:
 Nombre: Curso 1. Formula las siguientes combinaciones binarias con el hidrógeno: 1) Ácido clorhídrico 2) Sulfuro de hidrógeno 3) Estibano 4) Agua u oxidano 5) Trihidruro de fósforo 6) Hidruro de estaño(iv)
Nombre: Curso 1. Formula las siguientes combinaciones binarias con el hidrógeno: 1) Ácido clorhídrico 2) Sulfuro de hidrógeno 3) Estibano 4) Agua u oxidano 5) Trihidruro de fósforo 6) Hidruro de estaño(iv)
Formulación de Química Inorgánica
 Formulación de Química Inorgánica F. G. Calvo-Flores 1. VALENCIA. Es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos. La valencia es
Formulación de Química Inorgánica F. G. Calvo-Flores 1. VALENCIA. Es la capacidad que tiene un átomo de un elemento para combinarse con los átomos de otros elementos y formar compuestos. La valencia es
FORMULACIÓN INORGÁNICA
 FORMULACIÓN INORGÁNICA 1. ELEMENTOS Un elemento es una sustancia que está formada por átomos de un solo elemento químico. Fe Au C H2 O2 O3 P4 S6 S8 Hierro Oro Carbono (grafito o diamante) Dihidrógeno Dioxígeno
FORMULACIÓN INORGÁNICA 1. ELEMENTOS Un elemento es una sustancia que está formada por átomos de un solo elemento químico. Fe Au C H2 O2 O3 P4 S6 S8 Hierro Oro Carbono (grafito o diamante) Dihidrógeno Dioxígeno
FORMULACIÓN INORGÁNICA IUPAC c) HIDRUROS NO METÁLICOS II (H con los grupos 16(Haluros) y 17(Anfigenuros)]
![FORMULACIÓN INORGÁNICA IUPAC c) HIDRUROS NO METÁLICOS II (H con los grupos 16(Haluros) y 17(Anfigenuros)] FORMULACIÓN INORGÁNICA IUPAC c) HIDRUROS NO METÁLICOS II (H con los grupos 16(Haluros) y 17(Anfigenuros)]](/thumbs/72/66650533.jpg) FORMULACIÓN INORGÁNICA IUPAC 2005- COMPUESTOS BINARIOS: 1.- COMBINACIONES BINARIAS CON EL OXÍGENO: a) ÓXIDOS a. METÁLICOS b. NO METÁLICOS b) HALUROS DE OXÍGENO (Oxígeno + Halógeno) c) PERÓXIDOS 2.- SALES
FORMULACIÓN INORGÁNICA IUPAC 2005- COMPUESTOS BINARIOS: 1.- COMBINACIONES BINARIAS CON EL OXÍGENO: a) ÓXIDOS a. METÁLICOS b. NO METÁLICOS b) HALUROS DE OXÍGENO (Oxígeno + Halógeno) c) PERÓXIDOS 2.- SALES
TEMA 5. ELEMENTOS Y COMPUESTOS
 I. E. S. Gamonares (Lopera Jaén) TEMA 5. ELEMENTOS Y COMPUESTOS 1. LOS ELEMENTOS QUÍMICOS 1. Identifica, dentro de estas sustancias, cuáles son elementos químicos y cuáles compuestos: a) CO2 b) HF c) P4
I. E. S. Gamonares (Lopera Jaén) TEMA 5. ELEMENTOS Y COMPUESTOS 1. LOS ELEMENTOS QUÍMICOS 1. Identifica, dentro de estas sustancias, cuáles son elementos químicos y cuáles compuestos: a) CO2 b) HF c) P4
Iniciación a la formulación y nomenclatura en Química Inorgánica.
 1.- Generalidades. 2.- Compuestos monarios. 2.1.- Sustancias neutras. 2.2.- Cationes. 2.3.- Aniones. 3.- Compuestos binarios. 3.1.- Compuestos con oxígeno. 3.2.- Sales binarias. 4.- Compuestos ternarios.
1.- Generalidades. 2.- Compuestos monarios. 2.1.- Sustancias neutras. 2.2.- Cationes. 2.3.- Aniones. 3.- Compuestos binarios. 3.1.- Compuestos con oxígeno. 3.2.- Sales binarias. 4.- Compuestos ternarios.
Formulación Inorgánica
 Formulación Inorgánica 1.- Sustancias Simples Por sustancias simples entendemos aquellas sustancias formadas por un solo tipo de elementos, podemos encontrar casos: Sustancias simples metálicas: se formulan
Formulación Inorgánica 1.- Sustancias Simples Por sustancias simples entendemos aquellas sustancias formadas por un solo tipo de elementos, podemos encontrar casos: Sustancias simples metálicas: se formulan
 FORMULACIÓN Inorgánica_ DEPARTAMENTO DE FÍSICA Y QUÍMICA http://www.juntadeandalucia.es/educacion/portalaverroes/contenidosdigitales/contenido/ndoiand-20080324-0007-las-formulas-quimicas http://agrega.juntadeandalucia.es//repositorio/28082013/c0/es-an_2013082813_9115336/ndoiand-20080324-0007/index.html
FORMULACIÓN Inorgánica_ DEPARTAMENTO DE FÍSICA Y QUÍMICA http://www.juntadeandalucia.es/educacion/portalaverroes/contenidosdigitales/contenido/ndoiand-20080324-0007-las-formulas-quimicas http://agrega.juntadeandalucia.es//repositorio/28082013/c0/es-an_2013082813_9115336/ndoiand-20080324-0007/index.html
H, Li, Na, K, Rb, Cs, Fr 1. Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd 2. B, Al 3. N, P, As, Sb 1, 3, 5. F, Cl, Br, I 1, 3, 5, 7. C, Si, Ge, Sn, Pb 2, 4 O 2
 H, Li, Na, K, Rb, Cs, Fr 1 Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd 2 B, Al 3 N, P, As, Sb 1, 3, 5 F, Cl, Br, I 1, 3, 5, 7 C, Si, Ge, Sn, Pb 2, 4 O 2 S, Se, Te 2, 4, 6 Cr 2, 3, 3, 6 Mn 2, 3, 4, 6, 7 Fe, Co, Ni 2,
H, Li, Na, K, Rb, Cs, Fr 1 Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd 2 B, Al 3 N, P, As, Sb 1, 3, 5 F, Cl, Br, I 1, 3, 5, 7 C, Si, Ge, Sn, Pb 2, 4 O 2 S, Se, Te 2, 4, 6 Cr 2, 3, 3, 6 Mn 2, 3, 4, 6, 7 Fe, Co, Ni 2,
TEMA 6: Formulación inorgánica
 TEMA 6: Formulación inorgánica Tema 6: Formulación Inorgánica 1 1.- COMPUESTOS BINARIOS Son sustancias formadas por la unión de dos elementos químicos, como por ejemplo NaH, Co O 3, Li S y PCl 3 1.1.-
TEMA 6: Formulación inorgánica Tema 6: Formulación Inorgánica 1 1.- COMPUESTOS BINARIOS Son sustancias formadas por la unión de dos elementos químicos, como por ejemplo NaH, Co O 3, Li S y PCl 3 1.1.-
Compuestos binarios (combinaciones de dos elementos) HIDRUROS METÁLICOS= Metal - Hidrógeno. X H m. H : - 1 Metales: el suyo. FeH 3
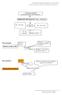 HIDRUROS METÁLICOS= Metal - Hidrógeno AlH 3 ; LiH; CuH 2 X H m KH ; FeH 3 ; ZnH 2 os N de H : - 1 Metales: el suyo Hidruro de hierro(iii) Metal a la izquierda FeH 3 Hidrógeno a la derecha (el mas electronegativo
HIDRUROS METÁLICOS= Metal - Hidrógeno AlH 3 ; LiH; CuH 2 X H m KH ; FeH 3 ; ZnH 2 os N de H : - 1 Metales: el suyo Hidruro de hierro(iii) Metal a la izquierda FeH 3 Hidrógeno a la derecha (el mas electronegativo
Tema 1 : Nomenclatura y formulación Química Inorgánica
 Tema 1 : Nomenclatura y formulación Química Inorgánica Esquema de trabajo: Introducción Compuestos Binarios 1. Combinaciones binarias del oxígeno 2. Combinaciones binarias del hidrógeno 3. Sales binarias
Tema 1 : Nomenclatura y formulación Química Inorgánica Esquema de trabajo: Introducción Compuestos Binarios 1. Combinaciones binarias del oxígeno 2. Combinaciones binarias del hidrógeno 3. Sales binarias
3º ESO 1. 1, 2, 3, 4, 5 Y
 FÍSICA Y QUÍMICA 2º ESO 1. Debe hacer un resumen de los temas 1, 2, 3, 4, 5, 6 y 7. 2. Debe entregar un folio con el esquema de las ecuaciones utilizadas en cada uno de los temas de física y química. 3.
FÍSICA Y QUÍMICA 2º ESO 1. Debe hacer un resumen de los temas 1, 2, 3, 4, 5, 6 y 7. 2. Debe entregar un folio con el esquema de las ecuaciones utilizadas en cada uno de los temas de física y química. 3.
Calcio(2+) Hierro(3+)
 CATIONES MONOATÓMICOS MONOATÓMICOS La carga se indica con un superíndice a la derecha del símbolo del elemento seguido del signo + Ca + Fe 3+ La carga se indica con un superíndice a la derecha seguido
CATIONES MONOATÓMICOS MONOATÓMICOS La carga se indica con un superíndice a la derecha del símbolo del elemento seguido del signo + Ca + Fe 3+ La carga se indica con un superíndice a la derecha seguido
FORMULACIÓN INORGÁNICA:
 FORMULACIÓN INORGÁNICA: Formular un compuesto consiste en expresar la fórmula química de dicho compuesto. Es decir, indicar qué tipo de átomos (qué elementos) están presentes en la molécula (o en la red
FORMULACIÓN INORGÁNICA: Formular un compuesto consiste en expresar la fórmula química de dicho compuesto. Es decir, indicar qué tipo de átomos (qué elementos) están presentes en la molécula (o en la red
FORMULACIÓN Ficha Nº 13
 FORMULACIÓN Ficha Nº 13 ÓXIDOS Y PERÓXIDOS NOMBRAR FÓRMULA 1. Fe O 2. Fe 2 O 3 3. S O 4. S O 2 5. S O 3 6. Pb O 2 7. Pb O 8. Ca O 2 9. Cr O 10. Cr 2 O 3 11. O Br 2 12. O 3 Br 2 13. O 5 Br 2 14. Li 2 O
FORMULACIÓN Ficha Nº 13 ÓXIDOS Y PERÓXIDOS NOMBRAR FÓRMULA 1. Fe O 2. Fe 2 O 3 3. S O 4. S O 2 5. S O 3 6. Pb O 2 7. Pb O 8. Ca O 2 9. Cr O 10. Cr 2 O 3 11. O Br 2 12. O 3 Br 2 13. O 5 Br 2 14. Li 2 O
Ejercicios y respuestas del apartado: Formulación de compuestos inorgánicos: Reglas básicas; Compuestos binarios; Compuestos ternarios más habituales
 Ejercicios y respuestas del apartado: Formulación de compuestos inorgánicos: Reglas básicas; Compuestos binarios; Compuestos ternarios más habituales 2 de 12 Tipo de compuesto Relaciona estos compuestos:
Ejercicios y respuestas del apartado: Formulación de compuestos inorgánicos: Reglas básicas; Compuestos binarios; Compuestos ternarios más habituales 2 de 12 Tipo de compuesto Relaciona estos compuestos:
Un elemento es una sustancia que no puede descomponerse en sustancias más simples, y está compuesta por una sola clase de átomos.
 Elementos químicos en Costa Rica Elementos Químicos en Costa Rica Un elemento es una sustancia que no puede descomponerse en sustancias más simples, y está compuesta por una sola clase de átomos. La mayoría
Elementos químicos en Costa Rica Elementos Químicos en Costa Rica Un elemento es una sustancia que no puede descomponerse en sustancias más simples, y está compuesta por una sola clase de átomos. La mayoría
Ejercicios Nomenclatura Inorgánica
 Ejercicios Nomenclatura Inorgánica 1. De nombre a los siguientes compuestos: 1. Cl 2 O 7 2. FeO 3. N 2 O 4. SO 3 5. Cr 2 O 3 6. P 2 O 5 2. Indique la fórmula de los siguientes compuestos: 1. Trióxido de
Ejercicios Nomenclatura Inorgánica 1. De nombre a los siguientes compuestos: 1. Cl 2 O 7 2. FeO 3. N 2 O 4. SO 3 5. Cr 2 O 3 6. P 2 O 5 2. Indique la fórmula de los siguientes compuestos: 1. Trióxido de
FÍSICA Y QUÍMICA 4º DE ESO CURSO 16/ 17
 FÍSICA Y QUÍMICA 4º DE ESO CURSO 16/ 17 Alumno/a: 1. Completa la tabla, utilizando el SP: NOMBRE SÍMBOLO Z A P + e - N CARGA *catión *anión *carga 0 24 28 3+ 65 28 35 Cobre 63 29 0 33 75 36 18 16 2-29
FÍSICA Y QUÍMICA 4º DE ESO CURSO 16/ 17 Alumno/a: 1. Completa la tabla, utilizando el SP: NOMBRE SÍMBOLO Z A P + e - N CARGA *catión *anión *carga 0 24 28 3+ 65 28 35 Cobre 63 29 0 33 75 36 18 16 2-29
UD 2 ENLACE QUÍMICO Y FUERZAS INTERMOLECULARES FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS TERNARIOS
 FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS TERNARIOS Ácidos oxoácidos o ternarios Se formulan añadiendo una molécula de agua a los óxidos no metálicos. Óxidos no metálicos Cl 2 O SO Cl 2 O 3 SO 2 N 2 O 3
FORMULACIÓN Y NOMENCLATURA DE COMPUESTOS TERNARIOS Ácidos oxoácidos o ternarios Se formulan añadiendo una molécula de agua a los óxidos no metálicos. Óxidos no metálicos Cl 2 O SO Cl 2 O 3 SO 2 N 2 O 3
1. Nombra los siguientes compuestos por medio de dos tipos de nomenclatura:
 FORMULACIÓN Y NOMENCLATURA DE QUÍMICA Bachillerato Especies químicas inorgánicas 1. Nombra los siguientes compuestos por medio de dos tipos de nomenclatura: a) SO 2 b) CO c) Rb 2 O d) Sc 2 O 3 e) OF 2
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA Bachillerato Especies químicas inorgánicas 1. Nombra los siguientes compuestos por medio de dos tipos de nomenclatura: a) SO 2 b) CO c) Rb 2 O d) Sc 2 O 3 e) OF 2
Formulación y nomenclatura inorgánica
 Formulación y nomenclatura inorgánica Números de oxidación Algunos de los números de oxidación con que actúan los elementos en los compuestos más frecuentes son los de la siguiente lista: Metales: +1 Li,
Formulación y nomenclatura inorgánica Números de oxidación Algunos de los números de oxidación con que actúan los elementos en los compuestos más frecuentes son los de la siguiente lista: Metales: +1 Li,
Nomenclatura Inorgánica
 Nomenclatura Inorgánica Nomenclatura Química O Es el sistema de normas, comunes en todo el mundo, para denominar a los elementos y compuestos químicos. O El organismo encargado de dictar tales normas se
Nomenclatura Inorgánica Nomenclatura Química O Es el sistema de normas, comunes en todo el mundo, para denominar a los elementos y compuestos químicos. O El organismo encargado de dictar tales normas se
Ejercicios de la unidad didáctica 4.- Formulación y nomenclatura.
 Nombre y apellidos: Ejercicios de la unidad didáctica 4.- Formulación y nomenclatura. 1 Los elementos que debes conocer este curso están recogidos en las siguientes tablas. Complétalas escribiendo los
Nombre y apellidos: Ejercicios de la unidad didáctica 4.- Formulación y nomenclatura. 1 Los elementos que debes conocer este curso están recogidos en las siguientes tablas. Complétalas escribiendo los
Formulación inorgánica. Tema 5
 Formulación inorgánica Tema 5 Valencia A valencia é a capacidade que ten un átomo dun determinado elemento para combinarse con outros átomos A valencia é un número negativo ou positivo e indica o número
Formulación inorgánica Tema 5 Valencia A valencia é a capacidade que ten un átomo dun determinado elemento para combinarse con outros átomos A valencia é un número negativo ou positivo e indica o número
Un átomo de sodio (Na) y otro de cloro(cl) Dos átomos de hidrógeno (H) y uno de oxígeno (O)
 Símbolos Un elemento químico es aquel compuesto químico que no puede ser descompuesto en otros más simples. Se conocen más de cien elementos químicos, aunque en la naturaleza sólo aparecen noventa, los
Símbolos Un elemento químico es aquel compuesto químico que no puede ser descompuesto en otros más simples. Se conocen más de cien elementos químicos, aunque en la naturaleza sólo aparecen noventa, los
Formulación Inorgánica
 Formulación Inorgánica Sustancias elementales: Son las que están constituidas por átomos de un elemento, constituyen la molécula del elemento. A. Sustancias monoatómicas: Se representan y nombran igual
Formulación Inorgánica Sustancias elementales: Son las que están constituidas por átomos de un elemento, constituyen la molécula del elemento. A. Sustancias monoatómicas: Se representan y nombran igual
REPASO: FORMULACIÓN INORGÁNICA
 COMPUESTOS BINARIOS REPASO: FORMULACIÓN INORGÁNICA OXÍGENO + METAL ÓXIDOS BÁSICOS COMPUESTOS BINARIOS CON OXÍGENO OXÍGENO + NO METAL ÓXIDOS ÁCIDOS El oxígeno se combina con todos los elementos excepto
COMPUESTOS BINARIOS REPASO: FORMULACIÓN INORGÁNICA OXÍGENO + METAL ÓXIDOS BÁSICOS COMPUESTOS BINARIOS CON OXÍGENO OXÍGENO + NO METAL ÓXIDOS ÁCIDOS El oxígeno se combina con todos los elementos excepto
FORMULACIÓN DE QUÍMICA INORGÁNICA
 DE QUÍMICA INORGÁNICA Del mismo modo que utilizamos las palabras para comunicarnos, en química recurrimos a las fórmulas para representar los compuestos. Estas fórmulas no son arbitrarias, sino que responden
DE QUÍMICA INORGÁNICA Del mismo modo que utilizamos las palabras para comunicarnos, en química recurrimos a las fórmulas para representar los compuestos. Estas fórmulas no son arbitrarias, sino que responden
ESTRUCTURA INTERNA DE LA MATERIA. LOS ÁTOMOS
 1. DE DEMÓCRITO A DALTON ESTRUCTURA INTERNA DE LA MATERIA. LOS ÁTOMOS Hasta dónde podemos dividir una sustancia? Tomamos un terrón de azúcar y lo partimos por la mitad. Elegimos una de las dos mitades
1. DE DEMÓCRITO A DALTON ESTRUCTURA INTERNA DE LA MATERIA. LOS ÁTOMOS Hasta dónde podemos dividir una sustancia? Tomamos un terrón de azúcar y lo partimos por la mitad. Elegimos una de las dos mitades
FORMULACIÓN INORGÁNICA 2º ESO. COLEGIO HIJAS DE JESÚS PAMPLONA.
 0. INTRODUCCIÓN. Formulación de química inorgánica basada en las recomendaciones de IUPAC (Internacional Union of Pure and Applied Chemistry) INDICE: 1. Sustancias elementales o simples 2. Compuestos binarios
0. INTRODUCCIÓN. Formulación de química inorgánica basada en las recomendaciones de IUPAC (Internacional Union of Pure and Applied Chemistry) INDICE: 1. Sustancias elementales o simples 2. Compuestos binarios
FORMULACIÓN (4º ESO)
 FORMULACIÓN (4º ESO) Valencia. Es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado. NO METALES H (1) -1 +1 METALES Li, Na, K, Rb,
FORMULACIÓN (4º ESO) Valencia. Es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado. NO METALES H (1) -1 +1 METALES Li, Na, K, Rb,
