FICHA TÉCNICA GARDASIL. 2. Denominación genérica Vacuna recombinante tetravalente contra el virus de papiloma humano
|
|
|
- Daniel Castillo Henríquez
- hace 6 años
- Vistas:
Transcripción
1 1. Denominación distintiva FICHA TÉCNICA 2. Denominación genérica Vacuna recombinante tetravalente contra el virus de papiloma humano 3. Composición cualitativa y cuantitativa Cada dosis de 0.5 ml contiene: Vacuna tetravalente de partículas parecidas a virus contra el virus del papiloma humano de los siguientes tipos: Proteína L1 Tipo 6 20 µg Proteína L1 Tipo µg Proteína L1 Tipo µg Proteína L1 Tipo µg Vehículo cbp 0.5 ml 4. Forma farmacéutica Suspensión 5. Datos clínicos 5.1 Indicaciones terapéuticas es una vacuna indicada en niñas y mujeres de 9 a 45 años de edad para la prevención del cáncer cervicouterino, vulvar, vaginal y anal; de las lesiones precancerosas o displásicas; de las verrugas genitales; y de la infección causados por el virus del papiloma humano (VPH). está indicada para prevenir las siguientes enfermedades: Cáncer cervicouterino, vulvar, vaginal y anal causados por el VPH tipos 16 y 18 Verrugas genitales (condilomas acuminados) causados por el VPH tipos 6 y 11 Y para las infecciones y las siguientes lesiones precancerosas o displásicas causadas por el VPH tipos 6, 11, 16, y 18: Neoplasia intraepitelial cervical (NIC) grado 2/3 y adenocarcinoma cervicouterino in situ (AIS, por sus siglas en inglés) Neoplasia intraepitelial cervical (NIC) de grado 1 Página 1 de 17
2 Neoplasia intraepitelial vulvar (NIV) de grados 2 y 3 Neoplasia intraepitelial vaginal (NIVa) de grados 2 y 3 NIV grado 1 y NIVa grado 1 Neoplasia intraepitelial anal (NIA) de grados 1, 2 y 3 también proporciona protección en niñas y mujeres de 9 a 26 años de edad en contra de la NIC (grados 1, 2, 3) o AIS relacionados con el VPH 31, 33, 52 y 58. está indicado en niños y hombres de 9 a 26 años de edad para la prevención de lesiones genitales externas e infecciones y las siguientes enfermedades causadas por el VPH de los tipos incluidos en la vacuna: Cáncer anal causado por el VPH tipos 16 y 18 Verrugas genitales (condiloma acuminado) causado por el VPH tipos 6 y 11 Y las siguientes lesiones displásicas o precancerosas causadas por el VPH tipos 6, 11, 16 y 18: Neoplasia intraepitelial anal (NIA) grados 1, 2 y Posología y vía de administración debe administrarse por vía intramuscular, en forma de tres dosis individuales de 0.5 ml, con el siguiente esquema: Primera dosis: en la fecha elegida Segunda dosis: dos meses después de la primera dosis Tercera dosis: seis meses después de la primera dosis Debe alentarse a los individuos para que se apeguen al esquema de vacunación de los 0, 2 y 6 meses. Sin embargo, en los estudios clínicos se ha demostrado su eficacia en individuos que recibieron las tres dosis en el transcurso de un año. La segunda dosis debe administrarse cuando menos un mes después de la primera, y la tercera dosis debe administrarse cuando menos tres meses después de la segunda. Las tres dosis deben de administrarse dentro de un periodo de un año. Alternativamente, en pacientes de 9 a 13 años de edad, puede ser administrado en un esquema de dos dosis (0, 6 meses, ó 0, 12 meses). El uso de debe ser de acuerdo a las recomendaciones oficiales. Página 2 de 17
3 Se recomienda que los pacientes que recibieron la primera dosis de completen el ciclo de vacunación con. No se ha establecido la necesidad de una dosis de refuerzo. Método de Administración debe administrarse por vía intramuscular, en la región deltoidea del brazo o en la zona anterolateral y superior del muslo. no debe inyectarse intravascularmente. No se han estudiado ni la administración subcutánea ni la intradérmica, y por consiguiente estos métodos de administración no se recomiendan. La jeringa prellenada es para un solo uso, y no debe usarse para más de una persona. En el caso de los frascos ámpula, deben usarse una jeringa y una aguja estériles distintas para cada persona. La vacuna debe administrarse tal como se presenta; no es necesario diluirla ni reconstituirla. Debe usarse la dosis completa recomendada de la vacuna. Agítese bien antes de usarse. Es necesario agitar la vacuna con energía, inmediatamente antes de administrarla, para mantener el estado de suspensión. Después de agitarlo completamente, es un líquido blanco turbio. Los medicamentos de uso parenteral deben inspeccionarse visualmente antes de su administración, en busca de partículas suspendidas y alteraciones de color. Debe desecharse el producto si contiene partículas o si presenta cambios de color. Modo de empleo de los frascos ámpula de dosis única Extraiga la dosis de 0.5 ml de vacuna del frasco ámpula de dosis única con una jeringa y una aguja estériles y libres de conservadores, antisépticos y detergentes Una vez que se haya perforado el tapón del frasco ámpula de dosis única, debe usarse de inmediato la vacuna extraída y desecharse el frasco ámpula. Modo de empleo de la jeringa prellenada Inyecte el contenido completo contenido en la jeringa prellenada. 5.3 Contraindicaciones Hipersensibilidad a las sustancias activas o a cualquiera de los excipientes de la vacuna. Los individuos que presenten síntomas indicativos de hipersensibilidad después de recibir una dosis de no deben recibir más dosis de. 5.4 Advertencias y precauciones especiales de uso Al igual que con cualquier vacuna, la aplicación de puede no brindar protección en todos los individuos vacunados con ella. Esta vacuna no está indicada para el tratamiento de lesiones genitales externas activas; cáncer cervical, vulvar, vaginal, o anal; NIC, NIV, NIVa, o NIA. Página 3 de 17
4 Esta vacuna no protege contra enfermedades que no sean causadas por el VPH. Al igual que con todas las vacunas inyectables, siempre debe tenerse disponible el tratamiento médico adecuado, en caso de que se presenten reacciones anafilácticas raras después de administrar la vacuna. Puede suceder síncope (pérdida súbita del estado de conciencia) en cualquier momento de la vacunación, especialmente en adolescentes y adultos jóvenes. El síncope, algunas veces asociado con caída, ha ocurrido después de la vacunación con. Por lo tanto, los vacunados deben permanecer en observación por aproximadamente 15 minutos después de la administración de. La decisión de administrar la vacuna o posponerla debido a una enfermedad febril presente o reciente depende en gran medida de la gravedad de los síntomas y de su origen. La febrícula en sí y las infecciones leves de las vías respiratorias altas no suelen ser contraindicaciones para la vacunación. Las personas con una respuesta inmune deficiente, ya sea por el empleo de tratamiento inmunosupresor, un defecto genético, infección por el Virus de la Inmunodeficiencia Humana (VIH) u otras causas, pueden tener una menor respuesta de anticuerpos a la inmunización activa. Esta vacuna debe administrarse con cautela a las personas que padezcan trombocitopenia o cualquier trastorno de la coagulación, ya que en ellas puede haber una hemorragia después de la inyección intramuscular. Debe evitarse el embarazo durante el esquema de vacunación con Empleo en niños y niñas No se han evaluado la seguridad y eficacia de en niños y niñas menores de 9 años de edad. Empleo en adultos mayores No se han evaluado la seguridad y eficacia de en adultos mayores de 45 años de edad. Empleo en poblaciones especiales No se han evaluado a fondo la seguridad, la inmunogenicidad y la eficacia de en personas con infección por el VIH. 5.5 Interacciones medicamentosas y de otro género Uso concomitante con otras vacunas Página 4 de 17
5 Los resultados de los estudios clínicos indican que puede administrarse de manera simultánea (en un sitio de inyección distinto) con la vacuna contra la hepatitis B (recombinante), Vacuna Meningocócica (Grupos A, C, Y y W-135), Vacuna Polisacárida Conjugada con Toxoide Diftérico; Vacuna de Toxoide Tetánico, Toxoide Tetánico Reducido y Vacuna Adsorbida de Tosferina Acelular (Tdap); Vacuna de Difteria, Tétanos, Tosferina (componente acelular,) y Vacuna contra la Poliomielitis (inactivada), (contenido de antígeno(s) adsorbido, reducido). Uso concomitante con medicamentos comunes En los estudios clínicos en niñas y mujeres (9 a 26 años de edad), 11.9%, 9.5%, 6.9% y 4.3% de los participantes usaron analgésicos, anti-inflamatorios, antibióticos y preparados de vitaminas, respectivamente. En un estudio clínico en mujeres (24 a 45 años de edad), 30.6%, 20.2%, 11.6%, y 7.5% de las participantes utilizaron analgésicos, fármacos anti-inflamatorios, antibióticos, y vitaminas, respectivamente. Recíprocamente en un estudio clínico en niños y hombres (24 a 45 años de edad), 10.3%, 7.8%, 6.8%, 3.4% y 2.6% de los participantes utilizaron analgésicos, fármacos antiinflamatorios, antibióticos, antihistamínicos y vitaminas, respectivamente. El empleo de tales medicamentos no influyó en la eficacia, inmunogenicidad y seguridad de la vacuna. Uso concomitante con anticonceptivos hormonales En los estudios clínicos, 50.2% de las mujeres (entre 16 y 45 años de edad) que recibieron empleaban anticonceptivos hormonales. El empleo de anticonceptivos hormonales no pareció afectar la respuesta inmune a. Uso concomitante con esteroides En los estudios clínicos en niñas y mujeres (16 a 26 años de edad), 1.7% (n = 158), 0.6% (n = 56) y 1.0% (n = 89) de las participantes usaron inmunosupresores inhalados, tópicos y parenterales, respectivamente. En un estudio clínico en mujeres (24 a 45 años de edad), 1.4% (n = 27) utilizaron corticoesteroides para uso sistémico. En un estudio clínico en niños y hombres (16 a 26 años de edad), 1.0% (n = 21) utilizaron corticoesteroides para uso sistémico. Los corticoesteroides para todos los participantes fueron administrados cerca del momento de administración de una dosis de. Estos medicamentos no parecieron afectar la respuesta inmune a. Muy pocos participantes en los estudios clínicos tomaban esteroides, y se piensa que el grado de inmunosupresión causado por estos fue leve. Uso concomitante con inmunosupresores sistémicos No hay información sobre el uso concomitante de inmunosupresores potentes y. Las personas que reciben tratamiento con agentes inmunosupresores (dosis sistémicas de corticoesteroides, antimetabolitos, agentes alquilantes o citotóxicos) pueden no responder de manera óptima a la inmunización activa. Página 5 de 17
6 5.6 Manifestaciones y manejo de la sobredosis o ingesta accidental Se ha reportado la administración de dosis de superiores a las recomendadas. En general, el perfil de reacciones adversas reportadas con la sobredosis fue comparable al de las dosis únicas recomendadas de. 5.7 Restricciones de uso durante el embarazo y la lactancia Embarazo Estudios en Ratas Hembras Los estudios en animales no mostraron ningún efecto dañino, directo o indirecto, con respecto al embarazo, el desarrollo embrionario y fetal, el parto y el desarrollo posnatal. indujo una respuesta de anticuerpos específicos contra el VPH de los tipos 6, 11, 16 y 18 en ratas gestantes después de una o varias inyecciones intramusculares. Los anticuerpos contra los cuatro tipos se transfirieron a las crías durante la gestación y, posiblemente, la lactancia. Estudios Clínicos en Humanos No hay estudios adecuados y bien controlados en mujeres embarazadas. Dado que los estudios de reproducción en animales no siempre pueden predecir la respuesta en los seres humanos, debe evitarse el embarazo durante el periodo de vacunación con. En los estudios clínicos, las participantes se sometieron a una prueba de embarazo en orina antes de administrarles cada dosis de. A las mujeres en quienes se diagnosticó un embarazo antes completar el esquema de tres dosis de se les indicó que pospusieran la conclusión del esquema de vacunación hasta después del embarazo. Tales esquemas no convencionales generaron una respuesta de anticuerpos contra el VPH de los tipos 6, 11, 16 y 18, después de la tercera dosis, comparable con las observadas en mujeres que recibieron un esquema de vacunación convencional a los 0, 2 y 6 meses. Durante los estudios clínicos, 3,819 mujeres (N = 1,894 con vacuna vs. N = 1,925 con placebo) reportaron cuando menos un embarazo. Las proporciones globales de embarazos con desenlace desfavorable definido como el número combinado de casos de aborto espontáneo, muerte fetal tardía y anomalías congénitas, excluídas del número total de desenlaces de embarazos para los cuales se conoció el desenlace (y excluyendo las terminaciones electivas), fueron 22.6% (446/1,973) en las participantes que recibieron y 23.1% (460/1,994) en las participantes que recibieron placebo. Página 6 de 17
7 Se realizaron sub-análisis ulteriores para evaluar los embarazos cuyo inicio se calculó en los 30 días siguientes o más de 30 días después de la administración de una dosis de o placebo. Entre los embarazos cuyo inicio se calculó en los 30 días siguientes a la vacunación, se observaron cinco casos de anomalías congénitas en el grupo que recibió, en comparación con 1 caso de anomalía congénita en el grupo que recibió placebo. A la inversa, entre los embarazos cuyo inicio se calculó más de 30 días después de la vacunación, se observaron 40 casos de anomalías congénitas en el grupo que recibió, en comparación con 33 casos de anomalías congénitas en el grupo que recibió placebo. El tipo de anomalías observadas concordó con las que se observan por lo general en los embarazos de mujeres entre16 a 45 años de edad, independientemente de la fecha de inicio del embarazo con respecto a la vacunación. Por lo tanto, no hay evidencia que sugiera que la administración de influye negativamente sobre la fertilidad o el desenlace del embarazo o de los recién nacidos. Los datos de administrada durante el embarazo no sugirieron ningún problema de seguridad. Sin embargo, estos datos son insuficientes para recomendar el uso de durante el embarazo. La vacunación se debe posponer hasta el término del embarazo. Madres lactantes Se desconoce si los antígenos de la vacuna o los anticuerpos que induce se excretan en la leche materna. Debido a que muchos fármacos se excretan en la leche humana, se debe de tener precaución cuando se aplique a una mujer que este amamantando. En los estudios con no se ha encontrado una contraindicación de su uso en la lactancia. puede ser administrada a mujeres lactando. o placebo fueron administrados a un total de 1,133 mujeres que amamantaron en cualquier momento durante los estudios clínicos Fase III. En dichos estudios, la frecuencia de reacciones adversas en las madres y los lactantes fue comparable entre los distintos grupos de vacunación. Además, la inmunogenicidad de la vacuna fue comparable entre las madres lactantes y las mujeres que no amamantaron durante la administración de la vacuna. 5.8 Efectos sobre la capacidad de conducir y utilizar máquinas No se reporta información Página 7 de 17
8 5.9 Reacciones secundarias y adversas Estudios Clínicos En 7 estudios clínicos (6 de ellos controlados con placebo), se administró a los participantes o placebo el día de su ingreso y aproximadamente 2 y 6 meses después. demostró un perfil de seguridad favorable cuando se le comparó con el placebo (ya fuese que este contuviera aluminio o no). Pocos participantes (0.2%) abandonaron los estudios por reacciones adversas. En todos los estudios clínicos salvo uno, la seguridad se evaluó mediante monitoreo apoyado en una bitácora o "libreta de calificaciones" durante 14 días después de cada inyección de o placebo. Los participantes a quienes se monitoreó con el uso de la bitácora fueron 10,088 que recibieron (6,995 niñas y mujeres de 9 a 45 años de edad y 3,093 niños y hombres de 9 a 26 años de edad al momento del ingreso) y 7,995 que recibieron placebo. En quienes recibieron, se observaron las siguientes reacciones adversas relacionadas con la vacuna, con una frecuencia de cuando menos 1.0% y también con una frecuencia mayor que en quienes recibieron placebo y se encuentran listadas de acuerdo a la frecuencia y órgano o sistema relacionado. Las clasificaciones de frecuencia son las siguientes: Muy comunes ( 1/10); Comunes ( 1/100, <1/10); Poco comunes ( 1/1,000, <1/100); Raras ( 1/10,000, <1/1,000); Muy raras (<1/10,000) Reacciones adversas relacionadas con la vacunación en niñas y mujeres de 9 a 45 años de edad Trastornos del sistema nervioso Muy comunes: cefalea Comunes: mareo Trastornos gastrointestinales Comunes: náusea Trastornos musculoesqueléticos y del tejido conectivo Comunes: dolor en la extremidad Trastornos generales y del sitio de administración Muy comunes: pirexia Página 8 de 17
9 Las siguientes reacciones en el sitio de inyección se presentaron con una incidencia mayor en el grupo que recibió comparado con los grupos de adyuvante de sulfato hidroxifosfato de aluminio amorfo o con el grupo que recibió solución salina como placebo: Muy comunes: eritema, dolor, e hinchazón. Comunes: prurito y hematoma. La mayoría de las reacciones en el sitio de inyección fueron de intensidad leve a moderada. Además, se reportó broncoespasmo muy rara vez, como una reacción adversa grave. Reacciones adversas relacionadas con la vacunación en niños y hombres de 9 a 26 años de edad Trastornos del sistema nervioso Comunes: cefalea Trastornos generales y del sitio de administración Comunes: pirexia Las siguientes reacciones en el sitio de la inyección ocurrieron con mayor incidencia en el grupo que recibió comparado con aquellos del grupo que contenía adyuvante de sulfato hidroxifosfato de aluminio amorfo o placebo de solución salina: Muy comunes: eritema, dolor e hinchazón. Las siguientes reacciones en el sitio de la inyección ocurrieron con mayor incidencia en el grupo que recibió comparado con aquellos del grupo que contenía adyuvante de sulfato hidroxifosfato de aluminio amorfo o placebo de solución salina: Comunes: hematoma. La mayoría de las reacciones en el sitio de inyección fueron de leves a moderadas. Administración concomitante con otras vacunas La seguridad de administrada simultáneamente con otras vacunas fue evaluada en estudios clínicos. La frecuencia de las reacciones adversas observadas con la administración simultánea con la vacuna de hepatitis B (recombinante) fue similar a la frecuencia observada cuando se administró sola. Página 9 de 17
10 Hubo un aumento de cefalea e inflamación en el sitio de inyección, cuando se administró simultáneamente con la Vacuna de Difteria, Tétanos, Tosferina (componente acelular) y Poliomielitis (inactivada) (contenido de antígeno(s) adsorbido, reducido). Hubo un incremento en la inflamación en el sitio de inyección, cuando se administró simultáneamente con la Vacuna Meningocócica (Grupos A, C, Y y W-135), Vacuna Polisacárida Conjugada con Toxoide Diftérico y Toxoide Tetánico, Toxoide Diftérico Reducido y Vacuna Adsorbida de Tosferina Acelular (Tdap). La mayoría de estas experiencias adversas observadas con la administración concomitante con otras vacunas se reportaron en intensidad de leve a moderada. Reportes post-comercialización Las siguientes reacciones adversas se han reportado de manera espontánea después de la aprobación de uso de. Debido a que estas reacciones fueron reportadas de manera voluntaria por una población de tamaño desconocido, no es posible estimar de manera confiable su frecuencia o establecer una relación causal con la exposición a la vacuna. Infecciones e infestaciones: celulitis Trastornos hematológicos y del sistema linfático: púrpura trombocitopénica idiopática, linfadenopatia Trastornos del sistema nervioso: encefalomielitis diseminada aguda, mareo, síndromede Guillain-Barré, cefalea, síncope algunas veces acompañado por movimientos tónico-clónicos. Trastornos gastrointestinales: náusea, vómito. Trastornos musculoesqueléticos y del tejido conectivo: artralgia, mialgia. Trastornos generales y del sitio de administración: astenia, escalofrío, fatiga, malestar. Trastornos del sistema inmunitario: reacciones de hipersensibilidad incluyendo reacciones anafilácticas/anafilactoides, broncoespasmo y urticaria. 6. Propiedades farmacológicas Página 10 de 17
11 6.1 Propiedades farmacodinámicas FICHA TÉCNICA contiene partículas parecidas a virus (PPV) de L1, las cuales son proteínas que semejan los viriones naturales. Dado que las partículas parecidas a virus no contienen ADN viral, no pueden infectar a las células ni reproducirse. En los estudios preclínicos, la inducción de anticuerpos contra el papilomavirus con las vacunas de PPV de L1 confirió protección contra la infección. La administración del suero de los animales vacunados a animales no vacunados logró transferir la protección contra el VPH a los segundos. Estos datos sugieren que la eficacia de las vacunas de PPV de L1 está mediada por la aparición de una respuesta inmune humoral. 6.2 Propiedades farmacocinéticas Análisis específicos de tipo con estándares específicos de tipo fueron utilizados para evaluar la inmunogenicidad contra cada tipo de VPH de la vacuna. Estos Inmunoensayos multiples competitivos Luminex midieron anticuerpos contra epítopes neutralizantes para cada tipo de VPH, en lugar de los anticuerpos totales dirigidos contra las partículas parecidas al virus de la vacuna. Las escalas para estos ensayos son únicas para cada tipo de VPH; por lo tanto, las comparaciones entre tipos y con otros análisis carecen de significado. Se demostró que los análisis empleados para medir la respuesta inmune a se correlacionaron con la capacidad para neutralizar los viriones vivos de VPH. Debido a la muy alta eficacia de en los estudios clínicos, no ha sido posible establecer los niveles mínimos de anticuerpos anti-vph 6, anti- VPH 11, anti-vph 16 y anti-vph 18 que protegen contra la enfermedad clínica por VPH. La inmunogenicidad de se evaluó en 23,951 mujeres y niñas de 9 a 45 años de edad (, N = 12,634; placebo, N = 11,317) y en 5,417 niños y hombres de 9 a 26 años de edad (, N = 3,109; placebo, N = 2,308). Los análisis primarios de inmunogenicidad se llevaron a cabo en una población de inmunogenicidad con apego al protocolo (PPI). Esta población consistió en individuos que eran seronegativos y tenían una reacción de cadena de polimerasa (PCR) negativa para el tipo o tipos relevantes de VPH a su ingreso, que mantuvieron una PCR negativa para el tipo o tipos relevantes de VPH hasta un mes después de la tercera dosis (Mes 7), que recibieron las tres dosis de vacuna y que no se desviaron del protocolo del estudio de alguna manera que pudiera interferir con los efectos de la vacuna. La inmunogenicidad fue medida por (1) el porcentaje de participantes que fueron seropositivos para anticuerpos contra los tipos relevantes de la vacuna de VPH, y (2) los Títulos Geométricos Promedio (TGP). Respuesta Inmune a en el Mes 7 en Niñas y Mujeres de 9 a 45 Años de Edad (Tiempo Aproximado al Pico Máximo de Inmunogenicidad) Página 11 de 17
12 En la población PPI de 9 a 45 años de edad, la seropositividad en el Mes 7 fluctuó de 96.4% a 99% a través de los 4 tipos de la vacuna y a través de las poblaciones definidas por rango de edad. Los TGPs anticuerpos anti-vph para todos los tipos disminuyeron con la edad. Este hallazgo era de esperarse, ya que las respuestas inmunes a las vacunas generalmente disminuyen con la edad de la vacunación. La eficacia de permaneció alta a pesar de la disminución observada en los TGPs anti-vph relacionados con la edad. Respuesta Inmune a en el mes 7 en Niños y Hombres de 9 a 26 Años de Edad (Tiempo Aproximado al Pico Máximo de Inmunogenicidad) En la población PPI de 9 a 26 años de edad, la seropositividad en el Mes 7 fluctuó de 97.4% a 99.9% a través de los 4 tipos de la vacuna y a través de las poblaciones definidas por rango de edad. Los TGPs de anticuerpos anti-vphpara todos los tipos disminuyeron con la edad. Este hallazgo era de esperarse, ya que las respuestas inmunes a las vacunas generalmente disminuyen con la edad de la vacunación. La eficacia de permaneció alta a pesar de la disminución observada en los TGPs anti-vph relacionados con la edad. Comparación de la eficacia de en los adultos y en los adolescentes Un estudio clínico comparó las respuestas contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18 en mujeres adolescentes de 10 a 15 años de edad con las respuestas en niñas y mujeres de 16 a 23 años de edad. Entre las niñas y mujeres que recibieron, 99.1% a 100% se volvieron seropositivas contra el VPH-6, el VPH-11, el VPH-16 y el VPH-18, respectivamente, un mes después de la tercera dosis. Las respuestas anti- VPH, en mujeres adolescentes de 10 a 15 años de edad, fueron significativamente superiores a las observadas en las niñas y mujeres de 16 a 23 años de edad. Se observaron resultados similares en una comparación de las respuestas anti-vph un mes después de la tercera dosis en mujeres adolescentes de 9 a 15 años de edad con las respuestas anti-vph en niñas y mujeres de 16 a 26 años de edad, en la base de datos combinada de los estudios de inmunogenicidad de. Las respuestas (TGPs) contra el VPH 6, VPH 11, VPH 16, y VPH 18 fueron comparadas entre varones adolescentes de 9 a 15 años de edad y niños y hombres de 16 a 26 años de edad. Entre los participantes que recibieron, 97.4% a 99.9% se volvieron seropositivos contra el VPH 6, VPH 11, VPH 16, y VPH 18 un mes después de la tercera dosis. Las respuestas anti-vph en varones adolescentes de 9 a 15 años de edad fueron significativamente superiores a aquellas observadas en los niños y hombres de 16 a 26 años de edad. Con base en estas comparaciones de la inmunogenicidad, la eficacia de en adolescentes de 9 a 15 años de edad es comparable con la eficacia de observada en los estudios de Fase III en niñas y mujeres de 16 a 26 años de edad. Adicionalmente la eficacia de en adolescentes de 9 a 15 años de edad es comparable a la eficacia de observada en los estudios en niños y hombres de 16 a 26 años de edad. Página 12 de 17
13 En el estudio de extensión a largo plazo del Protocolo 018, que incluyó niñas y niños de 9 a 15 años de edad vacunados con en el estudio base y seguidos en la extensión, no se observaron de enfermedades por VPH (NIC de cualquier grado y / o verrugas genitales relacionadas con VPH tipos 6/11/16/18) después de un seguimiento mediano de aproximadamente 6.9 y 6.5 años, respectivamente. En este estudio de extensión, las niñas y los niños serán seguidos hasta por 10 años. Persistencia de la Respuesta Inmune a La duración de la inmunidad siguiendo un esquema completo de inmunización con no se ha establecido. En el Protocolo 007, se observaron picos de los Títulos Geométricos Promedio (TGP) anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en el Mes 7. Los TGP disminuyeron hasta el mes 24 y después se estabilizaron generalmente hasta por lo menos el mes 60 (véase la Figura 1). Un subgrupo de los individuos incluidos en los estudios de Fase III, fue seguido por un período de largo plazo para la seguridad, inmunogenicidad y eficacia. La IgG total por inmunoensayo Luminex (IgG LIA) fue utilizada para evaluar la persistencia de la respuesta inmune, además de clia. En todas las poblaciones (mujeres de 9-45 años, hombres de 9-26 años), se observaron picos TGP/cLIA anti- VPH 6, anti-vph 11, anti-vph 16 y anti-vph 18 en el Mes 7. Posteriormente, los GMTs declinan en los meses y luego por lo general se estabilizan. La duración exacta de la inmunidad después de una serie de 3 dosis se está estudiando actualmente. Las niñas y niños de 9-15 años de edad vacunados en el estudio base Protocolo 018 con serán seguidos en un estudio de extensión para evaluar persistencia de la inmunidad hasta por 10 años. Dependiendo del tipo de VPH, 64-97% y % de los sujetos fueron seropositivos por clia e IgG LIA respectivamente, 8 años después de la vacunación. Figura 1 Persistencia de las Respuestas Anti-VPH Después de Aplicar un Esquema de 3-dosis de Página 13 de 17
14 Persistencia de las Respuestas Anti-VPH 6 FICHA TÉCNICA Persistencia de las Respuestas Anti-VPH 11 Persistencia de las Respuestas Anti-VPH 16 Persistencia de las Respuestas Anti-VPH 18 La mujeres vacunadas con a los años de edad en el estudio base FUTURE II serán seguidas en un estudio de extensión hasta por 14 años. Nueve años después de la vacunación, 94%, 96%, 99% y 60% eran seropositivas para anti-vph 6, anti-hvph 11, anti-vph 16 y anti-vph 18 en clia respectivamente, y el 98%, 96%, 100% y 91% fueron seropositivas respectivamente conanti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en el IgG LIA. Las mujeres vacunadas con a los años de edad en el estudio base FUTURE III serán seguidas en un estudio de extensión hasta por 10 años. Seis años después de la vacunación, 89%, 92%, 97% y 45% eran seropositivas anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en los clia respectivamente, y 88%, 84%, 100% y 82% eran seropositivas anti-vph6, anti-vph 11, anti-vph 16 y anti-vph 18 en el IgG LIA, respectivamente. Página 14 de 17
15 Hombres vacunadas con a los años de edad en el estudio base Protocolo 020 serán seguidos en un estudio de extensión hasta por 10 años. Seis años después de la vacunación, eran seropositivos 84%, 87%, 97% y 48%, anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en los clia, respectivamente y 89%, 86%, 100% y 82% eran anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 seropositivos respectivamente en el IgG LIA. En estos estudios de seguimiento a más largo plazo en mujeres de 16 a 45 años y hombres de 16 a 26 años, los individuos que al final del estudio eran seronegativos para anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 en el clia, siguieron estando protegidos contra la enfermedad clínica después de un seguimiento de 9 años para las mujeres de años de edad, 6 años para las mujeres de años de edad, y 6 años para los hombres de años de edad. Evidencia de Respuesta Anamnésica (Memoria Inmune) La evidencia de respuesta anamnésica se observó en individuos vacunados que eran seropositivos a los tipos relevantes de VPH antes de la vacunación. En un estudio realizado para evaluar la capacidad de inducir memoria inmune, los individuos que recibieron una serie primaria de 3 dosis de vacuna recibieron una dosis de reto de, 5 años después del comienzo de la vacunación. Estos individuos mostraron una respuesta anamnésica rápida y potente que superó los TGP anti-vph observados 1 mes después de la dosis 3 (Mes 7). Los TGP una semana después de la dosis de reto fueron 0.9, 2.2, 1.2 y 1.4 veces más altos que los TGP Post-dosis 3 para los tipos 6, 11, 16 y 18, respectivamente. Los TGP un mes después de la dosis de reto fueron 1.3, 4.2, 1.5 y 1.7 veces más altos que los TGP Pos-dosis 3 para los tipos 6, 11, 16 y 18, respectivamente. Una semana después de la dosis de reto, 87.2%, 94.9%, 86.4% y 95.2% de los individuos tenían TGP anti-vph 6, anti-vph 11, anti-vph 16 y anti-vph 18 más altos que aquellos detectados en el Mes 60. Además, un sub-grupo de individuos que recibió una serie primaria de 3 dosis de la vacuna se convirtió nominalmente en anti-vph 18 seronegativos para el Mes 60. Aunque estos individuos eran nominalmente anti-vph 18 seronegativos, no se detectaron casos de enfermedad relacionada con el VPH tipo 18 entre estos individuos. Ellos también mostraron memoria inmune; cuando a estos sujetos se les dio una dosis de reto de (al Mes 60), 93% y 97% se volvieron anti-vph 18 seropositivos a la semana 1 y en el mes 1 post reto, respectivamente; 73% tuvieron niveles de anti-vph18 al mes 1 posterior a la dosis de reto que fueron más elevados que los niveles anti-vph 18 al Mes 7 (1 mes un después de la dosis 3). Flexibilidad del esquema Todos los participantes evaluados en las poblaciones PPE de los estudios de Fases II y III recibieron el esquema de tres dosis de en el transcurso de un año, independientemente del intervalo entre las dosis. Un análisis de la información de la respuesta inmune sugiere que la flexibilidad de ±1 mes para la segunda dosis (es decir, del mes 1 al mes 3 en el esquema de vacunación) y la flexibilidad de ±2 meses para la tercera dosis (es decir, del mes 4 al mes 8 en el esquema de vacunación) no influye sustancialmente en las respuestas inmunes a. Página 15 de 17
16 Respuesta Inmune a utilizando un esquema de dos dosis En un estudio se demostró que, en el mes 7, la respuesta inmune en niñas entre 9-13 años de edad (n=259) que recibieron 2 dosis de (a los 0, 6 meses) no fue inferior a la respuesta inmune en mujeres entre años de edad (n=310) que recibieron 3 dosis de (a los 0, 2, 6 meses). No se ha establecido la duración de la protección del esquema de dos dosis de. 6.3 Datos preclínicos sobre seguridad administrado a ratas hembra en una dosis de 120 mcg de proteína total, lo cual corresponde aproximadamente a un múltiplo de 300 veces la dosis proyectada para seres humanos, no tuvo efectos sobre el desempeño reproductivo, la fertilidad o la supervivencia embrionaria/fetal. administrado a ratas macho en una dosis de 120 mcg de proteína total, lo cual corresponde aproximadamente a un múltiplo de 200 veces la dosis proyectada para seres humanos, no mostró efectos en el desempeño reproductivo incluyendo fertilidad, conteo de esperma, y motilidad de esperma, y no hubo cambios histo-morfológicos o totales relacionados con la vacuna en las pruebas y sin efectos en las pruebas consideradas. 7. Datos farmacéuticos. 7.1 Lista de aditivos Sulfato de hidroxifosfato de aluminio amorfo, cloruro de sodio, L-histidina, polisorbato 80, borato de sodio, agua para la fabricación de inyectables 7.2 Incompatibilidades N/A 7.3 Plazo de caducidad 36 meses, debiendo expresar el año con número y el mes con letra. 7.4 Condiciones de conservación y almacenaje Consérvese en refrigeración entre 2 y 8 C. No se congele. Protéjase de la luz. debe administrarse tan pronto como sea posible después de sacarse de refrigeración. puede estar sin refrigeración (a temperatura de o por debajo de 25 C) durante no más de 72 horas. Página 16 de 17
17 7.5 Presentaciones Caja con un frasco ámpula que contiene una dosis de 0.5 ml. Caja con 10 frascos ámpula que contienen una dosis de 0.5 ml cada uno Caja con una jeringa prellenada que contiene una dosis de 0.5 ml Caja con 10 jeringas prellenadas que contienen una dosis de 0.5 ml cada una 7.6 Leyendas de advertencia y precautorias Su venta requiere receta médica. Literatura exclusiva para médicos. No se deje al alcance de los niños. No se use en el embarazo Reporte las sospechas de reacción adversa al correo: farmacovigilancia@cofepris.gob.mx 8. Razón social y domicilio del titular del registro Schering-Plough, S.A. de C.V. Av. 16 de Septiembre No. 301, Col. Xaltocan, C.P , Deleg. Xochimilco, Ciudad de México, México. 9. Razón social y domicilio del fabricante del medicamento Merck Sharp & Dohme Corp. 770 Sumneytown Pike, West Point, PA 19486, EUA. 10. Razón social y domicilio del acondicionador Merck Sharp & Dohme Corp. 770 Sumneytown Pike, West Point, PA 19486, EUA. o Merck Sharp & Dohme B.V. Waarderweg 39, 2031 BN Haarlem, Países Bajos. 11. Razón social y domicilio del distribuidor Merck Sharp & Dohme Comercializadora, S. de R.L. de C.V. Carretera México- Querétaro Km 34.5, Nave 6, interior 13, Col. Rancho San Isidro, C.P , Cuautitlán Izcalli, Estado de México, México. 12. Número de registro 148M2006 SSA 13. Fecha de vigencia 19 de enero del Fecha de la última actualización. 02 de septiembre del Número de trámite asociado a dicha actualización Z0141 Página 17 de 17
Vacuna frente al papilomavirus humano. (Comentarios a las fichas técnicas)
 Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
Vacuna frente al papilomavirus humano (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO Gardasil suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida).
GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE
 FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FOLLETO DE INFORMACIÓN AL PROFESIONAL GARDASIL 9 VACUNA NONAVALENTE ANTIVIRUS PAPILOMA HUMANO RECOMBINANTE ADSORBIDA, SUSPENSIÓN INYECTABLE 1. INDICACIONES Y USO 1.1 Niñas y Mujeres GARDASIL 9 es una vacuna
FICHA TECNICA. Adultos en prediálisis o en diálisis: 1 dosis (40 µg) de 1 ml en cada inyección.
 1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
1. NOMBRE DEL MEDICAMENTO RECOMBIVAX HB 40 mg Vacuna recombinante antihepatitis B. FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Una dosis de RECOMBIVAX HB 40microgramos/ ml, suspensión inyectable
FICHA TÉCNICA VACUNA ADSORBIDA ANTIDIFTÉRICA, ANTITETÁNICA Y CONTRA LA TOS FERINA
 1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
1. DENOMINACIÓN DISTINTIVA 2. DENOMINACIÓN GENÉRICA Toxoide Diftérico / Toxoide Tetánica / Vacuna Pertussis 3. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Componentes Cada: Toxoide Diftérico Corynebacterium
IM cara anterolateral del muslo en los lactantes o el músculo deltoides de la parte superior del brazo en los niños.
 ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
ESQUEMA CON VACUNAS ESPECIALES VACUNACION NO CUBIERTA POR EL PAN OBLIGATORIO DE SALUD Hepatitis B Anti hepatitis B A partir de los 5 º dosis en la fecha elegida. ª un mes después de la primera dosis. ª
PI-GRD-I-082008-COLOMBIA GARDASIL
 1. NOMBRE DEL PRODUCTO Y DENOMINACIÓN COMÚN INTERNACIONAL DEL PRINCIPIO ACTIVO GARDASIL * [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)] 2. FORMA FARMACEUTICA
1. NOMBRE DEL PRODUCTO Y DENOMINACIÓN COMÚN INTERNACIONAL DEL PRINCIPIO ACTIVO GARDASIL * [Vacuna Recombinante Tetravalente contra el Virus de Papiloma Humano (Tipos 6, 11, 16, 18)] 2. FORMA FARMACEUTICA
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HIPRAVIAR-BPL2 Emulsión inyectable para aves 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX suspensión inyectable en jeringa precargada Vacuna antidiftero-tetánica (adsorbida) para adultos y adolescentes. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VANGUARD R Suspensión inyectable para perros, gatos, bovino, porcino, ovino, caprino, equino y hurones 2. COMPOSICIÓN
Guía educativa sobre el Virus del Papiloma Humano (VPH), cáncer cervicouterino y otras enfermedades
 Guía educativa sobre el Virus del Papiloma Humano (VPH), cáncer cervicouterino y otras enfermedades Qué es el Virus del Papiloma Humano (VPH) y cuántos tipos de VPH existen? El VPH (Virus del Papiloma
Guía educativa sobre el Virus del Papiloma Humano (VPH), cáncer cervicouterino y otras enfermedades Qué es el Virus del Papiloma Humano (VPH) y cuántos tipos de VPH existen? El VPH (Virus del Papiloma
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Vacuna contra la poliomielitis. (Comentarios a las fichas técnicas)
 Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
Vacuna contra la poliomielitis (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Composición
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS BVD Suspensión inyectable para bovino. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
FICHA TÉCNICA. VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable
 FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
FICHA TÉCNICA VAXIGRIP 2016 Vacuna anti-influenza inactivada suspensión inyectable 1. NOMBRE DEL MEDICAMENTO VAXIGRIP, suspensión inyectable en jeringa precargada Vacuna antiinfluenza de virus fraccionados,
El sistema inmune y las vacunas
 SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
SESIÓN DE INFORMACIÓN SOBRE VACUNAS, Santiago, Chile 7 de mayo 9 mayo, 2014 El sistema inmune y las vacunas Dra. Juanita Zamorano R Pediatra- Infectóloga jzamorano@uandes.cl 1 Jenner: En 1796 inicia la
GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616
![GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616 GARDASIL [Vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] SP9883616](/thumbs/34/13114587.jpg) USPPI Información para el paciente sobre GARDASIL Nombre genérico: [vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] Lea esta información con atención antes
USPPI Información para el paciente sobre GARDASIL Nombre genérico: [vacuna cuadrivalente contra el virus del papiloma humano (tipos 6, 11, 16 y 18), recombinante] Lea esta información con atención antes
Inmunizaciones. Vacunas Infantiles. Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Objetivo:
 Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
Inmunizaciones Vacunas Infantiles Objetivo: Objetivo: Disminuir la morbilidad y mortalidad de la enfermedades transmisible. Definición: n: Administración n de microorganismos o sus toxinas previamente
* producido en levadura Saccharomyces cerevisiae (cepa ) mediante tecnología recombinante de ADN.
 1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
1. NOMBRE DEL MEDICAMENTO HBVAXPRO 40 microgramos, suspensión inyectable Vacuna antihepatitis B (radn) 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis (1 ml) contiene: Antígeno de superficie del virus
Vacunas Tosferina. Quién debe recibir la vacuna?
 Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
Vacunas Tosferina Dos vacunas nuevas que contienen la vacuna acelular contra la tosferina fueron aprobadas en el 2005 por la FDA para uso en personas mayores. Estas vacunas son abreviadas Tdap. Una es
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP
 Virus del Papiloma Humano Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP VPH: Agente ADN Virus de doble cadena Flia: Papillomaviridae Producen infección en tejidos estratificados de piel y mucosas de
Virus del Papiloma Humano Dr. Fernando Arrieta Dpto. Inmunizaciones CHLA EP VPH: Agente ADN Virus de doble cadena Flia: Papillomaviridae Producen infección en tejidos estratificados de piel y mucosas de
Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1.
 1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
1. NOMBRE DEL MEDICAMENTO CHIROMAS, suspensión inyectable en jeringa precargada Vacuna antigripal de antígeno de superficie, inactivado, con adyuvante MF59C.1. (CAMPAÑA 2014/2015) 2. COMPOSICIÓN CUALITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Gardasil, suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Gardasil, suspensión inyectable. Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante,
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
II. ESQUEMA NACIONAL DE VACUNACIÓN Dosis y lugar de aplicación Hepatitis B. No de dosis Intervalo entre dosis
 II. ESQUEMA NACIONAL DE VACUNACIÓN 2009 Vacuna Edad a vacunar No de dosis Intervalo entre dosis Dosis y lugar de aplicación Recién Nacido 12 horas * 1 0.5cc IM, área del (antero lateral) 0.1CC ID, en la
II. ESQUEMA NACIONAL DE VACUNACIÓN 2009 Vacuna Edad a vacunar No de dosis Intervalo entre dosis Dosis y lugar de aplicación Recién Nacido 12 horas * 1 0.5cc IM, área del (antero lateral) 0.1CC ID, en la
Ministerio de Salud y Protección Social República de Colombia
 Los Virus del Papiloma Humano y el Cáncer Cartilla de Preguntas y Respuestas (página Web) Qué es el cáncer de cuello uterino? Es una desorganización de las células que componen el cuello del útero, formando
Los Virus del Papiloma Humano y el Cáncer Cartilla de Preguntas y Respuestas (página Web) Qué es el cáncer de cuello uterino? Es una desorganización de las células que componen el cuello del útero, formando
FICHA TÉCNICA. La vacuna MSD Antirrubéola cumple los requisitos de la OMS para productos biológicos y vacunas Antirrubéola.
 1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
1. NOMBRE DEL MEDICAMENTO VACUNA MSD ANTIRRUBEOLA FICHA TÉCNICA 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Vacuna MSD Antirrubéola (vacuna con virus de la rubéola vivos) es una vacuna de virus vivos para
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana
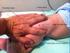 Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Procedimiento para la administración de la vacuna frente al Virus del Papiloma Humano (VPH) en la Comunidad Valenciana Desde la aparición de dos casos de adolescentes que experimentaron una posible reacción
Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2013/2014 2. COMPOSICIÓN
Prevención del cáncer de cuello de útero
 Prevención del cáncer de cuello de útero Ref. 150/ Febrero 2008 Servicio de Ginecología ( )" " * " " +, % "- Gran Vía Carlos III 71-75 08028 Barcelona Tel. 93 227 47 00 Fax 93 418 78 32 info@dexeus.com
Prevención del cáncer de cuello de útero Ref. 150/ Febrero 2008 Servicio de Ginecología ( )" " * " " +, % "- Gran Vía Carlos III 71-75 08028 Barcelona Tel. 93 227 47 00 Fax 93 418 78 32 info@dexeus.com
Vacuna frente a Haemophilus influenzae tipo b
 Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
Vacuna frente a Haemophilus influenzae tipo b Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Previo al empleo sistemático
PENTAVALENTE DESCRIPCIÓN VÍA DE ADMINISTRACIÓN
 DESCRIPCIÓN Es una vacuna combinada que contiene; los toxoides diftérico y tetánico y toxoide Pertússico así como los tres tipos de virus inactivados de la poliomielitis. PRESENTACIÓN Jeringa prellenada
DESCRIPCIÓN Es una vacuna combinada que contiene; los toxoides diftérico y tetánico y toxoide Pertússico así como los tres tipos de virus inactivados de la poliomielitis. PRESENTACIÓN Jeringa prellenada
FICHA TECNICA. Tratamiento de la intoxicación por Amanita phalloides.
 FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
FICHA TECNICA 1 - NOMBRE DEL MEDICAMENTO Legalon SIL 2 - COMPOSICION CUALITATIVA Y CUANTITATIVA Un vial para infusión con 598,5 mg de producto liofilizado contiene: 528,5 mg de silibinina-c-2',3- dihidrogenosuccinato
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA. Gotas Óticas. Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g.
 DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
DELOS OTIC CIPROFLOXACINA CLORHIDRATO - HIDROCORTISONA Gotas Óticas Industria Argentina Venta bajo receta FORMULA Cada 100 ml contienen: Hidrocortisona 1,00 g. Ciprofloxacina Clorhidrato 0,20 g. Excipientes:
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
La vacuna no es eficaz para la prevención de la otitis media aguda, sinusitis y otras infecciones comunes del tracto respiratorio superior.
 1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
1. NOMBRE DEL MEDICAMENTO Pneumovax 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna contiene 25 microgramos
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Fevaxyn Pentofel, suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
PRIMERA REUNION NACIONAL DE HEPATITIS B y C. Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud
 PRIMERA REUNION NACIONAL DE HEPATITIS B y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud Misión: Protección de la población chilena frente a enfermedades inmunoprevenibles
PRIMERA REUNION NACIONAL DE HEPATITIS B y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud Misión: Protección de la población chilena frente a enfermedades inmunoprevenibles
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
K:\Jenner_Public\QSS\VACCINE QUALITY & REGULATION GROUP\Inserts\Spanish\esp_Insert measles rubella Vd2-rev.doc
 MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
MODELO DE PROSPECTO VACUNA COMBINADA CONTRA EL SARAMPIÓN Y LA RUBÉOLA (MR) DESCRIPCIÓN La vacuna MR es un polvo liofilizado que contiene dos antígenos, el del sarampión y el de la rubéola. Debe reconstituirse
NÚMERO DE DOSIS RECOMENDADO DE CADA VACUNA SEGÚN LA EDAD Asociación Española de Pediatría 2015 Comité Asesor de Vacunas.
 1 de enero de 2015 Esta tabla indica el número de necesarias según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se
1 de enero de 2015 Esta tabla indica el número de necesarias según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M.
 VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
VAQTA VACUNA ANTI-HEPATITIS A PURIFICADA E INACTIVADA Suspensión Inyectable Estéril de uso I.M. INDUSTRIA NORTEAMERICANA VENTA BAJO RECETA FÓRMULA: Formulación para uso pediátrico y en adolescentes Cada
MODELO DE FORMATO TEXTO PARA LITERATURA INTERIOR
 PARA LITERATURA INTERIOR Heberpenta Vacuna combinada de Difteria, Tétanos, células enteras de Pertussis, Hepatitis B y Haemophilus influenzae tipo b COMPOSICIÓN Composición de la vacuna, una vez lista
PARA LITERATURA INTERIOR Heberpenta Vacuna combinada de Difteria, Tétanos, células enteras de Pertussis, Hepatitis B y Haemophilus influenzae tipo b COMPOSICIÓN Composición de la vacuna, una vez lista
VACUNA VPH. Dra Carlota Russ Pro-secretaria del Comité de Infectologia de la Sociedad Argentina de Pediatría
 VACUNA VPH Dra Carlota Russ Pro-secretaria del Comité de Infectologia de la Sociedad Argentina de Pediatría 1. Un matrimonio consulta con su hija de 11 años y pregunta cual vacuna le puede dar para protegerla
VACUNA VPH Dra Carlota Russ Pro-secretaria del Comité de Infectologia de la Sociedad Argentina de Pediatría 1. Un matrimonio consulta con su hija de 11 años y pregunta cual vacuna le puede dar para protegerla
CENAVUL Suspensión inyectable
 Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
Camí Pedra Estela s/n 43205 Reus Telf. 977 75 72 73 Fax. 977 75 13 98 www.cenavisa.com E-mail: cenavisa@cenavisa.com FICHA TÉCNICA: CENAVUL Suspensión inyectable Reg. nº: 2145 ESP FICHA TÉCNICA (RESUMEN
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Eurican MHPPi 2 -LR Liofilizado y suspensión para suspensión inyectable 2. COMPOSICIÓN CUALITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada,
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada,
Secretaría de Salud Programa Ampliado de Inmunizaciones. Conceptos y principios generales de inmunización
 Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
Secretaría de Salud Programa Ampliado de Inmunizaciones Conceptos y principios generales de inmunización Siguatepeque 27 de junio al 01 de julio de 2011 Contenido Conceptos básicos Principios generales
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RISPOVAL IBR-MARKER VIVUM Liofilizado y disolvente para suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2)...25 microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA. no menos de 20 Unidades Internaciones (UI) (5 Lf) 1adsorbidos en hidróxido de aluminio hidratado (Al(OH)3)
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Boostrix suspensión inyectable en jeringa precargada Vacuna antidiftérica, antitetánica y antitos ferina (componente acelular) (adsorbida, contenido antigénico reducido)
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Poulvac Marek CVI Suspensión y disolvente para suspensión inyectable para
Vacunación. Infantil
 Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
Vacunación Infantil E N C A S T I L L A - L A M A N C H A Edición Dirección General de Salud Pública y Consumo Consejería de Sanidad Junta de Comunidades de Castilla-La Mancha Actualizado Febrero 2016
FICHA TÉCNICA. La duración estimada del tratamiento será de dos semanas.
 FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD UVALETTE 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Contenido por comprimido recubierto: - 120,00 mg de extracto seco etanólico al 30%, de planta entera de Taraxacum
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HEPTAVAC P PLUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO HEPTAVAC P PLUS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Sustancias activas:
PROSPECTO: INFORMACIÓN PARA EL USUARIO
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Gardasil, suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida) Lea todo el prospecto detenidamente antes
PROSPECTO: INFORMACIÓN PARA EL USUARIO Gardasil, suspensión inyectable Vacuna frente al Virus del Papiloma Humano [Tipos 6, 11, 16, 18] (Recombinante, adsorbida) Lea todo el prospecto detenidamente antes
LA NUEVA VACUNA PARA LA PREVECIÓN DE LA INFECCIÓN POR VPH. Judit Morraja Nadal R-4 Ginecología-Obstetricia HMI-HIC
 LA NUEVA VACUNA PARA LA PREVECIÓN DE LA INFECCIÓN POR VPH Judit Morraja Nadal R-4 Ginecología-Obstetricia HMI-HIC VACUNA CONTRA VIRUS DE PAPILOMA HUMANO LCR L2 E6 E7 E5 E4 E2 E1 Un nuevo hito contra el
LA NUEVA VACUNA PARA LA PREVECIÓN DE LA INFECCIÓN POR VPH Judit Morraja Nadal R-4 Ginecología-Obstetricia HMI-HIC VACUNA CONTRA VIRUS DE PAPILOMA HUMANO LCR L2 E6 E7 E5 E4 E2 E1 Un nuevo hito contra el
CALENDARIO DE VACUNACIONES DE LA ASOCIACIÓN ESPAÑOLA DE PEDIATRÍA Comité Asesor de Vacunas 2014
 1 Esta tabla indica el número de necesarias, según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se ha de reiniciar
1 Esta tabla indica el número de necesarias, según la edad, para los niños y los adolescentes con el calendario de vacunación incompleto o que comienzan la vacunación tardíamente. No se ha de reiniciar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
100 UI 80 mg 95% IgG
 1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
1. NOMBRE DEL MEDICAMENTO IGANTIBE 200 UI/ml solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA - Principio activo: 100 UI/0,5 ml 600 UI/3 ml 1000 UI/5 ml Inmunoglobulina humana antihepatitis
PROSPECTO: INFORMACIÓN PARA EL USUARIO. PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos
 PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
PROSPECTO: INFORMACIÓN PARA EL USUARIO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos Lea todo el prospecto detenidamente antes de que usted o su hijo sean
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA 3. FORMA FARMACÉUTICA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ketoconazol Abamed 2% crema 2. COMPOSICIÓN CUALITATIVA y CUANTITATIVA Composición por gramo: Ketoconazol (DOE)... 20 mg Para excipientes véase sección 6.1 3. FORMA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
LO QUE DEBES SABER SOBRE LA VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH)
 LO QUE DEBES SABER SOBRE LA VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH) 2 Qué estudios se han realizado en el mundo para determinar si la vacuna contra el virus del papiloma humano (VPH) es efectiva?
LO QUE DEBES SABER SOBRE LA VACUNA CONTRA EL VIRUS DEL PAPILOMA HUMANO (VPH) 2 Qué estudios se han realizado en el mundo para determinar si la vacuna contra el virus del papiloma humano (VPH) es efectiva?
FICHA TÉCNICA. Adsorbido en hidróxido de aluminio hidratado Total: 0,50 mg Al 3+ Una dosis (0,5 ml) de Havrix 720 contiene: 720 Unidades ELISA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
MINISTERIO DE SALUD Esquema Nacional de Vacunación NIÑOS MENORES DE 1AÑO. 2015
 MINISTERIO DE SALUD Esquema Nacional de Vacunación NIÑOS MENORES DE 1AÑO. 2015 Tipo de vacuna EDAD A VACUNAR Nº DE DOSIS INTERVALO ENTRE CADA DOSIS DOSIS, VÍA Y LUGAR DE APLICACIÓN *Recién nacidos antes
MINISTERIO DE SALUD Esquema Nacional de Vacunación NIÑOS MENORES DE 1AÑO. 2015 Tipo de vacuna EDAD A VACUNAR Nº DE DOSIS INTERVALO ENTRE CADA DOSIS DOSIS, VÍA Y LUGAR DE APLICACIÓN *Recién nacidos antes
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Menveo 2.0. DENOMINACIÓN GENÉRICA Vacuna contra Neisseria meningitidis serogrupos A, C. W135 e Y 3.0.
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Menveo 2.0. DENOMINACIÓN GENÉRICA Vacuna contra Neisseria meningitidis serogrupos A, C. W135 e Y 3.0.
Objetivos de Aprendizaje
 Objetivos de Aprendizaje Discutir los cánceres asociados al VPH debido a los tipos de VPH y el impacto de las vacunas actuales contra el VPH Analizar los beneficios de la vacuna contra el VPH 9 Valente
Objetivos de Aprendizaje Discutir los cánceres asociados al VPH debido a los tipos de VPH y el impacto de las vacunas actuales contra el VPH Analizar los beneficios de la vacuna contra el VPH 9 Valente
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad
 El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
El Virus del Papiloma Humano y la vacuna para prevenir el cáncer cérvico uterino: descripción y prevención de la enfermedad No. DE AUTORIZACION: 093300201B1730 SSA El cáncer cérvico uterino P1 Dónde se
CANCER DE CUELLO UTERINO. Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior
 CANCER DE CUELLO UTERINO Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior IMPORTANCIA Tras el cáncer de mama, el cáncer de cérvix es el cáncer femenino mundial más frecuente tanto en incidencia
CANCER DE CUELLO UTERINO Dra. Silvia Fraga Campo Unidad de Tracto genital Inferior IMPORTANCIA Tras el cáncer de mama, el cáncer de cérvix es el cáncer femenino mundial más frecuente tanto en incidencia
VACUNAS. Generalidades y calendarios. C. S. San Blas, 21 de junio de 2006
 C. S. San Blas, 21 de junio de 2006 VACUNAS Generalidades y calendarios Dr. Manuel Merino Moína Pediatra C. S. El Greco Comité Asesor de Vacunas de Madrid Qué es una vacuna? Sustancia que, administrada
C. S. San Blas, 21 de junio de 2006 VACUNAS Generalidades y calendarios Dr. Manuel Merino Moína Pediatra C. S. El Greco Comité Asesor de Vacunas de Madrid Qué es una vacuna? Sustancia que, administrada
MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable.
 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo del grupo C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo del grupo C. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Una dosis
Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida)
![Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida) Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida)](/thumbs/25/5103336.jpg) 1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida) 2. COMPOSICIÓN CUALITATIVA Y
1. NOMBRE DEL MEDICAMENTO Cervarix suspensión inyectable en jeringa precargada Vacuna frente al Virus del Papiloma Humano [Tipos 16, 18] (Recombinante, adyuvada, adsorbida) 2. COMPOSICIÓN CUALITATIVA Y
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO MENJUGATE KIT 10 microgramos polvo y disolvente para suspensión inyectable. Vacuna conjugada frente al meningococo
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Oncept IL-2 liofilizado y disolvente para suspensión inyectable para gatos. 2. COMPOSICIÓN
Vaqta 50 U/1 ml ayuda a proteger a adultos (de 18 años de edad y mayores) frente a la enfermedad causada por el virus de la hepatitis A.
 Prospecto: Información para el usuario VAQTA 50 Unidades/1 ml Suspensión inyectable en jeringa precargada Vacuna antihepatitis A, inactivada, adsorbida Para adultos Lea todo el prospecto detenidamente
Prospecto: Información para el usuario VAQTA 50 Unidades/1 ml Suspensión inyectable en jeringa precargada Vacuna antihepatitis A, inactivada, adsorbida Para adultos Lea todo el prospecto detenidamente
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis Influenza H5N2 emulsión inyectable para pollos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis Influenza H5N2 emulsión inyectable para pollos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ACTIVIDADES SANITARIAS PREVENTIVAS PARA VIAJES A PAISES DE RIESGO
 ACTIVIDADES SANITARIAS PREVENTIVAS PARA VIAJES A PAISES DE RIESGO Papel fundamental de la Enfermería de Empresa Vanesa Alviat. DUE de Empresa Vigilancia de la salud para viajeros a países de riesgo Establecer
ACTIVIDADES SANITARIAS PREVENTIVAS PARA VIAJES A PAISES DE RIESGO Papel fundamental de la Enfermería de Empresa Vanesa Alviat. DUE de Empresa Vigilancia de la salud para viajeros a países de riesgo Establecer
FICHA TÉCNICA. Azelastina hidrocloruro al 0,05% (0,5 mg/ml). Cada gota contiene 0,015 mg de azelastina hidrocloruro
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Azelastina MABO 0,5 mg/ml colirio en solución 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Composición cualitativa y cuantitativa Azelastina hidrocloruro al 0,05% (0,5
Vaqta 25 U/0,5 ml ayuda a proteger a niños de 12 meses de edad hasta 17 años de edad frente a la enfermedad causada por el virus de la hepatitis A.
 Prospecto: Información para el usuario VAQTA 25 Unidades/0,5 ml Suspensión inyectable en jeringa precargada Vacuna antihepatitis A, inactivada, adsorbida Para niños y adolescentes Lea todo el prospecto
Prospecto: Información para el usuario VAQTA 25 Unidades/0,5 ml Suspensión inyectable en jeringa precargada Vacuna antihepatitis A, inactivada, adsorbida Para niños y adolescentes Lea todo el prospecto
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TÉCNICA FLUZACTAL TETRA
 1. Denominación distintiva Fluazactal Tetra 2. Denominación genérica Vacuna antiinfluenza tetravalente tipos A y B 3. Composición cualitativa y cuantitativa Cada dosis (0.5 ml) contiene: A/California/7/2009
1. Denominación distintiva Fluazactal Tetra 2. Denominación genérica Vacuna antiinfluenza tetravalente tipos A y B 3. Composición cualitativa y cuantitativa Cada dosis (0.5 ml) contiene: A/California/7/2009
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
INSTITUTO DE EDUCACIÓN SUPERIOR TECNOLÓGICO PRIVADO SANTA ROSA DE LIMA ENFERMERÍA Y VÍAS DE ADMINISTRACIÓN DE LAS VACUNAS
 INSTITUTO DE EDUCACIÓN SUPERIOR TECNOLÓGICO PRIVADO SANTA ROSA DE LIMA ENFERMERÍA Y VÍAS DE ADMINISTRACIÓN DE LAS VACUNAS LIC. JUDITH ISABEL POLO NICHO 1. PUNTOS CLAVE: Las vacunas deben administrarse
INSTITUTO DE EDUCACIÓN SUPERIOR TECNOLÓGICO PRIVADO SANTA ROSA DE LIMA ENFERMERÍA Y VÍAS DE ADMINISTRACIÓN DE LAS VACUNAS LIC. JUDITH ISABEL POLO NICHO 1. PUNTOS CLAVE: Las vacunas deben administrarse
Tos ferina Epidemiología a WHO
 Tos ferina Epidemiología a WHO Los primeros brotes de Tos ferina fueron descritos en el siglo 16. B. pertusis fue aislada en 1906 La introducción de la vacuna de células enteras en 1940 produce un drástico
Tos ferina Epidemiología a WHO Los primeros brotes de Tos ferina fueron descritos en el siglo 16. B. pertusis fue aislada en 1906 La introducción de la vacuna de células enteras en 1940 produce un drástico
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO PARACETAMOL SP, 300 mg/ml Solución para administración en agua de bebida, para cerdos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. TRIAXIS, suspensión inyectable.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TRIAXIS, suspensión inyectable. Vacuna de difteria, tétanos, tos ferina (componente acelular) (adsorbida, contenido de antígenos reducido). 2. COMPOSICIÓN CUALITATIVA
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
FICHA TECNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Vivotif cápsulas duras gastrorresistentes (Vacuna viva antitífica oral) 2. COMPOSICION CUALITATIVA Y CUANTITATIVA.
2da REUNION NACIONAL DE HEPATITIS B Y C. Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud
 2da REUNION NACIONAL DE HEPATITIS B Y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud 2 Misión del Departamento de Inmunizaciones Protección de la población
2da REUNION NACIONAL DE HEPATITIS B Y C Marcela Avendaño V. Enfermera Departamento de Vacunas e Inmunizaciones Ministerio de Salud 2 Misión del Departamento de Inmunizaciones Protección de la población
Contraindicaciones de las Vacunas
 Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
Contraindicaciones de las Vacunas Alergias Los alérgicos a la levadura no deberían recibir la vacuna de la hepatitis B. Los que tienen una historia de anafilaxia (alergia grave) a la gelatina no deben
