COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA
|
|
|
- Jaime Iglesias Rey
- hace 6 años
- Vistas:
Transcripción
1 COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS CAPACITACIÓN LABORATORISTA QUÍMICO MANUAL DE ACTIVIDADES EXPERIMENTALES APLICAR TÉCNICAS DE IDENTIFICACION PARA HONGOS Y LEVADURAS SEMESTRE 2014-A
2 DIRECCIÓN ACADEMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS PRESENTACIÓN Dentro del nuevo enfoque de la educación basada en competencias es importante redefinir la importancia de las actividades experimentales para, en el marco del Sistema Nacional de Bachillerato, involucrar a los alumnos, de tal manera que consideren las actividades experimentales como una parte importante del trabajo académico y del objetivo para desarrollar ciertas actividades genéricas y disciplinares que enriquezcan verdaderamente su desempeño con el reflejo inmediato en su preparación inegral. Cumpliendo entonces con la misión y visión de nuestro subsistema Colegio de Bachilleres del Estado de Tlaxcala 6to SEMESTRE 2014-A Página 1
3 DRA. JOSEFINA ESPINOSA CUÉLLAR DIRECTORA GENERAL LIC. VICTOR SERRANO PÉREZ DIRECTOR ACADÉMICO LIC. FRANCISCO JUÁREZ MUÑOZ SUBDIRECTOR ACADÉMICO M.V.Z. GREGORIO SERRANO MORALES JEFE DEL DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS 6to SEMESTRE 2014-A Página 2
4 Cantidad Cantidad CAPACITACIÓN LABORATORISTA QUÍMICO DIRECCIÓN ACADÉMICA SUBDIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS MATERIAL Y REACTIVOS NECESARIOS PARA LA REALIZACIÓN DE LAS ACTIVIDADES EXPERIMENTALES No. Act. Exp. Nombre de la actividad experimental Material Reactivos to SEMESTRE 2014-A Página 3
5 No. Act. Exp CAPACITACIÓN LABORATORISTA QUÍMICO DIRECCIÓN ACADEMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS CONTENIDO Nombre de la actividad experimental Pág. IDENTIFICAR HONGOS Y LEVADURAS MEDIANTE 3 TECNICAS DE REPRODUCCION Y CRECIMIENTO. Introducción 3 Fundamento 3 Objetivo general 3 Material y sustancias 4 Procedimiento experimental 4 Lista de cotejo 6 MEDIANTE TECNICAS DE TINCION IDENTIFICAR 7 HONGOS Y LEVADURAS. Fundamentos 7 Material y sustancias 8 Procedimiento experimental 9 Lista de cotejo 11 UTILIZANDO TINCION DE GRAM IDENTIFICAR HONGOS 12 Y LEVADURAS Introducción 12 Objetivo experimental 12 Reactivos 13 Material y sustancias 14 Procedimiento 15 Lista de cotejo 16 IDENTIFICACIÓN DE CRYPTOCOCCUS NEOFORMANS POR MÉTODOS ENZIMÁTICOS 17 Fundamento 17 Procedimiento 17 Interpretación 17 Lista de cotejo 19 6to SEMESTRE 2014-A Página 4
6 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS. ACTIVIDAD EXPERIMENTAL NÚM. 1 IDENTIFICAR HONGOS Y LEVADURAS MEDIANTE TECNICAS DE REPRODUCCION Y CRECIMIENTO. INTRODUCCIÓN Los mohos y levaduras están ampliamente distribuidos en la naturaleza y se pueden encontrar formando parte de la flora normal de un alimento, o como agentes contaminantes y en los equipos sanitizados inadecuadamente, provocando el deterioro fisicoquímico de éstos, debido a la utilización en su metabolismo de los carbohidratos, ácidos orgánicos, proteínas y lípidos originando mal olor, alterando el sabor y el color en la superficie de los productos contaminados. Además los mohos y levaduras pueden sintetizar metabolitos tóxicos termoresistentes, capaces de soportar algunas sustancias químicas, así como la irradiación y presentan capacidad para alterar sustratos desfavorables, permitiendo el crecimiento de bacterias patógenas. Es de gran importancia cuantificar los mohos y levaduras en los alimentos, puesto que al establecer la cuenta de estos microorganismos, permite su utilización como un indicador de prácticas sanitarias inadecuadas durante la producción y el almacenamiento de los productos, así como el uso de materia prima inadecuada. OBJETIVO Mediante el uso de una técnica de reproducción identificar hongos y levaduras auxiliándose de la Norma Oficial Mexicana que determina la cuenta de hongos y levaduras en alimentos. FUNDAMENTO El método se basa en inocular una cantidad conocida de muestra de prueba en un medio selectivo específico, acidificado a un Ph 3,5 e incubado a una temperatura de 25 ± 1 C, dando como resultado el crecimiento de colonias características para este tipo de microorganismos. DEFINICIONES Para fines de esta práctica se entiende: 1. Colonias, agrupamiento de células en forma de masas visibles, sobre el agar de cultivo. 2. Levaduras, son microorganismos cuya forma dominante de crecimiento es unicelular. Poseen un núcleo y se multiplican por reproducción sexual o asexual, por gemación o por fisión transversal. La reproducción sexual cuando ocurre, es por medio de ascosporas contenidas en un saco o asca. 3. Mohos, grupo de hongos microscópicos; organismos pertenecientes al reino Fungi, que se caracterizan por tener un cuerpo formado por estructura filamentosa con ramificaciones, que se conocen con el nombre de hifas, el conjunto de hifas constituye el micelio, carecen de clorofila, se alimentan por absorción pudiendo propagarse por esporas flageladas o no, las paredes celulares pueden ser de queratina, celulosa. Crecen formando colonias en un medio selectivo a 25 C. 4. Unidades Formadoras de Colonias (UFC), término que debe utilizarse para reportar la cuenta de colonias en placa, las cuales pueden surgir de una célula o de un cúmulo de células. 6to SEMESTRE 2014-A Página 5
7 REACTIVOS Agar papa-dextrosa (la cantidad necesaria) Solución reguladora de fosfatos (para trabajo) ésta se obtiene mediante una solución preparada previamente que se llama concentrada. Se toma 1.25 ml. De la solución concentrada y se lleva a 1 lt. De agua esterilizar a C. durante 15 min. PREPARACIÓN: Disolver 34 gr, de fosfato monobásico en 500 ml. De agua y ajustar el ph a 7.2 con Hidróxido de sodio 1 N aforar a 1 Lt. De agua esterilizar a C. durante 15 min. Conservar en refrigeración. (SOLUCION CONCENTRADA) Solución estéril de ácido tartárico al 10 % Preparación: Disolver 10 gr. De ácido tartárico en 100 ml. De agua destilada y esterilizar a C. por 15 min. MATERIAL. o Pipetas bacteriológicas para distribuir 10 y 1 ml. o Cajas petri o Frascos de vidrio de 250 ml. Con tapón de rosca o Tubos de 16 x 150 mm con tapón de rosca o Utensilios esterilizables para la obtención de muestras: cuchillos, pinzas, tijeras, cucharas, espátulas, etc. NOTA Todo el material e instrumentos que tengan contacto con las muestras bajo estudio, deben esterilizarse mediante: Horno, durante 2 h de 170 a 175 C o por 1h a 180 C o autoclave, durante 15 minutos como mínimo a 121 ± 1,0 C. Aparatos e instrumentos Horno para esterilizar que alcance una temperatura mínima de 170 C. Incubadora con termostato que pueda ser mantenido a 25 ± 1,0 C provista con termómetro calibrado. Autoclave que alcance una temperatura mínima de 121 ± 1,0 C. Baño de agua con control de temperatura y circulación mecánica, provista con termómetro calibrado con divisiones de 0,1 C y que mantenga la temperatura a 45 ± 1,0 C. PROCEDIMIENTO 1. Colocar por duplicado en cajas Petri 1 ml de la muestra líquida directa o de la dilución primaria, utilizando para tal propósito una pipeta estéril Repetir el procedimiento tantas veces como diluciones decimales se requiera sembrar, utilizando una pipeta estéril diferente para cada dilución. 3. Verter de 15 a 20 ml de agar papa dextrosa acidificado, fundido y mantenido a 45 ± 1 C en un baño de agua. El tiempo transcurrido entre la preparación de la dilución primaria y el momento en que es vertido el medio de cultivo, no debe exceder de 20 minutos. 4. Mezclar cuidadosamente el medio con seis movimientos de derecha a izquierda, seis en el sentido de las manecillas del reloj, seis en el sentido contrario y seis de atrás para adelante, 6to SEMESTRE 2014-A Página 6
8 sobre una superficie lisa. Permitir que la mezcla se solidifique dejando las cajas Petri reposar sobre una superficie horizontal fría. 5. Preparar una caja control con 15 ml de medio, para verificar la esterilidad. 6. Invertir las cajas y colocarlas en la incubadora a 25 ± 1 C. 7. Contar las colonias de cada placa después de 3, 4 y 5 días de incubación. Después de 5 días, seleccionar aquellas placas que contengan entre 10 y 150 colonias. Si alguna parte de la caja muestra crecimiento extendido de mohos o si es difícil contar colonias bien aisladas, considerar los conteos de 4 días de incubación y aún de 3 días. En este caso, informar el periodo de incubación de 3 o 4 días en los resultados del análisis. 8. Si es necesario, cuando la morfología colonial no sea suficiente, examinar microscópicamente para distinguir las colonias de levaduras y mohos de las bacterias. BIBLIOGRAFIA NORMA Oficial Mexicana NOM-111-SSA to SEMESTRE 2014-A Página 7
9 APLICAR TÉCNICAS DE IDENTIFICACIÓN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Nombre del alumno: Lista de cotejo de la actividad experimental No. Instrucciones: Se presentan los criterios para evaluar el desempeño del estudiante, mediante la verificación de los puntos mencionados. De la siguiente lista marque con una las observaciones que se han cumplido por el estudiante durante su desempeño, su evaluación será contando la columna de Sí. Desarrollo Si No 1. Toma en cuenta las indicaciones para realizar la práctica. 2. Trabaja en equipo. 3. Manipula en forma correcta los materiales y reactivos del laboratorio. 4. Realiza el procedimiento o desarrollo de la actividad experimental. 5. Los resultados son de acuerdo a lo esperado. 6. Utiliza adecuadamente los conceptos y nombres de la materia asignada en la práctica. 7. Realiza la práctica con responsabilidad. 8. Utiliza alguna tecnología de información y comunicación durante el desarrollo de la actividad experimental. 9. Durante el desarrollo de la actividad experimental trabajó con orden y limpieza. 10. Dio tratamiento adecuado a los residuos y entrego limpio y seco el material utilizado. NOMBRE DEL DOCENTE HORA DE INICIO: HORA DE TÉRMINO: EVALUACIÓN: FECHA: 6to SEMESTRE 2014-A Página 8
10 APLICAR TÉCNICAS DE IDENTIFICACIÓN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Rúbrica de evaluación de la actividad experimental No: Nombre del alumno: Instrucciones: A continuación se presentan los criterios a verificar para evidenciar el desempeño del estudiante. Indicador De la siguiente lista marque con una las observaciones que se toman en cuenta para la evaluación del estudiante. Ejecución Cumplimiento Ponde- Calificación Observaciones ración Entrega puntualmente el reporte de la actividad experimental e Incluye adecuadamente los conceptos previos 2 Presenta el reporte con calidad 3 4 Esquematiza el procedimiento o desarrollo de la actividad experimental Anota los resultados, mostrando la evidencia de su trabajo Completos las actividades previas 2do. día y/o incompleto las actividades previas Lapicero y con buena ortografía Lápiz y mala ortografía Dibujos a color, las TIC s Sin color y no completos los dibujos Los resultados, evidencias son lo esperado y utiliza los conceptos adecuados No hay evidencia de trabajo y los resultados no son claros 5 Presenta las conclusiones y cita la bibliografía consultada Conclusión y bibliografía Conclusión o bibliografía Tabla de ponderación 2,1 = sí cumplió 0= no cumplió Evaluación: Suma de las calificaciones EVALUACIÓN: NOMBRE DEL DOCENTE FECHA: 6to SEMESTRE 2014-A Página 9
11 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS. ACTIVIDAD EXPERIMENTAL NÚM. 2 MEDIANTE TECNICAS DE TINCION IDENTIFICAR HONGOS Y LEVADURAS. FUNDAMENTOS El tamaño de la mayoría de las células bacterianas es tal que resultan difíciles de ver con el microscopio óptico. La principal dificultad es la falta de contraste entre la célula y el medio que la rodea, y el medio más simple de aumentar el contraste es la utilización de colorantes. Estos pueden emplearse para distinguir entre tipos diferentes de células o para revelar la presencia de determinados constituyentes celulares, tales como flagelos, esporas, cápsulas, paredes celulares, centros de actividad respiratoria, etc. Las células generalmente son tratadas para coagular el protoplasma antes de teñirlas, proceso llamado fijación. Para bacterias, la fijación por el calor es lo más corriente, aunque también puede fijarse con sustancias químicas como formaldehido, ácidos y alcoholes. Después de la fijación, si se añade el colorante, no se producen ulteriores cambios estructurales en el protoplasma. La fijación se realiza habitualmente en células que han sido fijadas sobre un portaobjetos, tratando después éste con el agente fijador, y siguiendo inmediatamente el proceso de tinción. La fijación produce habitualmente el encogimiento de las células; la tinción, por el contrario, hace que las células aparezcan mayores que lo que son realmente, de manera que las medidas de las células que han sido fijadas o teñidas no pueden realizarse con mucha precisión. La mayoría de los colorantes son compuestos orgánicos que tienen alguna afinidad específica por los materiales celulares. Muchos colorantes utilizados con frecuencia son moléculas cargadas positivamente (cationes) y se combinan con intensidad con los constituyentes celulares cargados negativamente, tales como los ácidos nucleicos y los polisacáridos ácidos. Ejemplos de colorantes catiónicos son el azul de metileno, el cristal violeta y la safranina. Otros colorantes son moléculas cargadas negativamente (aniones) y se combinan con los constituyentes celulares cargados positivamente, tales como muchas proteínas. Esos colorantes incluyen la eosina, la fucsina ácida y el rojo Congo. Otro grupo de colorantes son sustancias liposolubles; los colorantes de este grupo se combinan con los materiales lipídicos de la célula, usándose a menudo para revelar la localización de las gotículas o depósítos de grasa. Un ejemplo de colorante liposoluble es el negro Sudán. Algunos colorantes teñirán mejor sólo después de que la célula haya sido tratada con otra sustancia química, que no es un colorante por sí mismo. Esta sustancia se denomina mordiente; un mordiente habitual es el ácido tánìco. El mordiente se combina con un constituyente celular y lo altera de tal modo que ahora sí podrá atacar el colorante. Si se desea simplemente incrementar el contraste de las células para la microscopía, son suficientes los procedimientos simples de tinción. El azul de metileno es un buen colorante simple que actúa sobre todas las células bacterianas rápidamente y que no produce un color tan intenso que 6to SEMESTRE 2014-A Página 10
12 oscurezca los detalles celulares. Es especialmente útil para detectar la presencia de bacterias en muestras naturales, puesto que la mayor parte del material no celular no se tiñe. La tinción negativa es el reverso del procedimiento de tinción usual: las células se dejan sin teñir, pero se colorea en cambio el medio que las rodea. Lo que se ve, por tanto, es el perfil de las células. La sustancia utilizada para la tinción negativa es un material opaco que no tiene afinidad por los constituyentes celulares y que simplemente rodea las células, tal como la tinta china (que es una suspensión de partículas de carbono coloidal) o la nigrosina (un colorante negro insoluble en agua). La tinción negativa es un modo satisfactorio de aumentar el contraste de las células en la microscopia óptica, pero su máxima utilidad está en revelar la presencia de cápsulas alrededor de las células de los microorganismos. Los métodos de tinción son de gran utilidad, pero deben usarse siempre con precaución, ya que pueden conducir a errores. Las moléculas de colorante forman en ocasiones precipitados o agregados que parecen estructuras celulares auténticas, pero que son formaciones completamente artificiales inducidas por el mismo colorante. Tales estructuras se denominan artefactos, y deben tomarse muchas precauciones para tener la seguridad de que no nos estamos equivocando al creer que un artefacto es una estructura realmente existente. PREPARACIÓN DE UN FROTIS Sobre un portaobjetos de vidrio, limpio y seco, se coloca una gota del material que se va a teñir (si es líquido) o se hace rodar el hisopo con que se tomó la muestra. Una vez que el hisopo ha tocado la superficie del portaobjetos, que no está estéril, ya no puede ser empleado para inocular los medios de cultivo. Puede usarse una aguja estéril para transferir una pequeña cantidad de un cultivo bacteriano a la superficie del portaobjetos. Este material es suspendido en una gota de agua o solución salina previamente colocada sobre el portaobjetos. Cuando se trata de colonias muy pequeñas que pueden perderse en una gota de líquido se emplea una varilla delgada de madera estéril con la cual se toca la colonia obteniéndose así una fracción apreciable del desarrollo. El material se frota directamente sobre el portaobjetos, donde puede visualizarse con facilidad. El material colocado en el portaobjetos se deja secar al aire o bien se pasa varias veces por la zona azul de la llama de un mechero de Bunsen hasta que el vidrio esté tan caliente que moleste al tacto pero no queme. REACTIVOS Hidróxido de potasio al 10% la cantidad necesaria Tinta china gotas MATERIAL Cultivo de hongos en placa petri (práctica anterior) Asa bacteriológica Porta y cubre objetos Mechero de bunsen Microscopio óptico o bacteriológico 6to SEMESTRE 2014-A Página 11
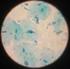
13 PROCEDIMIENTO Tinta china Es un método de contraste. Permite visualizar la cápsula de polisacárido de Cryptococcus neoformans, mediante la presencia de un halo claro y nítido alrededor de la levadura. Existen artefactos (hematíes, burbujas de aire, leucocitos, gotas de grasa y partículas de talco) que pueden interferir y confundir al analista. La sensibilidad de la técnica es de 50% en pacientes sin VIH y se puede incrementar hasta 88% en pacientes VIH con meningitis criptococósica. Cryptococus neoformans en una tinción con tinta china. Para la preparación del frotis es necesario el cultivo de los microorganismos mediante placas de petri y medios de cultivo (utilizar el obtenido en la actividad experimental anterior), se toma la muestra con alguna aguja estéril o palillo de madera y se transfiere al portaobjetos, previamente añadido con una gota estéril para albergar el cultivo del microorganismos. Se deja secar al aire libre o en su defecto se expone levemente a la llama del mechero solo para propósitos de secado y teniendo mucho cuidado de no excederse ya que provocaría el quemado de la muestra, simplemente que el portaobjetos esté caliente pero no queme. Se observa finalmente al microscopio óptico para la identificación del tipo de microorganismos obtenido en la preparación y su caracterización. BIBLIOGRAFIA Norma Oficial Mexicana. NOM-111-SSA Bienes y Servicios. Método para la cuenta de mohos y levaduras en alimentos. Frazier W. & Westhoff D. (1994) Microbiología de los Alimentos. 4ª. ed. Acribia, España Beuchat L.R. & Cousin M.A. (2001) Yeasts and Molds. In: Compendium of Methods for the Microbiological Examination of Foods. 4 th ed. Downs F.P. & Ito K. (Eds.) APHA. Washington Pierson M. & Smoot L. (2001) Indicator Microorganisms and Microbiological Criteria. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA to SEMESTRE 2014-A Página 12
14 Hocking A. (2001) Toxigenic Aspergillus Species. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Pitt J. (2001) Toxigenic Penicillium Species. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Food and Drug Administration (2003) Bacteriological Analytical Manual. 9 thed. Arlington, VA: AOAC. International Commission on Microbiological. Specifications of Foods (2005) Microorganisms in Foods 6 Chapman & Hall. 2nd ed. 6to SEMESTRE 2014-A Página 13
15 APLICAR TÉCNICAS DE IDENTIFICACIÓN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Nombre del alumno: Lista de cotejo de la actividad experimental No. Instrucciones: Se presentan los criterios para evaluar el desempeño del estudiante, mediante la verificación de los puntos mencionados. De la siguiente lista marque con una las observaciones que se han cumplido por el estudiante durante su desempeño, su evaluación será contando la columna de Sí. Desarrollo Si No 1. Toma en cuenta las indicaciones para realizar la práctica. 2. Trabaja en equipo. 3. Manipula en forma correcta los materiales y reactivos del laboratorio. 4. Realiza el procedimiento o desarrollo de la actividad experimental. 5. Los resultados son de acuerdo a lo esperado. 6. Utiliza adecuadamente los conceptos y nombres de la materia asignada en la práctica. 7. Realiza la práctica con responsabilidad. 8. Utiliza alguna tecnología de información y comunicación durante el desarrollo de la actividad experimental. 9. Durante el desarrollo de la actividad experimental trabajó con orden y limpieza. 10. Dio tratamiento adecuado a los residuos y entrego limpio y seco el material utilizado. NOMBRE DEL DOCENTE HORA DE INICIO: HORA DE TÉRMINO: EVALUACIÓN: FECHA: 6to SEMESTRE 2014-A Página 14
16 APLICAR TÉCNICAS DE IDENTFICACIÓN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Rúbrica de evaluación de la actividad experimental No: Nombre del alumno: Instrucciones: A continuación se presentan los criterios a verificar para evidenciar el desempeño del estudiante. Indicador De la siguiente lista marque con una las observaciones que se toman en cuenta para la evaluación del estudiante. Ejecución Cumplimiento Ponde- Calificación Observaciones ración Entrega puntualmente el reporte de la actividad experimental e Incluye adecuadamente los conceptos previos 2 Presenta el reporte con calidad 3 4 Esquematiza el procedimiento o desarrollo de la actividad experimental Anota los resultados, mostrando la evidencia de su trabajo Completos las actividades previas 2do. día y/o incompleto las actividades previas Lapicero y con buena ortografía Lápiz y mala ortografía Dibujos a color, las TIC s Sin color y no completos los dibujos Los resultados, evidencias son lo esperado y utiliza los conceptos adecuados No hay evidencia de trabajo y los resultados no son claros 5 Presenta las conclusiones y cita la bibliografía consultada Conclusión y bibliografía Conclusión o bibliografía Tabla de ponderación 2,1 = sí cumplió 0= no cumplió Evaluación: Suma de las calificaciones EVALUACIÓN: NOMBRE DEL DOCENTE FECHA: 6to SEMESTRE 2014-A Página 15
17 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS. ACTIVIDAD EXPERIMENTAL NÚM. 3 UTILIZANDO TINCION DE GRAM IDENTIFICAR HONGOS Y LEVADURAS. OBJETIVO Mediante la tinción de Gram observar blastoconidias y pseudomicelios de las especies del género Candida, Malassezia y Cryptococcus, las cuales son Gram positivas con variaciones en la intensidad de la coloración. INTRODUCCION Tinción GRAM La tinción de Gram es uno de los métodos de tinción más importantes en el laboratorio bacteriológico y con el que el estudiante debe estar perfectamente familiarizado. Su utilidad práctica es indiscutible y en el trabajo microscópico de rutina del Laboratorio de Microbiología las referencias a la morfología celular bacteriana (cocos, bacilos, positivos, negativos, etc) se basan justamente en la tinción de GRAM Esta tinción se denominada así por el bacteriólogo danés Christian Gram, quien la desarrolló en Sobre la base de su reacción a la tinción de Gram, las bacterias pueden dividirse en dos grupos, Grampositivas y Gramnegativas (en este caso, los términos positivo y negativo no tiene nada que ver con carga eléctrico, sino simplemente designan dos grupos morfológicos distintos de bacterias). Las bacterias Gram-positivas y Gram-negativas tiñen de forma distinta debido a las diferencias constitutivas en la estructura de sus paredes celulares. La pared de la célula bacteriana sirve para dar su tamaño y forma al organismo así como para prevenir la lisis osmótica. El material de la pared celular bacteriana que confiere rigidez es el peptidoglicano. La pared de la célula gram-positiva es gruesa y consiste en varias capas interconectandas de peptidoglicano así como algo de ácido teicoico. Generalmente, 80%-90% de la pared de la célula gram-positiva es peptidoglicano. La pared de la célula gram-negativa, por otro lado, contiene una capa mucho más delgada, únicamente de peptidoglicano y está rodeada por una membrana exterior compuesta de fosfolípidos, lipopolisacáridos, y lipoproteínas. Sólo 10% - 20% de la pared de la célula gram-negativa es peptidoglicano. 6to SEMESTRE 2014-A Página 16
18 Debido a su importancia en taxonomía bacteriana y a que indica diferencias fundamentales de la pared celular de las distintas bacterias, describiremos aquí con algún detalle la tinción de Gram y las interpretaciones que actualmente se hacen sobre el porqué de su funcionamiento. Las células fijadas al calor sobre un portaobjetos se tiñen, primero con una solución de cristal violeta (otros colorantes básicos no son tan efectivos) y son lavadas después para quitar el exceso de colorante. En este estado, todas las células, tanto las grampositivas como las gramnegativas, están teñidas de azul. El portaobjetos se cubre entonces con una solución de yodo-yoduro potásico. El ingrediente activo es aquí el I; el KI simplemente hace soluble el I 2 en agua. El I 2 entra en las células y forma un complejo insoluble en agua con el cristal violeta. De nuevo tanto las células grampositivas como las gramnegativas se encuentran en la misma situación. Se lleva a cabo después la decoloración, usando una mezcla de alcohol-acetona, sustancias en las que es soluble el complejo I 2 - cristal violeta. Algunos organismos (grampositivos) no se decoloran, mientras que otros (gramnegativos) lo hacen. La diferencia esencial entre esos dos tipos de células está por tanto en su resistencia a la decoloración; esta resistencia se debe probablemente al hecho de que en el caso de bacterias gram-negativas, la mezcla de alcohol/acetona es un solvente lipídico y disuelve la membrana exterior de la pared de la célula (y también puede dañar la membrana citoplásmica a la que se une peptidoglicano). La delgada capa de peptidoglicano es incapaz de retener el de complejo cristal violeta-yodo y la célula se decolora. Las células grampositivas, a causa de sus paredes celulares más espesas (tienen más peptidoglicano y menos lípido), no son permeables al disolvente ya que éste deshidrata la pared celular y cierra los poros, disminuyendo así el espacio entre las moléculas y provocando que el de complejo cristal violeta-yodo quede atrapado dentro de la pared celular. Después de la decoloración las células grampositivas son todavía azules, pero las gramnegativas son incoloras. Para poner de manifiesto las células gramnegativas se utiliza una coloración de contraste. Habitualmente es un colorante de color rojo, como la safranina o la fucsina básica. Después de la coloración de contraste las células gramnegativas son rojas, mientras que las grampositivas permanecen azules. REACTIVOS Colorante Cristal Violeta Solución yodada o lugol Mezcla alcohol etílico/acetona Colorante safranina Todos gotas y en el caso de la mezcla alcohol etílico/acetona muy péquelas cantidades solo para el uso de las preparaciones al microscopio. 6to SEMESTRE 2014-A Página 17
19 MATERIAL Porta y cubre objetos Microscopio óptico o bacteriológico Muestra de cultivo de hongos o levaduras Asa bacteriológica Mechero de bunsen Goteros CAPACITACIÓN LABORATORISTA QUÍMICO PROCEDIMIENTO Descrita en forma breve, la secuencia de la tinción es la siguiente: El Frotis fijado con calor se tiñe 1 min con Violeta Cristal, se lava con agua, se cubre con solución Yodada durante 1 min y se lava de nuevo con agua, decolorar con mezcla alcohol etílico/acetona. Escurrir y cubrir con Safranina (color de contraste) durante 20 seg. Lavar y secar. Deben destacarse algunos aspectos cruciales de la tinción de Gram: 1) El tratamiento con cristal violeta debe preceder al tratamiento con yodo. El yodo por sí solo tiene poca afinidad con las células. 2) La decoloración debe realizarse con poca agua para evitar que pierdan la tinción las células grampositivas. EI proceso de decoloración debe ser corto y es esencial un cálculo preciso del tiempo para obtener resultados satisfactorios. 3) Cultivos más viejo de 24 horas pueden perder su habilidad de retener el complejo cristal violeta - yodo. El carácter de grampositivo no es siempre un fenómeno del todo o nada. Algunos organismos son más grampositivos que otros y algunos son gram-variables, es decir, unas veces grampositivos y otras gramnegativos. BIBLIOGRAFÍA Norma Oficial Mexicana. NOM-111-SSA Bienes y Servicios. Método para la cuenta de mohos y levaduras en alimentos. Frazier W. & Westhoff D. (1994) Microbiología de los Alimentos. 4ª. ed. Acribia, España Beuchat L.R. & Cousin M.A. (2001) Yeasts and Molds. In: Compendium of Methods for the Microbiological Examination of Foods. 4 th ed. Downs F.P. & Ito K. (Eds.) APHA. Washington to SEMESTRE 2014-A Página 18
20 Pierson M. & Smoot L. (2001) Indicator Microorganisms and Microbiological Criteria. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Hocking A. (2001) Toxigenic Aspergillus Species. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Pitt J. (2001) Toxigenic Penicillium Species. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Food and Drug Administration (2003) Bacteriological Analytical Manual. 9 thed. Arlington, VA: AOAC. International Commission on Microbiological. Specifications of Foods (2005) Microorganisms in Foods 6 Chapman & Hall. 2nd ed. 6to SEMESTRE 2014-A Página 19
21 APLICAR TÉCNICAS DE IDENTIFICACIÓPN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Nombre del alumno: Lista de cotejo de la actividad experimental No. Instrucciones: Se presentan los criterios para evaluar el desempeño del estudiante, mediante la verificación de los puntos mencionados. De la siguiente lista marque con una las observaciones que se han cumplido por el estudiante durante su desempeño, su evaluación será contando la columna de Sí. Desarrollo Si No 1. Toma en cuenta las indicaciones para realizar la práctica. 2. Trabaja en equipo. 3. Manipula en forma correcta los materiales y reactivos del laboratorio. 4. Realiza el procedimiento o desarrollo de la actividad experimental. 5. Los resultados son de acuerdo a lo esperado. 6. Utiliza adecuadamente los conceptos y nombres de la materia asignada en la práctica. 7. Realiza la práctica con responsabilidad. 8. Utiliza alguna tecnología de información y comunicación durante el desarrollo de la actividad experimental. 9. Durante el desarrollo de la actividad experimental trabajó con orden y limpieza. 10. Dio tratamiento adecuado a los residuos y entrego limpio y seco el material utilizado. NOMBRE DEL DOCENTE HORA DE INICIO: HORA DE TÉRMINO: EVALUACIÓN: FECHA: 6to SEMESTRE 2014-A Página 20
22 APLICAR TÉCNICAS DE IDENTIFICACIÓN PAARA GONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Rúbrica de evaluación de la actividad experimental No: Nombre del alumno: Instrucciones: A continuación se presentan los criterios a verificar para evidenciar el desempeño del estudiante. Indicador De la siguiente lista marque con una las observaciones que se toman en cuenta para la evaluación del estudiante. Ejecución Cumplimiento Ponde- Calificación Observaciones ración Entrega puntualmente el reporte de la actividad experimental e Incluye adecuadamente los conceptos previos 2 Presenta el reporte con calidad 3 4 Esquematiza el procedimiento o desarrollo de la actividad experimental Anota los resultados, mostrando la evidencia de su trabajo Completos las actividades previas 2do. día y/o incompleto las actividades previas Lapicero y con buena ortografía Lápiz y mala ortografía Dibujos a color, las TIC s Sin color y no completos los dibujos Los resultados, evidencias son lo esperado y utiliza los conceptos adecuados No hay evidencia de trabajo y los resultados no son claros 5 Presenta las conclusiones y cita la bibliografía consultada Conclusión y bibliografía Conclusión o bibliografía Tabla de ponderación 2,1 = sí cumplió 0= no cumplió Evaluación: Suma de las calificaciones EVALUACIÓN: NOMBRE DEL DOCENTE FECHA: 6to SEMESTRE 2014-A Página 21
23 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS. ACTIVIDAD EXPERIMENTAL NÚM. 4 IDENTIFICACIÓN DE CRYPTOCOCCUS NEOFORMANS POR MÉTODOS ENZIMÁTICOS FUNDAMENTO Detección de ureasa Una levadura con reacción positiva a la prueba de la ureasa es sugestiva de pertenecer al género Cryptococcus. Concretamente, las cepas de C. neoformans que son grandes productores de ureasa, comienzan a provocar cambio de color a las 2 h de incubación a 35 C. Procedimiento 1. Pasar la punta de un aplicador de algodón, impregnado con agar base ureasa de Christensen, sobre la superficie de dos o tres colonias aisladas del microorganismo a estudiar, de un cultivo de 48 a 72 h en cualquiera de los medios habituales. 2. Colocar el aplicador inoculado en un tubo con 3 gotas de cloruro de benzalconio al 1% (ajustar el ph a 4,8). 3. Presionar con fuerza la punta del hisopo contra el fondo del tubo para que se desprendan los microorganismos contenidos en las fibras de algodón. 4. Tapar el tubo e incubar a 45 C. 5. Examinar el tubo a los 10, 15, 20 y 30 min. Interpretación El desarrollo de un color rojo-púrpura, indica el resultado positivo de la prueba 6to SEMESTRE 2014-A Página 22
24 Bibliografia Norma Oficial Mexicana. NOM-111-SSA Bienes y Servicios. Método para la cuenta de mohos y levaduras en alimentos. Frazier W. & Westhoff D. (1994) Microbiología de los Alimentos. 4ª. ed. Acribia, España Beuchat L.R. & Cousin M.A. (2001) Yeasts and Molds. In: Compendium of Methods for the Microbiological Examination of Foods. 4 th ed. Downs F.P. & Ito K. (Eds.) APHA. Washington Pierson M. & Smoot L. (2001) Indicator Microorganisms and Microbiological Criteria. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Hocking A. (2001) Toxigenic Aspergillus Species. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Pitt J. (2001) Toxigenic Penicillium Species. In: Food Microbiology. Fundamentals and Frontiers. 2 nd ed. Doyle M. Beuchat L. & Montville T. (Eds.) ASM Press. USA Food and Drug Administration (2003) Bacteriological Analytical Manual. 9 thed. Arlington, VA: AOAC. International Commission on Microbiological. Specifications of Foods (2005) Microorganisms in Foods 6 Chapman & Hall. 2nd ed. 6to SEMESTRE 2014-A Página 23
25 APLICAR TÉCNICAS DE IDENTIFICACIÓN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Nombre del alumno: Lista de cotejo de la actividad experimental No. Instrucciones: Se presentan los criterios para evaluar el desempeño del estudiante, mediante la verificación de los puntos mencionados. De la siguiente lista marque con una las observaciones que se han cumplido por el estudiante durante su desempeño, su evaluación será contando la columna de Sí. Desarrollo Si No 1. Toma en cuenta las indicaciones para realizar la práctica. 2. Trabaja en equipo. 3. Manipula en forma correcta los materiales y reactivos del laboratorio. 4. Realiza el procedimiento o desarrollo de la actividad experimental. 5. Los resultados son de acuerdo a lo esperado. 6. Utiliza adecuadamente los conceptos y nombres de la materia asignada en la práctica. 7. Realiza la práctica con responsabilidad. 8. Utiliza alguna tecnología de información y comunicación durante el desarrollo de la actividad experimental. 9. Durante el desarrollo de la actividad experimental trabajó con orden y limpieza. 10. Dio tratamiento adecuado a los residuos y entrego limpio y seco el material utilizado. NOMBRE DEL DOCENTE HORA DE INICIO: HORA DE TÉRMINO: EVALUACIÓN: FECHA: 6to SEMESTRE 2014-A Página 24
26 APLICAR TÉCNICAS DE IDENTIFICACIÓN PARA HONGOS Y LEVADURAS 6 to Semestre Grupo Plantel SEMESTRE 2014-A Nombre de la actividad experimental: Rúbrica de evaluación de la actividad experimental No: Nombre del alumno: Instrucciones: A continuación se presentan los criterios a verificar para evidenciar el desempeño del estudiante. Indicador De la siguiente lista marque con una las observaciones que se toman en cuenta para la evaluación del estudiante. Ejecución Cumplimiento Ponde- Calificación Observaciones ración Entrega puntualmente el reporte de la actividad experimental e Incluye adecuadamente los conceptos previos 2 Presenta el reporte con calidad 3 4 Esquematiza el procedimiento o desarrollo de la actividad experimental Anota los resultados, mostrando la evidencia de su trabajo Completos las actividades previas 2do. día y/o incompleto las actividades previas Lapicero y con buena ortografía Lápiz y mala ortografía Dibujos a color, las TIC s Sin color y no completos los dibujos Los resultados, evidencias son lo esperado y utiliza los conceptos adecuados No hay evidencia de trabajo y los resultados no son claros 5 Presenta las conclusiones y cita la bibliografía consultada Conclusión y bibliografía Conclusión o bibliografía Tabla de ponderación 2,1 = sí cumplió 0= no cumplió Evaluación: Suma de las calificaciones EVALUACIÓN: NOMBRE DEL DOCENTE FECHA: 6to SEMESTRE 2014-A Página 25
AcuaNatura ÍNDICE TÉCNICAS DE TINCIÓN
 TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
TÉCNICAS DE TINCIÓN ÍNDICE 1. Introducción 3 2. Tipos de tinciones 4 2.1. Tinción de Gram 4 2.2. Tinción ácido alcohol resistencia 5 2.3. Tinción de esporas 5 2.4. Tinción negativa 6 3. Precauciones 7
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM
 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS BIOLOGÍA I ACTIVIDAD EXPERIMENTAL NUM. 2 ESTRUCTURA CELULAR (BLOLQUE III) INTRODUCCIÓN La célula es la unidad anatómica y fisiológica de los
COLEGIO DE BACHILLERES DEL ESTADO DE TLAXCALA DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS
 DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL NÚM. 2 TABLA PERIÓDICA PROPIEDAD DE LOS NO METALES EN COMPARACIÓN CON LOS METALES (BLOQUE IV) INTRODUCCIÓN Una de las
DIRECCIÓN ACADÉMICA DEPARTAMENTO DE BIBLIOTECAS Y LABORATORIOS ACTIVIDAD EXPERIMENTAL NÚM. 2 TABLA PERIÓDICA PROPIEDAD DE LOS NO METALES EN COMPARACIÓN CON LOS METALES (BLOQUE IV) INTRODUCCIÓN Una de las
NORMA Oficial Mexicana NOM-111-SSA1-1994, Bienes y servicios. Método para la cuenta de mohos y levaduras en alimentos.
 09-13-95 NORMA Oficial Mexicana NOM-111-SSA1-1994, Bienes y servicios. Método para la cuenta de mohos y levaduras en alimentos. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.-
09-13-95 NORMA Oficial Mexicana NOM-111-SSA1-1994, Bienes y servicios. Método para la cuenta de mohos y levaduras en alimentos. Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.-
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR
 UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS CAMPUS IV OCOZOCOAUTLA DE ESPINOZA. LABORATORIO DE BIOLOGIA CELULAR Catedrático: Dra. Ana Olivia cañas Urbina. PRACTICA No. 3: TINCIONES Equipo:
PRACTICA 2 TINCION DE GRAM
 PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRACTICA 2 TINCION DE GRAM OBJETIVOS DE APRENDIZAJE: Cuando haya completado este experimento, usted debe comprender: 1. La base teórica y química de los procedimientos de tinción diferencial. 2. La base
PRÁCTICO N 3. Técnicas para la observación, aislamiento y conservación de microorganismos
 PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
PRÁCTICO N 3 Técnicas para la observación, aislamiento y conservación de microorganismos Objetivos Conocer el manejo del microscopio óptico, sus partes y utilidad en el laboratorio de microbiología. Conocer
Cuenta en placa de bacterias
 Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química,. México. Cuenta en placa de bacterias OBJETIVOS Realizar adecuadamente la técnica de cuenta en placa para diversos grupos microbianos de
Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química,. México. Cuenta en placa de bacterias OBJETIVOS Realizar adecuadamente la técnica de cuenta en placa para diversos grupos microbianos de
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO
 RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
RECONOCIMIENTO DE LOS PRINCIPIOS INMEDIATOS QUE HAY EN UN ALIMENTO Fundamento Los alimentos se diferencian entre sí por las sustancias o principios inmediatos que contienen y por la cantidad de cada uno
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
UNIVERSIDAD TECNOLOGICA NACIONAL
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUIMICA CATEDRA DE BIOTECNOLOGIA Trabajo práctico n 4 Tinción y observación de microorganismos. 2009 Jefe de Cátedra:
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NMX-F-187-1978. DETERMINACIÓN DEL NÚMERO MÁS PROBABLE DE GÉRMENES. METHOD OF TEST FOR GERMS MOST PROBABLE NUMBER. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de esta Norma
NMX-F-187-1978. DETERMINACIÓN DEL NÚMERO MÁS PROBABLE DE GÉRMENES. METHOD OF TEST FOR GERMS MOST PROBABLE NUMBER. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO En la elaboración de esta Norma
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR
 UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
UNIVERSIDAD AUTÓNOMA CHAPINGO DEPARTAMENTO DE INGENIERÍA AGROINDUSTRIAL FICHA CURRICULAR 1. Datos Generales: Departamento Nombre del Programa Licenciatura Línea curricular Tecnológica Asignatura Biología
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Introducción
 PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
PRÁCTICA No. 4 Métodos de cultivo y descripción morfológica de hongos Objetivos. Que el alumno aprenda las técnicas de cultivo y manipulación de diferentes tipos de hongos. Que el estudiante conozca las
Técnicas de observación de microorganismos
 Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Fundamentos y técnicas de análisis microbiológicos Técnicas de observación de microorganismos - 1 Técnicas de observación de microorganismos El examen microscópico es el primer paso para el estudio de
Determinación de coliformes totales por cuenta en placa
 Camacho, A., M.Giles, A.Ortegón, M.Palao, B.Serrano y O.Velázquez. 2009. Técnicas para el Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química, UNAM. México. Determinación de coliformes totales
Camacho, A., M.Giles, A.Ortegón, M.Palao, B.Serrano y O.Velázquez. 2009. Técnicas para el Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química, UNAM. México. Determinación de coliformes totales
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Unidad Curricular: Virología y Micología Veterinaria TRABAJO PRÁCTICO No. 6 MICOLOGÍA OBJETIVO 1. Estudiar las características morfológicas de los hongos y su crecimiento en los medios de cultivo. GENERALIDADES
1 Unidad Curricular: Virología y Micología Veterinaria TRABAJO PRÁCTICO No. 6 MICOLOGÍA OBJETIVO 1. Estudiar las características morfológicas de los hongos y su crecimiento en los medios de cultivo. GENERALIDADES
Trabajo práctico Nº 6. Introducción. Ejercicio teórico MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS. Objetivo. Procedimiento.
 Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
Introducción Ejercicio teórico Objetivo Trabajo práctico Nº 6 MORFOLOGÍA Y TINCIÓN DE LOS MICROORGANISMOS Procedimiento Resultados Actividades adicionales Bibliografía INTRODUCCIÓN Una de las características
PROCEDIMIENTO RECUENTO DE COLIFORMES EN MEDIO SÓLIDO
 PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II
 UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
UNIVERSIDAD NACIONAL DE COLOMBIA FACULTAD DE MEDICINA DEPARTAMENTO DE MICROBIOLOGIA PRACTICAS DE LABORATORIO IDENTIFICACION BACTERIANA II Maye Bernal Rivera PARTE II. LECTURA E INTERPRETACION DE LOS CULTIVOS
Laboratorio 4: Tinción de microorganismos. Biol 3725L
 Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Laboratorio 4: Tinción de microorganismos Biol 3725L 1 ml 1 ml Repaso de diluciones 0.1 ml 1 ml 1 ml 9 ml 1 / 10 10-1 99 ml 9.9ml 9 ml 1 / 100 10-3 1 ml 0.1/ 10 1/ 100 10-5 1/10 10-6 1 ml 9 ml 1/10 10-7
Laboratorio de Introducción a la Microbiología. Practico N 1
 Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
Laboratorio de Introducción a la Microbiología Practico N 1 PREPARACIÓN PARA LA OBSERVACIÓN DE MICROORGANISMOS POR MICROSCOPIA Los microorganismos son demasiado pequeños para ser observados a simple vista,
PREPARACIÓN DE MEDIOS DE CULTIVO
 Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
Introducción Clasificación de los medios de cultivo Almacenamiento de los medios de cultivo Trabajo Práctico Nº 6 PREPARACIÓN DE MEDIOS DE CULTIVO Objetivo Fundamento Procedimiento Resultados Bibliografía
QUÍMICA DEL ARSÉNICO, ANTIMONIO Y BISMUTO
 QUÍMICA DEL ARSÉNICO, ANTIMONIO Y BISMUTO Los tres elementos que se estudiarán en esta práctica corresponden al grupo 15 de la Tabla Periódica. El arsénico cuya toxicidad es bien conocida se encuentra
QUÍMICA DEL ARSÉNICO, ANTIMONIO Y BISMUTO Los tres elementos que se estudiarán en esta práctica corresponden al grupo 15 de la Tabla Periódica. El arsénico cuya toxicidad es bien conocida se encuentra
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS
 LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
LABORATORIO No.3 OBSERVACIÓN DE CÉLULAS VEGETALES Y DIFERENCIACIONES CITOPLASMATICAS INTRODUCCIÓN En el universo biológico se encuentran dos tipos de células: procariotas y eucariotas. Estas últimas a
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente
 Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA
 TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA 1. COMPLETE EL MAPA CONCEPTUAL. FUNCIONES: NUCLEO CROMOSOMAS NUCLEOLOS ESTRUCTURA LA CELULA MEMBRANA CELULAR FUNCIONES: FUNCIONES MITOCONDRIAS: RIBOSOMAS: CITOPLASMA
TALLER No 1 MAPA CONCEPTUAL DE LA CÉLULA 1. COMPLETE EL MAPA CONCEPTUAL. FUNCIONES: NUCLEO CROMOSOMAS NUCLEOLOS ESTRUCTURA LA CELULA MEMBRANA CELULAR FUNCIONES: FUNCIONES MITOCONDRIAS: RIBOSOMAS: CITOPLASMA
o Solución de KOH al 0,01% Disolver el colorante en el alcohol, y añadir la solución de KOH
 OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
OBSERVACIÓN DE LAS BACTERIAS TINCIÓN SENCILLA 1.- Material necesario Cultivo bacteriano de 24 horas, en medio sólido Portaobjetos limpios y desengrasados Frasco lavador con agua de grifo o destilada Asa
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
1 Bacteriología Veterinaria. TRABAJO PRÁCTICO No. 1 PRIMER PERIODO MICROSCOPÍA Y MORFOLOGÍA DE BACTERIAS OBJETIVOS 1. Manipular correctamente cada una de las partes del microscopio compuesto de campo claro.
TÍTULO: Determinación colorimétrica de fenoles en agua por el método de la 4- aminoantipirina
 Página 1 de 6 1.- INTRODUCCIÓN Desde el punto de vista analítico el término fenol engloba este producto y sus homólogos inmediatamente superiores. El fenol se emplea como patrón y el resultado obtenido
Página 1 de 6 1.- INTRODUCCIÓN Desde el punto de vista analítico el término fenol engloba este producto y sus homólogos inmediatamente superiores. El fenol se emplea como patrón y el resultado obtenido
MEDIOS DE CULTIVO Y TINCIÓN DE GRAM
 MEDIOS DE CULTIVO Y TINCIÓN DE GRAM AUTORIA AZAHARA CABRERA ORTEGA TEMÁTICA PRÁCTICAS ETAPA EDUCACIÓN SECUNDARIA POSTOBLIGATORIA Resumen Tanto los medios de cultivo como la realización de tinciones de
MEDIOS DE CULTIVO Y TINCIÓN DE GRAM AUTORIA AZAHARA CABRERA ORTEGA TEMÁTICA PRÁCTICAS ETAPA EDUCACIÓN SECUNDARIA POSTOBLIGATORIA Resumen Tanto los medios de cultivo como la realización de tinciones de
BIORREACTRES. Estudios básicos y aplicados sobre procesos de fermentación
 BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
BIORREACTRES Ing. en Alimentos Estudios básicos y aplicados sobre procesos de fermentación Mg. Anahí V. Cuellas Docente investigadora Universidad Nacional de Quilmes TRABAJO PRACTICO Obtención de enzimas
Escuela de Ciencias Agrícolas, Pecuarias y del Medio Ambiente
 GUÍA: Bacteriología y Micología: Descripción Microscópica y Macroscópica MICROBIOLOGIA AMBIENTAL CÓDIGO 358010 Programa de Ingeniería Ambiental y Tecnología en Saneamiento Ambiental. ESTRATEGIA DE APRENDIZAJE:
GUÍA: Bacteriología y Micología: Descripción Microscópica y Macroscópica MICROBIOLOGIA AMBIENTAL CÓDIGO 358010 Programa de Ingeniería Ambiental y Tecnología en Saneamiento Ambiental. ESTRATEGIA DE APRENDIZAJE:
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo
 Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
Dr. Oscar Gutiérrez Coronado Microbiologia Práctica No. 1 Preparación y esterilización de materiales y medios de cultivo Objetivos. Que el alumno conozca los principios generales de las técnicas de esterilización
TRABAJO PRÁCTICO N 3: Identificación microbiana
 TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
TRABAJO PRÁCTICO N 3: Identificación microbiana PARTE A: Identificación Fenotípica 1.-Pruebas Bioquímicas 2- Coloraciones 3. Uso del Manual Bergey Pruebas Bioquímicas Son una serie de pruebas que permiten
DETERMINACIÓN DEL PORCENTAJE DE PLOMO MTC E
 DETERMINACIÓN DEL PORCENTAJE DE PLOMO MTC E 1219 2000 Este Modo Operativo está basado en la Norma ASTM D 49, el mismo que se han adaptado al nivel de implementación y a las condiciones propias de nuestra
DETERMINACIÓN DEL PORCENTAJE DE PLOMO MTC E 1219 2000 Este Modo Operativo está basado en la Norma ASTM D 49, el mismo que se han adaptado al nivel de implementación y a las condiciones propias de nuestra
Microscopio y observación de células
 I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
I.E.S. Rayuela - Departamento de Biología y Geología Práctica nº1 de Anatomía Aplicada Microscopio y observación de células Las células suelen ser de tamaño muy pequeño de modo que permanecen invisibles
SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado por: Licda. Vivian Margarita Sánchez Garrido
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS-CUM UNIDAD DIDÁCTICA QUÍMICA- PRIMER AÑO PRÁCTICAS DE LABORATORIO 2016 SEMANA 25 PROPIEDADES QUÍMICAS Y FÍSICAS DE CARBOHIDRATOS Elaborado
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
NORMA Oficial Mexicana NOM-112-SSA1-1994, Bienes y servicios. Determinación de bacterias coliformes. Técnica del número más probable.
 10-19-95 NORMA Oficial Mexicana NOM-112-SSA1-1994, Bienes y servicios. Determinación de bacterias coliformes. Técnica del número más probable. Al margen un sello con el Escudo Nacional, que dice: Estados
10-19-95 NORMA Oficial Mexicana NOM-112-SSA1-1994, Bienes y servicios. Determinación de bacterias coliformes. Técnica del número más probable. Al margen un sello con el Escudo Nacional, que dice: Estados
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE
 PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
PRACTICA Núm. 3 PREPARACIONES DE EXTENSIONES O FROTIS Y TINCION SIMPLE I. OBJETIVO Conocer el procedimiento para preparar extensiones ó frotis y los diferentes métodos de tinción, así como su utilidad
LABORATORIO DE MICROBIOLOGÍA EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote
 Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
Semana 2 Semana 1 LABORATORIO DE EXPERIMENTAL Grupo 2 (10:00 13:00 hrs) Semestre 2013-2 Profesores: Guadalupe Tsuzuki Reyes y Rosalba Esquivel-Cote CALENDARIO DE ACTIVIDADES UNIDAD Lunes 28 ENERO Miércoles
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
Petrifilm Recuento de Enterobacteriaceae
 3 Petrifilm Recuento de Enterobacteriaceae Guía de Interpretación 1 2 3 1 2 Recuento de Enterobacteriaceae = 13 Es fácil contar las colonias de Enterobacteriaceae en placas Petrifilm Recuento de Enterobacteriaceae.
3 Petrifilm Recuento de Enterobacteriaceae Guía de Interpretación 1 2 3 1 2 Recuento de Enterobacteriaceae = 13 Es fácil contar las colonias de Enterobacteriaceae en placas Petrifilm Recuento de Enterobacteriaceae.
Saint Gaspar College
 Saint Gaspar College MISIONEROS DE LA PRECIOSA SANGRE Formando Personas Integras Departamento de Ciencias y Tecnología. Miss Patricia Calderón Guía de Laboratorio de Biología Enzimas digestivas Nombre
Saint Gaspar College MISIONEROS DE LA PRECIOSA SANGRE Formando Personas Integras Departamento de Ciencias y Tecnología. Miss Patricia Calderón Guía de Laboratorio de Biología Enzimas digestivas Nombre
DETERMINACIÓN YODO EN ALIMENTOS Método volumétrico Basado en AOAC
 DETERMINACIÓN YODO EN ALIMENTOS Versión: 1 ME-711.02-245 Página 1 de 5 1. OBJETIVO Determinar yodo en alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE El método es aplicable a sal comestible yodada, cuando
DETERMINACIÓN YODO EN ALIMENTOS Versión: 1 ME-711.02-245 Página 1 de 5 1. OBJETIVO Determinar yodo en alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE El método es aplicable a sal comestible yodada, cuando
 TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TRABAJO PRÁCTICO N 2 CAMBIOS DE ESTADO SÓLIDO LÍQUIDO GASEOSO Manteniendo constante la presión, a baja temperatura los cuerpos se presentan en forma sólida tal que los átomos se encuentran entrelazados
TEMA 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas
 TEMA 9 Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas Tema 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas 1. Examen microscópico del material
TEMA 9 Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas Tema 9. Métodos ópticos para el diagnóstico de laboratorio de enfermedades infecciosas 1. Examen microscópico del material
GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS
 ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
ESCUELA DE SALUD GUÍA REALIZACIÓN DE CULTIVOS MICROBIOLÓGICOS DIRIGIDO A ALUMNOS DE: Técnico de laboratorio Clínico y Banco de Sangre Técnico de Enfermería Técnico de Radiodiagnóstico y Radioterapia Informática
Células. 2ª Parte: Células procariotas. Tema 13 de Biología NS Diploma BI Curso
 Células 2ª Parte: Células procariotas Tema 13 de Biología NS Diploma BI Curso 2012-2014 Estructura de la célula procariota: Escherichia coli Las bacterias son las células procariotas típicas. Tienen pequeño
Células 2ª Parte: Células procariotas Tema 13 de Biología NS Diploma BI Curso 2012-2014 Estructura de la célula procariota: Escherichia coli Las bacterias son las células procariotas típicas. Tienen pequeño
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO
 UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE QUÍMICA ORGÁNICA DETERMINACIÓN DE HALÓGENOS TRABAJO PRÁCTICO Nº:... NOMBRE Y APELLIDO:... FECHA:...
UNIVERSIDAD TECNOLOGICA NACIONAL FACULTAD REGIONAL ROSARIO DEPARTAMENTO DE INGENIERIA QUÍMICA CÁTEDRA DE QUÍMICA ORGÁNICA DETERMINACIÓN DE HALÓGENOS TRABAJO PRÁCTICO Nº:... NOMBRE Y APELLIDO:... FECHA:...
Determinación de Sólidos Disueltos Totales en Aguas
 QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Sólidos Disueltos en Aguas Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 22/09/2013 Método Gravimétrico Página 2 de 7
QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Sólidos Disueltos en Aguas Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 22/09/2013 Método Gravimétrico Página 2 de 7
Determinación de Alcalinidad en aguas naturales y residuales
 QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Alcalinidad en aguas naturales y residuales Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 29/09/2013 Método Titulométrico
QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Alcalinidad en aguas naturales y residuales Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 29/09/2013 Método Titulométrico
Práctica 6. Propiedades físicas y enlace químico
 Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
Práctica 6. Propiedades físicas y enlace químico Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA Qué tipo de enlace predomina
Práctica 3: Identificación de Componentes de la Pared Celular Vegetal
 Práctica 3: Identificación de Componentes de la Pared Celular Vegetal Práctica 3 Contenidos teóricos La pared celular Modificaciones Desarrollo práctico La Pared Celular Citosol Pared celular Pared celular
Práctica 3: Identificación de Componentes de la Pared Celular Vegetal Práctica 3 Contenidos teóricos La pared celular Modificaciones Desarrollo práctico La Pared Celular Citosol Pared celular Pared celular
PROCESAMIENTO DE MUESTRAS VAGINALES
 PROCESAMIENTO DE MUESTRAS VAGINALES Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS TOMA DE LA MUESTRA
PROCESAMIENTO DE MUESTRAS VAGINALES Proyecto AECID 2012 Nuevos procedimientos para el diagnóstico de enfermedades olvidadas utilizando tele-microscopía de bajo coste. 1 TABLA DE CONTENIDOS TOMA DE LA MUESTRA
MANUAL DE PRÁCTICAS DE LABORATORIO
 MANUAL DE PRÁCTICAS DE LABORATORIO IBT QUÍMICA ORGÁNICA FICHA TECNICA FICHA TÉCNICA QUIMICA ORGÁNICA Fecha: 12 Abril 2012 Nombre del catedrático: Edith Ponce Recinos Nombre de la práctica: Identificación
MANUAL DE PRÁCTICAS DE LABORATORIO IBT QUÍMICA ORGÁNICA FICHA TECNICA FICHA TÉCNICA QUIMICA ORGÁNICA Fecha: 12 Abril 2012 Nombre del catedrático: Edith Ponce Recinos Nombre de la práctica: Identificación
3.2. PARTÍCULAS SUBATÓMICAS.
 3.2. PARTÍCULAS SUBATÓMICAS. 3.2.1. PROTONES Y ELECTRONES. Aunque Dalton creía que los átomos eran indivisibles e inalterables, a lo largo del siglo XIX aparecieron cada vez más evidencias de que los átomos
3.2. PARTÍCULAS SUBATÓMICAS. 3.2.1. PROTONES Y ELECTRONES. Aunque Dalton creía que los átomos eran indivisibles e inalterables, a lo largo del siglo XIX aparecieron cada vez más evidencias de que los átomos
COLEGIO DE BACHILLERES PLANTEL 5
 COLEGIO DE BACHILLERES PLANTEL 5 LABORATORIO DE QUIMICA III PLAN 2009 PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Reconocer que los cambios están acompañados de cambios de energía a partir de
COLEGIO DE BACHILLERES PLANTEL 5 LABORATORIO DE QUIMICA III PLAN 2009 PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Reconocer que los cambios están acompañados de cambios de energía a partir de
5.2. NITRÓGENO Y AZUFRE.
 5.2. NITRÓGENO Y AZUFRE. 5.2.1. PROTEÍNAS. Si hidratos de carbono y lípidos están formados únicamente por átomos de carbono, oxígeno e hidrógeno, las proteínas tienen en su composición, además, nitrógeno
5.2. NITRÓGENO Y AZUFRE. 5.2.1. PROTEÍNAS. Si hidratos de carbono y lípidos están formados únicamente por átomos de carbono, oxígeno e hidrógeno, las proteínas tienen en su composición, además, nitrógeno
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS
 PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
PRACTICA #2 ESTUDIO MICROSCOPICO DE LAS BACTERIAS OBJETIVO DE LA PRACTICA Desarrollar las técnicas microscópicas comunes para observar, teñir y medir a las bacterias y sus estructuras. INTRODUCCION El
PRACTICA 2. ESTERILIZACIÓN DE MATERIAL Y PREPARACIÓN DE MEDIOS DE CULTIVO PARA ANÁLISIS MICROBIOLÓGICO
 UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO TALLER MULTIDISCIPLINARIO DE PROCESOS TECNOLÓGICOS DE FRUTOS Y HORTALIZAS PRACTICA 2. ESTERILIZACIÓN DE MATERIAL Y PREPARACIÓN DE MEDIOS DE CULTIVO PARA ANÁLISIS
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO TALLER MULTIDISCIPLINARIO DE PROCESOS TECNOLÓGICOS DE FRUTOS Y HORTALIZAS PRACTICA 2. ESTERILIZACIÓN DE MATERIAL Y PREPARACIÓN DE MEDIOS DE CULTIVO PARA ANÁLISIS
Petrifilm. Placas para Recuento de E. coli y Coliformes. Guía de Interpretación. E. coli : E. coli es capaz de crecer en medios conteniendo
 Guía de Interpretación Petrifilm Placas para Recuento de E. coli y Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de E. coli y Coliformes
Guía de Interpretación Petrifilm Placas para Recuento de E. coli y Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de E. coli y Coliformes
PRACTICA No.9 REACCIONES QUIMICAS I
 PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRACTICA No.9 REACCIONES QUIMICAS I INTRODUCCION: Las transformaciones de la materia se conocen como REACCIONES QUIMICAS. En ellas se opera un cambio en la estructura íntima de las sustancias reaccionantes
PRÁCTICO N 4 CARBOHIDRATOS
 PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
PRÁCTICO N 4 CARBOHIDRATOS I. INTRODUCCIÓN. Los compuestos químicos de la célula se clasifican en dos grandes grupos: moléculas inorgánicas y moléculas orgánicas. Las primeras se caracterizan por la ausencia
2. Observación de hongos de interés industrial
 2. Observación de hongos de interés industrial En esta práctica se realizarán observaciones en fresco de varios hongos de interés industrial. 2.1 Preparaciones para el estudio microscópico de los aislados
2. Observación de hongos de interés industrial En esta práctica se realizarán observaciones en fresco de varios hongos de interés industrial. 2.1 Preparaciones para el estudio microscópico de los aislados
OBTENCIÓN DE INDICADORES DEL TIPO DE LAS FTALEÍNAS FENOLFTALEÍNA Y FLUORESCEINA
 EXPERIMENT No. 8 BTENCIÓN DE INDICADRES DEL TIP DE LAS FTALEÍNAS FENLFTALEÍNA Y FLURESCEINA BJETIVS a) El alumno aprenda los métodos de síntesis de colorantes del tipo de las ftaleínas, por condensación
EXPERIMENT No. 8 BTENCIÓN DE INDICADRES DEL TIP DE LAS FTALEÍNAS FENLFTALEÍNA Y FLURESCEINA BJETIVS a) El alumno aprenda los métodos de síntesis de colorantes del tipo de las ftaleínas, por condensación
Células. Tema 13 de Biología NS Diploma BI Curso
 Células procariotas 2ª Parte: Células Tema 13 de Biología NS Diploma BI Curso 2013-2015 Diversidad del dominio Eubacteria Grupo muy amplio de bacterias que, debido a su gran variedad genética, participan
Células procariotas 2ª Parte: Células Tema 13 de Biología NS Diploma BI Curso 2013-2015 Diversidad del dominio Eubacteria Grupo muy amplio de bacterias que, debido a su gran variedad genética, participan
PLANIFICACIÓN DE SESIÓN DE APRENDIZAJE. La célula es el origen del mundo vivo
 PLANIFICACIÓN DE SESIÓN DE APRENDIZAJE GRADO UNIDAD SESIÓN HORAS 1. er 1 3/4 2 TÍTULO DE LA SESIÓN La célula es el origen del mundo vivo APRENDIZAJES ESPERADOS COMPETENCIAS CAPACIDADES INDICADORES Indaga,
PLANIFICACIÓN DE SESIÓN DE APRENDIZAJE GRADO UNIDAD SESIÓN HORAS 1. er 1 3/4 2 TÍTULO DE LA SESIÓN La célula es el origen del mundo vivo APRENDIZAJES ESPERADOS COMPETENCIAS CAPACIDADES INDICADORES Indaga,
LOS MICROORGANISMOS EN EL AMBIENTE
 Introducción Objetivo Fundamento Trabajo Práctico Nº 2 LOS MICROORGANISMOS EN EL AMBIENTE Procedimiento Resultados Observaciones Conclusiones INTRODUCCIÓN La microbiología es la ciencia que estudia los
Introducción Objetivo Fundamento Trabajo Práctico Nº 2 LOS MICROORGANISMOS EN EL AMBIENTE Procedimiento Resultados Observaciones Conclusiones INTRODUCCIÓN La microbiología es la ciencia que estudia los
INFORME DE RESULTADOS
 INFORME DE RESULTADOS Los análisis realizados al producto con Aloe vera, se desarrollaron de acuerdo a lo establecido en CCAYAC-P-062, para determinar la dilución correspondiente con las 3 cepas analizadas
INFORME DE RESULTADOS Los análisis realizados al producto con Aloe vera, se desarrollaron de acuerdo a lo establecido en CCAYAC-P-062, para determinar la dilución correspondiente con las 3 cepas analizadas
Sistema Integrado de Gestión OBTENCIÓN Y PROPIEDADES DEL OXÍGENO. INTRODUCIÓN A LA CATÁLISIS Y A LA ESTEQUIOMETRÍA
 Sistema Integrado de Gestión OBTENCIÓN Y PROPIEDADES DEL OXÍGENO. INTRODUCIÓN A LA CATÁLISIS Y A LA ESTEQUIOMETRÍA Versión 3 Proceso: Investigación IV Febrero de 2016 Página 2 de 8 1. OBJETIVOS: Identificar
Sistema Integrado de Gestión OBTENCIÓN Y PROPIEDADES DEL OXÍGENO. INTRODUCIÓN A LA CATÁLISIS Y A LA ESTEQUIOMETRÍA Versión 3 Proceso: Investigación IV Febrero de 2016 Página 2 de 8 1. OBJETIVOS: Identificar
LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218. Práctica de Laboratorio No. 3 CALIBRACIÓN DE MATERIAL VOLUMÉTRICO ANALÍTICO
 UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
UNIVERSIDAD NACIONAL AUTÓNOMA DE HONDURAS FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA DEPARTAMENTO DE QUÍMICA LABORATORIO DE QUÍMICA ANALÍTICA I LQ-218 Práctica de Laboratorio No. 3 COMPETENCIAS A LOGRAR:
5. Mantenimiento de equipos e instrumentos de laboratorio
 5. Mantenimiento de equipos e instrumentos de laboratorio INTRODUCCIÓN Este módulo, de 114 horas pedagógicas, está orientado a que los y las estudiantes logren las habilidades necesarias para poder verificar
5. Mantenimiento de equipos e instrumentos de laboratorio INTRODUCCIÓN Este módulo, de 114 horas pedagógicas, está orientado a que los y las estudiantes logren las habilidades necesarias para poder verificar
COMPROBACIÓN DE LA PRESENCIA DE ALMIDÓN EN EMBUTIDOS
 NOMBRE: GRUPO: PRÁCTICA: FECHA: COMPROBACIÓN DE LA PRESENCIA DE ALMIDÓN EN EMBUTIDOS El almidón es un polisacárido que se encuentra en el citoplasma de las células vegetales Es muy abundante en los tubérculos,
NOMBRE: GRUPO: PRÁCTICA: FECHA: COMPROBACIÓN DE LA PRESENCIA DE ALMIDÓN EN EMBUTIDOS El almidón es un polisacárido que se encuentra en el citoplasma de las células vegetales Es muy abundante en los tubérculos,
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I
 UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
UNIVERSIDAD DE MAYORES PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA Y BIOTECNOLOGÍA MICROBIOLOGÍA I DRAS. MARÍA LUISA ORTIZ Y ANA PEDREGOSA 1 PRÁCTICAS DE MICROBIOLOGÍA DEPARTAMENTO DE BIOMEDICINA
MARCO TEÓRICO. Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo
 Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo OBJETIVOS Al final de esta práctica el estudiante deberá comprobar que: Las células vegetales como las animales poseen
Título: Célula: estructura función. Diversidad celular. Docente: Rolando Hernández Lazo OBJETIVOS Al final de esta práctica el estudiante deberá comprobar que: Las células vegetales como las animales poseen
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDACTICA QUIMICA PRIMER AÑO PRACTICAS DE LABORATORIO QUIMICA 2010 CARBOHIDRATOS ELABORADO POR: LICDA. LUCRECIA CASASOLA DE LEIVA
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA
 UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
Práctica 4. Propiedades de algunos elementos y sus óxidos (Parte I)
 Práctica 4. Propiedades de algunos elementos y sus óxidos (Parte I) Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA De
Práctica 4. Propiedades de algunos elementos y sus óxidos (Parte I) Revisaron: M. en C. Martha Magdalena Flores Leonar Dr. Víctor Manuel Ugalde Saldívar PREGUNTA A RESPONDER AL FINAL DE LA PRÁCTICA De
Práctica de Laboratorio INDICADORES DE ACIDEZ Y BASICIDAD
 Práctica de Laboratorio INDICADORES DE ACIDEZ Y BASICIDAD Objetivo Identificar sustancias de uso cotidiano como ácidas o básicas según la determinación de su ph y de la escala del indicador utilizado.
Práctica de Laboratorio INDICADORES DE ACIDEZ Y BASICIDAD Objetivo Identificar sustancias de uso cotidiano como ácidas o básicas según la determinación de su ph y de la escala del indicador utilizado.
APÉNDICE G. Identificación bioquímica de enterobacterias por el sistema API 20E
 APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
TP: DIVERSIDAD MICROBIANA. Lic. Soria Josè
 TP: DIVERSIDAD MICROBIANA Lic. Soria Josè Microorganismos Algas Hongos Protozoarios Bacterias Virus Según su organización celular los podemos clasificar en: Eucariotas: Algas Hongos Protozoarios Procariotas:
TP: DIVERSIDAD MICROBIANA Lic. Soria Josè Microorganismos Algas Hongos Protozoarios Bacterias Virus Según su organización celular los podemos clasificar en: Eucariotas: Algas Hongos Protozoarios Procariotas:
RELACIONES PERIÓDICAS Y FAMILIAS DE LOS ELEMENTOS
 RELACIONES PERIÓDICAS Y FAMILIAS DE LOS ELEMENTOS Guía de Química EXPERIMENTO N 7 RELACIONES PERIODICAS Y FAMILIAS DE LOS ELEMENTOS OBJETIVO GENERAL: El estudiante: Interpretará las variaciones periódicas
RELACIONES PERIÓDICAS Y FAMILIAS DE LOS ELEMENTOS Guía de Química EXPERIMENTO N 7 RELACIONES PERIODICAS Y FAMILIAS DE LOS ELEMENTOS OBJETIVO GENERAL: El estudiante: Interpretará las variaciones periódicas
Práctica 3. Solubilidad
 Práctica 3. Solubilidad PREGUNTS RESPONDER L FINL DE L PRÁTI La concentración es una propiedad intensiva o extensiva? Por qué? Por qué al aumentar la temperatura aumenta la solubilidad de una disolución
Práctica 3. Solubilidad PREGUNTS RESPONDER L FINL DE L PRÁTI La concentración es una propiedad intensiva o extensiva? Por qué? Por qué al aumentar la temperatura aumenta la solubilidad de una disolución
DESCRIPCION DE BIOCOUNTER
 DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
COLORACION o TINCION DE GRAM?
 Artículo escrito por: COLORACION o TINCION DE GRAM? Lic. TM Yvan V. Salazar Criado Lic TM Julia M. Neciosup Zapata INTRODUCCION La rápida evolución tecnológica está transformando el Mundo en que vivimos,
Artículo escrito por: COLORACION o TINCION DE GRAM? Lic. TM Yvan V. Salazar Criado Lic TM Julia M. Neciosup Zapata INTRODUCCION La rápida evolución tecnológica está transformando el Mundo en que vivimos,
PRACTICA N 10. DETERMINACIÓN DE CARBOHIDRATOS.
 PRACTICA N 10. DETERMINACIÓN DE CARBOHIDRATOS. 10.1.- OBJETIVOS: Diferenciar carbohidratos simples y complejos por sus propiedades químicas. Determinar el contenido de azúcar de una muestra por medio de
PRACTICA N 10. DETERMINACIÓN DE CARBOHIDRATOS. 10.1.- OBJETIVOS: Diferenciar carbohidratos simples y complejos por sus propiedades químicas. Determinar el contenido de azúcar de una muestra por medio de
LA ORGANIZACIÓN DEL CUERPO HUMANO
 LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
QUÉ CONTIENE UN MEDIO? Aquellos requerimientos nutricionales que los microorganismos necesitan para crecer. Depende del ambiente en donde viven.
 OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
OBJETIVOS u Diferenciar entre ciertos tipos de medios u Conocer actividades bioquímicas de las bacterias u Conocer los procesos bioquímicos de fermentación u Descibir los patrones de fermentación de carbohidratos
INSTRUMENTOS BÁSICOS DE UN LABORATORIO
 INSTRUMENTOS BÁSICOS DE UN LABORATORIO Trasfondo y Contenido En un laboratorio se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio. Pueden
INSTRUMENTOS BÁSICOS DE UN LABORATORIO Trasfondo y Contenido En un laboratorio se utiliza una amplia variedad de instrumentos o herramientas que, en su conjunto, se denominan material de laboratorio. Pueden
MATERIAL VOLUMETRICO. Establecer los criterios y la metodología que se utilizarán para el verificado del material volumétrico.
 Página de 9. OBJETIVO Establecer los criterios y la metodología que se utilizarán para el verificado del material volumétrico. 2. CAMPO DE APLICACIÓN Aplica para el verificado de aparatos volumétricos,
Página de 9. OBJETIVO Establecer los criterios y la metodología que se utilizarán para el verificado del material volumétrico. 2. CAMPO DE APLICACIÓN Aplica para el verificado de aparatos volumétricos,
PROCEDIMIENTO RECUENTO DE AREOBIOS MESOFILOS EN LECHE UHT
 PRT- 712.02-078 Página 1 de 9 1. OBJETIVO Conocer la calidad microbiológica de la leche sometida a ultra alta temperatura de acuerdo a lo establecido en el Reglamento Sanitario de los Alimentos. 2. CAMPO
PRT- 712.02-078 Página 1 de 9 1. OBJETIVO Conocer la calidad microbiológica de la leche sometida a ultra alta temperatura de acuerdo a lo establecido en el Reglamento Sanitario de los Alimentos. 2. CAMPO
diferentes sustratos Método de Baermann en embudo y modificación en vaso de precipitado. Rina G. de Kaminsky
 Extracción de larvas de diferentes sustratos Método de Baermann en embudo y modificación en vaso de precipitado. p Rina G. de Kaminsky Método de Baermann Existen algunas variaciones, las dos más utilizadas
Extracción de larvas de diferentes sustratos Método de Baermann en embudo y modificación en vaso de precipitado. p Rina G. de Kaminsky Método de Baermann Existen algunas variaciones, las dos más utilizadas
UNIVERSIDAD AUTONOMA DE CHIAPAS FACULTAD DE CIENCIAS QUIMICAS EXTENSIÓN OCOZOCOAUTLA
 CATEDRATICO: Dra. Ana Olivia Cañas Urbina MATERIA: Biología celular TEMA: Practica 10 Extracción de ADN SEMESTRE: 2do A INTEGRANTES: Blanca Guadalupe Penagos Gómez Diana Laura Vázquez Vázquez Andrea Pérez
CATEDRATICO: Dra. Ana Olivia Cañas Urbina MATERIA: Biología celular TEMA: Practica 10 Extracción de ADN SEMESTRE: 2do A INTEGRANTES: Blanca Guadalupe Penagos Gómez Diana Laura Vázquez Vázquez Andrea Pérez
PRÁCTICO 3: SOLUCIONES
 Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
Curso de Laboratorio Página: 1/6 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 3: SOLUCIONES Bibliografía: Química, La Ciencia Central, T.L. Brown, H.E.LeMay, Jr., B.Bursten; Ed. Prentice-Hall Hispanoamericana,
