Bioquímica I. Globinas
|
|
|
- Samuel Vega Murillo
- hace 5 años
- Vistas:
Transcripción
1 Bioquímica I. Globinas 1. Funciones de las proteínas Las proteínas pueden ser simples o conjugadas (con grupo prostético). Las principales proteínas conjugadas son las lipoproteínas (lípidos), nucleoproteínas (ácidos nucleicos), glucoproteínas (glúcidos), fosfoproteínas (ácido ortofosfórico) y metaloproteínas (metales). Las proteínas tienen unan funciones muy diversas: 1) Catálisis enzimática 2) Transporte y almacenamiento: transferrina/ferritina, Hb/Mb, lipoproteínas 3) Movimiento coordinado: actina/miosina, tubulina. 4) Soporte mecánico: colágeno, elastina, queratina. 5) Defensa: anticuerpos, fibrinógeno, trombina. 6) Control y transmisión de impulsos nerviosos 7) Control del crecimiento y la diferenciación 2. Proteínas plasmáticas Son moléculas segregadas activamente a la sangre en condiciones fisiológicas normales, por lo que su concentración se ve alterada en muchas enfermedades. Se sintetizan en el RE de las células hepáticas, salvo las inmunoglobulinas, que se sintetizan en los linfocitos B; y algún tipo de beta-globulina. Cuando dejamos coagular la sangre, la solución restante carente de fibrinógeno, fibrina y diversos factores de coagulación, se denomina suero. El plasma es el líquido que se obtiene de la sangre después de eliminar las células sanguíneas por centrifugación en presencia de inhibidores de la coagulación. Por tanto, el plasma contiene fibrinógeno y otros factores de coagulación; el suero no. El plasma normal contiene entre 60 y 80 g/l de proteínas. Tenemos los siguientes grupos de proteínas plasmáticas: 1) Albúmina (55%): transporte de aniones, presión osmótica. 2) Alfa-1-globulinas (5%): glucoproteínas, HDL. 3) Alfa-2-globulinas (9%): haptoglobina, ceruloplasmina (transporte Cu 2+ ), VLDL. 4) Beta-globulinas (13%): transferrina, LDL. 5) Gamma-globulinas (11%): inmunoglobulinas. 6) Fibrinógeno o factor de coagulación I (7%) Funciones principales a. Mantenimiento de la presión osmótica y regulación del volumen intravascular. b. Participación en el equilibrio electrolítico. c. Fuente de AAs para los tejidos. d. Transporte de ligandos (iones metálicos, ácidos grasos, hormonas). e. Inmunidad. f. Coagulación Albúmina Representa el 50% de las proteínas plasmáticas. Su pi = 4 8, por lo que está muy cargada negativamente a ph fisiológico (7 4). Se secreta en forma de proalbúmina en el hígado. Sus funciones principales son: 1) Nutritiva: fuente de AAs para tejidos. 2) Transportadora: aniones, cationes, ácidos grados, bilirrubina. 3) Reguladora del volumen intravascular: responsable del 80% de la presión osmótica del plasma. BIOQUÍMICA I 1
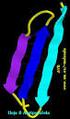
2 2.3. Lipoproteínas Se clasifican en función de su densidad determinada por ultracentrifugación en quilomicrones, VLDL, LDL, IDL, HDL. Contienen una parte proteica (apoproteína) y una lipídica de composición variable. Su función es la solubilización y transporte de lípidos por el organismo. Se organizan de acuerdo a su polaridad adoptando estructuras esféricas: los lípidos apolares en el interior, mientras que los lípidos de cabeza polar y las proteínas se encuentran en el exterior. Los valores entre los que se sitúa cada una son los siguientes: LDL: mg/dl. HDL: mg/dl. Colesterol total: menos de 200 mg/dl. Triglicéridos: mg/dl Globinas de transporte y almacenamiento de oxígeno La mioglobina (Mb) es la proteína de almacenamiento de oxígeno en animales. La hemoglobina (Hb) transporta oxígeno en vertebrados y algunos invertebrados, además del transporte de dióxido de carbono. La estructura terciaria de ambas proteínas es muy similar. La mioglobina presenta una sola cadena polipeptídica de 153 aa, que se pliega sobre un grupo prostético (hemo) que contiene el sitio de unión al oxígeno. El polipéptido está formado por 8 segmentos alfa-helicoidales dextrógiros, que se designan con las letras A-H, conectados por giros. El grupo hemo está incluido en una hendidura hidrofóbica, formada por las hélices E y F, aunque también participan otros segmentos. Se encuentra unido de forma no covalente. Cuando se libera el oxígeno, permanece Fe(II), pero fuera de la célula se oxida a Fe(III) con el aire = metamioglobina. La hemoglobina es una proteína tetramérica constituida por 4 cadenas polipeptídicas muy similares a la mioglobina aunque sus secuencias de AAs presentan muchas diferencias. Cada una de estas subunidades está unida a un grupo hemo Porfirinas Una molécula que una oxígeno debe evitar que oxide otras sustancias y debe liberarlo según la demanda. Ciertos metales de transición como Fe(II) y Cu(I) tienen fuerte tendencia a unir oxígeno. En la Mb y Hb, estos metales están quelados por un sistema de anillo tetrapirrólico = protoporfirina IX. Estas porfirinas suelen ser muy coloreadas normalmente. El grupo hemo se forma por el complejo protoporfirina IX + Fe(II). La afinidad de Mb y Hb por CO es 200 veces mayor que por el O2, lo que explica que el CO sea tan tóxico. 3. Características de la mioglobina (Mb) La P50 de la Mb es muy baja, unos 4 mmhg, por lo que significa una gran afinidad. A la concentración de oxígeno de los capilares = 30 mmhg, la Mb de los tejidos adyacentes está casi saturada. En células metabólicamente activas, la PO2 interna disminuye mucho y la Mb descarga el oxígeno. El proceso limitante para la liberación de oxígeno es la apertura de una vía para que este escape del bolsillo del grupo hemo. 4. Transporte de oxígeno por la hemoglobina (Hb) Cómo debe comportarse una proteína transportadora?: 1) Debe aceptar oxígeno de forma eficaz en los pulmones, unos 100 mmhg. 2) Debe ceder oxígeno en los tejidos, unos 30 mmhg. 3) Se consigue gracias a la unión de varias subunidades. 4) La curva de unión es sigmoidea, yendo de afinidad baja a alta y por interacción cooperativa. BIOQUÍMICA I 2
3 La Hb ha evolucionado hasta tener esta curva sigmoidea, mucho más eficaz, ya que permite una saturación casi completa de la proteína en los pulmones, así como una máxima liberación en los capilares. A presiones de oxígeno bajas, actúa débilmente, pero a medida que se une más oxígeno, la afinidad se vuelve mayor. Es un tetrámero, con 4 sitios de unión que presentan cooperatividad positiva (la unión de oxígeno aumenta la afinidad de los demás lugares de unión). El grado de cooperatividad viene dado por la representación de Hill. Si su pendiente es 1 = mioglobina. Cuando es mayor de 1, se da la unión cooperativa. La hemoglobina se corresponde con una pendiente máxima, representando el estado de unión fuerte. Presenta regulación alostérica, es decir, que la captación de un ligando influye sobre las afinidades de los lugares de unión restantes sin ocupar Unión cooperativa del oxígeno a la hemoglobina (efecto alostérico) Cada subunidad puede cambiar su conformación terciaria cundo se une al oxígeno. Esta unión favorece la unión fuerte en subunidades adyacentes. Existen moléculas mixtas con subunidades de unión fuerte y débil. La conformación puede ser T=tensa (unión débil) o R=relajada (unión fuerte), en equilibrio. La oxigenación desplaza el equilibrio hacia la forma R. Al unirse el oxígeno, un dímero alfa-beta rota unos 15º y se desliza respecto al otro. Esto hace que las cadenas beta se aproximen y que se estreche la cavidad central de la molécula. Se rompen varias interacciones fuertes y se adquiere una conformación de mayor energía y más laxa = relajada (R). El precio energético de este cambio se paga mediante la unión de oxígeno a la molécula. Una vez ha salido el oxígeno, la Hb vuelve de manera natural a su conformación desoxigenada, de menor energía y más ajustada = tensa (T). Por esto, la Hb posee dos estados de estructura cuaternaria: desoxi y oxi. La conformación oxi es la que tiene mayor afinidad por el oxígeno. 5. El efecto Bohr Cuando el oxígeno se utiliza en los tejidos, se produce dióxido de carbono. La acumulación de este dióxido reduce el ph de los eritrocitos mediante la reacción para dar bicarbonato. El bicarbonato es más soluble que el dióxido de carbono. Esta caída de ph reduce la afinidad de la Hb por el oxígeno, permitiendo su liberación. Esto es lo que denominamos efecto Bohr. Tiene diferentes efectos según donde actúe: Efecto en los tejidos El ph en los tejidos baja debido a su metabolismo. Por esto, hay casi más CO2, favoreciéndose la forma desoxi, por lo que se libera oxígeno y se une dióxido de carbono. Esto libera protones, que disminuyen la afinidad de la Hb por el oxígeno y aumentan su P50. Efecto en los pulmones La oxigenación desplaza el equilibrio hacia la liberación de protones de la Hb, lo que favorece la liberación de dióxido de carbono en los pulmones. Cuando se da hiperventilación (respiración con mucha rapidez), el CO2 se elimina rápidamente desde los tejidos, por lo que no ayuda a la liberación del oxígeno de los mismos. Una solución es respirar dentro de una bolsa para elevar los valores de CO2 en sangre. Determinados lugares de unión a protones tienen más afinidad en la forma desoxi. Al ph sanguíneo (7,4), algunos residuos (His 146, N-terminal de las cadenas alfa) están desprotonados en la forma oxi. Un aumento de protones favorece la forma desoxi, tensa (T). Parte del dióxido de carbono es transportado como carbamatos formados por aminoácidos N- terminales. Esto da lugar a liberación de protones = mayor acidificación = liberación de oxígeno. BIOQUÍMICA I 3
4 6. Transporte de CO2 Su primer efecto está mediado por la anhidrasa carbónica, que desplaza el equilibrio a la derecha, por lo que los protones contribuyen al efecto Bohr. En su segundo efecto, el CO2 reacciona directamente con los grupos N-terminales de la Hb, formando carbamatos. Esto genera más protones para el efecto Bohr y se estabiliza la forma T de la Hb. 7. Bifosfoglicerato (BPG) Permite adaptarse a cambios graduales en la disponibilidad de oxígeno. Esto reduce la afinidad de Hb por el oxígeno. Cuanto más BPG hay, más estable es la forma desoxi, ya que no puede unirse a la forma oxi. Cuando BPG es elevado, se da una mejor descarga de oxígeno a los tejidos. Esto ocurre a grandes alturas, en fumadores y en condiciones de hipoxia. Los hematíes fetales tienen más afinidad por el oxígeno que los maternos. En presencia de BPG, la afinidad por el oxígeno de la Hb fetal es mayor que la de la materna. Por esto, se da la transferencia de oxígeno e la sangre materna al feto. El efecto alostérico del BPG, junto con protones y CO2, desplaza el equilibrio hacia la forma desoxi (T). Interaccionan en sitios distintos, por lo que sus efectos pueden ser aditivos. 8. La familia de proteínas Mb-Hb Los eucariotas superiores poseen genes distintos para la Mb y para las diferentes cadenas de Hb, distribuidos en distintos cromosomas. Son genes homólogos que se originaron por duplicaciones y traslocaciones durante la evolución. Sólo unos pocos aminoácidos conservados a lo largo de la evolución, indican las posiciones esenciales de la molécula: His proximal y distal, residuos próximos a contactos alfa1-beta1 y alfa2-beta2 y residuos involucrados en el cambio de conformación desoxi-oxi Mutaciones patológicas en globinas humanas 1) Hemoglobinas M: tienden a oxidarse con facilidad por mutación de His proximal o distal. 2) Desestabilización del tetrámero de Hb: Hb St. Lukes. 3) Inhibición del cambio alostérico por estabilización de oxi-desoxi: Hb Suresnes. 4) Estructura terciaria inestable: Hb Hammersmith. 5) Hb adrenopática: anemia falciforme Se da por sustitución de Glu por Val en la posición 6 de las cadenas beta. La HbS mutante se agrega en bastones y los hematíes se alargan, obstruyendo los vasos. Da lugar a inflamación, dolor y anemia por fragilidad de eritrocitos. Los homocigotos mueren. Los heterocigotos manifiestan la enfermedad en privación de oxígeno. Hay una mayor incidencia en zonas con malaria. 6) Talasemias Uno o varios genes de las cadenas se han perdido. Existe una mutación sin sentido que da lugar a una cadena más corta. Un cambio de fase de lectura produce una proteína no funcional. Además, se da mutación en las regiones no codificantes que afecta a la transcripción o al adecuado procesamiento del ARNm. Hay 2 tipos de talasemias: Beta-talasemias Muy grave en heterocigotos, mueren antes de la madurez. Mantienen las cadenas fetales gamma durante más tiempo. Las beta + producen poca beta-globina por genes inhibidos. BIOQUÍMICA I 4
5 Alfa-talasemias Normalmente hay 2 copias del gen alfa, debiendo faltar 3-4 copias para desarrollar una enfermedad grave. Se puede compensar con la formación de tetrámeros beta4 o gamma 4. El caso de hidropesía fetal es mortal ya que se nace sin las 4 copias del gen alfa. BIOQUÍMICA I 5
Tema 5 Estructura cuaternaria de proteínas
 Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Copyright (c) Marina González, Gabriela Gómez
 PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
Ej. Miglobina/hemoglobina. PROTEINA CONJUGADA proteina = parte proteica + parte no-proteica funcional apo-proteina IMPORTANCIA DEL GRUPO PROSTETICO
 Ej. Miglobina/hemoglobina - explicar la importancia de los grupos prostéticos - describir las características importantes de las proteínas fibrosas y globulares - explicar la fisiología de la hemoglobina
Ej. Miglobina/hemoglobina - explicar la importancia de los grupos prostéticos - describir las características importantes de las proteínas fibrosas y globulares - explicar la fisiología de la hemoglobina
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Como transportamos el Oxigeno a los tejidos. A través de proteínas asociadas a metales de transición como el hierro y el cobre.
 Como transportamos el Oxigeno a los tejidos A través de proteínas asociadas a metales de transición como el hierro y el cobre. Grupo Hemo Los anillos pirrol tiene puentes a-metileno y grupos M, V, M,
Como transportamos el Oxigeno a los tejidos A través de proteínas asociadas a metales de transición como el hierro y el cobre. Grupo Hemo Los anillos pirrol tiene puentes a-metileno y grupos M, V, M,
HEMOBLOBINA Y MIOGLOBINA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 HEMOBLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva Enríquez Hemoglobina
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 HEMOBLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva Enríquez Hemoglobina
Dra. Carmen Aída Martínez
 Dra. Carmen Aída Martínez Hemoproteínas Más abundantes en el ser humano. Función de almacenamiento y transporte de oxigeno. Valores normales: Hombres: 13 18 gr/dl Mujeres: 12-16 gr/dl Globina ESTRUCTURA
Dra. Carmen Aída Martínez Hemoproteínas Más abundantes en el ser humano. Función de almacenamiento y transporte de oxigeno. Valores normales: Hombres: 13 18 gr/dl Mujeres: 12-16 gr/dl Globina ESTRUCTURA
HEMOGLOBINA Y MIOGLOBINA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva Enríquez Hemoglobina
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva Enríquez Hemoglobina
HEMOBLOBINA Y MIOGLOBINA
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO HEMOBLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva Enríquez Hemoglobina y Mioglobina Objetivos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO HEMOBLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva Enríquez Hemoglobina y Mioglobina Objetivos
HEMOGLOBINA Y MIOGLOBINA
 HEMOGLOBINA Y MIOGLOBINA 1 CARACTERÍSTICAS DE HIERRO Configuración electrónica [Ar] 3d 6 4s 2 Sus complejos mononucleares suelen ser octaédricos y de espín alto Sus momentos magnéticos son prácticamente
HEMOGLOBINA Y MIOGLOBINA 1 CARACTERÍSTICAS DE HIERRO Configuración electrónica [Ar] 3d 6 4s 2 Sus complejos mononucleares suelen ser octaédricos y de espín alto Sus momentos magnéticos son prácticamente
CLASIFICACIÓN DE PROTEÍNAS
 CLASIFICACIÓN DE PROTEÍNAS HOLOPROTEÍNAS Atendiendo a la estructura terciaria las proteínas se clasifican: 1. Proteínas globulares o esferoproteínas 2. Proteínas filamentosas o escleroproteínas Proteínas
CLASIFICACIÓN DE PROTEÍNAS HOLOPROTEÍNAS Atendiendo a la estructura terciaria las proteínas se clasifican: 1. Proteínas globulares o esferoproteínas 2. Proteínas filamentosas o escleroproteínas Proteínas
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
TEMA PROTEINAS.
 TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
ERITROPOYESIS. T.M. Pamela Carmona Rios Instituto de Fisiología
 ERITROPOYESIS T.M. Pamela Carmona Rios Instituto de Fisiología Regulación de la eritropoyesis Cuando una célula madre se compromete hacia la línea eritroide se requieren varios factores en el microambiente
ERITROPOYESIS T.M. Pamela Carmona Rios Instituto de Fisiología Regulación de la eritropoyesis Cuando una célula madre se compromete hacia la línea eritroide se requieren varios factores en el microambiente
TEMA 5: ARQUITECTURA DE PROTEINAS. Parte 2
 TEMA 5: ARQUITECTURA DE PROTEINAS. Parte 2 Estructura Cuaternaria Estructuras Cuaternarias -Homotípicas: asociación entre dos o mas cadenas polipeptídicas iguales o muy similares -Heterotípicas: interacción
TEMA 5: ARQUITECTURA DE PROTEINAS. Parte 2 Estructura Cuaternaria Estructuras Cuaternarias -Homotípicas: asociación entre dos o mas cadenas polipeptídicas iguales o muy similares -Heterotípicas: interacción
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Enzimas Regulatorias. Enzimas Alostéricas. Enzimas modificadas covalentemente. Activación proteolítica de pro-enzimas
 Enzimas Regulatorias Enzimas Alostéricas Enzimas modificadas covalentemente Activación proteolítica de pro-enzimas La inhibición por retroalimentación se refiere a la inhibición de una de las primeras
Enzimas Regulatorias Enzimas Alostéricas Enzimas modificadas covalentemente Activación proteolítica de pro-enzimas La inhibición por retroalimentación se refiere a la inhibición de una de las primeras
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
 NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de α-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen codificación
NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de α-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen codificación
Estructura tridimensional de las proteínas
 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
ESTRUCTURA DE PROTEÍNAS
 ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
MODULO 3 (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca)
 MODULO 3 (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca) 1) Si una proteína se desnaturaliza: a. mantiene su estructura primaria y su función b. pierde su estructura terciaria pero no su
MODULO 3 (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca) 1) Si una proteína se desnaturaliza: a. mantiene su estructura primaria y su función b. pierde su estructura terciaria pero no su
Lugar de unión del oxígeno
 Lugar de unión del oxígeno Porfirina (C 20 H 14 N 4 ) Geometría de la coordinación del hierro. Coordinación octaédrica del átomo de hierro. El hierro y los cuatro átomos de nitrógeno de la protoporfirina
Lugar de unión del oxígeno Porfirina (C 20 H 14 N 4 ) Geometría de la coordinación del hierro. Coordinación octaédrica del átomo de hierro. El hierro y los cuatro átomos de nitrógeno de la protoporfirina
PROTEINAS NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
 PROTEINAS NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de a-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen
PROTEINAS NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de a-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Consecuencias estructurales del descenso del Fe(II): Curvas de saturación y Efectos modificadores.
 Consecuencias estructurales del descenso del Fe(II): Curvas de saturación y Efectos modificadores. Vamos a estudiar las curvas de afinidad de la mioglobina y de la hemoglobina frente al oxígeno, así como
Consecuencias estructurales del descenso del Fe(II): Curvas de saturación y Efectos modificadores. Vamos a estudiar las curvas de afinidad de la mioglobina y de la hemoglobina frente al oxígeno, así como
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ERITROCITO - HEMATIE o GLOBULO ROJO
 ERITROCITO - HEMATIE o GLOBULO ROJO Discos bicóncavos, anucleados. Diámetro 7-8 μm. Espesor 1,5 um y 2,5 um en el centro. Volumen medio: 90 a 95 um 3. Contienen hemoglobina. Son estructuras flexibles.
ERITROCITO - HEMATIE o GLOBULO ROJO Discos bicóncavos, anucleados. Diámetro 7-8 μm. Espesor 1,5 um y 2,5 um en el centro. Volumen medio: 90 a 95 um 3. Contienen hemoglobina. Son estructuras flexibles.
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
COMPOSICIÓN DE LOS SERES VIVOS
 COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
COMPOSICIÓN DE LOS SERES VIVOS SERES VIVOS: Un ser vivo es un organismo que nace, crece, se reproduce y muere. CONSTITUIDOS POR BIOELEMENTOS BIOMOLECULAS PRIMARIOS SECUNDARIOS ORGANICOS INORGANICOS CARBONO
Universidad de San Carlos de Guatemala, Facultad de Ciencia Médicas Fase I, 2º Año 2011 HEMOGLOBINA Y MIOGLOBINA. Dr. Mynor A. Leiva E.
 Universidad de San Carlos de Guatemala, Facultad de Ciencia Médicas Fase I, 2º Año 2011 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva E. CONTENIDO: Estructura de Mioglobina y Hemoglobina Transporte de Oxígeno
Universidad de San Carlos de Guatemala, Facultad de Ciencia Médicas Fase I, 2º Año 2011 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva E. CONTENIDO: Estructura de Mioglobina y Hemoglobina Transporte de Oxígeno
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
FUNCIONES. Gran parte de la información genética de las células se expresa en forma de proteínas, las cuales desempeñan muy diversas funciones:
 Bioquímica CONCEPTO Son polímeros formados por monómeros llamados aminoácidos. Hay 20 aminoácidos en la naturaleza, que se combinan para formar miles de proteínas (muchos grupos funcionales: alcoholes,
Bioquímica CONCEPTO Son polímeros formados por monómeros llamados aminoácidos. Hay 20 aminoácidos en la naturaleza, que se combinan para formar miles de proteínas (muchos grupos funcionales: alcoholes,
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI
 CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
CARRERA DE ESPECIALIZACION EN BIOTECNOLOGIA INDUSTRIAL FCEyN-INTI Materia de Articulación CEBI_A4 Química Biológica Docente a cargo:marta Blanca Mazzetti CEBI_A4_2B :Proteínas ESTRUCTURA SECUNDARIA Se
Universidad de San Carlos de Guatemala, Facultad de Ciencias Médicas Fase I, 2º Año 2012
 Universidad de San Carlos de Guatemala, Facultad de Ciencias Médicas Fase I, 2º Año 2012 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva E. CONTENIDO: Estructura de Mioglobina y Hemoglobina Transporte de Oxígeno
Universidad de San Carlos de Guatemala, Facultad de Ciencias Médicas Fase I, 2º Año 2012 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva E. CONTENIDO: Estructura de Mioglobina y Hemoglobina Transporte de Oxígeno
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
Cada persona sana tiene unos 4-6 litros de sangre: ÚNICO TEJIDO LÍQUIDO DE TODO EL ORGANISMO:
 Cada persona sana tiene unos 4-6 litros de sangre: Ø hombre adulto: entre 5 y 6 litros de sangre. Ø mujer adulta: entre 4 y 5 litros. ÚNICO TEJIDO LÍQUIDO DE TODO EL ORGANISMO: Es un tipo de tejido conectivo
Cada persona sana tiene unos 4-6 litros de sangre: Ø hombre adulto: entre 5 y 6 litros de sangre. Ø mujer adulta: entre 4 y 5 litros. ÚNICO TEJIDO LÍQUIDO DE TODO EL ORGANISMO: Es un tipo de tejido conectivo
Universidad de San Carlos de Guatemala, Facultad de Ciencias Médicas Fase I, 2º Año 2013
 Universidad de San Carlos de Guatemala, Facultad de Ciencias Médicas Fase I, 2º Año 2013 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva E. CONTENIDO: Estructura de Mioglobina y Hemoglobina Transporte de Oxígeno
Universidad de San Carlos de Guatemala, Facultad de Ciencias Médicas Fase I, 2º Año 2013 HEMOGLOBINA Y MIOGLOBINA Dr. Mynor A. Leiva E. CONTENIDO: Estructura de Mioglobina y Hemoglobina Transporte de Oxígeno
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA?
 TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
Sistema circulatorio y cardiovascular
 Sistema circulatorio y cardiovascular .: SISTEMA CIRCULATORIO DE LOS VERTEBRADOS FUNCIONES MÁS IMPORTANTES: Transporte de O 2 de los pulmones a los tejidos y de CO 2 de los tejidos hacia los pulmones.
Sistema circulatorio y cardiovascular .: SISTEMA CIRCULATORIO DE LOS VERTEBRADOS FUNCIONES MÁS IMPORTANTES: Transporte de O 2 de los pulmones a los tejidos y de CO 2 de los tejidos hacia los pulmones.
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
ERITROCITOS. Función: transporte e intercambio gaseoso mediado por Hb Forma: disco bicóncavo
 ERITROCITOS Función: transporte e intercambio gaseoso mediado por Hb Forma: disco bicóncavo Concentración: hombres 5,4 x 10 6 /mm 3 mujeres 4,8 x 10 6 /mm 3 VARIACIONES FISIOLOGICAS DE CONCENTRACIÓN DE
ERITROCITOS Función: transporte e intercambio gaseoso mediado por Hb Forma: disco bicóncavo Concentración: hombres 5,4 x 10 6 /mm 3 mujeres 4,8 x 10 6 /mm 3 VARIACIONES FISIOLOGICAS DE CONCENTRACIÓN DE
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Prof. Carlos Montelara Tirado
 Prof. Carlos Montelara Tirado 1 Composición de la Sangre Introducción (Figura 17-1) Compuesta de plasma y elementos formes. Medio de transporte que realiza los servicios de captación y liberación para
Prof. Carlos Montelara Tirado 1 Composición de la Sangre Introducción (Figura 17-1) Compuesta de plasma y elementos formes. Medio de transporte que realiza los servicios de captación y liberación para
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Las proteínas son biomoléculas orgánicas formadas por C, O, H y N; y en menor proporción S y P, y a veces otros elementos como Fe, Cu, etc.
 LAS PROTEÍNAS Las proteínas son biomoléculas orgánicas formadas por C, O, H y N; y en menor proporción S y P, y a veces otros elementos como Fe, Cu, etc. Las proteínas son macromoléculas de gran complejidad
LAS PROTEÍNAS Las proteínas son biomoléculas orgánicas formadas por C, O, H y N; y en menor proporción S y P, y a veces otros elementos como Fe, Cu, etc. Las proteínas son macromoléculas de gran complejidad
ACTIVIDADES DE BIOQUIMICA Dra. Brandan N., Dra. Aguirre M.V. GUIA TALLER Nº1 MODULO I DIAGRAMA CONCEPTUAL DE CONTENIDOS
 Universidad Nacional del Nordeste Facultad de Medicina Cátedra de Bioquímica PRIMER AÑO DE LA CARRERA DE MEDICINA ACTIVIDADES DE BIOQUIMICA Dra. Brandan N., Dra. Aguirre M.V. GUIA TALLER Nº1 MODULO I DIAGRAMA
Universidad Nacional del Nordeste Facultad de Medicina Cátedra de Bioquímica PRIMER AÑO DE LA CARRERA DE MEDICINA ACTIVIDADES DE BIOQUIMICA Dra. Brandan N., Dra. Aguirre M.V. GUIA TALLER Nº1 MODULO I DIAGRAMA
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
Estructura de proteínas
 Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α-l - AA unidos por Uniones Peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y biosintetizados
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α-l - AA unidos por Uniones Peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y biosintetizados
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
PROTEÍNAS AMINOÁCIDOS
 PROTEÍNAS Se trata de las biomoléculas más abundantes. Están constituidas mayoritariamente por C, H, O, N, que se organizan en monómero llamados aminoácidos. AMINOÁCIDOS Los aminoácidos se constituyen
PROTEÍNAS Se trata de las biomoléculas más abundantes. Están constituidas mayoritariamente por C, H, O, N, que se organizan en monómero llamados aminoácidos. AMINOÁCIDOS Los aminoácidos se constituyen
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Rol de los lípidos: Fuentes de energía (triglicéridos, ácidos grasos) Componentes de membranas celulares (esteroles, fosfolípidos, etc.
 Rol de los lípidos: Fuentes de energía (triglicéridos, ácidos grasos) Componentes de membranas celulares (esteroles, fosfolípidos, etc.) Precursores de hormonas (colesterol) Coloración corporal y visión
Rol de los lípidos: Fuentes de energía (triglicéridos, ácidos grasos) Componentes de membranas celulares (esteroles, fosfolípidos, etc.) Precursores de hormonas (colesterol) Coloración corporal y visión
Metabolismo de LIPOPROTEÍNAS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 Metabolismo de LIPOPROTEÍNAS Dr. Mynor A. Leiva Enríquez Metabolismo
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,009 Metabolismo de LIPOPROTEÍNAS Dr. Mynor A. Leiva Enríquez Metabolismo
Tema 4. Proteínas. Contenidos: Criterios de evaluación mínimos: CONCEPTOS ACORDADOS PARA LA PAEG EN LA UCLM. Proteínas:
 Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
PROTEINAS. Licda. Lilian Judith Guzmán Melgar
 CONJUGADAS SIMPLES PROTEINAS Licda. Lilian Judith Guzmán Melgar 2016 30 Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono,
CONJUGADAS SIMPLES PROTEINAS Licda. Lilian Judith Guzmán Melgar 2016 30 Las proteínas son macromoléculas biológicas, formadas de polímeros lineales de aminoácidos, de dimensión variable. Además de Carbono,
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
Moléculas orgánicas. Proteínas y Lípidos
 Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
IV electivo. Unidad 1: Integración célula organismo Genes, proteínas y enzimas
 IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
IV electivo Unidad 1: Integración célula organismo Genes, proteínas y enzimas Objetivo Analizar la composición de un gen y la respectiva formación de proteínas Material genético Material genético Cromosoma
La Bioquímica y los Bioelementos. 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales
 La Bioquímica y los Bioelementos 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales LOS ELEMENTOS DE LA VIDA Los ss.vv. (seres vivos) están constituidos por materia y, por
La Bioquímica y los Bioelementos 1.Los elementos de la vida 2.Las biomoléculas 3.El agua 4.Las sales minerales LOS ELEMENTOS DE LA VIDA Los ss.vv. (seres vivos) están constituidos por materia y, por
Las proteínas. Dra. Nardy Diez García Investigadora
 Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
ESTRUCTURA DE LAS PROTEÍNAS. La conformación de las proteínas viene definida por cuatro estructuras: Enlaces sencillos de rotación libre
 ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
Reconociendo al Sistema Respiratorio como un eliminador de desechos
 Reconociendo al Sistema Respiratorio como un eliminador de desechos INTRODUCCIÓN Como sabemos el cuerpo humano produce muchos desechos, por esto nuestros sistemas están encargados de eliminarlos, pero
Reconociendo al Sistema Respiratorio como un eliminador de desechos INTRODUCCIÓN Como sabemos el cuerpo humano produce muchos desechos, por esto nuestros sistemas están encargados de eliminarlos, pero
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
METABOLISMO-NUTRICIÓN
 METABOLISMO-NUTRICIÓN SEGUNDO SEMESTRE PRIMER AÑO METABOLISMO-NUTRICIÓN TEMA IV. METABOLISMO DE LOS LÍPIDOS CONFERENCIA 6 TÍTULO: Incorporación de los lípidos a las células del organismo Prof. Ileana Rodríguez
METABOLISMO-NUTRICIÓN SEGUNDO SEMESTRE PRIMER AÑO METABOLISMO-NUTRICIÓN TEMA IV. METABOLISMO DE LOS LÍPIDOS CONFERENCIA 6 TÍTULO: Incorporación de los lípidos a las células del organismo Prof. Ileana Rodríguez
Química de la Vida. Br. Ángel E. Hernández C.
 Química de la Vida Br. Ángel E. Hernández C. Conceptos básicos Bioquímica Biología Molecular Átomo Partículas subatómicas Molécula Polaridad Solubilidad Compuesto Orgánico Inorgánico Solución Mezcla Carga
Química de la Vida Br. Ángel E. Hernández C. Conceptos básicos Bioquímica Biología Molecular Átomo Partículas subatómicas Molécula Polaridad Solubilidad Compuesto Orgánico Inorgánico Solución Mezcla Carga
Proteínas de Choque Térmico (HSP)
 Traducción Proteínas de Choque Térmico (HSP) son proteínas altamente conservadas tanto en células procariotas como eucariotas. estabilizan y facilitan el plegamiento de proteínas parcialmente desnaturalizadas
Traducción Proteínas de Choque Térmico (HSP) son proteínas altamente conservadas tanto en células procariotas como eucariotas. estabilizan y facilitan el plegamiento de proteínas parcialmente desnaturalizadas
03/08/2009 DESORDEN ENERGÍA DISIPADA ENERGÍA CONVERTIDA EN: -SÍNTESIS -MOVIMIENTO -REPRODUCCIÓN -PENSAMIENTO
 Enzimas, vitaminas y nutrientes INTRODUCCIÓN VIDA organización ió estructuras simple complejo Leyes universales: Orden desorden La energía se disipa Caos, aleatoriedad: Flecha del tiempo ENERGÍA 1 Fuente
Enzimas, vitaminas y nutrientes INTRODUCCIÓN VIDA organización ió estructuras simple complejo Leyes universales: Orden desorden La energía se disipa Caos, aleatoriedad: Flecha del tiempo ENERGÍA 1 Fuente
Proteínas y su Papel Biológico
 Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
