Actualización Médica Periódica Número 73 Junio 2007
|
|
|
- Salvador Sánchez Duarte
- hace 7 años
- Vistas:
Transcripción
1 Actualización Médica Periódica Número 73 Junio 2007 ARTICULO DE REVISION Dr. Orlando Quesada Vargas TRASTORNOS DEL EQUILIBRIO ACIDO BASE GENERALIDADESFISIOPATOLOGÍA Introducción E l metabolismo normal, aporta aproximadamente 12,000 a 15,000 mmol diarios de ácido carbónico y 80 mmol de ácidos no volátiles a los fluidos corporales. A pesar de lo anterior la concentración de hidrogeniones en estos espacios es mantenida en un límite estrecho, siendo el ph normal del líquido extracelular entre 7.38 y 7.44 (44.7 a 35.5 neq/l de H + ). La anterior constancia es mantenida gracias a la acción de diversos y eficientes sistemas buffer intra y extracelulares, así como por la acción de los pulmones y los riñones. Un sistema buffer, puede ser visto como una sustancia que es capaz de donar o aceptar protones y por lo tanto, puede atenuar aunque no prevenir del todo cambios en el ph. Del gran número de buffers disponibles para estabilizar el ph sanguíneo, el más importante es el formado por la pareja ácido carbónico/bicarbonato, debido a su abundancia, la facilidad para medirlo y al hecho de que refleja íntimamente los factores de regulación pulmonar (ácido carbónico) y renal (bicarbonato), en el equilibrio ácidobase. El dióxido de carbono es el producto volátil formado por la oxidación completa de las grasas, carbohidratos y proteínas, y ejerce una presión parcial como la ejercida por un gas al estar diluido en un medio líquido. La cantidad de CO 2 disuelto es directamente proporcional al pco 2 (el pco 2 es directamente proporcional a la concentración de ácido carbónico). Su cifra normal es de 35 a 45 mm Hg AR 1
2 Sistema ácido carbónicobicarbonato Metabolismo proteico H+ H 2 CO 3 H 2 O CO 2 Renal Pulmones Por motivos de espacio no se abordarán en detalle aspectos relacionados con la terapéutica específica de estos desórdenes. Iones H + salen al líquido extracelular producto del metabolismo intermedio y se combinan de inmediato con bicarbonato para formar ácido carbónico. El bicarbonato es aportado de los riñones, a través de su conservación del filtrado glomerular o de la regeneración de novo del mismo. El ácido carbónico, es rápidamente convertido a H 2 O y CO 2. Los pulmones al controlar la pco 2, indirectamente controlan los niveles de ácido carbónico. El nivel de CO 2 se mantiene constante, ya que la frecuencia y la profundidad de la ventilación alveolar son altamente sensibles a mínimos cambios de la pco 2 así como del ph. Cuando la pco 2 se eleva o el ph desciende la ventilación se incrementa y el grado de eliminación del CO 2 es mayor. Eventos contrarios aunque en menor cuantía ocurren cuando el ph aumenta al ocurrir hipoventilación y elevación del pco 2. El CO 2 se considera el principal estímulo para activar la repiración, hecho que ocurre con elevaciones mínimas de la pco 2. La hipoxia representa un estímulo menor y se torna efectivo cuando la po 2 desciende a mmhg. En presencia de neumopatías severas la hipoxia se convierte en un importante estímulo para la ventilación con niveles de po 2 mayores (70 a 90 mm Hg) Los 6080 mmols diarios de ácidos no volátiles que son producto del metabolismo normal, requieren para evitar que conduzcan a la acidemia de la conservación y regeneración del bicarbonato por parte del riñón. Para conseguir lo anterior, los riñones deben reabsorber todo el bicarbonato filtrado que a razón de 24mEq/L a 120 ml/min (180L/día) de filtrado glomerular, equivalen a aproximadamente 4500 meq diarios. En segundo lugar, el riñón debe regenerar los 6080 meq de bicarbonato consumido en el proceso de buffer de los H + del metabolismo normal. Síntesis de bicarbonato Tanto la conservación del bicarbonato filtrado como la regeneración de este, ocurren a través de un proceso similar en las células del epitelio tubular. Estos procesos se ilustran en la figura número AR 2
3 Figura no. 1 Conservación y regeneración de bicarbonato por el riñón REABSORCIÓN LEC Célula tubular Lumen tubular H 2 O filtrado OH H + H + H 2 CO 3 CO 2 CO 2 H 2 O REGENERACIÓN (se regenera un meq de por cada H + excretado en la orina) H 2 O OH H + H + HPO 4 H 2 PO4 CO 2 H 2 O NH 3 OH H + H + NH 4 LEC: líquido extracelular CO 2 La brecha aniónica urinaria puede ser empleada para estimar de manera indirecta la magnitud de la eliminación de amonio en la orina y se calcula mediante la siguiente fórmula: (Na + ) + (K + ) (Cl ). Una brecha muy negativa sugiere una concentración elevada de amonio en la orina. En estados de acidemia, este fenómeno alcanza su máximo al cabo de 3 a 7 días AR 3
4 Definiciones El empleo de una terminología apropiada, es de gran importancia en la introducción al estudio de los trastornos del equilibrio ácidobase. Acidemia, alcalemia: el sufijo emia describe la acidez sanguínea. Acidemia ph menor de Alcalemia, ph mayor de Acidosis, alcalosis: se refiere solo al proceso primario sin implicar el resultado final del ph sanguíneo. Un trastorno único débil o al agregarse un segundo proceso opuesto, pueden ocasionar que el ph final permanezca en un rango normal. Puede haber por lo tanto, existir acidosis o alcalosis sin acidemia o alcalemia. Acidosis se define como un trastorno fisiopatológico que tiende a agregar ácido o a remover base de los fluidos corporales. Alcalosis es aquel trastorno del equilibrio ácidobase que tiende a remover ácido o agregar base. Metabólico: describe un desorden del equilibrio ácidobase, iniciado por un cambio en la concentración de bicarbonato en sentido de un aumento o disminución. Respiratorio: se refiere a aquel trastorno del equilibrio ácidobase, iniciado por un cambio de la pco 2 en sentido de aumento o disminución. Estos trastornos pueden ser agudos o crónicos, traducen siempre hipo o hiperventilación y no implican aumento en la síntesis de ácidos volátiles. La magnitud de la excreción de CO 2 es directamente proporcional a la ventilación alveolar. Compensación: los trastornos primarios metabólicos evocan respuestas respiratorias y viceversa, los desórdenes primarios respiratorios generan respuestas metabólicas (hipo o hiperbicarbonatemia). Estas respuestas tienen un grado esperado y corresponden a bandas de confidencia dadas por el 95% de la gente normal. En ellas debe de contemplarse no solo la magnitud de la respuesta, sino que también el tiempo necesario para que se lleven a cabo. La magnitud de estas respuestas secundarias es groseramente proporcional a la magnitud del proceso inicial. Estas respuestas son consecuencia fisiopatológica del proceso iniciante y por lo tanto no deben ser vistas o llamadas alcalosis o acidosis secundarias. Tales respuestas generalmente no normalizan el ph, excepto en el caso de la alcalosis respiratoria crónica. Las respuestas respiratorias a los desórdenes metabólicos ocurren casi de inmediato, mientras que las respuestas renales duran significativamente más (24 días). ph: es el resultado del balance entre pco 2 y HCO 3. H + (neq/l) = 24 x pco 2 mm Hg Kassirer y Bleich * meq/l ph= pk + log meq/l Henderson Hasselbach 0.03 x pco 2 mm Hg *la ecuación de Kassirer y Bleich, adaptada de la de Henderson Hasselbach, evita el uso de la tabla de logaritmos y permite un rápido cálculo del H+, pco 2 o del conociendo dos de los tres parámetros. Aporta a la vez, un medio para verificar rápidamente la exactitud o consistencia de los 3 parámetros. Los laboratorios clínicos miden con electrodos altamente sensibles el ph y el pco 2 y calculan HCO 3 de un nomograma. Esta última lectura puede ser errónea y el clínico puede detectar así este error AR 4
5 Trastorno simple: denota la presencia de un proceso primario más su apropiada respuesta de compensación. Trastorno mixto: se refiere a la coexistencia de dos o más desórdenes primarios del equilibrio ácidobase. Estos trastornos pueden tener un aditivo o nulificante en la acidez sanguínea, es decir, en un sentido desviaciones extremas o por el contrario cambios mínimos o incluso mantener el ph normal. Brecha aniónica: representa aquellos aniones exceptuando el o Cl necesarios para contrarrestar la carga positiva del Na +. B.A.= Na + (Cl + ) Normal= 8 16 meq/l Estas cargas negativas están representadas normalmente por las proteínas (cargadas negativamente), el fosfato, el sulfato y los aniones orgánicos. Por cada g/dl de disminución de la albumina plasmática, la brecha aniónica disminuye 2 a5 meq/l. Una brecha aniónica aumentada puede ser la única evidencia de una acidosis metabólica, cuando la misma coexista con un desorden como alcalosis metabólica. Importancia de la relación pco 2 / para definir la acidez o el ph Ejemplos Paciente normal Paciente A Paciente B HCO 3 meq/l pco 2 mm Hg H + neq/l PH El paciente A podría representar un caso de shock séptico o un edema pulmonar severo y tendría la asociación de acidosis metabólica con alcalosis respiratoria. El paciente B podría representar un caso de enfermedad pulmonar obstructiva crónica al que se le agregan diuréticos o se complica con vómitos importantes. Este caso representa una acidosis respiratoria con alcalosis metabólica asociada. En los tres ejemplos el ph es normal enfatizándose que la concentración de H + depende de la relación pco 2 / y no del valor absoluto de ninguno de los factores. Conversión de ph a H + (neq/l) Esta conversión permite aplicar la ecuación de Kassirer y verificar la validez de los datos de laboratorio. (ver página no. 4) 1. ph 7.4= 40 neq/l de H + 2. Ver tabla adjunta 3. en el rango de 7.1 a 7.5 de ph por cada cambio de 0.01 unidad de ph a partir de 7.4 cambia la concentración de H + en un neq/l. Ejemplos: ph 7.2= H + 60 neq/l (aprox) ph 7.5= H + 30 neq/l (aprox) AR 5
6 Sangre venosa o sangre arterial Las muestras para gasometría deben tomarse idealmente de sangre arterial. Sin embargo algunas equivalencias son útiles de saber cuando por motivos técnicos no se cuenten con muestras arteriales. En sangre venosa fluyendo libremente (sin torniquete), el pco 2 es 57 mmhg mayor que en sangre arterial, el es 13 meq/l menor y el ph es menor. Tabla para conversión de ph a H + (neq/l) ph H+ ph H Rangos de compensación para trastornos simples del equilibrio ácidobase (1*) Trastorno Cambio primario Respuesta compensatoria Acidosis Bicarbonato pco 2 metabólica (2*) Alcalosis Bicarbonato pco 2 metabólica (3*) Acidosis respiratoria aguda Acidosis respiratoria crónica Alcalosis respiratoria aguda Alcalosis respiratoria crónica Compensación esperadarango pco 2= 1.5 x HCO / 2 pco 2 aumentado 67 mmhg por cada 10 meq/l de aumento del bicarbonato pco 2 Bicarbonato HCO 3 aumentado 12 meq/l por cada 10 mmhg de aumento de pco 2 pco 2 Bicarbonato(4*) HCO 3 aumentado 34 meq/l por cada 10 mm Hg de aumento de pco 2 pco 2 Bicarbonato HCO 3 disminuido 23 meq/l por cada 10 mm Hg de caída de pco 2 pco 2 Bicarbonato(5*) HCO 3 disminuido 56 meq/l por cada 10 mmhg de caída del pco 2 Límite de compensación 1012 mmhg (6*) 55 mm Hg(7*) 30 meq/l(8*) 45 meq/l(9*) 18mEq/L(10*) 1215 meq/l(11*) AR 6
7 1. nótese que en los trastornos simples las respuestas compensadoras son en el mismo sentido que los cambios primarios. 2. respuesta compensadora: hiperventilación. 3. respuesta compensadora: hipoventilación. 4. respuesta compensadora: conservar y regenerar bicarbonato. 5. respuesta compensadora: bicarbonaturia y retención de ácidos endógenos. 6. mayor pco 2 al esperado como compensación implicaría coexistencia de acidosis respiratoria 7. mayor pco 2 al esperado como compensación implicaría coexistencia de acidosis respiratoria menor pco 2 al esperado como compensación implicaría coexistencia de alcalosis respiratoria 8. y 9 mayor bicarbonato al esperado como compensación implicaría coexistencia de alcalosis metabólica. Menor bicarbonato al esperado como compensación implicaría coexistencia de acidosis metabólica 10 y 11 mayor bicarbonato esperado como compensación implicaría coexistencia de alcalosis metabólica. Menor bicarbonato esperado como compensación implicaría coexistencia de acidosis metabólica Nomograma Se ha tomado como referencia el presentado por Goldberg y colaboradores y que resume las curvas de respuesta in vivo de sujetos normales para problemas respiratorios o metabólicos, sintetizando la experiencia de varios científicos, y permitiendo una evaluación más racional de los trastornos ácidobase. En este nomograma el pco 2 (mmhg) se localiza en la abscisa, en las ordenadas el H + en neq/l a la izquierda y ph a la derecha; líneas diagonales para representar la concentración sérica de bicarbonato en meq/l. Se ha delimitado el área que limita al rango de normalidad, al igual que la correspondiente para cada uno de los desórdenes fisiopatológicos simples, junto con la compensación fisiológica esperada en forma de bandas de confidencia que representa dos desviaciones estandar en el 95% de sujetos normales. Valores de pco 2 y de que se salen de las bandas consignadas, representan alteraciones o trastornos mixtos del equilibrio ácidobase. Es así como el valor de pco 2 de 50 mm Hg con un de 15 meq/l y un ph en 7.8 identifican la asociación de acidosis respiratoria más acidosis metabólica (acidemia mixta). Otras combinaciones posibles, afectan trastornos simples con efectos opuestos en la desviación del ph y que al compararlos el resultado final del ph es una desviación mínima o nula. Un paciente con choque séptico, puede presentarse con un pco 2 en 20 mmhg, un bicarbonato de 11 meq/l y un ph prácticamente normal de 7.36 (43.6 neq/l de H + ), cayendo en un área intermedia de acidosis metabólica más alcalosis respiratoria. Otro ejemplo, que correspondería a un área intermedia, podría ser un paciente con enfermedad pulmonar obstructiva crónica, en quien se han agregado vómitos cuantiosos. Su bicarbonato estaría muy elevado en 40 meq/l y su pco 2 en 60 mmhg. Este es un trastorno mixto, de acidosis respiratoria más alcalosis metabólica y los procesos al tener un efecto opuesto sobre el ph, dan un resultado final en la acidez sanguínea cercano a lo normal. Otra zona intermedia que se observa en el nomograma, es la que aparece entre la acidosis respiratoria aguda y la crónica. Un caso que se presente con un bicarbonato en 30 meq/l y una pco 2 en 65 mm Hg, correspondería a esta área y tal paciente podría representar una de las siguientes posibilidades de acuerdo con la clínica: una insuficiencia respiratoria crónica agudizada, en sentido opuesto una insuficiencia respiratoria aguda en quien no ha habido el tiempo suficiente para su compensación, o bien podría representar un paciente en acidosis respiratoria crónica, que inicia un descenso de bicarbonato y va camino hacia una acidemia mixta respiratoria y metabólica AR 7
8 Queda claro que el aspecto dinámico de los datos una vez colocado en el nomograma se los da el médico tratante en estrecha correlación con el cuadro clínico y el patrón electrolítico. El área de normalidad, representa la convergencia de valores de pco 2 y bicarbonato para mantener el ph entre 7.38 y Sin embargo, valores que caigan en ese rango de normalidad no descartan trastornos ácidobase antagónicos o nulificantes entre si. Un paciente con un bicarbonato en 24 meq/l y un pco 2 de 40 mm Hg y un ph normal puede tener acidosis metabólica más alcalosis metabólica (vómitos más diarrea). Solamente alcalosis respiratoria crónica y ocasionalmente, acidosis respiratoria crónica leve puede cursar con un ph normal, como entidades simples, cuando su respuesta compensatoria es apropiada. NOMOGRAMA AR 8
9 Clasificación de los trastornos del equilibrio ácidobase Simples Aguda Respiratorios Acidosis Alcalosis Crónica Aguda Crónica Metabólicos Alcalosis Acidosis Mixtos 1. acidosis respiratoria + acidosis metabólica. 2. acidosis respiratoria + alcalosis metabólica. 3. alcalosis metabólica + alcalosis respiratoria. 4. alcalosis respiratoria + acidosis metabólica. 5. acidosis metabólica + alcalosis metabólica. 6. triples, acidosis metabólica + alcalosis metabólica + alcalosis o acidosis respiratoria. Como iniciar el análisis de un gas arterial? Las siguientes son algunas consideraciones que permiten un enfoque ordenado para quien no es un experto en este campo: 1. mantenga siempre una estrecha correlación con la clínica 2. verifique la constancia y veracidad de los datos (ph, pco 2, mediante el empleo de la ecuación: H + neq/l = 24x pco 2 Convierta el ph a H + con la tabla adjunta en la página no.6. Recuerde que en la mayoría de los casos el laboratorio calculó el bicarbonato indirectamente con un nomograma, conociendo el ph y el pco 2 y por lo tanto, su cálculo puede estar errado. 3. ayúdese con el nomograma colocando los datos del paciente en el área correspondiere. 4. hágase estas tres preguntas en el siguiente orden: Tiene acidemia, alcalemia o es el ph normal? Es el trastorno metabólico o respiratorio, y si es respiratorio es este agudo o crónico? Es el trastorno simple o mixto? AR 9
10 La primera interrogante la contestaría simplemente al analizar el ph, al significar ph menor de 7.38 acidemia y mayor de 7.44 alcalemia. La segunda pregunta amerita correlación con el cuadro clínico. Acidemia será metabólica si fue iniciada por un descenso en el bicarbonato y será respiratoria si un ascenso en la pco 2 fue el fenómeno inicial. Alcalemia podrá ser el resultado de una elevación del bicarbonato (metabólica) o un descenso del pco 2 (respiratoria). Si ambos fenómenos se llevan a cabo se conoce como desorden mixto. Finalmente, para la última pregunta se hará un análisis global que llevará a la solución de la misma. Deberán tenerse presentes los rangos de compensación para cada uno de los trastornos simples (ver tabla y nomograma) para verificar si los resultados corresponden a lo esperado para un trastorno simple o, si ya corresponden a uno mixto. Se deben recordar que las respuestas metabólicas compensadoras a los trastornos respiratorios primarios requieren días para completarse. Cifras que vayan en sentido opuesto, bicarbonato elevado con pco 2 disminuida o viceversa identifican el trastorno como mixto. Las cifras podrán estar desviadas en el mismo sentido, elevación o disminución, y el trastorno ser mixto, pco 2 elevada más bicarbonato elevado pero no corresponder a los rangos de compensación ni de alcalosis metabólica crónica ni de una acidosis respiratoria crónica. Igualmente ambos parámetros podrán estar disminuidos y no corresponder ni a una acidosis metabólica pura ni a una alcalosis respiratoria crónica ya que las cifras se salen de los rangos esperados para cada desorden simple. La sospecha por medio de la clínica, con respecto a la presencia de un trastorno mixto o la posibilidad de su aparición es de vital importancia. b) TRASTORNOS SIMPLES DEL EQUILIBRIO ÁCIDO BASE Acidosis metabólica (AcM) Definición Trastorno primario iniciado por una disminución de la concentración del bicarbonato sérico. Lo anterior puede ser debido a la ganancia de un ácido fuerte, a la incapacidad para eliminar la producción normal de ácido no volátil o a la pérdida de del líquido extracelular. Estos trastornos conducen a una disminución del ph < 7.38 (acidemia metabólica). Características básicas Cambio primario Respuesta Compensación esperada compensadora Bicarbonato pco 2 Hiperventilación pco 2 = / 12 o pco 2 diminuido 1 a 1.3 mm Hg por cada meq de consumido o últimos 2 dígitos de ph deben ser iguales e la pco AR 10
11 Fisiopatología Mecanismo Ejemplo Se identifican por Se corrige con 1. pérdida de Alcali exógeno bicarbonato: Brecha aniónica síntesis renal de tubo digestivo Diarrea normal disminuido bicarbonato Riñón Acidosis tub. CL aumentado Alcali exógeno renal 2. ganancia de ácido, sobreproducción Lactoacidosis, cetoacidosis disminución de la eliminación normal Insuficiencia renal Brecha aniónica aumentada disminuido CL normal Aniones no medibles aumentados Reoxidación de aniones orgánicos síntesis renal de bicarbonato álcali exógeno (controversial) Álcali exógeno La respuesta de compensación respiratoria se caracteriza por aumento de la ventilación alveolar, secundaria al estímulo que a nivel del centro respiratorio ejerce el ph ácido. Esta respuesta alcanza su máxima expresión al cabo de 12 a 24 horas; por lo tanto la ausencia de una respuesta respiratoria apropiada puede significar: AcM muy aguda. Trastorno mixto: AcM más alcalosis o acidosis respiratoria. Proceso primario inestable. Una disminución mantenida del pco 2 por 12 a 36 horas es de esperarse una vez corregida la AcM. La disminución del ph no retorna el ph a la normalidad y esta corrección dependerá de una reposición del bicarbonato perdido, de una completa reabsorción del mismo filtrado en el riñón en unión de la resíntesis de bicarbonato por el riñón (amoniogénesis), cuya máxima expresión, de hasta mmol, se alcanza al cabo de 3 a 4 días. Migración del potasio del líquido intracelular hacia el espacio extracelular ocasiona hiperkalemia inicial durante la AcM, principalmente en acidosis debidas a ácidos inorgánicos. Manifestaciones clínicas: Acidemia severa puede causar: Exceso de catecolaminas circulantes. Respuesta de vasos arteriolares disminuida a las catecolaminas. Hiperkalemia. Leucocitosis. Emesis, Movilización del calcio óseo o hipercalciuria. Contracción de venas y predisposición al edema pulmonar. Dificultad para desfibrilar el miocardio AR 11
12 Clasificación El concepto de brecha aniónica fue presentado en el capítulo de generalidades. A través del mismo se elabora la clasificación de las diferentes entidades que pueden causar acidosis metabólica. Brecha aniónica (B.A.): Na + (Cl + ) = 8 a 16 Este rango se considera como normal. La presencia de B.A. normal implica disminución del bicarbonato y aumento del cloruro en una acidosis metabólica. Una BA aumentada implica un descenso del bicarbonato sérico asociado con normocloremia y un aumento de aniones no rutinariamente medibles. Ejemplo: meq/l Normal AcM con B.A. normal AcM con brecha aniónica aumentada Na Cl B.A Entre mayor sea la brecha aniónica más factible será identificar el ácido productor de acidosis metabólica. Causas: a) Con brecha aniónica aumentada: 1. insuficiencia renal 2. cetoacidosis diabética. 3. cetoacidosis alcohólica 4. lactoacidosis 5. cetolactoacidosis 6. cetoacidosis por inanición 7. tóxicos o drogas (etilenglicol, metanol, aspirina) 8. glicogenosis b) Con brecha aniónica normal (hipercloremia) y potasio normal o disminuido 1. diarrea o fístulas digestivas (BA urinaria negativa) 2. acidosis tubular renal (BA urinaria positiva) 3. estado posthipocapnia 4. inhibidores de la anhidrasa carbónica (acetazolanida) 5. derivaciones uretrales o disfunción de ileostomía 6. colestiramina, sulfato de magnesio, laxantes AR 12
13 c) con brecha aniónica normal (hiperclorémica) y potasio normal o elevado 1. insuficiencia renal temprana. 2. nefritis intersticial 3. hidronefrosis 4. hipoaldosteronismo 5. alimentación parenteral 6. otros: lupus eritematoso sistémico, amiloidosis, drepanocitosis, agentes acidificantes: ácido clorhídrico, arginina, lisina, NH 3, Cl ) d) Mixtas: hiperclorémica más brecha aniónica aumentada 1. cetolactoacidosis 2. lactoacidosis + tóxicos 3. insuficiencia renal + cetoacidosis diabética o lactoacidosis. e) Hipercloremias mixtas 1. acidosis tubular renal + diarrea 2. hiperalimentación más diarrea. Definición Alcalosis metabólica (AlM) Trastorno primario iniciado por una elevación en la elevación de la concentración de bicarbonato sérico. Este desorden puede ocasionar una elevación del ph > 7.44, llamándose tal condición alcalemia metabólica. Características básicas Cambio primario Respuesta compensatoria Compensación esperada Bicarbonato pco 2 hipoventilación pco 2 debe aumentar de 0.6 a 0.7 mmhg por cada meq de bicarbonato en exceso pco 2 = 0.9 x + 9 límite de compensación aumento de pco 2 hasta 55 mmhg AR 13
14 Fisiopatología El cambio primario metabólico lo constituye un aumento en el bicarbonato sérico, lo que disminuye la relación pco 2 /. Como parte de este trastorno inicial, ocurre una respuesta compensatoria, consistente en hipoventilación alveolar secundaria a depresión respiratoria central y de los quimiorreceptores periféricos, a consecuencia de la elevación del bicarbonato. Esta respuesta eleva la pco 2 y tiende a evitar la desviación extrema del ph. El aumento de la pco 2 no llega a normalizar el ph. Se acepta como una respuesta adecuada a la elevación del pco a 0.7 mm Hg por cada meq de bicarbonato en exceso lo que equivale a la fórmula: pco 2 = 0.9 x + 9 El límite máximo de esta respuesta consiste en una elevación del pco 2 hasta 5560 mmhg. La ausencia de una respuesta compensatoria puede significar: 1. proceso de AIM aguda o inestable 2. acidosis respiratoria asociada (pco 2 mayor al esperado). 3. alcalosis respiratoria asociada (pco 2 menor al esperado) Recordemos que solamente el estómago o el riñón pueden conseguir una síntesis neta de bicarbonato y conducir a un trastorno de hiperbicarbonatemia. En la mayoría de los casos, la AlM requiere la partiipación de un factor causal y de uno (o varios) perpetuantes para mantener el estado de elevación del bicarbonato. Alcalosis metabólica Requiere Factor causal + Factores perpetuantes Hipovolemia o Hipokalemia o Hipercapnia Aumento Intercambio NA+ / H+ Ganancia o pérdida de H AR 14
15 El trastorno inicial, lo es con frecuencia una pérdida de cloruro de sodio (vómitodiuréticos). Esto ocasiona dos hechos que son fundamentales para la fisiología de AlM. La pérdida de sodio se acompaña lógicamente de contracción de volumen plasmático y la de cloruro de depleción del mismo. Esta combinación de factores producen a nivel del túbulo proximal una gran avidez por la retención de sodio y al estar el cloruro depletado, el sodio es reabsorbido en conjunto con (anión disponible) evitando con ello la aparición de HCO 3 en la orina (ph urinario puede permanecer ácido). Lo anterior, bloquea el mecanismo necesario para aliviar el exceso de bicarbonato sérico ( evita la bicarbonaturia). El Cl urinario, en estos casos estará muy disminuido, como reflejo de su depleción corporal En el caso de vómito o empleo prolongado de sonda nasogástrica, ocurre además una pérdida directa de H + como HCl, con ganancia neta de bicarbonato. La hipovolemia coexistente impide junto con la hipocloremia la eliminación del exceso de bicarbonato. La hipovolemia es el factor perpetuante más frecuente en AlM no solo por promover la conservación de Na + con HCO 3, sino por que también a través de aldosteronismo secundario, precipita la aparición de hipokalemia. Este último trastorno puede ayudar a mantener una AlM a través de un aumento en la síntesis de amonio renal y eliminación de H + (NH 3 +H + ) con ganancia neta de HCO 3 y también la hipokalemia, cuando es significativa, ocasiona un aumento del intercambio de Na + /H + en lugar de Na + /K +. Por lo tanto las siguientes medidas son necesarias para aliviar la AlM. Medida terapéutica 1. Reponer volumen Finalidad Disminuir la absorción tubular proximal de sodio con bicarbonato. Abolir el aldosteronismo secundario 2. Reponer cloruro Permitir la bicarbonaturia y favorecer la concentración de sodio, no solo a nivel proximal sino también en la bomba activa para cloruro en el asa ascendente de Henle 3. Reponer déficit de K + Disminuir la síntesis de NH 3 y aumentar el intercambio de Na + /K + y no de Na + /H + Un grupo de pacientes con AlM no responden a la administración de volumen y cloruro. En ellos, frecuentemente hay un estado de expansión del volumen circulante a consecuencia de un exceso de mineralocorticoides, endógenos y o exógenos, que ocasionan un efecto directo a nivel del túbulo distal aumentando el intercambio de Na +/ H +. En este grupo la excreción de H + y la síntesis de bicarbonato superan la eliminación de bicarbonato y conducen a un estado de alcalemia, frecuentemente perturbado por severa hipokalemia. Dichos pacientes no tienen depleción de cloruro y se presentan con altas concentraciones de cloruro urinario, lo que facilita la clasificación para diferenciarlos del grupo anterior que cursan con contracción del volumen plasmático y niveles bajos de cloruro urinario (<10 meq/l) AR 15
16 Manifestaciones clínicas (inespecíficas) La alcalemia metabólica se puede acompañar de: Hipocloremia siempre presente Hipokalemia con sus manifestaciones propias Aumento leve de la brecha aniónica. Hiperexitabilidad neuromusclar* Confusión mental. Arritmias cardiacas* Aumento de la afinidad al oxígeno por la hemoglobina. Aumento de la sensibilidad a los digitálicos *en casos severos ph >7.55 La hiperexcitabilidad neuromuscular puede manifestarse con signo de Trosseau o Chvostek, tetania y/o convulsiones. Hay un aumento en la afinidad de las proteínas por el calcio iónico y una elevación de la eliminación de acetilcolina en las terminaciones neuromusculares. Arritmias cardiacas serias se han asociado a AlM en pacientes críticamente enfermos o expuestos a situaciones de gran estrés como anestesia y cirugía. La presencia de anomalías electrocardiográficas, refleja la hipokalemia coexistente (QT prolongado, onda U, T aplanada o invertida) Clasificación La respuesta a la terapia salina con NaCl permite clasificar a los pacientes con AlM. En el primer grupo están los casos con respuesta a la terapia salina, que cursan con disminución del volumen plasmático y cloruro en orina menor de 10 meq/l. El segundo grupo se restringe a los pacientes sin respuesta a la terapia salina, el volumen plasmático está aumentado lo mismo que el cloruro urinario (>10 meq/l) en los últimos existe un estado de hipermineralocorticismo de origen exógeno o endógeno. Lógicamente, si el paciente ha persistido tomando diuréticos, la elevación del cloruro urinario pierde valor, ya que en esos casos habrá cloruro urinario aumentado y buena respuesta a la reposición de Cl y K AR 16
17 Alcalosis metabólica Flujograma diagnóstico <10 meq/l Responde a la terapia de NaCl Buscar Pérdida renal Pérdida extrarenal exógeno Contracción del volumen plasmático De H+ o Cl y ganancia de Cloruro en orina >1520 meq/l No responde a terapia con NaCl Tensión arterial Elevada Normal Buscar causa de exceso de mineralocorticoides Pensar en: Bartter Hipokalemia hipercalcemia Postayuno Causas de alcalosis metabólica 1. Con respuesta a la terapia salina (NaCl) (cloruro urinario < 1020 meq/l) a) Pérdidas extrarrenales Vómitos Sonda nasogástrica Síndrome de ZollingerEllison. Diarrea perdedora de cloruro Adenoma velloso de colon Fibrosis quística del páncreas b) Pérdidas renales Diuréticos* Aniones pobremente reabsorbibles (carbenicilina, penicilina, sulfato o fosfato de sodio) c) Ganancia exógena Administración de Na Antiácidos Bicarbonato de soda Transfusiones (citrato) Sales de ácidos fuertes (lactato, citrato, acetato) AR 17
18 d) Alcalemia por contracción *Cl orina puede ser > 10 meq/l si el paciente aún los toma e) Estado posthipercapnia 2. Sin respuesta a la terapia salina (NaCl) (cloruro urinario >1520 meq/l) Definición a) Variantes con hipertensión arterial Endógenas (fuente de mineralocorticoides) hipertensión renovascular hiperaldosteronismo primario hiperreninismo Cushing (principalmente síndrome ACTH ectópico) Deficiencia de 11 a 17 hidroxilasa Síndrome de Liddle Exógenas Regaliz (licorice, carbenoxolone) Mineralocorticoides Glucocorticoides b) Variantes con normotensión arterial síndrome de Bartter o de Gitelman depleción severa de potasio administración de glucosa, posterior a ayuno prolongado hipercalcemia o hipoparatiroidismo administración de álcali. Acidosis respiratoria (AcR) Trastorno fisiopatológico iniciado por una elevación de la pco mayor de 45 mm Hg, aumentando la relación pco 2 / y causando ascenso en la concentración de hidogenión (H + ) por aumento de ácido carbónico. Si este desorden conduce a la disminución del ph a menos de 7.35, ello se conoce como acidemia respiratoria AR 18
19 Características básicas Acidosis respiratoria aguda Acidosis respiratoria crónica Cambio primario Respuesta compensatoria Compensación esperada pco2 Aumento de 1 meq/l de bicarbonato por cada 10 mm Hg de elevación de pco2 pco2 34 meq/l de HCO3 por cada 10 mm Hg de elevación de pco2 Fisiopatología Límite de compensación Hasta 20 meq/l de HCO3 Hasta 45 meq/l de HCO3 El aumento de pco 2 es dado por una disminución de la ventilación alveolar, ya que, prácticamente no se da el caso de que el aumento de la producción de CO2 conduzca a AcR. La AcR, se caracteriza por titulación del ácido carbónico por buffers no bicarbonato, produciéndose una elevación de este último en el rango aproximado de 1mEq/L por cada 10 mm Hg de elevación de pco 2. El bicarbonato no sube durante esta fase de 12 a 24 horas a más de 30 meq/l, es decir un aumento de 34 meq/l. Este incremento de bicarbonato ocurre como una respuesta compensatoria, tratando de atenuar la desviación del ph hacia la acidemia. Ya que la elevación de bicarbonato es de poca cuantía, grados importantes de acidemia pueden verse en AcR aguda. En las acidosis respiratorias crónicas, los centros respiratorios son menos sensibles a la pco 2 y la hipoxemia se convierte en el estímulo principal para regular la ventilación alveolar. Durante la AcR, la elevación de H + puede calcularse con la siguiente fórmula: H + neq/l= 0.8 pco 2 Valga decir que la elevación de H+ será de un 80% de la del pco 2 en mm Hg. En la AcR crónica (lapso mayor a 1224 hrs), la carga de ácido carbónico estimula con el fin de conseguir una mejor compensación, la conservación total de bicarbonato filtrando a nivel renal, junto con la síntesis neta del mismo a través del proceso de síntesis y excreción de amonio. Tal hecho ocurre mediante la eliminación de H + con una molécula de NH 3 y su combinación con cloruro en el lumen tubular. Es de notar que aumentos del cloruro urinario, con hipocloremia sarán un rasgo de la acidosis respiratoria crónica AR 19
20 Manifestaciones clínicas Entre más abrupto el inicio de la AcR mayor será la posibilidad de precipitar signos y síntomas. Confusiónestuporcoma. Hipertensión endocraneana. Papiledema Los propios de una hipoxemia que frecuentemente coexiste Hiperkalemia impredecible y de menor cuantía que en las acidosis metabólicas por ácidos inorgánicos. Venoconstricción central. Taquicardia pulsos amplios. Hipocloremia (AcR crónica) Nótese que el patrón electrolítico incluyendo hipocloremia, bicarbonato elevado (rasgo de compensación), semeja al de la alcalosis metabólica. La clínica, la hipoxemia, el potasio normal o alto, orientan a AcR antes de conocer el ph. Clasificación La AcR se divide en: Aguda Crónica Esta división es crítica para planear las modalidades de tratamiento. Muchas de las entidades que producen AcR aguda se mantienen y ocasionan AcR crónica. Las causas más frecuentes se incluyen en las listas siguientes. Acidosis respiratoria aguda Acidosis respiratoria Causas más frecuentes 1. Anomalías neuromusculares Infección, tumor, trastorno vascular o trauma del S.N.C. Trauma medular alto. Síndrome de Guillain Barré, tétano Miastenia gravis. Botulismo, parálisis periódica hipokalémica. Sobredosis de narcóticos, sedantes o hipnóticos. Terapia con O 2 en EPOC 2. Obstrucción de la vía aérea cuerpo extraño, tumor o estenosis aspiración de vómito epiglotitis estado asmático obstrucción de traqueostomía o tubo endotraqueal OSA, síndrome de obstrucción ligada al sueño AR 20
21 3. Desórdenes toracopulmonares Tórax inestable (politrauma), fracturas. Pneumotórax y/o derrame pleural. Inhalación de gases tóxicos Edema pulmonar severo Síndrome de distress respiratorio agudo del adulto Uso inadecuado del ventilador Paro cardiorrespiratorio 4. Enfermedad vascular Embolia pulmonar primaria Acidosis respiratoria crónica Enfermedad pulmonar obstructiva crónica Cifoesclerosis. Obesidad extrema, ascitis severa Uso inadecuado del ventilador Enfermedad intersticial avanzada Distrofia muscular o mielopatías crónicas Hipoventilación primaria trastorno del sueño, mixedema Hipokalemia, hipofosfatemia, aminoglicósidos OSA, mixedema. (AlR) Alcalosis respiratoria Definición Trastorno fisiopatológico iniciado por una disminución de la pco 2 (hipocapnía) a un nivel inferior de 35 mm Hg, disminuyendo así la relación del pco 2 / y causando un descenso en la concentración del H + al disminuir el ácido carbónico. Si este desorden conduce a elevar el ph a más de 7.44, se llama alcalemia respiratoria. Características básicas Alcalosis respiratoria aguda Cambio Respuesta primario compensatoria pco 2 Compensación esperada 2.3 meq/l de descenso de bicarbonato por cada 10 mm Hg de caída Límite de compensación 18 meq/l de Alcalosis respiratoria Crónica pco 2 de pco 2 Descenso de 456 meq/l de bicarbonato por cada 10 mm Hg de caída de pco meq/l de AR 21
22 El descenso en la pco 2 es dado por un aumento de la ventilación alveolar. Se considera una AlR severa cuando el ph sanguíneo sea superior a 7.6,siendo este concepto de interés en relación con las decisiones terapéuticas. AlR es el trastorno del equilibrio ácidobase que con mayor frecuencia se ve en el paciente hospitalizado, en el paciente críticamente enfermo y se le ha identificado como un signo de mal pronóstico. En la AlR aguda poco después de iniciada la hiperventilación, los buffers tisulares y los eritrocitos proveen H+ para consumir HCO3 e intentar disminuir la desviación del ph hacia la alcalemia. Sin embargo, esta respuesta de compensación no impide que el ph se torne alcalino, a veces a cifras extremas ya que la hiperventilación puede ser muy aguda y severa (la caída del pco 2 ) y el consumo de HCO 3 de muy poca cuantía. El bicarbonato disminuye en esta fase de 23.5 meq/l por cada 10 mm Hg de descenso del pco 2. Cambios mayores de en esta fase implicarían la coexistencia de AcM, o si el bicarbonato estuviese elevado se mantuviese normal, la de alcalosis metabólica. El límite de este descenso de bicarbonato en AlR aguda es de hasta 18 meq/l. El descenso en el H+ se calcula con la fórmula: H + = 0.8 x cambio del pco 2 en mm Hg. Si el pco 2 disminuye de 40 a 20 mm Hg, 0.8 x 20 de cambio igual a 16 neq/l de descenso de H+. En la AlR crónica se lleva a cabo una disminución de la reabsorción tubular de y una retención de ácidos endógenos con el fin de provocar bicarbonaturia y un descenso mayor del que mitigue la desviación del ph hacia la alcalemia, como consecuencia del descenso inicial del pco 2. Esta respuesta alcanza su máxima efectividad hasta dos semanas después y puede ser de tal magnitud que incluso normalice el ph en ausencia de acidosis metabólica coexistente. El límite de disminución compensatoria a que llega el en una AlR crónica es de 1215 meq/l Al disminuir el, el Cl aumenta para mantener la electroneutralidad. A la vez, hipokalemia leve, puede aparecer para compensar la salida del H+ intracelular. La brecha aniónica puede aumentar levemente, 1417 meq/l por acumulación discreta de ácido láctico y aporte del H + de las proteínas. Este patrón de hipercloremia y BA levemente aumentada semeja el de la acidosis metabólica, pero la clínica, el ph y la magnitud del descenso de hacen frecuentemente la diferencia. Bicarbonato menor de 12 meq/l es indicativo de acidosis metabólica. Manifestaciones clínicas Aparecen en caso de alcalemia marcada, ph > 7.6 o en situaciones de AlR aguda: Parestesias, calambres Espasmos carpo pedales Mareos Nauseasvómitos Angustia Arritmias cardiacas Trastornos del sensorio secundarios a vasoconstricción cerebral. Este trastorno adquiere gran interés en el campo del postoperatorio en neurocirugía en donde la hiperventilación del paciente en ventilador mecánico es frecuente. Hipercloremia Hipokalemia leve? BA levemente aumentada AR 22
23 Clasificación La alcalosis respiratoria se divide en aguda y crónica. La mayoría de las condiciones que producen AlR aguda pueden permanecer y ocasionar AlR crónica. De acuerdo al mecanismo que origina la hiperventilación, las causas de AlR se dividen en centrales (cuando afectan al centro respiratorio) y pulmonares. Alcalosis respiratoria Causas más frecuentes 1. Mecanismo central ansiedad histeria, dolor, pánico encefalopatía hepática hipoxemia, anemia severa sepsis con Gram. negativos intoxicación por salicilatos embarazo fiebre afecciones del S.N.C: infección, tumor, trauma, vascular varios, tirotoxicosis, analépticos, salicilatos, progesterona, teofilina y catecolaminas, nicotina. 2. Mecanismo pulmonar grandes altitudes pneumonías asma bronquial embolia pulmonar pneumonía intersticial insuficiencia cardiaca congestiva edema pulmonar inicial uso inapropiado del ventilador y paciente críticamente enfermo TRASTORNOS MIXTOS DEL EQUILIBRIO ÁCIDOBASE Un trastorno mixto del equilibrio ácidobase se define como la coexistencia simultánea de dos o tres trastornos simples. Lógicamente lo anterior excluye la combinación de desórdenes respiratorios, pues es imposible que un paciente hiperventile (alcalosis respiratoria) e hipoventila (acidosis respiratoria) a la vez. El diagnóstico de un trastorno mixto es posible realizarlo mediante la aplicación de la fisiopatología de cada uno de los trastornos simples, ya que estos alteran el equilibrio ácidobase y el patrón electrolítico de una manera predecible. Es absolutamente necesario recordar que el trastorno inicial y su esperada respuesta de compensación forman parte de un proceso integral que tiende a mitigar las desviaciones del ph. La ausencia de una respuesta compensadora respiratoria para un trastorno metabólico o viceversa marca la presencia de un trastorno mixto. Las respuestas de compensación respiratoria a los trastornos metabólicos, ocurren casi de inmediato, aunque alcanzan su máxima expresión al cabo de varias horas, mientras que las AR 23
24 respuestas de compensación renales a los trastornos respiratorios no ocurren plenamente sino hasta 2 a 4 días después. Lo anterior, permite el análisis cauteloso de los datos para no implicar la presencia de un trastorno mixto sin antes haber analizado el factor del tiempo necesario para alcanzar la compensación de un trastorno simple. Otro aspecto a contemplarse antes de formular la presencia de un trastorno mixto, es la exactitud o consistencia de los datos de laboratorio El resultado final del ph ante un trastorno mixto, puede ser el de una desviación extrema en el sentido de acidemia o alcalemia cuando se agrupan dos desórdenes sinérgicos (AcM + AcR o AlM +AlR) o puede ser normal si los trastornos simples tienen efectos opuestos sobre el ph (AcM + AlR o AlM + AcR o AcM + AlM). Si en uno de estos últimos ejemplos el ph se desvía fuera de lo normal, ésto implica que el proceso predominante es mucho más severo que lo que aparenta, ya que logra producir alcalemia o acidemia a pesar de existir un proceso antagónico simultáneo. El resultado final del ph depende de la relación pco 2 / y no de ningún valor aislado de cada factor. Los trastornos simples, a excepción de la alcalosis respiratoria crónica no cursan con el ph normal a pesar de sus adecuadas respuestas de compensación y estas últimas nunca sobrecorrigen. La presencia de un ph normal ante una circunstancia clínica que suele cursar con un trastorno ácidobase (uremia severaacidosis metabólica) implica la presencia de un trastorno simultáneo opuesto (vómito alcalosis metabólica) Trastornos mixtos del equilibrio ácidobase Síntesis de combinaciones posibles Trastornos simples (trastorno inicial) Acidosis metabólica (AcM) Alcalosis metabólica (AlM) Acidosis respiratoria aguda pco 2 (AcR aguda) Acidosis respiratoria crónica Respuesta compensadora normal PCO 2 (pco 2 = 1.5 x pco (0.7 mm Hg por cada meq/l de HCO3 en exceso) (12 meq de HCO3 por cada 10 mm Hg de elevación de pco2) Trastorno mixto se puede agregar al estar PCO 2 en exceso =AlR coexistente PCO 2 normal o aumentado = AcR coexistente, normal = AlM coexistente pco 2 normal o =AlR coexistente pco 2 en exceso =AcR coexistente, normal = AcM coexistente > 30 meq/l =AlM coexistente 24 meq/l =AcM coexistente en exceso =AlM pco 2 (AcR crónica) ( 3 a 4 meq de bicarbonato por cada 10 mm Hg de elevación de pco2) coexistente, HCO3 normal o =AcM coexistente Alcalosis respiratoria aguda pco 2 (AlR aguda) (23 meq/l de HCO3 por cada 10 mmhg de descenso de pco2) < 18 meq/l =AcM coexistente > 24 meq/l =AlM coexistente AR 24
25 Alcalosis respiratoria crónica pco 2 (AlM crónica) Clasificación (56 meq/l de HCO3 por cada 10 mmhg de descenso de pco2) normal o =AlM Coexistente, en exceso =AcM Coexistente Los trastornos mixtos se clasifican de acuerdo a las siguientes combinaciones: 1. Acidosis metabólica + Acidosis respiratoria (AcM) (AcR 2. Acidosis respiratoria + Alcalosis metabólica (AcR) (AcM) 3. Alcalosis metabólica + Alcalosis respiratoria (AlM) (AlR) 4. Alcalosis respiratoria + Acidosis metabólica (AlR) (AcM) 5. Acidosis metabólica + Alcalosis metabólica (AcM) (AlM) 5. Triples: Acidosis metabólica + Alcalosis metabólica + Acidosis o alcalosis respiratoria. Las tablas 1 y 3 resumen la manera de integrar el diagnóstico de un trastorno mixto del equilibrio ácidobase. En ningún trastorno simple se desvían el pco 2 y el en sentido opuesto, ya que las respuestas de compensación tienden a evitar las desviaciones del ph. Por lo tanto la presencia de un pco 2 aumentado con disminuido o viceversa, marcan de inmediato la presencia de un trastorno mixto. Tabla 1. Trastorno mixto ácidobase Cómo hacer el diagnóstico Compensación inapropiada para un trastorno simple Nomograma: datos de y un pco 2 corresponden a una zona que no limita a ninguna de las bandas de confidencia a los trastornos simples. Verificar la exactitud de los datos de laboratorio. PCO 2 alterados en sentido opuesto. Orientación clínica (ver tabla) Patrón electrolítico (ver tabla). ph normal a sabiendas que existe u trastorno que altera el equilibrio ácidobase (hay un fenómeno opuesto coexistente) AR 25
26 Flujograma para analizar un trastorno ácidobase como simple o mixto Existe acidemia ph < 7.38 No Hay alcalemia ph >7.44 No ph normal Si Si Respiratoria pco 2 Metabólica Respiratoria pco 2 Metabólica Trastorno mixto por coexistencia de trastornos simples opuestos: 1. AcM + AlR ( HCO3 y pco 2 disminuidos) 2. AcR + AlM ( HCO3 y pco 2 aumentado) 3. AcM + AlM ( HCO3 y pco 2 normal) Brecha aniónica aumentada? 4. Alcalosis respiratoria crónica leve 5. ausencia de trastorno ácidobase Trastorno simple si aumenta el bicarbonato compensador ocurre en el rango Trastorno simple si la disminución del pco 2 compensador ocurre en el Trastorno simple si la disminución del bicarbonato compensador ocurre en al rango esperado, si no hay un trastorno mixto Trastorno simple si el aumento del pco 2 compensador ocurre en el rango esperado, si no hay trastorno.mixto. Pronóstico reservado AR 26
27 Tabla no. 2 Hallazgo clínico Insuficiencia renal Cetosis diabetes descompensada Choque Shock Diarrea Vómitosprolongada succión gástrica Contracción de volumen circulante Uso previo de diuréticos Tetania excitabilidad muscular Arritmias cardiacas Fiebre Hepatopatía Sepsis Afecciones del sistema nervioso central Embolismo pulmonar Paciente críticamente enfermo Cianosis Tiraje intercostal Papiledema Orienta a presencia de Acidosis metabólica Acidosis metabólica Acidosis metabólica Acidosis metabólica Alcalosis metabólica Alcalosis metabólica Alcalosis metabólica AlM o AlR AlM o AlR Alcalosis respiratoria Alcalosis respiratoria Alcalosis respiratoria Alcalosis respiratoria Alcalosis respiratoria Alcalosis respiratoria o AlM Acidosis respiratoria Acidosis respiratoria Acidosis respiratoria Tabla no.3 Trastornos mixtos Orientación por patrón electrolítico Hallazgo electrolítico Orienta a HCO 3 > 45 meq/l Denota siempre presencia de alcalosis metabólicatal cifra nunca es compensación para AcR. HCO 3 < 12 meq/l Denota presencia de acidosis metabólica. Tal cifra nunca es compensación para AlR Hipocloremia (Cl menor de 98 meq/l) Sospeche alcalosis metabólica o acidosis respiratoria crónica. Hipercloremia (Cl > 106 meq/l) Sospeche acidosis metabólica, alcalosis respiratoria crónica o rápida administración de NaCl B.A aumentada (>16mEq/L) Sospeche acidosis metabólica, drogas (carbenicilina), deshidratación severa o alcalosis metabólica. Hipokalemia (K + <3.8 meq/l) Sospeche alcalosis metabólica o si hay acidemia la hipokalemia en este estado es signo de severo déficit de K +. En AcM descarte diarrea, acidosis tubular renal, recuperación de cetoacidosis diabética o uso de acetazolamida. Hiperkalemia (K + > 5.2 meq/l) Acidemia, principalmente AcM hiperclorémica en presencia de insuficiencia renal. PCO 2 > 55 mm Hg Denota siempre la presencia de acidosis respiratoria. Esta cifra nunca es compensación para AlM AR 27
28 Bibliografía complementaria 1. Quesada O. Trastornos del equilibrio Ácido base. Manual de Emergencias Médicas. Edit LiL 1984, no.11, p Acid base disorders; N Medicine Disease a Month 1996;nl x L11: Halperin ML, Jungas RL. Metabolic production and renal disposal of hydrogen ions. Kidney Int. 1983;24: Bushinsky Da, Coe FL, Katzénberg C, Szidon JP, et al. Arterial PCO 2 in chronic metabolic acidosis. Kidney Int. 1982;22: Palmer BF, Alpern RJ. Metabolic alkalosis. J Am Soc Nephrol. 1997;8: Bia M., Their SO. Mixed acidbase disturbances, a clinical approach. Med. Clin. N Am 65:347,1981;65: Emmett M, Narins RG. Clinical use of anion gap. Medicine, 1977;56: Gabow PA, Kaehny W, Fennessey PV, et al. Diagnostic importance of an increased serum anion gap. New Eng J Med. 305:854, 1980;305: Goldberg M, Green SB, Moss ML, et al. Computerbased instruction and diagnosis of acidbase disorders. J.A.M.A 233:269,1973;233: Mc Curdy DK: Mixed metabolic and respiratory acidbase disturbances. Diagnosis and treatment. Chest 62:358,1972;65: Naris RG, Jones ER, Stom MC, et al. diagnostic strategies in disorders of fluid, electrolyte and acidbase homeostasis. Am J. 72:496, 1982;72: Oh, MS, Carroll HJ. The anion gap. New Eng J Med 297:814,1977;297: Their SO. Disorders of acidbase metabolism. Am College Phys. Annual Session. New Orleans, AR 28
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS
 EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
ESTADO ACIDO BASE ACIDOSIS METABOLICA. ETIOLOGÍA DE LA ACIDOSIS METABÓLICA Inhabilidad Para Secretar La Carga Acida De La Dieta +
 ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Programa 3º Curso. Curso (Prof. M García-Caballero)
 Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
DESORDEN ACIDO BASICO
 DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
Cátedra de Fisiología Humana CAPÍTULO I CAPITULO III. Equilibrio Acido Base PH. Carrera de Enfermería. Universidad Nacional del Nordeste
 CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
TALLER DE ANALISIS DE GASES ARTERIALES
 TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ
 MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
1. Líquidos corporales. 2. Anatomía y función renal. 3. Hormonas ADH y aldosterona
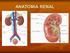 1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
Carvajal Ramos M, Sánchez Sánchez M, Cornide Santos I, Panadero Carlavilla FJ
 ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE Carvajal Ramos M, Sánchez Sánchez M, Cornide Santos I, Panadero Carlavilla FJ El ph refleja la concentración de cationes de hidrógeno presentes en una determinada
ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE Carvajal Ramos M, Sánchez Sánchez M, Cornide Santos I, Panadero Carlavilla FJ El ph refleja la concentración de cationes de hidrógeno presentes en una determinada
Alteraciones de los Fluidos Corporales, Electrolitos
 Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Trastornos respiratorios. Acidosis y alcalosis
 Trastornos respiratorios Acidosis y alcalosis Acidosis Respiratoria Trastorno que se caracteriza por aumento primario de la paco2 con elevación de la concentración de H+ en sangre, disminución del ph y
Trastornos respiratorios Acidosis y alcalosis Acidosis Respiratoria Trastorno que se caracteriza por aumento primario de la paco2 con elevación de la concentración de H+ en sangre, disminución del ph y
Alteraciones ácido-base Simples y Mixtos: Una Aproximación Práctica Robert C Narins, M.D. y Michael Emmett, M.D. Modificado por Mauricio Durán, M.D.
 1 Alteraciones ácido-base Simples y Mixtos: Una Aproximación Práctica Robert C Narins, M.D. y Michael Emmett, M.D. Modificado por Mauricio Durán, M.D. Revisiones recientes del metabolismo ácido-base se
1 Alteraciones ácido-base Simples y Mixtos: Una Aproximación Práctica Robert C Narins, M.D. y Michael Emmett, M.D. Modificado por Mauricio Durán, M.D. Revisiones recientes del metabolismo ácido-base se
Fisiología y envejecimiento Aparato urinario. Tema 11
 Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
ACIDOSIS RESPIRATORIA
 ACIDOSIS RESPIRATORIA El presente artículo es una actualización al mes de julio del 2006 del Capítulo del Dr. Carlos Lovesio, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos
ACIDOSIS RESPIRATORIA El presente artículo es una actualización al mes de julio del 2006 del Capítulo del Dr. Carlos Lovesio, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos
ENFERMERÍA CLÍNICA I Felicitas Merino de la Hoz TEMA 1.2.2 DESEQUILIBRIOS ACIDOBÁSICOS
 TEMA 1.2.2 DESEQUILIBRIOS ACIDOBÁSICOS ÍNDICE 1. Introducción. 2. Análisis e interpretación de los gases arteriales. 3. Alteraciones del equilibrio ácido- base. 3.1. Acidosis respiratoria. 3.2. Alcalosis
TEMA 1.2.2 DESEQUILIBRIOS ACIDOBÁSICOS ÍNDICE 1. Introducción. 2. Análisis e interpretación de los gases arteriales. 3. Alteraciones del equilibrio ácido- base. 3.1. Acidosis respiratoria. 3.2. Alcalosis
INTOXICACION CON ASPIRINA
 INTOXICACION CON ASPIRINA La intoxicación con aspirina es un hecho sumamente común en la práctica médica. La misma responde entre otras cosas, a que es un medicamento que puede adquirirse sin receta en
INTOXICACION CON ASPIRINA La intoxicación con aspirina es un hecho sumamente común en la práctica médica. La misma responde entre otras cosas, a que es un medicamento que puede adquirirse sin receta en
7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
FISIOPATOLOGIA. Concentración normal H+: 40 nmoles/l. -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3
 FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
Pauta de corrección guía IV medio Homeostasis
 Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
Un adulto sano, suele ser capaz de mantener los equilibrios hidroelectrolíticos y ácido-base.
 BALANCE HIDRICO BALANCE HIDRICO Para conservar la salud y mantener las funcíones corporales, es necesario un EQUILIBRIO líquido, electrolítico y ácido báse. El requerimiento es: aporte y eliminación armónico
BALANCE HIDRICO BALANCE HIDRICO Para conservar la salud y mantener las funcíones corporales, es necesario un EQUILIBRIO líquido, electrolítico y ácido báse. El requerimiento es: aporte y eliminación armónico
Ventilación Pulmonar. -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón
 Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
El equilibrio ácido-base del organismo es posible merced a la interrelación de tres sistemas:
 ALTERACIONES DEL EQUILIBRIO ACIDO BÁSICO Dr.- Benito Saínz Menéndez (1) 1. INTRODUCCIÓN. Los procesos metabólicos intracelulares producen ácidos, es decir, sustancias capaces de liberar iones H+, por oxidación
ALTERACIONES DEL EQUILIBRIO ACIDO BÁSICO Dr.- Benito Saínz Menéndez (1) 1. INTRODUCCIÓN. Los procesos metabólicos intracelulares producen ácidos, es decir, sustancias capaces de liberar iones H+, por oxidación
Alteraciones del Equilibrio Ácido Base
 Alteraciones del Equilibrio Ácido Base Pedro Jiménez Santana Fuente: Dr. Aberman Equilibrio ácido base ph arterial VALOR NORMAL : 7.37 7.43 ACIDEMIA: < 7.37 ALCALEMIA: > 7.43 Equilibrio ácido base PaCO2
Alteraciones del Equilibrio Ácido Base Pedro Jiménez Santana Fuente: Dr. Aberman Equilibrio ácido base ph arterial VALOR NORMAL : 7.37 7.43 ACIDEMIA: < 7.37 ALCALEMIA: > 7.43 Equilibrio ácido base PaCO2
Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D.
 Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D. Vallejos Javier Serial Marcos Sebastián Rausch Ricardo Simón Laura Solé Juan
Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D. Vallejos Javier Serial Marcos Sebastián Rausch Ricardo Simón Laura Solé Juan
Trastornos del equilibrio ácido-base
 NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Prospecto: información para el usuario. Bicarbonato Sódico 1/6 M Braun solución para perfusión Hidrogenocarbonato de sodio
 Prospecto: información para el usuario Bicarbonato Sódico 1/6 M Braun solución para perfusión Hidrogenocarbonato de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve
Prospecto: información para el usuario Bicarbonato Sódico 1/6 M Braun solución para perfusión Hidrogenocarbonato de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica.
 capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
Ventilación Mecánica en el RN Cardiópata con Hiperflujo Pulmonar
 Ventilación Mecánica en el RN Cardiópata con Hiperflujo Pulmonar Dra. Ximena Alegría Palazón Profesor Adjunto Universidad de Valparaíso Unidad de Neonatología Hospital Carlos Van Buren VM Cardiopatías
Ventilación Mecánica en el RN Cardiópata con Hiperflujo Pulmonar Dra. Ximena Alegría Palazón Profesor Adjunto Universidad de Valparaíso Unidad de Neonatología Hospital Carlos Van Buren VM Cardiopatías
2.- Sistema renal: Instauración tardía (24-48 horas) y de acción más duradera. Los riñones regulan el bicarbonato plasmático mediante tres procesos:
 Santos Nores, Juan*; Borrajo Prol, María Paz*; Camba Caride, María Jesús* *Servicio de Nefrología INTRODUCCIÓN Y CONCEPTOS: El metabolismo normal produce constantemente radicales ácidos. Sin embargo, el
Santos Nores, Juan*; Borrajo Prol, María Paz*; Camba Caride, María Jesús* *Servicio de Nefrología INTRODUCCIÓN Y CONCEPTOS: El metabolismo normal produce constantemente radicales ácidos. Sin embargo, el
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Bicarbonato Sódico 1M Grifols Solución inyectable Hidrogenocarbonato de sodio
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Bicarbonato Sódico 1M Grifols Solución inyectable Hidrogenocarbonato de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Bicarbonato Sódico 1M Grifols Solución inyectable Hidrogenocarbonato de sodio Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Curso Superior de Medicina Intensiva y Cuidados Críticos Necochea, 2007-2009
 Trastornos del equilibrio ácido-base Introducción Las primeras definiciones contemporáneas de ácido y base pueden atribuirse a Arrhenius, quien en 1887 definió ácido como un donante de ion hidrógeno y
Trastornos del equilibrio ácido-base Introducción Las primeras definiciones contemporáneas de ácido y base pueden atribuirse a Arrhenius, quien en 1887 definió ácido como un donante de ion hidrógeno y
Lección 24. Fármacos Diuréticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS. Ricardo Brage e Isabel Trapero - Farmacología Lección 24
 Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
El Sistema Nervioso Autónomo en el Nativo de Altura
 El Sistema Nervioso Autónomo en el Nativo de Altura María Rivera-Ch 1, Marc J. Drinkhill 2, Roger Hainsworth 2 1 UPCH, 2 Universidad de Leeds Esquema de la presentación I. Poblaciones que viven en la altura
El Sistema Nervioso Autónomo en el Nativo de Altura María Rivera-Ch 1, Marc J. Drinkhill 2, Roger Hainsworth 2 1 UPCH, 2 Universidad de Leeds Esquema de la presentación I. Poblaciones que viven en la altura
Causa Parálisis Cerebral
 Asfixia Perinatal Dr. Jorge A. Carvajal Cabrera, Ph.D. Jefe Unidad de Medicina Materno Fetal Departamento de Obstetricia y Ginecología. Pontificia Universidad Católica de Chile Parálisis Cerebral Se define
Asfixia Perinatal Dr. Jorge A. Carvajal Cabrera, Ph.D. Jefe Unidad de Medicina Materno Fetal Departamento de Obstetricia y Ginecología. Pontificia Universidad Católica de Chile Parálisis Cerebral Se define
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. Bicarbonato Sódico 1M Grifols Solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bicarbonato Sódico 1M Grifols Solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml de solución contiene: Hidrogenocarbonato de sodio
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Bicarbonato Sódico 1M Grifols Solución inyectable 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ampolla de 10 ml de solución contiene: Hidrogenocarbonato de sodio
Nefrología y urología canina y felina
 Nefrología y urología canina y felina Nefrología y urología de pequeños animales Autor David J. Polzin, Joe Bartges Formato 20 x 28 cm Edición 1ª Paginas 936 Año 2013 Tapa Cartoné Ilustraciones Color Calificación:
Nefrología y urología canina y felina Nefrología y urología de pequeños animales Autor David J. Polzin, Joe Bartges Formato 20 x 28 cm Edición 1ª Paginas 936 Año 2013 Tapa Cartoné Ilustraciones Color Calificación:
DIARREA o SÍNDROME DIARREICO. Prof. MARCOS MOREIRA ESPINOZA INSTITUTO DE FARMACOLOGIA y MORFOFISIOLOGIA UNIVERSIDAD AUSTRAL DE CHILE
 DIARREA o SÍNDROME DIARREICO Prof. MARCOS MOREIRA ESPINOZA INSTITUTO DE FARMACOLOGIA y MORFOFISIOLOGIA UNIVERSIDAD AUSTRAL DE CHILE DIARREA O SINDROME DIARREICO DEFINICIÓN: EVACUACIÓN DE HECES LÍQUIDAS,
DIARREA o SÍNDROME DIARREICO Prof. MARCOS MOREIRA ESPINOZA INSTITUTO DE FARMACOLOGIA y MORFOFISIOLOGIA UNIVERSIDAD AUSTRAL DE CHILE DIARREA O SINDROME DIARREICO DEFINICIÓN: EVACUACIÓN DE HECES LÍQUIDAS,
ALTERACIONES DEL EQUILIBRIO ACIDO BÁSICO
 Rev Cubana Cir 2006; 45(1) ALTERACIONES DEL EQUILIBRIO ACIDO BÁSICO INTRODUCCIÓN Los procesos metabólicos intracelulares producen ácidos, es decir, sustancias capaces de liberar iones H+, por oxidación
Rev Cubana Cir 2006; 45(1) ALTERACIONES DEL EQUILIBRIO ACIDO BÁSICO INTRODUCCIÓN Los procesos metabólicos intracelulares producen ácidos, es decir, sustancias capaces de liberar iones H+, por oxidación
Terapia Líquida en Pediatría
 PROGRAMA DE EDUCACIÓN MEDICA CONTINUADA TERCER CURSO DE 1974-1975 LÍQUIDOS Y ELECTROLITOS EN LA PRACTICA MEDICA Terapia Líquida en Pediatría Dr. Francisco Cleaves T. La administración de líquidos parenterales
PROGRAMA DE EDUCACIÓN MEDICA CONTINUADA TERCER CURSO DE 1974-1975 LÍQUIDOS Y ELECTROLITOS EN LA PRACTICA MEDICA Terapia Líquida en Pediatría Dr. Francisco Cleaves T. La administración de líquidos parenterales
INSUFICIENCIA RESPIRATORIA AGUDA GIOVANNY CAMPOMANES ESPINOZA MEDICO INTERNISTA
 INSUFICIENCIA RESPIRATORIA AGUDA GIOVANNY CAMPOMANES ESPINOZA MEDICO INTERNISTA Zona de Conducción TRAQUEA BRONQUIOS BRONQUIOLOS BRONQUIOLOS TERMINALES Z O 1 2 3 4 5 16 Zona de Transición Y Respiratoria
INSUFICIENCIA RESPIRATORIA AGUDA GIOVANNY CAMPOMANES ESPINOZA MEDICO INTERNISTA Zona de Conducción TRAQUEA BRONQUIOS BRONQUIOLOS BRONQUIOLOS TERMINALES Z O 1 2 3 4 5 16 Zona de Transición Y Respiratoria
EPOC Manejo de las exacerbaciones agudas y graves. Dra. Miriam Barrales López.
 EPOC Manejo de las exacerbaciones agudas y graves Dra. Miriam Barrales López. Introducción. EPOC: enfermedad caracterizada por limitación al flujo aéreo que no es reversible en su totalidad. Esta limitación
EPOC Manejo de las exacerbaciones agudas y graves Dra. Miriam Barrales López. Introducción. EPOC: enfermedad caracterizada por limitación al flujo aéreo que no es reversible en su totalidad. Esta limitación
MEDICINA II. DR. EFRAIN ESTRADA CHOQUE, M.D. Lima, Perú GOMEZ LOPEZ JHAQUELINE PIEDRA RIOS CARLOS VARGA MORENO GUILLERMO. www.reeme.arizona.
 MEDICINA II DR. EFRAIN ESTRADA CHOQUE, M.D. Lima, Perú GOMEZ LOPEZ JHAQUELINE PIEDRA RIOS CARLOS VARGA MORENO GUILLERMO El anàlisis de gases arteriales es un procedimiento que tiene por finalidad: Evaluar
MEDICINA II DR. EFRAIN ESTRADA CHOQUE, M.D. Lima, Perú GOMEZ LOPEZ JHAQUELINE PIEDRA RIOS CARLOS VARGA MORENO GUILLERMO El anàlisis de gases arteriales es un procedimiento que tiene por finalidad: Evaluar
Práctica clínica. Interpretación de los resultados de los gases en sangre
 Práctica clínica Para interpretar los gases en sangre es necesaria la evaluación sistemática de la oxigenación, el ph, el bicarbonato estándar (shco3 ) y el exceso de bases, la presión parcial de anhídrido
Práctica clínica Para interpretar los gases en sangre es necesaria la evaluación sistemática de la oxigenación, el ph, el bicarbonato estándar (shco3 ) y el exceso de bases, la presión parcial de anhídrido
INSUFICIENCIA RENAL AGUDA
 INSUFICIENCIA RENAL AGUDA La insuficiencia renal aguda es un síndrome clínico que se produce por una reducción brusca de la filtración glomerular con retención progresiva de productos nitrogenados en sangre
INSUFICIENCIA RENAL AGUDA La insuficiencia renal aguda es un síndrome clínico que se produce por una reducción brusca de la filtración glomerular con retención progresiva de productos nitrogenados en sangre
Antihiperkalémico - Antihipermagnesémico. Composición. Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g. Excipientes:
 Antihiperkalémico - Antihipermagnesémico. Composición Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g Excipientes: 1 / 21 Sacarato de calcio agua para inyectables c.s. Proporciona: Calcio 0.465
Antihiperkalémico - Antihipermagnesémico. Composición Cada 10 ml de solución contiene: Gluconato de Calcio 1.0 g Excipientes: 1 / 21 Sacarato de calcio agua para inyectables c.s. Proporciona: Calcio 0.465
PROCEDIMIENTO DE OXIGENOTERAPIA PARA EL SERVICIO DE URGENCIAS
 PROCEDIMIENTO DE OXIGENOTERAPIA PARA EL SERVICIO DE URGENCIAS PO-URG-OTU-48 : 2 18/01/2013 PROCEDIMIENTO DE OXIGENOTERAPIA CONTROL DE CAMBIOS Fecha Descripción del Cambio 1 30/03/2012 Se actualiza documentación
PROCEDIMIENTO DE OXIGENOTERAPIA PARA EL SERVICIO DE URGENCIAS PO-URG-OTU-48 : 2 18/01/2013 PROCEDIMIENTO DE OXIGENOTERAPIA CONTROL DE CAMBIOS Fecha Descripción del Cambio 1 30/03/2012 Se actualiza documentación
1. El pericardio limita la dilatación brusca de las cavidades cardíacas que pudiera resultar de hipervolemia o de sobrecargas agudas
 Guía de Estudio de Fisiopatología Cardiovascular: Fisiopatología del pericardio (Sept 2011). Alumnos Mario Zanolli, Tamara Ventura, Valentina de Petris, Dr Jorge Jalil I. Defina: 1) Tamponamiento cardíaco
Guía de Estudio de Fisiopatología Cardiovascular: Fisiopatología del pericardio (Sept 2011). Alumnos Mario Zanolli, Tamara Ventura, Valentina de Petris, Dr Jorge Jalil I. Defina: 1) Tamponamiento cardíaco
Oliguria. Tema 25: Alteraciones de la cantidad y el ritmo urinario
 Tema 25: Alteraciones de la cantidad y el ritmo urinario Oliguria Poliuria Polaquiuria, disuria, tenesmo, estranguria Nicturia Síndromes de las vías urinarias Síndrome prostático Síndrome de infección
Tema 25: Alteraciones de la cantidad y el ritmo urinario Oliguria Poliuria Polaquiuria, disuria, tenesmo, estranguria Nicturia Síndromes de las vías urinarias Síndrome prostático Síndrome de infección
Desórdenes renales. Profa. Noemí Díaz Ruberté, MSN
 Desórdenes renales Profa. Noemí Díaz Ruberté, MSN 1 Glomerulonefritis posestreptococcica aguda Reacción inmunológica (antígeno-anticuerpo) a una infección del organismo que suele ser provocada por una
Desórdenes renales Profa. Noemí Díaz Ruberté, MSN 1 Glomerulonefritis posestreptococcica aguda Reacción inmunológica (antígeno-anticuerpo) a una infección del organismo que suele ser provocada por una
Tema 27: Elevación de urea y creatinina séricas
 Tema 7: Elevación de urea y séricas Origen y significado Concentraciones normales Estimación del filtrado glomerular Definición de insuficiencia renal Formas de insuficiencia renal Introducción al diagnóstico
Tema 7: Elevación de urea y séricas Origen y significado Concentraciones normales Estimación del filtrado glomerular Definición de insuficiencia renal Formas de insuficiencia renal Introducción al diagnóstico
Qué es la tensión arterial?
 Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
GenoROOT Monitor del Metabolismo
 Product 3 GenoROOT Monitor del Metabolismo Para bajar de peso, usualmente las personas optan por alguna de estas opciones: Quemar más calorías a través del ejercicio físico, y/o Reducir/Controlar el consumo
Product 3 GenoROOT Monitor del Metabolismo Para bajar de peso, usualmente las personas optan por alguna de estas opciones: Quemar más calorías a través del ejercicio físico, y/o Reducir/Controlar el consumo
ELABORACIÓN DE SOLUCION DE FUROSEMIDA 2 mg/ml
 ELABORACIÓN DE SOLUCION DE FUROSEMIDA 2 mg/ml Fórmula materia prima cantidad/ml cantidad/100 ml Furosemida Ph.Eur. 2 mg 200 mg Sodio metil paraben (Nipagín ) 0,68 mg 68 mg Sodio propil paraben (Nipasol
ELABORACIÓN DE SOLUCION DE FUROSEMIDA 2 mg/ml Fórmula materia prima cantidad/ml cantidad/100 ml Furosemida Ph.Eur. 2 mg 200 mg Sodio metil paraben (Nipagín ) 0,68 mg 68 mg Sodio propil paraben (Nipasol
INTRODUCCIÓN. Otras investigaciones mostraron que el incremento de la glicemia basal en ayunas en hipertiroideos fue más alta que en normales (4,5,6).
 INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
INTRODUCCIÓN La alteración en el metabolismo de la glucosa ha sido descrita en pacientes con hipertiroidismo; muchas investigaciones se han realizado al respecto, siendo sus resultados controversiales.
TEST APARATO RESPIRATORIO BIR 2015-2016
 1.- Cuál de los siguientes es el estímulo directo para las neuronas del área quimiosensible de la zona bulbar reguladora de la respiración?: 1. po 2. 2. pco 2. 3. CO 3 H 2. 4. CO 3 H -. 5. Concentración
1.- Cuál de los siguientes es el estímulo directo para las neuronas del área quimiosensible de la zona bulbar reguladora de la respiración?: 1. po 2. 2. pco 2. 3. CO 3 H 2. 4. CO 3 H -. 5. Concentración
Sistema renal. Odontología 2008
 Sistema renal Odontología 2008 Sistema renal Los riñones Si están bien perfundidos Mediante los mecanismos básicos: Filtración Reabsorción Secreción Regulan el medio interno Eliminan sustancias de deshecho
Sistema renal Odontología 2008 Sistema renal Los riñones Si están bien perfundidos Mediante los mecanismos básicos: Filtración Reabsorción Secreción Regulan el medio interno Eliminan sustancias de deshecho
ALCALOSIS RESPIRATORIA
 ALCALOSIS RESPIRATORIA El presente artículo es una actualización al mes de julio del 2006 del Capítulo del Dr. Carlos Lovesio, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos
ALCALOSIS RESPIRATORIA El presente artículo es una actualización al mes de julio del 2006 del Capítulo del Dr. Carlos Lovesio, del Libro Medicina Intensiva, Dr. Carlos Lovesio, Editorial El Ateneo, Buenos
Mujeres - De R00 a R99
 R00. Anormalidades del latido cardíaco R01. Soplos y otros sonidos cardíacos R02. Gangrena, no clasificada en otra R03. Lectura de presión sanguínea anormal, sin diagnóstico R04. Hemorragias de las vías
R00. Anormalidades del latido cardíaco R01. Soplos y otros sonidos cardíacos R02. Gangrena, no clasificada en otra R03. Lectura de presión sanguínea anormal, sin diagnóstico R04. Hemorragias de las vías
Balance ácido-base, más que. una fórmula y unos gases
 Balance ácido-base, más que B a l a n c e á c i d o - b a s e, m á s q u e una fórmula y unos gases u n a f ó r m u l a y u n o s g a s e s Jaime H. Galindo López, MD Pediatra Profesor Universidad del
Balance ácido-base, más que B a l a n c e á c i d o - b a s e, m á s q u e una fórmula y unos gases u n a f ó r m u l a y u n o s g a s e s Jaime H. Galindo López, MD Pediatra Profesor Universidad del
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COMPLEJO B COMPRIMIDOS RECUBIERTOS VITAMINA Página 1 COMPLEJO B Comprimidos Recubiertos Principio Activo Tiamina
Disfunción Diastólica y Geométrica Ventricular Izquierda en Pacientes con Preeclampsia Eclampsia. Apaza Coronel, Hector Williams.
 DISCUSION Durante el embarazo normal acontecen un gran número de cambios hemodinámicos, tales como un incremento en el volumen sanguíneo, volumen de stroke y frecuencia cardíaca, asimismo una disminución
DISCUSION Durante el embarazo normal acontecen un gran número de cambios hemodinámicos, tales como un incremento en el volumen sanguíneo, volumen de stroke y frecuencia cardíaca, asimismo una disminución
Análisis sistemático del equilibrio ácido-base en formato automatizado. Principios básicos y propuesta
 Trabajo de investigación Huerta Torrijos et al. Análisis sistemático del equilibrio ácido-base en formato automatizado Revista de la Asociación Mexicana de 69 pp 69-79 Vol. XV, Núm. 3 / May.-Jun. 2001
Trabajo de investigación Huerta Torrijos et al. Análisis sistemático del equilibrio ácido-base en formato automatizado Revista de la Asociación Mexicana de 69 pp 69-79 Vol. XV, Núm. 3 / May.-Jun. 2001
Ciclo Cardiaco -Guía de Estudio PARTE II - Presión arterial.
 Area de Fisiología Cardiovascular, Renal y Respiratoria. - 2016 - TRABAJO PRACTICO Nº 3 - CICLO CARDIACO II Ciclo Cardiaco -Guía de Estudio PARTE II - Presión arterial. I. Defina 1) Presión Sistólica 2)
Area de Fisiología Cardiovascular, Renal y Respiratoria. - 2016 - TRABAJO PRACTICO Nº 3 - CICLO CARDIACO II Ciclo Cardiaco -Guía de Estudio PARTE II - Presión arterial. I. Defina 1) Presión Sistólica 2)
Fisiología del evento ISQUEMIA / ANOXIA. Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira
 Fisiología del evento ISQUEMIA / ANOXIA Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira Porque cualquier miembro suelto, ya esté recubierto por piel o por carne,
Fisiología del evento ISQUEMIA / ANOXIA Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira Porque cualquier miembro suelto, ya esté recubierto por piel o por carne,
1. Es importante dejar de fumar? 2. Cuáles son los beneficios de dejar de fumar?
 1. Es importante dejar de fumar? Si, es muy importante. El consumo de tabaco es la mayor causa de muerte prevenible en nuestro país y en el mundo (o sea EVITABLE). Cada año, 40.000 argentinos mueren por
1. Es importante dejar de fumar? Si, es muy importante. El consumo de tabaco es la mayor causa de muerte prevenible en nuestro país y en el mundo (o sea EVITABLE). Cada año, 40.000 argentinos mueren por
Verónica Mate García Isabel Moreno Moraleda Gracia Guajardo-Fajardo Adriana Serrano Olave
 Verónica Mate García Isabel Moreno Moraleda Gracia Guajardo-Fajardo Adriana Serrano Olave Introducción Efectos del tabaco fumado Afectaciones por polución aérea Intoxicación por CO Intoxicación por oxígeno
Verónica Mate García Isabel Moreno Moraleda Gracia Guajardo-Fajardo Adriana Serrano Olave Introducción Efectos del tabaco fumado Afectaciones por polución aérea Intoxicación por CO Intoxicación por oxígeno
Dra. en Medicina. Prof. Reg. Adjunta Medicina. Coordinadora y Directora de la Carrera Médicos Especialistas en Endocrinología. UBA Jefa de División
 Prof. Dra. Graciela A. de Cross Dra. en Medicina. Prof. Reg. Adjunta Medicina. Coordinadora y Directora de la Carrera Médicos Especialistas en Endocrinología. UBA Jefa de División Endocrinología. Hospital
Prof. Dra. Graciela A. de Cross Dra. en Medicina. Prof. Reg. Adjunta Medicina. Coordinadora y Directora de la Carrera Médicos Especialistas en Endocrinología. UBA Jefa de División Endocrinología. Hospital
Aplicación y utilidad de las reglas de oro del bicarbonato
 El Residente REVISIÓN - OPINIÓN Aplicación y utilidad de las reglas de oro del bicarbonato Araceli Monserrath Reyes-Palomino,* Horacio Márquez-González,** Cleotilde Mireya Muñoz-Ramírez,* Lizeth Toledo-Gómez,*
El Residente REVISIÓN - OPINIÓN Aplicación y utilidad de las reglas de oro del bicarbonato Araceli Monserrath Reyes-Palomino,* Horacio Márquez-González,** Cleotilde Mireya Muñoz-Ramírez,* Lizeth Toledo-Gómez,*
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
CRITERIOS DE INGRESO Y EGRESO UPC ADULTOS
 CRITERIOS DE INGRESO Y EGRESO UPC DR: LUIS TISNE BROUSSE AÑO 2009 INDICE CRITERIOS DE INGRESOS A UPC 3 CRITERIOS DE INGRESO POR PRIORIZACIÓN 4 CRITERIOS DE INGRESO POR PATOLOGÍA ESPECIFICA 5 DESORDENES
CRITERIOS DE INGRESO Y EGRESO UPC DR: LUIS TISNE BROUSSE AÑO 2009 INDICE CRITERIOS DE INGRESOS A UPC 3 CRITERIOS DE INGRESO POR PRIORIZACIÓN 4 CRITERIOS DE INGRESO POR PATOLOGÍA ESPECIFICA 5 DESORDENES
Asma y embarazo. Dra. Hernández MR3 Dra. Omier MR2
 Asma y embarazo Dra. Hernández MR3 Dra. Omier MR2 Concepto Patología caracterizaada por inflamación crónica de la vía aérea, con respuesta incrementada a una variedad de estímulos y obstrucción que es
Asma y embarazo Dra. Hernández MR3 Dra. Omier MR2 Concepto Patología caracterizaada por inflamación crónica de la vía aérea, con respuesta incrementada a una variedad de estímulos y obstrucción que es
PROTOCOLO CRITERIOS DE INGRESOS Y EGRESOS A UNIDAD DE INTERMEDIO PEDIATRICO Y NEONATAL
 Página: - 1 de 12 PROTOCOLO CRITERIOS DE INGRESOS Y EGRESOS A UNIDAD DE INTERMEDIO PEDIATRICO Y NEONATAL UNIDAD DE CALIDAD Y SEGURIDAD DEL PACIENTE HOSPITAL DE SANTA CRUZ Página: - 2 de 12 1.- OBJETIVO
Página: - 1 de 12 PROTOCOLO CRITERIOS DE INGRESOS Y EGRESOS A UNIDAD DE INTERMEDIO PEDIATRICO Y NEONATAL UNIDAD DE CALIDAD Y SEGURIDAD DEL PACIENTE HOSPITAL DE SANTA CRUZ Página: - 2 de 12 1.- OBJETIVO
LIQUIDO CEFALORRAQUIDEO Y OTROS LIQUIDOS BIOLOGICOS
 LIQUIDO CEFALORRAQUIDEO Y OTROS LIQUIDOS BIOLOGICOS Marcelo Castillo Navarrete, TM MsC (c) Facultad de Medicina Dpto. Especialidades Médicas Carrera Tecnología Médica 20 de Abril de 2005 Meninges Líquido
LIQUIDO CEFALORRAQUIDEO Y OTROS LIQUIDOS BIOLOGICOS Marcelo Castillo Navarrete, TM MsC (c) Facultad de Medicina Dpto. Especialidades Médicas Carrera Tecnología Médica 20 de Abril de 2005 Meninges Líquido
Universidad Central Del Este U C E Facultad de Ciencias de la Salud Escuela de Medicina
 Universidad Central Del Este U C E Facultad de Ciencias de la Salud Escuela de Medicina MED-491 Nefrología Programa de la asignatura: Total de Créditos: 3 Teórico: 3 Práctico: 0 Prerrequisitos: MED-311
Universidad Central Del Este U C E Facultad de Ciencias de la Salud Escuela de Medicina MED-491 Nefrología Programa de la asignatura: Total de Créditos: 3 Teórico: 3 Práctico: 0 Prerrequisitos: MED-311
Concepto de ph. Bases
 Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
INSUFICIENCIA RESPIRATORIA AGUDA DIAGNÓSTICO DIFERENCIAL DRA. WILDA E. MEDINA ZAPATA R1 NEUMOLOGIA
 INSUFICIENCIA RESPIRATORIA AGUDA DIAGNÓSTICO DIFERENCIAL DRA. WILDA E. MEDINA ZAPATA R1 NEUMOLOGIA DEFINICIÓN ES EL FRACASO DEL APARATO RESPIRATORIO EN SU FUNCIÓN N DE INTERCAMBIO GASEOSO NECESARIO PARA
INSUFICIENCIA RESPIRATORIA AGUDA DIAGNÓSTICO DIFERENCIAL DRA. WILDA E. MEDINA ZAPATA R1 NEUMOLOGIA DEFINICIÓN ES EL FRACASO DEL APARATO RESPIRATORIO EN SU FUNCIÓN N DE INTERCAMBIO GASEOSO NECESARIO PARA
DESORDENES DEL POTASIO. Introducción
 DESORDENES DEL POTASIO Introducción El potasio es un catiòn intracelular, el 98% de las reservas corporales 3000 a 4000 meq están dentro de la célula a diferencia del sodio. La concentración plasmática
DESORDENES DEL POTASIO Introducción El potasio es un catiòn intracelular, el 98% de las reservas corporales 3000 a 4000 meq están dentro de la célula a diferencia del sodio. La concentración plasmática
Lo que debe conocerse de la gasometría durante la guardia
 TEMAS DE ACTUALIDAD 1 Horacio Márquez-González, 2 Jesús Pámanes-González, Horacio Márquez-Flores, 1 Alonso Gómez-Negrete, 4 Mireya C. Muñoz-Ramírez, 5 Antonio Rafael Villa-Romero 1 Hospital de Pediatría,
TEMAS DE ACTUALIDAD 1 Horacio Márquez-González, 2 Jesús Pámanes-González, Horacio Márquez-Flores, 1 Alonso Gómez-Negrete, 4 Mireya C. Muñoz-Ramírez, 5 Antonio Rafael Villa-Romero 1 Hospital de Pediatría,
Hipotensión en el Paciente Geriátrico. Dr. Ismenio Millán Aponte Universidad de Puerto Rico Recinto de Ciencias Medicas
 Hipotensión en el Paciente Geriátrico Dr. Ismenio Millán Aponte Universidad de Puerto Rico Recinto de Ciencias Medicas Hipotensión Ortostática w Reducción de >= 20 mm presión sistólica o >= 10 mm presión
Hipotensión en el Paciente Geriátrico Dr. Ismenio Millán Aponte Universidad de Puerto Rico Recinto de Ciencias Medicas Hipotensión Ortostática w Reducción de >= 20 mm presión sistólica o >= 10 mm presión
Día Mundial de la Trombosis DÍA MUNDIAL DE LA TROMBOSIS 13 DE OCTUBRE
 Día Mundial de la Trombosis Qué es la Trombosis? La TROMBOSIS es un coágulo sanguíneo que se forma en las arterias o venas y bloquea la llegada de sangre y oxígeno. Constituye el principal factor responsable
Día Mundial de la Trombosis Qué es la Trombosis? La TROMBOSIS es un coágulo sanguíneo que se forma en las arterias o venas y bloquea la llegada de sangre y oxígeno. Constituye el principal factor responsable
Nutrición n Mineral. Parte I
 Nutrición n Mineral Parte I Por qué usamos minerales en producción animal Funciones del organismo 1. Mantenimiento 2. Actividad 3. Crecimiento 4. Reproducción 5. Producción de leche Funciones de los Minerales
Nutrición n Mineral Parte I Por qué usamos minerales en producción animal Funciones del organismo 1. Mantenimiento 2. Actividad 3. Crecimiento 4. Reproducción 5. Producción de leche Funciones de los Minerales
EL APARATO URINARIO. 1. Patología. 2. Procedimientos relacionados TERESA ULLOA NEIRA ET 310
 EL APARATO URINARIO 1. Patología 2. Procedimientos relacionados TERESA ULLOA NEIRA ET 310 Hormonas implicadas en la formación de orina: H. ANTIDIURÉTICA (ADH): Regula la absorción y eliminación del agua
EL APARATO URINARIO 1. Patología 2. Procedimientos relacionados TERESA ULLOA NEIRA ET 310 Hormonas implicadas en la formación de orina: H. ANTIDIURÉTICA (ADH): Regula la absorción y eliminación del agua
SEMINARIO: ESTUDIO DEL PH FETAL INTRAPARTO
 Fecha: 1 de Diciembre de 2010 Nombre: Dra. Ana Fuentes Rozalén R2 Tipo de Sesión: Seminario SEMINARIO: ESTUDIO DEL PH FETAL INTRAPARTO El objetivo de este seminario es que entendamos la fisiopatología
Fecha: 1 de Diciembre de 2010 Nombre: Dra. Ana Fuentes Rozalén R2 Tipo de Sesión: Seminario SEMINARIO: ESTUDIO DEL PH FETAL INTRAPARTO El objetivo de este seminario es que entendamos la fisiopatología
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
10 de marzo del 2016
 10 de marzo del 2016 Qué es el Día Mundial del Riñón? El Día Mundial del Riñón es una campaña mundial dirigida a crear conciencia sobre la importancia de nuestros riñones. Pretende concientizar sobre la
10 de marzo del 2016 Qué es el Día Mundial del Riñón? El Día Mundial del Riñón es una campaña mundial dirigida a crear conciencia sobre la importancia de nuestros riñones. Pretende concientizar sobre la
FICHA TÉCNICA CORREO ELECTRÓNICO C/ CAMPEZO, 1 EDIFICIO MADRID.
 FICHA TÉCNICA CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO Potasio Grifols 10 meq/500 ml en Salina Fisiológica solución para perfusión 2. COMPOSICIÓN
FICHA TÉCNICA CORREO ELECTRÓNICO Sugerencias_ft@aemps.es C/ CAMPEZO, 1 EDIFICIO 8 28022 MADRID 1. NOMBRE DEL MEDICAMENTO Potasio Grifols 10 meq/500 ml en Salina Fisiológica solución para perfusión 2. COMPOSICIÓN
EQUILIBRIO ACIDO BASE
 EQUILIBRIO ACIDO BASE DR. EFRAIN ESTRADA CHOQUE, M.D. Lima, Perú EQUILIBRIO ACIDO BASE Es el mantenimiento de un nivel normal de la concentración n de iones hidrogeno (H+) en los fluidos del organismo.
EQUILIBRIO ACIDO BASE DR. EFRAIN ESTRADA CHOQUE, M.D. Lima, Perú EQUILIBRIO ACIDO BASE Es el mantenimiento de un nivel normal de la concentración n de iones hidrogeno (H+) en los fluidos del organismo.
Abordaje y Manejo del Paciente con Pancreatitis aguda. Luz Elena Flórez Rueda Cirujana General 2016
 Abordaje y Manejo del Paciente con Pancreatitis aguda Luz Elena Flórez Rueda Cirujana General 2016 Definición Proceso inflamatorio del páncreas, no bacteriano, agudo, produciendo lesión tisular con respuesta
Abordaje y Manejo del Paciente con Pancreatitis aguda Luz Elena Flórez Rueda Cirujana General 2016 Definición Proceso inflamatorio del páncreas, no bacteriano, agudo, produciendo lesión tisular con respuesta
Pruebas de función pulmonar. Diana Carolina Góngora
 Pruebas de función pulmonar Diana Carolina Góngora Definición Grupo de exámenes para medir la eficiencia de los pulmones para tomar y liberar aire, para movilizar gases, como el oxígeno, desde la atmósfera
Pruebas de función pulmonar Diana Carolina Góngora Definición Grupo de exámenes para medir la eficiencia de los pulmones para tomar y liberar aire, para movilizar gases, como el oxígeno, desde la atmósfera
MEDIO INTERNO HOMEOSTASIS. Estructura del medio interno. Se denomina asi al medio extracelular, el medio que rodea a las celulas
 MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
Concepto de ph. ph = - log [H + ]
![Concepto de ph. ph = - log [H + ] Concepto de ph. ph = - log [H + ]](/thumbs/39/19109627.jpg) Fuerza de Ácidos y Bases Concepto de ph Ácidos Los ácidos se diferencian de acuerdo a su capacidad para ceder protones al medio, o químicamente dicho, por su capacidad de disociación, esa también es la
Fuerza de Ácidos y Bases Concepto de ph Ácidos Los ácidos se diferencian de acuerdo a su capacidad para ceder protones al medio, o químicamente dicho, por su capacidad de disociación, esa también es la
HERIDAS, HEMORRAGIAS. ACTUACION ANTE EL SHOCK HEMORRAGICO
 HERIDAS, HEMORRAGIAS. ACTUACION ANTE EL SHOCK HEMORRAGICO HERIDAS Lesión n traumática tica de la piel o mucosas con solución n de continuidad. CLASIFICACIÓN N HERIDAS Según n el agente productor: Incisas.
HERIDAS, HEMORRAGIAS. ACTUACION ANTE EL SHOCK HEMORRAGICO HERIDAS Lesión n traumática tica de la piel o mucosas con solución n de continuidad. CLASIFICACIÓN N HERIDAS Según n el agente productor: Incisas.
Enfermedad Renal. Programa de Promoción y Educación en Salud. Rev. 2014 MP-HEP-PPT-726-01-020514-S
 Enfermedad Renal Programa de Promoción y Educación en Salud Rev. 2014 2014, MMM Healthcare, Inc. - PMC Medicare Choice, Inc. Se prohíbe la reproducción de este material. MP-HEP-PPT-726-01-020514-S M&P-PRD-TEM-030-032511-S
Enfermedad Renal Programa de Promoción y Educación en Salud Rev. 2014 2014, MMM Healthcare, Inc. - PMC Medicare Choice, Inc. Se prohíbe la reproducción de este material. MP-HEP-PPT-726-01-020514-S M&P-PRD-TEM-030-032511-S
