DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy Tel Fax
|
|
|
- Dolores Agüero Henríquez
- hace 6 años
- Vistas:
Transcripción
1 DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy Tel Fax Modificaciones: - Supresiones: 15.4; LIAISON Toxo IgG Avidity II (310790) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Toxo IgG Avidity II emplea la tecnología de la quimioluminiscencia (CLIA) en un ensayo inmunológico para la determinación de la avidez del enlace de anticuerpos específicos de clase IgG dirigidos contra el Toxoplasma gondii en muestras de suero o plasma humano. El ensayo debe realizarse en el instrumento LIAISON. 2. SUMARIO Y EXPLICACIÓN DEL TEST La toxoplasmosis es una enfermedad infecciosa de gran difusión causada por el parásito protozoario endocelular Toxoplasma gondii. La infección, que afecta tanto a los hombres como a los animales homeotermos, se puede contraer a través de la ingestión de alimentos infectados o contaminados con oocistos, por contagio directo de animales domésticos o por transmisión transplacentaria. En la literatura se habla también de la transmisión del Toxoplasma como consecuencia de transfusiones o trasplante de órganos. En el individuo adulto normal, la toxoplasmosis casi siempre tiene un proceso benigno: puede ser asintomática. Sólo excepcionalmente se manifiestan molestias más serias, tales como miocarditis, hepatitis, pneumonía, meningoencefalitis y retinocoroiditis. La protección de esta infección parasitaria depende generalmente de la inmunidad mediada por células. Por consiguiente, es más frecuente observar un proceso sintomático en los pacientes sometidos a terapia inmunosupresiva. La encefalitis por Toxoplasma se ha demostrado una importante causa de muerte en los pacientes afectados por el síndrome de inmunodeficiencia adquirida (SIDA). Si se adquiere durante la gestación, la toxoplasmosis puede causar graves consecuencias, tales como el aborto espontáneo, parto prematuro y mortalidad del feto, dado que el agente patógeno puede transmitirse al feto por vía transplacentaria. El feto cuya madre ha contraído la infección por Toxoplasma durante el primer trimestre de embarazo desarrolla graves lesiones en el sistema nervioso central que provocan casi siempre la muerte del feto. Si la infección se verifica durante el segundo trimestre de embarazo, el feto está expuesto a riesgos tales como la hidrocefalia, retardo mental o psicomotor, ceguera y calcificaciones cerebrales. Sin embargo la toxoplasmosis es común sobre todo en el tercer trimestre de embarazo, cuando causa retinocoroiditis y otras lesiones oculares, lesiones al sistema nervioso central e infección asintomática latente que puede dar origen a la enfermedad declarada. Los niveles de la IgG anti-toxoplasma aumentan gradualmente y alcanzan un máximo entre dos y cinco meses después de que aparezca la sintomatología clínica. Por lo tanto, el ensayo sérico de la IgG es útil para diferenciar a la población que ha contraído la enfermedad de la no inmune. Esto es particularmente importante para la adopción de medidas profilácticas adecuadas en las mujeres fértiles susceptibles. A causa de la variabilidad o de la ausencia de los síntomas, la detección de la toxoplasmosis durante el embarazo no debe basarse en los resultados clínicos, sino en la serología materna. En efecto es necesario conocer la duración de la toxoplasmosis materna con seguridad para establecer el riesgo de infección congénita sucesiva. Sin embargo, los ensayos convencionales en una sola muestra no permiten una distinción clara entre infección primaria e infección pasada. Además, la presencia de IgM en la circulación materna normalmente está asociada a infección reciente, pero la síntesis de estas inmunoglobulinas puede persistir durante un tiempo variable, a veces incluso largo. En particular, los resultados positivos para la IgM no son fáciles de interpretar, porque la IgM tiene la tendencia de persistir en circulación, también a niveles elevados, después de la infección primaria. Una solución para identificar las infecciones primarias de los cuadros clínicos debidos a reactivación o persistencia de la IgM puede ser la medición de la avidez del enlace entre IgG específica y antígeno. Efectivamente, la fuerza de la interacción entre el anticuerpo presente en una muestra y los diferentes epítopes de un antígeno multivalente (es decir, la avidez del enlace antígeno-anticuerpo) aumenta con la duración de la infección. El ensayo permite discriminar entre la IgG específica anti-toxoplasma gondii de elevada y baja avidez. La detección de anticuerpos IgG de avidez elevada en muestras positivas para IgM excluye la presencia de una infección primaria contraída menos de cuatro meses antes. 26 / 107 ES - 200/ , F - 03/2012
2 3. PRINCIPIO DEL ENSAYO El método para la determinación de la avidez del enlace de IgG específica anti-toxoplasma gondii es un ensayo indirecto basado en el principio de la quimioluminiscencia (CLIA). El antígeno del Toxoplasma gondii se emplea para recubrir las partículas magnéticas (fase sólida) y un anticuerpo monoclonal de ratón anti-igg humana está enlazado a un derivado del isoluminol (conjugado anticuerpo-isoluminol). La presencia de enlaces fuertes entre anticuerpos IgG y Toxoplasma gondii (es decir la avidez de la IgG) en una determinada muestra positiva para IgG se detecta comparando la señal de una muestra de referencia (es decir no tratada) con la señal de la misma muestra tratada con urea, que disocia los enlaces débiles entre IgG y Toxoplasma gondii. Durante la primera incubación, los anticuerpos anti-toxoplasma gondii presentes en los calibradores, en las muestras o en los controles enlazan la fase sólida (muestra de referencia y tratada). Durante la segunda incubación, el agente disociante modifica los enlaces entre antígeno y anticuerpo (sólo muestra tratada). Sólo los anticuerpos de alta avidez permanecen enlazados a la fase sólida, mientras que los anticuerpos de baja avidez son eliminados. Durante la última incubación, el anticuerpo conjugado reacciona con la IgG anti-toxoplasma gondii ya enlazada a la fase sólida (muestra de referencia y tratada). Después de cada incubación, el material no enlazado se elimina mediante un ciclo de lavado. A continuación, se añaden los reactivos starter que inducen una reacción de quimioluminiscencia. La señal luminosa, y por lo tanto la cantidad de conjugado anticuerpo-isoluminol, se mide con un fotomultiplicador en unidades relativas de luz (RLU, relative light units) e indica la concentración de IgG anti-toxoplasma gondii presente en los calibradores, en las muestras o en los controles. El índice de avidez del enlace de la IgG deriva de la relación entre muestra tratada con urea y muestra de referencia. 4. MATERIALES SUMINISTRADOS Integral de reactivos Partículas magnéticas (1,3 ml) Calibrador 1 (2,7 ml) Calibrador 2 (2,7 ml) Tampón B (3,5 ml) Diluyente de muestras (2 x 28 ml) Conjugado (28 ml) Partículas magnéticas recubiertas con Toxoplasma gondii inactivado (cepa RH), obtenido de trofozoítos sometidos a ultrasonidos y a extracción con detergentes, albúmina sérica bovina, tampón fosfato, < 0,1% azida sódica. Suero/plasma humano que contiene niveles bajos de IgG anti-toxoplasma gondii, albúmina sérica bovina, tampón fosfato, 0,2% ProClin 300 y un colorante amarillo inactivo. Suero/plasma humano que contiene niveles altos de IgG anti-toxoplasma gondii, albúmina sérica bovina, tampón fosfato, 0,2% ProClin 300 y un colorante azul inactivo. Tampón borato, urea, 0,2% ProClin 300, conservantes. Albúmina sérica bovina, tampón fosfato, 0,2% ProClin 300 y un colorante amarillo inactivo. Anticuerpos monoclonales de ratón anti-igg humana conjugados con un derivado del isoluminol, albúmina sérica bovina, tampón fosfato, 0,2% ProClin 300, conservantes. Número de ensayos 25 Todos los reactivos se suministran listos para su uso. El orden de los reactivos refleja el orden con el que se han ensamblado los contenedores en el integral de reactivos. Materiales requeridos, pero no suministrados Otros materiales requeridos LIAISON Module (código ). Controles LIAISON Toxo IgG Avidity II LIAISON Starter Kit (código ). (de baja y de alta avidez) (código ). LIAISON Light Check (código ). LIAISON Cleaning Kit (código ). LIAISON Wash/System Liquid (código ). LIAISON Waste Bags (código ). 5. ADVERTENCIAS Y PRECAUCIONES Sólo para uso diagnóstico in vitro. Todas las unidades de suero y plasma utilizadas para la fabricación de los componentes de este kit se han analizado y se han encontrado no reactivas para la presencia de HBsAg, anti-hcv, anti-hiv-1 y anti-hiv-2. Sin embargo, visto que ningún método de análisis puede asegurar que los agentes patógenos estén ausentes, todo el material de origen humano se deberá considerar potencialmente infeccioso y manipularlo como tal. 6. NORMAS DE SEGURIDAD No coma, beba, fume o se maquille durante la ejecución del ensayo. No pipetee las soluciones con la boca. Evite el contacto directo con el material potencialmente infeccioso usando batas de laboratorio, gafas de protección y guantes desechables. Lávese cuidadosamente las manos al terminar el ensayo. Evite salpicaduras o formación de aerosoles. En caso de que esto sucediera, cada gota de reactivo se debe eliminar con una solución de hipoclorito sódico al 5% y el medio utilizado se deberá tratar como material residuo potencialmente infeccioso. Todas las muestras, los reactivos biológicos del kit y los materiales usados para efectuar el ensayo se deben considerar capaces de transmitir agentes infecciosos; por lo tanto los residuos se deberán eliminar de acuerdo con las reglamentaciones de las agencias autorizadas que tengan jurisdicción sobre el laboratorio, y con las normativas de cada país. El material desechable deberá ser incinerado; los residuos líquidos deberán ser descontaminados con una solución de hipoclorito sódico a una concentración final del 5% durante media hora como mínimo. Cualquier material que pueda ser reutilizado deberá ser tratado en autoclave con un tratamiento de exceso (overkill) (USP 24, 2000, p. 2143). Generalmente se considera que una hora a 121 C es un tiempo de esterilización adecuado; sin embargo se recomienda a cada usuario que verifique la eficacia del ciclo de descontaminación mediante una validación inicial y el uso rutinario de indicadores biológicos. 27 / 107 ES - 200/ , F - 03/2012
3 Los reactivos que contienen ProClin 300 se clasifican como irritantes según las Directivas Europeas aplicables: R 43 - Posibilidad de sensibilización en contacto con la piel. S 24 - Evítese el contacto con la piel. S 37 - Úsense guantes adecuados. S 60 - Elimínense el producto y su recipiente como residuos peligrosos. 7. PREPARACIÓN DEL INTEGRAL DE REACTIVOS Antes de quitar la protección de los contenedores, es esencial agitar horizontalmente el integral de reactivos con delicadeza y sumo cuidado. Evite la formación de espuma. Elimine la protección de los contenedores y gire hacia adelante y hacia atrás la ruedecilla dentada situada por debajo del contenedor de las partículas magnéticas hasta que la suspensión adopte una coloración morena. Este procedimiento da inicio a la resuspensión de las partículas magnéticas. Seque con sumo cuidado la superficie de cada pared para eliminar el líquido residual. Coloque el integral de reactivos en el área de los reactivos del instrumento con la etiqueta de los códigos de barras situada a la izquierda y déjelo agitar durante 30 minutos antes del uso. Durante este tiempo las partículas magnéticas serán mantenidas en agitación automáticamente para garantizar una resuspensión completa. Hágase referencia al manual operativo del instrumento para cargar las muestras e iniciar el ensayo. 8. CONSERVACIÓN Y ESTABILIDAD DEL INTEGRAL DE REACTIVOS En el momento de su llegada, el integral de reactivos se debe mantener en posición vertical para facilitar la resuspensión de las partículas magnéticas. Si el integral se conserva sellado y se mantiene en posición vertical, los reactivos son estables a 2-8 C hasta la fecha de caducidad. No congele. El integral de reactivos no se debe usar pasada la fecha de caducidad indicada en las etiquetas del kit y del integral. Después de la eliminación de la protección, el integral de reactivos es estable durante cuatro semanas si se conserva refrigerado a 2-8 C o bien en el área de los reactivos del instrumento. 9. RECOGIDA Y PREPARACIÓN DE LAS MUESTRAS El ensayo se puede efectuar en muestras de suero o plasma humano. Se pueden utilizar anticoagulantes como el citrato, el EDTA y la heparina. Recoja la sangre mediante punción venosa, déjela coagular y separe el suero del coágulo lo antes posible. Clarifique por filtración o centrifugación antes del ensayo las muestras que presenten material en suspensión, opalescencia, lipemia o residuos eritrocitarios. No use muestras fuertemente hemolizadas o lipémicas, ni muestras que presenten material suspendido o evidente contaminación microbiana. Elimine las eventuales burbujas de aire que pueda haber antes del ensayo. Si el ensayo se lleva a cabo dentro de los siete días sucesivos a la recogida, las muestras se pueden conservar a 2-8 C. En caso contrario, se deben subdividir en alícuotas congeladas a 20 C o a temperaturas inferiores. Si las muestras han sido descongeladas, agítelas con cuidado antes de realizar el ensayo. Cuatro muestras de diferente reactividad se han conservado durante siete días a 2-8 C y se han sometido a cuatro ciclos de congelación y descongelación. Los resultados no han presentado diferencias significativas. El volumen mínimo de muestra necesario es 180 μl (30 μl de muestra μl de volumen muerto). Sólo las muestras positivas para IgG anti-toxoplasma gondii con LIAISON pueden ser analizadas para la avidez del enlace de la IgG. 10. CALIBRACIÓN El ensayo de los calibradores contenidos en el integral de reactivos permite ajustar la curva predefinida memorizada por el fabricante (curva patrón) en el instrumento como se indica en los códigos de barras que aparecen en la etiqueta del integral de reactivos. El instrumento se debe calibrar en triplicado cada vez que se verifique una de las siguientes condiciones: Se usa un nuevo lote de integral de reactivos o un nuevo lote de reactivos starter. La calibración anterior fue realizada más de dos semanas antes. El instrumento ha sufrido una intervención de asistencia técnica. Los valores de los controles están fuera de los rangos esperados. 11. PROCEDIMIENTO OPERATIVO Para obtener unas prestaciones analíticas ideales hay que respetar estrictamente las instrucciones del manual operativo del instrumento. Cada parámetro del test es identificado mediante el código de barras en la etiqueta del integral de reactivos. En caso de que el lector del código de barras no funcione correctamente, se deberán introducir manualmente los datos convenientes. Hágase referencia al manual operativo del instrumento para una información más detallada. Las muestras se analizan con ambos protocolos para obtener el resultado final (índice de avidez). El instrumento realiza las operaciones siguientes: Protocolo A 1. Distribuye calibradores, controles o muestras en el módulo de reacción. 2. Distribuye las partículas magnéticas recubiertas. 3. Distribuye el diluyente de muestras. 4. Incuba. 5. Lava con el líquido de lavado. 6. Distribuye el conjugado en el módulo de reacción. 7. Incuba. 8. Lava con el líquido de lavado. 9. Añade los reactivos starter 1 y 2 y mide la luz emitida. 28 / 107 ES - 200/ , F - 03/2012
4 Protocolo B 1. Distribuye controles o muestras en el módulo de reacción (la calibración no está realizada). 2. Distribuye las partículas magnéticas recubiertas. 3. Distribuye el diluyente de muestras. 4. Incuba. 5. Lava con el líquido de lavado. 6. Distribuye el tampón B. 7. Incuba. 8. Lava con el líquido de lavado. 9. Distribuye el conjugado en el módulo de reacción. 10. Incuba. 11. Lava con el líquido de lavado. 12. Añade los reactivos starter 1 y 2 y mide la luz emitida. 12. CONTROL DE CALIDAD El control de calidad se debe realizar (a) por lo menos una vez por cada día de trabajo, (b) cuando se usa un nuevo integral de reactivos, (c) cuando se calibra el kit, o según las disposiciones legislativas y las reglamentaciones vigentes en cada país. Los controles LIAISON se deben analizar individualmente para evaluar las prestaciones del test. Los valores de los controles tienen que estar comprendidos entre los rangos esperados: cada vez que los valores estén fuera de los rangos esperados habrá que volver a efectuar la calibración y probar de nuevo los controles. Si los valores experimentales de los controles estén de nuevo fuera de los rangos predefinidos después de la calibración, habrá que repetir el test usando un frasco de control no abierto. Si los valores de los controles estén fuera de los rangos esperados, los resultados no deben ser notificados. Las prestaciones de otros controles se deben evaluar para asegurar su compatibilidad con este test antes del uso. Por lo tanto es indispensable establecer los intervalos de los valores de los materiales usados para el control de calidad. 13. INTERPRETACIÓN DE LOS RESULTADOS El instrumento calcula automáticamente el índice de avidez de enlace de la IgG específica anti-toxoplasma gondii (relación de la muestra tratada con urea respecto a la muestra de referencia) y clasifica los resultados. Hágase referencia al manual operativo del instrumento para una información más detallada. Hay que interpretar con atención los resultados de las muestras con concentraciones de IgG anti-toxoplasma gondii por debajo de 15 UI/mL con LIAISON. Se aconseja analizar las muestras tomadas en sucesión al menos dos o tres semanas más tarde para establecer si los niveles de anticuerpos y el índice de avidez aumentan o disminuyen. Intervalo de medición. 0-1,00 de índice de avidez Liaison (Av) de la IgG anti-toxoplasma gondii. Las muestras que contengan concentraciones de IgG anti-toxoplasma gondii superiores al intervalo de medición con LIAISON deben ser pre-diluidas mediante la función Dilute del instrumento antes de realizar el test Toxo IgG Avidity. El factor de dilución aconsejado es 1:10. Si las muestras diluidas 1:10 están todavía por encima del intervalo de medición del test para la avidez, se visualizará el mensaje Invalid Combi Partner (es decir, cálculo imposible); habrá que pre-diluir las muestras 1:20 y repetir el test Toxo IgG Avidity. Las muestras que contengan concentraciones de IgG anti-toxoplasma gondii comprendidas en el intervalo de medición se pueden analizar directamente. Si las muestras presentan niveles por encima del intervalo de medición del test Toxo IgG Avidity, se visualizará el mensaje Invalid Combi Partner (es decir cálculo imposible); las muestras deberán ser pre-diluidas 1:10 y analizadas de nuevo. Los resultados se multiplicarán automáticamente por el factor de dilución para obtener los niveles de anticuerpos de las muestras no diluidas y calcular el índice de avidez. El diluyente de muestras disponible en exceso en el integral de reactivos permite realizar la pre-dilución de 25 muestras. Los resultados de las muestras deben ser interpretados como sigue: Un valor de índice de avidez Liaison de la IgG anti-toxoplasma gondii por debajo de 0,30 se debe clasificar avidez baja. Un valor de índice de avidez Liaison de la IgG anti-toxoplasma gondii comprendido entre 0,30 y 0,40 se debe clasificar avidez moderada. Un valor de índice de avidez Liaison de la IgG anti-toxoplasma gondii igual o por encima de 0,40 se debe clasificar avidez elevada. Las muestras con índice de avidez por encima de 0,950 deben analizarse de nuevo. Si el valor de índice de avidez se confirma, se debe clasificar avidez elevada. Un valor de índice de avidez bajo sugiere la posibilidad de una infección primaria contraída menos de cuatro meses antes. Atención - Sin embargo, un valor de índice de avidez bajo no excluye una infección pasada, ya que una parte de las personas infectadas pueden presentar la persistencia de anticuerpos de clase IgG de baja avidez. Un valor de índice de avidez moderado no excluye la posibilidad de una infección reciente, pero puede indicar una infección pasada con maduración no completa de la avidez de la IgG. Un valor de índice de avidez Liaison por debajo de 0,40 no aporta una indicación clara de infección reciente. Un valor de índice de avidez elevado puede excluir que la infección primaria se haya contraído menos de cuatro meses antes. Los datos serológicos provenientes de la detección de otros marcadores de Toxoplasma gondii pueden aportar informaciones útiles para la interpretación de los resultados. Sin embargo, el diagnóstico de una enfermedad infecciosa no se debe formular en base al resultado de un solo ensayo, sino que éste se debe validar con otras pruebas clínicas, procedimientos diagnósticos y con la opinión del médico. 14. LIMITACIONES DEL ENSAYO Cuando se repite el test de muestras con valores de índice de avidez cerca del umbral de discriminación (0,30 e 0,40 IA), pueden observarse fluctuaciones en la clasificación de las muestras, que dependen de la precisión del sistema. Éste es un comportamiento previsto que no afecta las prestaciones metodológicas del kit. Para obtener resultados fiables es necesario atenerse estrictamente a las instrucciones de utilización y poseer una adecuada técnica manual. La contaminación bacteriana de las muestras o la inactivación mediante calentamiento pueden modificar los resultados del análisis. 29 / 107 ES - 200/ , F - 03/2012
5 15. PRESTACIONES METODOLÓGICAS DEL KIT Especificidad analítica Interferencias. Estudios controlados sobre los factores potencialmente interferentes han demostrado que las prestaciones del test no están influenciadas por anticoagulantes (citrato sódico, EDTA, heparina), hemolisis (hasta 500 mg/dl de hemoglobina), lipemia (hasta 3000 mg/dl de triglicéridos), bilirrubinemia (hasta 20 mg/dl de bilirrubina) o por los ciclos de congelación y descongelación de las muestras Precisión La repetibilidad y la reproducibilidad del ensayo (es decir las variaciones intra-ensayo e inter-ensayo) han sido determinadas utilizando las muestras de referencia en diferentes concentraciones de analito. La variabilidad observada no ha dado lugar a una clasificación errónea de las muestras. Los resultados se refieren a los grupos de pacientes tomados en consideración; no se trata de prestaciones garantizadas porque pueden existir diferencias entre los diferentes laboratorios. Repetibilidad. Para evaluar la repetibilidad se han analizado veinte replicados en la misma sesión analítica. Repetibilidad A B C D E Número de determinaciones Índice de avidez medio 0,091 0,101 0,181 0,361 0,432 Valor mínimo 0,079 0,086 0,145 0,320 0,353 Valor máximo 0,111 0,126 0,240 0,418 0,521 Coeficiente de variación (%) 8,5 10,5 14,5 6,9 8,80 Reproducibilidad. Para evaluar la reproducibilidad se han analizado veinte replicados en días diferentes (una o dos sesiones analíticas al día). Los ensayos se realizaron en dos sitios, en el laboratorio donde se desarrolló el kit (sitio 1) y en un laboratorio independiente (sitio 2). Reproducibilidad SITIO 1 SITIO 2 F G H I J F H I Número de determinaciones Índice de avidez medio 0,132 0,385 0,477 0,555 0,199 0,133 0,493 0,569 Valor mínimo 0,101 0,340 0,354 0,483 0,140 0,086 0,414 0,449 Valor máximo 0,182 0,455 0,554 0,640 0,264 0,179 0,628 0,710 Coeficiente de variación (%) 19,8 6,8 9,5 7,8 16,1 18,7 11,6 12, Veracidad La veracidad del ensayo ha sido controlada mediante el test de dilución. Test de dilución. Se han analizado diluciones en serie de cuatro sueros de concentración elevada de IgG anti-toxoplasma gondii tanto de alta como de baja avidez realizadas con el diluyente de muestras. Los valores de índice de avidez de la IgG anti-toxoplasma gondii medidos antes y después de la dilución de las muestras no han puesto de relieve discrepancias en la clasificación de las muestras. Avidez Dilución Índice de avidez medido % Coeficiente de variación Avidez Dilución Índice de avidez medido % Coeficiente de variación 1:2 0,495 1:2 0,525 Elevada 1:4 0,538 11,3 Elevada 1:4 0,515 5,1 1:8 0,576 1:8 0,519 1:16 0,583 1:16 0,585 1:4 0,146 1:2 0,139 1:8 0,226 1:4 0,109 1:16 0,176 1:8 0,116 Baja 1:32 0,148 19,0 Baja 1:16 0,081 17,9 1:64 0,158 1:32 0,108 1:128 0,170 1:64 0,106 1:256 0,176 1:128 0,110 1:256 0, / 107 ES - 200/ , F - 03/2012
6 15.4. Datos clínicos Se han analizado 135 muestras provenientes de diversas poblaciones positivas para IgG anti-toxoplasma gondii (pacientes afectados por infección primaria por Toxoplasma gondii, sujetos con infección pasada por Toxoplasma gondii, sujetos afectados por infección pasada por Toxoplasma gondii y con persistencia de la IgM anti-toxoplasma gondii). Los resultados del ensayo se han definido tomando en consideración los resultados obtenidos con el método de referencia y la concordancia con la clasificación clínica del paciente por parte del encargado de la validación. La clasificación clínica y el seguimiento del paciente, cuando estuvo disponible, así como también el ensayo de otros marcadores de Toxoplasma gondii, se han utilizado para validar el resultado clínico. En la población estudiada, que ha probablemente contraído la infección menos de cuatro meses antes, ninguna muestra ha resultado de avidez elevada, una muestra ha resultado de avidez moderada y 59 muestras han resultado de avidez baja. La concordancia diagnóstica, evaluada respecto a la condición clínica, ha sido de 100% (intervalo de confianza al 95%: 94,04-100%). En la población estudiada, que ha contraído la infección más de cuatro meses antes, 2 muestras han resultado de avidez baja, 2 muestras han resultado de avidez moderada y 71 muestras han resultado de avidez elevada. La concordancia diagnóstica, evaluada respecto a la condición clínica, ha sido de 94,67% (intervalo de confianza al 95%: 86,90-98,53%). Los resultados obtenidos son los siguientes: Condición clínica Avidez Liaison Toxo IgG avidity Método de referencia Elevada 0 0 Infección primaria por Toxoplasma y seguimiento Moderada 1 0 Baja Infección pasada por Toxoplasma Elevada con persistencia de la IgM Moderada 1 2 Baja 2 0 Elevada Infección pasada por Toxoplasma Moderada 1 2 Baja / 107 ES - 200/ , F - 03/2012
7 LIAISON Control Toxo IgG Avidity II (310791) 1. Finalidad del ensayo. Los controles LIAISON Control Toxo IgG Avidity II (310791) deben ser usados en el ensayo de quimioluminiscencia (CLIA) LIAISON para verificar la fiabilidad de los ensayos. Las prestaciones metodológicas de los controles LIAISON no son definidas con otros ensayos o instrumentos automáticos. 2. Materiales suministrados Control de baja avidez (2 x 0,6 ml) Control de alta avidez (2 x 0,6 ml) Suero/plasma humano que contiene IgG anti-toxoplasma gondii con baja avidez, estabilizado en tampón PBS, albúmina sérica bovina y 0,2% ProClin 300. Suero/plasma humano que contiene IgG anti-toxoplasma gondii con alta avidez, estabilizado en tampón PBS, albúmina sérica bovina, 0,2% ProClin 300 y un colorante amarillo inactivo. Todos los reactivos se suministran listos para su uso. El intervalo de índice de avidez para cada control está impreso en el certificado de análisis e indica los límites definidos por DiaSorin para los valores de los controles obtenidos con test fiables. Cada laboratorio es responsable de adoptar límites diferentes para cumplir exigencias específicas. Los controles no son específicos para lote de kit. Se pueden intercambiar entre sí aunque pertenezcan a lotes diferentes. 3. Conservación y estabilidad. En el momento de su llegada, los controles se deben mantener a 2-8 C en posición vertical para evitar el contacto de la solución con la tapa del frasco. No congele. Si los controles se conservan sellados y en posición vertical, ellos son estables a 2-8 C hasta la fecha de caducidad. Después de la apertura, los controles son estables durante cuatro semanas si se conservan refrigerados a 2-8 C entre dos usos sucesivos. Evite la contaminación bacteriana de los controles. Los controles no se deben usar pasada la fecha de caducidad indicada en las etiquetas de los frascos. En el momento del uso, acondicione los controles a temperatura ambiente (20-25 C) antes de la apertura de los frascos y déjelos en el área de las muestras del instrumento sólo durante el tiempo requerido para realizar el test de control de calidad. Después del uso, tape los frascos lo antes posible y manténgalos a 2-8 C en posición vertical. El volumen muerto es 400 μl. Toxo-Av2-es.fm LIAISON Control Toxo IgG Avidity II (310791) 32 / 107 ES - 200/ , F - 03/2012
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON HSV-1/2 IgG (REF )
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 11; Supresiones: - LIAISON HSV-1/2 IgG (REF 310800) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 11; Supresiones: - LIAISON HSV-1/2 IgG (REF 310800) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON Toxo IgM (REF )
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: - Supresiones: 4; LIAISON Toxo IgM (REF 310710) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Toxo IgM emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: - Supresiones: 4; LIAISON Toxo IgM (REF 310710) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Toxo IgM emplea
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy LIAISON HAV IgM (310180)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON HAV IgM (310180) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HAV IgM emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON HAV IgM (310180) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HAV IgM emplea
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON Anti-HBc (310130)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 13, 15.6; Supresiones: - LIAISON Anti-HBc (310130) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Anti-HBc
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 13, 15.6; Supresiones: - LIAISON Anti-HBc (310130) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Anti-HBc
LIAISON VZV IgG (310850)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON VZV IgG (310850) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON VZV IgG emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON VZV IgG (310850) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON VZV IgG emplea
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy LIAISON Anti-HBs (310120), Anti-HBs Plus (310190)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Anti-HBs (310120), Anti-HBs Plus (310190) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Anti-HBs (310120), Anti-HBs Plus (310190) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy LIAISON Anti-HBs II (310220), Anti-HBs II Plus (310230)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com LIAISON Anti-HBs II (310220), Anti-HBs II Plus (310230) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Anti-HBs II emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com LIAISON Anti-HBs II (310220), Anti-HBs II Plus (310230) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Anti-HBs II emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com. LIAISON HSV-1/2 IgM (REF 310820)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON HSV-1/2 IgM (REF 310820) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON HSV-1/2 IgM (REF 310820) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - ITALY Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa del antígeno CA 15-3
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa del antígeno CA 15-3
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - ITALY Modificaciones: 11 Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: 11 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa del antígeno CA
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: 11 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa del antígeno CA
LIAISON DHEA-S (310430)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy Tel. 39.0161.487.093 - Fax 39.0161.487.628 Atención a las modificaciones! LIAISON DHEA-S (310430) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy Tel. 39.0161.487.093 - Fax 39.0161.487.628 Atención a las modificaciones! LIAISON DHEA-S (310430) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - ITALY Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO La prueba in vitro para la determinación cuantitativa de ferritina
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO La prueba in vitro para la determinación cuantitativa de ferritina
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy LIAISON XL HIV Ab / Ag (310260)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Modificaciones: 4 Supresiones: LIAISON XL HIV Ab / Ag (310260) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON XL MUREX
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Modificaciones: 4 Supresiones: LIAISON XL HIV Ab / Ag (310260) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON XL MUREX
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - ITALY Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de la hormona
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de la hormona
4. MATERIALES SUMINISTRADOS El orden de los reactivos refleja el orden con el que se han ensamblado los contenedores en el integral de reactivos.
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: LIAISON Insulin ([REF] 310360) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Insulin emplea la
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: LIAISON Insulin ([REF] 310360) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Insulin emplea la
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4, 10, 11, Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4, 10, 11 Supresiones: 10
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11 Supresiones: 10 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11 Supresiones: 10 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italia Modificaciones: Supresiones: LIAISON CMV IgG II (310745)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italia www.diasorin.com Modificaciones: Supresiones: LIAISON CMV IgG II (310745) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgG II emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italia www.diasorin.com Modificaciones: Supresiones: LIAISON CMV IgG II (310745) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgG II emplea
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON XL HBsAg Quant (REF )
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 13; 15.4; Supresiones: 13; LIAISON XL HBsAg Quant (REF 310250) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 13; 15.4; Supresiones: 13; LIAISON XL HBsAg Quant (REF 310250) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de péptido C en
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de péptido C en
DiaSorin Deutschland GmbH Von-Hevesy-Str. 3, Dietzenbach - GERMANY Modificaciones: 4, 11, 12, 15.
 DiaSorin Deutschland GmbH Von-Hevesy-Str. 3, 63128 Dietzenbach - GERMANY www.diasorin.com 0197 Modificaciones: 4, 11, 12, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación
DiaSorin Deutschland GmbH Von-Hevesy-Str. 3, 63128 Dietzenbach - GERMANY www.diasorin.com 0197 Modificaciones: 4, 11, 12, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4, 11; Supresiones: -
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON CMV IgM II (REF 310755) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgM
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON CMV IgM II (REF 310755) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgM
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com. LIAISON Treponema Screen (310840)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Treponema Screen (310840) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Treponema
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Treponema Screen (310840) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Treponema
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4,10,11,15.9 Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4,10,11,15.9 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4,10,11,15.9 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - ITALY Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de prolactina
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de prolactina
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Tel LIAISON Anti-HBc ([REF] )
![DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Tel LIAISON Anti-HBc ([REF] ) DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Tel LIAISON Anti-HBc ([REF] )](/thumbs/74/70961420.jpg) DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Tel. +39.0161.4871 Modificaciones: - Supresiones: 4; LIAISON Anti-HBc ([REF] 310130) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Tel. +39.0161.4871 Modificaciones: - Supresiones: 4; LIAISON Anti-HBc ([REF] 310130) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com. Modificaciones: 11 Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: 11 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa de alfafetoproteína
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: 11 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa de alfafetoproteína
ScanGel ReverScan A1, B x 5 ml ReverScan A1, A2, B, O x 5 ml
 ScanGel ReverScan A1, B 86790 2 x 5 ml ReverScan A1, A2, B, O 86795 4 x 5 ml GLÓBULOS ROJOS TEST DE ORIGEN HUMANO PARA LA PRUEBA SÉRICA DEL TIPAJE ABO IVD Todos los productos fabricados y comercializados
ScanGel ReverScan A1, B 86790 2 x 5 ml ReverScan A1, A2, B, O 86795 4 x 5 ml GLÓBULOS ROJOS TEST DE ORIGEN HUMANO PARA LA PRUEBA SÉRICA DEL TIPAJE ABO IVD Todos los productos fabricados y comercializados
1. FINALIDAD DEL ENSAYO
 DiaSorin, Inc 1951 Northwestern Ave Stillwater, MN 55082 EE.UU Tel. +1.651.439.9710 Fax +1.651.351.5669 Preste atención a los cambios! LIAISON HSV-1 Type Specific IgG (310830) 1. FINALIDAD L ENSAYO DiaSorin
DiaSorin, Inc 1951 Northwestern Ave Stillwater, MN 55082 EE.UU Tel. +1.651.439.9710 Fax +1.651.351.5669 Preste atención a los cambios! LIAISON HSV-1 Type Specific IgG (310830) 1. FINALIDAD L ENSAYO DiaSorin
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN EE.UU. Tel Fax
 DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 EE.UU. Tel 1.651.439.9710 Fax 1.651.351.5669 Preste atención a los cambios! LIAISON Progesterone (310420) 1. INDICACIONES El ensayo LIAISON Progesterone
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 EE.UU. Tel 1.651.439.9710 Fax 1.651.351.5669 Preste atención a los cambios! LIAISON Progesterone (310420) 1. INDICACIONES El ensayo LIAISON Progesterone
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com. Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación de tiroglobulina humana (htg)
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación de tiroglobulina humana (htg)
HBsAg CONFIRMATORY TEST INTERÉS CLÍNICO
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS. INTERÉS CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
WITNESS RELAXIN (plasma, serum) RLX RLX u d 9 n n ersio V X RLX L R -W IO B S
 WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
Examen de laboratorio: Chagas. Obtención de sangre Cantidad Características Conservación Procesa miento En capilares Heparinizados.
 Examen de laboratorio: Chagas Examen de laboratorio Microconcentra ción en Micrométodo en tubo centración Strout ELISA IFI HAI Tipo de muestra venosa o Venosa Suero o plasma sanguíneo Obtención de sangre
Examen de laboratorio: Chagas Examen de laboratorio Microconcentra ción en Micrométodo en tubo centración Strout ELISA IFI HAI Tipo de muestra venosa o Venosa Suero o plasma sanguíneo Obtención de sangre
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE
 VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
Instrucciones para el uso 10/2009. ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße Mainz Tel.: Fax:
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Instrucciones para el uso 10/2009 1/8 alegria-0910-04-e ÍNDICE DESCRIPCIÓN BREVE... 3 METODOLOGÍA... 3 INDICACIONES
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Instrucciones para el uso 10/2009 1/8 alegria-0910-04-e ÍNDICE DESCRIPCIÓN BREVE... 3 METODOLOGÍA... 3 INDICACIONES
Positive Control (ORG ) Negative Control (ORG ) Instrucciones para el uso 10/2009
 ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
ORGENTEC Diagnostika GmbH Carl-Zeiss-Straße 49 55129 Mainz Tel.: 06131-9258-0 Fax: 06131-9258-58 Positive Control (ORG 310-24) Negative Control (ORG 311-24) Instrucciones para el uso 10/2009 1/7 alegria-control-0910-04-es
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 USA Tel. +1.651.439.9710 Fax +1.651.351.5669
 DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 USA Tel. +1.651.439.9710 Fax +1.651.351.5669 Ensayo LIAISON N-TACT PTH (310910) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON N-TACT PTH emplea la tecnología
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 USA Tel. +1.651.439.9710 Fax +1.651.351.5669 Ensayo LIAISON N-TACT PTH (310910) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON N-TACT PTH emplea la tecnología
ScanGel ScanCell P x 10 ml
 ScanGel ScanCell P 86596 3 x 10 ml GLÓBULOS ROJOS TEST DE ORIGEN HUMANO PRETRATADOS CON PAPAÍNA PARA LA DETECCIÓN DE LOS ANTICUERPOS IRREGULARES ANTIERITROCITARIOS IVD Todos los productos fabricados y
ScanGel ScanCell P 86596 3 x 10 ml GLÓBULOS ROJOS TEST DE ORIGEN HUMANO PRETRATADOS CON PAPAÍNA PARA LA DETECCIÓN DE LOS ANTICUERPOS IRREGULARES ANTIERITROCITARIOS IVD Todos los productos fabricados y
LIAISON Cortisol (REF )
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy Tel. +39.0161.487.093 Fax +39.0161.487.628 Exclusivamente para uso profesional! Modificaciones: 10, 13 Supresiones: LIAISON Cortisol (REF
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy Tel. +39.0161.487.093 Fax +39.0161.487.628 Exclusivamente para uso profesional! Modificaciones: 10, 13 Supresiones: LIAISON Cortisol (REF
Hoja de protocolo del instrumento QIAsymphony SP
 Hoja de protocolo del instrumento QIAsymphony SP Protocolo DNA_Blood_200_V7_DSP Información general Para uso en diagnóstico in vitro. Este protocolo está indicado para la purificación de ADN mitocondrial
Hoja de protocolo del instrumento QIAsymphony SP Protocolo DNA_Blood_200_V7_DSP Información general Para uso en diagnóstico in vitro. Este protocolo está indicado para la purificación de ADN mitocondrial
Programa Formativo. Objetivos. Código: Curso: Hematología y Hemoterapia. Duración: 70h.
 Código: 40657 Curso: Hematología y Hemoterapia Modalidad: ONLINE Duración: 70h. Objetivos La sangre es un tejido líquido que circula permanentemente por el sistema vascular y está formado por vasos sanguíneos
Código: 40657 Curso: Hematología y Hemoterapia Modalidad: ONLINE Duración: 70h. Objetivos La sangre es un tejido líquido que circula permanentemente por el sistema vascular y está formado por vasos sanguíneos
Universidad Central Del Este UCE Facultad de Ciencias de la Salud Escuela de Bioanálisis
 Universidad Central Del Este UCE Facultad de Ciencias de la Salud Escuela de Bioanálisis Programa de la Asignatura: (BIA-101) Serología Clínica Total de Créditos: 1 Teoría: 0 Practica: 2 Prerrequisitos:
Universidad Central Del Este UCE Facultad de Ciencias de la Salud Escuela de Bioanálisis Programa de la Asignatura: (BIA-101) Serología Clínica Total de Créditos: 1 Teoría: 0 Practica: 2 Prerrequisitos:
Albúmina 22 % I.- Introducción. II.- Características. III.- Presentación
 Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
Albúmina 22 % I.- Introducción En 1945 Cameron y Diamond establecieron que ciertos sueros anti-d(anti-rh) podían aglutinar glóbulos rojos Rho positivos en presencia de albúmina de bovino pero no aglutinaban
LEER CAMBIOS SOMBREADOS
 BIO-FLASH Toxo IgG 3000-8551 50 tests BIO-FLASH Toxo IgG es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cuantitativa de anticuerpos IgG anti-toxoplasma
BIO-FLASH Toxo IgG 3000-8551 50 tests BIO-FLASH Toxo IgG es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cuantitativa de anticuerpos IgG anti-toxoplasma
NycoCard CRP Single Test
 NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
ScanGel ScanBrom ml
 ScanGel ScanBrom 86445 12 ml BROMELINA PARA PRUEBAS CRUZADAS IVD Todos los productos fabricados y comercializados por la sociedad Bio-Rad se hallan bajo un sistema de garantía de calidad desde la recepción
ScanGel ScanBrom 86445 12 ml BROMELINA PARA PRUEBAS CRUZADAS IVD Todos los productos fabricados y comercializados por la sociedad Bio-Rad se hallan bajo un sistema de garantía de calidad desde la recepción
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt
 Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
LEER CAMBIOS SOMBREADOS
 BIO-FLASH CMV IgG 3000-8563 50 tests BIO-FLASH CMV IgG es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación semicuantitativa de anticuerpos IgG anti-citomegalovirus
BIO-FLASH CMV IgG 3000-8563 50 tests BIO-FLASH CMV IgG es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación semicuantitativa de anticuerpos IgG anti-citomegalovirus
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES. Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé
 GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
GUIA DE SOLUCIÓN DE ERRORES EN EL TAMIZAJE DE HEMOTRANSMISIBLES Lic. TM. ANDRÉS LARA RODRÍGUEZ Hospital San Bartolomé Esquema de investigación en pruebas fallidas Revisar el procedimiento y determinar
BUENAS PRACTICAS DE LABORATORIO EN EL ANÁLISIS DE NIVELES DE FÁRMACOS Y SUS METABOLITOS EN ESPECÍMENES BIOLÓGICOS
 MINISTERIO DE SANIDAD Y CONSUMO BUENAS PRACTICAS DE LABORATORIO EN EL ANÁLISIS DE NIVELES DE FÁRMACOS Y SUS METABOLITOS EN ESPECÍMENES BIOLÓGICOS DOCUMENTO Nº 5 1ª Versión Noviembre 2001 AGENCIA ESPAÑOLA
MINISTERIO DE SANIDAD Y CONSUMO BUENAS PRACTICAS DE LABORATORIO EN EL ANÁLISIS DE NIVELES DE FÁRMACOS Y SUS METABOLITOS EN ESPECÍMENES BIOLÓGICOS DOCUMENTO Nº 5 1ª Versión Noviembre 2001 AGENCIA ESPAÑOLA
DISPOSICIÚN N
 DISPOSICIÚN N 2 5 1 6 Ministerio de Salud Secretaría de Políticas, Regulación A. N. M. A. T 2011 Año del TraJx o Decente, la Salud y Seguridad de los Trabqjadores BUENOS AIRES VISTO, el expediente n 1-47-20242/10-2
DISPOSICIÚN N 2 5 1 6 Ministerio de Salud Secretaría de Políticas, Regulación A. N. M. A. T 2011 Año del TraJx o Decente, la Salud y Seguridad de los Trabqjadores BUENOS AIRES VISTO, el expediente n 1-47-20242/10-2
INDICACIONES TRADOS. Orina. control hcg. Juego de. hcg Orina. etapas de embarazo. temprano. Cuando se. hcg Orina. tamponada con.
 Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
Instrucciones para uso profesional INDICACIONES El Juego de control hcg Orina se utiliza con la prueba de QuickVue+ hcg Combo, prueba de QuickVue hcg Orina o Combo y prueba de RapidVue hcg. Estos controles
REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD. DECRETO EJECUTIVO No (De 27 de agosto de 2007 ) EL PRESIDENTE DE LA REPÚBLICA,
 1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
Pruebas diagnósticas basadas en la respuesta inmunitaria
 Pruebas diagnósticas basadas en la respuesta inmunitaria 1 Por qué utilizamos el diagnóstico inmunológico? El diagnóstico clínico no suele ser definitivo. Las lesiones histológicas pueden ser indicativas
Pruebas diagnósticas basadas en la respuesta inmunitaria 1 Por qué utilizamos el diagnóstico inmunológico? El diagnóstico clínico no suele ser definitivo. Las lesiones histológicas pueden ser indicativas
GELES FORMULADOS CON REACTIVOS MONOCLONALES DE ORIGEN MURINO O HUMANO O GEL NEUTRO
 ScanGel ABO Complete/RH/K Duo 86719 2 x 24 tarjetas 86709 2 x 144 tarjetas ScanGel ABO Complete/RH1 Duo y ScanGel Monoclonal RH/K Phenotypes Duo tarjetas GELES FORMULADOS CON REACTIVOS MONOCLONALES DE
ScanGel ABO Complete/RH/K Duo 86719 2 x 24 tarjetas 86709 2 x 144 tarjetas ScanGel ABO Complete/RH1 Duo y ScanGel Monoclonal RH/K Phenotypes Duo tarjetas GELES FORMULADOS CON REACTIVOS MONOCLONALES DE
DiaSorin Inc 1951 Northwestern Ave - Stillwater, MN EE.UU. Tel Fax
 DiaSorin Inc 1951 Northwestern Ave - Stillwater, MN 55082 - EE.UU. Tel. +1.651.439.9710 - Fax +1.651.351.5669 Preste atención a los cambios! LIAISON Calcitonin II-Gen (310650) 1. INDICACIONES El ensayo
DiaSorin Inc 1951 Northwestern Ave - Stillwater, MN 55082 - EE.UU. Tel. +1.651.439.9710 - Fax +1.651.351.5669 Preste atención a los cambios! LIAISON Calcitonin II-Gen (310650) 1. INDICACIONES El ensayo
AGENTES BIOLÓGICOS Antonio Lobato Gutiérrez
 AGENTES BIOLÓGICOS Antonio Lobato Gutiérrez Introducción Contaminantes biológicos Son organismos con un determinado ciclo de vida que al penetrar en el hombre, determinan en él un efecto adverso para su
AGENTES BIOLÓGICOS Antonio Lobato Gutiérrez Introducción Contaminantes biológicos Son organismos con un determinado ciclo de vida que al penetrar en el hombre, determinan en él un efecto adverso para su
Programa de Diagnóstico de Toxoplasmosis Materna en Armenia
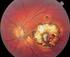 Rev. Salud Pública. 4 (Sup. 2): 23-28, 2002 Programa de Diagnóstico de Toxoplasmosis Materna en Armenia Maria Teresa Montoya,Bacterióloga. Parasitologa, Laboratorio Solidaridad, Armenia, Quindio D urante
Rev. Salud Pública. 4 (Sup. 2): 23-28, 2002 Programa de Diagnóstico de Toxoplasmosis Materna en Armenia Maria Teresa Montoya,Bacterióloga. Parasitologa, Laboratorio Solidaridad, Armenia, Quindio D urante
INSTRUCTIVO PARA LA SOLICITUD DE REGISTRO DE PRODUCTOS VETERINARIOS CONSIDERADOS COMO KITS DE DIAGNÓSTICO
 INSTRUCTIVO PARA LA SOLICITUD DE REGISTRO DE PRODUCTOS VETERINARIOS CONSIDERADOS COMO KITS DE DIAGNÓSTICO Para la evaluación del expediente para el registro nacional de productos veterinarios considerados
INSTRUCTIVO PARA LA SOLICITUD DE REGISTRO DE PRODUCTOS VETERINARIOS CONSIDERADOS COMO KITS DE DIAGNÓSTICO Para la evaluación del expediente para el registro nacional de productos veterinarios considerados
GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA
 GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA S E R V I C I O D E N E O N A T O L O G Í A H G U A S H E I L A S E G U R A S Á N C H E Z R 3 T U T O R : H O N O R I O S Á N C H E Z Z A P L A N A Contenido Introducción
GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA S E R V I C I O D E N E O N A T O L O G Í A H G U A S H E I L A S E G U R A S Á N C H E Z R 3 T U T O R : H O N O R I O S Á N C H E Z Z A P L A N A Contenido Introducción
Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico
 TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
LEER CAMBIOS SOMBREADOS
 BIO-FLASH Rubella IgG 3000-8557 50 tests BIO-FLASH Rubella IgG es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cuantitativa de anticuerpos IgG frente al
BIO-FLASH Rubella IgG 3000-8557 50 tests BIO-FLASH Rubella IgG es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cuantitativa de anticuerpos IgG frente al
Técnico en Hematología y Hemoterapia. Sanidad, Dietética y Nutrición
 Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Murex HBsAg Version 3
 es 9F80-01/-05 GE34/36 Primera edición 04/2009 Murex HBsAg Version 3 Enzimoinmunoanálisis para la detección del antígeno de superficie del virus de la hepatitis B en suero o plasma humanos Centro de Asistencia
es 9F80-01/-05 GE34/36 Primera edición 04/2009 Murex HBsAg Version 3 Enzimoinmunoanálisis para la detección del antígeno de superficie del virus de la hepatitis B en suero o plasma humanos Centro de Asistencia
Tecnicas rápidas Alergenos Alimentarios: ELISA convencional Tests Inmunocromatográficos. Alejandro Castanera Vitaltech Ibérica s.l.
 Tecnicas rápidas para detección de Alergenos Alimentarios: ELISA convencional Tests Inmunocromatográficos Alejandro Castanera Vitaltech Ibérica s.l. Antecedentes Los alergenos alimentarios son proteínas
Tecnicas rápidas para detección de Alergenos Alimentarios: ELISA convencional Tests Inmunocromatográficos Alejandro Castanera Vitaltech Ibérica s.l. Antecedentes Los alergenos alimentarios son proteínas
FICHA DE DATOS DE SEGURIDAD (MSDS) KIT CLART STIs B
 1. Identificación de la sustancia y proveedor Nombre comercial CLART STIs B Referencias: Extracción y purificación 16 determinaciones Ref.: CS-1113-16 48 determinaciones Ref.: CS-1113-48 Amplificación
1. Identificación de la sustancia y proveedor Nombre comercial CLART STIs B Referencias: Extracción y purificación 16 determinaciones Ref.: CS-1113-16 48 determinaciones Ref.: CS-1113-48 Amplificación
Prospecto del envase. Español
 Tarjeta de prueba de la mononucleosis infecciosa (para sangre entera, suero o plasma) Prueba rápida para la detección cualitativa en sangre entera, suero o plasma de anticuerpos heterófilos de la mononucleosis
Tarjeta de prueba de la mononucleosis infecciosa (para sangre entera, suero o plasma) Prueba rápida para la detección cualitativa en sangre entera, suero o plasma de anticuerpos heterófilos de la mononucleosis
LEER CAMBIOS SOMBREADOS
 BIO-FLASH Toxo IgM 3000-8554 50 tests BIO-FLASH Toxo IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-toxoplasma
BIO-FLASH Toxo IgM 3000-8554 50 tests BIO-FLASH Toxo IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-toxoplasma
Hoja de protocolo del instrumento QIAsymphony SP
 Hoja de protocolo del instrumento QIAsymphony SP Protocolo DNA_Buffy_Coat_200_V7_DSP Información general Para uso en diagnóstico in vitro. Este protocolo está indicado para la purificación de ADN mitocondrial
Hoja de protocolo del instrumento QIAsymphony SP Protocolo DNA_Buffy_Coat_200_V7_DSP Información general Para uso en diagnóstico in vitro. Este protocolo está indicado para la purificación de ADN mitocondrial
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
QUANTA Chek ANA Panel 708111 Uso previsto El QUANTA Chek TM ANA Panel se utiliza como control de calidad de los procedimientos IFA y ELISA para anticuerpos antinucleares. Cada suero sirve como control
Inmunohematología. Dra. Ana Cecilia Haro
 Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
REGISTRO DE KITS DE DIAGNOSTICO CONTRASTACIÓN
 REGISTRO DE KITS DE DIAGNOSTICO CONTRASTACIÓN LABORATORIO CENTRAL DE VETERINARIA Esmeralda del Sur Mora Ley 8/2003, de 24 de abril, de Sanidad Animal RD 488/2010, de 23 de abril, por el que se regulan
REGISTRO DE KITS DE DIAGNOSTICO CONTRASTACIÓN LABORATORIO CENTRAL DE VETERINARIA Esmeralda del Sur Mora Ley 8/2003, de 24 de abril, de Sanidad Animal RD 488/2010, de 23 de abril, por el que se regulan
INSTRUCCIÓN TÉCNICA DISTRIBUCIÓN: Jefe de la Unidad de Calidad SUMARIO DE MODIFICACIONES
 Investigación de crioaglutininas Página 1 de 5 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería
Investigación de crioaglutininas Página 1 de 5 DISTRIBUCIÓN: DEPARTAMENTO Dirección Hematología Enfermería RESPONSABLE Jefe de la Unidad de Calidad Jefe de la Unidad de Hematología Coordinadora de Enfermería
Página 1 of 10 Revision
 D-252 96 INSTRUCCIONES DE USO "DS-ЕIA-Anti-HDV-M" INMUNOENSAYO ENZIMATICO ELISA PARA LA DETECCION DE ANTICUERPOS TOTALES CONTRA EL VIRUS DE LA HEPATITIS D Página 1 of 10 Revision 006 INDICE I. USO INDICADO...
D-252 96 INSTRUCCIONES DE USO "DS-ЕIA-Anti-HDV-M" INMUNOENSAYO ENZIMATICO ELISA PARA LA DETECCION DE ANTICUERPOS TOTALES CONTRA EL VIRUS DE LA HEPATITIS D Página 1 of 10 Revision 006 INDICE I. USO INDICADO...
Estudio de la estabilidad del sistema Paratest usado para diagnóstico de las parasitosis intestinales Rev /01/2011
 1 Estudio de la estabilidad del sistema Paratest usado para diagnóstico de las parasitosis intestinales Rev. 00-10/01/2011 1. Introducción Las parasitosis intestinales representan un serio problema de
1 Estudio de la estabilidad del sistema Paratest usado para diagnóstico de las parasitosis intestinales Rev. 00-10/01/2011 1. Introducción Las parasitosis intestinales representan un serio problema de
Canine Distemper Virus Test Kit
 SensPERT Canine Distemper Virus Test Kit CONCEPTO SENSPERT La línea de diagnóstico SensPERT de Rapid Test proporciona una solución rápida, específica y fiable para los médicos veterinarios en su práctica
SensPERT Canine Distemper Virus Test Kit CONCEPTO SENSPERT La línea de diagnóstico SensPERT de Rapid Test proporciona una solución rápida, específica y fiable para los médicos veterinarios en su práctica
TERMINOLOGÍA ANALÍTICA - PROCESO ANALÍTICO - TÉCNICA ANALÍTICA - MÉTODO ANALÍTICO - PROCEDIMIENTO ANALÍTICO - PROTOCOLO ANALÍTICO
 TERMINOLOGÍA ANALÍTICA - PROCESO ANALÍTICO - TÉCNICA ANALÍTICA - MÉTODO ANALÍTICO - PROCEDIMIENTO ANALÍTICO - PROTOCOLO ANALÍTICO PROCESO ANALÍTICO Conjunto de operaciones analíticas intercaladas que se
TERMINOLOGÍA ANALÍTICA - PROCESO ANALÍTICO - TÉCNICA ANALÍTICA - MÉTODO ANALÍTICO - PROCEDIMIENTO ANALÍTICO - PROTOCOLO ANALÍTICO PROCESO ANALÍTICO Conjunto de operaciones analíticas intercaladas que se
Inmunohematología 2017
 Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
RIQAS PROGRAMA DE DROGAS TERAPEUTICAS RQ 9111
 PRESENTACION: 12 x 5 ml. PROGRAMA DE DROGAS TERAPEUTICAS RQ 9111 MATRIZ: Suero humano liofilizado Las muestras están cerradas al vacío. Abrir el frasco con mucho cuidado, para evitar cualquier pérdida
PRESENTACION: 12 x 5 ml. PROGRAMA DE DROGAS TERAPEUTICAS RQ 9111 MATRIZ: Suero humano liofilizado Las muestras están cerradas al vacío. Abrir el frasco con mucho cuidado, para evitar cualquier pérdida
SGT Nº 11 SAÚDE / CPS / GAH PRODUTOS MÉDICOS / Ata Nº 02/10 UNIDO VII
 SGT Nº 11 SAÚDE / CPS / GAH PRODUTOS MÉDICOS / Ata Nº 02/10 UNIDO VII Porto Alegre, 20 a 22 de setembro de 2010 PROPUESTA DE CLASIFICACIÓN DE REACTIVOS DE DIAGNÓSTICO DE USO IN VITRO URUGUAY Introducción
SGT Nº 11 SAÚDE / CPS / GAH PRODUTOS MÉDICOS / Ata Nº 02/10 UNIDO VII Porto Alegre, 20 a 22 de setembro de 2010 PROPUESTA DE CLASIFICACIÓN DE REACTIVOS DE DIAGNÓSTICO DE USO IN VITRO URUGUAY Introducción
Infección de transmisión vertical y Embarazo. Susana Loyola Infectología Hospital Materno Neonatal
 Infección de transmisión vertical y Embarazo Susana Loyola Infectología Hospital Materno Neonatal Toxoplasmosis y Embarazo Toxoplasmosis y Embarazo La primoinfección materna origina la infección del feto.
Infección de transmisión vertical y Embarazo Susana Loyola Infectología Hospital Materno Neonatal Toxoplasmosis y Embarazo Toxoplasmosis y Embarazo La primoinfección materna origina la infección del feto.
Mejora Continua de la Calidad. QFB Rocío Valdés Gómez
 Mejora Continua de la Calidad Mejora continua de la calidad Son todas aquellas acciones necesarias para aumentar la efectividad y la eficiencia de la estructura, el proceso y los resultados del análisis
Mejora Continua de la Calidad Mejora continua de la calidad Son todas aquellas acciones necesarias para aumentar la efectividad y la eficiencia de la estructura, el proceso y los resultados del análisis
Toxoplasmosis. Dr. Renzo Tassara Oliveri. Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios
 Dr. Renzo Tassara Oliveri Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios Facultad de Medicina, Universidad de Chile Protozoo coccidio Zoonosis Parásito
Dr. Renzo Tassara Oliveri Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios Facultad de Medicina, Universidad de Chile Protozoo coccidio Zoonosis Parásito
Anexo V. Guías de Bioseguridad para el Manejo de Muestras en el. Síndrome Respiratorio Agudo y Grave (SRAS)
 nexo V Guías de Bioseguridad para el Manejo de Muestras en el Síndrome Respiratorio gudo y Grave (SRS) Traducido de WHO: Biosafety guidelines for handling of SRS specimens. http://www.who.int/csr/srs/biosafety2003_04_25/en/)
nexo V Guías de Bioseguridad para el Manejo de Muestras en el Síndrome Respiratorio gudo y Grave (SRS) Traducido de WHO: Biosafety guidelines for handling of SRS specimens. http://www.who.int/csr/srs/biosafety2003_04_25/en/)
One Step Dengue IgG/IgM Antibody Test
 One Step Dengue IgG/IgM Antibody Test Instrucciones de uso Formato: Cassette Espécimen: Suero/Plasma y Sangre Entera Numero de Catalogo: A03-08- 322 * Por favor, lea atentamente las instrucciones antes
One Step Dengue IgG/IgM Antibody Test Instrucciones de uso Formato: Cassette Espécimen: Suero/Plasma y Sangre Entera Numero de Catalogo: A03-08- 322 * Por favor, lea atentamente las instrucciones antes
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/18 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ZULVAC 1 Bovis suspensión inyectable para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Título: FICHA TÉCNICA. Producto: BIO-MARK-VET C VACUNA VIVA ATENUADA Y CONGELADA CONTRA LA ENFERMEDAD DE MAREK (HVT FC 126)
 de 5 En: 3/05/2 NOMBRE COMERCIAL BIO-MARK-VET C DESCRIPCIÓN Vacuna contra la Enfermedad de Marek congelada COMPOSICIÓN Suspensión concentrada de Herpes-Virus, origen de pavo, muestra FC 26, cultivada en
de 5 En: 3/05/2 NOMBRE COMERCIAL BIO-MARK-VET C DESCRIPCIÓN Vacuna contra la Enfermedad de Marek congelada COMPOSICIÓN Suspensión concentrada de Herpes-Virus, origen de pavo, muestra FC 26, cultivada en
A: Protocolo de Actuación para trabajos con Bromuro de Etidio.
 TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA
 SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
Clamidia MIF IgM. Características de rendimiento. Código del producto IF1250M Rev. I. No para su distribución en Estados Unidos
 Código del producto IF1250M Rev. I Características de rendimiento No para su distribución en Estados Unidos VALORES ESPERADOS Población con neumonía adquirida en la comunidad Dos investigadores externos
Código del producto IF1250M Rev. I Características de rendimiento No para su distribución en Estados Unidos VALORES ESPERADOS Población con neumonía adquirida en la comunidad Dos investigadores externos
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
TOXOPLASMA IgM EIA WELL REF K1TM. Español. M48.es Rev /2006
 0123 TOXOPLASMA IgM EIA WELL REF K1TM 96 Español M48.es Rev. 10 02/2006 REACTIVOS DEL KIT REACTIVOS CANTIDAD ESTADO FÍSICO MTP 1 x 96 Listo para usar WASH 1 x 50 ml Concentrada DIL 1 x 100 ml Listo para
0123 TOXOPLASMA IgM EIA WELL REF K1TM 96 Español M48.es Rev. 10 02/2006 REACTIVOS DEL KIT REACTIVOS CANTIDAD ESTADO FÍSICO MTP 1 x 96 Listo para usar WASH 1 x 50 ml Concentrada DIL 1 x 100 ml Listo para
INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia.
 Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
TEST ELISA RESPIRATORIO
 TEST ELISA RESPIRATORIO BIO K 28 Las afecciones respiratorias suponen un problema preocupante para los bovinos dada su frecuencia y el elevado número de animales que las sufren. Estas afecciones se encuentran
TEST ELISA RESPIRATORIO BIO K 28 Las afecciones respiratorias suponen un problema preocupante para los bovinos dada su frecuencia y el elevado número de animales que las sufren. Estas afecciones se encuentran
FluoroSpheres Code No. K0110
 FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
FluoroSpheres Code No. K0110 6a edición Perlas de calibración para monitoreo diario del citómetro de flujo. Contiene reactivos para 40 calibraciones. (105798-004) SSK0110CE_02/ES/2015.12 p. 1/8 Contenidos
LEER CAMBIOS SOMBREADOS
 BIO-FLASH CMV IgM 3000-8566 50 tests BIO-FLASH CMV IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-citomegalovirus
BIO-FLASH CMV IgM 3000-8566 50 tests BIO-FLASH CMV IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-citomegalovirus
CRITERIOS TÉCNICOS DE EVALUACIÓN DE UN DOSSIER DE ESPECIALIDADES FARMACEUTICAS DIRECTIVA SANITARIA N 001-MINSA/DIGEMID V.01
 CRITERIOS TÉCNICOS DE EVALUACIÓN DE UN DOSSIER DE ESPECIALIDADES FARMACEUTICAS EQUIPO DE REGISTRO DE PRODUCTOS FARMACÉUTICOS DIRECCIÓN DE AUTORIZACIONES SANITARIAS VALIDACIÓN DE UN PROCEDIMIENTO ANALÍTICO
CRITERIOS TÉCNICOS DE EVALUACIÓN DE UN DOSSIER DE ESPECIALIDADES FARMACEUTICAS EQUIPO DE REGISTRO DE PRODUCTOS FARMACÉUTICOS DIRECCIÓN DE AUTORIZACIONES SANITARIAS VALIDACIÓN DE UN PROCEDIMIENTO ANALÍTICO
