UN NUEVO PARADIGMA EN HEMATOLOGÍA: HABLEMOS DE RITUXIMAB BIOSIMILAR
|
|
|
- José María Soriano Lagos
- hace 6 años
- Vistas:
Transcripción
1 SIMPOSIO SATÉLITE UN NUEVO PARADIGMA EN HEMATOLOGÍA: HABLEMOS DE RITUXIMAB BIOSIMILAR LIX Congreso Nacional de la Sociedad Española de Hematología y Hemoterapia (SEHH) Palacio de Ferias y Congresos de Málaga 27 de Octubre de 2017
2 Producción, diseño y edición: Medical Media, scp C/ Salut , Sant Just Desvern (Barcelona) Toda forma de reproducción, distribución, comunicación pública o transformación de esta obra sólo puede ser realizada con la autorización de sus titulares y autores, salvo la excepción prevista por la ley. 2
3 Dr. Armando López Guillermo Hematólogo del Hospital Clínic de Barcelona Luisa Bermúdez de Castro Medical Science de Kern Pharma Biologics Dr. Juan Manuel Sancho Hematólogo del Hospital Universitario Germans Trias i Pujol de Badalona (Barcelona) 3
4 4
5 De izquierda a derecha: Dr. Armando López Guillermo, Luisa Bermúdez de Castro y Dr. Juan Manuel Sancho Farmacosalud.com Introducción La aparición de los fármacos biosimilares está suponiendo una revolución en el tratamiento terapéutico de numerosas enfermedades. Se trata de medicamentos de origen biológico que han demostrado ser tan seguros y eficaces como sus medicamentos de referencia (biológicos originales), y que se lanzan al mercado una vez que expira la patente de éstos. Recientemente, se ha comercializado el primer biosimilar de rituximab. Con el objetivo de analizar su eficacia y utilización en el campo de la Hematología, se celebró el simposio Un nuevo paradigma en hematología: hablemos de rituximab biosimilar, patrocinado por Kern Pharma, en el marco del LIX Congreso Nacional de la Sociedad Española de Hematología y Hemoterapia (SEHH), que tuvo lugar del 26 al 28 de octubre en Málaga. El simposio fue moderado por el Dr. Armando López Guillermo, hematólogo del Hospital Clínic de Barcelona, y contó con la intervención de Luisa Bermúdez de Castro, Medical Science de Kern Pharma Biologics, y del Dr. Juan Manuel Sancho, hematólogo del Hospital Universitario Germans Trias i Pujol de Badalona (Barcelona). Rituximab biosimilar (Truxima ) es un anticuerpo monoclonal quimérico (AcM) aprobado por la Agencia Europea del Medicamento (EMA) para las mismas indicaciones terapéuticas que el fármaco biológico de referencia: linfoma no-hodgkin, leucemia linfática crónica, artritis reumatoide, granulomatosis con poliangeítis y poliangeítis microscópica. 5
6 Fármacos biológicos y biosimilares Biosimilares: evidencia de equivalencia El Dr. López Guillermo inició el simposio destacando, a modo de introducción, que el desarrollo de los fármacos biológicos ha revolucionado el tratamiento de muchas enfermedades y, particularmente, del cáncer 1. En este sentido, el experto afirmó que la aparición de rituximab, supuso un antes y un después en el tratamiento de los linfomas, aumentando la supervivencia de los pacientes de manera notable. Luisa Bermúdez de Castro, medical science de Kern Pharma Biologics, expuso las particularidades concretas de los fármacos biosimilares, y comenzó destacando que un medicamento biosimilar, desarrollado con el fin de crear una réplica de un medicamento original de referencia, tiene que demostrar comparabilidad 3 a través de numerosos estudios científicos sobre los que se sustente su evidencia terapéutica. Bermúdez de Castro subrayó que un biosimilar no es un fármaco genérico 4. Los genéricos son moléculas químicas, con una estructura bien definida y de pequeño tamaño, sin embargo, -apuntó la experta-, los biosimilares son moléculas más complejas y de mayor tamaño, y resulta fundamental demostrar que se comporta de igual manera que el medicamento de referencia desde el punto de vista estructural y biológico. Dr. Armando López Guillermo Farmacosalud.com No obstante, el Dr. López Guillermo comentó que, pese a que los biológicos representan tan sólo el 1% del total de fármacos disponibles, se debe tener en cuenta que suponen casi un 30% del total del coste farmacéutico 2. Por tanto, pese a su eficacia, el aumento de su uso en la población está muy condicionado por su elevado precio, lo que impide que muchos sistemas públicos de salud puedan introducirlo en la práctica diaria para el tratamiento de muchas enfermedades. Por este motivo, los fármacos biosimilares representan una buena opción para extender su utilización, ya que son comparables en calidad, eficacia y seguridad a un medicamento biológico original, a un menor precio. Además, agregó que el fármaco biosimilar no es una copia idéntica del fármaco de referencia debido a su componente biológico, que impide que no se pueda reproducir de manera exacta, y requiere de un complejo proceso biotecnológico más aún en el caso de los anticuerpos monoclonales, añadió Bermúdez de Castro. Todo esto conlleva, a su vez, que los biosimilares sean mucho más difíciles y costosos de desarrollar que los genéricos de molécula pequeña. Los medicamentos biosimilares también presentan una vía legal y de regulación específica y distinta a la de los medicamentos genéricos 2. Todos los medicamentos derivados de métodos biotecnológicos son evaluados de forma centralizada por la Agencia Europea del Medicamento (EMA), y, una vez se evalúa a través de Comité de Medicamentos de Uso Humano (CHMP), es la Comisión Europea la que aprueba su comercialización, explicó Bermúdez de Castro. En este sentido, Bermúdez de Castro señaló que los biosimilares tienen el mismo procedimiento de registro centralizado que los fármacos biológicos, evaluados por los mismos expertos 2. 6
7 Extrapolación de indicaciones, farmacovigilancia y trazabilidad La extrapolación es el concepto regulatorio de conceder una indicación clínica a un medicamento sin demandar nuevos datos de eficacia y seguridad clínica que respalden la indicación. Según explicó Bermúdez de Castro, esta extrapolación de indicaciones no es automática. Sólo se puede estudiar cuando se cumplen tres condiciones 5 : que el producto biosimilar tenga el mismo modo de acción que su producto de referencia; que se haya demostrado comparabilidad en términos biológicos y de calidad; y que existan evidencias concluyentes de un mismo perfil de seguridad y eficacia en al menos una indicación del medicamento de referencia, aquella que sea considerada suficientemente sensible para detectar diferencias. mejorar la trazabilidad del medicamento biológico para su correcta identificación y permitir así la correcta notificación de reacciones adversas 6. Bermúdez de Castro subrayó que, según se recoge en la última edición de la Guía Europea de Medicamentos Biosimilares 7, en los últimos 10 años, el sistema de Farmacovigilancia europea, no ha identificado ninguna diferencia en cuanto a la naturaleza, severidad o frecuencia de efectos adversos entre los biosimilares y sus productos de referencia. En el caso de Truxima, Bermúdez de Castro aseveró que, en comparación con su medicamento biológico de referencia, podemos asegurar que ambos productos contienen en esencia el mismo principio activo, tiene las mismas indicaciones, se utilizan a la misma dosis, por la misma vía y en el tratamiento de las mismas enfermedades 8. En cuanto a los estudios de calidad realizados, la experta destacó que han demostrado que Truxima presenta una estructura primaria idéntica a la de su producto de referencia, al igual que presenta estructuras secundarias y de grado superior altamente similares a la de su producto de referencia. Luisa Bermúdez de Castro Farmacosalud.com En conclusión, Bermúdez de Castro afirmó que todos los ensayos realizados han demostrado, mediante los métodos más sensibles, la comparabilidad de Truxima frente a su molécula de referencia. Bermúdez de Castro incidió en la importancia de la farmacovigilancia y trazabilidad, y comentó que tanto los medicamentos biológicos como biosimilares son sometidos a una vigilancia constante por parte de las agencias reguladoras. Según subrayó la experta, la legislación europea obliga a que toda notificación de una reacción adversa de un medicamento biológico vaya acompañada del nombre aprobado del medicamento y del número de lote, e indicó que es importante Truxima en linfoma folicular Por su parte, el Dr. Juan Manuel Sancho, hematólogo del Hospital Universitario Germans Trias i Pujol de Badalona (Barcelona), presentó los datos clínicos del uso de Truxima en linfoma folicular, aunque comenzó apuntando que la aprobación del rituximab biosimilar en el ámbito de la hematología se ha producido a partir de los datos obtenidos en otra de sus indicaciones: la artritis reumatoide. 7
8 Por este motivo, el Dr. Juan Manuel Sancho presentó los resultados de dos estudios; Fase I 9.10, y Fase III 11 realizados en pacientes con artritis reumatoide, que apoyan que Truxima y el producto de referencia han demostrado tener una farmacocinética equivalente y una eficacia, farmacodinámica, inmunogenicidad y seguridad comparables. También demuestran que Truxima es eficaz y seguro a largo plazo en pacientes que recibieron tratamiento durante dos años y en pacientes en switch. Con estos datos sobre artritis reumatoide, la EMA realizó una extrapolación de la indicación, no sólo a esta enfermedad, sino a todo el ámbito de la hematología con las mismas indicaciones para las que iba dirigido rituximab, explicó el experto. No obstante, el laboratorio fabricante elaboró un programa de desarrollo clínico en Hematología, en concreto para el linfoma folicular. El linfoma folicular es una patología muy frecuente que se suele detectar en estadio avanzado (estadios III-IV), que responde bien, en estos casos, a la utilización de un tratamiento de inducción con el objetivo de reducir el tamaño de los tumores seguido de un tratamiento de mantenimiento que prolonga la supervivencia libre de progresión. El tratamiento de inducción consiste en quimioterapia combinada con rituximab. El tratamiento de mantenimiento comienza después de completar el tratamiento de inducción y consiste en la utilización de rituximab cada 2 meses durante 2 años. clínico demostraron, por un lado, la no-inferioridad de Truxima en términos de eficacia respecto al biológico de referencia y, por otro, una farmacocinética comparable 13. Para demostrar la no-inferioridad, el criterio de valoración que se empleó fue la tasa de respuestas globales según los criterios del International Working Group del año 1999, al finalizar los ocho ciclos de inducción con R-CVP (rituximab, ciclofosfamida, sulfato de vincristina y prednisona) o con Truxima -CVP. Para demostrar la equivalencia farmacocinética, los parámetros de valoración que se escogieron fueron el área bajo la curva de concentración sérica-tiempo en estado estacionario (AUCτ) y la concentración sérica máxima en estado estacionario (CmaxSS) alcanzada en el ciclo 4 de inducción. Como objetivos secundarios, este estudio también demostró que los perfiles de tolerabilidad, seguridad e inmunogenicidad de rituximab biosimilar son comparables a los del fármaco de referencia tras ocho ciclos de tratamiento en estos pacientes, lo que convierte a Truxima en una opción terapéutica muy razonable para el tratamiento de pacientes con linfoma folicular en estadio avanzado o sin tratamiento previo y, posiblemente, también para otras neoplasias linfoides B maduras, CD20 positivas, en sustitución del rituximab original, concluyó el Dr. Juan Manuel Sancho. El Dr. Juan Manuel Sancho destacó que la aparición de fármacos biosimilares de rituximab representa una oportunidad muy importante de facilitar el acceso, a los pacientes, a estos fármacos biológicos, ya que permite disminuir el coste y facilita la sostenibilidad del sistema sanitario. Con el objetivo de lograr una mayor evidencia en la utilización de Truxima, se efectuó un estudio en Fase III 12, realizado en pacientes con linfoma folicular avanzado que no habían recibido tratamiento previo, y cuyas conclusiones presentó el Dr. Juan Manuel Sancho. El experto puntualizó que los datos publicados corresponden, de momento, a la fase de inducción; no tenemos todavía datos correspondientes al mantenimiento. Dr. Juan Manuel Sancho Farmacosalud.com Como objetivos primarios, según expuso el Dr. Juan Manuel Sancho, los resultados de este ensayo 8
9 Bibliografía 1.Waller CF. Biosimilars and their use in hematology and oncology. Commun Oncol. 2012;9(6): Sarpatwari A, Avorn J, Kesselheim AS. Progress and Hurdles for Follow-on Biologics. N Engl J Med Jun 18;372(25): European Commission. Consensus Information Paper What you need to know about Biosimilar Medicinal Products. 4.Centralised Procedure, the Rules governing Medicinal Products in the European Community, Notice to Applicants, Volume 2A, Chapter Weise M, Bielsky MC, De Smet K, Ehmann F, Ekman N, Giezen TJ, et al. Biosimilars: what clinicians should know. Blood Dec 20;120(26): Real Decreto 577/2013, de 26 de julio, por el que se regula la farmacovigilancia de medicamentos de uso humano. 7.Biosimilars in the EU. Information guide for healthcare professionals. Prepared jointly by the European Medicines Agency and the European Commission. 8.Ficha técnica Truxima. European Medicines Agency (2017). EMEA/H/C/ Available at: docs/en_gb/document_library/epar_-_product_information/human/004112/wc pdf 9.Yoo DH, Suh CH, Shim SC, Jeka S, Cons-Molina FF, Hrycaj P, et al. A multicentre randomised controlled trial to compare the pharmacokinetics, efficacy and safety of CT-P10 and innovator rituximab in patients with rheumatoid arthritis. Ann Rheum Dis. 2017;76(3): Park W, Suh CH, Shim SC, Molina FFC, Jeka S, Medina-Rodriguez FG, et al. Efficacy and Safety of Switching from Innovator Rituximab to Biosimilar CT-P10 Compared with Continued Treatment with CT-P10: Results of a 56-Week Open-Label Study in Patients with Rheumatoid Arthritis. BioDrugs Jun Suh CH, Berrocal A, Chalouhi E, Miranda P, Bozic L, Jeka S, et al. Pharmacokinetics and Safety of Three Formulations of Rituximab (CT-P10, US-sourced Innovator Rituximab and EU-sourced Innovator Rituximab) in Patients with Rheumatoid Arthritis: Results from Phase 3 Randomized Controlled Trial over 24 Weeks [abstract]. Arthritis Rheumatol. 2016; 68 (suppl 10). 12.Kim WS, Buske C, Ogura M, Jurczak W, Sancho JM, Zhavrid E, et al. Efficacy, pharmacokinetics, and safety of the biosimilar CT-P10 compared with rituximab in patients with previously untreated advanced-stage follicular lymphoma: a randomised, double-blind, parallel-group, non-inferiority phase 3 trial. Lancet Haematol Aug;4(8):e362-e Buske C, Kim WS, Kwak L, Coiffier B, Jurczak W, Sancho JM, et al. A Double-Blind, Randomized Phase 3 Study to Compare Efficacy and Safety of CT-P10 to Rituximab in Combination with CVP Therapy in Patients with Advanced-Stage Follicular Lymphoma. Hematological Oncology. 2017;35(S2):
10
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares Guía breve para el paciente Qué son los medicamentos biológicos? Los medicamentos biológicos son moléculas grandes y complejas, que se obtienen a partir de organismos
Medicamentos biológicos y biosimilares Guía breve para el paciente Qué son los medicamentos biológicos? Los medicamentos biológicos son moléculas grandes y complejas, que se obtienen a partir de organismos
MEDICAMENTOS BIOSIMILARES
 Murcia, 30 de Noviembre de 2016 MEDICAMENTOS BIOSIMILARES Mª del Rocío Gutiérrez Cívicos Farmacia Hospitalaria Hospital Universitario Santa Lucía INTRODUCCIÓN Las terapias biológicas están en constante
Murcia, 30 de Noviembre de 2016 MEDICAMENTOS BIOSIMILARES Mª del Rocío Gutiérrez Cívicos Farmacia Hospitalaria Hospital Universitario Santa Lucía INTRODUCCIÓN Las terapias biológicas están en constante
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS.
 POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
POSICIONAMIENTO DE LA SEEP EN RELACIÓN A LOS BIOSIMILARES DE LA HORMONA DE CRECIMIENTO E INSULINAS. Los fármacos biosimilares son fármacos biológicos aprobados por la Agencia Europea del Medicamento (EMA)
Biosimilares: Tratar a más pacientes con el mismo presupuesto o Facilitar el acceso de la población a nuevos tratamientos
 Biosimilares: Tratar a más pacientes con el mismo presupuesto o Facilitar el acceso de la población a nuevos tratamientos La biotecnología ha permitido el avance en los tratamientos para diversas enfermedades
Biosimilares: Tratar a más pacientes con el mismo presupuesto o Facilitar el acceso de la población a nuevos tratamientos La biotecnología ha permitido el avance en los tratamientos para diversas enfermedades
EL SERVICIO MURCIANO DE SALUD.
 RESOLUCIÓN DE LA DIRECTORA GENERAL DE PLANIFICACIÓN, INVESTIGACIÓN, FARMACIA Y ATENCIÓN AL CIUDADANO PARA EL CUMPLIMIENTO DEL ACUERDO ADOPTADO POR LA COMISIÓN REGIONAL DE FARMACIA Y TERAPÉUTICA DE FECHA
RESOLUCIÓN DE LA DIRECTORA GENERAL DE PLANIFICACIÓN, INVESTIGACIÓN, FARMACIA Y ATENCIÓN AL CIUDADANO PARA EL CUMPLIMIENTO DEL ACUERDO ADOPTADO POR LA COMISIÓN REGIONAL DE FARMACIA Y TERAPÉUTICA DE FECHA
LOS SISTEMAS SANITARIOS ANTE LA LLEGADA DE LOS BIOSIMILARES
 LOS SISTEMAS SANITARIOS ANTE LA LLEGADA DE LOS BIOSIMILARES Natividad Calvente, Associate Dir Public Policy Department MSD Madrid, 14 de marzo de 2016 Biotecnología, una Tecnología Clave para Europa 2
LOS SISTEMAS SANITARIOS ANTE LA LLEGADA DE LOS BIOSIMILARES Natividad Calvente, Associate Dir Public Policy Department MSD Madrid, 14 de marzo de 2016 Biotecnología, una Tecnología Clave para Europa 2
MEDICAMENTOS DE BIOTECNOLOGÍA Y BIOSIMILARES
 MEDICAMENTOS DE BIOTECNOLOGÍA Y BIOSIMILARES FACTORES A CONSIDERAR EN LA EVALUACIÓN Y SELECCIÓN DE MEDICAMENTOS DE BIOTECNOLOGÍA Benito Dorantes Calderón. Jefe de Servicio y Director de la UGC de Farmacia
MEDICAMENTOS DE BIOTECNOLOGÍA Y BIOSIMILARES FACTORES A CONSIDERAR EN LA EVALUACIÓN Y SELECCIÓN DE MEDICAMENTOS DE BIOTECNOLOGÍA Benito Dorantes Calderón. Jefe de Servicio y Director de la UGC de Farmacia
POSICIONAMIENTO SOBRE IDENTIFICACIÓN, INTERCAMBIABILIDAD Y SUSTITUCIÓN DE MEDICAMENTOS BIOSIMILARES
 POSICIONAMIENTO SOBRE IDENTIFICACIÓN, INTERCAMBIABILIDAD Y SUSTITUCIÓN DE MEDICAMENTOS BIOSIMILARES La SEFC valora muy positivamente la introducción de biosimilares en el Sistema Nacional de Salud (SNS)
POSICIONAMIENTO SOBRE IDENTIFICACIÓN, INTERCAMBIABILIDAD Y SUSTITUCIÓN DE MEDICAMENTOS BIOSIMILARES La SEFC valora muy positivamente la introducción de biosimilares en el Sistema Nacional de Salud (SNS)
Clasificación de los medicamentos. Originales, copias y genéricos. Productos biotecnológicos y biosimilares.
 Clasificación de los medicamentos. Originales, copias y genéricos. Productos biotecnológicos y biosimilares. Prof. Dr. Christian Höcht Departamento de Farmacología Facultad de Farmacia y Bioquímica Universidad
Clasificación de los medicamentos. Originales, copias y genéricos. Productos biotecnológicos y biosimilares. Prof. Dr. Christian Höcht Departamento de Farmacología Facultad de Farmacia y Bioquímica Universidad
Definición. Regulación. Evaluación
 Definición Regulación Evaluación Definición Qué es un medicamento biotecnológico? Definición Medicamento cuyo principio activo se produce por material de origen biológico (microorganismos, tejidos u órganos,
Definición Regulación Evaluación Definición Qué es un medicamento biotecnológico? Definición Medicamento cuyo principio activo se produce por material de origen biológico (microorganismos, tejidos u órganos,
Biosimilares Cuestiones de interés
 X San Salvador, 22 al 24 de octubre 2014 Iberoamericanos Biosimilares Cuestiones de interés San Salvador 2014 Biosimilares Extrapolación de Indicaciones Farmacovigilancia Trazabilidad/Nomenclatura Intercambio/sustitución/Selección
X San Salvador, 22 al 24 de octubre 2014 Iberoamericanos Biosimilares Cuestiones de interés San Salvador 2014 Biosimilares Extrapolación de Indicaciones Farmacovigilancia Trazabilidad/Nomenclatura Intercambio/sustitución/Selección
Anticuerpos Monoclonales Biogenéricos?
 Anticuerpos Monoclonales Biogenéricos? Los Anticuerpos Monoclonales se elaboran en CÉLULAS VIVAS Complejidad Tamaño Tamaño Estructura - Complejidad Molécula Química Aspirina 21 átomos Molécula Biológica
Anticuerpos Monoclonales Biogenéricos? Los Anticuerpos Monoclonales se elaboran en CÉLULAS VIVAS Complejidad Tamaño Tamaño Estructura - Complejidad Molécula Química Aspirina 21 átomos Molécula Biológica
DOCUMENTO DE POSICIÓN DE ASEBIO Requisitos de Denominación y Etiquetado para Medicamentos Biosimilares
 Enero de 2007 (Asociación Española de Empresas de Biotecnología) DOCUMENTO DE POSICIÓN DE ASEBIO Requisitos de Denominación y Etiquetado para Medicamentos Biosimilares Introducción La Agencia Europea del
Enero de 2007 (Asociación Española de Empresas de Biotecnología) DOCUMENTO DE POSICIÓN DE ASEBIO Requisitos de Denominación y Etiquetado para Medicamentos Biosimilares Introducción La Agencia Europea del
MEDICAMENTOS BIOLÓGICOS Y BIOSIMILARES
 MEDICAMENTOS BIOLÓGICOS Y BIOSIMILARES Qué es un Medicamento Biológico? Son aminoacidos ensamblados para crear proteínas complejas únicas Cada proceso, molécula y dispositivo se obtiene un producto biológico
MEDICAMENTOS BIOLÓGICOS Y BIOSIMILARES Qué es un Medicamento Biológico? Son aminoacidos ensamblados para crear proteínas complejas únicas Cada proceso, molécula y dispositivo se obtiene un producto biológico
Marco general de los medicamentos biosimilares
 Marco general de los medicamentos biosimilares Fernando de Mora PhD, MBA Profesor Departamento de Farmacología, de Terapéutica y de Toxicología () Universitat Autónoma de Barcelona PRESENTACIÓN CONFIDENCIAL
Marco general de los medicamentos biosimilares Fernando de Mora PhD, MBA Profesor Departamento de Farmacología, de Terapéutica y de Toxicología () Universitat Autónoma de Barcelona PRESENTACIÓN CONFIDENCIAL
Reflexiones sobre biológicos y biosimilares en cáncer de mama. Joan Albanell, Hospital del Mar
 Reflexiones sobre biológicos y biosimilares en cáncer de mama Joan Albanell, Hospital del Mar Reflexiones sobre biológicos y biosimilares en cáncer de mama 1. Los anticuerpos monoclonales anti-her2 han
Reflexiones sobre biológicos y biosimilares en cáncer de mama Joan Albanell, Hospital del Mar Reflexiones sobre biológicos y biosimilares en cáncer de mama 1. Los anticuerpos monoclonales anti-her2 han
Biosimilars: una alternativa segura i eficaç
 JORNADA CONJUNTA DE LES SOCIETATS CATALANES DE FARMÀCIA CLÍNIC, GESTIÓ SANITÀRIA I REUMATOLOGIA Biosimilars: una alternativa segura i eficaç Fernando de Mora Dpt. de Farmacologia, de Terapèutica i de Toxicologia
JORNADA CONJUNTA DE LES SOCIETATS CATALANES DE FARMÀCIA CLÍNIC, GESTIÓ SANITÀRIA I REUMATOLOGIA Biosimilars: una alternativa segura i eficaç Fernando de Mora Dpt. de Farmacologia, de Terapèutica i de Toxicologia
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
Entorno Regulatorio para Medicamentos Biosimilares Introducción
 INDICE Entorno Regulatorio para Medicamentos Biosimilares Introducción Los Requerimientos Regulatorios Reflejan la Complejidad de los Productos Biológicos La Industria Farmacéutica es la segunda más regulada
INDICE Entorno Regulatorio para Medicamentos Biosimilares Introducción Los Requerimientos Regulatorios Reflejan la Complejidad de los Productos Biológicos La Industria Farmacéutica es la segunda más regulada
INTERCAMBIABILIDAD DE PRODUCTOS FARMACÉUTICOS.
 INTERCAMBIABILIDAD DE PRODUCTOS FARMACÉUTICOS. Dr. Francisco Javier Flores Murrieta Unidad de Investigación en Farmacología Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas Ciudad
INTERCAMBIABILIDAD DE PRODUCTOS FARMACÉUTICOS. Dr. Francisco Javier Flores Murrieta Unidad de Investigación en Farmacología Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas Ciudad
Medicamentos Biosimilares Marco Regulatorio: Agencia Europea de Medicamentos (EMA)
 INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
CAPTOPRIL STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO CAPTOPRIL STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Captopril STADA comprimidos EFG se ha realizado siguiendo las Directrices que la Agencia
OBJETIVO CAPTOPRIL STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Captopril STADA comprimidos EFG se ha realizado siguiendo las Directrices que la Agencia
Controversias y nuevos tratamientos en linfoma de Hodgkin
 Controversias y nuevos tratamientos en linfoma de Hodgkin Dr. Antonio Rueda Domínguez Área de Oncohematología Hospital Costa del Sol Marbella Controversias Controversias Tratamiento t combinado versus
Controversias y nuevos tratamientos en linfoma de Hodgkin Dr. Antonio Rueda Domínguez Área de Oncohematología Hospital Costa del Sol Marbella Controversias Controversias Tratamiento t combinado versus
Controversias en torno a fármacos biosimilares
 Controversias en torno a fármacos biosimilares Fernando de Mora PhD, MBA Profesor Departamento de Farmacología, de Terapéutica y de Toxicología () Universitat Autónoma de Barcelona PRESENTACIÓN CONFIDENCIAL
Controversias en torno a fármacos biosimilares Fernando de Mora PhD, MBA Profesor Departamento de Farmacología, de Terapéutica y de Toxicología () Universitat Autónoma de Barcelona PRESENTACIÓN CONFIDENCIAL
Manifiesto por la seguridad del paciente en los tratamientos biológicos
 Manifiesto por la seguridad del paciente en los tratamientos biológicos Productos biológicos tienen un histórico de éxito en el tratamiento de muchas enfermedades crónicas y que traen riesgo a la vida.
Manifiesto por la seguridad del paciente en los tratamientos biológicos Productos biológicos tienen un histórico de éxito en el tratamiento de muchas enfermedades crónicas y que traen riesgo a la vida.
Tema 17. Registro de medicamentos. Legislación y deontología farmacéutica
 Tema 17. Registro de medicamentos Legislación y deontología farmacéutica 1 ESTATAL DISPOSICIONES LEGALES REAL DECRETO 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización,
Tema 17. Registro de medicamentos Legislación y deontología farmacéutica 1 ESTATAL DISPOSICIONES LEGALES REAL DECRETO 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización,
BIOSIMILARES EN PSORIASIS: PRACTICA CLINICA Y PERSPECTIVAS REGULATORIAS EN LATAM. Claudia de la Cruz
 BIOSIMILARES EN PSORIASIS: PRACTICA CLINICA Y PERSPECTIVAS REGULATORIAS EN LATAM Claudia de la Cruz Supported in part by Objetivos: Reunir información detallada sobre compañias que producen biosimilares,
BIOSIMILARES EN PSORIASIS: PRACTICA CLINICA Y PERSPECTIVAS REGULATORIAS EN LATAM Claudia de la Cruz Supported in part by Objetivos: Reunir información detallada sobre compañias que producen biosimilares,
Autores: ÍNDICE: 1. Justificación. 2. Objetivo. 3. Ámbito de aplicación. 4. Protocolo de tratamiento. 5. Recursos necesarios
 PROTOCOLO DE USO DE PLERIXAFOR (MOZOBIL ) EN MOVILIZACIÓN Y COLECTA DE PROGENITORES DE SANGRE PERIFÉRICA PARA TRASPLANTE AUTÓLOGO DE PROGENITORES HEMATOPOYÉTICOS (TPH) Autores: Dr Jorge Gayoso. Jefe Sección
PROTOCOLO DE USO DE PLERIXAFOR (MOZOBIL ) EN MOVILIZACIÓN Y COLECTA DE PROGENITORES DE SANGRE PERIFÉRICA PARA TRASPLANTE AUTÓLOGO DE PROGENITORES HEMATOPOYÉTICOS (TPH) Autores: Dr Jorge Gayoso. Jefe Sección
Comunicación dirigida a profesionales sanitarios
 Comunicación dirigida a profesionales sanitarios Bendamustina (Levact, Bendamustina Accord, Bendamustina Dr. Reddys, Bendamustina Intas): aumento de la mortalidad observado en estudios clínicos recientes
Comunicación dirigida a profesionales sanitarios Bendamustina (Levact, Bendamustina Accord, Bendamustina Dr. Reddys, Bendamustina Intas): aumento de la mortalidad observado en estudios clínicos recientes
El futuro de los medicamentos biosimilares. Regina Múzquiz Directora General de BioSim Madrid, 23 de febrero 2017
 El futuro de los medicamentos biosimilares Regina Múzquiz Directora General de BioSim Madrid, 23 de febrero 2017 El mejor profeta del futuro es el pasado (Lord Byron). QUÉ ES UN MEDICAMENTO BIOSIMILAR?
El futuro de los medicamentos biosimilares Regina Múzquiz Directora General de BioSim Madrid, 23 de febrero 2017 El mejor profeta del futuro es el pasado (Lord Byron). QUÉ ES UN MEDICAMENTO BIOSIMILAR?
Prof. Javier García-Conde
 01.12.2000 Prof. Javier García-Conde Clinico Universitario, Spanien Rituximab más CHOP es superior a CHOP en pacientes ancianos con linfoma difuso de células B grandes (LDCG): Resultados preliminares de
01.12.2000 Prof. Javier García-Conde Clinico Universitario, Spanien Rituximab más CHOP es superior a CHOP en pacientes ancianos con linfoma difuso de células B grandes (LDCG): Resultados preliminares de
Medicamentos Biológicos: Aspectos científicos y de fabricación Comparabilidad y Similitud
 INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
INDICE Diferencias entre Medicamento Biológico y Medicamento Genérico Marco Regulatorio Marco Regulatorio EMA (Agencia Europea del Medicamento) Aspectos científicos y de fabricación Aspectos Científicos:
Políticas públicas para la equidad en el acceso y el uso racional de medicamentos y bioterapéuticos
 Políticas públicas para la equidad en el acceso y el uso racional de medicamentos y bioterapéuticos Claudia P. Vaca González Profesora Universidad Nacional de Colombia. Comité de expertos de farmacovigilancia
Políticas públicas para la equidad en el acceso y el uso racional de medicamentos y bioterapéuticos Claudia P. Vaca González Profesora Universidad Nacional de Colombia. Comité de expertos de farmacovigilancia
QUETIAPINA STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO QUETIAPINA STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Quetiapina STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda
OBJETIVO QUETIAPINA STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Quetiapina STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
CURRICULUM VITAE (RESUMEN CORTO)
 CURRICULUM VITAE (RESUMEN CORTO) 1- Nombre: Generoso Guerra Bautista 2- Estado Civil: Casado 3- Apartado Postal: 0819-05356, Panamá, Panamá 4- Teléfonos: (507) 263-3464 265-5155 EDUCACION 1976-1982 Doctor
CURRICULUM VITAE (RESUMEN CORTO) 1- Nombre: Generoso Guerra Bautista 2- Estado Civil: Casado 3- Apartado Postal: 0819-05356, Panamá, Panamá 4- Teléfonos: (507) 263-3464 265-5155 EDUCACION 1976-1982 Doctor
Enfermedades Raras y Medicamentos Huérfanos
 Enfermedades Raras y Medicamentos Huérfanos Prof. A. Domínguez-Gil Hurlé Hospital Universitario de Salamanca Servicio de Farmacia e-mail: adgh@usal.es Valencia, 23 de Octubre de 2008 Las enfermedades
Enfermedades Raras y Medicamentos Huérfanos Prof. A. Domínguez-Gil Hurlé Hospital Universitario de Salamanca Servicio de Farmacia e-mail: adgh@usal.es Valencia, 23 de Octubre de 2008 Las enfermedades
Tratamiento con Revlimid y segundos cánceres, existe una relación?
 Tratamiento con Revlimid y segundos cánceres, existe una relación? Revlimid (lenalidomida) es uno de los varios tratamientos nuevos introducidos en la última década que han cambiado el curso del tratamiento
Tratamiento con Revlimid y segundos cánceres, existe una relación? Revlimid (lenalidomida) es uno de los varios tratamientos nuevos introducidos en la última década que han cambiado el curso del tratamiento
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS. Esther Salgueiro 10, 17 de Marzo de 2015
 FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
FARMACOVIGILANCIA PRESCRIPCIÓN RAZONADA DE MEDICAMENTOS 10, 17 de Marzo de 2015 Esther Salgueiro (salgueiroesther@uniovi.es) FASES DEL DESARROLLO DE MEDICAMENTOS ENSAYO CLÍNICO CONTROLADO/ PRÁCTICA CLÍNICA
Utilidad de PET-TC en el estudio y tratamiento de los linfomas
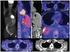 Utilidad de PET-TC en el estudio y tratamiento de los linfomas Montero Juan Manuel ; FiorenzaJuliana ; Villavicencio Roberto Diagnóstico Médico Oroño Oroño1515 -Rosario - Santa Fe Introducción Los linfomas
Utilidad de PET-TC en el estudio y tratamiento de los linfomas Montero Juan Manuel ; FiorenzaJuliana ; Villavicencio Roberto Diagnóstico Médico Oroño Oroño1515 -Rosario - Santa Fe Introducción Los linfomas
BIOSIMILARES Marco Regulatorio Nacional e Internacional. Dra. Claudia Saidman 6-noviembre-2015
 BIOSIMILARES Marco Regulatorio Nacional e Internacional Dra. Claudia Saidman 6-noviembre-2015 1 AGENDA Definición de biológicos Definición de biosimilares Qué es (y qué NO es) un biosimilar? Desarrollo
BIOSIMILARES Marco Regulatorio Nacional e Internacional Dra. Claudia Saidman 6-noviembre-2015 1 AGENDA Definición de biológicos Definición de biosimilares Qué es (y qué NO es) un biosimilar? Desarrollo
Para más información sobre el tratamiento con Keytruda, el paciente deberá leer el prospecto o consultar a su médico o farmacéutico.
 EMA/524789/2017 EMEA/H/C/003820 Resumen del EPAR para el público general pembrolizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia
EMA/524789/2017 EMEA/H/C/003820 Resumen del EPAR para el público general pembrolizumab El presente documento resume el Informe Público Europeo de Evaluación (EPAR) para. En él se explica cómo la Agencia
ACICLOVIR STADA 200 mg comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 ACICLOVIR STADA 200 mg comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Aciclovir STADA 200 mg comprimidos EFG se ha realizado siguiendo las Directrices
ACICLOVIR STADA 200 mg comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Aciclovir STADA 200 mg comprimidos EFG se ha realizado siguiendo las Directrices
ANTICUERPOS ONCONEURONALES y otros anticuerpos EN LA BUSQUEDA DE NEOPLASIAS OCULTAS. Congreso Nacional del Laboratorio Clínico 2016
 ANTICUERPOS ONCONEURONALES y otros anticuerpos EN LA BUSQUEDA DE NEOPLASIAS OCULTAS Congreso Nacional del Laboratorio Clínico 2016 Dr. JoseLuis García de Veas Silva Síndromes neurológicos para neoplásicosy
ANTICUERPOS ONCONEURONALES y otros anticuerpos EN LA BUSQUEDA DE NEOPLASIAS OCULTAS Congreso Nacional del Laboratorio Clínico 2016 Dr. JoseLuis García de Veas Silva Síndromes neurológicos para neoplásicosy
Posibilidad para las personas con esta neoplasia hematológica incurable de vivir más tiempo sin empeoramiento de la enfermedad
 Comunicado de prensa Basilea, 31 de enero de 2011 La FDA aprueba Rituxan/MabThera como terapia de mantenimiento de primera línea de los linfomas foliculares Posibilidad para las personas con esta neoplasia
Comunicado de prensa Basilea, 31 de enero de 2011 La FDA aprueba Rituxan/MabThera como terapia de mantenimiento de primera línea de los linfomas foliculares Posibilidad para las personas con esta neoplasia
REQUISITOS DE CALIDAD EN EL MEDICAMENTO EN INVESTIGACIÓN (Junio 2008)
 agencia española de SUBDIRECCIÓN GENERAL DE MEDICAMENTOS DE USO HUMANO Área de Ensayos Clínicos REQUISITOS DE CALIDAD EN EL MEDICAMENTO EN INVESTIGACIÓN (Junio 2008) Medicamento: toda sustancia o combinación
agencia española de SUBDIRECCIÓN GENERAL DE MEDICAMENTOS DE USO HUMANO Área de Ensayos Clínicos REQUISITOS DE CALIDAD EN EL MEDICAMENTO EN INVESTIGACIÓN (Junio 2008) Medicamento: toda sustancia o combinación
A. DESCRIPCIÓN DEL MEDICAMENTO Y SU INDICACIÓN
 6 CARMUSTINA EN IMPLANTES A. DESCRIPCIÓN DEL MEDICAMENTO Y SU INDICACIÓN 1. Denominación común internacional (DCI), denominación oficial española (DOE) o nombre genérico del principio activo. CARMUSTINA
6 CARMUSTINA EN IMPLANTES A. DESCRIPCIÓN DEL MEDICAMENTO Y SU INDICACIÓN 1. Denominación común internacional (DCI), denominación oficial española (DOE) o nombre genérico del principio activo. CARMUSTINA
ARTRITIS REUMATOIDE DR. ALEJANDRO OLIVÉ MARQUÈS H. U. GERMANS TRIAS I PUJOL. BADALONA (BARCELONA)
 Washington, D.C. ARTRITIS REUMATOIDE DR. ALEJANDRO OLIVÉ MARQUÈS H. U. GERMANS TRIAS I PUJOL. BADALONA (BARCELONA) Dr. Alejandro Olivé Marquès H. U. Germans Trias i Pujol. Badalona (Barcelona) Buenas Noches
Washington, D.C. ARTRITIS REUMATOIDE DR. ALEJANDRO OLIVÉ MARQUÈS H. U. GERMANS TRIAS I PUJOL. BADALONA (BARCELONA) Dr. Alejandro Olivé Marquès H. U. Germans Trias i Pujol. Badalona (Barcelona) Buenas Noches
PREGUNTAS Y RESPUESTAS SOBRE MEDICAMENTOS BIOLÓGICOS - BIOSIMILARES MARZO 2015
 PREGUNTAS Y RESPUESTAS SOBRE MEDICAMENTOS BIOLÓGICOS - BIOSIMILARES MARZO 2015 1. Qué es un medicamento biológico, y en qué se diferencia de los productos químicos? Los fármacos biológicos son medicamentos
PREGUNTAS Y RESPUESTAS SOBRE MEDICAMENTOS BIOLÓGICOS - BIOSIMILARES MARZO 2015 1. Qué es un medicamento biológico, y en qué se diferencia de los productos químicos? Los fármacos biológicos son medicamentos
REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD. DECRETO EJECUTIVO No (De 27 de agosto de 2007 ) EL PRESIDENTE DE LA REPÚBLICA,
 1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
Dr. Christian López Silva. Consolidación del Marco Jurídico de la
 Dr. Christian López Silva Consolidación del Marco Jurídico de la Biotecnología en México Colaboraciones académicas pasadas Mercado Empresas Biotecnológicas en México Salud Agricultura Alimentos Fermentación
Dr. Christian López Silva Consolidación del Marco Jurídico de la Biotecnología en México Colaboraciones académicas pasadas Mercado Empresas Biotecnológicas en México Salud Agricultura Alimentos Fermentación
BLOQUE 2: ETNOFARMACOLOGÍA. Capítulo 9. El estudio farmacológico y clínico de las plantas medicinales.
 BLOQUE 2: ETNOFARMACOLOGÍA Capítulo 9. El estudio farmacológico y clínico de las plantas medicinales. de las plantas medicinales. Interrogantes centrales del tema Farmacología. La investigación y el descubrimiento
BLOQUE 2: ETNOFARMACOLOGÍA Capítulo 9. El estudio farmacológico y clínico de las plantas medicinales. de las plantas medicinales. Interrogantes centrales del tema Farmacología. La investigación y el descubrimiento
vs Sustitución no médica
 Enero 2017 SUSTITUCION O CAMBIO (SWITCHING) NO MÉDICO Mientras que los medicamentos del siglo XXI representan algunos avances notables, a menudo vienen con altos costos. Como resultado, muchas agencias
Enero 2017 SUSTITUCION O CAMBIO (SWITCHING) NO MÉDICO Mientras que los medicamentos del siglo XXI representan algunos avances notables, a menudo vienen con altos costos. Como resultado, muchas agencias
NOMBRE DEL FÁRMACO e indicación clínica (Informe para la Comisión de Farmacia y Terapéutica del Hospital xxxxxxxxxx) Fecha xx/xx/xx
 NOMBRE DEL FÁRMACO e indicación clínica (Informe para la Comisión de Farmacia y Terapéutica del Hospital xxxxxxxxxx) Fecha xx/xx/xx 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Indicación
NOMBRE DEL FÁRMACO e indicación clínica (Informe para la Comisión de Farmacia y Terapéutica del Hospital xxxxxxxxxx) Fecha xx/xx/xx 1.- IDENTIFICACIÓN DEL FÁRMACO Y AUTORES DEL INFORME Fármaco: Indicación
Evaluación del tratamiento con Sunitinib y Sorafenib en el Cáncer de Riñón Metastásico
 Evaluación del tratamiento con Sunitinib y Sorafenib en el Cáncer de Riñón Metastásico Grupo de Seguimiento Dr. Henry Albornoz, Lic. Marcela Baldizzoni, MSc. Gustavo Saona, Dr. Abayuba Perna, QF. Silvia
Evaluación del tratamiento con Sunitinib y Sorafenib en el Cáncer de Riñón Metastásico Grupo de Seguimiento Dr. Henry Albornoz, Lic. Marcela Baldizzoni, MSc. Gustavo Saona, Dr. Abayuba Perna, QF. Silvia
Topiramato STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO Topiramato STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA Los Estudios de Bioequivalencia de Topiramato STADA 25 mg comprimidos recubiertos con película EFG, Topiramato STADA 50
OBJETIVO Topiramato STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA Los Estudios de Bioequivalencia de Topiramato STADA 25 mg comprimidos recubiertos con película EFG, Topiramato STADA 50
AVANCES REGULACIÓN DE MEDICAMENTOS BIOTECNOLÓGICOS ISP-CHILE
 CMC Strategy Forum Latin América 2015 BRASILIA AVANCES REGULACIÓN DE MEDICAMENTOS BIOTECNOLÓGICOS ISP-CHILE oz Espinoza Sección Registro Pr Q.F. FABIOLA MUÑOZ E. SUBDEPARTAMENTO REGISTRO AGENCIA NACIONAL
CMC Strategy Forum Latin América 2015 BRASILIA AVANCES REGULACIÓN DE MEDICAMENTOS BIOTECNOLÓGICOS ISP-CHILE oz Espinoza Sección Registro Pr Q.F. FABIOLA MUÑOZ E. SUBDEPARTAMENTO REGISTRO AGENCIA NACIONAL
Nota mensual. Medicamentos. Productos Sanitarios. Diciembre. sobre. de Uso Humano y. Medicamentos
 Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Nota mensual sobre Medicamentos de Uso Humano y Productos Sanitarios Medicamentos Alertas de productos sanitarios, cosméticos y productos de higiene personal. Medicamentos Nuevos medicamentos aprobados
Forma farmacéutica Vía de administración. Contenido (Concentración) Estado miembro. Nombre. Dinamarca. Vantas 50 mg Implante Subcutánea 50 mg
 ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
ANEXO I RELACIÓN DE LOS NOMBRES DEL MEDICAMENTO, FORMA FARMACÉUTICA, DOSIS, VÍA DE ADMINISTRACIÓN, SOLICITANTE, TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN EN LOS ESTADOS MIEMBROS Estado miembro Dinamarca
DESARROLLO CLÍNICO DE LOS MEDICAMENTOS
 V EDICIÓN LA BUENA PRÁCTICA CLÍNICA EN LOS ENSAYOS CLÍNICOS 7-8 de ABRIL de 2015 DESARROLLO CLÍNICO DE LOS MEDICAMENTOS Dra. Dolores Ochoa Mazarro Servicio de Farmacología Clínica Hospital Universitario
V EDICIÓN LA BUENA PRÁCTICA CLÍNICA EN LOS ENSAYOS CLÍNICOS 7-8 de ABRIL de 2015 DESARROLLO CLÍNICO DE LOS MEDICAMENTOS Dra. Dolores Ochoa Mazarro Servicio de Farmacología Clínica Hospital Universitario
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL
 MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
MEDICAMENTOS SUJETOS A SEGUIMIENTO ADICIONAL v.1 actualización: 17 de mayo de 2013 Fecha de publicación: 17 de mayo de 2013 CORREO ELECTRÓNICO smhaem@aemps.es Página 1 de 6 C/ CAMPEZO, 1 EDIFICIO 8 28022
FENTANILO MATRIX STADA PARCHES TRANSDÉRMICOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 FENTANILO MATRIX STADA PARCHES TRANSDÉRMICOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Fentanilo Matrix STADA se ha realizado siguiendo las Directrices que la
FENTANILO MATRIX STADA PARCHES TRANSDÉRMICOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Fentanilo Matrix STADA se ha realizado siguiendo las Directrices que la
Los Biosimilares: Nuevos Medicamentos Biológicos. Visión de la Industria. José R. Luis-Yagüe Sánchez Director Relaciones CCAA
 Los Biosimilares: Nuevos Medicamentos Biológicos. Visión de la Industria José R. Luis-Yagüe Sánchez José R. Luis-Yagüe Sánchez Director Relaciones CCAA 1 FARMAINDUSTRIA Asociación Nacional Empresarial
Los Biosimilares: Nuevos Medicamentos Biológicos. Visión de la Industria José R. Luis-Yagüe Sánchez José R. Luis-Yagüe Sánchez Director Relaciones CCAA 1 FARMAINDUSTRIA Asociación Nacional Empresarial
El Diagrama de Ariens & Simonis BIOFARMACEUTICA ADMINISTRACION ADMINISTRACION ADMINISTRACION EFECTO EFECTO. Fase BIOFARMACEUTICA. Fase BIOFARMACEUTICA
 UNIVERSIDAD DE LA SABANA FACULTAD DE MEDICINA UNIDAD DE FARMACOLOGIA CLINICA BIOFARMACEUTICA El Diagrama de Ariens & Simonis Dr. CARLOS BUSTAMANTE ROJAS 1 2 Fármaco PRESCRITO ADMINISTRACION Desintegración
UNIVERSIDAD DE LA SABANA FACULTAD DE MEDICINA UNIDAD DE FARMACOLOGIA CLINICA BIOFARMACEUTICA El Diagrama de Ariens & Simonis Dr. CARLOS BUSTAMANTE ROJAS 1 2 Fármaco PRESCRITO ADMINISTRACION Desintegración
Equivalentes terapéuticos
 Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Versión 1 10 Oct 2006 Equivalentes terapéuticos Por qué surge el concepto de equivalentes terapéuticos? El sistema de autorización de medicamentos por parte de las Agencias Reguladoras provoca que en el
Coincidencias con las áreas de actividad de una compañía farmacéutica. 58 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria.
 Programa oficial de formación en la especialización en Farmacia Hospitalaria Coincidencias con las áreas de actividad de una compañía farmacéutica 58 Congreso Nacional de la Sociedad Española de Farmacia
Programa oficial de formación en la especialización en Farmacia Hospitalaria Coincidencias con las áreas de actividad de una compañía farmacéutica 58 Congreso Nacional de la Sociedad Española de Farmacia
CRITERIOS REGULATORIOS PARA EL DICTAMEN DE MEDICAMENTOS BIOTECNOLÓGICOS INNOVADORES Y BIOCOMPARABLES
 CRITERIOS REGULATORIOS PARA EL DICTAMEN DE MEDICAMENTOS BIOTECNOLÓGICOS INNOVADORES Y BIOCOMPARABLES La complejidad de los Medicamentos biotecnológicos, nos obliga a implementar un marco regulatorio robusto
CRITERIOS REGULATORIOS PARA EL DICTAMEN DE MEDICAMENTOS BIOTECNOLÓGICOS INNOVADORES Y BIOCOMPARABLES La complejidad de los Medicamentos biotecnológicos, nos obliga a implementar un marco regulatorio robusto
TRAMADOL/PARACETAMOL STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 TRAMADOL/PARACETAMOL STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Tramadol/Paracetamol STADA se ha realizado siguiendo las Directrices que la Unión
TRAMADOL/PARACETAMOL STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Tramadol/Paracetamol STADA se ha realizado siguiendo las Directrices que la Unión
CONTROVERSIAS CLÍNICAS: PROS Y CONTRAS DEL USO DE FÁRMACOS GENÉRICOS EN TRASPLANTE DE ÓRGANOS SÓLIDOS
 CONTROVERSIAS CLÍNICAS: PROS Y CONTRAS DEL USO DE FÁRMACOS GENÉRICOS EN TRASPLANTE DE ÓRGANOS SÓLIDOS NORMATIVA La Normativa Europea en materia de Medicamentos es tremendamente exigente y garantista :
CONTROVERSIAS CLÍNICAS: PROS Y CONTRAS DEL USO DE FÁRMACOS GENÉRICOS EN TRASPLANTE DE ÓRGANOS SÓLIDOS NORMATIVA La Normativa Europea en materia de Medicamentos es tremendamente exigente y garantista :
Experiencia de Anvisa en biológicos
 Agencia Nacional de Vigilancia Sanitaria Gerencia de Investigaciones, Ensayos Clínicos, Medicamentos Biológicos y Nuevos Coordinación de Productos Biológicos Experiencia de Anvisa en biológicos Brenda
Agencia Nacional de Vigilancia Sanitaria Gerencia de Investigaciones, Ensayos Clínicos, Medicamentos Biológicos y Nuevos Coordinación de Productos Biológicos Experiencia de Anvisa en biológicos Brenda
Retos y oportunidades de los biosimilares en Reumatología
 Retos y oportunidades de los biosimilares en Reumatología Joan M. Nolla Servicio de Reumatología Hospital Universitari de Bellvitge L Hospitalet de LLobregat. Barcelona Conflicto de interés Abbvie, Amgen,
Retos y oportunidades de los biosimilares en Reumatología Joan M. Nolla Servicio de Reumatología Hospital Universitari de Bellvitge L Hospitalet de LLobregat. Barcelona Conflicto de interés Abbvie, Amgen,
ESOMEPRAZOL STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO ESOMEPRAZOL STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Esomeprazol STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda
OBJETIVO ESOMEPRAZOL STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Esomeprazol STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda
ITRACONAZOL STADA CÁPSULAS DURAS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 ITRACONAZOL STADA CÁPSULAS DURAS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El estudio de Bioequivalencia de Itraconazol STADA cápsulas se ha realizado siguiendo las Directrices que la Unión Europea
ITRACONAZOL STADA CÁPSULAS DURAS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El estudio de Bioequivalencia de Itraconazol STADA cápsulas se ha realizado siguiendo las Directrices que la Unión Europea
Experiencias exitosas de Farmacovigiliancia en coordinación con programas de Salud Pública
 Experiencias exitosas de Farmacovigiliancia en coordinación con programas de Salud Pública Dr. Lázaro Eduardo Ávila Berumen Coordinador de Asesores del Comisionado Federal Tel: 5080-5200 ext. 1669, 1483
Experiencias exitosas de Farmacovigiliancia en coordinación con programas de Salud Pública Dr. Lázaro Eduardo Ávila Berumen Coordinador de Asesores del Comisionado Federal Tel: 5080-5200 ext. 1669, 1483
INSTRUCTIVO EXTERNO ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS. Versión [1.0]
![INSTRUCTIVO EXTERNO ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS. Versión [1.0] INSTRUCTIVO EXTERNO ENMIENDAS O MODIFICACIONES EN ENSAYOS CLÍNICOS. Versión [1.0]](/thumbs/67/57830378.jpg) Versión [1.0] Coordinación Técnica de Certificaciones, Autorizaciones y Buenas Prácticas Sanitarias Dirección Técnica de Ensayos Clínicos Septiembre, 2017 Página 3 de 7 CONTENIDO 1. OBJETIVO DEL INSTRUCTIVO...
Versión [1.0] Coordinación Técnica de Certificaciones, Autorizaciones y Buenas Prácticas Sanitarias Dirección Técnica de Ensayos Clínicos Septiembre, 2017 Página 3 de 7 CONTENIDO 1. OBJETIVO DEL INSTRUCTIVO...
CEFUROXIMA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO CEFUROXIMA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Cefuroxima STADA EFG se ha realizado siguiendo las Directrices que la Unión Europea recomienda para
OBJETIVO CEFUROXIMA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Cefuroxima STADA EFG se ha realizado siguiendo las Directrices que la Unión Europea recomienda para
AMLODIPINO STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 AMLODIPINO STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Amlodipino STADA comprimidos EFG se ha realizado siguiendo las Directrices que la Agencia
AMLODIPINO STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Amlodipino STADA comprimidos EFG se ha realizado siguiendo las Directrices que la Agencia
SERTRALINA STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO SERTRALINA STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Sertralina STADA comprimidos EFG se ha realizado siguiendo las Directrices que la Agencia
OBJETIVO SERTRALINA STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Sertralina STADA comprimidos EFG se ha realizado siguiendo las Directrices que la Agencia
Medicamentos. Marco regulador y normativo. Olga Delgado Academia de Ciencias Médicas de Cataluña y Baleares Barcelona, 22 abril :15-16:40 h
 Medicamentos B i o s i m i l a r e s Marco regulador y normativo Olga Delgado Academia de Ciencias Médicas de Cataluña y Baleares Barcelona, 22 abril 2015 16:15-16:40 h Fármacos biológicos presente y futuro
Medicamentos B i o s i m i l a r e s Marco regulador y normativo Olga Delgado Academia de Ciencias Médicas de Cataluña y Baleares Barcelona, 22 abril 2015 16:15-16:40 h Fármacos biológicos presente y futuro
Medicamento Dosis Días Administración Vinorelbina mg/m 2 (2,3) 1 Infusión de 50 ml SF administrado en min* (4,5)
 1. DENOMINACIÓN DEL ESQUEMA: VINORELBINA 2. INDICACIÓN Carcinoma de mama avanzado (1) 3. ESQUEMA Medicamento Dosis Días Administración Vinorelbina 25 30 mg/m 2 (2,3) 1 Infusión de 50 ml SF administrado
1. DENOMINACIÓN DEL ESQUEMA: VINORELBINA 2. INDICACIÓN Carcinoma de mama avanzado (1) 3. ESQUEMA Medicamento Dosis Días Administración Vinorelbina 25 30 mg/m 2 (2,3) 1 Infusión de 50 ml SF administrado
PLATAFORMA DE ONCOLOGÍA
 PROGRAMA SINGULAR EN MEDICINA NUCLEAR : RADIOTERAPIA METABÓLICA Responsables: Dra. Dña. Aurora Crespo y Dr. D. Francisco Pena DEFINICIÓN DE LA LINEA SINGULAR MÉTODO DE APLICACIÓN INDICACIONES MAS IMPORTANTES
PROGRAMA SINGULAR EN MEDICINA NUCLEAR : RADIOTERAPIA METABÓLICA Responsables: Dra. Dña. Aurora Crespo y Dr. D. Francisco Pena DEFINICIÓN DE LA LINEA SINGULAR MÉTODO DE APLICACIÓN INDICACIONES MAS IMPORTANTES
MEDICAMENTOS GENERICOS, SUPERGENERICOS Y BIOSIMILARES
 ESAME MBA Pharma Biotech MEDICAMENTOS GENERICOS, SUPERGENERICOS Y BIOSIMILARES José Javier Muruzábal Tipos de fármacos: Tendencias Biológicos / Biosimilares Nuevas formas farmacéuticas: vectorización Genéricos
ESAME MBA Pharma Biotech MEDICAMENTOS GENERICOS, SUPERGENERICOS Y BIOSIMILARES José Javier Muruzábal Tipos de fármacos: Tendencias Biológicos / Biosimilares Nuevas formas farmacéuticas: vectorización Genéricos
METFORMINA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO
 OBJETIVO METFORMINA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Metformina STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda para demostrar
OBJETIVO METFORMINA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Metformina STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda para demostrar
TAMSULOSINA STADA 0,4 mg cápsulas EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO TAMSULOSINA STADA 0,4 mg cápsulas EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Tamsulosina STADA 0,4 mg cápsulas duras de liberación modificada EFG se ha realizado
OBJETIVO TAMSULOSINA STADA 0,4 mg cápsulas EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Tamsulosina STADA 0,4 mg cápsulas duras de liberación modificada EFG se ha realizado
USO SEGURO DE LA TERAPIA ONCOLÓGICA: INTERCAMBIABILIDAD DE MEDICAMENTOS
 USO SEGURO DE LA TERAPIA ONCOLÓGICA: INTERCAMBIABILIDAD DE MEDICAMENTOS Dra. Carmen Juliana Pino. MD. Esp. Farmacóloga Clínica. MSc. (c) en Docencia de la Educación Superior. Profesora Asistente Universidad
USO SEGURO DE LA TERAPIA ONCOLÓGICA: INTERCAMBIABILIDAD DE MEDICAMENTOS Dra. Carmen Juliana Pino. MD. Esp. Farmacóloga Clínica. MSc. (c) en Docencia de la Educación Superior. Profesora Asistente Universidad
Nelson Rodríguez. Experiencia en Intercambiabilidad de Medicamentos: Panamá. Julio 2017 SECCIÓN DE BIOEQUIVALENCIA
 SECCIÓN DE BIOEQUIVALENCIA DIRECCIÓN NACIONAL DE FARMACIA Y DROGAS Experiencia en Intercambiabilidad de Medicamentos: Panamá Nelson Rodríguez Julio 2017 Antecedentes Marco Legal Ley No. 1 de 10 de enero
SECCIÓN DE BIOEQUIVALENCIA DIRECCIÓN NACIONAL DE FARMACIA Y DROGAS Experiencia en Intercambiabilidad de Medicamentos: Panamá Nelson Rodríguez Julio 2017 Antecedentes Marco Legal Ley No. 1 de 10 de enero
En esta primera sesión de comunicaciones orales sobre melanoma y otros tumores cutáneos se han presentado las siguientes comunicaciones:
 En esta primera sesión de comunicaciones orales sobre se han presentado las siguientes comunicaciones: 1213O. Characterization of complete responses (CRs) in patients with advanced melanoma (MEL) who received
En esta primera sesión de comunicaciones orales sobre se han presentado las siguientes comunicaciones: 1213O. Characterization of complete responses (CRs) in patients with advanced melanoma (MEL) who received
Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana
 Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana Dialogo con las Agencias Regulatorias Extranjeras Bio Latin America Mercedes Soriano 26 de octubre 2016 São Paulo,
Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana Dialogo con las Agencias Regulatorias Extranjeras Bio Latin America Mercedes Soriano 26 de octubre 2016 São Paulo,
AMOXICILINA/ÁCIDO CLAVULÁNICO STADA 875/125 mg polvo para suspensión oral EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 AMOXICILINA/ÁCIDO CLAVULÁNICO STADA 875/125 mg polvo para suspensión oral EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Amoxicilina/Ácido Clavulánico STADA 875/125
AMOXICILINA/ÁCIDO CLAVULÁNICO STADA 875/125 mg polvo para suspensión oral EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Amoxicilina/Ácido Clavulánico STADA 875/125
CONSEJO GENERAL DE COLEGIOS OFICIALES DE MÉDICOS
 La Asamblea General del Consejo General de Colegios Oficiales de Médicos, en sesión celebrada el 16 de noviembre de 2012, adoptó el acuerdo de aprobar, por unanimidad la siguiente Declaración elaborada
La Asamblea General del Consejo General de Colegios Oficiales de Médicos, en sesión celebrada el 16 de noviembre de 2012, adoptó el acuerdo de aprobar, por unanimidad la siguiente Declaración elaborada
PIOGLITAZONA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 PIOGLITAZONA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Pioglitazona STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda para
PIOGLITAZONA STADA EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Pioglitazona STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda para
ÁCIDO IBANDRÓNICO STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 ÁCIDO IBANDRÓNICO STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Ácido Ibandrónico STADA se ha realizado siguiendo las Directrices que la Unión Europea
ÁCIDO IBANDRÓNICO STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Ácido Ibandrónico STADA se ha realizado siguiendo las Directrices que la Unión Europea
RISPERIDONA STADA comprimidos y solución EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO RISPERIDONA STADA comprimidos y solución EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Risperidona STADA se ha realizado siguiendo las Directrices que la Unión Europea
OBJETIVO RISPERIDONA STADA comprimidos y solución EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Risperidona STADA se ha realizado siguiendo las Directrices que la Unión Europea
REVISTA CIENTÍFICA FACULTAD DE FARMACIA. UNIVERSIDAD DE GRANADA. ESPAÑA. Ars Pharmaceutica. Toribio MS, Pombar AS, Oriani SD, Toso RE, Fernández JG.
 REVISTA CIENTÍFICA FACULTAD DE FARMACIA. UNIVERSIDAD DE GRANADA. ESPAÑA Ars Pharmaceutica 2013;54(4):32-36 http://farmacia.ugr.es/ars Originales» Efectos de un programa de Atención Farmacéutica para pacientes
REVISTA CIENTÍFICA FACULTAD DE FARMACIA. UNIVERSIDAD DE GRANADA. ESPAÑA Ars Pharmaceutica 2013;54(4):32-36 http://farmacia.ugr.es/ars Originales» Efectos de un programa de Atención Farmacéutica para pacientes
Clopidogrel STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO Clopidogrel STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Clopidogrel STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda
OBJETIVO Clopidogrel STADA comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Clopidogrel STADA se ha realizado siguiendo las Directrices que la Unión Europea recomienda
MANIDIPINO STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO MANIDIPINO STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA Los Estudios de Bioequivalencia de Manidipino STADA comprimidos EFG se han realizado siguiendo las Directrices que la Agencia
OBJETIVO MANIDIPINO STADA COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA Los Estudios de Bioequivalencia de Manidipino STADA comprimidos EFG se han realizado siguiendo las Directrices que la Agencia
TELMISARTÁN STADA GENÉRICOS COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 TELMISARTÁN STADA GENÉRICOS COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Telmisartán STADA Genéricos se ha realizado siguiendo las Directrices que la
TELMISARTÁN STADA GENÉRICOS COMPRIMIDOS EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA OBJETIVO El Estudio de Bioequivalencia de Telmisartán STADA Genéricos se ha realizado siguiendo las Directrices que la
Dr. JAVIER PALOMINO R. MEDICINA NUCLEAR E IMAGEN MOLECULAR. Abril 2012
 Dr. JAVIER PALOMINO R. MEDICINA NUCLEAR E IMAGEN MOLECULAR Abril 2012 CLASIFICACION DE LINFOMAS Y PATRÓN DE CAPTACIÓN DE FDG. INDICACIONES DE LA 18 F-FDG PET/CT EN LINFOMAS ESTADIAJE LH LNH REESTADIAJE
Dr. JAVIER PALOMINO R. MEDICINA NUCLEAR E IMAGEN MOLECULAR Abril 2012 CLASIFICACION DE LINFOMAS Y PATRÓN DE CAPTACIÓN DE FDG. INDICACIONES DE LA 18 F-FDG PET/CT EN LINFOMAS ESTADIAJE LH LNH REESTADIAJE
Tratamiento inmunoterápico de las metástasis cerebrales. Alfonso Berrocal Hospital General de Valencia
 Tratamiento inmunoterápico de las metástasis cerebrales Alfonso Berrocal Hospital General de Valencia Inmunidad y metástasis cerebrales Cancer 2013;119:2737-46. Ipilimumab y metástasis SNC Ipilimumab bloquea
Tratamiento inmunoterápico de las metástasis cerebrales Alfonso Berrocal Hospital General de Valencia Inmunidad y metástasis cerebrales Cancer 2013;119:2737-46. Ipilimumab y metástasis SNC Ipilimumab bloquea
l 25% de los pacientes con hemofilia A grave desarrolla inhibidores que...
 l 25% de los pacientes con hemofilia A grave desarrolla inhibidores que... http://www.europapress.es/noticiaabonadoprint.aspx?ch=52&cod=2011... de 2 31/10/2011 15:39 Noticias El 25% de los pacientes con
l 25% de los pacientes con hemofilia A grave desarrolla inhibidores que... http://www.europapress.es/noticiaabonadoprint.aspx?ch=52&cod=2011... de 2 31/10/2011 15:39 Noticias El 25% de los pacientes con
