FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge
|
|
|
- Rosa Vázquez Palma
- hace 7 años
- Vistas:
Transcripción
1 BIOMOLÉCULAS. PROTEÍNAS BIOMOLÉCULAS Los bioelementos se unen para formar biomoléculas, también denominadas principios inmediatos. En los seres vivos las moléculas se caracterizan por presentar una gran diversidad, a diferencia del mundo inorgánico que es mucho más uniforme y monótono. La clasificación de las moléculas se realiza también según múltiples criterios, uno de los cuales es que su presencia sea exclusiva de los seres vivos, biomoléculas orgánicas: glúcidos, lípidos, proteínas y ácidos nucleicos; o bien que carezcan de dicha exclusividad y formen también parte del mundo mineral, biomoléculas inorgánicas, como el agua y sales inorgánicas como fosfatos, carbonatos, sulfatos, etc. Del conjunto de moléculas que forman parte de los seres vivos, el agua es sin duda la mayoritaria y aparte de ella, el resto de las biomoléculas, porcentualmente relevantes, son las orgánicas, que son compuestos derivados del carbono. Biomoléculas % peso celular total Tipos de moléculas Agua 70 % 1 Metabolitos 0,2 % 300 Monómeros 2,8 % 550 Macromoléculas 26% ~ 3000 Desde el punto de vista de su tamaño, las biomoléculas son denominadas como: 1) Precursores: Moléculas de peso molecular bajo, tales como el H 2 O, o el CO 2. 2) Metabolitos: Moléculas de peso molecular intermedio, de vida corta e intermediarios de las reacciones metabólicas. 3) Monómeros estructurales: Moléculas de peso molecular intermedio, que son unidades de construcción de las macromoléculas, como los monosacáridos, aminoácidos, etc., 4) Macromoléculas o supramoléculas: Moléculas de elevado peso molecular, como las proteínas, ácidos nucleicos, etc. que presentan una gran variabilidad estructural (Tabla 1) y consecuentemente de función. Las propiedades de estas macromoléculas dan lugar a las características que definen y diferencian a los seres vivos como son: el autoensamblaje, la utilización de energía y la autopropagación. Las biomoléculas desarrollan funciones muy variadas, desde un papel estructural o arquitectónico, consistente en el mantenimiento de la morfología del organismo; a una función energética, para sostener las funciones vitales, o bien una actividad reguladora o de control ajustando todos los requerimientos de materia, energía e información para el organismo. 1
2 PROTEÍNAS Las proteínas son las biomoléculas más abundantes, más variadas y con mayor diversidad de funciones dentro del organismo. Desempeñan papeles fundamentales tanto en el interior de la célula como en el espacio extracelular. El conocimiento del funcionamiento del organismo exige un estudio detallado de la estructura y propiedades de las proteínas. Todos los tipos conocidos de proteínas están formados por tan sólo 20 aminoácidos, denominados aminoácidos comunes, que al unirse forman polímeros. Con tan sólo veinte unidades elementales de construcción se puede realizar tal variedad de combinaciones, que pueden contarse por miles las estructuras distintas diseñadas para desarrollar multitud de actividades biológicas. 1. AMINOÁCIDOS Desde el punto de vista químico, se definen como ácidos orgánicos con un grupo funcional amino. Estructura general de los aminoácidos Los aminoácidos comunes tienen una estructura general similar para todos, formada por un átomo de carbono central o átomo de carbono alfa (α), unido de forma covalente a un grupo ácido o carboxílico (-COOH), un grupo básico o amino (-NH 2 ) y un átomo de hidrógeno. Su cuarta valencia se encuentra saturada por una cadena lateral (R), que es el elemento que diferencia cada uno de los 20 aminoácidos. La existencia de los dos grupos funcionales ácido y amino, además de para obtener su denominación, caracteriza a estas moléculas químicamente, y proporciona a las mismas una serie de propiedades que les permitirá la formación de grandes polímeros. 2
3 Clasificación de los aminoácidos Las estructuras de las cadenas laterales son muy variadas y sus propiedades químicas sirven para clasificar a los aminoácidos en cuatro grupos, dependiendo de la carga o polaridad que presentan a ph fisiológico. Esta carga determina su relación con las moléculas de agua, existiendo aminoácidos hidrófobos o insolubles en agua y aminoácidos hidrófilos muy solubles en agua. Los cuatro grupos son los siguientes: 1) Aminoácidos apolares o hidrófobos. Constituyen el mayor grupo de aminoácidos, y se distinguen porque su cadena lateral no presenta carga, ya que está formada por una cadena hidrocarbonada más o menos larga e insoluble en agua. Dentro de este grupo y de menor a mayor complejidad estarían: Glicina o glicocola, alanina, valina, leucina, isoleucina, prolina, fenilalanina, triptófano y metionina. Twenty-One Amino Acids ( Dan Cojocari). 2) Aminoácidos polares con carga neutra o sin carga. Este grupo de aminoácidos tiene en sus cadenas laterales grupos hidrofílicos que forman puentes de hidrógeno con las moléculas de agua, aumentando su solubilidad, serían: Serina, treonina y tirosina (con un grupo hidroxilado -OH), cisteina (con un grupo sulfhidrilo -SH) y asparragina y glutamina (con un grupo amida -NH 2 ). 3) Aminoácidos aniónicos o ácidos, con carga negativa. Presentan en su cadena lateral un grupo carboxilo que al disociarse a ph 7,0, les proporciona carga neta negativa y propiedades ácidas. Son: Acido aspártico (o aspartato) y ácido glutámico (o glutamato). 3
4 4) Aminoácidos catiónicos o básicos, con carga positiva. Este grupo al contrario que el anterior tiene en su cadena lateral un grupo nitrogenado o amino que le da carga neta positiva y propiedades básicas. Son: Histidina, lisina y arginina. Las propiedades polares y apolares de los aminoácidos tienen una gran importancia para la comprensión del papel jugado por cada uno de ellos en la estructura y propiedades de las proteínas. Los más hidrofóbicos tienden a plegarse situándose en el centro de la molécula proteica, lejos de las moléculas de agua; mientras que, por el contrario, los aminoácidos polares tienden a situarse en el exterior de las moléculas proteicas. Aminoácidos derivados Además de los aminoácidos comunes, en algunas proteínas hay aminoácidos derivados. Cada uno de éstos se obtiene por una reacción química en la cadena lateral. Las modificaciones que se observan son muy variadas, y se producen después de constituida la proteína con el objeto de mejorar la función de la misma. Dentro de las modificaciones más frecuentes se encuentran las incorporaciones de diferentes grupos o radicales como los metilo, acetilo, hidroxilo, fosfato, carboxilo, etc. O bien las ciclaciones, las dimerizaciones como es el caso de la cistina formada por un puente disulfuro entre las dos cadenas laterales de dos cisteinas. Algunos aminoácidos no se encuentran formando parte de proteínas; comparativamente son muy minoritarios, y puede apreciarse en ellos pequeños cambios respecto a los aminoácidos comunes. En algunos casos, desarrollan funciones claramente diferenciadas, como es, por ejemplo, el ácido gamma-amino-butírico (GABA) que actúa como neurotransmisor; la creatina que deriva de la glicocola y es un importante metabolito de reserva energética de las células musculares, o la taurina que unida a los ácidos biliares es un componente de las sales biliares. 4
5 2. EL ENLACE PEPTÍDICO Para construir un péptido o una proteína, los aminoácidos deben unirse a través de un enlace covalente que permita su estabilidad y, como se podrá observar, también su amplia versatilidad. El enlace se establece entre un grupo carboxilo de un aminoácido y un grupo amino de un segundo aminoácido mediante una condensación que provoca la liberación de una molécula de agua, quedando formado un enlace amida. La formación de un único enlace da lugar al péptido más pequeño, o dipéptido, constituido tan sólo por dos aminoácidos. Las uniones de sucesivos aminoácidos da lugar a tripéptidos, tetrapéptidos, oligopéptidos, polipéptidos y en último extremo proteínas. El enlace peptídico es la base para justificar todas las características tanto estructurales como funcionales de las proteínas. La posición que adoptan los electrones del nitrógeno con respecto al carbono le proporcionan algunas características de los enlaces dobles, entre ellas la imposibilidad de rotación de un átomo con respecto al otro, obligando a situarse a dichos átomos y sus sustituyentes en un mismo plano. Sin embargo los enlaces que establece el átomo de carbono α, con el N del grupo amino (enlace φ) y con el C del grupo carboxilo (enlace ψ), sí presentan posibilidades de giro, ya que son enlaces sencillos que permiten una gran libertad de rotación a los lados del rígido plano del enlace peptídico. 5
6 3. PÉPTIDOS Con el nombre de péptidos se definen las moléculas formadas por menos de 100 residuos de aminoácidos, mientras que las moléculas de mayor tamaño son descritas como proteínas. Existe un ilimitado número de péptidos posibles, que se pueden formar con los 20 aminoácidos comunes, sin embargo en el organismo su número es bastante más concreto. Estructura y denominación de los péptidos La estructura simplificada de un péptido podría resumirse en un esqueleto formado por los enlaces peptídicos y los carbonos α. Las cadenas laterales unidas a estos carbonos forman ramificaciones que cuelgan de dicho esqueleto, designándoselas residuos o restos aminoacídicos. La denominación en sentido estricto de un péptido vendría dada por la descripción de sus aminoácidos constituyentes, comenzando por convenio por el aminoácido que tiene su grupo amino libre, y terminando por el que tiene el grupo carboxilo libre, ( 2 HN-Glu-Asn-Pro-Met-Gly-His- Leu-COOH); a pesar de esta regla, los péptidos de interés fisiológico tienen nombres comunes mantenidos por el uso. Entre los péptidos con función biológica bien caracterizada merecen destacarse: a) Glutation (GSH). Tripéptido (γ-glutamil-cisteinil-glicina) que actúa como antioxidante y destoxificante en el interior celular por su capacidad de unirse entre sí formando dímeros a través de la cisteína. b) Oxitocina y Vasopresina: Dos nonapéptidos muy parecidos entre sí, que producidos en la hipófisis, desarrollan diferentes acciones hormonales. c) Encefalinas: Pentapéptidos producidos en el sistema nervioso central que al unirse a determinadas neuronas inducen analgesia (eliminación de las sensaciones de dolor). Metencefalina ( 2 HN-Tyr-Gly-Gly-Phe-Met-COOH) y Leu-encefalina ( 2 HN-Tyr-Gly-Gly-Phe-Leu- COOH). d) Bradiquinina: Nonapéptido que inhibe la inflamación tisular ( 2 HN- Arg-Pro-Pro-Gly-Phe- Ser-Pro-Phe-Arg-COOH) 6
7 Propiedades de los péptidos Sus propiedades derivan en buena parte de las propiedades de los aminoácidos que los componen; así, su solubilidad depende del número de aminoácidos hidrófilos que contengan, y también de la longitud de la cadena peptídica, ya que cuanto más larga sea tendrán menor solubilidad. Su polaridad depende de sus grupos carboxilo y amino terminales, y de la carga de las cadenas laterales de los aminoácidos componentes de su estructura, y al igual que en los aminoácidos tienen pks característicos que son utilizados en múltiples procedimientos bioquímicos para lograr su aislamiento o separación. 7
8 4. CONFORMACIÓN DE LAS PROTEÍNAS Las proteínas son moléculas, en general, muy grandes pudiendo llegar a tener miles de aminoácidos, y por lo tanto sus miles de átomos pueden adoptar una variedad de posiciones en el espacio extremadamente amplia. Cada proteína presenta una estructura espacial característica y única, que se denomina estructura o conformación nativa, y que resulta absolutamente necesaria para que pueda desarrollar su función. Por ello, la descripción de esta estructura permite un conocimiento prácticamente completo de la molécula. Sin embargo, desde el punto de vista práctico resulta una tarea costosa y difícil, de ahí que en la actualidad, tan sólo se conozca íntegramente una pequeña parte de todas las proteínas existentes. Para llevar a cabo el estudio estructural de las proteínas se parcela el análisis en cuatro escalones o niveles, de menor a mayor complejidad, que se denominan: Estructura primaria, secundaria, terciaria y cuaternaria, yuxtaponiéndose uno sobre otro para completar la imagen tridimensional o arquitectónica de la molécula. Main protein structures levels ( Mariana Ruiz Villarreal). 8
9 Estructura primaria Consiste en la determinación de la secuencia de aminoácidos de una proteína, es el nivel de conocimiento más básico y más importante. Las proteínas se diferencian entre sí porque cada una tiene un número de aminoácidos y una secuencia de los mismos distinta. Una serie determinada de aminoácidos dará lugar a una configuración espacial también única y determinada, lo que llevará en último extremo a una función específica y concreta. Estructura secundaria Define las posiciones regulares y repetitivas de aminoácidos adyacentes en una cadena peptídica. Podría suponerse que las posibilidades de colocación en el espacio, que tiene un residuo aminoacídico con respecto a sus vecinos más próximos, son infinitas; sin embargo, la rigidez del plano del enlace peptídico y las limitadas posibilidades de giro alrededor del carbono α, reducen en gran medida las estructuras estables que pueden existir en la realidad. Las rotaciones posibles se miden mediante ángulos de rotación denominados por convención ángulo φ (phi) al enlace N-Cα, y ψ (psi) al enlace Cα -C. Y aunque las posibilidades teóricas permitirían valores entre -180º y +180º, en la realidad muchas de las mismas son imposibles, debido a las interferencias espaciales entre los átomos del esqueleto peptídico y los átomos de las cadenas laterales. Por dicho motivo, las dos estructuras más importantes y abundantes en las proteínas son: La hélice α y la conformación β. (Estudio individual de ambas). 9
10 FISIOLOGÍA GENERAL Jesús Merino Pérez y María José Noriega Borge Estructura terciaria Describe las relaciones espaciales entre todos los aminoácidos de la cadena peptídica, proporciona una imagen tridimensional completa de la molécula. En este nivel se analizan las posiciones en el espacio de aminoácidos que no son consecutivos. A lo largo de una cadena peptídica existen zonas de cambio que están determinadas por la presencia de un número y posición de aminoácidos concretos como son habitualmente Pro, Ser, Thr y Gly. Una proteína grande normalmente contiene varios tipos de estructura secundaria, el plegamiento de la cadena en las zonas de cambio da lugar a que residuos muy alejados en la secuencia primaria aparezcan juntos. Los segmentos de la cadena peptídica plegada se mantienen en posición mediante una serie de enlaces, de naturaleza débil en su mayoría, que se establecen entre residuos aminoacídicos y entre éstos y el entorno. Los enlaces pueden ser puentes de hidrógeno, interacciones hidrofóbicas, fuerzas de Van der Waals, e incluso enlaces covalentes a través de puentes disulfuro. La frontera entre estructura secundaria y terciaria resulta a veces muy difuminada, dependiendo del tipo de molécula que se esté analizando. Existe una clasificación morfológica de las proteínas en dos grupos denominadas proteínas fibrosas y proteínas globulares. Dentro de las fibrosas se encontrarían el colágeno, la queratina o la elastina, proteínas todas ellas que aportan resistencia y/o elasticidad a los medios donde se encuentran. En estas proteínas la conformación queda descrita analizando los dos niveles iniciales de estructura, ya que sus cadenas polipeptídicas tienen una secuencia única y repetitiva de hélice alfa. En cambio las proteínas globulares, que son las más abundantes, disponen de nivel de estructuración terciaria donde se describe la posición y estructura de cada segmento con una estructura secundaria característica. En éstas se describen diferentes regiones denominadas Dominios, que son cadenas de 50 a 350 aminoácidos, formadas por una combinación de hélices alfa y láminas beta, que adoptando diversas posiciones en el espacio dan lugar a una unidad globular. 10
11 Estructura cuaternaria Cuando una proteína está formada por varias cadenas polipeptídicas, cada una recibe el nombre de monómero o subunidad, y la descripción de sus posiciones espaciales y su forma de asociarse determina este último nivel de estructuración. Las interacciones entre los monómeros son del mismo tipo que las que estabilizan las estructuras terciarias, en general interacciones de tipo no covalente. Los monómeros que componen una proteína pueden ser iguales, o análogos, como es el caso de la molécula de hemoglobina formada por cuatro subunidades o monómeros muy parecidos, iguales dos a dos (dos cadenas α y dos cadenas β, α 2 β 2 ); o bien ser totalmente diferentes. Existe un nivel de estructuración que estaría por encima del nivel molecular y que corresponde a las grandes estructuras formadas por autoensamblamiento, que dan lugar a tubos, filamentos, láminas, anillos, etc. Una de estas estructuras complejas sería, por ejemplo, el ribosoma, orgánulo intracelular construido por dos tipos de macromoléculas que son los ácidos nucleicos y las proteínas, su formación se realiza de manera automática al acoplarse sus elementos constituyentes. 5. CLASIFICACIÓN DE LAS PROTEÍNAS Además de su clasificación morfológica en proteínas fibrosas y globulares, existen otros criterios para su clasificación. Desde el punto de vista químico se las cataloga en dos grupos: 1) Proteínas simples, formadas únicamente por aminoácidos. 2) Proteínas conjugadas, en las que además de los aminoácidos, contienen otro tipo de moléculas denominados grupos prostéticos, recibiendo la fracción peptídica el nombre de apoproteína. Dependiendo de la naturaleza del grupo prostético, las proteínas conjugadas se clasifican en: a) Glicoproteínas, si es de naturaleza glucídica. b) Lipoproteínas, si es de naturaleza lipídica. c) Nucleoproteínas, asociadas a los ácidos nucleicos. d) Cromoproteínas, el grupo prostético es una molécula orgánica, porfirina, asociada normalmente con un átomo metálico. e) Fosfoproteínas: Su grupo prostético es un éster fosfato. f) Otras, con grupos muy variados, metales, vitaminas o derivados de las mismas, etc. 11
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
CLASIFICACIÓN SEGÚN SU POLARIDAD NO POLARES POLARES NEUTROS ACIDOS BASICOS
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas.
 Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
I) Biomoléculas 5) Proteínas I-5 PROTEÍNAS
 I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Agua, carbohidratos y Lípidos
 Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
28 A 32. HOJA DE TRABAJO 5o. BLOQUE. Licda. Lilian Judith Guzmán Melgar
 HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
Ácidos nucléicos. Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en Mirel Nervenis
 Ácidos nucléicos Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en 1869 La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos
Ácidos nucléicos Los ácidos nucleicos fueron descubiertos por Freidrich Miescher en 1869 La información genética o genoma, está contenida en unas moléculas llamadas ácidos nucleicos. Existen dos tipos
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
Estructura tridimensional de las proteínas
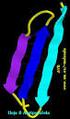 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
4. El esquema adjunto representa la estructura de una molécula denominada lisozima.
 BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
BLOQUE I : La base físico-química de la materia 1. a. Nombre y formule un monosacárido que contenga seis átomos de carbono. b. Indica esquemáticamente una diferencia estructural existente entre el almidón
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Aminoácidos y Proteínas
 Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los
Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura primaria. Estructura secundaria o modelo de Watson y Crick
 COFERENCIA 5 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. ÁCIDOS NUCLEICOS Autor: Dr. Daniel Sánchez Serrano SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura
COFERENCIA 5 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. ÁCIDOS NUCLEICOS Autor: Dr. Daniel Sánchez Serrano SUMARIO Ácidos nucleicos. Estructura general. Tipos principales: ADN y ARN. ADN. Estructura
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
01. INTRODUCCION. Conceptos previos. Verónica González Núñez Universidad de Salamanca
 01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas
 Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Tema 1: Los seres vivos: composición y función
 Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Glúcidos o hidratos de carbono.
 Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Figura 1: Esquema de polímero
 Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
Eje temático: Química: Fenómenos nucleares Polímeros Procesos químicos industriales Contenido: Tipos de polímeros y polimerización Nivel: Cuarto medio Polímeros. Polímeros sintéticos y naturales Polímeros
A M I N O Á C I D O S
 A M I N O Á C I D O S Qué son? Son componentes básicos, estructurales o funcionales de los pép-dos y las proteínas. Presentan: un grupo carboxilo COOH (ácido) y un grupo amino NH2 (básico) Todos los aminoácidos
A M I N O Á C I D O S Qué son? Son componentes básicos, estructurales o funcionales de los pép-dos y las proteínas. Presentan: un grupo carboxilo COOH (ácido) y un grupo amino NH2 (básico) Todos los aminoácidos
INTRODUCCIÓN A LA BIOQUÍMICA. La bioquímica se puede definir como el estudio de las bases moleculares de la vida.
 INTRODUCCIÓN A LA BIOQUÍMICA La bioquímica se puede definir como el estudio de las bases moleculares de la vida. BIOMOLECULAS + Los seres vivos están formados por miles de clases diferentes de moléculas
INTRODUCCIÓN A LA BIOQUÍMICA La bioquímica se puede definir como el estudio de las bases moleculares de la vida. BIOMOLECULAS + Los seres vivos están formados por miles de clases diferentes de moléculas
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS AMINOÁCIDOS
 ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
PREUNIVERSITARIO POPULAR FRAGMENTOS COMUNES. Sábado 24 abril 2012 Ciencias - Biología. Aldo Gárate Soto BIOMOLÉCULAS. Aminoácidos y Proteínas.
 Sábado 24 abril 2012 Ciencias - Biología. Aldo Gárate Soto BIOMOLÉCULAS Aminoácidos y Proteínas. Los aminoácidos son compuestos orgánicos que poseen un grupo amino (NH 2 ), un grupo carboxilo (COOH), un
Sábado 24 abril 2012 Ciencias - Biología. Aldo Gárate Soto BIOMOLÉCULAS Aminoácidos y Proteínas. Los aminoácidos son compuestos orgánicos que poseen un grupo amino (NH 2 ), un grupo carboxilo (COOH), un
Metabolismo de AMINOÁCIDOS
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Metabolismo de AMINOÁCIDOS Dr. Mynor A. Leiva Enríquez Fuente:
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Lehninger Principles of Biochemistry Fourth Edition
 David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
LA ORGANIZACIÓN DEL CUERPO HUMANO
 LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
Proteínas fibrosas. α-queratinas
 Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
MEMBRANA PLASMÁTICA. Guía de Actividades N 10
 Guía de Actividades N 10 MEMBRANA PLASMÁTICA SECTOR EJE 1 UNIDAD 1 : CIENCIAS NATURALES - BIOLOGÍA : ESTRUCTURA Y FUNCIÓN DE LOS SERES VIVOS : ESTRUCTURA Y FUNCIÓN DE LA CÉLULA ESTUDIANTE : PROFESOR :
Guía de Actividades N 10 MEMBRANA PLASMÁTICA SECTOR EJE 1 UNIDAD 1 : CIENCIAS NATURALES - BIOLOGÍA : ESTRUCTURA Y FUNCIÓN DE LOS SERES VIVOS : ESTRUCTURA Y FUNCIÓN DE LA CÉLULA ESTUDIANTE : PROFESOR :
Organización básica del cuerpo humano
 Organización básica del cuerpo humano I. Niveles de organización del cuerpo humano El ser humano es un organismo extremadamente complejo. Existen diferentes niveles de complejidad o de organización en
Organización básica del cuerpo humano I. Niveles de organización del cuerpo humano El ser humano es un organismo extremadamente complejo. Existen diferentes niveles de complejidad o de organización en
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
METABOLISMO DE AMINOACIDOS. Kinesiología 2011
 METABOLISMO DE AMINOACIDOS Kinesiología 2011 BALANCE NITROGENADO BN=Nitrógeno total ingerido Nitrógeno total excretado BN=0 existe equilibrio nitrogenado BN es negativo, cuando hay condiciones de síntesis
METABOLISMO DE AMINOACIDOS Kinesiología 2011 BALANCE NITROGENADO BN=Nitrógeno total ingerido Nitrógeno total excretado BN=0 existe equilibrio nitrogenado BN es negativo, cuando hay condiciones de síntesis
Metabolismo y uso de Proteínas. Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica
 Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
Metabolismo y uso de Proteínas Jorge Ml. Sánchez Centro de Inv. en Nutrición Animal Escuela de Zootecnia Universidad de Costa Rica Metabolismo de las Proteínas Funciones en el organismo 1. Constituyen
Bases Químicas de la Vida II
 Bases Químicas de la Vida II Macromoléculas Moléculas de gran tamaño formadas de unidades variadas de compuestos hechos a base de esqueletos del elemento carbono. A estos compuestos con esqueletos a base
Bases Químicas de la Vida II Macromoléculas Moléculas de gran tamaño formadas de unidades variadas de compuestos hechos a base de esqueletos del elemento carbono. A estos compuestos con esqueletos a base
SESIÓN 5 ESTRUCTURA DE LOS ÁCIDOS NUCLEICOS. Los Ácidos Nucleicos. Moléculas Esenciales Para La Vida
 SESIÓN 5 ESTRUCTURA DE LOS ÁCIDOS NUCLEICOS Los Ácidos Nucleicos. Moléculas Esenciales Para La Vida La secuencia de aminoácidos de un polipéptido está programada en una unidad heredable denominada gen.
SESIÓN 5 ESTRUCTURA DE LOS ÁCIDOS NUCLEICOS Los Ácidos Nucleicos. Moléculas Esenciales Para La Vida La secuencia de aminoácidos de un polipéptido está programada en una unidad heredable denominada gen.
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
QUÍMICA DE PROTEÍNAS COMPOSICIÓN ALIMENTO VOLATIL POR SECADO (AGUA o HUMEDAD) MATERIA SECA ORGANICA INORGANICA (CENIZAS) SOLUBLE EN DISOLVENTES ORGANICOS (GRASA O LIPIDOS) CON NITROGENO (PROTEINAS) NO
I) Biomoléculas 6) Proteínas I-6 PROTEÍNAS
 I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Proteínas. Tabla 1: Funciones de las proteínas
 Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
Colegio Lectura Hispano Complementaria Americano Depto. de Ciencias - Biología Nivel: 4to medio Unidad I Proteínas 1 En las células, son las proteínas las macromoléculas más abundantes y las que constituyen
BIOLOGIA GENERAL Y METODOLOGIA DE LAS CIENCIAS Trabajo Práctico Nº 1:
 BIOLOGIA GENERAL Y METODOLOGIA DE LAS CIENCIAS Trabajo Práctico Nº 1: - 1 - NIVELES DE ORGANIZACIÓN Y BIOMOLÉCULAS Objetivos: Comprender como la materia se va organizando en diferentes niveles. Diferenciar
BIOLOGIA GENERAL Y METODOLOGIA DE LAS CIENCIAS Trabajo Práctico Nº 1: - 1 - NIVELES DE ORGANIZACIÓN Y BIOMOLÉCULAS Objetivos: Comprender como la materia se va organizando en diferentes niveles. Diferenciar
SESIÓN 3 LA QUÍMICA DE LA VIDA
 Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
inactivación de materiales tóxicos o peligrosos, etc.).
 Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLAM 2014
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLAM 2014 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLAM 2014 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Actividad introductoria: Aplicación en la industria de las fuerzas intermoleculares.
 Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Grado 10 Ciencias - Unidad 3 Cómo se relacionan los componentes del mundo? Tema Cómo afectan las fuerzas intermoleculares las propiedades de los compuestos? Curso: Nombre: Actividad introductoria: Aplicación
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
CAPÍTULO 2 FLUJO DE LA INFORMACIÓN BIOLÓGICA FACULTAD DE AGRONOMÍA CURSO DE BIOQUÍMICA
 CAPÍTULO 2 FLUJO DE LA INFORMACIÓN BIOLÓGICA FACULTAD DE AGRONOMÍA CURSO DE BIOQUÍMICA Contenido 2.1 Información biológica e interacciones no covalentes. 2.2 Almacenamiento de la información biológica
CAPÍTULO 2 FLUJO DE LA INFORMACIÓN BIOLÓGICA FACULTAD DE AGRONOMÍA CURSO DE BIOQUÍMICA Contenido 2.1 Información biológica e interacciones no covalentes. 2.2 Almacenamiento de la información biológica
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Plataforma para la monitorización de la Gripe en España
 Plataforma para la monitorización de la Gripe en España La gripe es una de las enfermedades más contagiosas que existen y cada año es responsable de la muerte de cientos de miles de personas en todo el
Plataforma para la monitorización de la Gripe en España La gripe es una de las enfermedades más contagiosas que existen y cada año es responsable de la muerte de cientos de miles de personas en todo el
Concepto de Lípido. Es un grupo de sustancias muy heterogéneas que sólo tienen en común estas dos características:
 Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Clasificación de los lípidos
 LIPIDOS Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden contener
LIPIDOS Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden contener
Pagina casos de estudios:
 Libros para consulta de alumnos en el Área de Biología La Célula. De Coopers Biología Celular y Molecular G. Karp Becker.El mundo de la Célula 6Ed. Editorial Pearson Education. Alberts/Bray/Hopkin/Johnson/Lewis/Raff/Roberts/Walter.
Libros para consulta de alumnos en el Área de Biología La Célula. De Coopers Biología Celular y Molecular G. Karp Becker.El mundo de la Célula 6Ed. Editorial Pearson Education. Alberts/Bray/Hopkin/Johnson/Lewis/Raff/Roberts/Walter.
La organización del cuerpo humano. Punto 1: Los niveles de organización.
 La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos
 1. Definición y clasificación HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) Son compuestos esenciales de los organismos vivos y son
1. Definición y clasificación HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) Son compuestos esenciales de los organismos vivos y son
Clave Genética y Síntesis de Proteínas
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Clave Genética y Síntesis de Proteínas Dr. Mynor A. Leiva Enríquez
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,011 Clave Genética y Síntesis de Proteínas Dr. Mynor A. Leiva Enríquez
