Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
|
|
|
- Encarnación Castillo Muñoz
- hace 8 años
- Vistas:
Transcripción
1 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina de la piel y uñas de los dedos, la fibroína de la seda y las telarañas, y el estimado de a enzimas que catalizan las reacciones biológicas en nuestros cuerpos son todas proteínas. Independientemente de su función, todas las proteínas están construidas de muchas unidades de aminoácidos unidos entre sí en una cadena larga.
2 Los aminoácidos, como su nombre lo implica, son bifuncionales (alfa amino-ácidos). Contienen un grupo amino básico y un grupo carboxilo ácido. Su valor como unidad de todas las proteínas, es la capacidad que tienen de unirse en grandes cadenas formando enlaces amida entre el NH 2 de un aminoácido y el COOH del otro. Con fines de clasificación, las cadenas con menos de 50 aminoácidos se denominan péptidos y las que se forman de más aminoácidos se denominan proteínas.
3 Si hablamos de peso molecular polipéptidos de 5,000 o menor, las proteínas varían entre 6,000 a 41, 000,000. Resumiendo las proteínas y péptidos están formados por unidades de aminoácidos. Al igual que los azucares a los pequeños se denominan según la cantidad de aminoácidos que tengan, pero se les denomina: dipéptidos, tripéptidos etc. Y la unión se realiza por medio de un enlace tipo amida.
4 20 aminoácidos comunes en las proteínas y sus propiedades, estructuras y clasificación según sus propiedades ácido-base. Alanina (Ala), Asparagina (Asn), Cisterna (Cys), Glutamina (Gln), Glicina (Gly), Isoleucina (Ile), Leucina (Leu), Metionina (Met), Fenilalanina (Phe), Prolina (Pro), Serina (Ser), Treonia (Thr), Triptofano (Trp), Tirosina (Tyr), Valina (Val), Ácido Aspártico (Asp), Ácido glutámico (Glu), Arginina (Arg), Histidina (His), Lisina (Lys) Se resumen a continuación en las tabla de libro McMurry 26-1 ( ), con todos sus datos importantes.
5
6
7 Todos son -aminoácidos, lo que significa que el grupo amino en cada uno es un sustituyente en el átomo de carbono, el siguiente al grupo carbonilo. Diecinueve de los 20 aminoácidos son aminas primarias, RNH 2, y únicamente difieren en la naturaleza del sustituyente unido al carbono, llamado cadena lateral. Además de los 20 aminoácidos que se encuentran comúnmente en las proteínas, otros dos selenocisteína y pirrolisina se encuentran en algunos organismos, y también se encuentran en la naturaleza más de 700 aminoácidos no proteínicos.
8
9 QUIRALIDAD A excepción de la glicina, H 2 NCH 2 CO 2 H, los carbonos de los aminoácidos son centros quirales. Por lo tanto, son posibles dos enantiómeros de cada uno, pero la naturaleza sólo utiliza uno para construir proteínas. En las proyecciones de Fischer, el estado natural de los aminoácidos se representa al colocar el grupo CO 2 en la parte superior y la cadena lateral abajo, como si se representara un carbohidrato y colocando el grupo NH 3 a la izquierda. Debido a su similitud estereoquímica con los azúcares, con frecuencia los -aminoácidos que se encuentran en estado natural se refieren como aminoácidos L.
10 Algunos D- aminoácidos se encuentran en pequeños péptidos presentes en la pared celular de algunas bacterias.
11 Además, los 20 aminoácidos comunes pueden clasificarse como neutros, ácidos o básicos, dependiendo de la estructura de sus cadenas laterales. Quince de los veinte tienen cadenas laterales neutras, dos (ácido aspártico y ácido glutámico) tienen una función extra de ácido carboxílico en sus cadenas laterales, y tres (lisina, arginina e histidina) tienen grupos amino básicos en sus cadenas laterales. Sin embargo, observe que la cisteína (un tiol) y la tirosina (un fenol), aunque es usual clasificarlos como aminoácidos neutros, tienen cadenas laterales débilmente ácidas que pueden desprotonarse en una disolución fuertemente básica.
12 A un ph fisiológico de 7.3 dentro de las células, se desprotonan los grupos carboxilo de la cadena lateral del ácido aspártico y del ácido glutámico y se protonan los nitrógenos básicos de la cadena lateral de la lisina y de la arginina. Sin embargo, la histidina, la cual contiene un anillo heterocíclico de imidazol en su cadena lateral, no es lo suficientemente básica como para protonarse a un ph de 7.3 Observe que sólo es básico el nitrógeno unido con un enlace doble parecido al de la piridina en la histidina. El nitrógeno unido con un enlace sencillo parecido al del pirrol no es básico debido a que su par de electrones no enlazado es parte de los seis electrones π del anillo aromático de imidazol.
13 Aminoácidos esenciales y no esenciales. Los aminoácidos se clasifican en esenciales y no esenciales, basados en las necesidades de la dieta humana, los esenciales son los que no producen el organismo y se requiere adquirir de los alimentos y los no esenciales si pueden ser sintetizados por el organismo humano. Los humanos son capaces de sintetizar sólo 11 de los 20 aminoácidos que se encuentran en las proteínas, llamados aminoácidos no esenciales. Los otros nueve, llamados aminoácidos esenciales, sólo se biosintetizan en plantas y microorganismos y deben obtenerse en nuestra ingesta diaria.
14 Sin embargo, la división entre aminoácidos esenciales y no esenciales no está bien definida, por ejemplo, algunas veces la tirosina se considera no esencial debido a que los humanos pueden producirla a partir de la fenilalanina, pero la fenilalanina es esencial y debe obtenerse en la ingesta diaria.
15 La arginina puede biosintetizarse por los humanos, pero la mayor parte de la arginina que necesitamos proviene de nuestra ingesta diaria. Esta clasificación puede variar según otros autores. A las proteínas que contienen todos los aminoácidos esenciales se las denomina completas y en general se encuentran en alimentos tales como carnes, huevos, lácteos y derivados. Las proteínas de vegetales y cereales se denominan incompletas ya que no aportan al organismo todos los aminoácidos esenciales. Este concepto es particularmente importante en individuos vegetarianos.
16 Según sus propiedades Ácido-Base Ácidos Neutros Básicos Asp & Glu Ala, Asn, Cys, Gln, Gly, Ile, Leu, Met, Phe, Pro, Ser, Thr, Trp, Tyr & Val Arg, His & Lys
17 Propiedades físicas: Los aminoácidos son sólidos cristalinos no volátiles, solubles en agua, que no funden sino se descomponen a altas temperaturas. Son insolubles en disolventes apolares, como éter etílico o cloroformo. Estas propiedades son características de compuestos iónicos y no de sólidos covalentes.
18 Aminoácidos como iones dipolares Los aminoácidos existen en disolución acuosa principalmente en la forma de un ion dipolar, o zwitterion (del alemán zwitter, que significa híbrido ) Los zwitteriones de los aminoácidos son sales internas y, por lo tanto, tienen muchas de las propiedades físicas asociadas con las sales. Tienen momentos dipolares grandes, son solubles en agua pero insolubles en hidrocarburos y son sustancias cristalinas con puntos de fusión relativamente altos.
19 Además, los aminoácidos son anfóteros, ya que pueden reaccionar como ácidos o como bases, dependiendo de las circunstancias. En disolución ácida acuosa, un zwitterion de aminoácido es una base que acepta un protón para producir un catión; en disolución básica acuosa, el zwitterion es un ácido que pierde un protón para formar un anión. Nótese que es el carboxilato, - COO, el que actúa como el sitio básico y acepta un protón en la disolución ácida, y es el catión amonio, + NH 3, el que actúa como el sitio ácido y dona un protón en la disolución básica.
20 Si conocemos tanto el ph de una disolución como el pk a de un ácido HA, podemos calcular la relación de [A] a [HA] en la disolución. Además, cuando ph = pk a, las dos formas A y HA están presentes en cantidades iguales debido a que log 1 = 0. Encontremos qué especies están presentes en una disolución 1.00 M de la Alanina a ph La Alanina protonada [ + H 3 NCH(CH 3 )CO 2 H] tiene un pk a = 2.34, y la Alanina como un ion dipolar neutro (zwitterion) [ + H 3 NCH(CH 3 )CO 2- ] tiene un pka =9.69:
21 Dado que el ph de la disolución está mucho más cerca de pk a2 que de pk a1, para el cálculo necesitamos utilizar pk a2. A partir de la ecuación de Henderson-Hasselbalch, tenemos: Además, sabemos que Al resolver las dos ecuaciones simultáneas se obtiene que [HA] = 0.83 y [A] = En otras palabras, a ph 9.00, 83% de las moléculas de Alanina en disolución 1.00 M son iones dipolares neutros (zwitteriones), y 17% están desprotonadas.
22 Se calcula por separado cada etapa de la curva de titulación. La primera etapa, de ph de 1 a 6, corresponde a la disociación de la alanina protonada, H 2 A +. La segunda etapa, de ph 6 a 11, corresponde a la disociación de la alanina como ion dipolar neutro (zwitterion), HA. Ejercicio en clase: Calcule la concentración de ión zwitterion y protonado de una solución de Alanina de 1.0 M a ph = 2.0. (tienen 10 minutos reunirse en lo grupos y entregar el resultado) = 0.34 [HA] = 1.00 / 2.19 = [A - ] =.543
23 Curva de Titulación de la Alanina: Observe cuidadosamente la curva de titulación. En disolución ácida, el aminoácido es protonado y existe principalmente como un catión.
24 En disolución básica, el aminoácido es desprotonado y existe principalmente como un anión. Entre las dos está a un ph intermedio en el que el aminoácido está balanceado exactamente entre las formas aniónica y catiónica y existe principalmente como un ion dipolar neutro (zwitterion). Este ph se llama punto isoeléctrico (pi) del aminoácido y tiene un valor de 6.01 para la alanina. Los 15 aminoácidos neutros tienen puntos isoeléctricos cercanos a un ph neutro, en el intervalo de ph de 5.0 a 6.5.
25 Los dos aminoácidos ácidos tienen puntos isoeléctricos en ph más bajos por lo que la desprotonación del CO 2 H de la cadena lateral no ocurre en su pi, y los tres aminoácidos básicos tienen puntos isoeléctricos a ph más altos, por lo que la protonación del grupo amino de la cadena lateral no ocurre en su pi. Más específicamente, el pi de cualquier aminoácido es el promedio de las dos constantes ácidas de disociación que involucran al ion dipolar neutro (zwitterion) Para los 13 aminoácidos con una cadena lateral neutra, el pi es el promedio de pk a1 y pk a2. Para los cuatro aminoácidos con una cadena lateral fuertemente o débilmente ácida, el pi es el promedio de los dos valores más bajos de pk a.
26 Para los tres aminoácidos con una cadena lateral básica, el pi es el promedio de los valores más altos de pka. De igual manera que los aminoácidos individuales tienen puntos isoeléctricos, las proteínas tienen un pi global debido a los aminoácidos ácidos o básicos que pueden contener.
27 Por ejemplo, la enzima lisozima tiene una preponderancia de aminoácidos básicos y por lo tanto tiene un punto isoeléctrico alto (pi =11.0). La pepsina tiene una preponderancia de aminoácidos ácidos y un punto isoeléctrico bajo (pi =1.0). No es sorprendente, que las solubilidades y las propiedades de las proteínas con pi s diferentes son afectadas fuertemente por el ph del medio. La solubilidad es por lo general más baja en el punto isoeléctrico, donde la proteína no tiene carga neta, y es mayor por arriba y por debajo del pi, donde la proteína está cargada. Aprovechamos la ventaja de las diferencias en los puntos isoeléctricos para separar una mezcla de proteínas en sus constituyentes puros. Si utilizamos una técnica conocida como electroforesis, una mezcla de proteínas se coloca cerca del centro de una tira de papel o de un gel. El papel o el gel se humedece con un amortiguador acuoso (buffer) a un ph dado, y los electrodos se conectan a los extremos de la tira.
28 Cuando se aplica un potencial eléctrico, las proteínas con cargas negativas (las que se desprotonan debido a que el ph del amortiguador está por encima de su punto isoeléctrico) migran lentamente hacia el electrodo positivo. Al mismo tiempo, los aminoácidos con cargas positivas (los que se protonan debido a que el ph del amortiguador está por debajo de su punto isoeléctrico) migran hacia el electrodo negativo. Las proteínas diferentes migran a velocidades distintas, dependiendo de sus puntos isoeléctricos y del ph del amortiguador acuoso, por lo que separan la mezcla en sus componentes puros.
29 Los aminoácidos se moverán en función de su punto isoeléctrico y el ph del medio.
30 Péptidos y proteínas, al tener también un pi, pueden ser separados por esta técnica.
31 Determinación del punto isoeléctrico de un péptido Considere el siguiente pentapéptido LEKAT (leucina-glutamato-lisina-alaninatreonina)
32 Cálculo del Punto Isoeléctrico pk a 1, aa C-terminal 3.1 pk a 2 grupo ácido del glutamato 4.4 pk a 3, aa N-terminal 8 pk a 4 grupo amino de lisina, 10 pi = ( )/2 = 6.2 A ph inferior a 2, la carga neta es +2 Se añade base y el ph se eleva a ph 6, entonces, se han desprotonado los carboxilos C-terminal y del glutamato y la carga neta es cero (punto isoeléctrico). A ph 9 se ha desprotonado el N-terminal, carga neta-1 A ph 12 se desprotona el amino de la lisina y la carga neta es -2.
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
AMINOÁCIDOS Y PÉPTIDOS
 TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
TEMA 4 AMINOÁCIDOS Y PÉPTIDOS 1. Estructura y clasificación de los aminoácidos. 2. Propiedades ácido-base de los aminoácidos y péptidos 3. El enlace peptídico 4. Péptidos: hidrólisis y secuenciación 1.
ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO
 ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO Todos los aminoácidos tienen, como mínimo, dos grupos titulables o ionizables, cada uno con un pka característico y, por tanto, con dos zonas tampón
ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO Todos los aminoácidos tienen, como mínimo, dos grupos titulables o ionizables, cada uno con un pka característico y, por tanto, con dos zonas tampón
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
3. AMINOACIDOS. PROPIEDADES ACIDO-BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 3. AMINOACIDOS. PROPIEDADES ACIDO-BASE ESQUEMA - Aminoácidos. Definición, funciones y clasificación - Tipos de aminoácidos: aminoácidos
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 3. AMINOACIDOS. PROPIEDADES ACIDO-BASE ESQUEMA - Aminoácidos. Definición, funciones y clasificación - Tipos de aminoácidos: aminoácidos
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
5. PROBLEMAS SOBRE EQUILIBRIOS ACIDO BASE & AMINOACIDOS
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 5. PROBLEMAS SOBRE EQUILIBRIOS ACIDO BASE & AMINOACIDOS Para realizar estos problemas se aconseja consultar una tabla con las
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 5. PROBLEMAS SOBRE EQUILIBRIOS ACIDO BASE & AMINOACIDOS Para realizar estos problemas se aconseja consultar una tabla con las
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS AMINOÁCIDOS
 ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
ESTRUCTURA Y PROPIEDADES DE AMINOÁCIDOS Y PÉPTIDOS Fabián Rodríguez Julio 2011 AMINOÁCIDOS Un aminoácido es una molécula orgánica que en su estructura contiene un grupo amino (NH 2 ) y un grupo carboxilo
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade
 +UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
+UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
Lehninger Principles of Biochemistry Fourth Edition
 David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
AMINOÁCIDOS, PÉPTIDOS Y PROTEINAS. M.Sc. GABY MÓNICA FELIPE BRAVO
 AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINOACIDOS Y PEPTIDOS. SEMANA 29 Licda. Lilian Judith Guzmán Melgar
 AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS SEMANA 29 Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los mas importantes en el mundo biológico son los α-aminoácidos,
XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA
 Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
Rol de los Aminoácidos en el Cultivo de Vid XII SIMPOSIUM INTERNACIONAL DE LA UVA DE MESA - SIUVA 2011 La Molina, 06 y 07 de Julio, 2011 Ing. M.Sc. Federico Ramírez D. Gerente Técnico Aminoácidos Las plantas
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Agua (o humedad, si se conoce)*
 QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Entregar el 21 de Mayo. Selecciona un alimento, de preferencia de los que consumes con regularidad, que contenga proteínas. 1. De acuerdo
QUÍMICA DE ALIMENTOS I Tarea 10: Las Proteínas en los alimentos. Entregar el 21 de Mayo. Selecciona un alimento, de preferencia de los que consumes con regularidad, que contenga proteínas. 1. De acuerdo
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
AMINOÁCIDOS, PEPTIDOS Y PROTEÍNAS. Profesor Carlos Urzúa Stricker
 AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
El agua como disolvente
 hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
hidrofobicas El agua como disolvente El elevado momento dipolar del agua y su facilidad para formar puentes de hidrógeno hacen que el agua sea un excelente disolvente. Una molécula o ión es soluble en
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 29 2018 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
29 2018 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Metodologías básicas del procesamiento de Proteinas
 Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES 2. - REACCIONES ENTRE LOS ACIDOS Y LAS BASES CH 3 COOH + NH 3 CH 3 COO - + NH 4 H 2 O OH - + H +
 1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
1 1. - DEFINICION DE LOS ÁCIDOS Y DE LAS BASES Se define un ácido como cualquier ión o molécula capaz de ceder protones. Por lo contrario, una base es cualquier ión o molécula capaz de fijar protones.
ácidos orgánicos con un grupo amino en posición alfa
 AMINOÁIDOS ASPETOS GENERALES Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa. Según esta definición, los cuatro sustituyentes del carbono
AMINOÁIDOS ASPETOS GENERALES Desde el punto de vista químico, los aminoácidos (AA) son ácidos orgánicos con un grupo amino en posición alfa. Según esta definición, los cuatro sustituyentes del carbono
Proteínas fibrosas. Alfa Queratinas Beta-Queratinas Fibroína Colágeno Elastina
 Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
PROTEINAS AMINOACIDOS
 PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
Diferencias entre leche de vaca y de cabra
 Diferencias entre leche de vaca y de cabra Introducción: La leche de cabra tiene propiedades interesantes. El objetivo de este trabajo es poner de relieve algunas de las diferencias entre leche de cabra
Diferencias entre leche de vaca y de cabra Introducción: La leche de cabra tiene propiedades interesantes. El objetivo de este trabajo es poner de relieve algunas de las diferencias entre leche de cabra
7.012 Serie de ejercicios 1
 ombre Grupo 7.01 Serie de ejercicios 1 Pregunta 1 a) uáles son los 4 tipos principales de moléculas biológicas mencionadas en clase? ite una función importante de cada tipo de molécula biológica celular.
ombre Grupo 7.01 Serie de ejercicios 1 Pregunta 1 a) uáles son los 4 tipos principales de moléculas biológicas mencionadas en clase? ite una función importante de cada tipo de molécula biológica celular.
Profesor Cristian Omar Alvarez De La Cruz
 Aminoácidos by Cristian Omar Alvarez is licensed under a Creative Commons Reconocimiento-NoComercial-CompartirIgual 3.0 Unported License. Profesor Cristian Omar Alvarez De La Cruz Son las unidades monoméricas
Aminoácidos by Cristian Omar Alvarez is licensed under a Creative Commons Reconocimiento-NoComercial-CompartirIgual 3.0 Unported License. Profesor Cristian Omar Alvarez De La Cruz Son las unidades monoméricas
AMINOACIDOS Y PROTEÍNAS
 AMINOACIDOS Y PROTEÍNAS I. OBJETIVO. Reconocer aminoácidos y proteínas a nivel de laboratorio. Analizar el tipo de estructura de los aminoácidos. II. FUNDAMENTO TEORICO. AMINOACIDOS: Cualquiera de los
AMINOACIDOS Y PROTEÍNAS I. OBJETIVO. Reconocer aminoácidos y proteínas a nivel de laboratorio. Analizar el tipo de estructura de los aminoácidos. II. FUNDAMENTO TEORICO. AMINOACIDOS: Cualquiera de los
Bioquímica Estructural y Metabólica. Tema 2. Aminoácidos
 TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas
 GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas I.- Conceptos básicos: Aminoácidos: Estructura y propiedades ácido base de los aminoácidos. Clasificación según su polaridad. Capacidad buffer. El
GUIA DE ESTUDIO Nº 9: Aminoácidos, Proteínas y Enzimas I.- Conceptos básicos: Aminoácidos: Estructura y propiedades ácido base de los aminoácidos. Clasificación según su polaridad. Capacidad buffer. El
Solubilidad. y se representa por.
 Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
Solubilidad Solubilidad. La solubilidad mide la cantidad máxima de soluto capaz de disolverse en una cantidad definida de disolvente, a una temperatura determinada, y formar un sistema estable que se denomina
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
PRACTICA 4 ELECTROFORESIS EN PAPEL DE AMINOACIDOS
 PRACTICA 4 ELECTROFORESIS EN PAPEL DE AMINOACIDOS 1.- OBJETIVO: El objetivo fundamental de la practica es la comprobación de la migración electroforética de los aminoácidos sometidos a un campo eléctrico
PRACTICA 4 ELECTROFORESIS EN PAPEL DE AMINOACIDOS 1.- OBJETIVO: El objetivo fundamental de la practica es la comprobación de la migración electroforética de los aminoácidos sometidos a un campo eléctrico
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Clasificación de los AA en familias, según su biosíntesis
 Tema 15: : Aspectos generales de la biosíntesis de aminoácidos. Fijación n del nitrógeno a cadenas carbonadas. Algunos ejemplos de interés s biológico. T 15 síntesis AA Los AA se clasifican en esenciales
Tema 15: : Aspectos generales de la biosíntesis de aminoácidos. Fijación n del nitrógeno a cadenas carbonadas. Algunos ejemplos de interés s biológico. T 15 síntesis AA Los AA se clasifican en esenciales
10.8. Balances de carga y materia
 10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
10.8. Balances de carga y materia La determinación de la concentración de todas las especies en equilibrio de la disolución acuosa diluida de ácidos y bases se resume a un problema de N ecuaciones no lineales
MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN
 MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN Propiedades de una proteína que son útiles para su purificación por cromatografía Peso molecular Carga iónica Hidrofobicidad
MÉTODOS CROMATOGRÁFICOS: 1. Exclusión molecular 2. Intercambio iónico 3. Afinidad SSN Propiedades de una proteína que son útiles para su purificación por cromatografía Peso molecular Carga iónica Hidrofobicidad
EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller
 2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
2010 Reacciones de intercambio de Protones EJERCICIOS PARA EXAMEN U6 Química 2º Bachiller Recopilación de ejercicios preguntados en exámenes de cursos anteriores Mª Teresa Gómez Ruiz IES Politécnico Cartagena.
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
El agua. El agua. Se pueden ver muy bien los 4 puentes de hidrógeno que forma la molécula de agua central.
 El agua El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente
El agua El agua es una de las sustancias más peculiares conocidas. Es una molécula pequeña y sencilla, pero tras su aparente simplicidad presenta una complejidad sorprendente que la hace especialmente
Aminoácidos y proteínas. Cintia Mendez Vedia
 Aminoácidos y proteínas Cintia Mendez Vedia Aminoácidos Grupo amino (protonado) Grupo carboxilo (disociado) H 3 N + C H Cadena lateral R Carbono Aminoácidos Funciones + H 3 N C H + H 3 N C H H C OH H
Aminoácidos y proteínas Cintia Mendez Vedia Aminoácidos Grupo amino (protonado) Grupo carboxilo (disociado) H 3 N + C H Cadena lateral R Carbono Aminoácidos Funciones + H 3 N C H + H 3 N C H H C OH H
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
Ablandamiento de agua mediante el uso de resinas de intercambio iónico.
 Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
Ablandamiento de agua por intercambio iónica página 1 Ablandamiento de agua mediante el uso de resinas de intercambio iónico. (Fuentes varias) Algunos conceptos previos: sales, iones y solubilidad. Que
Proteínas y su Papel Biológico
 Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas Proteínas y su Papel Biológico Las proteínas son macromoléculas de gran diversidad de formas y versatilidad de funciones. Pueden servir como componentes estructurales de células y tejidos (pelo,
Proteínas: Leche y caseína
 Proteínas: Leche y caseína El papel de la leche en la naturaleza es para alimentar y proporcionar una protección inmunológica para los mamíferos jóvenes. La leche ha sido una fuente de alimento para los
Proteínas: Leche y caseína El papel de la leche en la naturaleza es para alimentar y proporcionar una protección inmunológica para los mamíferos jóvenes. La leche ha sido una fuente de alimento para los
a) Aminoácidos b) Estructura primaria
 Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
2.2- FENOLES. Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH.
 2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
2.2- FENOLES Como ya hemos indicado, se obtienen al sustituir uno o más átomos de hidrógeno del benceno por radicales OH. Si se sustituye un solo átomo de hidrógeno, se obtienen los fenoles; si se sustituyen
1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina.
 1521 Química rgánica III TAEA 2 1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina. 2. Cómo prepararías los siguientes aminoácidos empleando
1521 Química rgánica III TAEA 2 1. Cómo prepararías los siguientes aminoácidos empleando la síntesis de Strecker? a) Glicina, b) Valina, c) Leucina. 2. Cómo prepararías los siguientes aminoácidos empleando
Proteínas, Aminoácidos y Ejercicio.
 Proteínas, Aminoácidos y Ejercicio. Leonardo Ferraretto Profesor de Nutrición Aplicada Universidad Abierta Interamericana Grupos de Estudio 757 Rosario, Argentina Introducción: Los aminoácidos son las
Proteínas, Aminoácidos y Ejercicio. Leonardo Ferraretto Profesor de Nutrición Aplicada Universidad Abierta Interamericana Grupos de Estudio 757 Rosario, Argentina Introducción: Los aminoácidos son las
TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO)
 TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO) Existen 2 clases de electrización, la positiva (que se representa con + ), y la negativa (que se representa con - ). Hay una partícula
TECNOLOGIA RESUMEN DEL TEMA 3 (NOCIONES DE ELECTRICIDAD Y MAGNETISMO) Existen 2 clases de electrización, la positiva (que se representa con + ), y la negativa (que se representa con - ). Hay una partícula
Tema 7: Solubilidad. (Fundamentos de Química, Grado en Física) Equilibrio químico Enero Mayo, 2011 1 / 24
 Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
Tema 7: Solubilidad. Producto de solubilidad. Efecto del ion común en la solubilidad. Limitaciones al producto de solubilidad: K ps. Criterios para la precipitación de la sal. Precipitación fraccionada.
EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE
 Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Página: 1/7 DEPARTAMENTO ESTRELLA CAMPOS PRÁCTICO 8: EQUILIBRIO QUÍMICO: REACCIONES ÁCIDO-BASE Bibliografía: Química, La Ciencia Central, T.L. Brown, H. E. LeMay, Jr., B. Bursten; Ed. Prentice-Hall, Hispanoamérica,
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
Practica la genética Ficha didáctica del profesorado Bachillerato
 Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
La electrólisis CONTENIDOS. Electrolitos. Iones. Carga eléctrica negativa. www.codelcoeduca.cl
 La electrólisis Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos
La electrólisis Las moléculas de ciertos compuestos químicos, cuando se encuentran en disolución acuosa, presentan la capacidad de separarse en sus estructuras moleculares más simples y/o en sus átomos
AMINOÁCIDOS 3B EXPLIQUE EL COMPORTAMIENTO DEL ACIDO ASPARTICO A UNA SOLUCION CON PH DE 8
 AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas.
 AMINÁCIDS Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas. Un aminoácido, posee dos grupos funcionales característicos
AMINÁCIDS Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas. Un aminoácido, posee dos grupos funcionales característicos
Dar a conocer la capacidad de disolución del agua frente a otras sustancias.
 MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
MINISTERIO DE EDUCACION Actividad 1: Agua en la vida II. Laboratorio: Solubilidad del agua 1. Tema: AGUA DISOLVENTE UNIVERSAL 2. Objetivo: Dar a conocer la capacidad de disolución del agua frente a otras
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Fuerzas de Van der Waals. Momento Dipolar
 Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
Momento Dipolar Muchas moléculas eléctricamente neutras, esto es, sin carga neta, poseen una distribución de cargas no homogénea. Esto se debe a que los átomos que las forman tienen diferente electronegatividad,
DISOLUCIONES Y AMINOÁCIDOS
 DISOLUCIONES Y AMINOÁCIDOS EQUILIBRIO QUIMICO Las reacciones reversibles son aquellas en las que los reactivos no se transforman totalmente en productos, ya que éstos vuelven a formar los reactivos, dando
DISOLUCIONES Y AMINOÁCIDOS EQUILIBRIO QUIMICO Las reacciones reversibles son aquellas en las que los reactivos no se transforman totalmente en productos, ya que éstos vuelven a formar los reactivos, dando
Todo lo que los padres deben saber para que su hijo se alimente bien y crezca sano
 http://www.librosaguilar.com/es/ Empieza a leer... Primeros capítulos ANA Mª REQUEJO ROSA Mª ORTEGA Todo lo que los padres deben saber para que su hijo se alimente bien y crezca sano NUTRIENTES Clasificación,
http://www.librosaguilar.com/es/ Empieza a leer... Primeros capítulos ANA Mª REQUEJO ROSA Mª ORTEGA Todo lo que los padres deben saber para que su hijo se alimente bien y crezca sano NUTRIENTES Clasificación,
Propiedades Físicas y Químicas de los Herbicidas. Lectura 2
 Físicas y Químicas de los Herbicidas Lectura 2 Conceptos Básicos Química orgánica ciencia que estudia los compuestos a base de Carbono (número atómico 6 en la Tabla Periódica) Compuestos orgánicos pueden
Físicas y Químicas de los Herbicidas Lectura 2 Conceptos Básicos Química orgánica ciencia que estudia los compuestos a base de Carbono (número atómico 6 en la Tabla Periódica) Compuestos orgánicos pueden
LAS PROTEÍNAS, LOS GLÚCIDOS Y LAS GRASAS
 LAS PROTEÍNAS, LOS GLÚCIDOS Y LAS GRASAS Las proteínas son elementos de construcción. Hombre de 65 kilos 65 gramos de proteínas Las necesidades diarias de proteínas se estiman en 1 g por kilo de peso.
LAS PROTEÍNAS, LOS GLÚCIDOS Y LAS GRASAS Las proteínas son elementos de construcción. Hombre de 65 kilos 65 gramos de proteínas Las necesidades diarias de proteínas se estiman en 1 g por kilo de peso.
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Lic. Lidia Iñigo Las fuerzas intermoleculares, como su nombre lo indica, son las fuerzas que unen moléculas. Ya deberías saber que no todas las sustancias forman moléculas. Existen
FUERZAS INTERMOLECULARES Lic. Lidia Iñigo Las fuerzas intermoleculares, como su nombre lo indica, son las fuerzas que unen moléculas. Ya deberías saber que no todas las sustancias forman moléculas. Existen
SUAVIZACIÓN CONCEPTOS BÁSICOS
 SUAVIZACIÓN CONCEPTOS BÁSICOS Revisemos algunos conceptos que utilizarás para el diseño de los equipos del sistema de suavización, recuerda que muchos ya los has visto en cursos anteriores y que esto es
SUAVIZACIÓN CONCEPTOS BÁSICOS Revisemos algunos conceptos que utilizarás para el diseño de los equipos del sistema de suavización, recuerda que muchos ya los has visto en cursos anteriores y que esto es
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base. Disoluciones reguladoras del ph
 Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
Ácidos y bases (III) Disoluciones reguladoras Valoraciones ácido- base IES La Magdalena. Avilés. Asturias Disoluciones reguladoras del ph Si añadimos una pequeña cantidad de ácido o base a agua pura, el
QUÍMICA DE LAS BIOMOLÉCULAS
 QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
Biopolímero s (4831)
 Biopolímero s (4831) 2.2. Interacciones electrostáticas Las interacciones que se presentan entre iones, dipolos permanentes o inducidos, cuadrupolos permanentes o inducidos, etc. reciben el nombre de interacciones
Biopolímero s (4831) 2.2. Interacciones electrostáticas Las interacciones que se presentan entre iones, dipolos permanentes o inducidos, cuadrupolos permanentes o inducidos, etc. reciben el nombre de interacciones
Electrólisis. Electrólisis 12/02/2015
 Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
Electrólisis Dr. Armando Ayala Corona Electrólisis La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes),
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
Qué son las proteínas?
 Qué son las proteínas? Son complejas estructuras formadas por la combinación de aminoácidos (generalmente + de 300 aminoácidos) Las proteínas forman parte de los tejidos animal y vegetal. AA = Aminoácido
Qué son las proteínas? Son complejas estructuras formadas por la combinación de aminoácidos (generalmente + de 300 aminoácidos) Las proteínas forman parte de los tejidos animal y vegetal. AA = Aminoácido
ELECTRÓLISIS. Electrólisis de sales fundidas
 El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
El proceso por el cual se produce una reacción química a partir de una energía eléctrica se denomina electrólisis. Y se lleva a cabo en un dispositivo que se conoce como cuba o celda electrolítica. Este
REACCIONES DE IONES METÁLICOS
 Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
Actividad Experimental 4 REACCIONES DE IONES METÁLICOS Investigación previa -Investigar las medidas de seguridad para trabajar con amoniaco -Investigar las reglas de solubilidad de las sustancias químicas.
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
Identificación de proteínas, lípidos y carbohidratos. En productos lácteos. Ramírez Gutiérrez Donají Mariana Torres Martínez Jocelyn Astrid
 Identificación de proteínas, lípidos y carbohidratos. En productos lácteos. Ramírez Gutiérrez Donají Mariana Torres Martínez Jocelyn Astrid Objetivos Comprobar de forma sencilla la existencia de proteínas,
Identificación de proteínas, lípidos y carbohidratos. En productos lácteos. Ramírez Gutiérrez Donají Mariana Torres Martínez Jocelyn Astrid Objetivos Comprobar de forma sencilla la existencia de proteínas,
METABOLISMO CELULAR. Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio
 METABOLISMO CELULAR Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio Reacciones Celulares Básicas. Los sistemas vivos convierten la energía
METABOLISMO CELULAR Es el conjunto de reacciones químicas a través de las cuales el organismo intercambia materia y energía con el medio Reacciones Celulares Básicas. Los sistemas vivos convierten la energía
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Guía nutricional acerca de las propiedades del chorizo
 Guía nutricional acerca de las propiedades del chorizo Fuente: Los Alimentos, Recopilaciones & El Portal del Chacinado Entre los alimentos que tenemos disponibles en nuestra tienda o supermercado habitual,
Guía nutricional acerca de las propiedades del chorizo Fuente: Los Alimentos, Recopilaciones & El Portal del Chacinado Entre los alimentos que tenemos disponibles en nuestra tienda o supermercado habitual,
CLASIFICACIÓN SEGÚN SU POLARIDAD NO POLARES POLARES NEUTROS ACIDOS BASICOS
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2015 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
BIOSÍNTESIS DE AMINOÁCIDOS
 BIOSÍNTESIS DE AMINOÁCIDOS 20 son los aminoácidos codificados por el código genético Alanina Ala A Isoleucina Ile I Arginina Arg R Leucina Leu L Asparagina Asn N Lisina Lys K Aspártico Asp D Metionina
BIOSÍNTESIS DE AMINOÁCIDOS 20 son los aminoácidos codificados por el código genético Alanina Ala A Isoleucina Ile I Arginina Arg R Leucina Leu L Asparagina Asn N Lisina Lys K Aspártico Asp D Metionina
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCES A LA UNIVERSIDAD MAYRES DE 5 AÑS PRUEBA ESPECÍFICA PRUEBA 01 PRUEBA SLUCINARI HAUTAPRBAK 5 URTETIK 014ko MAIATZA DE 5 AÑS MAY 014 Aclaraciones previas Tiempo de duración de la prueba: 1
PRUEBA DE ACCES A LA UNIVERSIDAD MAYRES DE 5 AÑS PRUEBA ESPECÍFICA PRUEBA 01 PRUEBA SLUCINARI HAUTAPRBAK 5 URTETIK 014ko MAIATZA DE 5 AÑS MAY 014 Aclaraciones previas Tiempo de duración de la prueba: 1
Cómo se unen los átomos
 Nivel: 2.º Medio Subsector: Ciencias químicas Unidad temática: Los cuerpos presentan aspectos y propiedades diferentes según el tipo de átomos que los componen y según la forma en que estos se unen. Pensemos
Nivel: 2.º Medio Subsector: Ciencias químicas Unidad temática: Los cuerpos presentan aspectos y propiedades diferentes según el tipo de átomos que los componen y según la forma en que estos se unen. Pensemos
AMINOACIDOS Y PEPTIDOS Elaborado por: Licda. Isabel Fratti de Del Cid
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS, CUM UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO GUIA DE ESTUDIO 2013 SEMANA 29 AMINOACIDOS Y PEPTIDOS Elaborado por: Licda. Isabel Fratti
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS, CUM UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO GUIA DE ESTUDIO 2013 SEMANA 29 AMINOACIDOS Y PEPTIDOS Elaborado por: Licda. Isabel Fratti
CÁTEDRA: QUIMICA GUIA DE PROBLEMAS Nº 10
 CÁTEDRA: QUIMICA GUIA DE PROBLEMAS Nº 10 TEMA: ph, NEUTRALIZACIÓN Y EQUILIBRIO ÁCIDO BASE OBJETIVOS: Clasificar ácidos y bases de acuerdo al potencial de hidrógeno. PRERREQUISITOS: Tener conocimiento de
CÁTEDRA: QUIMICA GUIA DE PROBLEMAS Nº 10 TEMA: ph, NEUTRALIZACIÓN Y EQUILIBRIO ÁCIDO BASE OBJETIVOS: Clasificar ácidos y bases de acuerdo al potencial de hidrógeno. PRERREQUISITOS: Tener conocimiento de
METABOLISMO DEL NITRÓGENO
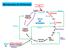 METABLISM DEL NITRÓGEN Descomposición por microorganismos Compuesto rgánicos Nitrogenados ANIMALES Desechos orgánicos Amonificación CICL DEL NITRÓGEN N 3 Nitrificación Nitrosomonas Nitrosación N 2 Nitratación
METABLISM DEL NITRÓGEN Descomposición por microorganismos Compuesto rgánicos Nitrogenados ANIMALES Desechos orgánicos Amonificación CICL DEL NITRÓGEN N 3 Nitrificación Nitrosomonas Nitrosación N 2 Nitratación
BIOQUIMICA 1 I.T.T.G. Aminoácidos
 BIOQUIMICA 1 I.T.T.G. Aminoácidos COOH H 2 N C H R TODOS LOS AMINOÁCIDOS QUE FORMAN PARTE DE LAS PROTEÍNAS SON L-AMINOÁCIDOS 2 Aminoácidos Grupo amino (protonado) COO - Grupo carboxilo (disociado) H 3
BIOQUIMICA 1 I.T.T.G. Aminoácidos COOH H 2 N C H R TODOS LOS AMINOÁCIDOS QUE FORMAN PARTE DE LAS PROTEÍNAS SON L-AMINOÁCIDOS 2 Aminoácidos Grupo amino (protonado) COO - Grupo carboxilo (disociado) H 3
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
