Aminoácidos y Proteínas
|
|
|
- María Gómez Rojo
- hace 7 años
- Vistas:
Transcripción
1 Aminoácidos y Proteínas Un aminoácido es una pequeña molécula orgánica que contiene, al menos, un grupo amino (-NH 2), de naturaleza básica, y un grupo carboxilo (-COOH), de carácter ácido. Aunque los seres vivos sintetizan para distintos propósitos diversos tipos de aminoácidos, sin duda los más importantes son los que forman parte de las proteínas, todos los cuales pertenecen al grupo de los -aminoácidos. Los -aminoácidos se caracterizan por presentar el grupo carboxilo y el grupo amino unidos al mismo átomo de carbono (que se denomina carbono ). Además, a este carbono se une, como tercer sustituyente, un átomo de hidrógeno y, como cuarto sustituyente, un grupo adicional de tamaño y características diversas, el cual diferencia a cada aminoácido de los demás. A este cuarto sustituyente se le denomina cadena lateral del aminoácido y, a menudo, se le representa de forma simplificada por la letra R. Temas Selectos de Bioquímica General Como los cuatro sustituyentes del carbono son distintos y al adoptar una disposición tetraédrica en torno a él, los -aminoácidos presentan isomería óptica (enantiómeros), en forma de imagen de espejo (configuraciones D y L). Existen más de 60 aminoácidos en las células, pero solo se utilizan 20 -aminoácidos en la configuración L, para la construcción de proteínas. Solo las proteínas de las membranas bacterianas contienen aminoácidos D, aminoácidos modificados o aminoácidos raros. Clasificación de aminoácidos Los aminoácidos se pueden clasificar de acuerdo a diferentes consideraciones, una de las más aceptadas es de acuerdo a la conformación de su cadena lateral, así se clasifican en: 70
2 71
3 Otra clasificación suele ser en base a la polaridad de su cadena lateral y la capacidad de interaccionar con las moléculas de agua, en ese sentido se dividen en: Hidrofóbicos, Hidrofílicos y de Polaridad intermedia. Comportamiento ácido-base de los aminoácidos libres en solución En solución acuosa (al interior de la célula), los aminoácidos se comportan como anfóteros. Es decir, dependiendo del ph, liberan protones comportándose como ácido (pasando el grupo carboxilo a carboxilato, -COOH a -COO - ); o aceptan protones, comportándose como base, donde los grupos -NH 2 pasan a -NH 3+. También pueden actuar como ácido y base a la vez. Cuando los aminoácidos están doblemente ionizados, aparece una forma dipolar iónica llamada zwitterión, donde su carga neta es cero. Esto permite definir el concepto de punto isoeléctrico (pi) de un aminoácido, como el valor de ph en el cual se encuentra la máxima concentración de zwitterión. El punto isoeléctrico, se calcula como la media de los valores de pka de las etapas que forma y descompone el zwitterión. 72
4 En la figura anterior se muestra el efecto que tienen tanto el grupo carboxilo como el amino sobre de sus respectivos valores de pka. La figura siguiente se muestra un ejemplo donde a valores de ph ácido el aminoácido se encuentra cargado positivamente, en el valor de ph que iguala el valor del pi el aminoácido está doblemente ionizado (zwitterión), y a valor de ph básico el aminoácido a liberado un H+ y se encuentra cargado negativamente. Este valor depende se ve modificado por las características químicas de la cadena lateral R. Al solubilizarse un aminoácido (ión híbrido) en agua (por ejemplo la alanina), puede actuar como Ácido (donador de protones) o como Base (aceptor de protones) dependiendo del ph: En medio ácido (ph < 2) actúan como bases (ganan H + ): En medio básico (ph > 11) actúan como ácidos (donan H + ): 73
5 El conocimiento de las propiedades ácido-base de los aminoácidos es de mucha importancia para la comprensión y el análisis de las proteínas. Por otra parte, las técnicas de separación, identificación y cuantificación de los aminoácidos presentes en una proteína y el orden en que están colocados (secuencia) se basan también en su comportamiento ácido-base. A continuación se presentan las curvas de titulación ácido-base de la glicina, el ácido aspártico y la histidina. En la Tabla siguiente se resumen algunas de las propiedades de los 20 aminoácidos que componen las proteínas. 74
6 El enlace peptídico Los aminoácidos se pueden unir para formar diferentes tipos de péptido (polipéptidos y proteínas). Los péptidos están formados por la unión de aminoácidos mediante un enlace covalente que se establece entre el grupo α-carboxilo de un primer aminoácido y el grupo α- amino del siguiente, dando lugar al desprendimiento de una molécula de agua. Este es el denominado enlace peptídico. Al unirse dos o más aminoácidos, siempre queda un extremo amino terminal y un grupo carboxilo terminal, independientemente de la longitud de la cadena. 75
7 A continuación se presenta la formación del enlace peptídico de los aminoácidos glicina y alanina, para formar el dipéptido glicilalanina. El producto de la reacción aún mantiene un grupo NH 3 + en un extremo, y un grupo COO - en el otro, sin reaccionar. Esto permite que sigan añadiéndose aminoácidos al extremo carboxilo, formando péptidos más largos. Además, el comportamiento anfótero visto anteriormente es común a todas las cadenas de aminoácidos, independientemente del número de aminoácidos que la conforme, debido a los extremos de las mismas. Breve semblanza de la biosíntesis y catabolismo de aminoácidos Como hemos dicho anteriormente, los aminoácidos que componen las proteínas son 20, pero sólo algunas plantas y bacterias pueden sintetizar la totalidad de ellos. Los mamíferos sólo sintetizan de 10 a 11 aminoácidos (aminoácidos no esenciales) mediante rutas biosintéticas simples. Algunas vías de síntesis son muy complejas y con mucho gasto de energía, como la síntesis de los aminoácidos aromáticos. Los aminoácidos que los mamíferos no pueden sintetizar son llamados aminoácidos esenciales, y deben ser incorporados en la dieta. Estos son, histidina, isoleucina, leucina, lisina, metionina, fenialanina, treonina, triptófano y valina; y en las fases tempranas del desarrollo la arginina. Todos los aminoácidos son sintetizados a partir de intermediarios de la glucólisis, del ciclo de Krebs y de la ruta de las pentosas-fosfato. Además, la hidrólisis de proteínas deja aminoácidos disponibles, los cuales son reutilizados por la célula, principalmente por la escasa disponibilidad de nitrógeno orgánico. Las reacciones que involucra la síntesis de aminoácidos son de transaminación, y transferencia de grupos de un carbono y grupos aminos. A continuación se presenta el esquema general de los precursores de la síntesis de aminoácidos. Las flechas punteadas indican que la síntesis se realiza en varias etapas. 76
8 En el catabolismo de los aminoácidos los esqueletos carbonados pueden utilizarse tanto para la síntesis de azúcares (aminoácidos glucogénicos) como de ácidos grasos (aminoácido cetogénicos). Los glucogénicos generan piruvato e intermediarios del ciclo de Krebs, en tanto que los cetogénicos generan acetil-coa y acetoacetil-coa. En este sentido, los aminoácidos también pueden ser utilizados como fuente de energía. Algunas de las rutas de degradación de aminoácidos se presentan a continuación: 77
9 78
10 Aminoácidos: Las unidades básicas para la construcción de las proteínas La unión de varios de aminoácidos mediante enlaces peptídicos, da lugar a la formación de cadenas de diferentes tamaños llamadas péptidos. De acuerdo con algunos autores, si el número de aminoácidos que forma la molécula está en el rango de 2 a 10, se denominan oligopéptidos, si es superior a 10 se llaman polipéptidos y si el número es superior a 50 aminoácidos, se designan como proteínas. Las proteínas son polímeros de aminoácidos, por lo tanto son moléculas de relativamente grandes, pertenecen a la categoría de macromoléculas. Cientos o miles de aminoácidos forman una proteína. Aunque, generalmente la mayoría caen en el rango de 80 a 300 aminoácidos por subunidad proteica. Existen varios niveles de estructuración en las proteínas: primaria, secundaria, terciaria, cuaternaria y quinaria. Estructura primaria. Secuencia de aminoácidos Es la secuencia de aminoácidos de la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos se encuentran. Esta estructura es importante tanto genética, como estructuralmente. 79
11 La secuencia de aminoácidos está determinada por la secuencia de nucleótidos del ARN mensajero, el cual a su vez ha sido codificado de la secuencia de nucleótidos del ADN, que representa el gen de esa proteína. Estructuralmente, las configuraciones siguientes, estructuras secundaria, terciaria y cuaternaria, están definidas por la estructura primaria, la cual especifica el plegamiento y enrollamiento de la cadena polipeptídica, y en algunos casos la interacción con otros polipéptidos. Por lo tanto, determina también la función de una proteína. Las posibilidades de estructuración a nivel primario son prácticamente ilimitadas. Independientemente de la longitud de la cadena polipeptídica, siempre hay un extremo amino terminal y un extremo carboxilo terminal que permanecen intactos. Por convención, la secuencia de una proteína se lee siempre a partir de su extremo amino. Como consecuencia del establecimiento de enlaces peptídicos entre los distintos aminoácidos que forman la proteína se origina una cadena principal o "esqueleto" a partir del cual emergen las cadenas laterales de cada aminoácido. Los átomos que componen la cadena principal de la proteína son el N del grupo amino (condensado con el aminoácido precedente), el C (a partir del cual emerge la cadena lateral) y el C del grupo carboxilo (que se condensa con el aminoácido siguiente). Por lo tanto, la unidad repetitiva básica que aparece en la cadena principal de una proteína es: (-NH-C -CO-). La comparación de la estructura primaria de una misma proteína en especies diversas tiene un enorme interés desde el punto de vista funcional y filogenético. Cuanto más alejadas estén las especies analizadas en el árbol filogenético, más diferencias se podrán observar en la estructura primaria de proteínas análogas. 80
12 A menudo se encuentra que ciertos aminoácidos aparecen siempre en idéntica posición en todas las especies estudiadas. Estos aminoácidos reciben el nombre de invariantes o conservados, y suelen ser indispensables para la función y estructura correcta de la proteína. Cualquier mutación en estas posiciones puede ser letal para el organismo. Estructura secundaria. Interacciones a entre aminoácidos situados a corta distancia Es el plegamiento que la cadena polipeptídica adopta debido a la formación de Puentes de hidrógeno entre los átomos que forman el enlace peptídico y que están situados a corta distancia. Los puentes de hidrógeno se establecen entre los grupos -CO- y -NH- del enlace peptídico (el CO como aceptor de H y el NH como donador H). De esta forma, la cadena polipeptídica es capaz de adoptar conformaciones de menor energía libre, y por tanto, más estables. Se pueden distinguir varios tipos de conformaciones que determinan la estructura secundaria de una proteína: a) Conformación al azar, b)hélice, c) Hoja, d) Giros y e) Estructuras supersecundarias. Conformación al azar En algunas proteínas, o en ciertas regiones de la misma, no existen interacciones de suficiente consideración como para que se pueda distinguir un nivel de organización superior a la estructura primaria. En estos casos se habla de conformación al azar. Por ejemplo el complejo estructural denominado dedo de zinc, muy común en proteínas que interaccionan con el DNA. Conformación -hélice En la década de 1930, Linus Pauling propuso que el H de un grupo NH en un aminoácido y el O de un grupo C=O de otro aminoácido podían interactuar para formar un puente de hidrógeno. Esta interacción puede formar la estructura polipeptídica denominada Hélice alfa. En una hélice α, el grupo CO del aminoácido n está unido mediante puente de hidrógeno al grupo NH del aminoácido (n+4). Esta conformación helicoidal dextrógira tiene 3.6 residuos de aminoácidos por giro. Las líneas punteadas indican enlaces de hidrógeno entre los grupos C=O y los grupos N-H que están a lo largo de los cuatro residuos más alejados de la cadena polipeptídica. Cada enlace peptídico puede establecer dos puentes de hidrógeno. Por estas razones, la conformación -Hélice es una estructura periódica (repetitiva). Donde cada aminoácido contribuye con 0.15 nm de longitud (1.5 A ), entonces la longitud total de cada vuelta es de 5.4 A. Las cadenas laterales de los aminoácidos se sitúan en la parte externa de la hélice, lo que evita problemas de impedimentos estéricos. 81
13 Por esta razón, esta estructura puede albergar a cualquier aminoácido, a excepción de la prolina, cuyo C no tiene libertad de giro, por estar integrado en una estructura cíclica. Por este motivo, la prolina suele determinar una interrupción en la conformación en hélice. Los aminoácidos muy polares, también desestabilizan la hélice porque los puentes de hidrógeno pierden importancia frente a las interacciones electrostáticas de atracción o repulsión de las cadenas cargadas. Por este motivo la estructura en hélice es la que predomina a valores de ph en los que los grupos ionizables de las cadenas laterales, no están cargados o ionizados. En caso contrario, adoptan la conformación al azar. Hojas o láminas plegadas-β Pauling también predijo otra estructura polipeptídica denominada lamina plegada (lámina plegada- ). Cuando la cadena principal de un polipéptido se estira al máximo que permiten sus enlaces covalentes, se adopta una configuración espacial denominada estructura, que suele representarse como una flecha. Las estructuras de distintas cadenas polipeptídicas o bien las estructuras de distintas zonas de una misma cadena polipeptídica pueden interaccionar entre sí mediante puentes de hidrógeno, dando lugar a estructuras laminares llamadas por su forma: Hojas plegadas. En esta estructura las cadenas laterales de los aminoácidos se sitúan de forma alternada a la derecha y a la izquierda del esqueleto de la cadena polipeptídica. Cuando las estructuras tienen el mismo sentido NH 3 + COO - la hoja resultante es paralela, y si las estructuras tienen sentidos opuestos, la hoja plegada resultante es antiparalela. Hojas. δas líneas punteadas indican Puentes de hidrógeno entre las hebras. δas cadenas laterales se omiten para mayor claridad. (a) Una hoja antiparalela, (b) una hoja paralela. 82
14 Representación de Hojas plegadas- en rojo, en verde una hélice-. Apariencia plisada de una hoja. δas líneas punteadas indican enlaces de hidrógenos. δos grupos R (violeta) alternados en cada cadena polipeptídica se extiende hacia lados opuestos de la hoja y están inscritos en cadenas adyacentes. Giros (bucles) Secuencias de la cadena polipeptídica con estructura o a menudo están conectadas entre sí por medio de los llamados giros-. Son secuencias cortas, con una conformación característica que impone un brusco giro de 180 o a la cadena principal de un polipéptido. Ciertos aminoácidos consecutivos como Asn, Gly y Pro (que se acomodan mal en estructuras de tipo o ) pueden ocasionar la formación de este tipo de estructura. δa conformación de los giros está estabilizada generalmente por medio de puentes de hidrógeno entre ciertos aminoácidos 1 y 4 del giro. 83
15 Estructuras Supersecundarias También llamadas Motivos, son combinaciones de las tres estructuras secundarias anteriores en mismo segmento de la cadena polipeptídica. 84
16 Estructura terciaria. Interacciones entre aminoácidos situados a larga distancia La estructura terciaria es el plegamiento que la cadena polipeptídica adopta gracias a la formación de puentes de hidrógeno entre los átomos que forman el enlace peptídico y otras interacciones en las cadenas laterales de aminoácidos situados a larga distancia. Las fuerzas que estabilizan la estructura terciaria de una proteína se establecen entre las distintas cadenas laterales de los aminoácidos que la componen. Los enlaces propios de la estructura terciaria pueden ser de dos tipos: covalentes y no covalentes. Los enlaces covalentes pueden deberse a: (1) La formación de un puente disulfuro entre dos cadenas laterales de Cisteína (2) La formación de un enlace amida (-CO-NH-) entre las cadenas laterales de la Lisina y un AA dicarboxílico (Glutámico o Aspártico). Los enlaces no covalentes pueden ser de cuatro tipos: (1) Fuerzas electrostáticas entre cadenas laterales ionizadas, con cargas de signo opuesto, (2) Puentes de hidrógeno, entre las cadenas laterales de aminoácidos polares (3) Interacciones hidrofóbicas entre cadenas laterales no polares y (4) Fuerzas de polaridad debidas a interacciones dipolo-dipolo Para las proteínas que constan de una sola cadena polipeptídica (carecen de estructura cuaternaria), la estructura terciaria es la máxima información estructural que se puede obtener. La estructura terciaria es una disposición precisa y única en el espacio, y surge a medida que se sintetiza la proteína. En otras palabras, la estructura terciaria está determinada por la secuencia de aminoácidos (estructura primaria). Es la disposición tridimensional de todos los átomos que componen la proteína, que da la conformación absoluta de la molécula. La estructura terciaria de una proteína es la responsable directa de sus propiedades biológicas, ya que la disposición espacial de los distintos grupos funcionales de las cadenas laterales determina su interacción con los diversos ligandos. Se distinguen dos tipos de estructura terciaria: A. Proteínas con estructura terciaria de Tipo Fibroso. En este caso, los elementos de estructura secundaria (hélices u hojas ) pueden mantener su ordenamiento sin recurrir a grandes modificaciones, tan sólo introduciendo ligeras torsiones longitudinales, como en las hebras de una cuerda. Ejemplos el colágeno, la queratina del cabello o la fibroína de la seda. B. Proteínas con estructura terciaria de Tipo Globular. Son más frecuentes, no existe una dimensión que predomine sobre las demás, y su forma es aproximadamente esférica. En este 85
17 tipo de estructuras se suceden regiones con estructuras al azar, hélice, hoja, bucles y estructuras supersecundarias. Existen regiones diferenciadas dentro de la estructura terciaria de las proteínas que actúan como unidades autónomas de plegamiento y/o desnaturalización de las proteínas, denominadas Dominios. Estas regiones constituyen un nivel estructural intermedio entre las estructuras secundaria y terciaria. Los dominios se pliegan por separado a medida que se sintetiza la cadena polipeptídica, es la asociación de los distintos dominios la que origina la estructura terciaria. Representación de la proteína piruvato quinasa, que consta de 4 dominios, cada uno representado de un color. Estructura cuaternaria. Varias subunidades proteicas (oligómeros) Cuando una proteína consta de más de una cadena polipeptídica, es decir, cuando se trata de una proteína oligomérica, decimos que tiene estructura cuaternaria. La Estructura cuaternaria implica la interacción de más de una cadena polipeptídica. Es la asociación de diferentes subunidades para formar complejos funcionales, en forma de dímeros, trímeros, tetrámeros, etc. La estructura cuaternaria debe considerar: el número y la naturaleza de las distintas subunidades o monómeros que integran el oligómero y la forma en que se asocian en el espacio para dar lugar al oligómero. Las fuerzas que mantienen unidas las distintas cadenas polipeptídicas son las mismas que estabilizan la estructura terciaria. Las más abundantes son las interacciones débiles (hidrofóbicas, polares, electrostáticas y puentes de hidrógeno), aunque en algunos casos, como en las inmunoglobulinas, la estructura cuaternaria se mantiene mediante puentes disulfuro. El ensamblaje de los monómeros se realiza de forma espontánea, lo que indica que el oligómero presenta un mínimo de energía libre con respecto a los monómeros. 86
18 Estructura Quinaria. Asociaciones supramoleculares En muchos casos, las proteínas se agrupan entre sí o con otros grupos de biomoléculas para formar estructuras supramoleculares, o sea de orden superior y que tienen un carácter permanente. Este nivel de asociación recibe el nombre de estructura quinaria, la cual puede ser de dos tipos: asociaciones entre proteínas y asociaciones de proteínas con otras biomoléculas. Propiedades de las proteínas Especificidad La especificidad se refiere a la función que tiene la proteína, la cual está determinada por la estructura primaria que le otorga una conformación espacial propia; por lo que un cambio en la estructura de la proteína puede significar una pérdida de la función. Además, cada especie biológica posee algunas proteínas que otros organismos no tienen, y aún dentro de una especie hay diferencias proteicas entre individuos. Esto no ocurre con los lípidos y carbohidratos, los cuales son comunes a todos los seres vivos. La especificidad de las proteínas explica algunos fenómenos biológicos como injertos biológicos; compatibilidad o no de trasplantes de órganos y sueros sanguíneos, además de permitir llevar a cabo estudios filogenéticos y establecer el parentesco evolutivo entre especies. Desnaturalización Consiste en la pérdida de la estructura tridimensional o conformación nativa por romperse los enlaces de la estructura cuaternaria, terciaria o secundaria, afectando la función biológica de la proteína. Este proceso recibe el nombre de desnaturalización. Todas las proteínas desnaturalizadas tienen la misma conformación, muy abierta y con una interacción máxima con el disolvente, por lo que una proteína soluble en agua cuando se desnaturaliza se hace insoluble en agua y precipita. La desnaturalización se puede producir por factores como cambios de temperatura (huevo cocido o frito) y presión, variaciones del ph, alta salinidad, etc. La desnaturalización puede ser reversible o irreversible. En el primer caso, los factores responsables han actuado con escasa intensidad y durante poco tiempo, por lo que la conformación nativa de la proteína puede recuperarse, este proceso se conoce como renaturalización. Sin embargo, la desnaturalización generalmente es irreversible. Solubilidad Normalmente, las proteínas globulares son solubles es agua, mientras que las proteínas con estructura terciaria fibrilar, al ser alargadas son insolubles. La solubilidad se debe a las características de los radicales R, muchos de los aminoácidos apolares se sitúan en el interior de la estructura, y los polares, que pueden establecer puentes hidrógeno con las moléculas de agua, se localizan en la periferia donde quedan solvatados. Esta capa de agua impide la unión entre proteínas. Si se pierde la capa de solvatación, las proteínas se unen entre sí y forman un agregado insoluble que precipita. Capacidad amortiguadora Al igual que los aminoácidos, las proteínas tienen un comportamiento anfótero, debido a la existencia de grupos ionizables en las cadenas laterales y de grupos COOH y NH2 terminales. Esto permite que sean capaces de neutralizar las variaciones de ph del medio, ya que pueden comportarse como un ácido (donando e-) o una base (aceptando e-) del medio donde se encuentran. Habrá un ph donde la carga neta de la proteína sea nula, ese valor es el punto isoeléctrico, el cual es característico de cada proteína. 87
19 Clasificación de las proteínas Desde el punto de vista químico, las proteínas se clasifican en dos grupos, holoproteínas, formadas solamente por aminoácidos, y heteroproteínas, que están formadas por una fracción proteica y un componente no proteico que se denomina grupo prostético, el cual puede ser un azúcar, un lípido, un ácido nucleico, un grupo heme o simplemente un ión inorgánico. En ausencia del grupo prostético, la proteína no es funcional y se llama apoproteína. Según la forma de la proteína también se pueden clasificar en globulares y fibrosas. Por su función pueden ser estructurales, las cuales dan apoyo estructural a las células y tejidos (como las glicoproteínas que forman parte de las membranas, o las histonas que forman parte de los cromosomas); de transporte (como las que realizan transporte transmembranal en ambos sentidos); de defensa, que protegen al organismo contra posibles ataques de agentes extraños (como las proteínas relacionadas con la patogénesis); hormonales; enzimáticas, que de hecho son las más numerosas y especializadas, las cuales aumentan la velocidad de las reacciones químicas, y de reserva (como la Ovoalbúmina de la clara de huevo, la Gliadina del grano de trigo, y la Lactoalbúmina de la leche). 88
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
PROTEINAS AMINOÁCIDOS FUNCIONES DE LOS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
Análisis de proteínas
 Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
PROTEINAS AMINOACIDOS
 PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
SERIE Nº 4. Aminoácidos, Péptidos y Proteínas
 SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
PROTEINAS CITOESQUELETO AMINOACIDOS
 PROTEINAS CITOESQUELETO AMINOACIDOS 1 Constituyen, en nuestro estudio de la célula, el 3er. concepto químico funcional. Esta asociado en sus aspectos estructurales: - al citoesqueleto celular - a las fosfolipo-proteínas
PROTEINAS CITOESQUELETO AMINOACIDOS 1 Constituyen, en nuestro estudio de la célula, el 3er. concepto químico funcional. Esta asociado en sus aspectos estructurales: - al citoesqueleto celular - a las fosfolipo-proteínas
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA
 BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
BIOSINTESIS DE AMINOÁCIDOS INTEGRANTES: ZACHARY FERNANDA CUELLAR CARDOZO PAOLA ANDREA CASTAÑO PAYA Aminoácidos Es una molécula orgánica con un grupo amino (-NH 2 ) y un grupo carboxilo (- COOH). Los aminoácidos
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
Licenciatura en Ciencias Biológicas LABORATORIO Nº 3. Proteínas
 LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
Estructura tridimensional de las proteínas
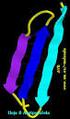 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS. Nombre:... Curso:.. Fecha:...
 Liceo La Florida Prof: M. Ibáñez H. GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS Nombre:... Curso:.. Fecha:... Introducción: Nuestro organismo produce proteínas, sin embargo si a las células les falta 1 ingrediente,
Liceo La Florida Prof: M. Ibáñez H. GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS Nombre:... Curso:.. Fecha:... Introducción: Nuestro organismo produce proteínas, sin embargo si a las células les falta 1 ingrediente,
SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade
 +UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
+UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO GUIA DE ESTUDIO 2016 SEMANA 29 AMINOACIDOS Y PÉPTIDOS Elaborado por: Lic. Fernando Andrade Lea
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 LOGO Composición: C, H, O, N, S (P, Fe, Cu, I, ). LAS PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS El C α es el del amino y el C 1 es el del carboxilo. GRUPO
LOGO Composición: C, H, O, N, S (P, Fe, Cu, I, ). LAS PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS El C α es el del amino y el C 1 es el del carboxilo. GRUPO
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
AMINOÁCIDOS 3B EXPLIQUE EL COMPORTAMIENTO DEL ACIDO ASPARTICO A UNA SOLUCION CON PH DE 8
 AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Clase Nº 3 PSU Ciencias: Biología Común Ácidos Nucleicos
 Clase Nº 3 PSU Ciencias: Biología Común Ácidos Nucleicos Profesora: Cristina Muñoz Rehbein biologia.preucrece.2014@gmail.com Tarea Denaturación de proteínas Desnaturalización a distintos niveles Estructura
Clase Nº 3 PSU Ciencias: Biología Común Ácidos Nucleicos Profesora: Cristina Muñoz Rehbein biologia.preucrece.2014@gmail.com Tarea Denaturación de proteínas Desnaturalización a distintos niveles Estructura
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
BIOMOLÉCULAS. Son aquellas que se encuentran presentes tanto en la materia orgánica (viva) como en la materia inerte. Ellas son:
 Nombre Curso Fecha : : : Revisión FICHA DE BIOLOGÍA N 1 Profesora Verónica Abasto Córdova Biología 2 Medio BIOMOLÉCULAS Las biomoléculas son las moléculas constituyentes de los seres vivos. Están formadas
Nombre Curso Fecha : : : Revisión FICHA DE BIOLOGÍA N 1 Profesora Verónica Abasto Córdova Biología 2 Medio BIOMOLÉCULAS Las biomoléculas son las moléculas constituyentes de los seres vivos. Están formadas
Esta obra está bajo una licencia Attribution-NonCommercial-ShareAlike3.0 Unportedde CreativeCommons. Para ver una copia de esta licencia, visite
 COMPOSICIÓN QUÍMICA DE LOS SERES VIVOS Esta obra está bajo una licencia Attribution-NonCommercial-ShareAlike3.0 Unportedde CreativeCommons. Para ver una copia de esta licencia, visite http://creativecommons.org/licenses/by-nc-sa/3.0/
COMPOSICIÓN QUÍMICA DE LOS SERES VIVOS Esta obra está bajo una licencia Attribution-NonCommercial-ShareAlike3.0 Unportedde CreativeCommons. Para ver una copia de esta licencia, visite http://creativecommons.org/licenses/by-nc-sa/3.0/
Tema 4. Proteínas. Contenidos: Criterios de evaluación mínimos: CONCEPTOS ACORDADOS PARA LA PAEG EN LA UCLM. Proteínas:
 Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
Bases moleculares de la herencia. Estructura de ácidos nucleicos.
 UNIVERSIDAD AUTÓNOMA DE SINALOA Unidad Académica de Ciencias de la Nutrición y Gastronomía. Bases moleculares de la herencia. Estructura de ácidos nucleicos. Dr. Javier Magaña 1. Anna Islas 2. Diego Moreira
UNIVERSIDAD AUTÓNOMA DE SINALOA Unidad Académica de Ciencias de la Nutrición y Gastronomía. Bases moleculares de la herencia. Estructura de ácidos nucleicos. Dr. Javier Magaña 1. Anna Islas 2. Diego Moreira
Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas.
 AMINÁCIDS Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas. Un aminoácido, posee dos grupos funcionales característicos
AMINÁCIDS Las proteínas están constituidas por la unión de sustancias químicas denominadas aminoácidos. Son estos la unidad estructural de las proteínas. Un aminoácido, posee dos grupos funcionales característicos
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos
 Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
IES La Gándara PREGUNTAS PAU CyL Dpto. Biología y Geología. EJERCICIOS PAU Y EBAU (Castilla y León) Fuente:
 Tema 4. PRTEÍNAS y ENZIMAS EJERCICIS PAU Y EBAU (Castilla y León) Fuente: http://www.usal.es/node/100506 1. a) Dibuje la fórmula estructural del hexapéptido Gly-Ser-Gly-Ala-Gly-Ala y señale con claridad
Tema 4. PRTEÍNAS y ENZIMAS EJERCICIS PAU Y EBAU (Castilla y León) Fuente: http://www.usal.es/node/100506 1. a) Dibuje la fórmula estructural del hexapéptido Gly-Ser-Gly-Ala-Gly-Ala y señale con claridad
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Las proteínas son las moléculas orgánicas más abundantes en las células, más del 50% del
 LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia.
 CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia. PROTEINAS Las proteínas son las moléculas orgánicas más abundantes; en la mayoría de los
CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia. PROTEINAS Las proteínas son las moléculas orgánicas más abundantes; en la mayoría de los
PAGS LIBRO PROTEÍNAS
 PAGS. 140 142 LIBRO PROTEÍNAS Las proteínas son las moléculas orgánicas más abundantes en las células Son polímeros formados por la unión de subunidades monoméricas; los aminoácidos El orden en el que
PAGS. 140 142 LIBRO PROTEÍNAS Las proteínas son las moléculas orgánicas más abundantes en las células Son polímeros formados por la unión de subunidades monoméricas; los aminoácidos El orden en el que
AMINOÁCIDOS, PEPTIDOS Y PROTEÍNAS. Profesor Carlos Urzúa Stricker
 AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
28 A 32. HOJA DE TRABAJO 5o. BLOQUE. Licda. Lilian Judith Guzmán Melgar
 HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
HOJA DE TRABAJO 5o. BLOQUE Licda. Lilian Judith Guzmán Melgar 2016 28 A 32 1. En La siguiente estructura señale lo que se le solicita: a) Colina b) Glicerol c) Acido graso d) Enlace esterfosfato 2. Cuales
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS
 AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
MODULO 3 (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca)
 MODULO 3 (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca) 1) Si una proteína se desnaturaliza: a. mantiene su estructura primaria y su función b. pierde su estructura terciaria pero no su
MODULO 3 (Docentes: Marina González Gabriela Gómez - Sede Montes de Oca) 1) Si una proteína se desnaturaliza: a. mantiene su estructura primaria y su función b. pierde su estructura terciaria pero no su
