Ecuación de Henderson Hasselbach: Relación entre el ph (medio) y el pka del fármaco.
|
|
|
- Sebastián Toro Ortíz
- hace 7 años
- Vistas:
Transcripción
1 Ecuación de Henderson Hasselbach: Relación entre el ph (medio) y el pka del fármaco. La mayoría de los fármacos son ácidos o bases débiles, sustancias en las que el grado de ionización depende del pka de la sustancia (constante) y del ph del medio (variable). En este sentido, las moléculas ionizadas (con carga eléctrica o protonadas) y las no ionizadas (sin carga eléctrica o no-protonadas) de un mismo fármaco están en equilibrio, acorde con su pka y el ph del medio en el que se encuentren. En el caso de los ácidos débiles, el pka es igual logaritmo negativo de su constante de ionización (pka= -log Ka). De forma global, a menor pka (mayor fuerza o más fuerte) el fármaco se encuentra más disociado. Por su parte, en el caso de las bases, el pkb es igual logaritmo negativo de su constante de ionización (pkb= -log Kb). Debido a que el pka es equivalente a 14 menos el pkb, se puede establecer la siguiente equivalencia: (Ka)x(Kb)= 1x o Kb= 1x / Ka De forma global, la ecuación de Henderson Hasselbach establece que para una sustancia: pka - ph= [forma protonada]/[forma no protonada] Sin embargo, se pueden establecer otras ecuaciones más comunes, tal como se ilustra: Ecuación de Henderson Hasselbach para los ácidos débiles (HA) HA + H2O H3O + + A - Por ello: pka = ph + log [HA]/[ A-] Ecuación deducida con el siguiente proceso: (1) HA + H2O H3O + + A - (estado de disociación) (2) Ka= [H3O + ] x [A - ]/[HA] (ecuación de equilibrio) (3) -log Ka= -log [H3O + ] -log [A - ]/[HA] (multiplicando por log a ambos lados de la ecuación)
2 (4) pka= ph -log [A - ]/[HA] (aplicando el concepto de pka y de ph) (5) pka= ph + log [HA]/ [A - ] (recordando que el -log de un cociente es igual a + log del cociente invertido) Ecuación de Henderson Hasselbach para las bases débiles (BOH) BOH B + + OH - Por ello: pka = ph + log [B + ]/[ BOH] Ecuación que se deduce de la siguiente forma: (1) BOH B + + OH - (estado de disociación) (2) Kb= [B + ] x [OH - ]/[BOH] (ecuación de equilibrio) Como: Kb= 1x / Ka (3) 1x / Ka = [B + ]/[BOH] x [OH - ] (4) -log 1x / Ka= -log [OH - ] log [B + ]/[BOH] (multiplicando por log a ambos lados de la ecuación) (5) 14 log Ka= poh log [B + ]/[BOH] (aplicando el concepto de de ph y reglas de logaritmos) (6) 14 pka= 14- ph log [B + ]/[BOH] (aplicando el concepto de de pka y relación ph-poh (7) -pka= - ph log [B + ]/[BOH] (8) pka= ph + log [B + ]/[BOH] (multiplicando por menos en ambos lados de la ecuación) Por otro lado, conceptualmente el pka de una sustancia corresponde al ph al que el 50% de las moléculas que se encuentran en la solución están en su forma ionizada. Por ello, el grado de ionización de un fármaco, a ph fisiológico ( ), depende de su pka. En este
3 sentido, el grado de ionización de los fármacos de carácter ácido aumenta con el aumento del ph (básico); mientras que el de los básicos lo hace con la disminución del ph (ácido), tal como se muestra en la gráfica 7. Gráfica 7. Variación de los fármacos ácidos y básicos acorde con el ph Aumento del grado de ionización ÁCIDOS Cromoglicato sódico (pka 2.0) Furosemida (pka 3.9) Sulfametoxazol (pka 6.0) Fenobarbital (pka 7.2) Fenitoína (pka 8.3) Clortalidona (pka 9.4) ph BASES Diazepam (pka 3.3) Clordiazepoxido (pka 4.8) Triamtereno (pka 6.1) Cimetidina (pka 6.8) Morfina (pka 8.0) Amantadina (pka 10.1) Aumento del grado de ionización Por lo anterior, se puede establecer que los fármacos ácidos en el estómago (ph 2) se encuentran principalmente en su forma no ionizada (favoreciéndose su absorción, pero se desfavorece su necesaria disolución). Por su parte, los fármacos de carácter básico estarán principalmente en su forma ionizada y, por ello, su posibilidad de absorción en este sitio en mínima. Desde el punto de vista práctico, para aproximarse a la determinación del grado de ionización de una sustancia, resulta importante entender y aplicar la regla de las tres unidades de ph, la cual se fundamenta en (ver gráfica 8).
4 Cuando el ph del medio es igual a su pka de ácido o de una base, el 50% de las moléculas se encuentra en forma ionizada y la otra mitad en forma no ionizada. En el caso de los ácidos, a un ph mayor de 3 unidades generara que el 100% se encuentre en su forma ionizada; mientras que para las bases ocurre cuando se presente una disminución en 3 unidades de ph. Gráfica 8. Ilustración de la regla de las tres unidades de ph en el grado de ionización de los ácidos y bases débiles. 100% IONIZADO IONIZADO 100% BASES ÁCIDOS 50% ÁCIDIFICAR BASIFICAR 50% 0% 0% ph = pka NO IONIZADO VALORES DE ph NO IONIZADO Influencia del cambio del ph del medio en la absorción de los fármacos: En general, la velocidad de absorción depende de la velocidad de difusión. Por otro lado, la velocidad de desintegración de la formulación, al igual que el grado y velocidad de disolución y de absorción del fármaco, son procesos que varían dependiendo del ph del medio en el que ocurre el proceso. Por ello, un fármaco u otra sustancia que modifique el ph gastrointestinal, como ocurre con los antiácidos, protectores de mucosa (sucralfato y
5 misoprostol) y los inhibidores de la secreción ácida: antimuscarínicos (pirenzepina), inhibidores de la bomba de protones (omeprazol, lanzoprazol, pantoprazol) y antihistamínicos de los receptores H 2, (cimetidina, ranitidina, famotidina), puede alterar la cantidad y/o la velocidad absorbida de otra. Efecto para los fármacos ácidos débiles HA + H2O H3O + + A - El aumento de ph (mayor concentración de OH-) desplaza el equilibrio hacia la derecha, aumentándose la concentración de la forma ionizada, aspecto que facilita la solubilidad del fármaco en el medio, pero que desfavorece su absorción, debido a la disminución en la fracción liposoluble (no ionizada) y, por tanto, su facilidad de atravesar la mucosa gastrointestinal, tal como sucede con el trimetoprim, captopril, digoxina y warfarina, entre otros. Efecto para los fármacos bases débiles BOH B + + OH - (BOH) El aumento de ph (mayor concentración de OH-) aumenta la concentración de la fracción no ionizada y por ello se favorece la absorción; pero la solubilidad disminuye, desfavoreciendo la necesaria disolución en el sitio de absorción, llegando a afectar notoriamente la cantidad absorbida, como ocurre en el caso del ketoconazol, el diazepam, las tetraciclinas, entre otros. En el caso de la absorción, con este tipo de fármacos, se ha evidenciado la necesidad de que, además de estar en su forma no ionizada (liposoluble), el fármaco debe estar en solución, lo que requiere que, previamente haya estado en su forma ionizada (hidrosoluble). Por lo expuesto, el efecto neto de los medicamentos que alteran el ph gastrointestinal, depende del grado de modificación del equilibrio existente entre la forma ionizada y sin ionizar, aspecto que se tendría que particularizar para cada fármaco. Por ello, el impacto de los cambios en el ph gastrointestinal sobre la absorción de fármacos es complejo, variable, difícil de predecir y, más aún, los datos disponibles sobre las alteraciones cuando se ha alcanzado el estado estacionario son escasos. Razón por la cual, desde el punto de vista práctico, se recomienda que los medicamentos de estrecho margen terapéutico, se administren con una hora antes o 2 horas después de la ingesta de sustancias que modifican el ph gastrointestinal, incluyendo los alimentos. Sin embargo, esta recomendación no resulta útil en todos los casos, tal como sucede con las quinolonas, las cuales se deben administrar 2 horas antes o 6 después de los antiácidos. Importancia del tamaño molecular en la absorción de los fármacos:
6 Como el coeficiente de difusión de las formas no ionizadas, por la bicapa lipídica de las membranas celulares, es inversamente proporcional a la raíz cuadrada del tamaño molecular, a mayor peso molecular, mayor dificultad en el procesos de absorción. Este aspecto no afecta notoriamente a fármacos con pesos moleculares entre los 100 y 1000 kda, situación que, para una proporción importante de los utilizados en la práctica clínica, aún es común. Sin embargo, fármacos con pesos moleculares superiores a los 1000 kda (la mayoría de fármacos con estructura proteica) presentan limitaciones para difundir entre los compartimentos del cuerpo, lo que hace que se tengan que administrar por vía parenteral o directamente en el compartimento en que ejercen su efecto (caso de la mayoría de los medicamentos biotecnológicos; como se ilustra en el caso del trombolítico ateplase (enzima fibrinolítica) la cual se administra vía intravenosa. Importancia de la solubilidad en lípidos o grado de liposolubilidad en la absorción de los fármacos: El grado de liposolubilidad de un fármaco se establece mediante el coeficiente de partición, parámetros que se determina estableciendo el grado de solubilidad del fármaco en un solvente apolar con relación a otro polar. En general, los fármacos con un mayor coeficiente de partición atraviesan más fácil las membranas celulares, lo cual influye no sólo la absorción, sino también el proceso de distribución (ver más adelante). Concentración del fármaco en fase lipídica P = Concentración del fármaco en fase acuosa A mayor valor de P, más facilidad para que el fármaco pase la membrana (más liposolubilidad). Importancia de motilidad gástrica en la absorción de los fármacos: La absorción del fármaco, desde la forma farmacéutica de la mayoría de los medicamentos administrados vía oral, ocurre en el intestino delgado, los cambios en la motilidad gástrica pueden afectar la velocidad e incluso la cantidad absorbida del principio activo. Por ello, los medicamentos que tienen la propiedad de retardar el vaciamiento gástrico (hipnóticos, sedantes, antipsicóticos, antidepresivos) pueden disminuir la velocidad de absorción y los que lo aumentan (metoclopramida y otros procinéticos) la pueden aumentar. Por otro lado, existen formulaciones de principios activos que requieren de más tiempo en el estómago para disolverse mejor. Este proceso se ve favorecido por la administración de fármacos que disminuyen el vaciamiento gástrico y que conduce a aumentar la cantidad de fármaco disponible para la absorción y, por tanto, la cantidad absorbida. Por su parte, en el caso de los fármacos que aumenten el vaciamiento gástrico, se puede esperar un efecto contrario.
FARMACOCINETICA PAUL CAMARGO SANTIZ Q.F.
 FARMACOCINETICA PAUL CAMARGO SANTIZ Q.F. DEFINICIONES: FARMACODINAMIA: Estudia las acciones y efectos de los fármacos (lo que el fármaco hace en el organismo) FARMACOCINETICA: Estudia los procesos y factores
FARMACOCINETICA PAUL CAMARGO SANTIZ Q.F. DEFINICIONES: FARMACODINAMIA: Estudia las acciones y efectos de los fármacos (lo que el fármaco hace en el organismo) FARMACOCINETICA: Estudia los procesos y factores
Farmacocinética. Prof. Héctor Cisternas R.
 Farmacocinética Prof. Héctor Cisternas R. Absorción y transporte de fármaco desde el tubo digestivo. La absorción es la transferencia de un fármaco desde el sitio en que se administra hasta el torrente
Farmacocinética Prof. Héctor Cisternas R. Absorción y transporte de fármaco desde el tubo digestivo. La absorción es la transferencia de un fármaco desde el sitio en que se administra hasta el torrente
PROPIEDADES IÓNICAS DE LAS SOLUCIONES
 PROPIEDADES IÓNICAS DE LAS SOLUCIONES IONIZACIÓN DEL AGUA La ionización del agua se refiere a la capacidad que tiene el agua de separarse y generar moléculas cargadas (iones). Esta tendencia del ión Hidrógeno
PROPIEDADES IÓNICAS DE LAS SOLUCIONES IONIZACIÓN DEL AGUA La ionización del agua se refiere a la capacidad que tiene el agua de separarse y generar moléculas cargadas (iones). Esta tendencia del ión Hidrógeno
Farmacología Clínica Aplicada a la Práctica Odontológica
 Farmacología Clínica Aplicada a la Práctica Odontológica Factores que afectan la elección de un sistema de liberación Omar F. Carrasco Qué es un Sistema de Liberación de Fármacos? Innovación biofarmacéutica
Farmacología Clínica Aplicada a la Práctica Odontológica Factores que afectan la elección de un sistema de liberación Omar F. Carrasco Qué es un Sistema de Liberación de Fármacos? Innovación biofarmacéutica
GUÍA DE EJERCICIOS TITULACIÓN ÁCIDO BASE Área Química
 Resultados de aprendizaje GUÍA DE EJERCICIOS TITULACIÓN ÁCIDO BASE Área Química Identifica, interpreta y analiza conceptos básicos sobre métodos de análisis por titulación, para la resolución de ejercicios,
Resultados de aprendizaje GUÍA DE EJERCICIOS TITULACIÓN ÁCIDO BASE Área Química Identifica, interpreta y analiza conceptos básicos sobre métodos de análisis por titulación, para la resolución de ejercicios,
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
INTENSIDAD DEL EFECTO FARMACOLOGICO
 BIODISPONIBILIDAD Y BIOEQUIVALENCIA. Miguel Luján Director Científico. Centro de Estudios de Bioequivalencia y de UNIVERIX BIODISPONIBILIDAD Y BIOEQUIVALENCIA DOSIS FARMACO LIBRE EN PLASMA CONCENTRACION
BIODISPONIBILIDAD Y BIOEQUIVALENCIA. Miguel Luján Director Científico. Centro de Estudios de Bioequivalencia y de UNIVERIX BIODISPONIBILIDAD Y BIOEQUIVALENCIA DOSIS FARMACO LIBRE EN PLASMA CONCENTRACION
Factores farmacocinéticos que
 Factores farmacocinéticos que determinan PROCESOS la acción GENERALES de los fármacos Liberación Absorción Distribución Metabolismo Excreción L A D M E receptor Respuesta Absorción: paso del fármaco a
Factores farmacocinéticos que determinan PROCESOS la acción GENERALES de los fármacos Liberación Absorción Distribución Metabolismo Excreción L A D M E receptor Respuesta Absorción: paso del fármaco a
Objetivos de conocimiento de esta lección. FARMACOCINETICA. Paso de fármacos a través de membranas biológicas. Absorción de fármacos.
 Objetivos de conocimiento de esta lección FARMACOCINETICA. Paso de fármacos a través de membranas biológicas. Absorción de fármacos. Dr. Jesús Frías Iniesta. Conocer el interés conceptual y clínico de
Objetivos de conocimiento de esta lección FARMACOCINETICA. Paso de fármacos a través de membranas biológicas. Absorción de fármacos. Dr. Jesús Frías Iniesta. Conocer el interés conceptual y clínico de
Proteínas plasmáticas. Proteínas plasmáticas. Sales de litio 0% Ampicilina 18% Morfina 35% Aspirina 50% Fenitoína 90% Diazepam 98% Warfarina 99%
 Distribución Distribución y fijación de fármacos Paso del fármaco desde la sangre a los diversos tejidos La capacidad de los fármacos para distribuirse en el organismo va a depender de: a) Características
Distribución Distribución y fijación de fármacos Paso del fármaco desde la sangre a los diversos tejidos La capacidad de los fármacos para distribuirse en el organismo va a depender de: a) Características
REACCIONES DE TRANSFERENCIA DE PROTONES ELECTROLITOS
 REACCIONES DE TRANSFERENCIA DE PROTONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA ELECTROLITOS Un electrolito es una sustancia que al disolverse en agua experimenta una disociación (o ionización) total
REACCIONES DE TRANSFERENCIA DE PROTONES CURSO: 2º DE BACHILLERATO ASIGNATURA: QUÍMICA ELECTROLITOS Un electrolito es una sustancia que al disolverse en agua experimenta una disociación (o ionización) total
Equilibrio Ácido-Base
 Equilibrio Ácido-Base Introducción. Los ácidos y las bases son sustancias conocidas desde muy antiguo. En 1663 Robert Boyle determinó que eran capaces de enrojecer pigmentos como el tornasol y precipitar
Equilibrio Ácido-Base Introducción. Los ácidos y las bases son sustancias conocidas desde muy antiguo. En 1663 Robert Boyle determinó que eran capaces de enrojecer pigmentos como el tornasol y precipitar
DISTRIBUCIÓN. Aivle Libertad Hernández
 DISTRIBUCIÓN Aivle Libertad Hernández Los procesos farmacociné9cos de ABSORCIÓN, DISTRIBUCIÓN, METABOLISMO y ELIMINACIÓN determinan la velocidad y duración en que el fármaco se presentará en el órgano
DISTRIBUCIÓN Aivle Libertad Hernández Los procesos farmacociné9cos de ABSORCIÓN, DISTRIBUCIÓN, METABOLISMO y ELIMINACIÓN determinan la velocidad y duración en que el fármaco se presentará en el órgano
EQUILIBRIO QUÍMICO ÁCIDO - BASE
 EQUILIBRIO QUÍMICO ÁCIDO - BASE TEMARIO 1) Química Analítica. Análisis Químico Cualitativo y Análisis Químico Cuantitativo 2) Importancia de la Química Analítica en la carrera de Agronomía 3) Equilibrio
EQUILIBRIO QUÍMICO ÁCIDO - BASE TEMARIO 1) Química Analítica. Análisis Químico Cualitativo y Análisis Químico Cuantitativo 2) Importancia de la Química Analítica en la carrera de Agronomía 3) Equilibrio
TEMA 4: FARMACOCINÉTICA II. DISTRIBUCIÓN
 TEMA 4: FARMACOCINÉTICA II. DISTRIBUCIÓN Acceso de los fármacos a los órganos en los que debe actuar Acceso de los fármacos a los órganos que los van a eliminar (metabolismo y excreción) Condiciona la
TEMA 4: FARMACOCINÉTICA II. DISTRIBUCIÓN Acceso de los fármacos a los órganos en los que debe actuar Acceso de los fármacos a los órganos que los van a eliminar (metabolismo y excreción) Condiciona la
Usos de fármacos durante el embarazo y la lactancia
 Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
CARACTERÍSTICAS ÁCIDOS: BASES:
 EQUILIBRIO IÓNICO CARACTERÍSTICAS ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
EQUILIBRIO IÓNICO CARACTERÍSTICAS ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
BIOFARMACIA Y FARMACOCINÉTICA. Mg. Q.F. Carla Cecilia Rodríguez Zegarra
 BIOFARMACIA Y FARMACOCINÉTICA Mg. Q.F. Carla Cecilia Rodríguez Zegarra Qué es la BIOFARMACIA? Estudio de los factores físico-químicos que influencian la biodisponibilidad de un fármaco en el hombre y los
BIOFARMACIA Y FARMACOCINÉTICA Mg. Q.F. Carla Cecilia Rodríguez Zegarra Qué es la BIOFARMACIA? Estudio de los factores físico-químicos que influencian la biodisponibilidad de un fármaco en el hombre y los
TEMA 8: REACCIONES DE TRANSFERENCIA DE PROTONES.
 TEMA 8: REACCIONES DE TRANSFERENCIA DE PROTONES. 1.- Concepto de ácido base. 1.1. Teoría de Arrhenius sobre ácidos y bases. Para el químico sueco Arrhenius, un ácido es toda aquella sustancia eléctricamente
TEMA 8: REACCIONES DE TRANSFERENCIA DE PROTONES. 1.- Concepto de ácido base. 1.1. Teoría de Arrhenius sobre ácidos y bases. Para el químico sueco Arrhenius, un ácido es toda aquella sustancia eléctricamente
Absorción. -Proceso ADME - A en ADME -Modelos de transporte - Factores que afectan la absorción oral. -Permeabilidad -Clasificación Biofarmacéutica
 Absorción -Proceso ADME - A en ADME -Modelos de transporte - Factores que afectan la absorción oral -Permeabilidad -Clasificación Biofarmacéutica SISTEMA LADME FARMACOS EN FORMA LIBERACIÓN DEL FÁRMACO
Absorción -Proceso ADME - A en ADME -Modelos de transporte - Factores que afectan la absorción oral -Permeabilidad -Clasificación Biofarmacéutica SISTEMA LADME FARMACOS EN FORMA LIBERACIÓN DEL FÁRMACO
QUIMICA GENERAL GUIA DE EJERCICIOS Nº4 Soluciones Ácido-base. 1.- Defina los ácidos y bases según las teorías ácido base que usted conoce.
 1 QUIMICA GENERAL GUIA DE EJERCICIOS Nº4 Soluciones Ácido-base PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los ácidos y bases según las teorías ácido base que usted conoce. 2.- Defina el ph y poh.
1 QUIMICA GENERAL GUIA DE EJERCICIOS Nº4 Soluciones Ácido-base PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los ácidos y bases según las teorías ácido base que usted conoce. 2.- Defina el ph y poh.
FARMACOCINETICA. Paso de fármacos f a través s de membranas biológicas. Dr. Pedro Guerra López
 FARMACOCINETICA. Paso de fármacos f a través s de membranas biológicas. Absorción n de fármacos. f Dr. Pedro Guerra López Objetivos de conocimiento de esta lección. Conocer el interés s conceptual y clínico
FARMACOCINETICA. Paso de fármacos f a través s de membranas biológicas. Absorción n de fármacos. f Dr. Pedro Guerra López Objetivos de conocimiento de esta lección. Conocer el interés s conceptual y clínico
Lección 36. Fármacos para el control de la secreción ácida gástrica UNIDAD IX: ALTERACIONES DIGESTIVAS
 Ricardo Brage e Isabel Trapero - Lección 36 UNIDAD IX: ALTERACIONES DIGESTIVAS Lección 36 Fármacos para el control de la secreción ácida gástrica Guión Ricardo Brage e Isabel Trapero - Lección 36 1. PRINCIPIOS
Ricardo Brage e Isabel Trapero - Lección 36 UNIDAD IX: ALTERACIONES DIGESTIVAS Lección 36 Fármacos para el control de la secreción ácida gástrica Guión Ricardo Brage e Isabel Trapero - Lección 36 1. PRINCIPIOS
Metabolismo Renal de Fármacos.
 Metabolismo Renal de Fármacos. Dr. MC. Rogelio Monreal Puente VI Congreso Regional de Químicos Farmacéuticos Biólogos Biblioteca Universitaria Raúl Rangel Frías 25 27 de Agosto de 2004 Introducción Mecanismos
Metabolismo Renal de Fármacos. Dr. MC. Rogelio Monreal Puente VI Congreso Regional de Químicos Farmacéuticos Biólogos Biblioteca Universitaria Raúl Rangel Frías 25 27 de Agosto de 2004 Introducción Mecanismos
Dr. Francisco Javier Flores Murrieta
 Dr. Francisco Javier Flores Murrieta Doctor en Farmacología egresado del CINVESTAV-IPN Jefe de la Unidad de Investigación en Farmacología del INER Profesor Titular de la ESM-IPN Ha publicado mas de 120
Dr. Francisco Javier Flores Murrieta Doctor en Farmacología egresado del CINVESTAV-IPN Jefe de la Unidad de Investigación en Farmacología del INER Profesor Titular de la ESM-IPN Ha publicado mas de 120
2.- Enuncie los principios o reglas que controlan el llenado de los niveles de energía atómicos permitidos.
 BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
BLOQUE PRIMERO 1.- Un compuesto contiene 85,7% de carbono y 14,3% de hidrógeno y la masa de la molécula del mismo es 42. Calcule la fórmula del compuesto sabiendo que la masa atómica del carbono. 2.- Enuncie
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM. ACIDOS Y BASES, ph, BUFFERS
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM ACIDOS Y BASES, ph, BUFFERS Ionización del agua y producto iónico del agua (K w ) H 2 O H + + OH - K eq = [H + ][OH - ] [H 2 O] K eq = [H + ][OH - ] [H 2 O] K eq
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM ACIDOS Y BASES, ph, BUFFERS Ionización del agua y producto iónico del agua (K w ) H 2 O H + + OH - K eq = [H + ][OH - ] [H 2 O] K eq = [H + ][OH - ] [H 2 O] K eq
ABSORCION, DISTRIBUCION, METABOLISMO Y ELIMINACION DE MEDICAMENTOS. Farm. B. L. Zylbersztajn
 ABSORCION, DISTRIBUCION, METABOLISMO Y ELIMINACION DE MEDICAMENTOS Farm. B. L. Zylbersztajn Farmacocinética Estudia el movimiento del fármaco en el individuo. Farmacocinética LADME Liberación El fármaco
ABSORCION, DISTRIBUCION, METABOLISMO Y ELIMINACION DE MEDICAMENTOS Farm. B. L. Zylbersztajn Farmacocinética Estudia el movimiento del fármaco en el individuo. Farmacocinética LADME Liberación El fármaco
ciencia-basica-experimental.net
 ciencia-basica-experimental.net Sistema material Sustancias puras Elemento Compuesto Mezcla Mezcla Homogénea Mezcla Heterogénea Mezcla coloidal Suspensión Es una mezcla homogénea de dos o mas sustancias
ciencia-basica-experimental.net Sistema material Sustancias puras Elemento Compuesto Mezcla Mezcla Homogénea Mezcla Heterogénea Mezcla coloidal Suspensión Es una mezcla homogénea de dos o mas sustancias
LABORATORIO N 3 SOLUCIONES ACIDO-BASE Y BUFFER
 LABORATORIO N 3 SOLUCIONES ACIDO-BASE Y BUFFER 1.- INTRODUCCIÓN Soluciones Ácido-Base Los solutos disueltos en agua pueden clasificarse como electrolitos y no electrolitos en función de su capacidad de
LABORATORIO N 3 SOLUCIONES ACIDO-BASE Y BUFFER 1.- INTRODUCCIÓN Soluciones Ácido-Base Los solutos disueltos en agua pueden clasificarse como electrolitos y no electrolitos en función de su capacidad de
Concepto de ph. Bases
 Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
BIOTRANSFORMACIÓN DE LOS TÓXICOS. Dra Ana García Dpto. Farmacología y Terapéutica UAM (ana.garcia@uam.es)
 BIOTRANSFORMACIÓN DE LOS TÓXICOS Dra Ana García Dpto. Farmacología y Terapéutica UAM (ana.garcia@uam.es) Toxicocinetica ABSORCIÓN ( Oral, inhalación, piel ) DISTRIBUCIÓN ELIMINACIÓN (Biotransformación
BIOTRANSFORMACIÓN DE LOS TÓXICOS Dra Ana García Dpto. Farmacología y Terapéutica UAM (ana.garcia@uam.es) Toxicocinetica ABSORCIÓN ( Oral, inhalación, piel ) DISTRIBUCIÓN ELIMINACIÓN (Biotransformación
COLEGIO SAN FRANCISCO JAVIER GUIAS
 COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
Biodisponibilidad y bioequivalencia
 Biodisponibilidad y bioequivalencia Adaptado de: OCW Farmacia Galénica [2013/12] [cas] http://ocw.ehu.es/file.php/199/tema_23_biodisponibilidad2_ocw.pdf http://ocw.ehu.es/file.php/199/tema_24_bioequivalencia2_ocw.pdf
Biodisponibilidad y bioequivalencia Adaptado de: OCW Farmacia Galénica [2013/12] [cas] http://ocw.ehu.es/file.php/199/tema_23_biodisponibilidad2_ocw.pdf http://ocw.ehu.es/file.php/199/tema_24_bioequivalencia2_ocw.pdf
ttp://www.ugr.es/~rsaucedo
 ttp://www.ugr.es/~rsaucedo ENFERMEDADES RELACIONADAS CON EL ACIDO GASTRICO - LESIONES ULCERO-EROSIVAS DE LA MUCOSA GASTRO-DUODENAL. - DE ETIOLOGIA MUY DISPAR. - PATOGENIA: HIPERCLORHIDRIA O NORMOCLORHIDRIA
ttp://www.ugr.es/~rsaucedo ENFERMEDADES RELACIONADAS CON EL ACIDO GASTRICO - LESIONES ULCERO-EROSIVAS DE LA MUCOSA GASTRO-DUODENAL. - DE ETIOLOGIA MUY DISPAR. - PATOGENIA: HIPERCLORHIDRIA O NORMOCLORHIDRIA
VÍAS DE ADMINISTRACIÓN, ABSORCIÓN Y TRANSPORTE DE FÁRMACOS
 niversitat Institute for LifeLong Learning Institut de Formació Contínua Instituto de Formación Continua de arcelona VÍAS DE ADMINISTRACIÓN, ASORCIÓN Y TRANSPORTE DE FÁRMACOS CONXITA ARAJAS DOCTORA EN
niversitat Institute for LifeLong Learning Institut de Formació Contínua Instituto de Formación Continua de arcelona VÍAS DE ADMINISTRACIÓN, ASORCIÓN Y TRANSPORTE DE FÁRMACOS CONXITA ARAJAS DOCTORA EN
= 10. TRABAJO PRÁCTICO: ph. TP ph 1/5
 TRABAJO PRÁCTICO: ph INTRODUCCIÓN: En el estudio de las reacciones ácido base en disolución acuosa, las magnitudes más importantes son las concentraciones de los iones hidrógeno (H +, también llamado protón
TRABAJO PRÁCTICO: ph INTRODUCCIÓN: En el estudio de las reacciones ácido base en disolución acuosa, las magnitudes más importantes son las concentraciones de los iones hidrógeno (H +, también llamado protón
Volumetrías ácido-base. Química Analítica Autor: Joaquín A. Ortuño
 Volumetrías ácido-base VALORACIÓN DE UN ÁCIDO FUERTE (HCl) CON UNA BASE FUERTE (NaOH) Etapas: 1. Antes del punto de equivalencia: ph de una disolución de ácido fuerte. 2. En el punto de equivalencia: ph
Volumetrías ácido-base VALORACIÓN DE UN ÁCIDO FUERTE (HCl) CON UNA BASE FUERTE (NaOH) Etapas: 1. Antes del punto de equivalencia: ph de una disolución de ácido fuerte. 2. En el punto de equivalencia: ph
OPCIÓN A. S = 4 = 4, moles L 1.
 OPCIÓN A CUESTIÓN 1.- a) Razona con los correspondientes equilibrios en disolución acuosa si las siguientes especies tienen carácter ácido, básico o anfótero: ion hidrogenocarbonato, ion hidrogenosulfuro
OPCIÓN A CUESTIÓN 1.- a) Razona con los correspondientes equilibrios en disolución acuosa si las siguientes especies tienen carácter ácido, básico o anfótero: ion hidrogenocarbonato, ion hidrogenosulfuro
Equilibrio en Soluciones Acuosas
 Equilibrio en Soluciones Acuosas Contenido I Pág. 1. Equilibrio en Soluciones Acuosas (Resumen) 1 1.1. Propiedades Electrolíticas 1 1.2. Compuestos iónicos en agua 2 1.3. Compuestos moleculares en agua
Equilibrio en Soluciones Acuosas Contenido I Pág. 1. Equilibrio en Soluciones Acuosas (Resumen) 1 1.1. Propiedades Electrolíticas 1 1.2. Compuestos iónicos en agua 2 1.3. Compuestos moleculares en agua
GUÍA DE EJERCICIOS EQUILIBRIO IÓNICO Área Química
 Resultados de aprendizaje GUÍA DE EJERCICIOS EQUILIBRIO IÓNICO Área Química Identifica, interpreta y analiza conceptos básicos sobre equilibrio iónico, para la resolución de ejercicios, desarrollando pensamiento
Resultados de aprendizaje GUÍA DE EJERCICIOS EQUILIBRIO IÓNICO Área Química Identifica, interpreta y analiza conceptos básicos sobre equilibrio iónico, para la resolución de ejercicios, desarrollando pensamiento
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
FÁRMACOS QUE MODIFICAN LA FUNCIÓN GASTROINTESTINAL
 FÁRMACOS QUE MODIFICAN LA FUNCIÓN GASTROINTESTINAL Departamento de Farmacología y Terapéutica Facultad de Medicina Universidad de la República ANTECEDENTES E IMPORTANCIA DEL TEMA GRUPO FARMACOLOGICO AMPLIAMENTE
FÁRMACOS QUE MODIFICAN LA FUNCIÓN GASTROINTESTINAL Departamento de Farmacología y Terapéutica Facultad de Medicina Universidad de la República ANTECEDENTES E IMPORTANCIA DEL TEMA GRUPO FARMACOLOGICO AMPLIAMENTE
GUÍA DE EJERCICIOS EQUILIBRIO IÓNICO Área Química
 Resultados de aprendizaje GUÍA DE EJERCICIOS EQUILIBRIO IÓNICO Área Química Identifica, interpreta y analiza conceptos básicos sobre equilibrio iónico, para la resolución de ejercicios, desarrollando pensamiento
Resultados de aprendizaje GUÍA DE EJERCICIOS EQUILIBRIO IÓNICO Área Química Identifica, interpreta y analiza conceptos básicos sobre equilibrio iónico, para la resolución de ejercicios, desarrollando pensamiento
Constante de equilibrio de un ácido débil (Indicador visual)
 Constante de equilibrio de un ácido débil (dicador visual) Laboratorio Química Física I QUIM 4051 Ileana Nieves Martínez agosto 2014 1 Propósito Determinar la constante de equilibrio de la disociación
Constante de equilibrio de un ácido débil (dicador visual) Laboratorio Química Física I QUIM 4051 Ileana Nieves Martínez agosto 2014 1 Propósito Determinar la constante de equilibrio de la disociación
GUÍA DE EJERCICIOS TITULACIÓN ÁCIDO BASE Área Química
 Resultados de aprendizaje GUÍA DE EJERCICIOS TITULACIÓN ÁCIDO BASE Área Química Identifica, interpreta y analiza conceptos básicos sobre métodos de análisis por titulación, para la resolución de ejercicios,
Resultados de aprendizaje GUÍA DE EJERCICIOS TITULACIÓN ÁCIDO BASE Área Química Identifica, interpreta y analiza conceptos básicos sobre métodos de análisis por titulación, para la resolución de ejercicios,
PASO DE FÁRMACOS A TRAVÉS DE MEMBRANAS BIOLÓGICAS
 Página 1 FARMACOCINÉTICA estudia los procesos de absorción, distribución, metabolismo y eliminación. Permite cuantificar las velocidades de absorción y de eliminación, la biodisponibilidad, el volumen
Página 1 FARMACOCINÉTICA estudia los procesos de absorción, distribución, metabolismo y eliminación. Permite cuantificar las velocidades de absorción y de eliminación, la biodisponibilidad, el volumen
12. Equilibrio ácido-base
 12. Equilibrio ácido-base 12.1. Ácidos y bases 12.2. Disociación del agua: autoionización 12.2.1. Producto iónico del agua 12.2.2. Escala ph 12.2.3. Medición ph 12.3. Ácidos y bases Br nsted-lowry 12.3.1.
12. Equilibrio ácido-base 12.1. Ácidos y bases 12.2. Disociación del agua: autoionización 12.2.1. Producto iónico del agua 12.2.2. Escala ph 12.2.3. Medición ph 12.3. Ácidos y bases Br nsted-lowry 12.3.1.
ANÁLISIS VOLUMÉTRICO
 ANÁLISIS VOLUMÉTRICO Análisis volumétrico Se determina la concentración de un analito en una solución por reacción química con una sustancia patrón Análisis volumétrico x A + y B C analito patrón Peso
ANÁLISIS VOLUMÉTRICO Análisis volumétrico Se determina la concentración de un analito en una solución por reacción química con una sustancia patrón Análisis volumétrico x A + y B C analito patrón Peso
Mónica Marín Casino Servicio de Farmacia
 Farmacocinética y Farmacodinamia de los fármacos usados en cardiología: qué tiene que conocer el clínico? Mónica Marín Casino Servicio de Farmacia 6 marzo 2015 Índice Farmacocinética Lo que el organismo
Farmacocinética y Farmacodinamia de los fármacos usados en cardiología: qué tiene que conocer el clínico? Mónica Marín Casino Servicio de Farmacia 6 marzo 2015 Índice Farmacocinética Lo que el organismo
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva 2, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2006 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 4, Opción A Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4, Opción B Reserva 2, Ejercicio
FARMACOCINETICA. Cátedra de Farmacología. Facultad de Medicina
 FARMACOCINETICA FARMACOCINÉTICA Es la rama de la Farmacología que estudia el paso de los fármacos a través del organismo en función del tiempo y de la dosis. Comprende los procesos de absorción, distribución,
FARMACOCINETICA FARMACOCINÉTICA Es la rama de la Farmacología que estudia el paso de los fármacos a través del organismo en función del tiempo y de la dosis. Comprende los procesos de absorción, distribución,
ACTIVIDAD ENZIMÁTICA. Dra. Lilian González Segura Departamento de Bioquímica Facultad de Química
 ACTIVIDAD ENZIMÁTICA Dra. Lilian González Segura Departamento de Bioquímica Facultad de Química Porqué la gran mayoría de las reacciones en los seres vivos necesitan ser catalizadas para que ocurran a
ACTIVIDAD ENZIMÁTICA Dra. Lilian González Segura Departamento de Bioquímica Facultad de Química Porqué la gran mayoría de las reacciones en los seres vivos necesitan ser catalizadas para que ocurran a
GUÍA DE EJERCICIOS ADICIONALES N 2 Acido-base, neutralización y buffer
 1 GUÍA DE EJERCICIOS ADICIONALES N 2 Acido-base, neutralización y buffer 1.- Un ácido según la teoría de Arrhenius es aquella sustancia que: a) Libera uno o más iones hidroxilos (OH - ) por cada molécula
1 GUÍA DE EJERCICIOS ADICIONALES N 2 Acido-base, neutralización y buffer 1.- Un ácido según la teoría de Arrhenius es aquella sustancia que: a) Libera uno o más iones hidroxilos (OH - ) por cada molécula
SEMINARIO N o 2 Ácidos y Bases
 SEMINARIO N o 2 Ácidos y Bases Desde que en 1884 el químico sueco Svante August Arrhenius sentara las bases de la disociación iónica en su tesis doctoral, un ácido se definió como una sustancia que, en
SEMINARIO N o 2 Ácidos y Bases Desde que en 1884 el químico sueco Svante August Arrhenius sentara las bases de la disociación iónica en su tesis doctoral, un ácido se definió como una sustancia que, en
INTERCAMBIABILIDAD DE PRODUCTOS FARMACÉUTICOS.
 INTERCAMBIABILIDAD DE PRODUCTOS FARMACÉUTICOS. Dr. Francisco Javier Flores Murrieta Unidad de Investigación en Farmacología Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas Ciudad
INTERCAMBIABILIDAD DE PRODUCTOS FARMACÉUTICOS. Dr. Francisco Javier Flores Murrieta Unidad de Investigación en Farmacología Instituto Nacional de Enfermedades Respiratorias Ismael Cosío Villegas Ciudad
GUÍA 2 DE EJERCICIOS EQUÍLIBRIO IONICO
 GUÍA DE EJERCICIOS EQUÍLIBRIO IONICO Resultados de aprendizaje Analiza conceptos básicos sobre equilibrio iónico, para la resolución de ejercicios, desarrollando pensamiento lógico y sistemático. Contenidos
GUÍA DE EJERCICIOS EQUÍLIBRIO IONICO Resultados de aprendizaje Analiza conceptos básicos sobre equilibrio iónico, para la resolución de ejercicios, desarrollando pensamiento lógico y sistemático. Contenidos
No. el alcohol no altera el mecanismo de acción o los efectos del Andanza.
 GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
GUÍA SOBRE 1 1. Qué es Es un fármaco aprobado para su uso como adyuvante, del plan alimentario hipocalórico y la práctica de ejercicio, en el manejo del sobrepeso y la obesidad en adolescentes y adultos.
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO FACULTAD DE ESTUDIOS SUPERIORES CUAUTITLÁN
 UNIVERSIDAD NACIONAL AUTÓNOMA MÉXICO FACULTAD ESTUDIOS SUPERIORES CUAUTITLÁN LICENCIATURA EN QUÍMICA FARMACEUTICA BIOLÓGICA Sexto semestre ASIGNATURA: FARMACOLOGÍA I HORAS / SEMANA 7 / SEMESTRE 112 CARÁCTER:
UNIVERSIDAD NACIONAL AUTÓNOMA MÉXICO FACULTAD ESTUDIOS SUPERIORES CUAUTITLÁN LICENCIATURA EN QUÍMICA FARMACEUTICA BIOLÓGICA Sexto semestre ASIGNATURA: FARMACOLOGÍA I HORAS / SEMANA 7 / SEMESTRE 112 CARÁCTER:
Ácidos, Bases y Electrolitos
 Ácidos, Bases y Electrolitos Semana 12 Licda. Lilian Judith Guzmán Melgar ACIDOS Y BASES ACIDOS Del latín Acidus= agrio Ejemplos Vinagre, jugo de limón. Tiene un sabor a agrio y pueden producir sensación
Ácidos, Bases y Electrolitos Semana 12 Licda. Lilian Judith Guzmán Melgar ACIDOS Y BASES ACIDOS Del latín Acidus= agrio Ejemplos Vinagre, jugo de limón. Tiene un sabor a agrio y pueden producir sensación
Equipo 5 Sistemas amortiguadores
 Equipo 5 Sistemas amortiguadores Anaya Gutiérrez Erick Jesús García García Esmira Jazmin García Montesinos Ana Paola Gonzales Galindo Jesús Antonio Jóse Ruíz Diego Mendez Silva Clara Anaid Yépez Cancino
Equipo 5 Sistemas amortiguadores Anaya Gutiérrez Erick Jesús García García Esmira Jazmin García Montesinos Ana Paola Gonzales Galindo Jesús Antonio Jóse Ruíz Diego Mendez Silva Clara Anaid Yépez Cancino
LACTANCIA ATENCIÓN DESDE LA OFICINA DE FARMACIA
 LACTANCIA ATENCIÓN DESDE LA OFICINA DE FARMACIA Puras G, Saenz del Burgo L Atención Farmacéutica. OCW UPV/EHU Esquema 2 1. Ventajas de la lactancia natural/materna 2. Consideraciones 3. Factores que condicionan
LACTANCIA ATENCIÓN DESDE LA OFICINA DE FARMACIA Puras G, Saenz del Burgo L Atención Farmacéutica. OCW UPV/EHU Esquema 2 1. Ventajas de la lactancia natural/materna 2. Consideraciones 3. Factores que condicionan
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
Acido: es una sustancia que en solución acuosa incrementa la concentración del ion hidrónio (H3O + )
 Conceptos de ácido- base Arrhenius Acido: es una sustancia que en solución acuosa incrementa la concentración del ion hidrónio (H3O + ) Base: es una sustancia que incrementa la concentración de iones oxidrilo
Conceptos de ácido- base Arrhenius Acido: es una sustancia que en solución acuosa incrementa la concentración del ion hidrónio (H3O + ) Base: es una sustancia que incrementa la concentración de iones oxidrilo
Bases Científicas 1 Autor: Marta Adonis
 ACIDO-BASE En los organismos vivos la concentración de protones debe mantenerse dentro de límites muy estrechos, como requisito indispensable para el desarrollo normal de los procesos metabólicos intracelulares.
ACIDO-BASE En los organismos vivos la concentración de protones debe mantenerse dentro de límites muy estrechos, como requisito indispensable para el desarrollo normal de los procesos metabólicos intracelulares.
MATEMÁTICA APLICADA. PROFA. MARÍA ROSARIA RUGGIERO Lic. En Educación Mención Física y Matemática de la UCAB Docente de la UCV-Escuela de Bioanálisis
 MATEMÁTICA APLICADA PROFA. MARÍA ROSARIA RUGGIERO Lic. En Educación Mención Física y Matemática de la UCAB Docente de la UCV-Escuela de Bioanálisis Caracas, septiembre 2011 INGRESO A LA UCAB ESTUDIANTE
MATEMÁTICA APLICADA PROFA. MARÍA ROSARIA RUGGIERO Lic. En Educación Mención Física y Matemática de la UCAB Docente de la UCV-Escuela de Bioanálisis Caracas, septiembre 2011 INGRESO A LA UCAB ESTUDIANTE
ÁCIDOS Y BASES MPSS GÓMEZ CHANG ERIKA. Todos los derechos reservados. Julio 2007 M. en C. Alicia Cea Bonilla -
 ÁCIDOS Y BASES MPSS GÓMEZ CHANG ERIKA 1 Probablemente no haya otro tipo de equilibrio tan importante como el de ácidos y bases B. M. Mahan y R. J. Myers 2 CASO AMC de 52 años de edad, acostumbraba consumir
ÁCIDOS Y BASES MPSS GÓMEZ CHANG ERIKA 1 Probablemente no haya otro tipo de equilibrio tan importante como el de ácidos y bases B. M. Mahan y R. J. Myers 2 CASO AMC de 52 años de edad, acostumbraba consumir
Reacciones de transferencia de protones. Ácido Base
 TEMA 6 REACCIONES DE TRANSFERENCIA DE PROTONES. ÁCIDO BASE 1 INTRODUCCION 1.1 PRIMERAS IDEAS DE ÁCIDO Y DE BASE 1.2 TEORIA DE ARRHENIUS 1.3 TEORÍA DE BRÖNSTED Y LOWRY ÁCIDOS Y BASES CONJUGADOS ANFÓTEROS
TEMA 6 REACCIONES DE TRANSFERENCIA DE PROTONES. ÁCIDO BASE 1 INTRODUCCION 1.1 PRIMERAS IDEAS DE ÁCIDO Y DE BASE 1.2 TEORIA DE ARRHENIUS 1.3 TEORÍA DE BRÖNSTED Y LOWRY ÁCIDOS Y BASES CONJUGADOS ANFÓTEROS
ÁCIDOS Y BASES GENERALIDADES DE LAS SALES CONCEPTOS DE ÁCIDOS CONCEPTOS DE BASES. EL ph DE UNA SOLUCIÓN. LA ESCALA DE ph EL PROCESO DE NEUTRALIZACIÓN
 GENERALIDADES DE LAS SALES CONCEPTOS DE ÁCIDOS CONCEPTOS DE BASES EL ph DE UNA SOLUCIÓN LA ESCALA DE ph EL PROCESO DE NEUTRALIZACIÓN LAS SALES Generalidades Las sales se reconocen por estar formadas generalmente
GENERALIDADES DE LAS SALES CONCEPTOS DE ÁCIDOS CONCEPTOS DE BASES EL ph DE UNA SOLUCIÓN LA ESCALA DE ph EL PROCESO DE NEUTRALIZACIÓN LAS SALES Generalidades Las sales se reconocen por estar formadas generalmente
Unidad V: Mediciones Potenciométricas Contenido
 Unidad V: Mediciones Potenciométricas Contenido Ácidos y bases Modelos de ácidos y bases Equilibrios de disociación de ácidos y bases Equilibrio iónico del agua Concepto, escala y medida del ph Ácidos
Unidad V: Mediciones Potenciométricas Contenido Ácidos y bases Modelos de ácidos y bases Equilibrios de disociación de ácidos y bases Equilibrio iónico del agua Concepto, escala y medida del ph Ácidos
Características ÁCIDOS: BASES:
 ÁCIDOS Y BASES Características ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
ÁCIDOS Y BASES Características ÁCIDOS: Tienen sabor agrio. Son corrosivos para la piel. Enrojecen ciertos colorantes vegetales. Disuelven sustancias Atacan a los metales desprendiendo H 2. Pierden sus
Tema 7: EQUILIBRIO QUÍMICO
 Tema 7: EQUILIBRIO QUÍMICO 1) Qué es un equilibrio químico? En los problemas de estequiometría del tema 1 supusimos que las reacciones químicas se detienen cuando uno o más reactivos se agotan. Estas reacciones
Tema 7: EQUILIBRIO QUÍMICO 1) Qué es un equilibrio químico? En los problemas de estequiometría del tema 1 supusimos que las reacciones químicas se detienen cuando uno o más reactivos se agotan. Estas reacciones
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE.
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE http://emestrada.wordpress.com Complete los siguientes equilibrios ácido-base identificando, de forma razonada, los
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE http://emestrada.wordpress.com Complete los siguientes equilibrios ácido-base identificando, de forma razonada, los
Biopolímero s (4831)
 Biopolímero s (4831) 4.7. Dependencia del ph de la catálisis enzimática. 4.7.1 Ionización de ácidos y bases: ecuaciones básicas. Sea AH un compuesto con una constante de acidez Ka y sea L una propiedad
Biopolímero s (4831) 4.7. Dependencia del ph de la catálisis enzimática. 4.7.1 Ionización de ácidos y bases: ecuaciones básicas. Sea AH un compuesto con una constante de acidez Ka y sea L una propiedad
Ácidos, Bases y Electrolitos. SEMANA 12 SEMANA 12 Licda. Lilian Judith Guzmán Melgar
 Ácidos, Bases y Electrolitos SEMANA 12 SEMANA 12 Licda. Lilian Judith Guzmán Melgar ACIDOS Y BASES ACIDOS Del latín Acidus= agrio Ejemplos Vinagre, jugo de limón. Tiene un sabor a agrio y pueden producir
Ácidos, Bases y Electrolitos SEMANA 12 SEMANA 12 Licda. Lilian Judith Guzmán Melgar ACIDOS Y BASES ACIDOS Del latín Acidus= agrio Ejemplos Vinagre, jugo de limón. Tiene un sabor a agrio y pueden producir
Grupo E- DISOLUCIONES AMORTIGUADORAS o TAMPÓN
 Grupo E DISOLUCIONES AMORTIGUADORAS o TAMPÓN 5 E01 La constante de ionización del hidróxido amónico a 25ºC es 1,8.10. Calcular: a) El ph de una disolución acuosa 0,02 M de hidróxido de amonio b) El ph
Grupo E DISOLUCIONES AMORTIGUADORAS o TAMPÓN 5 E01 La constante de ionización del hidróxido amónico a 25ºC es 1,8.10. Calcular: a) El ph de una disolución acuosa 0,02 M de hidróxido de amonio b) El ph
Reacciones ácido-base: equilibrios cotidianos. Prof: Mario Azan
 Reacciones ácido-base: equilibrios cotidianos Prof: Mario Azan Diferenciando ácidos y bases Indicadores ácido-base Extracto vegetal, el cual adquiere dos colores claramente diferenciados según se encuentre
Reacciones ácido-base: equilibrios cotidianos Prof: Mario Azan Diferenciando ácidos y bases Indicadores ácido-base Extracto vegetal, el cual adquiere dos colores claramente diferenciados según se encuentre
MEMBRANA Y TRANSPORTE
 MEMBRANA Y TRANSPORTE Membrana Celular Qué organización tiene la membrana en el esquema? Los componentes de la membrana tienen una disposición asimétrica, es decir, cada mitad tiene una disposición diferente
MEMBRANA Y TRANSPORTE Membrana Celular Qué organización tiene la membrana en el esquema? Los componentes de la membrana tienen una disposición asimétrica, es decir, cada mitad tiene una disposición diferente
Farmacocinética. Modelo monocompartimental Administración extravasal
 Farmacocinética Modelo monocompartimental Administración extravasal SISTEMA LADME FARMACOS EN FORMA LIBERACIÓN DEL FÁRMACO FÁRMACOS CRISTALINOS DISOLUCIÓN DE DOSIFICACIÓN EXPUESTOS A FLUIDOS EN DE CRISTALES
Farmacocinética Modelo monocompartimental Administración extravasal SISTEMA LADME FARMACOS EN FORMA LIBERACIÓN DEL FÁRMACO FÁRMACOS CRISTALINOS DISOLUCIÓN DE DOSIFICACIÓN EXPUESTOS A FLUIDOS EN DE CRISTALES
SEMINARIO DE FARMACOLOGIA Nº 2
 CUESTIONARIO GUIA: Farmacocinética SEMINARIO FARMACOLOGIA Nº 2 1- Cuáles son los pasos de la Farmacocinética? 2- Cuáles son los componentes de la membrana que sufren mutilación? 3- Las glicoproteínas y
CUESTIONARIO GUIA: Farmacocinética SEMINARIO FARMACOLOGIA Nº 2 1- Cuáles son los pasos de la Farmacocinética? 2- Cuáles son los componentes de la membrana que sufren mutilación? 3- Las glicoproteínas y
Liberación de fármacos
 Liberación de fármacos Adaptado de: OCW Farmacia Galénica [2013/12] [cas] http://ocw.ehu.es/file.php/199/tema_3_liberacion_ocw.pdf Tema 2 Índice de contenidos 2 Introducción Fases de la liberación Disgregación
Liberación de fármacos Adaptado de: OCW Farmacia Galénica [2013/12] [cas] http://ocw.ehu.es/file.php/199/tema_3_liberacion_ocw.pdf Tema 2 Índice de contenidos 2 Introducción Fases de la liberación Disgregación
PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES
 PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES 2015 1) a) A 25 ºC la constante de basicidad del NH 3 es 1,8 10 5. Si se tiene una disolución 0,1 M, calcula el grado de disociación. b) Calcula la concentración
PROBLEMAS DE SELECTIVIDAD. TEMA 5: ÁCIDOS Y BASES 2015 1) a) A 25 ºC la constante de basicidad del NH 3 es 1,8 10 5. Si se tiene una disolución 0,1 M, calcula el grado de disociación. b) Calcula la concentración
T. 29 FARMACOLOGÍA INFANTIL. Prof. Montserrat López de Luzuriaga
 T. 29 FARMACOLOGÍA INFANTIL. Prof. Montserrat López de Luzuriaga Fisiopatología del dolor y de la infección. Farmacología pediátrica. Farmacocinética. Farmacodinamia. Dosificación de fármacos en el niño.
T. 29 FARMACOLOGÍA INFANTIL. Prof. Montserrat López de Luzuriaga Fisiopatología del dolor y de la infección. Farmacología pediátrica. Farmacocinética. Farmacodinamia. Dosificación de fármacos en el niño.
GUÍA DE ESTUDIO SEMANA 12 ACIDOS, BASES Y ELECTROLITOS Elaborado por: Licda. Vivian Margarita Sánchez Garrido
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO GUÍA DE ESTUDIO 2014 SEMANA 12 ACIDOS, BASES Y ELECTROLITOS Elaborado por: Licda. Vivian
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDACTICA DE QUIMICA, PRIMER AÑO GUÍA DE ESTUDIO 2014 SEMANA 12 ACIDOS, BASES Y ELECTROLITOS Elaborado por: Licda. Vivian
Introducción histórica
 Introducción histórica Ácidos y bases se conocen desde la antigüedad. Robert Boyle (s. XVII) propiedades de los ácidos. Primera descripción sistemática de las Lavoisier (1743 1794) Primera teoría sobre
Introducción histórica Ácidos y bases se conocen desde la antigüedad. Robert Boyle (s. XVII) propiedades de los ácidos. Primera descripción sistemática de las Lavoisier (1743 1794) Primera teoría sobre
Tema 6: Equilibrio ácido-base
 Tema 6: Equilibrio ácido-base Equilibrios en disolución. Producto iónico del agua. Disoluciones neutras, ácidas y básicas. Concepto de ph. Modelos ácido-base. Ácidos y bases fuertes y débiles: K a y K
Tema 6: Equilibrio ácido-base Equilibrios en disolución. Producto iónico del agua. Disoluciones neutras, ácidas y básicas. Concepto de ph. Modelos ácido-base. Ácidos y bases fuertes y débiles: K a y K
LA MATERIA VIVA Y EL AGUA
 Página 1 de 11 LA MATERIA VIVA Y EL AGUA Haga clic en la respuesta correcta. Mostrar las preguntas individualmente 1. Tipo C. Siempre se produce una variación en el ph de una disolución reguladora si simultáneamente
Página 1 de 11 LA MATERIA VIVA Y EL AGUA Haga clic en la respuesta correcta. Mostrar las preguntas individualmente 1. Tipo C. Siempre se produce una variación en el ph de una disolución reguladora si simultáneamente
GUÍAS DE SEMINARIOS 1 Y 2 CURSO DE FARMACOCINÉTICA 2010
 UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE MEDICINA ESCUELA JOSÉ MARÍA VARGAS CÁTEDRA DE FARMACOLOGÍA GUÍAS DE SEMINARIOS 1 Y 2 CURSO DE FARMACOCINÉTICA 2010 PROFESORA MÉLIDA BERMUDEZ SEMINARIO Nº 1.
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE MEDICINA ESCUELA JOSÉ MARÍA VARGAS CÁTEDRA DE FARMACOLOGÍA GUÍAS DE SEMINARIOS 1 Y 2 CURSO DE FARMACOCINÉTICA 2010 PROFESORA MÉLIDA BERMUDEZ SEMINARIO Nº 1.
6,5408 ml i. básica, neutro, ácido, básico i. Kb=0, , ph=12,176 i M ii. ph=11,377 i. NaOH i ii. 4,597 %
 ÁCIDO BASE 1. Se toman 20 ml de una disolución de 4,0 M de Ca(OH)2 y se les añade agua hasta obtener 100 ml de disolución. Calcule los ml de ácido clorhídrico del 25% en peso y de 1,12 g/ml de densidad
ÁCIDO BASE 1. Se toman 20 ml de una disolución de 4,0 M de Ca(OH)2 y se les añade agua hasta obtener 100 ml de disolución. Calcule los ml de ácido clorhídrico del 25% en peso y de 1,12 g/ml de densidad
Lección 5. Interacciones farmacológicas UNIDAD I: BASES DE LA FARMACOLOGÍA CLÍNICA. Ricardo Brage e Isabel Trapero - Farmacología Lección 5
 Ricardo Brage e Isabel Trapero - Lección 5 UNIDAD I: BASES DE LA FARMACOLOGÍA CLÍNICA Lección 5 Interacciones farmacológicas Guión Ricardo Brage e Isabel Trapero - Lección 5 1. PRINCIPIOS GENERALES 2.
Ricardo Brage e Isabel Trapero - Lección 5 UNIDAD I: BASES DE LA FARMACOLOGÍA CLÍNICA Lección 5 Interacciones farmacológicas Guión Ricardo Brage e Isabel Trapero - Lección 5 1. PRINCIPIOS GENERALES 2.
PRUEBA ESPECÍFICA PRUEBA 2010
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 2010 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora. Contesta 4 de los 5 ejercicios propuestos. (Cada
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 2010 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora. Contesta 4 de los 5 ejercicios propuestos. (Cada
ASPECTOS ESTRUCTURALES DE LA ACCIÓN DE LOS FÁRMACOS (Parte 1)
 Universidad Privada Antonio Guillermo Urrelo Facultad de Ciencias de la Salud Carrera de Farmacia y Bioquímica ASPECTOS ESTRUCTURALES DE LA ACCIÓN DE LOS FÁRMACOS (Parte 1) Mg. Q.F. Patricia I. Minchán
Universidad Privada Antonio Guillermo Urrelo Facultad de Ciencias de la Salud Carrera de Farmacia y Bioquímica ASPECTOS ESTRUCTURALES DE LA ACCIÓN DE LOS FÁRMACOS (Parte 1) Mg. Q.F. Patricia I. Minchán
Estudio de Interacciones in Vitro entre Omeprazol y diferentes Antiácidos Dra. Lucía G. Cantú Cárdenas
 Estudio de Interacciones in Vitro entre Omeprazol y diferentes Antiácidos Dra. Lucía G. Cantú Cárdenas Introducción: La administración concomitante de algunos medicamentos puede generar interacciones que
Estudio de Interacciones in Vitro entre Omeprazol y diferentes Antiácidos Dra. Lucía G. Cantú Cárdenas Introducción: La administración concomitante de algunos medicamentos puede generar interacciones que
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 009 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 5, Opción A Reserva 1, Ejercicio 4, Opción
ULCERA PÉPTICA. CONCEPTO. Pérdida circunscrita de tejido que reviste las partes del tubo digestivo expuestas a la acción del jugo gástrico
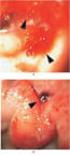 ANTIULCEROSOS SUMARIO Concepto de úlcera péptica. Etiopatogenia. Clasificación de las drogas antiulcerosas. Aspectos farmacológicos de drogas antiulcerosas mas empleadas. Pautas internacionales de tratamiento.
ANTIULCEROSOS SUMARIO Concepto de úlcera péptica. Etiopatogenia. Clasificación de las drogas antiulcerosas. Aspectos farmacológicos de drogas antiulcerosas mas empleadas. Pautas internacionales de tratamiento.
Descubrimiento y Diseño de Fármaco
 Descubrimiento y Diseño de Fármaco 2016 DESCUBRIMIENTO Y DISEÑO DE FARMACOS DISEÑO DE DROGAS Y LA RELACIÓN DEL GRUPO FUNCIONAL CON LA ACTIVIDAD FARMACOLÓGICA La Química Medicinal Estudia La influencia
Descubrimiento y Diseño de Fármaco 2016 DESCUBRIMIENTO Y DISEÑO DE FARMACOS DISEÑO DE DROGAS Y LA RELACIÓN DEL GRUPO FUNCIONAL CON LA ACTIVIDAD FARMACOLÓGICA La Química Medicinal Estudia La influencia
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 3, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio 6, Opción A Reserva 1, Ejercicio 4,
EQUILIBRIO IONICO. Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico
 Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico EQUILIBRIO IONICO Es una aplicación de equilibrio químico a las reacciones donde participan soluciones
Química General e Inorgánica Licenciatura en Ciencias Biológicas Profesorado en Biología Analista Biológico EQUILIBRIO IONICO Es una aplicación de equilibrio químico a las reacciones donde participan soluciones
