Introducción Modelos atómicos. Estructura atómica. José Mariano Lucena Cruz 27 de abril de 2010
|
|
|
- Hugo Robles Vidal
- hace 6 años
- Vistas:
Transcripción
1 José Mariano Lucena Cruz 27 de abril de 2010
2 Esquema 1 Importancia del estudio del átomo 2
3 Las propiedades físicas y químicas de la materia son función de la estructura atómica. La investigación atómica ha supuesto un gran avance tecnológico: energía nuclear, rayos X, aparatos de televisión, microscopios electrónicos, etc., y científico: composición del Universo, desarrollo de la Química, etc. Es un ejemplo perfecto de evolución de modelos teóricos cuando los hechos experimentales demuestran que no son correctos. Con la Mecánica Cuántica entramos en una descripción matemática del átomo, renunciando a modelos intuitivos (sistema solar). El electrón es una ecuación. A cambio de precisión, la Química y la Física se han vuelto abstractas. Las reacciones químicas se explican teniendo en cuenta sólo los cambios que sufre la disposición de los electrones que envuelven el núcleo. Importancia del estudio del átomo Importancia del estudio del átomo
4 Modelo atómico de Dalton Modelo 1 La materia está constituida por átomos, que son partículas indivisibles. 2 Todos los átomos de un mismo elemento químico son iguales en masa y propiedades. 3 Los átomos de diferentes elementos químicos tienen masa diferente y distintas propiedades químicas. 4 Los compuestos están formados por combinaciones de átomos de diversos elementos químicos. 5 En las reacciones químicas, la masa permanece siempre constante.
5 Modelo atómico de Thomson Modelo El átomo es una esfera material de electricidad positiva dentro de la cual, como pequeños gránulos, se encuentran los electrones en número suficiente para que el conjunto resulte neutro. Este modelo explica la producción de iones (por pérdida o ganancia de electrones), la electricidad estática y la corriente eléctrica, así como los fenómenos que ocurrían en los tubos de vacío.
6 La radiactividad Descubierta por Becquerel consistía en la emisión de tres radiaciones diferentes: Alfa (α) Corriente de iones He 2+. Beta (β) Corriente de electrones. Gamma (γ) Sin naturaleza corpuscular. Ondas electromagnéticas de menor λ que los rayos X.
7 Modelo atómico de Rutherford Modelo El átomo está constituido por un núcleo en el que se encuentra localizada la casi totalidad de la masa atómica y toda la carga positiva. En torno a este núcleo y a grandes distancias de él, giran los electrones con una velocidad tal que la fuerza centrípeta es proporcionada por la fuerza de atracción electrostática. Además, con el fin de que el átomo sea eléctricamente neutro, el número de cargas positivas del núcleo ha de ser igual al de los electrones que giran en torno a él.
8 Fallos del modelo de Rutherford Está basado en leyes de la Física Clásica. Según los principios del electromagnetismo clásico, una carga en movimiento circular (acelerada) debe emitir energía en forma de radiación y, por tanto, perder energía. La continua pérdida de energía haría que el electrón acabara cayendo sobre el núcleo: el átomo es inestable. La pérdida de energía sería gradual: espectros de emisión continuos; sin embargo los espectros atómicos de emisión son discontinuos, formados por rayas.
9 Ondas electromagnéticas Definición Una onda electromagnética es la propagación de energía a través del espacio mediante la vibración de un campo eléctrico y un campo magnético perpendiculares entre sí y perpendiculares a la dirección de propagación. Las características de toda onda electromagnética son: longitud de onda (λ), frecuencia (f), periodo (T ) y velocidad de propagación (c), que es la misma para todas: 2, m/s en el vacío. Naturalmente se cumple: c = λ f
10 Teoría de Planck Para explicar la radiación emitida por los cuerpos calientes, Max Planck, en 1900, llegó a la conclusión de que la radiación sólo podía ser emitida o absorbida de forma discontinua, es decir, los átomos no podían abosrber o emitir cualquier valor de energía, sino unos valores concretos. La energía de la radiación electromagnética se dispone en paquetes o cuantos. La energía de un cuanto de radiación es proporcional a la frecuencia de la radiación: E = hf donde h es la denominada constante de Planck, cuyo valor es 6, J s, y f es la frecuencia de la radiación.
11 Teoría de Planck Un fotón es un cuanto de radiación electromagnética, o cuanto de energía. Es una partícula sin masa. La energía de un fotón depende de su frecuencia: cuanto mayor sea esta (o menor su longitud de onda) mayor será la energía que transporta. La energía de una radiación es la energía de cada uno de sus fotones, mientras que la intensidad viene determinada por el número de fotones.
12 Efecto fotoeléctrico
13 Explicación de Einstein del efecto fotoeléctrico Ecuación de Einstein hf = hf 0 + E c,m = W ext + E c,m donde W ext = hf 0 es la energía mínima necesaria para que se produzca la extracción del electrones. Y f 0 es la frecuencia umbral del metal, es decir, la frecuencia mínima que debe tener el fotón incidente para que extraiga electrones del metal.
14 Espectros atómicos
15 Espectros atómicos
16 Espectros atómicos
17 Fórmula de Balmer J.J. Balmer había descubierto en 1885 que las longitudes de onda correspondientes al espectro del hidrógeno respondían a la fórmula: ( 1 1 λ = R 4 1 ) n 2 donde R es la constante de Rydberg. Las distintas ĺıneas del espectro se obtenían dando a n valores enteros a partir de 3.
18 Series espectrales
19 Modelo de Bohr Niels Bohr dio en 1913 un modelo atómico basado en el de Rutherford pero salvando los inconvenientes de éste al aplicar la nueva hipótesis de Planck. Postulados de Bohr 1 er postulado Los electrones giran alrededor del núcleo en órbitas circulares estacionarias, sin emitir energía. 2 postulado Sólo son posibles aquellas órbitas en las que el electrón tiene un momento angular, L, múltiplo entero de h/2π. 3 er postulado La energía absorbida o emitida cuando un electrón pasa de una órbita a otra tiene una frecuencia que viene dada por la ecuación de Planck.
20 Órbitas de Bohr Por el primer postulado: F c = F e m e v 2 e r = k q pq e r 2 ; m eve 2 = k q2 r Por el segundo postulado: L = n h 2π ; m ev e r = n h 2π Eliminando v entre los dos postulados y despejando r, se obtiene: r = h 2 4π 2 m e kq 2 n2 = a 0 n 2 donde a 0 = 0,529 Å y n es el denominado número cuántico principal.
21 Energías en el modelo de Bohr La energía de un electrón en cualquier órbita es: Su energía cinética vale: E = E c + E p E c = 1 2 m ev 2 = k q2 (por el primer postulado) 2r Su energía potencial vale: E p = qv y como V = k q r tenemos que E p = k q2 r Por tanto: E = k q2 2r k q2 q2 = k r 2r Y sustituyendo r por su valor del 2 o postulado: E = 2π2 k 2 m e q 4 h 2 n 2 = K 1 n 2
22 Limitaciones del modelo de Bohr 1 Sólo es válido para especies monoelectrónicas (H, He +, Li 2+ ). Para multielectrónicas presenta dificultades insuperables. 2 Los espectros presentan más rayas que no explica el modelo. 3 No justifica por qué el electrón no emite energía en su movimiento en torno al núcleo: el electromagnetismo clásico no tiene respuestas para los fenómenos cuánticos. 4 La dualidad onda-corpúsculo y el principio de incertidumbre terminan con la idea de órbita como trayectoria definida por donde se mueve el electrón.
23 Corrección de Sommerfeld Modelo de Bohr-Sommerfeld Algunas rayas del espectro eran en realidad multipletes, varias rayas muy próximas entre sí. Sommerfeld propuso que cada órbita constaba en realidad de varias subórbitas (varios tipos de órbitas), siendo una de ellas siempre circular. Estas órbitas de representan mediante un nuevo número cuántico, (l), denominado número cuántico secundario. Los posibles valores que puede tomar l dependen del nivel y van desde 0 hasta n 1.
24 Efecto Zeeman Cuando el espectro se realizaba en presencia de un campo magnético las rayas se desdoblaban apareciendo más. Esto es debido a que en cada nivel existían diferentes subcapas con orientaciones distintas. Para explicar esa orientación en el campo magnético se introdujo un nuevo número cuántico, denominado magnético, (m), que podía tomar los valores desde l hasta l incluyendo al 0.
25 Efecto de espín Se observó que cada raya del espectro realizado en un campo magnético era en realidad un doblete (dos rayas muy próximas entre sí). Esto se justificó suponiendo que los electrones tenían además un movimiento de rotación sobre sí mismos (efecto de espín). Para ello se introdujo un nuevo número cuántico, denominado de espín, representado por la letra s o m s y que puede tomar los valores 1/2 o +1/2. En realidad, el espín es una propiedad intrínseca del electrón (y de otras partículas) que no se debe al giro sobre sí mismo.
26 Principio de dualidad onda-corpúsculo Siglos XVII y XVIII controversia sobre la naturaleza de la luz: Huygens naturaleza ondulatoria. Newton naturaleza corpuscular. En 1905 Einstein explica el efecto fotoeléctrico admitiendo que cualquier onda electromagnética está formada por partículas: fotones. Así, todas las ondas electromagnéticas presentan una doble naturaleza ondulatoria-corpuscular y nunca se manifiestan simultáneamente ambas naturalezas. Louis de Broglie halló la relación entre la cantidad de movimiento y la longitud de onda del fotón aplicando las ecuaciones de Planck y Einstein.
27 Principio de dualidad onda-corpúsculo Según Planck: E = hf = h c λ Según Einstein: E = mc 2 Y despejando la longitud de onda de la igualación de ambas expresiones: λ = h mc e hizo extensiva esta doble naturaleza a todas las partículas de materia. Las consideradas ordinariamente partículas (como los electrones) presentaban características ondulatorias. La dualidad onda-corpúsculo es una propiedad general de la materia
28 Deducción del 2 o postulado Los electrones al girar en torno al núcleo lo hacen en órbitas estacionarias estables, y para que esto se cumpla la distancia recorrida tiene que ser un múltiplo entero de su longitud de onda. Así que: 2πr = nλ Su carácter ondulatorio le asocia un valor de longitud de onda dado por la ecuación de De Broglie: λ = h mv Sustituyendo λ en la primera ecuación: 2πr = n h mv y reordenando términos: mvr = n h 2π El 2 o postulado de Bohr!!!
29 Principio de incertidumbre de Heisenberg Enunciado por Werner Heisenberg constituye uno de los principios más sorprendentes de la ciencia: P.I.H. Es imposible medir simultáneamente y con exactitud la posición y la cantidad de movimiento de una partícula. x p h 2π La precisión en la medida es limitada. La incertidumbre se deriva del propio hecho de medir.
30 La ecuación de Schrödinger Ya que el electrón es una onda, su comportamiento puede ser descrito mediante una ecuación de onda. Es lo que propuso Erwin Schrödinger en 1926: Ecuación h2 8π 2 m ( 2 ) Ψ x Ψ y Ψ z 2 + V (x, y, z)ψ = EΨ donde los términos conocidos son m (masa de la partícula) y V (x, y, z) (su energía potencial, dependiente de las coordenadas del espacio).
31 Ecuación de Schrödinger. Ψ 2 De forma abreviada la ecuación de Schrödinger se puede expresar: Ecuación 2 Ψ + 8π2 m h 2 (E V )Ψ = 0 Ψ Es la función de onda, análoga a la elongación. Contiene información sobre la posición del electrón orbital, por analogía con las órbitas de Bohr. No tiene, sin embargo, significación física concreta. Ψ 2 Densidad de probabilidad relativa del electrón. Multiplicada por el dv representa la probabilidad de encontrar al electrón en un elemento de volumen (dx dy dz) en el espacio.
32 Ecuación de Schrödinger. Ψ 2 E Energía total del electrón. Sus valores vienen condicionados por las limitaciones, lógicas, que se imponen a Ψ (realmente al cuadrado): Que sea función continua. Que no tenga valores diferentes en un mismo punto. Que no tome valores infinitos en ningún punto. V Energía potencial del electrón en un punto (x, y, z). Por tanto (E V ) es la energía cinética del electrón cuando se encuentra en la posición dada.
33 Números cuánticos Significado Número cuántico principal, n. Nivel energético. Tamaño del orbital. n = 1, 2, 3,..., Número cuántico secundario o acimutal, l. Subnivel energético. Forma del orbital. l = 0, 1, 2,..., (n 1) Número cuántico magnético, m. Orientación del orbital. m = l,..., 0,..., l Número cuántico de espín, s. Giro del electrón. s = +1/2, 1/2
34 Órbitas y orbitales Órbita y orbital Para Bohr, los electrones se distribuyen en órbitas, que son lugares precisos donde se pueden encontrar dichas partículas. Los modelos mecánico-ondulatorios, por el contrario, hablan de orbitales, que son regiones del espacio donde hay una determinada probabilidad de encontrar al electrón. Por tanto, según los modelos mecánico-ondulatorios, no es posible concretar dónde se encuentra un electrón; tan solo se puede indicar la probabilidad estadística de que esté presente en una determinada región en torno al núcleo u orbital.
35 Números cuánticos Niveles y orbitales N o cuántico n Capa K L M N O P Q Cuadro: Capas o niveles de energía N o cuántico l Orbital s p d f Cuadro: Tipos de orbitales Tipo de orbital s p d f Valores de m 0-1, 0, 1-2, -1, 0, 1, 2-3, -2, -1, 0, 1, 2, 3 N o de orbitales Cuadro: Número de orbitales
36 Electrones y orbitales Resumen Nivel: Los electrones con el mismo n forman parte de la misma capa o nivel energético. Subnivel: Los electrones que tienen además de n el mismo l pertenecen al mismo subnivel o subcapa. En un nivel n hay n subniveles. Orbital: Los electrones que además de los dos números cuánticos anteriores tienen el mismo m, pertenecen al mismo orbital.
37 Distribución de orbitales Orbitales s hay en todos los niveles. Los orbitales p aparecen a partir del segundo nivel; los d a partir del tercero y los f a partir del cuarto. Sólo existe un orbital s en cada nivel; los orbitales p aparecen en grupos de tres; los d en grupos de cinco, y los f en grupos de siete. En un nivel hay como máximo n 2 orbitales en los que caben, como máximo, 2n 2 electrones. En un subnivel caben como máximo 2(2l + 1). (n) define un nivel; (n, l) definen un subnivel (o tipo de orbital); (n, l, m) definen un tipo concreto de orbital y (n, l, m, s) definen un electrón.
38 Principio de Exclusión de Pauli P.E.P. En un mismo átomo no pueden existir dos electrones con los cuatro números cuánticos iguales. Así, dos electrones pueden ocupar el mismo orbital si sus espines están apareados (s opuestos).
39 Regla de Hund o de la máxima multiplicidad R. de H. Mientras sea posible, los electrones se colocan solitarios en los orbitales de cada subnivel, evitando formar parejas en el mismo orbital. Esto indica que tienen sus espines desapareados.
40 Principio de constitución P.C. Los electrones de un átomo se colocan siempre ocupando los orbitales de menor energía. Así se dispone el estado fundamental, que es aquel en cual el átomo tiene la menor energía posible.
41 Regla de Madelung R. de M. Un orbital tiene menos energía cuanto más bajo sea el valor de n + l. Si dos orbitales tienen el mismo valor de n + l, tiene menos energía aquel que tiene el menor valor de n.
42 Llenado de orbitales
43 La tabla periódica Distinción entre metales y no metales Hasta principios del s. XIX. Tríadas de Döbereiner Propuesta en Octavas de Newlands Publicada en Tabla de Meyer y Mendeleiev Ordenados por masa atómica, pero inviertiendo algunos elementos y dejando huecos para los no descubiertos. Publicada en Tabla actual debida a Moseley, Werner y Seaborg Ordenados por orden creciente de sus números atómicos. Obviamente se dejan huecos para aquellos elementos no descubiertos. Hacia 1905.
Unidad 1 Estructura atómica de la materia. Teoría cuántica
 Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
Unidad 1 Estructura atómica de la materia. Teoría cuántica 1.El átomo y la constitución de la materia DALTON NO ACEPTADO POR LOS FÍSICOS que creían en la idea de que los átomos se encontraban como disueltos
FÍSICA y QUÍMICA. Número cuántico Secundario (SUBNIVEL) l. Número cuántico Magnético (ORBITAL, como si fuera una caja) m.
 TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
TEMA 1: ESTRUCTURA DE LA MATERIA. MODELOS ATÓMICOS 1. Modelo Atómico de RUTHERFORD a. Modelo predecesor de Thomson. b. Modelo atómico de Rutherford. c. Virtudes y defectos del Modelo de Rutherford. 2.
EXTRUCTURA ATOMICA ACTUAL
 ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
ATOMOS Y ELEMENTOS TEMA 4 Química ATOMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON NUCLEO + SI NEUTRON NUCLEO 0 SI ELECTRON ORBITAS - DESPRECIABLE La masa del átomo reside en el núcleo.
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS. Partícula Masa (g) Carga (Coulombs) Carga unitaria. Electrón
 MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
MATERIA MOLÉCULAS ÁTOMOS PARTÍCULAS SUBATÓMICAS Partícula Masa (g) Carga (Coulombs) Carga unitaria Electrón 9.10939 10-28 -1.6022 10-19 -1 Protón 1.67262 10-24 +1.6022 10-19 +1 Neutrón 1.67493 10-24 0
EL MODELO ATOMICO DE BOHR
 EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
EL MODELO ATOMICO DE BOHR En 1913, Niels Bohr ideó un modelo atómico que explica perfectamente los espectros determinados experimentalmente para átomos hidrogenoides. Estos son sistemas formados solamente
INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3.
 El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
El modelo de átomo INTERACTIVEBOOK - Física y Química 4º ESO McGraw-Hill Education INDICE 1. El modelo de átomo 1.1. Dalton 1.2. Thomson: Descubrimiento del electrón. 1.3. Rutherford: 1.3.1. Radioactividad
J.J Thomson propone el primer modelo de átomo:
 MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
MODELOS ATÓMICOS. DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1.
ESQUEMA. De él cabe destacar el experimento que demostró que el modelo de Thompson era falso y los postulados que llevaron a que formulara su modelo:
 TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
TEMA 2. ESTRUCTURA DE LA MATERIA.. MODELOS ATÓMICOS Dalton: Los átomos son indivisibles Thompson: Los átomos están formados por protones y neutrones. El átomo es una esfera de carga positiva y los electrones
MODELOS ATOMICOS. Solución Å; Ultravioleta; 1106 m/s
 MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
MODELOS ATOMICOS 1. Calcular el valor del radio de la órbita que recorre el electrón del hidrogeno en su estado normal. Datos. h = 6 63 10 27 erg s, m(e ) = 9 1 10 28 gr, q(e ) = 4 8 10-10 u.e.e. Solución.
ÁTOMO..su historia y su estudio
 ÁTOMO.su historia y su estudio LOS GRIEGOS Y SU APORTE 2000 años antes de Cristo, la civilización griega representada por varios filósofos, ya se preguntaban acerca de qué estaba formado el universo?...
ÁTOMO.su historia y su estudio LOS GRIEGOS Y SU APORTE 2000 años antes de Cristo, la civilización griega representada por varios filósofos, ya se preguntaban acerca de qué estaba formado el universo?...
EVOLUCIÓN DE LOS MODELOS ATÓMICOS
 MODELO ATÓMICO DE DALTON Modelo EVOLUCIÓN DE LOS MODELOS ATÓMICOS La materia está constituida por átomos, que son partículas indivisibles. Todos los átomos de un mismo elemento químico son iguales en masa
MODELO ATÓMICO DE DALTON Modelo EVOLUCIÓN DE LOS MODELOS ATÓMICOS La materia está constituida por átomos, que son partículas indivisibles. Todos los átomos de un mismo elemento químico son iguales en masa
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES
 QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
QUÍMICA LICENCIATURA DE INGENIERÍA EN ENERGÍAS RENOVABLES 2013-1 Teoría: Dra. Karina Cuentas Gallegos Martes y jueves 10-12 hrs. Laboratorio: M.C. Mirna Guevara García Jueves 12-14 hrs. Curso de Química
El átomo: sus partículas elementales
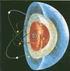 El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
El átomo: sus partículas elementales Los rayos catódicos estaban constituidos por partículas cargadas negativamente ( a las que se llamo electrones) y que la relación carga/masa de éstas partículas era
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS. Tipos de radiaciones electromagnéticas según λ.
 RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
RADIACIÓN ELECTROMAGNÉTICA Y ESPECTROS ATÓMICOS λ Tipos de radiaciones electromagnéticas según λ. Rayos γ Rayos X Rayos UV Radiación visible. Rayos IR Microondas Ondas de radio Ondas de radar Ondas de
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
Modelos atómicos Los filósofos de la antigüedad especularon sobre cómo estaba formada la materia. Demócrito (460-370 a.c) y otros filósofos anteriores a él, pensaban que el mundo material debería estar
El ÁTOMO de HIDRÓGENO
 El ÁTOMO de HIDRÓGENO Dr. Andres Ozols Dra. María Rebollo FIUBA 006 Dr. A. Ozols 1 ESPECTROS DE HIDROGENO espectros de emisión espectro de absorción Dr. A. Ozols ESPECTROS DE HIDROGENO Secuencias de las
El ÁTOMO de HIDRÓGENO Dr. Andres Ozols Dra. María Rebollo FIUBA 006 Dr. A. Ozols 1 ESPECTROS DE HIDROGENO espectros de emisión espectro de absorción Dr. A. Ozols ESPECTROS DE HIDROGENO Secuencias de las
Un modelo atómico, por lo tanto consiste en representar de manera grafica, la dimensión atómica de la materia. El objetivo de estos modelos es que el
 Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Modelos atómicos Debido a que no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
- Marie Curie. - Joseph Thomson. - Ernest Rutherford. - Max Planck. - Albert Einstein. - Niels Bohr. - Louis de Broglie. - Werner Heisenberg
 - Marie Curie - Joseph Thomson - Ernest Rutherford - Max Planck - Albert Einstein - Niels Bohr - Louis de Broglie - Werner Heisenberg - Wolfgang Pauli - Arnorld Sommerfeld Autores (Orden Alfabético): Celia
- Marie Curie - Joseph Thomson - Ernest Rutherford - Max Planck - Albert Einstein - Niels Bohr - Louis de Broglie - Werner Heisenberg - Wolfgang Pauli - Arnorld Sommerfeld Autores (Orden Alfabético): Celia
QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA.
 Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
Modelos atómicos QUÍMICA 2º BACH. TEMA 1. ESTRUCTURA ATÓMICA. Teoría atómica de Dalton: La materia está formada por átomos indivisibles. Los átomos de un elemento son distintos de los átomos de otro elemento
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico.
 EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
EL ÁTOMO 1. El átomo. 2. Modelos atómicos. 3. Núcleo atómico. 4. Espectros atómicos. 5. Modelo atómico cuántico. Química 1º bachillerato El átomo 1 El átomo no es una partícula indivisible, sino que está
Clase N 1. Modelo Atómico I
 Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
Pre-Universitario Manuel Guerrero Ceballos Clase N 1 Modelo Atómico I ICAL ATACAMA Módulo Plan Común Modelos Atómicos Teoría Atómica De Dalton Los elementos están formados por partículas extremadamente
ESTRUCTURA DEL ÁTOMO - RESUMEN
 TEMA 1 ESTRUCTURA DEL ÁTOMO - RESUMEN 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA (ideas generales) Dalton: consideraba que un átomo no podía romperse en trozos más pequeños. El primer indicio de que el
TEMA 1 ESTRUCTURA DEL ÁTOMO - RESUMEN 1. DESCUBRIMIENTO DE LA ESTRUCTURA ATÓMICA (ideas generales) Dalton: consideraba que un átomo no podía romperse en trozos más pequeños. El primer indicio de que el
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS. TEMA 7 Pág. 155 libro nuevo
 PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
PARTÍCULAS DEL ÁTOMO MODELOS ATÓMICOS TEMA 7 Pág. 155 libro nuevo DESCUBRIMIENTO DEL ÁTOMO. PARTÍCULAS SUBATÓMICAS En la antigua Grecia ya había dos teorías sobre la materia: Teoría Atomística (siglo IV
EL ESPECTRO ELECTROMAGNÉTICO
 FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
FACULTAD DE CIENCIAS QUÍMICAS Espectrometría Objeto de Estudio Nº 1 LECTURA N 2 EL ESPECTRO ELECTROMAGNÉTICO Bibliografía: http://almaak.tripod.com/temas/espectro.htm Facultad de Ciencias Químicas F.C.Q.
PLAN DE EVALUACIÓN 2015
 PLAN DE EVALUACIÓN 2015 Año: 2015 Período: I Semestre Sub-sector: Química Nivel: NM1 Curso: I Medio Profesor: Alejandra Sotomaor A. Aprendizajes Esperados Indicadores Aprendizajes Evaluados Procedimientos
PLAN DE EVALUACIÓN 2015 Año: 2015 Período: I Semestre Sub-sector: Química Nivel: NM1 Curso: I Medio Profesor: Alejandra Sotomaor A. Aprendizajes Esperados Indicadores Aprendizajes Evaluados Procedimientos
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV
 M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
M. Eugenia Villaseca R. Licenciada y Profesora de Biología PUCV Comprender la utilidad de los modelos atómicos y de la teoría atómica para explicar los procesos de transformación físico-química de la materia
Modelo atómico de la materia.
 Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
Modelo atómico de la materia. La Teoría Atómica se basa en la suposición (ratificada después por datos experimentales) de que la materia no es continua, sino que está formada por partículas distintas.
Espectros de emisión y absorción.
 Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Espectros de emisión y absorción. Los espectros de emisión y absorción de luz por los átomos permitieron la justificación y ampliación del modelo cuántico. Espectros de emisión: Calentar un gas a alta
Respuestas del Control 1. Curso Noviembre 2008
 NOMBRE y APELLIDOS... NOTA: En los cálculos numéricos tenga en cuenta la precisión de las constantes y de las magnitudes que se dan y dé el resultado con el número de cifras significativas adecuado. La
NOMBRE y APELLIDOS... NOTA: En los cálculos numéricos tenga en cuenta la precisión de las constantes y de las magnitudes que se dan y dé el resultado con el número de cifras significativas adecuado. La
ESTRUCTURA DE LA MATERIA
 ESTRUCTURA DE LA MATERIA CONTENIDOS. 1.- Radiación electromagnética y espectros atómicos. 1.1. Espectros atómicos. 1.2. Series espectrales. 1.3. Ley de Rygberg ( ). 2.- Orígenes de la teoría cuántica.
ESTRUCTURA DE LA MATERIA CONTENIDOS. 1.- Radiación electromagnética y espectros atómicos. 1.1. Espectros atómicos. 1.2. Series espectrales. 1.3. Ley de Rygberg ( ). 2.- Orígenes de la teoría cuántica.
Robert A. MILLIKAN ( )
 Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
Robert A. MILLIKAN (1906 1914) Modelo atómico de Rutherford - Todo átomo está formado por un núcleo y corteza. - El núcleo, muy pesado, y de muy pequeño tamaño, formado por un número de protones igual
MODELOS ATÓMICOS. Ya ves que se empezó pronto con el estudio de la composición de la materia.
 MODELOS ATÓMICOS El primero en hablar de la estructura de la materia fue Demócrito de Abdera, 460 a. C-370 a. C. Consideraba que la materia estaba compuesta por pequeñas partículas indivisibles e indestructibles.
MODELOS ATÓMICOS El primero en hablar de la estructura de la materia fue Demócrito de Abdera, 460 a. C-370 a. C. Consideraba que la materia estaba compuesta por pequeñas partículas indivisibles e indestructibles.
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
GUÍA DIDACTICA CURSO FÍSICA 2º BACHILLERATO. PROFESOR: Alicia Blanco Pozos
 GUÍA DIDACTICA FÍSICA 2º BACHILLERATO CURSO 2016-17 PROFESOR: Alicia Blanco Pozos CONTENIDOS Los contenidos se organizan en 13 unidades didácticas distribuidos en cinco bloques de conocimiento: BLOQUE
GUÍA DIDACTICA FÍSICA 2º BACHILLERATO CURSO 2016-17 PROFESOR: Alicia Blanco Pozos CONTENIDOS Los contenidos se organizan en 13 unidades didácticas distribuidos en cinco bloques de conocimiento: BLOQUE
Experimento 12 LÍNEAS ESPECTRALES. Objetivos. Teoría. Postulados de Bohr. El átomo de hidrógeno, H
 Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
Experimento 12 LÍNEAS ESPECTRALES Objetivos 1. Describir el modelo del átomo de Bohr 2. Observar el espectro del H mediante un espectrómetro de rejilla 3. Medir los largos de onda de las líneas de la serie
TEMA 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS
 TEMA 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS MARÍA PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Introducción 2. Modelo de Thomson 3. Modelo de Rutherford 4. La luz y las ondas electromagnéticas 5. Dispersión
TEMA 2 ESTRUCTURA ELECTRÓNICA DE LOS ÁTOMOS MARÍA PILAR RUIZ OJEDA BORJA MUÑOZ LEOZ Contenidos: 1. Introducción 2. Modelo de Thomson 3. Modelo de Rutherford 4. La luz y las ondas electromagnéticas 5. Dispersión
LiceoTolimense Química Séptimo 1 Periodo ESTRUCTURA INTERNA DE LA MATERIA
 ESTRUCTURA INTERNA DE LA MATERIA Lectura comprensiva Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es
ESTRUCTURA INTERNA DE LA MATERIA Lectura comprensiva Desde la antigüedad los filósofos se preguntaban de qué estaban formadas las cosas que los rodeaban. Primero pensaron que la materia era continua, es
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO
 UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
UNIDAD 1: EL ÁTOMO Y EL SISTEMA PERIÓDICO 1. PRIMERAS TEORÍAS ATÓMICAS Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería
ESTRUCTURA DEL ÁTOMO. MODELOS DE RUTHERFORD Y DE BOHR-SOMMERFELD
 ESTRUCTURA DEL ÁTOMO. MODELOS DE RUTHERFORD Y DE BOHR-SOMMERFELD De todas las partículas subatómicas elementales, ay tres que interesan fundamentalmente, pues son necesarias para construir un modelo atómico
ESTRUCTURA DEL ÁTOMO. MODELOS DE RUTHERFORD Y DE BOHR-SOMMERFELD De todas las partículas subatómicas elementales, ay tres que interesan fundamentalmente, pues son necesarias para construir un modelo atómico
Con posterioridad el físico alemán Sommerfeld introdujo en el modelo la posibilidad de órbitas elípticas. Köningsberg, Munich, 1951
 4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
4. El paso de una órbita a otra supone la absorción o emisión de radiación. El átomo sólo absorberá o emitirá la radiación justa para pasar de una órbita a otra. Las órbitas de los electrones son estables
EL ÁTOMO CONTENIDOS. ANTECEDENTES HISTÓRICOS. ( ) MODELOS ATÓMICOS. RAYOS CATÓDICOS. MODELO DE THOMSON.
 EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
EL ÁTOMO CONTENIDOS. 1.- Antecedentes históricos.( ) 2.- Partículas subatómicas. ( ) 3.- Modelo atómico de Thomsom. 4.- Los rayos X. 5.- La radiactividad. 6.- Modelo atómico de Rutherford. 7.- Radiación
DIVISIÓN DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA PROGRAMA DE ASIGNATURA
 CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERÍAS DIVISIÓN DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA PROGRAMA DE ASIGNATURA NOMBRE DE LA MATERIA FÍSICA MODERNA CLAVE DE MATERIA FS 301 DEPARTAMENTO
CENTRO UNIVERSITARIO DE CIENCIAS EXACTAS E INGENIERÍAS DIVISIÓN DE CIENCIAS BÁSICAS DEPARTAMENTO DE FÍSICA PROGRAMA DE ASIGNATURA NOMBRE DE LA MATERIA FÍSICA MODERNA CLAVE DE MATERIA FS 301 DEPARTAMENTO
MODELO ATÓMICO DE DALTON 1808
 ESTRUCTURA ATÓMICA MODELO ATÓMICO DE DALTON 1808 Sienta las bases para la estequiometría de composición y la estequiometría de reacción. 1. Un elemento se compone de partículas extremadamente pequeñas,
ESTRUCTURA ATÓMICA MODELO ATÓMICO DE DALTON 1808 Sienta las bases para la estequiometría de composición y la estequiometría de reacción. 1. Un elemento se compone de partículas extremadamente pequeñas,
Teoría Cuántica y la estructura electrónica de los Átomos
 EN EL INTERIOR DEL ATOMO TEMA 3 Química General e Inorgánica A Teoría Cuántica y la estructura electrónica de los Átomos 1 LO QUE SABEMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON
EN EL INTERIOR DEL ATOMO TEMA 3 Química General e Inorgánica A Teoría Cuántica y la estructura electrónica de los Átomos 1 LO QUE SABEMOS EXTRUCTURA ATOMICA ACTUAL PARTICULA UBICACION CARGA MASA PROTON
- Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson ( )
 REPASO QUÍMICA 01 - Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson (1856-1940) Modelo de Thompson Modelo del budín de pasas - EN 1895 WILHELM RONTGEN Descubre
REPASO QUÍMICA 01 - Dalton: TEORIA ATÓMICA ( inicio del SIGLO XIX) - Descubrimiento del electrónjoseph John Thomson (1856-1940) Modelo de Thompson Modelo del budín de pasas - EN 1895 WILHELM RONTGEN Descubre
1. Estructura Atómica
 1. Estructura Atómica 1.1 Modelos atómicos: de Dalton a Rutherford 1.1.1 Modelo atómico de Dalton 1.1.2 Modelo atómico de Thomson 1.1.3 Modelo atómico de Rutherford 1.2 Modelo atómico de Bohr 1.2.1 Espectro
1. Estructura Atómica 1.1 Modelos atómicos: de Dalton a Rutherford 1.1.1 Modelo atómico de Dalton 1.1.2 Modelo atómico de Thomson 1.1.3 Modelo atómico de Rutherford 1.2 Modelo atómico de Bohr 1.2.1 Espectro
Las estructura electrónica de los átomos
 Las estructura electrónica de los átomos Al preguntarnos por las diferencias entre las propiedades químicas y físicas de los elementos, así como, su forma de enlazarse y la forma en la cual emiten o absorben
Las estructura electrónica de los átomos Al preguntarnos por las diferencias entre las propiedades químicas y físicas de los elementos, así como, su forma de enlazarse y la forma en la cual emiten o absorben
Estas partículas son estudiadas por J.J. Thomson que las caracterizó determinando el tipo de carga que poseían y su relación carga/masa.
 página 1/12 Partículas en el átomo Los experimentos de Volta y más tarde otros que pusieron de manifiesto la existencia de partículas cargadas en la materia llevaron a la investigación que obligó a replantearse
página 1/12 Partículas en el átomo Los experimentos de Volta y más tarde otros que pusieron de manifiesto la existencia de partículas cargadas en la materia llevaron a la investigación que obligó a replantearse
Como esta formada la materia?
 Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
Como esta formada la materia? Demócrito, filósofo griego que vivió en el siglo IV a. C. propuso que, si se dividía la materia en trozos cada vez más pequeños, debería llegarse a una porción que ya no podría
BLOQUE 4.1 ÓPTICA FÍSICA
 BLOQUE 4.1 ÓPTICA FÍSICA 1. NATURALEZA DE LA LUZ Hasta ahora hemos considerado a la luz como algo que transporta energía de un lugar a otro. Por otra parte, sabemos que existen dos formas básicas de transportar
BLOQUE 4.1 ÓPTICA FÍSICA 1. NATURALEZA DE LA LUZ Hasta ahora hemos considerado a la luz como algo que transporta energía de un lugar a otro. Por otra parte, sabemos que existen dos formas básicas de transportar
Thompson (1898) Rutherford (1911) Bohr (1913) Schrödinger (1926) NUMEROS CUANTICOS
 Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Thompson (1898) Modelo Atómico Rutherford (1911) Bohr (1913) Propiedad corpuscular de las onda (PLANCK) Propiedad ondulatoria de las partículas (De Broglie) Schrödinger (1926) Números cuánticos 1 NUMEROS
Guía de Estudio para 1er Parcial Temas Selectos de Química
 Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Guía de Estudio para 1er Parcial Temas Selectos de Química 1. Menciona que científicos ordenaron los elementos conocidos en su época en triadas (grupos de tres), en octavas, por número atómico y quien
Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete. Núcleo. (protones y neutrones)
 Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete EL ÁTOMO Núcleo Envoltura (electrones) (protones y neutrones) El átomo, como lo conocemos
Colegio Alberto Pérez Institución Teresiana Departamento de Ciencias Química Profesora Caterina González Poblete EL ÁTOMO Núcleo Envoltura (electrones) (protones y neutrones) El átomo, como lo conocemos
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B
 Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
Integrantes :Natalia Castillo Carolina Cabello Laura Otálora Nicolás Osorio Asignatura : Química Curso : 2º año B * Historia del Átomo: -El átomo en la antigüedad (pág. 3) -Leucipo y Demócrito (pág.4)
Radiación. Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler. L. Infante 1
 Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiación Cuerpo Negro Espectros Estructura del Atomo Espectroscopia Efecto Doppler L. Infante 1 Cuerpo Negro: Experimento A medida que el objeto se calienta, se hace más brillante ya que emite más radiación
Radiaciones Ionizantes: Utilización y Riesgos RIUR. Guía de estudio
 Radiaciones Ionizantes: Utilización y Riesgos RIUR . Estructura y radiaciones atómicas Esta guía describe el conjunto de actividades que forman el tema 2 del módulo 1: " Estructura y radiaciones atómicas"
Radiaciones Ionizantes: Utilización y Riesgos RIUR . Estructura y radiaciones atómicas Esta guía describe el conjunto de actividades que forman el tema 2 del módulo 1: " Estructura y radiaciones atómicas"
Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín. El átomo.
 Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín El átomo 06 de Marzo 2015 Objetivos de la clase Comprender el Modelo corpuscular de
Colegio Pasionista de Quilpué Departamento de Ciencias Ciencias Naturales 8 año básico 2015 Miss. Cecilia Rojas Olguín El átomo 06 de Marzo 2015 Objetivos de la clase Comprender el Modelo corpuscular de
1.6-Series espectrales Ley de Rydberg. 2.- Orígenes de la teoría cuántica. 3.- Modelo atómico de Bohr. 4.- Principios de la mecánica cuántica.
 Clase 7 Contenidos 2 1.Estructura de la materia 1.1- Rayos catódicos y anódicos. 1.2- Experimento de j. J. Thomson, e/m, experimento de Millikan, carga del electrón. 1.3-Rayos x. Radiactividad. 1.4- modelo
Clase 7 Contenidos 2 1.Estructura de la materia 1.1- Rayos catódicos y anódicos. 1.2- Experimento de j. J. Thomson, e/m, experimento de Millikan, carga del electrón. 1.3-Rayos x. Radiactividad. 1.4- modelo
TEMA 4 La Materia: Propiedades. eléctricas y el átomo
 TEMA 4 La Materia: Propiedades eléctricas y el átomo La mente curiosa de un científico le hace preguntarse incluso por aquellos que no ve? Pero esas preguntas nacen de aquellos fenómenos que apreciamos
TEMA 4 La Materia: Propiedades eléctricas y el átomo La mente curiosa de un científico le hace preguntarse incluso por aquellos que no ve? Pero esas preguntas nacen de aquellos fenómenos que apreciamos
ESTRUCTURA ATOMICA DESARROLLO HISTORICO
 ESTRUCTURA ATOMICA DESARROLLO HISTORICO MODELOS ATOMICOS Átomo: Partícula más pequeña de un elemento que retiene sus propiedades. DEMOCRITO Y LEUCIPO. En el Siglo V A.C. dos Filósofos Griegos Leucipo y
ESTRUCTURA ATOMICA DESARROLLO HISTORICO MODELOS ATOMICOS Átomo: Partícula más pequeña de un elemento que retiene sus propiedades. DEMOCRITO Y LEUCIPO. En el Siglo V A.C. dos Filósofos Griegos Leucipo y
PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA
 PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA CURSO 013 014 CONVOCATORIA: PROBLEMAS OPCIÓN A MATERIA: FÍSICA De las dos opciones propuestas, sólo hay que desarrollar
PRUEBAS DE ACCESO A LA UNIVERSIDAD MATERIAS DE MODALIDAD: FASES GENERAL Y ESPECÍFICA CURSO 013 014 CONVOCATORIA: PROBLEMAS OPCIÓN A MATERIA: FÍSICA De las dos opciones propuestas, sólo hay que desarrollar
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica. Clasificación de los elementos y propiedades periódicas
 Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
Modelos atómicos: Dalton, Thomson, Rutherford, Bohr y Mecánica Cuántica Clasificación de los elementos y propiedades periódicas Modelos atómicos: Átomo de Dalton NOMBRE EN QUÉ CONSISTE QUÉ EXPLICA QUÉ
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA.
 ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
ESTRUCTURA DE LA MATERIA VICENTE PUCHADES PUCHADES. SERVICIO DE RADIOFÍSICA Y PROTECCIÓN RADIOLÓGICA DEL HGU SANTA LUCÍA. CARTAGENA. INDICE Qué es la materia? Modelos de la materia Fuerzas Fundamentales
Modelo atómico de Dalton(1808)
 El átomo Modelos atómicos Como no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
El átomo Modelos atómicos Como no se podían ver los átomos los científicos crearon modelos para describirlos, éstos fueron evolucionando a lo largo de la historia a medida que se descubrieron nuevas cosas.
Espectro electromagnético
 RADIOCOMUNICACIONES 11-03-2015 Espectro electromagnético La naturaleza de la luz ha sido estudiada desde hace muchos años por científicos tan notables como Newton y Max Plank. Para los astrónomos conocer
RADIOCOMUNICACIONES 11-03-2015 Espectro electromagnético La naturaleza de la luz ha sido estudiada desde hace muchos años por científicos tan notables como Newton y Max Plank. Para los astrónomos conocer
I.E.S. Virgen del Puerto Química 2º Bachillerato 2016/2017
 UD. 1 ESTRUCTURA ATÓMICA 1. INTRODUCCIÓN Dalton Thomson Rutherford Bohr Schrödinger (El concepto de átomo surge en la Grecia clásica, pero hasta principios del siglo XIX no se formula la primera teoría
UD. 1 ESTRUCTURA ATÓMICA 1. INTRODUCCIÓN Dalton Thomson Rutherford Bohr Schrödinger (El concepto de átomo surge en la Grecia clásica, pero hasta principios del siglo XIX no se formula la primera teoría
Teoría Atómica y Molecular
 Luz visible Nombre de la onda ondas de radio micro-ondas infrarojo ultravioleta Rayos X Rayos, metros 10 2 10 1 10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 8 10 9 10 10 10 11 10 12 Largo de la onda Parque de
Luz visible Nombre de la onda ondas de radio micro-ondas infrarojo ultravioleta Rayos X Rayos, metros 10 2 10 1 10 1 10 2 10 3 10 4 10 5 10 6 10 7 10 8 10 9 10 10 10 11 10 12 Largo de la onda Parque de
Comportamiento Electrónico de los Materiales. Tema 1. Fundamentos Físicos de la Estructura Electrónica del Átomo
 Comportamiento Electrónico de los Materiales Tema 1. Fundamentos Físicos de la Estructura Electrónica del Átomo 1.1 Fundamentos de la Estructura Atómica de la Materia1. 1.1.1 Historia: Se tiene conocimiento
Comportamiento Electrónico de los Materiales Tema 1. Fundamentos Físicos de la Estructura Electrónica del Átomo 1.1 Fundamentos de la Estructura Atómica de la Materia1. 1.1.1 Historia: Se tiene conocimiento
Actividad: Cómo son las configuraciones electrónicas?
 Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
Cómo son las configuraciones electrónicas de los elementos que forman una familia? Nivel: 2º Medio Subsector: Ciencias químicas Unidad temática: Actividad: Cómo son las configuraciones electrónicas? En
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
La Ecuación de Schrödinger
 La Ecuación de Schrödinger Dr. Héctor René VEGA CARRILLO Notas del curso de Física Moderna Unidad Académica de Ingeniería Eléctrica Universidad Autónoma de Zacatecas Buzón electrónico: fermineutron@yahoo.com
La Ecuación de Schrödinger Dr. Héctor René VEGA CARRILLO Notas del curso de Física Moderna Unidad Académica de Ingeniería Eléctrica Universidad Autónoma de Zacatecas Buzón electrónico: fermineutron@yahoo.com
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST
 ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie C- COMPOSICION DEL ÁTOMO Serie D- ESTRUCTURA ELECTRÓNICA Serie E- ATOMO DE THOMPSON Serie F- DEFECTO DE
ESTRUCTURA ATÓMICA - PREGUNTAS DE TEST Serie A: PARTICULAS SUBATOMICAS: Serie B- ESPECTROS: Serie C- COMPOSICION DEL ÁTOMO Serie D- ESTRUCTURA ELECTRÓNICA Serie E- ATOMO DE THOMPSON Serie F- DEFECTO DE
PROGRAMA DE: FISICA MODERNA II IDENTIFICACION DE LA ASIGNATURA CODIGO OPTICO:
 UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS D.E.B.S. COORDINACION ACADEMICA DE LA FEC DEPARTAMENTO DE FISICA UNIDAD ACADÉMICA FÍSICA CUÁNTICA PROGRAMA DE: FISICA MODERNA II IDENTIFICACION DE
UNIVERSIDAD DEL ZULIA FACULTAD EXPERIMENTAL DE CIENCIAS D.E.B.S. COORDINACION ACADEMICA DE LA FEC DEPARTAMENTO DE FISICA UNIDAD ACADÉMICA FÍSICA CUÁNTICA PROGRAMA DE: FISICA MODERNA II IDENTIFICACION DE
Sistema Periódico de los elementos. 2º Bachillerato
 Sistema Periódico de los elementos 2º Bachillerato Índice 1. Clasificación de los elementos 2. Núcleo atómico 3. Configuración electrónica 4. La tabla periódica 5. Propiedades periódicas Tamaño y radio
Sistema Periódico de los elementos 2º Bachillerato Índice 1. Clasificación de los elementos 2. Núcleo atómico 3. Configuración electrónica 4. La tabla periódica 5. Propiedades periódicas Tamaño y radio
Corteza atómica: Estructura electrónica
 Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Corteza atómica: Estructura electrónica Aunque los conocimientos actuales sobre la estructura electrónica de los átomos son bastante complejos, las ideas básicas son las siguientes: 1. Existen 7 niveles
Tercero: una reacción química incluye sólo la separación combinación o reordenamiento de átomos sin crearlos o destruirlos.
 Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
Coomppoonneennt teess ffuunnddaameennt taalleess ddeell áát toomoo El filósofo griego demócrito en el siglo V a.c. propuso la idea de que la materia estaba formada por partículas muy pequeñas indivisibles
MODELOS ATOMICOS. Conoce algo acerca de los Modelos Atómicos? Te Invito A Que Eches Un Vistazo AL Libro!
 MODELOS ATOMICOS Conoce algo acerca de los Modelos Atómicos? Te Invito A Que Eches Un Vistazo AL Libro! POR: Yariza Lombo Caterine Ortiz Natalia Salazar Yesika Novoa F_76336 Qué es el átomo? Definimos
MODELOS ATOMICOS Conoce algo acerca de los Modelos Atómicos? Te Invito A Que Eches Un Vistazo AL Libro! POR: Yariza Lombo Caterine Ortiz Natalia Salazar Yesika Novoa F_76336 Qué es el átomo? Definimos
Estructura de la materia. Introducción a la Química moderna.
 Estructura de la materia. Introducción a la Química moderna. 6. Estructura atómica y clasificación periódica de los elementos Contenidos Del átomo de Bohr al modelo cuántico. Hipótesis de Planck y Einstein.
Estructura de la materia. Introducción a la Química moderna. 6. Estructura atómica y clasificación periódica de los elementos Contenidos Del átomo de Bohr al modelo cuántico. Hipótesis de Planck y Einstein.
EJERCICIOS RESUELTOS DE TABLA PERIODICA
 EJERCICIOS RESUELTOS DE TABLA PERIODICA 1. Indique Cuál es el modelo atómico que está actualmente vigente? El Modelo Mecano- cuántico 2. Cuáles fueron los principales hechos y/o descubrimientos que llevaron
EJERCICIOS RESUELTOS DE TABLA PERIODICA 1. Indique Cuál es el modelo atómico que está actualmente vigente? El Modelo Mecano- cuántico 2. Cuáles fueron los principales hechos y/o descubrimientos que llevaron
INDICE 22. La carga eléctrica Resumen, preguntas, problemas 23. El campo eléctrico Resumen, preguntas, problemas Resumen, preguntas, problemas
 INDICE 22. La carga eléctrica 22-1. las propiedades de la materia con carga 646 22-2. la conservación y cuantización de la carga 652 22-3. la ley de Colulomb 654 22-4. las fuerzas en las que intervienen
INDICE 22. La carga eléctrica 22-1. las propiedades de la materia con carga 646 22-2. la conservación y cuantización de la carga 652 22-3. la ley de Colulomb 654 22-4. las fuerzas en las que intervienen
ATOMO DE HIDROGENO. o = permitividad al vacío = 8.85 X C 2 N -1 cm -1. = metros. F = Newtons 2. Ó (3)
 ATOMO DE HIDROGENO I. Atomo de hidrógeno A. Descripción del sistema: Dos partículas que interaccionan por atracción de carga eléctrica y culómbica. 1. Ley de coulomb: a. En el sistema cgs en unidades de
ATOMO DE HIDROGENO I. Atomo de hidrógeno A. Descripción del sistema: Dos partículas que interaccionan por atracción de carga eléctrica y culómbica. 1. Ley de coulomb: a. En el sistema cgs en unidades de
1. Qué es un modelo atómico?
 MODELOS ATÒMICOS ÌNDICE. 1. Qué es un modelo atómico? 2. Historia del modelo atómico. 3. Modelos atómicos. 3.1. Modelo Atómico de Dalton. 3.2. Modelo Atómico de Thomson. 3.3. Modelo atómico de Perrin.
MODELOS ATÒMICOS ÌNDICE. 1. Qué es un modelo atómico? 2. Historia del modelo atómico. 3. Modelos atómicos. 3.1. Modelo Atómico de Dalton. 3.2. Modelo Atómico de Thomson. 3.3. Modelo atómico de Perrin.
3.1. Estructura atómica
 3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
3.1. Estructura atómica Átomo Protones (+) Núcleo Neutrones (sin carga) Corteza Electrones (-) *Z Número atómico = Número de protones. Cuando el átomo está en estado neutro, Z también es equivalente al
2º Bachillerato. Química. Unidad 1 (Estructura atómica de la materia). Fotocopia 1.
 Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
Partículas subatómicas Los átomos están formados por un núcleo (formado por protones y neutrones) rodeado por una nube de electrones, que se encuentran en la corteza. Entre núcleo y corteza hay espacio
Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C
 Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C La materia es todo aquello que tiene masa, ocupa un lugar en el espacio y es cuantificable (se puede medir).la Química es la ciencia que estudia su naturaleza,
Hecho por: Patricia Arroyo Gamallo nº 2 4ºeso C La materia es todo aquello que tiene masa, ocupa un lugar en el espacio y es cuantificable (se puede medir).la Química es la ciencia que estudia su naturaleza,
2.- Los átomos de un mismo elemento son iguales en masa y propiedades. Y los átomos de elementos diferentes son diferentes en masa y propiedades.
 FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
Modelos atómicos. El valor de la energía de estos niveles de energía está en función de un número n, denominado número cuántico principal 18 J.
 MODELO ATÓMICO DE BOHR (1913) El modelo atómico de Rutherfod tuvo poca vigencia, ya que inmediatamente a su publicación, se le puso una objeción que no supo rebatir: según la teoría del electromagnetismo
MODELO ATÓMICO DE BOHR (1913) El modelo atómico de Rutherfod tuvo poca vigencia, ya que inmediatamente a su publicación, se le puso una objeción que no supo rebatir: según la teoría del electromagnetismo
3.1 Fisica Atómica y Rayos X
 3.1 Fisica Atómica y Rayos X (Formulas & Ejercicios) Dr. Willy H. Gerber Instituto de Fisica Universidad Austral Valdivia, Chile Objetivos: Comprender como se comportan el cuerpo humano ante la radiación
3.1 Fisica Atómica y Rayos X (Formulas & Ejercicios) Dr. Willy H. Gerber Instituto de Fisica Universidad Austral Valdivia, Chile Objetivos: Comprender como se comportan el cuerpo humano ante la radiación
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS.
 PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
PROBLEMAS RESUELTOS DE DISTRIBUCIÓN ELECTRONICA EN NIVELES, SUBNIVELES Y ORBITALES ATÓMICOS. 1. Explique que indica el número cuántico magnético y el número cuántico de espín. Número cuántico magnético:
Ejercicios de Física cuántica y nuclear. PAU (PAEG)
 1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
1. Las longitudes de onda del espectro visible están comprendidas, aproximadamente, entre 390 nm en el violeta y 740 nm en el rojo. Qué intervalo aproximado de energías, en ev, corresponde a los fotones
Departamento de Física y Química
 1 PAU Física, septiembre 2011 OPCIÓN A Cuestión 1.- Un espejo esférico convexo, proporciona una imagen virtual de un objeto que se encuentra a 3 m del espejo con un tamaño 1/5 del de la imagen real. Realice
1 PAU Física, septiembre 2011 OPCIÓN A Cuestión 1.- Un espejo esférico convexo, proporciona una imagen virtual de un objeto que se encuentra a 3 m del espejo con un tamaño 1/5 del de la imagen real. Realice
Problemas. Cuestiones. Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA. Nombre: [2 PUNTOS /UNO]
![Problemas. Cuestiones. Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA. Nombre: [2 PUNTOS /UNO] Problemas. Cuestiones. Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA. Nombre: [2 PUNTOS /UNO]](/thumbs/49/25535199.jpg) Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA Problemas Nombre: [2 PUNTOS /UNO] 1. Al iluminar una célula fotoeléctrica con radiación electromagnética de longitud de onda 185
Física 2º Bach. Física moderna 20/05/09 DEPARTAMENTO DE FÍSICA E QUÍMICA Problemas Nombre: [2 PUNTOS /UNO] 1. Al iluminar una célula fotoeléctrica con radiación electromagnética de longitud de onda 185
Estructura atómica y clasificación periódica de los elementos
 Tema Estructura atómica y clasificación periódica de los elementos Química, º Bachillerato. Tema Tema. Estructura atómica y clasificación periódica de los elementos. Introducción....Pág.3. Primeros modelos
Tema Estructura atómica y clasificación periódica de los elementos Química, º Bachillerato. Tema Tema. Estructura atómica y clasificación periódica de los elementos. Introducción....Pág.3. Primeros modelos
MODELOS ATÓMICOS REALIZADO POR: NICOLÁS CASTELLANO SUÁREZ. Nº2, 4ºesoB. Física y Química
 MODELOS ATÓMICOS REALIZADO POR: NICOLÁS CASTELLANO SUÁREZ. Nº2, 4ºesoB Física y Química 2 Índice: Introducción..3 Modelo atómico de Dalton..4 Modelo atómico de Thomson.5 Modelo atómico de Rutherford..6
MODELOS ATÓMICOS REALIZADO POR: NICOLÁS CASTELLANO SUÁREZ. Nº2, 4ºesoB Física y Química 2 Índice: Introducción..3 Modelo atómico de Dalton..4 Modelo atómico de Thomson.5 Modelo atómico de Rutherford..6
Estructura de la materia y Sistema Periódico
 Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Estructura de la materia y Sistema Periódico 1 - Respecto el número cuántico «n» que aparece en el modelo atómico de Bohr indicar de manera razonada cuáles de las siguientes frases son correctas y cuáles
Estructura Atómica. Los inicios años A.C. Demócrito y ÁTOMO. Los inicios.. Tuvieron que pasar casi 2400 años. Sin. División
 Estructura Atómica Los inicios.. 500 años A.C. Demócrito y Leucippus fundan la escuela atomista. Sostienen que la materia era finita, discontinua, indivisible formada por una partícula común a la que llamaron
Estructura Atómica Los inicios.. 500 años A.C. Demócrito y Leucippus fundan la escuela atomista. Sostienen que la materia era finita, discontinua, indivisible formada por una partícula común a la que llamaron
INDICE Capitulo 27. La Carga Eléctrica y la Ley de Coulomb Capitulo 28. El Campo Eléctrico Capitulo 29. La Ley de Gauss
 INDICE Capitulo 27. La Carga Eléctrica y la Ley de Coulomb 1 27.1. Electromagnetismo. Un estudio preliminar 1 27.2. La carga eléctrica 2 27.3. Conductores y aislantes 3 27.4. La Ley de Coulomb 4 27.5.
INDICE Capitulo 27. La Carga Eléctrica y la Ley de Coulomb 1 27.1. Electromagnetismo. Un estudio preliminar 1 27.2. La carga eléctrica 2 27.3. Conductores y aislantes 3 27.4. La Ley de Coulomb 4 27.5.
PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS
 PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS 1.- DATOS INFORMATIVOS MATERIA: Química General I CARRERA: Química Analítica NIVEL: Primero
PONTIFICIA UNIVERSIDAD CATÓLICA DEL ECUADOR FACULTAD DE CIENCIAS EXACTAS Y NATURALES ESCUELA DE CIENCIAS QUÍMICAS 1.- DATOS INFORMATIVOS MATERIA: Química General I CARRERA: Química Analítica NIVEL: Primero
