ANALISIS CONFORMACIONAL
|
|
|
- Pablo Carmona Sevilla
- hace 6 años
- Vistas:
Transcripción
1 ANALISIS ONFORMAIONAL uando las moléculas se estudian desde una forma tridimensional, encontramos, entre otros, los isómeros conformacionales. Este tipo de isómeros tienen el mismo esqueleto pero difieren en cuanto a la posición relativa de ciertos átomos en el espacio tridimensional. En los isómeros conformacionales, estas diferencias se eliminan por rotación en torno a uno o más enlaces?, es decir, luego de un giro en al menos un enlace?, la disposición de los átomos se hace idéntica. Este proceso, que se conoce como análisis conformacional, describe los aspectos energéticos de esta clase de interconversión relacionando las posiciones atómicas relativas durante la rotación con los cambios de energía potencial. Etano uando se examina la rotación en torno al enlace carbono-carbono del etano, se observa que, aunque hay un número infinito de conformaciones, solamente existen dos extremos. En una de las estructuras cada enlace - del -1 se encuentra directamente enfrente de los enlaces - del -2, esta estructura es llamada la conformación eclipsada del etano. En la segunda estructura, cada enlace - del -1 se encuentra exactamente entre dos enlaces - del -2 y es llamada la conformación alternada del etano. Estas dos estructuras pueden ser interconvertidas por un simple giro de 60 o en torno al enlace? -. onformación Eclipsada onformación Alternada Estas representaciones son llamadas proyecciones de Newman, en las cuales el enlace - se aleja del observador y tanto el enlace - como el -2 se encuentran ocultos detrás del -1. Los electrones de los enlaces - en los carbonos anterior y posterior se encuentran más próximos entre sí en la conformación eclipsada lo que origina una repulsión entre ellos, resultando que esta conformación es energéticamente menos favorable que la conformación alternada. Esta diferencia de energía se conoce como tensión torsional. Para la rotación en torno al enlace? - del etano podemos dibujar un perfil que relacione la energía potencial relativa con el ángulo diedro entre un par de átomos de hidrógeno de cada uno de los carbonos.
2 La diferencia de energía entre las conformaciones eclipsada y alternada es de alrededor de 2.8 kcal/mol (unas 0.9 kcal/mol por cada interacción -). La conformación alternada se encuentra en un mínimo de energía mientras que la conformación eclipsada se encuentra en un máximo. Propano El propano también tiene una barrera de torsión., esta barrera es un poco mayor que la del etano (3.4 kcal/mol). En el confórmero eclipsado del propano hay dos interacciones - del tipo de las del etano y una entre un enlace - y uno -. omo cada interacción eclipsada - contribuye con 0.9 kcal/mol, podemos atribuir un valor de 1.4 kcal/mol a la interacción eclipsada entre el enlace - y el -. onformación Alternada onformación Eclipsada Butano La situación de las conformaciones se complica a medida que el alcano es mayor. Por ejemplo las proyecciones de Newman del butano muestran que la rotación en torno al enlace - central genera varias disposiciones alternadas y eclipsadas, no todas las conformaciones eclipsadas tienen la misma energía como tampoco las conformaciones alternadas. El arreglo con mínima energía, llamado conformación anti (antiperiplanar) es aquel en que los dos grandes grupos metilo están lo más alejados posible. Al girar las partes en torno al enlace 2-3 se llega a una conformación eclipsada en que hay dos interacciones entre metilo e hidrógeno y una - (conformación anticlinal). Si asignamos los valores de energía vistas con anterioridad, podríamos decir que esta conformación anticlinal será 3.7 kcal/mol menos estable que la conformación antiperiplar. Al continuar la rotación en derredor del enlace se llega a un mínimo de energía en la conformación alternada en la cual los grupos metilo forman un ángulo de 60 o. Esta es la conformación gauche (gosh) o synclinal y tiene 0.9 kcal/mol más energía que la conformación anti, aún cuando carece de interacciones eclipsadas. Esta diferencia de energía se debe a la tensión estérica causada por la repulsión entre los hidrógenos de los dos grupos metilo. A medida que el ángulo entre los grupos metilo tiende a 0 o, se llega a un máximo de energía ya que se generan cantidades apreciables de tensión tanto torsional como estérica.
3 Para esta conformación se ha calculado una diferencia de energía de 4.5 kcal/mol, lo que nos permite calcular un valor de 2.7 kcal/mol para la interacción 3? 3. Antiperiplanar Anticlinal Synclinal (Gauche) Synperiplanar Ahora podemos construir un perfil de energía para la rotación en torno al enlace central - entre los diferentes confórmeros del butano. Los mismos principios que acabamos de explicar para el butano se aplican al pentano, hexano y todos los alcanos superiores. uando se dice que determinado confórmero es más estable que otro, no queremos decir que la molécula adopte y mantenga la conformación más estable. A temperatura ambiente existe la suficiente energía térmica para girar alrededor de los enlaces? con tal velocidad que todos los confórmeros estarán en equilibrio. iclopropano omo hemos visto anteriormente, los alcanos de cadena abierta pueden presentar tensión tanto torsional debida al eclipsamiento de los enlaces en átomos vecinos como estérica ocasionada por las interacciones de repulsión cuando los átomos se acercan demasiado. Los cicloalcanos, además de estos dos tipos de tensiones podrán presentar tensión angular de dos tipos, tensión de ángulo pequeño y tensión de ángulo grande originada al abrir o cerrar los ángulos entre los enlaces. El ciclopropano al ser plano con ángulos de 60 o tiene enlace doblados con un carácter s de aproximadamente 17% y los enlaces - tienen un carácter s de aproximadamente 33% por lo que son orbitales aproximadamente sp 2. El carácter p adicional de los enlaces - libera algo de tensión. En un alcano sin deformar, la superposición de los orbitales es máxima y estos apuntan directamente uno hacia el otro. En el ciclopropano los orbitales no pueden hacerlo, solo se traslapan en un ángulo pequeño. El resultado es que los enlaces del ciclopropano son más débiles y reactivos que los enlaces normales de los alcanos.
4 iclobutano El ciclobutano exhibe el mismo fenómeno pero en un grado menor, presenta menor tensión angular que el ciclopropano pero más tensión torsional, por su mayor cantidad de hidrógenos en el anillo. omo un resultado de esto la tensión total en ambos compuestos es muy similar 26.4 kcal/mol para ciclobutano y 27.5 kcal/mol para ciclopropano. El ciclobutano está ligeramente flexionado, de manera que un átomo de carbono está a unos 25 o arriba del plano de los otros tres (esta conformación recibe el nombre de medio sobre). El efecto de este ligero doblez es el aumento de las tensiones angulares y la disminución de la tensión torsional. iclopentano Aunque el ciclopentano plano prácticamente no tiene tensión angular, sí presenta gran tensión torsional. En consecuencia se tuerce y adopta una conformación no plana, cuatro de los átomos de carbono se encuentran más o menos en el mismo plano y el quinto se sale de este (conformación de sobre). En su mayor parte los hidrógenos están casi alternados respecto a sus vecinos. iclohexano
5 Los ciclohexanos sustituidos son los cicloalcanos más comunes, muchos agentes farmacéuticos importantes contienen anillos de ciclohexano. Si el ciclohexano fuera plano, los ángulos de enlace deberían ser de 120 o con todos sus enlaces - eclipsados. Los ángulos -- del ciclohexano pueden llegar a tener el valor tetraédrico si el anillo adopta una conformación de silla. Al observar a lo largo de cualquier enlace - se observa que todos los enlace - vecinos están alternados. En esta conformación existen dos clases de posiciones para los sustituyentes en el anillo: axiales y ecuatoriales. En la conformación de silla del ciclohexano existen seis hidrógenos axiales perpendiculares al anillo y paralelos al eje de éste y seis hidrógenos ecuatoriales que están más o menos en el plano del anillo en torno a su ecuador. Los hidrógenos axiales se encuentran alternados entre sí, uno arriba y los vecinos abajo. De la misma forma se encuentran los hidrógenos ecuatoriales, arriba-abajo. omo el ciclohexano en la conformación de silla tiene dos clases de posiciones, se podría esperar que existieran dos isómeros del ciclohexano monosustituido, sin embargo
6 solamente existe uno. Esto es debido a que los anillos de ciclohexano son conformacionalmente móviles a temperatura ambiente, la conversión de una conformación de silla en otra requiere una energía de activación de aproximadamente 10 kcal/mol. Un sustituyente axial en una conformación de silla se convierte en un sustituyente ecuatorial después de la conversión. Axial Ecuatorial Además de la conformación de silla del ciclohexano existen otras posibilidades llamadas conformación de bote y conformación de bote torcido. Aunque la tensión angular se alivia en la conformación de bote, existen dos enlaces eclipsados. Algunas moléculas prefieren esta conformación. La conformación de bote del ciclohexano es 7 kcal/mol menos estable que el ciclohexano de silla, aunque este valor se reduce a unas 5.5 kcal/mol por un ligero torcimiento, lo que desahoga algo de la tensión torsional. Incluso esta conformación de bote torcido está mucho más deformada que la conformación de silla y las moléculas solamente la adoptan en circunstancias especiales, por ejemplo cuando hay formación de puente de hidrógeno entre los sustituyentes 1,4-. O O Las tres conformaciones del ciclohexano están en equilibrio, no obstante que las barreras energéticas para la interconversión son significativamente mayores que en los alcanos de cadena abierta. La ruta de más baja energía para la conversión de la conformación de silla en las de bote y bote torcido pasa por la semisilla, una conformación en la cual cinco de los seis átomos de carbono se encuentran en el mismo plano. A
7 continuación se muestran las diferencias de energía entre diversas conformaciones para las interconversiones. Vale la pena destacar varios puntos en este perfil de energía. La energía de activación para la conversión de la conformación de silla a la de semisilla es de 11 kcal/mol, considerablemente mayor que cualquier barrera conformacional que hayamos encontrado hasta el momento. Por consiguiente, esta transformación del ciclohexano se produce con una rapidez alrededor de un millón de veces menor que la rotación en torno al enlace - del etano. Por otra parte, la barrera para la interconversión de las conformaciones de bote torcido, a través del bote, requiere sólo 1.6 kcal/mol y es por lo tanto más rápida que la rotación del etano. La diferencia de energía entre las conformaciones de silla y de bote torcido del ciclohexano son lo bastante grande para que el bote torcido constituya solamente una pequeña fracción de la concentración en el equilibrio a temperatura ambiente.
Análisis Conformacional de Cicloalcanos. Facultad de CC.QQ y Farmacia USAC Departamento de Química Orgánica Química Orgánica 1 Sección D 2014
 Análisis Conformacional de Cicloalcanos Facultad de CC.QQ y Farmacia USAC Departamento de Química Orgánica Química Orgánica 1 Sección D 2014 La forma de los Cicloalcanos: Son Planos o No? Rotación restringida
Análisis Conformacional de Cicloalcanos Facultad de CC.QQ y Farmacia USAC Departamento de Química Orgánica Química Orgánica 1 Sección D 2014 La forma de los Cicloalcanos: Son Planos o No? Rotación restringida
TEMA 7 ESTEREOQUIMICA I
 TEMA 7 ESTEREOQUIMIA I. oncepto de estereoquímica.. Isomería conformacional.. onformaciones y estabilidades de los cicloalcanos. Fundamentos de Química Orgánica TEMA 7. ESTEREOQUIMIA I.. oncepto de estereoquímica..
TEMA 7 ESTEREOQUIMIA I. oncepto de estereoquímica.. Isomería conformacional.. onformaciones y estabilidades de los cicloalcanos. Fundamentos de Química Orgánica TEMA 7. ESTEREOQUIMIA I.. oncepto de estereoquímica..
CONFORMACIONES DE CICLOALCANOS
 ONFORMAIONES DE ILOALANOS Estabilidad de los cicloalcanos: tensión en el anillo A finales del 800, aunque se conocían varios compuestos que contenían anillos con cinco y seis miembros, no se habían podido
ONFORMAIONES DE ILOALANOS Estabilidad de los cicloalcanos: tensión en el anillo A finales del 800, aunque se conocían varios compuestos que contenían anillos con cinco y seis miembros, no se habían podido
Temas 4 y 5. Estereoisomería. Estereoisomería de configuración. Isomería geométrica
 Temas 4 y 5. Estereoisomería Estereoisomería de conformación Estereoisomería de configuración Isomería geométrica Isomería óptica Tema 4. Estereoisomería Estereoisomería de conformación Estereoisomería
Temas 4 y 5. Estereoisomería Estereoisomería de conformación Estereoisomería de configuración Isomería geométrica Isomería óptica Tema 4. Estereoisomería Estereoisomería de conformación Estereoisomería
Tema 2. Alcanos y cicloalcanos, isomería conformacional y geométrica
 Tema 2. Alcanos y cicloalcanos, isomería conformacional y geométrica Existen tres clases principales de Hidrocarburos: Hidrocarburos saturados (alcanos y cicloalcanos) Hidrocarburos insaturados (alquenos
Tema 2. Alcanos y cicloalcanos, isomería conformacional y geométrica Existen tres clases principales de Hidrocarburos: Hidrocarburos saturados (alcanos y cicloalcanos) Hidrocarburos insaturados (alquenos
PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCANOS (II)
 PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCANOS (II) Propiedades Físicas y Químicas de los Cicloalcanos Los Calores de Combustión de los cicloalcanos revelan la existencia de Tensión de Anillo 1. Anillos
PROPIEDADES FÍSICAS Y QUÍMICAS DE LOS ALCANOS (II) Propiedades Físicas y Químicas de los Cicloalcanos Los Calores de Combustión de los cicloalcanos revelan la existencia de Tensión de Anillo 1. Anillos
Clase 4: Unidad 1.2.3 Conformaciones del ciclohexano y otros ciclos mono y disustituídos
 Clase 4: Unidad 1.2.3 Conformaciones del ciclohexano y otros ciclos mono y disustituídos Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala
Clase 4: Unidad 1.2.3 Conformaciones del ciclohexano y otros ciclos mono y disustituídos Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad de San Carlos de Guatemala
ALCANOS. Estructura y propiedades
 TEMA 5.- idrocarburos y alcanos. idrocarburos: tipos y clasificación. idrocarburos saturados. Características generales. Formas de representación espacial. Análisis conformacional. Reactividad. Los hidrocarburos
TEMA 5.- idrocarburos y alcanos. idrocarburos: tipos y clasificación. idrocarburos saturados. Características generales. Formas de representación espacial. Análisis conformacional. Reactividad. Los hidrocarburos
QUIMICA ORGANICA 1 ALCANOS Y CICLOALCANOS 20/08/2010 ALCANOS
 0/0/00 QUIMICA ORGANICA Y CICLO Son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono carbono, solo poseen carbono e hidrogeno y no tienen grupos funcionales. El enlace
0/0/00 QUIMICA ORGANICA Y CICLO Son la primera clase de hidrocarburos simples y contienen sólo enlaces sencillos de carbono carbono, solo poseen carbono e hidrogeno y no tienen grupos funcionales. El enlace
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS
 CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
CONJUGACIÓN, RESONANCIA Y ESTABILIDAD DE ALQUENOS Universidad de San Carlos de Guatemala Facultad de Ciencias Químicas y Farmacia Departamento de Química Orgánica Sistemas Conjugados Los sistemas insaturados
Susana Latorre Licenciada en Ciencias químicas
 Susana Latorre Licenciada en Ciencias químicas QUIMICA INORGANICA QUIMICA ORGANICA TIPOS DE ENLACES QUE ES UN ELEMENTO QUIMICO QUE ES UNA MOLECULA QUE ES UNA REACCION. COMO SE ESCRIBE ELEMENTO QUIMICO
Susana Latorre Licenciada en Ciencias químicas QUIMICA INORGANICA QUIMICA ORGANICA TIPOS DE ENLACES QUE ES UN ELEMENTO QUIMICO QUE ES UNA MOLECULA QUE ES UNA REACCION. COMO SE ESCRIBE ELEMENTO QUIMICO
Tema 7 CO 2. PCl 5. Los enlaces múltiples se tratan como los sencillos en RPECV 1 enlace doble 1 enlace simple 109,5º.
 Tema 7: El Enlace Químico (III): moléculas poliatómicas 7.1 Geometría molecular: teoría RPEV (AJ3.1-3, P12, W8, 10) 7.2 Orbitales híbridos (AJ3.5-7) 7.3 Orbitales moleculares deslocalizados: compuestos
Tema 7: El Enlace Químico (III): moléculas poliatómicas 7.1 Geometría molecular: teoría RPEV (AJ3.1-3, P12, W8, 10) 7.2 Orbitales híbridos (AJ3.5-7) 7.3 Orbitales moleculares deslocalizados: compuestos
TEMA 3 EL ENLACE COVALENTE
 TEMA 3 EL ENLACE COVALENTE 1. Orbitales atómicos. 2. Teoría de orbitales moleculares (OM). 3. El enlace en la molécula de metano. 4. La molécula de etano. 5. La molécula de etileno. 6. La molécula de acetileno.
TEMA 3 EL ENLACE COVALENTE 1. Orbitales atómicos. 2. Teoría de orbitales moleculares (OM). 3. El enlace en la molécula de metano. 4. La molécula de etano. 5. La molécula de etileno. 6. La molécula de acetileno.
Clasificación de los isómeros:
 ISOMERÍA onsiste en que dos o más compuestos tienen la misma fórmula molecular, pero diferente estructura molecular. En consecuencia poseen diferentes propiedades físicas y químicas. Se denominan isómeros
ISOMERÍA onsiste en que dos o más compuestos tienen la misma fórmula molecular, pero diferente estructura molecular. En consecuencia poseen diferentes propiedades físicas y químicas. Se denominan isómeros
Capítulo 4. Reacciones orgánicas.
 apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
Química Orgánica. por átomos de carbono. A diferencia de otros
 Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
Química Orgánica La definición moderna de la química orgánica es el estudio de los compuestos que se componen por átomos de carbono. A diferencia de otros elementos, el carbono crea enlaces muy fuertes
ALCANOS. Antología de química. Definición de Hidrocarburos. Clasificación de Hidrocarburos. Clasificación de los Hidrocarburos.
 Definición de idrocarburos Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno, enlazados entre sí por uniones covalentes. Su estructura molecular comprende
Definición de idrocarburos Los hidrocarburos son compuestos orgánicos formados únicamente por átomos de carbono e hidrógeno, enlazados entre sí por uniones covalentes. Su estructura molecular comprende
1. Composición. Clase y número de átomos que dan lugar a la molécula.
 Tema 2 Principios estereoquímicos. 2. QUIALIDAD Y ELEMENTOS DE SIMETÍA. uatro aspectos generales definen la estructura de la molécula:. omposición. lase y número de átomos que dan lugar a la molécula.
Tema 2 Principios estereoquímicos. 2. QUIALIDAD Y ELEMENTOS DE SIMETÍA. uatro aspectos generales definen la estructura de la molécula:. omposición. lase y número de átomos que dan lugar a la molécula.
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Superficie de energía potencial
 Superficie de energía potencial Energía de una molécula (E). ) Ψ=EΨ ) = T ) N + T ) e + V ) ee + V ) Ne + V ) NN No se puede resolver Aproximación de Born-Oppenheimer. ) ele (R)Ψ ele (R) = E ele (R)Ψ ele
Superficie de energía potencial Energía de una molécula (E). ) Ψ=EΨ ) = T ) N + T ) e + V ) ee + V ) Ne + V ) NN No se puede resolver Aproximación de Born-Oppenheimer. ) ele (R)Ψ ele (R) = E ele (R)Ψ ele
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Enlace químico II: geometría e hibridación de orbitales atómicos Capítulo 10 Modelo de la repulsión de los pares de electrones de la capa de valencia (): Predice la geometría de la molécula a partir de
Teoría de repulsión de pares electrónicos de la capa de Valencia
 Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste las siguientes preguntas.
 EXPERIMENTO 2 Estructuras de los Alcanos Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste
EXPERIMENTO 2 Estructuras de los Alcanos Fecha: Sección de laboratorio: Nombre del estudiante: Grupo #: Preguntas de preparación para el laboratorio. Después de leer cuidadosamente el experimento, conteste
TEMA 8 ESTEREOQUIMICA II
 TEMA 8 ESTEREQUIMIA II 1. Isomería geométrica. 2. Quiralidad: noción de centro esteroquímico. Nomenclatura R y S. 3. ompuestos con varios carbonos quirales: diastereoisómeros y compuestos meso. 4. Actividad
TEMA 8 ESTEREQUIMIA II 1. Isomería geométrica. 2. Quiralidad: noción de centro esteroquímico. Nomenclatura R y S. 3. ompuestos con varios carbonos quirales: diastereoisómeros y compuestos meso. 4. Actividad
QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos.
 QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de 2011 Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos. 1. Qué significado tienen los parámetros termodinámicos
QUÍMICA FÍSICA II Grupo A. Tercer control, 10 de mayo de 2011 Escoged 2 de las 3 preguntas que os propongo, cada una de las preguntas vale 5 puntos. 1. Qué significado tienen los parámetros termodinámicos
QUÍMICA. 1º A bachillerato.
 QUÍMIA. º A bachillerato. Isomería y nomenclatura 9/ebrero/05.. Establece la jerarquía, de mayor a menor, de los grupos funcionales que se formulan a continuación, nombra cada grupo funcional y la familia
QUÍMIA. º A bachillerato. Isomería y nomenclatura 9/ebrero/05.. Establece la jerarquía, de mayor a menor, de los grupos funcionales que se formulan a continuación, nombra cada grupo funcional y la familia
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Quimica orgánica básica
 Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
Quimica orgánica básica Química orgánica básica La química orgánica es el estudio de los compuestos de carbono. Los átomos de carbono son únicos en su habilidad de formar cadenas muy estables y anillos,
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
Enlace químico II: geometría molecular e hibridación de orbitales atómicos
 Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
Enlace químico II: geometría molecular e hibridación de orbitales atómicos Capítulo 10 Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. Teorías de cómo ocurren
ALCANOS: ESTRUCTURA. Y NOMENCLATURA DE HIDROCARBURO SENCILLOS
 ALCANOS: ESTRUCTURA. Y NOMENCLATURA DE DROCARBURO SENCLLOS Los compuestos orgánicos se clasifican de acuerdo con características estructurales comunes que imparten propiedades químicas y físicas similares
ALCANOS: ESTRUCTURA. Y NOMENCLATURA DE DROCARBURO SENCLLOS Los compuestos orgánicos se clasifican de acuerdo con características estructurales comunes que imparten propiedades químicas y físicas similares
MOMENTO DIPOLAR DE ENLACE. La polaridad de un enlace se mide con el momento dipolar de enlace, µ.
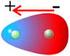 didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
didactalia.net En la mayoría de los compuestos orgánicos el átomo de carbono se enlaza a átomos más electronegativos, lo que promueve que los electrones del enlace covalente sean atraídos con mayor intensidad
La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos
 QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
QUÍMICA ORGÁNICA La Química Orgánica es el estudio de los compuestos de carbono. El carbono puede formar más compuestos que ningún otro elemento, por tener la capacidad de unirse entre sí formando cadenas
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN ÍNDICE
 CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
CRISTALOQUÍMICA TEMA 9 POLIMORFISMO Y TRANSFORMACIONES POLIMÓRFICAS. TRANSFORMACIONES ORDEN - DESORDEN 9.1 Introducción 9.2 Estabilidad y equilibrio ÍNDICE 9.3 Concepto de polimorfismo y de transformación
Técnico Profesional QUÍMICA
 Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
Programa Técnico Profesional QUÍMICA Geometría molecular Nº Ejercicios PSU 1. La siguiente figura muestra la estructura del gas metano. C Al respecto, qué valor adopta el ángulo de enlace en este compuesto?
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
Profesor: Carlos Gutiérrez Arancibia. Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares
 Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
Profesor: Carlos Gutiérrez Arancibia Temas a tratar: - - Sustancias Puras - Mezclas - Enlaces Químicos - Fuerzas Intermoleculares A. Sustancia Pura: SUSTANCIAS PURAS Y MEZCLAS Una sustancia pura es un
TEMA 2. Grupos funcionales con enlaces simples.
 TEMA 2. Grupos funcionales con enlaces simples. Alcanos. icloalcanos. Grupos alquilos. alogenuros de alquilo. Alcoholes. Éteres. Epóxidos. Tioles. Aminas. Nomenclatura y propiedades. Grupo funcional: es
TEMA 2. Grupos funcionales con enlaces simples. Alcanos. icloalcanos. Grupos alquilos. alogenuros de alquilo. Alcoholes. Éteres. Epóxidos. Tioles. Aminas. Nomenclatura y propiedades. Grupo funcional: es
UNIDAD II HIDROCARBUROS ALIFÁTICOS
 UNIDAD II HIDROCARBUROS ALIFÁTICOS Alcanos, alquenos y alquinos: Introducción y Nomenclatura Q.A. Eduardo Vega Barrios Pte. M. en C.Q. Macaria Hernández Chávez Definición de Hidrocarburos Los hidrocarburos
UNIDAD II HIDROCARBUROS ALIFÁTICOS Alcanos, alquenos y alquinos: Introducción y Nomenclatura Q.A. Eduardo Vega Barrios Pte. M. en C.Q. Macaria Hernández Chávez Definición de Hidrocarburos Los hidrocarburos
TEMA 4. EFECTOS ELECTRÓNICOS. ENLACES DESLOCALIZADOS.
 TEMA 4. EFECTOS ELECTRÓNICOS. ENLACES DESLOCALIZADOS. 1. Estructuras de resonancia. 1.1. Contribución de las estructuras resonantes. 1.2. Cómo dibujar estructuras resonantes 2. Efecto inductivo. 3. Efecto
TEMA 4. EFECTOS ELECTRÓNICOS. ENLACES DESLOCALIZADOS. 1. Estructuras de resonancia. 1.1. Contribución de las estructuras resonantes. 1.2. Cómo dibujar estructuras resonantes 2. Efecto inductivo. 3. Efecto
TEMA 2 ESTEREOQUÍMICA
 TEMA 2 ESTEREOQUÍMICA La estereoquímica es el estudio de las moléculas en tres dimensiones. Quiralidad vs Aquiralidad Imagen especular original Molécula original Molécula quiral: La molécula rotada no
TEMA 2 ESTEREOQUÍMICA La estereoquímica es el estudio de las moléculas en tres dimensiones. Quiralidad vs Aquiralidad Imagen especular original Molécula original Molécula quiral: La molécula rotada no
Facultad de Ciencias Forestales UNIVERSIDAD NACIONAL DE SANTIAGO DEL ESTERO
 Serie Didáctica N 32 Facultad de Ciencias Forestales UNIVERSIDAD NACIONAL DE SANTIAGO DEL ESTERO E-Book ISBN 978-987-1676-42-2. Fecha de catalogación: 19/12/2014. C A T E D R A D E Química Orgánica y Biológica
Serie Didáctica N 32 Facultad de Ciencias Forestales UNIVERSIDAD NACIONAL DE SANTIAGO DEL ESTERO E-Book ISBN 978-987-1676-42-2. Fecha de catalogación: 19/12/2014. C A T E D R A D E Química Orgánica y Biológica
Isomería estructural o constitucional
 TEMA 7.- Estereoisomería. Isomería: constitucional y estereoisomería. Isomería óptica. Quiralidad y enantiomería. Configuraciones absoluta y relativa. Moléculas con dos o más estereocentros: diastereoisomería
TEMA 7.- Estereoisomería. Isomería: constitucional y estereoisomería. Isomería óptica. Quiralidad y enantiomería. Configuraciones absoluta y relativa. Moléculas con dos o más estereocentros: diastereoisomería
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 3: ENLACES QUÍMICOS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA : ENLACES QUÍMICOS Junio, Ejercicio, Opción A Reserva 1, Ejercicio, Opción A Reserva, Ejercicio, Opción B Reserva, Ejercicio, Opción B Septiembre,
ESTRUCTURA DE LA MATERIA QCA 05 ANDALUCÍA
 1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
1.- a) Escriba la configuración electrónica de los elementos A, B y C, cuyos números atómicos son 33, 35 y 37, respectivamente. b) Indique el grupo y el periodo al que pertenecen. c) Razone que elemento
QUÍMICA ORGÁNICA GENERAL
 UNIVERSIDAD DEL VALLE VICERRECTORIA ACADÉMICA DIRECCIÓN DE EDUCACIÓN DESESCOLARIZADA CURSO DE QUÍMICA ORGÁNICA GENERAL AUTORA: LUZ MARINA JARAMILLO PhD Profesora Titular Facultad de Ciencias - Departamento
UNIVERSIDAD DEL VALLE VICERRECTORIA ACADÉMICA DIRECCIÓN DE EDUCACIÓN DESESCOLARIZADA CURSO DE QUÍMICA ORGÁNICA GENERAL AUTORA: LUZ MARINA JARAMILLO PhD Profesora Titular Facultad de Ciencias - Departamento
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
TEMA 2: Resonancia Magnética Nuclear RMN-1H y 13C Fundamentos
 Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
Fundamentos La Resonancia Magnética Nuclear (RMN) es la técnica que mayor información estructural proporciona. Ello se debe a que se observan los núcleos de los átomos y se puede conocer la influencia
USOS Y FUENTES DE ALCANOS
 1 USOS Y FUENTES DE ALCANOS LOS PRIMEROS CUATRO ALCANOS (METANO, ETANO, PROPANO Y BUTANO) SON GASES A TEMPERATURA AMBIENTE Y PRESIÓN ATMOSFÉRICA. EL ETANO Y ETANO SON DIFÍCILES DE LICUAR. EL GAS NATURAL
1 USOS Y FUENTES DE ALCANOS LOS PRIMEROS CUATRO ALCANOS (METANO, ETANO, PROPANO Y BUTANO) SON GASES A TEMPERATURA AMBIENTE Y PRESIÓN ATMOSFÉRICA. EL ETANO Y ETANO SON DIFÍCILES DE LICUAR. EL GAS NATURAL
Espectro Electromagnético
 1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
1 Espectro Electromagnético La luz es radiación electromagnética y está compuesta por una parte eléctrica y otra magnética. Las particulas subatómicas, electrones y fotones, tienen propiedades de partículas
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
TEMA 2. CLASIFICACION Y NOMECLATURA DE LOS COMPUESTOS ORGANICOS.
 TEMA 2. LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. 1. oncepto de radical y grupo funcional. Series homólogas. 2. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. 2 Tema 2 TEMA 2.
TEMA 2. LASIFIAIN Y NMELATURA DE LS MPUESTS RGANIS. 1. oncepto de radical y grupo funcional. Series homólogas. 2. Principales tipos de compuestos orgánicos. Formulación y nomenclatura. 2 Tema 2 TEMA 2.
Instituto de Física Universidad de Guanajuato Agosto 2007
 Instituto de Física Universidad de Guanajuato Agosto 2007 Física III Capítulo I José Luis Lucio Martínez El material que se presenta en estas notas se encuentra, en su mayor parte, en las referencias que
Instituto de Física Universidad de Guanajuato Agosto 2007 Física III Capítulo I José Luis Lucio Martínez El material que se presenta en estas notas se encuentra, en su mayor parte, en las referencias que
DIENOS. Los dienos conjugados son aquellos donde los enlaces dobles se alternan con enlaces simples. Ej: 1,3-pentadieno CH 2 =CH-CH=CH-CH 3
 Teoría de Química Orgánica I DIENOS Un hidrocarburo que contiene dos dobles enlaces se denomina dieno y la relación entre los dobles enlaces puede clasificarse como aislados, conjugados o acumulados. Los
Teoría de Química Orgánica I DIENOS Un hidrocarburo que contiene dos dobles enlaces se denomina dieno y la relación entre los dobles enlaces puede clasificarse como aislados, conjugados o acumulados. Los
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2002 QUÍMICA TEMA 2: LA ESTRUCTURA DEL ÁTOMO Junio, Ejercicio 2, Opción A Reserva 1, Ejercicio 2, Opción A Reserva 2, Ejercicio 3, Opción B Reserva 3, Ejercicio
Propiedades Periódicas y Propiedades de los elementos
 Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
Propiedades Periódicas y Propiedades de los elementos Se denominan propiedades periódicas, aquellas que tienen una tendencia de variación de acuerdo a la ubicación de los elementos en la tabla periódica.
SOLUCIONES EJERCICIOS DE ENLACE QUÍMICO. 1º BCT
 SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SOLUCIOES EJERCICIOS DE ELACE QUÍMICO. 1º CT 1. La teoría de la repulsión de los pares electrónicos de la capa de valencia (TRPECV) dice que los pares electrónicos que rodean al átomo central se disponen
SEGUNDO DE BACHILLERATO QUÍMICA. a A + b B c C + d D
 TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
TEMA 5. CINÉTICA QUÍMICA a A + b B c C + d D 1 d[a] 1 d[b] 1 d[c] 1 d[d] mol v = = = + = + a dt b dt c dt d dt L s El signo negativo en la expresión de velocidad es debido a que los reactivos desaparecen,
ÍNDICE DE CONTENIDOS
 ÍNDICE DE CONTENIDOS Presentación... 15 Presentación autoras... 17 UNIDAD DIDÁCTICA I Tema 1. Hidrocarburos I: Alcanos. Alquenos. Dienos y polienos Rosa M. a Claramunt Vallespí... 21 1.1. Introducción...
ÍNDICE DE CONTENIDOS Presentación... 15 Presentación autoras... 17 UNIDAD DIDÁCTICA I Tema 1. Hidrocarburos I: Alcanos. Alquenos. Dienos y polienos Rosa M. a Claramunt Vallespí... 21 1.1. Introducción...
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
GERMÁN FERNÁNDEZ. Versión: 1.0
 GERMÁN FERNÁNDEZ Versión:.0 DEREHOS DE AUTOR i DEREHOS DE AUTOR Los derechos de copia y reproducción de este documento son propiedad de Germán Fernández. El presente documento se distribuye en forma gratuita
GERMÁN FERNÁNDEZ Versión:.0 DEREHOS DE AUTOR i DEREHOS DE AUTOR Los derechos de copia y reproducción de este documento son propiedad de Germán Fernández. El presente documento se distribuye en forma gratuita
 El carbono y sus propiedades 1.-Definición El carbón es un combustible sólido de origen vegetal. El carbón o carbón mineral es una roca sedimentaria de color negro, muy rica en carbono, utilizada como
El carbono y sus propiedades 1.-Definición El carbón es un combustible sólido de origen vegetal. El carbón o carbón mineral es una roca sedimentaria de color negro, muy rica en carbono, utilizada como
Interacciones químicas de no enlace. Fuerzas de van der Waals
 Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Interacciones químicas de no enlace IES La Magdalena. Avilés. Asturias En el mundo material, además de los enlaces entre átomos existen otras interacciones, más débiles, pero lo suficientemente intensas
Conceptos básicos en estequiometría
 Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Conceptos básicos en estequiometría Tomado de: http://www.eis.uva.es/~qgintro/esteq/tutorial-01.html El Mol Un mol se define como la cantidad de materia que tiene tantos objetos como el número de átomos
Biopolímero s (4831)
 Biopolímero s (4831) 5.4. Factores que determinan la estructura de los ácidos nucleicos. 5.4.4 Apilamiento de bases Cuando se examinan los cristales de ácidos nucleicos helicoidales se observa que los
Biopolímero s (4831) 5.4. Factores que determinan la estructura de los ácidos nucleicos. 5.4.4 Apilamiento de bases Cuando se examinan los cristales de ácidos nucleicos helicoidales se observa que los
FÍSICA Y QUÍMICA 4º ESO Apuntes: Química del carbono
 1(16) 1 INTRODUCCIÓN Tradicionalmente la química se ha dividido en dos grandes ramas: - Química inorgánica. Se encarga de todos los elementos excepto el carbono. - Química orgánica o química del carbono.
1(16) 1 INTRODUCCIÓN Tradicionalmente la química se ha dividido en dos grandes ramas: - Química inorgánica. Se encarga de todos los elementos excepto el carbono. - Química orgánica o química del carbono.
17 Principios generales de química orgánica
 174 Química General. Grupo B. urso 1993/94 17 Principios generales de química orgánica 17.1 Los compuestos orgánicos 17.2 Isomería 17.3 aracterísticas químicas generales de los compuestos orgánicos 17.4
174 Química General. Grupo B. urso 1993/94 17 Principios generales de química orgánica 17.1 Los compuestos orgánicos 17.2 Isomería 17.3 aracterísticas químicas generales de los compuestos orgánicos 17.4
Docente: Raquel Villafrades Torres. Química General
 Propiedades Periódicas Docente: Raquel Villafrades Torres Química General UPB Introducción Las propiedades periódicas son aquellas que varían de forma regular por la posición que ocupan los elementos en
Propiedades Periódicas Docente: Raquel Villafrades Torres Química General UPB Introducción Las propiedades periódicas son aquellas que varían de forma regular por la posición que ocupan los elementos en
TEMA 5. ESTRUCTURA Y PROPIEDADES MOLECULARES
 TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
TEMA 5. ESTRUTURA Y PRPIEDADES MLEULARES 1. Enlaces más débiles que el enlace covalente. 1.1. Fuerzas entre dipolos. 1.2. Fuerzas de dispersión de London. 1.3. Puente de hidrógeno. 2. Influencia de la
LA FORMA DE LAS MOLÉCULAS
 LA FORMA DE LAS MOLÉCULAS Dr. Hugo Cerecetto Prof. Titular de Química Temario 7. Las formas de las moléculas: Estructura de Lewis Distancias de enlace Ángulos de enlace Geometría molecular Bibliografía
LA FORMA DE LAS MOLÉCULAS Dr. Hugo Cerecetto Prof. Titular de Química Temario 7. Las formas de las moléculas: Estructura de Lewis Distancias de enlace Ángulos de enlace Geometría molecular Bibliografía
Reacciones en Química Orgánica
 Reacciones en Química Orgánica 4º Año Cód- 8002-14 Prof: Ay lén Ávila Química Dpto. de Química INDICE Introducción a los compuestos carbonados (p.2) Nomenclatura (p.3) Cicloalcanos (p.5) Aromaticidad (p.7)
Reacciones en Química Orgánica 4º Año Cód- 8002-14 Prof: Ay lén Ávila Química Dpto. de Química INDICE Introducción a los compuestos carbonados (p.2) Nomenclatura (p.3) Cicloalcanos (p.5) Aromaticidad (p.7)
MOLÉCULAS Y FUERZAS INTERMOLECULARES
 4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
4 MLÉULAS Y UERZAS TERMLEULARES SLUES A LAS ATVDADES DE AL DE UDAD Método RPEV e hibridación 1 Las nubes electrónicas que se dibujan en torno al átomo central en el método RPEV, son una representación
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS.
 PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
PARTÍCULAS FUNDAMENTALES. NÚMEROS CUÁNTICOS. PROPIEDADES PERIÓDICAS. PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones,
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
PREPARACIÓN Y ESTUDIO DE ALGUNOS COMPLEJOS DE COBRE.
 PREPARACIÓN Y ESTUDIO DE ALGUNOS COMPLEJOS DE COBRE. Concepto de complejo. El concepto de complejo resulta ser muy general. Se puede definir cuando un átomo o ión central, M, se une a uno o más ligantes
PREPARACIÓN Y ESTUDIO DE ALGUNOS COMPLEJOS DE COBRE. Concepto de complejo. El concepto de complejo resulta ser muy general. Se puede definir cuando un átomo o ión central, M, se une a uno o más ligantes
UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica. Profesora: Gladys Rivera Jerez
 UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica Profesora: Gladys Rivera Jerez Las sencillas combinaciones del carbono con algunos pocos átomos han dado origen a más de 10 millones
UNIDAD: Química orgánica UNIDAD DE APRENDIZAJE: Nomenclatura Orgánica Profesora: Gladys Rivera Jerez Las sencillas combinaciones del carbono con algunos pocos átomos han dado origen a más de 10 millones
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Tutorial Chemsketch Autores: Gabriel Iglesias, Rosana Rota y Lucía B Chemes
 Tutorial Chemsketch Autores: Gabriel Iglesias, Rosana Rota y Lucía B Chemes Chemsketch es un programa para dibujo avanzado en Química. Útil para dibujar estructuras químicas, reacciones y esquemas. El
Tutorial Chemsketch Autores: Gabriel Iglesias, Rosana Rota y Lucía B Chemes Chemsketch es un programa para dibujo avanzado en Química. Útil para dibujar estructuras químicas, reacciones y esquemas. El
Temario FÍSICA Y QUÍMICA 59
 Temario FÍSICA Y QUÍMICA 59 Química del carbono. Estructura y enlaces del carbono. Nomenclatura. Isomería. Comprobación experimental de la actividad óptica. 25-15223-13 FÍSICA Y QUÍMICA 59 3 1. ENLACES
Temario FÍSICA Y QUÍMICA 59 Química del carbono. Estructura y enlaces del carbono. Nomenclatura. Isomería. Comprobación experimental de la actividad óptica. 25-15223-13 FÍSICA Y QUÍMICA 59 3 1. ENLACES
ISOMERÍA Teóricamente, el número de compuestos orgánicos es infinito.
 Clase 10 ISOMERÍA Teóricamente, el número de compuestos orgánicos es infinito. Estos compuestos se representan comúnmente mediante fórmulas moleculares o estructurales. ejemplos C 4,C,yC 2 6 3 8 -C-C-C-C-
Clase 10 ISOMERÍA Teóricamente, el número de compuestos orgánicos es infinito. Estos compuestos se representan comúnmente mediante fórmulas moleculares o estructurales. ejemplos C 4,C,yC 2 6 3 8 -C-C-C-C-
S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS
 S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS NOMBRE DE LA ASIGNATURA: QUIMICA ORGANICA I (4-2-10) NIVEL: LICENCIATURA CARRERA: INGENIERIA BIOQUIMICA INGENIERIA QUIMICA CLAVE: ACC-9328 TEMARIO:
S.E.P. S.E.I.T DIRECCION GENERAL DE INSTITUTOS TECNOLOGICOS NOMBRE DE LA ASIGNATURA: QUIMICA ORGANICA I (4-2-10) NIVEL: LICENCIATURA CARRERA: INGENIERIA BIOQUIMICA INGENIERIA QUIMICA CLAVE: ACC-9328 TEMARIO:
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS
 FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
FORMULACIÓN DE QUÍMICA ORGÁNICA 1- HIDROCARBUROS DE CADENA ABIERTA A) ALCANOS Fórmula molecular C n H 2n+2 Sufijo ANO. Para los alcanos de cadena lineal, si tienen 1 C se utiliza el prefijo met-; 2 C et-;
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
UNA GUÍA PARA EL USO Y CONSTRUCCIÓN DE MODELOS MOLECULARES
 UNA GUÍA PARA EL USO Y CONSTRUCCIÓN DE MODELOS MOLECULARES MODELOS DARLING Stephen D. Darling z Octaédrica X & y Alcano Alqueno 2D Tetraédrica & Bipirámide trigonal Planar cuadrada Planar trigonal Lineal
UNA GUÍA PARA EL USO Y CONSTRUCCIÓN DE MODELOS MOLECULARES MODELOS DARLING Stephen D. Darling z Octaédrica X & y Alcano Alqueno 2D Tetraédrica & Bipirámide trigonal Planar cuadrada Planar trigonal Lineal
TALLER DE OSCILACIONES Y ONDAS
 TALLER DE OSCILACIONES Y ONDAS Departamento De Fı sica y Geologı a, Universidad De Pamplona DOCENTE: Fı sico Amando Delgado. TEMAS: Todos los desarrollados el primer corte. 1. Determinar la frecuencia
TALLER DE OSCILACIONES Y ONDAS Departamento De Fı sica y Geologı a, Universidad De Pamplona DOCENTE: Fı sico Amando Delgado. TEMAS: Todos los desarrollados el primer corte. 1. Determinar la frecuencia
16. Estructuras de Lewis (III)
 16. Estructuras de Lewis (III) ( Son todas las estructuras de Lewis creadas igual? Modelo 1. Dos posibles estructuras para el CO 2. Experimentalmente, encontramos que ambos enlaces C O en CO 2 son idénticos.
16. Estructuras de Lewis (III) ( Son todas las estructuras de Lewis creadas igual? Modelo 1. Dos posibles estructuras para el CO 2. Experimentalmente, encontramos que ambos enlaces C O en CO 2 son idénticos.
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
TEMA 3.2 El Enlace Covalente
 TEMA 3.2 El Enlace Covalente» Estructuras de Lewis: Regla del ctete Formas resonantes Carga formal Excepciones a la regla del octete» Geometría Molecular: Teoría RPENV (Repulsión de los pares de electrones
TEMA 3.2 El Enlace Covalente» Estructuras de Lewis: Regla del ctete Formas resonantes Carga formal Excepciones a la regla del octete» Geometría Molecular: Teoría RPENV (Repulsión de los pares de electrones
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León.
 Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Universidad de San Carlos de Guatemala. Facultad de Ingeniería. Escuela de Ciencias. Departamento de Química. Catedrática: Tania de León. Química General. Código: 0348. Primer semestre. Hoja de trabajo.
Bloque 1. Las magnitudes físicas y su medida
 Bloque 1. Las magnitudes físicas y su medida El sistema métrico decimal El sistema internacional de unidades Conversiones de unidades con factores de conversión. Unidades compuestas Magnitudes escalares
Bloque 1. Las magnitudes físicas y su medida El sistema métrico decimal El sistema internacional de unidades Conversiones de unidades con factores de conversión. Unidades compuestas Magnitudes escalares
Hibridación y Momento Dipolar
 Hibridación y Momento Dipolar Conceptos Previos El orbital o capa de valencia es el orbital asociado al más alto nivel cuántico que contiene electrones. La forma de como se ordenan los electrones de valencia
Hibridación y Momento Dipolar Conceptos Previos El orbital o capa de valencia es el orbital asociado al más alto nivel cuántico que contiene electrones. La forma de como se ordenan los electrones de valencia
EJERCICIOS RESUELTOS DE ENLACE QUIMICO
 EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
EJERCICIOS RESUELTOS DE ENLACE QUIMICO 1. a) Qué tipo de enlace presenta el compuesto formado por F y Ca? b) Formule dicho compuesto a) Considerando los números atómicos del F (Z=9) y el Ca (Z=20) se desarrollan
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
El Modelo Moderno y resultados de nuestro interés
 CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
CLASES 3 Y 4 ESTRUCTURA ELECTRÓNICA DE LOS ELEMENTOS AL ESTADO FUNDAMENTAL. TABLA PERIÓDICA. ELECTRONEGATIVIDAD. El Modelo Moderno y resultados de nuestro interés Así es como el Modelo Moderno (MM) reemplazó
Unidad. Formas en que se presenta la energía. Física y Química 4. ESO. La energía. Energía interna. Energía mecánica. Energía electromagnética
 La energía Puede ser de tres tipos mecánica interna electromagnética Se presenta como Se presenta como Se presenta como química térmica nuclear cinética potencial elástica luminosa o radiante potencial
La energía Puede ser de tres tipos mecánica interna electromagnética Se presenta como Se presenta como Se presenta como química térmica nuclear cinética potencial elástica luminosa o radiante potencial
CAMPO MAGNÉTICO. El origen del magnetismo.
 CAMPO MAGNÉTICO. El origen del magnetismo. Los imanes atraen fuertemente a metales como el hierro, esto es debido a que son materiales que tienen un campo magnético propio. Vamos a tener en los imanes
CAMPO MAGNÉTICO. El origen del magnetismo. Los imanes atraen fuertemente a metales como el hierro, esto es debido a que son materiales que tienen un campo magnético propio. Vamos a tener en los imanes
Identidad Eje de simetría de orden n
 1 Teoría de grupos aplicada a la simetría 1.1 Operaciones de simetría 1.2 Grupos puntuales de simetría 1.3 Tablas de caracteres 1.4 Representaciones de simetría 1.1 Operaciones de simetría metría molecular.
1 Teoría de grupos aplicada a la simetría 1.1 Operaciones de simetría 1.2 Grupos puntuales de simetría 1.3 Tablas de caracteres 1.4 Representaciones de simetría 1.1 Operaciones de simetría metría molecular.
