Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura CÁTEDRA: HEMATOLOGÍA CLÍNICA TRABAJOS PRÁCTICOS
|
|
|
- César Belmonte Palma
- hace 6 años
- Vistas:
Transcripción
1 Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura CÁTEDRA: HEMATOLOGÍA CLÍNICA TRABAJOS PRÁCTICOS ALUMNO: GRUPO:... AÑO:
2 INTEGRANTES DE LA CÁTEDRA: PROFESORA ADJUNTA RESPONSABLE: BQCA. RINA MARINA TEJADA DE MARTÍNEZ JTP: BQCO. GONZALO OJEDA JTPs ADSCRIPTOS: BQCA. VICTORIA IVAN - BQCA. CLAUDIA PATRICIA SERRANO AUXILIAR DOCENTE ADSCRIPTA: BQCA. FLAVIA CHAMORRO AYUDANTES ALUMNOS: SENA TIBERIO CELESTE, CASTILLO RUVEDA EDUARDO, PINTO MARIA LUISA. ALUMNOS PASANTES: GALARZA DARIO, ENCINAS SEBASTIÁN, MELANA JUAN PABLO. NÓMINA DE TRABAJOS PRÁCTICOS TP1: HEMOGRAMA 1 (HTO, HEMOGLOBINA, VSG, COLORACIÓN MGG) TP2: HEMOGRAMA 2 (FÓRMULA NORMAL, RECUENTO DE GB) TP3: FÓRMULA PATOLÓGICA-ALTERACIONES SERIE BLANCA (MICROSCOPIA) TP4: ANEMIA ARREGENERATIVAS (MICROSCOPIA) TP5: ANEMIAS REGENERATIVAS (MICROSCOPIA Y RETICULOCITOS) TP6: INMUNOHEMATOLOGÍA (GRUPO Y FACTOR, COOMBS D e I) TP7: ELECTROFORESIS DE HEMOGLOBINA TP8: CITOQUÍMICA (MPO-PERLS-KLEIHAUER BETKE) MEDULOGRAMA (MICROSCOPIA) TP9: LEUCEMIAS AGUDAS (LMA Y LLA / MICROSCOPIA) TP10: SINDROMES PROLIFERATIVOS CRÓNICOS (SMPC SLPC / MICROSCOPIA) TP11: HEMOSTASIA PRIMARIA (RECUENTO DE Pq, TIEMPO DE SANGRÍA, TIEMPO DE COAGULACIÓN, RETRACCIÓN DE COÁGULO) TP12: HEMOSTASIA SECUNDARIA (TP, KPTT, MÉTODOS MANUALES Y AUTOMATIZADOS) 2
3 MODELO DE INFORME (EL INFORME ES INDIVIDUAL) TP N GRUPO DE LABORATORIO: FECHA NOMBRE Y APELLIDO 1-ACTIVIDADES REALIZADAS (detallar en forma resumida las actividades realizadas) 2- RESULTADOS HALLADOS Determinación Valor hallado Método Valores de referencia 3- ELEMETOS OBSERVADOS Para los TPs de microscopia especificar cada uno de los elementos observados (coloración y aumento) así como también, en caso de disponer de ellos, datos referentes al cuadro en que fue encontrado (edad, datos de hemograma, patología, tratamiento, etc). Ej. Se observó un frotis con anisocitosis moderada (MGG 40x), correspondiente a un cuadro de anemia ferropénica en recuperación (Niño 8 años, GB: 7300 cel/mm 3 GR: 4,18 x 10 6 cel/mm 3 Hb 11,2 g%, Hto: 37 %, VCM: 87,3 fl, HCM 26,7 pg, CHCM 30,2 g%, RDW 18 %, Pq 323x10 3 /mm 3, Tratamiento: Hierro oral) Ej. Se observaron numerosos esferocitos (MGG 100x) en un frotis perteneciente a un paciente con AHAI. 4- DISCUSION DE RESULTADOS (variaciones fisiológicas, patológicas, posibles causas de error, procedimientos para la validación del resultado) 3
4 TRABAJO PRÁCTICO N 1 HEMOGRAMA 1 (HTO, HEMOGLOBINA, VSG, COLORACION MGG) Objetivos Generales - Puesta en práctica de normas de bioseguridad básicas. - Práctica de los pasos para la obtención de muestras de sangre venosa para la realización de las determinaciones incluidas en el hemograma. - Aplicación de los criterios necesarios para la elección de anticoagulantes en función de las determinaciones a realizar. - Manejo del material necesario para las prácticas a desarrollar. - Interpretación de resultados. 1 -Instructivo para la obtención de sangre periférica por punción venosa 1. Durante la toma de muestra deben guardarse las más estrictas normas de higiene. 2. El material descartable a usar se abrirá sólo al momento de su utilización y, una vez manipulado, no podrá guardarse nuevamente aún cuando se lo considere nuevo. 3. Una vez realizada la toma de muestra, descartar inmediatamente los materiales usados en recipientes para ese fin. 4. Al momento de hacer la extracción colocarse los guantes, los cuales se mantendrán puestos durante todo el procedimiento. 5. Antes de iniciar la toma de muestra, tener TODO el material preparado. 6. Elegir una vena bien visible en el antebrazo, localizándola visualmente y por palpación. Colocar el lazo y volver a palpar la vena, indicarle al paciente que abra y cierre el puño para facilitar la extracción. 7. Una vez identificada la vena, limpiar el área circundante con algodón empapado en alcohol. Dejar secar. 8. En este momento se romperá el sello de garantía de la aguja, se la colocará en la jeringa sin tocar con los dedos, controlando el correcto funcionamiento del émbolo. 9. La aguja se insertará en la vena elegida con el bisel hacia arriba, dejando que la sangre fluya en la jeringa aspirando suavemente con el émbolo. La escala de la jeringa debe estar visible (hacia arriba). 10. Después de la toma, se le indica al paciente que abra la mano, se retira el torniquete y luego la aguja, presionando el lugar de la punción con un trozo de algodón seco. 11. LA AGUJA SE DESCARTARÁ EN EL CONTENEDOR DESTINADO PARA ESE FIN. 12. La sangre que está en la jeringa se descargará en los tubos o frascos que contienen los anticoagulantes correspondientes, evitando hacer espuma y homogeneizando inmediatamente por inversión suave. 13. Rotular los tubos o frascos con los datos del paciente. 14. En el sitio de la punción se pondrá un apósito después de controlar que no haya más sangrado. 15. La persona que hace la extracción deberá quitarse los guantes al finalizar la toma de muestra y desecharlos inmediatamente. NO REUTILIZARLOS. 16. Si hay algún dato que haya interferido con el procedimiento, aclararlo en el registro de muestras. 2 - Descripción de los anticoagulantes usados en Hematología Los anticoagulantes se utilizan para obtener plasma o muestras de sangre total para estudiar las características morfológicas y realizar los recuentos celulares. Deben intentar que las células sanguíneas a estudiar se encuentren en el estado más parecido al fisiológico. Para ello los anticoagulantes no deben alterar la morfología de los leucocitos, el tamaño eritrocitario, no 4
5 producir hemólisis e impedir la agregación plaquetaria, posibilitando al mismo tiempo el máximo período de conservación de la muestra (generalmente no más de 24 horas incluso refrigerada a 4 C). Los anticoagulantes más utilizados son: EDTA (C 10 H 16 N 2 O 8 ) o sal disódica, dipotásica o tripotásica del ácido etilendiaminotetraacético, actua mediante un efecto quelante sobre el calcio (Ca ++ ), impidiendo el proceso de la coagulación al fijarlo. ES EL ANTICOAGULANTE DE ELECCIÓN PARA HEMOGRAMA. Este anticoagulante se utiliza fundamentalmente para la realización de recuentos celulares, sobretodo en los autoanalizadores y permite además la realización del hematocrito y del frotis sanguíneo hasta dos horas después de la extracción de la muestra al mismo tiempo que impide la aglutinación de las plaquetas. Las sales de potasio tienen la ventaja, respecto a las de sodio, de ser más fácilmente solubles en sangre cuando las usamos a partir del producto sólido, sin embargo, las tres sales afectan el tamaño del eritrocito, especialmente después del almacenamiento de la sangre anticoagulada por espacio de algunas horas. El International Council for Standardization in Hematology (ICSH) recomienda la sal dipotásica como anticoagulante para recolectar muestras sanguíneas destinadas al recuento y caracterización del tamaño celular y especialmente cuando los valores del hematocrito se requieren para la calibración de los contadores automáticos. El K 2 EDTA. 2H 2 O posee un peso molecular relativo de 404,1g; 1g quela 100 mg de calcio iónico y el ph para una solución al 1% es de 4.8 ± 1,0. La cantidad de EDTA dihidratado agregada a la sangre debe ser de mg/ml. de sangre total. Esta cantidad es un compromiso entre la cantidad requerida para evitar la coagulación y la cantidad a la cual se producen las alteraciones celulares. Los productos habitualmente comercializados consisten en una solución equilibrada de sales sódicas y potásicas de EDTA (0,342 mol/l) ph 7,2, con estas la proporción recoemendad es 1/100 Ej: 10 μl de anticoagulante para 1 ml de sangre (990 μl estrictamente hablando). HEPARINA SÓDICA. HEPARINA DE LITIO, es un anticoagulante fisiológico que actúa impidiendo que la protrombina se transforme en trombina. Estructuralmente es un mucopolisacárido ácido. Los frotis realizados con muestras sanguíneas anticoaguladas con heparina producen en las tinciones panópticas un color azulado y una pseudovacuolización celular por lo tanto no se lo recomienda para tal fin. La proporción adecuada es de UI ( mg) de heparina por ml de sangre. CITRATO TRISÓDICO, C 6 H 5 O 7 Na 3, actúa impidiendo que el calcio se ionice, evitando así la coagulación. Se utiliza para realizar las pruebas de Hemostasia en una proporción sangre: anticoagulante 9+1 (Por Ej.:2,25 ml sangre con 250μL anticoagulante); así como para la velocidad de eritrosedimentación en una proporción sangre: anticoagulante 4+1 (Por Ej.: 2 ml sangre con 500 μl anticoagulante). ACD se emplea fundamentalmente en Bancos de Sangre para conservar las unidades de sangre y estudios metabólicos eritrocitarios por permitir una buena conservación de los hematíes. Se utiliza en una proporción de un volumen de ACD por cada cuatro volúmenes de sangre. La proporción de la mezcla del anticoagulante es de: Acido Cítrico 0.9 g, Citrato disódico 2 g, Dextrosa 2 g, H 2 O destilada 120 ml. 3 - Recuento de hematíes RECUENTO MANUAL: si bien resulta OBSOLETO para fines diagnósticos el detalle de soluciones y técnica puede ser aplicable en otras áreas. Consiste en hacer el recuento en una dilución de sangre entera anticoagulada. Es un método poco usado debido al elevado error que presenta. 5
6 Líquido diluyente: solución fisiológica o citrato de sodio 3,8%., o Solución de Hayem (HgCl 2 0,25%, Na 2 SO 4 2,5%, NaCl 0,5%) La dilución empleada es de 1/200, para lo cual se mide exactamente: Solución fisiológica o citratada: 3,98 ml Sangre: 0,02 ml El recuento se realiza en la cámara de Neubauer (40X) cuyo esquema es el siguiente: El recuento de hematíes se realiza en el cuadrado central, se eligen 5 de los cuadrados que se encuentran subdivididos en 16 cuadrados pequeños, como se muestra a continuación: Las líneas reforzadas, o triples, sirven únicamente como límites de cada cuadrado que contiene los 16 cuadrados pequeños. Se deben contar 5 de estos cuadrados. La superficie de este cuadrado es de 1 mm 2 y la cámara tiene una profundidad de 0,1 mm. Con la dilución indicada, luego de agitar adecuadamente, se carga la cámara y se cuentan los glóbulos rojos de los 80 cuadrados pequeños (zona sombreada). La cámara puede ser cargada con un capilar, evitando que queden burbujas y que la misma quede cargada uniformemente. 6
7 Considerando entonces, que el retículo tiene 400 cuadrados pequeños en total, el cálculo que se debe hacer es el siguiente: Donde: N x D x FC x ST = nº de glóbulos rojos/mm 3 TC N: número de eritrocitos contados. D: Título de la dilución realizada (200). FC: Factor de corrección de la profundidad, para llevar a 1 mm 3 (10). ST: Total de cuadrados pequeños en la superficie de 1 mm 2 (400). TC: Total de cuadrados pequeños contados. Causas de error en el recuento en cámara de Neubauer El recuento manual de eritrocitos tiene un error del 10%, el cual puede deberse a: 1. Errores de extracción: dilución o hemoconcentración. Coagulación parcial. Hemólisis. 2. Mala homogeneización por agitación insuficiente de la sangre. 3. Utilización de material mal calibrado, sucio o húmedo. 4. Falta de suficiente agitación de la sangre diluida. 5. Cámara de Neubauer mal ajustada, sucia o mojada. 6. Llenado incompleto de la cámara Neubauer. 7. Empleo de cubreobjetos deformable, no rígido. 8. Células mal distribuidas en el fondo de la cámara. 9. Errores del operador al realizar el recuento. 10. Errores al efectuar los cálculos. VALORES DE REFERENCIA Edad Sexo Intervalo de referencia Recién nacidos ambos 4,7x10 12 /L - 6,3x10 12 /L Niños (2-12 años) ambos 4,0x10 12 /L - 5,3x10 12 /L Adultos jóvenes (12-18 años) mujeres 4,1x10 12 /L - 5,1x10 12 /L varones 4,5x10 12 /L - 5,3x10 12 /L Adultos jóvenes (19-60 años) mujeres 4,1x10 12 /L - 5,2x10 12 /L varones 4,6x10 12 /L - 5,9x10 12 /L 4 - Hematocrito DEFINICION El hematocrito (Hto) es la relación existente entre el volumen de eritrocitos y el volumen total de sangre, expresado como porcentaje. Está directamente relacionado con la concentración de hemoglobina, por lo que su determinación constituye el procedimiento más simple para el diagnóstico de anemia (pero no el recomendado por la OMS). Así, un descenso del Hto es sugestivo de anemia, mientras que el aumento lo es de poliglobulia. El método de referencia para la determinación del Hto es la centrifugación de sangre total en tubo capilar (micrométodo), es una técnica sencilla, barata y accesible a laboratorios de baja complejidad. 7
8 En la actualidad, todos los autoanalizadores hematológicos suministran, dentro del contexto del hemograma automatizado, un valor de Hto que resulta de un cálculo electrónico a partir del Volumen Corpuscular Medio (obtenido por conductividad o campo oscuro) y la concentración de eritrocitos. Obviamente este valor obtenido electrónicamente difiere del obtenido por centrifugación en que no considera el efecto del plasma atrapado entre los eritrocitos ni el efecto de las restantes células sanguíneas, por lo que es siempre algo inferior (1-3 %). Tanto el Hto. obtenido por microcentrifugación o por métodos automatizados, son un buen parámetro del estado de la serie eritroide. El Hto refleja la concentración y no la masa total de glóbulos rojos. Por Ej., un paciente en estado de shock acompañado de hemoconcentración, el Hto. puede ser normal o alto, aún cuando la masa eritrocitaria total disminuye por la pérdida de sangre. Por lo tanto no es confiable como indicador de anemia poco después de una hemorragia o una transfusión. METODO MANUAL Micrométodo (microhematocrito) Es una técnica muy utilizada, por necesitar muy poca cantidad de sangre, muy sencilla y poderse realizar en gran número de muestras a la vez y en muy poco tiempo. Se utilizan tubos capilares de vidrio de 7 a 7,5 cm. de longitud por 1mm. de diámetro interno. Heparinizados o no, dependiendo del tipo de muestra (sangre entera anticoagulada o sangre capilar). Si se utiliza sangre capilar, se desechará la primera gota después de la punción. Se llena el tubo capilar hasta tres cuartas partes de su capacidad con la sangre (aproximadamente 50 L). El llenado de los tubos se realiza por capilaridad, favoreciendo el proceso inclinando el capilar hacia abajo a medida que se va llenando. Limpiar con papel o gasa el capilar y tapar el extremo limpio con plastilina o sellándolo a la llama del mechero. Una vez cerrados se colocan los capilares en la centrífuga con el extremo del capilar cerrado hacia fuera y de modo que quede perfectamente equilibrada. Se centrifugan durante cinco minutos a rpm. Tan pronto se detiene la centrífuga se extraen los capilares y se procede a su lectura. Esta se puede realizar con los lectores de hematocrito (ABACO), que nos darán el resultado directamente, o con una regla milimetrada, aplicando la siguiente regla de tres: A x: hematocrito en tanto por ciento B x A: longitud total B: longitud de la parte corpuscular La determinación del Hto debe realizarse por duplicado y la diferencia entre los dos valores obtenidos no debe ser nunca superior a 0,01%. Causas de error Las fugas de muestra al no quedar bien sellado los capilares producen una disminución en el valor, al perderse mayor proporción de células que de plasma. El uso de anticoagulantes líquidos provoca un error por dilución de la muestra En muestras capilares no descartar la primer gota, produce una mezcla con los líquidos tisulares que provoca hemodilución. En muestras de sangre venosa, el lazo colocado durante un cierto tiempo produce hemoconcentración. La lectura no inmediata de los capilares, provoca que el sedimento de hematíes vaya tomando forma de bisel si el capilar permanece en posición horizontal. 8
9 VALORES DE REFERENCIA ( x 2 DE) El valor de Hto varía con la edad y el sexo. Edad y sexo Hematocrito % Fracción Recién Nacidos ,54 0,1 Niños (hasta 10 años) ,38 0,05 Mujeres (18-50 años) ,42 0,05 Embarazadas ,39 0,05 Varones (18-50 años) ,45 0, Determinación de hemoglobina: método de la cianmetahemoglobina FUNDAMENTO Este método tiene como fundamento la transformación previa de la hemoglobina en cianmetahemoglobina (HiCN), que es muy estable y posee un color característico cuya absorbancia a 540 nm puede ser cuantificada comparándola con la de varias soluciones de concentraciones conocidas de hemoglobina preparadas a partir del patrón de referencia (curva de calibración). Los distintos compuestos de hemoglobina, excepto la sulfohemoglobina que casi nunca es significativa, se transforman en HiCN según el siguiente proceso: Hemoglobina + [K 3 Fe(CN) 6] metahemoglobina Metahemoglobina + [CNK] cianmetahemoglobina MATERIAL 1. Espectrofotómetro o fotocolorímetro: Estos instrumentos deben ser calibrados periódicamente mediante la solución patrón de HiCN, preparada de acuerdo a las especificaciones del International Committee for Standardization in Haematology (ICSH) 2. Tubos: 12 x 100 mm. 3. Sangre venosa total: anticoagulada con EDTA-Na 2 (1,5 mg/ml) o con heparina (10 UI/ml). Puede emplearse sangre capilar. 4. Pipetas volumétricas: de vidrio y de 5 ml. 5. Pipetas automáticas: de 20 L, debidamente calibradas. 6. Reactivo de Cianmetahemoglobina: Composición (ph 7-7,4) Ferricianuro potásico [K 3 Fe(CN) 6] Cianuro potásico [CNK] Fosfato monopotásico [KH 2 PO 4 ] Detergente no iónico* Agua destilada hasta 200 mg 50 mg 140 mg 1 ml 1000 ml Detergentes no iónicos: Tritón X-100, Nonic 218, Nonidet/40, Quolac Nic 218. El detergente no iónico facilita la solubilización de proteínas insolubles y acelera la transformación de la hemoglobina en HiCN, de forma que aquella se completa en 3 min. Este reactivo debe tener un color amarillo pálido, ser completamente transparente y tener un 9
10 ph entre 7 y 7,4. La lectura de absorbancia a 540 nm utilizando agua destilada como blanco debe ser igual a cero. Para su conservación utilizar botellas de vidrio de borosilicato opacas y mantener a temperatura ambiente (el frío modifica el color del reactivo). 7. Patrón de referencia (solución comercial): Es una solución de HiCN cuya absorbancia corresponde a una determinada concentración de hemoglobina. Todo patrón de HiCN debe cumplir las especificaciones del llamado patrón primario de HiCN. METODO Se determinará la concentración de Hemoglobina de una muestra problema siguiendo los pasos detallados a continuación: 1. Conectar el espectrofotómetro. 2. Homogeneizar bien la sangre mediante agitación suave con un sistema automático (rodillos/disco giratorio) durante un tiempo mínimo de 5 min o manualmente por inversión del tubo 3 veces. 3. Pipetear (CON PROPIPETA) 5 ml de reactivo de Drabkin en un tubo de ensayo limpio. 4. Mediante la micropipeta añadir 20 l de sangre homogeneizada al tubo que contiene 5 ml de reactivo de Drabkin. Al realizar esta operación, es fundamental eliminar el exceso de sangre que pueda quedar en las paredes externas del capilar antes de introducirlo en el reactivo y procurar asimismo que no quede sangre adherida a las paredes internas de la pipeta. 5. Agitar el tubo mediante inversión (4 o 5 veces) con el fin de conseguir homogeneizar bien la mezcla sangre-reactivo y esperar un mínimo de 5 min para que se produzca la hemólisis total y se complete la transformación de toda la hemoglobina en cianmetahemoglobina. 6. Leer la A de la solución a 540 nm, utilizando agua destilada como blanco. 7. Para calcular la concentración de hemoglobina es recomendable disponer de una curva de calibración. Curva de calibración de hemoglobina Se toma un Kit. de calibración con estándar de CC. Normal, de una CC. Alta y otro de una CC.baja, y se miden las absorbancia de cada una de ellas o se toma un Standard de CC. conocida y se hacen diluciones mayores y menores que el normal y se miden las absorbancia y se determina un factor que es el promedio de las tres diluciones. Teniendo que A=ɛ. b. C y como b=1 cm => A/ ɛ = C para facilitar el calculo A. (1/ ɛ) = C donde (1/ ɛ)= F y es la inversa de la pendiente de la curva tendremos que C= F. A. Dicho en otras palabras la recta se ajusta a una ecuación del tipo y=ax+b. Grafico: De esta manera controlo: La linealidad del equipo El deterioro que sufre el reactivo 10
11 Puedo trabajar con un estándar diario, procesado por cada operador que realiza la determinación de hemoglobina, como si fuese una muestra más y determino el factor del estándar. Procesando un estándar todos los días: CONTROLO EL DETERIORO QUE PUEDE SUFRIR EL REACTIVO DESDE EL DIA QUE SE LO PREPARO Y SE REALIZÓ LA CURVA. CONTROLO EL FACTOR HUMANO CAMBIOS EN LA TENSIÓN DE LA RED O DESGASTE DE LA LÁMPARA DEL FOTOCOLORÍMETRO Causas de error en la determinación de la concentración de hemoglobina La determinación de hemoglobina está sometida a posibles errores que deben ser tenidos en cuenta. Algunos de ellos obedecen a características peculiares del espécimen como la presencia de hiperlipemia o leucitocitosis intensa ( 50 x 10 9 /l). No obstante, la mayoría de las veces los errores se deben a defectos técnicos en la manipulación y el análisis del espécimen. Errores en la obtención del espécimen de sangre: 1. Errores de extracción 2. Empleo de anticoagulantes no recomendados 3. Coagulación parcial de la sangre Errores de la dilución: 1. Empleo de pipetas automáticas descalibradas u otras pipetas sucias o húmedas 2. No eliminación del exceso de sangre adherida a las paredes externas del capilar antes de introducirlo en el reactivo 3. Dilución incompleta de la sangre en el reactivo Errores de la transformación de la hemoglobina en HiCN: 1. Empleo de reactivo de Drabkin mal preparado o vencido 2. Lectura antes del tiempo necesario para la completa transformación de la Hb en HiCN Errores de la determinación: 1. Empleo de instrumentos no calibrados 2. Cubetas sucias o deterioradas 3. Soluciones turbias de HiCN Errores en la conservación del reactivo: 1. Congelación del reactivo, lo que produce transformación de K 3 Fe(CN) 6 en K 4 Fe(CN) 6 y una oxidación parcial de la Hb. Conservación del reactivo en botellas de polietileno: se pierden grupos CN con formación exclusiva de metahemoglobina, en vez de HiCN, con lo que los valores de concentración de Hb obtenidos son inferiores a los reales. 11
12 6 - Velocidad de sedimentación globular (VSG) o Eritrosedimentación FUNDAMENTO El test de velocidad de sedimentación globular (VSG) mide la sedimentación de eritrocitos en su plasma nativo. VSG es un test no específico que puede ser utilizado para detectar un amplio rango de enfermedades y para monitorear el curso evolutivo de ciertas enfermedades crónicas como los procesos inflamatorios crónicos (artritis reumatoidea, polimialgia reumática y tuberculosis) o la respuesta a la terapia, por ejemplo con citostáticos (enfermedad de Hodgkin, linfomas y mieloma múltiple). Sin embargo en ocasiones cuadros tan graves como neoplasias y la cirrosis pueden presentar una VSG normal. Constituye uno de los tests más utilizados como screening en el laboratorio clínico. Se trata de un método sencillo para realizar y que requiere equipamiento simple. MECANISMO El mecanismo por el cual se produce la eritrosedimentación no está completamente dilucidado, pero parece obedecer a interacciones electrostáticas entre la superficie de los GR y diversas proteínas del plasma que favorecen (fibrinógeno y globulinas) o disminuyen (albúmina) la agregabilidad de estas células. Desde el punto de vista físico, este fenómeno depende de los siguientes factores: a. Tamaño de los GR b. Diferencia de densidad entre los eritrocitos y el plasma, c. Viscosidad del plasma. d. Temperatura. Estos factores se hallan relacionados entre sí a través de la ley de Stokes si se considera al GR como una esfera suspendida en un medio infinito (relación entre la resistencia R que encuentra una partícula esférica de radio r al desplazarse en el seno de un fluido de viscosidad a una velocidad v: R = 6 vr La sedimentación ocurre en 3 etapas: 1) una etapa en que se produce la aglutinación de los GR con formación de agregados en forma de "pilas de monedas", 2) un período durante el cual los agregados de GR sedimentan a velocidad constante, y 3) una etapa final donde la velocidad de sedimentación se hace más lenta al mismo tiempo que los GR se acumulan en el fondo del recipiente. La etapa más importante es la primera o de aglutinación, ya que de ella dependerá la velocidad de todo el proceso. Así, cuanto más pequeño sean los agregados, más lentamente se producirá la sedimentación y viceversa. Dado que, como se mencionó más arriba, el test también está influenciado por la forma y el tamaño de los GR, éste resulta poco confiable como un índice de enfermedad en la anemia falciforme o cuando hay una marcada poiquilocitosis. La velocidad de sedimentación se incrementa por las altas concentraciones de fibrinógeno y otras proteínas de fase aguda e inmunoglobulinas. La albúmina retarda la VSG. El mecanismo por el cual el fibrinógeno y las globulinas facilitan la aglutinación de GR no se conoce fehacientemente aunque se cree que actúan disminuyendo la fuerza de repulsión que normalmente existe entre GR debido a su carga superficial o potencial zeta. El potencial zeta es producido por una intensa carga negativa a nivel de la superficie de los GR, lo que explica que 12
13 estas células se mantengan separadas. La intensidad del potencial zeta depende en gran medida de la composición proteica del plasma y especialmente de la relación entre las concentraciones de albúmina, globulinas y fibrinógeno. Así, mientras la albúmina tiende a aumentar el potencial zeta, las globulinas y sobre todo el fibrinógeno tienden a disminuirlo. Ello obedece a que tanto el fibrinógeno como las globulinas tienen un mayor peso molecular y una conformación menos esférica que la albúmina, lo que aumenta la constante dieléctrica del plasma y reduce el potencial zeta eritrocitario. La disminución del potencial zeta de los GR tiene como consecuencia una mayor tendencia de éstos a agregarse y formar las llamadas pilas de moneda. De acuerdo con este mecanismo, el valor normal de la VSG resulta del equilibrio entre las principales proteínas plasmáticas. METODOLOGIA Existen dos métodos comúnmente utilizados para medir la VSG: el método de Westergren y el método de Wintrobe. Ambos métodos poseen limitaciones. El método de Westergren es menos sensible a pequeños aumentos de los factores que causan la sedimentación de los GR y así puede ser levemente menos confiable como un procedimiento de screening. El método de Wintrobe, por el otro lado, puede dar lecturas bajas incorrectas cuando la VSG Westergren es marcadamente elevada. Ambos métodos son altamente sensitivos a la relación entre el plasma y los GR en la muestra, y un bajo hematocrito causa un aumento no específico de la VSG probablemente acelerando la agregación y reduciendo las fuerzas de fricción entre los agregados en sedimentación. Se trataron de aplicar factores de corrección para anemias, pero no resultaron confiables. Tradicionalmente, la VSG se ha determinado más frecuentemente por el método de Westergren que fue propuesto como método de referencia por el International Council for Standardization in Hematology (ICSH). Durante los últimos años, han aparecido sistemas semiautomáticos para medir la VSG que emplean soportes especiales y pipetas de material plástico desechable. Estos sistemas, aunque reproducen exactamente el método de Westergren, se diferencian de éste por su carácter cerrado (recogida de los especímenes en tubos al vacío que incorporan una cantidad precisa de anticoagulante) y por el empleo de material complementario (bombas aspirativas) que aumentan la rapidez y precisión del llenado de las pipetas. MÉTODO DE WESTERGREN Es el método de referencia para medir la VSG. Sin embargo, continua siendo un método poco reproducible y sometido a diversas variables difíciles de controlar, como es la necesidad de prediluir la sangre. A. MATERIALES. A.1 Anticoagulante Si utiliza citrato trisódico dihidratado (Na 3 C 6 H 5 O 7.2H 2 O) en solución acuosa 32,08 g/l. Proporción 4+1 (sangre + anticoagulante). A.2 Tubo de sedimentación Se utilizan tubos de vidrio especialmente diseñados de una longitud de mm y de un diámetro de mm. El diámetro del tubo debe ser uniforme ( mm) todo a lo largo del tubo y éste debe poseer una escala graduada con exactitud en mm numerada de
14 mm en el fondo hasta 0 mm. Los tubos estandarizados que cumplen las especificaciones de ICSH deben aprobados por Comités de Estandarización en los diferentes países. Los tubos deben ser cuidadosamente limpiados en acetona-agua. No se recomienda el uso de detergentes o dicromatos para la limpieza. Tubos plásticos descartables: Se fabrican tubos plásticos descartables según las especificaciones, los cuales son provistos limpios y secos por el fabricante. Algunos plásticos resultan inadecuados pues unen GR siendo así más susceptibles a los problemas de taponamiento. Otros tubos plásticos se manufacturan recubiertos de agentes que eliminan hongos o contienen componentes que interactuan con la sangre. A.3 Gradillas Las gradillas o dispositivos de sostén están diseñados para sostener los tubos en una posición vertical inmóvil. Un dispositivo de burbuja niveladora debe formar parte integral de la gradilla para asegurar que la posición de los tubos sea vertical dentro de un límite de 1. La misma debe estar construida de modo tal que no existan pérdidas de sangre cuando el tubo está colocado en ella. B. TÉCNICA A) La sangre se obtiene por punción venosa, evitando contaminación con materiales utilizados para la higiene de la piel. La sangre se agrega en proporción de 4 Vol de sangre a 1 Vol de solución de citrato de sodio, por ejemplo 2 ml de sangre en 0,5 ml de anticoagulante. El test debe ser realizado dentro de las 2 hs si la sangre es mantenida a temperatura ambiente, o dentro de las 6 hs. si es mantenida a 4 C. B) Si la sangre citratada se equilibra a temperatura ambiente, se mezcla por inversión repetidas veces, y se sumerge un tubo de Westergren en la muestra dejando que la sangre ascienda por capilaridad. El nivel de la sangre se ajusta a cero. C) El tubo es colocado en la gradilla en posición estrictamente vertical a temperatura ambiente (18-25 C), sin exposición a la luz del sol directa, libre de vibraciones y corrientes de aire, manteniéndolo exactamente 60 min. D) Una vez transcurrido el tiempo, se lee la distancia entre la superficie del menisco de la columna eritrocitaria y la parte superior de la columna de sangre situada a nivel de la marca cero de la escala graduada. El valor de esta distancia, expresado en mm, corresponde al de la VSG durante la primera hora (mm/hora). C. VALORES DE REFERENCIA EDAD (años) Valores de Límite superior de referencia (mm) la normalidad Niños mayores y a jóvenes Varones adultos ± ± ± 4 14 Mujeres adultas ± ± ±
15 Factores técnicos capaces de modificar la VSG Causas de aumento Desviación de verticalidad de la pipeta Incremento de la longitud y el diámetro de la pipeta Elevación de la temperatura ambiente Dilución de la sangre Causas de disminución: Reducción del diámetro de la pipeta Utilización tardía de la sangre (especimen envejecido) Cambio de anticoagulante D. INTERPRETACION DE RESULTADOS Los valores de referencia de la VSG se expresan exclusivamente en mm/h y varían fundamentalmente con el sexo y en cierto grado también con la edad (ver valores de referencia), el ciclo menstrual, y las medicaciones (corticosteroides, contraconceptivos orales, etc.) La VSG no parece estar influenciada por las ingestas o por los ritmos circadianos. Las determinaciones de la VSG a la segunda hora o a las 24 hs, muy utilizadas anteriormente, han demostrado ser poco fiables y de escasa significación clínica, por lo que no se recomienda su empleo. Existen numerosas patologías con alteraciones proteicas del plasma que cursan con modificaciones del valor de VSG. Se observan aumentos de VSG en un amplio espectro de enfermedades principalmente relacionadas a las proteínas de fase aguda, y también en el embarazo normal y el puerperio. Un 10% de los niños normales también presentan VSG aumentadas. La VSG es especialmente baja (0-1 mm) en la policitemia, vera anormalidades de GR (hemoglobinopatías, esferocitosis hereditaria, anemia falciforme, etc.), hipofibrinogenemia, defectos cardíacos congestivos, y ocasionalmente sin causa aparente. Además de estas condiciones que pueden tender a ocultar una alta VSG, es inusual obtener falsos negativos, por ende, un valor normal de VSG generalmente asegura que no existe enfermedad orgánica. Para muestras pediátricas o cuando el volumen a obtener será escaso se puede utilizar las pipetas de Chattas, estas requieren un volumen de sangre mucho menor (40 μl), la técnica se realiza de la misma manera pero los resultados deben ser corregidos utilizando un nomograma o tabla para conversión. 15
16 NOMOGRAMA DE CHATTAS Chattas (mm) Westergren (mm) Chattas (mm) Westergren (mm) Chattas (mm) Westergren (mm) 1 a 10 1 a > > > > > > OBTENCIÓN DEL FROTIS DE SANGRE Sobre un portaobjetos perfectamente limpio, se coloca en un extremo una gota pequeña de sangre (1-2 mm) recién obtenida, ya se trate de punción digital, o del talón (en pediatría) o de la última gota de sangre extraída con la jeringa y que se encuentra en la luz de la aguja. Evitar usar sangre con anticoagulantes porque altera la morfología de las células. Por medio de otro portaobjetos de borde pulido y al cual se le ha quitado los ángulos (extensor), se realiza la extensión de la gota de sangre: conservando un ángulo menor de 45 respecto al portaobjetos horizontal, el extensor se apoya delante de la gota de sangre y retrocediendo hasta tocarla, una vez que la misma se extiende a lo largo del borde de contacto por capilaridad, se avanza con firmeza y no muy rápidamente. Así se obtiene una fina película de sangre que representa integralmente a la gota de sangre que se extiende. Secar rápidamente el extendido al aire para evitar el deterioro de las células. Un extendido así obtenido poseerá tres áreas de diferente espesor y con distribución también distinta de leucocitos: 1. Zona excesivamente gruesa: Se encuentra en la región inmediata al punto de partida de la extensión (cabeza). En ella hay siempre un aumento del número de linfocitos. 2. Zona excesivamente fina: Corresponde al final de la extensión (cola) y en ésta se observa un exceso de granulocitos y monocitos. 3. Zona ideal: Región central (cuerpo), en ella hay un reparto equilibrado de las células. 16
17 1 3 2 Para que un frotis sea valido: 1) No debe ser demasiado grueso (los elementos estarán retenidos y no serán identificados. 2) No debe ser demasiado delgado (será muy pobre en elementos lo que impediría una lectura conveniente). 3) No debe alcanzar los bordes ni las extremidades del porta (se perderían los elementos mas voluminosos). La gota debe agotarse sobre el porta. 4) No debe presentar agujeros (utilización de portas mal desengrasados) ni estrías o flecos (provocados por un extensor de bordes no esmerilados, irregulares). Conviene elegir el extensor observando sus bordes en el microscopio para asegurarse de que sean bien lisos. 5) Debe ser regular (si no, el reparto de elementos es heterogéneo y por tanto el recuento variara según los campos examinados). 6) Debe ser secado correctamente (un secado defectuoso produce artefactos: hematíes festoneados por ejemplo). Existen algunas sutilezas que es necesario cuidar: El tamaño de la gota debe ser el adecuado y esto lo enseñara la experiencia. Si ha caído un exceso de gota limpiar el porta con gasa o algodón. Repetir el procedimiento las veces que sea necesario hasta que la cantidad de sangre sea la adecuada. Si tuvieran que elegir entre un extendido largo, y uno corto, es preferible el segundo, pero lo ideal es que ocupe ¾ partes de la lamina. Se prefieren en general los frotis delgados pero el excesivamente fino tiene muchos inconvenientes: los hematíes aparecen poligonales con su claridad central desaparecida, las plaquetas se destruyen y los leucocitos resultan rotos o distorsionados. Nunca debe llevarse la gota de sangre por delante del extensor porque produciría erosión de las células. Un buen frotis debe constar de una zona inicial gruesa (cabeza), una zona central mediana (espesor ideal para la lectura) y la cola delgada terminada suavemente en un borde convexo sin estrías prolongadas que hablan de un extensor defectuoso. Un buen extendido luce como una pincelada sobre el vidrio. Aun cuando el frotis sea ideal y el reparto homogéneo no se puede evitar una cierta segregación de los elementos. Los linfocitos (mas pequeños) predominan en el centro de la extensión. Los polimorfonucleares y los monocitos son atraídos hacia los bordes y cola. FROTIS ARRASTRADOS: todos los elementos están en la cola. Deben rechazarse para la formula. Defectos observados en frotis con sangre anticoagulada: 1) Impide agrupación de plaquetas. 2) Los núcleos de los monocitos aparecen como con lóbulos, inclusive pueden estar desintegrados o coloreados más homogeneamente, más compactos que con sangre fresca, el citoplasma puede aparecer vacuolado. Importante: Lavar y secar bien el extensor entre una y otra extensión Los portas nuevos deben ser desengrasados con agua jabonosa, enjuagados minuciosamente. 17
18 8-COLORACIÓN DEL FROTIS DE SANGRE La coloración se realiza por el método de May Grünwald-Giemsa. Fundamento Prácticamente todos los métodos empleados para teñir las células de la sangre se basan en el empleo de una mezcla de eosina y azul de metileno. Estos colorantes son muy sensibles a las variaciones de ph de las diferentes estructuras celulares, de modo que las que tienen carácter básico fijan en mayor medida la eosina (colorante ácido), mientras que las que poseen propiedades ácidas fijan principalmente el azul de metileno (colorante básico). Esto explica que ciertas estructuras basófilas presentes en el núcleo (nucléolo) o en el citoplasma (ribosomas) se coloreen de azul, mientras que otros componentes acidófilos como la hemoglobina adquieren color rosado. De esta manera, la diferente afinidad de ciertas granulaciones citoplasmáticas por dichos colorantes permite clasificar los leucocitos polimorfonucleares en: neutrófilos, en los que la granulación específica posee compuestos neutros que fijan ambos colorantes simultáneamente, resultando en un color pardo; eosinófilos, en los que la granulación específica contiene sustancias de intenso carácter básico que fijan fundamentalmente los colorantes ácidos, dando un color rojo-naranja; y los basófilos, cuya granulación específica posee sustancias de carácter ácido, que fijan colorantes básicos dando un color azul oscuro. Reactivos Solución May Grünwald : eosinato de azul de metileno en metanol. Solución Giemsa: azul de metileno (clorhidrato de tetrametiltionina), su derivado oxidado en medio alcalino: el azur II, y eosina (tetrabromofluoresceína). Método Cubrir el frotis de sangre seco con solución May Grünwald. Dejar 3 minutos. A continuación, agregar buffer fosfato ph 6.8 o una mezcla de agua de canilla con agua destilada en partes iguales, en proporción igual a la de colorante. Homogeneizar soplando suavemente con una pipeta o moviendo el portaobjetos con un movimiento de vaivén. Dejar 3-5 minutos. Volcar, enjuagar bajo chorro de canilla suave y cubrir el preparado con una solución de Giemsa, obtenida a razón de dos gotas del colorante por ml de agua (1/10). Dejar minutos. Lavar con agua, limpiar la cara inferior del portaobjeto con un algodón y secar al aire. 18
19 TRABAJO PRÁCTICO N 2 HEMOGRAMA 2 (FÓRMULA NORMAL, RECUENTO DE GB) Objetivos generales -Familiarizarse con el uso de la cámara de Neubauer -Adquirir destreza en la preparación de diluciones y manejo de muestras de sangre entera -Adquirir destreza en el manejo del microscopio y la cámara de Neubauer para el recuento de glóbulos blancos -Delinear los criterios para la identificación de glóbulos blancos en preparados coloreados con MGG -Realizar fórmulas leucocitarias en muestras de pacientes sanos -Interpretación y validación de resultados 1- RECUENTO DE LEUCOCITOS Método manual 1) Agregar 20 l de sangre anticoagulada a un tubo de Kahn conteniendo 0,38 ml de solución de Türk. Esta solución contiene acido acético al 1 % en agua destilada y el agregado de una punta de espátula de azul de metileno. DILUCION 1/20 2) Homogeneizar la mezcla. 3) Cargar la cámara de recuento 4) Ubicar el reticulado de la cámara con bajo aumento (10X), constatar la ausencia de burbujas y que la distribución sea regular. 5) Proceder al recuento de los elementos presentes en los cuadrados angulares grandes (4) de la cámara. Las cuentas de los cuatro cuadrados no deben diferir entre sí en más del 20%. En caso contrario debe cargarse nuevamente la cámara. 19
20 La lectura se realiza en los cuatro campos L. Además de los leucocitos contados dentro de cada uno de los cuadrantes, se deben contar todos los leucocitos adheridos en la línea horizontal superior y vertical exterior, o de lo contrario, todos los leucocitos adheridos a la línea horizontal inferior y vertical interior. Si el valor obtenido (leucocitos/mm 3 de sangre) es menor de 2500, se practica nuevamente el recuento empleando una dilución 1:10. Si por el contrario el número resulta notablemente elevado se emplean diluciones 1:100 o 1:200. 6) Cálculo: m x 10 x d n = N de leucocitos/ mm 3 Donde: m=número de leucocitos contados en n (4) cuadrados de 1 mm de superficie y d=dilución utilizada, n= número de cuadrantes contados. Valores de referencia Adultos / mm 3 Recién nacidos / mm 3 Niños de 1 año / mm 3 Niños de 4 a 7 años / mm 3 Niños de 8 a 12 años / mm 3 2- DETERMINACIÓN DE LA FÓRMULA LEUCOCITARIA: RECUENTO DIFERENCIAL DE LEUCOCITOS En todo frotis coloreado con M.G.G. debe colocarse una delgada capa de aceite de inmersión, aun para el pequeño aumento a seco. Si no se cumple este requisito la refringencia de los elementos impide una buena observación. Para esto es suficiente depositar una gota en un extremo, aplicar de plano sobre ella otro portaobjetos que puede contener otro extendido en cuyo caso se harán coincidir ambas caras que los contengan y desplazarlos suavemente unos contra otros. La observación debe hacerse al principio de manera panorámica con objetivo de 10X para ver la dispersión de los elementos. Con este aumento se observaran la presencia de células grandes como los linfocitos hiperbasofilos de la mononucleosis. Por ello debe evitarse la tendencia a usar e comienzo la inmersión. Luego se pasa a 40 X aumento que resulta útil para evaluar alteraciones de tamaño de los glóbulos rojos y finalmente se pasa a 100X para el recuento diferencial de los glóbulos blancos y para la observación detallada de los elementos sanguíneos. Un extendido correctamente realizado poseerá tres áreas de diferente espesor y con distribución también distinta de leucocitos: 1. Zona excesivamente gruesa: Se encuentra en la región inmediata al punto de partida de la extensión (cabeza). En ella hay siempre un aumento del número de linfocitos. 2. Zona excesivamente fina: Corresponde al final de la extensión (cola) y en ésta se observa un exceso de granulocitos y monocitos. 3. Zona ideal: Región central (cuerpo antes de la cola), en ella hay un reparto equilibrado de las células. 20
21 Formas de recorrer el preparado Contar por lo menos 100 leucocitos anotando la cantidad de cada uno de ellos para establecer los porcentajes. Refiriendo al valor de recuento de glóbulos blancos se puede expresar cada tipo de leucocitos en valores absolutos por mm3 de sangre. Siempre que sea posible se deben contar 100 elementos, recordar que se está haciendo una estimación porcentual de las poblaciones, el recuento de 100 elementos resulta relativamente sencillo en pacientes con valores absolutos de GB dentro de los valores de referencia. Distinto es el caso de pacientes leucopénicos con recuento bajos por ej: 1500 GB / mm 3 en estos casos resultará muy tedioso llegar a encontrar 100 elementos para poder expresar en %, por ello es aconsejable expresar literalmente lo que se vió al observar el preparado por ej: se realiza la fórmula leucocitaria en un paciente leucopénico y solo se logró contar 80 elementos ( pueden ser 70, 90 dependiendo del tiempo utilizado y del grado de leucopenia del paciente) entonces lo aconsejable es expresar los resultados de la siguiente manera: DE 80 ELEMENTOS CONTADOS x son Neutrófilos, y son eosinófilos, z son linfocitos, etc, etc, es decir se expresa cuantos elementos de cada serie se observó en el total de GB contados Y NO EN PORCENTAJE! FORMULA LEUCOCITARIA EN ADULTOS SANOS LEUCOCITOS (%) ABSOLUTO (cel / mm 3 ) CAYADOS 0 2% NEUTROFILOS SEGMENTADOS % EOSINOFILOS 1 4 % BASOFILOS 0 1 % LINFOCITOS % MONOCITOS 4 8 % No hay variación de la fórmula según el sexo, pero sí según la edad. Nacimiento: 70% de neutrófilos. Primera semana: 50% de neutrófilos y 50% de linfocitos. Segunda semana: 65% de linfocitos y 25% de neutrófilos3-4 años: 50% de linfocitos y 50% de neutrófilos años: valores de referencia del adulto. Descripción de cada uno de los elementos que componen una fórmula normal 1. Neutrófilos: Núcleo lobulado (2-5 lóbulos). Los lóbulos están unidos entre sí por filamentos cromatínicos muy delgados. La cromatina es condensada. Es una célula terminal. Mide aproximadamente 12 m. El citoplasma es abundante y rosado, cubierto por una granulación fina específica de color pardo rojiza. 21
22 2. Eosinófilos: Mide aproximadamente 13 m. El núcleo es segmentado, con predominio del bisegmentado en forma de anteojo aunque pueden aparecer con más lóbulos. El citoplasma es abundante y está cubierto de granulaciones esféricas de mayor tamaño que las del neutrófilo y que se colorean de anaranjado. 3. Basófilos: Mide aproximadamente 10 m. El núcleo está irregularmente lobulado. La cromatina es densa. La masa nuclear es voluminosa con relación al citoplasma. Las granulaciones son groseras y muy irregulares en forma y tamaño pudiendo quedar superpuestas al núcleo, cubriéndolo parcialmente. 4. Linfocitos: Es una célula generalmente pequeña (7 m), pero puede llegar hasta 12 m. La forma más pequeña posee sólo un escaso anillo de citoplasma color celeste. Alrededor de un 10% de los linfocitos circulantes son células más grandes y con citoplasma más abundante. El núcleo por lo general es redondo, pero puede tener una escotadura. La cromatina es densa. Monocito: Es el leucocito normal de mayor tamaño (18-24 m). El núcleo presenta forma irregular y variada, la cromatina se esponjosa. La proporción núcleo-citoplasma es aproximadamente semejante. El citoplasma se tiñe de celeste plomizo y no presenta granulaciones. 22
23 TRABAJO PRÁCTICO N 3: ELEMETOS SANGUÍNEOS NORMALES Y PATOLÓGICOS ALTERACIONES DE LA SERIE BLANCA Objetivos Generales -Identificar los diferentes elementos sanguíneos normales y patológicos -Desarrollar criterios para la clasificación de elementos patológicos -Correlacionar los elementos encontrados con diferentes patologías y datos de contador hematológico. GLOBULOS ROJOS: PROERITROBLASTO (1): Célula voluminosa (20-30 um. de diámetro) Núcleo: ocupa la mayor parte de la célula. Cromatina con aspecto de esponja uno o dos nucleolos teñidos de rosa por el giemsa. Citoplasma: intensamente basófilo por el gran contenido de ARN. Presenta sobre uno de los costados del núcleo una formación redondeada que se destaca por su coloración rosada: el arcoplasma que corresponde al APARATO DE GOLGI y CENTRO CELULAR. Hay numerosos ribosomas. Escasos organoides membranosos, excepto mitocondrias. ERITROBLASTO BASOFILO (1): Tamaño: menor (15-18 um.) Núcleo: menor tamaño nuclear. Desaparición de los nucleolos. Cromatina condensada en grumos. Citoplasma: intensamente basófilo. El halo perinuclear es menos notorio. Contiene mitocondrias. Ferritina en mayor cantidad formando acumulos. 23
24 ERITROBLASTO POLICROMATÓFILO (2): Tamaño: se sigue reduciendo um. Núcleo: menor tamaño, se va condensando la cromatina. Citoplasma: comienza a cargarse de un tinte lilaceo, debido a la superposición de la basofilia ribosómica con la acidofilia de la hemoglobina. A medida que los estadios progresan predominan los tintes rojizos sobre los azulados. Presentan mitocondrias donde se metaboliza el HEM. Ferritina en acumulos groseros (siderosomas). ERITROBLASTO ORTOCROMÁTICO (2): Perdió la capacidad de división. Tamaño: alrededor de 10 um. Núcleo: picnotico, retraído. Citoplasma: acidofilo (rosado).menos mitocondrias y ribosomas. Gran cantidad de siderosomas. RETICULOCITO: Es la célula anterior que ha perdido el núcleo por expulsión o lisis (aunque se acepta más lo primero). Contiene todavía algunos ribosomas y mitocondrias. En un extendido coloreado con Giemsa aparece de tamaño algo mayor que el glóbulo rojo maduro y con una ligera policromatofilia. Pero con una coloración supravital (colorea los elementos vivos, fuera del organismo) el colorante precipita los ribosomas, formando una sustancia retículo-filamentosa, que toma distintos aspectos según la cantidad de ARN que contienen, siendo los mas maduros aquellos que contienen menos ARN. GLOBULO ROJO MADURO, ERITROCITO O HEMATIE: Es un residuo celular desprovisto de núcleo en todos los mamíferos. Forma: disco bicóncavo. Diámetro: 7,5 um. Esta recubierto por una membrana cuya estructura responde al modelo de mosaico fluido, al igual que todas las unidades de membrana biológicas. Tiene forma de disco bicóncavo 24
25 GRANULOPOYESIS: Durante la maduración de la serie granulocítica se suceden una serie de cambios morfológicos que consisten en la desaparición de los nucléolos, la reducción de la relación núcleo/citoplasma, la condensación de la cromatina, la desaparición de la basofilia citoplasmática, la aparición de las granulaciones primarias o azurófilas en el estadio de promielocito y de las secundarias o específicas a partir del estadio de mielocito. Por último en esta serie de cambios morfológicos se va a comenzar a producir la segmentación nuclear que se puede apreciar en el metamielocito, para dar origen al polimorfonuclear en banda o cayado y por último a la célula más madura de esta serie, el polimorfonuclear segmentado. MIELOBLASTO: Elemento iniciador de la progenie. Tamaño: aproxim. 20 um. Núcleo: de gran tamaño, ocupa casi toda la célula, con una fina membrana nuclear lisa y delgada y una cromatina muy fina, muy delicada que no hace condensación cerca de la membrana nuclear. Suele tomar el aspecto de una red o tamiz. Contiene uno o dos NUCLEOLOS. Citoplasma: se colorea de celeste claro, es apenas un halo alrededor del núcleo tan voluminoso. Con el microscopio común no se observan granulaciones. Sin embargo el microscopio electrónico detecta la presencia de lisosomas que en otras etapas van a constituir las granulaciones inespecíficas. PROMIELOCITO: Tamaño: mayor que el anterior (25-30 um.) Núcleo: grande, pero la relación núcleo citoplasma es menor. Puede ser redondo u ovalada, generalmente es excéntrico. La cromatina todavía es laxa, aunque algo menos que en el anterior. Presenta NUCLEOLOS. Citoplasma: presenta una zona clara perinuclear llamada arcoplasma (corresponde a la zona del complejo de golgi y centro celular). Sigue siendo basófilo y ya son visibles con el microscopio óptico numerosas granulaciones inespecíficas (se llaman así porque no permite identificar a la célula como precursora de neutrofilo-eosinofilo-basófilo). Tambien son llamadas primarias. Contienen enzimas y la más características es a mieloperoxidasa. Los gránulos primarios son lisosomas rodeados por lo tanto de unidades de membrana. 25
26 MIELOCITO (1): Tamaño: um. Núcleo: ya no muestra NUCLEOLOS. La cromatina comienza a mostrar condensaciones. Citoplasma: es todavía basófilo, pero además de las granulaciones primarias presenta en la zona del arcoplasma, granulaciones específicas que permiten hablar de mielocito neutrofilo-eosinofilobasófilo según el contenido de sus gránulos específicos o secundarios. El mielocito es el último elemento en el cual se presenta división. METAMIELOCITO: Tamaño: algo menor que el mielocito. Núcleo: de forma arriñonada con cromatina en forma parcelada, mostrando zonas condensadas. No presenta nucleolos. Citoplasma: policromatofilo (intermedio entre azul y rosado). Predominan las granulaciones específicas. Las granulaciones primarias son escasas y van poco a poco perdiendo su coloracion. GRANULOCITO EN BANDA O CAYADO: Tamaño: menor que el metamielocito. Núcleo: en forma de C (bastón o cayado) S o en una banda. Con cromatina condensada, disposición parcelada. Citoplasma: acidofilo (rosado) con granulaciones específicas o secundarias. Las granulaciones primarias ya no son visibles al microscopio común. De acuerdo a los gránulos que presenta será neutrofilo, eosinofilo o basófilo. 26
27 GRANULOCITO MADURO: granulocito con núcleo segmentado. GRANULOCITO NEUTRÓFILO: Es el elemento más abundante del frotis normal de un adulto Núcleo: lobulado o segmentado. Presenta de 2 a 5 lóbulos que se van formando a partir de estrangulaciones en el núcleo del granulocito en cayado, que se van profundizando de manera que van quedando los segmentos o lóbulos unidos por filamentos de cromatina. La cromatina tiene una disposición en mosaico, con zonas de cromatina muy condensada y otras de cromatina extendida. La mayor cantidad de lóbulos indica mayor madurez de la célula. Tamaño: de 12 a 14 um. Citoplasma: rosado con granulaciones específicas muy finas, que toman tanto los colorantes ácidos como los básicos (de allí el nombre de neutrófilos) y aparecen de color violeta. Contienen enzimas como la fosfatasa alcalina y sustancias de acción bactericida. GRANULOCITOS EOSINÓFILOS: Tamaño: um. Núcleo: predomina el núcleo bilobulado, semejante a un anteojo. Disposición de la cromatina en mosaico. Citoplasma: cubierto de granulaciones esféricas de mayor tamaño que las neutrófilos, coloreadas de color naranja (o pardo rojizo) por la eosina. Prácticamente cubren todo el citoplasma y se consideran lisosomas. GRANULOCITO BASÓFILO: Tamaño: um. Núcleo: irregularmente lobulado. Cromatina muy densa, masa nuclear voluminosa en relación al citoplasma. Citoplasma: rosado. Contiene granulaciones grandes, irregulares en forma y tamaño, de color azul oscuro, casi negro, que a veces, por el aspecto esférico de la célula viva, cuando se transforma en disco por la desecación (al realizar el frotis) quedan superpuestas al núcleo cubriéndolo parcialmente. Son solubles en agua, por eso muchas se disuelven durante la coloración. Contiene heparina e histamina. 27
28 ORIGEN DE LOS MONOCITOS: Se acepta como único lugar productor de monocitos en el organismo, la médula ósea. MONOBLASTO: Tamaño: aproximadamente 20 um. Es muy parecido al mieloblasto, se diferencia de el en que el núcleo presenta una ligera indentacion (que hace recordar al monocito maduro) presenta tambien varios nucleolos. La otra diferencia es que el citoplasma es ligeramente grisáceo y a veces marca pliegues. PROMONOCITO: Tamaño: algo mayor que el monoblasto. Cromatina nuclear: con aspecto de fina red. Queda restos de nucleolos. Núcleo de contorno irregular con indentaciones. Citoplasma: de un color grisáceo mas basófilo que su predecesor. MONOCITO: Célula de mayor tamaño en el extendido (18-24 um) Forma: irregular. Núcleo: con lobulaciones incompletas como si se replegara sobre si mismo, de modo que recuerda las circunvoluciones del cerebro. A veces forma arriñonada. Con forma abigarrada en herradura, indentado o doblado. Cromatina laxa, delicada, condensada en grumos, dando un aspecto como de pinceladas desparejas. No presenta nucleolos. Citoplasma: grisáceo. No presenta gránulos pero si un polvillo muy fino, en el limite de visibilidad del microscopio y pequeñas vacuolas. Ese polvillo esta constituido por acumulos de lisosomas. 28
29 LINFOPOYESIS: Se originan en médula ósea y luego sufren procesos de maduración y diferenciación en órganos linfáticos secundarios. LINFOBLASTO: Tamaño: aproxim. 20 um. Núcleo: grande, con membrana nuclear gruesa debido a que la cromatina se condensa cerca de la membrana. Esto permite diferenciarlo de un mieloblasto y monoblasto. Citoplasma: basófilo. Sin gránulos. Es escaso porque el núcleo ocupa gran parte de la célula. PROLINFOCITO: Tamaño: um. Núcleo: algo más pequeño, cromatina más condensada. Generalmente es excéntrico. Todavía se identifican nucleolos. Citoplasma: mas abundante que en el linfoblasto. Sin gránulos. LINFOCITO MADURO: Podemos encontrarlo como linfocito pequeño o linfocito mediano y grande. LINFOCITO PEQUEÑO: Tamaño: aprox. 9 a 14 um. Núcleo: color púrpura, cromatina muy condensada. A veces puede atisbarse algún nucleolo. Ocupa casi toda la célula. Generalmente es redondo. A veces presenta una escotadura. Citoplasma: azul celeste muy escaso. 29
30 LINFOCITO GRANDE: Tamaño: mayor um. (A veces tamaño de un monocito). Núcleo: cromatina densa. Se ubica oralmente en forma excéntrica. Citoplasma: más abundante que en el pequeño y mediano. Color celeste. Suele contener algunas granulaciones muy pequeñas de color púrpura. CELULA PLASMATICA: Representa el 1-4% de las células nucleadas de MO en un sujeto normal y es el estadio final de la maduración y transformación del linfocito B maduro. Es una célula redonda u ovalada que mide entre 11 y 15 um. de diámetro. Se caracteriza por el núcleo redondo, denso y excéntrico con la heterocromatina dispuesta en masas groseras de disposición radial ( en rueda de carro ). Por lo general no presentan nucléolo. El citoplasma puede tener frecuentemente bordes de apariencia irregular y se tiñe de azul violáceo muy intenso, indicio de su riqueza en RNA con una zona clara cercana al núcleo denominada "arcoplasma". Normalmente no contienen granulaciones, pero pueden mostrar vacuolas o cuerpos de inclusión pálida o rosa, que corresponden a acumulos de inmunoglobulinas (cuerpos de Russell). Cuando estas inclusiones son muy numerosas, el aspecto de la célula es el de una mórula (célula de Mott). En algunos procesos reactivos que cursan con estimulación antigénica crónica (por ej. artritis reumatoidea activa) pueden aparecer en SP en un pequeño número. Se pueden observar también plasmocitos con inclusiones que representan acumulos de inmunoglobulinas en la cisterna perinuclear con la subsecuente invaginación dentro del núcleo, que da la apariencia de ser intranucleares. Estas estructuras se conocen como cuerpos de Dutcher. En algunos pacientes con mielomas IgA se pueden observar células plasmáticas flameadas caracterizadas por una coloración eosinofilica en la periferia o a veces en el citoplasma completo. En raras ocasiones se pueden observar plasmocitos multinucleados o células plasmáticas inmaduras (plasmoblastos) en aspirados de MO normal. SERIE MEGACARIOCITICA-PLAQUETARIA En la serie megacariocítica las divisiones nucleares no son seguidas de divisiones citoplasmáticas, lo que da lugar a la existencia de células poliploides de gran tamaño. Se 30
31 distinguen cuatro estadios evolutivos: el megacarioblasto, el promegacariocito, el megacariocito granular y el megacariocito formador de plaquetas o maduro. MEGACARIOBLASTO: Es la célula descendiente de la SC, con orientación plaquetogénica. Su tamaño oscila entre micras. El núcleo generalmente tetraploide u octaploide es único, grande, ovalado o bilobulado con cromatina laxa y numerosos nucléolos. El citoplasma, es intensamente basófilo, agranular y puede presentar algunas prolongaciones a modo de seudópodos muy característicos. PROMEGACARIOCITO: Mide 30 a 50 micras y se identifica fácilmente en MO por su gran tamaño y por el aspecto característico de su citoplasma que posee bordes mal limitados y emite numerosas prolongaciones. El núcleo es multilobulado, su cromatina es densa y no posee nucléolos. En el citoplasma persiste su tonalidad basófila, con numerosas granulaciones azurófilas que cubren distintas zonas. MEGACARIOCITO GRANULAR: Es característico su gran tamaño (80 micras o más) y su elevada ploidía. Su citoplasma amplio no posee basofilia y está totalmente cubierto por granulación azurófila rojo rosada. El núcleo es multilobulado o segmentado con cromatina condensada sin nucléolo. 31
32 MEGACARIOCITO MADURO ACTIVO: En este estadio el núcleo sigue siendo lobulado pero más compacto. Finalizada la síntesis de ADN se inicia en el citoplasma la granulogénesis que dará origen a las plaquetas. Los gránulos azurófilos se distribuyen especialmente en la periferia, en pequeños agregados rodeados por una zona hialina citoplasmática correspondiente a las membranas de demarcación que irán delimitando las futuras plaquetas. Las plaquetas son finalmente liberadas como fragmentos citoplasmáticos por fusión de las membranas de demarcación. FORMULA LEUCOCITARIA NORMAL Valores de referencia para adultos sanos Valor relativo (%) Valor absoluto (x10 9 /L) Cayados 0 2 0,1 0,25 Neutrófilos Segmentados ,5 6,5 Eosinófilos 1 4 0,05 0,35 Basófilos ,1 Linfocitos ,5 4,0 Monocitos 4 8 0,1 0,8 ALTERACIONES CUANTITATIVAS Se refiere a una variación en la cantidad de los diferentes tipos leucocitos o bien a variaciones en el recuento total. Se evalúan mediante un conteo total de leucocitos y conteo diferencial de cada uno de ellos. Pueden ser trastornos malignos o benignos. Los trastornos malignos pueden ser ocasionados por transformación neoplásica de células progenitoras Los trastornos benignos pueden ser adquiridos o hereditarios. 1-ALTERACIONES FISIOLÓGICAS Son todas aquellas alteraciones desencadenadas por causas diferentes a la enfermedad subyacente del paciente, son transitorias y no necesitan tratamiento ya que NO constituyen un parámetro de enfermedad. Edad Embarazo Stress emocional Ejercicio Raza (algunas personas de raza negra tienen tendencia a leucopenia) 32
33 2-ALTERACIONES PATOLÓGICAS 2.1-LEUCOCITOSIS: >11.0 x 10 9 /L (Neutrofilia, eosinofilia, basofilia, linfocitosis, monocitosis) 2.2-LEUCOPENIA: < 4.0 x 10 9 /L (Neutropenia, eosinopenia, monocitopenia, linfopenia) 2.3-REACCIONES LEUCEMOIDES entre x 10 9 /L 2.1 LEUCOCITOSIS Neutrofilia: > 6.5 x 10 9 /L Aumento absoluto de los neutrófilos La causa más común es la infección bacteriana. Mecanismo: La invasión bacteriana estimula los precursores en la M.O, esto intensifica la proliferación, el pool marginal se desplaza hacia el pool circulante; reflejándose en la sangre como leucocitosis y neutrofilia. También es causada por quemaduras, medicamentos, lesiones, y leucemia mieloide crónica. (LMC). Los corticoides, actividad física intensa, situaciones de stress pueden manifestarse con neutrofilias sin desviación a la izquierda. Eosinofilia: > 0.5 x 10 9 /L Puede verse en infecciones con parásitos metazoarios, trastornos alérgicos, cáncer y estados inflamatorios crónicos. Se observa también en el síndrome de Loeffler, el cual parece ser producido por una reacción alérgica. Una causa común es la migración del parásito Ascaris lumbricoides a través del tracto respiratorio. Otros parásitos de la familia Ascaris también pueden producir el síndrome. Entre las posibles causas adicionales se puede incluir la alergia a medicamentos, por ejemplo antibióticos sulfonamida. También se puede presentar en coexistencia con tumores sólidos. Basofilia: > 0.1 x 10 9 /L Aumento absoluto de los basófilos. Está vinculada con reacciones de hipersensibilidad inmediata y afecciones mieloproliferativas crónicas (LMC). Se observa también en enfermedades inflamatorias del intestino, el mixedema y después de la exposición a la radiación Linfocitosis: > 4 x 10 9 / L Incremento absoluto en el número de linfocitos. Generalmente responde a una infección viral. Un marcado incremento en el número de linfocitos puede estar asociado a una leucemia linfática crónica. Monocitosis: > 0.8 x 10 9 / L Incremento absoluto del número de monocitos. Este estado se encuentra asociado a períodos largos y crónicos de infección bacteriana (brucelosis, tuberculosis, fiebre tifoidea) Se presenta en la etapa de recuperación de las infecciones agudas. Otras causas son leucemia monocítica y enfermedades del colágeno 2.2 LEUCOPENIAS Neutropenias: < 2.3 x 10 9 /L Disminución en la producción medular: aplasia medular, agentes citotóxicos que deprimen la división celular (sulfamidas, cloranfenicol), hematopoyesis ineficaz. Exceso de destrucción por Ac antineutrófilos, por medicamentos como la fenotiazina. Se observa en enfermedades virales, bacterianas y protozoarias (paludismo, tifo, etc) 33
34 Fase inicial de la infección: la salida de los PNN a los tejidos es mayor que la salida medular (gran demanda tisular). Eosinopenia: < 0.05 x 10 9 /L Disminución en la cantidad de eosinófilos. Difícil de establecer debido a su bajo recuento. La ACTH aumenta los PMN circulantes pero disminuye los eosinófilos circulantes. Se presenta en situaciones estresantes agudas, reacciones inflamatorias y con la administración de glucocorticoides. La infección bacteriana puede causar disminución debido a una marginación creciente y a la migración de estas células a los tejidos, pero la recuperación se puede acompañar de eosinofilia leve Monocitopenias: < 0.1 x 10 9 /L Se encuentra en trastornos de las células progenitoras como en la anemia aplásica, en las leucemias, y después de la terapia con glucocorticoides. En la fase inicial de procesos infecciosos. Linfopenias: < 1.5 x 10 9 /L Disminución en el número de linfocitos Puede originarse por: falla en la producción, exceso en su destrucción, o pérdidas celulares a través de los conductos linfáticos del intestino. Las linfopenias por defectos en la producción son característica de algunas IDP, tales como: inmunodeficiencia severa combinada, síndrome de DiGeorge completo, hipoplasia cartílagopelo, inmunodeficiencia común variable, SIDA REACCION LEUCEMOIDE Reacción benigna de leucocitos caracterizada por leucocitosis con muchos precursores inmaduros de leucocitos circulantes. Esta respuesta puede ser linfocítica, eosinofílica, así como neutrofílica. Puede producir un cuadro sanguíneo indistinguible de la leucemia mielocítica crónica. Es transitoria y desaparece cuando el estímulo desencadenante se elimina, por ejemplo extirpación del tumor y control de la infección. Como sucede con la leucemia, la persona que presenta una reacción leucemoide presenta una proliferación desorganizada de glóbulos blancos inmaduros en la sangre y en la médula ósea. REACCION LEUCEMOIDE NEUTROFILICA Se encuentra aumento de los PNN, acompañados de mielocitos y metamielocitos. Causas: Neoplasias Broncopulmonares y gástricas Tumores malignos de mama y próstata Algunas infecciones bacterianas: Osteomielitis, tuberculosis. ALTERACIONES CUALITATIVAS 1-ALTERACIONES NUCLEARES Anomalía de Pelger Hüet Es un trastorno nuclear hereditario autosómico dominante o adquirido debido a quimioterapia, síndromes mieloproliferativos agudos o crónicos, quemaduras, reacciones a fármacos e infecciones. Hay una falla en el desarrollo del núcleo durante la diferenciación terminal, el núcleo es en forma de nuez o maní. Hay hipercondensación de la cromatina. Se observa hiposegmentación nuclear.no hay pérdida de la función celular. 34
35 Hipersegmentación Nuclear Trastorno hereditario (autosómico dominante) o adquirido. Se debe a una anormalidad en la maduración del núcleo (síntesis de DNA). Presentación de PMN con 6 o más lóbulos. Células de mayor tamaño que las normales. Se observa asociada a la eritropoyesis megaloblástica. También puede estar asociado a infecciones crónicas o a déficit de vitamina B12, folatos, etc. 2-ALTERACIONES CITOPLASMATICAS Síndrome de Chediak Higashi. Esta rara enfermedad autosómica recesiva se caracteriza por albinismo parcial, gránulos lisosómicos gigantes en la mayoría de las células granulosas (aunque también se observan en linfocitos y monocitos), y mayor susceptibilidad a las infecciones. Es fácil observar las células sanguíneas anormales en los frotis sanguíneos de rutina. La enfermedad se diagnostica por lo general en niños. Hay diversas anomalías en los neutrófilos incluyendo neutropenia moderada, reducción en la quimiotaxis de neutrófilos. Además, en estudios microbicidas, se observa que los gránulos primarios gigantes se degranulan con lentitud, y por lo tanto, se retarda la muerte de las bacterias fagocitadas. Anomalía de Alder Reilly. Trastorno de tipo autosómico. Presencia de gránulos azurófilos agrupados en racimos en el citoplasma de granulocitos, monocitos y linfocitos. Se diferencian de las granulaciones tóxicas ya que se presentan en otras células diferentes a los neutrófilos y la ausencia de vacuolas tóxicas. Esta asociada a mucopolisacaridosis. Anomalía de May Hegglin. Trastorno autosómico dominante. Asociado con hemorragias leves, macroplaquetas con escasos gránulos y trombocitopenia. Se caracteriza por aparición en los neutrófilos segmentados de unos cuerpos de inclusión muy similares a los cuerpos de Döhle; se observan coloreados azul pálido, con la diferencia que por lo general no están hacia la periferia de la célula sino distribuidos indistintamente en el citoplasma. Cuerpos de Döhle. No son exclusivos de los neutrófilos, igualmente se pueden encontrar en el citoplasma de los monocitos, se observan como inclusiones redondeadas basófilas únicas o múltiples que se depositan en la periferia de las células y son poco nítidos. La presencia de estas inclusiones indica hiperactividad celular. Se encuentran en condiciones tóxicas tales como Fiebre escarlatina, sepsis, quemaduras, embarazo y tuberculosis Granulaciones Tóxicas. Las granulaciones tóxicas de los segmentados neutrófilos son gránulos hipertrofiados que le dan un aspecto hipergranular al citoplasma de los neutrófilos que junto con las vacuolas y los cuerpos de Döhle se encuentran en condiciones tóxicas como infecciones, septicemia, quemaduras. Son gránulos primarios que debido a algún desbalance en la maduración del neutrófilo no lograron ser eliminados eficazmente. Cuerpos o bastones de Auer. 35
36 Inclusiones intracitoplasmáticas en forma de varilla o de bastón que se observa en los mieloblastos, promielocitos y monoblastos. Se cree que son gránulos azurófilos que se fusionan, tienen afinidad por la eosina. Se encuentran en la leucemia mieloide aguda y durante la crisis blástica de la leucemia mieloide crónica. Linfocitos atípicos Llamados también células linfomonocitoides, linfocitos activados, inmuncitos, etc. Miden de 15μm a 30μm, núcleo irregular, indentado, excéntrico y puede observarse nucleolos. El citoplasma es amplio, color azul tenue o intenso, y puede presentar gránulos azurófilos y vacuolas. Estas células pueden observarse en mononucleosis infecciosa, hepatitis viral, herpes zoster, enfermedades autoinmunes y normalmente pueden hallarse hasta en 5%. Vacuolas Se pueden presentar en el citoplasma de neutrófilos tóxicos, monocitos, eosinófilos y menos frecuentemente linfocitos. Al MO se observan como puntos blancos en sacabocado. En frotis realizados del frasco de hemograma estas vacuolas se pueden presentar en muestras envejecidas por fagocitosis de las sales del anticoagulante, por lo tanto para su confirmación resulta imprescindible el extendido de punta de aguja. Degranulación Neutrófilo sin granulaciones, citoplasma limpio, indicativo de hemopatías severas, SMD y SMP. Sepsis de mala evolución, etc. 36
37 TRABAJOS PRÁCTICOS 4 Y 5 ALTERACIONES SERIE ROJA - ANEMIAS HEMATIES NORMOCÍTICOS - NORMOCRÓMICOS Discos cuya biconcavidad hace que aparezcan con cierta palidez central. Miden aproximadamente de 7,2 μm a 7,4 μm. Las alteraciones eritrocitarias se dividen en: Alteraciones en tamaño (Anisocitosis) Alteraciones en su forma (Poiquilocitosis) Alteraciones de color (Anisocromía) Inclusiones anormales. Alteraciones en el tamaño. Pueden ser de dos tipos: Macrocitos: Hematíes que presentan un tamaño superior al normal (más de 9 μm) y su expresión máxima es el megalocito. Suelen aparecer en la anemia megaloblástica debida a déficit de vitamina B12 o ácido fólico. Se suele observar cuando hay un aumento de la actividad eritropoyética, como un mecanismo de compensación a la pérdida de los hematíes, sea por anemia severa o hemorragias. En la sangre periférica se pueden observar como hematíes grandes policromatófilos o reticulocitos. Microcitos: Hematíes que presentan un tamaño inferior al normal (menos de 6 μm) y se encuentran en pacientes con anemia ferropénica y talasemias. Alteraciones en la forma Esferocitos: Son hematíes esféricos, no son bicóncavos, presentan un diámetro inferior al normal pero más grueso. Su vida media es de 14 días, producen taponamiento de los vasos sanguíneos. Se encuentran en la esferocitosis hereditaria o enfermedad de Mihkowski- Chauffard (defecto congénito de la membrana eritrocitaria). También pueden ser adquiridos por factores extraeritrocitarios (autoanticuerpos, quemaduras extensas, etc.) Codocitos o Target cells: Llamados también dianocitos. En la región central presentan un área con mayor contenido hemoglobínico (zona densa). La interfase entre la membrana celular y el centro es transparente. Se encuentran en hemoglobinopatías (Hb C), talasemias, anemia ferropénica y en algunas hepatopatías crónicas con aumento de colesterol y fosfolípidos. Drepanocitos: Son hematíes con HbS precipitada. Su apariencia es propia del estado homocigoto de la hemoglobina S, aunque también se puede presentar en estados de heterocigozis. Eliptocitos: Los hematíes son alargados (ovalocitos). Se encuentran en la eliptocitosis hereditaria. Su presencia se debe a una alteración congénita de la membrana del hematíe, aunque puede ser adquirida en caso de una anemia megaloblástica, ferropénica o arregenerativa. Equinocitos: Son aquellos que presentan membrana ondulante e irregular. Se encuentran en algunas anemias hemolíticas. Este fenómeno puede ser inducido in vitro exponiendo los hematíes a una solución hipertónica. También se pueden encontrar en pacientes con IRC, hepatopatías, déficit de PK, etc. 37
38 Acantocitos: Las prominencias de la membrana eritrocitaria son más aguzadas (alargadas) y distribuidas irregularmente. Se encuentran en la acantocitosis que se caracterizan por la ausencia de lipoproteínas plasmáticas. También pueden encontrase en pacientes con hepatopatías, dislipidemias, hipotiroidismo, etc. Dacriocitos: Son hematíes en forma de lágrima. Se encuentran en la anemia ferropénica, anemia megaloblástica y talasemia. También se encuentran en situaciones en las que la MO padece alguna patología severa (SMD, MFI, etc) y en esplenomegalia. Esquistocitos: Son fragmentos hemáticos. Se encuentran en anemias hemolíticas microangiopáticas (SUH, PTT, etc.), quemaduras, etc. Estomatocitos: Son hematíes que en lugar de una depleción central clara tienen una banda pálida central que les da un aspecto de boca. Se hereda como carácter autosómico dominante. Esta enfermedad es causada por anormalidad hereditaria de la membrana eritrocitaria. También se pueden encontrar en pacientes con hepatopatías y dislipidemias. Excentrocitos: Son hematíes con distribución irregular de la hemoglobina. Su tamaño es inferior al normal y se caracteriza por poseer contornos parcialmente arrugados, pero además se observa una distribución irregular de la hemoglobina que aparece desplegada de la parte interna hacia uno de los extremos. Knocitos: Son hematíes que presentan un estoma o boca en la región central completamente coloreada y lo demás incoloro. Morfológicamente es todo lo contrario a las características del estomatocito. Se encuentran en algunas anemias como las ferropénicas. Alteraciones de color Aquí observamos las diferentes tonalidades de color de los hematíes dependiendo del contenido hemoglobínico u otros. Tenemos: Hipocromía: Son hematíes con disminución del contenido de la hemoglobina y dependiendo de la cantidad de este pigmento es que observamos a los hematíes con diferentes caracteres de color. Aquí están incluidos los anulocitos, que son hematíes en forma de anillo en que solo la membrana eritrocitaria está coloreada y que se traduce en una hipocromía de grado severo (+++). Pseudo - Hipercromía: Son hematíes ávidos de hemoglobina. Pueden encontrarse en caso de enfermedades como la policitemia vera o la policitemia fisiológica y esferocitosis hereditaria Policromatofilia: Presencia de hematíes con tonalidad (azul y rojo) morada. Se le relaciona con inmadurez celular, células nucleadas, presencia de reticulocitos, macrocitos, etc. Esto debido a su elevada cantidad de ARN. Anisocromía: Diferentes tonalidades de color como hematíes hipocrómicos, hipercrómicos, normocrómicos y policromatófilos. Se encuentran en ciertas anemias refractarias. Inclusiones anormales Punteado basófilo: Son gránulos basófilos presentes en el citoplasma de los hematíes. Indica una alteración de la eritropoyesis más que un aumento de la misma. Se produce en muchas enfermedades sanguíneas: talasemia, anemias megaloblasticas, infecciones, hepatopatías, intoxicación por plomo y otros metales pesados, hemoglobinas inestables y deficiencia de pirimidina-5 -nucleotidasa. Actualmente el consumo de ciertos fármacos también puede producir este fenómeno. 38
39 Cuerpos de Heinz: Son formaciones redondeadas de hasta 3 μm de diámetro localizadas habitualmente en la periferia de la célula. Se observan con colorantes para reticulocitos. Estos cuerpos son abundantes en sujetos esplenectomizados. Anillos de Cabot: Se cree que sean restos de membrana nuclear eritroblástica o restos después de una mitosis anormal. Se observan en forma de anillo u ocho invertido. Pueden ser precipitados de ARN o proteína carente de importancia diagnóstica. Su presencia indica severas signos de diseritropoyesis. Cuerpos de Howel-Jolly: Son restos de cromatina nuclear, resultados de la pérdida del núcleo por parte del eritroblasto ortocromático hasta la conversión del hematíe. Se les considera signos de regeneración celular. Pueden observarse (habitualmente aislados) en un pequeño porcentaje de hematíes en la anemia perniciosa. Las células que los contienen aparecen habitualmente tras la esplenectomía y cuando se ha producido una atrofia esplénica. En general, solo se encuentran unas cuantas células de este tipo, pero pueden ser muy numerosas en los casos de enfermedad celiaca, en la que hay una atrofia esplénica y una deficiencia de folato concomitante. Cuerpos de Pappenheimer: Los cuerpos de Pappenheimer son pequeñas inclusiones eritrocitarias basòfilas (casi negras) dispuestas periféricamente. Habitualmente, solo hay una pequeña cantidad en el interior de la célula. Están formados por hemosiderina y su presencia se relaciona con una sobrecarga de hierro y con hipoesplenismo. A veces, se encuentran en la mayoría de los hematíes circulantes. Su naturaleza puede confirmarse por medio de una tinción de Perls. Corresponden a los gránulos sideroticos de los siderocitos y nunca se encuentran en grandes cantidades en el interior de las células, como el clásico punteado basofilo. Sin embargo, en una sola célula se pueden encontrar ambos elementos, es decir, el punteado basofilo y los cuerpos de Pappenheimer. Con la tinción de Perls, los primeros de estos gránulos se tiñen de rosa mientras que los últimos lo hacen de azul. Siderocitos: Son hematíes con contenido de hierro libre no hemoglobínico de color verde azulado. Gránulos de Shuffner: Son gránulos que presentan algunos hematíes en caso de parasitismo por plasmodium vivax. Gránulos de Maurer: Son gránulos de color violeta oscuro que se encuentran en pacientes con parasitismo por plasmodium falciparum. ANEMIA: Según la definición de la OMS se acepta que existe Anemia cuando la concentración de HEMOGLOBINA se halla por debajo de los límites establecidos en función de la edad y el sexo; independientemente de que la concentración de eritrocitos se encuentre normal o incluso elevada. EDAD HEMOGLOBINA (g/dl) MENOR A. Recién nacidos (a termino) 14,0 Niños de 3 meses 9,0 Niños de 2 años 11,0 Mujeres (no embarazadas) 12,0 Varones 13,0 Mujeres embarazadas 11,0 39
40 CLASIFICACION MORFOLÓGICA: Se debe recordar que el VCM se correlaciona con la HCM (que informa el contenido medio hemoglobínico de los eritrocitos circulantes) de forma que disminuirá la HCM al hacerlo el VCM (anemia microcítica hipocrómica) y aumenta cuando aumente el VCM (anemia macrocítica hipercrómica ). Siempre se debe recordar que en determinadas situaciones el VCM puede estar afectado por factores no debidos al tamaño de los eritrocitos, como alteraciones en la forma o la deformabilidad celular, lo que obedece a los métodos automatizados para medir el VCM por lo tanto, siempre que analicemos un histograma, debemos tener en cuenta que el VCM es un valor medio y no informa sobre la homogeneidad celular y es necesario correlacionarlo con el índice ADE y hacer una inspección al microscopio del frotis para que una posible anisocitosis no pase desapercibida. a) ANEMIAS MICROCITICAS (VCM< 82 fl) Anemia Ferropénica. Deficiencia de Hierro. Talasemias. Defectos en la síntesis de Hemoglobina. Anemia secundaria a enfermedades crónicas. Mala disponibilidad del hierro orgánico. Anemia Sideroblástica. Defectos en la síntesis del grupo HEM. b) ANEMIAS NORMOCITICAS (VCM: fl) Anemias hemolíticas. Aplasia Medular. Invasión Medular. Anemia secundaria a enfermedades crónicas. Anemia secundaria a procesos hemorrágicos agudos. Anemias tempranas de otras anemias. c) ANEMIAS MACROCITICAS (VCM> 98 fl) i. HEMATOLOGICAS. (VCM > 115 fl) Anemias megaloblásticas. Deficiencia de folato o vit B 12 Anemias aplásicas. Anemias hemolíticas con crisis reticulocitaria. Síndromes mielodisplásicos. ii. NO HEMATOLOGICAS. (VCM < 115 fl) Anemia secundaria a abuso de alcohol Anemia secundaria a Hepatopatía crónica Anemia secundaria a Hipotiroidismo Anemia secundaria a Hipoxia. 40
41 CLASIFICACIÓN FISIOPATOLOGICA DE LAS ANEMIAS ANEMIAS ARREGENERATIVAS: En este tipo de Anemias también llamadas Arregenerativas, la medula ósea no presenta una capacidad regenerativa normal y no se cumple una relación inversa entre la disminución de la concentración de la hemoglobina y el aumento de Reticulocitos. Esto es, la Medula Ósea no puede responder adecuadamente al grado de anemia. Defecto de proliferación y diferenciación de stem cells: aplasia medular, leucemia, mielodisplasias. Defecto de proliferación y diferenciación de progenitores de los GR: aplasia roja pura, insuficiencia renal, enfermedades endocrinas, etc. Defecto en síntesis de DNA: deficiencia de vitamina B12 y folatos. Defecto en síntesis de Hemoglobina: deficiencia de fierro, talasemias. Mecanismos múltiples o desconocidos: anemia de enfermedades crónicas, infiltración medular (metástasis), anemias sideroblásticas. ANEMIAS REGENERATIVAS: En general, obedecen a una perdida periférica de eritrocitos por hemorragias o hemólisis. Son anemias regenerativas, es decir que la medula presenta una capacidad de respuesta normal y existe una relación inversa entre el grado de anemia y el aumento de Reticulocitos. DEFECTOS INTRÍNSECOS: - De membrana: esferocitosis, acantocitosis, etc. - De enzimas: deficiencias de G-6-PD, piruvato kinasa, etc. - De globinas: enfermedad de las células falciformes (HbS), Hemoglobinas inestables, etc. DEFECTOS EXTRÍNSECOS: - Mecánicos: microangiopatía, prótesis, etc. - Químicos o físicos: hemólisis por drogas, venenos. - Infecciones: clostridium, malaria, otras septicemias... - Anticuerpos: autoinmune, aloinmune, drogas. - Hiperactividad monocito-macrófago: hiperesplenia. - Pérdida de sangre: hemorragia aguda. RECUENTO DE RETICULOCITOS Los Reticulocitos son eritrocitos no nucleados, inmaduros, que contienen ARN y que continúan sintetizando hemoglobina después de la pérdida del núcleo. El carácter regenerativo o arregenerativo de una anemia puede conocerse a través del recuento de Reticulocitos. Además, el recuento de Reticulocitos sirve para el seguimiento en el tratamiento de ciertas anemias. Por ejemplo, la respuesta de los reticulocitos en el día 6 después de la terapia confirma la respuesta a la terapia con folato o con B12 siempre que sólo se hayan 41
42 dado dosis bajas, en una anemia por déficit de folato o cabalamina. Podemos observar los reticulocitos al microscopio óptico mediante la tinción con colorantes vital, azul de metileno o azul brillante de cresilo. Estos colorantes dan lugar a la precipitación de los restos de ARN, y se observan como filamentos de color azul intenso en el interior de la célula. El número de reticulocitos en sangre circulante es, probablemente el mejor y más sencillo indicador de la eritropoyesis. Un aumento puede interpretarse como indicación de una elevada demanda de nuevos eritrocitos y un correcto funcionamiento de la médula ósea. Por el contrario cuando la demanda disminuye o la médula ósea falla en sus funciones, la cifra de reticulocitos baja. Según el grado de maduración que posea el reticulocito presentará un modelo de reticulocito distinto, de ovillo denso en el caso de los más inmaduros o de gránulos escasos para los más maduros PROCEDIMIENTO: 1) Se prepara un tubo que ya contenga el colorante (azul brillante de cresilo). 2) La sangre debe ser anticoagulada con EDTA-Na 2. (Debido a que los Reticulocitos también maduran in vitro, es aconsejable que la sangre utilizada se haya extraído recientemente, como máximo 6 horas antes de su análisis). Añadir 2 gotas de sangre a uno de los tubos ya preparados que contienen 100 ul de colorante. 3) Mezclar e incubar durante minutos a 37ºC. 4) Volver a mezclar la suspensión 5) Realizar un extendido 6) Dejar secar al aire 7) Una vez realizado todo esto observar al microscopio con el objetivo de 100x con aceite de inmersión. En la coloración, los hematíes se tiñen de color verde amarillento y los Reticulocitos se diferencian porque presentan en su interior unos hilos finos de color azul. 50 hematíes X= 5 campos Luego se procede a contar los Reticulocitos en 5 campos, por ejemplo: También se pueden contar 10 campos homogéneos y luego sacar un promedio y se obtiene así el porcentaje. Si se utiliza esta técnica conviene moverse aleatoriamente por el preparado buscando zonas de distribución homogénea realizando el recuento cada 2 o 3 campos. Recordar que los campos en los que no se encuentran reticulocitos deben considerarse en el cálculo final. Así por ejemplo para un paciente sano podríamos tener: 42
43 = 1,1 % 10 Los Reticulocitos pueden expresarse de diferentes maneras: PORCENTAJE DE RETICULOCITOS: El porcentaje de Reticulocitos se determina en al menos 1,000 hematíes. El recuento de Reticulocitos se determina multiplicando el porcentaje de Reticulocitos por el recuento de hematíes. Los adultos normales muestran un recuento de Reticulocitos de 0.5 a 2 %. En los recién nacidos, el porcentaje oscila entre 2 a 6%. VALOR ABSOLUTO: Se expresa como Nº de Reticulocitos/mm 3. Para adultos, el valor de referencia se sitúa entre VALOR CORREGIDO I: Si se expresan los Reticulocitos en porcentaje van referidos a la concentración normal de eritrocitos y no tiene en cuenta la salida prematura de Reticulocitos desde la medula ósea, por ello siempre debe corregirse en función de la intensidad de la anemia: % Ret x Hto paciente (%) Hto normal (%) VALOR CORREGIDO II: En condiciones normales los Reticulocitos permanecen 4 días en la medula ósea y tardan de 1-2 días en sangre periférica en madurar; pero si hay anemia, el estimulo eritropoyético compensador disminuye el periodo de maduración intramedular y se alarga en sangre periférica, haciendo que el recuento de Reticulocitos sea falsamente elevado. Esto se conoce como "desviación reticulocitaria" y se observa en el frotis por la aparición de hematíes grandes con un color azulado. Este es el motivo por el cual suele corregirse por el periodo en días que tardan los Reticulocitos en madurar a eritrocitos, y a esto se le llama índice de producción reticulocitaria (IPR). IPR = Valor corregido I Factor El factor en condiciones normales es de 1 y aumenta en 0,5 por cada 10% de disminución del Hto. Reticulocitos 100 x Azul Brillante de Cresilo 43
44 TRABAJO PRÁCTICO N 6 Grupos sanguíneos ABO y Rh: pruebas de Coombs FUENTE: UNIVERSIDAD NACIONAL DE LA PLATAFACULTAD DE CIENCIAS EXACTAS DEPARTAMENTO DE CIENCIAS BIOLOGICAS CATEDRA DE ANALISIS CLINICOS I (HEMATOLOGIA) A. TIPIFICACION DE ANTIGENOS ABO EN HEMATIES: METODO EN TUBO POR SEDIMENTACION a) Preparar una suspensión de hematíes de grupo sanguíneo desconocido, al 2 % en salina fresca (véase más abajo el apartado C. Preparación de la suspensión globular al 2%). b) Agregar una gota de la suspensión globular, a igual volumen de suero anti-a, anti-b, anti- AB y plasma AB normal (poli o monoclonales) en tubos de Kahn. c) Simultáneamente controlar cada antisuero contra hematíes A 1, B y O al 2% d) Incubar 1 hora a temperatura ambiente o centrifugar 1 minuto a 1000 rpm. e) Leer primero los controles y luego los problemas microscópicamente en visor y macroscópicamente. f) Scores de lectura: +++ un gran aglutinato ++ varios aglutinatos grandes + muchos aglutinatos pequeños pequeños aglutinatos, muy escasos, visibles a ojo desnudo - negativo no se observan aglutinatos B. TIPIFICACION DE ANTICUERPOS ABO EN SUERO a) Tomar una muestra de suero libre de hematíes. b) En tubos de Kahn, agregar una gota de suero a igual volumen de suspensión al 2%, de los siguientes hematíes: 1) hematíes A conocidos 2) hematíes B conocidos 3) hematíes del propio individuo 4) hematíes O conocidos c) Incubar 1 hora a temperatura ambiente o centrifugar 1 minuto a 1000 rpm. d) Leer primero los controles y luego los problemas, microscópicamente en visor y macroscópicamente. C. PREPARACIÓN DE LA SUSPENSIÓN GLOBULAR AL 2% a) Separar los hematíes del plasma y trasvasar una porción de los mismos a un tubo de Kahn. b) Llenar el tubo con solución fisiológica al 0.85% y centrifugar a 1000 rpm durante 1 minuto. c) Eliminar el sobrenadante y repetir los lavados dos veces más, teniendo la precaución de resuspender perfectamente el culot globular antes de completar el agregado de solución fisiológica. d) Tomar una gota de culot (50 l) y agregarle 0,5 ml de solución fisiológica. Se tendrá así la suspensión al 2%. D. SUBAGRUPACION DEL GRUPO A: METODO EN PLACA a) Colocar una cantidad de sangre total igual a ¼ de gota. b) Agregar una gota de anti-a absorbido y mezclar bien con una varilla de punta fina. c) Al terminar de mezclar, disparar el cronómetro. 44
45 d) Rotar la placa en forma circular y observar la aparición de aglutinación dentro del minuto. Los siguientes cuadros resumen los posibles resultados: Glóbulos problema Suero problema rojos Anti A Anti B Anti AB Grupo ABO A B O AB GR A GR B GR AB Grupo ABO A B O AB E. TIPIFICACION DEL FACTOR D DEL SISTEMA Rh a) Coloque 2 gotas de suero anti-d en un tubo de Kahn. b) Adicione una gota pequeña de suspensión de glóbulos o en su defecto de sangre entera de la muestra. c) Agite para mezclar los reactivos y centrifugue durante 1 minuto a 1500 rpm. d) Desprenda suavemente el culot globular y lea. La lectura se hará microscópicamente con un visor y macroscópicamente. e) Proceda de la misma manera con los tubos controles. E.1 Controles a) Prueba sobre la bondad del suero: sangre D positiva + anti-d b) Prueba sobre la inespecificidad respecto de anti-d: sangre D negativa + anti-d c) Control de seudoaglutinación: muestras de sangre + plasma de persona AB. E.2 Reacciones Positiva: los hematíes D (Rh o ) positivos permanecerán aglutinados al querer desprender el culot globular. Negativa: los hematíes (Rh-rh) se suspenderán nuevamente sin evidenciar aglutinación. F. PRUEBA PARA DETECTAR D u Nunca puede ser diagnosticada como negativa la sangre de un dador por ofrecer reacciones negativas frente a sueros anti D. Siempre debe descartarse la posibilidad de estar en presencia de un individuo D u. Para ello es necesario aplicar la prueba de Coombs. 1) Coloque dos gotas de suero anti D (Rho) en un tubo de Kahn. 2) Agregue 1 gota de una suspensión sanguínea al 2% en salina. 3) Agite para mezclar los reactivos e incube durante 30 minutos a 37 C. 4) Lave los hematíes 3 veces con abundante cantidad de SF (ocupando casi todo el volumen del tubo). Centrifugue y elimine el sobrenadante. 5) Agregue 2 gotas del suero antiglobulina humana. 45
46 6) Agite para mezclar los reactivos y centrifugue inmediatamente durante 1 minuto a 1500 rpm, desprenda suavemente el culot globular y lea. La lectura se hará macro y microscópicamente. F.1 Reacciones Positiva: los hematíes D u (Rho u ) positivos permanecerán aglutinados luego de intentar desprender el culot globular. Negativa: los hematíes Rh-(rh) y D u (Rho u ) negativos se resuspenderán y no aglutinarán. F.2 Controles utilizados Se utilizan tres controles para 1. Probar la bondad del suero 2. Comprobar su especificidad 3. Para seudoaglutinación Para el primer control positivo deben emplearse hematíes Rh positivos de dador conocido OR1r (Cde/cde). Es aconsejable usar esos hematíes y evitar emplear eritrocitos D(Rho) positivos con el antígeno E(rh ) presente,dado que, en tales hematíes el factor D(Rho) es mas reactivo. El control negativo consiste en eliminar la posibilidad de estar utilizando un suero que contenga aglutininas inespecíficas para el antígeno en cuestión (por ejemplo: anti-a y/o anti-b no absorbidos durante la preparación del suero). Estos dos primeros controles sirven para demostrar que el suero a emplear es específico y no posee ningún contaminante que pueda falsear los resultados. El tercer control, es de seudoaglutinación y para ello se reemplaza el suero anti D por suero de persona de grupo sanguíneo AB, se lo enfrenta con los hematíes que están siendo tipificados. G. COMPROBACIÓN DE LA PRESENCIA DE ANTICUERPOS INMUNES MEDIANTE LA PRUEBA DE COOMBS. G.1 Prueba de Coombs indirecta 1) Colocar en un tubo de Kahn 2 gotas de suero problema y 2 gotas de suspensión de hematíes de grupo O Rh+ al 2%. Agitar suavemente 2 o 3 veces durante el período de incubación de 1 hora a 37 C. Proceder de la misma manera con un tubo control que contiene 2 gotas de solución fisiológica y 2 gotas de suspensión de hematíes O Rh+ al 2%. 2) Centrifugar, quitar el sobrenadante y lavar 3 veces con solución fisiológica, eliminando completamente el sobrenadante en el último lavado. 3) Preparar otros controles siguiendo las indicaciones del apartado F.2 4) Leer al microscopio antes del agregado del suero antiglobulina humana. 5) Agregar una gota de suero antiglobulina humana. Centrifugar 1 minuto a 1500 rpm. Leer microscópicamente con visor y microscópicamente. 46
47 G.2 Prueba de Coombs directa 6) Colocar en un tubo de Kahn 2 gotas de suspensión al 2% de hematíes problema. Preparar un tubo control que contenga 2 gotas de suspensión de hematíes O Rh+ sensibilizados al 2%. 7) Preparar otros controles siguiendo las indicaciones del apartado F.2 8) Leer al microscopio antes del agregado del suero antiglobulina humana. 9) Agregar una gota de suero antiglobulina humana. Centrifugar 1 minuto a 1500 rpm. Leer microscópicamente con visor y microscópicamente. RECOMENDACIONES: *es importante realizar con cuidado los sucesivos lavados, la temperatura que sea 37 C, la ultima centrifugación no debe ser enérgica ni más de un minuto. *siempre que una prueba de Coombs directa de negativa de debe dejarla minutos a 37 C y luego volver a realizar un corta centrifugación Anti-A, Anti-B o Anti A,B Monoclonal Reactivos para la determinación de grupos sanguíneos ABO SIGNIFICACION CLINICA En el año 1900 Landsteiner descubrió que los glóbulos rojos humanos podían ser clasificados en A, B, AB u O de acuerdo a la presencia (grupos A, B, o AB) o ausencia (grupo O) de antígenos altamente reactivos en su superficie. También demostró que existen anticuerpos (aglutininas) para los anfígenos A y B y que el suero de un individuo no contiene anticuerpos para el antígeno presente en sus propios glóbulos rojos pero sí contra los que no posee. Actualmente se han identificado subgrupos de los grupos A y B con distinta especificidad. Todas estas observaciones revelaron la importancia de la compatibilidad ABO en la práctica transfusional. Por este motivo, la tipificación de los grupos sanguíneos ABO es la prueba fundamental sobre la que se basan los demás ensayos pretransfusionales. FUNDAMENTOS DEL METODO Los glóbulos rojos del paciente se ponen en contacto con Reactivo Anti-A, Anti-B o Anti-A,B monoclonal. Si existen en la superficie de los eritrocitos los antígenos correspondientes, se producirá una aglutinación visible macroscópicamente. La ausencia de aglutinación en todos los casos, implica grupo O. REACTIVOS PROVISTOS Anti-A, Anti-B o Anti-A,B monoclonal: reactivos preparados a partir de anticuerpos monoclonales secretados por líneas celulares de hibridomas de ratón. REACTIVOS NO PROVISTOS De acuerdo a la técnica que se emplee pueden requerirse adicionalmente: - Solución fisiológica - Solución fisiológica tamponada con buffer fosfatos (PBS) - Solución fisiológica de baja fuerza iónica (LISS) - Albúmina Bovina 30% de Wiener lab. INSTRUCCIONES PARA SU USO Los Reactivos se proveen listos para usar. 47
48 ESTABILIDAD E INSTRUCCIONES DE ALMACENAMIENTO Los Reactivos Provistos son estables en refrigerador (2-10oC) hasta la fecha de vencimiento indicada en la caja. INDICIOS DE INESTABILIDAD O DETERIORO DE LOS REACTIVOS Desechar el reactivo cuando se observe contaminación del mismo. MUESTRA Glóbulos rojos o sangre entera a) Recolección: la sangre debe ser obtenida asépticamente, con o sin anticoagulante. b) Aditivos: pueden emplearse como anticoagulantes: EDTA, heparina, ACD (ácido cítrico, citrato, dextrosa) CPD (citrato, fosfato, dextrosa) o CPDA-1 (citrato, fosfato, dextrosa, adenina). Se recomienda el uso de Anticoagulante W de Wiener lab. c) Estabilidad e instrucciones de almacenamiento: las muestras deben conservarse en refrigerador (2-10oC). Si se utilizó heparina o EDTA, la tipificación debe llevarse a cabo en 48 horas. Las muestras recogidas con ACD, CPD o CPDA-1 pueden ser ensayadas hasta los 35 días. Si se emplean coágulos, deberá efectuarse la tipificación dentro de los 7 días de obtenida la muestra. MATERIAL REQUERIDO (no provisto) - Centrífuga - Tubos de hemólisis - Placas - Palillos mezcladores descartables PRECAUCIONES Los reactivos son para uso diagnóstico "in vitro". PROCEDIMIENTO En las siguientes técnicas la suspensión de glóbulos rojos a ensayar debe ser preparada con solución fisiológica, PBS o LISS. I- TECNICA EN PLACA Preparar una suspensión de glóbulos rojos al 10%. Como alternativa puede emplearse una suspensión al 35-45% en plasma del mismo paciente o sangre entera.0 1) A una gota de Reactivo Anti-A, Anti-B o Anti-A,B monoclonal colocada en una placa limpia, agregar 1 gota de suspensión de glóbulos rojos. 2) Mezclar el Reactivo y los glóbulos con un palillo descartable cubriendo un área circular de 2 cm de diámetro y balancear la placa continuamente durante 2 minutos. Observar aglutinación visible microscópicamente hasta los 2 minutos. No debe emplearse microscopio. II- TECNICA EN TUBO (por centrifugación) 1) A una gota de Reactivo Anti-A, Anti-B o Anti-A,B monoclonal colocada en un tubo de hemólisis, agregar 1 gota de suspensión de glóbulos rojos al 3-5%. III- TECNICA EN TUBO (por sedimentación) 1) A una gota de Reactivo Anti-A, Anti-B o Anti-A,B monoclonal colocada en un tubo de hemólisis, agregar 1 gota de suspensión de glóbulos rojos al 3-5%. 2) Mezclar e incubar durante 60 minutos a temperatura ambiente. 3) Agitar el tubo para despegar las células y examinar macroscópicamente la aglutinación. 48
49 INTERPRETACION DE LOS RESULTADOS La observación de aglutinación (con cualquiera de las técnicas utilizadas) indica una reacción positiva. Grupo sanguíneo A B 0 AB Variants débiles del grupo A como Ax Antisuero Anti-A Anti-B / Anti- A,B METODO DE CONTROL DE CALIDAD El control de calidad puede efectuarse ensayando glóbulos rojos tipificados. LIMITACIONES DEL PROCEDIMIENTO Reacciones débiles pueden observarse en las siguientes situaciones: - Neonatos: los antígenos A y B no se encuentran totalmente expresados en el recién nacido. Por esta razón deben extremarse los cuidados, sobre todo en los prematuros. - Leucemias u otros desórdenes malignos. - Pacientes recientemente transfundidos con cantidades sustanciales de sangre de grupo no idéntico. - Reacciones falsas positivas: se han observado problemas ocasionados en la tipificación de los grupos sanguíneos ABO debido a anticuerpos que reaccionan con drogas, colorantes, compuestos químicos o con partículas de sílica coloidal liberadas de vidrios de mala calidad. - Aglutininas frías: en presencia de aglutininas frías, el lavado de los glóbulos rojos 4-6 veces con solución fisiológica, resulta generalmente suficiente para obtener células aptas para la tipificación. En muy raras ocasiones se requiere un calentamiento a 37oC durante 10 minutos antes de los lavados mencionados. Como control, se coloca una gota de estas células con 2 gotas de solución fisiológica. No debe producirse aglutinación. PRESENTACION Anti-A: frasco x 10 ml (Cód ). Anti-B: frasco x 10 ml (Cód ). Anti-AB: frasco x 10 ml (Cód ). BIBLIOGRAFIA - Moore, S. et al. Int. Symp. on Monoclonal Antibodies: Standardization of their Characterization and use. París, France, Develop. Biol. Standard 57: Widman, F.K. Technical Manual. 9th Edition, Washington, D.C. American Association of Blood Banks Chapter 8. 2) Mezclar y centrifugar 20 segundos a rpm. 3) Agitar el tubo para despegar las células y examinar macroscópicamente la presencia o ausencia de aglutinación. Wiener lab Rosario - Argentina Elaborado por: Wiener Laboratorios S.A.I.C. Riobamba Rosario - Argentina 49
50 Anti-D (Rho) monoclonal Reactivo para la detección de antígeno D (Rho) SIGNIFICACION CLINICA Las observaciones de Levine y Stetson en 1939 y de Landsteiner y Wiener en 1940 establecieron las bases para el conocimiento actual de la importancia clínica de la detección en el laboratorio de los anticuerpos anti-d. Aproximadamente el 15% de los individuos de raza blanca y el 8% de los individuos de raza negra carecen del antígeno D y son fácilmente estimulados cuando reciben este antígeno, ya sea por transfusión o durante el parto, produciendo anti-d. Este anticuerpo es responsable de severas reacciones postransfusionales y de la enfermedad hemolítica del recién nacido. Existen muchos otros antígenos identificados dentro del sistema Rh. Sin embargo, es el antígeno D el que posee mayor importancia en la clínica después del sistema ABO. FUNDAMENTOS DEL METODO Los glóbulos rojos del paciente se ponen en contacto con suero anti-d (anti-rho). Si existe en la superficie del eritrocito el antígeno correspondiente, se producirá una aglutinación visible macroscópicamente. REACTIVO PROVISTO Anti-D (Rho): solución de anticuerpos monoclonales humanos. REACTIVOS NO PROVISTOS De acuerdo a la técnica empleada puede requerirse adicionalmente: - Solución fisiológica. - Suero Anti-humano (poliespecífico) provisto separadamente por Wiener lab. INSTRUCCIONES PARA SU USO Anti-D (Rho): listo para usar. PRECAUCIONES El reactivo es para uso diagnóstico "in vitro". ESTABILIDAD E INSTRUCCIONES DE ALMACENAMIENTO El Reactivo Provisto es estable en refrigerador (2-10oC) hasta la fecha de vencimiento indicada en la caja. INDICIOS DE INESTABILIDAD O DETERIORO DE LOS REACTIVOS Desechar el reactivo cuando se observe contaminación del mismo. MUESTRA Glóbulos rojos o sangre entera a) Recolección: obtener la sangre en forma aséptica con o sin anticoagulantes. b) Aditivos: pueden emplearse como anticoagulantes: heparina, EDTA, ACD (ácido cítrico, citrato, dextrosa), CPD (citrato, fosfato, dextrosa) o CPDA-1 (citrato, fosfato, dextrosa, adenina). c) Sustancias interferentes conocidas: los glóbulos rojos recubiertos con inmunoglobulinas o fracciones del complemento pueden dar reacciones falsamente positivas. Cuando se sospecha esta situación deberá realizarse una Prueba de Antiglobulina Directa. d) Estabilidad e instrucciones de almacenamiento: las muestras deben conservarse en refrigerador (2-10oC). 50
51 Si se utilizó heparina o EDTA, la tipificación debe llevarse a cabo en 48 horas. Las muestras recogidas con ACD, CPD o CPDA-1 pueden ser ensayadas hasta los 35 días. Si se emplean coágulos, deberá efectuarse la tipificación dentro de los 7 días de obtenida la muestra. MATERIAL REQUERIDO (no provisto) Dependiendo de la técnica que se emplee, podrán ser necesarios: - Centrífuga - Tubos de hemólisis - Placa de vidrio - Palillos mezcladores descartables PROCEDIMIENTO I- TECNICA EN PLACA Preparar una suspensión de glóbulos rojos al 40-50% en plasma o suero autólogos, o solución fisiológica. También puede emplearse sangre entera. 1) Colocar una gota de Anti-D (Rho) sobre una placa de vidrio limpia. 2) Agregar una gota de la suspensión de glóbulos rojos a probar. 3) Mezclar el antisuero y los glóbulos rojos con un palillo descartable en un área de 2 cm de diámetro y balancear constantemente la placa durante 2 minutos. Observar macroscópicamente la presencia o ausencia de aglutinación. II- TECNICA EN TUBO Preparar una suspensión de glóbulos rojos al 3-5% en plasma o suero autólogos, o en solución fisiológica. 1) Colocar una gota de Anti-D (Rho) en un tubo de hemólisis. 2) Agregar una gota de la suspensión de glóbulos rojos a probar. 3) Mezclar y centrifugar 20 segundos a rpm. 4) Agitar el tubo para despegar las células y examinar macroscópicamente la presencia o ausencia de aglutinación. Las reacciones aparentemente negativas deben incubarse a 37oC durante minutos, luego centrifugar y volver a leer como se describió en 4). Las muestras que aún en estas condiciones resulten negativas deben ser investigadas respecto al antígeno Du. III- PRUEBA ANTIGLOBULINA INDIRECTA PARA Du Preparar una suspensión al 3-5% de glóbulos rojos en plasma o suero autólogos, o solución fisiológica. 1) Colocar una gota de Anti-D (Rho) en un tubo de hemólisis. 2) Agregar una gota de la suspensión de glóbulos rojos a probar. 3) Mezclar e incubar a 37oC durante minutos. 4) Lavar las células 3-4 veces con solución fisiológica, descartando perfectamente el sobrenadante y resuspender las células luego de cada lavado. 5) Agregar 2 gotas de Suero Anti-humano (poliespecífico), mezclar, centrifugar 20 segundos a 3500 rpm. 6) Agitar el tubo para despegar las células y examinar macroscópicamente. INTERPRETACION DE LOS RESULTADOS La observación de aglutinación (con cualquiera de las técnicas empleadas) indica una reacción positiva. LIMITACIONES DEL PROCEDIMIENTO Ver Sustancias interferentes conocidas en MUESTRA. La prueba para tipificación de antígeno D (Rho) de glóbulos rojos sensibilizados debe realizarse solamente en medio salino. La determinación del Du no puede efectuarse sobre glóbulos rojos sensibilizados. 51
52 Pueden obtenerse resultados más rápidos y mejor visualización precalentando la placa a 45-50oC. PRESENTACION Frasco x 10 ml (Cód ). BIBLIOGRAFIA - Landsteiner, K.; Wiener, A.S. - Proc. Soc. Exp. Biol. Med. 43: 223, Wiener, A.S.; Unger, L.J. - JAMA 169:696, Widman, F.K. - Technical Manual - 9 th. Ed. Washington D.C., American Association of Blood Banks, Chapter 9, Race, R.R. and Sanger, R. - Blood Groups in Man - 6 th Ed. Oxford Blackwell Scientific Publications, pág. 178, Wiener lab Rosario - Argentina Elaborado por: Wiener Laboratorios S.A.I.C. Riobamba Rosario - Argentina Suero Anti-humano (poliespecífico) Para realizar Pruebas Antiglobulina (Coombs) Directa o Indirecta SIGNIFICACION CLINICA Las experiencias descriptas por Coombs, Mourant y Race en 1945 establecieron que las Pruebas Antiglobulina Humana resultaban los mejores métodos para detectar anticuerpos sensibilizantes pero no directamente aglutinantes. El ejemplo descripto originalmente hacía referencia a antígenos del sistema Rh. Experiencias posteriores probaron el valor de estas pruebas en la detección de anticuerpos en casi todos los grupos sanguíneos de importancia clínica, siendo empleadas actualmente en los siguientes casos: Prueba Antiglobulina Indirecta - Screening de suero de donantes y pacientes para anticuerpos. - Pruebas de compatibilidad previas a la transfusión. - Fenotipo de glóbulos rojos. - Identificación y titulación de anticuerpos encontrados en suero o eluatos. Prueba Antiglobulina Directa - Diagnóstico de laboratorio de anemia hemolítica y enfermedad hemolítica del recién nacido. - Investigación de reacciones dudosas en una transfusión. - Investigación de enfermedades autoinmunes que involucran la unión de inmunoglobulinas y/o fracciones del complemento a los glóbulos rojos. FUNDAMENTOS DEL METODO El agregado de Suero Anti-humano (poliespecífico) a glóbulos rojos que están cubiertos de inmunoglobulinas y/o Fragmentos de complemento (C3b, C3bi, C3dg o C3d), produce una aglutinación de los glóbulos rojos visible macroscópicamente. 52
53 REACTIVO PROVISTO Suero Anti-humano (poliespecífico): suero obtenido de conejos inmunizados con inmunoglobulina G purificada y C3. REACTIVOS NO PROVISTOS - Reactivos para la determinación de grupos sanguíneos. De acuerdo a la técnica a emplear puede requerirse adicionalmente: - Solución fisiológica. - Solución fisiológica tamponada con buffer fosfato (PBS). - Solución fisiológica de baja fuerza iónica (LISS). INSTRUCCIONES PARA SU USO Suero Anti-humano (poliespecífico): listo para usar. PRECAUCIONES El Reactivo Provisto es para uso diagnóstico "in vitro". ESTABILIDAD E INSTRUCCIONES DE ALMACENAMIENTO El Reactivo Provisto es estable en refrigerador (2-10oC) hasta la fecha de vencimiento indicada en la caja. INDICIOS DE INESTABILIDAD O DETERIORO DE LOS REACTIVOS Desechar el reactivo si se observa contaminación del mismo. MUESTRA Glóbulos rojos a) Recolección: la sangre debe ser obtenida asépticamente, con o sin anticoagulante. b) Aditivos: pueden emplearse como anticoagulantes: EDTA, heparina, ACD (ácido cítrico, citrato, dextrosa) CPD (citrato, fosfato, dextrosa) o CPDA-1 (citrato, fosfato, dextrosa, adenina). Se recomienda el uso de Anticoagulante W de Wiener lab. c) Estabilidad e instrucciones de almacenamiento: las muestras deben conservarse en refrigerador (2-10oC). Si se utilizó heparina o EDTA, la tipificación debe llevarse a cabo en 48 horas. Las muestras recogidas con ACD, CPD o CPDA-1 pueden ser ensayadas hasta los 35 días. Si se emplean coágulos, deberá efectuarse la tipificación dentro de los 7 días de obtenida la muestra. Cuando se efectúan pruebas antiglobulina directas, la sangre debe ser preferentemente fresca (menos de 24 horas de la extracción). Si los glóbulos provienen de coágulos, no deben ser refrigerados antes de las pruebas directas. MATERIAL REQUERIDO (no provisto) - Centrífuga - Baño de agua a 37oC - Tubos de hemólisis PROCEDIMIENTO I- PRUEBA ANTIGLOBULINA INDIRECTA (en solución salina de fuerza iónica normal). 1) En un tubo de hemólisis colocar 2 gotas del suero a probar. 2) Agregar 1 gota de suspensión de glóbulos rojos a probar al 3% lavados 3 veces y resuspendidos en PBS. 3) Mezclar e incubar a 37oC durante minutos. 53
54 4) Lavar los glóbulos 3 veces con PBS teniendo la precaución de descartar completamente el sobrenadante y resuspender el precipitado luego de cada lavado. Descartar completamente el sobrenadante luego del último lavado. 5) Agregar 2 gotas de Suero Anti-humano (poliespecífico) al botón de células. Mezclar perfectamente y centrifugar durante 15 segundos a rpm. 6) Resuspender las células por agitación y observar macroscópicamente. Tener en cuenta que agitaciones demasiado vigorosas pueden desligar aglutinaciones débiles. 7) Los resultados negativos deben confirmarse por adición de glóbulos rojos sensibilizados con IgG débiles. II- PRUEBA ANTIGLOBULINA INDIRECTA (en solución fisiológica de baja fuerza iónica). El empleo de esta solución permite reducir el tiempo de incubación a 15 minutos. Los glóbulos rojos deben lavarse 2 veces con PBS y una vez con LISS. Finalmente preparar con esta solución una suspensión de glóbulos rojos al 3%. 1) Colocar en un tubo de hemólisis 1 gota de suero a probar. 2) Agregar 1 gota de glóbulos rojos a probar al 3% en LISS. 3) Mezclar e incubar a 37 C durante 15 minutos en baño de agua. Continuar como se indica en los pasos 4) a 7) de la técnica I). III- PRUEBA ANTIGLOBULINA DIRECTA Se emplea para demostrar la absorción in vivo de IgG y/o fracciones del complemento en la superficie de los glóbulos rojos. 1) Preparar una suspensión de glóbulos rojos a probar en PBS al 3%. 2) En un tubo de hemólisis colocar 1 gota de esta suspensión y continuar con los pasos 4) a 7) de la técnica I). INTERPRETACION DE LOS RESULTADOS La observación de aglutinación (con cualquiera de las técnicas empleadas) indica una reacción positiva. LIMITACIONES DEL PROCEDIMIENTO Reacciones falsas positivas y falsas negativas pueden ocurrir por las siguientes causas: - Contaminación química o bacteriana de la muestra u otros materiales empleados para la prueba. - Lavado inadecuado de las células. - Tiempo o temperatura de incubación inadecuados. - Tiempo o velocidad de centrifugación inadecuados. - Concentración inadecuada de glóbulos rojos. - Agitación excesiva para despegar los glóbulos rojos aglutinados. Recordar que los reactivos han sido estandarizados para detectar inmunoglobulinas humanas y fragmentos C3 unidos a los glóbulos rojos. No son aptos para detectar anticuerpos de otro origen. PRESENTACION Frasco x 10 ml (Cód ). BIBLIOGRAFIA - Coombs, R.R.A.; Mourant., A.E. and Race, R.R. - Lancet, ii:15, Coombs, R.R.A.; Mourant, A.E. and Race, R.R. - Brit. J. Exp. Path. 26:225, Widman, F.K. - Technical Manual. 9th ed. Washington D.C. American Association of Blood Banks, pág. 376, Wiener lab Rosario - Argentina Elaborado por: 54
55 Wiener Laboratorios S.A.I.C. Riobamba Rosario - Argentina Determinación de anticuerpos inmunes A. TITULACIÓN DE ANTICUERPOS A.1 Técnica básica de titulación A.1.1. Preparación de diluciones madres. a) Colocar en una gradilla 10 tubos de Kahn numerados del 1 al 10 (el número de tubos puede aumentarse o disminuirse si fuera necesario). b) En los tubos 2 al 10, colocar 0,100 ml de solución fisiológica (SF). Colocar 0,300 ml de suero a titular en el tubo N 1. c) Tomar 0,100 ml de suero del tubo 1 y transvasarlo al tubo N 2. d) Homogeneizar la mezcla de suero y SF con la misma pipeta. Luego se toman 0,100 ml de la misma y se trasvasan al tubo de Kahn N 3. Homogeneizar y repetir la operación hasta completar las diluciones. A.1.2 Titulación a) Se toman 10 tubos de Kahn, numerados del 1 al 10 y se disponen en una gradilla. Con una pipeta Pasteur para cada dilución, colocar 2 gotas de las mismas en los correspondientes tubos. b) Adicionar con pipeta Pasteur 2 gotas de suspensión de hematíes al 2%. Agitar la mezcla. c) Incubar a la temperatura apropiada, el tiempo requerido. d) Simultáneamente se llevan a cabo controles de autoaglutinación y de especificidad del suero. e) Leer los resultados macro y microscópicamente comenzando por los controles y luego por el tubo de mayor dilución. El grado de aglutinación se considerará según los scores anteriormente indicados. El título es la recíproca de la dilución más alta donde se observa aglutinación. Si en la última dilución, con aglutinación, el tipo de aglutinato es tr, el título se determinará promediando dicha dilución con la precedente. Por ejemplo, si en el tubo N 5 cuya dilución es 1/16, el tipo de aglutinato es tr, el título será (16+8)/2=12. a) Control de autoaglutinación: consiste en enfrentar dos gotas de suspensión de hematíes a usarse con dos gotas del suero del dador de hematíes. b) Control de especificidad del suero: consiste en enfrentar dos gotas de hematíes O con dos gotas del suero a titular. 55
56 TRABAJO PRÁCTICO N 7 SEPARACION ELECTROFORETICA DE HEMOGLOBINAS Fundamentos La electroforesis consiste en la separación de partículas aprovechando su traslado mediante la aplicación de campos eléctricos. La capacidad de movimiento de las diferentes moléculas depende de la intensidad del campo aplicado, su carga y su peso molecular. La hemoglobina, proteína presente en los glóbulos rojos, tiene varias formas moleculares, algunas normales y otras anormales. El proceso de electroforesis aprovecha el hecho de que las diferentes hemoglobinas migran a diferentes velocidades, permitiendo así su separación. En acetato de celulosa, a ph alcalino, la HbA migra hacia el ánodo, mientras que la HbF (que en condiciones normales se encuentra en pequeñas cantidades) queda cercana a esta. La HbA 2 tiene una velocidad menor por lo que queda cerca del cátodo. Durante la electroforesis, una corriente eléctrica pasa a través de la muestra de sangre de una persona, lo cual hace que los tipos de hemoglobina se separen en diferentes momentos y formen bandas. Al comparar la forma en la que se separan con la de una muestra de sangre normal, se pueden ver los tipos y las cantidades de hemoglobina existentes en la muestra de sangre. Entre sus ventajas están, que constituye una microtécnica y el costo en reactivos y tiempo laboral es muy bajo; además mediante esta técnica pueden diferenciarse con precisión la presencia de las hemoglobinas A, S y C. Soporte: Acetato de celulosa gelatinizado, en medio alcalino (ph= 8,5). Las tiras deben conservarse en posición vertical y en un recipiente tapado conteniendo metanol al 40%. Las tiras secas pierden las dimensiones y las características del gel. La superficie de las tiras que es penetrable a las proteínas se reconoce porque es más opaca luego de secarse entre dos tiras de papel de filtro. Reactivos Solución buffer: Tris-(hidroximetil)-amino etano...10,2 g EDTA di sódico....0,6 g Ácido Bórico. 3, 2 g Agua Destilada.1000mL Solución colorante: Amido Schwartz (0,5 g Amido Schwartz / 45 ml alcohol metílico / 10 ml ácido acético / 45 ml agua destilada) Solución decolorante: Ácido acético 5%. Ácido acético: metanol (1+9). Solución deshidratante: Metanol puro. Solución de transparentización (preparar en el momento) : Metanol...85 ml Ácido acético...14 ml Glicerol...1 ml 56
57 Solución disolvente: Ácido acético 80% Preparación de solución de hemoglobina Puede utilizarse sangre fresca con cualquier anticoagulante (EDTA di sódico). Centrifugar la sangre a 3000rpm durante 10 min en tubo de centrifuga cónico. Separar por aspiración el plasma sobrenadante y la capa de blancos y plaquetas. Lavar los glóbulos rojos 3 veces con solución fisiológica 5 min. Centrifugar cada vez a 3000 rpm. El último centrifugado dejarlo 15 min. Separar el sobrenadante. Agregar a los GR igual volumen de agua destilada. Mezclar bien por inversión con tapón. Dejar reposar 10 min. Agregar un volumen de tetracloruro de carbono igual a la mitad del volumen de GR. Agitar enérgicamente 5 a 10 min. Dejar reposar 30 min. Centrifugar a 3000 rpm durante 15 min. Aspirar la solución límpida de Hb que queda en la parte superior del tubo. Se determina la concentración de hemoglobina en el hemolizado obtenido, mediante el método de la cianometahemoglobina, se lleva la concentración hasta los valores 7-8 g/dl de hemoglobina con agua destilada o solución fisiológica. Esta solución de Hb debe procesarse inmediatamente si se sospecha de hemoglobina H. de no ser así puede conservase una semana a -20 C. Técnica 1. Sumergir las tiras en el buffer por lo menos 10 minutos. 2. Eliminar el exceso de líquido secando entre 2 papeles de filtro (suavemente). 3. Extender las tiras sobre el puente de la cámara electroforética. La superficie penetrable tiene que ir dirigida hacia arriba. La tira debe estar bien tiesa y plana. Operar rápidamente para evitar evaporaciones. 4. Sembrar las muestras: hemolizado obtenido siguiendo la técnica expuesta en el presente trabajo. 5. Conectar la fuente de poder, realizar la corrida a un voltaje constante de 200 volts, durante 60 minutos. 6. Desconectar la corriente y retirar las tiras. 7. Colorear durante 5 minutos. 8. Decolorar de la siguiente manera: - 5 minutos en AcH al 5%. - 5 minutos en AcH al 5%. - 5 minutos en AcH: metanol (1+9). 9. Determinación cuantitativa: Cortar las fracciones coloreadas e introducirlas en tubos de ensayo conteniendo la solución disolvente y agitar. Leer a 630 nm. si se usó colorante Amido Schwartz. 10. Transparentización: Luego de decolorar las tiras se sumergen en metanol puro anhidro durante 30 segundos, a continuación se las coloca en la solución transparentizadora durante 1 minuto como mínimo. Se colocan luego en una placa de vidrio, eliminando cuidadosamente las burbujas de aire y se calienta a la llama de un mechero durante unos minutos, hasta la transparencia completa. Así se conserva para leer en densitometría. 57
58 El siguiente cuadro muestra los resultados obtenidos en diferentes Hemoglobinopatías TIPO Polo negativo Polo positivo ACLARACIONES Normal HbA 98% Recién nacido Drepanocitosis homocigota Drepanocitosis heterocigota Hemoglobinopatía C homocigota Hemoglobinopatía C heterocigota -talasemia heterocigota -talasemia homocigota Doble Heterocigota S/C *Datos de bibliografía Anhidrasas HbA 2 HbA Carbónicas Anhidrasas HbA 2 Carbónicas Anhidrasas HbA 2 Hb S Carbónicas Anhidrasas HbA 2 Hb S Carbónicas Anhidrasas Carbónicas HbC HbF HbA HbA Anhidrasas HbC HbA Carbónicas Anhidrasas HbA 2 Carbónicas Anhidrasas HbA 2 Carbónicas Anhidrasas HbC HbS Carbónicas HbA HbF HbA HbA 2 2% HbF Aprox 90% HbA 10% HbA 2 1% HbA 2 2% HbS 98% HbA < 50% HbS > 50% HbA 2 2% HbC 98% HbA 2 2% HbC > 50% HbA < 50% HbA 2 entre 4-8%* (Hasta 5%) HbA 2 normal % de HbF y HbA, variable según tipo de Th homocigota HbS 50% HbC 50% 58
59 TRABAJO PRÁCTICO N 8: CITOQUÍMICA -MEDULOGRAMA En el laboratorio de hematología, la citoquímica constituye un elemento de capital importancia y un complemento indispensable al la observación morfológica convencional para la identificación de las estirpes celulares. La citoquímica estudia la composición química de la célula y permite detectar la localización topográfica de algunos principios inmediatos, enzimas, metales pesados y otras sustancias. Se considera como un nexo de unión entre la morfología y la bioquímica En este trabajo se describirán las técnicas citoquímicas aplicadas con mayor frecuencia en la Hematología tradicional. TECNICAS CITOQUIMICAS: RECONOCIMIENTO DE SUSTRATOS NO ENZIMATICOS Tinción histoquímica de hierro: coloración de Perls La coloración de Perls pone de manifiesto la presencia de hemosiderina en el citoplasma tipo de célula pudiendo ser aplicada a las células presentes en un extendido de médula ósea. La hemosiderina es un derivado insoluble de la ferritina, que se considera el resultado de la precipitación de varias moléculas desnaturalizadas de apoferritina. Normalmente, constituye el hierro no hemínico de los eritroblastos y puede hallarse abundantemente en las células del sistema mononuclear fagocítico. CONSIDERACIONES 1. Frotis de la médula ósea bien extendidos en portaobjetos totalmente libres de hierro. Se debe tener cuidado de evitar toda contaminación por exceso de hierro que pueda contener el portaobjeto a utilizar en la coloración; para ello deberán ser sumergidos en una solución de HCl 3 mol/l como mínimo dos minutos o más para poder eliminar todo exceso de hierro. 2. Solución clorhídrica de ferricianuro potásico. Debe prepararse extemporáneamente mezclando dos volúmenes iguales de una solución acuosa de ferricianuro potásico al 2% en agua destilada (20g/L) y otra en HCl 0.2 N durante 10 minutos a temperatura ambiente (24ºC). METODO 1. Fijar los frotis en metanol o etanol al 80% durante minutos. 2. Dejarlos secar a temperatura ambiente. 3. Preparar en el momento la solución compuesta por partes iguales de ferrocianuro de potasio (20gr/L) y HCl 0,2M. 4. Dejar actuar dicha solución durante 10 minutos. 5. Lavar con agua de canilla durante 20 minutos. 6. Enjuagar con agua destilada. 7. Contracolorear con Hematoxilina durante 1-2 minutos. 8. Dejar secar y luego observar en microscopio óptico. 59
60 Resultados Tinción de Perls en Anemia Sideroblástica Refractaria (100x) Detección histoquímica de hemoglobina fetal: reacción de Kleihauer-Betke FUNDAMENTO La hemoglobina fetal (HbF o 2 2 ) es ácido y alcalirresistente. Por consiguiente, sometido un preparado fresco de sangre a una elución ácida será arrastrada la hemoglobina A y retenida la fetal dentro de los eritrocitos, lo cual se reconoce por la coloración de estos últimos. REACTIVOS 1. Alcohol etílico al 80% 2. Buffer de ácido cítrico, ph 3,4 constituido por dos soluciones: Solución A: Ácido cítrico... 4,2 g Agua destilada ml Solución B: Citrato de sodio... 5,9 g Agua destilada ml Solución Buffer ph 3,4: Solución A ml Solución B ml 3. Eosina al 0,1 % en agua. DESARROLLO 1. Extendidos de sangre secos de no más de una hora de obtención, se fijan durante 5 minutos en el alcohol etílico al 80% 2. Lavado rápido con agua y secado. 3. Inmersión en una cápsula de Petri que contenga el buffer de citrato. Llevarlos a estufa a 37 C un mínimo de 5 minutos, agitando cada dos minutos. Lavar rápidamente en agua común y secar en posición vertical. 4. Colorear en 3 a 5 minutos con la solución de eosina. Lavar con agua y secar. RESULTADOS Los hematíes con hemoglobina fetal se colorean por la eritrosina o eosina. Los que contienen hemoglobina A han sido reducidos a sus membranas vacías y aparecen como sombras. El análisis cuantitativo puede hacerse estableciendo el porcentaje de hematíes coloreados e incoloros. 60
61 Resultados Hematies con Hemoglobina Fetal (100x) RECONOCIMIENTO DE SUSTRATOS ENZIMATICOS PEROXIDASAS (MIELOPEROXIDASA) Fundamento Método de Washburn: frente al agregado de agua oxigenada, aquellas organelas que poseen la enzima desprenden oxígeno naciente del agua oxigenada y este oxida la bencidina a un óxido intermedio color azul oscuro al principio que luego vira al negro. Reactivos 1. Colorante (conservar en heladera y oscuridad) Bencidina 300 mg Solución saturada de nitroprusiato de Na 1 ml Alcohol etílico absoluto 99 ml 2. Solución H 2 O 2 -AcH H 2 O 2 (10 vol.) H 2 O destilada AcH puro 2 gotas 50 ml 1 gota Preparar en el momento. Procedimiento 1. Fijar el extendido con metanol o etanol 80% durante 5 minutos. Conviene etanol 80%. 2. Impregnar el extendido con la solución 1 durante 3 minutos. 3. Volcar sobre la misma solución anterior la solución 2, dejar actuar durante 2 minutos. 4. Pasado el tiempo tomar el extendido con alguna pinza, lavarlo y dejarlo verticalmente hasta que se seque. 5. Contracolorear con una solución de Giemsa diluido 1/10 durante 15 minutos. 6. Lavar con agua de canilla y dejar secar 7. Observar al microscopio óptico con aceite de inmersión. Resultados Positivo: citoplasma cubierto de color negro en aquellas células que poseen la enzima (100x) 61
62 BIOPSIA Y ASPIRADO DE MEDULA ÓSEA - MEDULOGRAMA La biopsia de médula ósea (BMO) se ha convertido en una herramienta útil en el diagnóstico de enfermedades hematológicas, de neoplasias primarias o metastásicas y estadificación de las mismas, de infecciones, y de enfermedades metabólicas. Para optimizar la valoración de la BMO, es necesario conocer los datos clínicos y de laboratorio, incluyendo los resultados de la sangre periférica y del aspirado de la médula ósea (MO), así como las posibilidades diagnósticas del médico tratante. Se debe contar con un procedimiento técnico adecuado para obtener y procesar la BMO. La médula ósea (MO) comprende entre 3.5 y 6% del peso corporal; es el principal órgano de hemopoyesis; es un órgano linfoide primario y secundario que proporciona un medio para la maduración celular y la interacción inmunológica; está influida por factores reguladores para la producción normal de células sanguíneas. La hemopoyesis es el proceso de producción de elementos formes de la sangre, y está localizada en el compartimento extravascular de la MO. La hemopoyesis en la MO se inicia desde la mitad de la gestación, y es el mayor sitio de hemopoyesis al nacimiento. Durante el primer año de la vida la hemopoyesis tiene lugar en la MO de huesos axiales y radiales del esqueleto, y a partir de la mitad de la adolescencia los huesos planos centrales se convierten en los principales sitios de hemopoyesis. Importa señalar que uno de los factores que modifican la hemopoyesis es la edad; los recién nacidos pueden tener una celularidad entre el 80 y 100% en la MO, mientras que en los ancianos de más de 70 años, la celularidad normal puede ser de menos del 50%. Conforme los niños crecen, la celularidad de la MO va decreciendo; en menores de 9 años la celularidad es del 78% ± 13, y de 10 a 19 años es de 72% ± 11. Las células progenitoras o células madre circulan en la sangre periférica y se alojan en la MO; de esta manera hay un suplemento continuo de células pluripotenciales, capaces de autorenovarse y diferenciarse en células destinadas hacia eritropoyesis, granulopoyesis, monocitopoyesis y megacariocitopoyesis. Las células progenitoras pluripotenciales, además de dar orígen a los eritrocitos, granulocitos, megacariocitos y plaquetas, también generan linfocitos (linfopoyesis), células cebadas y macrófagos. INDICACIONES La BMO está indicada en todas las enfermedades que puedan afectarla, ya sea en forma primaria o secundaria. La indicación hematológica más frecuente corresponde a la disminución de elementos formes de la sangre periférica, las citopenias, leucopenia, anemia y trombocitopenia, ya sea en forma aislada o de las tres series (pancitopenia). Las citopenias periféricas pueden deberse a: 1) producción insuficiente de células en la MO; 2) incremento en su utilización periférica, por destrucción o por pérdida, sin una adecuada producción compensadora en la MO; 3) una combinación de estas causas. El aspirdo de MO se utiliza frecuentemente para el diagnóstico de procesos proliferetivos ya sea para la observación microscópica como para la inmunomarcación y posterior identificación por citometría de flujo. Las especialidades médicas que con mayor frecuencia solicitan la BMO corresponden a hematología, oncología, infectología y medicina interna. Las indicaciones de la BMO se agrupan en Cuadro 1. Cuadro 1: Indicaciones de BMO - En pacientes con citopenias no explicadas previamente por los estudios hematológicos (incluye la evaluación de procesos mielodisplásicos) - En la sospecha de infiltración de neoplasia con diagnóstico previo desconocido - Para la estadificación oncológica de tumores con diagnóstico previo confirmado: linfomas, otros tumores sólidos como neuroblastoma, rabdomiosarcoma, etc. - Para conocer la respuesta al tratamiento de algunas neoplasias: remisión, recaída, etc. - Evaluación de la médula ósea antes del trasplante de células progenitoras - En el estudio de pacientes con fiebre de origen desconocido: sospecha de agentes infecciosos como histoplasmosis, tuberculosis. - En la evaluación de pacientes con enfermedad metabólica por depósito de material anormal 62
63 CONTRAINDICACIONES No existe una contraindicación absoluta para la BMO. Se debe tener controlado al paciente con tendencia a sangrar y conocer el tipo de tratamiento que puede ocasionar hemorragias: aspirina o anticoagulantes. COMPLICACIONES En general la BMO es un procedimiento relativamente bien tolerado y con bajo riesgo de morbilidad. Las complicaciones de la toma de BMO son raras; corresponden a 0.08%, generalmente debido a sangrados que pueden ocasionar hematomas. Otras complicaciones más serias son aún menos frecuentes, como la neuropatía transitoria, una infección de la herida y osteomielitis, reacción a medicamentos, así como dolor persistente. El riesgo de sangrado puede ser mayor en pacientes con trombocitopenia y alteraciones de la función plaquetaria; ellos deben tenerse en observación en el hospital por 24 horas después del procedimiento. La siembra de células malignas puede ocurrir excepcionalmente en pacientes con metástasis diseminadas. TECNICA La BMO se debe realizar exclusivamente por personal capacitado y con experiencia en la técnica. La BMO se puede tomar en forma uni o bilateral, generalmente de la cresta ilíaca posterosuperior. Para el estudio de enfermedades hematológicas, un fragmento es suficiente. Para el estudio de las neoplasias malignas, frecuentemente se toman biopsias de dos sitios diferentes: una de cada cresta ilíaca. El sitio de donde se obtiene la biopsia debe ser de fácil acceso, con mínimo trauma y sin peligro para el paciente. En niños muy pequeños o en pacientes no cooperadores, la biopsia se toma bajo anestesia general. En lesiones óseas precisas es importante la guía con estudios de imagen. La aguja para biopsia que más se usa, especialmente por los hematólogos, es la de 11 a 8 gauge, que obtiene una biopsia de 2 mm de diámetro, con una longitud de 1 a 2 cm, de acuerdo con la profundidad a la que se introduce la aguja. El aspirado de MO debe efectuarse después de haber tomado la biopsia del tejido, colocando la aguja a 1 cm de esa zona; se hacen los frotis, y el material restante se puede colocar en tubos con anticoagulante para estudio con citometría de flujo, para estudios citogenéticos, etc. MANEJO DEL TEJIDO La biopsia de MO se debe fijar de inmediato en formaldehido con amortiguador (buffer) de fosfatos al 10%, cuando menos durante seis horas; posteriormente se coloca en solución descalcificadora, generalmente suficiente por 24 h. Los cortes histológicos no deben exceder 4 micras de espesor. Las tinciones iniciales más usadas son hematoxilina y eosina, ácido periódico de Schiff (PAS), Giemsa, tinción para fibras reticulares (Sweet) y para hierro (Perls). Se realizarán estudios adicionales con imunohistoquímica, si son necesarios, sobre todo para el diagnóstico diferencial de neoplasias. INTERPRETACIÓN Histología normal En condiciones normales el tejido hematopoyético en los espacios medulares tiene una distribución y topografía especiales: los grupos de células eritropoyéticas, los megacariocitos y las formas maduras de la serie granulocítica, se localizan en sinusoides del centro del espacio medular, mientras que los precursores mieloides tempranos se localizan con relación a la superficie endosteal de las trabéculas óseas y en la vecindad de las arteriolas. Por lo tanto, las variaciones espaciales de las diferentes series son importantes en la interpretación. Las células madre no se identifican por la morfología tradicional en los aspirados de MO, aunque recuerdan a las células linfoides pequeñas. Las células madre se identifican por su función y por el inmunofenotipo que incluye la expresión de CD34, c-kit y Thy1, y están localizadas en la región endosteal de la MO. 63
64 Celularidad. La celularidad en la MO corresponde a la proporción entre las células hemopoyéticas y el tejido adiposo, que varía según la edad del paciente, es casi del 100% en recién nacidos y disminuye aproximadamente 10% conforme avanza cada década de la vida (Cuadro 2). En los recién nacidos a término hay predominio de los precursores mieloides, que ocupan dos terceras partes de la celularidad, y disminuyen a un tercio al mes de edad. Los linfocitos en recién nacidos ocupan un 15%, y aumentan hasta 50% al mes de edad, lo que se prolonga hasta los 18 meses. Relación mieloide:eritroide (RM:E). Se refiere a la proporción relativa entre el componente granulocítico y el eritroide; el resto de los componentes de la médula ósea (megacariocitos, linfocitos, células plasmáticas) no se toman en cuenta en esta relación. En la primera semana de vida hasta el 70% de las células corresponde a la serie eritroide, principalmente proeritroblastos y eritroblastos basófilos, por lo que la RM:E en esta etapa de la vida está invertida, y es de 1:2. Posteriormente el componente granulocítico aumenta y la relación se estabiliza entre 2.5:1 y 4:1 en adultos. La tinción de PAS acentúa la diferencia entre los dos componentes, ya que la serie granulocítica tiene citoplasma PAS positivo difuso. La IHQ con anticuerpos antimieloperoxidasa y anti-glucoforina, identifica con mayor precisión los dos componentes. MÉDULA ÓSEA NORMAL 64
65 Eritropoyesis. En condiciones normales la maduración de eritroblasto a normoblasto se lleva a cabo en cinco días, y estos precursores nucleados de los eritrocitos se encuentran en grupos (seis o más células) con grados variables de maduración. Frecuentemente se localiza un macrófago (célula reticular) en el centro o en la vecindad de los grupos eritropoyéticos y aparentemente tiene un papel importante en la producción normal de células rojas. La RM:E normalmente es de 1.5:1 a 3:1. Una disminución en esta relación, encontrada en una MO normo a hipocelular, indica una hiperplasia eritroide, mientras no haya disminución en los otros elementos. Las células eritroides tienen núcleo redondo, hipercromático con un halo perinuclear, características que las distinguen de los linfocitos maduros. La tinción de Giemsa identifica a la serie eritroide por la basofilia intensa de su citoplasma. Una de las alteraciones más frecuentes es la modificación en la maduración con cambios megaloblásticos, en la que se observan precursores rojos con núcleos más grandes e irregulares. ISLOTE ERITROBLÁSTICO Granulopoyesis. En condiciones normales todas las células de la serie granulocítica se identifican en la BMO: mieloblastos, promielocitos, mielocito, metamielocito, bandas y segmentados (neutrófilos, eosinófilos y basófilos). Un incremento en la RM:E, en MO normal o hipocelular, sin disminución de las otras series, indica hiperplasia granulocítica. Normalmente los precursores granulocíticos como los promielocitos y los mielocitos, no exceden el 3% y se encuentran distribuídos junto a la superficie del endocito de las trabéculas óseas. Los metamielocitos, bandas y segmentados se localizan hacia el centro de la región intrertrabecular, y las células maduras llegan a la circulación, migrando a traves del endotelio de sinusoides. Las tinciones de IHQ con mieloperoxidasa, CD-117, CD-13, CD-15, CD-33 las identifican; las células progenitoras se identifican con CD-34 y QBEND10. Células cebadas. Generalmente se encuentran adyacentes a las células endoteliales de sinusoides, bordeando la superficie endosteal de las trabéculas óseas, en el periostio y adyacentes a la pared de pequeñas arterias; aparentemente se originan del mismo precursor de los granulocitos basófilos. Se caracterizan por tener núcleo redondo u oval con gránulos citoplásmicos basófilos, que son rojos con la tinción de Giemsa y positivos con CD117 por IHQ. Puede aumentar su número en algunos procesos infecciosos y por efecto de medicamentos. Megacariocitos y trombopoyesis. Los megacariocitos son las células más grandes de la MO, con diámetros que van de 12 a 150 μm; varían en tamaño y en la configuración nuclear, son positivos con la tinción de PAS. Se reconocen tres etapas de maduración: 1) megacarioblasto que mide 15 a 20 μm, con núcleo oval o arriñonado y citoplasma basófilo; 2) promegacariocito que mide de 20 a 80 μm, cuyo citoplasma es menos basófilo y tiene una zona perinuclear de gránulos en desarrollo; 3) megacariocito maduro con núcleo cerebriforme o multilobulado, citoplasma eosinófilo con granularidad variable; en esta etapa se liberan las plaquetas. Los megacariocitos maduros se hallan en relación a las sinusoides y liberan directamente las 65
66 plaquetas hacia la luz. Todo el megacariocito o parte de su citoplasma entra al sinusoide, y se fragmenta directamente en el sistema vascular. En niños menores de nueve años normalmente hay 20+/-8 megacariocitos por mm 2 ; en adolescentes, 16+/-4, y disminuyen conforme avanza la edad hasta 10+/-6 en los ancianos. Otra forma de cuantificarlos es de 1 a 3 por campo a 40x. Puede haber agrupamiento de megacariocitos cuando hay regeneración de la MO, sin que esto sugiera neoplasia. Las tinciones auxiliares de IHQ para facilitar su identificación son: relacionado al Factor VIII, CD-41, CD-61 y CD-79a. Monocitos/macrófagos y células dendríticas. Estas células tienen una progenitora común que comparten con los granulocitos, y en condiciones normales generalmente son invisibles. Los monocitos llegan de la circulación a la MO, son menos del 5% del total de las células, y maduran hacia macrófagos/histiocitos. Los macrófagos tisulares tienen núcleo redondo con nucléolo de tamaño variable y citoplasma abundante que frecuentemente muestra elementos celulares fagocitados (eritrocitos, fragmentos nucleares, hemosiderina), y son responsables de la fragmentación de eritrocitos viejos y del almacenamiento de hierro. Son positivas con CD68 y para CD163 con IHQ. En estas células se encuentra el material de depósito anormal de las enfermedades metabólicas por almacenamiento. Las células dendríticas son escasas en la MO; se pueden identificar con IHQ porque son positivas con proteína S-100 y CD1a. Linfocitos y linfopoyesis. La función linfopoyética de la MO, existe desde las etapas embrionarias y persiste hasta la vida adulta, aunque en menor proporción. Las células linfoides se encuentran dispersas en la MO, independientemente de que se hayan originado en este sitio; comprenden entre 15 y 20% de la celularidad, y conservan la misma proporción, que en la sangre periférica: 65-75% son linfocitos T (CD-3+); 10-15% son linfocitos B (CD-20+), y 10-20% son NK (CD-56+ y CD-16+). La proporción de cúmulos linfoides aumenta con la edad. En los procesos benignos los cúmulos linfoides se localizan en la región intertrabecular y perivascular; cuando son paratrabeculares sugieren malignidad. Hematogonias. Son precursores de linfocitos B benignos, que generalmente no se identifican en los aspirados de MO. En la BMO tienen núcleo denso, sin nucléolo prominente y escaso citoplasma; presentan una mezcla de positividad para CD-45, CD-34, tdt, CD-20 y CD-10. Importa señalar que sólo una pequeña proporción de ellas son positivas para tdt y CD-34. Su presencia varía de 3 hasta 25% en recién nacidos y prematuros sanos. En condiciones normales disminuyen las hematogonias a 9% en niños menores de dos años; hasta 3-4% a los 5 años de edad. Pueden aumentar a más de 5% en MO con cambios regenerativos, sobre todo relacionados con citopenias. La población de hematogonias siempre exhibe un espectro variable en la expresión de antígenos que identifica una maduración normal, continua y completa de los precursores B. Esto las distingue de las células de la LAL-pre-B, ya que éstas carecen de maduración, y además pueden presentar expresiones aberrantes de antígenos asociados con diferenciación mieloide. El conocimiento de este hallazgo es pertinente para la interpretación adecuada de la BMO en los diferentes grupos de edad. Hay que destacar que las hematogonias no se encuentran en sangre periférica. Células plasmáticas. Representan la etapa final de la maduración de un grupo de linfocitos B; corresponden al 1% de la celularidad de la BMO; son positivas con IHQ para kappa, lambda y CD-138. En niños y adolescentes hay de 20 a 30 células por mm 2. Cuando la IHQ muestra restricción para una de las cadenas ligeras (kappa o lambda), es un dato útil para sospechar monoclonalidad. Hay dos tipos de células plasmáticas normalmente presentes en la MO: uno corresponde a las habituales previamente mencionadas y fácilmente identificables, denominadas reticulares (Marschalko); el otro tipo es la célula plasmática linfoplasmocitoide, que deriva de linfocitos B positivos para IgM; es más pequeña, con escaso citoplasma, núcleo menos excéntrico, y zona de Golgi poco definida; frecuentemente aparece en infecciones virales. 66
67 Estroma. Proporciona el sostén del tejido hematopoyético, constituído por células adiposas, fibroblastos y sus prolongaciones; por la extensa red de vasos sanguíneos, incluyendo sinusoides y por los nervios acompañantes. Las fibras reticulares normalmente sólo se localizan alrededor de los vasos con muy ocasionales fibras en las celdillas, que se visualizan con tinciones de Gomori o de Gordon-Sweet.. Todo esto constituye el microambiente de la MO, con una estrecha relación entre todos los elementos mesenquimatosos y la hemopoyesis. Las moléculas de adhesión son las responsables de que las células madre permanezcan en el estroma. Las células adiposas ocupan una tercera parte del volumen de la MO. RESUMIENDO: PROGENIE % RELATIVOS ERITROIDE Proeritroblastos 0,5 7,5 % Eritroblastos basófilos Eritroblastos policromatófilos 7 40 % y ortocromáticos MIELOIDE Mieloblastos 0,5 5 % Promielocitos 0 7,5% Mielocitos 5 25 % Metamielocitos 5 20 % Cayados 5 25 % Segmentados 0,5 15 % Eosinófilos 1 7 % Basófilos 0 1 % LINFOIDE Linfoblastos 0,5 4 % Linfocitos 2,5 15 % Células plasmáticas 0,5 3% MONOCITOS y su 0,5 3% progenie MEGACARIOCITOS 0,5 2 % (AUMENTO 40 X) Artificios en médula ósea. Pueden ocurrir debido a una técnica inadecuada, a un error en la toma de la muestra, o por artificios en la preparación histopatológica. La depleción de la celularidad acompañada de hemorragia se puede presentar cuando se realiza primero el aspirado y posteriormente se efectúa en el mismo sitio la biopsia de MO. CITOPENIAS Citopenia de serie roja La aplasia pura de la serie roja puede ser congénita como en el síndrome de Blackfan-Diamond, o adquirida, por inhibición selectiva de la eritropoyesis como en la insuficiencia renal crónica. Hay formas transitorias como ocurre en el curso de procesos virales, en lupus eritematoso sistémico y en estados preleucémicos En la BMO la vista panorámica puede no mostrar alteraciones en la celularidad, pero a mayor aumento llama la atención que no se observan las islas eritropoyéticas normales, y sólo en forma ocasional uno o dos precursores eritroides; puede haber depósito de hierro en las células estromales y escasos agregados linfoides, que frecuentemente corresponden a hematogonias 67
68 Citopenia de serie blanca La causa más frecuente de neutropenia adquirida son los procesos infecciosos, en los que aumenta la destrucción de neutrófilos. La BMO puede mostrar necrosis, edema y fibrina. Una alteración semejante se puede observar en la citotoxicidad inducida por medicamentos. El síndrome de Shwachman-Diamond es una enfermedad congénita con herencia autosómica recesiva, caracterizado por insuficiencia pancreática exócrina y neutropenia severa. La BMO muestra disminución acentuada de células precursoras y de granulocitos maduros La neutropenia con una BMO hipercelular se puede ver en pacientes con enfermedades autoinmunes: artritis reumatoide, síndrome de Felty, lupus eritematoso sistémico, y en ciertos tipos de linfomas. Hay que recordar que las inmunodeficiencas primarias también pueden cursar con neutropenia Citopenia de megacariocitos Los mecanismos de trombocitopenia pueden corresponder a: 1) defecto en la producción, donde la BMO muestra disminución de megacariocitos; 2) pérdida o utilización acelerada como en la coagulación intravascular diseminada, el síndrome urémico hemolítico, la septicemia, o los procesos autoinmunes; 3) distribución anormal, particularmente en esplenomegalia. Al igual que otras citopenias, también se divide en trombocitopenia primaria y adquirida. Las trombocitopenias primarias incluyen las congénitas, como el síndrome de Tar en el que se reduce el número de megacariocitos, y las constitucionales, donde la MO es celular con ausencia virtual de megacariocitos; algo semejante se ve en trombocitopenias, en el síndrome de Wiskott-Aldrich y sus variantes. Las trombocitopenias adquiridas frecuentemente se deben a procesos infecciosos o tóxicos, a infiltración neoplásica, en síndrome urémico hemolítico, en procesos autoinmunes como la púrpura trombocitopénica idiopática donde hay anticuerpos con IgG contra los antígenos de las plaquetas. Sin embargo, en estos casos la MO muestra megacariocitos normales en la fase aguda, y elevada en número en la fase crónica. Anemia Aplásica. Es la disminución acentuada de elementos maduros en la sangre periférica (pancitopenia), debido a la producción insuficiente en la MO; puede ser familiar, congénita o secundaria. La más frecuente es la secundaria, generalmente por exposición a agentes tóxicos. Se requiere la BMO para excluir otras causas de pancitopenia, así como para conocer la gravedad de la hipoplasia/ aplasia y la reacción del estroma. Para una adecuada valoración en estos pacientes, se necesita de una biopsia de 20 a 30 mm de longitud, excluyendo la cortical ósea La BMO muestra acentuada hipocelularidad, de 5 a 10% o menos; escasas células maduras, prácticamente sin mieloblastos, y entonces debido a la hipoplasia medular, otros elementos como los linfocitos y las células plasmáticas pueden ser evidentes. Generalmente no hay fibrosis reticulínica en los casos de anemia aplásica secundaria idiopática. HIPOCELULAR MO NORMAL MO 68
69 HIPERPLASIA DE MO La hiperplasia de la MO es frecuente en procesos no neoplásicos, como las infecciones bacterianas y virales (virus de Epstein-Barr); las reacciones alérgicas y los medicamentos. En ocasiones estos procesos elevan el número de células mieloides maduras, principalmente granulocitos neutrófilos y ocasionan las llamadas reacciones leucemoides. La diferenciación histológica entre una reacción leucemoide y una leucemia mieloide crónica, exclusivamente con la BMO es prácticamente imposible; sin embargo, en los procesos reactivos generalmente hay un incremento proporcionado de los tres elementos de la MO. La eosinofilia periférica se refleja en la BMO con incremento en el número de eosinófilos maduros que puede deberse a infecciones parasitarias, enfermedades alérgicas y dermatológicas, a mastocitosis sistémica y a reacción a los medicamentos. La eosinofilia acentuada se puede observar en el síndrome hipereosinofílico como precursor de leucemias/linfomas de tipo linfoblástico, y en el linfoma de Hodgkin El incremento en la megacariopoyesis puede verse en la púrpura trombocitopénica idiopática, en la hemólisis, el hiperesplenismo, enfermedades linfoproliferativas, linfoma de Hodgkin y otras neoplasias malignas. En estos casos el incremento de megacariocitos se presenta sin pleomorfismo ni atipia. MO HIPERBLÁSICA MO HIPERPLÁSICA ALTERACIONES DE LA MADURACIÓN Síndromes mielodisplásicos. La MO muestra un aumento en la proliferación de las células germinales con alteración en la maduración (displasia), hemopoyesis defectuosa de una o más líneas celulares con incremento en la apoptosis, lo que causa discrepancia entre la hipercelularidad de la MO y las citopenias periféricas. En algunos casos la proliferación sobrepasa a la apoptosis y entonces la hipercelularidad de la MO puede coexistir con elevación de la cuenta de las células periféricas. Estos casos se pueden confundir fácilmente con desórdenes mieloproliferativos y se designan como síndrome mielodisplásico/mieloproliferativo mixto. Los SMP son muy raros en niños: 4 por Aproximadamente una tercera parte de los niños con SMD tienen un trastorno genético predisponerte, como alteraciones cromosómicas, inmunodeficiencias primarias o deficiencia en la reparación del ADN. Es importante mencionar que la BMO puede mostrar cambios de tipo mielodispoyéticos/mielodisplásicos (MD), que morfológicamente pueden ser indistinguibles del SMD, pero clínicamente pueden corresponder a causas exógenas como deficiencias vitamínicas o de hierro, neoplasias malignas (tumores sólidos), infecciones, reacción tóxica a 69
70 medicamentos, alteraciones autoinmunes, cambios regenerativos transitorios secundarios a quimioterapia, a radioterapia o ambas, así como en hemopoyesis residual en las etapas intermedias entre desordenes linfoproliferativos y linfomas. La morfología que muestra la BMO en el SMD generalmente es de hipercelularidad con maduración inadecuada cuando menos en dos de las tres series: frecuentemente cambios megaloblásticos en la serie roja, hiperplasia de los precursores de la serie blanca con ausencia de maduración a polimorfonucleares e hiperplasia de megacariocitos, que pueden estar hipolobulados o ser pequeños, generalmente agrupados; se acompaña de localización anormal de los precursores inmaduros. Se ha relacionado el incremento de células de fenotipo blástico a mal pronóstico en pacientes con SMD. Frecuentemente se encuentran grados variables de fibrosis reticulínica y puede haber hemosiderina. En algunos casos las BMO repetidas pueden mostrar incremento de blastos o bien leucemia mieloide aguda. fibrosis no es común en EMPT, pero muy frecuente en LAM M7. Aparentemente esta mielopoyesis anormal no predispone a otro tipo de leucemia linfoide (Cuadro 8). Lesiones infiltrativas mieloides: Es poco frecuente que se tome BMO para el diagnóstico de LAM, ya que generalmente bastan los estudios hematológicos. En ocasiones se realiza porque los aspirados no son suficientes en celularidad, o porque la cuenta de blastos no rebasa 30%, sobre todo en el diagnóstico diferencial con síndrome mielodisplásico. El diagnóstico morfológico de LAM se sospecha en una MO con celularidad del 100% con células monótonas de citoplasma eosinófilo y núcleo con cromatina irregular y nucléolo prominente. La IHQ es importante para corroborar la inmadurez homogénea de las células mieloides con mieloperoxidasa, CD34 y CD117 positivos, acompañados de fibrosis reticulínica Grado II a III. Lesiones infiltrativas no mieloides: La neoplasia linfoide más frecuente en niños es la leucemia linfoblástica, ya sea pre-b o pre-t. Cuando se presenta el cuadro clínico típico de leucemia con más de 30% de blastos en sangre periférica o en los aspirados, generalmente el diagnóstico es hematológico y no es necesaria la BMO. Solamente cuando los aspirados de MO son insuficientes para el diagnóstico hematológico inicial o cuando se sospecha una recaída la BMO puede mostrar sustitución del tejido hemopoyético por una neoplasia de morfología homogénea con células de núcleo de cromatina fina, muy escaso citoplasma y frecuentemente fibrosis reticulínica en grado variable. La IHQ con positividad para antígeno común leucocitario (CD45), tdt, CD10 y CD-34 corrobora que se trata de blastos; si además es positiva para CD79a y PAX5, corresponde a LAL pre-b; si es positiva para CD3 el diagnóstico es LAL pre-t. El diagnóstico de linfoma en la BMO, generalmente se hace como parte del estudio de estadificación, una vez que el diagnóstico se ha hecho en otro tejido, frecuentemente ganglio linfático. Histiocitosis: Las histiocitosis que pueden infiltrar la médula ósea son de dos tipos: 1) Histiocitosis de células de Langerhans (HCL). Es una enfermedad clonal de células dendríticas epiteliales. La más frecuente es en niños, usualmente se observa en las dos primeras décadas de la vida y puede ser una enfermedad generalizada o localizada (hueso). La forma diseminada se caracteriza por lesiones en MO, huesos, hígado, bazo, ganglios linfáticos y otras vísceras; frecuentemente tiene curso clínico agresivo. La BMO muestra grupos intersticiales o láminas de histiocitos con citoplasma eosinófilo y núcleo con hendiduras, pueden formar células gigantes multinucleadas y están mezclados con un número variable de eosinófilos y linfocitos. También se puede encontrar fibrosis y hematopoyesis displásica, acompañada de hemofagocitosis que puede ser muy notable. Algunos casos de HCL pueden presentarse como síndromes hemofagocíticos. La IHQ corrobora la presencia de células de Langerhans con positividad para S-100 y CD1a. 2) Histiocitosis hemofagocítica. Es frecuente en niños. Se caracteriza por incremento de histiocitos que contienen elementos hemopoyéticos fagocitados. El síndrome hemofagocítico es una enfermedad grave en el que la proliferación de histiocitos ocurre en respuesta a una estimulación variada de citoquinas. Los pacientes presentan fiebre, hepatoesplenomegalia, 70
71 citopenias (anemia 80%; neutropenia, trombocitopenia o las dos 50%), incremento de triglicéridos e hipofibrinogenemia Procesos infecciosos Son múltiples los microorganismos que pueden alterar la MO; sin embargo, la BMO sólo está indicada en pacientes con fiebre en estudio en quienes múltiples estudios con cultivos, serológicos y de imagen, no han identificado la etiología. Algunos de estos pacientes pueden tener inmunodeficiencia primaria o secundaria (post-tratamiento de neoplasias o de enfermedades autoinmunes, SIDA), causante de una pobre respuesta inmune. Los gérmenes que frecuentemente se buscan en la MO son micobacterias y micosis, principalmente histoplasmosis. El parvovirus 19 puede ocasionar cuadros de anemia con reticulocitopenia por infección de los precursores eritroides y la MO muestra hipoplasia de la serie eritroide con pronormoblastos gigantes e inclusiones intranucleares que le dan aspecto de vidrio esmerilado con halo perinuclear. Enfermedades metabólicas Son susceptibles de biopsia de MO cuando se sospecha clínicamente una enfermedad por depósito de material que se pueda reconocer, frecuentemente en macrófagos: material eosinófilo fibrilar citoplásmico, PAS positivo en enfermedad de Gaucher, o bien macrófagos vaculados por lípidos en enfermedad de Niemann-Pick. Algunas enfermedades metabólicas con depósito sistémico de cristales, incluso en la MO, como la cistinosis y la oxalosis, muestran además de los cristales, alteraciones en el estroma. En la oxalosis los cristales son grandes y existen en el estroma y en la matriz ósea; son causa de fibrosis acentuada, así como reacción a cuerpo extraño. Los cristales de la cistinosis son menos visibles: son pequeños, rectangulares; están en el citoplasma de los macrófagos. Ambas enfermedades son autosómicas recesivas y ocasionan insuficiencia renal crónica, además de otras alteraciones multiorgánicas. 71
72 TRABAJO PRÁCTICO N 9 LEUCEMIAS AGUDAS LEUCEMIAS MIELOIDES AGUDAS La leucemia mieloide aguda (LMA) es un desorden caracterizado por presencia de células progenitoras mieloides en medula ósea (MO), infiltración de la sangre periférica (SP) y otros tejidos, así como también la interrupción de la hematopoyesis normal, ocasionando la disminución de los componentes mieloides de la sangre La LMA representa un grupo heterogéneo de enfermedades hematológicas que derivan de los precursores mieloides, monocíticos, eritroides y megacariocíticos de la MO. Las LMA se clasifican en primer lugar por su morfología (características del núcleo, citoplasma y gránulos) y también según las características citoquímicas, inmunofenotípicas (expresión de determinadas moléculas en la membrana o en el citoplasma de las células leucémicas, que son reconocidas por anticuerpos monoclonales mediante técnicas como la citometría de flujo), citogenéticas (alteraciones en el cariotipo) y moleculares (alteraciones que se detectan por Southern blott, PCR). Los mieloblastos difieren de los linfoblastos en que los primeros tienen una menor relación núcleo citoplasma, una cromatina nuclear más fina, y un nucleolo claramente en sacabocado. Los gránulos citoplasmáticos están frecuentemente presentes en los mieloblastos y la detección de cuerpos o bastones de Auer es patognomónica. BLASTOS MIELOIDES Aproximadamente un tercio de las LMA presentan bastones de Auer: inclusiones citoplasmáticas, que representan aglomeraciones de gránulos azurófilos. Los cuerpos de Auer contienen peroxidasa, enzimas lisosomales e inclusiones cristalinas. Cuando están presentes, son encontradas típicamente en solo 1 a 10% de los blastos. Se ven predominantemente en granulocitos inmaduros y solo raramente en monocitos inmaduros. Los promielocítos malignos pueden contener múltiples bastones de Auer agrupados en paquete, recibiendo estas células el nombre de células de faggot y las inclusiones del mismo Sultan bodies. BASTON DE AUER 72
73 Dos clasificaciones han sido usadas en la LMA. La primera, creada en 1976 por el Grupo Franco-Américo-Británico (FAB) se basa en la descripción morfológica de las células neoplásicas comparándolas con los precursores hematopoyéticos normales. Esta clasificación (si bien ha sido superada por la clasificación de la OMS que incluye citogenética, inmunofenotipo, etc.) será la mas importante en la práctica de rutina, ya que, como bioquímicos, en un laboratorio clínico o de urgencias, jugamos un rol relevante en la detección del paciente con leucemia, para lo cual la morfología y algún signo clínico que aporte el médico en la solicitud de análisis, serán la única herramienta con que contamos en ese momento. La clasificación French-American-British (FAB) usada desde 1976 utiliza un umbral de 30% de blastos en MO para diagnóstico y divide a la LMA en subgrupos que van de M0 a M7. El diagnóstico de LMA según la WHO, y a diferencia de FAB, se confirma al encontrar más de 20% de mieloblastos en SP o en MO. Clasificación FAB. Criterios para los diferentes subtipos Según el grupo FAB, la LMA se clasifica en: M0=Mieloide con mínima diferenciación M1= Mieloide inmadura M2= Mieloide con maduración M3= Promielocítica M4= Mielomonocítica M5= Monocítica, M6= Eritroleucemia, M7= Megacarioblástica Criterio para LMA M0 (indiferenciada): Con mínima diferenciación mieloide. No estaba incluida en la primera versión de la clasificación FAB. No puede ser diagnosticada sobre una base morfológica solamente, dado que los blastos son grandes y agranulares, a veces semejando linfoblastos L2 o raramente L1 y deberían ser identificados por una reacción de mieloperoxidasa (MPO) y sudan black (SB) negativas (o positivas en menos de 3% de los blastos), marcadores de linaje B y T negativos y expresión de antígenos mieloides reconocidos por al menos uno de los anticuerpos monoclonales CD13 o CD33. Frecuentemente, otros marcadores mieloides son positivos, e incluyen CD11b y la enzima MPO demostrada por inmunocitoquímica y/o análisis por microscopía electrónica. Criterio para LMA M1 (sin maduración): La suma de células blásticas tipo I y II en MO debe ser 90% o mas de las células no eritroides y por lo menos 3% de estas células blásticas serán peroxidasa o sudan black positivo. Las restantes (10%) células serán granulocitos desde promielocitos en adelante, o monocitos. Criterio para LMA M2 (con maduración): La suma de los blastos tipo I y II en MO es de 20% a 89% de las células no eritroides; las células monocíticas son menores al 20%; y los granulocitos de promielocitos a neutrófilo maduro son mas del 10%. Criterio LMA para M3 (promielocítica) (LPM): Es la leucemia hipergranular promielocítica. A) La gran mayoría de las células son promielocitos anormales, con un modelo característico de granulación densa; B) el núcleo varía ampliamente en tamaño y forma y es frecuentemente reniforme o bilobulado; C) el citoplasma de la mayoría de las células esta ocupado completamente por granulación roja, rosa o púrpura. 73
74 D) En algunas células el citoplasma esta cubierto de finos gránulos como polvo. Las células características conteniendo manojos de cuerpos de Auer ("faggots"), azarosamente esparcidos por el citoplasma, están invariablemente presentes en MO y a veces en SP. El citoplasma de las células que contienen faggots es frecuentemente claro o está pálidamente teñido, pero puede también contener gránulos azurófilos. La mayoría de los casos de M3 cumple esta descripción, pero existe una forma atípica caracterizada por una minima granulación denominada "M3 Variante". Su característica citomorfológica más saliente se relaciona a la configuración nuclear y a la aparición escasa de células con densa granulación y de células conteniendo múltiples bastones de Auer. El núcleo de casi todas las células en SP es bilobulado, multilobulado o reniforme, pero la mayoría de las células están desprovistas de gránulos o contienen unos pocos finos gránulos azurófilos. Sin embargo, están presentes algunas células con característica de la típica M3. La morfología atípica es propia de células en SP. En MO la morfología es semejante a la de M3 típica. Criterio para LMA M4 (mielomonocítica): En MO las células blásticas son más del 20% de las células no eritroides. La suma de mieloblastos, promielocito, mielocito y granulocitos en sus últimos estadios de maduración es >20%, pero < de 80% de células no eritroides. Mas del 20% de células no eritroides son de estirpe monocítica en diferentes estadios de maduración; generalmente son promonocitos y monocitos. Cuando las células monocíticas exceden 80%, se diagnostica LMA M5. Cuando los hallazgos en MO son como se ha indicado y el recuento de monocitos periférico (monoblastos, promonoblasto y monocito) es /l, el diagnostico es LMA M4. Si el recuento de monocitos es < 5.109/l, aun persiste el diagnostico de M4 si los hallazgos en MO son como se describió y se demuestra la presencia de un componente monocítico, como la estimación de lisozima o métodos histoquímicos que incorporan una doble reacción de esterasas, cloroacetato esterasa especifica, alfa naftil acetato esterasa no especifica, u otras esterasas que identifican monocitos como naftol ASD acetato con o sin incubación con fluoruro de sodio. El diagnostico de M4 se establece si mas de 20% de precursores de MO son monocitos, evidenciados por reacción citoquímica, o si la concentración de lisozima excede 3 veces el valor normal de suero u orina. Si la medula parece la de los casos de LMA M2, el diagnostico de M4 es aun posible si el recuento de monocitos periférico es de /l y uno de los tests mencionados señala un aumento de componente monocítico en MO. M4 con eosinofilia: Estos eosinófilos son anormales y algunos tienen además de los gránulos eosinófilos específicos, amplios gránulos basófilos (inmaduros) y puede tener un único núcleo no segmentado. Tiñe con cloroacetato esterasa y PAS. Criterio para M5 o monocítica Se basa en el aspecto de la MO. El 80% o más de todas las células no eritroides en MO son monoblastos, promonocitos o monocitos. Se describen dos variedades. -M5a: 80% o más de todas las células monocíticas son monoblastos. -M5b: menos del 80% de todas las células monocíticas son monoblastos, las restantes son predominantemente promonocitos y monocitos. Criterio para LMA M6 (eritroleucemia): El criterio de diagnostico para M6 es diferente del utilizado para los otros subtipos de LMA (M1-M5). El criterio revisado para el diagnostico de M6 requiere que 30% o mas de las células no eritroides en MO sean blastos tipo I o II. Criterio para LMA M7 (megacariocítica): Estas células son altamente polimórficas y van desde pequeñas células redondas con escasa cantidad de citoplasma y densa cromatina, a veces semejando linfoblastos (L1), a células que semejan los blastos vistos en L2, con o sin gránulos y con 1 a 3 nucleolos prominentes. El 74
75 núcleo es redondo con cromatina finamente reticulada. Hay cierta heterogeneidad en el tamaño debido a que aproximadamente 20 % al 30 % de los blastos presentan 3 veces o mas el tamaño de un linfocito normal. A veces, las células en MO o SP pueden tener mamelones, o se ve un núcleo desnudo con grupos de plaquetas alrededor. Los blastos son Sudan Black o MPO negativos. Puede ocurrir confusión con monocitos dado que la alfa naftil acetato esterasa o la naftil AS-D acetato esterasa da reacción positiva y la reacción puede ser inhibida significativamente con fluoruro. Sin embargo los megacariocitos son casi siempre negativos a la alfa naftol butirato esterasa (lo que los diferencia de los monocitos). Además, los megacarioblastos frecuentemente tienen una positividad localizada y distintiva con la alfa naftil acetato esterasa en contraste con una tinción citoplasmática más difusa en los monocitos. La reacción de PAS o fosfatasa acida son también frecuentemente positivas con un modelo característico. La incidencia de los distintos tipos FAB es, aproximadamente: M1:18%, M2:28%, M3:8%, M4:27%, M5:10%, M6:4%, M7:5%. En 2002, la OMS propuso un sistema de clasificación que incorporaba información citogenética diagnóstica que se correlacionaba de forma más confiable con los resultados. En esta clasificación, los pacientes con t (8;21), inv (16), t(15;17) y aquellos con desplazamientos MLL, los cuales de manera colectiva constituían casi la mitad de los casos de LMA infantil, fueron clasificados como "LMA con anomalías citogenéticas recidivantes". Esta clasificación también disminuyó los requisitos en cuanto al porcentaje de blastos en la MO para el diagnostico de LMA (de 30 a 20%). Se hizo una aclaración de que los pacientes con anomalías citogenéticas recidivantes no necesitaban cumplir con los requisitos mínimos de blastos para considerárseles con LMA. El análisis citogenético, identifica la presencia de ciertas anomalías genéticas asociadas con un pronostico favorable (denominado de bajo riesgo ) como lo son: inv(16)(p13q22), t(8;21)(q22;q22) y t(15;17) (q22;q12). Mientras que alteraciones en el 11q23, t(6;9), t(9;22), -7, del(5q), inv(3) o t(3), están asociadas a un pobre pronostico (es decir de alto riesgo ). Dada su importancia, este aspecto fue reconocido por la OMS, creando así, los grupos: - Grupo I: LMA con Anormalidades Genéticas Recurrentes que incluye, como se menciono anteriormente, subgrupos genéticos específicos. - Grupo II: La LMA que comparte anormalidades citogenéticas y otras características clínicas y biológicas con el SMD fue clasificada como LMA con Displasia Multilinaje (DML). La OMS sugiere que el principal determinante para el diagnóstico de este tipo LMA sea la evidencia o historia de SMD o de neoplasia mielodisplásica/mieloproliferativa (SMD/NMP) de seis meses de evolución. En la nueva clasificación, el diagnostico de LMA con DML sin antecedentes de SMD o SMD/NMP se hace cuando los blastos alcanzan el 20% en el aspirado de MO y cuando el 50% o mas de las células en dos o mas líneas mieloides son displásicas en una muestra previa al tratamiento. - Grupo III: Los casos inducidos por la exposición a terapias antineoplásicas (agentes alquilantes, radiaciones e inhibidores de la Topoisomerasa II) son incluidos en LMA Y SMD relacionados con terapias previas. Los alquilantes y la radiación inducen aberraciones citogenéticas cuatro a siete anos después de la exposición mientras que para el tratamiento con inhibidores de la Topoisomerasa II el periodo es entre uno a tres años. - Grupo IV: Las LMA que no cumplen los criterios de los anteriores grupos conforman el LMA no clasificable de otra forma cuyos subtipos no difieren mucho de su correspondiente en la clasificación FAB incluyendo además la leucemia basofílica aguda, panmielosis aguda con mielofibrosis y sarcoma mieloide. 75
76 Clasificación de la OMS para la LMA LMA con anomalías genéticas recidivantes LMA con t(8;21)(q22;q22), RUNX1-RUNX1T1(CBFA/ETO). LMA con inv(16)(p13q22) o t(16;16)(p13;q22), CBFB-MYH11. Leucemia promielocítica aguda con t(15;17)(q22;q11-12), PML-RARA. LMA con t(9;11)(p22;q23), MLLT3-MLL. LMA con t(6;9)(p23;q34); DEK-NUP214. LMA con inv(3)(q21q26.2) o t(3;3)(q21;q26.2), RPN1-EVI1. LMA (megacarioblástica) con t(1;22)(p13;q13), RBM15-MKL1. LMA con NPM1 mutado. LMA con CEBPA mutado. LMA con características relacionadas con la mielodisplasia Neoplasia mieloide relacionado a terapia LMA no especificada de otra manera LMA con diferenciación minima. LMA sin maduración. LMA con maduración. Leucemia aguda mielomonocítica. Leucemia monoblástica y monocíticas aguda. Leucemia eritroide aguda. Leucemia megacarioblástica aguda. Leucemia basofílica aguda. Panmielosis aguda con mielofibrosis. Sarcoma mieloide. Proliferaciones mieloides relacionadas con el síndrome de Down: Mielopoyesis anormal transitoria. Leucemia mieloide relacionada con el síndrome de Down. Neoplasma celular dendrítico plasmocitoide blástico CITOQUÍMICA DE LAS LMA M0 M1-M2-M3 M4 M5 M6 M7 MPO ENE CAE /- - - ANAE * +* - +/- * SUDAN PAS - - +/- +/- + difuso - * Inhibidas por fluoruro INMUNOFENOTIPO MÁS RELEVANTE M0 M1 M2 M3 M4 M5 M6 M7 CD13 CD 13 CD 13 CD 13 CD 13 CD 13 Gly A CD 61 CD 33 CD33 CD 33 CD 33 CD 33 CD 33 CD CD 41 CD CD 11 b CD 11 HLA DR CD 14 CD CD 13 y 14- CD 65 b CD 14 CD 15 HLA DR + CD 33 +/- +/- CD 15 HLA DR CD
77 LMA M0 LMA M1 LMA M2 LMA M3 LMA M3 V LMA M4 LMA M5 LMA M6 77
78 LMA M7 78
79 LEUCEMIA LINFOBLASTICA AGUDA Leucemia Linfoblástica Aguda Es también conocida como leucemia linfoide aguda o leucemia linfoblástica aguda (LLA). Es el cáncer mas frecuente en pediatría. La LLA puede ser de estirpe B o T. Aproximadamente 85% de los casos de LLA son de células linfocíticas de linaje B (LLA-B), la LLA-T es diagnosticada en el 15% de los niños y adultos con LLA. 1- Generalidades 5200 casos/año en US (National Cancer Institute), Pico de incidencia a la edad de 4 años, generalmente menores de 15 años 80% de las leucemias en niños son LLA - 85% son de célula B, -15% son T, pero ambas frecuentemente presentan expresión aberrante de antígenos mieloides o linfoides asociados. Factores de riesgo: radiación in útero, síndrome de Down, ataxia telangiectasia, sin embargo la mayoría de los casos no presentan causa conocida. Síntomas: de abrupto establecimiento, relacionados a depresión de la MO, (fatiga, fiebre, sangrado), dolor óseo, dolor de articulaciones, linfadenopatía generalizada, hepatoesplenomegalia, compromiso testicular, manifestaciones de sistema nervioso central. Presentación atípica: hipercalcemia, lesiones óseas, ausencia de blastos circulantes. Laboratorio: la anemia es común, el recuento de plaquetas es <100x10 9 /l en el 75% de los casos y <10x10 9 /l en el 15%; la leucopenia se presenta en el 25% de los afectados, en un 10 % de los pacientes se observa leucocitosis (WBC>100x109/l) Pronóstico favorable: edad entre 2-10 años, sexo femenino, raza blanca; fenotipo preb, hiperdiploidía >50, t(12,21), recuento de blancos normal a la presentación, respuesta rápida a la quimioterapia, CD10+. Pronóstico intermedio: hiperploidía 47-50, diploidía, 6q-, reárelos del 8q24 Pronóstico desfavorable: < de 2 años (pues generalmente presentan translocaciones 11q23) o >de 10 años; t (9;22) (pero no si es >de 59 años); hipoploidía, casi tetraploide, 17p-, t(11q23); LLA preb CD10 negativa; expresión de MDR1 en niños y adultos. Hiperleucocitosis y plaquetopenia. 2- Epidemiología La LLA es la enfermedad maligna mas frecuente en la edad pediátrica. Constituye un 25% de los tumores pediátricos y el 75% de todas las leucemias pediátricas. El pico de incidencia se sitúa entre los 2 y 5 años. En países con poblaciones heterogéneas se ha observado un aumento de frecuencia en la raza blanca. Es algo mas frecuente en los varones, sobre todo en la edad puberal. Desde el punto de vista geográfico, la LLA es mas frecuente en los países más industrializados. Se cree que esto es debido a la mayor exposición a agentes leucemogénicos en dichos países. 3- Etiopatogenia La LLA es la consecuencia de la transformación maligna de una célula progenitora linfoide inmadura que tiene la capacidad de expandirse y formar un clon de células progenitoras idénticas bloqueadas en un punto de su diferenciación. La secuencia de eventos que llevan a la transformación maligna es multifactorial. Estos eventos se producen durante el desarrollo linfoide, momento en el que los precursores linfoides tienen mayor riesgo de presentar 79
80 mutaciones espontáneas debido a la alta tasa de proliferación de estas células y al reordenamiento genético que se lleva a cabo en ese proceso. La acumulación de estos linfoblastos en la MO y en diversos órganos provoca las manifestaciones clínicas de las LLA. Se han identificado pocos factores que estén relacionados con un aumento en el riesgo de LLA. Los factores de riesgo no genéticos primarios aceptados son la exposición prenatal a los rayos X y la exposición postnatal a dosis altas de radiación. Se han identificado múltiples translocaciones cromosómicas en las LLA. Existe un mayor riesgo de desarrollar leucemia aguda en pacientes con síndrome de Down (hasta 15 veces más que en la población normal), de Schwachman, Klinefelter, neurofibromatosis y en síndromes caracterizados por fragilidad cromosómica como la ataxia-telangiectasia, síndrome de Bloom o la anemia de Fanconi. La frecuencia de LLA es mayor entre familiares de pacientes afectados. Estos pacientes representan una minoría de casos de LLA. Síndrome de Down. Los niños con síndrome de Down muestran un aumento en el riesgo de presentar LLA y leucemia mieloide aguda, con un riesgo acumulativo de presentar leucemia de aproximadamente 2,1% a la edad de 5 años y 2,7% a la edad de 30 años. Aproximadamente de la mitad a dos tercios de los casos de LA en niños con síndrome de Down son LLA. Los pacientes con LLA y síndrome de Down tienen una incidencia más baja de hallazgos citogenéticos, tanto de pronóstico favorable como desfavorable, y una incidencia menor de fenotipo de células T. Aproximadamente un 20% de los casos de LLA que surgen en los niños con síndrome de Down presentan mutaciones JAK2 somáticamente adquiridas. Mientras que la vasta mayoría de casos de LMA en los niños con síndrome de Down se presentan antes de los cuatro años de edad (mediana de edad, un año), la LLA tiene una distribución de edad similar a la de los niños con LLA sin síndrome de Down, con una mediana de edad de 3 a 4 años. Los factores que se han asociado claramente a un mayor riesgo de presentar LLA son el sexo masculino, la edad entre 2 y 5 años, la raza caucásica, la exposición intraútero a radiaciones ionizantes y la exposición posnatal a la radiación causada por bombas atómicas o tratamientos con radioterapia. No se ha comprobado asociación clara entre el riesgo de desarrollar LLA y los campos electromagnéticos de baja frecuencia o la exposición al radón. En los últimos años se ha dado mucha importancia a la posible etiología viral en las LLA. La única asociación clara descripta en pacientes pediátricos hasta ahora ha sido el virus de Epstein-Barr en el linfoma tipo Burkitt y algunos tipos de linfoma de Hodgkin. 4- Clasificación Morfológica Los criterios morfológicos se basan en la definición del Grupo FAB (de French- American British). El grupo FAB reconoce tres variedades morfológicas de LLA: L1, L2 y L3. El subtipo morfológico L1 es el más común (85%), le sigue el subtipo L2 (14%), y el L3 (1%). En la actualidad solo tiene un valor relativo debido a que los subtipos L1 y 2 no definen a un subtipo biológicamente relevante, y su valor pronóstico es muy limitado. 80
81 Rasgos L1 L2 L3 citológicos Tamaño celular Células pequeñas Células grandes Células grandes Cromatina Homogénea Variable, Heterogénea Forma núcleo del Regular, Ocasionalmente hendido Irregular, hendido o indentado Homogénea mitosis >5% Regular,oval o redondo Nucleolos No visibles o pequeños Uno o mas Uno o mas Vacuolización Habitualmente ausente Habitualmente Prominente ausente Basofilia citoplasmática Ligera Variable Muy intensa 1-LINFOBLASTOS 2-LINFOCITOS LINFOBLASTOS Los linfoblastos L1 son células pequeñas caracterizadas por una elevada relación núcleo/citoplasma (N:C). El citoplasma es azul pálido y escaso, y esta limitado a una pequeña porción del borde celular. Las células tienen nucleolo indistinto y la membrana nuclear varia de redonda a clivada. Los linfoblastos L2 son mayores, frecuentemente son una población más heterogénea, con menor relación N:C. El nucleolo prominente (frecuentemente con condensación de cromatina perinuclear). La membrana nuclear puede ser irregular o reniforme. Los linfoblastos L3 son un grupo heterogéneo de células, caracterizado por una profunda basofilia citoplasmática y prominente vacuolización citoplasmática. La LLA no esta típicamente asociada con la presencia de gránulos azurófilos, que son una figura mucho mas común de las LMA. Sin embargo, la LLA granular es un fenómeno morfológico que debe ser reconocido y no debe ser confundido con LMA. Este error puede ocurrir particularmente si existe una granulación densa en conjunción con la morfología FAB L2. Los estudios inmunológicos y citoquímicos corroborarán el diagnóstico correcto. La variante granular ocurre en aproximadamente 7% de niños con LLA. La vacuolización citoplasmática es una característica de la categoría FAB L3 donde está asociada con un gran tamaño celular e intensa basofilia citoplasmática. Sin embargo, tales vacuolas no son exclusivas de la variante L3. Generalmente menores y mas escasas, se las puede encontrar en células de una minoría de niños con LLA L1 y L2. Los blastos vacuolados 81
82 de la LLA pediátrica suelen ser PAS positivos y son mas comúnmente encontrados en pacientes de 3 a 7 años de edad con bajos recuentos leucocitarios y positividad al CD 10. El sistema de escarificación propuesto enfatiza la importancia de la elevada relación N:C y ausencia de nucleolo para L1 y la baja relación N:C, nucleolo prominente, irregularidades de membrana groseras y gran tamaño del blasto para la L2 Por otra parte el subtipo L3, que se reconoce inmunofenotípicamente como LLA B, se considera como la fase leucémica del linfoma de Burkitt. 5- Citoquímica Acido periódico de Schiff (PAS): Aproximadamente en el 80 % de los casos de LLA los linfoblastos son PAS reactivos. La reacción es positiva en un 40-70% de los blastos de las LLA. Estas células característicamente presentan un patrón granular o en mazacote (rosado fuerte) con un fondo negativo. Los blastos mieloides o monocíticos son débilmente positivos o negativos. Los blastos en la LLA son negativos a la reacción de MPO, Sudan Black B y naftol ASD cloroacetato esterasa, sin embargo hay casos descriptos de positividad al Sudan Black en estas leucemias. En la LLA L3 las vacuolas se tiñen con la coloración aceite rojo O (oil red O). CITOQUÍMICA LLA - B LLA - T MPO - - SUDAN BLACK - - PAS + + débil FAC - + focal NASDA + débil/- + NASDA F - No se inhibe No se inhibe ANABE - + ANAE Clasificación Inmunológica Se basa en la expresión de antígenos específicos presentes durante las diferentes fases de la diferenciación de la célula. La co expresión en células blásticas de HLA-DR y antígenos asociados a la célula B como el CD19, CD22 o CD10 es consistente con el diagnostico de LLA de célula B. Dentro de las LLA, el grupo EGIL (European group for the immunological characterization of leukaemia) ha establecido una clasificación inmunológica tanto de las LLA de línea B como de las de línea T basada en la expresión de diferentes antígenos. Dentro de las de línea B, uno de los aspectos mas importantes es identificar correctamente las LLA B maduras. Estas se caracterizan por la expresión de cadenas livianas de Ig en la superficie celular (ocasionalmente en el citoplasma). Aunque se relacionan con el tipo morfológico L3, se han identificado casos sin esta morfología. Su identificación es de gran importancia, ya que su tratamiento y pronóstico es diferente al del resto de las LLA. Clasificación inmunológica de las LLA LLA de estirpe B CD19+ y/o CD79+ y/o CD20+ (al menos 2 +). La mayoría Tdt+ y HLA-DR+ ProB : sin expresión de otros antígenos de diferenciación B-Común : CD10+ Pre B : IgM citoplasmática + B madura : Ig superficie + 82
83 LLA estirpe T CD3 citoplasmático +. La mayoría Tdt +, HLA-DR + y CD34 - Pro T: CD7 + Pre T: CD2 + y/o CD5 + y/o CD8 + T intermedia: CD1a + T madura: CD3 + en membrana. Aproximadamente tres cuartos de los pacientes con LLA de células precursoras B, tienen inmunofenotipo de la célula precursora B común y cuentan con el mejor pronostico. Aproximadamente 5% de los pacientes tienen el inmunofenotipo de precursor pro-b. Este fenotipo es el más frecuente en niños jóvenes y con frecuencia se relaciona con un t(4;11). Las células leucémicas de pacientes con LLA PRE-B, contienen Igc y el 25% de los pacientes con LLA PRE-B, tienen t(1;19). Aproximadamente el 2% de los pacientes presentan leucemia de células B (expresión Ig de superficie, generalmente con morfología FAB L3 y desplazamiento del gen C-MYC) también se llama leucemia de Burkitt. Su tratamiento es completamente diferente del de otras formas de LLA infantil. 7- Citogenética Convencional y Genética Molecular La citogenética convencional detecta solo células neoplásicas en metafase. Actualmente, el desarrollo de técnicas que incluyen nuevos métodos de bandeo cromosómico e hibridización de fluorescencia in situ (FISH), técnicas de genética molecular de cariotipo espectral (SKY) e hibridización genómica comparativa (CGH), permiten reconocer anormalidades cromosómicas en las células leucémicas en la mayoría de los casos de LLA pediátrica. Las anormalidades genéticas reportadas en LLA incluyen número cromosómico (ploidía) y rearreglos estructurales. Desplazamientos cromosómicos De todas las anomalías cromosómicas estructurales, las translocaciones son las más frecuentes. - La anormalidad cromosómica mas frecuente en pacientes pediátricos con cáncer es la t(12;21) que se encuentra en 25% de los niños con LLA de linaje B. Estas alteraciones son el resultado de la fusión del gen TEL (del cromosoma 12) con el AML (del cromosoma 21) y se asocia a pronóstico favorable. - La t(9;22) es común en adultos y en niños se presenta en aproximadamente el 5% de los casos, asociada con mal pronostico. - Los reordenamientos con el gen MLL(11q23) se presentan en alrededor del 8% de los niños con LLA y se asocia generalmente a un aumento del riesgo de fracaso al tratamiento. La t(4;11) es el desplazamiento mas frecuente relacionado con el gen MLL y se presenta en 2% de los casos, estos pacientes son generalmente lactantes con recuentos elevados de leucocitos y respuesta pobre al tratamiento. La t(11;19) se presenta en el 1%. - La t(1;19) se presenta con una frecuencia del 5-6%, asociada con fenotipo PRE-B y resulta en la formación del gen de fusión E2A en el cromosoma 19 al gen PBX1 en el cromosoma 1. Los pacientes presentan hiperleucocitosis, y el pronóstico es pobre. - La t(8;14)(q24;p32) afecta al 1-2% de los casos. Los genes afectados son MYC-IgH - La desregulación TAL-1 es la anormalidad genética más común en LLA-T. Puede ocurrir como resultado de t(1;14) o mas comúnmente debido a deleciones en el cromosoma 1p32 La LLA puede ser clasificada en 4 subgrupos en base al n modal de cromosomas: - hiperdiploide con mas de 47 cromosomas (35-45% de los casos) -pseudodiploide 46 cromosomas con anormalidades numéricas o estructurales (40%) - hipodiploide < 46 cromosomas (aproximadamente 8% de los casos) 83
84 La hiperdiploidía es común y se ha comprobado que en los linfoblastos es un factor de buen pronóstico. En la actualidad se sabe que esto probablemente se deba a que las células leucémicas hiperdiploides tienen una mayor predisposición a la apoptosis porque son capaces de acumular mayor concentración de metabolitos activos del metotrexato (poliglutamatos) y por ello son más sensibles a este fármaco. 8- Presentación clínica La LLA puede presentarse en forma insidiosa o aguda, como un hallazgo incidental en un recuento de rutina en un niño asintomático o como una hemorragia con riesgo de vida, infección, o episodio de distress respiratorio. La duración de los síntomas en niños con LLA puede variar de días a meses. Los primeros síntomas son generalmente no-específicos e incluyen, anorexia, irritabilidad y letargia. La fiebre es el hallazgo más común, y ocurre en aproximadamente 60% de los pacientes. Progresivamente el fallo medular conduce a palidez (anemia), sangrado (trombocitopenia) y susceptibilidad a las infecciones (neutropenia). La linfadenopatía (generalmente indolora, localizada o generalizada) debido a infiltración leucémica es también un signo frecuente. Los pacientes con LLA de estirpe T, generalmente de mayor edad, presentan manifestaciones clínicas características, como mayor frecuencia de masa mediastinal y mayor porcentaje de afectación del sistema nervioso central. La exploración física debe ser exhaustiva y minuciosa, sin olvidar nunca la exploración de los testículos en el varón. 9- Diagnóstico La prueba complementaria que mas frecuentemente confirma la sospecha clínica inicial de una LLA es el hemograma. En el se puede encontrar leucocitosis en el 50% de los casos, anemia en el 80% y trombocitopenia menor de 100x10 9 /l en el 75% de los pacientes. En el examen de la extensión periférica pueden observarse linfoblastos, aunque en algunas ocasiones no aparecen. El diagnóstico de una leucemia aguda siempre debe realizarse con el aspirado de MO. La presencia de al menos un 20% de blastos en la MO confirma el diagnóstico de leucemia. El diagnostico de LLA se establecerá con los estudios de inmunofenotipo, biología molecular y citogenética de dicho aspirado. Se deberá realizar exámen del líquido cefalorraquídeo en toda leucemia al diagnóstico, para descartar la afectación del sistema nervioso central. Una radiografía de tórax inicial permitirá conocer la existencia de una masa mediastínica (mas frecuente en LLA de estirpe T). 10- Laboratorio Al momento del diagnostico están generalmente presentes: anemia, recuento de leucocitos y diferencial anormales, y trombocitopenia, reflejando el grado en el cual ha sido reemplazada la medula ósea por linfoblastos leucémicos. El recuento de leucocitos varia desde 0.1 a 150 x10 9 /L (mediana 15x109/L) y se encuentra elevado (>10x10 9 /L) en casi mas de la mitad de los pacientes. Hiperleucocitosis (> 100x109/L) ocurre en 10% a 15% de los pacientes. El grado de elevación del recuento de leucocitos al diagnostico es un predictor muy importante del pronostico en LLA. 84
85 Neutropenia (< de 500 granulocitos por mm 3 ) es común y esta asociada con un aumento de riesgo de infecciones serias. Hipereosinofilia, generalmente reactiva, puede estar presente al diagnostico Los recuentos disminuidos de plaquetas (mediana 50x10 9 /L) están frecuentemente presentes al diagnostico y pueden ser rápidamente diferenciados de una trombocitopenia inmune, dado que la trombocitopenia aislada es rara en la leucemia. Coagulopatía generalmente leve, puede ocurrir en LLA-T y esta solo raramente asociada con sangrado severo. Mas del 75% de los pacientes presentan anemia, la cual es generalmente normocítica y normocrómica y asociada con recuento de reticulocitos normales a bajos. La anemia o trombocitopenia es frecuentemente leve (o aun ausente) en LLA T. En raros casos una pancitopenia seguida por un periodo de recuperación hematopoyética espontánea puede preceder al diagnostico de LLA y debe ser diferenciada de la anemia aplásica. 11 LLA ACTUALIZACIÓN 1- Cambios en el diagnóstico y clasificación de neoplasias de célula precursora B y T. A continuación se detallan cambios en la clasificación WHO de neoplasias de células B y T precursoras: 1. La nomenclatura ha cambiado de leucemia/linfoma linfoblástico precursor B y leucemia/linfoma linfoblástico precursor T a leucemia/linfoma linfoblástico B y leucemia/linfoma linfoblástico T 2. Leucemia/linfoma linfoblástico B ha sido posteriormente dividido en 7 entidades distintivas definidas por anormalidades cromosómicas recurrentes especificas; los casos de LLA-B que carecen de estas anormalidades son consideradas como sin otra especificación. Si bien la distinción entre leucemia linfoblástica y linfoma linfoblástico es obvia cuando el paciente presenta una masa compuesta por linfoblastos B o T y sin blastos en SP o MO, es más arbitraria cuando hay masa y compromiso medular limitado. Se sugiere que cuando hay masa presente y 25% o mas de las células nucleadas en MO son linfoblastos, el diagnóstico sea leucemia linfoblástica antes que linfoma linfoblástico. Leucemia/linfoma linfoblástico B Leucemia/linfoma linfoblástico B, sin otra especificación Leucemia/linfoma linfoblástico B con anormalidades genéticas recurrentes Leucemia/linfoma linfoblástico B con t(9;22)(q34;q11.2);bcr-abl 1 Leucemia/linfoma linfoblástico B con t(v;11q23);reordenamientos MLL Leucemia/linfoma linfoblástico B con t(12;21)(p13;q22) TEL-AML1 (ETV6-RUNX1) Leucemia/linfoma linfoblástico B con hiperdiploidía Leucemia/linfoma linfoblástico B con hipodiploidía Leucemia/linfoma linfoblástico B con t(5;14)(q31;q32) IL3-IGH Leucemia/linfoma linfoblástico B con t(1;19)(q23;p13.3);tcf3-pbx1 Leucemia/linfoma linfoblástico T 12 TRATAMIENTO Aunque el tratamiento de la LLA debe ser dirigido y específico para los distintos grupos de riesgo, el tratamiento en todos ellos comprende las siguientes fases: inducción de la remisión, tratamiento del sistema nervioso central, intensificación (consolidación) y mantenimiento. - Tratamiento de inducción. El objetivo inicial de todo tratamiento de una LLA es inducir una remisión completa con una recuperación de la hematopoyesis normal. Obtener la remisión completa es la base del tratamiento de la LLA y un requisito imprescindible para obtener una supervivencia prolongada. 85
86 Se define la remisión completa cuando no existe evidencia de leucemia en la exploración física, en el examen de sangre periférica ni de MO. La remisión completa incluye también la ausencia de afectación del sistema nervioso central o de afectación extramedular. El tratamiento de inducción incluye necesariamente un glucocorticoide, un alcaloide de la vinca (vincristina) y por lo menos otro fármaco (antraciclina o asparraginasa). Algunos protocolos que incluyen un cuarto fármaco como la daunorrubicina han demostrado prolongar la duración de la remisión completa incluso en grupos de riesgo alto. El fracaso de la inducción es un acontecimiento raro que tan solo ocurre en un porcentaje inferior al 5% de los pacientes pediátricos con LLA y determina un pronóstico muy desfavorable. - Tratamiento de intensificación (consolidación). En la fase de consolidación se administra un tratamiento intensivo inmediatamente después de finalizar el tratamiento de inducción, que se ha mostrado muy efectivo sobre todo en los pacientes de alto riesgo. La intensificación retardada o la reinducción promulgada por el grupo BFM (Berlín-Frankfurt- Munich) es probablemente el régimen mas utilizado. Consiste en una repetición del tratamiento de inducción a los 3 meses de la remisión completa y su beneficio es claro en los pacientes de riesgo estándar - Tratamiento de mantenimiento. Los pacientes con LLA requieren un tratamiento prolongado de mantenimiento. Con las nuevas y sofisticadas técnicas de laboratorio los investigadores han comprobado que en pacientes que están en aparente remisión completa puede existir enfermedad minima residual (EMR). La combinación de metotrexato administrado semanalmente y 6-mercaptopurina a diario constituye el tratamiento estándar de mantenimiento en las LLA. En la actualidad, la norma general es prolongar el tratamiento un total de 2 años o 2 años y medio. Muchos investigadores prefieren ampliarlo a 3 años en el caso de los varones, por su peor pronóstico comparado con el sexo femenino. -Tratamiento del sistema nervioso central. La importancia de la afectación del SNC en el tratamiento de la LLA estriba en que dicho sistema actúa como un refugio para las células leucémicas que residen en el, al quedar protegidas por la barrera hematoencefálica de las dosis terapéuticas sistémicas de los distintos quimioterápicos. Actualmente, la mayoría de los protocolos en Europa y EE.UU. han prescindido de la irradiación intracraneal como profilaxis del SNC y se utiliza mayoritariamente la profilaxis intratecal con metotrexato en monoterapia, junto con la quimioterapia intensiva sistémica. Trasplante hematopoyético. En las ultimas 2 décadas los avances en el campo de los trasplantes de progenitores hematopoyéticos han sido notables. Destacan la mejoría en la prevención de la enfermedad del injerto contra huésped, el desarrollo de los bancos de donantes no emparentados, la disminución del tiempo de injerto hematopoyético y las mejorías en el tratamiento de soporte. Sin embargo, el desarrollo paralelo de la quimioterapia hace que en la actualidad las indicaciones de trasplante hematopoyético en pacientes en primera remisión sean difíciles de establecer y tan solo se aceptan como claras en los pacientes con cromosoma Ph positivo y en pacientes que no alcanzan la remisión completa al finalizar el tratamiento de inducción. Enfermedad mínima residual (EMR) La resistencia a agentes terapéuticos es el factor principal en el fracaso del tratamiento del cáncer. 86
87 En la leucemia, las células resistentes remanentes en MO y/o SP constituyen la EMR y son detectables por ensayos de alta sensibilidad cuando el paciente aparenta estar en remisión completa. La detección temprana de la expansión de células residuales permite intervención clínica con el objetivo de revertir la proliferación de células leucémicas resistentes. De esta forma, la medición exacta y precisa de EMR puede mejorar la optimización del manejo clínico del paciente oncológico. LLA L1 LLA L2 LLA L3 87
88 TRABAJO PRÁCTIVO N 10: SLPC Y SMPC SINDROMES LINFOPROLIFERATIVOS CRÓNICOS (SLPC) El término síndrome linfoproliferativos crónicos (SLC) incluye una variedad de entidades clínico-biológicas que resultan de la proliferación clonal de un linfocito B o T maduro e inmunocompetente. El diagnóstico preciso de los SLC debe basarse en una constelación de datos clínicos y de laboratorio. Estos últimos deben incluir: citología, histología, marcadores inmunológicos y, en determinados casos, estudios citogenéticos y moleculares. Desde un punto de vista práctico, la citología, histología e inmunofenotipo constituyen los pilares diagnósticos fundamentales. En términos generales, la morfología de las células linfoides se aprecia mejor en extensiones de sangre periférica y por consiguiente, ésta es la muestra que deberá examinarse con preferencia en entidades que cursan con un cuadro leucémico. Si bien, es recomendable la observación de otros tejidos como la médula ósea y/o improntas de ganglio linfático, bazo u otros órganos ya que pueden existir discrepancias en cuanto a morfología en los diferentes órganos que tal vez indiquen progresión o transformación del proceso. Por ejemplo, en procesos de bajo grado, Ej. leucemia linfática crónica o linfoma folicular, el hallazgo de células grandes en médula ósea es un signo que sugiere transformación. Otros puntos importantes a tener en consideración para apreciar bien el detalle morfológico del linfocito son los siguientes: 1 - las extensiones deben realizarse de sangre fresca y con una tinción adecuada de May-Grunwald-Giemsa y, 2- la observación debe realizarse en una zona de la preparación en la que los glóbulos rojos estén bien extendidos; por ejemplo un caso de leucemia prolinfocítica B puede remedar una leucemia linfática crónica si se observa en una parte gruesa de la extensión o por el contrario, asemejarse a una leucemia aguda si se observa en una zona demasiado fina. Finalmente, la citomorfología tiene sus limitaciones y por tanto es esencial disponer de la información del inmunofenotipo del linfocito neoplásico, es decir tener conocimiento de si nos hallamos ante un SLC de naturaleza B o T. Así, la variante de células pequeñas de Sézary puede asemejar morfológicamente un linfoma centrofolicular o bien, una variante de células pequeñas de leucemia prolinfocítica T parecerse a una leucemia linfática crónica atípica. SINDROMES LINFOPROLIFERATIVOS B PRIMARIAMENTE LEUCÉMICOS Leucemia linfática crónica (LLC) Las células de la LLC poseen unos rasgos morfológicos característicos. Son de tamaño pequeño o mediano, el núcleo tiene un contorno regular, la cromatina es cuarteada, el nucléolo no es visible o es muy pequeño y el citoplasma es escaso. En las formas típicas de LLC, esta población es la predominante y constituye más del 80% de linfocitos circulantes; la presencia de sombras de Gumprecht es común, especialmente en casos con recuentos linfocitarios elevados. Existen dos variantes morfológicas de LLC cuya identificación tiene importancia desde un punto de vista clínico y biológico: la LLC con cifras superiores al 10% de prolinfocitos o LLC/PL y la LLC atípica en la que una cifra superior al 15% de células circulantes posee un núcleo hendido o rasgos linfoplasmocíticos. El reconocimiento de estas dos formas es importante ya que suelen asociarse a estadios más avanzados y a enfermedad progresiva con un mayor índice de proliferación. Es probable que esta asociación clínico-morfológica tenga su base en la elevada frecuencia en estas variantes de LLC de trisomía 12 así como de mutaciones o deleciones del gen supresor de tumores p53, hechos ambos que son infrecuentes en las formas de LLC típicas. Tan sólo la citología permite el diagnóstico de LLC/PL o LLC atípica ya que el inmunofenotipo en estas dos variedades suele ser el característico de la LLC. La LLC, como todo proceso de bajo grado, puede sufrir transformación a un linfoma de células grandes, cuadro que se reconoce como síndrome de Richter. Aunque ello es más común que acontezca en ganglios linfáticos periféricos o se manifieste con masas abdominales y durante el curso evolutivo de la LLC, en algunos pacientes, el síndrome de Richter puede ser la manifestación 88
89 inicial de la enfermedad e incluso manifestarse en forma de leucemia con franca afectación de sangre periférica y médula ósea. En estos pacientes, la observación de extensiones de sangre periférica demuestra la presencia de dos poblaciones celulares, una de células pequeñas con una morfología típica de LLC y una segunda población de células de tamaño grande con diámetro superior a tres glóbulos rojos, cromatina reticular, nucléolo prominente y citoplasma basófilo. Debido a que el perfil inmunológico de las células en el síndrome de Richter es similar al de la LLC en la mayoría de los casos, si sólo se considera el inmunofenotipo y se prescinde de la morfología, se realizará el diagnóstico erróneo de "LLC". Por tanto, la citología en esta situación es esencial para el diagnóstico. El inmunofenotipo, por otro lado, es de ayuda especialmente en pacientes en los que el síndrome de Richter se manifiesta en la fase diagnóstica ya que, al ser característico de LLC, nos está indicando que se trata de la transformación de una LLC. Existen casos en los que el linfoma de células grandes representa una neoplasia "de novo" que resulta de la expansión clonal de una nueva clona independiente de la LLC. La citología no distingue entre estas dos situaciones mientras que los datos citogenéticos y moleculares permiten su distinción. Leucemia prolinfocítica B (LP-B) La LP-B fue inicialmente descrita por Galton y cols. (1974) como una variante de LLC. Si bien, la LP-B representa una entidad clínico-biológica definida diferente a la LLC. El examen morfológico de las células circulantes es esencial para establecer el diagnóstico. El prolinfocito B posee un tamaño superior al del linfocito de la LLC; el núcleo es de contorno regular, cromatina densa pero no cuarteada y posee un nucléolo único, prominente, vesicular y generalmente en posición central. Estas células se hallan en sangre periférica en una proporción superior al 55% del total de linfocitos circulantes. En algunos casos, pueden apreciarse formas bilobuladas que sugieren cierto grado de transformación. El diagnóstico diferencial de la LP-B se plantea con la LLC/PL, el linfoma de manto y la variante de tricoleucemia. El análisis citológico es el test básico para el diagnóstico de la LP-B ya que el inmunofenotipo, si bien difiere de la LLC, puede ser similar al de los linfomas B leucemizados incluyendo el del manto, y al de la variante de tricoleucemia. En un 20% de LP-B se demuestra la presencia de la t (11; 14) (q23; q32) con expresión de ciclina Dl idéntica a la documentada en linfomas del manto, de ahí los problemas de diagnóstico diferencial entre la LP-B y dicho linfoma en fase leucémica. La citología y la histología del bazo, cuando se dispone de la misma, constituyen tests diferenciales esenciales. Tricoleucemia y variante de tricoleucemia La tricoleucemia es un SLC que cursa habitualmente con citopenias, en particular monocitopenia y una proporción variable de células atípicas circulantes con unos rasgos citológicos muy característicos. El tricoleucocito es una célula de tamaño mediano que posee un núcleo redondeado o más frecuentemente arriñonado o hendido y una cromatina algodonosa; el nucléolo no es visible generalmente al microscopio óptico. Aunque la franca transformación de la tricoleucemia a un proceso de alto grado no ha sido descrita, en una minoría de pacientes, junto a los tricoleucocitos típicos se puede apreciar la presencia de células de tamaño superior con una relación núcleo/citoplasmática más elevada, un núcleo de cromatina reticular y la presencia o no de uno a tres nucléolos. Ello ha sido documentado en el curso evolutivo de la tricoleucemia en aproximadamente el 5% de los pacientes y se halla asociado a masas adenopáticas abdominales y cierto grado de resistencia a los análogos de las purinas, deoxicoformicina y clorodeoxiadenosina. Todos estos datos sugieren un cierto de grado de transformación de la tricoleucemia si bien, la agresividad clínica es menor si se compara a la de un linfoma de células grandes que se desarrolla en uno de bajo grado. Además de la tricoleucemia típica, existe una forma especial denominada variante de tricoleucemia. En ésta y, a diferencia de la forma típica, los recuentos leucocitarios son elevados y no se constata monocitopenia. La morfología del linfocito circulante podría considerarse intermedia entre el 89
90 tricoleucocito y el prolinfocito. El núcleo es redondeado y posee una cromatina más densa que la del tricoleucocito y un nucléolo prominente similar al del prolinfocito; por el contrario, el citoplasma es abundante con vellosidades similares al del tricoleucocito si bien con un grado mayor de basofilia. El diagnóstico diferencial de la variante de tricoleucemia se plantea con la forma típica, la leucemia prolinfocítica y el linfoma esplénico de células vellosas. La morfología y marcadores inmunológicos son esenciales para distinguir entre la tricoleucemia y su variante ya que la histología del bazo y médula ósea son similares en ambos procesos. La morfología e histología del bazo y médula ósea permiten el diagnóstico diferencial entre la variante de tricoleucemia y el linfoma esplénico de células vellosas o la leucemia prolinfocítica. La distinción de estos tres procesos es importante por la diferente conducta terapéutica a adoptar. Leucemia de células Plasmáticas Este es un proceso muy infrecuente y que se define de forma arbitraria por la presencia de una cifra superior a 2x10 9 /l de células plasmáticas en sangre periférica. Este cuadro debe diferenciarse de la leucemización de un mieloma múltiple, el cual en fases terminales puede asociarse a la presencia de plasmocitos circulantes. Las manifestaciones clínicas de la leucemia de células plasmáticas con alta frecuencia de organomegalia, hipercalcemia y su forma de presentación aguda difieren asimismo del mieloma múltiple. En la leucemia de células plasmáticas, los elementos circulantes muestran grados variables de diferenciación. Así pues, los rasgos morfológicos pueden ser similares a los de células plasmáticas maduras aunque en general con un cierto grado de asincronismo o atipía. El núcleo suele ser excéntrico y poseer una cromatina densa aunque formas con cromatina reticular no son raras; el citoplasma suele ser marcadamente basófilo. En general, la leucemia de células plasmáticas no plantea problemas diagnósticos cuando la célula circulante que predomina es la descrita, si bien hay formas indiferenciadas puramente blásticas en las que los marcadores inmunológicos son esenciales para establecer el diagnóstico ya que demuestran la presencia de inmunoglobulina en el citoplasma de los blastos con restricción clonal y expresión marcada de cadena ligera y negatividad para muchos de los marcadores pan-b. LINFOMAS NO HODGKIN B LEUCEMIZADOS La leucemización de los linfomas no Hodgkin es altamente frecuente, en especial en aquellos de bajo grado, aunque también puede acontecer en los linfomas de alto grado de células grandes. La linfocitosis puede documentarse en la fase diagnóstica y no es infrecuente que estos pacientes se diagnostiquen erróneamente de LLC si uno no tiene en consideración la morfología de las células circulantes así como los marcadores inmunológicos. El significado pronóstico de la manifestación leucémica de un linfoma varía de acuerdo al tipo histológico, grado de linfocitosis y a la presencia o no de células grandes circulantes que sugieran transformación del proceso. Describiremos a continuación los rasgos morfológicos que caracterizan los linfomas B que con mayor frecuencia se leucemizan. Linfoma centrofolicular Los linfocitos son de tamaño muy pequeño, similar al de un glóbulo rojo, la cromatina es densa pero uniforme, no cuarteada y en algunas células puede apreciarse una hendidura nuclear muy estrecha; el citoplasma es apenas visible. En algunos pacientes, junto a estas células pequeñas, pueden observarse células de tamaño superior con citoplasma abundante y un nucléolo periférico, es decir, mostrando rasgos morfológicos de centroblastos. El diagnóstico diferencial del linfoma centrofolicular se plantea con la LLC y más raramente con el linfoma del manto. Si bien, la morfología de los linfocitos es diferente en estos tres procesos, la histología y/o citogenética/estudios moleculares son pruebas esenciales para la confirmación del diagnóstico de uno u otro tipo de linfoma mientras que el inmunofenotipo permite distinguir la LLC del linfoma centrofolicular. 90
91 Linfoma esplénico de células vellosas Como su nombre indica, este linfoma se caracteriza por la presencia en sangre periférica de una cifra variable de linfocitos con un citoplasma irregular que muestra múltiples vellosidades finas. La cromatina nuclear es densa e incluso en algunos casos cuarteada como la de los linfocitos de la LLC y el nucléolo raramente puede observarse al microscopio óptico. A diferencia de la tricoleucemia o su variante, el citoplasma de las células en este linfoma es menos abundante así como el tamaño celular es menor. En algunos pacientes, junto a los linfocitos vellosos, pueden apreciarse células con rasgos de linfoplasmocitos y de hecho, en aproximadamente el 20% de casos, se documenta una pequeña banda monoclonal, generalmente lgg. El diagnóstico diferencial se plantea con la LLC o con los otros procesos que cursan con células vellosas, tricoleucemia y su variante, y ello es importante por cuanto pacientes con un linfoma de células vellosas responden bien a la esplenectomía o bien a la fludarabina mientras que suelen mostrar resistencia a los agentes alquilantes. Además de la morfología, los marcadores inmunológicos son importantes para distinguir este linfoma de la LLC y, la histología del bazo y de la médula ósea para diferenciarlo de la tricoleucemia y su variante. En un 5% de los casos el linfoma de células vellosas puede sufrir transformación a un linfoma de células grandes, bien a nivel ganglionar o incluso en sangre periférica. En tal situación, se observan células pequeñas de citoplasma velloso junto a células grandes con núcleo de cromatina reticular y nucléolo prominente. Linfoma linfoplasmocítico La manifestación leucémica de un linfoma linfoplasmacítico es relativamente frecuente. En las extensiones de sangre periférica se puede apreciar "rouleaux" debido a la presencia de una banda monoclonal. Los linfocitos circulantes poseen un aspecto maduro, cromatina densa y citoplasma escaso o de mediano tamaño con diferentes grados de basofilia. El diagnóstico diferencial de este linfoma se plantea con la LLC atípica y con el linfoma esplénico de células vellosas, básicamente en aquellos pacientes en los que se detecta una pequeña banda monoclonal. Además de la citología, los marcadores inmunológicos son de gran valor para diferenciar la LLC atípica del linfoma linfoplasmocítico. Linfoma de células del manto Es ésta una entidad clínico-biológica cuya definición ha sido establecida durante la última década. La frecuencia de un cuadro leucémico en este tipo de linfoma, bien al diagnóstico o durante su evolución, se desconoce, ya que una proporción substancial de casos se diagnostican de LLC atípicas. El cuadro morfológico en sangre periférica en el linfoma del manto se caracteriza por su marcado pleomorfismo en lo que se refiere a tamaño celular e irregularidad del contorno nuclear. La célula más típica es un linfocito de tamaño medio con un núcleo de cromatina punteada, una o dos hendiduras de corta longitud y visibles al microscopio óptico y un citoplasma escaso o mediano; el nucléolo no es visible o en caso de visualizarse es pequeño y no prominente. Actualmente se considera que el linfoma de células del manto puede transformarse a formas blásticas y/o anaplásicas lo que le confiere un peor pronóstico a un linfoma que, de por sí, es de difícil manejo clínico por su resistencia a tratamiento o respuesta corta al mismo. El diagnóstico diferencial del linfoma del manto leucemizado se plantea con la LLC/PL ya que ésta suele manifestar un cierto pleomorfismo, la LP-B, especialmente en casos asociados a la t(11;14) y con otros linfomas leucemizados, en particular el folicular y el esplénico de células vellosas. Además de la citología, la histología es un pilar esencial para el diagnóstico diferencial entre estas entidades y, los marcadores inmunológicos y la citogenética son asimismo de gran valor siempre que se tenga presente que la t(11;1 4) no es estrictamente específica de linfoma de manto. 91
92 Linfoma de células grandes La manifestación leucémica de un linfoma de células grandes es infrecuente pero puede acontecer ya como cuadro de presentación en la fase diagnóstica o durante el curso clínico. Las células linfoides circulantes poseen gran tamaño y rasgos citológicos de inmunoblastos tales como un núcleo con cromatina laxa, uno o varios nucléolos y un citoplasma marcadamente basófilo; en algunos casos, las células asemejan centroblastos o bien muestran rasgos anaplásicos. Raramente las células corresponden a un linfoma multilobulado. El diagnóstico diferencial se plantea esencialmente con la leucemia aguda, en particular la monoblástica, y muy en especial en aquellos pacientes en los que el cuadro se manifiesta "d'amblee" en forma de leucemia y sin organomegalia. El inmunofenotipo es esencial para distinguir entre un linfoma de células grandes y la leucemia aguda monoblástica ya que la morfología en la mayoría de los casos no permite distinguirlos. Linfocitosis B policlonal Si bien este cuadro no puede considerarse como un SLO, lo describiremos aquí por los problemas de diagnóstico que ofrece con linfomas leucemizados. El grado de linfocitosis en estos pacientes, que suelen ser mujeres de mediana edad y con una historia marcada de tabaquismo, no suele ser muy marcado, alrededor de 5 a 10x10 9 /l. Los linfocitos muestran una morfología muy peculiar. Estos poseen un tamaño grande y citoplasma abundante, un núcleo hendido o bien bilobulado y algunas células poseen nucléolo. Formas con ciertos rasgos linfoplasmocitoides pueden también hallarse presentes. Aunque esta morfología e incluso la histología de médula ósea con presencia de agregados linfoides sugieren un linfoma, el inmunofenotipo es esencial ya que si bien muestra la naturaleza B de la célula, no evidencia restricción clonal. Ello se confirma mediante análisis de ADN de las cadenas pesada y ligeras de la inmunoglobulina. SINDROMES LINFOPROLIFERATIVOS T PRIMARIAMENTE LEUCÉMICOS Leucemia prolinfocítica T (LP-T) Es ésta una entidad bien definida en cuanto a sus características clínicas y de laboratorio. Desde un punto de vista morfológico, las células circulantes corresponden a prolinfocitos. Es decir son células de tamaño mediano con un núcleo de cromatina densa y contorno regular o irregular con un nucléolo único; el citoplasma muestra irregularidades o protusiones y suele ser intensamente basófilo. No existen diferencias marcadas entre el prolinfocito B y el T en las formas de leucemia prolinfocítica T típica excepto por el hecho de que los prolinfocitos T poseen un tamaño inferior, el núcleo puede mostrar irregularidades en su contorno y el citoplasma es más basófilo que el del prolinfocito B. Junto a la forma típica, existe una variante de LP-T, designada de células pequeñas, la cual se caracteriza porque las células tienen un tamaño inferior a la forma típica y el nucléolo solo es visible por microscopía óptica en una proporción de células si bien se identifica mediante estudios ultraestructurales. Esta variante de células pequeñas representa el 20% de casos de LP-T y se ha descrito en la literatura bajo el término de LLC-T, designación que da lugar a confusión ya que la enfermedad no suele comportarse como una leucemia crónica sino que tiene un curso agresivo y, por el hecho de que la designación LLC-T se había empleado en las décadas de los 70 y 80 para describir la leucemia de linfocitos granulares. Debido a que no existen diferencias entre la forma de LP-T típica y la variante de células pequeñas en cuanto a clínica, marcadores inmunológicos y citogenética es justificado que se incluya como variante de LP-T ya que ambas, la LP-T típica y la variante, representan una única entidad clínico biológica. El diagnóstico diferencial de la LP- T se plantea con la LP-B en aquellos casos con morfología típica mientras que la variante de 92
93 células pequeñas de LP-T puede erróneamente diagnosticarse de LLC. Los marcadores inmunológicos permiten la distinción entre la LP-T y LP-B así como de la LP-T con la LLC. Leucemia de linfocitos granulares (LLG) Ésta representa una entidad definida y tal vez una de las primeras en las que se demostró el origen T de los linfocitos circulantes. La sangre periférica se halla afectada en la mayoría de los casos, aunque en unos pocos, la enfermedad se manifiesta en forma tumoral, ej. esplenomegalia, y la sangre periférica solo se halla involucrada durante la evolución clínica y, en especial, después de una esplenectomía que, en estos pacientes, suele realizarse con fines diagnósticos. Las citopenias, particularmente neutropenia y anemia, son comunes. El grado de linfocitosis es muy variable y generalmente no suele ser muy marcado e inferior a 20x10 9 /l. El cuadro morfológico es homogéneo y la célula predominante es un linfocito de tamaño mediano o grande con un núcleo de cromatina madura, generalmente excéntrico, de cromatina densa y nucléolo no visible; el citoplasma es abundante, claro y posee varios gránulos azurófilos, de ahí la denominación de leucemia de linfocitos granulares. Dicha granulación contiene enzimas tales como la fosfatasa ácida así como otras citocinas (por ejemplo granzimas) que desarrollan un papel importante en la función citotóxica/killer o "natural killer" de estos linfocitos. Estudios ultraestructurales demuestran que algunos de estos gránulos poseen en su interior una estructura peculiar integrada por haces de microtúbulos dispuestos en posición paralela y que por ello se designan: haces de túbulos paralelos o PTA. De acuerdo al fenotipo, existen dos variantes de leucemias de linfocitos granulares: la variante T-citotóxica y la de células "natural killer". No existen grandes diferencias entre ambas excepto por: 1- su incidencia, la variante de células natural killer es mas frecuente en países orientales, 2- curso clínico, que suele ser más agresivo en la leucemia de células natural killer y 3- la morfología, ya que la granulación citoplasmática es más marcada en la variante de células T. Los rasgos morfológicos de los linfocitos en la leucemia de linfocitos granulares son idénticos o muy similares a los que muestran la pequeña proporción (5-10%) de linfocitos granulares presentes en sangre periférica de individuos normales. Raramente la leucemia de linfocitos granulares sufre transformación a un linfoma de alto grado T; en algunos casos descritos, las células blásticas poseen unas características citoplasmáticas similares a las de los linfocitos granulares incluyendo granulación citoplasmática. El diagnóstico diferencial de la leucemia de linfocitos granulares se plantea esencialmente con cuadros de linfocitosis reactivos a procesos virales o post-esplenectomía y con la tricoleucemia. La leucemia de linfocitos granulares se diferencia de linfocitosis reactivas, no clonales, mediante estudios citogenéticos o de análisis molecular investigando la configuración de los genes que codifican las cadenas del receptor de células T (RCT) que demuestra la presencia de una clona solamente en procesos leucémicos. Si bien, cuando no se dispone de estas técnicas, datos que apoyan el diagnóstico de un cuadro leucémico no reactivo son: una morfología y fenotipo uniformes (por ejemplo >90% de linfocitos CD8+>, inmunofenotipos atípicos o muy infrecuentes en linfocitos normales (por ejemplo CD4+CD16+CD56+) y una linfocitosis superior a 5x10 9 /I que persista durante o más de 6 meses. El diagnóstico diferencial con la tricoleucemia se presenta en aquellos casos en los que la enfermedad se manifiesta con marcada esplenomegalia y la linfocitosis no es obvia. La histología del bazo en estos pacientes puede remedar la de la tricoleucemia ya que como ésta, la leucemia de linfocitos granulares afecta primordialmente la pulpa roja del bazo. El inmunofenotipo, particularmente en cortes del bazo permite distinguir entre ambos procesos. Leucemia de linfocitos "Sézary-like" Ésta es una entidad muy infrecuente que se caracteriza por la presencia de linfocitos circulantes con una morfología similar o idéntica a la de las células de Sézary pero que, a diferencia del síndrome de Sézary, la afectación cutánea es inexistente. La enfermedad tiene un curso agresivo, similar al de la LP-T. Desde un punto de vista morfológico, las células circulantes son idénticas a las de la variante pequeña o de células grandes del síndrome de Sézary; el núcleo es 93
94 cerebriforme y el nucléolo no puede visualizarse por microscopía óptica o ultraestructural, mientras que el último análisis permite confirmar la configuración cerebriforme del núcleo de estas células. Recientes estudios citogenéticos en una minoría de casos han demostrado la presencia de anomalías características de la LP-T, tales como inv(14)(qll;q32) así como anomalías que se observan con una frecuencia relativa en el síndrome de Sézary, como aquellas que afectan a 17q. Por consiguiente, es incierto sí este tipo de leucemia puede clasificarse como una entidad definida, con rasgos intermedios entre la LP-T y el síndrome de Sézary, o bien encuadrarse como una variante cerebriforme de la LP-T. LINFOMAS T LEUCEMIZADOS Leucemia linfoma T del adulto (LLTA) Éste es un síndrome linfoproliferativo T con una distribución racial y geográfica y etiología características y que con una gran frecuencia (>75%) afecta sangre periférica. El cuadro citológico se caracteriza por un marcado pleomorfismo en relación al tamaño celular, grado de condensación cromatínica e irregularidades nucleares. La célula más característica es un linfocito de mediano tamaño con citoplasma escaso y agranular y un núcleo polilobulado o con múltiples hendiduras visibles al microscopio óptico. Por dicha configuración nuclear que asemeja los pétalos de flores, esta célula se ha designado "célula en flor". Una proporción muy pequeña de linfocitos en flor puede ser identificada en la sangre periférica de portadores del retrovirus HTLV-l, agente causal de la LLTA. Asimismo en la LLTA, pueden observarse en sangre periférica células linfoides de tamaño grande y con características de inmunoblastos, especialmente en la forma aguda de presentación, aunque su proporción es pequeña. El diagnóstico diferencial de la LLTA se plantea con otros linfomas T leucemizados, el síndrome de Sézary y linfomas cutáneos con expresión periférica. La morfología es de gran ayuda en el diagnóstico diferencial ya que existe un marcado "overlapping" en cuanto a datos histológicos e inmunofenotipo que no permiten diferenciar entre la LLTA y los otros linfomas cutáneos T. El test definitivo es la demostración del retrovirus HTLV-l bien mediante serología o análisis del ADN ya que sólo se halla presente en la LLTA. Síndrome de Sézary El síndrome de Sézary es un linfoma cutáneo T que por definición afecta la sangre periférica. Los recuentos linfocitarios en estos pacientes no suelen ser muy elevados, generalmente inferiores a 50x10 9 /l pero en la extensión de sangre periférica destacan siempre linfocitos atípicos. En base al tamaño celular se distinguen dos variantes de síndrome de Sézary: la de células pequeñas y la de células grandes, si bien no es infrecuente hallar los dos tipos celulares en un mismo paciente. La célula de Sézary posee unos rasgos nucleares muy característicos. En las células de mayor tamaño, el núcleo es altamente convoluto con irregularidades que asemejan las circunvoluciones del cerebro y por ello se designa núcleo cerebriforme. Este aspecto no siempre se objetiva en las células de Sézary pequeñas, las cuales suelen exhibir un núcleo hipercromático. El citoplasma en estas últimas es escaso, mientras que puede ser algo más abundante en las de tamaño grande y contener o no vacuolas. El estudio ultraestructural permite documentar de forma más precisa las irregularidades nucleares y demostrar un núcleo serpentino con dos o más indentaciones de escasa amplitud. En general, no existen problemas de diagnóstico diferencial entre el síndrome de Sézary y otros procesos T cuando se dispone de los datos clínicos y de inmunofenotipo, excepto con la LLTA, en especial en países endémicos para el HTLV-l. Como hemos mencionado antes, estudios serológicos o moleculares de este retrovirus son esenciales junto con los otros datos clínicos y de laboratorio para distinguir el síndrome de Sézary u otros linfomas cutáneos leucemizados de la LLTA. 94
95 Otros linfomas T con expresión leucémica Los linfomas de células grandes T pueden manifestarse o evolucionar con un cuadro leucémico como ocurre con los de origen B, si bien con una frecuencia menor. Desde un punto de vista morfológico las células circulantes son de tamaño grande y no poseen rasgos que permitan diferenciarlas de aquellas que se observan en los linfomas B de células grandes. El inmunofenotipo, por consiguiente, es necesario para tal diferenciación. Los linfomas pleomórficos T, anaplásicos y linfomas / raramente se leucemizan y el cuadro morfológico es altamente variable. LLC LPL B TL LEUCEMIA DE CELULAS PLASMATICAS LINFOMA CENTROFOLICULAR LINFOMA DE MANTO 95
96 LEUCEMIA PROLINFOCITICA T LEUCEMIA LGG SINDROME DE SEZARY SINDROMES MIELOPROLIFERATIVOS CRÓNICOS (SMPc) Son alteraciones clonales de la célula madre hematopoyética, caracterizados por la proliferación en la médula ósea, de una o más líneas celulares mieloides (granulocítica, eritroide y megacariocítica). Pueden cursar con un grado variable de mielofibrosis. En su evolución tienen el potencial de sufrir progresión de la enfermedad y fallo medular debido a mielofibrosis, hematopoyesis inefectiva o transformación en una fase blástica aguda. Son enfermedades de adultos, con edad de presentación comprendida entre 50 y 70 años. El tratamiento de los SMPC no está encaminado a la curación de la enfermedad, sino a la supervivencia y mantenimiento de una situación clínica óptima. La excepción la constituye la leucemia mieloide crónica (LMC) que requiere un tratamiento más agresivo. Son desordenes clonales de las células sanguíneas caracterizados por proliferación en MO de uno o mas de los linajes mieloides (eritroide, granulocítico, megacariocítico) Cambios en las Denominaciones La clasificación WHO 2001 utilizaba la denominación de enfermedades mieloproliferativas crónicas. La clasificacion WHO 2008, con el objeto de reflejar exactamente la naturaleza neoplásica de estas entidades, paso a denominarlas neoplasias mieloproliferativas (NMP). Se ha incorporado además, un nuevo subgrupo, el de las neoplasias mieloides y linfoides con eosinofilia y anormalidades del PDGFRA, PDGFRB, y FGFR1. Razones que justificaron los cambios En los primeros esquemas de la clasificacion WHO, para confirmar el diagnostico de Leucemia Mieloide Crónica (LMC) se consideraba la detección del cromosoma 96
97 Philadelphia (Ph) y/o el gen de fusión BCR-ABL1 mientras que los subtipos de NMP BCR- ABL1 negativos eran diagnosticados de acuerdo a características clínicas y de laboratorio y sustentado en mínimas contribuciones histopatológicas. Hoy se reconoce que en las NMP la proliferación anormal es debida a rearreglos clonales o mutaciones de genes que codifican proteínas tirosinquinasa. Dos factores han influido para generar los cambios producidos en la revisión de los criterios WHO para NMP: 1) el descubrimiento de anormalidades genéticas que pueden ser utilizadas como marcadores diagnósticos en las NMP con transcripto genético BCR-ABL1 negativas y 2) y una mejor caracterización de figuras histológicas en estas neoplasias. El descubrimiento en 2005 de la mutación JAK2 V617F (gen Janus cinasa 2) fue un hecho relevante para la comprensión de la fisiopatogenia en las NMP y ha generado una revolución en el diagnostico y clasificacion de este grupo de enfermedades, y especialmente de la Policitemia Vera (PV). Anormalidades, como el JAK2 o KIT mutado, no son específicas de un NMP específica, pero proveen una prueba de que la proliferación es clonal permitiendo así eliminar la posibilidad de un proceso reactivo. Hasta el presente la mutación más común reconocida en las NMP BCR- ABL1 negativas es JAK2 V617F. Esta mutación se detecta en mas del 90% de pacientes con PV y en casi la mitad de aquellos con mielofibrosis primaria (MFP) o trombocitemia esencial (TE). De esta manera, JAK2 V617F no es específica de una NMP exclusiva, ni su ausencia excluye una NMP. Clasificacion WHO -Neoplasias Mieloproliferativas (NMP) Leucemia mieloide crónica, BCR-ABL1 positiva Leucemia neutrofílica crónica Policitemia vera Mielofibrosis Primaria Trombocitemia Esencial Leucemia eosinofílica crónica, sin otra especificación Mastocitosis Neoplasias mieloproliferativas, inclasificables -Neoplasias Mieloides y Linfoides con Eosinofilia asociada con anormalidades del PDGFRA, PDGFRB, o FGFR1 Todos estos trastornos implican desregulación en la célula madre hematopoyética multipotente (CD34), y comparten una o más de las siguientes características: Sobreproducción de uno o varios elementos sanguíneos con predominio de un clon transformado. Medula hipercelular o fibrosis medular. Anomalías citogenéticas. Diátesis trombótica o hemorrágica. Hematopoyesis extramedular (hígado o bazo). Transformación a leucemia aguda. Superposición de características clínicas LEUCEMIA MIELOIDE CRÓNICA (LMC) La LMC es una expansión clonal de celulas progenitoras hematopoyéticas caracterizada clínicamente por hiperplasia mieloide, leucocitosis con basofilia y esplenomegalia. La LMC tiene una huella genética (el cromosoma Ph formado por la translocación entre los cromosomas 9 y 22) y un correlato molecular (el gen de fusión BCR/ABL). 97
98 Características de la LMC Examen clínico Al momento del diagnostico, >80% de los pacientes están en fase crónica, que en muchos pacientes se presenta asintomática. El hallazgo mas común del examen físico en el momento del diagnostico es la esplenomegalia. El bazo puede ocupar gran parte del abdomen, o puede presentarse solo un aumento mínimo. En alrededor del 10% de los pacientes, el bazo no se palpa durante una exploración esplénica. En aquellos pacientes que experimentan síntomas, estos son generalmente secundarios a esplenomegalia, e incluyen dolor, plenitud abdominal, y perdida de peso. Fases de la Enfermedad La enfermedad suele presentar un curso evolutivo bifásico, con un periodo inicial o fase crónica, fácil de controlar con distintas terapéuticas, y otro final o crisis blástica, muy similar desde el punto de vista clínico y hematológico a una leucemia aguda, aunque de peor pronóstico. En algunos pacientes se intercala entre ambos un tercer periodo, la denominada fase de aceleración. 1. Fase crónica (FC): Durante esta fase la LMC es una enfermedad poco agresiva y fácil de controlar, y permite a los pacientes una vida prácticamente normal. Al cabo de un periodo variable, cuyo promedio es de unos 3,5 años, la enfermedad entra en una fase terminal muy agresiva y resistente al tratamiento. 2. Fase de aceleración (FA): Se observa en alrededor de un tercio de los pacientes. En ella cambian las características de la enfermedad y puede aparecer: fiebre y/o sudoración nocturna, esplenomegalia progresiva y resistente al tratamiento. Las celulas diferenciadas persisten, aunque a menudo muestran mayores anomalías morfológicas. Pueden presentar anemia o trombocitopenia no atribuibles a la quimioterapia, leucocitosis resistente al tratamiento, trombocitosis (superior a /l), blastos del 10-15% en SP o MO. Aparición de anomalías citogenéticas adicionales al cromosoma Ph. Algunos enfermos fallecen en esta fase por infección o hemorragia, pero la mayoría acaban por presentar en pocos meses los criterios de crisis blástica. 3. Crisis blástica (FB): Consiste en el paso sin solución de continuidad de la FC a un cuadro superponible al de LA, con la invasión mas o menos rápida de la MO, la SP y a veces otros órganos por blastos. Este patrón evolutivo (sin fase de aceleración previa) es el más frecuente, ya que se da en el 60% de los pacientes. Fase crónica - Alteraciones citogenéticas (ver mas adelante) - < 10% de blastos y promielocitos en SP y MO Fase acelerada (FA) - Blastos 10-19% en SP o MO, - Basófilos en SP hasta 20%, - Trombocitopenia o trombocitosis persistente que no responde a la Terapia (< /l o > /l respectivamente) -Aumento del tamaño del bazo y aumento del recuento de leucocitos que no responde a la terapia -Evidencia citogenética de evolución clonal -Una proliferación megacariocítica importante en clusters, asociada con marcada fibrosis de reticulina o colágeno, y/o severa displasia granulocítica, debería ser considerada como sugestiva de FA. Estos hallazgos aun no han sido analizados en grandes estudios clínicos, así que no esta claro si son criterios independientes para la FA. Ellos frecuentemente ocurren simultáneamente con una o más de las características enumeradas. 98
99 Fase blástica (FB) - Blastos >20% en SP o MO, - Proliferación extramedular de blastos, - Grandes focos o clusters de blastos en biopsia de MO Algunos estudios han indicado que ciertas características a la presentación tienen importancia pronostica. La transición de FC a FA y posteriormente a FB puede ocurrir gradualmente durante un periodo de un ano o mas, o aparecer bruscamente (crisis blástica). La tasa de evolución anual de FC a crisis blástica es de 5% a 10% los primeros dos anos y de 20% en los anos subsiguientes. Los factores que predicen una FC de menor duración son: Padecer esplenomegalia o hepatomegalia creciente y dolorosa Ser de edad avanzada. Ser de sexo masculino. Tener una concentración elevada de lactato deshidrogenasa perica. Anomalías citogenéticas adicionales al cromosoma Ph1. Una proporción en el límite de blastos de MO o SP. Leucocitosis evolutiva. Basofilia. Eosinofilia. Trombocitosis o trombocitopenia. Anemia. Fiebre. Dolores óseos. Desarrollo de lesiones óseas destructivas. Complicaciones trombóticas o hemorrágicas Exámen de MO y SP La MO es hipercelular, y los recuentos diferenciales tanto de MO como SP muestran un espectro de granulocitos maduros e inmaduros similares a los que se encuentran en una MO normal. A menudo se observan cantidades mayores de eosinófilos o basófilos, y a veces se observa monocitosis. Con frecuencia se encuentra un aumento de megacariocitos en la MO, y en ocasiones se observa en SP fragmentos de núcleos megacariocíticos, especialmente cuando el recuento de plaquetas es muy alto. El porcentaje de linfocitos es menor, tanto en MO como en SP, en comparación con sujetos normales, y la proporción mieloide/eritroide en la MO es generalmente muy elevada. El examen histopatológico del aspirado de MO demuestra un cambio en las series mieloides a formas inmaduras que aumentan en numero a medida que el paciente progresa a la FB de la enfermedad. SP: _ presenta recuento de leucocitos >10 x 10 9 /l _ con neutrófilos, metamielocitos y mielocitos, _ generalmente < 5% mieloblastos en SP y MO; _ se observa eosinofilia y basofilia; _ 50% de los casos trombocitosis. MO: _ hipercelular (hasta 100% celular) _ con precursores granulociticos aumentados, basófilos, eosinófilos y ocasionalmente monocitos; _ serie eritroide normal, _ megacariocitos con disposición en clusters en número normal o aumentado, _ presencia variable sea-blue histiocitos; 99
100 _ aumento de fibras de reticulina, _ sin embargo la fibrosis medular es rara a la presentación y esta asociada con el n de megacariocitos CD61+. Score de fosfatasa alcalina: La fosfatasa alcalina leucocitaria (LAP) esta ausente o marcadamente reducida en los neutrófilos de pacientes con LMC. La LAP es un marcador de diferenciación terminal de neutrófilos. Para su cuantificación se realiza un score (en 100 neutrófilos) de 0 a 4+ sobre la base de la intensidad del precipitado azul en su citoplasma; se suman los valores de 100 celulas y se reporta la puntuación total. Un score bajo: indica desarrollo de neutrófilos anormales, asociado con LMC, PNH. Citogenética y Alteraciones Moleculares Como se menciono en la introducción, la LMC es un trastorno clonal que generalmente se diagnostica con facilidad porque las celulas leucémicas de más del 95% de los pacientes presentan una anomalía citogenética distintiva, el cromosoma Ph. Este cromosoma resulta de un desplazamiento reciproco entre los brazos largos del cromosoma 9 y el 22 en todos los precursores hematopoyéticos. El desplazamiento o translocación produce la transferencia de la región ABL (Abelson) en el oncogén del cromosoma 9 a un área en el cromosoma 22 denominada BCR (región de rotura de conglomerados). Esto a su vez resulta en un gen fusionado BCR/ABL y en la producción de una proteína anormal con actividad tirosinquinasa que puede estar relacionada con la mielopoyesis desordenada que se encuentra en la LMC. El seguimiento molecular de la enfermedad se realiza a través de la cuantificación de la expresión del transcripto de fusión BCR/ABL, por técnicas de PCR cuantitativa. La cuantificación de BCR/ABL tiene además importancia pronostica y ayuda a tomar decisiones terapéuticas en el manejo de los pacientes con LMC. Aunque las técnicas citogenéticas continúan siendo el gold standard para monitorear la respuesta al tratamiento de los pacientes con LMC Ph positiva, una vez alcanzada la respuesta citogenética completa (RCC), el único método que permite monitorear los niveles de enfermedad del paciente es el estudio molecular. En la actualidad, con el tratamiento con inhibidores de tirosinquinasa, mas de un 80% de los pacientes alcanzan RCC, por lo tanto es necesario introducir estas técnicas de análisis más sensibles, que permiten medir respuesta al tratamiento. En los enfermos que alcanzan RCC, el nivel del transcrito BCR/ABL sigue disminuyendo con el tiempo, incluso en algunos casos hasta pasados tres anos de la obtención de la respuesta citogenética. La respuesta molecular completa se define como la desaparición de la detección de BCR/ABL mediante PCR convencional o la disminución de 4,5 logaritmos mediante PCR cuantitativa. La recaída molecular se define como el aumento del nivel de expresión del transcrito BCR/ABL de un logaritmo, comprobado en dos determinaciones consecutivas. Cuando esto ocurre, la probabilidad de recaída de la enfermedad es alta, y por ello deben considerarse señales de alarma sobre las posibles causas y, si es necesario, modificar el tratamiento del enfermo. LMC en edad pediátrica La LMC comprende menos de 5% de todas las leucemias de la niñez, y en el rango de edad pediátrica, se presenta principalmente en los adolescentes mayores. El imatinib ha mostrado un índice alto de actividad en niños con LMC, que es comparable con el que se observa entre adultos. El único tratamiento curativo que se conoce actualmente para la LMC es el trasplante de celulas madre hematopoyéticas autólogo. Informes publicados describen tasas de respuesta de 70 a 80% cuando se utiliza un donante familiar HLA compatible en el tratamiento de niños en la fase crónica temprana, con tasas de supervivencia mas bajas cuando se utilizan donantes HLA compatible no emparentados con. 100
101 LEUCEMIA NEUTROFÍLICA CRÓNICA (LNC) El interrogante que surge respecto de la LNC es si realmente es una enfermedad. La clasificacion WHO la incluye en los desordenes mieloproliferativos, con la recomendación de que sea cuidadosamente excluida una enfermedad subyacente. Si esta presente otra neoplasia, tal como un mieloma, el diagnostico de LNC solo debería ser considerado, si se demuestra evidencia genética de neoplasia mieloide. La LNC es un trastorno mieloproliferativo crónico poco común de etiología desconocida, que se caracteriza por una neutrofilia en SP (> /L) y hepatoesplenomegalia. La MO es hipercelular. No hay displasia significativa en ningún linaje celular y la fibrosis de MO es poco común. Los estudios citogenéticos son normales en casi el 90% de los pacientes. En el 10% restante, las anomalías cariotípicas clonales, podrían incluir +8, +9, del(20q) y del(11q). No hay cromosoma Ph o gen de fusión BCR/ABL. Leucocitosis en SP 25 x 109/L Neutrófilos y cayados >80% Granulocitos inmaduros <10% Mieloblastos <1% Biopsia de MO hipercelular Aumento de granulocitos neutrófilos Mieloblastos <5% Maduración neutrofílica normal La LNC es un trastorno que evoluciona lentamente y la supervivencia de los pacientes es variable, oscilando entre seis meses y más de 20 anos. POLICITEMIA VERA (PV) Un poco de historia La PV, TE y MFI son tres condiciones que comparten varias características, incluyendo hipercelularidad de MO, predisposición a la trombosis y hemorragia, y riesgo de transformación leucémica en el largo plazo. La PV es una condición de hipercelularidad persistente y excesiva acompañada por cianosis que fue reconocida por primera vez por Vazquez en La MFP fue descripta casi al mismo tiempo y la TE reconocida en los 1930s. Dameshek, en 1951, fue el primero en observar la considerable superposición de características clínicas y de laboratorio en estas condiciones y propuso que, junto con la LMC y otros desordenes constituían un espectro de desordenes relacionados. Uso el término de desordenes mieloproliferativos. En 1974, un experimento critico mostró que los progenitores eritroides de MO de pacientes con PV eran capaces de crecer in vitro en ausencia de eritropoyetina (EPO). Se determino que estas enfermedades se originan en un clon de stem cells hematopoyéticas. Con el tiempo, se fueron encontrando otras claves del mecanismo responsable de los desordenes mieloproliferativos. Estas incluyen la asociación de varias neoplasias mieloides crónicas con tirosinquinasas activadas y el reconocimiento de pasos de señalización aumentada a través de Janus cinasas y traductores de señales y activadores de transcripción (JAK STAT) y fosfatidil inositol 3-cinasa (PI3K) en celulas mieloides y eritroides. El descubrimiento de la mutación JAK2V617F en PV, TE y MFP y de las mutaciones en el exón 12 en PV y de MPLW515L/K en MFP y TE, ha ocasionado tal impacto en el diagnostico de estas entidades que no solo se ha impuesto como prueba diagnostica esencial en la clínica cotidiana, sino que ha obligado a efectuar la revisión de los criterios diagnósticos de la WHO vigentes desde 2001 y ha llevado, en 2007, al grupo de expertos en estas enfermedades, a publicar una nueva propuesta para las tres NMP Ph negativas clásicas. 101
102 Criterios para PV Requiere la presencia de los 2 criterios mayores y uno de los criterios menores, o la presencia del primer criterio mayor junto con 2 criterios menores. Criterio Mayor 1- Hb >18.5g/dl en varones, > 16.5 g/dl en mujeres u otra evidencia de aumento de la masa de celulas rojas* 2- Presencia de JAK2 V617F u otra mutación tal como la mutación del exón 12 de JAK2 Criterio Menor 1- Biopsia de MO mostrando hipercelularidad para la edad con crecimiento de los 3 linajes (panmielosis) con prominente proliferación eritroide, granulocítica y megacariocítica 2- Nivel de eritropoyetina sérica inferior al rango de referencia 3- Formación de colonias eritroides endógenas in Vitro *Hb o hematocrito en el percentil 99 del rango de referencia o Hb 17 g/dl en varones, 15 g/dl en mujeres si esta asociado con un aumento sostenido de al menos 2 g/dl del valor basal de una persona que no pueda ser atribuido a corrección por deficiencia de Fe o masa de GR 25% sobre el valor normal. El estudio de la mutación JAK2 V617F ha tenido un gran impacto en la aproximación diagnostica a las NMP, en especial a la PV. JAK2 2V617F se ha convertido en el primer marcador biológico pronóstico independiente, junto a los factores pronósticos convencionales, para PV, TE y MFP. Los siguientes hallazgos confirmatorios ya no se requieren para emitir un diagnostico: Saturación de oxigeno con gasometría arterial venosa >92%. Esplenomegalia. Trombocitosis (> plaquetas/mm 3 ). Leucocitosis (>12.000/mm 3 ). Fosfatasa alcalina leucocitaria (>100 unidades en ausencia de fiebre o infección). Algunos signos y síntomas de la PV: Dolor de cabeza, sudoración exagerada, zumbido en los oídos, trastornos visuales, como visión borrosa o áreas ciegas, mareos o vértigo. En algunos pacientes aparece picazón en la piel, especialmente después de baños o duchas tibias. Puede aparecer un aspecto rojizo o violáceo de la piel, especialmente en las palmas, los lóbulos de la oreja, la nariz y las mejillas. Algunos pacientes tal vez experimenten una sensación de ardor en los pies. Las ulceras pépticas se pueden asociar con la PV y pueden tener como resultado hemorragias gastrointestinales Esplenomegalia. La angina de pecho o insuficiencia cardiaca congestiva pueden ser efectos nocivos de la sangre viscosa y la elevación de plaquetas puede causar trombos. La gota puede aparecer o empeorar. Hemorragias o hematomas, generalmente leves, ocurren en aproximadamente el 25% de los pacientes con PV. MIELOFIBROSIS IDIOPÁTICA PRIMARIA (MFP) Sinónimos: metaplasia mieloide agnogénica, mieloesclerosis con metaplasma mieloide, mielosis crónica granulocítica-megacariocítica) 102
103 La MFP es una proliferación clonal de una célula madre hematopoyética pluripotencial, en la que la fibrosis y la reacción del estroma constituyen fenómenos reactivos a la liberación de citoquinas, fundamentalmente por los megacariocitos, los monocitos y las celulas endoteliales. Esta enfermedad afecta fundamentalmente a personas de edad avanzada, si bien también hay pacientes jóvenes. Esta caracterizada por panmielopatia con maduración intacta, fibrosis medular progresiva, hematopoyesis extramedular en bazo, hígado y nódulos linfáticos, y marcada esplenomegalia (hasta 4 Kg.). También anemia, otras citopenias, síntomas B (fiebre, perdida de peso >10%, sudoración nocturna), gota, infecciones, episodios tromboticos, sangrado. La MFP se caracteriza por fibrosis de la MO, hemopoyesis extramedular con esplenomegalia, anemia con dacriocitosis y síndrome leucoeritroblástico. La MFP es heterogénea en su presentación y evolución, oscilando su espectro clínico desde pacientes asintomáticos al diagnostico hasta otros con sintomatología constitucional o síntomas derivados de la esplenomegalia y la anemia. Cambios en MO Presencia de proliferación megacariocítica con atipía (megacariocitos pequeños a grandes con relación núcleo/citoplasma aberrante y núcleos hipercromáticos, con mamelón, o irregularmente plegados y agrupamiento denso), generalmente esta acompañada de fibrosis de colágeno o reticulina o, en ausencia de fibrosis significativa, los cambios en megacariocitos deben estar acompañados por aumento en la celularidad medular caracterizada por proliferación granulocítica y frecuentemente disminución de la eritropoyesis. EN SANGRE PERIFÉRICA DACRICITOS!!! TROMBOCITEMIA ESENCIAL (ET) Algunos investigadores argumentan que los pacientes con figuras clínicas y morfológicas de TE pueden tener recuentos de plaquetas que exceden el rango normal, pero que no alcanzan el umbral diagnostico requerido. En la ultima revisión de criterios para el diagnostico de TE ha sido, por esto, bajado de /l a /l. Cabe destacar, además de lo referido previamente, que en presencia de marcador clonal JAK2V617F, MPLW515L/K, u otros, la presencia de trombocitosis reactiva asociada no excluyen el diagnostico de TE si se cumplen los tres criterios mayores que se describen en la tabla
104 Cuando se mencionan cambios en MO compatibles con TE refieren a una biopsia de MO que muestra proliferación principalmente del linaje megacariocítico con numero aumentado de megacariocitos grandes, maduros; sin aumento significativo o desviación a la izquierda en la granulopoyesis neutrófila o de la eritropoyesis. Es importante destacar que la mutación JAK2V617F, aunque muy característica, no es especifica de las NMP Ph negativas clásicas, ya que se puede detectar también en otras patologías mieloides: en el 50% de las anemias refractarias con sideroblastos en anillo y trombocitosis (ARSA-T), en el 20% de los SMD atípicos y en el 3% de los SMD o LMA de novo. De modo que, ante la sospecha de TE, la detección de la mutación JAK2V617F no descartaría un SMD o MFP si bien conviene resaltar que no se detecta en patología tumoral no mieloide ni en LMC. plaquetaria disminuida. Leucemia Eosinofílica Crónica (LEC) y Síndrome Hipereosinofílico (SHE) La decisión de incluir LEC y SHE juntos no significa que la WHO considere que todos los casos de SHE sean enfermedades mieloproliferativas clonales. Mas bien señala el problema de que en la práctica es virtualmente imposible distinguir entre eosinofilia clonal y eosinofilia secundaria a producción anormal de citosina para la cual no se reconocen bases etiológicas. El diagnostico de LEC o SHE puede ser hecho solo tras la exclusión de un número de enfermedades infecciosas, inflamatorias y neoplásicas con asociación conocida a eosinofilia (incluyendo LMC, LMA con inv(16), otros desordenes mieloproliferativos crónicos, linfoma de célula T, linfoma Hodgkin, y otros). Entonces, si no hay evidencia de clonalidad, se prefiere establecer el diagnóstico de SHE, mientras que el hallazgo de una anormalidad clonal mieloide soportaría el diagnostico de LEC. Características exclusión de causas reactivas, infecciosas y neoplásicas Eosinofilia persistente >1.5 x 109/L en SP Aumento de eosinófilos en MO Mieloblastos <20% en SP o MO Los casos de Neoplasia Mieloide con Eosinofilia que carecen de reordenamientos del PDGFRA, PDGFRB, o FGFR1 deberían ser clasificados como LEC sin otras especificaciones, si se cumplen los siguientes criterios: _ recuento de eosinófilos /l, 104
105 _ blastos < 20% en SP y MO, _ ausencia de BCR-ABL1, inv(16)(p13.1q22) o t(16;16)(p13.1;q22), y _ ausencia de evidencia de otra NMP o SMD/NMP, pero hay: _ una anormalidad clonal, citogenética relacionada mieloide _ anormalidad genética molecular, _ blastos >2 % en SP o 5% en MO. Los casos con eosinofilia que carecen de evidencia de clonalidad pueden ser diagnosticados como SHE idiopático tras descartar todas las causas de eosinofilia reactiva. LMC SP FASE CRÓNICA LMC MO FASE CRÓNICA LMC MO FASE ACELERADA LMC MO CRISIS BLÁSTICA 105
TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA
 TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA NORMAS PARA CORRECTA EXTRACCIÓN SANGUÍNEA #Punción venosa Región antecubital, yugular o femoral en RN, dorso de la mano y pie en
TEMA 3. RECOGIDA Y MANIPULACIÓN N DE MUESTRAS. COLORANTES EN HEMATOLOGÍA NORMAS PARA CORRECTA EXTRACCIÓN SANGUÍNEA #Punción venosa Región antecubital, yugular o femoral en RN, dorso de la mano y pie en
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATOCRITO - ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS
 TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATOCRITO - ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS 2017 Dra. Ana Cecilia Haro HEMOGLOBINA Molécula de la
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATOCRITO - ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS 2017 Dra. Ana Cecilia Haro HEMOGLOBINA Molécula de la
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATÓCRITO ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS
 TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATÓCRITO ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS BIOQUÍMICA CLÍNICA I. INSTITUTO DE BIOQUÍMICA APLICADA.
TEÓRICO PRÁCTICO 2 HEMOGLOBINA HEMATÓCRITO ÍNDICES HEMATIMÉTRICOS VELOCIDAD DE SEDIMENTACIÓN GLOBULAR ALTERACIONES MORFOLÓGICAS DE LOS ERITROCITOS BIOQUÍMICA CLÍNICA I. INSTITUTO DE BIOQUÍMICA APLICADA.
Anemias en Pediatría Diagnóstico, interpretación del hemograma
 Anemias en Pediatría Diagnóstico, interpretación del hemograma Dra. Marcela Gutiérrez Médica Pediatra Hematóloga Hospital de Niños Ricardo Gutiérrez Buenos Aires Técnica de recolección: recursos para su
Anemias en Pediatría Diagnóstico, interpretación del hemograma Dra. Marcela Gutiérrez Médica Pediatra Hematóloga Hospital de Niños Ricardo Gutiérrez Buenos Aires Técnica de recolección: recursos para su
TEMA 8: HEMATOLOGÍA. Hematíes: < Anemia, > Policitemia Leucocitos:<Leucopenia,>Leucocitosis Plaquetas: <Trombocitopenia, > Trombocitosis
 b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
b) Métodos automáticos: basados en variaciones en la conductividad o resistencia, basados en la difracción Células: TEMA 8: HEMATOLOGÍA Hematíes: < Anemia, > Policitemia Leucocitos:Leucocitosis
Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura CÁTEDRA: HEMATOLOGÍA CLÍNICA TRABAJOS PRÁCTICOS
 Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura CÁTEDRA: HEMATOLOGÍA CLÍNICA TRABAJOS PRÁCTICOS ALUMNO: GRUPO:... AÑO: 2012 1 INTEGRANTES DE LA CÁTEDRA: PROFESORA
Universidad Nacional del Nordeste Facultad de Ciencias Exactas y Naturales y Agrimensura CÁTEDRA: HEMATOLOGÍA CLÍNICA TRABAJOS PRÁCTICOS ALUMNO: GRUPO:... AÑO: 2012 1 INTEGRANTES DE LA CÁTEDRA: PROFESORA
I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG).
 I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG). Técnica. 1 Extraiga sangre del tubo o frasco con una pipeta Pasteur. 2 Transfiérala a un tubo de Wintrobe y llénelo hasta la
I Determinación de la velocidad de sedimentación eritrocitaria (VSE o VSG). Técnica. 1 Extraiga sangre del tubo o frasco con una pipeta Pasteur. 2 Transfiérala a un tubo de Wintrobe y llénelo hasta la
PARA EL ESTUDIO DE LOS ERITROCITOS
 OTROS MÉTODOS M PARA EL ESTUDIO DE LOS ERITROCITOS HEMOGRAMA Parámetros cualitativos Morfología celular Fórmula leucocitaria Parámetros cuantitativos Hemoglobina Hematocrito Recuentos celulares Índices
OTROS MÉTODOS M PARA EL ESTUDIO DE LOS ERITROCITOS HEMOGRAMA Parámetros cualitativos Morfología celular Fórmula leucocitaria Parámetros cuantitativos Hemoglobina Hematocrito Recuentos celulares Índices
Fisiología del Tejido Sanguíneo Volemia y Glóbulos Rojos
 Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Programa de Enfermería Departamento de Ciencias Funcionales Sección de Fisiología Fisiología del Tejido Sanguíneo Volemia
Universidad Centroccidental Lisandro Alvarado Decanato de Ciencias de la Salud Programa de Enfermería Departamento de Ciencias Funcionales Sección de Fisiología Fisiología del Tejido Sanguíneo Volemia
TITULO DEL PROCEDIMIENTO RECUENTO DE LEUCOCITOS EN SANGRE TOTAL
 PAGINA: 1 de n RECUENTO DE LEUCOCITOS EN SANGRE TOTAL OBJETO Establecer el procedimiento para realizar el recuento de leucocitos o glóbulos blancos en el laboratorio CALIDAD. CAMPO DE APLICACIÓN Este procedimiento
PAGINA: 1 de n RECUENTO DE LEUCOCITOS EN SANGRE TOTAL OBJETO Establecer el procedimiento para realizar el recuento de leucocitos o glóbulos blancos en el laboratorio CALIDAD. CAMPO DE APLICACIÓN Este procedimiento
Procesado de muestras de sangre
 6 6.Prevención de la salud Procesado de muestras de sangre Los análisis de sangre son una herramienta diagnóstica muy útil en la Clínica Veterinaria. La fiabilidad de un análisis y su interpretación dependen
6 6.Prevención de la salud Procesado de muestras de sangre Los análisis de sangre son una herramienta diagnóstica muy útil en la Clínica Veterinaria. La fiabilidad de un análisis y su interpretación dependen
Prácticas: Configuración de los seres vivos. Curso académico Práctica 2. Preparación de extensiones celulares.
 Prácticas: Configuración de los seres vivos. Curso académico 2009-2010 16 Práctica 2. Preparación de extensiones celulares Introducción Se entiende por extensión o frotis celular, a la formación de una
Prácticas: Configuración de los seres vivos. Curso académico 2009-2010 16 Práctica 2. Preparación de extensiones celulares Introducción Se entiende por extensión o frotis celular, a la formación de una
Propiedades fisicoquímicas y funcionales de los alimentos 2015
 TRABAJO PRÁCTICO N 2: EMULSIONES DETERMINACIÓN DE LA ESTABILIDAD DE EMULSIONES POR CONDUCTIMETRÍA, MICROSCOPÍA Y TURBIDIMETRÍA. OBJETIVOS: 1. Determinar la estabilidad de emulsiones por conductimetría,
TRABAJO PRÁCTICO N 2: EMULSIONES DETERMINACIÓN DE LA ESTABILIDAD DE EMULSIONES POR CONDUCTIMETRÍA, MICROSCOPÍA Y TURBIDIMETRÍA. OBJETIVOS: 1. Determinar la estabilidad de emulsiones por conductimetría,
Calidad de muestras. Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero
 Calidad de muestras Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero Calidad de muestras Factores intervinientes: Obtención de muestra Contenedores Anticoagulantes Manipulación Preparación
Calidad de muestras Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero Calidad de muestras Factores intervinientes: Obtención de muestra Contenedores Anticoagulantes Manipulación Preparación
09/11/2017. Hematología Curso 2017/2018
 El Hemograma Hematología Curso 2017/2018 El Hemograma es una determinación analítica básica mediante la que se estudian elementos formes de la sangre desde el punto de vista cuantitativo y cualitativo.
El Hemograma Hematología Curso 2017/2018 El Hemograma es una determinación analítica básica mediante la que se estudian elementos formes de la sangre desde el punto de vista cuantitativo y cualitativo.
TRABAJO PRÁCTICO Nº 5 ESTUDIO DE ANEMIAS. Emilse Ledesma Achem
 TRABAJO PRÁCTICO Nº 5 ESTUDIO DE ANEMIAS Emilse Ledesma Achem - 2016 - EVALUACIÓN CLÍNICA: Cuándo fue el último análisis sin anemia? Origen étnico Antecedentes personales y heredofamiliares ESTUDIO DE
TRABAJO PRÁCTICO Nº 5 ESTUDIO DE ANEMIAS Emilse Ledesma Achem - 2016 - EVALUACIÓN CLÍNICA: Cuándo fue el último análisis sin anemia? Origen étnico Antecedentes personales y heredofamiliares ESTUDIO DE
Volemia y Glóbulos Rojos
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE FISIOLOGIA ENFERMERIA Volemia y Glóbulos Rojos Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO.-Sangre
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE FISIOLOGIA ENFERMERIA Volemia y Glóbulos Rojos Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO.-Sangre
HEMATOLOGÍA. A. Características físicas de la sangre (fig. 17-1)
 HEMATOLOGÍA A. Características físicas de la sangre (fig. 17-1) B. Composición de la sangre 1. Plasma - 55% de la sangre 2. Elementos formes (células sanguíneas) - 45% de la sangre (fig. 17-2) 3. Volumen
HEMATOLOGÍA A. Características físicas de la sangre (fig. 17-1) B. Composición de la sangre 1. Plasma - 55% de la sangre 2. Elementos formes (células sanguíneas) - 45% de la sangre (fig. 17-2) 3. Volumen
Universidad Mariano Gálvez Facultad de Ciencias Médicas y de la Salud Carrera de Médico y Cirujano CÉLULAS SANGUÍNEAS. Práctica 3
 CÉLULAS SANGUÍNEAS Práctica 3 1. Introducción La fórmula leucocitaria tiene por objetivo determinar los porcentajes de las distintas clases de leucocitos normales y anormales en la sangre. A partir de
CÉLULAS SANGUÍNEAS Práctica 3 1. Introducción La fórmula leucocitaria tiene por objetivo determinar los porcentajes de las distintas clases de leucocitos normales y anormales en la sangre. A partir de
Fase inicial de agregación Fase de sedimentación rápida Fase final de concentración
 1.- Introducción: La membrana de los glóbulos rojos tiene una membrana electrostática negativa que da lugar a fuerzas de repulsión entre los hematíes que hacen que los eritrocitos tiendan a permanecer
1.- Introducción: La membrana de los glóbulos rojos tiene una membrana electrostática negativa que da lugar a fuerzas de repulsión entre los hematíes que hacen que los eritrocitos tiendan a permanecer
Cada persona sana tiene unos 4-6 litros de sangre: ÚNICO TEJIDO LÍQUIDO DE TODO EL ORGANISMO:
 Cada persona sana tiene unos 4-6 litros de sangre: Ø hombre adulto: entre 5 y 6 litros de sangre. Ø mujer adulta: entre 4 y 5 litros. ÚNICO TEJIDO LÍQUIDO DE TODO EL ORGANISMO: Es un tipo de tejido conectivo
Cada persona sana tiene unos 4-6 litros de sangre: Ø hombre adulto: entre 5 y 6 litros de sangre. Ø mujer adulta: entre 4 y 5 litros. ÚNICO TEJIDO LÍQUIDO DE TODO EL ORGANISMO: Es un tipo de tejido conectivo
HEMOGRAMA MANUAL. Bqco. Gonzalo A Ojeda Cátedra Hematología Clínica Fa.C.E.N.A-U.N.N.E 2011
 HEMOGRAMA MANUAL Bqco. Gonzalo A Ojeda Cátedra Hematología Clínica Fa.C.E.N.A-U.N.N.E 2011 Definición ES EL ESTUDIO CUALI Y CUANTITATIVO DE LOS ELEMENTOS CORPUSCULARES DE LA SANGRE CUANTITATIVO : Recuento
HEMOGRAMA MANUAL Bqco. Gonzalo A Ojeda Cátedra Hematología Clínica Fa.C.E.N.A-U.N.N.E 2011 Definición ES EL ESTUDIO CUALI Y CUANTITATIVO DE LOS ELEMENTOS CORPUSCULARES DE LA SANGRE CUANTITATIVO : Recuento
RECUENTOS CELULARES.
 RECUENTOS CELULARES. Los recuentos celulares son una serie de procedimientos que tienen por objeto determinar el número de cada uno de los tipos celulares que están comprendidos en una unidad de volumen
RECUENTOS CELULARES. Los recuentos celulares son una serie de procedimientos que tienen por objeto determinar el número de cada uno de los tipos celulares que están comprendidos en una unidad de volumen
TRABAJO PRÁCTICO Nº 5 ESTUDIO DE ANEMIAS. Dra. Ana Cecilia Haro
 TRABAJO PRÁCTICO Nº 5 ESTUDIO DE ANEMIAS Dra. Ana Cecilia Haro - 2017 - EVALUACIÓN CLÍNICA: Cuándo fue el último análisis sin anemia? ESTUDIO DE LAS ANEMIAS Origen étnico Antecedentes personales y heredofamiliares
TRABAJO PRÁCTICO Nº 5 ESTUDIO DE ANEMIAS Dra. Ana Cecilia Haro - 2017 - EVALUACIÓN CLÍNICA: Cuándo fue el último análisis sin anemia? ESTUDIO DE LAS ANEMIAS Origen étnico Antecedentes personales y heredofamiliares
Prácticas fisiología sangre y sistema inmunitario.
 Prácticas fisiología sangre y sistema inmunitario. Práctica 1: extracción de sangre Material Jeringuilla Agujas endovenosas Tubos de vacío o Vacutainer Algodón Cinta elástica Gasas Alcohol etílico 70%
Prácticas fisiología sangre y sistema inmunitario. Práctica 1: extracción de sangre Material Jeringuilla Agujas endovenosas Tubos de vacío o Vacutainer Algodón Cinta elástica Gasas Alcohol etílico 70%
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR
 ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
ESTUDIO MICROSCÓPICO DE LAS BACTERIAS DEL YOGUR 1- Prepara un portaobjetos bien limpio con una gota de agua. 2 - Coge una porción pequeña de yogur con un palillo o una aguja enmangada y hacer una extensión
Orientación diagnóstica de las anemias en Urgencias. Hematología Clínica Rotger 2016
 Orientación diagnóstica de las anemias en Urgencias Definición Disminución de la hemoglobina por debajo de los valores normales Definición La hemoglobina es el parámetro más correcto para valorar una anemia
Orientación diagnóstica de las anemias en Urgencias Definición Disminución de la hemoglobina por debajo de los valores normales Definición La hemoglobina es el parámetro más correcto para valorar una anemia
La fórmula leucocitaria, junto con los recuentos celulares siguen siendo pruebas de gran importancia biodiagnóstica.
 SERVICIO DE LABORATORIO 29 DE 7 7 LEUCOGRAMA 7.1 GENERALIDADES La fórmula leucocitaria, junto con los recuentos celulares siguen siendo pruebas de gran importancia biodiagnóstica. 7.2 OBJETIVO Con ella
SERVICIO DE LABORATORIO 29 DE 7 7 LEUCOGRAMA 7.1 GENERALIDADES La fórmula leucocitaria, junto con los recuentos celulares siguen siendo pruebas de gran importancia biodiagnóstica. 7.2 OBJETIVO Con ella
3. MATERIALES Y MÉTODOS
 3. MATERIALES Y MÉTODOS En este trabajo se realizó un estudio experimental en muestras de sangre periférica de individuos del sexo masculino aparentemente sanos de Hermosillo, Sonora, México. Se empleo
3. MATERIALES Y MÉTODOS En este trabajo se realizó un estudio experimental en muestras de sangre periférica de individuos del sexo masculino aparentemente sanos de Hermosillo, Sonora, México. Se empleo
Se tiene que preparar el frotis con anticipación y debes enfocar con el menor aumento y asi
 Frotis sanguíneo Material Porta objetos Microscopio Lanceta Placa excava de porcelana Tècnica Se limpia el dedo con alcohol y se hace una punción en el mismo hasta que caiga la gota de sangre que es necesaria
Frotis sanguíneo Material Porta objetos Microscopio Lanceta Placa excava de porcelana Tècnica Se limpia el dedo con alcohol y se hace una punción en el mismo hasta que caiga la gota de sangre que es necesaria
MANUAL DE NORMAS Y PROCEDIMIENTOS PROCEDIMIENTO: OPERATIVOS DE ORINAS
 SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
SERVICIO DE LABORATORIO 1 DE 5 1. OBJETIVO El objetivo del presente documento es describir el procedimiento para determinar las características físicas, química y microscópicas de muestras de orinas. 2.
MMP. MÉTODOS DE MUESTREO Y PRUEBA DE MATERIALES
 LIBRO: PARTE: TÍTULO: CAPÍTULO: MMP. MÉTODOS DE MUESTREO Y PRUEBA DE MATERIALES 4. MATERIALES PARA PAVIMENTOS 05. Materiales Asfálticos, Aditivos y Mezclas 003. Viscosidad Cinemática de Cementos Asfálticos
LIBRO: PARTE: TÍTULO: CAPÍTULO: MMP. MÉTODOS DE MUESTREO Y PRUEBA DE MATERIALES 4. MATERIALES PARA PAVIMENTOS 05. Materiales Asfálticos, Aditivos y Mezclas 003. Viscosidad Cinemática de Cementos Asfálticos
Programa Formativo. Objetivos. Código: Curso: Hematología y Hemoterapia. Duración: 70h.
 Código: 40657 Curso: Hematología y Hemoterapia Modalidad: ONLINE Duración: 70h. Objetivos La sangre es un tejido líquido que circula permanentemente por el sistema vascular y está formado por vasos sanguíneos
Código: 40657 Curso: Hematología y Hemoterapia Modalidad: ONLINE Duración: 70h. Objetivos La sangre es un tejido líquido que circula permanentemente por el sistema vascular y está formado por vasos sanguíneos
Trabajo Práctico Nº 8 SANGRE
 Trabajo Práctico Nº 8 SANGRE Este tejido conectivo líquido se estudia mediante los frotis sanguíneos. Estos consisten en la colocación de una gota de sangre sobre el portaobjetos que será extendida con
Trabajo Práctico Nº 8 SANGRE Este tejido conectivo líquido se estudia mediante los frotis sanguíneos. Estos consisten en la colocación de una gota de sangre sobre el portaobjetos que será extendida con
Técnico en Hematología y Hemoterapia. Sanidad, Dietética y Nutrición
 Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
SÍLABO. Este formato se basa en el anterior y que fuera aprobado por el Consejo de Planificación Académica.
 SÍLABO De acuerdo con el Modelo General para la Evaluación de Carreras con Fines de Acreditación (CEAACES 2011), cada asignatura de la carrera debe contar con un sílabo estandarizado que especifica los
SÍLABO De acuerdo con el Modelo General para la Evaluación de Carreras con Fines de Acreditación (CEAACES 2011), cada asignatura de la carrera debe contar con un sílabo estandarizado que especifica los
QUÉ ES? QUÉ TIENE? QUÉ HACE?
 QUÉ ES? QUÉ TIENE? E QUÉ HACE? TRANSPORTA: Gases Respiratorios Nutrientes Sustancias Reguladoras Desechos Metabólicos Medicamentos OTRAS: Termoregulación Defensa Equilibrio Ácido-Básico Equilibrio Osmótico
QUÉ ES? QUÉ TIENE? E QUÉ HACE? TRANSPORTA: Gases Respiratorios Nutrientes Sustancias Reguladoras Desechos Metabólicos Medicamentos OTRAS: Termoregulación Defensa Equilibrio Ácido-Básico Equilibrio Osmótico
REPORTE DE CELULAS SANGUINEAS Y ANORMALIDADES ENCONTRADAS EN EL FSP. Jeanette Jurado Blanco Paola Andrea Acuña Bacteriologas, Dinamica Sede Palermo
 REPORTE DE CELULAS SANGUINEAS Y ANORMALIDADES ENCONTRADAS EN EL FSP Jeanette Jurado Blanco Paola Andrea Acuña Bacteriologas, Dinamica Sede Palermo GLOBULOS ROJOS ANTES: Normociticos Normocromicos (Clasificacion
REPORTE DE CELULAS SANGUINEAS Y ANORMALIDADES ENCONTRADAS EN EL FSP Jeanette Jurado Blanco Paola Andrea Acuña Bacteriologas, Dinamica Sede Palermo GLOBULOS ROJOS ANTES: Normociticos Normocromicos (Clasificacion
Urianálisis y hematología de laboratorio
 LA EDITORIAL DE LOS VETERINARIOS ANIMALES DE COMPAÑÍA Urianálisis y hematología de laboratorio Dirigido a veterinarios, estudiantes, profesores y profesionales del sector. CARACTERÍSTICAS TÉCNICAS Autor:
LA EDITORIAL DE LOS VETERINARIOS ANIMALES DE COMPAÑÍA Urianálisis y hematología de laboratorio Dirigido a veterinarios, estudiantes, profesores y profesionales del sector. CARACTERÍSTICAS TÉCNICAS Autor:
PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES
 PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES 1 El procedimiento agrupa tres etapas: 1. Procedimiento previo a la punción capilar. 2. Procedimiento de la punción
PROCEDIMIENTO PARA LA DETERMINACIÓN DE HEMOGLOBINA MEDIANTE HEMOGLOBINOMETROS PORTATILES 1 El procedimiento agrupa tres etapas: 1. Procedimiento previo a la punción capilar. 2. Procedimiento de la punción
ENSAYO DE COAGULACION (JAR TEST)
 ENSAYO DE COAGULACION (JAR TEST) ENSAYO DE COAGULACION (JAR TEST) Este ensayo consiste en la adición de dosis crecientes de coagulante y/o floculante a una serie de porciones del agua a ensayar, determinando
ENSAYO DE COAGULACION (JAR TEST) ENSAYO DE COAGULACION (JAR TEST) Este ensayo consiste en la adición de dosis crecientes de coagulante y/o floculante a una serie de porciones del agua a ensayar, determinando
Composición Líquido Elementos formes
 Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
PROGRAMA DE CAPACITACIÓN A DISTANCIA EN FISIOPATOLOGÍA RENAL BASADO EN LA RESOLUCIÓN DE CASOS CLÍNICOS CASO CLÍNICO N 1
 PROGRAMA DE CAPACITACIÓN A DISTANCIA EN FISIOPATOLOGÍA RENAL BASADO EN LA RESOLUCIÓN DE CASOS CLÍNICOS CASO CLÍNICO N 1 EN CONVENIO CON LA UNIVERSIDAD JUAN AGUSTÍN MAZA Temas relacionados: Fisiopatología
PROGRAMA DE CAPACITACIÓN A DISTANCIA EN FISIOPATOLOGÍA RENAL BASADO EN LA RESOLUCIÓN DE CASOS CLÍNICOS CASO CLÍNICO N 1 EN CONVENIO CON LA UNIVERSIDAD JUAN AGUSTÍN MAZA Temas relacionados: Fisiopatología
Trastornos de los órganos hematopoyéticos
 Trastornos de los órganos hematopoyéticos Anemias Leucemias Trastornos de coagulación Anemia Se entiende por anemia a la disminución de la concentración de hemoglobina en sangre por debajo de 13 g/dl
Trastornos de los órganos hematopoyéticos Anemias Leucemias Trastornos de coagulación Anemia Se entiende por anemia a la disminución de la concentración de hemoglobina en sangre por debajo de 13 g/dl
TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA
 TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con
TRABAJO PRÁCTICO N 2 FISIOLOGÍA LEUCOCITARIA 1. OBJETIVOS 1. A. OBJETIVOS GENERALES - Relacionar las variaciones fisiológicas de la concentración de Leucocitos y de la Fórmula Leucocitaria Relativa con
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
Hemograma. Por: Dr. Camones. ULADECH Dr. Camones M. Diomedes 1
 Hemograma Por: Dr. Camones. ULADECH Dr. Camones M. Diomedes 1 Definición: El hemograma es la lectura de un frotis de sangre; dando una apreciación: Semicualitativa (recuento) de los elementos figurados
Hemograma Por: Dr. Camones. ULADECH Dr. Camones M. Diomedes 1 Definición: El hemograma es la lectura de un frotis de sangre; dando una apreciación: Semicualitativa (recuento) de los elementos figurados
Guía del Curso Técnico en Hematología y Hemoterapia
 Guía del Curso Técnico en Hematología y Hemoterapia Modalidad de realización del curso: Titulación: A distancia y Online Diploma acreditativo con las horas del curso OBJETIVOS La sangre es un tejido líquido
Guía del Curso Técnico en Hematología y Hemoterapia Modalidad de realización del curso: Titulación: A distancia y Online Diploma acreditativo con las horas del curso OBJETIVOS La sangre es un tejido líquido
Componentes de la sangre
 Componentes de la sangre Determinación n del Hematocrito Cámara de recuento globular (Neubauer( Neubauer) Automatización n en Hematología Exactitud Precisión Rapidez Standarización Screening Toma de muestra
Componentes de la sangre Determinación n del Hematocrito Cámara de recuento globular (Neubauer( Neubauer) Automatización n en Hematología Exactitud Precisión Rapidez Standarización Screening Toma de muestra
Práctica 1. Obtención de una muestra sanguínea
 Práctica 1. Obtención de una muestra sanguínea Punción venosa Jeringas y agujas endovenosas de todas las medidas. Tubos de vacio o Vacutainer ( Con EDTA). Torundas de algodón Alcohol etílico al 70 % Ligadura
Práctica 1. Obtención de una muestra sanguínea Punción venosa Jeringas y agujas endovenosas de todas las medidas. Tubos de vacio o Vacutainer ( Con EDTA). Torundas de algodón Alcohol etílico al 70 % Ligadura
Presencia de algas en agua de consumo
 Presencia de algas en agua de consumo Provoca: Deterioro de la calidad Aparición de olores y sabores Consumo del cloro residual Favoreciendo desarrollo de bacterias SECUENCIA PARA EL ANALISIS DEL FITOPLANCTON
Presencia de algas en agua de consumo Provoca: Deterioro de la calidad Aparición de olores y sabores Consumo del cloro residual Favoreciendo desarrollo de bacterias SECUENCIA PARA EL ANALISIS DEL FITOPLANCTON
Taller de la ronda de aptitud LACOMET-DMF
 Taller de la ronda de aptitud LACOMET-DMF-003-2015 1 Temas a Revisar 1. Antecedentes 2. Objetivos 3. Aspectos Generales de la calibración 1. Características de los equipos a calibrar 2. Equipos y patrones
Taller de la ronda de aptitud LACOMET-DMF-003-2015 1 Temas a Revisar 1. Antecedentes 2. Objetivos 3. Aspectos Generales de la calibración 1. Características de los equipos a calibrar 2. Equipos y patrones
Estimación de Biomasa
 Estimación de Biomasa Dra. Alejandra Cardillo Proceso de producción Monitoreo de información ph Temperatura Biomasa po Concentración 2 de producto Sustrato consumido Estrategias de control Toma de decisiones
Estimación de Biomasa Dra. Alejandra Cardillo Proceso de producción Monitoreo de información ph Temperatura Biomasa po Concentración 2 de producto Sustrato consumido Estrategias de control Toma de decisiones
Inmunohematología 2017
 Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
Inmunohematología 2017 REACCIONES DE HEMAGLUTINACIÓN 1-Sensibilización 2-Aglutinación Ag + Ac Ag-Ac FACTORES QUE AFECTAN LA HEMAGLUTINACIÓN Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo
T écnicas. de análisis hematológico
 T écnicas de análisis hematológico Consulte nuestra página web: www.sintesis.com En ella encontrará el catálogo completo y comentado T écnicas de análisis hematológico Anabel Escobar Cerrato Laura Barrero
T écnicas de análisis hematológico Consulte nuestra página web: www.sintesis.com En ella encontrará el catálogo completo y comentado T écnicas de análisis hematológico Anabel Escobar Cerrato Laura Barrero
Tema 5: Tejido Conectivo Especializado Sangre y Hematopoyesis Unidad de Histología
 Universidad la República Escuela de Salud Licenciatura en Enfermería Asignatura: Histología Tema 5: Tejido Conectivo Especializado Sangre y Hematopoyesis Unidad de Histología Mg Bárbara Cuevas Montuschi
Universidad la República Escuela de Salud Licenciatura en Enfermería Asignatura: Histología Tema 5: Tejido Conectivo Especializado Sangre y Hematopoyesis Unidad de Histología Mg Bárbara Cuevas Montuschi
Prof. Carlos Montelara Tirado
 Prof. Carlos Montelara Tirado 1 Composición de la Sangre Introducción (Figura 17-1) Compuesta de plasma y elementos formes. Medio de transporte que realiza los servicios de captación y liberación para
Prof. Carlos Montelara Tirado 1 Composición de la Sangre Introducción (Figura 17-1) Compuesta de plasma y elementos formes. Medio de transporte que realiza los servicios de captación y liberación para
DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos.
 1 PRACTICA Nº 5 DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos. I. INTRODUCCIÓN: En espectrofotometría se usa como fuente luminosa la luz blanca natural o artificial
1 PRACTICA Nº 5 DETERMINACIONES ESPECTROFOTOMETRICAS EN ALIMENTOS. Carotenoides totales y nitritos. I. INTRODUCCIÓN: En espectrofotometría se usa como fuente luminosa la luz blanca natural o artificial
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO
 COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de mayo y hasta el 30 de
COMENTARIOS Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del 1º de mayo y hasta el 30 de
Sangre. Como parte del tejido conectivo esta formada por células y substancia intercelular llamada plasma
 Sangre Sangre Como parte del tejido conectivo esta formada por células y substancia intercelular llamada plasma Las células sanguíneas se dividen en: 1. Glóbulos rojos 2. Glóbulos blancos 3. Plaquetas
Sangre Sangre Como parte del tejido conectivo esta formada por células y substancia intercelular llamada plasma Las células sanguíneas se dividen en: 1. Glóbulos rojos 2. Glóbulos blancos 3. Plaquetas
HEMATOLOGÍA Resultado Valores de Referencia
 PROPIETARIO: TRIPLE A. NOMBRE ANIMAL: MILI 23615 NÚMERO DE MUESTRA: 10856911 FECHA RECEPCIÓN: 03/01/2018 FECHA EMISIÓN: 04/01/2018 TRIPLE A PROTECTORA (2148) CTRA. DE OJEN S/N KM 33 29600 MARBELLA HEMATOLOGÍA
PROPIETARIO: TRIPLE A. NOMBRE ANIMAL: MILI 23615 NÚMERO DE MUESTRA: 10856911 FECHA RECEPCIÓN: 03/01/2018 FECHA EMISIÓN: 04/01/2018 TRIPLE A PROTECTORA (2148) CTRA. DE OJEN S/N KM 33 29600 MARBELLA HEMATOLOGÍA
OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas.
 Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Extracción de Sangre Venosa Periférica
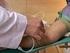 Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
Extracción de Sangre Venosa Periférica Introducción La extracción venosa de sangre es un proceso muy acequiado en el análisis biológico dado que es posible detectar diversas enfermedades o condiciones
La sangre. Departamento de Fisiología, Facultad de medicina Juan Manuel Moreno
 La sangre Departamento de Fisiología, Facultad de medicina Juan Manuel Moreno jmmayuso@ugr.es 1 BIBLIOGRAFÍA RECOMENDADA BERNE Y LEVY. Fisiología + Student consult Koeppen, B.M. / Stanton, B.A. Editorial
La sangre Departamento de Fisiología, Facultad de medicina Juan Manuel Moreno jmmayuso@ugr.es 1 BIBLIOGRAFÍA RECOMENDADA BERNE Y LEVY. Fisiología + Student consult Koeppen, B.M. / Stanton, B.A. Editorial
Método de ensayo de cementos. Determinación del tiempo de fraguado y de la estabilidad de volumen
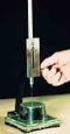 González,E.yAlloza,A.M. Método de ensayo de cementos. Determinación del tiempo de fraguado y de la estabilidad de volumen FUNDAMENTO La pasta de cemento de consistencia normal tiene una resistencia especificada
González,E.yAlloza,A.M. Método de ensayo de cementos. Determinación del tiempo de fraguado y de la estabilidad de volumen FUNDAMENTO La pasta de cemento de consistencia normal tiene una resistencia especificada
MC. Edgar Alejandro Turrubiartes Martínez Serie blanca
 Serie blanca Caso 1 La enfermera de una universidad llevó a una estudiante de primer año de 18 años de edad a la sala de urgencia por dolor abdominal interno. No tenía antecedente de enfermedades previas,
Serie blanca Caso 1 La enfermera de una universidad llevó a una estudiante de primer año de 18 años de edad a la sala de urgencia por dolor abdominal interno. No tenía antecedente de enfermedades previas,
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE
 VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
VERSIÓN PARA EQUIPOS COBAS c501/c502 DE ROCHE EQUIPO ADICIONAL NO SUMINISTRADO: La preparación de los reactivos requiere el empleo de micropipetas o sistemas que permitan dispensar los volúmenes especificados.
Obsevación y recuento de células sanguíneas. Semestre B-2010
 1 Práctica 2 Obsevación y recuento de células sanguíneas Semestre B-2010 Introducción En la sangre se encuentran los leucocitos o glóbulos blancos que son las células móviles del sistema inmunitario. Todos
1 Práctica 2 Obsevación y recuento de células sanguíneas Semestre B-2010 Introducción En la sangre se encuentran los leucocitos o glóbulos blancos que son las células móviles del sistema inmunitario. Todos
TRONCO COMUN DIVISIONAL DE CIENCIAS BIOLOGICAS Y DE LA SALUD. MODULO: ENERGIA Y CONSUMO DE SUSTANCIAS FUNDAMENTALES. PRACTICA No.
 TRONCO COMUN DIVISIONAL DE CIENCIAS BIOLOGICAS Y DE LA SALUD. MODULO: ENERGIA Y CONSUMO DE SUSTANCIAS FUNDAMENTALES. PRACTICA No. 2 DETERMINACIÓN DE PROTEÍNAS. METODO DE BIURET OBJETIVO: Manejar en el
TRONCO COMUN DIVISIONAL DE CIENCIAS BIOLOGICAS Y DE LA SALUD. MODULO: ENERGIA Y CONSUMO DE SUSTANCIAS FUNDAMENTALES. PRACTICA No. 2 DETERMINACIÓN DE PROTEÍNAS. METODO DE BIURET OBJETIVO: Manejar en el
TOMA Y CONSERVACION DE MUESTRAS DE AGUA
 TOMA Y CONSERVACION DE MUESTRAS DE AGUA 1.- TOMA DE MUESTRA 1.1 Introducción La toma de muestra de aguas es una operación delicada, que debe llevarse a cabo con el mayor cuidado, dado que condiciona los
TOMA Y CONSERVACION DE MUESTRAS DE AGUA 1.- TOMA DE MUESTRA 1.1 Introducción La toma de muestra de aguas es una operación delicada, que debe llevarse a cabo con el mayor cuidado, dado que condiciona los
FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO. Claudia Isabel Bedoya C. Bacterióloga
 FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO Claudia Isabel Bedoya C. Bacterióloga FASE PREANALÍTICA EN EL PROCESAMIENTO DE LAS MUESTRAS Procedimiento especializado que consiste en la obtención
FUNDACION PANZENU TOMA DE MUESTRAS EN EL LABORATORIO CLINICO Claudia Isabel Bedoya C. Bacterióloga FASE PREANALÍTICA EN EL PROCESAMIENTO DE LAS MUESTRAS Procedimiento especializado que consiste en la obtención
Instructivo de Laboratorio. Cocos Piógenos
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Instructivo de Laboratorio. Cocos Piógenos
 Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Universidad de San Carlos de Guatemala Facultad de Ciencias Médicas Curso de Inmunología y Microbiología Tercer año, Fase II Instructivo de Laboratorio Cocos Piógenos Dra. Débora Esmeralda Aldana Introducción:
Práctica # 2: Reconocimiento de Material de Laboratorio Y Técnicas Experimentales
 República Bolivariana de Venezuela Ministerio del poder popular para la Educación Unidad Educativa Colegio Aplicación Palo Gordo-Edo. Táchira Lcda. Katherine Gómez Práctica # 2: Reconocimiento de Material
República Bolivariana de Venezuela Ministerio del poder popular para la Educación Unidad Educativa Colegio Aplicación Palo Gordo-Edo. Táchira Lcda. Katherine Gómez Práctica # 2: Reconocimiento de Material
PRÁCTICA III. AISLAMIENTO DE MITOCONDRIAS: ACTIVIDAD MALATO DESHIDROGENASA
 PRÁCTICA III. AISLAMIENTO DE MITOCONDRIAS: ACTIVIDAD MALATO DESHIDROGENASA 1. Fundamento Teórico La mayoría de los procesos bioquímicos que producen energía química se realizan en orgánulos intracelulares
PRÁCTICA III. AISLAMIENTO DE MITOCONDRIAS: ACTIVIDAD MALATO DESHIDROGENASA 1. Fundamento Teórico La mayoría de los procesos bioquímicos que producen energía química se realizan en orgánulos intracelulares
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL
 UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
UNIVERSIDAD NACIONAL DEL NORDESTE Facultad de Ciencias Exactas y Naturales y Agrimensura Departamento de Biología - Área Zoología EMBRIOLOGÍA ANIMAL PROTOCOLO PARA OBTENCIÓN DE EMBRIONES DE POLLO EN LABORATORIO
Inmunohematología. Dra. Ana Cecilia Haro
 Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
CURSO DE MORFOLOGÍA HEMATOLÓGICA
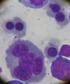 CURSO DE MORFOLOGÍA HEMATOLÓGICA Caracas, 10 de julio de 2015 Caso Clínico I.A.H.U.L.A. Mérida Alexander Manuel Arellano Rojas Médico Residente de Hematología de la ULA SOCIEDAD VENEZOLANA DE HEMATOLOGÍA
CURSO DE MORFOLOGÍA HEMATOLÓGICA Caracas, 10 de julio de 2015 Caso Clínico I.A.H.U.L.A. Mérida Alexander Manuel Arellano Rojas Médico Residente de Hematología de la ULA SOCIEDAD VENEZOLANA DE HEMATOLOGÍA
1- Contenidos del módulo
 IES Francesc de B. Moll SAN306P0 4 Información para el alumnado matriculado como libres en el módulo de Fundamentos y técnicas de análisis hematológicos y citológicos C.F.G.S. DE LABORATORIO DE DIAGNÓSTICO
IES Francesc de B. Moll SAN306P0 4 Información para el alumnado matriculado como libres en el módulo de Fundamentos y técnicas de análisis hematológicos y citológicos C.F.G.S. DE LABORATORIO DE DIAGNÓSTICO
VSG (Westergren) < 15 mm en 1 h VSG (Wintrobe) (1.ª h) 0-20 mm 0-9 mm
 ANEXO Valores normales de laboratorio y nomogramas Anexo - Valores normales en el adulto de los datos de laboratorio de uso más frecuente. Hematíes, hematocrito, hemoglobina e índices hemoglobínicos, VSG
ANEXO Valores normales de laboratorio y nomogramas Anexo - Valores normales en el adulto de los datos de laboratorio de uso más frecuente. Hematíes, hematocrito, hemoglobina e índices hemoglobínicos, VSG
CUADRO # 1 DISTRIBUCIÓN DE PACIENTES SEGÚN EL SEXO. SEXO PACIENTES PORCENTAJE MASCULINO 64 63% FEMENINO 37 37% TOTAL %
 CUADRO # 1 DISTRIBUCIÓN DE PACIENTES SEGÚN EL SEXO. SEXO PACIENTES PORCENTAJE MASCULINO 64 63% FEMENINO 37 37% TOTAL 11 1% GRÁFICO N 1 DISTRIBUCIÓN DE PACIENTES SEGÚN EL SEXO FEMENINO 37% MASCULINO 63%
CUADRO # 1 DISTRIBUCIÓN DE PACIENTES SEGÚN EL SEXO. SEXO PACIENTES PORCENTAJE MASCULINO 64 63% FEMENINO 37 37% TOTAL 11 1% GRÁFICO N 1 DISTRIBUCIÓN DE PACIENTES SEGÚN EL SEXO FEMENINO 37% MASCULINO 63%
Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma.
 Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma. Hematopoyesis: Proceso de formación de células sanguíneas (glóbulos rojos glóbulos
Componentes de la sangre: Elementos celulares (glóbulos rojos, glóbulos blancos y plaquetas) Elemento líquido o plasma. Hematopoyesis: Proceso de formación de células sanguíneas (glóbulos rojos glóbulos
Hoefer SG15, SG30, SG50 y SG100
 man ual del usuario Español Hoefer SG15, SG30, SG50 y SG100 Grandiente fabricantes mu SG100-IM/Spanish/Rev.C0/08-12 Tabla de contenidos 1. Introducción: Hoefer SG15, SG30, SG50, SG100 y fabricantes de
man ual del usuario Español Hoefer SG15, SG30, SG50 y SG100 Grandiente fabricantes mu SG100-IM/Spanish/Rev.C0/08-12 Tabla de contenidos 1. Introducción: Hoefer SG15, SG30, SG50, SG100 y fabricantes de
EXÁMENES MÍNIMOS PARA LABORATORIOS CLÍNICOS Y SUS REQUERIMIENTOS:
 EXÁMENES MÍNIMOS PARA LABORATORIOS CLÍNICOS Y SUS REQUERIMIENTOS: La Junta Directiva del Colegio de Microbiólogos y Químicos Clínicos Considerando que: Los exámenes de laboratorio deben realizarse conforme
EXÁMENES MÍNIMOS PARA LABORATORIOS CLÍNICOS Y SUS REQUERIMIENTOS: La Junta Directiva del Colegio de Microbiólogos y Químicos Clínicos Considerando que: Los exámenes de laboratorio deben realizarse conforme
PROMIELOCITO INICIAL:
 27 LEUCOPOYESIS ESTRUCTURA DEL TEMA: 27.1. Granulopoyesis. 27.2. Monopoyesis. 27.3. Linfopoyesis. 27.1. GRANULOPOYESIS Es el proceso de formación de los granulocitos (neutrófilos, eosinófilos y basófilos).
27 LEUCOPOYESIS ESTRUCTURA DEL TEMA: 27.1. Granulopoyesis. 27.2. Monopoyesis. 27.3. Linfopoyesis. 27.1. GRANULOPOYESIS Es el proceso de formación de los granulocitos (neutrófilos, eosinófilos y basófilos).
EL LABORATORIO DE HEMATOLOGÍA. Dra Tania I. Carballo Treto
 EL LABORATORIO DE HEMATOLOGÍA Dra Tania I. Carballo Treto ORIENTACIÓN N DEL LABORATORIO DE HEMATOLOGÍA: A: ORGANIZAR DE MANERA ÓPTIMA SUS ÁREAS DE ACUERDO A SU NIVEL DE ATENCIÓN INTRODUCIR TECNOLOGÍA A
EL LABORATORIO DE HEMATOLOGÍA Dra Tania I. Carballo Treto ORIENTACIÓN N DEL LABORATORIO DE HEMATOLOGÍA: A: ORGANIZAR DE MANERA ÓPTIMA SUS ÁREAS DE ACUERDO A SU NIVEL DE ATENCIÓN INTRODUCIR TECNOLOGÍA A
UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química. MEDICIÓN DEL ph DE ÁCIDOS, BASES Y SALES 2. INTRODUCCIÓN
 UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química 1 MEDICIÓN DEL ph DE ÁCIDOS, BASES Y SALES 1. OBJETIVOS. Reconocer la acidez o basicidad de una sustancia mediante el uso de indicadores. Relacionar
UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química 1 MEDICIÓN DEL ph DE ÁCIDOS, BASES Y SALES 1. OBJETIVOS. Reconocer la acidez o basicidad de una sustancia mediante el uso de indicadores. Relacionar
ph DE LOS SUELOS I.N.V. E
 ph DE LOS SUELOS I.N.V. E 131 07 1. OBJETO 1.1 Este método de prueba cubre la determinación del ph de los suelos para usos diferentes de la prueba de corrosión. Tales determinaciones se usan en campos
ph DE LOS SUELOS I.N.V. E 131 07 1. OBJETO 1.1 Este método de prueba cubre la determinación del ph de los suelos para usos diferentes de la prueba de corrosión. Tales determinaciones se usan en campos
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON
 PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
PRACTICA Núm. 6 TINCION DE FLAGELOS BACTERIANOS POR EL METODO DE LEIFSON I. OBJETIVO Demostrar la presencia de flagelos mediante tinción y observar la movilidad que presentan algunas bacterias diferenciándola
Guía teórico - Práctica
 UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Guía teórico - Práctica BOTÁNICA MORFOLÓGICA 2017 UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Prof. María
UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Guía teórico - Práctica BOTÁNICA MORFOLÓGICA 2017 UNIVERSIDAD NACIONAL DE ENTRE RÍOS FACULTAD DE CIENCIAS AGROPECUARIAS Prof. María
INSTRUCCIONES PARA AISLAMIENTO DE LEUCOCITOS A PARTIR DE SANGRE TOTAL
 INSTRUCCIONES PARA AISLAMIENTO DE LEUCOCITOS A PARTIR DE SANGRE TOTAL EL PRIMER PASO, ES LEER PRIMERO Y LUEGO SEGUIR TODAS LAS INSTRUCCIONES!!!!! ALFREDO URIBE ARDILA M.SC. REACTIVOS SOLUCION DEXTRAN-HEPARINA
INSTRUCCIONES PARA AISLAMIENTO DE LEUCOCITOS A PARTIR DE SANGRE TOTAL EL PRIMER PASO, ES LEER PRIMERO Y LUEGO SEGUIR TODAS LAS INSTRUCCIONES!!!!! ALFREDO URIBE ARDILA M.SC. REACTIVOS SOLUCION DEXTRAN-HEPARINA
Manual del Usuario. Entrega de Resultados electrónicos
 Manual del Usuario Entrega de Resultados electrónicos Sede Principal Poblado: Carrera 43C No. 5-33 Toma de Muestras: Centro Comercial Sandiego, Torre Norte, Piso 10, No. 1034 Teléfono: 4444 200 - www.lch.co
Manual del Usuario Entrega de Resultados electrónicos Sede Principal Poblado: Carrera 43C No. 5-33 Toma de Muestras: Centro Comercial Sandiego, Torre Norte, Piso 10, No. 1034 Teléfono: 4444 200 - www.lch.co
CASOS CLÍNICOS: SERIE ROJA
 CASOS CLÍNICOS: SERIE ROJA Caso 1 El hijo de 6 meses de edad de una madre de 16 años fue referido al laboratorio del hospital por una clínica para niños sanos. El profesional de salud de la clínica notó
CASOS CLÍNICOS: SERIE ROJA Caso 1 El hijo de 6 meses de edad de una madre de 16 años fue referido al laboratorio del hospital por una clínica para niños sanos. El profesional de salud de la clínica notó
PRÁCTICAS DE QUÍMICA P-11: Preparación de una disolución 0,1M de Hidróxido de sodio (sosa)
 NOTA: PRÁCTICAS DE QUÍMICA P-11: Preparación de una disolución 0,1M de Hidróxido de sodio (sosa) Alumno: Fecha: Curso: 1. OBJETIVOS - Manejo del material básico de laboratorio. - Aprender a preparar disoluciones
NOTA: PRÁCTICAS DE QUÍMICA P-11: Preparación de una disolución 0,1M de Hidróxido de sodio (sosa) Alumno: Fecha: Curso: 1. OBJETIVOS - Manejo del material básico de laboratorio. - Aprender a preparar disoluciones
Determinación de Sulfatos en Aguas
 QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Sulfatos en Aguas Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 22/09/2013 Descripción del método de determinación de
QUÍMICA ANALITICA APLICADA INORGÁNICA QMC 613 Determinación de Sulfatos en Aguas Procedimiento Operativo Estándar Lic. Luis Fernando Cáceres Choque 22/09/2013 Descripción del método de determinación de
