Capítulo 6 Termoquímica. En este capítulo se estudian los conceptos de la termoquímica. Al terminar este capítulo, el estudiante podrá:
|
|
|
- Juan Luis de la Cruz Botella
- hace 6 años
- Vistas:
Transcripción
1 Capítul 6 Termquímica En este capítul se estudian ls cncepts de la termquímica. Al terminar este capítul, el estudiante pdrá: 1. Definir y explicar ls términs siguientes:. Energía. Energía radiante. Energía térmica. Energía química. Energía ptencial. Termquímica. Sistema abiert. Sistema cerrad. Sistema aislad. Endtérmic. Extérmic. Entalpía ( H). Calrimetia. Capacidad calrífica. Calr específic 2. Clasificar ls prcess cmunes cm endtérmics extérmics. 3. Usar ecuacines de termquímica y estequimetría para determinar la cantidad de calr perdid ganad en una reacción química. 4. Realizar cálculs que invlucran calr específic, masa y cambi de temperatura. 5. Dibujar ls cmpnentes principales de una bmba calrimétrica a vlumen cnstante. 6. Determinar el calr de las reaccines dads ls dats experimentales reunids en un experiment de calrimetría. 7. Calcular la entalpía estándar de reaccines dada la entalpía estándar de frmacines para ls prducts y reactivs. 8. Aplicar la ley de Hess a un prces de multipas para determinar la entalpía estándar de reacción. 9. Describir calr de slución, energía reticular, calr de hidratación, calr de dilución, sistema, alrededres, y energía interir. 10. Clasificar prpiedades de materiales cm funcines de estad funcines de n estad. 11. Reiterar la Primera Ley de la Termdinámica. 12. Recrdar ls signs cnvencinales para trabaj y calr usads en el libr de text.
2 13. Aplicar las relacines de calr y trabaj para ls prblemas de fase gasesa. 14. Definir H en términs de E, P, y V. 15. Calcular el cambi en la energía interir ( E) dadas las ecuacines de termquímica. 6.1 La naturaleza de la energía y ls tips de energía La energía, es decir, la capacidad para efectuar un trabaj, tma muchas frmas. Éstas incluyen la energía cinética, ptencial, radiante, térmica, y química. Ls estudiantes algunas veces cnfunden energía y temperatura. Si pnems una lla de agua en la estufa de la ccina y se vuelve una marca alta, bservams que la temperatura del agua aumenta (usand un termómetr) cnfrme se calienta el agua. Este prces cntinúa hasta que alcanzams el punt de ebullición del agua. Una vez que esta temperatura es alcanzada, el agua ya n aumenta en la temperatura, per tdavía agregams energía al sistema prque la marca en la estufa tdavía lee alt. L que muestra es que la temperatura del agua y la energía bmbeadas en él sn prprcinales hasta que el punt de ebullición se alcanza. A ese punt, la energía se usa para cambiar el estad físic del agua líquida a vapr sin cambiar la temperatura de ambs. Si utilizams el cncept de la cnservación de energía, sabems que la energía prprcinada pr la estufa al punt de ebullición del agua debe usarse para rmper las fuerzas de atracción que sstienen las mléculas del agua juntas en la fase líquida. 6.2 Cambis de energía en las reaccines químicas El calr se define cm la transferencia de energía térmica entre ds cuerps que están a diferentes temperaturas. Es un prces y n es energía. Es incrrect referirse a calentar la energía. La termquímica es el estudi de ls cambis de calr en las reaccines químicas. En la termquímica, tenems el sistema y ls alrededres que cnstituyen el univers. También ns referims a sistemas abiert, cerrad, aislad. Un sistema abiert permite la transferencia de energía y masa; un sistema cerrad permite la transferencia sól de energía; y un sistema aislad n permite la transferencia de energía masa. Ls prcess extérmics emiten energía. El prefij ex se refiere a extern, así extérmic significa energía que se da fuera de. L puest de extérmic es endtérmic que significa que la energía es absrbida. Se puede cnsiderar
3 que en una reacción extérmica la energía es un de ls prducts de la reacción, así cm un reactiv en las reaccines endtérmicas. Ls estudiantes a veces piensan que puest que se agrega energía al sistema en una reacción endtérmica, la temperatura del sistema debe subir. Su lógica es que si se agrega energía al sistema, entnces la temperatura debe elevarse. De hech, la energía está alejada de ls alrededres; así un efect de enfriamient curre y está incrprad en ls prducts cm energía almacenada en ls enlaces químics. Ls estudiantes parecen cmprender mejr las reaccines extérmicas puest que, si la energía se libera, entnces la temperatura de ls alrededres debe elevarse. 6.3 Entalpía La mayría de las reaccines que se realizan está abierta a la atmósfera, pr l que nrmalmente hay interés en ls prcess de presión cnstante. La energía que se transfiere en un prces de presión cnstante se llama entalpía y se simbliza pr H. La entalpía es una prpiedad extensiva y también es una función que establece l que mide H, el cambi en la entalpía es independiente de la trayectria tmada yend del estad un al estad ds. H es igual a H para ls prducts, mens H para ls reactivs. Si H es negativ, la reacción es extérmica (la energía se libera) y si H es psitiv, la reacción es endtérmica (la energía se absrbe). Un métd para ayudar a que ls estudiantes cmprendan est, es cnsiderar ls siguientes cnjunts de reaccines. Asuma que la reacción siguiente curre: A + B C Asuma más allá que ls reactivs A y B cntienen un ttal de 100 unidades de energía y el prduct C cntiene 80 unidades de energía. Pr cnsiguiente, prque la ley de cnservación de energía debe sstenerse, 20 unidades de energía deben liberarse. Si la energía se libera, entnces la reacción debe ser extérmica. Para esta reacción H = H prducts - H reactivs = = -20 El punt imprtante es que H<0 es negativ. Pr cnsiguiente, H para las reaccines extérmicas debe ser negativa. La cnversión es verdadera para reaccines
4 endtérmicas. Pr ejempl, asuma que la siguiente reacción curre: F + E G Asuma que la reacción es endtérmica y que la suma de la energía en F y E es 70 unidades y la energía de G es 120 unidades. Así deben prprcinarse 50 unidades de energía para que prceda esta reacción. La reacción es endtérmica. H = H prducts - H reactivs = = +50 Aquí H es > 0 que siempre es verdad para las reaccines endtérmicas. Se pdría pensar en la reacción extérmica cm A + B C + energía dnde la energía es un prduct para la reacción extérmica y energía + F + E G dnde la energía es un reactiv para la reacción endtérmica. La fusión de hiel es H 2 O(s) H 2 O (l) El calr que se requiere para hacer est es 6.01 kj para un ml y se le cnce cm calr de fusión del agua. Pr cnsiguiente, H = kj. El prces invers H 2 O (l) H 2 O(s) debe tener H = kj. Pr cnsiguiente, la fusión del hiel es endtérmica prque el calr está alejad de ls ambientes mientras la cngelación del agua caliente se libera a ls alrededres y es extérmica. El prces de cnvertir el agua líquida a vapr H 2 O (l) H 2 O(g) tiene H = kj para un ml y se cnce cm el calr de vaprización. El prces invers H 2 O(g) H 2 O (l) es extérmic. Es pr esta razón que las quemaduras de vapr
5 sn a menud severas. La cnversión del vapr a agua líquida libera una gran cantidad de energía a ls alrededres que prducen una quemadura a la piel expuesta. 6.4 Calrimetría El calr específic y la capacidad calrífica sn cncepts a menud cnfuss. El calr específic se define cm la cantidad de calr requerid para elevar la temperatura de un gram de material a un grad Celsius. Tiene unidades de jules pr el gram grads Celsius. La capacidad calrífica es la cantidad de energía requerida para elevar una cantidad dada de material un grad Celsius. Tiene las unidades de jules pr grad Celsius. Mirand las unidades simplemente, es fácil ver que calr tiemp masa específica es igual a capacidad calrífica. El autr incluye ambas, bmba calrimétrica a vlumen cnstante y calrímetr a presión cnstante. La mayría de ls estudiantes n experimentará cn la bmba calrimétrica puest que requiere equip bastante sfisticad En el ejempl 6.4, el autr muestra que el calr de neutralización para HCl cn NaOH es kj/ml. Ésta es una buena prtunidad para repasar el cncept de ecuacines iónicas netas puest que de hech kj/ml es el H para la reacción de H + (ac) + OH-(ac) H 2 O (l) Pr cnsiguiente, cualquier reacción de neutralización que prduce esta ecuación iónica neta siempre tendrá el mism H. Este cncept puede resultar n tan bvi a ls estudiantes. L invers de esta reacción se bserva en la tabla 6.2 y tiene un H igual a kj/ml. 6.5 Entalpía estándar de frmación y reacción La frma más estable de xígen a 25 C es el xígen mlecular, O 2, y n el zn, O 3. Ls estudiantes quizás l aceptarán prque han íd hablar sbre la capa de zn y cóm ls clrflurcarbns la están destruyend. Les será más difícil aceptar que el grafit es más estable que el diamante prque están cnscientes de que aquel se quemará, per ls diamantes "duran para siempre". El prfesr necesita explicar que pr estabilidad se debe entender estabilidad termdinámica y n reactividad química. Quizás la analgía siguiente puede ayudar a explicar la diferencia entre estabilidad termdinámica y reactividad química. Respect a la energía ptencial, una caja de diez
6 libras ubicada encima de un precipici que pasa pr l alt de un cañón n es tan estable cm una caja similar ubicada una pulgada sbre el suel del cañón. Si la caja en la cima del precipici se ubica cn firmeza en la tierra mientras la caja en el fnd del cañón está equilibrada en la cabeza de un alfiler, ciertamente la caja al fnd del cañón es la más reactiva de las ds cajas. La caja cn la energía más baja es la más reactiva. La analgía cnsiste en que la caja ubicada en la cima del precipici crrespnde al diamante (energía más alta, mens reactiv) mientras la caja en el alfiler crrespnde al grafit (más baja energía, más reactiv). El cambi en la entalpía para una reacción, H, se puede determinar experimentalmente usand calrimetría indirectamente la ley de Hess. En el ejempl 6.5, se demuestra el métd tradicinal, en el que se usa la ley de Hess, para determinar H para C2H 2. Para alguns f estudiantes est se vuelve cnfus intimidante pr tdas las fórmulas químicas. Puede ser más cómd si cada un de ls químics asigna una sla letra variable y entnces, después de escribir varias ecuacines, resuelva para la ecuación deseada. Pr ejempl, usand las ecuacines etiquetadas a, b, y c en el ejempl 6.5, permítans definir l siguiente: C(grafit) = A O 2 (g) = B CO 2 (g) = C H 2 (g) = D H 2 O (l) = E C 2 H 2 (g) = F La reacción a en el ejempl 6.5 se vuelve aa) A + B = C H rxn = kj La reacción b, bb) D + 1/2B = E = kj H rxn
7 La reacción c, cc) 2F + 5B = 4C + 2E H rxn = kj La reacción deseada para la frmación de C 2 H 2 de sus elements es dd) 2A + D = F H rxn =? La tarea es, entnces, cambiar en frma algebraica las ecuacines aa, bb y cc a la ecuación prducida dd. El primer pas es advertir que la ecuación dd tiene F en el lad derech así cc de la ecuación debe multiplicarse pr -1/2 para prducir -1/2(2F + 5B = 4C + 2E) -1/2( H rxn ) -F 5/2B = -2C E ee) 2C + E = F + 5/2B (-1/2)( kJ) La ecuación dd tiene 2A en la izquierda, así la ecuación aa se duplica. ff) 2A + 2B = 2C (2) H rxn (2) ( kj) La ecuación dd tiene D en la izquierda así la ecuación bb se usará sin cambis. La ecuación dd se btiene si se agregan ee, ff, y bb 2C + E = F + 5/2B 2A + 2B = 2C H rxn H rxn = kj = kj D + 1/2B = E H rxn = kj 2A + D = F H rxn = C(grafit) + H 2 (g) C 2 H 2 (g) H rxn = kj Este métd cnsume más tiemp, per una vez que el estudiante adquiere cnfianza reslviend ls prblemas de la ley de Hess cn este métd, puede sentirse más segur usand
8 el métd más tradicinal mstrad en el ejempl Calr de dislución y dilución Ls estudiantes recncen el prces de calr extérmic de dislución prque muchs de ells han experimentad cn dislucines que generan calr al mezclarse. Pr ejempl, pueden haber experimentad el calr generad cuand se mezcla ácid sulfúric y agua. Las reaccines endtérmicas sn mens cmunes per muchas sales de amni sn endtérmicas cuand se mezclan en frma mixta cn el agua. Las bandas frías que usan ls atletas sn ejempls de reaccines endtérmicas que curren al mezclarse. 6.7 Intrducción a la termdinámica La energía, el vlumen, la presión y la temperatura sn funcines de estad, prpiedades determinadas pr el estad del sistema, independientemente de cóm esa cndición se haya alcanzad. Pr tr lad, calr y trabaj n sn funcines de estad prque dependen del camin tmad para alcanzar el estad final. La primera ley de la termdinámica establece que la energía se puede cnvertir de una frma a tra frma, per n se puede crear ni destruir. Nstrs l cncems cm la ley de la cnservación de la energía. Est puede expresarse cm E = q + w Es imprtante entender la cnvención de signs para calr y trabaj. La cnvención para q es psitiv para un prces endtérmic y negativ para un prces extérmic. El cnveni de signs para el trabaj establece que w es psitiv para trabaj hech pr ls alrededres sbre el sistema, y negativ para el trabaj hech pr el sistema sbre ls alrededres. La cnvención de signs para q es igual que para H para las reaccines extérmicas y endtérmicas. Si pensams en el trabaj que se ejecuta en el sistema cm un reactiv, entnces el sign en w será psitiv cm q es psitiv para las reaccines extérmicas. Para sistemas dnde se realiza el trabaj, éste se puede cnsiderar cm un prduct y así es similar a las reaccines extérmicas y el sign sería negativ. Si recrdams que R = L atm/ml K = J/ml K, entnces, tenems 1 L atm = J. Ls términs L atm n pueden ser fácilmente recncids cm unidades para la
9 energía, per en realidad sí l sn. Se define el cambi de entalpía cm y también H = E + (PV) E = q + w se cnsigue H = q + w + (PV) Si se sustituye w = -P V y se mantiene la presión cnstante se cnsigue H = q P Puest que la mayría de las reaccines cmunes existentes se realiza a presión cnstante, el calr bservad, perdid ganad, es una medida directa de H rxn
UNA CIENCIA PARA TODOS
 UNA CIENCIA PARA TODOS LECTURA: REACCIONES QUÍMICAS Recuperad de http://www.wikipedia.rg/ Ecuacines Químicas. Sn expresines matemáticas abreviadas que se utilizan para describir l que sucede en una reacción
UNA CIENCIA PARA TODOS LECTURA: REACCIONES QUÍMICAS Recuperad de http://www.wikipedia.rg/ Ecuacines Químicas. Sn expresines matemáticas abreviadas que se utilizan para describir l que sucede en una reacción
Unidad III: Termoquímica. 3. 1. Calores estándar de formación
 67.30 - Cmbustión - Unidad III 5 Unidad III: Termquímica 3.. Calres estándar de frmación El calr estándar de frmación de una sustancia, H f (kcal/ml), se define cm el calr invlucrad cuand se frma un ml
67.30 - Cmbustión - Unidad III 5 Unidad III: Termquímica 3.. Calres estándar de frmación El calr estándar de frmación de una sustancia, H f (kcal/ml), se define cm el calr invlucrad cuand se frma un ml
Energía libre y equilibrio químico
 Energía libre y equilibri químic.- Cncepts previs..- Energía libre de las sustancias puras. La magnitud termdinámica energía libre se define cm = H - TS siend H la entalpia y S la entrpía. Para las sustancias
Energía libre y equilibri químic.- Cncepts previs..- Energía libre de las sustancias puras. La magnitud termdinámica energía libre se define cm = H - TS siend H la entalpia y S la entrpía. Para las sustancias
5.- Calcule: a) La entalpía de combustión del etino a partir de los siguientes datos: o
 TERMOQUÍMICA QCA 09 ANDALUCÍA.- Cnsidere la reacción de cmbustión del etanl. a) Escriba la reacción ajustada y calcule la entalpía de reacción en cndicines estándar. b) Determine la cantidad de calr, a
TERMOQUÍMICA QCA 09 ANDALUCÍA.- Cnsidere la reacción de cmbustión del etanl. a) Escriba la reacción ajustada y calcule la entalpía de reacción en cndicines estándar. b) Determine la cantidad de calr, a
CALOR Y TEMPERATURA. En el SI el calor se mide en Julios (J) aunque es frecuente expresarlo en valorías (cal).
 CALOR Y TEMPERATURA EL CALOR Y TEMPERATURA CALOR El calr es la energía intercambiada entre ds cuerps cuand se pnen en cntact y se encuentran a distinta temperatura. Pasará calr del cuerp caliente al cuerp
CALOR Y TEMPERATURA EL CALOR Y TEMPERATURA CALOR El calr es la energía intercambiada entre ds cuerps cuand se pnen en cntact y se encuentran a distinta temperatura. Pasará calr del cuerp caliente al cuerp
TEMA 8. ENERGÍA Y TRABAJO
 TEMA 8. ENERGÍA Y TRABAJO 8.1 CONCEPTO DE ENERGÍA De frma general, se puede decir que la energía es una prpiedad de tds ls cuerps que hace psible la interacción entre ells. Tda la energía del Univers estuv
TEMA 8. ENERGÍA Y TRABAJO 8.1 CONCEPTO DE ENERGÍA De frma general, se puede decir que la energía es una prpiedad de tds ls cuerps que hace psible la interacción entre ells. Tda la energía del Univers estuv
Hallar el orden de la reacción y la constante de velocidad.
 6 Capítul 0. Para estudiar la cinética de la reacción de descmpsición del N O 5 a 38 K: N O 5(g) NO (g) + / O (g) se ha estudiad la variación de la presión que se prduce en un recipiente cuy vlumen n varía
6 Capítul 0. Para estudiar la cinética de la reacción de descmpsición del N O 5 a 38 K: N O 5(g) NO (g) + / O (g) se ha estudiad la variación de la presión que se prduce en un recipiente cuy vlumen n varía
C O L L E G I S A N A N T O N I O D E P A D U A
 C L L E G I S A N A N T N I D E P A D U A F Í S I C A Y Q U Í M I C A 3 º E S C U R S 2 0 1 0 / 2 0 1 1 Reaccines químicas Una reacción transfrmación química es un prces pr el cual ls enlaces de las sustancias
C L L E G I S A N A N T N I D E P A D U A F Í S I C A Y Q U Í M I C A 3 º E S C U R S 2 0 1 0 / 2 0 1 1 Reaccines químicas Una reacción transfrmación química es un prces pr el cual ls enlaces de las sustancias
FÍSICA TÉRMICA Y ONDULATORIA. Práctica de Laboratorio No. 5 CALOR ESPECÍFICO DE UN SÓLIDO
 FÍSICA TÉRMICA Y ONDULATORIA Práctica de Labratri N. 5 CALOR ESPECÍFICO DE UN SÓLIDO OBJETIVOS: 1) Verificar experimentalmente la validez de la ecuación Q = m c T. 2) Verificar experimentalmente la validez
FÍSICA TÉRMICA Y ONDULATORIA Práctica de Labratri N. 5 CALOR ESPECÍFICO DE UN SÓLIDO OBJETIVOS: 1) Verificar experimentalmente la validez de la ecuación Q = m c T. 2) Verificar experimentalmente la validez
Tema 4B. Inecuaciones
 1 Tema 4B. Inecuacines 1. Intrducción Una inecuación es una desigualdad en la que aparecen númers y letras ligads mediante las peracines algebraicas. Ls signs de desigualdad sn: , Las inecuacines
1 Tema 4B. Inecuacines 1. Intrducción Una inecuación es una desigualdad en la que aparecen númers y letras ligads mediante las peracines algebraicas. Ls signs de desigualdad sn: , Las inecuacines
Explica, en un esquema, el recorrido que realiza una molécula de oxígeno desde que llega a los pulmones hasta cuando llega a la célula.
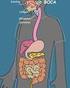 Plan de Clase Respiración Celular 7-12 Plan de clase # 056 Respiración celular Objetiv Ls estudiantes analizarán el cncept de respiración celular y l entenderán cm el fenómen que ayuda a nuestras células
Plan de Clase Respiración Celular 7-12 Plan de clase # 056 Respiración celular Objetiv Ls estudiantes analizarán el cncept de respiración celular y l entenderán cm el fenómen que ayuda a nuestras células
Control de la cantidad de productos en una reacción química
 Lección 6.2 Cntrl de la cantidad de prducts en una reacción química Cncepts clave El cambi de la cantidad de reactivs afecta la cantidad de prducts prducids en una reacción química. En una reacción química,
Lección 6.2 Cntrl de la cantidad de prducts en una reacción química Cncepts clave El cambi de la cantidad de reactivs afecta la cantidad de prducts prducids en una reacción química. En una reacción química,
CUESTIONES PROBLEMAS TERMOQUÍMICA. Autor: Tomás Mata García
 CUESTIONES Y PROBLEMAS TERMOQUÍMICA Autr: Tmás Mata García CUESTIONES 1.- Indique, raznadamente, si cada una de las siguientes prpsicines, relativas a la variación de energía libre de Gibbs, G, es verdadera
CUESTIONES Y PROBLEMAS TERMOQUÍMICA Autr: Tmás Mata García CUESTIONES 1.- Indique, raznadamente, si cada una de las siguientes prpsicines, relativas a la variación de energía libre de Gibbs, G, es verdadera
Funciones de Estado y Camino U
 Funcines de Estad y amin NIDAD 2: PRINIPIO i ADIABAIO w 0 q 0 f NO ADIABAIO w 0 q 0 i f d En ambs rcess es el mism (función de estad) sl deende de las cndicines iniciales y finales (ej:,, ) En cambi w
Funcines de Estad y amin NIDAD 2: PRINIPIO i ADIABAIO w 0 q 0 f NO ADIABAIO w 0 q 0 i f d En ambs rcess es el mism (función de estad) sl deende de las cndicines iniciales y finales (ej:,, ) En cambi w
17.65 Una varilla de cobre tiene 45 cm de longitud y área transversal A=1.25 cm 2. Sea T c
 17.65 Una varilla de cbre tiene 45 cm de lngitud y área transversal A1.5 cm. Sea T c 100 y T F 0. a) alcule el gradiente de temperatura final en el estad estable a l larg de la varilla. b) alcule la crriente
17.65 Una varilla de cbre tiene 45 cm de lngitud y área transversal A1.5 cm. Sea T c 100 y T F 0. a) alcule el gradiente de temperatura final en el estad estable a l larg de la varilla. b) alcule la crriente
TEMA 4: TERMOQUÍMICA.
 TEMA 4: TERMOQUÍMICA. Índice 1.- OBJETO DE LA TERMODINÁMICA QUÍMICA...1 2.- INTRODUCCIÓN: TERMOQUÍMICA, ESPONTANEIDAD, EQUILIBRIO...2 3.- DEFINICIONES BÁSICAS: SISTEMA, VARIABLES, ESTADO DE UN SISTEMA...2
TEMA 4: TERMOQUÍMICA. Índice 1.- OBJETO DE LA TERMODINÁMICA QUÍMICA...1 2.- INTRODUCCIÓN: TERMOQUÍMICA, ESPONTANEIDAD, EQUILIBRIO...2 3.- DEFINICIONES BÁSICAS: SISTEMA, VARIABLES, ESTADO DE UN SISTEMA...2
Cálculo de las condiciones de equilibrio para los sistemas metalagua
 Cálcul de las cndicines de equilibri para ls sistemas metalagua Apellids, nmbre Muñz Prter, María Jsé (mjmunz@iqn.upv.es) Departament Centr Ingeniería Química y Nuclear scuela Técnica Superir de Ingeniers
Cálcul de las cndicines de equilibri para ls sistemas metalagua Apellids, nmbre Muñz Prter, María Jsé (mjmunz@iqn.upv.es) Departament Centr Ingeniería Química y Nuclear scuela Técnica Superir de Ingeniers
Figura 6.1 Sistema de flujo con atraso por transporte
 6. TIEMPO MUERTO 6.1 INTRODUCCION Un fenómen que se presenta muy a menud en ls sistemas de fluj es el del atras pr transprte, que se cnce también cm tiemp muert. Para explicar dich fenómen, se cnsidera
6. TIEMPO MUERTO 6.1 INTRODUCCION Un fenómen que se presenta muy a menud en ls sistemas de fluj es el del atras pr transprte, que se cnce también cm tiemp muert. Para explicar dich fenómen, se cnsidera
CINETICA 1.- INTRODUCCIÓN
 CINETICA.- INTRODUCCIÓN El área de la química que estudia la velcidad rapidez cn la que curre una reacción se denmina cinética química. La imprtancia de la cinética química abarca ds aspects: - predecir
CINETICA.- INTRODUCCIÓN El área de la química que estudia la velcidad rapidez cn la que curre una reacción se denmina cinética química. La imprtancia de la cinética química abarca ds aspects: - predecir
Equilibrio químico. Constantes de equilibrio K c y K p. Grado de disociación. Factores que afectan al equilibrio.
 Energía de las reaccines químicas. Equilibri químic Equilibri químic. Cnstantes de equilibri K c y K p. Grad de disciación. Factres que afectan al equilibri. En una reacción química, ls reactivs se van
Energía de las reaccines químicas. Equilibri químic Equilibri químic. Cnstantes de equilibri K c y K p. Grad de disciación. Factres que afectan al equilibri. En una reacción química, ls reactivs se van
ESTUDIO DE LA CAPACIDAD AMORTIGUADORA DE DISOLUCIONES REGULADORAS
 Práctica 5. Dislucines reguladras V 1 PRÁCTICA 5 ESTUDIO DE LA CAPACIDAD AMORTIGUADORA DE DISOLUCIONES REGULADORAS FUNDAMENTO DE LA PRÁCTICA En esta experiencia prepararems una dislución reguladra, determinarems
Práctica 5. Dislucines reguladras V 1 PRÁCTICA 5 ESTUDIO DE LA CAPACIDAD AMORTIGUADORA DE DISOLUCIONES REGULADORAS FUNDAMENTO DE LA PRÁCTICA En esta experiencia prepararems una dislución reguladra, determinarems
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO
 GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Octav. PERIODO: Segund UNIDAD: Ecuacines inecuacines lineales
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Octav. PERIODO: Segund UNIDAD: Ecuacines inecuacines lineales
Principios de calorimetría
 Principios de calorimetría Principios Si entran en contacto dos cuerpos o sustancias a distinta temperatura, y no hay intercambio de calor con los alrededores, el cuerpo con mayor temperatura cederá energía
Principios de calorimetría Principios Si entran en contacto dos cuerpos o sustancias a distinta temperatura, y no hay intercambio de calor con los alrededores, el cuerpo con mayor temperatura cederá energía
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO
 GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Octav. PERIODO: Segund UNIDAD: Sistemas de númers reales.
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Octav. PERIODO: Segund UNIDAD: Sistemas de númers reales.
7.- Rectificación y amplificación.
 Lección 8. Circuits de crriente alterna. 30 7.- ectificación y amplificación. 7.1.- ectificación En multitud de dispsitivs es necesari dispner de crriente cntinua para su funcinamient (placas base de rdenadres
Lección 8. Circuits de crriente alterna. 30 7.- ectificación y amplificación. 7.1.- ectificación En multitud de dispsitivs es necesari dispner de crriente cntinua para su funcinamient (placas base de rdenadres
V d o. Electrónica Analógica II Parte 3 Slew Rate (razón o velocidad de cambio)
 Electróna nalóga Parte 3 Slew Rate (razón velcidad de cambi) Otr fenómen que puede causar la distrsión n-lineal cuand señales grandes de salida están presentes, es la limitación del slew rate. El slew
Electróna nalóga Parte 3 Slew Rate (razón velcidad de cambi) Otr fenómen que puede causar la distrsión n-lineal cuand señales grandes de salida están presentes, es la limitación del slew rate. El slew
Limitaciones de la 1ra. ley de la termodinámica
 Termodinámica Tema 9 (segunda parte) Química General e Inorgánica A Limitaciones de la 1ra. ley de la termodinámica Procesos espontáneos o irreversibles Una cascada corre cuesta abajo Un terrón de azúcar
Termodinámica Tema 9 (segunda parte) Química General e Inorgánica A Limitaciones de la 1ra. ley de la termodinámica Procesos espontáneos o irreversibles Una cascada corre cuesta abajo Un terrón de azúcar
1. Primer principio de la termodinámica.
 1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
Sistemas de numeración
 Indice 1. Intrduccin 2. Sistema de numeración binari 3. Operacines Binarias 4. Bibligrafía (Internet) www.mngrafias.cm Sistemas de numeración 1. Intrducción La imprtancia del sistema decimal radica en
Indice 1. Intrduccin 2. Sistema de numeración binari 3. Operacines Binarias 4. Bibligrafía (Internet) www.mngrafias.cm Sistemas de numeración 1. Intrducción La imprtancia del sistema decimal radica en
NOCIÓN INTUITIVA DE CONJUNTO
 NOCIÓN INTUITIVA DE CONJUNTO Un cnjunt es la reunión en un td de bjets bien definids y diferenciables entre sí, que se llaman elements del mism. A ls elements se ls simbliza cn letras en minúscula y a
NOCIÓN INTUITIVA DE CONJUNTO Un cnjunt es la reunión en un td de bjets bien definids y diferenciables entre sí, que se llaman elements del mism. A ls elements se ls simbliza cn letras en minúscula y a
1 son: (4, 1, 0, + 2
 CUESTIÓN 1.- La cnfiguración electrónica del últim nivel energétic de un element es s p 3. De acuerd cn este dat: a) Deduce la situación de dich element en la tabla periódica. b) Escribe ls valres psibles
CUESTIÓN 1.- La cnfiguración electrónica del últim nivel energétic de un element es s p 3. De acuerd cn este dat: a) Deduce la situación de dich element en la tabla periódica. b) Escribe ls valres psibles
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
CERRADURAS PARA CONTROL DE ACCESO
 CERRADURAS PARA CONTROL DE ACCESO CLASIFICACION DE LAS CERRADURAS Pdems clasificar a las cerraduras en ds grandes grups: 1) Fail Secure: a. se mantienen cerradas aunque n haya crriente eléctrica. b. El
CERRADURAS PARA CONTROL DE ACCESO CLASIFICACION DE LAS CERRADURAS Pdems clasificar a las cerraduras en ds grandes grups: 1) Fail Secure: a. se mantienen cerradas aunque n haya crriente eléctrica. b. El
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO NOVENO
 GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO NOVENO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Nven. PERIODO: Segund UNIDAD: Sistemas de ecuacines lineales
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO NOVENO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Nven. PERIODO: Segund UNIDAD: Sistemas de ecuacines lineales
Termoquímica. Química General II era Unidad
 Termoquímica Química General II 2011 1era Unidad Termodinámica Es el estudio científico de la conversión del calor a otras formas de energía Energía Es la capacidad de efectuar un trabajo. Algunas formas
Termoquímica Química General II 2011 1era Unidad Termodinámica Es el estudio científico de la conversión del calor a otras formas de energía Energía Es la capacidad de efectuar un trabajo. Algunas formas
Ejemplo: En este ejemplo veremos cómo podemos utilizar un coaxial slotted line para calcular la impedancia de carga Z L.
 91 Ejempl: En este ejempl verems cóm pdems utilizar un caxial sltted line para calcular la impedancia de carga. Un caxial sltted line tiene una pequeña abertura lngitudinal (i.e. slit) en su cnductr exterir.
91 Ejempl: En este ejempl verems cóm pdems utilizar un caxial sltted line para calcular la impedancia de carga. Un caxial sltted line tiene una pequeña abertura lngitudinal (i.e. slit) en su cnductr exterir.
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
Equipos de respaldo de energía eléctrica UPS, SPS
 Equips de respald de energía eléctrica UPS, SPS Intrducción Pág. 1 Sistema UPS Pág. 2 Funcinamient Pág. 2 Sistema SPS Pág. 2 Funcinamient Pág. 3 Diferencias Técnicas Principales Pág. 3 Cnclusión Pág. 4
Equips de respald de energía eléctrica UPS, SPS Intrducción Pág. 1 Sistema UPS Pág. 2 Funcinamient Pág. 2 Sistema SPS Pág. 2 Funcinamient Pág. 3 Diferencias Técnicas Principales Pág. 3 Cnclusión Pág. 4
Cuando la fricción es excesiva se genera desgaste y por lo tanto reduce la vida útil de la máquina.
 Cuand una superficie se desliza sbre tra, se genera una fuerza de resistencia (fricción) que depende de la naturaleza de las ds superficies de cntact; cuand la fricción es grande las superficies se calientan
Cuand una superficie se desliza sbre tra, se genera una fuerza de resistencia (fricción) que depende de la naturaleza de las ds superficies de cntact; cuand la fricción es grande las superficies se calientan
CONDUCTOR EN EQULIBRIO ELECTROSTÁTICO
 CONDUCTOR EN EQULIBRIO ELECTROSTÁTICO Un cnductr en euilibri electrstátic tiene las siguientes prpiedades: El camp eléctric es cer en punts situads dentr del cnductr. Cualuier carga en exces ue se clue
CONDUCTOR EN EQULIBRIO ELECTROSTÁTICO Un cnductr en euilibri electrstátic tiene las siguientes prpiedades: El camp eléctric es cer en punts situads dentr del cnductr. Cualuier carga en exces ue se clue
ELECTROQÍMICA. La electrólisis puede definirse como un proceso en el que se consume energía eléctrica para provoca un cambio químico.
 ELECTROQÍMICA Las reaccines de xidación-reducción implican la transferencia de electrnes. Dad que la crriente eléctrica está cnstituida pr un fluj de electrnes, es psible utilizar reaccines químicas para
ELECTROQÍMICA Las reaccines de xidación-reducción implican la transferencia de electrnes. Dad que la crriente eléctrica está cnstituida pr un fluj de electrnes, es psible utilizar reaccines químicas para
Práctica 1. Termoquímica I 1 PRÁCTICA 1 TERMOQUÍMICA FUNDAMENTO DE LA PRÁCTICA
 Práctica 1. Termuímica I 1 PRÁCTICA 1 TERMOQUÍMICA FUNDAMENTO DE LA PRÁCTICA En esta experiencia vams a medir la cantidad de calr ue se absrbe se desprende en reaccines ue tienen lugar en dislución acusa.
Práctica 1. Termuímica I 1 PRÁCTICA 1 TERMOQUÍMICA FUNDAMENTO DE LA PRÁCTICA En esta experiencia vams a medir la cantidad de calr ue se absrbe se desprende en reaccines ue tienen lugar en dislución acusa.
FACULTAD DE INGENIERÍA DEPARTAMENTO DE CIENCIAS BÁSICAS QUÍMICA GENERAL REACCIONES QUÍMICAS
 FACULTAD DE INGENIERÍA DEPARTAMENTO DE CIENCIAS BÁSICAS QUÍMICA GENERAL REACCIONES QUÍMICAS Los componentes de una reacción química son los reactantes y los productos, los cuales pueden estar en estado
FACULTAD DE INGENIERÍA DEPARTAMENTO DE CIENCIAS BÁSICAS QUÍMICA GENERAL REACCIONES QUÍMICAS Los componentes de una reacción química son los reactantes y los productos, los cuales pueden estar en estado
Clasificación de los sistemas materiales.
 Clasificación de ls sistemas materiales. Hems vist que una primera clasificación de la materia estaba en función de su estad de agregación (sólid, líquid, gases). La clasificación que ns interesa en este
Clasificación de ls sistemas materiales. Hems vist que una primera clasificación de la materia estaba en función de su estad de agregación (sólid, líquid, gases). La clasificación que ns interesa en este
UNIVERSIDAD CATÓLICA ANDRÉS BELLO GUAYANA Escuela de Ingeniería Industrial Manual de Prácticas Laboratorio Química CALORIMETRIA.
 1. INTRODUCCION Un calorímetro es un dispositivo que mide la cantidad de calor que se produce en una reacción. Es un sistema adiabático y por lo tanto no permite la transferencia de energía con el medio
1. INTRODUCCION Un calorímetro es un dispositivo que mide la cantidad de calor que se produce en una reacción. Es un sistema adiabático y por lo tanto no permite la transferencia de energía con el medio
Mezclas homogéneas de sólidos, líquidos y gases Las disoluciones
 Dislucines 1/7 Mezclas hmgéneas de sólids, líquids y gases Las dislucines Cn frecuencia, ls sistemas químics cn ls que trabajams n ls encntrams frmads pr sustancias puras, sin pr mezclas de varias sustancias
Dislucines 1/7 Mezclas hmgéneas de sólids, líquids y gases Las dislucines Cn frecuencia, ls sistemas químics cn ls que trabajams n ls encntrams frmads pr sustancias puras, sin pr mezclas de varias sustancias
Expresa algebraicamente relaciones funcionales en las que unas magnitudes varían en función de otras.
 RELACIÓN FUNCIONAL 14 Expresa algebraicamente relacines funcinales en las que unas magnitudes varían en función de tras. En Presentación de Cntenids se explica qué es la relación funcinal y sus diferentes
RELACIÓN FUNCIONAL 14 Expresa algebraicamente relacines funcinales en las que unas magnitudes varían en función de tras. En Presentación de Cntenids se explica qué es la relación funcinal y sus diferentes
OPCIÓN A. d) El elemento B, gas noble y, por ello, muy estable, es el que posee menor reactividad química.
 OPCIÓN A CUESTIÓN A.- Para ls elements A, B, C D, de númers atómics 3, 0, 0 35, respectivamente: a) Escribe la cnfiguración electrónica de cada un de ells. b) Indica su situación en la tabla periódica.
OPCIÓN A CUESTIÓN A.- Para ls elements A, B, C D, de númers atómics 3, 0, 0 35, respectivamente: a) Escribe la cnfiguración electrónica de cada un de ells. b) Indica su situación en la tabla periódica.
Química 3131 Primer Semestre Prontuario
 Universidad de Puert Ric Recint Universitari de Mayagüez Facultad de Artes y Ciencias- Departament de Química 1. Infrmación General del Prfesr Química 3131 Primer Semestre 2007-08 Prntuari Prfesr Oficina
Universidad de Puert Ric Recint Universitari de Mayagüez Facultad de Artes y Ciencias- Departament de Química 1. Infrmación General del Prfesr Química 3131 Primer Semestre 2007-08 Prntuari Prfesr Oficina
MODELAJE DE SISTEMAS HIDRAULICOS
 MODELJE DE SISEMS HIDULICOS EJEMPLO.- NQUE DE LMCENMIENO CON DENJE VÉS DE UN UBEÍ CO (FLUJO LMIN) anque de área transversal, que almacena un fluid cuya densidad ρ es cnstante. Fluid drena a través de una
MODELJE DE SISEMS HIDULICOS EJEMPLO.- NQUE DE LMCENMIENO CON DENJE VÉS DE UN UBEÍ CO (FLUJO LMIN) anque de área transversal, que almacena un fluid cuya densidad ρ es cnstante. Fluid drena a través de una
Teoría elemental de conjuntos
 Tería elemental de cnjunts Lógica prpsicinal Una prpsición es cualquier enunciad lógic al que se le pueda asignar un valr de verdad (1) falsedad (0). Dada una prpsición p, se define la negación de p cm
Tería elemental de cnjunts Lógica prpsicinal Una prpsición es cualquier enunciad lógic al que se le pueda asignar un valr de verdad (1) falsedad (0). Dada una prpsición p, se define la negación de p cm
ÁLGEBRA Y GEOMETRÍA ANALÍTICA SUPERFICIES CUÁDRICAS SUPERFICIES
 SUPERFICIES En el área de estudi del electrmagnetism ns encntrams cn la guiente tuación: Ds superficies cilíndricas caxiales cuys radis sn de cm y de 3 cm respectivamente, llevan cargas eléctricas iguales
SUPERFICIES En el área de estudi del electrmagnetism ns encntrams cn la guiente tuación: Ds superficies cilíndricas caxiales cuys radis sn de cm y de 3 cm respectivamente, llevan cargas eléctricas iguales
Ámbito Científico-Tecnológico 3º Diversificación. Recuperación de la primera evaluación. Curso EJERCICIOS TEMA 1
 Ámbit Científic-Tecnlógic 3º Diversificación Recuperación de la primera evaluación Curs 2013-2014 1. Define las siguientes palabras: * Estrella: * Galaxia: * Vía Láctea: * Nebulsa: EJERCICIOS TEMA 1 2.
Ámbit Científic-Tecnlógic 3º Diversificación Recuperación de la primera evaluación Curs 2013-2014 1. Define las siguientes palabras: * Estrella: * Galaxia: * Vía Láctea: * Nebulsa: EJERCICIOS TEMA 1 2.
GUÍA SEMANAL DE APRENDIZAJE GRADO DECIMO
 GUÍA SEMANAL DE APRENDIZAJE GRADO DECIMO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Decim. PERIODO: Primer UNIDAD: Raznes trignmétricas TEMA: Raznes
GUÍA SEMANAL DE APRENDIZAJE GRADO DECIMO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Decim. PERIODO: Primer UNIDAD: Raznes trignmétricas TEMA: Raznes
Química general II Equilibrio químico
 Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
Cómo configurar el aula en Moodle?
 Cóm cnfigurar el aula en Mdle? La platafrma Mdle les da a ls tutres pcines para cnfigurar un curs cn el fin de que puedan diseñar a su gust el espaci en el que publicarán sus cntenids. La función de cnfiguración
Cóm cnfigurar el aula en Mdle? La platafrma Mdle les da a ls tutres pcines para cnfigurar un curs cn el fin de que puedan diseñar a su gust el espaci en el que publicarán sus cntenids. La función de cnfiguración
Un área importante en el estudio de las ciencias es la Termodinámica y un aspecto de este estudio, relacionado con los cambios químicos, es la
 Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Un área importante en
Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Un área importante en
Componentes del sistema de frenado
 Sistema de frenad El sistema de frens está diseñad para que a través del funcinamient de sus cmpnentes se pueda detener el vehícul a vluntad del cnductr. La base del funcinamient del sistema principal
Sistema de frenad El sistema de frens está diseñad para que a través del funcinamient de sus cmpnentes se pueda detener el vehícul a vluntad del cnductr. La base del funcinamient del sistema principal
La información no es de valor hasta que un número es asociado con ella. o Benjamín Franklin.
 Histria de la Medición en el Sftware La infrmación n es de valr hasta que un númer es asciad cn ella. Benjamín Franklin. N puedes cntrlar l que n puedes medir. Si crees que el cst de la medición es alt,
Histria de la Medición en el Sftware La infrmación n es de valr hasta que un númer es asciad cn ella. Benjamín Franklin. N puedes cntrlar l que n puedes medir. Si crees que el cst de la medición es alt,
Apuntes de Electroquímica. El proceso de producción electrolítica más importante en países desarrollados
 Apuntes de Electrquímica Electrlisis industrial Síntesis Cl 2 / NaOH El prces de prducción electrlítica más imprtante en países desarrllads 2 Cl (aq) + 2 H 2 O (l) 2 OH (aq) + H 2(g) + Cl 2(g) º= 2.19
Apuntes de Electrquímica Electrlisis industrial Síntesis Cl 2 / NaOH El prces de prducción electrlítica más imprtante en países desarrllads 2 Cl (aq) + 2 H 2 O (l) 2 OH (aq) + H 2(g) + Cl 2(g) º= 2.19
ELECTIVA I PROGRAMA DE FISICA Departamento de Física y Geología Universidad de Pamplona Marzo de 2010 NESTOR A. ARIAS HERNANDEZ - UNIPAMPLONA
 ELECTIVA I PROGRAMA DE FISICA Departament de Física y Gelgía Universidad de Pamplna Marz de 2010 En esta sección ns enfcarems en una clase muy limitada, per imprtante que invlucra mdificacines sencillas
ELECTIVA I PROGRAMA DE FISICA Departament de Física y Gelgía Universidad de Pamplna Marz de 2010 En esta sección ns enfcarems en una clase muy limitada, per imprtante que invlucra mdificacines sencillas
REPRESENTACIÓN GRÁFICA DE FUNCIONES REALES
 Unidad didáctica 7. Funcines reales de variable real Autras: Glria Jarne, Esperanza Minguillón, Trinidad Zabal REPRESENTACIÓN GRÁFICA DE FUNCIONES REALES CRECIMIENTO Y DECRECIMIENTO Dada una función real
Unidad didáctica 7. Funcines reales de variable real Autras: Glria Jarne, Esperanza Minguillón, Trinidad Zabal REPRESENTACIÓN GRÁFICA DE FUNCIONES REALES CRECIMIENTO Y DECRECIMIENTO Dada una función real
GUIA DE EJERCICIOS II. (Primera Ley Segunda Ley - Ciclo de Carnot)
 UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS II. (Primera Ley Segunda Ley - Ciclo de Carnot) 1. Deducir qué forma adopta la primera ley de la termodinámica aplicada a un gas ideal para
UNIVERSIDAD PEDRO DE VALDIVIA TERMODINAMICA. GUIA DE EJERCICIOS II. (Primera Ley Segunda Ley - Ciclo de Carnot) 1. Deducir qué forma adopta la primera ley de la termodinámica aplicada a un gas ideal para
Función Pago y Cuadro de Amortización
 Función Pag y Cuadr de Amrtización Función: =PAGO( ) HL Mata Esta función calcula ls pags periódics que se deben hacer sbre un préstam, a un interés y tiemp determinad. Pdrems ver cuant se tiene que pagar
Función Pag y Cuadr de Amrtización Función: =PAGO( ) HL Mata Esta función calcula ls pags periódics que se deben hacer sbre un préstam, a un interés y tiemp determinad. Pdrems ver cuant se tiene que pagar
Capítulo 14: Equilibrio químico
 Capítulo 14: Equilibrio químico Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM 3002 Química general II, Cap. 14: Eq. químico p.1 Concepto
Capítulo 14: Equilibrio químico Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM 3002 Química general II, Cap. 14: Eq. químico p.1 Concepto
Aceleración del algoritmo K-NN
 Aceleración del algritm K-NN Günther Rland Universidad Carls III Av. de la Universidad, 30 28911 Leganés (Madrid) g.rland(at)student.tugraz.at RESUMEN En el siguiente trabaj presentaré un algritm K-NN
Aceleración del algritm K-NN Günther Rland Universidad Carls III Av. de la Universidad, 30 28911 Leganés (Madrid) g.rland(at)student.tugraz.at RESUMEN En el siguiente trabaj presentaré un algritm K-NN
Dualidad y sensitividad
 Dualidad y sensitividad 1. Dualidad Dad un prblema de minimización en frma canónica PC: min c T x s.a Ax v x 0 su dual es el prblema max w T b s.aw T A c T W 0 Para un prblema de prgramación lineal en
Dualidad y sensitividad 1. Dualidad Dad un prblema de minimización en frma canónica PC: min c T x s.a Ax v x 0 su dual es el prblema max w T b s.aw T A c T W 0 Para un prblema de prgramación lineal en
DERIVADA DE UNA FUNCIÓN REAL
 Unidad didáctica 7 Funcines reales de variable real Autras: Glria Jarne, Esperanza Minguillón, Trinidad Zabal DERIVADA DE UNA FUNCIÓN REAL CONCEPTOS BÁSICOS Dada una función real y f( ) y un punt D en
Unidad didáctica 7 Funcines reales de variable real Autras: Glria Jarne, Esperanza Minguillón, Trinidad Zabal DERIVADA DE UNA FUNCIÓN REAL CONCEPTOS BÁSICOS Dada una función real y f( ) y un punt D en
PRODUCCIÓN DE ELECTRICIDAD
 PRODUCCIÓN DE ELECTRICIDAD Índice 1. Generadres; 2. Central eléctrica; 3. Centrales Hidreléctricas; 4. Centrales Térmicas; 5. Centrales Nucleares; 6. Centrales Slares; 7. Centrales Eólicas; 8. Centrales
PRODUCCIÓN DE ELECTRICIDAD Índice 1. Generadres; 2. Central eléctrica; 3. Centrales Hidreléctricas; 4. Centrales Térmicas; 5. Centrales Nucleares; 6. Centrales Slares; 7. Centrales Eólicas; 8. Centrales
Tema 9: La energía y sus fuentes.
 Tema 9: La energía y sus fuentes. Ciencias de la Naturaleza 2º ESO. Nmbre alumn/a: Objetivs a) Describir la energía cm una prpiedad de ls sistemas materiales y que td sistema material es una prción del
Tema 9: La energía y sus fuentes. Ciencias de la Naturaleza 2º ESO. Nmbre alumn/a: Objetivs a) Describir la energía cm una prpiedad de ls sistemas materiales y que td sistema material es una prción del
LECTURA 02: DISTRIBUCIÓN NORMAL (PARTE II) CALCULO INVERSO EN LA DISTRIBUCIÓN NORMAL ESTÁNDAR. ESTANDARIZACIÓN.
 LECTURA 2: DISTRIBUCIÓN NORMAL (PARTE II) CALCULO INVERSO EN LA DISTRIBUCIÓN NORMAL ESTÁNDAR. ESTANDARIZACIÓN. TEMA 4: CALCULO INVERSO EN LA DISTRIBUCION NORMAL ESTANDAR En la sesión anterir llevams acab
LECTURA 2: DISTRIBUCIÓN NORMAL (PARTE II) CALCULO INVERSO EN LA DISTRIBUCIÓN NORMAL ESTÁNDAR. ESTANDARIZACIÓN. TEMA 4: CALCULO INVERSO EN LA DISTRIBUCION NORMAL ESTANDAR En la sesión anterir llevams acab
UNIVERSIDAD NACIONAL DE COLOMBIA SEDE MEDELLÍN FACULTAD DE CIENCIAS-ESCUELA DE FÍSICA FÍSICA MECÁNICA MÓDULO #2: FUNDAMENTOS SOBRE VECTORES
 UNIVERSIDAD NACIONAL DE COLOMBIA SEDE MEDELLÍN FACULTAD DE CIENCIAS-ESCUELA DE FÍSICA FÍSICA MECÁNICA MÓDULO #2: FUNDAMENTOS SOBRE VECTORES Dieg Luis Aristizábal R., Rbert Restrep A., Tatiana Muñz H. Prfesres,
UNIVERSIDAD NACIONAL DE COLOMBIA SEDE MEDELLÍN FACULTAD DE CIENCIAS-ESCUELA DE FÍSICA FÍSICA MECÁNICA MÓDULO #2: FUNDAMENTOS SOBRE VECTORES Dieg Luis Aristizábal R., Rbert Restrep A., Tatiana Muñz H. Prfesres,
TRAZABILIDAD. La trazabilidad de un producto deberá hacerse en tres niveles:
 TRAZABILIDAD Intrducción La trazabilidad que debe aplicarse en las industrias alimentarias se define cm la psibilidad de encntrar y seguir el rastr, a través de tdas las etapas de prducción, transfrmación
TRAZABILIDAD Intrducción La trazabilidad que debe aplicarse en las industrias alimentarias se define cm la psibilidad de encntrar y seguir el rastr, a través de tdas las etapas de prducción, transfrmación
ELIMINATORIA, 28 de marzo de 2009 PROBLEMAS
 ELIMINATORIA, 28 de marz de 2009 PROBLEMAS 1. Ana y Pedr viven en la m ism a calle (sbre la m ism a banquet a). De un lad de la casa de Ana hay 2 casas y del tr hay 13 casas. Pedr vive en la casa que está
ELIMINATORIA, 28 de marz de 2009 PROBLEMAS 1. Ana y Pedr viven en la m ism a calle (sbre la m ism a banquet a). De un lad de la casa de Ana hay 2 casas y del tr hay 13 casas. Pedr vive en la casa que está
Química general II Equilibrio químico
 Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
Química general II Equilibrio químico capitulo 14, Chang El equilibrio es un estado en el que no se observan cambios conforme el tiempo transcurre. Cuando una reacción química alcanza el equilibrio, las
Gestión del cambio. Requisitos y estrategias de incorporación de las TIC
 PRESENTACIÓN Cm ya hems id viend, las TIC abren psibilidades y camins para un Centr un cnjunt de Centrs que de tra manera serian abslutamente inaccesibles. Una de estas psibilidades tiene que ver cn la
PRESENTACIÓN Cm ya hems id viend, las TIC abren psibilidades y camins para un Centr un cnjunt de Centrs que de tra manera serian abslutamente inaccesibles. Una de estas psibilidades tiene que ver cn la
TUTORIAL DEFORMACIONES Y LÍMITE ELÁSTICO
 TUTORIAL DEFORMACIONES Y LÍMITE ELÁSTICO En este tutrial explicarems un cncept clave en Resistencia de Materiales cm es el que marca el límite en el cmprtamient elástic de cualquier material smetid a un
TUTORIAL DEFORMACIONES Y LÍMITE ELÁSTICO En este tutrial explicarems un cncept clave en Resistencia de Materiales cm es el que marca el límite en el cmprtamient elástic de cualquier material smetid a un
Conceptos Básicos de Electroquímica
 Cncepts Básics de Electrquímica David Uribe Diciembre 2010 I.E.S. La Cañada, Departament de Física y Química Avda. de la Cañada 44, 28823 Cslada (Madrid) En la enseñanza de la electrquímica hay ciertas
Cncepts Básics de Electrquímica David Uribe Diciembre 2010 I.E.S. La Cañada, Departament de Física y Química Avda. de la Cañada 44, 28823 Cslada (Madrid) En la enseñanza de la electrquímica hay ciertas
QUÍMICA. Calcular la molaridad de una solución que contiene 456 gr de cloruro de sodio en 125 ml de solución.
 UNIDAD I LIQUIDOS VITALES QUÍMICA Concentración (molar y normal) Calcular la molaridad de una solución que contiene 456 gr de cloruro de sodio en 125 ml de solución. Cuantos gramos de ácido nítrico debo
UNIDAD I LIQUIDOS VITALES QUÍMICA Concentración (molar y normal) Calcular la molaridad de una solución que contiene 456 gr de cloruro de sodio en 125 ml de solución. Cuantos gramos de ácido nítrico debo
SITUACIONES DONDE SE USA FUNCIÓN LINEAL I
 SITUACIONES DONDE SE USA FUNCIÓN LINEAL I Función Oferta y Función Demanda de un Mercad. Ejercicis prpuests: 1) Cnsidere la relación 8p +0Q 000 0, dnde p es el preci de un prduct. a) Da la función explícita
SITUACIONES DONDE SE USA FUNCIÓN LINEAL I Función Oferta y Función Demanda de un Mercad. Ejercicis prpuests: 1) Cnsidere la relación 8p +0Q 000 0, dnde p es el preci de un prduct. a) Da la función explícita
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA
 UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA 01015 TERMODINÁMICA EJERCICIOS DE AUTOEVALUACIÓN Mg. RUBÉN DARÍO MÚNERA TANGARIFE Directr Nacinal Mg. ANA ILVA CAPERA URREGO Acreditadr PALMIRA Septiembre de
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA 01015 TERMODINÁMICA EJERCICIOS DE AUTOEVALUACIÓN Mg. RUBÉN DARÍO MÚNERA TANGARIFE Directr Nacinal Mg. ANA ILVA CAPERA URREGO Acreditadr PALMIRA Septiembre de
Tema 3: Termoquímica. Termoquímica Conceptos básicos Primer principio Entalpía Ley de Hess Segundo principio
 Tema 3: Termoquímica Objetivos. Principios y conceptos básicos. Primera ley de la termodinámica. Energía interna y entalpía. Calores de reacción. Ley de Hess. Segunda ley de la termodinámica. Entropía.
Tema 3: Termoquímica Objetivos. Principios y conceptos básicos. Primera ley de la termodinámica. Energía interna y entalpía. Calores de reacción. Ley de Hess. Segunda ley de la termodinámica. Entropía.
CRISTALOGRAFÍA GEOMÉTRICA. TEMA 3 SIMETRÍA y REDES
 CRISTALOGRAFÍA GEOMÉTRICA TEMA 3 SIMETRÍA y REDES ÍNDICE 3.1 Simetría cntenida en las redes 3.2 Cncept de simetría 3.3 Operacines de simetría 3.4 Elements de simetría 3.5 Traslación 3.6 Rtación y eje de
CRISTALOGRAFÍA GEOMÉTRICA TEMA 3 SIMETRÍA y REDES ÍNDICE 3.1 Simetría cntenida en las redes 3.2 Cncept de simetría 3.3 Operacines de simetría 3.4 Elements de simetría 3.5 Traslación 3.6 Rtación y eje de
INTRODUCCIÓN. Tema 1: CORROSIÓN (Ingeniería Química) TEMA 1. Definición y formas de corrosión. Importancia de la corrosión
 Tema 1: INTRODUCCIÓN Definición y frmas de crrsión Imprtancia de la crrsión Universidad de Alicante Departament de Química Física 1 INTRODUCCIÓN 1. DEFINICIÓN Y FORMAS DE CORROSIÓN Resultad destructiv
Tema 1: INTRODUCCIÓN Definición y frmas de crrsión Imprtancia de la crrsión Universidad de Alicante Departament de Química Física 1 INTRODUCCIÓN 1. DEFINICIÓN Y FORMAS DE CORROSIÓN Resultad destructiv
Unidad 2 Empresa Empresario
 Unidad 2 Empresa Empresari 2.1 Empresa - Organización cm institución. Empresa- Organización: Cncept. Diferencias Una institución es un sistema de nrmas, reglas de cnducta cn la finalidad de satisfacer
Unidad 2 Empresa Empresari 2.1 Empresa - Organización cm institución. Empresa- Organización: Cncept. Diferencias Una institución es un sistema de nrmas, reglas de cnducta cn la finalidad de satisfacer
LA TABLA PERIÓDICA. Cuestiones generales.
 I.E.S. Clara Campamr (Getafe) Ejempl (Selectividad. Madrid Previ 998). Dads ls elements A y B de númers atómics 9 y respectivamente: a) Establezca la cnfiguración electrónica de cada un de ells. b) Indique
I.E.S. Clara Campamr (Getafe) Ejempl (Selectividad. Madrid Previ 998). Dads ls elements A y B de númers atómics 9 y respectivamente: a) Establezca la cnfiguración electrónica de cada un de ells. b) Indique
Sesiones 2-3: Transformación de datos
 Curs de intrducción a Stata Jrdi Muñz (UAB) Sesines 2-3: Transfrmación de dats Hasta ahra hems vist ls elements básics de stata, y cóm inspeccinar ls dats que tenems. A partir de ahra vams a trabajar sbre
Curs de intrducción a Stata Jrdi Muñz (UAB) Sesines 2-3: Transfrmación de dats Hasta ahra hems vist ls elements básics de stata, y cóm inspeccinar ls dats que tenems. A partir de ahra vams a trabajar sbre
E = dw. cuya unidad de medida es el volt. Figura 1:
 Ls circuits de crriente directa Estudiarems el cmprtamient de ls circuits eléctrics, que incluyen elements cm resistres individuales, baterías alambres. Estudiarems circuits de crriente directa (CD), dnde
Ls circuits de crriente directa Estudiarems el cmprtamient de ls circuits eléctrics, que incluyen elements cm resistres individuales, baterías alambres. Estudiarems circuits de crriente directa (CD), dnde
Cómo escribir el Trabajo Fin
 Cóm escribir el Trabaj Fin de Grad TRABAJO FIN DE GRADO Grad Magisteri Educación Infantil/Primaria/Educación Scial 0 0 Cóm escribir el Trabaj Fin de Grad CURSO DE ADAPTACIÓN El Trabaj Fin de Grad debe
Cóm escribir el Trabaj Fin de Grad TRABAJO FIN DE GRADO Grad Magisteri Educación Infantil/Primaria/Educación Scial 0 0 Cóm escribir el Trabaj Fin de Grad CURSO DE ADAPTACIÓN El Trabaj Fin de Grad debe
o o 2 1 2 2 24 α = + α = + α = α =
 Tema 7 Trignmetría Matemáticas 4º ESO 1 TEMA 7 TRIGONOMETRÍA UNIDADES DE MEDIDAS DE ÁNGULOS EJERCICIO 1 a) Pasa a radianes ls siguientes ánguls: 10 y 70 b) Pasa a grads ls ánguls: 7π rad 6 y,5 rad π 7π
Tema 7 Trignmetría Matemáticas 4º ESO 1 TEMA 7 TRIGONOMETRÍA UNIDADES DE MEDIDAS DE ÁNGULOS EJERCICIO 1 a) Pasa a radianes ls siguientes ánguls: 10 y 70 b) Pasa a grads ls ánguls: 7π rad 6 y,5 rad π 7π
Información recogida en una Ficha de Datos de Seguridad
 Identificación de Prducts Químics Para cncer ls peligrs de un prduct químic se requiere cncer tant la identificación del nmbre de la sustancia, cm las características de ls riesgs que ésta pueda tener.
Identificación de Prducts Químics Para cncer ls peligrs de un prduct químic se requiere cncer tant la identificación del nmbre de la sustancia, cm las características de ls riesgs que ésta pueda tener.
, si X toma valores muy grandes positivos, f(x) se va aproximando a l. o., si X toma valores muy grandes negativos, f(x) se va aproximando a l.
 3.8 Límites en el infinit En casines interesa cnsiderar el cmprtamient de una función cuand la variable independiente tiende, n a un valr cncret, sin a valres muy grandes, tant psitivs cm negativs. En
3.8 Límites en el infinit En casines interesa cnsiderar el cmprtamient de una función cuand la variable independiente tiende, n a un valr cncret, sin a valres muy grandes, tant psitivs cm negativs. En
Segmentación dinámica de mercados B2B
 1 Segmentación dinámica de mercads B2B Palabras clave: B2B, servicis empresariales, segmentación de mercads, mercads cambiantes. Intrducción Esta Herramienta se deriva del Zm Gerencial Pr la rutas digitales
1 Segmentación dinámica de mercads B2B Palabras clave: B2B, servicis empresariales, segmentación de mercads, mercads cambiantes. Intrducción Esta Herramienta se deriva del Zm Gerencial Pr la rutas digitales
APARATO DE OSCILACIÓN GIRATORIA. Cálculo de momentos de Inercia
 APARATO DE OSCILACIÓN GIRATORIA Cálcul de mments de Inercia 1. OBJETIVO Estudi de las vibracines de trsión aplicadas a la determinación cuantitativa de mments de inercia de distints bjets. Cmprbación experimental
APARATO DE OSCILACIÓN GIRATORIA Cálcul de mments de Inercia 1. OBJETIVO Estudi de las vibracines de trsión aplicadas a la determinación cuantitativa de mments de inercia de distints bjets. Cmprbación experimental
Repaso de Ingeniería Económica
 Repas de Ingeniería Ecnómica Interés: es la cantidad pagada pr el us del diner btenid en préstam la cantidad prducida pr una inversión financiera (cst gast en el primer cas e ingres en el segund): en dnde:
Repas de Ingeniería Ecnómica Interés: es la cantidad pagada pr el us del diner btenid en préstam la cantidad prducida pr una inversión financiera (cst gast en el primer cas e ingres en el segund): en dnde:
Cambiar el estado: Evaporación
 Lección 2.2 Cambiar el estad: Evapración Cncepts clave La evapración curre cuand las mléculas de un líquid reciben suficiente energía para que superen las atraccines de tras mléculas y se separen para
Lección 2.2 Cambiar el estad: Evapración Cncepts clave La evapración curre cuand las mléculas de un líquid reciben suficiente energía para que superen las atraccines de tras mléculas y se separen para
Química: todo por ti. Module 6. Actividades prácticas: Experimentos con el agua
 Química: td pr ti Mdule 6. Actividades prácticas: Experiments cn el agua CONTENIDOS Mdule 6. Actividades prácticas: Experiments cn el agua... 3 1. Filtración... 4 2. El desafí del alambique slar... 6 MODULE
Química: td pr ti Mdule 6. Actividades prácticas: Experiments cn el agua CONTENIDOS Mdule 6. Actividades prácticas: Experiments cn el agua... 3 1. Filtración... 4 2. El desafí del alambique slar... 6 MODULE
Materia: Matemática de Séptimo Tema: Propiedades de los Números Racionales vs Números irracionales
 Materia: Matemática de Séptim Tema: Prpiedades de ls Númers Racinales vs Númers irracinales Qué pasa si quieres identificar un númer cm? Es un númer racinal irracinal? Después de cmpletar este cncept,
Materia: Matemática de Séptim Tema: Prpiedades de ls Númers Racinales vs Númers irracinales Qué pasa si quieres identificar un númer cm? Es un númer racinal irracinal? Después de cmpletar este cncept,
