Equilibrio acido-base
|
|
|
- Andrea Cano Revuelta
- hace 7 años
- Vistas:
Transcripción
1 Equilibrio acido-base Vamos a ver otro de los grandes problemas que tiene el organismo. El organismo siempre tiene una lucha para tratar de mantener el equilibrio ácido-base. Cuando se habla de equilibrio del medio interno, se refiere a que el organismo trata de mantener: la osmolaridad, el Volumen y además el ph. También la temperatura. Cómo trata el organismo de mantener el equilibrio ácido- base? En general cuando uno habla del equilibrio ácido-base, por un lado esta el elemento ácido y por otro el elemento base. El ácido va aportar hidrogeniones y la base va a recibir los hidrogenines. También se habla del equilibrio de la concentración de hidrogeniones, por lo tanto cuando uno habla de ácido-base, nos referimos al concepto de ph. Pero el concepto de ph que esta relacionado con la concentración de hidrogeniones. Una cosa es el ph y otra es la concentración de hirdrogeniones. La concertación de hidrogenines esta dada por nanomoles por Litros. Se dice que el ph normal es cuando hay 40 nanomoles por litro, en cambio uno va a decir que el ph normal es 7.4. La presión de ph es una expresión logarítmica (en la formula ph=-log (H)). Se esta haciendo mansión a la concentración de hidrogeniones. Por lo tanto cuando se habla de ph, se habla de la concentración de hidrogeniones y estos son Hidrogeno libre no asociado, por lo tanto cuando el ph se modifica en el organismo y se hizo acido, significa que aumento el hidrogeno libre y eso determina que el ph sea ácido. Cuando se habla de un medio alcalino es porque el hay menos H libre. Cuando se mide ph con un peachimetro este mide solo el hidrogeno libre. Para medir hidrogeno asociado hay otras formas. Por eso habrá acidosis cuando la concentración de hidrogeniones sea superior a 40 nanomes por litros y habrá alquilosis cuando es inferior esta imagen representa lo que dice el profe. Cuando se calcula el ph, este no tiene que tener un valor tan rígido, sino que el organismo mueve los elementos en un cierto rango y ese rango esta entre 7.35 y 7.45, así cuando uno dice que el ph es igual 7.40, esta dando solo un promedio dentro del rango y podría disminuir hasta 7.25 o aumentar hasta 7.80 mas allá se producirá la muerte La línea verde esta marcando el nivel normal que seria 7.4. Las otras líneas verdes (mas cortas) indica los limites normales, que será 7.35 en el lado acido y 7.45 en el lado alcalino, pero todavía la literatura indica que podría ser mas estrecho el rango. O sea que pondría variar 0.02 en ambos lados. Si bajamos en una décima el valor de 7.35 ya estamos ante una acidosis severa y si aumentamos en una décima el valor 7.55 estamos ante una alcalosis severa. La línea roja marca el límite compatible con la vida y si varía
2 Si hablamos de equilibrio del medio interno debemos considerar todos los elementos que rodean a la célula y que le darán los aspectos bioquímicos. Si vemos el ph, esta será el ph extracelular y cuando se hace medición siempre se considera al ph sanguíneo, como se hace en la osmolaridad, pues mas difícil medirla dentro de la célula por tanto se asume que el intracelular será igual (por el concepto Kirl.. creo q así dijo). Generalmente tiende a ser mas bajo el ph intracelular (más ácido) que el extracelular por lo tanto el organismo asume que si es 7.40 en el plasma, en el intracelular el ph es normal. Si el ph es superior a 7.45 se produce ALCALOSIS Si el ph es inferior a 7.35 se produce ACIDOSIS. Así como hay un rango de ph en el que se puede mover o gravitar la concentración de hidrogeniones, esto no produciría un efecto nocivo en el organismo. También es posible que el ph varíe más allá de ese rango, o sea que haya acidosis o alcalosis produciendo condiciones que no son compatibles con la vida. Es importante esta consideración porque si el ph normal es 7.4 y puede disminuir hasta 6.8 o puedo aumentar hasta 7.8. La diferencia acá es 0.4 y acá es Que se puede deducir?? Que el organismo es menos resistente, el rango en que puede variar el ph alcalino es mucho mas estrecho que lo que puede variar cuando se acidifica. El organismo tiene bastantes mecanismos lo adaptan a las variaciones de ph cuando se acidifica. En cambio cuando se genera alcalosis habrá más complicaciones para el organismo producto de que no tiene los mecanismos que sean suficientes para adaptarse a una variación de ph que lleve a una alcalosis. EL ORAGANISMO SIEMPRE TIENDE A HACERSE ACIDO, y el metabolismo siempre esta produciendo hidrogeniones, por lo tanto en condiciones normales el organismo esta impidiendo que se haga ácido. El organismo tiene mecanismos que lo adapta mejor frente a una acidosis, en cambio como tiende a no generar alcalosis, frente a una alcalosis el organismo presenta muchas complicaciones. El ph esta relacionado con las concentraciones de hidrogeniones. Cuando se dice que el ph normal es 7.4 eso corresponde a 40 nanomoles por litro. Si el ph se hace ácido, bajo 7.25, tenemos una concentración de más o menos 60 nanomoles por litro y a 6.8 de ph tenemos 160 nanomoles por litro, lo cual aumentó a 4 veces la concentración de hidrogeniones y las reducciones de ph se va haciendo en forma decimal. Por lo que se esta generando un aumento de los hidrogeniones... En caso de alcalosis y acidosis el pacientes presenta un estado de coma, la diferencia es que en la alcalosis se presentan convulsiones y tetania, e hiperexcitación antes de entrar en coma. Primero convulsiones luego tetania IMPORTANCIA DE LA MANTENCION DEL ph - SISTEMA ENZIMÁTICO - FUNCIÓN CELULAR: METABOLISMO El metabolismo depende de las enzimas y la actividad enzimática es influenciada fuertemente por la temperatura y el ph. Por lo tanto si se modifica el ph se tiene que modificar la cinética enzimática si se modifica mucho el ph las encimas se tornaran mas activas y ese es el elemento que nos interesa en particular. Las enzimas son proteínas y la proteína a ph 7.4 estas cargada negativamente por lo tanto si aumenta la concentración de hidrogeniones plasmático, en una acidosis, todas las proteínas pueden captar hidrogeniones. Ahora si aumenta la concentración de H+ plasmático también aumenta la concentración de H+ celular, por lo tanto dentro de la célula habrán proteínas que captaran estos H+ y comenzaran a cambiar su estado de ionización. De negativa se van haciendo cada vez menos negativa incluso pueden llegar a no tener carga, y al ir cambiando su estado de ionización, ira cambiando su estructura y si esta tiene un sitio activo en el cual reconoce el sustrato, entonces si se modifica la conformación espacial también se modificará el sitio activo, por lo tanto no será capas de reconocer el sustrato y finalmente podría llevar a que no se genere el metabolismo. Le metabolismo deficiente o que no se realiza llevara que los tejidos mueran. - INTEGRIDAD MEMBRANA CELULAR Es importante también el efecto que tiene el ph sobre la integridad de la membrana celular. Recordando, la célula tiene más k+ en su interior y más Na+ en el exterior. Si se altera la membrana celular y la bomba Na/K la permeabilidad se vera afectada y por lo tanto habrá una mala
3 distribución de estos iones, el potasio tendería a salir y el Na+ a entrar. Por lo tanto se alteran el impulso nervioso, los potenciales de acción, se altera la actividad contráctil y el corazón no puede seguir funcionando. Todos lo mecanismos de integración se verán afectados por el daño en la membrana que esa altamente sensible a los cambios de ph. Por ej. Cuando se hablemos de shock, veremos que los problemas que se van a generar por hipoxia mantenida de los tejidos es que finalmente se generaran AC. Láctico y lo que hace este es acidificar el medio en el que se encuentran los tejidos, por lo tanto uno de los problemas que va generar será que alterara la permeabilidad de la membrana y va a salir K+ y enzimas desde la célula. - ALTERACIÓN EQUILIBRIO DEL K+ Ahora, también en el equilibrio acido- base genera un efecto sobre el K+. Si aumenta el H+ fuera de la célula este puede ser amortiguado, es decir, de alguna manera reducir el impacto que puede generar en el plasma, también una parte importante de ese H+ va a entrar a la célula y dentro de ella se puede unir a proteínas y a fosfato. Y por cada hidrogeno que entre la tendencia va a ser de sacar K+. Por lo tanto cuando aumente la concentración de hidrogeniones también va a aumentar la concentración de K+ extracelular. También ocurre lo inverso, si hay poco h+ fuera de la celular, sale H+ desde la célula e ingresa K ORIGEN Y PRODUCCION DE H+: METABOLICO Cómo se origina o produce los hidrogeniones?. Todo el H+ se produce a partir del metabolismo, a través de: Acido volátil: se caracteriza porque se pude eliminar por el pulmón, el CO2, técnicamente, no es una acido porque no posee H+, pero al metabolizar con agua puede generar acido carbónico (en personar con problemas respiratorio, Ej. : asma. Tienden a retener el acido carbónico), y cómo puede el organismo eliminar ese acido?.. Por el pulmón pues elimina el CO2 y de esa forma evita que se forma el acido, es por eso que se dice que el CO2 es un acido volátil. Es mas cuando uno quiere determinar cuánto ácido carbónico se produce se calcula por medio de la cantidad de CO2 el cual se multiplica por una constante. Acido fijo: el concepto de acido fijo... la diferencia es que no se puede eliminar por el pulmón, sino que principalmente por vía renal, excepto el acido láctico Acido láctico: se regula por metabolismo hepático, el riñón igual pero casi nada Acido fosforito: eliminado por riñón Cetoacidos: en diabetes mellitus usan la grasa como energía y entregan ácidos grasos libres al hígado y este produce cetoacidos (por Ej.: ácido betahidroxibutilico. Acido cetoacetico). El riñón es importante eliminando hidrogeniones en condiciones normales. La diferencia es que en acidosis va a tener que eliminar más h+. Normalmente el organismo esta eliminando hidrogeniones, pues tiene que deshacerse de ello y la mejor vía es el riñón. Siempre digo: HIPOXIA de moderada a severa, siempre metabolismo anaerobio, y metabolismo anaerobio siempre significa acidosis Láctica, por lo tanto siempre que se genere hipoxia en los tejidos se va a producir ac.láctico. Por ejemplo cuando hay deshidratación, esto produce hipovolemia, lo que produce menor volumen circulando. La respuesta nerviosa ante una hipovolemia es generar vasoconstricción periférica, entonces los tejidos como la piel, la corteza renal, tejido digestivo quedan con poca irrigación, por tanto reciben poco oxigeno, desarrollan metabolismo anaerobio lo que genera acidosis láctica. SIEMPRE QUE HAYA DESHIDRATACION HABRA ACIDOSIS LACTICA, Y EL PASO PARA QUE HAYA ACIDOSIS. LACTICA ES LA HIPOXIA Anemia, todas la alteraciones respiratoria, la insuficiencia cardiaca y renal llevan a una acidosis láctica. Si el organismo tiende a la acides, significa que tiene mecanismo que evitan esto en condiciones normales, estas puede ser por un simple efecto físico, por ejemplo creando dilución cuando tiene la suficiente cantidad de agua (una persona de 60 Kg. tiene 45 lt. Una de 30 lt.). Pero lo que nos interese a es: El mecanismo de amortiguación fuera y dentro de la célula. El mecanismo de eliminación por el pulmón y el riñón Estos mecanismos están ordenados de acuerdo a la velocidad en la que se van generando. El efecto de la dilución es instantáneo, la amortiguación toma un poco de tiempo pues se trata de
4 reacciones químicas, pero es rápido. Luego del efecto de amortiguador debería producirse el la eliminación, ahora quien elimina mas rápido es el pulmón. El riñón es mas lento, puede tomarse 12 horas hasta días, 3 a 5 días en alcanzar su máxima efectividad. Por lo tanto los mecanismo están tan bien estructurados que hay algunos que demorando desde segundos, horas y días, para final mente se va generar una integración de todos los mecanismos que generan un efecto sobre el ph. Cuando hay mecanismos de amortiguación, se habla del sistema buffer que pueden actuar tanto en LEC como en el LIC. El pulmón lo que va hacer es retención y excreción del CO2. Retiene cuando existe alcalosis y excreta cuando existe acidosis El riñón reabsorbe, sintetiza o excreta bicarbonato y excreta hidrogeniones, en condiciones normales filtra el bicarbonato en un 90 % a través del TCP. Sintetiza poco bicarbonato en condiciones normales y secreta el H+. Cambios de concentración de hidrogeniones en el extracelular... Si hay un aumento de H+ en el extracelular se va a utilizar el bicarbonato para amortiguarlo y las sustancias buffer, una vez que esto ocurre debería producirse la respuesta pulmonar que lo que hará es depurar la presión arterial de CO2, si hay acidosis eliminara mas CO2 si hay alcalosis elimina menos CO2. y la regulación renal tiende de alguna manera a recuperar el bicarbonato gastado y finalmente el H+ en el LEC deberá llegar a ser normal. Osea, mantener el ph y se deberá recuperar la capacidad buffer, osea la cantidad de bicarbonato que tenia antes de generar un efecto amortiguador. Amortiguación. - AMORTIGUACIÓN EXTRACELular NaHCO3 / H2CO3, PROTEÍNAS, FOSFATOS - AMORTIGUACIÓN INTRACELULAR PROTEÍNAS (Hb), FOSFATOS, NaHCO3 / H2CO3 Se refiere a que hay sustancia dentro del organismo que son capases de reducir la variación de ph. Es importante considerar que el los amortiguadores reducen la variación de ph, pero no la impiden. Lo que se logra es reducir el efecto de la variación de ph y evitar que llegue a los limistes compatibles con la vida. La amortiguación extracelular se produce fundamentadamente por el sistema bicarbonato de sodio acido carbónico (NaHCO3 / H2CO3),. Ester es la mas importante con respecto a los otros. Es mas cuando uno hace el calculo de ph extracelular y ph plamtico generalmente lo que hace es medir por un lado el bicarbonato y por otro el CO2 y con eso dos valores uno hace la estimación de ph plasmático. Las proteínas son menos importantes extracelularmente... La amortiguación intracelular esta generada por proteínas.(hb)., después los fosfatos y el sistema NaHCO3 / H2CO3 tiene poca importancia, excepto en el glóbulo rojo, este es supergonico y también es importante.. Como ocurre la amortiguación?? Tenemos un amortiguador (proteína o un sistema NaHCO3 / H2CO3), lo que hace es reducir la variación de ph y como lo hace? Si aumenta la concentración de H+ los capta, si disminuye la contracción de H+ plasmático lo que hace es ceder hidrogeniones. En acidosis capta H+ En alcalosis cede H+ Ahora si consideramos que el amortiguador extracelular, mas importante es el sistema NaHCO3 / H2CO3 y el amortiguador intracelular mas importantes son las proteínas... entonces qué es mas importantes: la amortiguación intracelular o la extracelular? A ph 7.4 (normal) en el extracelular se amortigua el 50% y en el intracelular 50%.. Prácticamente tiene la misma importancia para ambos. Cuando hay acidosis, la amortiguación extracelular es aprox. 20% o menor y el intracelular es 80% o mayor. Por lo tanto a medida que se acidifica el organismo cada vez se hace más importante la amortiguación intracelular.
5 Si el ph es 7.35 significa que la concertación de H+ aumentó por lo tanto tiene que incorporarlo a la célula y la mayor posibilidad que tiene ese H+ en la célula es unirse a proteínas, y como estas son mas abundantes en intracelular la capacidad amortiguadora será mucho mas grande que en el extracelular. Y por eso entre mas H+ haya fuera de la célula mas entrara y mas importante es la amortiguación intracelular. SUSTANCIAS AMORTIGUADORAS: Las sustancias amortiguadoras que son aquellas capaces de ceder o captar H+ según sea el ph. Se pueden diferenciar en : Sustancias buffer que es el sistema NaHCO3 / H2CO3 Sustancias anfóteras que son proteínas. Porque es importante hacer esta diferenciación?? Habíamos dicho que la proteínas al captar H+ lo único que cambia es su ionizacion.. se hace menos negativa En cambio en el sistemas buffer sucede que en un medio acido, el acido va a reaccionar con el bicarbonato y el bicarbonato se gasta, por lo tanto cada vez que el organismo amortigua una molécula de acido pierde un bicarbonato y ese bicarbonato desaparece. En cambio la proteína sigue allí, podrá ser menos negativa pero esta presente. Entonces cuando comienzan a disminuir los H+ extracelular la proteína va entregar de apoco los hidrigeniones hacia el extracelular. De esta forma se vuelve al estado normal y la proteína queda disponible para unir otros H+ en posteriores eventos de acidosis. Por lo tanto se dice que por efecto de la amortiguación que el la proteína cambia su estado de ionizacion y el bicarbonato se gasta como estructura química, también es cierto que ambos pueden reducir su capacidad amortiguadora. Pero la proteína puede entregar fácilmente sus H+ y recuperar su capacidad amortiguadora, en cambio el bicarbonato se gasta y el organismo debe sintetizarlo, de esto se encarga el riñón. El sistema buffer. Esta formado por un acido débil y una sal conjugada y de acuerdo a la ley de acción de masas : cuando una sustancia reacciona en un medio liquido, por ejemplo un acido. va a ionizarse produciendo H+ y produciendo un anion, si H2CO3 (acido carbónico) va a producir un H+ y bicarbonato. eso va a ocurrir hasta que se alcance la condición de equilibrio y cuando se alcance el equilibrio ya no va a ver una velocidad de reaccion en el sentido de formar H+ y anion, que es alta, sino que se va a transar el equilibrio, por lo tanto por cada molécula que se ionice, se transforme en H+ y anion va haber un H+ y anion que va a formar la molécula de estado molecular, o sea ya se alcanzó una constante. No hay variación de los componentes de esta reacción. Va haber una cierta fracción que va a estar en estado molecular y un cierto porcentaje que va estar en estado ionizado y eso se va a mantener constante, y eso es lo que da origen a la constante de ionizacion. Ahora el calculo de la constante de ionizacion es lo que esta en ESTADO MOLECULAR va a dividir los componentes que estaban en estado ionizado: K = [H+] [A-] [HA] SISTEMA BUFFER : ACIDO DEBIL / BASE CONJUGADA 1 HA H + + A - K = [H+] [A-] 2 [HA] - K: CONSTANTE DE IONIZACION ACIDO DEBIL: HA H+ + A- ACIDO FUERTE: HA H+ + A- Por tanto si una sustancia en particular tiene una constante de ionización baja significa que la mayor parte va a quedar en estado molecular, va a alcanzar el equilibrio cuando este la mayor parte este en estado molécular. Este factor va hacer alto y si yo divido el producto por un valor alto me va a dar una constante de ionizacion que es baja.
6 Entonces K es la constante de ionización y vamos a ver ahora lo que ocurre con un acido debil con respecto a la constante de ionizacion (Diapo N 9) el tamaño de las letras estan indicando que un acido debil cuando alcanza su estado de ionizacion. La composición esta en estado molecular y muy poco en estado ionizado. Esta es una característica que tiene el acido carbónico. El acido carbónico cuando alcanza su constante de ionizacion, el equilibrio, la mayor parte esta en estado molecular y muy poco esta ionizado. Por qué es impotente que se mantenga ionizado? Por que el acido cuando mantiene su estructura no incide sobre el ph. Lo que modifica el ph es la concentración de H+ libre, por lo tanto un acido débil es un acido que tiene un ph que no es muy bajo, es literalmente acido pues es inferior a ph 7, pero no los es tanto como una acido fuerte en que la mayor parte de sus elementos terminan siendo ionizados. El HCl tiene un ph mucho mas bajo que el ac. Carbonico, el a. sulfúrico tiene un ph mucho mas alto que el carbónico, el ac. Láctico es mas acido que el carbónico, el acido fosforito es mas acido que el carbónico porque son acidos fuertes en que la mayor parte del equilibrio, cuando se alcanza, están casi completamente ionizados. El H+ libre es el que se considera para medir ph y si es mas acido hay mas H+ libre. Por eso es importante que en el sistema buffer el acido que participa como acido no sea uno que modifique el ph o que el efecto sobre el ph plasmático sea bajo. Por ello un componente el sistema buffer debe ser un acido débil. Existen dos elementos importantes, uno es la acidez actual que es la que mido en una solución, el ph de esa solución va a estar de acuerdo a la concentración de hidrogeniones libre que exista. Si el ph de esa solución es bajo significa que la concertación de H+ libre es alta. Si el ph no es muy bajo, como sucede con el ac. Carbonico, en este caso se produce poco H+ libre cuando reacciona, por lo tanto se dice que tiene acidez actual baja. No genera un efecto importante en el ph de la solución en la que se encuentra, pero sin embargo tiene una ventaja en que la mayor parte esta en estado molecular y pude aportar hidrogeniones al medio y eso es lo que se conoce como acidez potencial. El ac. Carbonico va a producir H+ y bicarbonato hasta que alcance el equilibrio, cuando eso ocurra la mayor parte - ACIDEZ ACTUAL - ACIDEZ POTENCIAL ACIDO DEBIL: del elemento va a estar en estado molecular y muy poco ionizado, por lo tanto si aporta muy poco H+ al medio produce menos acidez por eso es que se dice que tiene una acidez actual baja. Acidez actual: ph que se mide en la que están los hidrógenos libres. Acidez potencial: no se puede medir el Ph, los hidrógenos están asociados. HA H+ + A- ACIDEZ POTENCIAL ALTA ACIDEZ ACTUAL BAJA La mayor parte va a estar en estado molecular y eso da la acidez potencial por que? Porque si por alguna razón, por ejemplo, se vierten los hidrogeniones al medio (en paciente que tiene vomito, que pierde contenido ácido y pierde ácido clorhídrico) y el ac. Carbonico esta en una constante, saco hidrogeniones de un sistema, se va a alterar la constante de este y lo que hará el sistema es que a partir del ácido carbónico (este esta en una estado molecular alto) producirá más H+ y mas bicarbonato, hasta que nuevamente se alcanza la constante de ionizacion. Cómo el organismo logro tener mas hidrogeniones? cuando se pierden los hidrogeniones, es a partir del ac. Carbonico que potencialmente puede aportar hidrogeniones y por lo tanto puede acidificar. A eso se refiere la acidez potencial. Ahora si la perdida de hidrogeniones es hacia allá generalmente significa alcalosis, hacia el exterior va a producir alcalosis, entonces una posibilidad de recuperar hidrogeniones es que el ácido carbónico aporte mas hidrogeniones al medio, por lo tanto ahi esta ocupando su capacidad de acidez potencial. Un ácido clorhídrico prácticamente entrega todos los hidrogeniones al medio, por lo tanto no tiene ninguna posibilidad de guardar potencialmente acidez, genera un acidez actual muy alta y una acidez potencial muy baja.
7 Lo otro importante es que la misma posibilidad que tiene el ac. Carbonico de ionizarse en H+ y bicarbonato tiene de producir CO2 y generar agua, por lo tanto si se pierde H+ (por ejemplo por vómito. Perdida de agua y HCl) y eso genere alcalosis, una manera de recuperar el H+ es que el ac. Carbonico genere más hidrogeniones y una manera de mantener el ac. Carbónico es que CO2 con H2O formen mas ac. Carbónico y una manera de aumentar el CO2 es que el pulmón HIPOVENTILE. Si hipoventila, retiene CO2: CO2 + H2O H2CO3 El H2CO3 produce mas hidrogeniones y estos son los que tratan de compensar aquellos que se han perdido: Pulmón Hipoventila pco2 H2O + CO2 HCO3 H+ H2CO3 Compensa Si aumento la concentración de H+, esto va a cambiar la constante de ionizacion. El H+ se va a unir a bicarbonato, va a formar aci. Carbónico se va producir mas CO2 y en ese caso el resultado debería ser hiperventilar, así se logra disminuir la presión de CO2, pero yo no puedo decir que hiperventilo para generar alcalosis respiratoria sino que lo hace porque, bajando el CO2 pude de alguna manera generar un efecto regulador. Pulmón H+ H+ H+ hipérventila pco2 H2O + CO2 HCO3 H+ H2CO3 Por que el organismo no produce AC. Láctico, si esta es una vía mas rápida? Cuando uno dice que la acidosis metabólica la compensa generando alcalosis respiratoria, es un error gravísimos. Porque cuando hay acidosis metabólica habrá mayor ácido carbónico si tiene mas ácido carbónico el pulmón va hiperventilar para eliminar el CO2, el resultado es que el CO2 este bajo y algunos dicen, eso es alcalosis respiratoria, entonces dicen una acidosis metabólica se compensa con una alcalosis respiratoria.. Pero esto no es así, pues una cosa patológica no se compensa con otra patológica. Ahora por una lado se esta perdiendo un exceso de hidrogeniones y por otro lado se esta produciendo un exceso. Si tiene vomito va perder un agran cantdad de agua y a la larga va a llevar a un acidosis láctica., pero no se va realizar esto para compensar sino que se produce porque hay una baja de perfusión en el tejido. Entonces la acidosis activa va a ser una consecuencia de la pérdida de agua y no necesariamente se va generar para adicionar más H+ al medio, porque seria complicado para el organismos, que luego de haber tenido un alcalosis toga que pasar a la otra parte que es una acidosis. Lo normal es que si tiene alcalosis, equilibre el sistema y lo lleve a una condición normal y no pasarla al otro extremo. Una alcalosis por vomito y que pude llevar a una acidosis láctica es cierto. Con respecto al concepto de ph, la ecuación esta relacionada con la ecuación de HENDERSON- HASSELBALCH. ph = pk + log [BASE] donde el pk es el log de la constant de ionizacion. [ACIDO] La base es bicarbonato (considerando el sist. Más importante en el extracelular) El ácido es el ac. Carbónico Cuando se habla de pk.. El ácido tiene su constante de ionizacion (K), el bicarbonato de sodio que es la otra parte del sistema también tiene su constante de ionizacion, pero cuando se toman en conjunto se van a relacionar las constantes de ionizacion porque tiene un elemento que es común para los dos. Por lo tanto cuando se modifique la constante de ionizacion del ácido se va a modificar la K de la base (y viceversa) y como hay una incidencia entre los dos es que se habla de pk del
8 sistema buffet el cual es igual al ph en que la relación ácido base es 1:1. Es decir la misma cantidad de acido que de base, eso para el sistema buffet NAHCO3/H2CO3 tiene un valor de 6.1. lo que significa a que ha ph = 6.1 la relacion acido-base es 1:1. El ph plamatico es 7.4, por lo tanto debería haber mas base. Sin en teoria el ph es 5.5 deberia haber mas acido según la Diapo N 12 la relacion de base-acido es de 20:1. Mejor explicado: el pk en el fondo.. Como hay una K para cada elemento y cuando están solos es importantes la K de cada uno por si solo. Pero en este caso se van a encontrar cada en uno en la misma solución por lo tanto, tienen un elemento en comun en ese momento la K del sistema va ser una y va a depender del pk. Entonces cuando uno dice que la concentración de ácido es la misma que de la base entonces se dice que el sistema esta actuando en su pk buffer. * SISTEMA BUFFER NaHCO3 / H2CO3 pk: 6,1 ph= 6,1 + log [NaHCO3] = 24 = 20 BASE RIÑON [H2CO3] 1,2 1 ACIDO PULMON PCO2 x 0,03 ph= 6,1 + log 20 ph= 6,1 + 1,3 ph = 7,4 ph PLASMÁTICO SE MANTIENE CONSTANTE CUANDO LA RELACIÓN NaHCO3 : H2CO3 ES 20 : 1 A.C H2O + CO2 H2CO3 H+ + HCO3- REGULACIÓN PULMON REGULACIÓN RENAL Porque es importante que la realcion sea 1:1 y por que se dice que en ese caso el sistema esta actuando en su pk buffer?? Porque se supone que cuando la relacion es 1: 1 un sistema buffer alcanzaría su maxima efectividad como sistema amortiguador. O sea si es que el ph plasmático pudiese llegar a 6.1 el sistema NaHCO3/H2CO3 alcanzaria su máxima efectividad como sistema amortiguador. Pero a ph 7.4 resulta que la concertación de bicarbonato es 24 Mkb/ lt y el ac. Carbonico estimado por la presión de CO2 que son 40 m3 por la constante de solubilidad de gas, que en este caso es la multiplicación 40x0.03= 1.2. Ahora las relacion siempre son 1: algo y para llegar a esta relacion lo que se hace, se transforma y se llega a que la relacion 20:1(base: acido). La pregunta es: si el sistema buffer es más eficiente en su pk con relación 1:1. Qué hace que el sistema NaHCO3/H2CO3 teniendo una relación 20:1 sea el sistema mas importante y mas eficiente para amortiguar el extracelular? Porque si fuera de relación 1:1 desde el punto de vista químico seria la relación ideal para efectos de amortiguador, entonces si yo le adiciono ácido la variación que se produce entre ambos es mínima y por lo tanto el efecto que va generar sobre el ph será menor, pero aca es 20:1 y aun asi sigue siendo el mejor sistema amortiguador esto es favorable porque: 1. es mejor que exista mas base pues el organismo tiende a formar mas ácidos, por eso es que responde mejor a la acidosis, pues tiene 20 veces mas base que ácido 2. porque hay sistemas amortiguadores cerrados y abiertos. Uno abierto es cuando un organismo puede generar influencia sobre ese sistema y en este caso la base pude ser regulada por el riñón, este elimina bicarbonato de sodio o pude retener si falta. El riñón genera un efecto importante en los valores de bicarbonato. Es el riñón el que constituye el elemento externo que influencia. Para el ácido depende la respuesta pulmonar. Hipventilando se retiene e hiperventilando de elimina La cantidad de ácido que tiene el organismo d acuerdo a su sistema buffer es bajo porque el efecto que puede generar el pulmón es mas rápido que el efecto que puede generar el riñón. Otra cosa es que cuando uno termina de hacer el calculo del ph., ya les habia mencionado que se puede hacer midiendo bicarbonato y medir CO2 los dos sirven pa calcular el ph. Uno sabe que la constante PK del sistema es 6.1 y que el logaritmo es 20.3 y por lo tanto si la relación es 20:1, siempre el ph debería ser 7.4. Lo que significa que si ponemos los valores reales (24, 1.2) sabemos que da una relación 20:1. Cuando el organismo tiene mucha base, por una lado trata de eliminar esa base y pero también trata de aumentar el acido para llegar lo mas rapido posible a una relacion de 20:1, y
9 cuando por ejemplo disminuye la base, el organismo disminuye el acido para llagar luego a la relacion normal. En fondo es llegar a los valores nomales del bicarbonato de del CO2 y del ac. Carbonico. Cuando se habla de amortiguación, y cuando se debe hacer hacia un ac. Fuerte (ac. Lactico, fosforico, sulfurico cetoacidos),si en algún momento si aumentan estos ácidos se producirá acidosis, el primer mecanismo químico que realizara será la amortiguación, por ejemplo el ac clorhídrico, este reacciona con el bicarbonato y se producirá una sal de ácido fuerte (ClNa) y dos ac. Carbónicos. Estos dos ácidos igual me indican acidez pero de efecto menor a que estuvieran los H+ como HCl. Lo que hace el amortiguador es transformar el ac. Fuerte en ac. Débil. Si fuera la reacción con ac. Láctico se formaría lactato de sodio y 2 bicarbonato de Na. Si es ac. Sulfúrico, se forma sales de fosfato + 2HCO3. si es un cetoacido será sales de cetoacidos + 2HCO3. El resultado de todo esto es que aumentamos el ácido y modificamos la relación 20:1. Tendremos más aci. Carbonico y mas bicarbonato.. Entonces actuaran los mecanismos de eliminación: El ac,.c arbonico se eliminara disociandolo en CO2 + H2O y le CO2 se elimina por el pulmon- hiperventila El bicarbonato que se gasto se recupera por el riñón. Estos dos mecanismos llevan a una condición normal de ph, esto puede tomar un poco de tiempo. Si se debe amortiguar una base fuerte, el organismo trata de transformarla en una base menos fuerte, como es el NaOH, este ingresa y se amortigua con el ácido Y el resultado es que aumentamos la concentración AMORTIGUACIÓN DE UN ÁCIDO: ACIDOSIS de base, pero ahora será mas débil y el efecto será menor a cuando era solo NaOH. El ácido carbónico se gasto y entonces la manera de recuperarlo es hipoventilando, así se NaHCO3 + H2CO3 + HCl NaCl + 2 H2CO3 retiene CO2 este rxna con H2O y foman H2CO3. Tenemos exceso de bicarbonato y se elimina por el riñon no se puede quedar pues si se queda se AMORTIGUACIÓN DE UNA BASE: ALCALOSIS NaHCO3 + H2CO3 + NaOH 2 NaHCO3 + H2O mantendría la alcalosis. Lo que hizo el efecto amortiguador fue reducir a variación de ph hacia el lado alcalino, pero sigue habiendo alcalosis por lo tanto se elimina por el riñón pues este órgano es muy eficiente eliminándolo. Cuando uno habla de la K de la base y del ácido uno la puede representar de la siguiente manera. Si ingresa H+ al sistema esos hidrogenines tendrán que reaccionar con bicarbonato, formando ac. Carbónico, entonces el K del ac. Carbonico es formar ac. Carbonico en estado molecular. Esto lleva a que aumente el ácido carbonico, y este qu estaba en equilibrio con el CO2 y el agua, tendera a formar mas CO2 y agua. Y si aumenta el CO2 este se elimina por pulmón. Para poder amortiguar el H+ se esta usando una cantidad considerable de bicarbonato Na del plasma y este tiende a disminuir por lo que su pk se modifica. Tiende a formas Na bicarbonato Aumenta el ácido, disminuye el bicarbonato pues se gasta. Esto es así pues (en un contexto general) cuando aumenta ac. Carbonico, aumenta el CO2 y se hipeventila, lo que lleva que reducir el ac. Carbónico que hay, pero también para amortiguar el H+ se va ocupar mucho bicarbonato, por lo tanto la K del bicarbonato de Na tendera a formar bicarbonato y Na, por lo tanto lo que esta en estado molecular como bicarbonato de Na deberia disminuir. Si uno mide aca como bicarbonato de Na y bicarbonato puro, ambos estaran disminuidos.
10 Las sustancias anfóteras son las proteínas plasmáticas como intracelulares.las proteínas generan el efecto amortiguador cuando modifican su estado ionización al captar H+. Las sust. Anfóteras son importante en la amortiguación intracelular. Dentro de la amortiguación intracelular se produce amortiguación en el eritrocito, este es la hemoglobina que amortigua CO2. Pero se vera que ingresa como CO2 pero termina en la Hb como H+, en cambio en otras células las proteínas intracelulares amortigua H+. Del total de CO2 plasmático el 90% ingresa al eritrocito y el 10 % queda a fuera y solo el 5% queda disuelto el cual esta representado como 40 mmhg. * SUSTANCIAS ANFÓTERAS: PROTEÍNAS CELULARES Y PLASMÁTICAS - AMORTIGUACIÓN INTRACELULAR: SUSTANCIAS INTRACELULARES a) ERITROCITO: Hb AMORTIGUACIÓN DE CO2 90% CO2 INGRESA A ERITROCITO 10% ES TRANSPORTADO EN PLASMA - 5% COMO C02-1% UNIDO A PROTEINAS - 4% COMO HC03- LA MAYOR PARTE DEL CO2 VIAJA HACIA EL PULMON COMO BICARBONATO. DEL 90% QUE INGRESO AL ERITROCITO EL 70-75% SALE DEL ERITROCITO COMO BICARBONATO. SE RECOMINDA COMENZAR EXPICANDO desde el tejido: El tejido siempre esta produciendo CO2 y lo difunde hacia el plasma por diferencia de presiones y del plasma difunde al eritrocito también por diferencia de presiones y además entra un 90% por la alta permeabilidad del eritrocito. Dentro de el va unirse a hemoglobina y finalmente producirá ac. Carbonico, lo mismo que producía fuera de la célula. El H+ se un a la Hemoglobina el bicarbonato sale hacia el plasma y finalmente de esa manera se va el CO2 hacia el pulmón. En este caso se hace intercambio anión ani: sale bicarbonato e ingresa cloro.. Continuación En base al esquema de la diapositiva número 15: Amortiguación intracelular de CO2: Hemoglobina (Hb) En el fondo cuando el cloro se mueve en el sentido de la célula por intercambio de bicarbonato la idea es generar un situación de equilibrio eléctrico es por eso que cuando sale el bicarbonato entra cloro, pero además de ingresar cloro ingresa agua, esta agua que la célula disponga de CO2 y así probablemente produzca más ácido carbónico. Una vez que se genera la unión H a la hemoglobina se dice que está amortiguado, se dice que esta amortiguación de co2 por qué no ingresa el hidrogeno a la célula si no que lo hace el co2 por lo tanto cuando uno dice el eritrocito amortigua co2 la verdad es que si pero lo que fundamentalmente lo que hace la Hb es unirse al H, aunque también es cierto que el co2 se une a la Hb y forma compuesto carbamínicos pero el % de esto es bajo, la mayoría del co2 se une al agua y forma ácido carbónico. Cuando el bicarbonato sale de la celula por este mecanismo una de las cosas que puede ocurrir es que el plasma se alcaliniza transitoriamente, el hecho de q entre agua al eritrocito hace que aumento su volumen.
11 En el pulmón se invierto todo, entra oxigeno a la celula este se une con la hb formando oxihemoglobina, por otro lado sale el cloro y el agua, entra bicarbonato (HCO3) se une al H que hay en la celula formando ácido carbónico, se obtiene el co2 libre que finalmente se elimina por el pulmón. Diapo 16 La amortiguación intracelular se puede producir como la forma que acabamos de ver o también a través de la amortiguación de H, se produce un intercambio de cationes, en este caso ingresa un hidrogeno y sale un K si es que hay acidosis, la situación sucede al revés si hay alcalosis con esto podemos decir que si hay acidosis hay hiperpotasemia y si hay alcalosis hipopotasemia. b) OTRAS CÉLULAS: INTERCAMBIO DE IONES (CATIONES) ACIDOSIS: ph [H+] LEC A. [H+] B. [K+] HIPERK - ACIDOSIS - ALCALOSIS H+ PROTEINAS K+ FOSFATOS Eliminación ALCALOSIS: ph [H+] LEC H+ PROTEINAS Pulmón: FOSFATOS Una vez que se acabó el mecanismo de B. [K+] K+ amortiguación, ya sea en el lec o en el lic por HIPOK medio de mecanismo buffer o de sustancias anfoteras viene el proceso de eliminación que es bastante simple sobre todo del punto de vista del pulmón, ya que si hay exceso de co2 hiperventila, esto lo hace en base a los niveles de co2 plasmático, ya que este el que estimula el centro respiratorio bulbar, no así el H o el ph esto por que el co2 no tiene carga y es liposoluble atravesando fácilmente la barrera hematoencefálica. Al otro lado de la barrera hematoencefálica el co2 se puede unir con agua formando ácido carbónico, el cual se hidroliza en H y bicarbonato, finalmente es el H el que estimula el centro respiratorio bulbar, pero por el H que se genero al otro lado de la barrera hematoencefálica. A. [H+] Entonces al hablar de hiperventilación, esta es estimulada por el centro respiratorio que capta la variación de H a nivel del LCR. Riñones: ELIMINA ÁCIDO FIJO, RESPUESTA LENTA PERO MAS EFECTIVA - EXCRECIÓN NETA DE H+ O HCO3- - REABSORCIÓN Y REGENERACIÓN DE HCO3- Debe ser el órgano más importante para regular el ph, ya que todos los ácidos que n ose eliminan por el pulmón lo hacen por esta vía, es la mejor respuesta para mantener el ph pero es más lenta, lo que hace es generar excreción neta de H, si hay ácidos los elimina y mantener bicarbonato si hay alcalosis al revés El bicarbonato se reabsorbe a nivel del TCP, porque tiene acción de anhidrasa carbónica, pero hay un nivel máximo de transporte, si se ve superado este se produce a eliminar por la orina. La [ ] de bicarbonato filtrado depende de la cantidad de bicarbonato plasmático si uno aumenta lo otro también.
12 La acidez neta considera dos elementos, acidez titulable y la excreción de amonio, el riñón privilegia que Na reabsorbe, tiene que elegir entre el Na asociado a cloro o a bicarbonato, el organismo lo primero q elige es el segundo ya que el Na tiene que mantener el volumen, y eso lo logra con el efecto osmótico del Na además le interesa mantener el ph y esto lo hace gracias al bicarbonato. Cuál segmento del riñón es más eficiente absorbiendo y secretando? La respuesta a estas dos preguntas es el TCP Diapo 20: REABSORCIÓN DE NaHCO3: T.C.P. Todas las células en su metabolismo tiene co2 y agua y por la acción de anhidrasa carbónica pueden producir ácido carbónico, cuando aumenta mucho su [ ] no puede mantener todo en estado molecular y se ioniza en H y bicarbonato, el primero puede ser secretado por diversas vía y el segundo queda en el espacio intersticial y después pasa al plasma. Lo que le interesa al organismo es generar la reabsorción de sodio, lo que hace es incorporarlo a la celula, y después lo saca al plasma por medio de la bomba Na/K, por cada sodio que sale se secreta un hidrogenión, este se une al bicarbonato formando ácido carbónico el que se transforma en agua y co2, el agua se absorbe el co2 difunde hacia el plasma y es eliminado vía pulmonar. Por que se hablara de reabsorción de bicarbonato de sodio si el que se filtró no es el mismo que pasa a la sangre? El ión bicarbonato se reabsorbió como tal? No. Como condición de equilibrio se puede decir que si ya que se filtra un bicarbonato y se secreta uno hacia el plasma pero no es el mismo ya que puede estar formado por otros carbonos. Lo que busca este mecanismo no es aumentar la cantidad de bicarbonato si no mantenerla. Pregunta: Cuando el organismo genera esta actividad acidifica la orina? Se secretan H hacia la orina, pero no la acidifica. El organismo necesita que los hidrogeniones no queden libres ya que una ves k se reabsorbe todo el bicarbonato posible en el TCP (95%) y los hidrogeniones van siendo secretados al lumen tubular se va a producir un gran aumento de H en el lumen y ya no se van a poder seguir secretando. Cuando el ph en el lumen alcanza los 4.8 o 4.5 ya no se puede seguir con la secreción. A continuación veremos los mecanismos que hacen que el H se una a una molécula para que así esté en estado libre y no se produzca un descenso tan brusco en el ph Cuando hablamos de acidez neta nos referimos a la cantidad de hidrogeno que esta asociada, por ejemplo la orina puede tener mucha acidez neta porque en ella hay mucho fosfato y amonio. Un paciente con insuficiencia renal puede tener en la orina un ph ácido por que tiene mucho H libre, si yo mido su acidez neta el fosfato y amonio no están presentes, el H libre se produce por que ya no se puede secretar más hacia el lumen tubular como ya vimos, la idea es generar acidez neta acoplando el H con otras moléculas.
13 Pregunta: Si la acidez neta esta elevada, se supone que son los hidrógenos asociados, entonces Por qué el ph esta elevado? Tienen que pensarlo así, les pongo el ejemplo del ácido carbónico, este ácido tienen k mantenerse constante y por eso parte de el tiende a ionizarse, lo mismo pasa con el fosfato o con el amonio, no todo esta en estado molecular, la parte ionizada aporta algo de H al medio, aporta menos que si la sustancia no existiera, pero igual suma. Toda sustancia tiene una constante de ionización y de acuerdo al ph que tenga la orina va a favorecer hacia el lado molecular o el ionizado, en el caso del fosfato, el ph de la orina tiende a llevarlo hacia el lado molecular, por esto aporta pocos H al medio, pero igual el ph de la orina podría descender por esta razón. Diapo 21: EFECTO DE LA PaCO2 SOBRE LA REABSORCION RENAL DE HCO3 En el gráfico se puede ver que a medida que aumenta la presión parcial de co2 aumenta también la reabsorción de bicarbonato Que pasa si aumenta la presión de co2 en el plasma? El co2 que esta dentro de la celula tubular puede salir por diferencia de presión? NO Su alternativa es formar ácido carbónico, generar hidrogeno y bicarbonato si puede secretar más H puede reabsorber más bicarbonato. Este sistema tiene un límite, se puede saturar. Diapo 23: Titulación del Buffer fosfato Urinario Cuando todo el bicarbonato es absorbido en el TCP empiezan a haber otros mecanismos que son capaces de eliminar H, actúan a nivel del TCD, el caso del fosfato, genera acidez titulable y acidez neta. La diferencia entra una y otra es que como su nombre lo indica la primera se puede titular, que quiere decir esto, que por ejemplo yo tengo orina en un envase, coloco un aparato para medir el ph en su interior y comienzo a agregar hidróxido de sodio hasta lograr un ph de 7.4, por que yo asumo que el fluido al ser filtrado tenia este ph ( antes de que se le agregaran los H que hacen ácida la orina), la acidez neta va a ser la cantidad de hidróxido de sodio que le debo agregar a la orina para lograr el ph de 7.4. Mientras más hidróxido de sodio se le agrega va a tener más acidez neta y por ende más fosfato, pero no cualquier fosfato, si no que fosfato monosódico. En el organismo generalmente se filtra como fosfato disódico y el túbulo lo transforma a fosfato monosódico, le saca un sodio y le agrega un H, este mecanismo sirve para eliminar H asociándolos Otra función importante de estos mecanismos es que nos permiten regenerar bicarbonato, en la foto podemos ver en el lumen tubular fosfato disódico, se le saca un sodio y queda monosódico, en el
14 lumen tubular no había bicarbonato pero después de la absorción del sodio va a pasar hacia el plasma un bicarbonato, este si va a sumar, antes se habían perdido bicarbonatos en la amortiguación, gracias a este mecanismo se van regenerando Por que el fosfato sirve como un elemento para eliminar hidrogeniones? El riñón reabsorbe fosfatos en el TCP, si no es ahí se pierde. Lo reabsorbido llega al TCD, al fosfato disódico se le saca un sodio y se le agrega un H y así se van eliminando. En el plasma hay de los dos tipos de fosfato que ya hemos mencionado, pero el que se encuentra en mayor cantidad es el disódico a ph 7.4 la relación es 1:4 en comparación con el monosódico. Este mecanismo depende solo de la filtración, cuando hay IR es el que más tarde desaparece dentro de los mecanismos que nos permiten amortiguar la orina. Diapo 25: secreción de amonio:tdc Acidez neta en la orina Regenera HCO3 Funciona en el TCD y es el mecanismo más importante para producir acidez neta en la orina y además regenera bicarbonato. A ph 7.4 el fosfato produce un 33% de la acidez neta y el amonio 66%, este ultimo entonces es el más importante para regular la acidez neta, la mayoría de los H que se eliminan por la orina lo hacen asociados a el. Cuando el ph es menor a 7.35, es decir, en acidosis se modifica en parte esta relación, el fosfato produce un 25% o menor y el amonio un 75% o mayor, esto significa que el mecanismo asociado al amonio es el mejor eliminando H y más aun en estados de acidosis. NaCl NH4Cl TCD SECRECION DE AMONIO TCD Este mecanismo del riñón es muy bueno, pero es lento, ya que esta acción puede tardar entre 3 y 5 días, además necesita que la celula tubular este sana, si esta dañada la excreción de amonio es deficiente. La celula necesita de aminoácidos para producir amoniaco (NH3), el que usa en este caso es la glutamina, al tener el amoniaco se uno un hidrogenión y se transforma en amonio (NH4). El amoniaco es un gas soluble, que atraviesa bien las membranas El amoniaco no puede pasar hacia el plasma ya que la cantidad de hidrogeniones que se están formando es tan alta que prácticamente todo el amoniaco se transforma inmediatamente en amonio y la única posibilidad que el amonio se mueva es en forma activa y solo lo hace hacia el lumen tubular ya que hacia el plasma no hay receptores de amonio, a diferencia del amoniaco que difunde muy fácilmente en ambos sentidos. Entonces como conclusión de este mecanismo se puede decir que en condiciones de ph ácido la cantidad de glutamina que se produce es mayor, por ende se produce más amoniaco, al entrar en contacto con la alta cantidad de H que hay se genera más amonio y se elimina más cloruro de amonio por la orina, entonces, mientras más hidrogeniones se generan más se eliminan A ph 7.4 habrá más amonio que amoniaco, a ph 5 se puede encontrar un amoniaco por amonio, decir un H libre por cada asociados. Mientras más acidez más se asocia los H.
15 Alteraciones del equilibrio ácido-base Se pueden diferenciar en alteraciones que se producen en el metabolismo o también de acuerdo a las variaciones que se producen en el ph, nosotros veremos la ultima por que la mayoría de las veces las alteraciones en el ph son acidosis, las alcalosis son poco comunes.
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
Pauta de corrección guía IV medio Homeostasis
 Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS
 EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
Cátedra de Fisiología Humana CAPÍTULO I CAPITULO III. Equilibrio Acido Base PH. Carrera de Enfermería. Universidad Nacional del Nordeste
 CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Concepto de ph. Bases
 Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
1. Líquidos corporales. 2. Anatomía y función renal. 3. Hormonas ADH y aldosterona
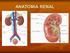 1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D.
 Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D. Vallejos Javier Serial Marcos Sebastián Rausch Ricardo Simón Laura Solé Juan
Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D. Vallejos Javier Serial Marcos Sebastián Rausch Ricardo Simón Laura Solé Juan
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Concepto de ph. ph = - log [H + ]
![Concepto de ph. ph = - log [H + ] Concepto de ph. ph = - log [H + ]](/thumbs/39/19109627.jpg) Fuerza de Ácidos y Bases Concepto de ph Ácidos Los ácidos se diferencian de acuerdo a su capacidad para ceder protones al medio, o químicamente dicho, por su capacidad de disociación, esa también es la
Fuerza de Ácidos y Bases Concepto de ph Ácidos Los ácidos se diferencian de acuerdo a su capacidad para ceder protones al medio, o químicamente dicho, por su capacidad de disociación, esa también es la
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
Alteraciones de los Fluidos Corporales, Electrolitos
 Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2010 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 010 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE Junio, Ejercicio 6, Opción A Junio, Ejercicio 4, Opción B Reserva 1, Ejercicio 4, Opción A Reserva, Ejercicio 5, Opción
Ventilación Pulmonar. -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón
 Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
COLEGIO SAN FRANCISCO JAVIER GUIAS
 COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
Manejo práctico del riego en cultivo sin suelo
 Manejo práctico del riego en cultivo sin suelo Domingo Ríos Mesa Belarmino Santos Coello agosto 0 2012 El manejo del riego es el factor más importante en el manejo de un cultivo sin suelo, siendo en la
Manejo práctico del riego en cultivo sin suelo Domingo Ríos Mesa Belarmino Santos Coello agosto 0 2012 El manejo del riego es el factor más importante en el manejo de un cultivo sin suelo, siendo en la
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES
 GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
GUÍA DE EJERCICIOS CONCEPTOS FUNDAMENTALES Área Resultados de aprendizaje Identifica, conecta y analiza conceptos básicos de química para la resolución de ejercicios, desarrollando pensamiento lógico y
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO
 FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2006 Ximena Páez TEMA 11 I. ABSORCIÓN AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABSORCIÓN MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN I.
FISIOLOGIA MEDICINA FISIOLOGÍA DEL APARATO DIGESTIVO 2006 Ximena Páez TEMA 11 I. ABSORCIÓN AGUA Y ELECTROLITOS II. SECRECIÓN ELECTROLITOS III. ABSORCIÓN MINERALES, VIT HIDROSOLUBLES IV. MALABSORCIÓN I.
Aparatos que intervienen en la nutrición
 Aparatos que intervienen en la nutrición El ser humano necesita ingerir alimentos y agua diariamente, para el mantenimiento de sus constantes vitales. De los alimentos se utilizan distintos nutrientes,
Aparatos que intervienen en la nutrición El ser humano necesita ingerir alimentos y agua diariamente, para el mantenimiento de sus constantes vitales. De los alimentos se utilizan distintos nutrientes,
Un adulto sano, suele ser capaz de mantener los equilibrios hidroelectrolíticos y ácido-base.
 BALANCE HIDRICO BALANCE HIDRICO Para conservar la salud y mantener las funcíones corporales, es necesario un EQUILIBRIO líquido, electrolítico y ácido báse. El requerimiento es: aporte y eliminación armónico
BALANCE HIDRICO BALANCE HIDRICO Para conservar la salud y mantener las funcíones corporales, es necesario un EQUILIBRIO líquido, electrolítico y ácido báse. El requerimiento es: aporte y eliminación armónico
Departamento de Ciencia y Tecnología QUIMICA 1. Comisión B. Dra. Silvia Alonso Lic. Evelina Maranzana
 Departamento de Ciencia y Tecnología QUIMICA 1 Comisión B Dra. Silvia Alonso (salonso@unq.edu.ar) Lic. Evelina Maranzana (emaran@unq.edu.ar) ACIDEZ-BASICIDAD: EL YING-YANG YANG DE LA QUIMICA Dra Silvia
Departamento de Ciencia y Tecnología QUIMICA 1 Comisión B Dra. Silvia Alonso (salonso@unq.edu.ar) Lic. Evelina Maranzana (emaran@unq.edu.ar) ACIDEZ-BASICIDAD: EL YING-YANG YANG DE LA QUIMICA Dra Silvia
SALES MINERALES , CO 3. Aniones: Cl -, PO 4. , NO 3, Cationes: Na +, Ca 2+, Mg 2+, Fe 2+, Fe 3+, K +
 SALES MINERALES Aniones: Cl -, PO 4 3-, CO 3 2-, NO 3, Cationes: Na +, Ca 2+, Mg 2+, Fe 2+, Fe 3+, K + SALES PRECIPITADAS Vieira SALES PRECIPITADAS: CaCO 3 Exoesqueleto de Ca Sales de Ca: caparazones
SALES MINERALES Aniones: Cl -, PO 4 3-, CO 3 2-, NO 3, Cationes: Na +, Ca 2+, Mg 2+, Fe 2+, Fe 3+, K + SALES PRECIPITADAS Vieira SALES PRECIPITADAS: CaCO 3 Exoesqueleto de Ca Sales de Ca: caparazones
MEDIO INTERNO HOMEOSTASIS. Estructura del medio interno. Se denomina asi al medio extracelular, el medio que rodea a las celulas
 MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
TEMA 8. ÁCIDOS Y BASES.
 TEMA 8. ÁCIDOS Y BASES. I. CONCEPTO. A lo largo del desarrollo de la teoría de ácido y base ha habido distintas definiciones desarrolladas por distintos científicos sobre estos conceptos. El primero en
TEMA 8. ÁCIDOS Y BASES. I. CONCEPTO. A lo largo del desarrollo de la teoría de ácido y base ha habido distintas definiciones desarrolladas por distintos científicos sobre estos conceptos. El primero en
LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO?
 LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO? En el tema anterior estudiamos que las sustancias nutritivas pasaban a la sangre desde el intestino delgado y el oxígeno
LAS FUNCIONES DEL APARATO CIRCULATORIO Ó PARA QUÉ SIRVE EL APARATO CIRCULATORIO? En el tema anterior estudiamos que las sustancias nutritivas pasaban a la sangre desde el intestino delgado y el oxígeno
Programa 3º Curso. Curso (Prof. M García-Caballero)
 Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos
 TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
TEMA 2 CONCEPTOS BÁSICOS Cálculos estequiométricos ÍNDICE 1. Ecuaciones (reacciones) químicas 2. Cálculos estequiométricos. Reactivo limitante y reacciones consecutivas 3. Pureza de un reactivo 4. Rendimiento
Fisiología y envejecimiento Aparato urinario. Tema 11
 Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
Resultado de aprendizaje:
 Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Volemia y Glóbulos Rojos
 UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE FISIOLOGIA ENFERMERIA Volemia y Glóbulos Rojos Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO.-Sangre
UNIVERSIDAD CENTROCCIDENTAL LISANDRO ALVARADO DECANATO DE CIENCIAS DE LA SALUD DEPARTAMENTO DE FISIOLOGIA ENFERMERIA Volemia y Glóbulos Rojos Lic. Ana López-Fonseca ana.lopez@.ucla.edu.ve CONTENIDO.-Sangre
GUÍA N 3: Equilibrio Químico y Cinética Química
 1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
1 PRIMERA PARTE: Ejercicios de desarrollo. 1.- Defina los siguientes términos: a) Reacción irreversible b) Reacción reversible c) Equilibrio químico d) Constante de equilibrio e) Principio de Le Chatelier
Lección 24. Fármacos Diuréticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS. Ricardo Brage e Isabel Trapero - Farmacología Lección 24
 Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Composición Líquido Elementos formes
 Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Composición Líquido Elementos formes Plasma Glóbulos blancos Glóbulos rojos Plaquetas Transporte de sustancias Homeostasis de los líquidos l corporales Protección TRANSPORTE O 2 desde los pulmones a los
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
GenoROOT Monitor del Metabolismo
 Product 3 GenoROOT Monitor del Metabolismo Para bajar de peso, usualmente las personas optan por alguna de estas opciones: Quemar más calorías a través del ejercicio físico, y/o Reducir/Controlar el consumo
Product 3 GenoROOT Monitor del Metabolismo Para bajar de peso, usualmente las personas optan por alguna de estas opciones: Quemar más calorías a través del ejercicio físico, y/o Reducir/Controlar el consumo
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS
 PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
PRACTICA #5 BIOLOGIA CELULAR VETERINARIA SOLUCIONES HIPERTONICAS E HIPOTONICAS OBJETIVO: Observar el efecto de las soluciones con diferente concentración de soluto en células sanguíneas. FUNDAMENTO: Todas
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre. La hemoglobina aumenta la capacidad de la sangre para transportar oxígeno.
 Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Transporte de oxígeno y de dióxido de carbono (CO 2 ) en la sangre La sangre transporta los gases respiratorios por todo el organismo. El O2 se transporta desde los pulmones hasta todos los tejidos del
Reacciones Ácido Base
 Reacciones Ácido Base Prof. Sergio Casas-Cordero E. sacce Contenido: (parte uno) 1. Definiciones 2. Equilibrio iónico del agua 3. Potencial de acidez; escala de ph 4. Fuerza de ácidos y bases 5. Medición
Reacciones Ácido Base Prof. Sergio Casas-Cordero E. sacce Contenido: (parte uno) 1. Definiciones 2. Equilibrio iónico del agua 3. Potencial de acidez; escala de ph 4. Fuerza de ácidos y bases 5. Medición
Tema 1. Introducción
 Tema 1. Introducción - Bioquímica: concepto, y objetivos - Importancia de la Bioquímica en la Lic. De Farmacia - Composición química del cuerpo humano: Bioelementos Bioelementos primarios o principales
Tema 1. Introducción - Bioquímica: concepto, y objetivos - Importancia de la Bioquímica en la Lic. De Farmacia - Composición química del cuerpo humano: Bioelementos Bioelementos primarios o principales
Enlace Químico. Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León
 Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Enlace Químico Colegio San Esteban Diácono Departamento de Ciencias Química Iº Medio Prof. Juan Pastrián / Sofía Ponce de León Objetivos u u u u u Comprender la interacción entre átomos a partir de su
Proteínas plasmáticas. Proteínas plasmáticas. Sales de litio 0% Ampicilina 18% Morfina 35% Aspirina 50% Fenitoína 90% Diazepam 98% Warfarina 99%
 Distribución Distribución y fijación de fármacos Paso del fármaco desde la sangre a los diversos tejidos La capacidad de los fármacos para distribuirse en el organismo va a depender de: a) Características
Distribución Distribución y fijación de fármacos Paso del fármaco desde la sangre a los diversos tejidos La capacidad de los fármacos para distribuirse en el organismo va a depender de: a) Características
Actividad: Cómo ocurren las reacciones químicas?
 Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
Cinética química Cómo ocurren las reacciones químicas? Nivel: 3º Medio Subsector: Ciencias químicas Unidad temática: Cinética Actividad: Cómo ocurren las reacciones químicas? Qué es la cinética de una
EJERCICIOS. UNIDAD 2. La nutrición humana.
 EJERCICIOS. UNIDAD 2. La nutrición humana. 1. El intercambio de materia y energía que todo ser vivo realiza con su medio, corresponde a la función de: a) Nutrición b) Relación c) Reproducción d) Adaptación
EJERCICIOS. UNIDAD 2. La nutrición humana. 1. El intercambio de materia y energía que todo ser vivo realiza con su medio, corresponde a la función de: a) Nutrición b) Relación c) Reproducción d) Adaptación
8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
Importancia del ph y la Conductividad Eléctrica (CE) en los sustratos para plantas
 2 Importancia del ph y la Conductividad Eléctrica (CE) en los sustratos para plantas Importancia del ph y la Conductividad Eléctrica (CE) en los sustratos para plantas ph El ph es una medida de la acidez
2 Importancia del ph y la Conductividad Eléctrica (CE) en los sustratos para plantas Importancia del ph y la Conductividad Eléctrica (CE) en los sustratos para plantas ph El ph es una medida de la acidez
Las enzimas. Interesante:
 Las enzimas Interesante: http://www.genomasur.com/lecturas/guia03.htm Las enzimas son catalizadores biológicos o biocatalizadores. Como tales: No se consumen en la reacción. No se alteran (sólo durante
Las enzimas Interesante: http://www.genomasur.com/lecturas/guia03.htm Las enzimas son catalizadores biológicos o biocatalizadores. Como tales: No se consumen en la reacción. No se alteran (sólo durante
El sistema respiratorio
 El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
El sistema respiratorio Así como es indispensable incorporar materia del medio, también es importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
E.E.T. Nº9. Físico-Química de 2do año. Guía Nº3. Profesor: Alumno: Curso:
 E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
E.E.T. Nº9 Físico-Química de 2do año Guía Nº3 Profesor: Alumno: Curso: Soluciones Una solución es un sistema homogéneo formado por dos o más componentes. En una solución formada por dos componentes se
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales. Verónica Pantoja. Lic. MSP.
 Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
RESPIRACIÓN AEROBIA Y ANAEROBIA
 RESPIRACIÓN AEROBIA Y ANAEROBIA Las células llevan a cabo diversos procesos para mantener su funcionamiento normal, muchos de los cuales requieren energía. La respiración celular es una serie de reacciones
RESPIRACIÓN AEROBIA Y ANAEROBIA Las células llevan a cabo diversos procesos para mantener su funcionamiento normal, muchos de los cuales requieren energía. La respiración celular es una serie de reacciones
CINÉTICA QUÍMICA. Dr. Hugo Cerecetto. Prof. Titular de Química
 CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
CINÉTICA QUÍMICA Dr. Hugo Cerecetto Prof. Titular de Química Temario 2) La reacción química: - Nociones de Termoquímica y Termodinámica. Conceptos de entalpía y entropía de reacción. Energía libre. Espontaneidad
METABOLISMO DE LIPIDOS
 METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
METABOLISMO DE LIPIDOS Al igual que en el metabolismo de los carbohidratos, el metabolismo de lípidos consiste en: Digestión Transporte Almacenamiento Degradación Biosíntesis DIGESTIÓN DE LIPIDOS Los lípidos
DIARREA o SÍNDROME DIARREICO. Prof. MARCOS MOREIRA ESPINOZA INSTITUTO DE FARMACOLOGIA y MORFOFISIOLOGIA UNIVERSIDAD AUSTRAL DE CHILE
 DIARREA o SÍNDROME DIARREICO Prof. MARCOS MOREIRA ESPINOZA INSTITUTO DE FARMACOLOGIA y MORFOFISIOLOGIA UNIVERSIDAD AUSTRAL DE CHILE DIARREA O SINDROME DIARREICO DEFINICIÓN: EVACUACIÓN DE HECES LÍQUIDAS,
DIARREA o SÍNDROME DIARREICO Prof. MARCOS MOREIRA ESPINOZA INSTITUTO DE FARMACOLOGIA y MORFOFISIOLOGIA UNIVERSIDAD AUSTRAL DE CHILE DIARREA O SINDROME DIARREICO DEFINICIÓN: EVACUACIÓN DE HECES LÍQUIDAS,
TEMA 7 ÁCIDOS Y BASES
 TEMA 7 ÁCIDOS Y BASES ÍNDICE 7.1. Concepto de ácido y base Teoría de Arrhenius Teoría de Brönsted-Lowry - Pares ácido-base conjugados 7.2. Fuerza relativa de los ácidos. Contantes y grado de disociación
TEMA 7 ÁCIDOS Y BASES ÍNDICE 7.1. Concepto de ácido y base Teoría de Arrhenius Teoría de Brönsted-Lowry - Pares ácido-base conjugados 7.2. Fuerza relativa de los ácidos. Contantes y grado de disociación
Guía para el docente
 Guía para el docente Descripción curricular: - Nivel: 3.º Medio - Subsector: Ciencias químicas - Unidad temática: Reactividad y equilibrio químico - Palabras clave: ácidos, bases, ph, acidez, basicidad,
Guía para el docente Descripción curricular: - Nivel: 3.º Medio - Subsector: Ciencias químicas - Unidad temática: Reactividad y equilibrio químico - Palabras clave: ácidos, bases, ph, acidez, basicidad,
SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA
 I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
I. CONTENIDOS: 1. Leyes de los gases. 2. Presión y temperatura. 3. Principio de Le Chatelier. 4. Constante de equilibrio. SESIÓN 13 EQUILIBRIO QUÍMICO EN FASE GASEOSA II. OBJETIVOS: Al término de la Sesión,
LOGO. Funciones del Hígado. Lic. Javier Céspedes Mata, M.E. 1
 LOGO Funciones del Hígado Lic. Javier Céspedes Mata, M.E. 1 Funciones del hígado Hígado En el adulto promedio, el hígado pesa 1,4 kg. Es el segundo órgano más grande del cuerpo. Se encuentra debajo del
LOGO Funciones del Hígado Lic. Javier Céspedes Mata, M.E. 1 Funciones del hígado Hígado En el adulto promedio, el hígado pesa 1,4 kg. Es el segundo órgano más grande del cuerpo. Se encuentra debajo del
Qué es la tensión arterial?
 Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
Qué es la tensión arterial? Cuando el corazón late, bombea sangre alrededor de su cuerpo para darle la energía y el oxígeno que necesita. La sangre se mueve y empuja las paredes de los vasos sanguíneos,
=0,32 moles/l. 0,32-x 0,32
 http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm 07/07/009 Química ªBachiller 1..Se preparan 0 m de una disolución de amoniaco diluyendo con agua m de amoniaco del 0.0 % en peso y de densidad 0.894
http://www.educa.aragob.es/iesfgcza/depart/depfiqui.htm 07/07/009 Química ªBachiller 1..Se preparan 0 m de una disolución de amoniaco diluyendo con agua m de amoniaco del 0.0 % en peso y de densidad 0.894
Trastornos del equilibrio ácido-base
 NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO.
 LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
LECTURA DIFERENCIA ENTRE METALES Y NO METALES POR SU COMPORTAMIENTO FRENTE AL OXÍGENO. Prácticamente todos los elementos conocidos, metales y no metales, reaccionan o son oxidados por el oxígeno formando
Clasificación de la materia hasta el nivel atómico
 1. Estequiometría Clasificación de la materia hasta el nivel atómico Materia puede separarse por un proceso físico? SÍ NO Mezcla es homogénea? Sustancia puede descomponerse por un proceso químico? SÍ NO
1. Estequiometría Clasificación de la materia hasta el nivel atómico Materia puede separarse por un proceso físico? SÍ NO Mezcla es homogénea? Sustancia puede descomponerse por un proceso químico? SÍ NO
Titulaciones en Química Analítica. Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D.
 Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
Titulaciones en Química Analítica Capítulo 13 CHEM 3320 Rosamil Rey Santos, Ph.D. Introducción En el análisis volumétrico, la concentración se determina midiendo su capacidad de reaccionar con un reactivo
SESIÓN 2 ESTUDIO DE LA ESTEQUIOMETRIA
 I. CONTENIDOS: 1. Ley de las proporciones definidas. 2. Ley de las proporciones múltiples. 3. Fórmulas mínimas. 4. Ecuación química. 5. Balanceo de ecuaciones químicas. SESIÓN 2 ESTUDIO DE LA ESTEQUIOMETRIA
I. CONTENIDOS: 1. Ley de las proporciones definidas. 2. Ley de las proporciones múltiples. 3. Fórmulas mínimas. 4. Ecuación química. 5. Balanceo de ecuaciones químicas. SESIÓN 2 ESTUDIO DE LA ESTEQUIOMETRIA
Capítulo 14: Equilibrio químico
 Capítulo 14: Equilibrio químico Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM 3002 Química general II, Cap. 14: Eq. químico p.1 Concepto
Capítulo 14: Equilibrio químico Dr. Alberto Santana Universidad de Puerto Rico Recinto Universitario de Mayagüez Departamento de Química QUIM 3002 Química general II, Cap. 14: Eq. químico p.1 Concepto
SEMINARIO: ESTUDIO DEL PH FETAL INTRAPARTO
 Fecha: 1 de Diciembre de 2010 Nombre: Dra. Ana Fuentes Rozalén R2 Tipo de Sesión: Seminario SEMINARIO: ESTUDIO DEL PH FETAL INTRAPARTO El objetivo de este seminario es que entendamos la fisiopatología
Fecha: 1 de Diciembre de 2010 Nombre: Dra. Ana Fuentes Rozalén R2 Tipo de Sesión: Seminario SEMINARIO: ESTUDIO DEL PH FETAL INTRAPARTO El objetivo de este seminario es que entendamos la fisiopatología
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 007 QUÍMICA TEMA 1: LA TRANSFORMACIÓN QUÍMICA Junio, Ejercicio 4, Opción A Junio, Ejercicio 5, Opción B Reserva 1, Ejercicio, Opción B Reserva, Ejercicio 5, Opción
FISIOPATOLOGIA. Concentración normal H+: 40 nmoles/l. -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3
 FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
Revisión- Opción Múltiple Procesamiento de energía
 Revisión- Opción Múltiple Procesamiento de energía 1. El mmetabolismo es considerado como las "reacciones químicas totales que ocurren dentro de un organismo". Estas reacciones químicas pueden estar vinculados
Revisión- Opción Múltiple Procesamiento de energía 1. El mmetabolismo es considerado como las "reacciones químicas totales que ocurren dentro de un organismo". Estas reacciones químicas pueden estar vinculados
UNIDAD 2. CINÉTICA QUÍMICA
 UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
UNIDAD 2. CINÉTICA QUÍMICA Introducción. Velocidad de reacción Cómo se producen las reacciones químicas Ecuación de la velocidad de reacción Factores que afectan a la velocidad de reacción Mecanismo de
Fisiología del evento ISQUEMIA / ANOXIA. Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira
 Fisiología del evento ISQUEMIA / ANOXIA Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira Porque cualquier miembro suelto, ya esté recubierto por piel o por carne,
Fisiología del evento ISQUEMIA / ANOXIA Rodolfo A. Cabrales Vega MD Docente Programa de Medicina Universidad Tecnológica de Pereira Porque cualquier miembro suelto, ya esté recubierto por piel o por carne,
Bases del Deporte Educativo
 Bases del Deporte Educativo BASES DEL DEPORTE EDUCATIVO 1 Sesión No. 8 Nombre: Energía para el ejercicio Contextualización Qué es la energía? La energía es lo que permite al cuerpo realizar movimientos
Bases del Deporte Educativo BASES DEL DEPORTE EDUCATIVO 1 Sesión No. 8 Nombre: Energía para el ejercicio Contextualización Qué es la energía? La energía es lo que permite al cuerpo realizar movimientos
REGULACIÓN DEL ph. Teoría Acido-Base - Anfolitos. Por lo común lo vemos representado como ph = - log [H + ]
![REGULACIÓN DEL ph. Teoría Acido-Base - Anfolitos. Por lo común lo vemos representado como ph = - log [H + ] REGULACIÓN DEL ph. Teoría Acido-Base - Anfolitos. Por lo común lo vemos representado como ph = - log [H + ]](/thumbs/40/20899659.jpg) REGULACIÓN DEL ph Teoría Acido-Base - Anfolitos Que es el ph??? Por lo común lo vemos representado como ph = - log [H ] Estrictamente, ph = - log a H En soluciones diluídas expresarlo en concentración
REGULACIÓN DEL ph Teoría Acido-Base - Anfolitos Que es el ph??? Por lo común lo vemos representado como ph = - log [H ] Estrictamente, ph = - log a H En soluciones diluídas expresarlo en concentración
BASES BIOFÍSICAS DE LA EXCITABILIDAD
 BASES BIOFÍSICAS DE LA EXCITABILIDAD Depto. Biofísica Facultad de Medicina ESFUNO Escuelas UTI: Biología Celular y Tisular Importancia del estudio de la membrana celular Funciones de la membrana: -Barrera
BASES BIOFÍSICAS DE LA EXCITABILIDAD Depto. Biofísica Facultad de Medicina ESFUNO Escuelas UTI: Biología Celular y Tisular Importancia del estudio de la membrana celular Funciones de la membrana: -Barrera
Biologia Celular CBI 111 Instituto de Ciencias Naturales. Estructura y función de la Membrana Citoplasmática. Clase 6
 Biologia Celular CBI 111 Instituto de Ciencias Naturales Estructura y función de la Membrana Citoplasmática. Clase 6 MATERIAL PROPIEDAD DE UDLA. AUTORIZADA SU UTILIZACIÓN SÓLO PARA FINES ACADÉMICOS. Objetivos
Biologia Celular CBI 111 Instituto de Ciencias Naturales Estructura y función de la Membrana Citoplasmática. Clase 6 MATERIAL PROPIEDAD DE UDLA. AUTORIZADA SU UTILIZACIÓN SÓLO PARA FINES ACADÉMICOS. Objetivos
CLASE Nº 2 ESTEQUIOMETRÍA
 UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITECNICA ANTONIO JOSÉ DE SUCRE VICERRECTORADO BARQUISIMETO DEPARTAMENTO DE INGENIERÍA QUÍMICA QUÍMICA GENERAL CLASE Nº 2 ESTEQUIOMETRÍA 1 Estequiometría Leyes que rigen
DESALACIÓN MEDIANTE OSMOSIS INVERSA
 DESALACIÓN MEDIANTE OSMOSIS INVERSA Ecoagua Ingenieros Avda. Manoteras, 38, C-314 28050-Madrid (Spain) Tel.: +(34) 913 923 562 TEC-003 Edition: 01 Date: 18/04/09 Page: 1 de 6 1. DESCRIPCION DEL PROCESO
DESALACIÓN MEDIANTE OSMOSIS INVERSA Ecoagua Ingenieros Avda. Manoteras, 38, C-314 28050-Madrid (Spain) Tel.: +(34) 913 923 562 TEC-003 Edition: 01 Date: 18/04/09 Page: 1 de 6 1. DESCRIPCION DEL PROCESO
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ENLACES QUÍMICOS. Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos.
 1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
1. Generalidades de los enlaces químicos ENLACES QUÍMICOS Los enlaces químicos, son las fuerzas que mantienen unidos a los átomos. Cuando los átomos se enlazan entre sí, ceden, aceptan o comparten electrones.
Matemáticas UNIDAD 5 CONSIDERACIONES METODOLÓGICAS. Material de apoyo para el docente. Preparado por: Héctor Muñoz
 CONSIDERACIONES METODOLÓGICAS Material de apoyo para el docente UNIDAD 5 Preparado por: Héctor Muñoz Diseño Gráfico por: www.genesisgrafica.cl LA RELACIÓN DE PROPORCIONALIDAD 1. DESCRIPCIÓN GENERAL DE
CONSIDERACIONES METODOLÓGICAS Material de apoyo para el docente UNIDAD 5 Preparado por: Héctor Muñoz Diseño Gráfico por: www.genesisgrafica.cl LA RELACIÓN DE PROPORCIONALIDAD 1. DESCRIPCIÓN GENERAL DE
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica
 Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
Solucionario Cuaderno Estrategias y Ejercitación Modelo atómico de la materia II: números cuánticos y configuración electrónica Química Técnico Profesional Intensivo SCUACTC002TC83-A16V1 Ítem Alternativa
PRUEBA ESPECÍFICA PRUEBA 2015
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 2015 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 2015 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada
PREGUNTAS DE EJEMPLO CIENCIAS NATURALES SEGUNDO NIVEL MEDIO
 PREGUNTAS DE EJEMPLO CIENCIAS NATURALES SEGUNDO NIVEL MEDIO VALIDACIÓN DE ESTUDIOS DECRETO Nº257 1. Cuando llega la primavera, algunas plantas y árboles liberan polen que queda en el ambiente, provocando
PREGUNTAS DE EJEMPLO CIENCIAS NATURALES SEGUNDO NIVEL MEDIO VALIDACIÓN DE ESTUDIOS DECRETO Nº257 1. Cuando llega la primavera, algunas plantas y árboles liberan polen que queda en el ambiente, provocando
Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H +
 Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
Reacciones ácido-base 1 Brønsted-Lowry (1923) Ácido: Especie que tiene tendencia a ceder un H + Base: Especie que tiene tendencia a aceptar un H + CH 3 COOH (aq) + H 2 O (l) H 3 O + (aq) + CH 3 COO (aq)
BIOQUIMICA DE LA VISIÓN
 BIOQUIMICA DE LA VISIÓN Bloque 1: Biomoléculas 1.El agua y los fluidos oculares. Propiedades fisicoquímicas de los fluidos oculares. 2.Carbohidratos: características generales. Importancia de los carbohidratos
BIOQUIMICA DE LA VISIÓN Bloque 1: Biomoléculas 1.El agua y los fluidos oculares. Propiedades fisicoquímicas de los fluidos oculares. 2.Carbohidratos: características generales. Importancia de los carbohidratos
Unidad 6: ELECTROQUIMICA
 Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
Unidad 6: ELECTROQUIMICA REACCIONES DE OXIDACION-REDUCCION Las reacciones redox son aquellas en las cuales hay intercambio de electrones entre las sustancias que intervienen en la reacción. Oxidación:
BIOTRANSFORMACIÓN DE LOS TÓXICOS. Dra Ana García Dpto. Farmacología y Terapéutica UAM (ana.garcia@uam.es)
 BIOTRANSFORMACIÓN DE LOS TÓXICOS Dra Ana García Dpto. Farmacología y Terapéutica UAM (ana.garcia@uam.es) Toxicocinetica ABSORCIÓN ( Oral, inhalación, piel ) DISTRIBUCIÓN ELIMINACIÓN (Biotransformación
BIOTRANSFORMACIÓN DE LOS TÓXICOS Dra Ana García Dpto. Farmacología y Terapéutica UAM (ana.garcia@uam.es) Toxicocinetica ABSORCIÓN ( Oral, inhalación, piel ) DISTRIBUCIÓN ELIMINACIÓN (Biotransformación
QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A
 1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
1. (2,5 puntos) QUÍMICA.SEPTIEMBRE (FE). OPCIÓN A Las entalpías estándar de combustión del C(s), H 2 (g) y propano gas, C 3 H 8 (g), son -394, -286 y -2220 kj/mol, respectivamente: i. Calcule la entalpía
Colegio San Lorenzo - Copiapó - Región de Atacama Per Laborem ad Lucem
 TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
TEMARIO EXAMENES QUIMICA 2012 7º BASICO Descubrimiento del átomo: Quién lo descubrió y su significado Estructura atómica: Partes del átomo, características del núcleo y la corteza, cálculo del protón,
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células.
 Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
Proporciona el oxígeno que el cuerpo necesita y elimina el dióxido de carbono o gas carbónico que se produce en todas las células. La respiración es un proceso involuntario y automático, en que se extrae
