ELECTROFORESIS VERTICAL DE PROTEÍNAS
|
|
|
- Enrique Blázquez Barbero
- hace 7 años
- Vistas:
Transcripción
1 6 grupos de estudiantes ELECTROFORESIS VERTICAL DE PROTEÍNAS 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aprender el uso de la ELECTOFORESIS DESNATURALIZANTE EN GEL DE POLIACRILAMIDA-SDS para comprender la estructura, función y diversidad de proteínas. 2. COMPONENTES para 6 grupos de estudiantes COMPONENTES Marcador de Proteínas estándar A Proteínas del suero de la Leche B Proteínas Séricas de Sangre C Proteínas de la clara del Huevo D Proteínas de hojas de Espinacas E Tampón de electroforesis Tris-Glicina-SDS (10X) Hojas de Protein InstaStain Tampón de carga para practicar CONSERVACIÓN Congelador Congelador Congelador Congelador Congelador Temperatura ambiente Temperatura ambiente Temperatura ambiente 2.1 Material requerido y no suministrado Aparato de electroforesis vertical para proteínas. Fuente de energía para la electroforesis. 3 geles de poliacrilamidas-sds 12%. Placa calefactora Micropipetas automáticas y puntas. Balanza. Microtubos. Agua destilada Papel de aluminio. Transiluminador de luz blanca. Ácido acético glacial. Metanol. Vasos. Tijeras. Espátulas.
2 3. INTRODUCCIÓN Las proteínas son una clase muy diversificada de biomoléculas. Las diferencias en sus propiedades químicas, tales como la carga, grupos funcionales, forma, tamaño y solubilidad les permitan realizar muchas funciones biológicas. Estas funciones incluyen la catálisis enzimática, la regulación metabólica, la unión y el transporte de moléculas pequeñas, la regulación génica, la defensa inmunológica y la estructura celular. La determinación del peso molecular de una proteína es de importancia fundamental para su caracterización bioquímica. La electroforesis en gel de SDS se usa comúnmente para obtener estimaciones de peso molecular fiables para polipéptidos desnaturalizados. Otras técnicas para la determinación de pesos moleculares muy precisos incluyen ultracentrifugación analítica y dispersión de la luz. Sin embargo, estos métodos requieren grandes cantidades de proteínas altamente purificadas y sofisticados equipos de elevado coste. Una proteína puede tener una carga positiva o negativa neta, dependiendo de su composición de aminoácidos y el ph. En ciertos valores de ph de las soluciones, la molécula puede ser eléctricamente neutra, es decir, las cargas negativas y positivas están en equilibrio. En presencia de un campo eléctrico, las proteínas con cargas netas migran hacia los electrodos de carga opuesta Las proteínas presentan diferentes formas tridimensionales y los patrones de plegado están determinados por sus secuencias de aminoácidos y procesamiento intracelular. La configuración tridimensional precisa de una proteína es crítica para su función. Las formas que pueden tener estas moléculas son esférica, elíptica o en forma de varilla. El peso molecular depende del número y tipo de aminoácidos de la cadena polipeptídica. Las proteínas pueden consistir en un solo polipéptido o varios polipéptidos específicamente asociada unos con otros. Las proteínas que se encuentran en sus formas normales, biológicamente activas se llaman nativas. Las propiedades físico-químicas de las proteínas afectan a la forma en que migran durante la electroforesis en gel. Los geles utilizados en electroforesis (por ejemplo, agarosa, poliacrilamida) consisten en poros microscópicos de un intervalo de tamaño definido que actúa como un tamiz molecular. Sólo las moléculas con carga neta migrarán a través del gel cuando está en un campo eléctrico. Las moléculas pequeñas pasan a través de los poros más fácilmente que los grandes. Las moléculas que tienen más carga que otros de la misma forma y tamaño migrarán más rápido. Las moléculas de la misma masa y carga pueden tener diferentes formas. En tales casos, aquellas con forma más compacta (de esfera) migrarán a través del gel más rápidamente que aquellos con una forma alargada, como una varilla. En resumen, la carga, tamaño y forma de una proteína nativa afectan a todos sus tasas de migración electroforética. ELECTROFORESIS EN GEL DE POLIACRILAMIDA Los geles de poliacrilamida se forman mezclando el monómero, la acrilamida, el agente de reticulación, metilenbisacrilamida, y un generador de radicales libres, persulfato de amonio, en tampón acuoso. La polimerización libre de la acrilamida se produce. Los polímeros de acrilamida están unidos entre sí como se muestra en la figura.
3 El tamaño de poro en los geles de poliacrilamida se controla por la concentración de gel y el grado de reticulación del polímero. La movilidad electroforética de las proteínas se ve afectada por la concentración de gel. Geles porcentuales más altos son más adecuados para la separación de polipéptidos más pequeños. Los geles de poliacrilamida también pueden ser preparados para tener un gradiente de concentraciones de gel. Típicamente, la parte superior del gel (en virtud de los pocillos de muestras) tiene una concentración de 5%, aumentando linealmente hasta el 20% en la parte inferior. Geles de gradiente pueden ser útiles en la separación de mezclas de proteínas que cubren una amplia gama de pesos moleculares. Los geles de concentración homogénea como los utilizados en este experimento son mejores para conseguir una separación de proteínas que se mueven en rangos pequeños en la diferencia de sus pesos moleculares. Cabe señalar que la acrilamida es una neurotoxina y puede ser absorbida a través de la piel. Sin embargo, en la forma de poliacrilamida polimerizada no es tóxica. El proceso de polimerización es inhibida por el oxígeno. Por consiguiente, los geles de poliacrilamida se prepararon con más frecuencia entre las placas de vidrio separadas por tiras llamadas espaciadores. Como la mezcla de acrilamida líquido se vierte entre las placas, el aire es desplazado y el producto de polimerización se produce más rápidamente. El Dodecilsulfato de sodio (SDS) es un detergente que consiste en una cadena de hidrocarburo unido a un grupo sulfato altamente cargado negativamente. Las proteínas que contienen varias cadenas de polipéptidos que se asocian sólo por fuerzas no covalentes se pueden disociar por el SDS en cadenas de polipéptidos desnaturalizados. Durante la electroforesis, las proteínas migran a través del gel hacia el electrodo positivo a una velocidad que es inversamente proporcional a su peso molecular. En otras palabras, cuanto menor sea el polipéptido desnaturalizado, más rápido migrará. El peso molecular de un polipéptido desconocido se obtiene mediante la comparación de su posición después de la electroforesis con las posiciones de las proteínas desnaturalizadas estándar. Los pesos moleculares de las proteínas estándar se han determinado previamente. Después de que las proteínas se visualizan por tinción y decoloración, se mide su distancia de migración. El log10 de los pesos moleculares de las proteínas estándar se representa frente su distancia de migración. Tomando el logaritmo Rf permite que los datos se representen gráficamente como una línea recta. El peso molecular de las proteínas desconocidas se calcula fácilmente a partir de la curva estándar.
4 MUESTRAS DE PROTEÍNAS PARA ESTE EXPERIMENTO Los marcadores de proteínas estándar son una mezcla de proteínas que dan los siguientes pesos moleculares: 94000; 67000; 38000; 30000; y Da. Los valores se han redondeado para mayor comodidad en el análisis gráfico. Las muestras de proteínas se han desnaturalizado con el detergente aniónico sodio dodecil sulfato (SDS). En las condiciones experimentales, las proteínas tendrán una movilidad en el gel que es inversamente proporcional al logaritmo de sus pesos moleculares. Las proteínas de pesos moleculares conocidos se separaran por electroforesis en paralelo y se utilizan para estimar los pesos moleculares de las muestras de proteínas desconocidas por análisis gráfico. Todas las muestras de proteína contienen tampón, SDS, -mercaptoetanol como agente reductor para los enlaces disulfuro, glicerol para crear una densidad mayor que la del tampón y el de colorante cargado negativamente azul de bromofenol para hacer el seguimiento de la electroforesis y migrará por delante de las proteínas más pequeñas en estas muestras hacia el electrodo inferior positivo. Dado que las proteínas están precoloreadas, las bandas individuales serán visibles durante la electroforesis. Después de la electroforesis, las mediciones preliminares se pueden realizar sin necesidad de retirar el gel de la casete de plástico. Las proteínas precoloreados se pueden hacer más visibles mediante la colocación del gel en solución de tinción. Las proteínas se precipitan por lo general durante el procedimiento de tinción por un proceso llamado fijación. La fijación es necesaria para evitar la difusión de proteínas, lo que provoca bandas borrosas y de intensidad reducida. Los agentes de fijación a menudo incluyen el ácido acético y metanol. Protein InstaStain es un nuevo método patentado de tinción disponible exclusivamente en EDVOTEK. A) PROTEÍNAS DE LA LECHE Las principales proteínas de la leche son las caseínas que con los lípidos emulsionadas dan el color. Las caseínas de la leche se acomplejan con el calcio que les causa a formar agregados y micelas. La fracción de caseína se puede precipitar a partir de leche desnatada (desgrasada) por valoración con ácido a ph 4,7. La grasa y caseínas también se pueden eliminar por precipitación salina con sulfato de amonio. El sobrenadante verde-amarillo resultante es el suero de leche, que contiene 20% de la proteína total de la leche. La fracción de suero de leche es un derivado filtrado de suero. Contiene pequeñas cantidades de albúmina, transferrina y lactoferrina. Estas proteínas pueden ser visualizadas como bandas de tinción débilmente entre los marcadores y La transferrina se une y transporta el hierro a los diversos tejidos del plasma sanguíneo. La principal proteína de suero de leche en rumiantes es b-lactoglobulina. La proteína nativa tiene un peso molecular de y consiste en dos cadenas polipeptídicas idénticas. La proteína aparece como una única banda de peso molecular , justo por debajo del marcador de dalton. b-lactoglobulina se une ácido fólico que es el precursor de tetrahydrafolate, una coenzima importante en la transferencia de carbono metabólico.
5 El-lactoalbúmina es un único polipéptido que tiene un peso molecular de daltons, aproximadamente. Aparece como una banda débil cerca del marcador de peso molecular más bajo. B) PROTEÍNAS SERICAS DE LA SANGRE Se cree que el plasma sanguíneo para contener más de 100 proteínas diferentes. El perfil electroforético de las proteínas plasmáticas revelará bandas que van desde aproximadamente a daltons. La banda más grande (superior) en la muestra de plasma tiene un peso molecular de y corresponde a macroglobulina. El peso molecular de la proteína nativa es de aproximadamente Se compone de dos subunidades de dímero asociados unos con otros a través de fuerzas no covalentes. Sin embargo, las subunidades de dímero constan de dos polipéptidos (190,000) que están asociados por fuerzas no covalentes. La macroglobulina es un inhibidor de la proteasa y puede estar involucrado con el control de los procesos proteolíticas como la coagulación de la sangre y las cascadas del complemento. La transferrina es una proteína de plasma mayor, que comprende 3% de la proteína total. La transferrina es una banda principal en el perfil electroforético SDS, migrando con o justo por debajo del marcador de peso molecular La banda principal de las proteínas plasmáticas es debida a la albúmina, con un peso molecular de aproximadamente Está justo debajo de la banda de transferrina. La albúmina es la proteína plasmática más abundante y es uno de los pocos que no es una glicoproteína. Debajo de la albúmina, hay varias bandas parcialmente resueltas que tienen movilidades entre y , como se juzga por los marcadores. La familia de la cadena pesada de las inmunoglobulinas (la mayoría de las subclases de IgG) migra en esta región, además de -antitripsina (53000) que es una proteína relativamente abundante involucrada en la inhibición de la proteolisis. Se compone de un 12% de hidratos de carbono en peso. Niveles anormalmente bajos de antitripsina pueden causar una predisposición a enfisema ya que las células pulmonares son dañadas por la proteólisis. C) PROTEÍNAS DE LA CLARA DEL HUEVO Las proteínas de clara de huevo son secretadas por las células del oviducto bajo estimulación hormonal. La mayoría de la proteína de clara de huevo se compone de la ovoalbúmina. La proteína consiste en una cadena polipeptídica única globular que tiene un peso molecular de La ovoalbúmina contiene un oligosacárido unido covalentemente a un residuo de asparagina. Una de las funciones de la ovoalbúmina es actuar como una forma de almacenamiento de los aminoácidos para el embrión en desarrollo. La clara de huevo también contiene globulinas que están representados por una banda prominente correspondiente a un peso molecular de aproximadamente a Bandas muy débiles pueden ser observables por encima de la banda de globulina con un peso molecular de cerca de correspondiente a conalbúmina. Esta proteína es el equivalente funcional de la transferrina. La lisozima es una enzima que degrada las cadenas de polisacárido en las paredes celulares bacterianas, que predisponen a la lisis de la célula. La enzima es un único polipéptido con un peso molecular de aproximadamente La clara de huevo contiene cantidades sustanciales de esta proteína que se puede observar como una banda que migraba con el marcador de peso molecular más bajo.
6 C) PROTEÍNAS DE PLANTAS Las proteínas de las hojas de la espinaca revelan un patrón complejo de bandas después de electroforesis, particularmente en el intervalo de peso molecular inferior. Muchas de estas proteínas son de los numerosos cloroplastos que se encuentran en el tejido de las hojas de las plantas superiores. Una característica destacada es una banda principal a un peso molecular de aproximadamente Esta banda se debe a la enzima ribulosa-1, 5-bifosfato carboxilasa. El polipéptido se denomina L, y está codificado por el ADN del cloroplasto. También hay una subunidad pequeña con un peso molecular de , denominado S, que se codifica en el núcleo. La banda que contiene el polipéptido S co-migra con el marcador más pequeño de peso molecular en el gel. 4. DESCRIPCIÓN DEL EXPERIMENTO El objetivo de este experimento es aprender el uso de la ELECTOFORESIS DESNATURALIZANTE EN GEL DE POLIACRILAMIDA-SDS para comprender la estructura, función y diversidad de proteínas. 4.1 Precauciones 1. Llevar gafas y guantes de laboratorio mientras se trabaja. 2. NO PIPETEAR CON LA BOCA, utilizar los dispositivos adecuados. 3. Extremar las precauciones cuando se trabajan con equipos que utilizan conjuntamente calor y mezcla de reactivos. 4. Lavarse las manos con jabón y agua después de haber trabajado en el laboratorio o utilizado reactivos o materiales biológicos. 5. Extremar las precauciones al utilizar equipos de laboratorios eléctricos. 6. La acrilamida no polimerizada es una neurotoxina y debería ser manipulada con mucho cuidado en una cabina adecuada. 7. La acrilamida polimerizada, como pueden ser los geles preparados, son seguros pero deben ser manipulados con guantes.
7 4.2 Preparaciones Previas Las preparaciones previas puede realizarlas el profesor o los estudiantes. ORGANIZACIÓN DE ESTE KIT Este kit contiene reactivos para 6 grupos de estudiantes compartiendo 3 geles de poliacrilamida (2 grupos por gel) y lleva suficiente tampón de electroforesis para 3 aparatos de electroforesis vertical. Los geles de poliacrilamida no están incorporados, usted puede realizar sus propios geles de poliacrilamida, o bien, comprar nuestros geles preparados. El experimento se divide en 3 partes: 1) Separación de las proteínas en los geles de poliacrilamida. 2) Tinción de las bandas de proteínas. 3) Identificar la mayor cantidad de bandas posibles en cada extracto. TIEMPO APROXIMADO PARA LAS PREPARACIONES PREVIAS Y PROCESOS DEL EXPERIMENTO 1. Las preparaciones previas pueden llevar a cabo 20 minutos. 2. Los estudiantes pueden requerir 15 minutos para preparar las muestras y la carga en el gel de poliacrilamida. Si se practica la carga de los geles con del tampón suministrado pueden ser 15 minutos adicionales. 3. La electroforesis tiene una duración de 1h o 1.5 h dependiendo del voltaje. RECONSTITUCIÓN DE LAS MUESTRAS DE PROTEÍNAS LIOFILIZDAS Cada microtubo contiene material suficiente para sembrar 6 pocillos del gel. 1. Añadir 130 l de agua destilada a todos los microtubos (A a E) y permitir que el material se rehidrate durante varios minutos. Vortex o mezclar vigorosamente. 2. Poner a calentar un vaso de agua, tapado con papel de aluminio, llevar a ebullición. 3. Asegurarse que los microtubos están bien tapados, utilizar los microtubos con tapón a rosca y marcarlos. La parte inferior de los microtubos deben ser empujados a través del papel de aluminio y estar inmersos en agua hirviendo durante 5 minutos. Los microtubos se debería mantener suspendidos por el papel de aluminio. Se puede también utilizar para ello algún sistema de laboratorio para hacer flotar las muestras. 4. Pida a los estudiantes cargar las muestras en el gel de poliacrilamida, mientras que las muestras están todavía calientes para evitar la agregación. El volumen de muestra a cargar es de 20 l. 5. Conservar las muestras no utilizadas a -20ºC y repetir los pasos 2 y 3 cuando se vuelvan a utilizar.
8 PREPARACIÓN DEL TAMPÓN DE ELECTROFORESIS Preparar el Tampón de electroforesis 1X, añadir 1 parte del Tampón de electroforesis Tris-Glicina-SDS (10X) concentrado a 9 partes de agua destilada. TIEMPO DE LA ELECTROFRESIS La disponibilidad de su tiempo determinará el voltaje y la longitud que correrán las proteínas. Se recomiendan 125 voltios durante minutos. PREPARACIÓN DE LA SOLUCIÓN DE FIJACIÓN PARA LA TINCIÓN 1. Solución de tinción con Protein InstaStain Preparar una solución stock de metanol y ácido acético glacial mediante la combinación de 180 ml de metanol, 140 ml de agua destilada y 40 ml de ácido acético glacial. 2. Solución de decoloración Utilice la solución stock de metanol, ácido acético glacial y agua destilada (paso 1) para decolorar el gel. 5. PRÁCTICA 1) Desnaturalización de las proteínas Las muestras de proteínas son enviadas liofilizadas y deben ser rehidratadas. Las muestras son proteínas desnaturalizadas que tienden a formar agregados moleculares y partículas insolubles. El calentamiento produce la rotura de los agregados meta-estables de las proteínas desnaturalizadas. Si las muestras de proteínas (tubos A a E) no han sido calentados por el profesor, realizar el calentamiento de las muestras. 1. Poner a calentar un vaso de agua, tapado con papel de aluminio, llevar a ebullición. 2. Asegurarse que los microtubos están bien tapados, utilizar los microtubos con tapón a rosca y marcarlos. La parte inferior de los microtubos deben ser empujados a través del papel de aluminio y estar inmersos en agua hirviendo durante 5 minutos. Los microtubos se deberían mantener suspendidos por el papel de aluminio. Se puede también utilizar para ello algún sistema de laboratorio para hacer flotar las muestras. 3. Proceder con la electroforesis de proteínas. Si las proteínas han sido ya calentadas por el profesor, proceder con la electroforesis de las proteínas. Una vez han se han sembrado o cargado las muestras para la electroforesis, volver a congelar las muestras de proteínas no utilizadas. Cuando se vuelvan a utilizar para otra electroforesis, se deben repetir los pasos 1 al 3.
9 2) Electroforesis de las proteínas A) Preparación del gel de poliacrilamida 1. Abra la bolsa que contiene el casete de gel con unas tijeras. Retire el casete y colóquelo sobre la mesa de trabajo con la parte delantera hacia arriba. 2. Algunas casetes tendrán cinta en la parte inferior de la placa frontal. Quitar toda la cinta para exponer la parte inferior del gel para permitir el contacto eléctrico. 3. Inserte el gel casete en la cámara de electroforesis. 4. Quite el peine mediante la colocación de sus pulgares en las marcas y empujando (presionando) hacia arriba, con cuidado y lentamente. 5. Coloque el casete de gel en la unidad de electroforesis en la orientación adecuada. Las muestras de proteínas no se separarán en geles que no están orientadas correctamente. Siga las instrucciones que acompañan al aparato específico. 6. Añadir el tampón de electroforesis 1X dentro de la cámara. Los pozos de la muestra y la placa posterior de la casete de gel deben ser sumergidas bajo el buffer. 7. Enjuague cada pocillo con tampón de electroforesis utilizando una pipeta de transferencia. 8. El gel está listo ahora para la práctica de carga y / o muestras de gel. Practicar la carga se puede hacer mediante el microtubo suministrado Practice Gel Loading Solution. B) Siembra o carga de las muestras de proteínas 2 grupos de estudiantes compartirán un gel. Cambiar de punta cada vez que se siembra una muestra de proteína. Las proteínas deberían ser sembradas en el siguiente orden:
10 GRUPO A Pocillo 1 20 microlitros tubo A Marcador de proteínas estándar Pocillo 2 20 microlitros tubo B Proteínas séricas de la leche Pocillo 3 20 microlitros tubo C Proteínas séricas de la sangre Pocillo 4 20 microlitros tubo D Proteínas de la clara del huevo Pocillo 5 20 microlitros tubo E Proteínas de la hoja de espinaca GRUPO B Pocillo 6 20 microlitros tubo A Marcador de proteínas estándar Pocillo 7 20 microlitros tubo B Proteínas séricas de la leche Pocillo 8 20 microlitros tubo C Proteínas séricas de la sangre Pocillo 9 20 microlitros tubo D Proteínas de la clara del huevo Pocillo microlitros tubo E Proteínas de la hoja de espinaca C) Correr el gel Configurar la fuente de energía al voltaje deseado y correr el gel. Se recomiendan 125 voltios durante minutos. 3) Tinción del gel con Protein InstaStain Los geles de poliacrilamida pueden ser teñidos de una forma muy fácil con las hojas de Protein InstaStain. La tinción es rápida, sensible y los geles están listos para su visualización en 1-3 horas. Los geles de poliacrilamida son muy finos y frágiles. Tener cuidado al manipular el gel para evitar que se rompa. 1. Añadir aproximadamente 100 ml de Solución de fijación en una pequeña bandeja. Solución de fijación: 50 ml metanol; 10 ml ácido acético glacial; 40 ml agua destilada. 2. Transferir la placa posterior del casete con el gel en la bandeja de la solución de fijación. Humedecerse los dedos protegidos con guantes con solución fijadora y suavemente empujar el gel de la placa posterior y retire la placa, dejando el gel sumergido en la solución fijadora. 3. Flotar suavemente una hoja de Protein InstaStain con la cara azul en el líquido. Retirar la hoja de Protein InstaStain después de 30 minutos. 4. Cubrir la bandeja de tinción para prevenir la evaporación. 5. Suavemente agitar en algún dispositivo de laboratorio durante 1-3 horas o toda la noche. 6. Después de la tinción, las bandas de proteínas aparecerán de un color azul medio a oscuro. El gel se puede desteñir si el background es demasiado oscuro mediante varios lavados con solución fijadora nueva.
11 5. RESULTADOS En el esquema de abajo se muestran la relativa posición de las bandas de proteínas, pero no están dibujadas a escala. Se pueden observar bandas menores débilmente teñidas que son pequeños contaminantes. Pocillo Muestra Proteínas 1 y 6 A Marcador de proteínas estándar 2 y 7 B Proteínas séricas de la leche 3 y 8 C Proteínas séricas de la sangre 4 y 9 D Proteínas de la clara del huevo 5 y 10 E Proteínas de la hoja de espinaca
DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS
 DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar el conocimiento de la estructura de las proteínas y determinar
DETERMINACIÓN DEL PESO MOLECULAR DE PROTEÍNAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar el conocimiento de la estructura de las proteínas y determinar
PURIFICACIÓN Y DETERMINACIÓN DEL TAMAÑO DE PROTEÍNAS FLUORESCENTES VERDES Y AZULES
 PURIFICACIÓN Y DETERMINACIÓN DEL TAMAÑO DE PROTEÍNAS FLUORESCENTES VERDES Y AZULES 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO En este experimento los estudiantes aprenderán a purificar parcialmente
PURIFICACIÓN Y DETERMINACIÓN DEL TAMAÑO DE PROTEÍNAS FLUORESCENTES VERDES Y AZULES 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO En este experimento los estudiantes aprenderán a purificar parcialmente
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo
1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo
Monitoreo de un proceso de purificación de proteínas. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa
 Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa.
 MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
Electroforesis de proteínas en geles de poliacrilamida
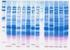 Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B
 ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS. Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo (+)
 GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
ELECTROFORESIS AVANZADA
 Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref. ELECAVANZADA (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA
 INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
PCR SIMULADA. Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO
 Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO PCR SIMULADA El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Ref.PCR Simulada (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO PCR SIMULADA El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa
 Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
DETERMINACIÓN DEL MAPA DE UN PLÁSMIDO CON ENZIMAS DE RESTRICCIÓN
 DETERMINACIÓN DEL MAPA DE UN PLÁSMIDO CON ENZIMAS DE RESTRICCIÓN 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar un conocimiento del mapaje de ADN determinando
DETERMINACIÓN DEL MAPA DE UN PLÁSMIDO CON ENZIMAS DE RESTRICCIÓN 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es desarrollar un conocimiento del mapaje de ADN determinando
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
QUÍMICA DE LAS PROTEÍNAS DE LA LECHE
 QUÍMICA DE LAS PROTEÍNAS DE LA LECHE La leche contiene un total de 3.3 % de proteína, que a su vez se encuentra compuesta por los 9 aminoácidos esenciales requeridos por el hombre. CATEGORÍAS DE LA PROTEÍNA
QUÍMICA DE LAS PROTEÍNAS DE LA LECHE La leche contiene un total de 3.3 % de proteína, que a su vez se encuentra compuesta por los 9 aminoácidos esenciales requeridos por el hombre. CATEGORÍAS DE LA PROTEÍNA
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
PURIFICACIÓN Y ELECTROFORESIS DE PROTEÍNAS BACTERIANAS
 PURIFICACIÓN Y ELECTROFORESIS DE PROTEÍNAS BACTERIANAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es introducir a los estudiantes en el conocimiento de las técnicas
PURIFICACIÓN Y ELECTROFORESIS DE PROTEÍNAS BACTERIANAS 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es introducir a los estudiantes en el conocimiento de las técnicas
Purificación de Proteínas Parte II
 Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA
 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA PRÁCTICA 3: PRUEBAS GENERALES PARA AMINOÁCIDOS Los aminoácidos constituyentes de las proteínas, contienen además
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA BIORGÁNICA PRÁCTICA 3: PRUEBAS GENERALES PARA AMINOÁCIDOS Los aminoácidos constituyentes de las proteínas, contienen además
Tema 6 Cuantificación de proteínas
 Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Proteínas de la leche. Caseinato de sodio Una proteína extraída de la leche y usada para estabilizar la grasa en una emulsión Escala= 50 µm
 Proteínas de la leche Caseinato de sodio Una proteína extraída de la leche y usada para estabilizar la grasa en una emulsión Escala= 50 µm PROTEINAS En la leche, la proteína más importante es la caseína,
Proteínas de la leche Caseinato de sodio Una proteína extraída de la leche y usada para estabilizar la grasa en una emulsión Escala= 50 µm PROTEINAS En la leche, la proteína más importante es la caseína,
Sistema Integrado de Gestión RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS PROGRAMAS DE DEPORTE Y FISIOTERAPIA GUIA PRÁCTICA N 6
 Sistema Integrado de Gestión RECONOCIMIENTO Y PROGRAMAS DE DEPORTE Y Versión 3 Proceso: Investigación - IV Octubre de 2013 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de las proteínas Determinar
Sistema Integrado de Gestión RECONOCIMIENTO Y PROGRAMAS DE DEPORTE Y Versión 3 Proceso: Investigación - IV Octubre de 2013 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de las proteínas Determinar
PRINCIPIOS DE CROMATOGRAFIA DE FILTRACIÓN EN GEL
 PRINCIPIOS DE CROMATOGRAFIA DE FILTRACIÓN EN GEL 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es introducir a los estudiantes en los principios de la cromatografía
PRINCIPIOS DE CROMATOGRAFIA DE FILTRACIÓN EN GEL 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es introducir a los estudiantes en los principios de la cromatografía
INTRODUCCIÓN AL ELISA
 INTRODUCCIÓN AL ELISA 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aportar a los estudiantes el conocimiento y metodología de la técnica del ELISA 2. COMPONENTES
INTRODUCCIÓN AL ELISA 10 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es aportar a los estudiantes el conocimiento y metodología de la técnica del ELISA 2. COMPONENTES
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
BIOLOGIA CELULAR Y MOLECULAR. LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE)
 BIOLOGIA CELULAR Y MOLECULAR LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) 1. INTRODUCCIÓN Uno de los métodos que permite la purificación y separación de proteínas de un organismo
BIOLOGIA CELULAR Y MOLECULAR LABORATORIO No 9: ELECTROFORESIS EN GELES DE POLIACRILAMIDA (SDS-PAGE) 1. INTRODUCCIÓN Uno de los métodos que permite la purificación y separación de proteínas de un organismo
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987)
 EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
EXTRACCIÓN DE ADN (Doyle & Doyle, 1987) MATERIALES Y REACTIVOS (Grado biología molecular a analítico) Cloroformo Alcohol Isoamilico Isopropanol. Etanol al 70%. Bloques de Hielo Microcentrifuga Bloque de
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
CYP 2C9 A1075C CYP2C9*3
 CYP 2C9 A1075C Sistema para la detección de la mutación A1075C en el gene del citocromo P450 2C9. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy
CYP 2C9 A1075C Sistema para la detección de la mutación A1075C en el gene del citocromo P450 2C9. Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71 60. Info@atgen.com.uy
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS
 Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDS-PAGE. Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE)
 ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
ELECTROFORESIS EN GELES DE POLIACRILAMIDA SDSPAGE Presencia de Sodio Dodecil Sulfato bajo condiciones reductoras (SDSPAGE) Método rápido, reproducible y de bajo costo Utilizado para cuantificar, comparar
Código: IDK-003 Ver: 1. Factor V Leiden
 Sistema para detección de la alteración G1691A en el gene que codifica para el Factor V de la coagulación humana Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71
Sistema para detección de la alteración G1691A en el gene que codifica para el Factor V de la coagulación humana Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336 71
INTRODUCCIÓN: Las proteínas son precipitadas de sus soluciones por ciertos ácidos tales como Zn +++, Hg ++, Fe ++, Cu ++ y Pb ++.
 INTRODUCCIÓN: Las proteínas pueden formar soluciones estables debido a las cargas de hidratación de las moléculas de proteína y a las cargas eléctricas que ellas poseen. Las proteínas ligan agua por formación
INTRODUCCIÓN: Las proteínas pueden formar soluciones estables debido a las cargas de hidratación de las moléculas de proteína y a las cargas eléctricas que ellas poseen. Las proteínas ligan agua por formación
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS
 ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
Guía de laboratorio: Reconocimiento de moléculas orgánicas.
 Departamento de Ciencias / Biología Primeros medios Prof. Daniela Gutiérrez G. Instrucciones generales: Guía de laboratorio: Reconocimiento de moléculas orgánicas. - Lean con detención cada una de las
Departamento de Ciencias / Biología Primeros medios Prof. Daniela Gutiérrez G. Instrucciones generales: Guía de laboratorio: Reconocimiento de moléculas orgánicas. - Lean con detención cada una de las
Ensayos de restricción
 Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Prof. INTRODUCCIÓN. Bata de laboratorio, Cuaderno de laboratorio, guantes, tapabocas, gorro, marcador vidriográfico
 Prof. INTRODUCCIÓN En los organismos se encuentran cuatro tipos diferentes moléculas orgánicas en gran cantidad: carbohidratos, lípidos, proteínas y nucleótidos. Todas estas moléculas contienen Carbono,
Prof. INTRODUCCIÓN En los organismos se encuentran cuatro tipos diferentes moléculas orgánicas en gran cantidad: carbohidratos, lípidos, proteínas y nucleótidos. Todas estas moléculas contienen Carbono,
DESARROLLO COGNOSCITIVO Y APRENDIZAJE
 Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS
 PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS OBJETIVOS Preparar soluciones acuosas a partir de la medición directa de reactivos sólidos y líquidos. Preparar soluciones acuosas por dilución. I. ASPECTOS
PRÁCTICA Nº 3 PREPARACIÓN DE SOLUCIONES ACUOSAS OBJETIVOS Preparar soluciones acuosas a partir de la medición directa de reactivos sólidos y líquidos. Preparar soluciones acuosas por dilución. I. ASPECTOS
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar
 4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
4. TIPADO GENÉTICO DE BACTERIAS PATÓGENAS MEDIANTE ELECTROFORESIS EN CAMPOS PULSADOS (PFGE) Materiales - Bacterias crecidas en placas de agar - Agarosa de grado molecular - Agarosa de bajo punto de fusión
TP3: Electroforesis en gel de poliacrilamida
 TP3: Electroforesis en gel de poliacrilamida Objetivos Comparar las fracciones de proteínas obtenidas en el TP Nº2 mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas.
TP3: Electroforesis en gel de poliacrilamida Objetivos Comparar las fracciones de proteínas obtenidas en el TP Nº2 mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas.
PURIFICACION PARCIAL DE LA CASEINA PRESENTE EN
 EXPERIMENTO 9 PURIFICACION PARCIAL DE LA CASEINA PRESENTE EN LA LECHE Y DETERMINACION DE SU PESO MOLECULAR Y DEL PRODUCTO DE LA HIDROLISIS POR LA ENZIMA BROMELINA DE LA PIÑA MEDIANTE ELECTROFORESIS REQUISITOS
EXPERIMENTO 9 PURIFICACION PARCIAL DE LA CASEINA PRESENTE EN LA LECHE Y DETERMINACION DE SU PESO MOLECULAR Y DEL PRODUCTO DE LA HIDROLISIS POR LA ENZIMA BROMELINA DE LA PIÑA MEDIANTE ELECTROFORESIS REQUISITOS
PRINCIPIOS DE LA CROMATOGRAFIA EN CAPA FINA
 PRINCIPIOS DE LA CROMATOGRAFIA EN CAPA FINA 4 u 8 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es conseguir la comprensión de la teoría y la metodología de la cromatografía
PRINCIPIOS DE LA CROMATOGRAFIA EN CAPA FINA 4 u 8 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de esta práctica es conseguir la comprensión de la teoría y la metodología de la cromatografía
1. FUNDAMENTOS TEÓRICOS
 DETERMINACIÓN DE LA MASA DE UNA SUSTANCIA 1. FUNDAMENTOS TEÓRICOS CLASIFICACIÓN DE LAS SUSTANCIAS Reactivos: La pureza de los reactivos es de fundamental importancia para la exactitud de los resultados
DETERMINACIÓN DE LA MASA DE UNA SUSTANCIA 1. FUNDAMENTOS TEÓRICOS CLASIFICACIÓN DE LAS SUSTANCIAS Reactivos: La pureza de los reactivos es de fundamental importancia para la exactitud de los resultados
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
TP3: Electroforesis en gel de poliacrilamida
 Objetivos TP3: Electroforesis en gel de poliacrilamida Comparar los perfiles proteicos obtenidos mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas. Introducción La
Objetivos TP3: Electroforesis en gel de poliacrilamida Comparar los perfiles proteicos obtenidos mediante SDS-PAGE. Calcular la movilidad electroforética de diferentes bandas proteicas. Introducción La
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
TEST de PATERNIDAD. Ref. PCR paternidad (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO
 Ref. PCR paternidad (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO TEST de PATERNIDAD Este experimento introduce a los alumnos en el uso del ADN y la PCR para simular una determinación de paternidad. Los estudiantes
Ref. PCR paternidad (4 prácticas) 1. OBJETIVO DEL EXPERIMENTO TEST de PATERNIDAD Este experimento introduce a los alumnos en el uso del ADN y la PCR para simular una determinación de paternidad. Los estudiantes
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Diagnóstico Avanzado en Enfermedades Tropicales
 Diagnóstico Avanzado en Enfermedades Tropicales Máster universitario en Enfermedades Tropicales Código 302731 (3 créditos ECTS) Área de Parasitología Departamento de Biología Animal, Parasitología, Ecología,
Diagnóstico Avanzado en Enfermedades Tropicales Máster universitario en Enfermedades Tropicales Código 302731 (3 créditos ECTS) Área de Parasitología Departamento de Biología Animal, Parasitología, Ecología,
Sistema Integrado de Gestión RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS PROGRAMAS DE DEPORTE Y FISIOTERAPIA GUIA PRÁCTICA N 6
 Sistema Integrado de Gestión RECONOCIMIENTO Y PROPIEDADES DE LAS PROGRAMAS DE DEPORTE Y Versión 5 Proceso: Investigación - IV Febrero de 2016 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de
Sistema Integrado de Gestión RECONOCIMIENTO Y PROPIEDADES DE LAS PROGRAMAS DE DEPORTE Y Versión 5 Proceso: Investigación - IV Febrero de 2016 Página 2 de 10 1. OBJETIVOS Reconocer algunas propiedades de
CORPORACION MUNICIPAL DE DESARROLLO SOCIAL LICEO INDUSTRIAL EULOGIO GORDO MONEO ANTOFAGASTA FONO FAX:
 CORPORACION MUNICIPAL DE DESARROLLO SOCIAL LICEO INDUSTRIAL EULOGIO GORDO MONEO ANTOFAGASTA FONO FAX:55-2231189 WWW.LICEOINDUSTRIALEGM.CL GUÍA DE APRENDIZAJE Profesor Asignatura Objetivo de Aprendizaje
CORPORACION MUNICIPAL DE DESARROLLO SOCIAL LICEO INDUSTRIAL EULOGIO GORDO MONEO ANTOFAGASTA FONO FAX:55-2231189 WWW.LICEOINDUSTRIALEGM.CL GUÍA DE APRENDIZAJE Profesor Asignatura Objetivo de Aprendizaje
Electroforesis de proteínas
 Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
ELECTROFORESIS AVANZADA
 Ref.ELECAVANZADA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref.ELECAVANZADA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS AVANZADA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Cuantificación del porcentaje de grasa cruda, extracto lipídico, extracto etéreo o fracción lipídica
 1 PRACTICA N 9 Cuantificación del porcentaje de grasa cruda, extracto lipídico, extracto etéreo o fracción lipídica I. Introducción: La cuantificación del contenido de grasa cruda es otra de las determinaciones
1 PRACTICA N 9 Cuantificación del porcentaje de grasa cruda, extracto lipídico, extracto etéreo o fracción lipídica I. Introducción: La cuantificación del contenido de grasa cruda es otra de las determinaciones
ELECTROFORESIS BASICA
 Ref.ELECBASICA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS BASICA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
Ref.ELECBASICA (4 prácticas) 1.OBJETIVO DEL EXPERIMENTO ELECTROFORESIS BASICA El objetivo de este experimento es introducir a los alumnos en el conocimiento de la teoría electroforética y familiarizarse
TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS
 1 TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS I) Péptidos Los aminoácidos pueden condesarse entre sí, uniéndose a través del grupo carboxilo de un aminoácido al grupo amino de otro
1 TRABAJO PRACTICO Nº2 RECONOCIMIENTO Y PROPIEDADES DE LAS PROTEINAS I) Péptidos Los aminoácidos pueden condesarse entre sí, uniéndose a través del grupo carboxilo de un aminoácido al grupo amino de otro
Repaso Opción múltiple Macromoléculas Biológicas
 Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
Repaso Opción múltiple Macromoléculas Biológicas 1. Por qué esta información sobre el carbono es tan importante para entender las moléculas de la vida? a. Es el esqueleto de las moléculas biológicas requeridas
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
Código: IDK-006 Ver: 1 MTHFR A1298C. Sistema para detección de la alteración A1298C en el gene de la Mutilen Tetrahidrofolato Reductasa
 Sistema para detección de la alteración A1298C en el gene de la Mutilen Tetrahidrofolato Reductasa Reg. MSP 21199 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336
Sistema para detección de la alteración A1298C en el gene de la Mutilen Tetrahidrofolato Reductasa Reg. MSP 21199 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598) 2 336
Código: KIT-005 Ver: 1 MTHFR C677T
 Sistema para detección de la alteración C677T en el gene que codifica para la Metilen-tetrahidrofolato reductasa humana 1 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598)
Sistema para detección de la alteración C677T en el gene que codifica para la Metilen-tetrahidrofolato reductasa humana 1 Valdense 3616. 11700. Montevideo. Uruguay. Teléfono (598) 2 336 83 01. Fax (598)
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
ESTUDIO DE LOS AMINOACIDOS Y PROTEÍNAS
 ESTUDI DE LS AMINACIDS Y PRTEÍNAS bjetivos Al finalizar la práctica el alumno estará en capacidad de: - Aplicar pruebas químicas para la determinación cualitativa de aminoácidos. - Analizar el efecto de
ESTUDI DE LS AMINACIDS Y PRTEÍNAS bjetivos Al finalizar la práctica el alumno estará en capacidad de: - Aplicar pruebas químicas para la determinación cualitativa de aminoácidos. - Analizar el efecto de
OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas.
 Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Química Biológica I TP : PROTEINAS Generalidades OBJETIVO: -Identificar aminoácidos y proteínas por medio de métodos basados en reacciones químicas. FUNDAMENTOS: Caracterización de las proteínas La caracterización
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009
 2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009 El genoma haploide de un humano contiene 20,000-25,000 genes que codifican a proteínas. Transportadores Enzimas Receptores Estructurales Hormonas
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009 El genoma haploide de un humano contiene 20,000-25,000 genes que codifican a proteínas. Transportadores Enzimas Receptores Estructurales Hormonas
Proyecto de Fin de Cursos
 Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Universidad de la República Oriental del Uruguay Proyecto de Fin de Cursos ELECTROFORESIS EN GEL DE MOLÉCULAS DE ADN Noviembre de 2006 Carolina Etchart C.I. 3.757.708-8 Marcelo Lavagna C.I. 3.508.715-8
Técnicas de Caracterización y purificación
 Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Ejercicio 5 Actividades Bioquímicas En Bacterias
 Objetivos Ejercicio 5 Actividades Bioquímicas En Bacterias Entender los procesos bioquímicos de distintas reacciones enzimáticas como son las fermentaciones e hidrólisis. Describir el patrón de las reacciones
Objetivos Ejercicio 5 Actividades Bioquímicas En Bacterias Entender los procesos bioquímicos de distintas reacciones enzimáticas como son las fermentaciones e hidrólisis. Describir el patrón de las reacciones
PCR gen 16S ARNr bacteriano
 PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
PCR gen 16S ARNr bacteriano Ref. PCR16S 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y la práctica de la Reacción en Cadena de la Polimerasa
PURIFICACIÓN DE PROTEÍNAS
 PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA?
 TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
TEMA 1: LA NATURALEZA BÁSICA DE LA MATERIA QUÉ ELEMENTOS INTEGRAN LA MATERIA VIVA? Concepto de Bioquímica Concepto de Bioelemento Los bioelementos, también conocidos como elementos biogénicos, son los
ANEXOS. Anexo 1. Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v).
 ANEXOS Anexo 1 Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v). 1. Tomar 6.011mL de ácido acético y aforar a 1L de agua HPLC. 2. Pesar 13.609 g de acetato de sodio y aforar a 1L de agua
ANEXOS Anexo 1 Solución Reguladora de Acetato 0.1 M, ph 4.0 y metanol al 2% (v/v). 1. Tomar 6.011mL de ácido acético y aforar a 1L de agua HPLC. 2. Pesar 13.609 g de acetato de sodio y aforar a 1L de agua
PRECIPITACIÓN EN BREVE. Francisco José Guerra Millán
 PRECIPITACIÓN EN BREVE Francisco José Guerra Millán www.pacopepe.com.mx BREVE DESCRIPCIÓN La precipitación consiste en la separación química de los componentes de una disolución. Esta separación se realiza
PRECIPITACIÓN EN BREVE Francisco José Guerra Millán www.pacopepe.com.mx BREVE DESCRIPCIÓN La precipitación consiste en la separación química de los componentes de una disolución. Esta separación se realiza
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
DETECCIÓN DE VIH POR WESTERN BLOT
 DETECCIÓN DE VIH POR WESTERN BLOT 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es que los estudiantes entiendan los conceptos y metodología involucrados en la técnica
DETECCIÓN DE VIH POR WESTERN BLOT 6 grupos de estudiantes 1. OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es que los estudiantes entiendan los conceptos y metodología involucrados en la técnica
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO
 PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
PRÁCTICA Nº 2 OPERACIONES COMUNES EN UN LABORATORIO OBJETIVO Utilizar el material de laboratorio en las operaciones más comunes realizadas en un laboratorio de química. I. ASPECTOS TEÓRICOS Una vez conocido
qprotein (BCA) Kit para cuantificar proteinas totales PB-L Productos Bio-Lógicos
 qprotein () Kit para cuantificar proteinas totales PB-L http://www.pb-l.com.ar qprotein () Cat. no. RA03 CONTENIDO Componentes RA0301 RA0302 Buffer A 250 ml 500 ml Buffer B 5 ml 10 ml Proteína Patrón 5
qprotein () Kit para cuantificar proteinas totales PB-L http://www.pb-l.com.ar qprotein () Cat. no. RA03 CONTENIDO Componentes RA0301 RA0302 Buffer A 250 ml 500 ml Buffer B 5 ml 10 ml Proteína Patrón 5
Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales
 Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales Enrique Dans. Creative Commons. http://www.flickr.com/photos/edans/1239
Práctica laboratorio: Reacciones de polimerización. Determinación del peso molecular de un polímero mediante análisis de grupos finales Enrique Dans. Creative Commons. http://www.flickr.com/photos/edans/1239
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
METODOLOGÍA DE EXTRACCIÓN Y PURIFICACIÓN DE INHIBIDORES DE PROTEASAS EN Opuntia streptacantha
 METODOLOGÍA DE EXTRACCIÓN Y PURIFICACIÓN DE INHIBIDORES DE PROTEASAS EN Opuntia streptacantha RESUMEN Estudiante: Jannet Alejandra Vargas Sánchez Instituto Tecnológico de Roque jannettitajm@hotmail.com
METODOLOGÍA DE EXTRACCIÓN Y PURIFICACIÓN DE INHIBIDORES DE PROTEASAS EN Opuntia streptacantha RESUMEN Estudiante: Jannet Alejandra Vargas Sánchez Instituto Tecnológico de Roque jannettitajm@hotmail.com
SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS Elaborado por Lic. Fernando Andrade
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2014 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2014 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química. MEDICIÓN DEL ph DE ÁCIDOS, BASES Y SALES 2. INTRODUCCIÓN
 UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química 1 MEDICIÓN DEL ph DE ÁCIDOS, BASES Y SALES 1. OBJETIVOS. Reconocer la acidez o basicidad de una sustancia mediante el uso de indicadores. Relacionar
UNIVERSIDAD TECNOLÓGICA EQUINOCCIAL Laboratorio de Química 1 MEDICIÓN DEL ph DE ÁCIDOS, BASES Y SALES 1. OBJETIVOS. Reconocer la acidez o basicidad de una sustancia mediante el uso de indicadores. Relacionar
SAPONIFICACIÓN: SÍNTESIS DE JABÓN
 SAPONIFICACIÓN: SÍNTESIS DE JABÓN Objetivos: 1. Preparar jabón a partir de aceite vegetal 2. Observar las propiedades del jabón al someterlo a distintas pruebas. Introducción: Las propiedades de las grasas
SAPONIFICACIÓN: SÍNTESIS DE JABÓN Objetivos: 1. Preparar jabón a partir de aceite vegetal 2. Observar las propiedades del jabón al someterlo a distintas pruebas. Introducción: Las propiedades de las grasas
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD A. CROMATOGRAFÍA DE INTERCAMBIO IÓNICO. Usos 1.- Purificar Proteínas 2.- Concentrar Proteínas Ventajas
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD A. CROMATOGRAFÍA DE INTERCAMBIO IÓNICO. Usos 1.- Purificar Proteínas 2.- Concentrar Proteínas Ventajas
Laboratorio No. 7 Titulo: DESNATURALIZACIÓN DE PROTEÍNAS
 Laboratorio No. 7 Titulo: DESNATURALIZACIÓN DE PROTEÍNAS Introducción: Las proteínas se encuentran involucradas en virtualmente todos los procesos que se llevan a cabo dentro del organismo, teniendo una
Laboratorio No. 7 Titulo: DESNATURALIZACIÓN DE PROTEÍNAS Introducción: Las proteínas se encuentran involucradas en virtualmente todos los procesos que se llevan a cabo dentro del organismo, teniendo una
SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA
 PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
PRÁCTICA Nº 3 SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA OBJETIVOS: Establecer los fundamentos teóricos de los proceso de separación. Separar los componentes de diversas muestras problema. I. FUNDAMENTOS
CRISTALIZACIÓN: PURIFICACIÓN DEL ÁCIDO BENZOICO. Purificar un compuesto orgánico mediante cristalización y determinar su punto de fusión
 EXPERIMENTO 1 CRISTALIZACIÓN: PURIFICACIÓN DEL ÁCIDO BENZOICO Objetivo general Purificar un compuesto orgánico mediante cristalización y determinar su punto de fusión Objetivos específicos 1.- Determinar
EXPERIMENTO 1 CRISTALIZACIÓN: PURIFICACIÓN DEL ÁCIDO BENZOICO Objetivo general Purificar un compuesto orgánico mediante cristalización y determinar su punto de fusión Objetivos específicos 1.- Determinar
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL
 FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL PRUEBAS DE CARACTERIZACIÓN DE ALCOHOLES Guía No: 07 Páginas: 1 a 7 1. INTRODUCCIÓN El grupo funcional
FACULTAD DE CIENCIAS NATURALES EXACTAS Y DE LA EDUCACIÓN DEPARTAMENTO DE QUÍMICA ÁREA QUÍMICA GENERAL PRUEBAS DE CARACTERIZACIÓN DE ALCOHOLES Guía No: 07 Páginas: 1 a 7 1. INTRODUCCIÓN El grupo funcional
