BLOQUE TEMÁTICO 5 Haluros de alquilo Problemas
|
|
|
- José Antonio Herrera Crespo
- hace 6 años
- Vistas:
Transcripción
1 aluros de alquilo 1 BLQUE TEMÁTIC 5 aluros de alquilo Problemas Problema 5.1. Un nucleófilo es una especie química que contiene, al menos, un par electrónico no compartido y que participa en una reacción cediendo un par de electrones a otra especie química denominada electrófilo. Un electrófilo es una especie química que participa en una reacción química aceptando un par de electrones de un nucleófilo. De acuerdo con las definiciones anteriores indique cuáles de las siguientes especies químicas son electrofílicas y cuáles son nucleofílicas. El metano no es ni nucleofílico ni electrofílico. Problema 5.2. Indique qué sustratos de los que se indican a continuación reaccionarán mediante un mecanismo S N2 cuando se traten con NaS en DMF. El mecanismo SN2 es muy sensible al impedimento estérico en el sustrato. Los compuestos que reaccionarán mediante el mecanismo SN2 son A, C y D. Los sustratos terciarios, como el compuesto B, presentan mucho impedimento estérico al ataque del nucleófilo y no reaccionan mediante el mecanismo SN2. El compuesto F tampoco reacciona porque es un sustrato de tipo neopentílico y los grupos metilo que flanquean al carbono unido al bromo impiden el acercamiento del nucleóófilo. El sustrato E no reacciona porque el bromo está situado sobre un carbono con hibridación sp 2 y el mecanismo SN2 solo es operativo sobre carbonos con hibridación sp 3. Problema 5.3. Explique qué reactivo, para cada una de las parejas de compuestos que se dan a continuación, será más nucleofílico en una reacción S N2. a) Cuando se comparan dos especies nucleofílicas cuyo átomo nucleofílico es el mismo nucleofília y basicidad correlacionan, siendo la especie más básica la más nucleofílica. En el apartado a el anión hidróxido es más básico y, por tanto, más nucleofílico que el agua. b) En el Sistema Periódico la nucleofilia aumenta de derecha a izquierda lo que explica que las aminas sean más nucleofílicas que los alcoholes. c) y d) En el Sistema Periódico la nucleofilia aumenta al bajar en una columna. Por tanto, las trifenilfosfina es más nucleofílica que las trimetilamina y el yoduro más nucleofílico que el cloruro.
2 2 aluros de alquilo Problema 5.4. Escriba la estructura, con indicación de su estereoquímica, del producto resultante en cada una de las siguientes reacciones: Las condiciones para que opere el mecanismo SN2 son las siguientes: 1) Sustrato sin impedimento estérico. 2) Nucleófilo fuerte. 3) Buen grupo saliente (base débil). 4) Además, el mecanismo SN2 se favorece si se emplean disolventes polares próticos cuando el nucleófilo se introduce en forma de anión salino (cianuro sódico, azida sódica, metanotiolato sódico etc). Formación de A. El sustrato de la reacción es un bromuro secundario sobre el que puede operar el mecanismo SN2. En la formación de A se emplea el anión cianuro (nucleófilo fuerte) y N,N-dimetilformamida (DMF) que es un disolvente polar aprótico favorecedor del mecanismo SN2. Por tanto, las condiciones de reacción que conducen al compuesto A son favorecedoras del mecanismo SN2. Si este mecanismo es el que opera en la reacción el nucleófilo atacará al centro estereogénico del (R)-2-bromohexano provocando inversión de la configuración. Por tanto, la estructura de A y la reacción que lo forma es la siguiente: Formación de B. En la reacción que forma B se emplea el anión acetato, que no es un nucleófilo fuerte. Sin embargo, la potencia nucleofílica del anión acetato aumenta cuando se emplea en el seno de DMF, por lo que es lógico deducir que el compuesto B se formará mediante una reacción de tipo SN2. La reacción que forma B es la siguiente: Formación de C. El mismo razonamiento que se ha aplicado para deducir el mecanismo en el caso del compuesto A es de aplicación en la formación del compuesto C. Por tanto, la reacción que forma C seguirá el mecanismo SN2 y, consiguientemente, la estructura de C es la que se indica a continuación:
3 aluros de alquilo 3 Problema 5.5. Deduzca el mecanismo de sustitución que operará en cada una de las siguientes reacciones. Dibuje la estructura del producto de reacción Será el producto de sustitución ópticamente activo? Todos los sustratos son haluros secundarios sobre los que puede funcionar el mecanismo SN2. Todos los nucleófilos empleados en las reacciones del problema son fuertes y los disolventes (DMF y DMS) son polares apróticos, favorecedores del mecanismo SN2. De acuerdo con este análisis es lógico deducir que el mecanismo que operará en todas las reacciones de este problema será el SN2, produciéndose inversión de configuración. Las estructuras de los productos A, B y C serán las que se indican a continuación: El compuesto A es ópticamente activo pero B y C no lo son, ya que estos compuestos tienen plano de simetría (de hecho los compuestos de partida que generan B y C tampoco son ópticamente inactivos porque también tienen plano de simetría). La reacción del apartado d se lleva a cabo sobre una mezcla racémica y el ataque SN2 del anión metanotiolato provocará la inversión de la configuración sobre cada uno de los 2- yodohexanos enantioméricos. Por tanto, el producto de la reacción será también una mezcla racémica, tal y como se indica en el siguiente esquema: Problema 5.6. rdene los siguientes sustratos según su velocidad relativa en una reacción S N1. El mecanismo SN1 consta de dos etapas. La primera es la de formación del carbocatión que es una etapa lenta que determina la velocidad global del proceso. La segunda es el ataque rápido
4 4 aluros de alquilo del nucleófilo al carbocatión. Por tanto, aquella reacción que exhiba una menor barrera de activación en la formación del carbocatión será la reacción más rápida. La reacción que genera el carbocatión es endotérmica y, por tanto, aquellos efectos que estabilicen al carbocatión también estabilizarán al estado de transición que lo forma (postulado de ammond). Por todo ello se puede deducir que las reacciones que formen los carbocationes más estables serán las más rápidas. Los carbocationes que se generan a partir de cada uno de los cloruros de alquilo se indican en el siguiente esquema. A partir del cloruro de t-butilo (2-cloro-2-metilpropano, apartado a) se genera el carbocatión t- butilo, que es terciario. A partir del (2-cloro-2-fenilpropano, apartado b) se genera un carbocatión terciario bencílico, que deslocaliza la carga positiva por el anillo aromático. A partir del 2-clorobutano se genera un carbocatión secundario. Por tanto, el orden de estabilidad de los carbocationes es: Y el orden de reactividad SN1 es: Problema 5.7. Dada la siguiente reacción: Explique cuál será mecanismo de sustitución nucleofílica (S N2 ó S N1) que operará en la misma e indique el producto (o productos) de sustitución que se formará(n). El sustrato de la reacción es un bromuro secundario bencílico sobre el que puede operar el mecanismo SN2 o el SN1. El nucleófilo de la reacción es el agua, que es un nucleófilo débil, y el disolvente es el agua, que es polar prótico favorecedor del mecanismo SN1. Por tanto, las
5 aluros de alquilo 5 condiciones de reacción son favorecedoras del mecanismo SN1. El mecanismo de la reacción se inicia con la formación del carbocatión, que es de tipo secundario bencílico (etapa 1 del mecanismo que se indica más abajo). El carbocatión es plano en el carbono catiónico y es atacado desde ambos lados por el agua (etapa 2). La desprotonación forma una mezcla de alcoholes diastereoisoméricos (etapa 3). Problema 5.8. La reacción de hidrólisis del 2-bromo-3-metilbutano proporciona el 2- metilbutan-2-ol. Explique la formación de este compuesto. El 2-metilbutan-2-ol se explica mediante un mecanismo SN1 en el cual el carbocatión secundario, generado en la heterólisis del enlace C-Br, experimenta una transposición, por migración 1,2-, para dar lugar a un carbocatión terciario. Esta reacción va seguida del ataque nucleofílico del agua y de la formación del 2-metilbutan-2-ol por desprotonación, tal y como se indica en el siguiente esquema:
6 6 aluros de alquilo Problema 5.9. Cuando se hace reaccionar el (S)-1-bromo-1-fenilbutano con acetato sódico (NaAc) en dimetilformamida se obtiene un compuesto A, ópticamente activo. Sin embargo, cuando el (S)-1-bromo-1-fenilbutano se calienta a ebullición en ácido acético se obtiene el compuesto A, pero la disolución que lo contiene es ópticamente inactiva. Proponga una explicación para los anteriores hechos experimentales. El sustrato es un bromuro secundario bencílico que puede reaccionar mediante el mecanismo SN2 o el SN1. El anión acetato no es un nucleófilo fuerte. Sin embargo, la potencia nucleofílica del anión acetato aumenta cuando se emplea en el seno de DMF, por lo que es lógico deducir que el mecanismo será de tipo SN2, con lo consiguiente inversión de la configuración en el estereocentro atacado. La reacción que formará A, en su forma ópticamente activa, será la siguiente: Cuando la reacción se lleva a cabo en ácido acético, el nucleófilo es el propio ácido acético, mucho menos nucleofílico que el anión acetato, y el disolvente es el ácido acético, que es polar prótico favorecedor del mecanismo SN1. Por tanto, las condiciones de reacción son favorecedoras del mecanismo SN1 y la reacción transcurrirá con formación de una mezcla
7 aluros de alquilo 7 racémica por ataque del ácido acético a ambos lados del carbocatión, tal y como se dibuja en el siguiente esquema: 1) Formación del carbocatión Br Ph + Br Carbocatión secundario bencílico 2) Ataque nucleofílico del ácido acético al carbocatión a a + b b 3) Desprotonación + - Ph (R) + (S) Enantiómeros Problema Cuando el compuesto A se trata con metanol se obtiene el compuesto B por sustitución del cloro en C-2. Explique mecanísticamente la formación de B por qué no se sustituye el átomo de cloro en C-3? La reacción se lleva a cabo en metanol, que es nucleófilo débil y un disolvente polar prótico favorecedor del mecanismo SN1. Por tanto, la formación de B transcurrirá mediante el mecanismo mecanismo SN1. En la primera etapa de este mecanismo se producirá la ruptura heterolítica del enlace C2-Cl y la formación del correspondiente carbocatión, que resulta muy estabilizado por resonancia de la carga positiva sobre el átomo de oxígeno contiguo. De hecho la estructura resonante de catión oxonio contribuye más al hibrido de resonancia que la estructura resonante de carbocatión porque en aquélla todos los átomos de C y tienen el octeto completo (véase el mecanismo más abajo). En la segunda etapa del mecanismo tendrá lugar el ataque nucleofílico del metanol al catión oxonio. Por último, la etapa de desprotonación formará el compuesto B.
8 8 aluros de alquilo El átomo de cloro en C-3 no resulta sustituido porque la ruptura heterolítica del enlace C3-Cl generaría un carbocatión secundario mucho menos estable que el carbocatión oxonio. Problema Un (R)-2-bromooctano, que exhibe un poder rotatorio de -20.8º, se somete a la reacción de hidrólisis bajo condiciones S N1. El producto de la reacción es un 2- octanol con una poder rotatorio de +3.96º. Si el (R)-2-bromooctano ópticamente puro tiene una poder rotatorio de -34.6º y el 2-octanol ópticamente puro tiene una rotación óptica de -9.9º, calcule: a) la pureza óptica del 2-bromoctano que se emplea en la reacción de hidrólisis y la pureza óptica del 2-octanol que se forma en esta reacción. b) el porcentaje de racemización y el porcentaje de inversión de la reacción de hidrólisis. c) el porcentaje de ataques dorsales (inversión de la configuración) y el porcentaje de ataques frontales (retención de la configuración) que se producen en la reacción de hidrolisis. Respuesta. Apartado a. La pureza óptica de un compuesto se expresa como (Ri/Rp)x100 donde Ri es la rotación óptica del compuesto impuro y Rp es la rotación óptica del compuesto puro. El cálculo de la pureza óptica del (R)-2-bromooactano que se emplea en la reacción de hidrólisis y la del 2-octanol que se forma en la reacción es el siguiente: Un 60% de pureza óptica en el (R)-2-bromooctano significa que este compuesto contiene un 80% de (R)-2-bromooctano y un 20% de (S)-2-bromooctano. El 20% de moléculas de (S)-2- bromooctano anulan la rotación óptica de un 20% de moléculas de (R)-2-bromooctano, con lo cual sólo un 60% del (R)-2-bromooctano contribuye a la rotación óptica de la mezcla de enantiómeros. Apartado b. Para calcular el porcentaje de racemización y el porcentaje de inversión de la reacción de hidrólisis hay que calcular primero la relación de pureza óptica de producto con respecto al reactivo que es: Si la reacción hubiera tenido lugar con inversión completa de la configuración la relación de pureza óptica sería de 1, o lo que es lo mismo, el porcentaje de pureza óptica del 2-octanol habría sido del 60%, lo que significaría que la mezcla de 2-bromooctano ópticamente impuro, que contiene un 80% de (R)-2-bromooctano y un 20% de (S)-2-bromooctano, habría
9 aluros de alquilo 9 reaccionado para dar un 80% de (S)-2-octanol y un 20% de (R)-2-octanol. Sin embargo, esto no es lo que ha ocurrido, ya que la pureza óptica del 2-octanol no es del 60% sino del 40%. Esto se explica porque en la reacción de hidrólisis parte de las moléculas de 2-bromooctano han reaccionado mediante inversión de la configuración y parte mediante retención de la configuración, que es propio de los mecanismos SN1. La relación de pureza óptica de 2/3 significa que ha habido 2/3 de inversión y el resto hasta 1, que es 1/3, ha sido de racemización. Apartado c. Las moléculas de 2-bromooctano que experimentan el ataque frontal (retención de la configuración) cancelan la rotación óptica de las moléculas que experimentan el ataque dorsal (inversión de la configuración). En la reacción se ha producido 1/3 de racemización, lo que significa que se han producido 1/6 de ataques frontales que han anulado la rotación óptica de 1/6 de ataques dorsales (1/6 + 1/6=1/3 de racemización). Por tanto, los porcentajes de inversión (ataque dorsal) y de retención (ataque frontal) son: Problema a) El bromuro de bencilo reacciona en una mezcla 2/C para dar lugar al alcohol bencílico. La velocidad de la reacción es independiente de la concentración de agua. Bajo las mismas condiciones el bromuro de p-metilbencilo proporciona el alcohol p-metilbencílico pero con una velocidad 58 veces mayor. b) Por otro lado, el bromuro de bencilo reacciona con etóxido sódico en etanol para dar bencil etil éter. La velocidad de esta reacción es dependiente de la concentración del bromuro de bencilo y del etóxido sódico. Bajo las mismas condiciones el bromuro de p- metilbencilo proporciona el p-metilbencil etil éter, con una velocidad 1.5 veces mayor. Proponga una explicación para estos resultados. Respuesta. Apartado a. La reacción del bromuro de bencilo en la mezcla de agua/ácido fórmico sigue el mecanismo SN1 ya que la velocidad de la reacción sólo depende de la concentración del bromuro de bencilo. El mecanismo de esta reacción SN1 es el siguiente: a) Formación del carbocatión Br C 2 C 2 lento Br + Bromuro de bencilo Carboc.1º Carboc.2º b) Ataque nucleofílico del agua al carbocatión bencílico C 2 rápido + 2 C 2 Carboc.2º C 2 Carboc.2º c) Desprotonación + Br rápido + Br Alcohol bencílico
10 10 aluros de alquilo La heterólisis del enlace C-Br genera, en el paso lento del mecanismo, el carbocatión bencílico, que deslocaliza la carga positiva sobre el anillo aromático, tal y como se puede apreciar en el esquema anterior. La reacción del bromuro de p-metilbencilo en la mezcla de agua/ácido fórmico también sigue el mecanismo SN1. Sin embargo, la velocidad de la reacción es 58 veces mayor. El mecanismo de esta reacción SN1 es el siguiente: En el caso del bromuro de p-metilbencilo forma, en el paso lento de la reacción, el catión p- metilbencílico. Las estructuras resonantes de este carbocatión se pueden ver en el esquema anterior. Si se comparan las estructuras resonantes del carbocatión p-metilbencilo con las del carbocatión bencilo se podrá ver que aquél tiene una estructura resonante de tipo carbocatión 3º, que contribuye más al híbrido de resonancia que la correspondiente estructura de carbocatión secundario en el híbrido de resonancia del carbocatión bencilo. Por tanto, el carbocatión p-metilbencilo es más estable que el carbocatión bencilo y se forma más rápidamente, lo que explica que la reacción SN1 que lo forma sea más rápida. Apartado b. La reacción del bromuro de bencilo y del bromuro de p-metilbencilo con etóxido sódico en etanol siguen el mecanismo SN2, ya que la velocidad de estas reacciones depende de la concentración del bromuro de bencilo y del etóxido sódico. En el mecanismo SN2 no se forman carbocationes, por lo que la estabilización adicional que ejerce el grupo metilo en el carbocatión p-metilbencilo, en el mecanismo SN2 no es apenas apreciable, por ello las velocidades de ambas reacciones son prácticamente iguales.
11 aluros de alquilo 11 Problema a) Prediga si las reacciones que se dan a continuación elegirán un mecanismo de eliminación E1 o E2. b) Cuál será el producto mayoritario en cada una de estas reacciones? a) La clave para determinar si una reacción de eliminación seguirá el mecanismo E1 o E2 es la base empleada en el proceso. Si la base es fuerte (hidróxido, metóxido, etóxido) el mecanismo será E2 y si la base es débil (agua, metanol, etanol) el mecanismo será E1. De acuerdo con estas premisas las anteriores reacciones se clasificarán del siguiente modo: mecanismo E1 = apartados a y c. mecanismo E2 = apartados b y d. b) La eliminación sobre el 2-cloro-2-metilpropano forma únicamente el 2-metilpropeno, independientemente del mecanismo que sigue la reacción. Formación del propeno a partir del 2-cloro-2-metilpropano a) 2 (E1) C 3 C 3 C Cl C 3 b) K (E2) DMF La eliminación sobre el 2-bromobutano forma, independientemente del mecanismo seguido, una mezcla de but-2-eno (isómeros E y Z) y but-1-eno. El producto mayoritario será el (E)- buteno por ser el alqueno más sustituido y además de configuración E. 2 C C 3 C 3 Problema La reacción de eliminación del 3-bromo-2,3-dimetilbutano, mediante calentamiento con etóxido sódico en DMS, proporciona un único alqueno A (C 61 2). Sin embargo, la reacción de eliminación del mismo bromoalcano por calentamiento en etanol conduce a la obtención de un alqueno B, isómero de A. Prediga mecanísticamente las estructuras de A y de B. Formación de A. La reacción de eliminación con etóxido sódico en DMS debe seguir el mecanismo E2 ya que la base empleada es una base fuerte. La estructura de A, y el mecanismo E2 que forma este alqueno, se indican a continuación:
12 12 aluros de alquilo Formación de B. La reacción de eliminación mediante calentamiento en etanol debe seguir el mecanismo E1 ya que la base empleada es una base débil. En el mecanismo E1 se generan carbocationes que pueden experimentar reacciones de transposición. Así, en la heterólisis del 3-bromo-2,2-dimetilbutano se forma un carbocatión secundario (paso 1 del esquema que se da más abajo). El carbocatión secundario experimenta una transposición 1,2-C3 que lo convierte en carbocatión terciario (paso 2). Finalmente, la eliminación forma el 2,3-dimetilbut-2-eno (alqueno B), como producto muy mayoritario (alqueno tetrasustituido) en el proceso de eliminación. Formación de B mediante mecanismo E1/transposición 1) Formación del carbocatión C 3 C 3 C C C 3 Br 2) Transposición 3 C C 3 3 C C 3 3) Eliminación 3 C C 3 C 3 C 3 1,2-C 3 3 C C 3 + Br 3 C C 3 Carbocatión secundario C 3 3 C C 3 C 3 Carbocatión terciario C C C 3 C 3 C 3 B (2,3-dimetilbut-2-eno) Problema Qué haluro de alquilo, de los que se indican a continuación, proporciona un único alqueno cuando se trata con NaEt en etanol? Los alquenos que se originan a partir de cada cloroalcano se indican a continuación. El cloroalcano que genera un único alqueno en la eliminación es el 3-cloro-3-etilpentano (reacción b), que forma únicamente el 3-etilpent-2-eno.
13 aluros de alquilo 13 Problema Cuando el compuesto A se calienta a reflujo de metanol, en presencia de metóxido sódico, se obtiene el alqueno B (C 11 14). Por otro lado, cuando el compuesto C se calienta a reflujo de metanol, en presencia de metóxido sódico, se obtiene el alqueno D (C 11 14), isómero de B. Deduzca mecanísticamente la estructura de los alquenos B y D. En la eliminación se emplea metóxido sódico, que es una base fuerte, por lo que el mecanismo será E2. La conformación reactiva coloca al bromo (grupo saliente) y al átomo de hidrógeno en posición anticoplanar. La eliminación sobre el bromoalcano A y la estructura del producto de eliminación B se indican en el siguiente esquema: La eliminación sobre el bromoalcano C proporciona la olefina isomérica D, de configuración Z, tal y como se indica a continuación:
14 14 aluros de alquilo Problema Prediga las estructuras de los alquenos A y B que se formarán en las siguientes reacciones: a) En la eliminación se emplea etóxido sódico, que es una base fuerte, por lo que el mecanismo será E2. En estos mecanismos, la conformación reactiva de los haluros de ciclohexilo coloca al grupo saliente y al hidrógeno en posición trans-diaxial. Las dos conformaciónes del trans-1-cloro-2-metilciclohexano se indican a continuación. Conformaciones del trans-1-cloro-2-metilciclohexano Cl Cl 3 C C 3 La reacción E2 sobre la conformación reactiva del trans-1-cloro-2-metilciclohexano proporciona un único alqueno, cuya estructura se indica a continuación: b) Las dos conformaciones del cis-1-cloro-2-metilciclohexano se indican a continuación. Conformaciones del cis1-cloro-2-metilciclohexano Cl C 3 Cl C 3 La reacción E2 sobre la conformación reactiva del cis-1-cloro-2-metilciclohexano proporciona una mezcla de alquenos, cuyas estructuras se indica a continuación: Problema Cuando el (1S,2S)-1-bromo-1,2-dimetilciclohexano (compuesto A) se calienta en metanol se obtienen los tres productos de eliminación que se indican a continuación: a) Explique mecanísticamente la formación de estos tres compuestos.
15 aluros de alquilo 15 b) Cuando el compuesto A se calienta con NaMe en Me sólo se forman dos de los productos de eliminación anteriores. Cuáles son? Explique mecanísticamente su formación? a) En la eliminación se emplea metanol, que es una base débil, por lo que el mecanismo será E1. El proceso se iniciará con la formación del carbocatión por heterólisis del enlace C-Br. La formación de los tres alquenos se explica por la presencia de tres carbonos contíguos al centro carbocatiónico, que contienen átomos de hidrógeno eliminables en el mecanismo E1. En el esquema que se indica a continuación se explica la formación de los tres alquenos. b) En la eliminación del apartad b se emplea metóxido sódico, que es una base fuerte, por lo que el mecanismo será E2. La conformación reactiva en este mecanismo sólo contiene dos hidrógenos eliminables, por lo que la reacción formará únicamente los alquenos B y C que se indican a continuación. El alqueno D, que es el producto mayoritario en el mecanismo de eliminación E1, no se forma cuando la reacción transcurre mediante el mecanismo de eliminación E2.
16 16 aluros de alquilo Problema Cuál de las dos reacciones que se indican a continuación es más apropiada para la preparación del isopropil metil éter. Por qué? En el proceso a el isopropil metil éter se forma por el ataque nucleofílico SN2 del anión metóxido sobre el 2-yodopropano. El anión metóxido es nucleofílico, pero también tiene carácter básico y su reacción con el 2-yodopropano también puede formar propeno, como consecuencia de una eliminación E2. Por tanto, el proceso a puede formar la mezcla que se indica a continuación: El anión isopropóxido, al igual que el anión metóxido, también es nucleofílico y básico, pero cuando reacciona con el yoduro de metilo en el proceso b sólo puede formar el producto SN2, ya que la eliminación E2 no puede tener lugar. Por tanto, el mejor método para preparar el isopropil metil éter es el b. Problema Explique por qué cuando el cloruro de mentilo se calienta a reflujo de etanol, en presencia de etóxido sódico, se obtiene el compuesto A como único producto de reacción. En la reacción de eliminación del cloruro de mentilo se emplea etóxido sódico, que es una base fuerte, por lo que el mecanismo será E2. La conformación reactiva del cloruro de mentilo en el proceso E2 sólo contiene un hidrógeno eliminable, por lo que la reacción formará únicamente el alqueno A, tal y como se indica a continuación:
17 aluros de alquilo 17 Problema Explique por qué cuando el cloruro de neomentilo se calienta a reflujo de etanol, en presencia de etóxido sódico, se obtiene una mezcla formada por el compuesto A y el compuesto B. En la reacción de eliminación del cloruro de neomentilo se emplea etóxido sódico, que es una base fuerte, por lo que el mecanismo será E2. La conformación reactiva del cloruro de mentilo en el proceso E2 contiene dos hidrógenos eliminables, por lo que la reacción formará el alqueno A (minoritario por ser disustituido) y el alqueno B (mayoritario por ser trisustituido), tal y como se indica a continuación: Eliminación E2 Cl C 3 C 3 3 C a b Cloruro de neomentilo - a C 3 3 C b - b C 3 a C 3 C 3 3 C C 3 3 C A C 3 C 3 3 C C 3 B Problema Tanto el cis-1-bromo-4-isopropilciclohexano como el trans-1-bromo-4- isopropilciclohexano reaccionan con etóxido de sodio en etanol a reflujo para dar el 4- isopropilciclohexeno. Sin embargo, el isómero cis reacciona mucho más rápidamente que el isómero trans. Proponga una explicación para estos hechos experimentales. Se obtendrá el 4-isopropilciclohexano en forma ópticamente activa? Por qué? En la reacción de eliminación se emplea etóxido sódico, que es una base fuerte, por lo que el mecanismo será E2. Las dos conformaciones del cis-1-bromo-4-isopropilciclohexano se dibujan a continuación. De las dos conformaciones, la más abundante en el equilibrio es la que coloca al grupo isopropilo en ecuatorial. Además, esta conformación más abundante también es la reactiva en E2, puesto que coloca al bromo en axial. Las dos conformaciones del trans-1-bromo-4-isopropilciclohexano se dibujan más abajo. De las dos conformaciones, la más abundante en el equilibrio es la que coloca al grupo isopropilo en ecuatorial pero esta conformación no es reactiva en el proceso E2 porque el bromo está en ecuatorial:
18 18 aluros de alquilo La reacción E2 sigue una cinética de segundo orden y su velocidad depende de la concentración de la base y de la concentración del sustrato reactivo. Por tanto, la eliminación E2 sobre el cis-1-bromo-4-isopropilciclohexano será mucho más rápida que sobre el isómero trans porque la concentración de la conformación reactiva en el cis es mucho mayor que en el trans. La eliminación E2 sobre el cis-1-bromo-4-isopropilciclohexano forma una mezcla racémica, tal y como se indica a continuación: La misma mezcla, aunque a menor velocidad, forma la reacción de eliminación E2 sobre el trans-1-bromo-4-isopropilciclohexano. Problema Cuando el 2-bromobiciclo[2.2.0]octano se calienta en t-butanol en presencia de t-butóxido de potasio se obtiene un producto de reacción. Cuál de los compuestos A, B o C dibujados a continuación se formará en esta reacción? La reacción formará el producto de eliminación B. El compuesto de eliminación A no se puede formar porque viola la regla de Bred. Esta regla indica que un doble enlace no puede estar ubicado en un carbono cabeza de puente en un sistema de anillos con puente, a menos que los ciclos sean suficientemente grandes como para acomodar el doble enlace sin excesiva tensión. Lo contrario equivaldría a tener un enlace doble trans en un anillo pequeño. El compuesto C, que sería el producto de sustitución S N2 tampoco se forma porque el anión t-butóxido no es nucleofílico debido a su gran impedimento estérico.
19 aluros de alquilo 19 Problema Tres bromoalcanos isoméricos A, B y C, de formula molecular C 6 13Br, se convierten en los correspondientes reactivos de Grignard por reacción con Mg en TF. La hidrólisis de cada uno de los reactivos de Grignard proporciona el 2-metilpentano. Cuando A se calienta con metóxido sódico en metanol se obtiene el 2-metilpent-1-eno, como único producto de eliminación. Por otro lado, el calentamiento de B ó C con metóxido sódico en metanol proporciona mayoritariamente el 2-metilpent-2-eno. Con estos datos deduzca las estructuras de A, B y C, sabiendo que este último compuesto es ópticamente activo y tiene configuración S. El esqueleto hidrocarbonado de los bromoalcanos será el del 2-metipentano, puesto que este hidrocarburo es el que se obtiene en la reacción de hidrólisis de cada uno de los reactivos de Grignard. Por tanto, las posibles estructuras de los bromoalcanos serán las siguientes: El bromoalcano I debe ser el compuesto A, puesto que en su reacción de eliminación E2 se formará únicamente 2-metilpent-1-eno. Por tanto A es el 1-bromo2-metilpentano, y sus reacciones son las siguientes: El bromoalcano II debe ser el compuesto B. En su reacción de eliminación E2 se formarán dos compuestos: el 2-metilpent-1-eno y el 2-metilpent-2-eno, pero este último será el mayoritario puesto que es el más sustituido (regla de Saytzev: en la reacción de eliminación de haloalcanos se forma mayoritariamente el producto termodinámicamente más estable, que es el más sustituido). Por tanto B es el 2-bromo2-metilpentano, y sus reacciones son las siguientes: El bromoalcano III debe ser el compuesto C. En su reacción de eliminación E2 se formarán dos compuestos: el 2-metilpent-2-eno y el 4-metilpent-2-eno (como mezcla E/Z). El 2-metilpent-2- eno será el mayoritario puesto que es el más sustituido (regla de Saytzev). El bromoalcano C contiene un estereocentro y su configuración debe ser S, tal y como indica el enunciado del problema. Por tanto, la estructura de C y sus reacciones son las siguientes:
20 20 aluros de alquilo Los bromoalcanos IV y V no pueden ser las estructuras de A, B o C puesto que forman los productos de eliminación que indica el enunciado del problema.
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
Tarea. Sustitución Nucleofílica Alifática
 Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica TESM-ca, Depto. C.B. Academia Química Tarea. Sustitución Nucleofílica Alifática Objetivos Describir e identificar las
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica TESM-ca, Depto. C.B. Academia Química Tarea. Sustitución Nucleofílica Alifática Objetivos Describir e identificar las
Prueba de proceso I ( ) Alumno:... DNI:...
 Prueba de proceso I (27-11-2012) Alumno:.............................................. DNI:............. 1) Escribir el nombre IUPAC de los siguientes compuestos: (0,4 puntos) (S,E)-4-hexen-2-ol trans-3-bromociclohexanol
Prueba de proceso I (27-11-2012) Alumno:.............................................. DNI:............. 1) Escribir el nombre IUPAC de los siguientes compuestos: (0,4 puntos) (S,E)-4-hexen-2-ol trans-3-bromociclohexanol
Tema 6.-Compuestos orgánicos halogenados
 Tema 6.-Compuestos orgánicos halogenados Reacciones de Sustitución y Eliminación La trans-rodofitina es un compuesto halogenado producido por las algas rojas, capaz de disuadir de acercarse a los herbívoros
Tema 6.-Compuestos orgánicos halogenados Reacciones de Sustitución y Eliminación La trans-rodofitina es un compuesto halogenado producido por las algas rojas, capaz de disuadir de acercarse a los herbívoros
Reacciones de Adición
 Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica Reacciones de Adición ITESM-cq, Depto. C.B. Academia Química Reacciones de Adición Objetivos Diferenciar entre una reacción
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica Reacciones de Adición ITESM-cq, Depto. C.B. Academia Química Reacciones de Adición Objetivos Diferenciar entre una reacción
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Termodinámica de las Reacciones, Propiedades Químicas y Adición Electrofílica a Carbono sp 2
 Termodinámica de las Reacciones, Propiedades Químicas y Adición Electrofílica a Carbono sp 2 Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad
Termodinámica de las Reacciones, Propiedades Químicas y Adición Electrofílica a Carbono sp 2 Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad
Desconexión del cloruro de t-butilo
 Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
Reacciones de Sustitución de los Halogenuros de Alquilo
 Reacciones de Sustitución de los Halogenuros de Alquilo Que es una reacción de sustitución? Una reacción de sustitución grupo saliente Una reacción de eliminación El átomo o grupo que es sustituído o eliminado
Reacciones de Sustitución de los Halogenuros de Alquilo Que es una reacción de sustitución? Una reacción de sustitución grupo saliente Una reacción de eliminación El átomo o grupo que es sustituído o eliminado
Departamento de Química del Cinvestav
 Departamento de Química del investav Preguntas tipo examen de admisión de Química rgánica onteste con una sola respuesta a cada pregunta. Si una pregunta tiene más de una respuesta, será anulada. El uso
Departamento de Química del investav Preguntas tipo examen de admisión de Química rgánica onteste con una sola respuesta a cada pregunta. Si una pregunta tiene más de una respuesta, será anulada. El uso
Ejercicios PAU orgánica
 Ejercicios PAU orgánica 1- Dado el 1-butanol, escriba su estructura semidesarrollada. Escriba la estructura semidesarrollada de un isómero de cadena, uno de posición y otro de función. Nombre los compuestos
Ejercicios PAU orgánica 1- Dado el 1-butanol, escriba su estructura semidesarrollada. Escriba la estructura semidesarrollada de un isómero de cadena, uno de posición y otro de función. Nombre los compuestos
Tema 9. Alquenos. Esther Lete Centro Asociado Bizkaia Curso
 Tema 9. Esther Lete Centro Asociado Bizkaia Curso 2011-12 Objetivo Relacionar la estructura con las propiedades físicas y el comportamiento químico de los alquenos, centrado en las REACCIONES de ADICIÓN
Tema 9. Esther Lete Centro Asociado Bizkaia Curso 2011-12 Objetivo Relacionar la estructura con las propiedades físicas y el comportamiento químico de los alquenos, centrado en las REACCIONES de ADICIÓN
ALQUENOS Estructura. Dobles enlaces: C=C 1,34 Å, Kcal/mol. Isomería geométrica: cis/trans
 TEMA 8.- Alquenos. Propiedades generales. Reacciones de adición. Estereoquímica de las reacciones de adición. Reacciones de oxidación. Reacciones en posición alílica. ALQUENOS Estructura C n H 2n Dobles
TEMA 8.- Alquenos. Propiedades generales. Reacciones de adición. Estereoquímica de las reacciones de adición. Reacciones de oxidación. Reacciones en posición alílica. ALQUENOS Estructura C n H 2n Dobles
Comparación entre los calores de hidrogenación del 1-penteno y del trans-2-penteno. 2.6 Kcal/mol. Hº = kcal/mol
 Química rgánica 1 conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de Br al 1,3- butadieno. Reacciones de desplazamiento
Química rgánica 1 conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de Br al 1,3- butadieno. Reacciones de desplazamiento
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
ORGÁNICA II Escribe la reacción de cloruro de hidrógeno con el propeno, nombrando el producto de la reacción: enuncia la regla que has aplicado.
 ORGÁNICA II 13.- Escribe y nombra todos los hidrocarburos de cinco átomos de carbono que tengan un doble enlace. Qué les ocurrirá cuando se hidrogenen?. 14.- _Escribe la fórmula estructural de un ácido
ORGÁNICA II 13.- Escribe y nombra todos los hidrocarburos de cinco átomos de carbono que tengan un doble enlace. Qué les ocurrirá cuando se hidrogenen?. 14.- _Escribe la fórmula estructural de un ácido
a) El compuesto de formula es el 2-cloro-3-metil-2-buteno.
 Modelo 201. Pregunta 3A.- Considere los compuestos orgánicos de fórmula C 3 H 8 O. a) Escriba y nombre los posibles alcoholes compatibles con esa fórmula. b) Escriba y nombre los isómeros de función compatibles
Modelo 201. Pregunta 3A.- Considere los compuestos orgánicos de fórmula C 3 H 8 O. a) Escriba y nombre los posibles alcoholes compatibles con esa fórmula. b) Escriba y nombre los isómeros de función compatibles
Comparación entre los calores de hidrogenación del 1-penteno y del trans-2-penteno. 2.6 Kcal/mol. Hº = kcal/mol
 Química rgánica Tema 8. Dienos 1 Tema 8. Dienos conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de al 1,3- butadieno.
Química rgánica Tema 8. Dienos 1 Tema 8. Dienos conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de al 1,3- butadieno.
Reacciones de adición
 erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO. Guías de Estudio Química 2010
 HIDROCARBUROS AROMÁTICOS Y COMPUESTOS ORGÁNICOS HALOGENADOS ELABORADO POR: LICDA. VIVIAN MARGARITA SANCHEZ GARRIDO. HIDROCARBUROS AROMATICOS (contienen anillos bencénicos) Benceno y sus derivados Hidrocarburos
HIDROCARBUROS AROMÁTICOS Y COMPUESTOS ORGÁNICOS HALOGENADOS ELABORADO POR: LICDA. VIVIAN MARGARITA SANCHEZ GARRIDO. HIDROCARBUROS AROMATICOS (contienen anillos bencénicos) Benceno y sus derivados Hidrocarburos
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH 2 + HBr b) CH 3 CH 2 CH 2 OH + H 2 SO 4 c) C 6 H 6 (benceno)
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH 2 + HBr b) CH 3 CH 2 CH 2 OH + H 2 SO 4 c) C 6 H 6 (benceno)
GUÍA DE EJERCICIOS. 5) Cuáles de los compuestos del problema anterior pueden existir como un par de enantiómeros? H 3 C CH 3 CH 3
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. olegio Santo Tomás de Villanueva Departamento de iencias átedra: Química Orgánica Año: 5 A, B Prof. Luis Aguilar GUÍA
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. olegio Santo Tomás de Villanueva Departamento de iencias átedra: Química Orgánica Año: 5 A, B Prof. Luis Aguilar GUÍA
C Cl 2sp 3 3p. C Br 2sp 3 4p C X = C X
 Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol
 COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
QUÍMICA - 2º DE BACHILLERATO EJERCICIOS DE SELECTIVIDAD UNIDADES 8 Y 9: QUÍMICA ORGÁNICA CUESTIONES 1
 CUESTIONES 1 HOJA 8-1 2002 modelo: Escribe el nombre de los compuestos que se indican a continuación: a) CH 3 -CH 2 COOCH 3 b) CH 3 -CH 2 CO CH 2 CH 3 c) CH 3 CHOH- CH 2 CH = CH 2 d) CH 3 -CH 2 NH 2 e)
CUESTIONES 1 HOJA 8-1 2002 modelo: Escribe el nombre de los compuestos que se indican a continuación: a) CH 3 -CH 2 COOCH 3 b) CH 3 -CH 2 CO CH 2 CH 3 c) CH 3 CHOH- CH 2 CH = CH 2 d) CH 3 -CH 2 NH 2 e)
REACCIONES EN QUÍMICA ORGÁNICA (I)
 (I) INTRODUCCIÓN * Debido al carácter covalente de los compuestos orgánicos, no aparecen en la Química orgánica reacciones iónicas, que tan frecuentes son en Química inorgánica. *Los enlaces son fuertes,
(I) INTRODUCCIÓN * Debido al carácter covalente de los compuestos orgánicos, no aparecen en la Química orgánica reacciones iónicas, que tan frecuentes son en Química inorgánica. *Los enlaces son fuertes,
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
F FA AC C U ULTAD LTAD D D E
 FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
Capítulo 6. Estereoquímica II.
 apítulo 6. Estereoquímica II. La química orgánica tiene como uno de sus objetivos conocer la relación entre estructura molecular y propiedades. La rama que se ocupa de la estructura en tres dimensiones
apítulo 6. Estereoquímica II. La química orgánica tiene como uno de sus objetivos conocer la relación entre estructura molecular y propiedades. La rama que se ocupa de la estructura en tres dimensiones
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
TEMA 4. ESTRUCTURA DE LAS MOLÉCULAS ORGÁNICAS
 W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
Trabajo 3. Éteres y Epóxidos.
 Universidad Central del Ecuador 1 Trabajo 3. Éteres y Epóxidos. - Resolución de Problemas Francis Carey Cap. 16 (pág. 706 710) 16.26 Cuando se deja reposar el (R)-(+)-2-fenil-2-butanol en metanol que contienen
Universidad Central del Ecuador 1 Trabajo 3. Éteres y Epóxidos. - Resolución de Problemas Francis Carey Cap. 16 (pág. 706 710) 16.26 Cuando se deja reposar el (R)-(+)-2-fenil-2-butanol en metanol que contienen
18 Reacciones orgánicas
 Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS
 Nombre: Mayra Morales Carrera: Bioquímica y Farmacia ACIDEZ UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS Los ácidos carboxílicos son compuestos
Nombre: Mayra Morales Carrera: Bioquímica y Farmacia ACIDEZ UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS Los ácidos carboxílicos son compuestos
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
PROFESOR JANO QUÍMICA
 ω2estforg20000702 En el análisis elemental por combustión de una sustancia orgánica se obtuvieron los siguientes resultados: 52 7 % de carbono, 3 04 % de hidrógeno y 34 79 % de oxígeno. a) Deduzca la fórmula
ω2estforg20000702 En el análisis elemental por combustión de una sustancia orgánica se obtuvieron los siguientes resultados: 52 7 % de carbono, 3 04 % de hidrógeno y 34 79 % de oxígeno. a) Deduzca la fórmula
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
Los enlaces C F son polares pero la geometría tetraédrica
 1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
1 PAU Química. Modelo 2010 PRIMERA PARTE Cuestión 1. Dadas las siguientes sustancias: CO 2, CF 4, H 2 CO y HF: a) Escriba las estructuras de Lewis de sus moléculas. b) Explique sus geometrías por la teoría
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS
 TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
o 0.96A o 1.43A 0.96A O O H CH 3 H
 Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
TEMA 6. LAS REACCIONES EN EL ENLACE COVALENTE
 TEMA 6. LAS REAIONES EN EL ENLAE OVALENTE 1. Tipos de reacciones orgánicas. 1.1. Reacciones de adición. 1.2. Reacciones de sustitución. 1.3. Reacciones de eliminación. 1.4. Reacciones de transposición.
TEMA 6. LAS REAIONES EN EL ENLAE OVALENTE 1. Tipos de reacciones orgánicas. 1.1. Reacciones de adición. 1.2. Reacciones de sustitución. 1.3. Reacciones de eliminación. 1.4. Reacciones de transposición.
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA 2º DE BACHILLERATO. Química del carbono
 DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA º DE BACHILLERATO Actividades tema 1 Química del carbono Los compuestos del carbono 1.-En el cuadro de abajo tienes una relación de fórmulas
DEPARTAMENTO DE FÍSICA Y QUÍMICA PROFESOR: LUIS RUIZ MARTÍN QUÍMICA º DE BACHILLERATO Actividades tema 1 Química del carbono Los compuestos del carbono 1.-En el cuadro de abajo tienes una relación de fórmulas
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
Cómo Reaccionan los Alquenos?, Adición de diferentes Reactivos.
 Cómo Reaccionan los Alquenos?, Adición de diferentes Reactivos. Mario Manuel Rodas Morán Universidad de San Carlos de Guatemala Faculta de Ciencias Químicas y Farmacia Departamento de Química Orgánica
Cómo Reaccionan los Alquenos?, Adición de diferentes Reactivos. Mario Manuel Rodas Morán Universidad de San Carlos de Guatemala Faculta de Ciencias Químicas y Farmacia Departamento de Química Orgánica
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO.
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO MATERIA: QUÍMICA Curso 010-011 INSTRUCCIONES Y CRITERIOS GENERALES DE CALIFICACIÓN La
Nomenclatura empírica o común de los ácidos carboxílicos. Nomenclatura IUPAC de los ácidos carboxílicos
 Nomenclatura empírica o común de los ácidos carboxílicos Poseen nombres derivados de su fuente original: Ácido fórmico (HCOOH) segregado por las hormigas Ácido acético (CH 3 COOH) contenido e integrante
Nomenclatura empírica o común de los ácidos carboxílicos Poseen nombres derivados de su fuente original: Ácido fórmico (HCOOH) segregado por las hormigas Ácido acético (CH 3 COOH) contenido e integrante
EJERCICIOS PARA EL PRIMER EXAMEN PARCIAL
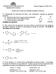 UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
EN PRESENCIA DE UN CATALIZADOR ADECUADO, EL HIDRÓGENO SE AGREGA AL ALQUINO, REDUCIÉNDOLO PARA DAR UN ALCANO.
 REACCIONES DE ADICIÓN ELECTROFÍLICA EN ALQUINOS (X 2, HX, H3O+). MUCHAS DE LAS REACCIONES DE LOS ALQUINOS SON SEMEJANTES A LAS REACCIONES CORRESPONDIENTES DE LOS ALQUENOS, PORQUE AMBAS IMPLICAN ENLACES
REACCIONES DE ADICIÓN ELECTROFÍLICA EN ALQUINOS (X 2, HX, H3O+). MUCHAS DE LAS REACCIONES DE LOS ALQUINOS SON SEMEJANTES A LAS REACCIONES CORRESPONDIENTES DE LOS ALQUENOS, PORQUE AMBAS IMPLICAN ENLACES
QUÍMICA ORGÁNICA MODELO 2015
 QUÍMICA ORGÁNICA MODELO 2015 1- Un alcohol insaturado A, de fórmula C 5 H 10 O, se oxida y se obtiene 3 penten 2 ona, mientras que la deshidratación del alcohol A con ácido sulfúrico conduce a 1,3 pentadieno.
QUÍMICA ORGÁNICA MODELO 2015 1- Un alcohol insaturado A, de fórmula C 5 H 10 O, se oxida y se obtiene 3 penten 2 ona, mientras que la deshidratación del alcohol A con ácido sulfúrico conduce a 1,3 pentadieno.
ISOMERÍA. Isómeros con fórmula molecular C4H10
 ISOMERÍA 2º BACHILLER 1. Definición de isomería Los isómeros son dos o más compuestos que tienen igual fórmula molecular, pero distinta fórmula desarrollada o espacial, es decir, se distinguen en las diversas
ISOMERÍA 2º BACHILLER 1. Definición de isomería Los isómeros son dos o más compuestos que tienen igual fórmula molecular, pero distinta fórmula desarrollada o espacial, es decir, se distinguen en las diversas
EJERCICIO DE EXAMEN DE QUÍMICA ORGÁNICA
 EJERCICIO DE EXAMEN DE QUÍMICA ORGÁNICA 1. Para saber si una sustancia sólida esta pura cuál de los siguientes criterios sería el más apropiado: a) Solubilidad b) λ absorción en el U.V. c) Ausencia de
EJERCICIO DE EXAMEN DE QUÍMICA ORGÁNICA 1. Para saber si una sustancia sólida esta pura cuál de los siguientes criterios sería el más apropiado: a) Solubilidad b) λ absorción en el U.V. c) Ausencia de
CH 2=CH 2 + H 2O. E. de hidrógeno H2SO4 180ºC. R: Radical alquílico CH3
 QUÍMIA ORGÁNIA. UESTIONES. 2002 Los compuestos 3 2O y 3 2 3 tienen masas moleculares similares. Indique, justificando la respuesta: a. uál tiene mayor punto de fusión. b. uál de ellos puede experimentar
QUÍMIA ORGÁNIA. UESTIONES. 2002 Los compuestos 3 2O y 3 2 3 tienen masas moleculares similares. Indique, justificando la respuesta: a. uál tiene mayor punto de fusión. b. uál de ellos puede experimentar
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio Fase general OPCIÓN A
 1 PAU Química. Junio 2010. Fase general OPCIÓN A Cuestión 1A. El elemento de número atómico 12 se combina fácilmente con el elemento de número atómico 17. Indique: a) La configuración electrónica de los
1 PAU Química. Junio 2010. Fase general OPCIÓN A Cuestión 1A. El elemento de número atómico 12 se combina fácilmente con el elemento de número atómico 17. Indique: a) La configuración electrónica de los
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO
 QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO EJERCICIOS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2013) DOMINGO
1. LA HIDROGENACIÓN 2. LA HALOGENACIÓN: REACCIONES DE ALQUENOS ADICIÓN AL DOBLE ENLACE
 REACCIONES DE ALQUENOS ADICIÓN AL DOBLE ENLACE 1 EN PRINCIPIO SE PODRÍAN AGREGAR MUCHOS REACTIVOS DISTINTOS A UN DOBLE ENLACE PARA FORMAR PRODUCTOS MÁS ESTABLES, ESTO ES LAS REACCIONES SON FAVORABLES ENERGÉTICAMENTE.
REACCIONES DE ALQUENOS ADICIÓN AL DOBLE ENLACE 1 EN PRINCIPIO SE PODRÍAN AGREGAR MUCHOS REACTIVOS DISTINTOS A UN DOBLE ENLACE PARA FORMAR PRODUCTOS MÁS ESTABLES, ESTO ES LAS REACCIONES SON FAVORABLES ENERGÉTICAMENTE.
Lección 9: HALUROS DE ALQUILO I
 Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
Lección 9: HALUROS DE ALQUILO I 1.Estructura y propiedades físicas. 2. Polaridad de las moléculas orgánicas: interacciones no enlazantes entre moléculas. 3. Efecto inductivo. 4. Concepto de electrófilo
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
EN QUÉ CONSISTE EL FENÓMENO DE LA ISOMERÍA?
 EN QUÉ CONSISTE EL FENÓMENO DE LA ISOMERÍA? DESEMPEÑO ESPERADO: EL ESTUDIANTE ENCUENTRA ISÓMEROS ESTRUCTURALES Y GEOMÉTRICOS, DIFERENCIÁNDOLOS A PARTIR DE SUS NOMBRES IUPAC. 1. INTRODUCCIÓN El alcohol
EN QUÉ CONSISTE EL FENÓMENO DE LA ISOMERÍA? DESEMPEÑO ESPERADO: EL ESTUDIANTE ENCUENTRA ISÓMEROS ESTRUCTURALES Y GEOMÉTRICOS, DIFERENCIÁNDOLOS A PARTIR DE SUS NOMBRES IUPAC. 1. INTRODUCCIÓN El alcohol
Reacciones de Sustitución Electrofílica Aromática (S E Ar) Halogenación: Bromación y Cloración. Alquilación de Friedel-Crafts
 TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2009 PRIMERA PARTE
 1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO
 QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) DOMINGO
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) DOMINGO
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS ORGÁNICA II
 UNIVERIDAD CENTRAL DEL ECUADR FACULTAD DE CIENCIA QUÍMICA RGÁNICA II INTEGRANTE: CARRERA: Calderón Varela Ana QUÍMICA Durán Jácome Lorena QUÍMICA Y FARMACIA 16.27 La oxidación del 4-terc-butilsulfuro con
UNIVERIDAD CENTRAL DEL ECUADR FACULTAD DE CIENCIA QUÍMICA RGÁNICA II INTEGRANTE: CARRERA: Calderón Varela Ana QUÍMICA Durán Jácome Lorena QUÍMICA Y FARMACIA 16.27 La oxidación del 4-terc-butilsulfuro con
Universidad de Puerto Rico Recinto de Río Piedras Facultad de Ciencias Naturales Departamento de Química. Química 3031 Nombre
 Universidad de Puerto Rico Recinto de Río Piedras Facultad de iencias aturales Departamento de Química Química 3031 ombre Primer Examen Parcial úmero de Estudiante 12 de septiembre de 2013 Sección de onferencia
Universidad de Puerto Rico Recinto de Río Piedras Facultad de iencias aturales Departamento de Química Química 3031 ombre Primer Examen Parcial úmero de Estudiante 12 de septiembre de 2013 Sección de onferencia
Tema 11: Química Orgánica
 Tema 11: Química Orgánica 1.Los alcanos tienen por formula general A) C n H 2n 4 B) C n H 2n 2 C) C n H 2n D) C n H 2n+2 E) C n H 2n+4 2.Los alquenos tienen por formula general A) C n H 2n 4 B) C n H 2n
Tema 11: Química Orgánica 1.Los alcanos tienen por formula general A) C n H 2n 4 B) C n H 2n 2 C) C n H 2n D) C n H 2n+2 E) C n H 2n+4 2.Los alquenos tienen por formula general A) C n H 2n 4 B) C n H 2n
Capítulo 4. Reacciones orgánicas.
 apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
apítulo 4. Reacciones orgánicas. Una reacción química se puede definir como un proceso de interacción entre especies químicas en el que, como consecuencia de la ruptura y formación de enlaces, se origina
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH + HBr b) CH 3 CH CH OH + H SO 4 c) C 6 H 6 (benceno) + HNO 3
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH + HBr b) CH 3 CH CH OH + H SO 4 c) C 6 H 6 (benceno) + HNO 3
los compuestos orgánicos.
 2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
2ª Parte: Estructura y reactividad de los compuestos orgánicos. 2.- Principales familias de compuestos orgánicos: - Hidrocarburos alifáticos: alcanos, alquenos y alquinos. - Hidrocarburos aromáticos. -
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO
 PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
PROBLEMAS DE ESTEQUIOMETRÍA DE 1º DE BACHILLERATO COLECCIÓN PRIMERA. 1. La descomposición térmica del carbonato de calcio produce óxido de calcio y dióxido de carbono gas. Qué volumen de dióxido de carbono,
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH + HBr b) CH 3 CH CH OH + H SO 4 c) C 6 H 6 (benceno) + HNO 3
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH + HBr b) CH 3 CH CH OH + H SO 4 c) C 6 H 6 (benceno) + HNO 3
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
acetileno enlace σ C sp -C sp enlace σ C sp -H 1s H C C H C C sistema de orbitales π del acetileno Química Orgánica Tema 7.
 Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. eacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de hidrácidos
Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. eacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de hidrácidos
Capítulo 11- Hidrocarburos Insaturados 11.3 Reacción de Adición
 Capítulo 11- Hidrocarburos Insaturados 1 11.3 Reacción de Adición Reacciones de Adición 2 En alquenos y Alquinos, el doble o triple enlace se rompe fácilmente, proveyendo electrones para formar nuevo enlaces.
Capítulo 11- Hidrocarburos Insaturados 1 11.3 Reacción de Adición Reacciones de Adición 2 En alquenos y Alquinos, el doble o triple enlace se rompe fácilmente, proveyendo electrones para formar nuevo enlaces.
Química Orgánica. 2º de Bachillerato
 1. Cuáles de los siguientes pares de compuestos son isómeros? En los casos en que sean isómeros decir que tipo de isomería presentan. a. Butano y metilpropano. b. Propeno y propino. c. Metilciclopropano
1. Cuáles de los siguientes pares de compuestos son isómeros? En los casos en que sean isómeros decir que tipo de isomería presentan. a. Butano y metilpropano. b. Propeno y propino. c. Metilciclopropano
Perspectiva de las reacciones orgánicas 25/06/2012
 Considera lo diferente que es la química respecto de otras ramas de la ciencia. Por ejemplo, tienen los astrónomos la posibilidad de sintetizar nuevas estrellas para comparar su comportamiento y propiedades
Considera lo diferente que es la química respecto de otras ramas de la ciencia. Por ejemplo, tienen los astrónomos la posibilidad de sintetizar nuevas estrellas para comparar su comportamiento y propiedades
Adición. Eliminación. Sustitución
 Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES DE FINAL DE UNIDAD Desplazamientos electrónicos 1. Explica, mediante algún ejemplo, qué significa que el ejerza efecto inductivo, I, y efecto
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES DE FINAL DE UNIDAD Desplazamientos electrónicos 1. Explica, mediante algún ejemplo, qué significa que el ejerza efecto inductivo, I, y efecto
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Química
 GRUPOS FUNCIONALES Se denomina función a un átomo, o grupo de átomos, que reemplaza uno o varios átomos de hidrógeno en la molécula de un hidrocarburo, confiriendo a la sustancia resultante propiedades
GRUPOS FUNCIONALES Se denomina función a un átomo, o grupo de átomos, que reemplaza uno o varios átomos de hidrógeno en la molécula de un hidrocarburo, confiriendo a la sustancia resultante propiedades
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo Curso 2009-2010 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A ESTUDIOS UNIVERSITARIOS (LOGSE) Modelo Curso 2009-2010 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba consta de dos
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD
 TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
TEMA 02 CONVERSIÓN, TERMODINÁMICA, CINÉTICA REACTIVIDAD Conversión: porcentaje de transformación de los reactivos en productos CONVERSIÓN (K eq ) ESTABILIDAD [CONTENIDO ENERGÉTICO (exo-endo)] [GRADO DE
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEORÍA Y PROBLEMAS RESUELTOS DE QUÍMICA ORGÁNICA HACIA UNA QUÍMICA PARA EL SIGLO XXI
 TEORÍA Y PROBLEMAS RESUELTOS DE QUÍMICA ORGÁNICA HACIA UNA QUÍMICA PARA EL SIGLO XXI Proyecto editorial BiBlioteca de Químicas director: Carlos Seoane Prado catedrático de Química orgánica universidad
TEORÍA Y PROBLEMAS RESUELTOS DE QUÍMICA ORGÁNICA HACIA UNA QUÍMICA PARA EL SIGLO XXI Proyecto editorial BiBlioteca de Químicas director: Carlos Seoane Prado catedrático de Química orgánica universidad
PROGRAMA DE ESTUDIO. Horas de Práctica
 Nombre de la asignatura: QUÍMICA ORGÁNICA 1 PROGRAMA DE ESTUDIO Clave: QUI04 Ciclo Formativo: Básico ( ) Profesional ( X ) Especializado ( ) Fecha de elaboración: MARZO DE 2015 Horas Semestre Horas semana
Nombre de la asignatura: QUÍMICA ORGÁNICA 1 PROGRAMA DE ESTUDIO Clave: QUI04 Ciclo Formativo: Básico ( ) Profesional ( X ) Especializado ( ) Fecha de elaboración: MARZO DE 2015 Horas Semestre Horas semana
Masas atómicas (g/mol): O = 16; S = 32; Zn = 65,4. Sol: a) 847 L; b) 710,9 g; c) 1,01 atm.
 1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
1) Dada la siguiente reacción química: 2 AgNO3 + Cl2 N2O5 + 2 AgCl + ½ O2. a) Calcule los moles de N2O5 que se obtienen a partir de 20 g de AgNO3. b) Calcule el volumen de O2 obtenido, medido a 20 ºC y
JUNIO FASE ESPECÍFICA. QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
JUNIO 2011. FASE ESPECÍFICA. QUÍMICA. OPCIÓN A 1. (2,5 puntos) Disponemos de los pares redox (Fe 2+ /Fe) y (O 2 /H 2 O), con potenciales estándar de reducción 0,44 V y +1,23 V, respectivamente. Con ellos
QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)
![QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g) QUÍMICA. [ΔH afinidad Cl(g)] = -349 kj mol -1 (0,25 puntos) K + (g) + Cl - (g)](/thumbs/49/25837773.jpg) OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
OPCIÓN A QUÍMICA. 1. (2,5 puntos) Construya el ciclo de Born-aber y calcule la energía de red (Δ red ) del KCl(s) a partir de los siguientes datos: Entalpía estándar de formación del KCl(s) [Δ f (KCl)]
QUÍMICA 2º Bachillerato Ejercicios: Química Orgánica
 1(6) Ejercicio nº 1 a) CH 2 =CH 2 + H 2 b) C 6 H 6 (benceno) + Cl 2 c) C 2 H 6 + O 2 Ejercicio nº 2 a) CH 4 + Cl 2 Luz b) CH 2 =CHCH 3 + H 2 c) CH 3 OH + O 2 Ejercicio nº 3 a) CH 2 =CHCH 3 + HCl b) CH
1(6) Ejercicio nº 1 a) CH 2 =CH 2 + H 2 b) C 6 H 6 (benceno) + Cl 2 c) C 2 H 6 + O 2 Ejercicio nº 2 a) CH 4 + Cl 2 Luz b) CH 2 =CHCH 3 + H 2 c) CH 3 OH + O 2 Ejercicio nº 3 a) CH 2 =CHCH 3 + HCl b) CH
ESTRUCTURA DE LA MATERIA QCA 01 ANDALUCÍA. 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad.
 1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
1.- Defina: a) Energía de ionización. b) Afinidad electrónica. c) Electronegatividad. 2.- Razone si son verdaderas o falsas las siguientes afirmaciones: a) El punto de ebullición del butano es menor que
