INSTITUTO TECNOLOGICO METROPOLITANO Establecimiento Público de Educación Superior, Adscrito a la Alcaldía de Medellín. Taller Repaso Evaluación 1
|
|
|
- Antonio Márquez Ayala
- hace 6 años
- Vistas:
Transcripción
1 Taller Repaso Evaluación 1 1. Las partículas representadas en el esquema conforman: a. un átomo b. un elemento c. un compuesto d. una mezcla 2. Completar la siguiente tabla: ELEMENTO N N N N N ATÓMICO MÁSICO PROTONES ELECTRONES NEUTRONES Be 4 9 Na Ca Cu Br Fe Mg P Ag Enuncie los modelos atómicos desde Demócrito hasta el modelo actual y postulado principal de cada uno.
2 4. Dado el átomo 27 Al, hallar: a. Estructura atómica 5. Hallar el conjunto de números cuánticos para el orbital 5f, 3d y 5s y el número de electrones que se encuentran en dichos orbitales. 6. Explique para cada uno de los números cuánticos: a. Que representa b. Que define c. Que valores toman 7. Uno de los componentes más dañinos de los residuos nucleares es un isótopo radiactivo del estroncio 90Sr38; puede depositarse en los huesos, donde sustituye al calcio. Cuántos protones y neutrones hay en el núcleo del Sr-90? 8. Qué cantidad de electrones tiene el subnivel 3d en un átomo de Br en su estado fundamental. 9. Qué partículas hay en el núcleo del 18 O8 Cuál es su número atómico? y su número másico? Y su masa atómica? 10. Haz un mapa conceptual con los siguientes conceptos: átomo, núcleo, protones, neutrones, corteza, número másico, número atómico, electrones, carga positiva, carga neutra, carga negativa, masa del átomo. 11. Tanto el oxígeno (O2) como el dióxido de carbono (CO2) son sustancias gaseosas. Son elementos o compuestos? Por qué? Qué son átomos isótopos? Explícalo y pon un ejemplo.
3 12. Qué explica el modelo atómico de Dalton? a. La materia está constituida por átomos b. Los átomos tienen un núcleo muy pequeño donde se concentra casi toda la masa c. Los fenómenos eléctricos d. Ninguna de las otras respuestas 13. Qué explica el modelo atómico de Thomson? a. La materia no está constituida por átomos. b. Los átomos tienen un núcleo muy pequeño donde se concentra casi toda la masa. c. Los fenómenos eléctricos. d. Ninguna de las otras respuestas. 14. Señala las afirmaciones correctas. a. Rutherford descubrió que el átomo era prácticamente hueco. b. Rutherford descubrió que casi toda la masa del átomo se encontraba alrededor de un núcleo muy pequeño y hueco. c. Rutherford descubrió la existencia de neutrones. d. Rutherford descubrió la existencia de electrones. 15. Señala las afirmaciones correctas. a. En valor absoluto, la carga de un electrón y de un protón son iguales. b. La carga de un protón y de un neutrón son iguales en valor absoluto. c. El protón tiene carga negativa. d. La masa de un neutrón y de un protón son muy diferentes. e. La masa de un electrón es muy superior a la de un neutrón. 16. Dónde se encuentra cada partícula subatómica? a. El electrón se encuentra en el núcleo. b. El neutrón se encuentra en la corteza. c. El neutrón se encuentra en el núcleo. d. El protón se encuentra en la corteza
4 17. Distribución de la carga eléctrica en el átomo. a. La carga eléctrica del núcleo es positiva. b. La carga eléctrica del núcleo es negativa. c. La carga eléctrica de la corteza es positiva. d. La carga eléctrica de la corteza es neutra. 18. Átomos: Definiciones (1) es el número de (2) que contiene el núcleo, coincide con el número de (3) sólo si el átomo es neutro. Los (4) se caracterizan por su número atómico; es decir, por el número de (5) del núcleo. Átomos con diferente número de protones pertenecen a elementos (6). (7) es el número de nucleones del núcleo atómico; es decir, la suma total de (8) y (9) del núcleo. Átomos de un mismo elemento que tienen diferente número de (10) se denominan isótopos de dicho elemento. Los isótopos de un elemento siempre tienen el mismo número de (11). 19. Átomos: Definiciones Se llama masa atómica de un elemento a la masa de uno de sus (1) medida en (2). La unidad de masa atómica se ha tomado como la (3) parte de la masa de carbono-12 Iones son átomos que ha perdido o ganado (4) quedando cargados eléctricamente. Los iones que han perdido electrones serán iones (5), también llamados (6).
5 Los iones que han ganado electrones serán iones (7), también llamados (8) 20. Tenemos dos isótopos de un mismo elemento. El primero tiene de número másico 35 y el segundo de número másico 37. El primero es neutro. El segundo es un anión con carga -1 que tiene 18 electrones. Completa el número de partículas de cada isótopo: a. Isótopo primero: (1) protones, (2) electrones, (3) neutrones. b. Isótopo segundo: (4) protones,(5) electrones,(6) neutrones. 21. Si el número atómico es 17: a. El átomo tendrá electrones si el átomo es neutro. b. El átomo tendrá electrones si el átomo tiene de carga +2. c. El átomo tendrá electrones si el átomo tiene de carga Completa: a. Si un átomo tiene de carga +3 y contiene 25 electrones, su número atómico es. b. Si un átomo tiene de carga -2 y contiene 15 electrones, su número atómico es. c. Si un átomo es neutro y contiene 35 electrones, su número atómico es. 23. Clasifique cada una de las siguientes como sustancia pura o mezcla. Si se trata de una mezcla, indique si es homogénea o heterogénea: a. arroz con leche b. agua de mar c. magnesio d. gasolina. 24. Escriba el símbolo químico o el nombre de los siguientes elementos, según corresponda: a. Azufre b. Magnesio
6 c. Potasio d. Cloro e. Cobre f. F g. Ni h. Na i. Al j. Si. 25. Una sustancia sólida blanca, A, se calienta intensamente en ausencia de aire. Se descompone para formar una nueva sustancia blanca, B, y un gas, C. El gas tiene exactamente las mismas propiedades que el producto que se obtiene cuando se quema carbono con exceso de oxígeno. Según estas observaciones, podemos determinar si los sólidos A y B, y el gas C son elementos o compuestos? Explique sus conclusiones para cada sustancia 26. En el proceso de intentar caracterizar una sustancia, un químico hace las siguientes observaciones: la sustancia es un metal blanco plateado lustroso. Funde a 649 C y hierve a 1105 C. Su densidad a 20 C es g/cm3. La sustancia arde en el aire produciendo una intensa luz blanca. Reacciona con cloro para formar un sólido blanco quebradizo. La sustancia puede moldearse para formar láminas delgadas, o estirarse para formar alambres. Es buena conductora de electricidad. Cuáles de estas características son propiedades físicas, y cuáles son propiedades químicas? 27. Clasifique cada uno de los siguientes procesos como físicos o químicos: a. corrosión de aluminio metálico b. fundición de hielo c. pulverización de una aspirina d. digestión de un dulce
7 e. explosión de nitroglicerina. 28. Sugiera un método para separar cada una de las siguientes mezclas en dos componentes: a. azúcar y arena b. hierro y azufre 29. Qué representa el siguiente dibujo, un átomo neutro o un ion? Escriba su símbolo químico completo incluyendo el número de masa, el número atómico y la carga neta (si la tiene). 30. Responda a las siguientes peguntas a. Cuáles son las principales partículas subatómicas que forman un átomo? b. Cuál es la carga relativa (en múltiplos de la carga electrónica) de cada una de las partículas? c. Cuál de las partículas es la de mayor cantidad de masa? (d) Cuál es la de menor masa? 31. Complete los espacios en la siguiente tabla, asuma que cada columna representa un átomo neutro:
8 32. Escriba el símbolo correcto, tanto su superíndice como su subíndice, para cada uno de los siguientes. a. el isótopo del platino que contiene 118 neutrones b. el isótopo del criptón con número de masa 84 c. el isótopo de arsénico con número de masa 75 d. el isótopo de magnesio que tiene el mismo número de protones y de neutrones. 33. Para n=4, a. cuáles son los valores posibles de l? b. para l=2, cuales son los valores posibles de ml c. si ml es igual a 2, cuales son los valores posibles de l? 34. Escriba los valores numéricos de n y l que corresponden a cada una de las siguientes designaciones de orbitales: a. 3p b. 2s c. 4f d. 5d 35. Cuál es el número máximo de electrones que pueden ocupar cada una de las siguientes subcapas a. 3p b. 5d
9 c. 2s d. 4f 36. Con base en tu experiencia, describe el aspecto que presentan las siguientes mezclas y de acuerdo con esto clasifícalas en homogéneas o heterogéneas y explica brevemente por qué. Mezcla Descripción Tipo de mezcla Agua y aceite Disolución acuosa de sal Azufre y agua Alcohol y agua Gasolina Salsa mexicana 37. Una mezcla está formada por dos o más sustancias diferentes que: a. conservan su individualidad b. pierden sus propiedades c. adquieren propiedades nuevas d. una vez unidas no se pueden separar 38. En una mezcla, sus componentes: a. están en proporciones constantes b. se combinan proporcionalmente de uno a uno c. se separan por métodos químicos d. se encuentran en proporción variable
10 MEZCLAS su composición es INSTITUTO TECNOLOGICO METROPOLITANO 39. Cuál de los siguientes ejemplos corresponde a una mezcla: a) sal b) agua c) leche d) alcohol 40. Escribe dentro del paréntesis (HO) si el enunciado corresponde a una mezcla homogénea o (HE) si corresponde a una mezcla heterogénea. a. ( ) Sus componentes se distinguen a simple vista o con ayuda de una lupa b. ( ) Su composición es la misma en cualquier punto de la mezcla c. ( ) Posee uniformidad en sus propiedades d. ( ) Son ejemplos la gasolina y el vino e. ( ) Tiene distinta composición por donde se observe f. ( ) Es un ejemplo el jugo de naranja recién hecho 41. Escribe 3 ejemplos de Mezclas homogéneas Mezclas heterogéneas 42. Diagrama conceptual. Completa el siguiente mapa colocando en el rectángulo el concepto que corresponda. Fases 3 Homogéneas 2 Variable 1 Soluto y disolvente 4 AGU Se contaminan fácilmente formando
11 43. Clasifica los ejemplos de mezclas que se encuentran en el rectángulo anotándolos en el cuadro sinóptico. aire, tierra, agua con aceite, madera, ensalada de frutas, agua con arena, agua potable, jugo de naranja, vinagre, agua de la llave, gasolina, bronce 44. Un método para separar una mezcla homogénea de líquidos seria:
12 a. Decantación b. Sublimación c. Filtración d. Destilación 45. Método que emplearías para separar una mezcla formada por un líquido con un sólido insoluble: a. Filtración b. Sublimación c. Cristalización d. Destilación 46. Para separar una mezcla de agua y aceite utilizarías el método de: a. Filtración b. Decantación c. Sublimación d. Cristalización 47. Cuál de los siguientes pares de métodos utilizarías para separar los componentes de una mezcla de sal, azufre y agua (la sal se disuelve en agua, el azufre no): a. Imantación y filtración b. Evaporación y centrifugación c. Decantación e imantación d. Filtración y evaporación 48. Elige la opción que contenga la característica de un cambio físico: a. No cambia la naturaleza intima de la materia. b. La cantidad de materia no se conserva. c. La naturaleza íntima de las sustancias sufren transformación. d. Las sustancias no conservan sus propiedades.
13 49. Los estados físicos que encontramos durante la ebullición del agua son: a. Líquido b. Líquido y gaseoso c. Sólido, líquido y gaseoso d. Sólido y líquido 50. Escribe dentro del paréntesis (V) si el enunciado es verdadero o (F) si es falso. a. En la mezcla homogénea sus componentes no se distinguen a simple vista. b. Las mezclas heterogéneas presentan una separación de fases. c. Los componentes de una mezcla homogénea forman una sola fase. d. En la mezcla heterogénea sus componentes se distinguen a simple vista. e. Los componentes de una mezcla homogénea se separan por método químicos,. f. Las mezclas heterogéneas forman una sola fase. 51. Si se sabe que el carbonato de calcio es insoluble en agua y se coloca un gramo de esta sustancia en 10 ml de agua y se agita perfectamente, el tipo de mezcla que se forma es? Por qué? 52. Cuál de los siguientes esquemas representa una mezcla heterogénea y explica brevemente por qué? A B 53. Con el código que a continuación se te proporciona, elabora los modelos (dibujos) que representen a las siguientes sustancias: Código
14 Elemento A = Elemento B = a. Una mezcla de elementos A y B b. Un compuesto AB c. Uno de los elementos d. Una mezcla de uno de los elemento con el compuesto AB a b c d 54. Dados los siguientes conjuntos de números cuánticos, establecer cuáles son posibles o imposibles, JUSTIFICADAMENTE: (5, 3, 4, ½) (3, 1, -1, -½) (4, 3, 3, ½) (2, 1, -1, 0) (2, -1, 0, ½) (3, - 4, 1, -½) 55. Todos los átomos de un mismo elemento tienen: a. Mismo número de electrones b. Mismo número de protones c. Mismo número de neutrones 56. Cuál de las siguientes aseveraciones es correcta para un electrón que tiene los números cuánticos n = 4 y ml = -2? a. el electrón se encuentra en la segunda capa principal b. el electrón podría estar en un orbital p c. el electrón podría estar en un orbital d d. el electrón debe tener un número cuántico de spin ms = + ½ e. ninguna de las anteriores aplica a este electrón
15 57. El principio de Incertidumbre de Heisenberg establece que: a. No es posible conocer ya sea el momento o la posición de un electrón con precisión b. No es posible conocer el momento de un electrón sin saber la posición c. Es posible conocer el momento o la posición de un electrón, pero no ambos simultáneamente d. Es posible conocer ambas variables, pero en experimentos separados e. Ninguno de los anteriores 58. Según el modelo de Bohr para el átomo de hidrógeno, el radio de la órbita: a. es proporcional a n2. b. es menor a mayores estados energéticos. c. aumenta cuando un fotón de luz es emitido desde un átomo excitado. d. puede tener cualquier valor mayor que el radio del estado base. e. ninguno de los anteriores 59. La química es una ciencia natural mediante la cual el hombre estudia la composición y el comportamiento de la materia, así como la relación de esta con la energía. Por lo tanto es un error afirmar que la química: a. Es fundamental en los esfuerzos para producir nuevos materiales que facilitan la vida y la hacen más segura. b. Es importante para producir nuevas fuentes de energía abundantes y no contaminantes c. Contribuye a comprender y controlar las diversas enfermedades que amenazan en los seres humanos y a las reservas alimenticias. d. Permite reconocer problemas y formularlos con claridad mediante el análisis de información, para así proponer soluciones posibles, sin necesidad de la observación, experimentación y formulación de hipótesis.
16 60. Analiza las siguientes afirmaciones acerca de la historia de la química y la forma como se desarrollo esta ciencia. Señala la incorrecta. a. Para los hombres de ciencia del siglo XVII, la teoría de la materia constituida por cuatro elementos: tierra, aire agua y fuego, ya no era suficiente para explicar la composición y el comportamiento de la materia. b. Debido a que los propósitos y técnicas de la alquimia fueron dudosos y casi siempre ilusorios, la alquimia no se puede considerar la antecesora de la química moderna c. A través del tiempo, la evolución del pensamiento humano y el perfeccionamiento de los métodos de investigación han permitido que estas ideas fueran cambiando y a finales del siglo XIX se renovaran completamente. d. Las razones por las cuales un modelo se cambia obedece a que con el progreso de la ciencia, la tecnología y la investigación los científicos encuentran nuevos hechos o fenómenos en la naturaleza para los cuales el modelo no presenta ninguna explicación y se requiere otro de mayor complejidad. 61. Analizar los siguientes modelos y responder las preguntas de la 61.1 a la La materia puede estar principalmente en tres estados: sólido, líquido y gaseoso. El modelo que mejor representa la unión (cohesión) entre las moléculas de un sólido es: a. Porque tienen forma y volumen fijo b. Porque tienen forma variable y volumen fijo c. Porque tiene forma y volumen variable
17 d. Porque existen moléculas con cargas positivas y negativas 61.2 En el estado gaseoso las partículas se difunden hasta ocupar el mayor espacio posible. Una explicación para este fenómeno es: a. En el estado gaseoso las partículas constitutivas de la materia están íntimamente ligadas entre sí. b. En el estado gaseoso las partículas materiales gozan de libertad y se deslizan unas sobre otras. c. En el estado gaseoso las partículas materiales carecen de cohesión, tendiendo a separarse una de las otras. d. En el estado gaseoso las partículas materiales pierden su masa, lo cual origina su evaporación. 62 Una de las formas para determinar el volumen de un sólido, es sumergiéndolo en una bureta o recipiente graduado que contenga agua, como se observa en la figura. De acuerdo con esto se puede plantear la siguiente hipótesis: a. El volumen de agua no se altera al introducir el sólido b. El volumen del sólido experimenta un cambio c. El sólido modifica la estructura química del líquido d. Al introducir el objeto ocurre un desplazamiento del agua igual al del volumen del sólido 63 El azufre es un sólido amarillo pálido que se quema en el aire para formar óxidos de azufre venenosos. Al calentarse se decolora y a 180ºC toma una coloración marrón. Funde a
18 113ºC, no es soluble en agua. De las anteriores características del azufre, las subrayadas corresponden a propiedades: a. Físicas b. Químicas c. Físicas y químicas respectivamente d. Químicas y físicas respectivamente 64 Dentro de un recipiente cerrado se encuentran contenidas muestras de aire (A), agua (O) y suelo (D), como se ilustra en la figura: De éste recipiente se puede afirmar que contiene una mezcla cuyos componentes son: a. El agua y el suelo porque se encuentran en forma de barro, mientras que el aire no se mezcla con ellos. b. El aire y el agua porque se encuentran en diferentes estados formando una mezcla homogénea. c. El aire, el agua y el suelo, ya que se encuentran en tres estados diferentes formando una mezcla heterogénea. d. El aire y el suelo porque se encuentran en diferentes estados formando una mezcla heterogénea. 65 Al jugar con arena los niños desean saber si en el agua la arena se comporta de la misma manera que la sal. Toman dos vasos con agua y adicionan una cucharada de arena en uno de los vasos y una de sal en el otro y los agitan por varios minutos. La ilustración que mejor representa el resultado es
19 66 La siguiente tabla muestra algunas propiedades de 4 sustancias. De acuerdo con la información de la tabla, es correcto afirmar que una mezcla conformada por las sustancias a. 1 y 4 se pueden separar utilizando un imán. b. 1 y 3 se pueden separar adicionando agua y filtrando. c. 2 y 4 se pueden separar utilizando un imán. d. 2 y 3 se pueden separar adicionado agua y evaporando 67 Si se tiene aceite, alcohol, agua, arena y gelatina en polvo, para preparar una mezcla que pueda ser separada por medio del filtro de un embudo como se muestra en la figura, las sustancias a mezclar son: a. Homogéneas: Aceite y alcohol
20 b. Heterogéneas: Alcohol y arena c. Heterogéneas: Agua y aceite d. Homogéneas: Agua y gelatina en polvo 68 El diagrama muestra el montaje para separar mezclas homogéneas, por medio de la destilación: proceso para separar los materiales que conforman una mezcla líquida teniendo en cuenta la diferencia en los puntos de ebullición, es decir la temperatura en la que un liquido pasa a estado gaseoso. Analizarlo y responder de la 68.1 a la Se tiene una mezcla de dos sustancias líquidas Z y N, las cuales se separan por destilación. La primera porción obtenida contiene un mayor porcentaje de N. De acuerdo con lo anterior es válido afirmar que: a. el punto de ebullición de N es menor que el de la sustancia Z b. al finalizar la separación, hay mayor cantidad de N que Z en el matraz c. el punto de fusión de N es mayor que el de la sustancia Z d. al iniciar la separación, hay mayor cantidad de Z que N en el matraz 68.2 Los cambios de estado que tienen lugar durante la destilación, teniendo en cuenta el orden en que suceden, son: a. condensación-evaporación b. solidificación-fusión c. evaporación-condensación
21 d. fusión-evaporación 69 De acuerdo con la información del cuadro, es válido afirmar que en el proceso de destilación, el orden en que se separan los siguientes derivados del petróleo es: Material asfalto Aceite Naftas obtenido diesel Punto de ebullición (ºC) a. asfalto, naftas y aceite diesel b. naftas, aceite diesel y asfalto c. naftas, asfalto y aceite diesel d. aceite diesel, naftas y asfalto 70 La materia está formada por partículas diminutas e indivisibles llamadas átomos, esto fue postulado desde los antiguos griegos y pertenece a a. Dalton b. Rutherford c. Thomson d. Demócrito y Leucipo 71 Analizar el siguiente esquema y responder las preguntas 71.1 y 71.2.
22 71.1 El científico que introduce un modelo nuclear del átomo con las siguientes características: Existe un núcleo cargado positivamente en el que se encuentra concentrada toda la masa. Los electrones giran alrededor de un núcleo en número igual a la carga nuclear. La carga positiva del núcleo coincide con el número de orden del elemento en el sistema periódico, o sea, con su número atómico, dicho autor es: a. Dalton b. Rutherford c. Bohr d. Thomson 71.2 El modelo atómico de Thomson explica a. La materia no está constituida por átomos. b. Los átomos tienen un núcleo muy pequeño donde se concentra casi toda la masa. c. Los fenómenos eléctricos. d. Los electrones saltan niveles de energía 73. De acuerdo a la siguiente grafica responder las preguntas.
23 73.1 Las partículas representadas como (+), (-) y (0) reciben el nombre de a. Núcleo y corteza b. Isotopos c. Protones, electrones y neutrones d. Átomos 73.2 El numero atómico (Z) del átomo representado es a. 4 b. 12 c. 8 d La masa atómica (A) del átomo representado es a. 4 b. 8 c. 12 d De acuerdo a la siguiente tabla responda las preguntas de la 74.1 a 74.2.
24 ATOMO PROTONES ELECTRONES NEUTRONES CARGA X Y Z De acuerdo con la información presentada en la tabla, es válido afirmar que a. Y y X son átomos de un mismo elemento con diferente carga b. Z es el catión del elemento Y c. X y Y tienen igual masa atómica d. X y Z son átomos de un elemento diferente a Y 74.2 La mayor masa atómica corresponde a a. X = 19 b. Y y Z = 40 c. X = 20 d. Z = El peso atómico o número másico (A) de un átomo se representa como A = Z + n donde Z corresponde al número atómico o número de protones, que en un átomo neutro es igual al número de electrones y n representa el número de neutrones. la siguiente tabla muestra algunas características para tres elementos: Elemento P Q R Z X X + 1 X + 2 A N Es correcto afirmar que los números atómicos (X, X+1 y X+2) para cada elemento son respectivamente
25 a. 9, 10 y 11 b. 17, 18, 19 c. 29, 30 y 31 d. 53, 54 y El número de electrones, protones y neutrones para el ion Na +1 es a. 12, 11, 12 b. 1, 11, 12 c. 10, 11, 23 d. 10, 11, Para un elemento los valores Z y A son respectivamente 92 y 238 por tanto, el número de neutrones es a. 92 b. 146 c. 330 d Los átomos que ganan electrones en la formación de una solución llevan una carga a. Positiva b. Negativa c. Neutra d. Isoelectrónica 79. Una de estas afirmaciones es correcta a. las cargas positivas repelen a las negativas b. cargas desiguales se repelen, cargas iguales se atraen c. cargas desiguales se atraen; cargas iguales se repelen d. los electrones se mueven de la carga positiva a la carga negativa
26 80. Clasifique como sustancia o mezcla: a. Una bebida no alcohólica b. La carne de res c. Barras de oro e. El carbón de leña f. El polvo de hornear g. Un cubo de azúcar i. El vapor j. Una moneda k. La leche d. El agua de h. La pintura acueducto 81. Consultar el nombre y símbolo de los elementos que forman las siguientes sustancias puras e identifique cada una como elementos o compuestos: a. Alcohol b. Cobre c. Azúcar d. Amoniaco e. Sal de cocina f. Azufre g. Gas carbónico h. Vinagre i. Agua oxigenada j. Diamante k. Hierro l. Mercurio 82. Clasificar las siguientes mezclas como homogéneas o heterogéneas: a. Una bolsa con bolas de papel de diferentes colores b. La arena de la playa c. Una muestra de cloruro de sodio en agua d. El aire e. Sangre f. Una ensalada de frutas g. Cubos de hielo en agua h. El vidrio de una ventana i. El agua de una charca j. La sopa k. El acero l. La madera m. Gasolina n. Polvo o. Naranja p. Cemento q. Aceite para moto r r. Algodón s. Papel t. Aceite y vina gre u. Smog
27 83. Clasifique cada uno de los siguientes métodos de separación de mezclas así: S-L: Si permite separar una fase sólida de una liquida L-L: S-S: Si permite separar una fase liquida de otra liquida con distinto punto de ebullición Si permite separar una fase sólida de otra sólida a. Destilación b. Filtración c. Evaporación d. Cristalización e. Magnetismo f. Decantación g. Centrifugación h. Sublimación 97. Explique en orden los métodos de separación que emplearía para obtener nuevamente por aparte los componentes de cada de las siguientes mezclas: a. Carbón en polvo y naftalina en polvo b. Agua, sal y limadura de hierro c. Agua, aceite y arena d. Extraer el alcohol de la chicha e. Extraer el plasma de la sangre f. Frijoles, arroz y arena
28 98. Describa detalladamente el proceso de separación del éter dietilico del agua si el punto de ebullición del agua es de 100 C y del éter dietilico 36.4 C. Cuál de los componentes de la mezcla se obtiene primero y por que? 99. Relaciono cada uno de los siguientes procesos industriales con el método de separación aplicado. PROCESO METODOS DE SEPARACIÓN 1. Producción de sal a. Destilación simple 2. Producción de azúcar b. Magnetismo 3. Obtención de gasolinas c. Cristalización 4. Tratamiento de aguas d. Evaporación 5. Purificación del alcohol e. Centrifugación 6. Separación de pigmentos de colorantes f. Cristalización 7. Separación de residuos metálicos en basura g. Cromatografía 8. Separación de células sanguíneas (parte solida) h. Destilación fraccionada del 84.. Indique cuantas fases y componentes tiene el sistema formado por: a. Alcohol, Arena, Agua y Hielo b. Agua, Hielo y Vapor de agua. c. Agua, Azúcar, Sal y Alcohol. d. Vinagre, Alcohol y Agua. e. Aceite, Arena y Agua. Y cuáles de ellos son Homogéneos y Heterogéneos
29 85.. Razona si son válidas las siguientes afirmaciones: a. Un compuesto puede descomponerse en elementos utilizando métodos físicos. b. Un compuesto es una combinación de distintos elementos y por ello, no puede ser una sustancia pura. c. Los compuestos son todas sustancias puras. d. Los elementos se combinan entre sí, químicamente, para formar mezclas homogéneas.
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO
 PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 20/07/12 1451. El elemento Q reacciona con el oxígeno formando el
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 20/07/12 1451. El elemento Q reacciona con el oxígeno formando el
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO
 PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 1451. El elemento Q reacciona con el oxígeno formando el monóxido
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 1451. El elemento Q reacciona con el oxígeno formando el monóxido
TEMA 3: Composición de la Materia
 TEMA 3: Composición de la Materia 1. Mezclas homogéneas y heterogéneas Una mezcla es una composición de varias sustancias con distintas propiedades. Distinguimos dos tipos de mezclas: Mezclas homogéneas:
TEMA 3: Composición de la Materia 1. Mezclas homogéneas y heterogéneas Una mezcla es una composición de varias sustancias con distintas propiedades. Distinguimos dos tipos de mezclas: Mezclas homogéneas:
ACTIVIDADES DE PENDIENTES DE FÍSICA Y QUÍMICA DE 3º ESO
 ACTIVIDADES DE PENDIENTES DE FÍSICA Y QUÍMICA DE 3º ESO 1. a) Qué es la Ciencia? Qué es la Física? Qué es la Química? b) Señala qué procesos se estudian la Física y cuáles estudia la Química: a. Descenso
ACTIVIDADES DE PENDIENTES DE FÍSICA Y QUÍMICA DE 3º ESO 1. a) Qué es la Ciencia? Qué es la Física? Qué es la Química? b) Señala qué procesos se estudian la Física y cuáles estudia la Química: a. Descenso
IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO
 IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO Tema 1: Medida y método científico. 1. Transforme las siguientes magnitudes al S.I de unidades: a) 228 Gm b) 436 ns
IES SIERRA DEL AGUA ACTIVIDADES DE FÍSICA Y QUÍMICA DE ALUMNOS PENDIENTES DE 3º DE ESO Tema 1: Medida y método científico. 1. Transforme las siguientes magnitudes al S.I de unidades: a) 228 Gm b) 436 ns
Elemento Neutrones Protones Electrones
 PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
PROBLEMAS DE ÁTOMOS 1. Argumenta cómo se explica la ley de conservación de la masa en las reacciones químicas mediante su teoría atómica de Dalton. Calcula cuánto carbono se necesita para reaccionar exactamente
El átomo. 4. Enuncia los postulados de la Teoría Atómica de Dalton.
 El átomo 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Rutherford. c) Descubrimiento del electrón. d) Modelo atómico de Rutherford. e) Modelo atómico
El átomo 1. Ordena cronológicamente los siguientes hechos. a) Descubrimiento del protón. b) Experimento de Rutherford. c) Descubrimiento del electrón. d) Modelo atómico de Rutherford. e) Modelo atómico
Unidad 3. Átomos y moléculas
 Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
Unidad 3. Átomos y moléculas Índice de contenido 1. Elementos y compuestos...2 1.1. Teoría atómica de Dalton...2 2.-El átomo...3 3.-Número atómico y número másico...4 4.-Isótopos, unidad de masa atómica
1. Explica qué se entiende por magnitud, medida y unidad. Pon un ejemplo de cada una para ilustrar tus explicaciones
 IES CARMEN CONDE ACTIVIDAES DE REPASO. SEPTIEMBRE 2014 Unidad 1. La ciencia: la materia y su medida 1. Explica qué se entiende por magnitud, medida y unidad. Pon un ejemplo de cada una para ilustrar tus
IES CARMEN CONDE ACTIVIDAES DE REPASO. SEPTIEMBRE 2014 Unidad 1. La ciencia: la materia y su medida 1. Explica qué se entiende por magnitud, medida y unidad. Pon un ejemplo de cada una para ilustrar tus
b) La zona externa del átomo se llama CORTEZA. y ahí es donde se mueven los ELECTRONES
 PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
PREGUNTAS DE RESPUESTA BREVE 1. Completa las siguientes frases relativas a los átomos de los elementos: a) La parte del átomo en donde se puede considerar que se concentra toda su masa es el NÚCLEO y ahí
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Departamento Ciencias. Física y Química MATERIA. se clasifica en. SUSTANCIAS PURAS pueden ser. por métodos. físicos originan. Compuestos.
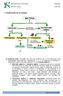 1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
1. Clasificación de la materia MATERIA se clasifica en MEZCLAS pueden ser por métodos físicos originan SUSTANCIAS PURAS pueden ser Heterogéneas Homogéneas Compuestos como las Disoluciones formados por
LA MATERIA Y SU DIVERSIDAD
 LA MATERIA Y SU DIVERSIDAD La materia es todo aquello que tiene masa y ocupa un espacio, es decir, tiene volumen. Propiedades generales La masa y el volumen, son comunes a toda la materia y no nos sirven
LA MATERIA Y SU DIVERSIDAD La materia es todo aquello que tiene masa y ocupa un espacio, es decir, tiene volumen. Propiedades generales La masa y el volumen, son comunes a toda la materia y no nos sirven
TEMA 2. COMPOSICIÓN DE LA MATERIA
 TEMA 2. COMPOSICIÓN DE LA MATERIA 1 COMPOSICIÓN DE LA MATERIA La materia se presenta en pedazos o porciones limitadas que llamamos cuerpos o sistemas materiales. Por lo tanto un sistema material es un
TEMA 2. COMPOSICIÓN DE LA MATERIA 1 COMPOSICIÓN DE LA MATERIA La materia se presenta en pedazos o porciones limitadas que llamamos cuerpos o sistemas materiales. Por lo tanto un sistema material es un
PORTAFOLIO SEGUNDA OPORTUNIDAD QUÍMICA I
 FECHA LÍMITE DE ENTREGA: EL DÍA DEL EXAMEN DE SEGUNDA OPORTUNIDAD. NO HAY PRÓRROGA Nombre: Grupo: Matrícula: Nombre del maestro: ETAPA 1 LA QUÍMICA Y SU CONSTRUCCIÓN AL AVANCE DE LA CIENCIA Y LA TECNOLOGÍA
FECHA LÍMITE DE ENTREGA: EL DÍA DEL EXAMEN DE SEGUNDA OPORTUNIDAD. NO HAY PRÓRROGA Nombre: Grupo: Matrícula: Nombre del maestro: ETAPA 1 LA QUÍMICA Y SU CONSTRUCCIÓN AL AVANCE DE LA CIENCIA Y LA TECNOLOGÍA
FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA
 FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA 1) MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Una mezcla es una composición de sustancias con distintas propiedades. Una mezcla es homogénea si está formada
FÍSICA Y QUÍMICA 2º ESO TEMA VI COMPOSICIÓN DE LA MATERIA 1) MEZCLAS HOMOGÉNEAS Y HETEROGÉNEAS Una mezcla es una composición de sustancias con distintas propiedades. Una mezcla es homogénea si está formada
PROPIEDADES DE LA MATERIA. Prof. Jackeline Ruttell torres Química Febrero 2017
 PROPIEDADES DE LA MATERIA Prof. Jackeline Ruttell torres Química Febrero 2017 DEFINICIONES IMPORTANTES Sustancia: materia con composición uniforme y constante Ej. Agua siempre posee dos átomos de hidrógeno
PROPIEDADES DE LA MATERIA Prof. Jackeline Ruttell torres Química Febrero 2017 DEFINICIONES IMPORTANTES Sustancia: materia con composición uniforme y constante Ej. Agua siempre posee dos átomos de hidrógeno
FÍSICA Y QUÍMICA 2º ESO Tema 2: LA MATERIA Mezclas y Soluciones. Sustancias puras y mezclas
 Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
Sustancias puras y mezclas La materia que nos rodea es, en la mayoría de los casos, una mezcla de sustancias. Los científicos han intentado clasificar las sustancias desde el principio de los tiempos.
LA ESTRUCTURA DEL ÁTOMO
 LA ESTRUCTURA DEL ÁTOMO 1 1.- EL ÁTOMO EN LA ANTIGÜEDAD Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía. Algunas
LA ESTRUCTURA DEL ÁTOMO 1 1.- EL ÁTOMO EN LA ANTIGÜEDAD Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía. Algunas
TEMA 3 LA MATERIA Y SU ESTRUCTURA
 TEMA 3 LA MATERIA Y SU ESTRUCTURA 1. Clasificación de la materia (página 58) Def. Sistema material: Es una porción de materia seleccionada para su estudio. Def. Sustancia pura: Decimos que una sustancia
TEMA 3 LA MATERIA Y SU ESTRUCTURA 1. Clasificación de la materia (página 58) Def. Sistema material: Es una porción de materia seleccionada para su estudio. Def. Sustancia pura: Decimos que una sustancia
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN
 FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
FÍSICA Y QUÍMICA 3º ESO ACTIVIDADES DE RECUPERACIÓN (PARTE 2) CURSO 2012/13 Nombre y apellidos: 1 LA CIENCIA Y SU MÉTODO. MEDIDA DE MAGNITUDES LOS ÁTOMOS Y SU COMPLEJIDAD 1. Qué explica el modelo atómico
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
Tiempo (minutos) Temperatura (ºC)
 EXAMEN FINAL 3º ESO. FÍSICA Y QUÍMICA. 1.- Al calentar un cierto sólido se ha obtenido la siguiente tabla de datos: Tiempo (minutos) 0 2 4 6 10 12 16 18 20 Temperatura (ºC) -5 0 5 10 20 20 20 25 30 Representa
EXAMEN FINAL 3º ESO. FÍSICA Y QUÍMICA. 1.- Al calentar un cierto sólido se ha obtenido la siguiente tabla de datos: Tiempo (minutos) 0 2 4 6 10 12 16 18 20 Temperatura (ºC) -5 0 5 10 20 20 20 25 30 Representa
Guía de Problemas- 5 BTO
 Química Guía de Problemas- 5 BTO Primera Parte Liliana Pagliano 2012 1 Introducción: 1. Qué diferencias existen entre un proceso físico y un proceso químico? 2. Qué es el conocimiento científico? 3. Ante
Química Guía de Problemas- 5 BTO Primera Parte Liliana Pagliano 2012 1 Introducción: 1. Qué diferencias existen entre un proceso físico y un proceso químico? 2. Qué es el conocimiento científico? 3. Ante
-Estructura del átomo. Explícala y realiza un dibujo.
 2. Polis y urbe: la ciudad como teatro de un mundo civilizado. 2.1. La ciudad como escenario; escenas de la ciudad 2.1.2. TRAMOYA URBANA. ESTRUCTURA DE LA MATERIA Alguien en la prehistoria se dio cuenta
2. Polis y urbe: la ciudad como teatro de un mundo civilizado. 2.1. La ciudad como escenario; escenas de la ciudad 2.1.2. TRAMOYA URBANA. ESTRUCTURA DE LA MATERIA Alguien en la prehistoria se dio cuenta
GUIA DE ESTUDIO Nº 1: Mezclas y Sustancias
 Página1 GUIA DE ESTUDIO Nº 1: Mezclas y Sustancias I.- Conceptos básicos: Estados de agregación de la materia. Cambios de estado. Mezclas homogéneas y mezclas heterogéneas. Número de fases y número de
Página1 GUIA DE ESTUDIO Nº 1: Mezclas y Sustancias I.- Conceptos básicos: Estados de agregación de la materia. Cambios de estado. Mezclas homogéneas y mezclas heterogéneas. Número de fases y número de
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA.
 PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
PORTAFOLIO DE EVIDENCIAS QUÍMICA I DE SEGUNDA OPORTUNIDAD I LEE DETENIDAMENTE CADA ENUNCIADO Y CONTESTA SEGÚN SE TE PIDA. 1.- Ciencia que estudia las características y la composición de los materiales,
Materia: FÍSICA Y QUÍMICA 3º E.S.O Curso
 ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
ACTIVIDADES FÍSICA Y QUÍMICA 3º ESO PROGRAMA DE REFUERZO. PRIMERA PARTE 1.-Calcular el tanto por ciento en peso y en volumen de una disolución que se prepara al disolver 40 ml de ácido nítrico cuya densidad
I. TEORÍA ATÓMICO-MOLECULAR
 Índice 1. La materia 2. Clasificación de la materia 3. Leyes ponderales 4. Teoría atómica de Dalton 5. Leyes volumétricas 6. La unidad de cantidad de materia: el mol 2 1 La materia Materia es todo aquello
Índice 1. La materia 2. Clasificación de la materia 3. Leyes ponderales 4. Teoría atómica de Dalton 5. Leyes volumétricas 6. La unidad de cantidad de materia: el mol 2 1 La materia Materia es todo aquello
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2
 FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
FÍSICA Y QUÍMICA - 3º ESO ESTRUCTURA ATOMICA Y ENLACE 2 1. Define y explica los siguientes conceptos: número atómico, número másico e isótopos de un elemento químico. 2. Copia el siguiente párrafo y complétalo:
Teoría es un principio unificador que explica un conjunto de hechos y aquellas leyes que se basan en ellos.
 Página 1 de 6 Repaso de Química 105 I. Método científico Pasos Basicos Observación Representación Interpretación Hipótesis explicación tentativa de un problema. Nos guia para planear experimentos adicionales.
Página 1 de 6 Repaso de Química 105 I. Método científico Pasos Basicos Observación Representación Interpretación Hipótesis explicación tentativa de un problema. Nos guia para planear experimentos adicionales.
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica. Ing. Sol de María Jiménez González
 Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Estudio del átomo: 1. Átomos e isótopos 2. Modelos Atómicos 3. Teoría cuántica 1 Núcleo: protones y neutrones Los electrones se mueven alrededor. Característica Partículas Protón Neutrón Electrón Símbolo
Unidad 2. La materia
 Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
Física y Química Unidad 2: La materia Unidad 2. La materia Índice de contenido 1. Estados de agregación de la materia...3 2. Cambios de estado...4 3. Clasificación de la materia...6 3.1.- Métodos de separación
1.5 Métodos de separación de mezclas Decantación, filtración, extracción, cristalización, destilación, cromatografía.
 1.5 Métodos de separación de mezclas Decantación, filtración, extracción, cristalización, destilación, cromatografía. 1 Para tomar apuntes MÉTODO DE SEPARACIÓN PROPIEDAD(ES) EN LAS QUE SE BASA MEZCLAS
1.5 Métodos de separación de mezclas Decantación, filtración, extracción, cristalización, destilación, cromatografía. 1 Para tomar apuntes MÉTODO DE SEPARACIÓN PROPIEDAD(ES) EN LAS QUE SE BASA MEZCLAS
ACTIVIDADES DE REPASO FÍSICA Y QUÍMICA
 ACTIVIDADES DE REPASO FÍSICA Y QUÍMICA 1. Esquema del método científico. 2. Cuáles son las magnitudes que forman el Sistema Internacional (S.I.)? Cuáles son sus unidades? 3. Realiza los siguientes cambios
ACTIVIDADES DE REPASO FÍSICA Y QUÍMICA 1. Esquema del método científico. 2. Cuáles son las magnitudes que forman el Sistema Internacional (S.I.)? Cuáles son sus unidades? 3. Realiza los siguientes cambios
SISTEMAS MATERIALES. Qué ejemplos podés dar de un mismo cuerpo formado por distintos materiales y de distintos cuerpos formados por un mismo material?
 SISTEMAS MATERIALES Lic. Lidia Iñigo Se denomina MATERIA a todo lo que forma los distintos objetos o cuerpos que nos rodean, ya sean inertes o seres vivos. La materia se caracteriza por ocupar un lugar
SISTEMAS MATERIALES Lic. Lidia Iñigo Se denomina MATERIA a todo lo que forma los distintos objetos o cuerpos que nos rodean, ya sean inertes o seres vivos. La materia se caracteriza por ocupar un lugar
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS
 I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
I.E.S. Grande Covián Física y Química 4º ESO ACTIVIDADES SOBRE ÁTOMO, SISTEMA PERIÓDICO Y ENLACES QUÍMICOS Nombre:. Apellidos: Grupo: Fecha:. 1º) Escribe la diferencia fundamental entre el modelo atómico
EL ÁTOMO. Departamento de Física y Química 3º ESO
 EL ÁTOMO Departamento de Física y Química 3º ESO 0. Mapa conceptual Metales No metales Tabla periódica Elementos Cationes Isótopos ÁTOMO Iones Aniones Protones Núcleo Neutrones Electrones Número atómico
EL ÁTOMO Departamento de Física y Química 3º ESO 0. Mapa conceptual Metales No metales Tabla periódica Elementos Cationes Isótopos ÁTOMO Iones Aniones Protones Núcleo Neutrones Electrones Número atómico
PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14
 PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14 INFORMACIÓN Y CONTENIDOS MÍNIMOS PARA LA EVALUACIÓN Información Para que los alumnos puedan recuperar esta asignatura lo más pronto posible,
PENDIENTES DE 3º ESO. DEPARTAMENTO DE FÍSICA Y QUÍMICA. CURSO 13-14 INFORMACIÓN Y CONTENIDOS MÍNIMOS PARA LA EVALUACIÓN Información Para que los alumnos puedan recuperar esta asignatura lo más pronto posible,
IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia.
 IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia. 1) Contesta las siguientes preguntas: a - Cuáles son los pasos del método científico?.
IES ALONSO QUESADA Física y Química 3º ESO Trabajo Científico. Estados de la materia. Clasificación de la materia. 1) Contesta las siguientes preguntas: a - Cuáles son los pasos del método científico?.
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1
 GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
GUÍA PARA EXAMEN DE REGULARIZACIÓN DE QUÍMICA 1 1.- Ciencia que estudia la composición, estructura de la materia y sus transformaciones. R= Química 2.-Es todo lo que tiene masa y posee inercia R= Materia
2.- Los átomos de un mismo elemento son iguales en masa y propiedades. Y los átomos de elementos diferentes son diferentes en masa y propiedades.
 FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
FICHA 1 TEMA 3: ESTRUCTURA DE LA MATERIA PRIMEROS MODELOS ATÓMICOS La discusión sobre la continuidad o discontinuidad de la materia viene desde muy antiguo. Ya en la antigua Grecia había varias corrientes
La materia se puede definir como todo aquello que tiene masa y ocupa un volumen.
 Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
Tema 2: LA MATERIA Que es la materia? La materia se puede definir como todo aquello que tiene masa y ocupa un volumen. Clasificación de la materia (criterio: separación) Mezclas Sustancias puras Composición
3 - Cómo podemos diferenciar un elemento químico de un compuesto, según la teoría de Dalton?
 TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
TEORÍA ATÓMICA 1- A partir de los siguientes datos, cuántas veces es maor la masa del protón que la del electrón? Masa del protón =1,673 10-27 kg Masa del electrón =9,1 10-31 kg 2 - El modelo del átomo
ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE
 ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE Los alumnos que hallan suspendido la asignatura de Física y Química de 3º deberán entregar, el día del examen de la asignatura,
ACTIVIDADES PARA LOS ALUMNOS CON LA ASIGNATURA DE FÍSICA Y QUÍMICA DE 3º PENDIENTE Los alumnos que hallan suspendido la asignatura de Física y Química de 3º deberán entregar, el día del examen de la asignatura,
La clasificación básica de la materia muestra a los elementos y compuestos. Mezclas Heterogénea heterogéneas Mezclas. Soluciones
 La clasificación básica de la materia muestra a los elementos y compuestos. Materia Mezclas Heterogénea heterogéneas Mezclas Homogénea Soluciones Sustancias Compuestos Elementos Hemos visto que las soluciones
La clasificación básica de la materia muestra a los elementos y compuestos. Materia Mezclas Heterogénea heterogéneas Mezclas Homogénea Soluciones Sustancias Compuestos Elementos Hemos visto que las soluciones
PROBLEMAS MEZCLAS Y DISOLUCIONES
 PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
PROBLEMAS MEZCLAS Y DISOLUCIONES 1. Clasifica como homogéneos o heterogéneos los siguientes sistemas materiales: un trozo de cobre, agua salada, hierro oxidado, una ensalada. 2. Al mezclar dos sistemas
5ª UNIDAD ELEMENTOS Y COMPUESTOS
 5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
5ª UNIDAD ELEMENTOS Y COMPUESTOS 3º E.S.O. Grupo Apellidos: Nombre: INTRODUCCIÓN Comenzamos recordando los conceptos más importantes del tema anterior: Cómo son los átomos? Cómo están distribuidos los
SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO.
 SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos 1. Solución: Descubrimiento de los dos «tipos» de electricidad. Siglo XVIII. Descubrimiento del electrón. 1897.
SOLUCIONES BLOQUE 2. EL ÁTOMO: MODELOS, TABLA PERIÓDICA Y ENLACE QUÍMICO. Modelos Atómicos 1. Solución: Descubrimiento de los dos «tipos» de electricidad. Siglo XVIII. Descubrimiento del electrón. 1897.
Física y Química 3º E.S.O. 2013/14
 Física y Química 3º E.S.O. 2013/14 TEMA 3: La materia. Propiedades eléctricas y el átomo 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A C E E
Física y Química 3º E.S.O. 2013/14 TEMA 3: La materia. Propiedades eléctricas y el átomo 1.- En la siguiente sopa de letras puedes encontrar los nombres de 13 elementos químicos. A O M O L P B A C E E
Sustancias puras y mezclas: Qué es una sustancia? Qué es una sustancia pura?: Clasificación de las sustancias puras: elementos y compuestos;
 SEXTO Sustancias puras y mezclas: Qué es una sustancia?: Es cualquier variedad de materia que tiene composición definida y reconocible. Las sustancias se clasifican en sustancias puras y mezclas. Qué es
SEXTO Sustancias puras y mezclas: Qué es una sustancia?: Es cualquier variedad de materia que tiene composición definida y reconocible. Las sustancias se clasifican en sustancias puras y mezclas. Qué es
CIENCIAS II CON ENFASIS EN QUIMICA
 CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
CIENCIAS II CON ENFASIS EN QUIMICA P1-TEMA 2.2 Propiedades intensivas y extensivas de los materiales y Proyectos 1. Explica con tus propias palabras en que consiste un proyecto. 2. Explica brevemente en
Examen de Diagnóstico Química I
 Examen de Diagnóstico Química I 1. Son los cuatro elementos básicos que conforman la materia. A) NaCl, NaOH, GaAs, H 2 CO 3 B) Be, Na, Ra, Rf C) Ca, He, Ni, D) ADN, ARN, gen, célula E) C, H, O, N 2. Sustancia
Examen de Diagnóstico Química I 1. Son los cuatro elementos básicos que conforman la materia. A) NaCl, NaOH, GaAs, H 2 CO 3 B) Be, Na, Ra, Rf C) Ca, He, Ni, D) ADN, ARN, gen, célula E) C, H, O, N 2. Sustancia
Departamento de Física y Química Ejercicios Repaso 2do Examen Átomos Moléculas Enlaces Químicos IES Ángel Corella MATERIA
 Tema 2 ESTRUCTURA DE LA MATERIA (tema 4 del libro, pg. 80) SUSTANCIAS PURAS 1. Completa el siguiente esquema: MATERIA mezcla homogénea hetereogénea átomos (se clasifican y ordenan en la tabla periódica)
Tema 2 ESTRUCTURA DE LA MATERIA (tema 4 del libro, pg. 80) SUSTANCIAS PURAS 1. Completa el siguiente esquema: MATERIA mezcla homogénea hetereogénea átomos (se clasifican y ordenan en la tabla periódica)
La Teoría atómica de Dalton se resume en los siguientes enunciados:
 1. EL ÁTOMO. Hasta ahora hemos estudiado cómo se presenta la materia y cómo se clasifica pero hay todavía muchas preguntas sin responder: cuál es la naturaleza de la materia?, cómo es por dentro?, Existe
1. EL ÁTOMO. Hasta ahora hemos estudiado cómo se presenta la materia y cómo se clasifica pero hay todavía muchas preguntas sin responder: cuál es la naturaleza de la materia?, cómo es por dentro?, Existe
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS
 TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
TEMA 3: MEZCLAS, DISOLUCIONES Y SUSTANCIAS PURAS 1. LA MATERIA Y SU ASPECTO Los sistemas materiales, formados por una o varias sustancias, pueden clasificarse en: - Sistemas materiales heterogéneos: presentan
Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas:
 TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
TITULO (edite antes de imprimir) NOMBRE: CURSO: 1) Clasifica los siguientes sistemas materiales en elementos, compuestos o mezclas homogéneas o heterogéneas: Plomo ; acero ; mercurio ; óxido de hierro
1- Cuál de estas cantidades es mayor: 1600 g o 1,5 kg? Y de estas otras: 1450 mm o 1,3 m?
 Entregar estos ejercicios el día del examen. Realizar también los ejercicios hechos en clase durante el curso. EJERCICIOS DE FÍSICA Y QUÍMICA 3º DE E.S.O. 1- Cuál de estas cantidades es mayor: 1600 g o
Entregar estos ejercicios el día del examen. Realizar también los ejercicios hechos en clase durante el curso. EJERCICIOS DE FÍSICA Y QUÍMICA 3º DE E.S.O. 1- Cuál de estas cantidades es mayor: 1600 g o
Es una ciencia porque tiene un objeto de estudio (la materia), y un método (el método experimental).
 Objetivos: La Química es una ciencia que estudia la materia en sentido general, su estructura, sus propiedades y las reacciones que transforman sustancias en otras. Es una ciencia porque tiene un objeto
Objetivos: La Química es una ciencia que estudia la materia en sentido general, su estructura, sus propiedades y las reacciones que transforman sustancias en otras. Es una ciencia porque tiene un objeto
Modelo de Democrito. Modelo de J. J. Thomson. Modelo de Rutherford. Modelo de Bohr. Modelo atómico actual. Schrödinger
 ESTRUTURA ATÓMIA Por que nos interesa la estructura de los átomos? Porque es la disposición de las partes de los átomos lo que determina las propiedades de los distintos tipos de materia. Solo si entendemos
ESTRUTURA ATÓMIA Por que nos interesa la estructura de los átomos? Porque es la disposición de las partes de los átomos lo que determina las propiedades de los distintos tipos de materia. Solo si entendemos
1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular
 UNIDAD 1: DIVERSIDAD Y UNIDAD DE ESTRUCTURA DE LA MATERIA 1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular 4. Sustanciaspuras puras,
UNIDAD 1: DIVERSIDAD Y UNIDAD DE ESTRUCTURA DE LA MATERIA 1. Sistemas materiales: propiedades 2. Estados de agregación g de los sistemas materiales 3. Teoría cinético molecular 4. Sustanciaspuras puras,
El átomo MODELOS ATÓMICOS
 El átomo Es la porción más pequeña de la materia. Los primeros en utilizar este término fueron Leucipo y Demócrito (los atomistas), quienes creían que la materia estaba formados por pequeñas partículas
El átomo Es la porción más pequeña de la materia. Los primeros en utilizar este término fueron Leucipo y Demócrito (los atomistas), quienes creían que la materia estaba formados por pequeñas partículas
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
FÍSICA Y QUÍMICA Solucionario ELECTRONES Y ENLACES 1.* Indicad cuántos electrones tienen en la última capa cada uno de estos elementos. a) C 4 f) O 6 k) K 1 b) F 7 g) P 5 l) S 6 c) Ne 8 h) H 1 m) He 8
Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos:
 II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
II EL ÁTOMO EJERCICIOS II Determina el número de protones que hay en el núcleo de los átomos correspondientes a los siguientes elementos químicos: a) b) 5. Determina la estructura atómica de los átomos
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES
 FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
FÍSICA Y QUÍMICA Cuaderno de ejercicios ELECTRONES Y ENLACES 1.* Indiquen cuántos electrones tienen en la última capa cada uno de estos elementos. a) C f) O k) K b) F g) P l) S c) Ne h) H m) He d) Br
QUÍMICA GENERAL QQ 103 TEORIA ATÓMICA LEYES FUNDAMENTALES DE LA MATERIA, PROPORCIONES DEFINIDAS Y MÚLTIPLES
 QUÍMICA GENERAL QQ 103 TEORIA ATÓMICA LEYES FUNDAMENTALES DE LA MATERIA, PROPORCIONES DEFINIDAS Y MÚLTIPLES Leyes y teorias Leyes son afirmaciones que resumen hechos experimentales referentes a la naturaleza,
QUÍMICA GENERAL QQ 103 TEORIA ATÓMICA LEYES FUNDAMENTALES DE LA MATERIA, PROPORCIONES DEFINIDAS Y MÚLTIPLES Leyes y teorias Leyes son afirmaciones que resumen hechos experimentales referentes a la naturaleza,
1) Indicar si las siguientes propiedades son extensivas o intensivas:
 Sistemas Materiales Guía de Ejercitación 1) Indicar si las siguientes propiedades son extensivas o intensivas: a) Volumen b) Densidad c) Olor d) Pto. de fusión e) Presión f) Sabor g) Pto. de ebullición
Sistemas Materiales Guía de Ejercitación 1) Indicar si las siguientes propiedades son extensivas o intensivas: a) Volumen b) Densidad c) Olor d) Pto. de fusión e) Presión f) Sabor g) Pto. de ebullición
Tema 1 Átomos y Tabla Periódica
 Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
Tema Átomos y Tabla Periódica Tres partículas subatómicas: el protón (carga +), el neutrón (carga = ) y el electrón (carga -) : son las partículas principales que afectan el comportamiento químico de los
ACTIVIDAD GENERAL DE NIVELACIÓN GRADO: 9º
 ACTIVIDAD GENERAL DE NIVELACIÓN GRADO: 9º INSTITUCIÓN EDUCATIVA LUIS PATRON ROSANO ASIGNATURA: QUIMICA JORNADA MATINAL DOCENTE: DAVID SALOMON ALVAREZ LOGROS GRADO NOVENO 1. Define cada una de las etapas
ACTIVIDAD GENERAL DE NIVELACIÓN GRADO: 9º INSTITUCIÓN EDUCATIVA LUIS PATRON ROSANO ASIGNATURA: QUIMICA JORNADA MATINAL DOCENTE: DAVID SALOMON ALVAREZ LOGROS GRADO NOVENO 1. Define cada una de las etapas
INSTITUCIÓN EDUCATIVA FE Y ALEGRÍA NUEVA GENERACIÓN
 INSTITUCIÓN EDUCATIVA FE Y ALEGRÍA NUEVA GENERACIÓN Formando para el amor y la vida - AREA CIENCIAS NATURALES: QUIMICA - FISICA Tema: La Materia, Energía y Sonido Tiempo: 2 periodos académicos Grado: Quinto
INSTITUCIÓN EDUCATIVA FE Y ALEGRÍA NUEVA GENERACIÓN Formando para el amor y la vida - AREA CIENCIAS NATURALES: QUIMICA - FISICA Tema: La Materia, Energía y Sonido Tiempo: 2 periodos académicos Grado: Quinto
SISTEMAS MATERIALES. Departamento de Física y Química 2º ESO
 SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
SISTEMAS MATERIALES Departamento de Física y Química 2º ESO 0. Mapa conceptual MATERIA Sustancias puras Mezclas Heterogéneas Homogéneas Sistemas coloidales Técnicas de separación Disoluciones Soluto Disolvente
EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES.
 EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES. 1. La materia puede presentarse en tres estados de agregación. Cuáles son? 2. Cómo son la forma y el volumen de un sólido? Y de un líquido? Y de un gas?
EJERCICIOS TEMA 2. LA MATERIA Y SUS PROPIEDADES. 1. La materia puede presentarse en tres estados de agregación. Cuáles son? 2. Cómo son la forma y el volumen de un sólido? Y de un líquido? Y de un gas?
ESTRUCTURA ATÓMICA. Nomenclatura Magnesio Sodio Neón Símbolo nuclear
 ESTRUCTURA ATÓMICA 1) Confeccione una lista con el número total de electrones, neutrones y protones que hay en cada una de las siguientes especies químicas: 12 40 a) C b) Ca 6 20 2) Escriba la configuración
ESTRUCTURA ATÓMICA 1) Confeccione una lista con el número total de electrones, neutrones y protones que hay en cada una de las siguientes especies químicas: 12 40 a) C b) Ca 6 20 2) Escriba la configuración
FUNDAMENTOS DE LA QUÍMICA Química 1º Bachillerato (Ciencias)
 FUNDAMENTOS DE LA QUÍMICA Química 1º Bachillerato (Ciencias) FUNDAMENTOS DE LA QUÍMICA I. La Química. La Química es la ciencia que estudia la materia en relación a su composición, propiedades y transformaciones
FUNDAMENTOS DE LA QUÍMICA Química 1º Bachillerato (Ciencias) FUNDAMENTOS DE LA QUÍMICA I. La Química. La Química es la ciencia que estudia la materia en relación a su composición, propiedades y transformaciones
MODELOS ATÓMICOS. Nombre y Apellidos:... Grupo:... Correctas Incorrectas Nota
 MODELOS ATÓMICOS Nombre y Apellidos:........................................ Grupo:........... 1.- Cuestionario (7 ptos) Correctas Incorrectas Nota 1.- El siguiente dibujo corresponde al modelo de: a)
MODELOS ATÓMICOS Nombre y Apellidos:........................................ Grupo:........... 1.- Cuestionario (7 ptos) Correctas Incorrectas Nota 1.- El siguiente dibujo corresponde al modelo de: a)
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN.
 MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
MATERIA: ES TODO LO QUE TIENE MASA Y VOLUMEN. CLASIFICACIÓN DE LA MATERIA: SEGÚN: A. ESTADO DE AGREGACIÓN. B. COMPOSICIÓN. A. ESTADO DE AGREGACIÓN. SE REFIERE A LA FORMA DE INTERACCIÓN ENTRE LAS MOLÉCULAS
Electrón: LAS PARTÍCULAS SUBATÓMICAS. Electrón: e - Carga eléctrica: 1,602x10-19 C Masa: 9,109x10-31 C
 ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
ENLACE QUÍMICO 1. Repaso de los Conceptos Básicos: Las partículas del átomo: Electrón, Protón y neutrón Número atómico, número másico, Isótopos 2. Modelos atómicos: Repaso de los modelos atómicos Modelo
4ª UNIDAD LOS ÁTOMOS Y SU COMPLEJIDAD
 4ª UNIDAD LOS ÁTOMOS Y SU COMPLEJIDAD FÍSICA Y QUÍMICA 3º ESO 3º E.S.O. Grupo Apellidos: Nombre: MODELOS ATÓMICOS (Resumen de los apartados 1 y 2 del tema 4) A principios del siglo XIX John Dalton propuso
4ª UNIDAD LOS ÁTOMOS Y SU COMPLEJIDAD FÍSICA Y QUÍMICA 3º ESO 3º E.S.O. Grupo Apellidos: Nombre: MODELOS ATÓMICOS (Resumen de los apartados 1 y 2 del tema 4) A principios del siglo XIX John Dalton propuso
TEMA 2: LA MATERIA: CÓMO SE PRESENTA?
 TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
TEMA 2: LA MATERIA: CÓMO SE PRESENTA? 1.- La materia: sustancias puras y mezclas. 1.1.- Recordatorio. 1.2.- Sustancias puras. 1.3.- Mezclas. 1.4.- Cómo distinguir un coloide de una mezcla homogénea. 2.-
Materia. La materia es cualquier sustancia que tenga masa y ocupe un espacio.
 Materia La materia es cualquier sustancia que tenga masa y ocupe un espacio. Propiedades fundamentales de la materia Generales o extensivas Específicas o intensivas Físicas Químicas Propiedades generales
Materia La materia es cualquier sustancia que tenga masa y ocupe un espacio. Propiedades fundamentales de la materia Generales o extensivas Específicas o intensivas Físicas Químicas Propiedades generales
Materia. Mezclas Son aquellas que están formados por 2 o más sustancias.
 Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
Qué es la materia? Materia Sustancias Puras Son aquellas que tienen una composición y propiedades DEFINIDAS. Mezclas Son aquellas que están formados por 2 o más sustancias. Elementos No se pueden separar
LA MATERIA. Características de los átomos
 LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
LA MATERIA Características de los átomos Años más tarde del modelo atómico de Rutherford (1911) se descubrió una nueva partícula en el núcleo, el neutrón. Esta fue descubierta por Chadwick en 1932, y se
ACTIVIDAD DE MEJORAMIENTO QUIMICA INORGANICA LIC. OMAIRA CALDERON RICO. DESARROLLAR EN EL CUADERNO TRABAJO 60% EVALUACION 40% NOCIONES PRELIMINARES
 ACTIVIDAD DE MEJORAMIENTO QUIMICA INORGANICA LIC. OMAIRA CALDERON RICO. EL HOMBRE ES EL VERDADERO CREADOR DE SU DESTINO.CUANDO NO ESTA CONVENCIDO DE ELLO, NO ES NADA EN LA VIDA. DESARROLLAR EN EL CUADERNO
ACTIVIDAD DE MEJORAMIENTO QUIMICA INORGANICA LIC. OMAIRA CALDERON RICO. EL HOMBRE ES EL VERDADERO CREADOR DE SU DESTINO.CUANDO NO ESTA CONVENCIDO DE ELLO, NO ES NADA EN LA VIDA. DESARROLLAR EN EL CUADERNO
Tema 2: La materia. Primera parte
 Esquema de trabajo: Tema 2: La materia. Primera parte 1.- La materia Propiedades de la materia: -Propiedades generales de la materia: A. Masa B. Volumen C. -Propiedades específicas de la materia: A. Densidad
Esquema de trabajo: Tema 2: La materia. Primera parte 1.- La materia Propiedades de la materia: -Propiedades generales de la materia: A. Masa B. Volumen C. -Propiedades específicas de la materia: A. Densidad
Tema 5: El átomo y sus uniones.
 Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Tema 5: El átomo y sus uniones. 1. Teoría Atómica de Dalton. En 1803, John Dalton expone su Teoría Atómica que se basa en los siguientes puntos: Los elementos químicos están formados por partículas muy
Técnico Profesional QUÍMICA
 Convenio Programa Técnico Profesional QUÍMICA Modelos atómicos, estructura atómica y tipos de átomos Nº Ejercicios PSU 1. Rutherford, luego de realizar pruebas con una lámina de oro bombardeada por partículas
Convenio Programa Técnico Profesional QUÍMICA Modelos atómicos, estructura atómica y tipos de átomos Nº Ejercicios PSU 1. Rutherford, luego de realizar pruebas con una lámina de oro bombardeada por partículas
TEMA 4: ESTRUCTURA DEL ÁTOMO IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA
 TEMA 4: ESTRUCTURA DEL ÁTOMO IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA 1. MATERIA DIVISIBLE O INDIVISIBLE El término átomo aparece en el siglo IV a.c. para designar a la porción indivisible más pequeña que
TEMA 4: ESTRUCTURA DEL ÁTOMO IES ATENEA 3º DE ESO FÍSICA Y QUÍMICA 1. MATERIA DIVISIBLE O INDIVISIBLE El término átomo aparece en el siglo IV a.c. para designar a la porción indivisible más pequeña que
I. Introducción. 1. La materia. Materia es todo lo que nos rodea. Podemos decir que la materia:
 Unidad I: El átomo. I. Introducción. 1. La materia Materia es todo lo que nos rodea. Podemos decir que la materia: Ocupa un lugar en el espacio. Tiene masa. Está formada por átomos. Puede ser percibida
Unidad I: El átomo. I. Introducción. 1. La materia Materia es todo lo que nos rodea. Podemos decir que la materia: Ocupa un lugar en el espacio. Tiene masa. Está formada por átomos. Puede ser percibida
LEYES FUNDAMENTALES DE LA QUÍMICA
 LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
LEYES FUNDAMENTALES DE LA QUÍMICA CONTENIDOS 1.- Sustancias homogéneas y heterogéneas. Elementos y compuestos..- Leyes fundamentales de la Química..1. Ley de conservación de la masa... Ley de las proporciones
Ciencias Naturales 7mo Grado Proyecto Nº 6 Marzo 2016 Profesor Melvyn García
 Ciencias Naturales 7mo Grado Proyecto Nº 6 Marzo 2016 Profesor Melvyn García Teoría atómica. Es una teoría de la naturaleza de la materia, que afirma que está compuesta por pequeñas partículas llamadas
Ciencias Naturales 7mo Grado Proyecto Nº 6 Marzo 2016 Profesor Melvyn García Teoría atómica. Es una teoría de la naturaleza de la materia, que afirma que está compuesta por pequeñas partículas llamadas
EL INTERIOR DE LA MATERIA
 EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
EL INTERIOR DE LA MATERIA Qué entendemos por materia? Materia es todo aquello que tiene masa y ocupa un lugar en el espacio. De qué está constituida la materia? Desde la Antigüedad, el ser humano se ha
II MINIOLIMPIADA DE QUÍMICA DE CANTABRIA CUESTIONARIO TIPO TEST (Parte I) 27 de mayo de 2016
 Sección Territorial de Cantabria de la II MINIOLIMPIADA DE QUÍMICA DE CANTABRIA CUESTIONARIO TIPO TEST (Parte I) 27 de mayo de 2016 Nombre y apellidos: Conteste en la Hoja de Respuestas. Sólo hay una respuesta
Sección Territorial de Cantabria de la II MINIOLIMPIADA DE QUÍMICA DE CANTABRIA CUESTIONARIO TIPO TEST (Parte I) 27 de mayo de 2016 Nombre y apellidos: Conteste en la Hoja de Respuestas. Sólo hay una respuesta
I. Relaciona la columna de la izquierda con la de la derecha escribiendo dentro del paréntesis la letra que corresponda a la respuesta correcta.
 AUTOEVALUACIÓN I. Relaciona la columna de la izquierda con la de la derecha escribiendo dentro del paréntesis la letra que corresponda a la respuesta correcta. 1.-Es un ejemplo de sustancia pura ( ) 2.-El
AUTOEVALUACIÓN I. Relaciona la columna de la izquierda con la de la derecha escribiendo dentro del paréntesis la letra que corresponda a la respuesta correcta. 1.-Es un ejemplo de sustancia pura ( ) 2.-El
Li Uranio U Hierro Fe
 1. Completa el siguiente cuadro: Elemento Símbolo Isótopo Atómico (Z) Másico (A) Protones Neutrones Electrones 2 2 Hidrógeno 2 Li 4 238 92U 56 26 Elemento Símbolo Isótopo Atómico (Z) Másico (A) Protones
1. Completa el siguiente cuadro: Elemento Símbolo Isótopo Atómico (Z) Másico (A) Protones Neutrones Electrones 2 2 Hidrógeno 2 Li 4 238 92U 56 26 Elemento Símbolo Isótopo Atómico (Z) Másico (A) Protones
UNAM Facultad de Química Curso Química General 1 Grupo 14 COLECCIÓN DE EJERCICIOS UNIDAD 1
 UNAM Facultad de Química Curso Química General 1 Grupo 14 COLECCIÓN DE EJERCICIOS UNIDAD 1 1. En un libro aparece la siguiente definición de Química: La Química es la ciencia que tiene por objeto el estudio
UNAM Facultad de Química Curso Química General 1 Grupo 14 COLECCIÓN DE EJERCICIOS UNIDAD 1 1. En un libro aparece la siguiente definición de Química: La Química es la ciencia que tiene por objeto el estudio
PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016
 PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016 I. ESTRUCTURA ATÓMICA 1.1 PARTÍCULAS SUBATÓMICAS Partícula subatómica Símbolo Carga fundamental (Q) Carga relativa
PREPARACIÓN PSU TEORÍA ATÓMICA PROF. ÁNGELA GAJARDO S. QUÍMICA ELECTIVO IV MEDIO 2016 I. ESTRUCTURA ATÓMICA 1.1 PARTÍCULAS SUBATÓMICAS Partícula subatómica Símbolo Carga fundamental (Q) Carga relativa
El átomo y las sustancias químicas
 El átomo y las sustancias químicas Conceptos previos En la naturaleza existen cargas eléctricas Si tienen el mismo signo se repelen, sin embargo se atraen si tienen signo distinto. Conceptos previos Las
El átomo y las sustancias químicas Conceptos previos En la naturaleza existen cargas eléctricas Si tienen el mismo signo se repelen, sin embargo se atraen si tienen signo distinto. Conceptos previos Las
1. MATERIA Y SU ASPECTO
 1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
1. MATERIA Y SU ASPECTO El aspecto de un sistema material puede variar según el método de observación. Algunos sistemas materiales como la leche, la sangre o la mantequilla a simple vista parecen uniformes,
IES RIBERA DE CASTILLA UNIDAD 4A CÓMO SON LOS ÁTOMOS? OBJETIVOS 8. FORMULACIÓN
 UNIDAD 4A CÓMO SON LOS ÁTOMOS? 1. Símbolos, moléculas y fórmulas Elementos o sustancias simples. Compuestos. 2. Estructura atómica Partículas subatómicas: Protones, neutrones y electrones. Estructura de
UNIDAD 4A CÓMO SON LOS ÁTOMOS? 1. Símbolos, moléculas y fórmulas Elementos o sustancias simples. Compuestos. 2. Estructura atómica Partículas subatómicas: Protones, neutrones y electrones. Estructura de
I.E.S. FRANCISCO GARCÍA PAVÓN. FÍSICA Y QUÍMICA 3º ESO. CURSO CONTROL 4 3ºB SOLUCIONADO FECHA:
 NOMBRE SOLUCIONADO CURSO FECHA: FÍSICA Y QUÍMICA 3º ESO: 3ª EVALUACIÓN. CONTROL 4 Y RECUPERACIÓN DE LA 1ª EVALUACIÓN. TEMA 1: LA MATERIA. TEMA 2: EL ÁTOMO. TEMA 3.- FORMULACIÓN QUÍMICA. NORMAS GENERALES
NOMBRE SOLUCIONADO CURSO FECHA: FÍSICA Y QUÍMICA 3º ESO: 3ª EVALUACIÓN. CONTROL 4 Y RECUPERACIÓN DE LA 1ª EVALUACIÓN. TEMA 1: LA MATERIA. TEMA 2: EL ÁTOMO. TEMA 3.- FORMULACIÓN QUÍMICA. NORMAS GENERALES
