CAMPAÑA DE VACUNACIÓN FRENTE A LA RUBÉOLA EN LA COMUNIDAD DE MADRID. DOCUMENTO OPERATIVO.
|
|
|
- Teresa Ortiz Segura
- hace 8 años
- Vistas:
Transcripción
1 CAMPAÑA DE VACUNACIÓN FRENTE A LA RUBÉOLA EN LA COMUNIDAD DE MADRID. DOCUMENTO OPERATIVO.
2 Este documento se ha elaborado con la participación de: Dolores Barranco Ordóñez. Servicio de Prevención de la Enfermedad. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. Domingo Iniesta Fornies. Servicio de Prevención de la Enfermedad. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. Francisco Marqués Marqués. Subdirección General de Epidemiología, Prevención, Promoción de la Salud y Sanidad Ambiental. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. Javier Gómez Marco. Gerencia de Atención Primaria Área 11. Dirección General Servicio Madrileño de Salud. Jenaro Astray Mochales. Servicio de Informes de Salud y Estudios. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. José Ignacio García Merino. Servicio de Promoción de la Salud. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. José Luis Sanchez Suárez. Servicio de Programas Asistenciales. Dirección General Servicio Madrileño de Salud Luis García Comas. Servicio de Epidemiología. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. Manuel Merino Moína. Gerencia de Atención Primaria Área 8. Dirección General Servicio Madrileño de Salud. Margarita García Barquero. Servicio Salud Pública del Área 1. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. María Jesús Gascón. Servicio Salud Pública del Área 3. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. María José Esteban Niveiro. Coordinación de Áreas de Salud Pública. Dirección General de Salud Pública y Alimentación. Maria Victoria Rodríguez Gracia. Servicio de Prevención de la Enfermedad. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. Moisés Cameno Heras. Servicio de Prevención de la Enfermedad. Instituto de Salud Pública. Dirección General de Salud Pública y Alimentación. Pilar Martín-Carrillo. Coordinación con Instituciones. Dirección General de Salud Pública y Alimentación. Sonia López Palacios. Gerencia de Atención Primaria Área 7. Dirección General Servicio Madrileño de Salud. Teresa Regidor. Gerencia de Atención Primaria Área 2. Dirección General Servicio Madrileño de Salud. Dirección General de Salud Pública y Alimentación - 2 -
3 ÍNDICE 1. JUSTIFICACIÓN 2. OBJETIVO GENERAL 3. OBJETIVO ESPECIFICO 4. POBLACIÓN DIANA 5. PROGRAMACIÓN DE ACTIVIDADES 5.1 Periodo de desarrollo de la campaña 5.2 Lugar de vacunación 5.3 Captación de la población 5.4 Distribución de la vacuna 5.5 Pauta de vacunación 5.6 Registro 5.7 Incidencias 5.8 Material gráfico 5.9 Evaluación 6. ANEXOS Anexo 1. MODELO CARTA PERSONALIZADA Anexo 2. MATERIALES DE INFORMACIÓN DE CAMPAÑA Anexo 3. RELACIÓN DE CENTROS DE SALUD PÚBLICA DE ÁREA Anexo 4. FICHAS TÉCNICAS Anexo 5. HOJA DE REGISTRO MANUAL DE PERSONAS SIN CARTA Y CENTROS NO MECANIZADOS Anexo 6. DECLARACIÓN DE REACCIONES ADVERSAS Anexo 7. HOJA RESUMEN DEL OPERATIVO DE CAMPAÑA VACUNACIÓN RUBÉOLA Dirección General de Salud Pública y Alimentación - 3 -
4 1. JUSTIFICACIÓN En las primeras semanas del año 2005 se detectó un incremento en el número de casos de rubéola confirmados en el marco del Plan de Eliminación del Sarampión de la Comunidad de Madrid (CM), motivo por el cual se reforzaron las actividades de vigilancia epidemiológica de la enfermedad a lo largo de este año. El brote ha afectado a 460 personas residentes en la Comunidad de Madrid y mayoritariamente a población entre 15 y 49 años de edad. El 56,2% de los casos son residentes que proceden de otros países, especialmente de países latinoamericanos. El 41,6% de los casos se han producido en mujeres, la mayoría en edad fértil. El 58,2% de los casos inmigrantes y el 18,5% de los casos autóctonos son mujeres. Las principales medidas de prevención tomadas ante esta situación consistieron en informar sobre la necesidad de incrementar la vacunación sistemática de los niños en el marco del calendario de vacunación infantil y de asegurar la inmunidad a todas las mujeres en edad fértil con el fin de evitar la infección y el síndrome de la rubéola congénita. Asimismo se han realizado intervenciones en los medios de comunicación de mayor audiencia en la población extranjera y reuniones con las ONGs que trabajan con estos colectivos. Con el fin de acelerar la inmunización de la población femenina para evitar la aparición de nuevos casos de infección y síndrome de rubéola congénita la Consejería de Sanidad y Consumo ha propuesto la realización de una campaña de captación activa en dicha población 2 OBJETIVO GENERAL El objetivo que se busca con esta campaña de vacunación es reducir el número de mujeres entre los 15 y 49 años susceptibles a la rubéola en la Comunidad de Madrid. 3 OBJETIVO ESPECÍFICO Asegurar la inmunidad frente a la rubéola de todas las mujeres entre 15 y 49 años residentes en la Comunidad de Madrid. Es necesario que todas las mujeres de estas edades tengan constancia documentada de vacunación con al menos una dosis de vacuna de rubéola (triple vírica u otra vacuna atenuada que contenga rubéola) o evidencia serológica de inmunidad frente a la rubéola. 4 POBLACIÓN DIANA. La población diana es todas las mujeres residentes en la Comunidad de Madrid con edades comprendidas entre los 15 y 49 años (nacidas entre el 1 de enero de 1957 y 31 de mayo de 1991) no vacunadas y sin evidencia serológica de inmunidad frente a la rubéola. De acuerdo con los datos de la III Encuesta de Serovigilancia de la Comunidad de Madrid realizada en , se puede estimar que una media del 1,4% de la población autóctona residente no presenta anticuerpos frente a la rubéola. Considerando la explotación de Tarjeta Individual Sanitaria (TIS) en junio de 2005 resulta una cifra de mujeres en edad fértil autóctonas susceptibles. De forma progresiva se está actualizando la información del estado vacunal de la población de otros países que se han ido incorporando a la Comunidad de Madrid, pero se estima que en su gran mayoría no han sido vacunadas frente a la rubéola en sus países de origen. El número de mujeres de origen extranjero residentes en la Comunidad de Madrid, según explotación de TIS es de , cifra que podrá variar a fecha de cierre de campaña. Dirección General de Salud Pública y Alimentación - 4 -
5 5. PROGRAMACIÓN DE ACTIVIDADES 5.1 Periodo de desarrollo de la campaña. Comienza el 27 de febrero y finaliza el 31 de mayo de Lugar de vacunación. Se realizará en los centros de salud y de vacunación habituales de la Comunidad de Madrid, tanto públicos como privados colaboradores. 5.3 Captación de la población Para la captación se va a realizar una campaña de información y difusión, y una captación activa de todas las mujeres de origen extranjero mediante envío de carta personalizada (anexo 1) donde se explica el objeto de la campaña y el procedimiento a seguir para vacunarse. Deseando garantizar un acceso y atención adecuados en los centros de vacunación se establece un cronograma de envío de cartas en tres fases en función del número de personas estimadas. En la carta se indica la necesidad de solicitar cita previa con su enfermera/o en su centro de vacunación para proceder a la administración de la vacuna. FECHA DE CITACIÓN Y VACUNACIÓN NÚMERO DE PERSONAS Del 27 de febrero al 27 marzo Del 28 de marzo al 30 de abril Del 1 al 31 de mayo Resto de población diana Como en todas las campañas de intervención es fundamentar identificar aquellos colectivos con barreras de acceso a la asistencia. Los Centros de Atención Primaria del Servicio Madrileño de la Salud, los Servicios de Salud Pública de Área, Servicios Sociales, Recurso de Salud Municipales, ONGs deben de trabajar de forma conjunta para asegurar la vacunación de estos colectivos. Para reforzar la captación de la población diana se desarrollaran actividades de información y difusión (anexo 2) Edición de carteles Edición de volantinas Intervenciones en medios de comunicación 5.4 Distribución de la vacuna La distribución de las vacunas se realizará desde el almacén del laboratorio adjudicatario y desde la cámara de vacunas de la DGSPyA a los centros de vacunación. En la semana anterior al inicio de la campaña se realizará un envío programado con las dosis necesarias para la vacunación de las mujeres captadas a través del primer envío de cartas, posteriormente los centros irán solicitando el resto de las dosis necesarias en función del ritmo de vacunación y por las vías habituales para la petición de vacunas de calendario. En el momento de la recepción de las vacunas en los centros se firmarán y/o sellarán los albaranes de entrega para que la distribución no se interrumpa. Después es necesario verificar los datos de identificación del centro, el número de dosis de las vacunas y proceder a la apertura del embalaje para comprobar que: Los indicadores de temperatura han sido activados y mantienen una coloración correcta. Las vacunas no están inutilizadas por rotura. Los albaranes se guardarán en el centro hasta el final de la campaña en que se enviarán a las Gerencias y de aquí al Servicio de Salud Pública de cada Área (anexo 3). Es Dirección General de Salud Pública y Alimentación - 5 -
6 importante colocar rápidamente las vacunas en los frigoríficos con el fin de no romper la cadena del frío. Si una recepción no está conforme y se plantea la devolución del envío, habrá que comunicarlo urgentemente al Servicio de Prevención de la Enfermedad de la DGSPA, al teléfono / Pauta de vacunación La vacuna que se utiliza en la campaña es la triple vírica que inmuniza frente al sarampión, la rubéola y la parotiditis por no existir vacuna monovalente. Si alguna persona no vacunada frente a la rubéola hubiera recibido dosis previas frente al sarampión o la parotiditis no existe contraindicación para la administración de una nueva dosis de la vacuna combinada excepto las contraindicaciones propias de los antígenos administrados. En (anexo 4) se incluyen las fichas técnicas de las vacunas disponibles. La pauta de vacunación para todas las mujeres objeto de la campaña es de una sola dosis administrada por vía subcutánea, preferiblemente en la cara externa de la parte superior del brazo. No se vacunan las mujeres ya vacunadas y aquellas con constancia documentada de serología previa positiva con determinación de IgG por el método de ELISA. En el caso de que no se haya realizado serología previa a la vacunación no es necesario realizarla. Aunque las fichas técnicas incluyen en las contraindicaciones que se debe de evitar el embarazo durante los 3 meses siguientes a la vacunación, las recomendaciones de la Comunidad Científica y de las instituciones oficiales (OMS, CDC, Ministerio de Sanidad y Consumo) indican que es suficiente únicamente un mes de intervalo. La administración inadvertida en el embarazo no se ha comprobado que pueda afectar al feto y en este sentido existen varios estudios a los que se hace referencia en el apartado de la ficha técnica I y en el Documento Técnico dirigido a profesionales. 5.6 Registros Registro Informático. En los centros del Servicio Madrileño de Salud el registro de vacunaciones se realizará en el sistema OMI-AP, con los códigos correspondientes. Es necesario registrar también el lote y laboratorio de la vacuna administrada. Dependiendo de la disponibilidad de la versión de OMI-AP (versión 5 o versión 6) y del área correspondiente, los códigos recomendados para registrar las dosis de vacuna administradas son: Código Descripción TV-C TRIPLE VIRICA CORR-CAL TV-A TRIPLE VIRICA ADULTO TV-C1 TRIPLE VIRICA [1] CORR-CAL OMI-AP v.6 En aquellas mujeres que tengan constancia documentada de serología para rubéola positiva previa (IgG positivo por ELISA) y por tanto no requieran vacunación, deberá registrarse con la palabra POSITIVO ó POS o + alguno de los siguientes códigos de DGPs de OMI-AP: ESRUBEOL (serología de rubéola) ESRUBEO2 (serología de rubéola) HVRUBEOL (inmunización de rubéola) Dirección General de Salud Pública y Alimentación - 6 -
7 Registro Manual. En los centros donde no se disponga de equipos para mecanizar los datos y por tanto no se disponga del sistema de registro OMI-AP o cualquier otra aplicación, se realizará el registro manual. Si la persona que se va a vacunar aporta la carta personalizada enviada a su domicilio, el sanitario que vacuna separará la parte troquelada una vez sellada con el nombre del centro, lote y fecha de vacunación y los remitirá mensualmente al Centro de Salud Pública de Área correspondiente para su posterior mecanización o en su defecto al Servicio de Prevención de la Enfermedad. Si la persona no aporta la carta personalizada enviada a su domicilio, el responsable de la vacunación registrará en la hoja de registro nominal (anexo 5) y las remitirá mensualmente al Centro de Salud Pública de Área correspondiente para su posterior mecanización. A la persona vacunada se le proporcionará la correspondiente cartilla de vacunación con los datos de la vacuna, fecha y profesional sanitario que la administra. En el siguiente diagrama se resumen las distintas posibilidades de registro: ARBOL DE DECISIONES PARA REGISTRAR LA VACUNACIÓN (INCLUIDO EL REGISTRO DE VACUNACIÓN PREVIA A LA CAMPAÑA) El Centro dispone y utiliza OMI-AP? si no El paciente tiene Historia clínica en el Centro? Aporta la carta de convocatoria? si no si no Registro de vacunación o registro de serología positiva en OMI Abrir ficha rápida y registro de vacunación o registro de serología positiva en OMI Utilizar la carta como registro de vacunación añadiendo datos de centro, fecha vacunación, lote y laboratorio o marcando serología positiva Registrar los datos de vacunación o serologia positiva cumplimentando la hoja de registro manual (Anexo 5) 5.7 Incidencias. Los responsables de la coordinación de la campaña para los Centros de vacunación públicos y privados autorizados serán las Secciones de Prevención y Promoción de los Servicios de Salud Pública de Área (anexo 3) o en su defecto, el Servicio de Prevención de la Enfermedad de la DGSPA, teléfono /82. Dirección General de Salud Pública y Alimentación - 7 -
8 La declaración de reacciones adversas debe seguir el curso habitual, a través del Centro de Fármacovigilancia de la Comunidad de Madrid, con la cumplimentación del modelo de declaración. Para más información, consultar la página de la Consejería de Sanidad En el anexo 6 se recogen las instrucciones para su registro en el caso de que se disponga del sistema OMI-AP y el modelo de hoja amarilla. 5.8 Material gráfico Antes del comienzo se remitirá a los centros de vacunación el material gráfico de la campaña. Se realizará una distribución durante la tercera semana de febrero. Si fueran necesarias reposiciones de material posteriores, se solicitarán a los Servicios de Salud Pública de Área. Dicho material consta de: Cartel de la campaña de vacunación Volantinas Documento para profesionales sanitarios Documento operativo de campaña Hoja resumen para sanitarios (anexo 7) Hoja de registro nominal Cartilla de vacunación de adultos 5.9 Evaluación. La DGSPA en colaboración con la Dirección General de Informática, Comunicaciones e Innovación Tecnológica y el Servicio Madrileño de Salud de la Comunidad de Madrid procederá a la explotación centralizada de los registros de vacunación en el sistema OMI-AP y contemplará los siguientes datos: Datos de proceso: Tasas de utilización de las vacunas a nivel Regional, Áreas y unidades funcionales, en base a las dosis recibidas, puestas y devueltas. Incidencias Datos de resultado: Coberturas de vacunación alcanzadas a nivel Regional, Áreas y unidades funcionales. Tasas de vacunación previa a la campaña y serología documentada previa. Dirección General de Salud Pública y Alimentación - 8 -
9 6. ANEXOS Anexo 1. MODELO CARTA PERSONALIZADA Anexo 2. MATERIALES DE INFORMACIÓN DE CAMPAÑA Anexo 3. RELACIÓN DE CENTROS DE SALUD PÚBLICA DE ÁREA Anexo 4. FICHAS TÉCNICAS Anexo 5. HOJA DE REGISTRO NOMINAL DE PERSONAS SIN CARTA Y CENTROS NO MECANIZADOS Anexo 6. DECLARACIÓN DE REACCIONES ADVERSAS Anexo 7. HOJA RESUMEN DEL OPERATIVO DE CAMPAÑA VACUNACIÓN RUBÉOLA Dirección General de Salud Pública y Alimentación - 9 -
10 Anexo 1. MODELO CARTA PERSONALIZADA Dirección General de Salud Pública y Alimentación
11 Anexo 2. MATERIALES DE INFORMACIÓN DE CAMPAÑA - CARTEL - VOLANTINA - Cara A - Cara B Dirección General de Salud Pública y Alimentación
12 Anexo 3. RELACIÓN DE SERVICIOS DE SALUD PÚBLICA DE ÁREA ÁREA I C/ Valdebernardo, 26 Post. Moratalaz MADRID Tlfno: Fax: Correo e: Isp.cspa1@salud.madrid.org ÁREA II Avda. Constitución, s/n Edificio OMIC COSLADA Tlfno: / 2821 / 3008 Fax: Correo e: Isp.cspa2@salud.madrid.org ÁREA III C/ Reyes Magos, s/n ALCALÁ DE HENARES Tfno: Fax: Correo e: Isp.cspa3@salud.madrid.org ÁREA IV C/ Albasanz - 2, 2ª planta MADRID Tfno: Fax: Correo e: Isp.cspa4@salud.madrid.org ÁREA V Avda. De Bruselas - 38, 1ª planta, edificio A ALCOBENDAS Tfno: Fax: Correo e: Isp.cspa5@salud.madrid.org ÁREA VII C/ Maudes, MADRID Tfno: Fax: Correo e: Isp.cspa7@salud.madrid.org ÁREA VIII Avda. Leganés, ALCORCÓN Tfno: / 5805 Fax: Correo e: Isp.cspa8@salud.madrid.org ÁREA IX C/ Rey Juan Carlos I 84, planta LEGANÉS Tfno: Fax: Correo e: Isp.cspa9@salud.madrid.org ÁREA X C/Juan de la Cierva, s/n GETAFE Tfno: / 9588 Fax: Correo e: Isp.cspa10@salud.madrid.org ÁREA XI Pza. De Parejas, 11 Escalera 10 planta ARANJUEZ Tfno: Fax: Correo e: Isp.cspa11@salud.madrid.org ÁREA VI Avda. Guadarrama, MAJADAHONDA Tfno: Fax: Correo e: Isp.cspa1@salud.madrid.org Dirección General de Salud Pública y Alimentación
13 Anexo 4. FICHAS TÉCNICAS FICHA TECNICA I 1. NOMBRE DEL MEDICAMENTO VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS (vacuna con virus vivos del sarampión, parotiditis y rubéola) es una vacuna de virus vivos para la inmunización frente al sarampión, la parotiditis y la rubéola. VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS es un preparado liofilizado estéril de (1) AMUNOVAX (vacuna con virus vivos del sarampión), una línea más atenuada del virus del sarampión, derivada de la cepa Edmonston atenuada por Enders y cultivada en cultivos celulares de embrión de pollo; (2) VACUNA MSD ANTIPAROTIDITIS (vacuna con virus vivos de la parotiditis), la cepa Jeryl Lynn (nivel B) del virus de la parotiditis cultivada en cultivos celulares de embrión de pollo, y (3) VACUNA MSD ANTIRUBÉOLA (vacuna con virus vivos de la rubéola), la cepa Wistar RA 27/3 de virus de la rubéola atenuados vivos cultivados en cultivos de células diploides humanas (WI-38). Los virus de la vacuna son iguales a los utilizados en la fabricación de AMUNOVAX (vacuna con virus vivos del sarampión), VACUNA MSD ANTIPAROTIDITIS (vacuna con virus vivos de la parotiditis) y VACUNA MSD ANTIRUBÉOLA (vacuna con virus vivos de la rubéola). Los tres virus se mezclan antes de ser liofilizados. Cuando se reconstituye según las instrucciones, la dosis para la inyección es de 0,5 ml, y su contenido no es en ningún caso inferior al equivalente de TCID 50 (dosis infecciosa en cultivo de tejido) del virus del sarampión, TCID 50 del virus de la parotiditis, y TCID 50 del virus de la rubéola. VIAL DE POLVO LIOFILIZADO PRINCIPIO ACTIVO. Virus del sarampión TCID 50 Virus de la rubéola TCID 50 Virus de la parotiditis TCID 50 EXCIPIENTES Neomicina Albúmina humana 25,0 mcg 0,3 mg y otros excipientes que se recogen en el apartado 6.1. VIAL DE DISOLVENTE. Agua para inyección 0,5 ml 3. FORMA FARMACÉUTICA Liofilizado inyectable en vial + vial con disolvente 4. DATOS CLÍNICOS 4.1. INDICACIONES TERAPÉUTICAS. La VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS está indicada en la inmunización activa de los niños y sujetos susceptibles frente a la parotiditis, el sarampión y la rubéola. La edad para la vacunación es a partir de los 15 meses. Debida a la posible persistencia de una escasa proporción de anticuerpos maternos del sarampión, puede que algunos niños que aún no hayan cumplido los 15 meses, no respondan al componente contra el sarampión de la vacuna. (Todo indica que los anticuerpos maternos de la parotiditis y la rubéola no subsisten, en proporciones apreciables, más de 12 meses). Si el propósito de la vacunación es interrumpir la transmisión del sarampión en una comunidad, se deberá administrar la vacuna a todos los niños de 15 meses en adelante. Los niños vacunados con vacuna del sarampión o triple vírica antes de los 15 meses de edad deben de recibir una nueva dosis de vacuna al llegar a la edad de 15 meses. La segunda dosis de vacuna triple anti-sarampión, rubéola, parotiditis puede administrarse como refuerzo en los programas de vacunación recomendados por las Autoridades Sanitarias. Dirección General de Salud Pública y Alimentación
14 La vacuna también puede administrarse en los programas de vacunación de adolescentes en edad prepuberal establecidos por las Autoridades Sanitarias POSOLOGÍA Y FORMA DE ADMINISTRACIÓN Posología. Se debe administrar la dosis recomendada de la vacuna. Una dosis única de 0,5 ml de VACUNA MSD ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS -se emplea la misma dosis para niños y adultos - proporcionará una inmunidad duradera frente al sarampión, la parotiditis y la rubéola a casi todos los individuos susceptibles de contraer estas enfermedades. Administrar por vía Subcutánea, preferiblemente en la cara externa de la parte superior del brazo. No administrar por vía intravenosa Forma de administración. Para la reconstitución, utilizar únicamente el diluyente suministrado, ya que carece de conservantes o de otras sustancias antivíricas capaces de inactivar la vacuna. Extraer en primer lugar el volumen completo de diluyente a la jeringa que se va a utilizar para la reconstitución. Inyectar todo el diluyente contenido en la jeringa en el vial de vacuna liofilizada y agitar para mezclar completamente. Extraer todo el contenido en una jeringa e inyectar el volumen total de vacuna reconstituida por vía subcutánea. Es importante utilizar jeringa y aguja estériles diferentes para cada paciente, con el fin de evitar la transmisión de la hepatitis B y de otros agentes infecciosos de una persona a otra. Se recomienda una aguja de calibre 25 y de 1,6 cm CONTRAINDICACIONES. No administrar VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS a mujeres embarazadas; en este momento se desconocen los posibles efectos de la vacuna sobre el desarrollo fetal. Si se vacuna a mujeres en edad pospuberal, debe evitarse el embarazo en los 3 meses siguientes a la vacunación (v. "Embarazo y lactancia"). Cualquier enfermedad respiratoria febril u otro tipo de infección febril activa. Tuberculosis activa no tratada. Pacientes que reciben tratamiento inmunosupresor. Esta contraindicación no es aplicable a pacientes que estén recibiendo corticoides como tratamiento de sustitución, como por ejemplo, en la enfermedad de Addison. Personas con discrasias sanguíneas, leucemia, linfomas de cualquier tipo u otras neoplasias malignas que afecten a la médula ósea o a los sistemas linfáticos. Estados de inmunodeficiencia primaria y adquirida; déficit de la inmunidad celular; estados hipo y disgammaglobulinémicos. La vacuna puede administrarse a personas infectadas por VIH asintomáticas. Personas con antecedentes familiares de inmunodeficiencia congénita o hereditaria, hasta que se demuestre la competencia inmunitaria del receptor potencial de la vacuna. Esta vacuna está contraindicada en sujetos con hipersensibilidad sistémica conocida a la neomicina, aunque una historia de dermatitis de contacto a la neomicina no constituye una contraindicación. Se ha demostrado que las vacunas producidas en cultivos de tejidos de embrión de pollo no contienen proteínas de huevo en cantidades suficientes para inducir reacciones de hipersensibilidad. Las personas que tengan alergias al huevo, que no sean de naturaleza anafiláctica, pueden ser consideradas para la inmunización ADVERTENCIAS Y PRECAUCIONES ESPECIALES DE EMPLEO. Generales Es preciso disponer de las medidas de tratamiento adecuadas, incluida adrenalina, para su utilización inmediata en caso de producirse una reacción anafiláctica o anafilactoide. Deberán tomarse ciertas precauciones cuando se administre VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS a personas con antecedentes individuales o familiares de convulsiones, historia de lesiones cerebrales o cualquier otra enfermedad en la que deba evitarse el estrés que produce la fiebre. El médico deberá estar alerta ante la elevación de la temperatura que puede producirse después de la vacunación. (v. Reacciones adversas). Puede vacunarse a los niños y adultos jóvenes con infección conocida por virus de la inmunodeficiencia humana pero que no presenten manifestaciones clínicas evidentes de inmunosupresión; sin embargo, en las personas vacunadas es obligada una vigilancia estrecha de la posible exposición a enfermedades que puedan prevenirse con vacunas, dada la posibilidad de que la inmunización sea menos eficaz que en personas no infectadas. En casos seleccionados puede estar indicada la confirmación de los niveles de anticuerpos circulantes para ayudar a tomar las medidas de protección adecuadas, incluida la inmunoprofilaxis si la inmunidad ha descendido a niveles no protectores. Dirección General de Salud Pública y Alimentación
15 En la mayor parte de los individuos sensibles se produce la excreción de pequeñas cantidades de virus de la rubéola atenuados vivos por la nariz y la garganta a los 7 a 28 días de la vacunación. No hay pruebas confirmadas que indiquen que dichos virus se transmitan a personas sensibles que estén en contacto con los individuos vacunados. En consecuencia, la transmisión por contacto personal estrecho, aunque aceptada como posibilidad teórica, no se considera un riesgo significativo. Sin embargo, está documentada la transmisión del virus de la vacuna de la rubéola a lactantes a través de la leche materna (v. Madres lactantes). No se han comunicado casos de transmisión de virus atenuados vivos del sarampión o de la parotiditis de personas vacunadas a contactos sensibles. Los niños sometidos a tratamiento de la tuberculosis no han experimentado exacerbaciones de la enfermedad cuando han sido inmunizados con vacunas de virus del sarampión vivos; hasta la fecha, no se han publicado estudios sobre el efecto de las vacunas con virus del sarampión sobre niños tuberculosos no tratados. Al igual que ocurre con otras vacunas, la vacunación con VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS puede no conseguir la seroconversión en el 100 % de las personas sensibles que reciben la vacuna. Los virus atenuados de la vacuna se inactivarán rápidamente con éter, alcohol y detergente, por lo que se debería tener la precaución de evitar el contacto con estas sustancias. Este medicamento contiene 1,9 mg de sacarosa por vial liofilizado, lo que deberá ser tenido en cuenta en los enfermos diabéticos INTERACCIÓN CON OTROS MEDICAMENTOS Y OTRAS FORMAS DE INTERACCIÓN. Utilización con otras vacunas Esta vacuna puede administrarse al mismo tiempo que la vacuna antipoliomielítica oral y la vacuna trivalente inyectable frente a la difteria-tétanos-pertussis, si se ajustan adecuadamente en un calendario de inmunización. De no ser así, deberá pasar un intervalo de al menos un mes entre la administración de dos vacunas de virus vivos diferentes. Las vacunas inyectables distintas deben administrarse en lugares de inyección diferentes. No administrar inmunoglobulinas (IG) conjuntamente con la VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS. VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS no debe administrarse menos de un mes antes o después de la administración de otras vacunas víricas. Debe retrasarse la vacunación hasta al menos 3 meses después de las transfusiones de sangre o plasma o de la administración de inmunoglobulina sérica humana. Se ha comunicado que la administración individual de vacunas con virus atenuados vivos de sarampión, parotiditis y rubéola puede provocar una depresión temporal de la sensibilidad cutánea a la tuberculina. Por tanto, si se va a realizar una prueba de la tuberculina, deberá hacerse antes o simultáneamente con la administración de VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS. 4.6 EMBARAZO Y LACTANCIA Embarazo No se han realizado estudios sobre reproducción en animales con VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS. Se desconoce también si VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS puede causar daños fetales cuando se administra a mujeres gestantes o si puede afectar a la capacidad de reproducción. Por tanto, no debe administrarse la vacuna a mujeres gestantes; además debe evitarse el embarazo durante los tres meses siguientes a la vacunación (Ver contraindicaciones). En la vacunación de mujeres en edad fértil se recomienda que antes de la inmunización se proceda a la realización de ensayos serológicos para determinar la inmunidad a rubéola. Al aconsejar a una mujer que ha sido vacunada de forma inadvertida cuando estaba embarazada o que se ha quedado embarazada en los 3 meses siguientes a la vacunación, el médico debe ser consciente de lo siguiente: (1) en una revisión de 10 años de duración que abarcaba más de 700 mujeres gestantes que recibieron la vacuna de la rubéola 3 meses antes o después de la concepción (de las que 189 recibieron la cepa Wistar RA 27/3), ninguno de los recién nacidos presentó anomalías compatibles con el síndrome de rubéola congénita; (2) aunque el virus de la parotiditis es capaz de infectar la placenta y el feto, no existen pruebas de que provoque malformaciones congénitas en los seres humanos. También se ha demostrado que el virus de la vacuna de la parotiditis infecta la placenta, aunque no se ha aislado en los tejidos fetales de mujeres sensibles que fueron vacunadas y se sometieron a abortos electivos, y (3) existen informes que indican que la adquisición de un sarampión natural durante la gestación aumenta el riesgo fetal. Se han observado tasas más elevadas de aborto espontáneo, nacimiento de niños muertos, defectos congénitos y prematuridad después del sarampión natural durante el embarazo. No existen estudios adecuados sobre la cepa atenuada (vacuna) del virus del sarampión en la gestación. Sin embargo, sería prudente suponer que la cepa del virus de la vacuna es capaz también de inducir efectos fetales adversos. Dirección General de Salud Pública y Alimentación
16 Lactancia Se desconoce si el virus de la vacuna del sarampión o de la parotiditis se segrega en la leche humana. Estudios recientes han demostrado que mujeres puérperas lactantes inmunizadas con vacuna de la rubéola con virus atenuados vivos pueden secretar el virus en la leche materna y transmitirlo a los niños alimentados con lactancia natural. De los lactantes con pruebas serológicas de infección por rubéola, ninguno mostró enfermedad grave; sin embargo, uno presentó una enfermedad clínica leve típica de la rubéola adquirida. Debe tenerse precaución al administrar VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS a mujeres en período de lactancia EFECTOS SOBRE LA CAPACIDAD PARA CONDUCIR VEHÍCULOS Y UTILIZAR MAQUINARIA Es poco probable que la vacuna produzca un efecto en la habilidad de conducir y usar maquinaria REACCIONES ADVERSAS Las reacciones adversas asociadas a la utilización de 'VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS' son las comunicadas tras la administración de las vacunas monovalentes. COMUNES Sensación de quemazón o de pinchazos de corta duración en el lugar de inyección. OCASIONALES En todo el cuerpo: fiebre (38,3º C o más) Piel: Erupción, habitualmente mínima, aunque puede ser generalizada. Generalmente aparecen fiebre, eritema o ambos entre los días 5 y 12. RAROS En todo el cuerpo: reacciones locales leves como eritema, induración e hipersensibilidad; dolor de garganta, malestar. Digestivos: parotiditis, náuseas, vómitos, diarreas. Hematológicos/linfáticos: adenopatías regionales, trombocitopenia, púrpura. Hipersensibilidad: reacciones alérgicas como habones y reacciones eritematosas en el lugar de la inyección, anafilaxis y reacciones anafilactoides, urticaria. Musculoesqueléticos: artralgias, artritis o ambas (habitualmente transitorias y rara vez crónicas, v. más adelante), mialgias. Nerviosos/psiquiátricos: Convulsiones febriles en niños, convulsiones febriles, cefaleas, vértigo, parestesias, polineuritis, síndrome de Guillain- Barre, ataxia. Se han comunicado casos de encefalitis o encefalopatía en aproximadamente 1 caso por cada 3 millones de dosis. En ningún caso se ha demostrado que las reacciones fueran causadas realmente por la vacuna. El riesgo de que se produzcan estos graves trastornos neurológicos después de la administración de la vacuna del sarampión con virus vivos es mucho menor que el riesgo de encefalitis y encefalopatía con el sarampión natural (1 por cada casos comunicados). Piel: eritema multiforme Sentidos especiales: formas de neuritis óptica, incluida neuritis retrobulbar, papilitis y retinitis; parálisis oculares, otitis media, sordera nerviosa, conjuntivitis. Urogenitales: orquitis. Existen comunicaciones de panencefalitis esclerosante subaguda (PEES) en niños sin historia de infección por sarampión natural, pero que habían recibido la vacuna del sarampión. Algunos de los casos pueden haberse debido a un sarampión no reconocido durante el primer año de vida o, posiblemente, a la vacunación contra el sarampión. Basándose en la distribución estimada de la vacuna del sarampión a nivel nacional, la asociación entre los casos de PEES y la vacuna del sarampión es de aproximadamente un caso por cada millón de dosis de vacuna distribuidas. Esta cifra es muy inferior a la de asociación con el sarampión natural, que es de 6-22 casos de PEES por cada millón de casos de sarampión. Los resultados de un estudio retrospectivo con control de casos llevado a cabo por el Center for Disease Control sugieren que el efecto global de la vacuna del sarampión ha sido la protección frente a la PEES mediante la evitación del sarampión, que lleva aparejado un mayor riesgo intrínseco de contraer PEES. Se han producido reacciones locales caracterizadas por tumefacción intensa, enrojecimiento y formación de vesículas en el lugar de inyección de la vacuna del sarampión con virus vivos atenuados, y reacciones sistémicas, como sarampión atípico, en personas que habían recibido anteriormente vacunas con virus del sarampión muertos. No se ha administrado VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS en estas condiciones en ensayos clínicos. En raras ocasiones, se han comunicado reacciones más graves que necesitaron hospitalización, como fiebre alta prolongada y reacciones locales extensas. Se han comunicado casos esporádicos de paniculitis después de la administración de la vacuna del sarampión. Dirección General de Salud Pública y Alimentación
17 Artralgias, artritis o ambas (habitualmente transitorias y rara vez crónicas) y polineuritis son características de la rubéola natural y varían en frecuencia y gravedad según la edad y el sexo, siendo más importantes en mujeres adultas y menos en niños en edad prepuberal. Se ha asociado una artritis crónica con la infección por rubéola natural y se ha relacionado con la persistencia del virus o del antígeno vírico en los tejidos corporales. Sólo en raras ocasiones han desarrollado los receptores de la vacuna síntomas articulares crónicos. Tras la vacunación en niños, las reacciones articulares son poco frecuentes y generalmente de breve duración. En la mujer, las tasas de incidencia de artritis y artralgias son generalmente mayores que en los niños (niños: 0-3 %; mujeres: %), y las reacciones suelen ser más intensas y de mayor duración. Los síntomas pueden persistir durante algunos meses o, en raras ocasiones, durante años. En chicas adolescentes, la incidencia de reacciones parece ser intermedia entre la observada en niños y la observada en mujeres adultas. Incluso en mujeres de edad más avanzada (35-45 años), estas reacciones suelen ser bien toleradas y rara vez interfieren en las actividades normales. Estas reacciones suceden con una frecuencia mucho menor después de la revacunación que de la vacunación primaria SOBREDOSIFICACIÓN No existen datos relacionados con la sobredosis. 5. PROPIEDADES FARMACOLÓGICAS PROPIEDADES FARMACODINÁMICAS. No procede 5.2. PROPIEDADES FARMACOCINÉTICAS. No procede 5.3. DATOS PRECLÍNICOS SOBRE SEGURIDAD. No procede 5.4. INFORMACION RELEVANTE PARA VACUNAS. Estudios clínicos realizados en 279 niños con triple seronegatividad, de edades comprendidas entre 11 meses y 7 años, demostraron que VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS es muy inmunógena y generalmente bien tolerada. En estos estudios, una sola inyección de la vacuna inducía anticuerpos de inhibición de la hemaglutinación (IH) del sarampión en el 95 %, anticuerpos neutralizantes de la parotiditis en el 96 % y anticuerpos IH de la rubéola en el 99 % de las personas sensibles. La cepa de la rubéola RA 27/3 de VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS origina niveles de anticuerpos IH, neutralizantes y fijadores del complemento inmediatamente después de la vacunación más elevados que las otras cepas de vacunas de la rubéola, y se ha demostrado que induce un perfil más amplio de anticuerpos circulantes, incluidos los anticuerpos precipitantes antizeta y antiiota. La cepa de la rubéola RA 27/3 simula inmunologicamente la infección natural de forma más exacta que otros virus de vacunas de la rubéola. Los mayores niveles y el perfil más amplio de anticuerpos producido por la vacuna con virus de la rubéola de la cepa RA 27/3 parecen estar relacionados con una mayor resistencia a la reinfección subclínica con el virus natural, y proporcionan una mayor confianza en una inmunidad duradera. Se ha demostrado que los niveles de anticuerpos inducidos por la vacuna después de la administración de VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS persisten durante más de 11 años y la inmunidad es probablemente permanente a lo largo de la vida. 6. DATOS FARMACÉUTICOS 6.1. LISTA DE EXCIPIENTES Fosfato sódico monobásico, fosfato sódico dibásico, bicarbonato sódico, medio 199, medio mínimo esencial Eagle, neomicina, rojo fenol, albúmina humana, sorbitol, fosfato potásico monobásico, fosfato potásico dibásico, gelatina hidrolizada, sacarosa, L-glutamato monosódico INCOMPATIBILIDADES Debe utilizarse una jeringa estéril sin conservantes, antisépticos ni detergentes para cada inyección o reconstitución de la vacuna, ya que esas sustancias podrían inactivar la vacuna de virus vivos PERIODO DE VALIDEZ La fecha de caducidad va impresa en el envase. El periodo de validez es de dos años cuando se almacena bajo las condiciones de temperatura prescritas, es decir entre +2º C y +8º C. El disolvente se puede almacenar a temperatura ambiente. Dirección General de Salud Pública y Alimentación
18 Se recomienda utilizar la vacuna lo antes posible después de su reconstitución. Proteger siempre la vacuna de la luz, ya que su exposición a ella podría inactivar el virus. Almacenar la vacuna reconstituida en el vial de la vacuna en un lugar oscuro a 2-8º C, y desecharla si no se utiliza en 8 horas PRECAUCIONES ESPECIALES DE CONSERVACIÓN La vacuna liofilizada deberá guardarse en un refrigerador a una temperatura de +2ºC a +8ºC. El disolvente se puede conservar a temperatura ambiente NATURALEZA Y CONTENIDO DEL RECIPIENTE Vial con una dosis única de vacuna liofilizada y un vial de diluyente INSTRUCCIONES DE USO Y MANIPULACIÓN Véase la posología. La vacuna deberá ser examinada visualmente para confirmar que no contiene ninguna partícula extraña y que no ha sufrido ninguna variación de su color característico antes de su administración NOMBRE O RAZÓN SOCIAL Y DOMICILIO PERMANENTE O SEDE SOCIAL DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN SANOFI PASTEUR MSD, S.A. Edificio Cuzco IV Paseo de la Castellana Madrid Texto revisado: Febrero 2005 FICHA TÉCNICA II 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente en jeringa precargada para solución inyectable Vacuna de virus vivos atenuados de sarampión, antiparotiditis y rubéola. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de vacuna reconstituida, 0,5 ml, contiene Virus vivos atenuados del sarampión de la cepa Schwarz* no menos de 10 3,0 CCID 50 (1) Virus vivos atenuados de la parotiditis de la cepa RIT 4385* no menos de 10 3,7 CCID 50 (1) Virus vivos atenuados de la rubéola de la cepa Wistar RA27/3** no menos de 10 3,0 CCID 50 (1) (1) (Cell Culture Infective Dose 50% - Dosis que infecta al 50% de los cultivos celulares= DITC 50 -Dosis infecciosa en cultivo de tejidos) * propagado en cultivo tisular de embrión de pollo ** propagado en células diploides humanas MRC 5 Para excipientes, ver FORMA FARMACÉUTICA Polvo y disolvente para solución inyectable. El componente liofilizado de sarampión, parotiditis y rubéola es un polvo de color blanco a rosáceo. El disolvente es transparente e incoloro. 4. DATOS CLÍNICOS 4.1. Indicaciones terapéuticas PRIORIX está indicado para la inmunización activa de niños a partir de 12 meses de edad, adolescentes y adultos frente al sarampión, parotiditis y rubéola Posología y forma de administración Posología La dosis es de 0,5 ml. Se puede utilizar para la inmunización primaria y/o la revacunación de acuerdo con las pautas recomendadas. Dirección General de Salud Pública y Alimentación
19 Forma de administración PRIORIX se administra por vía subcutánea, aunque también se puede administrar por vía intramuscular (ver 4.4.) Contraindicaciones Como sucede con otras vacunas, se debe posponer la administración de PRIORIX a personas que padecen enfermedades febriles agudas severas. Sin embargo, la presencia de una infección leve no es una contraindicación para la vacunación. PRIORIX está contraindicado en personas con historia de anafilaxia alas proteínas del huevo, o con hipersensibilidad conocida a la neomicina o a cualquier otro componente de la vacuna (ver 4.4.). Una historia previa de dermatitis de contacto a la neomicina, no es una contraindicación. No se debe administrar PRIORIX a personas con una respuesta inmunitaria deficiente. Aquí se incluyen las personas con inmunodeficiencias primarias o secundarias. La vacunación frente al sarampión, parotiditis y rubéola en personas infectadas por VIH, se deja a criterio del médico que trate al paciente. Está contraindicada la administración de PRIORIX en mujeres embarazadas. Además, se debe evitar el embarazo durante los tres meses siguientes a la vacunación. No hay datos suficientes del uso de PRIORIX en mujeres en periodo de lactancia. La vacunación de mujeres en el periodo de lactancia puede ser considerada, si los beneficios de la vacunación superan los posibles riesgos Advertencias y precauciones especiales de empleo Los virus vivos atenuados de la vacuna se inactivan con alcohol y otros agentes desinfectantes. Por tanto, estos desinfectantes se tienen que dejar evaporar de la piel, antes de la administración de la vacuna. Debido a la existencia de anticuerpos maternos antisarampión, los niños menores de 12 meses pueden no responder de forma satisfactoria al componente del sarampión de la vacuna. No debe administrarse esta vacuna a niños menores de 12 meses, aunque la vacunación puede estar indicada en determinadas situaciones, tales como en áreas de alto riesgo. En estas situaciones se debería administrar una dosis adicional. En individuos con alteraciones del sistema nervioso central, susceptibles de padecer convulsiones febriles o con historia familiar de convulsiones debe prevenirse el incremento de temperatura. Como sucede con todas las vacunas inyectables, siempre se debe disponer de fácil acceso al tratamiento médico apropiado, en previsión de que se presenten reacciones anafilácticas tras la administración de la vacuna. Se ha demostrado que las vacunas fabricadas en cultivos tisulares de embrión de pollo no contienen proteínas de huevo en cantidad suficiente para provocar reacciones de hipersensibilidad. Se puede considerar la vacunación de las personas que tienen alergia al huevo, si la alergia no es de naturaleza anafiláctica (ver 4.3.). No se ha documentado la transmisión de virus de sarampión o rubéola de las personas vacunadas a contactos susceptibles. La excreción faríngea del virus de la rubéola puede producirse entre los 7 y los 28 días siguientes a la vacunación con una mayor incidencia a los 11 días. Sin embargo, no hay evidencia de transmisión del virus vacunal excretado a los contactos susceptibles. Los datos disponibles obtenidos de los ensayos clínicos en personas a las que se administró PRIORIX por vía intramuscular muestran que los niveles de serconversión a los tres componentes de la vacuna son equivalentes a los observados tras la administración por vía subcutánea. Los títulos de anticuerpos frente a la parotiditis y a la rubéola pueden ser comparativamente menores. PRIORIX contiene trazas de neomicina. La vacuna debería utilizarse con precaución en sujetos con hipersensibilidad conocida a este excipiente (ver sección 4.3). BAJO NINGUNA CIRCUNSTANCIA PUEDE ADMINISTRARSE PRIORIX POR VÍA INTRAVENOSA Interacción con otros medicamentos y otras formas de interacción Si se tiene que realizar la prueba de la tuberculina, ésta se debe realizar antes o simultáneamente a la administración de la vacuna, ya que se ha comunicado que las vacunas combinadas de virus vivos atenuados de sarampión, parotiditis y -rubéola pueden producir una disminución temporal de la sensibilidad de la piel a la tuberculina. Como esta energía puede durar como máximo de 6 semanas, no debe realizarse la prueba de la tuberculina durante dicho periodo de tiempo para evitar resultados falsos negativos. Las vacunas combinadas de sarampión, parotiditis y rubéola pueden administrarse simultáneamente con otras vacunas cumpliendo las recomendaciones del comité asesor de vacunas de cada estado miembro y/o las prácticas clínicas. Se deberían utilizar lugares diferentes de inyección. Si la administración de PRIORIX no se realiza simultáneamente con otra vacuna de virus vivos atenuados, la administración de ambas vacunas se debe realizar con un intervalo de al menos un mes. Dirección General de Salud Pública y Alimentación
20 En personas que han recibido gammaglobulinas humanas o transfusiones sanguíneas, la vacunación debe retrasarse durante al menos tres meses, ya que la vacuna puede no ser eficaz debido a la presencia de anticuerpos adquiridos de forma pasiva frente al sarampión, parotiditis o rubéola. PRIORIX se puede utilizar en la revacunación de sujetos que se hayan vacunado previamente con otra vacuna combinada de sarampión, parotiditis y rubéola Embarazo y lactancia Ver sección 4.3. Contraindicaciones Efectos sobre la capacidad para conducir vehículos y utilizar maquinaria La vacuna no tiene o tiene escaso efecto sobre la capacidad de conducir y utilizar maquinaria Reacciones adversas Las reacciones adversas que podrían ocurrir tras la administración de una vacuna combinada de sarampión, parotiditis y rubéola corresponden a las observadas tras la administración de la correspondiente vacuna monovalente sola o en combinación. En ensayos clínicos controlados, se monitorizaron activamente los signos y síntomas en más de personas durante 42 días tras la administración de la vacuna. También se les solicitó que comunicaran cualquier manifestación clínica que ocurriera durante el periodo del ensayo. Los vacunados comunicaron las siguientes reacciones adversas. Las frecuencias se reportan como sigue: Muy frecuentes: 10% Frecuentes: 1% y < 10% Poco frecuentes: 0,1% y < 1% Raras: 0,01% y < 0,1% Muy raras: < 0,01% Síntomas generales: Muy frecuentes: fiebre (rectal 38ºC - 39,5ºC, axilar/oral 37,5ºC - <39ºC) Frecuentes: fiebre (rectal >39,5ºC; axilar/oral 39,0ºC) Poco frecuentes: llanto anormal Raras: malestar Sistema nervioso central y periférico: Poco frecuentes: convulsiones febriles Sistema endocrino: Poco frecuentes: Inflamación de la parótida Aparato gastrointestinal: Poco frecuentes: diarrea, vómitos, anorexia Trastornos psiquiátricos: Frecuentes: nerviosismo Poco frecuentes: somnolencia, insomnio Mecanismo de resistencia: Poco frecuentes: otra infección vírica, otitis media Aparato respiratorio: Poco frecuentes: faringitis, infección del tracto respiratorio superior, rinitis, bronquitis, tos Piel y anejos: Frecuentes: rash Leucocitos y sistema reticuloendotelial: Poco frecuentes: linfadenopatía. Durante el seguimiento post-comercialización, se han notificado las siguientes reacciones adicionalmente, en asociación temporal con la vacunación con PRIORIX : Síntomas generales: Muy raras: artralgia, artritis, reacciones alérgicas, incluyendo reacciones anafilácticas, síndrome de Kawasaki Sistema nervioso central y periférico: Muy raras: meningitis, mielitis transversa, síndrome de Guillain-Barré, neuritis periférica, encefalitis Plaquetas, hemorragia y coagulación: Muy raras: trombocitopenia, púrpura trombocitopénica Dirección General de Salud Pública y Alimentación
FICHA TECNICA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS (vacuna con
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA VACUNA MSD TRIPLE ANTI-SARAMPIÓN, RUBÉOLA, PAROTIDITIS (vacuna con
FICHA TÉCNICA. Nota: La utilización de Priorix debe realizarse de acuerdo a las recomendaciones oficiales.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PRIORIX polvo y disolvente en jeringa precargada con aguja para solución inyectable PRIORIX polvo y disolvente
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
Vacuna triple vírica (sarampión, rubeola, parotiditis)
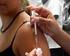 Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
Vacuna triple vírica (sarampión, rubeola, parotiditis) (Comentarios a las fichas técnicas) Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO. DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO DIFTAVAX jeringa precargada Vacuna Antidiftero-tetánica adsorbida para adultos y adolescentes. 2. COMPOSICION
ASPECTOS GENERALES SOBRE VACUNACIÓN
 Qué es la vacunación? La vacunación es el proceso que tiene por objetivo conseguir una respuesta inmunitaria o protección frente a una enfermedad determinada mediante la administración de una vacuna. Es
Qué es la vacunación? La vacunación es el proceso que tiene por objetivo conseguir una respuesta inmunitaria o protección frente a una enfermedad determinada mediante la administración de una vacuna. Es
FICHA TECNICA. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO. ACT-HIB Vacuna de polisacárido de Haemophilus influenzae tipo b conjugado a proteína del tétanos 2. COMPOSICION CUALITATIVA Y CUANTITATIVA. Liofilizado (para una
VACUNACION DE LA EMBARAZADA. Conceptos
 11 VACUNACION DE LA EMBARAZADA Conceptos Las enfermedades infecciosas pueden ocasionar complicaciones graves en el embrión y el feto si los gérmenes atraviesen la barrera placentaria. La placenta se deja
11 VACUNACION DE LA EMBARAZADA Conceptos Las enfermedades infecciosas pueden ocasionar complicaciones graves en el embrión y el feto si los gérmenes atraviesen la barrera placentaria. La placenta se deja
RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO. 25 μg
 agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
agencia española de medicamentos y productos sanitarios RESUMEN DE CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO HibTITER solución inyectable Vacuna conjugada frente a Haemophilus influenzae tipo
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Inflexal V, suspensión inyectable Vacuna antigripal (antígeno de superficie, inactivado, virosoma). Campaña 2011/2012 2. COMPOSICIÓN
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN MH-ONE (todos los países excepto Francia y Dinamarca) Emulsión inyectable para cerdos Suvaxyn M. Hyo Mono
RESUMEN DE LAS CARACTERISTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO SUVAXYN MH-ONE (todos los países excepto Francia y Dinamarca) Emulsión inyectable para cerdos Suvaxyn M. Hyo Mono
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/5 1. NOMBRE DEL MEDICAMENTO VETERINARIO AVINEW 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Virus vivo de la enfermedad de Newcastle, cepa VG/GA, como mínimo:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/5 1. NOMBRE DEL MEDICAMENTO VETERINARIO AVINEW 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Virus vivo de la enfermedad de Newcastle, cepa VG/GA, como mínimo:
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
POLIOMIELITIS INTRODUCCIÓN INDICACIONES
 POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
POLIOMIELITIS 3 INTRODUCCIÓN Es una enfermedad vírica aguda, a menudo identificada por la parálisis flácida aguda, pero con una amplia diversidad de presentaciones clínicas. El agente infeccioso es el
Tuberculosis Hospital Event
 Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Vacunas Varicela- Herpes Zoster. Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC
 Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
Vacunas Varicela- Herpes Zoster Pablo Aldaz Herce Grupo de prevención de Enfermedades Infecciosas PAPPS-SEMFYC 1 Vacunas de la varicela 2 3 Posibles complicaciones de la varicela: Sobreinfecciones bacterianas
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014.
 PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
PREGUNTAS FRECUENTES SOBRE CAMPAÑA DE VACUNACIÓN CONTRA EL SARAMPIÓN Y RUBÉOLA 2013-2014. A quiénes está dirigida la campaña? A todas aquellas personas nacidas entre 1967 y 1986 que no puedan comprobar
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL
 INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
INFORMACIÓN SOBRE VIRUS PAPILOMA HUMANO (VPH) DIRIGIDO A POBLACIÓN GENERAL Desde la perspectiva de Salud Pública, disminuir la incidencia y/o prevenir enfermedades como el cáncer de cuello de útero, producido
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela
 Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
Comentarios a las Fichas Técnicas de las vacunas frente a la varicela Prof. Ángel Gil de Miguel, Catedrático de Medicina Preventiva y Salud Pública, Universidad Rey Juan Carlos, Comunidad de Madrid Las
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS
 VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
VACUNACIÓN FRENTE A SARAMPIÓN, RUBEOLA Y PAROTIDITIS Mª Concepción n Fariñas as Álvarez Servicio de Medicina Preventiva, Calidad y Seguridad del Paciente. Hospital Sierrallana Jornadas de vacunación en
PROGRAMA AMPLIADO DE INMUNIZACIONES. Paraguay
 PROGRAMA AMPLIADO DE INMUNIZACIONES Paraguay Programa Ampliado de Inmunizaciones-PAI Es una acción conjunta de los países de la Región y del mundo para apoyar acciones tendientes a mejorar coberturas de
PROGRAMA AMPLIADO DE INMUNIZACIONES Paraguay Programa Ampliado de Inmunizaciones-PAI Es una acción conjunta de los países de la Región y del mundo para apoyar acciones tendientes a mejorar coberturas de
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Qué es el herpes genital?
 Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
Lote 5: 3.000 vacunas contra la Meningitis Tetravalente ACWY
 PLIEGO DE PRESCRIPCIONES TÉCNICAS PARA LA CONTRATACIÓN DEL SUMINISTRO DE VACUNAS CON DESTINO AL CENTRO DE SALUD INTERNACIONAL, PERTENECIENTE AL INSTITUTO DE SALUD PÚBLICA DEL ORGANISMO AUTÓNOMO MADRID
PLIEGO DE PRESCRIPCIONES TÉCNICAS PARA LA CONTRATACIÓN DEL SUMINISTRO DE VACUNAS CON DESTINO AL CENTRO DE SALUD INTERNACIONAL, PERTENECIENTE AL INSTITUTO DE SALUD PÚBLICA DEL ORGANISMO AUTÓNOMO MADRID
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO BOVILIS LACTOVAC C 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis (5 ml): Sustancia/s activa/s Rotavirus bovino
Vacunación Infantil. www.madrid.org
 Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
Vacunación Infantil www.madrid.org INTRODUCCIÓN a vacunación constituye una de las medidas más eficaces de la moderna salud pública para la prevención de importantes enfermedades que afectan a todos los
PREGUNTAS FRECUENTES SOBRE VPH.
 PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
Que es la rubéola? Todas las personas que se contagian con el virus de la rubéola tienen los síntomas de la enfermedad?
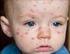 Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
Que es la rubéola? Es una enfermedad causad por un virus. Se caracteriza por fiebre, ganglios agrandados (principalmente en el cuello y detrás de las orejas) y erupción en la piel que dura de 3 a 5 días,
FICHA TECNICA 2. COMPOSICION CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO EchinaMed gotas orales en solución 2. COMPOSICION CUALITATIVA Y CUANTITATIVA 1 ml [= 0.905g] contiene: 860 mg de extracto (como tintura) de la parte aérea fresca
VACUNACIÓN del personal sanitario
 VACUNACIÓN del personal sanitario 21 INTRODUCCIÓN El personal que trabaja en el ámbito sanitario constituye un grupo de riesgo de adquisición y de transmisión de determinadas enfermedades infecciosas,
VACUNACIÓN del personal sanitario 21 INTRODUCCIÓN El personal que trabaja en el ámbito sanitario constituye un grupo de riesgo de adquisición y de transmisión de determinadas enfermedades infecciosas,
CONTRAINDICACIONES Y PRECAUCIONES DE LAS VACUNAS. Herminio R. Hernández Díaz Universidad Peruana Cayetano Heredia
 CONTRAINDICACIONES Y PRECAUCIONES DE LAS VACUNAS Herminio R. Hernández Díaz Universidad Peruana Cayetano Heredia Contraindicaciones y Precauciones de las vacunas Conceptos Una contraindicación significa
CONTRAINDICACIONES Y PRECAUCIONES DE LAS VACUNAS Herminio R. Hernández Díaz Universidad Peruana Cayetano Heredia Contraindicaciones y Precauciones de las vacunas Conceptos Una contraindicación significa
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. DURAMUNE CACHORROS DP + C Liofilizado y disolvente para suspensión inyectable para perros
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Liofilizado y disolvente para suspensión inyectable para perros 2. COMPOSICIÓN
Vacunación contra el sarampión en Argentina
 Vacunación contra el sarampión en Argentina El Ministerio de Salud de la Nación lanzó una campaña masiva de vacunación contra el sarampión, una enfermedad que puede generar graves complicaciones en menores
Vacunación contra el sarampión en Argentina El Ministerio de Salud de la Nación lanzó una campaña masiva de vacunación contra el sarampión, una enfermedad que puede generar graves complicaciones en menores
Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Bovilis IBR Marker viva, liofilizado y disolvente para suspensión para bovino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 2 ml de vacuna reconstituida:
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO RABDOMUN 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cantidad por dosis (1
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DE PRODUCTO TERMINADO 1 1.0. DENOMINACIÓN DISTINTIVA. Vacuna contra el Sarampión, Parotiditis y Rubéola. 2.0. DENOMINACIÓN GENÉRICA Vacuna contra el Sarampión,
ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014
 ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014 La influenza es una de las 15 enfermedades objetivo del Plan Nacional de Inmunizaciones del Ministerio de Salud de Chile. La vacunación anti-influenza
ESTRATEGIA DE VACUNACION CONTRA LA INFLUENZA 2014 La influenza es una de las 15 enfermedades objetivo del Plan Nacional de Inmunizaciones del Ministerio de Salud de Chile. La vacunación anti-influenza
No lo dude, la vacunación es la prevención más efectiva contra la gripe. Prevenir la gripe es más simple de lo que usted piensa
 No lo dude, la vacunación es la prevención más efectiva contra la gripe Prevenir la gripe es más simple de lo que usted piensa Arriesgarse a contraer la gripe o vacunarse? Qué es la gripe? La gripe es
No lo dude, la vacunación es la prevención más efectiva contra la gripe Prevenir la gripe es más simple de lo que usted piensa Arriesgarse a contraer la gripe o vacunarse? Qué es la gripe? La gripe es
POR QUÉ YA NO SE RECOMIENDA ESPERAR 3 MESES PARA HACERSE LA PRUEBA DEL VIH?
 QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
QUÉ ES LA PRUEBA DEL VIH? La prueba del VIH es la única forma fiable de saber si una persona está o no infectada por el VIH, el virus del sida. Las pruebas de diagnóstico del VIH que se emplean habitualmente
Algunas personas infectadas no parecen estar enfermas, pero igual pueden transmitir el microbio a otros.
 Vacuna Contra el Tifus Vivo (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La vacuna
Vacuna Contra el Tifus Vivo (Por vía oral) Índice de contenidos - DESCRIPCIÓN GENERAL - A TENER EN CUENTA - UTILIZACIÓN - ADVERTENCIAS - EFECTOS SECUNDARIOS - COMENTARIOS DESCRIPCIÓN GENERAL La vacuna
Datos clave sobre la influenza y la vacuna contra la
 Datos clave sobre la influenza y la vacuna contra la influenza Qué es la influenza (también llamada gripe)? La influenza es una enfermedad respiratoria contagiosa provocada por los virus de la influenza
Datos clave sobre la influenza y la vacuna contra la influenza Qué es la influenza (también llamada gripe)? La influenza es una enfermedad respiratoria contagiosa provocada por los virus de la influenza
FICHA TÉCNICA. Solución estéril inyectable por vía intramuscular (preferiblemente) o subcutánea. Pneumo 23 es un líquido transparente e incoloro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMO 23, solución inyectable en jeringa precargada Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene:
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
Qué son las vacunas y cómo actúan?
 Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
Qué son las vacunas y cómo actúan? Cuando se sufre una infección, el organismo reacciona produciendo unas sustancias llamadas anticuerpos, que nos defienden de la enfermedad y protegen frente a futuras
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS
 ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
ANEXO CONDICIONES O RESTRICCIONES RESPECTO AL USO SEGURO Y EFICAZ DEL MEDICAMENTO A APLICAR POR LOS ESTADOS MIEMBROS 1 Los Estados Miembros se tienen que asegurar de que se apliquen todas las condiciones
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO M-M-RVAXPRO Polvo y disolvente para suspensión inyectable. Vacuna del sarampión, la parotiditis y la rubéola
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO M-M-RVAXPRO Polvo y disolvente para suspensión inyectable. Vacuna del sarampión, la parotiditis y la rubéola
ANEXO III OBLIGACIONES DEL INDUSTRIAL
 ANEXO III OBLIGACIONES DEL INDUSTRIAL NOTIFICACIÓN ANEXO III OBLIGACIONES DEL INDUSTRIAL Todos los industriales cuyos establecimientos estén afectados por el RD 1254/1999 están obligados a enviar una notificación
ANEXO III OBLIGACIONES DEL INDUSTRIAL NOTIFICACIÓN ANEXO III OBLIGACIONES DEL INDUSTRIAL Todos los industriales cuyos establecimientos estén afectados por el RD 1254/1999 están obligados a enviar una notificación
FICHA TÉCNICA. Polisacárido capsular Vi purificado de Salmonella typhi (cepa Ty2)...25 microgramos
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO TYPHIM Vi, solución inyectable Vacuna antitifoidea de polisacáridos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada dosis de 0,5 ml contiene: Polisacárido capsular
FICHA TÉCNICA. STREPSILS pastillas para chupar sabor miel y limón
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor miel y limón 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Campaña Nacional de Vacunación contra la Rubeola Preguntas frecuentes
 Campaña Nacional de Vacunación contra la Rubeola Preguntas frecuentes Por qué tengo que vacunarme si soy varón? Actualmente en Argentina se vacunan para la rubéola los niños al año de vida, a los 6 años,
Campaña Nacional de Vacunación contra la Rubeola Preguntas frecuentes Por qué tengo que vacunarme si soy varón? Actualmente en Argentina se vacunan para la rubéola los niños al año de vida, a los 6 años,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
DEPARTAMENTO DE MEDICAMENTOS VETERINARIOS RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO NOBILIS SALENVAC T Suspensión inyectable para gallinas. 2. COMPOSICIÓN
QUÉ ES LA HEPATITIS C? CÓMO SE CONTAGIA?
 QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
QUÉ ES LA HEPATITIS C? La hepatitis C es una inflamación del hígado producida por la infección del virus de la hepatitis C. La inflamación puede causar que el hígado no funcione adecuadamente. Se estima
Vacunaciones en grupos de riesgo
 Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
Actividades: 1. Niño con inmunodeficiencia. 2. Niño con diatesis hemorrágica. 3. Niño prematuro. 4. Niño con infección VIH. 5. Niño viajero. 6. Niño con otras condiciones, enfermedades o riesgos. Actividad
FICHA TÉCNICA. Excipientes con efecto conocido: 1,38 g de sacarosa y 1,10 g de glucosa.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor ciruela 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4 diclorobencílico,
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
Que son "inyecciones para la alergia"?
 Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Que son "inyecciones para la alergia"? Este folleto está diseñado para responder las preguntas básicas de quién, qué, cuándo, dónde, cómo y por qué que pueda tener con respecto a la inmunoterapia alergénica,
Guía de Referencia Rápida. Vacunación en la Embarazada GPC. Guía de Práctica Clínica. Catálogo maestro de guías de práctica clínica: IMSS-580-12
 Guía de Referencia Rápida Vacunación en la Embarazada GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-580-12 Guía de Referencia Rápida Z24 Necesidad de inmunización contra
Guía de Referencia Rápida Vacunación en la Embarazada GPC Guía de Práctica Clínica Catálogo maestro de guías de práctica clínica: IMSS-580-12 Guía de Referencia Rápida Z24 Necesidad de inmunización contra
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES
 DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
DÉFICIT SELECTIVO DE IgA INFORMACIÓN PARA PACIENTES Y FAMILIARES UNA PEQUEÑA NOCIÓN DE INMUNOLOGÍA BÁSICA Existen cinco tipos (clases) de inmunoglobulinas o anticuerpos en la sangre: IgG, IgA, IgM, IgD
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje.
 . Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
. Vacunarse antes de viajar puede ayudarle a evitar problemas de salud graves. Es importante planificar la vacunación 4-6 semanas antes del viaje. GMSI C/09 Las vacunaciones recomendadas para destinos
Virus de la bronquitis infecciosa aviar (IBV) cepa variante 4-91 vivo atenuado: 3,6 log10 EID50 *.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Nobilis IB 4-91, liofilizado para suspensión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene por dosis: Sustancia activa: Virus de la bronquitis
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Transfusión de sangre
 Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
Transfusión de sangre Blood Transfusion - Spanish Información para pacientes sobre los beneficios, riesgos y alternativas UHN Cuáles son los beneficios de una transfusión de sangre? Las transfusiones de
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. VERSICAN DHPPi/L3R, liofilizado y disolvente para suspensión inyectable para perros.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSICAN DHPPi/L3R, liofilizado y disolvente para suspensión inyectable para perros. 2. COMPOSICIÓN CUALITATIVA Y
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VERSICAN DHPPi/L3R, liofilizado y disolvente para suspensión inyectable para perros. 2. COMPOSICIÓN CUALITATIVA Y
PROTOCOLO DE VACUNACION DE PACIENTES CON PSORIASIS
 Hospital PROTOCOLO DE VACUNACION DE PACIENTES CON PSORIASIS Los pacientes con psoriasis tienen un mayor riesgo de infecciones asociado tanto a la disregulacion inmune endógena generada por su enfermedad
Hospital PROTOCOLO DE VACUNACION DE PACIENTES CON PSORIASIS Los pacientes con psoriasis tienen un mayor riesgo de infecciones asociado tanto a la disregulacion inmune endógena generada por su enfermedad
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1/21 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Purevax RCPCh FeLV 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio(s) activo(s) Por dosis de 1 ml:
Qué es la influenza o gripe?
 Qué es la influenza o gripe? Es una enfermedad de las vías respiratorias causada por un virus muy contagioso. Existen tres tipos de virus (A, B, C), los cuales pueden cambiar (mutar) cada año o eventualmente
Qué es la influenza o gripe? Es una enfermedad de las vías respiratorias causada por un virus muy contagioso. Existen tres tipos de virus (A, B, C), los cuales pueden cambiar (mutar) cada año o eventualmente
HEPATITIS B INTRODUCCIÓN
 HEPATITIS B 9 INTRODUCCIÓN El virus de la hepatitis B es un virus tipo ADN de la clase hepadnaviridae que se reproduce en el hígado y causa trastornos a este nivel. Se trata de una enfermedad infecciosa
HEPATITIS B 9 INTRODUCCIÓN El virus de la hepatitis B es un virus tipo ADN de la clase hepadnaviridae que se reproduce en el hígado y causa trastornos a este nivel. Se trata de una enfermedad infecciosa
FICHA TÉCNICA. Pastillas circulares de color rosa con sabor a fresa y el icono de Strepsils grabado en ambos lados.
 1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
1. NOMBRE DEL MEDICAMENTO FICHA TÉCNICA STREPSILS pastillas para chupar sabor fresa 2.- COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla para chupar: Amilmetacresol, 0,6 mg Alcohol 2,4-diclorobencílico,
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Las infecciones de transmisión sexual. Gonococia. Preguntas y respuestas
 Las infecciones de transmisión sexual Gonococia Preguntas y respuestas Qué es la gonococia? Es una infección causada por la bacteria Neisseria gonorrhoeae o gonococo, y forma parte del grupo de las infecciones
Las infecciones de transmisión sexual Gonococia Preguntas y respuestas Qué es la gonococia? Es una infección causada por la bacteria Neisseria gonorrhoeae o gonococo, y forma parte del grupo de las infecciones
EchinaMed Junior, comprimidos
 EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
EchinaMed Junior, comprimidos PROSPECTO: información para el usuario Lea todo el prospecto detenidamente porque tiene información importante para Ud. Este medicamento puede obtenerse sin receta, para el
Prospecto: información para el usuario. Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG. Atosiban
 Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
GALLIVAC SE. Vacuna doblemente atenuada Salmonella enteritidis mutante en liofilizado para suspensión oral
 GALLIVAC SE Vacuna doblemente atenuada Salmonella enteritidis mutante en liofilizado para suspensión oral Laboratorio MERIAL LABORATORIOS, S.A. Forma farmacéutica Liofilizado para suspensión oral (Liof.susp.o.)
GALLIVAC SE Vacuna doblemente atenuada Salmonella enteritidis mutante en liofilizado para suspensión oral Laboratorio MERIAL LABORATORIOS, S.A. Forma farmacéutica Liofilizado para suspensión oral (Liof.susp.o.)
INFORMACIÓN ADICIONAL
 DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
DE: DIRECCIÓN GENERAL DE SALUD PÚBLICA 01/12/2015 VACUNACIÓN FRENTE A TOS FERINA EN EL TERCER TRIMESTRE ASUNTO: DEL EMBARAZO INFORMACIÓN ADICIONAL Referencia: mmd VACUNA A EMPLEAR Hasta nueva indicación
CONFIRMACIÓN EPIDEMIOLÓGICA DE LA ENFERMEDAD DE AUJESZKY ANTE LA PRESENCIA DE ANIMALES POSITIVOS AISLADOS O FALSOS POSITIVOS
 MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
MINISTERIO DE MEDIO AMBIENTE Y MEDIO RURAL Y MARINO DG DE RECURSOS AGRICOLAS Y GANADEROS SUBDIRECCIÓN GENERAL DE SANIDAD DE LA PRODUCCIÓIN PRIMARIA PROTOCOLO DE ACTUACIÓN PARA LA CONFIRMACIÓN EPIDEMIOLÓGICA
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS
 5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
5. ACCIONES ANTE LA NOTIFICACIÓN DE CASOS DE LEGIONELOSIS 5.1. Consideraciones generales Para abordar las actuaciones a realizar en un edificio/instalación asociado con casos de legionelosis se deben tener
FICHA TÉCNICA. * cultivados en huevos de gallina embrionados procedentes de pollos sanos ** hemaglutinina
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO MUTAGRIP, suspensión inyectable en jeringa precargada. Vacuna antigripal (virus fraccionados, inactivados). 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Virus de la
Preguntas generales sobre la meningitis
 Preguntas generales sobre la meningitis P: Qué es la meningitis? R: La meningitis es una inflamación de las membranas que recubren el cerebro y la médula espinal. Algunas veces se le conoce como meningitis
Preguntas generales sobre la meningitis P: Qué es la meningitis? R: La meningitis es una inflamación de las membranas que recubren el cerebro y la médula espinal. Algunas veces se le conoce como meningitis
La mayoría de exposiciones no ocasionan una infección. Después de una exposición, el riesgo de infección depende de factores como los siguientes:
 Exposición a la sangre Lo que deben saber los trabajadores de la salud Departamento de Salud y Servicios Humanos Centros para el Control y la Prevención de Enfermedades Exposiciones ocupacionales a la
Exposición a la sangre Lo que deben saber los trabajadores de la salud Departamento de Salud y Servicios Humanos Centros para el Control y la Prevención de Enfermedades Exposiciones ocupacionales a la
LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO LEUCOFELIGEN FeLV/RCP liofilizado y disolvente para suspensión inyectable para gatos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por dosis de 1 ml: Sustancias
Llibreta Plasma-4 cast:plasma-int.cat 26/3/08 16:48 Página 1. Club aféresis. Cuando donas plasma. tú, eres especial. Banc de Sang i Teixits
 Llibreta Plasma-4 cast:plasma-int.cat 26/3/08 16:48 Página 1 Cuando donas plasma tú, eres especial Club aféresis Banc de Sang i Teixits Llibreta Plasma-4 cast:plasma-int.cat 26/3/08 16:48 Página 2 Llibreta
Llibreta Plasma-4 cast:plasma-int.cat 26/3/08 16:48 Página 1 Cuando donas plasma tú, eres especial Club aféresis Banc de Sang i Teixits Llibreta Plasma-4 cast:plasma-int.cat 26/3/08 16:48 Página 2 Llibreta
FICHA TÉCNICA. Las personas con infección sintomática o asintomática por VIH, deben ser vacunadas lo antes posible, una vez confirmado el diagnóstico.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO PNEUMOVAX 23 Solución inyectable en vial. Vacuna antineumocócica de polisacáridos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA La dosis de 0,5 mililitros de vacuna
MINISTERIO DE SANIDAD SERVICIOS SOCIALES E IGUALDAD. Qué es la sangre del cordón umbilical y para qué sirve?
 RESPUESTAS A LAS PREGUNTAS MÁS COMUNES SOBRE SANGRE DE CORDÓN UMBILICAL, PLANTEADAS TRAS LA APROBACIÓN DEL REAL DECRETO 1301/2006 SOBRE CALIDAD Y SEGURIDAD DE CÉLULAS Y TEJIDOS. Qué es la sangre del cordón
RESPUESTAS A LAS PREGUNTAS MÁS COMUNES SOBRE SANGRE DE CORDÓN UMBILICAL, PLANTEADAS TRAS LA APROBACIÓN DEL REAL DECRETO 1301/2006 SOBRE CALIDAD Y SEGURIDAD DE CÉLULAS Y TEJIDOS. Qué es la sangre del cordón
Las infecciones de transmisión sexual. Generalitat de Catalunya Diseño: WHADS ACCENT. Sífilis. Preguntas y respuestas
 Las infecciones de transmisión sexual Generalitat de Catalunya Diseño: WHADS ACCENT Sífilis Preguntas y respuestas Qué es la sífilis? Es una infección causada por la bacteria Treponema pallidum, y forma
Las infecciones de transmisión sexual Generalitat de Catalunya Diseño: WHADS ACCENT Sífilis Preguntas y respuestas Qué es la sífilis? Es una infección causada por la bacteria Treponema pallidum, y forma
Vacunas para la alergia
 Vacunas para la alergia 1 Las vacunas para la alergia o inmunoterapia específica con alergenos, es una forma de tratamiento con el objetivo de disminuir la sensibilidad a sustancias a las que se es alérgico.
Vacunas para la alergia 1 Las vacunas para la alergia o inmunoterapia específica con alergenos, es una forma de tratamiento con el objetivo de disminuir la sensibilidad a sustancias a las que se es alérgico.
Por qué tantos adultos mayores resultan diagnosticados con el VIH y otras enfermedades de transmisión sexual?
 2 Manténgase saludable y sexualmente activo. * El 17% de los casos de VIH/SIDA recientemente diagnosticados en el estado de Nueva York se manifiesta en adultos mayores de 50 años. Según los Centros para
2 Manténgase saludable y sexualmente activo. * El 17% de los casos de VIH/SIDA recientemente diagnosticados en el estado de Nueva York se manifiesta en adultos mayores de 50 años. Según los Centros para
Preguntas frecuentes de interés para los viajeros procedentes de países donde hay casos de poliomielitis
 Preguntas frecuentes Preguntas frecuentes de interés para los viajeros procedentes de países donde hay casos de poliomielitis Por qué ha formulado la Directora General estas recomendaciones para los viajeros
Preguntas frecuentes Preguntas frecuentes de interés para los viajeros procedentes de países donde hay casos de poliomielitis Por qué ha formulado la Directora General estas recomendaciones para los viajeros
FICHA TECNICA ROPHYLAC
 FICHA TECNICA ROPHYLAC RHOPHYLAC Solución INYECTABLE 300 mcg/2 Ml Jeringa de vidrio (Vidrio de Clase 1) prellenada con 2 ml de solución inyectable (1500 UI de inmunoglobulina anti D Indicaciones: Profilaxis
FICHA TECNICA ROPHYLAC RHOPHYLAC Solución INYECTABLE 300 mcg/2 Ml Jeringa de vidrio (Vidrio de Clase 1) prellenada con 2 ml de solución inyectable (1500 UI de inmunoglobulina anti D Indicaciones: Profilaxis
Varicela 1. Agente inmunizante 2. Conservación
 Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
Varicela 1. Agente inmunizante Es una vacuna viral atenuada, desarrollada en Japón en 1974; se utiliza el virus varicela-zoster cepa OKA atenuada (aceptada por OMS) obtenida en cultivos de células diploides
LAS VACUNAS PARA LA ALERGIA. Vacunas
 LAS VACUNAS PARA LA ALERGIA Vacunas 1 Qué son las vacunas para la alergia? La vacunación alérgica o inmunoterapia con alergenos consiste en la administración de pequeñas cantidades crecientes de un alergeno
LAS VACUNAS PARA LA ALERGIA Vacunas 1 Qué son las vacunas para la alergia? La vacunación alérgica o inmunoterapia con alergenos consiste en la administración de pequeñas cantidades crecientes de un alergeno
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO
 ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
ANEXO 9: PLAN DE GESTIÓN DE RIESGOS PARA LA PREVENCIÓN DEL EMBARAZO 1.1. Plan de gestión de riesgos para la prevención del embarazo 1.1.1. Plan de gestión de riesgos para la prevención del embarazo con
FICHA TÉCNICA. Adsorbido en hidróxido de aluminio hidratado Total: 0,50 mg Al 3+ Una dosis (0,5 ml) de Havrix 720 contiene: 720 Unidades ELISA
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Havrix 1440 suspensión inyectable en jeringa precargada Havrix 720 suspensión inyectable en jeringa precargada Vacuna antihepatitis A (inactivada, adsorbida) 2.
La importancia de la vacunación:
 Información para voceros La importancia de la vacunación: La vacunación es la intervención 1 costo efectividad en los últimos dos siglos. Por lo tanto la salud y la prevención de enfermedades a través
Información para voceros La importancia de la vacunación: La vacunación es la intervención 1 costo efectividad en los últimos dos siglos. Por lo tanto la salud y la prevención de enfermedades a través
