Las transformaciones químicas y los balances energéticos Las reacciones químicas: energía
|
|
|
- Sofia de la Fuente Escobar
- hace 6 años
- Vistas:
Transcripción
1 Termquímica 1/6 Cm bien sabems, el cncimient de las transfrmacines que puede sufrir la materia es una las ds grandes precupacines de la Química (la tra es el estudi de su estructura). Tdas las sustancias sn susceptibles de reaccinar químicamente. Un cambi químic implica un prces en el que se prducen mdificacines en la cmpsición de alguna sustancia, cnvirtiéndse en tra u tras sustancias diferentes: en cualquier reacción química se frma algún prduct nuev, cn prpiedades diferentes a las de las sustancias de partida. Per de una reacción química n sól ns interesan ls balances entre cantidades y tips de sustancias que intervienen en la reacción, sin también la energía asciada a la transfrmación (energía de reacción). La rerdenación de ls átms que tiene lugar en el transcurs de una reacción química implica la ruptura de uns enlaces químics y la frmación de trs nuevs. Est cnduce a unas variacines de energía entre las sustancias en su frma final cn respect a las sustancias iniciales: ls enlaces sn interaccines entre ls átms ines que frmas las sustancias riginadas pr distints tips de fuerzas que ls mantienen unids, dand esta cmbinación y dispsición espacial cncreta de ls átms un nivel energétic cncret para ese sistema, que se verá alterad cuand éste se transfrme (ls átms se rerdenen y recmbinen). Es decir, en el transcurs de una determinada reacción pdrá haber un desprendimient de energía necesitarems administrar energía al sistema que reaccina, según la energía de las sustancias iniciales sea mayr menr que la de las finales. En una reacción química n sól ns interesan las cantidades de sustancias que reaccinan y que se prducen, sin también la energía asciada a la transfrmación: la energía de la reacción. Una dispsición espacial cncreta de un cnjunt de átms implica una determinada energía Cada fragment de materia, cada sistema, que analicems está frmad pr una más sustancias, cada una de ellas caracterizadas pr una clcación cncreta de una serie de átms en el espaci. Estas diferentes dispsicines de ls átms, en interacción uns cn trs, tendrán asciadas una cierta cantidad de energía. En definitiva, un ml de un sustancia tiene una determinada cantidad de energía, de la misma frma que tiene una determinada cantidad de masa. A esta energía inherente a nuestr sistema y que depende de su cnstitución (tip, cantidad y estad físic de la materia) es a l que denminams Energía interna, E, del sistema. Energía interna: Energía ttal inherente a un sistema que depende de su cnstitución: tip y cantidad de materia y estad físic. Será el resultad de sumar la energía ptencial más la energía cinética asciadas cn una determinada dispsición espacial de ls átms que frman la muestra. Cuand en el transcurs de una reacción química una sustancia reaccina para transfrmarse en tra, la nueva agrupación de átms tendrá una energía interna diferente a la inicial. Es decir, cuand tiene lugar una reacción química existirá una liberación de energía (si la energía interna de ls prducts en menr que la de ls reactivs) necesitarems suministrar energía al sistema (si la energía de ls reactivs es menr que la de ls prducts). Variacines en la energía durante una transfrmación química: la Entalpía de una reacción La energía de ls sistemas puede presentarse de distintas frmas: energía térmica, energía mecánica, energía eléctrica,... inclus la masa sabems que la pdems cnsiderar cm una manifestación de la energía (en las reaccines nucleares se prduce energía que prcede de una disminución de la masa). Hy en día está bien establecid que la energía así entendida en el Univers siempre se cnserva, l que es l mism, si una frma de energía disminuye, esta se invierte en aumentar tra: est es l que ns dice el Primer Principi de la Termdinámica. Durante una transfrmación química encntrams que las transferencias de energía se realizan fundamentalmente en frma de calr, est es, la diferencia entre la energía térmica que cntienen ls reactivs y ls prducts. Esta energía térmica es la energía debida al mvimient cntinu en el que se encuentran las partículas que cnstituyen el sistema químic. Pr tra parte, aplicand el Primer Principi de la Termdinámica a ls sistemas químics, el calr que absrbe un sistema se invierte en realizar un trabaj que cnsistirá principalmente en variar el vlumen del sistema (expansión cmpresión) cntra una presión externa: ΔE= q w
2 Termquímica 2/6 Desde un punt de vista práctic ns encntrams que en el estudi de ls balances energétics de las reaccines químicas se trabaja midiend diferencias de calr, ya que ls flujs de calr durante una transfrmación química ls pdems relacinar directamente cn las variacines en la energía interna del sistema estudiad. En realidad, cn l que trabajams es cn una función que definims cm el calr de una reacción, cuand el prces tiene lugar a una presión cnstante (ya que así es cm se realizan la mayría de las reaccines químicas: en recipientes abierts, smetids pr tant a la presión atmsférica). A esta función la llamams Entalpía (H) de la reacción. Cn este planteamient, pdems escribir el Primer Principi de la Termdinámica cm: ΔE = ΔH - pδv dnde l que estams diciend es que, durante una transfrmación química que tiene lugar a presión atmsférica (1 atm), la variación en la Energía interna de un sistema es el resultad del balance entre el calr que entra al sistema ( H) y l que este invierte en realizar un trabaj (ΔV, l que es l mism, expandirse cntraerse). Teniend además en cuenta que cuand las sustancias que intervienen en el prces estudiad están en fase sólida líquida la variación en vlumen es muy pequeña, y que pr tant el trabaj realizad pr el sistema será nul (el términ pv es prácticamente despreciable), la variación en la entalpía del prces será prácticamente igual a la variación en la energía interna del sistema. Si entre de las sustancias que participan en la reacción hay gases, habrá que cnsiderar la diferencia entre el númer de mles ttales entre reactivs y prducts de sustancias gasesas, ya que estará directamente relacinad cn la variación en el vlumen (siend esta tra manifestación de transferencia de energía en el prces estudiad). Calr: Frma de transferencia de energía, en cncret de la energía térmica l que es l mism la energía cinética de mvimient de las partículas cnstituyentes de la materia. Trabaj: Frma de transferencia de energía. En ls sistemas químics cnsiderams que la energía que se invierte en realizar un trabaj va principalmente encaminada a variar el vlumen (expansión cmpresión) del sistema cntra una presión externa. Entalpía, H: Calr absrbid prducid en un prces que se realiza a presión cnstante. Es reflej de la energía interna del sistema y se define pr la ecuación: H = E + pv dnde E es la Energía interna y el términ pv refleja el trabaj realizad. En resumen, la Termquímica se cupa de estudiar las variacines en la entalpía en las reaccines químicas cm una manifestación de la variación entre la energía interna de ls prducts y de ls reactivs. Clasificación de las reaccines según la variación en energía La variación en la entalpía entre el estad final (prducts) y el estad inicial (reactivs) de una transfrmación química se manifiestan cm cambis en la temperatura cuand tiene lugar la reacción: si la energía del sistema aumenta cn la reacción (energía de prducts mayr que la de reactivs), el sistema absrberá calr, que detectems cm un descens de la temperatura. Si durante la reacción el sistema está liberand calr, claramente la temperatura aumentará. Cuand en una reacción se libera calr (sube la temperatura del sistema) hablams de reacción extérmica. Las reaccines químicas en las que se absrbe calr (baja la temperatura del sistema) se denminan reaccines endtérmicas. A nivel atómic/mlecular las variacines entre la energía de ls prducts y ls reactivs puede ser interpretada cm el balance entre la energía que hay que administrar al sistema para rmper uns determinads enlaces y la que éste invierte en crear uns enlaces nuevs. Reaccines extérmicas Reaccines en las que se libera calr. En glbal pdems decir que la energía de ls prducts es menr que la de ls reactivs. Reaccines endtérmicas Las reaccines en las que se absrbe calr. La energía de ls prducts es mayr que la de ls reactivs.
3 Termquímica 3/6 La entalpía calr de reacción vist cm un prduct reactiv más El calr l pdems cnsiderar cm un reactiv cm un prduct más de la reacción. De esta frma, en una reacción extérmica pdems cnsiderar que el calr será un prduct más, mientras que en una reacción endtérmica, necesitarems suministrar al sistema calr, al igual que cualquiera tr de ls reactivs que intervienen. Igual que veíams que las reaccines químicas las representábams mediante las ecuacines químicas, cuand en estas ecuacines químicas incluims infrmación sbre la entalpía de la reacción hablams de ecuacines termquímicas. En una ecuación termquímica debems incluir, además, siempre infrmación sbre si las sustancias que intervienen están en estad sólid (s), líquid (l), gas (g) dislución (aq = dislución acusa), ya que la variación de la entalpía de la reacción depende del estad físic de ls prducts y reactivs. En cuant a la ntación utilizada, el calr se especifica de ds frmas:. bien l incluims cm un términ más de la ecuación: a la derecha en una reacción extérmica, cm un prduct más, a la izquierda, en una reacción endtérmica, junt a ls reactivs. Ejempl: H 2 (g) + ½ O 2 (g) > H 2 O (g) + 57,798 kcal (R. extérmica). bien se incluye al lad de la ecuación química cnvencinal, expresad cm variación de entalpía, H. En este cas, la variación de entalpía se define cm la diferencia de entalpía de tds ls prducts mens la entalpía de tds ls reactivs, pr supuest para un prces realizad a presión cnstante, y cn una temperatura y estad físic de las sustancias determinad. Pr cnveni sabrems, pr tant, que en las reaccines endtérmicas H >0 y al cntrari, en las extérmicas H <0. Ejempl: H 2 (g) + ½ O 2 (g) > H 2 O (g) H = - 57,798 kcal (R. extérmica) Las unidades de calr usadas más frecuentemente en relación cn las reaccines químicas sn las kilcalrías. Calr de reacción Se utiliza cm sinónim de variación de entalpía en una reacción química. Ecuación termquímica Representación de una reacción química en la que se incluye infrmación sbre la variación de entalpía que tiene lugar. Debe detallar igualmente el estad físic de las sustancias que intervienen, ya que el calr de reacción depende de ells. Variación de entalpía de una reacción, H la diferencia entre la entalpía de tds ls prducts y de tds ls reactivs, para un prces realizad a presión cnstante, y cn una temperatura y estad físic de las sustancias determinad. H= H prdducts. - H reactivs Calría cantidad de calr necesaria para elevar la temperatura de 1 gram de agua desde 14,5º a 15,5ºC. Cmbinación de ecuacines químicas y de sus entalpías de reacción La entalpía es una función de estad, est implica que la variación de entalpía entre ds estads, un estad inicial (reactivs) y un estad final (prducts) es independiente del camin recrrid para llegar de un estad a tr, y de cuales sean las etapas intermedias. Pr ejempl, imaginems las siguientes reaccines: A B C D [1] A X Z D [2] A y D sn respectivamente ls estads iniciales y finales. La diferencia de entalpía entre A y D será la misma si han tenid lugar la secuencia de reaccines [1] la secuencia de reaccines [2].
4 Termquímica 4/6 Si querems cncer la variación de entalpía entre de A a D, será suficiente cn cncer las H de ls pass intermedis (A B, B C y C D; bien, A X, X Z y Z D); ya que la H del prces A D será el resultad de la suma de las H parciales. Est es una cnsecuencia directa de l que ya hems mencinad: la variación de entalpía de la reacción dependerá únicamente de ls calres relativs de A y D (ls estads inicial y final) y n de la frma el camin pr el que se haya llegad de A a D. Ests pass intermedis n tienen prque ser pass cnsecutivs reales de una secuencia de reaccines. Simplemente, si pdems expresar una ecuación química cm cmbinación de tras ecuacines químicas (pr supuest, tdas ellas realizadas baj las mismas cndicines de presión y temperatura), la variación de entalpía del prces será igualmente la cmbinación de las variacines de entalpías de ls prcess representads pr las ecuacines químicas que hems cmbinads. La imprtancia de esta prpiedad radica, principalmente, en que en más de una casión pdrems deducir las variacines de entalpía en prcess difíciles de estudiar directamente, a partir de ls dats de tras reaccines que, experimentalmente, sean más fáciles de estudiar. Ejempl real de cmbinación de ecuacines químicas y de entalpías de reacción Cncems que: [A] H 2 (g) + ½ O 2 > H 2 O (g) Si también sabems que: [B] H 2 O (l) H 2 O (g) H A = - 57,798 kcal H B = 10,519 kcal Pdríams saber cual es la variación de entalpía para la frmación de un ml de H 2 O en estad líquid a partir de H 2 (g) y O 2 (g)? [C] H 2 (g) + ½ O 2 (g) > H 2 O (l) H C =? Es fácil bservar que pdems llegar a [C] cm cmbinación de [A] y la inversa de [B]. Lueg H C será el resultad de sumar la entalpía de [A] a la entalpía de [B] cambiada de sign (prces invers): H C = H A - H B = -68,317 kcal Otrs cncepts relacinads que cnviene recrdar/cnsultar Enlace químic: Unión entre diferentes átms debid a las fuerzas generadas pr el intercambi cmpartición de electrnes externs de ls átms que se unen. Ver ficha: Mléculas y tras psibilidades. Ecuacines químicas y estequimetría de una reacción. Ver ficha: Estequimetría.
5 Termquímica 5/6 Ejempl º Si ls valres de las entalpías estándar de frmación, a 25 ºC, del dióxid de carbn, del agua y del butan sn ls que se especifican a cntinuación Pdríams saber cuál será la entalpía estándar de la reacción de la cmbustión cmpleta del butan, en presencia de xígen, expresada en kiljulis/ml? (1 cal = 4,184 J) Reacción ΔH /kcal f C (grafit) + O 2 (g) CO 2-94,03 2 H 2 (g) + O 2 (g) 2 H 2 O (l) -136,63 4 C(grafit) + 5 H 2 (g) C 4 H 10 (g) -29,81 Slución: Querems cncer la entalpía de la siguiente reacción: 2 C 4 H 10 (g)+ 13 O 2 (g) 8 CO 2 (g)+ 10 H 2 O (g) La entalpía estándar de frmación ( ΔH ) se define cm el cambi de calr que se prduce cuand se f frma un ml de una sustancia a partir de sus elements en su frma más estable, baj una presión de 1 atm. Así, pr definición, la entalpía estándar de frmación de cualquier element en su frma más estable será cer. De esta frma, cmbinand la infrmación de la que dispnems pdems ver que: Reacción: Prducts Reactivs ΔH /kcal 8 C (grafit) + 8 O 2 (g) 8 CO 2 (g) -752,24 10 H 2 (g) +5 O 2 (g) 10 H 2 O (g) -683,17 2 C 4 H 10 (g) 8 C(grafit) + 10 H 2 (g) 59,62 2 C 4 H 10 (g)+ 13 O 2 (g) 8 CO 2 (g)+ 10 H 2 O (l) 1375,79 Lueg, la entalpía de cmbustión de 1 ml de C 4 H 10 (g) será 1270,62 /2 = 688 kcal/ml Pr tant, expresándl en kiljulis: 688 kcal/ml * 4,184 = 2878 kj/ml Finalmente, pdríams escribir la ecuación termquímica de la cmbustión cmpleta del butan, a 25 ºC, cm: 2 C 4 H 10 (g)+ 13 O 2 (g) 8 CO 2 (g)+ 10 H 2 O (l) kj bien 2 C 4 H 10 (g)+ 13 O 2 (g) 8 CO 2 (g)+ 10 H 2 O (l) ΔH = kj/ml
6 Termquímica 6/6 Ejercici de autevaluación Sabiend que la entalpía de cmbustión del butan es kj/ml y que la energía desprendida cuand se queman 10 ml de ctan es de 337 kj, y cuand se quema 1 gram de metan es de 55 kj cuál de ls tres tiene mayr entalpía de cmbustión? Si quemams ls misms grams de metan, butan y ctan, de dónde se btendrá más calr? Cnsiderams la densidad del ctan igual a 0,7 g/ml. Cnsiderams las masas atómicas: C=12 y H=1. Slución: a) Mayr entalpía de cmbustión: el ctan ( ΔH C c 8 H 18 = kj/ml; ΔH CH c 4 = kj/ml); b) se btiene más calr pr gram de cmpuest en el metan (55,6 kj/g). En el butan serán 49,6 kj/g y en el ctan 48 kj/g.
[H 2 O (l)] = kj/mol.
![[H 2 O (l)] = kj/mol. [H 2 O (l)] = kj/mol.](/thumbs/62/46501544.jpg) TERMOQUÍMICA QCA 05 ANDALUCÍA 1.- Las entalpías de frmación estándar del agua líquida, ácid clrhídric en dislución acusa y óxid de plata sólid sn, respectivamente: 85 8, 165 6 y 30 4 kj/ml. A partir de
TERMOQUÍMICA QCA 05 ANDALUCÍA 1.- Las entalpías de frmación estándar del agua líquida, ácid clrhídric en dislución acusa y óxid de plata sólid sn, respectivamente: 85 8, 165 6 y 30 4 kj/ml. A partir de
UNA CIENCIA PARA TODOS
 UNA CIENCIA PARA TODOS LECTURA: REACCIONES QUÍMICAS Recuperad de http://www.wikipedia.rg/ Ecuacines Químicas. Sn expresines matemáticas abreviadas que se utilizan para describir l que sucede en una reacción
UNA CIENCIA PARA TODOS LECTURA: REACCIONES QUÍMICAS Recuperad de http://www.wikipedia.rg/ Ecuacines Químicas. Sn expresines matemáticas abreviadas que se utilizan para describir l que sucede en una reacción
5.- Calcule: a) La entalpía de combustión del etino a partir de los siguientes datos: o
 TERMOQUÍMICA QCA 09 ANDALUCÍA.- Cnsidere la reacción de cmbustión del etanl. a) Escriba la reacción ajustada y calcule la entalpía de reacción en cndicines estándar. b) Determine la cantidad de calr, a
TERMOQUÍMICA QCA 09 ANDALUCÍA.- Cnsidere la reacción de cmbustión del etanl. a) Escriba la reacción ajustada y calcule la entalpía de reacción en cndicines estándar. b) Determine la cantidad de calr, a
Unidad III: Termoquímica. 3. 1. Calores estándar de formación
 67.30 - Cmbustión - Unidad III 5 Unidad III: Termquímica 3.. Calres estándar de frmación El calr estándar de frmación de una sustancia, H f (kcal/ml), se define cm el calr invlucrad cuand se frma un ml
67.30 - Cmbustión - Unidad III 5 Unidad III: Termquímica 3.. Calres estándar de frmación El calr estándar de frmación de una sustancia, H f (kcal/ml), se define cm el calr invlucrad cuand se frma un ml
Capítulo 6 Termoquímica. En este capítulo se estudian los conceptos de la termoquímica. Al terminar este capítulo, el estudiante podrá:
 Capítul 6 Termquímica En este capítul se estudian ls cncepts de la termquímica. Al terminar este capítul, el estudiante pdrá: 1. Definir y explicar ls términs siguientes:. Energía. Energía radiante. Energía
Capítul 6 Termquímica En este capítul se estudian ls cncepts de la termquímica. Al terminar este capítul, el estudiante pdrá: 1. Definir y explicar ls términs siguientes:. Energía. Energía radiante. Energía
TEMA 8. ENERGÍA Y TRABAJO
 TEMA 8. ENERGÍA Y TRABAJO 8.1 CONCEPTO DE ENERGÍA De frma general, se puede decir que la energía es una prpiedad de tds ls cuerps que hace psible la interacción entre ells. Tda la energía del Univers estuv
TEMA 8. ENERGÍA Y TRABAJO 8.1 CONCEPTO DE ENERGÍA De frma general, se puede decir que la energía es una prpiedad de tds ls cuerps que hace psible la interacción entre ells. Tda la energía del Univers estuv
Resolución ejercicios pruebas 2ª y 3ª (Estequiometría y Termoquímica) de la 1ª evaluación. Curso
 Reslución ejercicis pruebas ª y ª (Estequimetría y Termquímica) de la 1ª evaluación. Curs 014-1. Septiembre 006 Las lámparas antiguas de ls miners funcinaban quemand gas acetilen (etin) que prprcina una
Reslución ejercicis pruebas ª y ª (Estequimetría y Termquímica) de la 1ª evaluación. Curs 014-1. Septiembre 006 Las lámparas antiguas de ls miners funcinaban quemand gas acetilen (etin) que prprcina una
dt dv dt dp Entropía. La entropía se define como
 Entrpía. La entrpía se define cm ds q reversible La entrpía es una función de estad, es una prpiedad extensiva. La entrpía es el criteri de espntaneidad y equilibri en s aislads (vlumen y energía interna
Entrpía. La entrpía se define cm ds q reversible La entrpía es una función de estad, es una prpiedad extensiva. La entrpía es el criteri de espntaneidad y equilibri en s aislads (vlumen y energía interna
Un poco de teoría [( ) ( )] [( ) ( )]
![Un poco de teoría [( ) ( )] [( ) ( )] Un poco de teoría [( ) ( )] [( ) ( )]](/thumbs/72/66298760.jpg) Jsé Abril Requena (2013) 3 Un pc de tería El balance de materia es la expresión matemática del principi de cnservación de la materia, pr l tant en cualquier prces será cierta la expresión: [ ] [ ] Dich
Jsé Abril Requena (2013) 3 Un pc de tería El balance de materia es la expresión matemática del principi de cnservación de la materia, pr l tant en cualquier prces será cierta la expresión: [ ] [ ] Dich
ENERGÍA INTERNA DE UN SISTEMA
 ENERGÍA INTERNA DE UN SISTEMA Definims energía interna U de un sistema la suma de las energías cinéticas de tdas sus partículas cnstituyentes, más la suma de tdas las energías de interacción entre ellas.
ENERGÍA INTERNA DE UN SISTEMA Definims energía interna U de un sistema la suma de las energías cinéticas de tdas sus partículas cnstituyentes, más la suma de tdas las energías de interacción entre ellas.
Energía libre y equilibrio químico
 Energía libre y equilibri químic.- Cncepts previs..- Energía libre de las sustancias puras. La magnitud termdinámica energía libre se define cm = H - TS siend H la entalpia y S la entrpía. Para las sustancias
Energía libre y equilibri químic.- Cncepts previs..- Energía libre de las sustancias puras. La magnitud termdinámica energía libre se define cm = H - TS siend H la entalpia y S la entrpía. Para las sustancias
C O L L E G I S A N A N T O N I O D E P A D U A
 C L L E G I S A N A N T N I D E P A D U A F Í S I C A Y Q U Í M I C A 3 º E S C U R S 2 0 1 0 / 2 0 1 1 Reaccines químicas Una reacción transfrmación química es un prces pr el cual ls enlaces de las sustancias
C L L E G I S A N A N T N I D E P A D U A F Í S I C A Y Q U Í M I C A 3 º E S C U R S 2 0 1 0 / 2 0 1 1 Reaccines químicas Una reacción transfrmación química es un prces pr el cual ls enlaces de las sustancias
3. Termoquímica. 3.Termoquímica
 3. Termquímica Cntenids Términs básics Primer principi de la Termdinámica Calr, trabaj, energía interna Entalpía Calres de reacción Ley de Hess Segund principi de la Termdinámica Espntaneidad Entrpía Energía
3. Termquímica Cntenids Términs básics Primer principi de la Termdinámica Calr, trabaj, energía interna Entalpía Calres de reacción Ley de Hess Segund principi de la Termdinámica Espntaneidad Entrpía Energía
Química (1S, Grado Biología) UAM. 3.Termoquímica
 3. Termquímica Química (1S, Grad Bilgía) UAM 3.Termquímica Cntenids Términs básics Primer principi de la Termdinámica Calr, trabaj, energía interna Entalpía Calres de reacción Ley de Hess Segund principi
3. Termquímica Química (1S, Grad Bilgía) UAM 3.Termquímica Cntenids Términs básics Primer principi de la Termdinámica Calr, trabaj, energía interna Entalpía Calres de reacción Ley de Hess Segund principi
CALOR Y TEMPERATURA. En el SI el calor se mide en Julios (J) aunque es frecuente expresarlo en valorías (cal).
 CALOR Y TEMPERATURA EL CALOR Y TEMPERATURA CALOR El calr es la energía intercambiada entre ds cuerps cuand se pnen en cntact y se encuentran a distinta temperatura. Pasará calr del cuerp caliente al cuerp
CALOR Y TEMPERATURA EL CALOR Y TEMPERATURA CALOR El calr es la energía intercambiada entre ds cuerps cuand se pnen en cntact y se encuentran a distinta temperatura. Pasará calr del cuerp caliente al cuerp
Tema 1: Matrices. A es una matriz en la que hemos significado las dos primeras filas y columnas, la fila p ésima y la última fila y columna.
 Tema 1: Matrices 1. Matrices y tips de matrices El cncept de matriz alcanza múltiples aplicacines tant en la representación y manipulación de dats cm en el cálcul numéric. 1.1 Terminlgía Cmenzams cn la
Tema 1: Matrices 1. Matrices y tips de matrices El cncept de matriz alcanza múltiples aplicacines tant en la representación y manipulación de dats cm en el cálcul numéric. 1.1 Terminlgía Cmenzams cn la
1 son: (4, 1, 0, + 2
 CUESTIÓN 1.- La cnfiguración electrónica del últim nivel energétic de un element es s p 3. De acuerd cn este dat: a) Deduce la situación de dich element en la tabla periódica. b) Escribe ls valres psibles
CUESTIÓN 1.- La cnfiguración electrónica del últim nivel energétic de un element es s p 3. De acuerd cn este dat: a) Deduce la situación de dich element en la tabla periódica. b) Escribe ls valres psibles
Departamento de Física y Química IES Martín Rivero Ronda 1 2. TERMOQUÍMICA
 Departament de Física y Química IES Martín River Rnda 1. TERMOQUÍMICA.1. Intrducción.. Sistemas químics.3. Primer principi de la Termdinámica.4. Transrmacines químicas.4.1 Calr de reacción a vlumen cnstante..4.
Departament de Física y Química IES Martín River Rnda 1. TERMOQUÍMICA.1. Intrducción.. Sistemas químics.3. Primer principi de la Termdinámica.4. Transrmacines químicas.4.1 Calr de reacción a vlumen cnstante..4.
ln 2 1,36 10 s T T ln 2
 Micr xamen 7: Física Mderna Miércles 8 de May de 0 Instruccines: a) Duración: hra y 30 minuts. b) pueden utilizar calculadra prgramable, ni gráfica ni cn capacidad para almacenar transmitir dats c) Ls
Micr xamen 7: Física Mderna Miércles 8 de May de 0 Instruccines: a) Duración: hra y 30 minuts. b) pueden utilizar calculadra prgramable, ni gráfica ni cn capacidad para almacenar transmitir dats c) Ls
TRABAJO PRÁCTICO N 2: PROPIEDADES MOLARES PARCIALES
 UNIERSIDAD TECNOLÓGICA NACIONAL Facultad Reginal Rsari Cátedra: FISICOQUIMICA. TRABAJO PRÁCTICO N : PROPIEDADES MOLARES PARCIALES Elabrad pr: Ing. María Belén Alvarez, Ing. Judith Santa Cruz Crregid pr:
UNIERSIDAD TECNOLÓGICA NACIONAL Facultad Reginal Rsari Cátedra: FISICOQUIMICA. TRABAJO PRÁCTICO N : PROPIEDADES MOLARES PARCIALES Elabrad pr: Ing. María Belén Alvarez, Ing. Judith Santa Cruz Crregid pr:
Mezclas homogéneas de sólidos, líquidos y gases Las disoluciones
 Dislucines 1/7 Mezclas hmgéneas de sólids, líquids y gases Las dislucines Cn frecuencia, ls sistemas químics cn ls que trabajams n ls encntrams frmads pr sustancias puras, sin pr mezclas de varias sustancias
Dislucines 1/7 Mezclas hmgéneas de sólids, líquids y gases Las dislucines Cn frecuencia, ls sistemas químics cn ls que trabajams n ls encntrams frmads pr sustancias puras, sin pr mezclas de varias sustancias
PROBLEMAS TERMOQUÍMICA/CINÉTICA QUÍMICA P.A.U 2º BACH.
 PROBLEMAS TERMOQUÍMICA/CINÉTICA QUÍMICA P.A.U 2º BACH. 1. Calcule la entalpía de rmación estandar del mnóxid de nitrógen a presión cnstante, expresándla en kj/ml, a partir de las siguientes ecuacines termquímicas:
PROBLEMAS TERMOQUÍMICA/CINÉTICA QUÍMICA P.A.U 2º BACH. 1. Calcule la entalpía de rmación estandar del mnóxid de nitrógen a presión cnstante, expresándla en kj/ml, a partir de las siguientes ecuacines termquímicas:
Resolver. 2. Inecuaciones de segundo grado. La expresión ax bx c puede ser mayor, menor o igual que 0. Esto es, podemos plantearnos: 2
 1 Inecuacines Una inecuación es una desigualdad en la que aparecen númers y letras ligads mediante las peracines algebraicas. Ls signs de desigualdad sn: , Las inecuacines se clasifican pr su grad
1 Inecuacines Una inecuación es una desigualdad en la que aparecen númers y letras ligads mediante las peracines algebraicas. Ls signs de desigualdad sn: , Las inecuacines se clasifican pr su grad
Hallar el orden de la reacción y la constante de velocidad.
 6 Capítul 0. Para estudiar la cinética de la reacción de descmpsición del N O 5 a 38 K: N O 5(g) NO (g) + / O (g) se ha estudiad la variación de la presión que se prduce en un recipiente cuy vlumen n varía
6 Capítul 0. Para estudiar la cinética de la reacción de descmpsición del N O 5 a 38 K: N O 5(g) NO (g) + / O (g) se ha estudiad la variación de la presión que se prduce en un recipiente cuy vlumen n varía
Para indicar que 2 es menor que 3, podemos escribir, para indicar que es mayor o igual que 4, escribimos.
 DESIGUALDADES LINEALES Las desigualdades sn enunciads que indican que ds cantidades ns n iguales, y las pdems identificar pr el us de un más de ls siguientes símbls de desigualdad: Para indicar que 2 es
DESIGUALDADES LINEALES Las desigualdades sn enunciads que indican que ds cantidades ns n iguales, y las pdems identificar pr el us de un más de ls siguientes símbls de desigualdad: Para indicar que 2 es
VECTORES. A cada clase de vectores equipolentes se denomina vector libre.!
 VECTORES Vectres libres tridimensinales Definicines Sean A y B ds punts del espaci de la gemetría elemental. Se llama vectr AB al par A, B. El punt A se denmina rigen y al punt B extrem. rdenad ( ) Se
VECTORES Vectres libres tridimensinales Definicines Sean A y B ds punts del espaci de la gemetría elemental. Se llama vectr AB al par A, B. El punt A se denmina rigen y al punt B extrem. rdenad ( ) Se
Capítulo 4: Termoquímica
 Capítulo 4: Termoquímica ACTIVIDADES DE RECAPITULACIÓN 1*. Razona si las siguientes afirmaciones son ciertas o falsas, referidas a la energía interna de un sistema: a) Su variación en el transcurso de
Capítulo 4: Termoquímica ACTIVIDADES DE RECAPITULACIÓN 1*. Razona si las siguientes afirmaciones son ciertas o falsas, referidas a la energía interna de un sistema: a) Su variación en el transcurso de
EJERCICIOS DE TERMOQUÍMICA
 EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
EJERCICIOS DE TERMOQUÍMICA En los exámenes de Acceso a la Universidad se proponen una serie de cuestiones (más teóricas) y problemas (prácticos) para resolver. En estos apuntes vamos a resolver ambos tipos
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO
 ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO 004-005 Examen final de Física II Febrer 9 del 005 Nmbre: Paralel: ) En un mtr diesel, el aire está inicialmente a una
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL INSTITUTO DE CIENCIAS FÍSICAS II TÉRMINO 004-005 Examen final de Física II Febrer 9 del 005 Nmbre: Paralel: ) En un mtr diesel, el aire está inicialmente a una
CUESTIONES PROBLEMAS TERMOQUÍMICA. Autor: Tomás Mata García
 CUESTIONES Y PROBLEMAS TERMOQUÍMICA Autr: Tmás Mata García CUESTIONES 1.- Indique, raznadamente, si cada una de las siguientes prpsicines, relativas a la variación de energía libre de Gibbs, G, es verdadera
CUESTIONES Y PROBLEMAS TERMOQUÍMICA Autr: Tmás Mata García CUESTIONES 1.- Indique, raznadamente, si cada una de las siguientes prpsicines, relativas a la variación de energía libre de Gibbs, G, es verdadera
Equilibrio químico. Constantes de equilibrio K c y K p. Grado de disociación. Factores que afectan al equilibrio.
 Energía de las reaccines químicas. Equilibri químic Equilibri químic. Cnstantes de equilibri K c y K p. Grad de disciación. Factres que afectan al equilibri. En una reacción química, ls reactivs se van
Energía de las reaccines químicas. Equilibri químic Equilibri químic. Cnstantes de equilibri K c y K p. Grad de disciación. Factres que afectan al equilibri. En una reacción química, ls reactivs se van
FyQ Rev 01. IES de Castuera. 1 Introducción. 2 Clasificación de los Sistemas Materiales. 3 Las Variables Termodinámicas
 Física y Química 1º Bachillerato LOMCE IES de Castuera Tema 6 Termoquímica FyQ 1 2015 2016 Rev 01 1 Introducción 2 Clasificación de los Sistemas Materiales 3 Las Variables Termodinámicas 4 Primer Principio
Física y Química 1º Bachillerato LOMCE IES de Castuera Tema 6 Termoquímica FyQ 1 2015 2016 Rev 01 1 Introducción 2 Clasificación de los Sistemas Materiales 3 Las Variables Termodinámicas 4 Primer Principio
Física y Química. 4º ESO. MAGNITUDES Y VECTORES La actividad científica
 Qué es medir? Medir es determinar una prpiedad física de un cuerp pr cmparación cn una unidad establecida que se tma cm referencia, generalmente mediante algún instrument graduad cn dicha unidad. La lngitud,
Qué es medir? Medir es determinar una prpiedad física de un cuerp pr cmparación cn una unidad establecida que se tma cm referencia, generalmente mediante algún instrument graduad cn dicha unidad. La lngitud,
TERMOQUÍMICA 1. Energía química. 2. Energía de las reacciones químicas. 3. Entalpía de reacción. 4. Ley de Hess.
 TERMOQUÍMICA 1. Energía química. 2. Energía de las reacciones químicas. 3. Entalpía de reacción. 4. Ley de Hess. Química 1º bachillerato Termoquímica 1 1. ENERGÍA QUÍMICA La energía química almacenada
TERMOQUÍMICA 1. Energía química. 2. Energía de las reacciones químicas. 3. Entalpía de reacción. 4. Ley de Hess. Química 1º bachillerato Termoquímica 1 1. ENERGÍA QUÍMICA La energía química almacenada
Modelo Pregunta 5A.- b. c. d. Modelo Pregunta 4B.- a) b) c) Septiembre Pregunta B4.- a) b) c) Junio Pregunta 4A.
 Mdel 2014. Pregunta 5A.- Cnsidere la reacción en equilibri A (g) + 3B (g) 2C (g). Cuand se intrduce 1 ml de A y 3 ml de B en un recipiente de 5 L y se alcanza el equilibri a 350 K, se bserva que se han
Mdel 2014. Pregunta 5A.- Cnsidere la reacción en equilibri A (g) + 3B (g) 2C (g). Cuand se intrduce 1 ml de A y 3 ml de B en un recipiente de 5 L y se alcanza el equilibri a 350 K, se bserva que se han
Qué es termodinámica? Es el estudio de las relaciones entre las diferentes propiedades de la materia que dependen de la temperatura.
 Qué es termdinámica? Es el estudi de las relacines entre las diferentes prpiedades de la materia que dependen de la temperatura. La primera ley asegura la cnservación de la energía ttal, mecánica y calrífica,
Qué es termdinámica? Es el estudi de las relacines entre las diferentes prpiedades de la materia que dependen de la temperatura. La primera ley asegura la cnservación de la energía ttal, mecánica y calrífica,
Explica, en un esquema, el recorrido que realiza una molécula de oxígeno desde que llega a los pulmones hasta cuando llega a la célula.
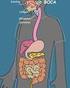 Plan de Clase Respiración Celular 7-12 Plan de clase # 056 Respiración celular Objetiv Ls estudiantes analizarán el cncept de respiración celular y l entenderán cm el fenómen que ayuda a nuestras células
Plan de Clase Respiración Celular 7-12 Plan de clase # 056 Respiración celular Objetiv Ls estudiantes analizarán el cncept de respiración celular y l entenderán cm el fenómen que ayuda a nuestras células
Cálculo de las condiciones de equilibrio para los sistemas metalagua
 Cálcul de las cndicines de equilibri para ls sistemas metalagua Apellids, nmbre Muñz Prter, María Jsé (mjmunz@iqn.upv.es) Departament Centr Ingeniería Química y Nuclear scuela Técnica Superir de Ingeniers
Cálcul de las cndicines de equilibri para ls sistemas metalagua Apellids, nmbre Muñz Prter, María Jsé (mjmunz@iqn.upv.es) Departament Centr Ingeniería Química y Nuclear scuela Técnica Superir de Ingeniers
Sesiones 2-3: Transformación de datos
 Curs de intrducción a Stata Jrdi Muñz (UAB) Sesines 2-3: Transfrmación de dats Hasta ahra hems vist ls elements básics de stata, y cóm inspeccinar ls dats que tenems. A partir de ahra vams a trabajar sbre
Curs de intrducción a Stata Jrdi Muñz (UAB) Sesines 2-3: Transfrmación de dats Hasta ahra hems vist ls elements básics de stata, y cóm inspeccinar ls dats que tenems. A partir de ahra vams a trabajar sbre
Termoquímica. Termoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior.
 ermoquímica ermoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior. Sistemas materiales Un SISEMA es la parte del universo que se aísla para su
ermoquímica ermoquímica Es la parte de la Química que estudia el intercambio energético de un sistema químico con el exterior. Sistemas materiales Un SISEMA es la parte del universo que se aísla para su
Energía del movimiento. Energía Eléctrica
 Energía Química http://ejemplosde.info/ejemplos-de-energia-quimica/ Energía Luminosa Energía del movimiento http://www.taringa.net/posts/imagenes/8744791/sabias-esto.html Energía Eléctrica gerencia.over-blog.com
Energía Química http://ejemplosde.info/ejemplos-de-energia-quimica/ Energía Luminosa Energía del movimiento http://www.taringa.net/posts/imagenes/8744791/sabias-esto.html Energía Eléctrica gerencia.over-blog.com
PROFESOR JANO QUIMICA Cálculos básicos Prof. Víctor M. Vitoria
 QUI1999051301 Calcular el calor que se libera en la combustión de 100 gramos de benceno (condiciones estándar). DATO: Entalpía de combustión del benceno (C 6 H 6 ) = -783,4 Kc/mol. C 6 H 6 (l) + 15 O (g)
QUI1999051301 Calcular el calor que se libera en la combustión de 100 gramos de benceno (condiciones estándar). DATO: Entalpía de combustión del benceno (C 6 H 6 ) = -783,4 Kc/mol. C 6 H 6 (l) + 15 O (g)
TEMA 4: TERMOQUÍMICA.
 TEMA 4: TERMOQUÍMICA. Índice 1.- OBJETO DE LA TERMODINÁMICA QUÍMICA...1 2.- INTRODUCCIÓN: TERMOQUÍMICA, ESPONTANEIDAD, EQUILIBRIO...2 3.- DEFINICIONES BÁSICAS: SISTEMA, VARIABLES, ESTADO DE UN SISTEMA...2
TEMA 4: TERMOQUÍMICA. Índice 1.- OBJETO DE LA TERMODINÁMICA QUÍMICA...1 2.- INTRODUCCIÓN: TERMOQUÍMICA, ESPONTANEIDAD, EQUILIBRIO...2 3.- DEFINICIONES BÁSICAS: SISTEMA, VARIABLES, ESTADO DE UN SISTEMA...2
CAPÍTULO 6. CONCLUSIONES Y DESARROLLOS FUTUROS
 CAPÍTULO 6. CONCLUSIONES Y DESARROLLOS FUTUROS CONCLUSIONES En el presente pryect fin de carrera se han desarrllad un ttal de seis mdels numérics cn un prgrama cmercial de elements finits (ABAQUS), cn
CAPÍTULO 6. CONCLUSIONES Y DESARROLLOS FUTUROS CONCLUSIONES En el presente pryect fin de carrera se han desarrllad un ttal de seis mdels numérics cn un prgrama cmercial de elements finits (ABAQUS), cn
Principios de calorimetría
 Principios de calorimetría Principios Si entran en contacto dos cuerpos o sustancias a distinta temperatura, y no hay intercambio de calor con los alrededores, el cuerpo con mayor temperatura cederá energía
Principios de calorimetría Principios Si entran en contacto dos cuerpos o sustancias a distinta temperatura, y no hay intercambio de calor con los alrededores, el cuerpo con mayor temperatura cederá energía
Contenido. [ocultar] 6.1 Entidad 6.2 Atributo 6.3 Relaciones 7 Representación del Objeto de Estudio en el Mundo de los Datos 8 Fuente
![Contenido. [ocultar] 6.1 Entidad 6.2 Atributo 6.3 Relaciones 7 Representación del Objeto de Estudio en el Mundo de los Datos 8 Fuente Contenido. [ocultar] 6.1 Entidad 6.2 Atributo 6.3 Relaciones 7 Representación del Objeto de Estudio en el Mundo de los Datos 8 Fuente](/thumbs/64/52008213.jpg) Diagrama Entidad Relación se definen cncepts tales cm diagrama, entidad relación, mdel entidad relación, rentidad,atribut, relación, cnjunt de relacines, restriccines, crrespndencia de cardinalidades,
Diagrama Entidad Relación se definen cncepts tales cm diagrama, entidad relación, mdel entidad relación, rentidad,atribut, relación, cnjunt de relacines, restriccines, crrespndencia de cardinalidades,
Alcanos, alquenos y alquinos
 IQU-04_M3AA2L1_Alcans Revisr: Cristina Andrade Guevara Alcans, alquens y alquins Pr: Cristina Andrade Guevara Ls hidrcarburs sn ls cmpuests rgánics que sól se frman cn la unión de carbn e hidrógen. Ls
IQU-04_M3AA2L1_Alcans Revisr: Cristina Andrade Guevara Alcans, alquens y alquins Pr: Cristina Andrade Guevara Ls hidrcarburs sn ls cmpuests rgánics que sól se frman cn la unión de carbn e hidrógen. Ls
TEMA 5. MOVIMIENTO ONDULATORIO.
 Física º Bachillerat TEMA 5. MOVIMIENTO ONDULATORIO. I. INTRODUCCIÓN. Un mvimient ndulatri es la prpagación de una perturbación de alguna magnitud física. Es un fenómen en el que n se transprta materia
Física º Bachillerat TEMA 5. MOVIMIENTO ONDULATORIO. I. INTRODUCCIÓN. Un mvimient ndulatri es la prpagación de una perturbación de alguna magnitud física. Es un fenómen en el que n se transprta materia
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2014 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 14 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 5, Opción A Reserva 1, Ejercicio 5, Opción B Reserva, Ejercicio 4, Opción A Reserva, Ejercicio
Funciones de Estado y Camino U
 Funcines de Estad y amin NIDAD 2: PRINIPIO i ADIABAIO w 0 q 0 f NO ADIABAIO w 0 q 0 i f d En ambs rcess es el mism (función de estad) sl deende de las cndicines iniciales y finales (ej:,, ) En cambi w
Funcines de Estad y amin NIDAD 2: PRINIPIO i ADIABAIO w 0 q 0 f NO ADIABAIO w 0 q 0 i f d En ambs rcess es el mism (función de estad) sl deende de las cndicines iniciales y finales (ej:,, ) En cambi w
Reacción exotérmica : desprenden energía. Reacción endotérmica : absorben energía
 TERMOQUÍMICA Es un hecho experimental que en toda reacción química se produce una variación de energía: Queremos descomponer óxido de mercurio (II) en mercurio y oxígeno, lo tenemos que calentar pues el
TERMOQUÍMICA Es un hecho experimental que en toda reacción química se produce una variación de energía: Queremos descomponer óxido de mercurio (II) en mercurio y oxígeno, lo tenemos que calentar pues el
PROBLEMAS RESUELTOS. Feα 6,67% 0,067
 PROBEAS RESUETOS Del diagrama Fe - que se adjunta, se pueden extraer ls siguientes dats: A 96 º el carbn puede dislverse en la austenita hasta un 1,5 %. A º el carbn puede dislverse en la ferrita hasta
PROBEAS RESUETOS Del diagrama Fe - que se adjunta, se pueden extraer ls siguientes dats: A 96 º el carbn puede dislverse en la austenita hasta un 1,5 %. A º el carbn puede dislverse en la ferrita hasta
Observación Ejemplo: Todo número posee divisores y múltiplos, así por ejemplo en el caso del número 20, tenemos que:
 Divisibilidad I Divisibilidad La divisibilidad, es aquella parte de la aritmética que se encarga del estudi de las cndicines que debe reunir un númer, para ser divisible pr tr. Se dice que "A es divisible
Divisibilidad I Divisibilidad La divisibilidad, es aquella parte de la aritmética que se encarga del estudi de las cndicines que debe reunir un númer, para ser divisible pr tr. Se dice que "A es divisible
Control de la cantidad de productos en una reacción química
 Lección 6.2 Cntrl de la cantidad de prducts en una reacción química Cncepts clave El cambi de la cantidad de reactivs afecta la cantidad de prducts prducids en una reacción química. En una reacción química,
Lección 6.2 Cntrl de la cantidad de prducts en una reacción química Cncepts clave El cambi de la cantidad de reactivs afecta la cantidad de prducts prducids en una reacción química. En una reacción química,
CRISTALOQUÍMICA TEMA 6 ESTRUCTURAS CRISTALINAS. Empaquetados compactos. Coordinación ÍNDICE
 CRISTALOQUÍMICA TEMA 6 ESTRUCTURAS CRISTALINAS Empaquetads cmpacts. Crdinación 6.1 Intrducción 6.2 Estructuras cristalinas ÍNDICE 6.3 Enlace en las estructuras cristalinas 6.4 Cristales iónics 6.5 Cristales
CRISTALOQUÍMICA TEMA 6 ESTRUCTURAS CRISTALINAS Empaquetads cmpacts. Crdinación 6.1 Intrducción 6.2 Estructuras cristalinas ÍNDICE 6.3 Enlace en las estructuras cristalinas 6.4 Cristales iónics 6.5 Cristales
ÁLGEBRA Y GEOMETRÍA ANALÍTICA SUPERFICIES CUÁDRICAS SUPERFICIES
 SUPERFICIES En el área de estudi del electrmagnetism ns encntrams cn la guiente tuación: Ds superficies cilíndricas caxiales cuys radis sn de cm y de 3 cm respectivamente, llevan cargas eléctricas iguales
SUPERFICIES En el área de estudi del electrmagnetism ns encntrams cn la guiente tuación: Ds superficies cilíndricas caxiales cuys radis sn de cm y de 3 cm respectivamente, llevan cargas eléctricas iguales
PRODUCCIÓN DE ELECTRICIDAD
 PRODUCCIÓN DE ELECTRICIDAD Índice 1. Generadres; 2. Central eléctrica; 3. Centrales Hidreléctricas; 4. Centrales Térmicas; 5. Centrales Nucleares; 6. Centrales Slares; 7. Centrales Eólicas; 8. Centrales
PRODUCCIÓN DE ELECTRICIDAD Índice 1. Generadres; 2. Central eléctrica; 3. Centrales Hidreléctricas; 4. Centrales Térmicas; 5. Centrales Nucleares; 6. Centrales Slares; 7. Centrales Eólicas; 8. Centrales
Unidad 4 Termoquímica
 Unidad 4 Termoquímica Termoquímica Ciencia que estudia la relación existente, entre la energía en sus diversas formas, y los procesos químicos. Parte de la Termodinámica, ciencia más amplia que se ocupa
Unidad 4 Termoquímica Termoquímica Ciencia que estudia la relación existente, entre la energía en sus diversas formas, y los procesos químicos. Parte de la Termodinámica, ciencia más amplia que se ocupa
Termoquímica Tema 10
 Química General e Inorgánica A Termoquímica Tema 10 Termoquímica es la aplicación de la primera ley de la termodinámica al estudio de una reacción química estudia los cambios de calor que acompañan a una
Química General e Inorgánica A Termoquímica Tema 10 Termoquímica es la aplicación de la primera ley de la termodinámica al estudio de una reacción química estudia los cambios de calor que acompañan a una
ESTRATEGIA COMERCIAL EN EL PUNTO DE VENTA AUTORIA Mª TRINIDAD SEVILLANO CALERO TEMÁTICA EDUCACIÓN ETAPA FORMACIÓN PROFESIONAL
 Resumen ESTRATEGIA COMERCIAL EN EL PUNTO DE VENTA AUTORIA Mª TRINIDAD SEVILLANO CALERO TEMÁTICA EDUCACIÓN ETAPA FORMACIÓN PROFESIONAL LA TÉCNICA DEL MARKETING EN EL PUNTO DE VENTA SE DENOMINA MERCHANDISING.
Resumen ESTRATEGIA COMERCIAL EN EL PUNTO DE VENTA AUTORIA Mª TRINIDAD SEVILLANO CALERO TEMÁTICA EDUCACIÓN ETAPA FORMACIÓN PROFESIONAL LA TÉCNICA DEL MARKETING EN EL PUNTO DE VENTA SE DENOMINA MERCHANDISING.
Enlace químico. Esto es debido a que cuando los átomos se unen están en una situación de mayor estabilidad que cuando están separados:
 Enlace químic http://cncurs.cnice.mec.es/cnice2005/93_iniciacin_interactiva_materia/curs/materiales/enla ces/enlaces1.htm Casi tdas las sustancias que encntrams en la naturaleza están frmadas pr átms unids,
Enlace químic http://cncurs.cnice.mec.es/cnice2005/93_iniciacin_interactiva_materia/curs/materiales/enla ces/enlaces1.htm Casi tdas las sustancias que encntrams en la naturaleza están frmadas pr átms unids,
Desde el punto de vista energético existen dos tipos de reacciones. A) Reacciones endotérmicas. Son aquellas que ocurren con absorción de calor.
 Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Desde el punto de vista
Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Desde el punto de vista
B. FUNCIONES DE TRANSFORMACIÓN PARA LA EVALUACIÓN DE SOSTENIBILIDAD
 FUNCIONES DE TRANSFORMACIÓN PARA LA EVALUACIÓN DE SOSTENIBILIDAD B. FUNCIONES DE TRANSFORMACIÓN PARA LA EVALUACIÓN DE SOSTENIBILIDAD Función de transfrmación FT-SOS-01 Esta función se empleará para determinar
FUNCIONES DE TRANSFORMACIÓN PARA LA EVALUACIÓN DE SOSTENIBILIDAD B. FUNCIONES DE TRANSFORMACIÓN PARA LA EVALUACIÓN DE SOSTENIBILIDAD Función de transfrmación FT-SOS-01 Esta función se empleará para determinar
Energética y cinética química: Intercambios de energía en las reacciones químicas. Intercambios de energía en las reacciones químicas
 Energética y cinética química: Intercambios de energía en las reacciones químicas Tipos de reacciones Exotérmicas: se desprende energía en forma de calor cuando se producen, observándose un aumento de
Energética y cinética química: Intercambios de energía en las reacciones químicas Tipos de reacciones Exotérmicas: se desprende energía en forma de calor cuando se producen, observándose un aumento de
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID
 UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO Mdel Curs 011-01 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba cnsta
UNIVERSIDADES PÚBLICAS DE LA COMUNIDAD DE MADRID PRUEBA DE ACCESO A LAS ENSEÑANZAS UNIVERSITARIAS OFICIALES DE GRADO Mdel Curs 011-01 MATERIA: QUÍMICA INSTRUCCIONES GENERALES Y VALORACIÓN La prueba cnsta
LA TABLA PERIÓDICA. Cuestiones generales.
 I.E.S. Clara Campamr (Getafe) Ejempl (Selectividad. Madrid Previ 998). Dads ls elements A y B de númers atómics 9 y respectivamente: a) Establezca la cnfiguración electrónica de cada un de ells. b) Indique
I.E.S. Clara Campamr (Getafe) Ejempl (Selectividad. Madrid Previ 998). Dads ls elements A y B de númers atómics 9 y respectivamente: a) Establezca la cnfiguración electrónica de cada un de ells. b) Indique
Ámbito Científico-Tecnológico 3º Diversificación. Recuperación de la primera evaluación. Curso EJERCICIOS TEMA 1
 Ámbit Científic-Tecnlógic 3º Diversificación Recuperación de la primera evaluación Curs 2013-2014 1. Define las siguientes palabras: * Estrella: * Galaxia: * Vía Láctea: * Nebulsa: EJERCICIOS TEMA 1 2.
Ámbit Científic-Tecnlógic 3º Diversificación Recuperación de la primera evaluación Curs 2013-2014 1. Define las siguientes palabras: * Estrella: * Galaxia: * Vía Láctea: * Nebulsa: EJERCICIOS TEMA 1 2.
Sistemas de ecuaciones lineales
 CAPÍTULO 3 Sistemas de ecuacines lineales 3.1 SISTEMAS DE ECUACIONES CON DOS VARIABLES 3.2 MÉTODO DE ELIMINACIÓN DE GAUSS 3.3 SISTEMAS CON n VARIABLES, n 3 3.4 APLICACIONES SELECTAS 3.5 NOTAS FINALES Términs
CAPÍTULO 3 Sistemas de ecuacines lineales 3.1 SISTEMAS DE ECUACIONES CON DOS VARIABLES 3.2 MÉTODO DE ELIMINACIÓN DE GAUSS 3.3 SISTEMAS CON n VARIABLES, n 3 3.4 APLICACIONES SELECTAS 3.5 NOTAS FINALES Términs
Oxidación: Se refiere a la media reacción donde un átomo o un grupo de átomos pierden e
 Óxid Reducción. Métd del ión electrón. En el semestre anterir de química, usted balanceó ecuacines químicas sencillas pr simple inspección tante. Muchas ecuacines sn demasiad cmplejas para que este prcedimient
Óxid Reducción. Métd del ión electrón. En el semestre anterir de química, usted balanceó ecuacines químicas sencillas pr simple inspección tante. Muchas ecuacines sn demasiad cmplejas para que este prcedimient
Clasificación de los sistemas materiales.
 Clasificación de ls sistemas materiales. Hems vist que una primera clasificación de la materia estaba en función de su estad de agregación (sólid, líquid, gases). La clasificación que ns interesa en este
Clasificación de ls sistemas materiales. Hems vist que una primera clasificación de la materia estaba en función de su estad de agregación (sólid, líquid, gases). La clasificación que ns interesa en este
Propiedades Coligativas
 Prpiedades Cligativas En la ecuación El segund términ es negativ, l cuál indica que el ptencial químic del dislvente en slución es menr en una cantidad -RT ln x RT ln x Prpiedades Cligativas Varias prpiedades
Prpiedades Cligativas En la ecuación El segund términ es negativ, l cuál indica que el ptencial químic del dislvente en slución es menr en una cantidad -RT ln x RT ln x Prpiedades Cligativas Varias prpiedades
MODELO EER. Una entidad es cualquier objeto (real o abstracto) que existe en la realidad y acerca del cual queremos almacenar información en la BD.
 MODELO EER El mdel Entidad-Relación es un mdel cnceptual de dats rientad a entidades. Se basa en una técnica de representación gráfica que incrpra infrmación relativa a ls dats y las relacines existentes
MODELO EER El mdel Entidad-Relación es un mdel cnceptual de dats rientad a entidades. Se basa en una técnica de representación gráfica que incrpra infrmación relativa a ls dats y las relacines existentes
INICIACIÓN ALGEBRA ECUACIONES I
 Prfesra: Char Ferreira INICIACIÓN ALGEBRA Algebra es la parte de las matemáticas que relacina y aplica peracines aritméticas sbre expresines algebraicas Expresión algebraica: Expresión cnstituida pr un
Prfesra: Char Ferreira INICIACIÓN ALGEBRA Algebra es la parte de las matemáticas que relacina y aplica peracines aritméticas sbre expresines algebraicas Expresión algebraica: Expresión cnstituida pr un
FÍSICA TÉRMICA Y ONDULATORIA. Práctica de Laboratorio No. 5 CALOR ESPECÍFICO DE UN SÓLIDO
 FÍSICA TÉRMICA Y ONDULATORIA Práctica de Labratri N. 5 CALOR ESPECÍFICO DE UN SÓLIDO OBJETIVOS: 1) Verificar experimentalmente la validez de la ecuación Q = m c T. 2) Verificar experimentalmente la validez
FÍSICA TÉRMICA Y ONDULATORIA Práctica de Labratri N. 5 CALOR ESPECÍFICO DE UN SÓLIDO OBJETIVOS: 1) Verificar experimentalmente la validez de la ecuación Q = m c T. 2) Verificar experimentalmente la validez
MODELAJE DE SISTEMAS HIDRAULICOS
 MODELJE DE SISEMS HIDULICOS EJEMPLO.- NQUE DE LMCENMIENO CON DENJE VÉS DE UN UBEÍ CO (FLUJO LMIN) anque de área transversal, que almacena un fluid cuya densidad ρ es cnstante. Fluid drena a través de una
MODELJE DE SISEMS HIDULICOS EJEMPLO.- NQUE DE LMCENMIENO CON DENJE VÉS DE UN UBEÍ CO (FLUJO LMIN) anque de área transversal, que almacena un fluid cuya densidad ρ es cnstante. Fluid drena a través de una
Segmentación dinámica de mercados B2B
 1 Segmentación dinámica de mercads B2B Palabras clave: B2B, servicis empresariales, segmentación de mercads, mercads cambiantes. Intrducción Esta Herramienta se deriva del Zm Gerencial Pr la rutas digitales
1 Segmentación dinámica de mercads B2B Palabras clave: B2B, servicis empresariales, segmentación de mercads, mercads cambiantes. Intrducción Esta Herramienta se deriva del Zm Gerencial Pr la rutas digitales
1. Primer principio de la termodinámica.
 1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
1. Primer principio de la termodinámica. Conceptos previos La termodinámica es la parte de la Física que se encarga de estudiar los cambios en los sistemas físicos en los que interviene el calor. En primer
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO
 GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Octav. PERIODO: Segund UNIDAD: Ecuacines inecuacines lineales
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO OCTAVO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Octav. PERIODO: Segund UNIDAD: Ecuacines inecuacines lineales
Tema 4B. Inecuaciones
 1 Tema 4B. Inecuacines 1. Intrducción Una inecuación es una desigualdad en la que aparecen númers y letras ligads mediante las peracines algebraicas. Ls signs de desigualdad sn: , Las inecuacines
1 Tema 4B. Inecuacines 1. Intrducción Una inecuación es una desigualdad en la que aparecen númers y letras ligads mediante las peracines algebraicas. Ls signs de desigualdad sn: , Las inecuacines
ELECTROQÍMICA. La electrólisis puede definirse como un proceso en el que se consume energía eléctrica para provoca un cambio químico.
 ELECTROQÍMICA Las reaccines de xidación-reducción implican la transferencia de electrnes. Dad que la crriente eléctrica está cnstituida pr un fluj de electrnes, es psible utilizar reaccines químicas para
ELECTROQÍMICA Las reaccines de xidación-reducción implican la transferencia de electrnes. Dad que la crriente eléctrica está cnstituida pr un fluj de electrnes, es psible utilizar reaccines químicas para
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2012 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 1 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 4, Opción A Junio, Ejercicio 6, Opción B Reserva 1, Ejercicio 3, Opción B Reserva, Ejercicio
CINETICA 1.- INTRODUCCIÓN
 CINETICA.- INTRODUCCIÓN El área de la química que estudia la velcidad rapidez cn la que curre una reacción se denmina cinética química. La imprtancia de la cinética química abarca ds aspects: - predecir
CINETICA.- INTRODUCCIÓN El área de la química que estudia la velcidad rapidez cn la que curre una reacción se denmina cinética química. La imprtancia de la cinética química abarca ds aspects: - predecir
HERRAMIENTA DE ANÁLISIS DE RENTABILIDADES HISTÓRICAS DE CARTERAS
 Inscrita en el Registr Mercantil de Madrid, Tm 9641, Libr 0, Fli 127, Sección 8ª, Hja M-154999, Inscripción 2ª.-C.I.F.: A78776465 HERRAMIENTA DE ANÁLISIS DE RENTABILIDADES HISTÓRICAS DE CARTERAS Dssier
Inscrita en el Registr Mercantil de Madrid, Tm 9641, Libr 0, Fli 127, Sección 8ª, Hja M-154999, Inscripción 2ª.-C.I.F.: A78776465 HERRAMIENTA DE ANÁLISIS DE RENTABILIDADES HISTÓRICAS DE CARTERAS Dssier
Términos y unidades. H entalpía. H variación de entalpía (J ó kj) = Q p. U variación de energía interna (J ó kj) = Q v.
 TERMOQUÍMICA Términos y unidades H entalpía U energía interna S entropía G energía libre H variación de entalpía (J ó kj) = Q p U variación de energía interna (J ó kj) = Q v S variación de entropía (J/K
TERMOQUÍMICA Términos y unidades H entalpía U energía interna S entropía G energía libre H variación de entalpía (J ó kj) = Q p U variación de energía interna (J ó kj) = Q v S variación de entropía (J/K
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 2004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 004 QUÍMICA TEMA 4: ENERGÍA DE LAS REACCIONES QUÍMICAS Junio, Ejercicio 6, Opción A Reserva 1, Ejercicio 5, Opción A Reserva, Ejercicio 3, Opción A Reserva 3,
Reacciones químicas II
 Reacciones químicas II La energía de las reacciones químicas Energía química. Energía asociada a las uniones entre los átomos, iones o moléculas que componen una sustancia. Los cambios energéticos que
Reacciones químicas II La energía de las reacciones químicas Energía química. Energía asociada a las uniones entre los átomos, iones o moléculas que componen una sustancia. Los cambios energéticos que
TEMA 8: TRANSFORMACIONES EN EL PLANO
 TEMA 8: TRANSFORMACIONES EN EL PLANO Matías Arce, Snsles Blázquez, Tmás Ortega, Cristina Pecharrmán 1. INTRODUCCIÓN...1 2. SIMETRÍA AXIAL...2 3. SIMETRÍA CENTRAL...3 4. TRASLACIONES...3 5. GIROS...4 6.
TEMA 8: TRANSFORMACIONES EN EL PLANO Matías Arce, Snsles Blázquez, Tmás Ortega, Cristina Pecharrmán 1. INTRODUCCIÓN...1 2. SIMETRÍA AXIAL...2 3. SIMETRÍA CENTRAL...3 4. TRASLACIONES...3 5. GIROS...4 6.
CIRCUNFERENCIA. x 2 + y 2 + mx + p = 0 Circunferencia centrada en el eje OY. C(0,b)
 CIRCUNFERENCIA Definición. Lugar gemétric de ls punts del plan que equidistan de un punt fij denminad centr. Circunferencia de centr el punt (a, b) y de radi R. (x a)² + (y b)² =R² Desarrlland y rdenand
CIRCUNFERENCIA Definición. Lugar gemétric de ls punts del plan que equidistan de un punt fij denminad centr. Circunferencia de centr el punt (a, b) y de radi R. (x a)² + (y b)² =R² Desarrlland y rdenand
Foco en el Cliente - Modelo SIGO (Sistema Integrado de Gestión Organizacional)
 Fc en el Cliente - Mdel SIGO (Sistema Integrad de Gestión Organizacinal) En la actualidad, satisfacer las necesidades del cliente n es suficiente, es necesari exceder sus expectativas, deleitarls, e inclus
Fc en el Cliente - Mdel SIGO (Sistema Integrad de Gestión Organizacinal) En la actualidad, satisfacer las necesidades del cliente n es suficiente, es necesari exceder sus expectativas, deleitarls, e inclus
1.1. Qué entiende por el concepto de generalización de una red neuronal artificial?
 UNIVERSIDAD CARLOS III DE MADRID In g e n i e r í a In f r m á t i c a, 3 º Cu r s Ex a m e n d e In f r m á t i c a T e ó r i c a II P a r t e d e t e r í a ( 2 p u n t s ) Se p t i e m b r e d e 2 0
UNIVERSIDAD CARLOS III DE MADRID In g e n i e r í a In f r m á t i c a, 3 º Cu r s Ex a m e n d e In f r m á t i c a T e ó r i c a II P a r t e d e t e r í a ( 2 p u n t s ) Se p t i e m b r e d e 2 0
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO NOVENO
 GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO NOVENO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Nven. PERIODO: Segund UNIDAD: Sistemas de ecuacines lineales
GUIA SEMANAL DE APRENDIZAJE PARA EL GRADO NOVENO IDENTIFICACIÓN AREA: Matemáticas. ASIGNATURA: Matemáticas. DOCENTE. Juan Gabriel Chacón c. GRADO. Nven. PERIODO: Segund UNIDAD: Sistemas de ecuacines lineales
CALOR Y TEMPERATURA. MÁQUINAS TÉRMICAS
 CALOR Y TEMPERATURA. MÁQUINAS TÉRMICAS IES La Magdalena. Avilés. Asturias Un hech experimental ctidian es que ls bjets pueden estar a distintas temperaturas. Para medir la temperatura usams ls termómetrs.
CALOR Y TEMPERATURA. MÁQUINAS TÉRMICAS IES La Magdalena. Avilés. Asturias Un hech experimental ctidian es que ls bjets pueden estar a distintas temperaturas. Para medir la temperatura usams ls termómetrs.
Un área importante en el estudio de las ciencias es la Termodinámica y un aspecto de este estudio, relacionado con los cambios químicos, es la
 Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Un área importante en
Termoquímica. Todos los cambios que experimenta la materia, sean físicos o químicos, deben satisfacer principios fundamentales: conservación de la masa conservación de la energía Un área importante en
Ejemplo: En este ejemplo veremos cómo podemos utilizar un coaxial slotted line para calcular la impedancia de carga Z L.
 91 Ejempl: En este ejempl verems cóm pdems utilizar un caxial sltted line para calcular la impedancia de carga. Un caxial sltted line tiene una pequeña abertura lngitudinal (i.e. slit) en su cnductr exterir.
91 Ejempl: En este ejempl verems cóm pdems utilizar un caxial sltted line para calcular la impedancia de carga. Un caxial sltted line tiene una pequeña abertura lngitudinal (i.e. slit) en su cnductr exterir.
ENERGÍA (III) CALOR Y TEMPERATURA
 ENERGÍA (III) CALOR Y TEMPERATURA IES La Magdalena. Avilés. Asturias Un hech experimental ctidian es que ls bjets pueden estar a distintas temperaturas. Para medir la temperatura usams ls termómetrs. Per
ENERGÍA (III) CALOR Y TEMPERATURA IES La Magdalena. Avilés. Asturias Un hech experimental ctidian es que ls bjets pueden estar a distintas temperaturas. Para medir la temperatura usams ls termómetrs. Per
CONTENIDO SÓLIDO RÍGIDO II. DINÁMICA. Ecuación de traslación de un sólido rígido. Momento angular de un sólido rígido
 CONTENIDO Ecuación de traslación de un sólid rígid Mment angular de un sólid rígid Ecuación de rtación de un sólid rígid Equilibri estátic. Cnservación del mment angular Energía cinética de rtación Trabaj
CONTENIDO Ecuación de traslación de un sólid rígid Mment angular de un sólid rígid Ecuación de rtación de un sólid rígid Equilibri estátic. Cnservación del mment angular Energía cinética de rtación Trabaj
En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos.
 Termoquímica En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos. Para romper enlaces se consume energía y al formar otros
Termoquímica En el transcurso de una reacción química se rompen enlaces de los reactivos y se forman nuevos enlaces que dan lugar a los productos. Para romper enlaces se consume energía y al formar otros
RESUMEN INFORMATIVO PROGRAMACIÓN DIDÁCTICA CURSO 2013/2014
 RESUMEN INFORMATIVO PROGRAMACIÓN DIDÁCTICA CURSO 2013/2014 FAMILIA PROFESIONAL: QUÍMICA MÓDULO: ACONDICIONAMIENTO Y ALMACENAMIENTO DE PRODUCTOS QUÍMICOS CURSO QUÍMICA INDUSTRIAL 2 OBJETIVOS: 1. Cntrlar
RESUMEN INFORMATIVO PROGRAMACIÓN DIDÁCTICA CURSO 2013/2014 FAMILIA PROFESIONAL: QUÍMICA MÓDULO: ACONDICIONAMIENTO Y ALMACENAMIENTO DE PRODUCTOS QUÍMICOS CURSO QUÍMICA INDUSTRIAL 2 OBJETIVOS: 1. Cntrlar
