ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
|
|
|
- Rosa Marín Sevilla
- hace 7 años
- Vistas:
Transcripción
1 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1
2 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones adversas. Ver la sección 4.8, en la que se incluye información sobre cómo notificarlas. 1. NOMBRE DEL MEDICAMENTO INCIVO 375 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 375 mg de telaprevir. Excipiente: 2,3 mg de sodio por comprimido recubierto con película. Para consultar la lista completa de excipientes, ver sección FORMA FARMACÉUTICA Comprimido recubierto con película. Comprimidos ovalados de color amarillo de aproximadamente 20 mm de longitud, marcados con T375 en una cara. 4. DATOS CLÍNICOS 4.1 Indicaciones terapéuticas INCIVO, en combinación con peginterferón alfa y ribavirina, está indicado para el tratamiento de pacientes adultos con hepatitis C crónica (genotipo 1) con enfermedad hepática compensada (incluyendo cirrosis): - que no han recibido ningún tratamiento previo (naïve); - que han recibido tratamiento previo con interferón alfa (pegilado o no pegilado) solo o en combinación con ribavirina, incluidos pacientes recaedores, respondedores parciales o con respuesta nula (ver secciones 4.4 y 5.1). 4.2 Posología y forma de administración El tratamiento con INCIVO debe ser iniciado y supervisado por un médico con experiencia en el tratamiento de la hepatitis C crónica. Posología Se debe administrar mg de INCIVO (tres comprimidos de 375 mg recubiertos con película) por vía oral dos veces al día (b.i.d.) con alimentos. Alternativamente, se puede administrar la dosis de 750 mg (dos comprimidos de 375 mg) por vía oral cada 8 horas (c8h) con alimentos. La dosis diaria total es de 6 comprimidos (2.250 mg). La toma de INCIVO sin alimentos o sin respetar el intervalo entre dosis puede hacer que disminuyan las concentraciones plasmáticas de telaprevir, con la consiguiente reducción de su efecto terapéutico. INCIVO se debe administrar en combinación con peginterferón alfa-2a o -2b y ribavirina. Por favor, consulte las secciones 4.4 y 5.1 relativas a la selección de peginterferón alfa-2a o -2b. Se debe consultar la Ficha Técnica de peginterferón alfa y ribavirina donde se pueden encontrar instrucciones específicas sobre la posología y forma de administración de estos medicamentos. 2
3 Duración del tratamiento - Adultos previamente no tratados y pacientes recaedores tras tratamiento previo El tratamiento con INCIVO se debe iniciar en combinación con peginterferón alfa y ribavirina y administrarse durante 12 semanas (ver figura 1). - Los pacientes con ácido ribonucléico del virus de la hepatitis C (ARN-VHC) indetectable (diana no detectada) en las semanas 4 y 12 deben recibir otras 12 semanas adicionales de tratamiento sólo con peginterferón alfa y ribavirina hasta una duración total del tratamiento de 24 semanas. - Los pacientes con ARN-VHC detectable en las semanas 4 ó 12 deben recibir otras 36 semanas adicionales de tratamiento sólo con peginterferón alfa y ribavirina hasta una duración total del tratamiento de 48 semanas. - En todos los pacientes con cirrosis, con independencia de que el ARN-VHC sea o no indetectable (diana no detectada) en las semanas 4 ó 12, se recomiendan 36 semanas adicionales de tratamiento sólo con peginterferón alfa y ribavirina hasta una duración total del tratamiento de 48 semanas (ver sección 5.1). Figura 1: Duración del tratamiento en pacientes previamente no tratados y en pacientes recaedores tras tratamiento previo Se deben medir los niveles de ARN-VHC en las semanas 4 y 12 para determinar la duración del tratamiento. En estudios de fase 3, se realizó un ensayo sensible de reacción en cadena de la polimerasa (PCR) en tiempo real utilizando un límite de cuantificación de 25 UI/ml y un límite de detección de UI/ml para determinar si los niveles de ARN-VHC eran indetectables (diana no detectada) (ver sección 5.1). Los niveles detectables de ARN-VHC por debajo del límite inferior de cuantificación del ensayo no se deben utilizar como un substituto de indetectable (diana no detectada), a la hora de tomar decisiones sobre la duración del tratamiento, dado que esto puede conducir a una duración insuficiente del tratamiento y a altas tasas de recaídas. Ver en la tabla 1 las recomendaciones para la interrupción del tratamiento con INCIVO, Peginterferón alfa y Ribavirina. Duración del tratamiento - Adultos previamente tratados con respuesta parcial o con respuesta nula al tratamiento previo El tratamiento con INCIVO se debe iniciar en combinación con peginterferón alfa y ribavirina y administrarse durante 12 semanas, seguido de un tratamiento sólo con peginterferón alfa y ribavirina (sin INCIVO) hasta una duración total del tratamiento de 48 semanas (ver figura 2). Figura 2: Duración del tratamiento en pacientes previamente tratados con respuesta parcial o con respuesta nula al tratamiento previo 3
4 Se deben medir los niveles de ARN-VHC en las semanas 4 y 12. Ver en la tabla 1 las recomendaciones para la interrupción del tratamiento con INCIVO, Peginterferón alfa y Ribavirina. Todos los pacientes Es muy poco probable que los pacientes con respuesta viral insuficiente consigan una respuesta viral sostenida (RVS), por lo que se recomienda interrumpir todo el tratamiento (INCIVO, Peginterferón alfa y Ribavirina) si el ARN-VHC es > UI/ml en la semana 4 o en la semana 12 (ver tabla 1). Tabla 1: Recomendaciones para la interrupción del tratamiento con INCIVO, Peginterferón alfa y Ribavirina Medicamentos ARN-VHC > UI/ml en la semana 4 de tratamiento a ARN-VHC > UI/ml en la semana 12 de tratamiento a INCIVO Interrupción definitiva Tratamiento con INCIVO completado Peginterferón alfa y Interrupción definitiva Ribavirina a tratamiento con INCIVO, peginterferón alfa y ribavirina. Estas recomendaciones podrían no funcionar de manera similar, cuando se ha utilizado una estrategia de inicio diferido con telaprevir, esto es, una fase de tratamiento inicial con perginterferón alfa y ribavirina antes de iniciar el tratamiento con INCIVO (ver sección 5.1). En estudios de fase 3, ninguno de los pacientes con ARN-VHC > UI/ml en la semana 4 o en la semana 12 alcanzaron una RVS con el tratamiento continuado de peginterferón alfa y ribavirina. En los estudios de fase 3 en pacientes que no han recibido ningún tratamiento previo, 4/16 (25%) de los pacientes con niveles de ARN-VHC entre 100 UI/ml y UI/ml a la semana 4 alcanzaron una RVS. Entre los pacientes con ARN-VHC entre 100 UI/ml y UI/ml a la semana 12, 2/8 (25%) alcanzaron una RVS. En pacientes con respuesta nula a un tratamiento previo, se debe considerar la posibilidad de realizar una medición adicional de ARN-VHC entre las semanas 4 y 12. Si la concentración de ARN-VHC es > UI/ml, se debe interrumpir la administración de INCIVO, peginterferón alfa y ribavirina. En los pacientes que reciban un total de 48 semanas de tratamiento, se debe interrumpir la administración de peginterferón alfa y ribavirina si el ARN-VHC es detectable en la semana 24 o la semana 36. INCIVO se debe tomar en combinación con peginterferón alfa y ribavirina para evitar el fracaso del tratamiento. Para evitar el fracaso del tratamiento, no se debe reducir ni interrumpir la dosis de INCIVO. Si el tratamiento con INCIVO se tiene que interrumpir por reacciones adversas a la medicación o por una respuesta viral insuficiente, no se debe reiniciar más adelante. Consulte en las respectivas Fichas Técnicas de peginterferón alfa y ribavirina las recomendaciones relativas a la modificación de la dosis, la interrupción temporal o definitiva del tratamiento o su reanudación con esos medicamentos (ver sección 4.4). Cuando se administra dos veces al día (b.i.d.), en caso de que se pierda una dosis de INCIVO sin que hayan transcurrido 6 horas desde el momento en que tocaba tomarla, se indicará a los pacientes que tomen la dosis prescrita de INCIVO lo antes posible con alimentos. En el caso de que hayan transcurrido 6 horas o más, el paciente no debe tomar la dosis omitida, sino la dosis siguiente a la hora habitual. Cuando se administra cada 8 horas (c8h), en caso de que se pierda una dosis de INCIVO sin que hayan transcurrido 4 horas desde el momento en que tocaba tomarla, se indicará a los pacientes que tomen la dosis prescrita de INCIVO lo antes posible con alimentos. En el caso de que hayan transcurrido 4 horas o más, el paciente no debe tomar la dosis omitida, sino la dosis siguiente a la hora habitual. 4
5 Poblaciones especiales Pacientes con insuficiencia renal No existen datos clínicos sobre el uso de INCIVO en pacientes infectados por el VHC con insuficiencia renal moderada o grave (aclaramiento de creatinina 50 ml/min) (ver sección 4.4). En pacientes sin infección por VHC e insuficiencia renal grave, no se observó ningún cambio clínicamente relevante en la exposición a telaprevir (ver sección 5.2). Por consiguiente, no se recomienda ajustar la dosis de INCIVO en pacientes con VHC e insuficiencia renal. No hay datos disponibles sobre el uso de INCIVO en pacientes en hemodiálisis. Ver también la Ficha Técnica de ribavirina en lo que respecta a los pacientes con aclaramiento de creatinina < 50 ml/min. Pacientes con insuficiencia hepática INCIVO no se recomienda en pacientes con insuficiencia hepática moderada o grave (Child-Pugh B o C, puntuación 7) ni con enfermedad hepática descompensada (ascitis, hemorragia por hipertensión portal, encefalopatía, y/o ictericia de causa distinta a la del Síndrome de Gilbert, ver sección 4.4). No se requiere modificar la dosis de INCIVO en pacientes con hepatitis C e insuficiencia hepática leve (Child-Pugh A, puntuación de 5-6). Consulte también las Fichas Técnicas de peginterferón alfa y ribavirina, ambos contraindicados cuando la puntuación de Child-Pugh es 6. Coinfección por el VHC y el virus de la inmunodeficiencia humana de tipo 1 (VIH-1) Los pacientes coinfectados con el VHC/VIH-1 se deben tratar del mismo modo que los pacientes infectados únicamente con el VHC. Se deben tener en cuenta cuidadosamente las interacciones entre medicamentos, ver secciones 4.4 y 4.5. Los pacientes en tratamiento con un régimen basado en efavirenz deben recibir mg de INCIVO cada 8 horas. Para los resultados obtenidos en los pacientes coinfectados VIH, consulte sección 5.1. Pacientes con trasplante hepático sin cirrosis El tratamiento con INCIVO se debe iniciar en combinación con peginterferón alfa y ribavirina y ser administrado durante 12 semanas seguidas de 36 semanas adicionales sólo con peginterferón alfa y ribavirina para una duración total de tratamiento de 48 semanas. No se requiere ajustar la dosis de INCIVO en pacientes con trasplante hepático estable (ver secciones 4.8 y 5.1). Se recomienda utilizar una dosis menor de ribavirina (600 mg/día) al inicio del tratamiento con INCIVO (ver sección 5.1). En el inicio y en la interrupción del tratamiento con INCIVO, las dosis administradas de forma conjunta de tacrólimus o ciclosporina A necesitan ser ajustadas cuidadamente (ver secciones 4.4 y 4.5, Inmunosupresores). Pacientes de edad avanzada Los datos clínicos sobre el uso de INCIVO en pacientes 65 años infectados por el VHC son escasos. Población pediátrica No se ha establecido todavía la seguridad ni la eficacia de INCIVO en niños < 18 años. No se dispone de datos. Forma de administración Se debe indicar a los pacientes que traguen los comprimidos enteros (es decir, sin masticarlos, partirlos o disolverlos). 4.3 Contraindicaciones Hipersensibilidad al principio activo o a alguno de los excipientes incluidos en la sección
6 Está contraindicada la administración concomitante con principios activos que son altamente dependientes del CYP3A para su eliminación y que, en concentraciones plasmáticas altas, se asocian a acontecimientos graves y/o potencialmente mortales. Estos principios activos son alfuzosina, amiodarona, bepridilo, quinidina, astemizol, terfenadina, cisaprida, pimozida, derivados ergotamínicos (dihidroergotamina, ergonovina, ergotamina, metilergonovina), lovastatina, simvastatina, atorvastatina, sildenafilo o tadalafilo (sólo cuando se utiliza en el tratamiento de la hipertensión arterial pulmonar), quetiapina y midazolam o triazolam por vía oral (ver sección 4.5). Está contraindicada la administración concomitante con cualquier antiarrítmico de Clase Ia o III, salvo lidocaína intravenosa (ver sección 4.5). Está contraindicada la administración concomitante de INCIVO con principios activos que sean inductores potentes del CYP3A, como rifampicina, Hipérico (Hypericum perforatum), carbamazepina, fenitoína y fenobarbital y que, por tanto, puedan reducir la exposición y la eficacia de INCIVO. Consulte la lista de contraindicaciones en la Ficha Técnica de peginterferón alfa y ribavirina, puesto que INCIVO se debe usar en combinación con peginterferón alfa y ribavirina. 4.4 Advertencias y precauciones especiales de empleo Exantema grave Con el tratamiento combinado con INCIVO se han notificado reacciones cutáneas graves, que potencialmente pueden ser fatales o poner en riesgo la vida del paciente. Durante la experiencia postcomercialización se han notificado casos de necrólisis epidérmica tóxica (NET) con desenlace mortal (ver sección 4.8). Se han notificado casos mortales en pacientes que presentaron una reacción cutánea progresiva y síntomas sistémicos y que continuaron recibiendo el tratamiento combinado con INCIVO después de haber identificado la reacción cutánea grave. En estudios de fase 2 y 3 controlados con placebo, se observó la aparición de exantema grave (principalmente eczematoso, pruriginoso y que afectaba a más del 50% de la superficie corporal) en el 4,8% de los pacientes que recibieron tratamiento combinado con INCIVO, en comparación con el 0,4% de los que recibieron peginterferón alfa y ribavirina. Los datos disponibles sugieren que peginterferón alfa y quizás también ribavirina, pueden contribuir a la frecuencia y gravedad de la reacción cutánea asociada al tratamiento combinado con INCIVO. El 5,8% de los pacientes interrumpieron únicamente INCIVO debido a exantema y el 2,6% de los pacientes interrumpieron todo el tratamiento combinado incluido INCIVO, en comparación con ninguno de los que recibieron solamente peginterferón alfa y ribavirina. En estudios de fase 2 y 3 controlados con placebo, el 0,4% de los pacientes presentaron una sospecha de Síndrome de Hipersensibilidad Sistémico con Eosinofilia (Síndrome DRESS). En la experiencia clínica con INCIVO, menos del 0,1% de los pacientes presentaron Síndrome de Stevens-Johnson (SSJ). Todas estas reacciones se resolvieron al interrumpir el tratamiento. El síndrome DRESS se presenta como un exantema cutáneo asociado a eosinofilia y uno o más de los signos siguientes: fiebre, linfadenopatía, edema facial y afección de órganos internos (hepática, renal, pulmonar). Puede aparecer en cualquier momento una vez iniciado el tratamiento, aunque en la mayoría de los casos aparece entre seis y diez semanas después del inicio del tratamiento con INCIVO. Los médicos que prescriban INCIVO se deben asegurar que los pacientes estén debidamente informados del riesgo de exantema grave así como sobre la necesidad de consultar con su médico de inmediato si presentan un nuevo exantema o un empeoramiento del exantema ya existente. Se debe vigilar la progresión de cualquier exantema hasta su resolución. El exantema puede tardar varias semanas en desaparecer. Se deben de usar con precaución otros medicamentos asociados con reacciones cutáneas graves durante la administración de INCIVO en tratamiento combinado para evitar posibles confusiones en cuanto a qué medicamento podría estar contribuyendo a una reacción 6
7 cutánea grave. En el caso que aparezca una reacción cutánea grave, se debe valorar la interrupción de aquellos medicamentos en los que sea conocida su asociación con reacciones cutáneas graves. Para más información sobre el exantema leve o moderado, vea sección 4.8. En la tabla siguiente se resumen las recomendaciones para el seguimiento de las reacciones cutáneas y la interrupción del tratamiento con INCIVO, ribavirina y peginterferón alfa: Extensión y signos de las reacciones cutáneas Exantema leve: erupción cutánea localizada y/o erupción cutánea con una distribución limitada (incluso en varios sitios aislados del cuerpo) Exantema moderado: Exantema difuso con afectación de 50% de la superficie corporal Exantema grave: Exantema que afecta a más del 50% de la superficie corporal o que se asocia a vesículas, ampollas, ulceraciones distintas a las del síndrome de Steven Johnson (SSJ) Reacciones cutáneas graves que incluyen exantema con síntomas sistémicos, exantema grave progresivo, sospecha o diagnóstico de erupción ampollosa generalizada, síndrome DRESS, SSJ/NET, pustulosis exantemática generalizada aguda, eritema multiforme Recomendaciones para el seguimiento de las reacciones cutáneas y la interrupción de INCIVO, Ribavirina y Peginterferón alfa si aparece un exantema grave Vigilar la progresión o los síntomas sistémicos hasta la resolución del exantema. Vigilar la progresión o los síntomas sistémicos hasta la resolución del exantema. Valorar la consulta con un dermatólogo. Si el exantema moderado progresa, se debe considerar la interrupción permanente de INCIVO. Si el exantema no mejora en los 7 días siguientes a la interrupción de INCIVO, se debe interrumpir la ribavirina. Puede que sea necesario interrumpir ribavirina antes de lo previsto si el exantema empeora a pesar de interrumpir telaprevir. Se puede mantener el peginterferón alfa salvo que su interrupción esté médicamente justificada. En presencia de exantema moderado que progresa a grave ( 50% de la superficie corporal), se debe interrumpir definitivamente el tratamiento con INCIVO (ver más abajo). Interrupción definitiva e inmediata de la administración de INCIVO. Se recomienda consultar con un dermatólogo. Vigilar la progresión o los síntomas sistémicos hasta la resolución del exantema. Se puede seguir administrando peginterferón alfa y ribavirina. Si no se observa una mejoría en los 7 días siguientes a la interrupción de INCIVO, se debe considerar la interrupción o suspensión secuencial o simultánea de ribavirina y/o peginterferón alfa. Si está médicamente justificado, puede que sea necesaria la interrupción o suspensión de peginterferón alfa y ribavirina antes de lo previsto. Interrupción definitiva e inmediata de INCIVO, peginterferón alfa y ribavirina. Se debe consultar con un dermatólogo. 7
8 Si interrumpe el tratamiento debido a una reacción cutánea, no debe reanudar el tratamiento con INCIVO. En la Ficha Técnica de peginterferón alfa y ribavirina se indican las reacciones cutáneas graves asociadas a estos medicamentos. Anemia En ensayos clínicos de fase 2 y 3 controlados con placebo, la incidencia global y la gravedad de la anemia fueron mayores con el tratamiento combinado con INCIVO que solo con peginterferón alfa y ribavirina. Se observaron valores de hemoglobina < 10 g/dl en el 34% de los pacientes que recibieron tratamiento combinado con INCIVO y en el 14% de los que recibieron peginterferón alfa y ribavirina. Se observaron valores de hemoglobina < 8,5 g/dl en el 8% de los pacientes que recibieron tratamiento combinado con INCIVO y en el 2% de los que recibieron peginterferón alfa y ribavirina. Los niveles de hemoglobina descienden en las primeras 4 semanas de tratamiento y alcanzan sus valores más bajos al final del período de administración de INCIVO. Los valores de hemoglobina aumentan gradualmente después de finalizar la administración de INCIVO. Se debe controlar periódicamente la hemoglobina antes y durante el tratamiento combinado con INCIVO (ver sección 4.4, Pruebas de laboratorio). La estrategia preferida para el manejo de la anemia que aparece durante el tratamiento es la reducción de la dosis de ribavirina. Consulte en la Ficha Técnica de ribavirina la información relativa a la reducción de la dosis y/o interrupción de ribavirina. Si se retira definitivamente la ribavirina en estos pacientes, se debe suspender también de forma permanente el tratamiento con INCIVO. Si la anemia obliga a interrumpir el tratamiento con INCIVO, esos pacientes podrán seguir recibiendo tratamiento con peginterferón alfa y ribavirina. El tratamiento con ribavirina se puede reanudar siguiendo las recomendaciones para la modificación de la dosis de este medicamento. No se puede reducir la dosis de INCIVO, ni reanudar su administración después de haberla suspendido. Embarazo y requisitos de anticoncepción Debido a que INCIVO se tiene que utilizar en combinación con peginterferón alfa y ribavirina, las contraindicaciones y advertencias aplicables a estos dos medicamentos son aplicables al tratamiento combinado. Se han observado efectos teratogénicos y/o embriocidas relevantes en todas las especies animales expuestas a ribavirina y, por tanto, se deben adoptar precauciones extremas para evitar el embarazo en las pacientes y en las parejas femeninas de los pacientes varones. Las mujeres en edad fértil y sus parejas masculinas, así como los pacientes varones y sus parejas femeninas, deben utilizar 2 métodos anticonceptivos eficaces durante el tratamiento con INCIVO y después de haberlo finalizado, tal y como se recomienda en la Ficha Técnica de ribavirina y se describe a continuación. Los anticonceptivos hormonales se pueden mantener, pero pueden no ser fiables durante la administración de INCIVO y hasta dos meses después de haber finalizado el tratamiento con INCIVO (ver sección 4.5). Durante ese tiempo, las mujeres en edad fértil deben utilizar dos métodos anticonceptivos no hormonales. Dos meses después de finalizar el tratamiento con INCIVO, los anticonceptivos hormonales volverán a ser adecuados como uno de los dos métodos anticonceptivos eficaces requeridos. Para más información, ver secciones 4.5 y 4.6. Sistema cardiovascular Los resultados de un estudio realizado en voluntarios sanos indican un efecto modesto de telaprevir administrado en dosis de mg cada 8 horas sobre el intervalo QTcF, con un incremento medio máximo ajustado para el placebo de 8,0 ms (IC 90%: 5,1-10,9) (ver sección 5.1). La exposición a esta dosis fue equivalente a la exposición en pacientes infectados por el VHC que recibían una dosis de 750 mg de INCIVO cada 8 horas en combinación con peginterferón alfa y ribavirina. La posible importancia clínica de estos resultados es incierta. 8
9 INCIVO debe usarse con precaución con los antiarrítmicos de Clase Ic propafenona y flecainida, incluyendo un apropiado seguimiento clínico y de ECG. Se recomienda precaución cuando se prescriba INCIVO en combinación con medicamentos que prolongan el intervalo QT y que son sustratos del CYP3A, como eritromicina, claritromicina, telitromicina, posaconazol, voriconazol, ketoconazol, tacrolimus o salmeterol (ver sección 4.5). Debe evitarse la administración conjunta de INCIVO con domperidona (ver sección 4.5). INCIVO puede aumentar las concentraciones de otros medicamentos administrados conjuntamente y aumentar con ello el riesgo de reacciones adversas cardíacas asociadas a ellos. Si se considera estrictamente necesaria la administración conjunta de estos medicamentos con INCIVO, se recomienda realizar un seguimiento clínico que incluya evaluaciones ECG. Ver también en la sección 4.3 los medicamentos que están contraindicados con INCIVO. El uso de INCIVO se debe evitar en los pacientes con prolongación congénita del intervalo QT, o antecedentes familiares de prolongación congénita del intervalo QT o muerte súbita. Si se considera estrictamente necesario el tratamiento con INCIVO en estos pacientes, se recomienda una estrecha vigilancia clínica que incluya evaluaciones ECG. INCIVO se debe utilizar con precaución en pacientes con: - antecedentes de prolongación congénita del intervalo QT; - bradicardia clínicamente importante (frecuencia cardíaca persistentemente < 50 latidos por minuto); - antecedentes de insuficiencia cardíaca con disminución de la fracción de eyección ventricular izquierda; - necesidad de medicamentos que se sabe que prolongan el intervalo QT, pero cuyo metabolismo no depende principalmente del CYP3A4 (como metadona, ver sección 4.5). Se recomienda un seguimiento médico estrecho de estos pacientes, que incluya evaluaciones ECG. Si se considera necesario, se deben vigilar y corregir las posibles alteraciones electrolíticas (como hipopotasemia, hipomagnesemia e hipocalcemia) antes y durante el tratamiento con INCIVO. Uso en pacientes con enfermedad hepática avanzada La hipoalbuminemia y la trombopenia se han identificado como factores predictores del desarrollo de complicaciones graves de enfermedad hepática, así como durante los tratamientos basados en interferón (por ejemplo: descompensación hepática, infecciones bacterianas graves). Además, en los pacientes con estas características, cuando se utiliza INCIVO junto con peginterferón y ribavirina se ha observado altas tasas de anemia. INCIVO en combinación con peginterferón y ribavirina no está recomendado en pacientes con plaquetas < /mm 3 y/o albúmina < 3,3 g/dl. Cuando se administre INCIVO en pacientes con enfermedad hepática avanzada, se recomienda hacer un seguimiento estrecho y un manejo precoz de los efectos adversos. Pruebas de laboratorio Se deben medir los niveles de ARN-VHC en las semanas 4 y 12 y cuando esté clínicamente indicado (ver también las recomendaciones para la interrupción de INCIVO, sección 4.2). Antes de iniciar el tratamiento combinado con INCIVO, se realizarán en todos los pacientes las siguientes pruebas de laboratorio (recuento sanguíneo completo con fórmula leucocitaria, electrólitos, creatinina sérica, pruebas funcionales hepáticas, TSH, ácido úrico). A continuación se indican los valores basales recomendados para iniciar el tratamiento combinado con INCIVO: - Hemoglobina: 12 g/dl (mujeres); 13 g/dl (varones) - Recuento de plaquetas /mm 3 - Recuento absoluto de neutrófilos 1.500/mm 3 - Función tiroidea debidamente controlada (TSH) - Aclaramiento de creatinina calculado 50 ml/min 9
10 - Potasio 3,5 mmol/l - Albúmina > 3,3 g/dl Se recomienda realizar hemogramas (incluida la fórmula leucocitaria) en las semanas 2, 4, 8 y 12 y cuando esté clínicamente justificado. Se recomienda realizar evaluaciones bioquímicas (electrólitos, creatinina sérica, ácido úrico, enzimas hepáticas, bilirrubina, TSH) con la misma frecuencia que las evaluaciones hematológicas o cuando esté clínicamente justificado (ver sección 4.8). Consultar la Ficha Técnica de peginterferón alfa y ribavirina, incluidos los requisitos sobre pruebas de embarazo (ver sección 4.6). Uso de INCIVO en combinación con peginterferón alfa-2b Todos los estudios de fase 3 se realizaron con peginterferón alfa-2a en combinación con INCIVO y ribavirina. No hay datos del uso de INCIVO en combinación con peginterferón alfa-2b en pacientes previamente tratados y hay datos escasos en pacientes que no han recibido ningún tratamiento previo. Los pacientes naïve tratados con peginterferón alfa-2a/ribavirina (n= 80) o peginterferón alfa- 2b/ribavirina (n= 81) en combinación con INCIVO, en un estudio abierto, tuvieron tasas de RVS comparables. Sin embargo, los pacientes tratados con peginterferón alfa-2b experimentaron con más frecuencia un rebrote viral, y tuvieron menos posibilidades de cumplir los criterios establecidos para acortar la duración total del tratamiento (ver sección 5.1). Consideraciones generales INCIVO no se debe administrar en monoterapia y solo se debe prescribir en combinación con peginterferón alfa y ribavirina. Por consiguiente, antes de iniciar el tratamiento con INCIVO es conveniente consultar la Ficha Técnica de peginterferón alfa y ribavirina. No se dispone de datos clínicos de retratamiento de los pacientes que no han respondido a un tratamiento previo con un inhibidor de la proteasa NS3-4A del VHC (ver sección 5.1). Respuesta viral insuficiente En pacientes con una respuesta viral insuficiente, se debe interrumpir el tratamiento (ver secciones 4.2 y 4.4, Pruebas de laboratorio). Uso de INCIVO para el tratamiento de otros genotipos del VHC No existen datos clínicos suficientes para justificar el tratamiento de pacientes con genotipos del VHC distintos al 1. Por consiguiente, no se recomienda el uso de INCIVO en pacientes con infección por el VHC con otros genotipos distintos al 1. Insuficiencia renal No se ha establecido la seguridad y la eficacia en pacientes con insuficiencia renal moderada o grave (aclaramiento de creatinina < 50 ml/min) ni en pacientes en hemodiálisis. Ver sección 4.4, Pruebas de laboratorio. Consultar también la Ficha Técnica de ribavirina para pacientes con aclaramiento de creatinina (CrCL) < 50 ml/min (ver también sección 4.2 y 5.2). Insuficiencia hepática INCIVO no se ha estudiado en pacientes con insuficiencia hepática grave (Child-Pugh C, puntuación 10) o enfermedad hepática descompensada (ascitis, hemorragia por hipertensión portal, encefalopatía, y/o ictericia de causa distinta a la del síndrome de Gilbert), por lo que no se recomienda su administración a esas poblaciones. INCIVO no se ha estudiado en pacientes infectados por el VHC con insuficiencia hepática moderada (Child-Pugh B, puntuación de 7-9). En pacientes sin infección por VHC y con insuficiencia hepática moderada, se observó una exposición reducida a telaprevir. No se ha determinado la dosis adecuada de INCIVO en pacientes infectados por el virus de la hepatitis C con insuficiencia hepática moderada. Por consiguiente, no se recomienda INCIVO en esos pacientes (ver secciones 4.2 y 5.2). 10
11 Consultar la Ficha Técnica de peginterferón alfa y ribavirina, los dos medicamentos que deben administrarse junto con INCIVO. Pacientes receptores de trasplantes de órganos INCIVO en combinación con peginterferón alfa y ribavirina fue evaluado en 74 pacientes infectados por el VHC-1, post-trasplante hepático sin cirrosis recibiendo o tacrólimus o ciclosporina A. Al inicio del tratamiento con INCIVO, las dosis administradas de forma conjunta de tacrólimus o ciclosporina A necesitan ser notablemente reducidas, incluyendo una prolongación en el intervalo de dosificación de tacrólimus, con el fin de mantener las concentraciones terapéuticas del inmunosupresor en plasma. Tras completar INCIVO, las dosis de tacrólimus o ciclosporina A necesitan ser aumentadas, y el intervalo de dosificación para tacrólimus necesitará ser reducido. Algunos pacientes pueden necesitar dosis más altas de tacrólimus o ciclosporina A que al inicio del tratamiento. Estos cambios deben estar basados en la frecuencia de monitorización de las concentraciones en plasma de tacrólimus o ciclosporina A durante el tratamiento con INCIVO. Para mayor información sobre el uso de INCIVO en combinación con peginterferón alfa y ribavirina en pacientes infectados por el VHC-1 naïve y previamente tratados que fueron receptores de trasplante hepático y estuvieran en un régimen estable de inmunosupresores tacrólimus o ciclosporina A, ver secciones 4.2, 4.5, Inmunosupresores, 4.8, y 5.1. No se dispone de datos clínicos sobre el tratamiento con INCIVO en combinación con peginterferón alfa y ribavirina de pacientes antes, o mientras reciben un trasplante de hígado o de otros órganos. Coinfección por el VHC/VIH Son frecuentes las interacciones entre telaprevir y los agentes antirretrovirales para el VIH, y se deben seguir detenidamente las recomendaciones de la tabla 2, sección 4.5. Entre los regímenes para el VIH que se pueden utilizar (no limitados a los que aparecen abajo), se debe tener en cuenta lo siguiente: Atazanavir/ritonavir: esta combinación está asociada a una frecuencia elevada de hiperbilirrubinemia/ictericia. En el estudio HPC3008 (ver secciones 4.8 y 5.1) se observaron aumentos transitorios de la bilirrubina de grado 3 (2,5 a 5 X ULN) y grado 4 (> 5 X ULN) durante el tratamiento con INCIVO en el 39% y en el 22% de los 59 pacientes con atazanavir/ritonavir, respectivamente. Efavirenz: con esta combinación la dosis de telaprevir se debe aumentar a mg tres veces al día (c/8h). Coinfección por VHC/VHB (virus de la hepatitis B) No existen datos sobre el uso de INCIVO en pacientes con coinfección por VHC/VHB. Población pediátrica No se recomienda el uso de INCIVO en niños y adolescentes menores de 18 años, ya que no se ha establecido la seguridad y eficacia en esta población. Enfermedad tiroidea El aumento de la hormona estimulante del tiroides (TSH) puede ocurrir durante el tratamiento combinado con INCIVO, lo cual puede indicar un empeoramiento o recurrencia de un hipotiroidismo pre-existente o previo, o bien hipotiroidismo de nueva aparición (ver sección 4.8). Los niveles de TSH se deben medir antes y durante el tratamiento combinado con INCIVO y tratados como sea clínicamente apropiado, incluyendo posibles ajustes en el tratamiento sustitutivo en pacientes con hipotiroidismo pre-existente (ver sección 4.4, Pruebas de laboratorio). Interacciones con medicamentos Telaprevir es un potente inhibidor de la enzima metabolizadora CYP3A4. La combinación de telaprevir con medicamentos altamente metabolizados por esta enzima puede producir un aumento de 11
12 su exposición sistémica. Consulte la sección 4.3 para obtener una lista de los medicamentos que están contraindicados para su uso con INCIVO debido a efectos adversos potencialmente mortales o a la potencial pérdida del efecto terapéutico de INCIVO. Consulte la sección 4.5 para conocer las interacciones establecidas entre medicamentos y otras potencialmente significativas. Información importante sobre algunos de los componentes de INCIVO Este medicamento contiene 2,3 mg de sodio por comprimido, lo que deben tener en cuenta los pacientes con dietas pobres en sodio. 4.5 Interacción con otros medicamentos y otras formas de interacción Telaprevir se metaboliza parcialmente en el hígado por el CYP3A y es un sustrato de la glicoproteína-p (gp-p). Además, también otras enzimas están involucradas en el metabolismo (ver sección 5.2). La administración conjunta de INCIVO y medicamentos inductores del CYP3A y/o la glicoproteína-p puede reducir notablemente las concentraciones plasmáticas de telaprevir. La administración conjunta de INCIVO y medicamentos inhibidores de CYP3A y/o la glicoproteína-p puede aumentar las concentraciones plasmáticas de telaprevir. INCIVO es un inhibidor potente, tiempo dependiente del CYP3A4 y también inhibe notablemente la gp-p. La dependencia del tiempo sugiere que la inhibición del CYP3A4 puede verse intensificada durante las 2 primeras semanas de tratamiento. Después de finalizar el tratamiento, puede ser necesario que transcurra aproximadamente una semana para que la inhibición desaparezca completamente. La administración de INCIVO puede aumentar la exposición sistémica a medicamentos que son sustratos del CYP3A o de la glicoproteína-p lo que puede dar lugar a un aumento o prolongación de sus efectos y del riesgo de reacciones adversas. En base a los resultados de estudios clínicos de interacción entre medicamentos (por ejemplo, escitalopram, zolpidem, etinilestradiol), no se puede descartar la inducción de enzimas metabólicas por telaprevir. Telaprevir inhibe los polipéptidos transportadores de aniones orgánicos (OATPs) OATP1B1 y OATP2B1. La administración conjunta de INCIVO y medicamentos transportados por estos transportadores como fluvastatina, pravastatina, rosuvastatina, pitavastatina, bosentan y repaglinida, debe ser realizada con precaución (ver tabla 2). La simvastatina está contraindicada debido al notable aumento previsto de su exposición causado por múltiples mecanismos. En base a los estudios in vitro, telaprevir puede aumentar potencialmente las concentraciones plasmáticas de los medicamentos en los cuales la excreción dependa de los transportadores MATE-1 y MATE2-K (transportadores de múltiples fármacos y extrusión de toxinas) (ver tabla 2). Los estudios de interacciones se han realizado sólo en adultos. Contraindicaciones de uso concomitante (ver sección 4.3) INCIVO no se debe administrar conjuntamente con otros principios activos que sean altamente dependientes del CYP3A para su aclaramiento y que puedan producir acontecimientos graves y/o potencialmente mortales si alcanzan concentraciones plasmáticas elevadas como arritmia cardíaca (p. ej., amiodarona, astemizol, bepridilo, cisaprida, pimozida, quinidina, terfenadina), vasoespasmo o isquemia periférica (p. ej., dihidroergotamina, ergonovina, ergotamina, metilergonovina) o miopatía, incluida rabdomiólisis (p. ej., lovastatina, simvastatina, atorvastatina) o sedación más profunda o prolongada o depresión respiratoria (p. ej., quetiapina, triazolam o midazolam por vía oral) o hipotensión o arritmia cardíaca (p. ej., alfuzosina y sildenafilo para la hipertensión arterial pulmonar). No se debe administrar INCIVO conjuntamente con ningún antiarrítmico de Clase Ia o III, con la excepción de la lidocaína intravenosa. INCIVO se debe utilizar con precaución con los antiarrítmicos de Clase Ic propafenona y flecainida, incluyendo una apropiada monitorización clínica y de ECG (ver sección 4.4). 12
13 Rifampicina La rifampicina reduce el AUC plasmático de telaprevir aproximadamente en un 92%. Por consiguiente, no se debe administrar INCIVO conjuntamente con rifampicina. Hipérico (Hypericum perforatum) Las concentraciones plasmáticas de telaprevir se pueden reducir cuando se administra al mismo tiempo que Hipérico, una planta medicinal (Hypericum perforatum). Por tanto, no se pueden administrar medicamentos a base de plantas que contengan Hipérico en combinación con INCIVO. Carbamazepina, fenitoína y fenobarbital La administración conjunta con inductores puede conducir a una menor exposición de telaprevir con el riesgo de disminuir la eficacia. Los inductores potentes de CYP3A, como carbamazepina, fenitoína y fenobarbital, están contraindicados (ver sección 4.3). Inductores del CYP3A leves y moderados Los inductores leves y moderados del CYP3A se deben evitar, particularmente en pacientes que son previamente no respondedores (respondedores parciales o respondedores nulos a peginterferón alfa/ribavirina), a menos que existan recomendaciones específicas de dosis (ver tabla 2). Otras combinaciones La tabla 2 contiene recomendaciones posológicas basadas en las interacciones de otros medicamentos con INCIVO. Estas recomendaciones se basan o en estudios de interacciones farmacológicas (indicados con *) o en las interacciones esperadas debido a la magnitud prevista de la interacción y la posibilidad de reacciones adversas graves o pérdida de eficacia. La mayoría de los estudios de interacción entre medicamentos se han realizado con dosis de telaprevir de 750 mg cada 8 horas (c8h). Dado que la pauta de mg dos veces al día resulta en la misma dosis diaria con similar exposición a telaprevir, es previsible que las interacciones asociadas a medicamentos sean similares. La dirección de la flecha ( = aumento, = disminución, = sin cambios) que aparece junto a cada parámetro farmacocinético indica si el intervalo de confianza del 90% del cociente de medias geométricas está dentro ( ), por debajo ( ) o por encima ( ) del intervalo %. Tabla 2: INTERACCIONES Y RECOMENDACIONES POSOLÓGICAS CON OTROS MEDICAMENTOS Medicamentos por áreas Efecto en la concentración de Comentario clínico terapéuticas INCIVO o de la medicación concomitante y posible mecanismo ANALGÉSICOS alfentanilo fentanilo alfentanilo fentanilo Se recomienda supervisión cuidadosa de los efectos terapéuticos y adversos (incluyendo depresión respiratoria) cuando telaprevir sea administrado conjuntamente con alfentanilo o fentanilo, incluyendo las preparaciones de fentanilo orales, bucales, nasales y de liberación prolongada transdérmica o transmucosa, especialmente al inicio del tratamiento. Puede ser necesario el ajuste de la dosis de fentanilo o alfentanilo. Los efectos más marcados se esperan en las formulaciones de fentanilo oral, nasal y bucal/sublingual. 13
14 ANTIARRÍTMICOS lidocaína (intravenosa) digoxina* ANTIBACTERIANOS claritromicina eritromicina telitromicina troleandomicina ANTICOAGULANTES warfarina dabigatrán ANTIEPILÉPTICOS carbamazepina* fenitoína* lidocaína inhibición del CYP3A digoxina AUC 1,85 (1,70-2,00) C max 1,50 (1,36-1,65) efecto en el transporte mediado por gp-p en el intestino telaprevir antibacterianos inhibición del CYP3A o warfarina modulación de enzimas metabólicas dabigatrán telaprevir efecto en el transporte mediado por gp-p en el intestino telaprevir AUC 0,68 (0,58-0,79) C max 0,79 (0,70-0,90) C min 0,53 (0,44-0,65) carbamazepina AUC 1,10 (0,99-1,23) C max 1,09 (0,98-1,21) C min 1,10 (0,97-1,24) inducción del CYP3A por acción de carbamazepina, e inhibición del CYP3A por acción de telaprevir telaprevir AUC 0,53 (0,47-0,60) C max 0,68 (0,60-0,77) C min 0,32 (0,25-0,42) fenitoína AUC 1,31 (1,15-1,49) C max 1,27 (1,09-1,47) C min 1,36 (1,21-1,53) inducción del CYP3A por acción de fenitoína, e inhibición del CYP3A por acción de telaprevir Se recomienda precaución y supervisión clínica del paciente cuando se administre lidocaína intravenosa para el tratamiento de la arritmia ventricular aguda. Inicialmente se debe prescribir la dosis más baja de digoxina. Se deben supervisar las concentraciones plasmáticas de digoxina y ajustar en consecuencia la dosis de digoxina para obtener el efecto clínico deseado. Se recomienda precaución y supervisión clínica del paciente cuando se administre un antibacteriano concomitantemente con INCIVO. Se ha observado prolongación del intervalo QT y Torsade de Pointes con claritromicina y eritromicina. Se ha observado prolongación del intervalo QT con telitromicina (ver sección 4.4). Se recomienda supervisar el cociente internacional normalizado (INR) cuando la warfarina se administra conjuntamente con telaprevir. Se recomienda precaución y un seguimiento analítico y clínico. La administración conjunta con carbamazepina está contraindicada. La administración conjunta con fenitoína está contraindicada. 14
15 fenobarbital ANTIDEPRESIVOS escitalopram* trazodona ANTIDIABÉTICOS metformina ANTIEMÉTICOS domperidona ANTIMICÓTICOS ketoconazol* itraconazol posaconazol voriconazol telaprevir o fenobarbital inducción del CYP3A por acción de fenobarbital, e inhibición del CYP3A por acción de telaprevir telaprevir escitalopram AUC 0,65 (0,60-0,70) C max 0,70 (0,65-0,76) C min 0,58 (0,52-0,64) mecanismo desconocido trazodona inhibición del CYP3A metformina inhibición de MATE-1 y MATE2-K domperidona inhibición del CYP3A ketoconazol (200 mg) AUC 2,25 (1,93-2,61) C max 1,75 (1,51-2,03) ketoconazol (400 mg) AUC 1,46 (1,35-1,58) C max 1,23 (1,14-1,33) telaprevir (con ketoconazol 400 mg) AUC 1,62 (1,45-1,81) C max 1,24 (1,10-1,41) itraconazol posaconazol o voriconazol Inhibición del CYP3A. Debido a las distintas enzimas que participan en el metabolismo del voriconazol, es difícil predecir la interacción con telaprevir. La administración conjunta con fenobarbital está contraindicada. Relevancia clínica desconocida. Es posible que haya que aumentar la dosis cuando se combina con telaprevir. La administración concomitante puede dar lugar a la aparición de acontecimientos adversos como náuseas, mareos, hipotensión y síncope. Se recomienda precaución cuando se administre trazodona conjuntamente con telaprevir, y debe considerarse una dosis menor de trazodona. Se recomienda realizar un seguimiento estrecho de la eficacia y seguridad de metformina cuando se inicie o interrumpa INCIVO en los pacientes que estén recibiendo metformina. Puede ser necesario un ajuste de la dosis de metformina. Se debe evitar la administración conjunta de domperidona con INCIVO (ver sección 4.4). Cuando sea necesaria su administración conjunta, no se recomienda la administración de dosis altas de itraconazol (> 200 mg/día) ni de ketoconazol (> 200 mg/día). Se recomienda precaución y un seguimiento clínico del paciente con itraconazol, posaconazol y voriconazol. Se ha descrito prolongación del intervalo QT y Torsade de Pointes con voriconazol y posaconazol. Se ha descrito prolongación del intervalo QT con ketoconazol (ver sección 4.4). No se debe administrar voriconazol a pacientes que estén recibiendo telaprevir, salvo que la relación beneficio-riesgo justifique su empleo. 15
16 ANTIGOTOSOS colchicina ANTIMICOBACTERIANOS rifabutina rifampicina* ANTIPSICÓTICOS quetiapina BENZODIAZEPINAS alprazolam* midazolam administrado por vía parenteral* midazolam oral* triazolam oral colchicina inhibición del CYP3A telaprevir rifabutina inducción del CYP3A por acción de rifabutina, inhibición del CYP3A por acción de telaprevir telaprevir AUC 0,08 (0,07-0,11) C max 0,14 (0,11-0,18) rifampicina inducción del CYP3A por acción de rifampicina, inhibición del CYP3A por acción de telaprevir Debido a que telaprevir inhibe el CYP3A, es esperable que las concentraciones de quetiapina aumenten. alprazolam AUC 1,35 (1,23-1,49) C max 0,97 (0,92-1,03) midazolam (intravenoso) AUC 3,40 (3,04-3,79) C max 1,02 (0,80-1,31) midazolam (por vía oral) AUC 8,96 (7,75-10,35) C max 2,86 (2,52-3,25) triazolam inhibición del CYP3A zolpidem (sedante no zolpidem benzodiazepínico)* AUC 0,53 (0,45-0,64) C max 0,58 (0,52-0,66) mecanismo desconocido ANTAGONISTAS DE LOS CANALES DE CALCIO amlodipino* amlodipino AUC 2,79 (2,58-3,01) C max 1,27 (1,21-1,33) inhibición del CYP3A Los pacientes con insuficiencia renal o hepática no deben de tomar colchicina con INCIVO, debido al riesgo de toxicidad de colchicina. En los pacientes con función renal y hepática normal, se recomienda la interrupción del tratamiento con colchicina, o bien seguir un curso limitado de tratamiento con colchicina a dosis reducidas. Telaprevir puede ser menos eficaz debido a concentraciones disminuidas. No se recomienda el uso concomitante de rifabutina y telaprevir. La administración conjunta de rifampicina con telaprevir está contraindicada. La administración concomitante de INCIVO y quetiapina está contraindicada dado que puede aumentar la toxicidad asociada a quetiapina. Las concentraciones aumentadas de quetiapina pueden llevar a un estado de coma. Relevancia clínica desconocida. La administración conjunta se debe hacer en un contexto que asegure la supervisión clínica y un manejo médico adecuado en caso de depresión respiratoria y/o sedación prolongada. Se debe considerar la reducción de la dosis de midazolam administrada por vía parenteral, sobre todo si se administra más de una única dosis de midazolam. La administración conjunta de midazolam o triazolam por vía oral y telaprevir está contraindicada. Relevancia clínica desconocida. Es posible que haya que aumentar la dosis de zolpidem para mantener la eficacia. Se debe usar con precaución y considerar una reducción de la dosis de amlodipino. Se recomienda supervisión clínica. 16
17 diltiazem felodipino nicardipino nifedipino nisoldipino verapamilo ANTAGONISTAS DEL CCR5 maraviroc* antagonistas de los canales de calcio inhibición del CYP3A y/o efecto en el transporte mediado por P-gp en el intestino maraviroc AUC 12 9,49 (7,94-11,34) C max 7,81 (5,92-10,32) C 12 10,17 (8,73-11,85) No se espera que las concentraciones de telaprevir se vean afectadas por la administración conjunta con maraviroc (en base a los antecedentes y a la vía de eliminación de telaprevir). Se recomienda precaución y supervisión clínica del paciente. 150 mg de maraviroc dos veces al día cuando se administra junto con telaprevir. CORTICOESTEROIDES sistémicos dexametasona telaprevir inducción del CYP3A El uso concomitante puede dar lugar a una pérdida del efecto terapéutico de telaprevir. Por lo tanto, se recomienda usar con precaución esta combinación o considerar otras alternativas. inhalado/nasal fluticasona budesonida fluticasona budesonida inhibición del CYP3A No se recomienda la administración concomitante de fluticasona o budesonida con telaprevir, a menos que el posible efecto beneficioso para el paciente sea mayor que el riesgo de efectos adversos de los corticoides sistémicos. ANTAGONISTAS DE LOS RECEPTORES DE LA ENDOTELINA bosentán bosentán telaprevir inducción de CYP3A por acción del bosentán, inhibición del CYP3A y polipéptidos transportadores de aniones orgánicos (OATPs) por acción de telaprevir Se recomienda precaución y supervisión clínica. ANTIRRETROVIRALES: INHIBIDORES DE LA PROTEASA (IPs) atazanavir/ritonavir* telaprevir AUC 0,80 (0,76-0,85) C max 0,79 (0,74-0,84) C min 0,85 (0,75-0,98) atazanavir AUC 1,17 (0,97-1,43) La hiperbilirrubinemia aparece con frecuencia con esta combinación. Se recomienda un seguimiento clínico y analítico por si aparece hiperbilirrubinemia (ver secciones 4.4 y 4.8). C max 0,85 (0,73-0,98) C min 1,85 (1,40-2,44) inhibición del CYP3A por acción de telaprevir darunavir/ritonavir* telaprevir AUC 0,65 (0,61-0,69) C max 0,64 (0,61-0,67) C min 0,68 (0,63-0,74) darunavir AUC 0,60 (0,57-0,63) C max 0,60 (0,56-0,64) C min 0,58 (0,52-0,63) mecanismo desconocido No se recomienda la administración concomitante de darunavir/ritonavir con telaprevir (ver sección 4.4) 17
18 fosamprenavir/ritonavir* lopinavir/ritonavir* telaprevir AUC 0,68 (0,63-0,72) C max 0,67 (0,63-0,71) C min 0,70 (0,64-0,77) amprenavir AUC 0,53 (0,49-0,58) C max 0,65 (0,59-0,70) C min 0,44 (0,40-0,50) mecanismo desconocido telaprevir AUC 0,46 (0,41-0,52) C max 0,47 (0,41-0,52) C min 0,48 (0,40-0,56) lopinavir AUC 1,06 (0,96-1,17) C max 0,96 (0,87-1,05) C min 1,14 (0,96-1,36) mecanismo desconocido No se recomienda la administración simultánea de fosamprenavir/ritonavir con telaprevir (ver sección 4.4). No se recomienda la administración simultánea de lopinavir/ritonavir con telaprevir (ver sección 4.4). ANTIRRETROVIRALES: INHIBIDORES DE LA TRANSCRIPTASA INVERSA efavirenz* telaprevir mg cada 8 horas (relativo a 750 mg cada 8 horas) AUC 0,82 (0,73-0,92) Si se administra conjuntamente, se debe utilizar telaprevir mg cada 8 horas (ver sección 4.4). C max 0,86 (0,76-0,97) C min 0,75 (0,66-0,86) efavirenz (+ TVR mg cada 8 horas) AUC 0,82 (0,74-0,90) C max 0,76 (0,68-0,85) C min 0,90 (0,81-1,01) inducción del CYP3A por acción del efavirenz. tenofovir disoproxil fumarato* telaprevir AUC 1,00 (0,94-1,07) C max 1,01 (0,96-1,05) Se recomienda aumentar la supervisión clínica y analítica (ver sección 4.4). C min 1,03 (0,93-1,14) tenofovir AUC 1,30 (1,22-1,39) C max 1,30 (1,16-1,45) C min 1,41 (1,29-1,54) efecto en el transporte mediado por P-gp en el intestino abacavir zidovudina No estudiado. No se puede descartar un efecto de telaprevir sobre las UDPglucuroniltrasferasas y esto puede afectar las concentraciones plasmáticas de abacavir o zidovudina. etravirina* telaprevir 750 mg cada 8h AUC 0,84 (0,71-0,98) C max 0,90 (0,79-1,02) C min 0,75 (0,61-0,92) etravirina (+ TVR 750 mg cada 8h) AUC 0,94 (0,85-1,04) C max 0,93 (0,84-1,03) C min 0,97 (0,86-1,10) Si se administran conjuntamente, no se requiere ajustes de dosis. 18
FOLLETO DE INFORMACIÓN AL PACIENTE INCIVO 375 mg comprimidos recubiertos
 FOLLETO DE INFORMACIÓN AL PACIENTE INCIVO 375 mg comprimidos recubiertos Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. -Conserve este prospecto, ya que puede tener que volver
FOLLETO DE INFORMACIÓN AL PACIENTE INCIVO 375 mg comprimidos recubiertos Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. -Conserve este prospecto, ya que puede tener que volver
INCIVEK TM (telaprevir) en comprimidos recubiertos con película para uso oral Aprobación inicial en los EE. UU.: 2011
 PUNTOS DESTACADOS DE LA FICHA TÉCNICA Estos puntos destacados no incluyen toda la información necesaria para utilizar INCIVEK de manera segura y eficaz. Consulte la ficha técnica completa de INCIVEK. INCIVEK
PUNTOS DESTACADOS DE LA FICHA TÉCNICA Estos puntos destacados no incluyen toda la información necesaria para utilizar INCIVEK de manera segura y eficaz. Consulte la ficha técnica completa de INCIVEK. INCIVEK
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
INFORME A LA COMISIÓN DE INFECCIONES Y POLÍTICA ANTIBIÓTICA (12 de Enero 2012)
 INFORME A LA COMISIÓN DE INFECCIONES Y POLÍTICA ANTIBIÓTICA (12 de Enero 2012) TELAPREVIR (Incivo ) DCI: TELAPREVIR Grupo terapéutico: J05AE: Inhibidores de la proteasa Presentación Laboratorio PVL (+4%IVA)
INFORME A LA COMISIÓN DE INFECCIONES Y POLÍTICA ANTIBIÓTICA (12 de Enero 2012) TELAPREVIR (Incivo ) DCI: TELAPREVIR Grupo terapéutico: J05AE: Inhibidores de la proteasa Presentación Laboratorio PVL (+4%IVA)
FOLLETO INFORMACIÓN AL PACIENTE. OLYSIO Simeprevir Cápsulas 150 mg
 FOLLETO INFORMACIÓN AL PACIENTE OLYSIO Simeprevir Cápsulas 150 mg OLYSIO se toma junto con peginterferón alfa y ribavirina. Por lo tanto es importante que lea los prospectos del envase que se proporcionan
FOLLETO INFORMACIÓN AL PACIENTE OLYSIO Simeprevir Cápsulas 150 mg OLYSIO se toma junto con peginterferón alfa y ribavirina. Por lo tanto es importante que lea los prospectos del envase que se proporcionan
FOLLETO DE INFORMACIÓN AL PACIENTE. OLYSIO SIMEPREVIR Cápsulas
 FOLLETO DE INFORMACIÓN AL PACIENTE OLYSIO SIMEPREVIR Cápsulas Industria Italiana Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
FOLLETO DE INFORMACIÓN AL PACIENTE OLYSIO SIMEPREVIR Cápsulas Industria Italiana Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
Anexo III. Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos
 Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
Anexo III Modificaciones a las secciones relevantes de la ficha técnica o resumen de las características del producto y los prospectos Nota: Estas modificaciones a las secciones relevantes de la Ficha
LLD Abreviado de Zoloft. Todo medicamento debe conservarse fuera del alcance de los niños.
 LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
LLD Abreviado de Zoloft Versión: 19.0 Fecha: 20 de febrero de 2015 Aprobación ARCSA: 23 febrero de 2016 Todo medicamento debe conservarse fuera del alcance de los niños. 1. Presentación: Sertralina que
FOLLETO DE INFORMACIÓN AL PACIENTE. OLYSIO SIMEPREVIR Cápsulas
 FOLLETO DE INFORMACIÓN AL PACIENTE OLYSIO SIMEPREVIR Cápsulas Industria Italiana Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
FOLLETO DE INFORMACIÓN AL PACIENTE OLYSIO SIMEPREVIR Cápsulas Industria Italiana Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante para
INFORMACIÓN DEL PRODUCTO
 INFORMACIÓN DEL PRODUCTO PUNTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para utilizar VICTRELIS con seguridad y eficacia. Consulte
INFORMACIÓN DEL PRODUCTO PUNTOS DESTACADOS DE LA INFORMACIÓN DE PRESCRIPCIÓN Estos puntos destacados no incluyen toda la información necesaria para utilizar VICTRELIS con seguridad y eficacia. Consulte
Es frecuente la infección crónica por el virus de hepatitis B (VHB)?
 HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
HEPATITIS B Qué es la hepatitis B y tipos? La hepatitis B es una enfermedad producida por la infección de un virus de tipo ADN, que infecta e inflama el hígado. Puede producir un cuadro agudo (hepatitis
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina
 FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
FICHA DE INFORMACIÓN AL PACIENTE: Simvastatina 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Hipolipemiante, inhibidor de la enzima hidroximetil-glutaril-coa-reductasa.. 1.2 Cómo actúa este fármaco: Inhibe
Interacciones de los nuevos inhibidores de la proteasa para el tratamiento de la hepatitis C: telaprevir y boceprevir
 Farm Hosp. 2012;36(6):469-482 REVISIÓN Interacciones de los nuevos inhibidores de la proteasa para el tratamiento de la hepatitis C: telaprevir y boceprevir E. Izquierdo-García* e I. Escobar-Rodríguez
Farm Hosp. 2012;36(6):469-482 REVISIÓN Interacciones de los nuevos inhibidores de la proteasa para el tratamiento de la hepatitis C: telaprevir y boceprevir E. Izquierdo-García* e I. Escobar-Rodríguez
ARIPIPRAZOL En adolescentes contrastorno Bipolar I
 ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
ARIPIPRAZOL En adolescentes contrastorno Bipolar I Información para profesionales sanitarios Preguntas frecuentes Disponible en la web de la AEMPS www.aemps.gob.es Información sobre prevención de riesgos
FOLLETO DE INFORMACIÓN AL PACIENTE PREZISTA Comprimidos recubiertos 400 mg DARUNAVIR
 FOLLETO DE INFORMACIÓN AL PACIENTE PREZISTA Comprimidos recubiertos 400 mg DARUNAVIR Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
FOLLETO DE INFORMACIÓN AL PACIENTE PREZISTA Comprimidos recubiertos 400 mg DARUNAVIR Lea todo el prospecto detenidamente antes de empezar a tomar este medicamento, porque contiene información importante
FICHA TÉCNICA. Cada comprimido recubierto con película contiene 100 mg de ritonavir.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ritonavir Mylan 100 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 100 mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Ritonavir Mylan 100 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 100 mg
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Medicamento con autorización anulada
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO VIRACEPT 50 mg/g polvo oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA El frasco contiene 144 g de polvo
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO VIRACEPT 50 mg/g polvo oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA El frasco contiene 144 g de polvo
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
LABORATORIOS NORMON, S.A. AMBROXOL NORMON 15 mg/5 ml Jarabe EFG
 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
1. NOMBRE DEL MEDICAMENTO 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada 5 ml de jarabe contienen: AMBROXOL (D.C.I.) hidrocloruro 15 mg Excipientes, ver apartado 6.1. 3. FORMA FARMACEUTICA Jarabe. 4. DATOS
Dr. Nahum Méndez-Sánchez Unidad de Hígado Fundación Clínica Médica sur México, D.F.
 Dr. Nahum Méndez-Sánchez Unidad de Hígado Fundación Clínica Médica sur México, D.F. Interacciones farmacológicas de los inhibidores de proteasa CLASIFICACIÓN DE LAS REACCIONES DE BIOTRANSFORMACIÓN DE LOS
Dr. Nahum Méndez-Sánchez Unidad de Hígado Fundación Clínica Médica sur México, D.F. Interacciones farmacológicas de los inhibidores de proteasa CLASIFICACIÓN DE LAS REACCIONES DE BIOTRANSFORMACIÓN DE LOS
Cápsula opaca azul y azul polvo en la que se imprime con tintas blanca y azul en una mitad BMS 150 mg y en la otra 3624.
 1. NOMBRE DEL MEDICAMENTO REYATAZ 150 mg cápsulas duras REYATAZ 200 mg cápsulas duras REYATAZ 300 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA REYATAZ 150 mg cápsulas duras Cada cápsula
1. NOMBRE DEL MEDICAMENTO REYATAZ 150 mg cápsulas duras REYATAZ 200 mg cápsulas duras REYATAZ 300 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA REYATAZ 150 mg cápsulas duras Cada cápsula
ENOXPRIM. Solución inyectable. Solución inyectable estéril, libre de pirógenos, contenida en jeringas pre-llenadas listas para usarse.
 ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
ENOXPRIM Solución inyectable ENOXAPARINA FORMA FARMACÉUTICA Y FORMULACIÓN Cada jeringa contiene: Enoxaparina sódica 20 mg 40 mg Equivalente a 2,000 U.I. 4,000 U.I. Agua inyectable, c.b.p. 0.2 ml 0.4 ml
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg
 PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
PAROXETINA COMPRIMIDOS CON RECUBRIMIENTO ENTÉRICO 12,5mg-25mg Lea cuidadosamente este folleto antes de la administración de este medicamento, contiene información importante acerca de su tratamiento. Si
TOLERANCIA A LA TRIPLE TERAPIA EN POBLACIONES ESPECIALES
 TOLERANCIA A LA TRIPLE TERAPIA EN POBLACIONES ESPECIALES C a r m e n V i n a i x a, C a r l a S a t o r r e s, B e a t r i z R o d r í g u e z, M a r í a G a r c í a, V i c t o r i a A g u i l e r a, A
TOLERANCIA A LA TRIPLE TERAPIA EN POBLACIONES ESPECIALES C a r m e n V i n a i x a, C a r l a S a t o r r e s, B e a t r i z R o d r í g u e z, M a r í a G a r c í a, V i c t o r i a A g u i l e r a, A
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ACICLOVIR 5% Crema CREMA ANTIVIRAL Página 1 ACICLOVIR 5% Crema Crema Principio Activo Aciclovir Excipientes necesarios
FICHA TÉCNICA. Cada comprimido contiene 250 mg de halofantrina hidrocloruro (equivalente a 233 mg de base libre).
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Halfan 250 mg Comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de halofantrina hidrocloruro (equivalente a 233 mg de base libre).
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Halfan 250 mg Comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 250 mg de halofantrina hidrocloruro (equivalente a 233 mg de base libre).
ESTATINAS EN PERSONAS MAYORES
 ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ESTATINAS EN PERSONAS MAYORES Farmacia Atención Primaria Sevilla Servicios de Farmacia de las Áreas y Distritos Sanitarios Aljarafe Norte, Sevilla, Sur y Osuna Consideraciones previas Principalmente prescritas
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Kaletra (80 mg + 20 mg)/ml solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Kaletra solución
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Kaletra (80 mg + 20 mg)/ml solución oral. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de Kaletra solución
DIRECCION DE SERVICIOS SANITARIOS
 PRODUCTOS SANITARIOS Página 1 de 5 Introducción La infección por el virus de la hepatitis C (VHC) es un problema de salud de primera magnitud en Europa y especialmente en los países mediterráneos, donde
PRODUCTOS SANITARIOS Página 1 de 5 Introducción La infección por el virus de la hepatitis C (VHC) es un problema de salud de primera magnitud en Europa y especialmente en los países mediterráneos, donde
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox
 TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
TECNOLOGÍA EN SALUD DE INTERÉS Deferasirox 1. RESUMEN Título del reporte: Evaluación de efectividad y seguridad de deferasirox en Hemosiderosis Transfusional Información general de la tecnología: deferasirox
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.)
 Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
Anexo II Tratamiento farmacológico de las cefaleas primarias y algias faciales (Grupo de Estudio de Cefaleas, S.E.N.) Las dosis recomendadas son para pacientes adultos. Estas recomendaciones no deberían
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Efavirenz Teva 600 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Efavirenz Teva 600 mg comprimidos recubiertos con película EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 COTRIMOXAZOL 200/40/5 ml SUSPENSIÓN ANTIINFECCIOSO-ANTIBACTERIANO Página 1 COTRIMOXAZOL 200/40/5 ml Suspensión Principio
PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA
 GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
GUÍA DEL FARMACÉUTICO PARA LA DISPENSACIÓN DE ISOTRETINOÍNA PROGRAMA DE PREVENCIÓN DE EMBARAZOS DE ISOTRETINOÍNA Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO. URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
 FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
FICHA TECNICA DE URINORM BENZBROMARONA 1. DENOMINACIÓN DEL MEDICAMENTO URINORM, 100 mg, comprimidos. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene: Benzbromarona (D.C.I.)...100 mg
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Atripla 600 mg/200 mg/245 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Atripla 600 mg/200 mg/245 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO PREZISTA 100 mg/ml suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de suspensión oral contiene
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO PREZISTA 100 mg/ml suspensión oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada ml de suspensión oral contiene
Psicofàrmacos. Escuela de parteras 2013
 Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Psicofàrmacos Escuela de parteras 2013 Psicofàrmacos Fàrmacos que actùan sobre las funciones cerebrales como sedantes o estimulantes, lo que produce cambios en la percepciòn, estado de ànimo, conciencia
Anexo II. Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto
 Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
Anexo II Modificaciones a las secciones pertinentes de la ficha técnica y el prospecto 6 Para los medicamentos que contienen los inhibidores de la enzima convertidora de angiotensina (IECA) benazepril,
OLYSIO SIMEPREVIR 150 mg Cápsulas. Grupo farmacoterapéutico: antivirales para uso sistémico, antivirales de acción directa, código ATC: J05AE14
 OLYSIO SIMEPREVIR 150 mg Cápsulas Industria Italiana Administración por vía oral Venta bajo receta archivada FORMULA CUALI Y CUANTITATIVA Cada cápsula de Olysio contiene: Simeprevir 150 mg (correspondiente
OLYSIO SIMEPREVIR 150 mg Cápsulas Industria Italiana Administración por vía oral Venta bajo receta archivada FORMULA CUALI Y CUANTITATIVA Cada cápsula de Olysio contiene: Simeprevir 150 mg (correspondiente
EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P.
 CIRCULAR DEL PRODUCTO Cápsulas EMEND (aprepitant) I. CLASE TERAPÉUTICA * EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P. II. INDICACIONES EMEND en combinación
CIRCULAR DEL PRODUCTO Cápsulas EMEND (aprepitant) I. CLASE TERAPÉUTICA * EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P. II. INDICACIONES EMEND en combinación
Documento Local del Producto
 1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
1 Documento Local del Producto Título del Documento de Producto: Alprazolam Fecha de CDS que reemplaza: 14 de octubre de 2013 Fecha Efectiva: 12 de diciembre de 2013 Versión CDS: 8.0 1. NOMBRE DEL MEDICAMENTO
Desórdenes renales. Profa. Noemí Díaz Ruberté, MSN
 Desórdenes renales Profa. Noemí Díaz Ruberté, MSN 1 Glomerulonefritis posestreptococcica aguda Reacción inmunológica (antígeno-anticuerpo) a una infección del organismo que suele ser provocada por una
Desórdenes renales Profa. Noemí Díaz Ruberté, MSN 1 Glomerulonefritis posestreptococcica aguda Reacción inmunológica (antígeno-anticuerpo) a una infección del organismo que suele ser provocada por una
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales
ANEXO I RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales
Si tenés VIH, estás embarazada o querés quedar embarazada consultá con tu médico cómo continuar tu tratamiento si ya lo has iniciado.
 Esta guía brinda información básica acerca de los medicamentos que conforman tu tratamiento antirretroviral. Aquí encontrarás información sobre los efectos adversos, posibles interacciones con otras drogas
Esta guía brinda información básica acerca de los medicamentos que conforman tu tratamiento antirretroviral. Aquí encontrarás información sobre los efectos adversos, posibles interacciones con otras drogas
Perpetuum mobile: Nuevos anticoagulantes orales CASO CLINICO 1. María Pereiro Sánchez MIR III Hematología y hemoterapia.
 Perpetuum mobile: Nuevos anticoagulantes orales CASO CLINICO 1 María Pereiro Sánchez MIR III Hematología y hemoterapia. Paciente de 60 años FA persistente Solicitan anticoagulación indefinida. NECESITAMOS
Perpetuum mobile: Nuevos anticoagulantes orales CASO CLINICO 1 María Pereiro Sánchez MIR III Hematología y hemoterapia. Paciente de 60 años FA persistente Solicitan anticoagulación indefinida. NECESITAMOS
Tratamiento de la HEPATITIS C CRÓNICA en pacientes monoinfectados
 DATOS IDENTIFICATIVOS DEL PACIENTE AÑO DE NACIMIENTO NOMBRE: DATOS RELATIVOS HEPATITIS C: HC : FECHA: Genotipo: Genotipo 1a Genotipo 1b otros (especificar: ) Genotipo CC de la IL28B Genotipo TT o CT de
DATOS IDENTIFICATIVOS DEL PACIENTE AÑO DE NACIMIENTO NOMBRE: DATOS RELATIVOS HEPATITIS C: HC : FECHA: Genotipo: Genotipo 1a Genotipo 1b otros (especificar: ) Genotipo CC de la IL28B Genotipo TT o CT de
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Lactulosa Level 667,5 mg/ml solución oral 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 1 mililitro de solución oral contiene
Pacientes de edad avanzada: debe considerarse la conveniencia de ampliar el intervalo de dosificación (Ver Propiedades Famacocinéticas).
 FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
FT290191-B+2 1. NOMBRE DEL MEDICAMENTO DARVON 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Dextropropoxifeno (D.C.I.) napsilato 100 mg. 3. FORMA FARMACÉUTICA Cápsulas para administración por vía oral. 4.
VIEKIRA PAK. (tabletas de ombitasvir, paritaprevir y ritonavir; tabletas de dasabuvir) embalado conjuntamente para uso oral Solo con receta
 046-1869455 VERSIÓ MAESTRA E ESPAÑOL VIEKIRA PAK (tabletas de ombitasvir, paritaprevir y ritonavir; tabletas de dasabuvir) embalado para uso oral Solo con receta PUTOS DESTACADOS DE LA IFORMACIÓ DE PRESCRIPCIÓ
046-1869455 VERSIÓ MAESTRA E ESPAÑOL VIEKIRA PAK (tabletas de ombitasvir, paritaprevir y ritonavir; tabletas de dasabuvir) embalado para uso oral Solo con receta PUTOS DESTACADOS DE LA IFORMACIÓ DE PRESCRIPCIÓ
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Mupirocina ISDIN 20 mg/g pomada 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada gramo de pomada contiene 20 mg de mupirocina. Para consultar
Excipiente con efecto conocido: cada cápsula contiene 56 mg de lactosa monohidrato.
 Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
Este medicamento está sujeto a seguimiento adicional, lo que agilizará la detección de nueva información sobre su seguridad. Se invita a los profesionales sanitarios a notificar las sospechas de reacciones
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 ERGOTAMINA + CAFEÍNA 1/100 mg COMPRIMIDOS RECUBIERTOS ANALGÉSICO, ANTIMIGRAÑOSO Página 1 ERGOTAMINA + CAFEÍNA 1/100
Lección 30. Fármacos Antiarrítmicos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS. Ricardo Brage e Isabel Trapero - Farmacología Lección 30
 Ricardo Brage e Isabel Trapero - Lección 30 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 30 Fármacos Antiarrítmicos Guión Ricardo Brage e Isabel Trapero - Lección 30 1. BASES CONCEPTUALES
Ricardo Brage e Isabel Trapero - Lección 30 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 30 Fármacos Antiarrítmicos Guión Ricardo Brage e Isabel Trapero - Lección 30 1. BASES CONCEPTUALES
FICHA DE INFORMACIÓN AL PACIENTE: VERAPAMILO
 FICHA DE INFORMACIÓN AL PACIENTE: VERAPAMILO 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antihipertensivo, antianginoso y antiarrítmico, bloqueante de los canales del calcio. 1.2 Cómo actúa este fármaco:
FICHA DE INFORMACIÓN AL PACIENTE: VERAPAMILO 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Antihipertensivo, antianginoso y antiarrítmico, bloqueante de los canales del calcio. 1.2 Cómo actúa este fármaco:
Usos de fármacos durante el embarazo y la lactancia
 Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Usos de fármacos durante el embarazo y la lactancia -Son situaciones farmacocinéticas especiales. -En estos estados fisiológicos los fármacos actúan de diferente manera. *Fármacos administrados a la madre
Repafet. Rupatadina Tabletas. Rupatadina II.- DENOMINACIÓN GENÉRICA: III.- FORMA FARMACÉUTICA Y FORMULACIÓN:
 Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
Repafet Rupatadina Tabletas II.- DENOMINACIÓN GENÉRICA: Rupatadina III.- FORMA FARMACÉUTICA Y FORMULACIÓN: Cada tableta contiene: Fumarato de Rupatadina equivalente a... 10 mg de Rupatadina Excipiente
HOSPITAL UNIVERSITARIO REINA SOFÍA Informe del Sº Farmacia Tenofovir en el tratamiento de la infección por el VHB
 1.- Identificación del fármaco: Nombre Comercial: Viread Presentaciones: E/30 comp Laboratorio: Gilead Sciences Precio adquisición: PVL+IVA: 294.25 (9.80 /comp) Grupo Terapéutico: JO5AF: Nucleósidos y
1.- Identificación del fármaco: Nombre Comercial: Viread Presentaciones: E/30 comp Laboratorio: Gilead Sciences Precio adquisición: PVL+IVA: 294.25 (9.80 /comp) Grupo Terapéutico: JO5AF: Nucleósidos y
Toctino (alitretinoína)
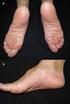 1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
1 PROGRAMA DE PREVENCIÓN Información de seguridad sobre para profesionales sanitarios PARA EL PROFESIONAL SANITARIO Información sobre prevención de riesgos autorizada por la Agencia Española de Medicamentos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 INDOMETACINA 25 mg COMPRIMIDOS RECUBIERTOS ANTIINFLAMATORIO ANTIRREUMÁTICO Página 1 INDOMETACINA 25 mg Comprimidos
FARMACOS HIPOLIPEMIANTES: Precauciones, contraindicaciones, insuficiencia renal, interacciones y reacciones adversas
 FARMACOS HIPOLIPEMIANTES: Precauciones, contraindicaciones, insuficiencia renal, interacciones y reacciones adversas PRECAUCIONES CONTRAINDICACIONES INSUFICIENCIA RENAL (IR) /INTERACCIONES REACCIONES ADVERSAS
FARMACOS HIPOLIPEMIANTES: Precauciones, contraindicaciones, insuficiencia renal, interacciones y reacciones adversas PRECAUCIONES CONTRAINDICACIONES INSUFICIENCIA RENAL (IR) /INTERACCIONES REACCIONES ADVERSAS
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO SUSTIVA 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 50 mg de
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO SUSTIVA 50 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 50 mg de
Alivio de los sofocos que aparecen durante la menopausia como consecuencia de la deprivación estrogénica.
 1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
1. NOMBRE DEL MEDICAMENTO Normosoy 40 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: 290 mg de extracto etanólico 85% V/V seco de semillas de Glycine max (L.) Merr.
Modificaciones respecto a la anterior edición. Elaborado: Revisado Aprobado: Dirección Médica Dirección Enfermería
 Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
Protocolo de nueva elaboración Modificaciones respecto a la anterior edición Elaborado: Revisado Aprobado: Comisión Infección, profilaxis y política antibiótica Dirección Médica Dirección Enfermería Dirección
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO VECOXAN 2,5 mg/ml SUSPENSION ORAL TERNEROS Y CORDEROS Diclazurilo 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
Cada comprimido recubierto con película contiene 150 mg de darunavir (como etanolato).
 1. NOMBRE DEL MEDICAMENTO PREZISTA 150 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 150 mg de darunavir (como etanolato).
1. NOMBRE DEL MEDICAMENTO PREZISTA 150 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido recubierto con película contiene 150 mg de darunavir (como etanolato).
Anexo 2. Figuras y tablas
 Anexo 2. Figuras y tablas Figura 1. Algoritmo de intervención farmacológica ELEGIR TRATAMIENTO de primera generación de segunda generación* 4 6 semanas Continuar el tratamiento Efectos secundarios intolerables?
Anexo 2. Figuras y tablas Figura 1. Algoritmo de intervención farmacológica ELEGIR TRATAMIENTO de primera generación de segunda generación* 4 6 semanas Continuar el tratamiento Efectos secundarios intolerables?
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3
 INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3 En este tercer ejemplar del Boletín de Interferencias por Fármacos en pruebas clínicas, detallaremos
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 3 En este tercer ejemplar del Boletín de Interferencias por Fármacos en pruebas clínicas, detallaremos
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Ginkokán 40 mg comprimidos Extracto de Ginkgo biloba EGb 761 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
Telaprevir para el tratamiento de pacientes adultos con hepatitis C crónica. Publicación de la Dirección General de Farmacia y Productos Sanitarios
 57/2012 - Volumen III Ficha Telaprevir para el tratamiento de pacientes adultos con nº 57 Publicación de la Dirección General de Farmacia y Productos Sanitarios Calificación Fármaco comparador: rivabirina
57/2012 - Volumen III Ficha Telaprevir para el tratamiento de pacientes adultos con nº 57 Publicación de la Dirección General de Farmacia y Productos Sanitarios Calificación Fármaco comparador: rivabirina
Eficacia y Seguridad de la Triple Terapia en HCU. Estado Actual Tratamiento VHC. Guillermo García Rayado MIR 3º Año. Digestivo
 Eficacia y Seguridad de la Triple Terapia en HCU Estado Actual Tratamiento VHC Guillermo García Rayado MIR 3º Año. Digestivo Eficacia y Seguridad de la Triple Terapia en Pacientes con Hepatitis Crónica
Eficacia y Seguridad de la Triple Terapia en HCU Estado Actual Tratamiento VHC Guillermo García Rayado MIR 3º Año. Digestivo Eficacia y Seguridad de la Triple Terapia en Pacientes con Hepatitis Crónica
Casos Clínicos en Dislipidemias. Juan Carlos Díaz Cardiología y Electrofisiología CES
 Casos Clínicos en Dislipidemias Juan Carlos Díaz Cardiología y Electrofisiología CES Introducción Droga de primera línea en enfermedades CV Excelente relación riesgo/beneficio Uso cada vez mas frecuente,
Casos Clínicos en Dislipidemias Juan Carlos Díaz Cardiología y Electrofisiología CES Introducción Droga de primera línea en enfermedades CV Excelente relación riesgo/beneficio Uso cada vez mas frecuente,
Interacciones farmacológicas (HAP). Qué sabemos y qué hacemos
 Justificación del tratamiento combinado La fisiopatología del HAP se explica por tres vías principales Los fármacos disponibles actualmente actúan específicamente sobre una u otra de estas vías Justificación
Justificación del tratamiento combinado La fisiopatología del HAP se explica por tres vías principales Los fármacos disponibles actualmente actúan específicamente sobre una u otra de estas vías Justificación
MEDICAMENTOS GENERICOS
 MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
MEDICAMENTOS GENERICOS ACLARACIONES AL CONCEPTO DE GENERICOS En general, Médicos y Farmacéuticos identifican inmediatamente como genérico a los medicamentos sin marca y se aplican a ellos conceptos en
CRONODINE (Diltiazem clorhidrato)
 CRONODINE (Diltiazem clorhidrato) 1. NOMBRE DEL MEDICAMENTO: CRONODINE 120 mg y 240 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: CRONODINE 120: Diltiazem (DCI) clorhidrato 120 mg CRONODINE 240: Diltiazem
CRONODINE (Diltiazem clorhidrato) 1. NOMBRE DEL MEDICAMENTO: CRONODINE 120 mg y 240 mg 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA: CRONODINE 120: Diltiazem (DCI) clorhidrato 120 mg CRONODINE 240: Diltiazem
Lección 22. Farmacos Antiepilepticos y anticonvulsivantes UNIDAD VI: ALTERACIONES NEUROLÓGICAS
 Ricardo Brage e Isabel Trapero - Lección 22 UNIDAD VI: ALTERACIONES NEUROLÓGICAS Lección 22 Farmacos Antiepilepticos y anticonvulsivantes Guión Ricardo Brage e Isabel Trapero - Lección 22 1. FUNDAMENTOS.
Ricardo Brage e Isabel Trapero - Lección 22 UNIDAD VI: ALTERACIONES NEUROLÓGICAS Lección 22 Farmacos Antiepilepticos y anticonvulsivantes Guión Ricardo Brage e Isabel Trapero - Lección 22 1. FUNDAMENTOS.
PROSPECTO. CEFTRIAXONA REIG JOFRÉ 1 g IM. Polvo y disolvente para solución inyectable. E.F.G. Ceftriaxona (D.C.I.)
 PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
PROSPECTO Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico.
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp
 Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Cuidado de la enfermera a pacientes con complicaciones de preeclampsia eclampsia, síndrome de Hellp Enf. María Guadalupe Vega Jefe de Piso Unidad de Terapia Intensiva Hospital General Las Américas, Ecatepec
Restricciones de uso de los medicamentos que contienen domperidona
 1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
1 de septiembre de 2014 EMA/465179/2014 Restricciones de uso de los medicamentos que contienen domperidona El 23 de abril de 2014, el Grupo de Coordinación de los Procedimientos de Reconocimiento Mutuo
Hepatitis C Manejo del Paciente Vírgen a Tratamiento David Kershenobich, MD, PhD Instituto Nacional de Ciencias Médicas y Nutrición, Salvador Zubirán
 Hepatitis C Manejo del Paciente Vírgen a Tratamiento David Kershenobich, MD, PhD Instituto Nacional de Ciencias Médicas y Nutrición, Salvador Zubirán México, Distrito Federal Hepatitis C La FDA aprobo
Hepatitis C Manejo del Paciente Vírgen a Tratamiento David Kershenobich, MD, PhD Instituto Nacional de Ciencias Médicas y Nutrición, Salvador Zubirán México, Distrito Federal Hepatitis C La FDA aprobo
VYTORIN 10/10 VYTORIN 10/20 VYTORIN 10/40 VYTORIN 10/80 CIRCULAR MUNDIAL DEL PRODUCTO. Comprimidos. (EZETIMIBA 10 mg/simvastatina 10 mg)
 CIRCULAR MUNDIAL DEL PRODUCTO Comprimidos VYTORIN 10/10 (EZETIMIBA 10 mg/simvastatina 10 mg) VYTORIN 10/20 (EZETIMIBA 10 mg/simvastatina 20 mg) VYTORIN 10/40 (EZETIMIBA 10 mg/simvastatina 40 mg) VYTORIN
CIRCULAR MUNDIAL DEL PRODUCTO Comprimidos VYTORIN 10/10 (EZETIMIBA 10 mg/simvastatina 10 mg) VYTORIN 10/20 (EZETIMIBA 10 mg/simvastatina 20 mg) VYTORIN 10/40 (EZETIMIBA 10 mg/simvastatina 40 mg) VYTORIN
DOCUMENTO DE CONSENSO DEL GRUPO ESPAÑOL PARA EL ESTUDIO DE LA HEPATITIS (GEHEP) SOBRE EL TRATAMIENTO DE LA HEPATITIS C
 DOCUMENTO DE CONSENSO DEL GRUPO ESPAÑOL PARA EL ESTUDIO DE LA HEPATITIS (GEHEP) SOBRE EL TRATAMIENTO DE LA HEPATITIS C Nota de la Junta Directiva de GEHEP: Con fecha 11/06/2015 se han actualizado las recomendaciones
DOCUMENTO DE CONSENSO DEL GRUPO ESPAÑOL PARA EL ESTUDIO DE LA HEPATITIS (GEHEP) SOBRE EL TRATAMIENTO DE LA HEPATITIS C Nota de la Junta Directiva de GEHEP: Con fecha 11/06/2015 se han actualizado las recomendaciones
FOLLETO DE INFORMACIÓN AL PROFESIONAL SOVALDI COMPRIMIDOS RECUBIERTOS 400 mg
 1 INDICACIONES Y USO SOVALDI es un inhibidor análogo nucleotídico de la polimerasa NS5B del virus de la hepatitis C (VHC) indicado para el tratamiento de la infección por hepatitis C crónica (HCC) como
1 INDICACIONES Y USO SOVALDI es un inhibidor análogo nucleotídico de la polimerasa NS5B del virus de la hepatitis C (VHC) indicado para el tratamiento de la infección por hepatitis C crónica (HCC) como
BASES FARMACOCINÉTICAS PARA EL DISEÑO O DE UNA PAUTA TERAPÉUTICA. Dr. Pedro Guerra López
 BASES FARMACOCINÉTICAS PARA EL DISEÑO O DE UNA PAUTA TERAPÉUTICA Dr. Pedro Guerra López Pautas terapeuticas Objetivos de esta lección. - Conocer el interés clínico de la farmacocinética en general en cuanto
BASES FARMACOCINÉTICAS PARA EL DISEÑO O DE UNA PAUTA TERAPÉUTICA Dr. Pedro Guerra López Pautas terapeuticas Objetivos de esta lección. - Conocer el interés clínico de la farmacocinética en general en cuanto
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO PREZISTA 300 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO PREZISTA 300 mg comprimidos recubiertos con película. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido
TECNOLOGÍA EN SALUD DE INTERÉS. Oxcarbazepina, lacosamida, vigabatrina, topiramato o levetiracetam. 1. RESUMEN
 TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
TECNOLOGÍA EN SALUD DE INTERÉS Oxcarbazepina, lacosamida, vigabatrina, topiramato y levetiracetam 1. RESUMEN Título del reporte: Efectividad y seguridad de oxcarbazepina, lacosamida, vigabatrina, topiramato
Interacciones medicamentosas en pacientes infectados con el VIH: aproximación para establecer y evaluar su relevancia clínica
 1130-6343/2007/31/5/283 FARMACIA HOSPITALARIA Copyright 2007 ARÁN EDICIONES, S. L. FARM HOSP Vol. 31. N. 5, pp. 283-302, 2007 REVISIÓN Interacciones medicamentosas en pacientes infectados con el VIH: P.
1130-6343/2007/31/5/283 FARMACIA HOSPITALARIA Copyright 2007 ARÁN EDICIONES, S. L. FARM HOSP Vol. 31. N. 5, pp. 283-302, 2007 REVISIÓN Interacciones medicamentosas en pacientes infectados con el VIH: P.
Lección 24. Fármacos Diuréticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS. Ricardo Brage e Isabel Trapero - Farmacología Lección 24
 Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Anexo III. Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos
 Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
Anexo III Modificaciones de las secciones pertinentes de las fichas técnicas y los prospectos 44 Modificaciones que se incluyen en las secciones pertinentes de la ficha técnica para las vacunas monovalentes
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Victrelis 200 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 200
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Victrelis 200 mg cápsulas duras 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula dura contiene 200
FICHA TÉCNICA. ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO ENTEROSTREP SP 500mg/g polvo para administración en agua de bebida para conejos 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada g contiene: Sustancia
Manejo de la hepatitis crónica C en Atención Primaria
 Manejo de la hepatitis crónica C en Atención Primaria Virus C 9 genotipos diferentes 40 subgenotipos 170 millones personas infectadas 800.000 portadores en España Prevalencia hepatitis C crónica: 1,5-2%
Manejo de la hepatitis crónica C en Atención Primaria Virus C 9 genotipos diferentes 40 subgenotipos 170 millones personas infectadas 800.000 portadores en España Prevalencia hepatitis C crónica: 1,5-2%
Disposición ANMAT Nº 1970/2001
 Disposición ANMAT Nº 1970/2001 Información que deberán contener los prospectos de especialidades medicinales que contengan como principio activo Hypericum Perforatum- Hipérico. Bs. As., 10/4/2001 VISTO
Disposición ANMAT Nº 1970/2001 Información que deberán contener los prospectos de especialidades medicinales que contengan como principio activo Hypericum Perforatum- Hipérico. Bs. As., 10/4/2001 VISTO
Nuevos y novísimos fármacos antiepilépticos
 Nuevos y novísimos fármacos antiepilépticos Cuál es el escenario en la epilepsia? 50% Control con monoterapia 30% Control con politerapia 20% Farmacorresistencia 5% están libres de crisis con un nuevo
Nuevos y novísimos fármacos antiepilépticos Cuál es el escenario en la epilepsia? 50% Control con monoterapia 30% Control con politerapia 20% Farmacorresistencia 5% están libres de crisis con un nuevo
PROTOCOLO DE HIPERTENSIÓN ARTERIAL. Cualquier persona que pertenezca a la zona de salud y que acuda al sistema sanitario por cualquier motivo.
 PROTOCOLO DE HIPERTENSIÓN ARTERIAL. 1. Objetivos. Detección y control de los hipertensos 2. Criterios de inclusión. 3. Captación. 4. Actividades. Cualquier persona que pertenezca a la zona de salud y que
PROTOCOLO DE HIPERTENSIÓN ARTERIAL. 1. Objetivos. Detección y control de los hipertensos 2. Criterios de inclusión. 3. Captación. 4. Actividades. Cualquier persona que pertenezca a la zona de salud y que
SIM Sistema de Información de Medicamentos
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos SIM EXPRESS Información dirigida a los profesionales
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos SIM EXPRESS Información dirigida a los profesionales
Tratamiento sintomático de procesos alérgicos tales como: Rinitis o conjuntivitis alérgica, urticaria crónica, dermatitis alérgica.
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO ASTEMIZOL RATIOPHARM 10 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Astemizol (D.C.I.)... 10 mg Excipientes: véase
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO ASTEMIZOL RATIOPHARM 10 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada cápsula contiene: Astemizol (D.C.I.)... 10 mg Excipientes: véase
