Estructura secundaria de las proteínas
|
|
|
- José González Blanco
- hace 7 años
- Vistas:
Transcripción
1 Estructura secundaria de las proteínas
2 Niveles de estructuración en las proteínas
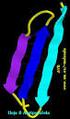
3 Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena principal sin tomar en cuenta la conformación de su cadena lateral o su interrelación con otros segmentos. Hélices α Conformaciones β Giros β ESTRUCTURA SECUNDARIA Los puentes de hidrógeno son la principal fuerza estabilizadora de esta estructura.
4 Hélice a La cadena se enrolla en espiral sobre sí misma. Esta estructura se mantiene gracias a los enlaces de hidrógeno intracatenarios formados entre el grupo NH de un enlace peptídico (n) y el grupo C=O del cuarto aminoácido que le sigue (n+4).
5
6 Tendencia de los aminoácidos a formar hélices a A mayor DDG 0 (relativo a la alanina) es menos propenso a formar hélices a
7 Factores que desestabilizan las hélices a Los aminoácidos disruptores de la hélice α desestabilizan la estructura helicoidal, como la prolina cuyo N de su enlace peptídico no tiene ningún H para formar un puente de hidrógeno.
8 Restricciones en la hélice-α Presencia de Pro y/o Gli: Pro: El átomo de N, es parte de un anillo rígido, lo que no permite la rotación del C α -N; además de que el mismo N no tiene H para participar en los puentes de H con otros residuos. Gli: Tiene mayor flexibilidad conformacional que otros residuos. Los polímeros de Gli tienden a formar estructuras enroscadas muy diferentes a la hélice-α.
9 Conformaciones b Hojas plisadas b:el esqueleto de la cadena polipeptídica se extiende en forma de zig-zag. Las cadenas de los polipéptidos adyacentes pueden ser paralelas o antiparalelas.
10
11 Giros b Giros b:muy abundantes en las proteínas globulares, las cuales tienen una estructura plegada de forma compacta. Los giros b conectan las terminaciones de dos segmentos adyacentes de una lámina bantiparalela. La estructura es un giro de 180 o que involucra cuatro residuos de aminoácidos. Los aminoácidos Gli y Pro, son los que frecuentemente forman los giros b, debido a su tamaño pequeño (Gli) y a su flexibilidad (Pro).
12 Giros b
13
14 Ejercicio 1. Estructura alfa-hélice Cuál de los siguientes péptidos es más probable que adopte una estructura de alfahélice? Por qué? L K A E N D E A A R A M S E A. Leu-Lis-Ala-Glu-Ans-Asp-Glu-Ala-Ala-Arg-Ala-Met-Ser-Glu-Ala C R A G G F P W D Q P G T S N. Cis-Arg-Ala-Gli-Gli-Phe-Pro-Trp-Asp-Gln-Pro-Gli-Thr-Ser-Asn
15 Ejercicio 2. Secuencia de aminoácidos (estructura primaria) de una proteína Nuestra creciente comprensión de los pliegues de las proteínas permite a los investigadores realizar predicciones sobre la estructura de las proteínas tomando en cuenta los datos de su estructura primaria (secuencia de aminoácidos). a) En que residuos de estas secuencia de aminoácidos pueden presentarse los giros β? b) Qué residuos podrían participar en la formación de los enlaces disulfuro intracadena?
16 Proteínas fibrosas Son moléculas muy alargadas. Las estructuras secundarias son los motivos predominantes. Sus funciones son fundamentalmente estructurales o motrices. Son resistentes e insolubles. Ejemplos: colágeno, queratina, fibroína de la seda
17
18 a-keratina Está formada por dos cadenas de hélice-α que van girando a la derecha, orientadas en paralelo y envueltas entre ellas mismas, formando una espiral superenrollada lo que le confiere una mayor fuerza. La estructura superenrollada gira hacia la izq. La α-keratina está enriquecida en residuos de Ala, Val, Ile, Met, Phe.
19 Proteínas fibrosas Sus cadenas polipeptídicas están organizadas en hebras o láminas largas. Ej. α-queratina, colágeno.
20
21
22 El colágeno como proteína fibrosa Se encuentra en tejido conectivo (tendones, cartílago, matriz orgánica de los huesos y córnea). Red fibrosa de tropocolágeno (unidad estructural). Formada por tres cadenas que se unen entre sí por puentes de hidrógeno. Abundante en glicina e hidroxiprolina (Gli-X-Y). X=Pro, Y=4OHPro). Forma una hélice triple que solo se rompe en los extremos. El colágeno es un componente abundante en piel, tendones, sistema vascular y otros materiales de desecho, de donde se puede obtener la gelatina comercial, que es un producto de degradación parcial del colágeno, extraída por calentamiento tras un tratamiento en medio ácido o alcalino.
23 Colágeno Su PM es 300,000 y tiene forma de varilla, de 3,000 Å de largo y 15 Å de ancho. Su estructura secundaria gira a la izquierda (left-handed). Cuenta con tres cadenas-α superenrolladas entre ellas mismas que cuentan con aprox. 1,000 residuos de a.a (cadenas-α hélices-α). Su estructura superenrollada va girando hacia la derecha.
24 Colágeno El contenido usual de aminoácidos en el colágeno es una tripéptido que se repite: Gli-X-Y, donde X es frecuentemente Pro y Y 4-OH-Pro Y su contenido es comúnmente: 35% Gli, 11% Ala, 21% Pro y 4-OHPro.
25 Colágeno Las fibrillas de colágeno están formadas de moléculas de colágeno alineadas y entrecruzadas, lo que le permite formar estrías cruzadas y que a su vez le confiere gran fuerza.
26
27 Ejercicio 3. Acción patógena de la bacteria que causa gangrena gaseosa. La bacteria anaerobia Clostridium perfringens es altamente patógena y es responsable de gangrena gaseosa, una condición en la cual la estructura del tejido animal se destruye. Esta bacteria secreta una enzima que cataliza la hidrólisis del enlace peptídico indicado en rojo en donde X y Y son cualquiera de los 20 aminoácidos. Cómo contribuye la secreción de esta enzima a la invasividad de esta bacteria al tejido humano? Por qué esta enzima no afecta a la bacteria?
28 Estructura terciaria de las proteínas Estructura terciaria: Es el arreglo tridimensional de todos los átomos de una proteína. Los aminoácidos polares se sitúan en el exterior y los apolares se internalizan. La estabilizan: Puentes de H Puentes disulfuro Interacciones de Van der Waals Efecto hidrofóbico Estructura terciaria de la mioglobina
29 Proteínas globulares Las cadenas polipeptídicas se pliegan de forma esférica o globular. Mioglobina
30 Caractersísticas de las proteínas globulares Forma mas o menos esférica. Ricas en estructuras secundarias. Múltiples funciones. Son solubles, flexibles y dinámicas. Ejemplo: hemoglobina, anticuerpos, enzimas
31 La funcionalidad de las proteínas globulares depende de sus propiedades dinámicas Flexibilidad No son estructuras rígidas. Su flexibilidad depende de un gran número de interacciones débiles. Cambios conformacionales Son pequeñas variaciones de su estructura terciaria. Sirven para regular su actividad. Interacciones Unión reversible de ligandos. Interacciones reversibles proteína-proteína. Se llevan a cabo mediante enlaces débiles.
32 Ejemplos de proteínas globulares: mioglobina y hemoglobina Mioglobina Hemoproteína monomérica. Función: Almacenamiento de O 2 en el músculo. Hemoglobina Hemoproteína tetramérica: cada cadena es muy similar a la mioglobina. Función: transporte de oxígeno y CO 2 entre los pulmones y los tejidos.
33 Estructura cuaternaria de las proteínas Estructura cuaternaria: Es la disposición espacial de las distintas cadenas polipeptídicas de una proteína multimérica. Proteínas oligoméricas: se componen de más de una cadena polipeptídica, ejemplo, la hemoglobina. Proteínas monoméricas: compuestas de una sola cadena polipeptídica, ejemplo, la mioglobina. Estructura de la hemoglobina
34 Estructura cuaternaria de las proteínas Los monómeros se asocian entre sí mediante interacciones no covalentes: Puentes de hidrógeno Interacciones hidrofóbicas También pueden existir interacciones covalentes entre las diferentes cadenas polipeptídicas: Puentes disulfuro. Son homodímeros cuando los monómeros que constituyen a las proteínas son iguales. Son heterodímeros cuando los monómeros son diferentes.
35 Dimensiones aproximadas de la albúmina sérica bovina (PM 64,500 y 585 residuos de aa) en una sola cadena polpéptidica si todos los residuos adoptaran las siguientes conformaciones.
36 Plegamiento y desnaturalización de las proteínas
37 El plegamiento de una proteína es el proceso por el que una proteína alcanza su estructura tridimensional. Su función biológica depende de su correcto plegamiento Estructura primaria Estructura terciaria
38
39 El plegamiento de una proteína es la transición reversible entre dos estados: El estado N (nativo) y D (desnaturalizado). El estado nativo es la forma funcional de una proteína El estado desnaturalizado se define como el resultante del deterioro cooperativo y generalizado de la estructura nativa, sin cambios en los enlaces covalentes (a excepción de los puentes disulfuro). Estado desnaturalizado Estado nativo
40 Durante la desnaturalización tiene lugar la solvatación generalizada de la mayor parte de la molécula, mientras que durante el plegamiento, algunas interacciones disolvente-proteína son reemplazadas por interacciones intramoleculares. Durante el plegamiento hay una disminución en la entropía configuracional (S) (medida del desorden) de la cadena polipeptídica. S configuracional nativa < S configuracional desnaturalizada DS configuracional < 0
41 En condiciones fisiológicas, el plegamiento es una reacción espontánea. G nativa < G desnaturalizada DG < 0
42 Una proteína pequeña como la RNAsa A, que tiene 124 residuos de aminoácidos tiene conformaciones posibles. Si la molécula pudiese probar una configuración cada segundos, serían necesarios años para probarlas todas. Sin embargo, se ha comprobado in vitro que la RNAsa se pliega en aproximadamente 1 minuto!!!
43 Agentes desnaturalizantes Son aquellos que provocan la pérdida de la estructura nativa de una proteína Agentes físicos: temperatura. Agentes químicos: detergentes y agentes caotrópicos. Cambios en el ph.
44 Efecto de la temperatura sobre la estructura de las proteínas Aumento de la energía cinética de las moléculas. Desorganización de la envoltura acuosa de las proteínas. Asimismo, el aumento de la temperatura destruye las interacciones débiles y desorganiza la estructura de la proteína, de forma que el interior hidrófobo interacciona con el medio acuoso y se produce la agregación y precipitación de la proteína desnaturalizada.
45 Agentes químicos: detergentes y agentes caotrópicos Los detergentes y los agentes caotrópicos (promotores del caos) originan la desnaturalización de la proteína bajo condiciones menos agresivas, ya que estas sustancias: No rompen los enlaces covalentes. Desorganizan la estructura secundaria, terciaria y cuaternaria, pero No desorganizan la estructura primaria.
46 Los agentes caotrópicos como las sales de guanidinio y la urea permiten que las moléculas de agua penetren en las proteínas, desorganizando así las interacciones hidrofóbicas que estabilizan la conformación nativa.
47 Efecto del ph sobre la estructura de las proteínas. Los H + y los OH - del agua provocan efectos parecidos, pero además de afectar a la envoltura acuosa de las proteínas también afectan a la carga eléctrica de los grupos ácidos y básicos de las cadenas laterales de los aminoácidos. Esta alteración de la carga superficial de las proteínas elimina las interacciones electrostáticas que estabilizan la estructura terciaria y a menudo provoca su precipitación.
48 El número de conformaciones que una cadena polipeptídica puede adoptar es astronómico, por lo que la adquisición de la estructura nativa por un mecanismo al azar tomaría un tiempo mayor que la edad del universo. A pesar de esto, las proteínas se pliegan en segundos. Esta observación conocida como la paradoja de Levinthal sugiere que existen rutas de plegamiento preferenciales que son termodinámicamente favorables. Termodinámica del plegado proteico
49 Restricciones en la hélice-a Otro factor que afecta la estabilidad de una hélice-α, es la identidad de los residuos de aminoácidos: Regularmente, al final de la hélice-α, se encuentran aminoácidos cargados negativamente, los cuales estabilizan la carga neta positiva de la hélice-α (debida a los puentes de H). Por lo que aminoácidos finales, cargados positivamente desestabilizan la hélice-α.
50
51
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
Estructura tridimensional de las proteínas
 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PRECIPITACIÓN EN BREVE. Francisco José Guerra Millán
 PRECIPITACIÓN EN BREVE Francisco José Guerra Millán www.pacopepe.com.mx BREVE DESCRIPCIÓN La precipitación consiste en la separación química de los componentes de una disolución. Esta separación se realiza
PRECIPITACIÓN EN BREVE Francisco José Guerra Millán www.pacopepe.com.mx BREVE DESCRIPCIÓN La precipitación consiste en la separación química de los componentes de una disolución. Esta separación se realiza
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Análisis de proteínas
 Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN
 UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Plegamiento y Estructura Terciaria
 Plegamiento y Estructura Terciaria Para el plegamiento apropiado y la formación correcta de los posibles enlaces disulfuro de una molécula proteica, no se requiere una mayor o especial información, que
Plegamiento y Estructura Terciaria Para el plegamiento apropiado y la formación correcta de los posibles enlaces disulfuro de una molécula proteica, no se requiere una mayor o especial información, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
Proteínas fibrosas. Alfa Queratinas Beta-Queratinas Fibroína Colágeno Elastina
 Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Estructura de proteínas
 Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
ACIDOS NUCLEICOS nucleotidos. PROTEINAS aminoácidos. POLISACARIDOS monosacáridos
 AIDOS NULEIOS nucleotidos PROTEINAS aminoácidos POLISAARIDOS monosacáridos ESTRUTURA DE PROTEÍNAS: POLÍMEROS DE AMINOÁIDOS PRIMARIA NIVELES ESTRUTURALES SEUNDARIA TERIARIA Formas de representación de proteínas
AIDOS NULEIOS nucleotidos PROTEINAS aminoácidos POLISAARIDOS monosacáridos ESTRUTURA DE PROTEÍNAS: POLÍMEROS DE AMINOÁIDOS PRIMARIA NIVELES ESTRUTURALES SEUNDARIA TERIARIA Formas de representación de proteínas
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Copyright (c) Marina González, Gabriela Gómez
 PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Formación del enlace peptídico por condensación de dos aminoácidos. Amida
 PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
SERIE Nº 4. Aminoácidos, Péptidos y Proteínas
 SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
 NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de α-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen codificación
NIVELES ESTRUCTURALES DE LAS PROTEÍNAS 1 Péptidos y Polipéptidos: Se forman por uniones peptídicas de α-l-aminoácidos, siguiendo un orden diseñado por las enzimas que los unen, pero no tienen codificación
Biopolímero s (4831)
 Biopolímero s (4831) 1.2. Niveles de estructura en las macromoléculas biológicas. (La visualización interactiva adecuada de las moléculas de la página requiere la instalación en el navegador del plug-in
Biopolímero s (4831) 1.2. Niveles de estructura en las macromoléculas biológicas. (La visualización interactiva adecuada de las moléculas de la página requiere la instalación en el navegador del plug-in
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos
 Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
Tema 8. Biomoléculas: Proteínas y Ácidos Nucleicos 1. Proteínas 1.1. Introducción 1.2. Aminoácidos, péptidos y proteínas 1.3. Estructura primaria: secuencia 1.4. Estructura secundaria 1.5. Estructura terciaria
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
PÉPTIDOS Y PROTEÍNAS
 PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
PROTEÍNAS. Profa. María Moreno Biología 1º bach.
 PROTEÍNAS Profa. María Moreno Biología 1º bach. DEFINICIÓN Polímeros (macromoléculas) formados por la unión de varios aminoácidos por enlace peptídico. Biomoléculas más abundantes en los s.v., después
PROTEÍNAS Profa. María Moreno Biología 1º bach. DEFINICIÓN Polímeros (macromoléculas) formados por la unión de varios aminoácidos por enlace peptídico. Biomoléculas más abundantes en los s.v., después
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS
 AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
AMINOÁCIDOS: LOS MONÓMEROS DE LAS PROTEÍNAS Los aminoácidos son moléculas sencillas, con una estructura general que presenta: 1- Una parte común, con un grupo carboxilo y un grupo amino unidos al mismo
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Unidad 3: Organización molecular de la célula Proteínas
 Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Proteínas Las proteínas son las biomoléculas más abundantes de las células, constituyendo el 50% de su peso seco aproximadamente. Estructuralmente, son polímeros de aminoácidos. Existe una enorme variedad
Licenciatura en Ciencias Biológicas LABORATORIO Nº 3. Proteínas
 LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Sesión 27. Tema: Proteínas. Que los alumnos reconozcan la estructura y función de las proteínas
 Sesión 27 Tema: Proteínas I. Objetivos de la sesión Que los alumnos reconozcan la estructura y función de las proteínas II. Temas Aminoácidos y estructura molecular. Si ranqueamos las moléculas de acuerdo
Sesión 27 Tema: Proteínas I. Objetivos de la sesión Que los alumnos reconozcan la estructura y función de las proteínas II. Temas Aminoácidos y estructura molecular. Si ranqueamos las moléculas de acuerdo
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Las proteínas son las moléculas orgánicas más abundantes en las células, más del 50% del
 LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas fibrosas. α-queratinas
 Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS. Nombre:... Curso:.. Fecha:...
 Liceo La Florida Prof: M. Ibáñez H. GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS Nombre:... Curso:.. Fecha:... Introducción: Nuestro organismo produce proteínas, sin embargo si a las células les falta 1 ingrediente,
Liceo La Florida Prof: M. Ibáñez H. GUIÁ DE PROTEÍNAS Y ÁCIDOS NUCLEICOS Nombre:... Curso:.. Fecha:... Introducción: Nuestro organismo produce proteínas, sin embargo si a las células les falta 1 ingrediente,
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS.
 Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Encefalopatías espongiformes mal de las vacas locas
 Priones http:// www.youtube. com/watch? v=endmhs0_ 8F8 Encefalopatías espongiformes mal de las vacas locas Priones PRÓTIDOS http:// www.youtube. com/watch? v=endmhs0_ 8F8 Encefalopatías espongiformes mal
Priones http:// www.youtube. com/watch? v=endmhs0_ 8F8 Encefalopatías espongiformes mal de las vacas locas Priones PRÓTIDOS http:// www.youtube. com/watch? v=endmhs0_ 8F8 Encefalopatías espongiformes mal
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS.
 Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia.
 CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia. PROTEINAS Las proteínas son las moléculas orgánicas más abundantes; en la mayoría de los
CONTENIDO: Bases moleculares de la vida: Proteínas y ácidos nucleicos. Características generales e importancia. PROTEINAS Las proteínas son las moléculas orgánicas más abundantes; en la mayoría de los
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
