Insuficiencia aórtica Aspectos clínicos y cuantificación ecocardiográfica
|
|
|
- Emilio Acosta Escobar
- hace 7 años
- Vistas:
Transcripción
1
2 Insuficiencia aórtica Aspectos clínicos y cuantificación ecocardiográfica Dr. Pablo Oberti Jefe de la Sección Imágenes Cardiovasculares Del Servicio de Cardiología del Hospital Italiano de Buenos Aires. Epidemiología La insuficiencia valvular aórtica (IA) ha sido reconocida desde hace largo tiempo como una causa de significativa morbilidad y mortalidad. Está caracterizada por el reflujo de sangre desde la aorta hacia el ventrículo izquierdo debido a una inadecuada coaptación de las cúspides aórticas secundario a anomalías de las valvas, sus estructuras de sostén (raíz aórtica y anillo) o ambas. Existe poca información acerca de la incidencia de la IA aguda. En cuanto a la prevalencia observada de IA crónica en un trabajo basado en una población adulta no seleccionada (the Framingham Offspring Study) diagnosticada por ecocardiografía Doppler fue de un 13% en hombres y de un 8.5% en mujeres. 1 Etiología Este cuadro es resultante de varias posibles etiologías que pueden afectar la raíz aórtica, anillo o las valvas e incluyen desde afecciones congénitas (aorta bicúspide o asociadas a otras anomalías tales como la membrana subaórtica, comunicación interventricular, etc.), a causas adquiridas como la degeneración valvular aterosclerótica - con fibrosis o calcificación-, infecciosas (fiebre reumática, endocarditis bacteriana), alteración mixomatosa del soporte del aparato valvular, dilatación del anillo valvular y disección aórtica (relacionadas o no a enfermedades del colágeno como el síndrome de Marfan o Ehlers-Danlos). Otras causas menos prevalentes también descriptas son las secundarias a injurias traumáticas, espondilitis anquilosante, aortitis sifilítica, osteogénesis imperfecta, artritis reumatoidea, síndrome antifosfolipídico y las relacionadas al uso de drogas anorexígenas. 2 En un estudio prospectivo de 104 pacientes con IA crónica, en un 35% la etiología era de origen desconocido, 26% secundaria a dilatación idiopática de la raíz aórtica, 13% a anomalías congénitas, 12% por enfermedad cardiaca reumática, 10% secundaria a endocarditis infecciosa y 7% por enfermedad valvular degenerativa. 3 Un estudio diferente de 246 pacientes observó un 40% asociada a causa degenerativa, 28% por alteraciones congénitas, 19% por dilatación de la raíz aórtica, 6% por causa reumática, 3% por aortitis y 3% por endocarditis. 4 Esos números solo representan una estimación grosera debido a que los cambios demográficos en la edad de la población, el estado socio-económico y la ubicación geográfica pueden afectar la prevalencia de las diferentes enfermedades. 1
3 Fisiopatología De este modo, existen múltiples condiciones clínicas que pueden afectar de tal manera la válvula dando lugar a inadecuada aposición de las valvas o cúspides y conducir a prolapso, movimiento valvar restringido, ruptura o perforación valvular. Entre estas causas podemos diferenciar aquellas capaces de desencadenar cuadros agudos y dramáticos con incremento significativo de las presiones de llenado y bajo gasto cardiaco como las secundarias a disección, endocarditis bacteriana o traumáticas. 5 Insuficiencia aórtica aguda: En la IA aguda la particularidad más notable es la sobrecarga aguda de volumen que se impone al ventrículo izquierdo con el consecuente incremento súbito y dramático de las presiones de fin de diástole y auricular izquierda. Esta situación pone en acción el mecanismo de Frank- Starling pero la incapacidad del ventrículo izquierdo de desarrollar una dilatación compensatoria de la cámara deriva en una disminución del volumen expulsivo anterogrado. Esto da a lugar a la frecuente presentación de estos pacientes en edema pulmonar, bajo gasto o shock cardiogénico. 5 En la IA aguda, desde el punto de vista diagnostico, se observa que los signos habituales de la fase crónica suelen estar modificados o ausentes lo cual puede derivar en una minimización de la gravedad de la misma. En particular, la ecocardiografía es imprescindible para confirmar el diagnostico y la severidad de la IA, definir su causa y estimar el valor de la presión sistólica pulmonar. En forma adicional, es posible evaluar la rápida equilibración de la presión intraventricular a través de la observación de un tiempo de hemipresión acortado, del tiempo de desaceleración mitral prolongado (ver diagnostico por Doppler pulsado) o del cierre prematuro de la válvula mitral. La ecocardiografía transesofágica, la resonancia magnética o la tomografía computada deben ser utilizadas ante la sospecha de disección aórtica las cuales permitirán una pronta identificación y manejo terapéutico adecuado. 6 7 En cuanto al enfoque terapéutico, la intervención quirúrgica de urgencia es la recomendación más acertada en la gran mayoría de los casos ya que el desenlace fatal secundario a colapso circulatorio o disociación electromecánica es la evolución habitual sin el tratamiento específico. El tratamiento médico con drogas vasodilatadoras puede llegar a ser de utilidad solo en el manejo temporario de los pacientes previo a la intervención quirúrgica. Insuficiencia aórtica crónica: En la IA crónica se ponen en marcha una serie de mecanismos compensatorios en respuesta a la sobrecarga de volumen, a diferencia de la presentación aguda, que incluyen un incremento en el volumen de fin de diástole, en la complacencia de la cámara y en una combinación de hipertrofia parietal excéntrica y concéntrica del ventrículo izquierdo. 5 De esta manera se logran mantener dentro del rango normal los índices de función sistólica (fracción de eyección y fracción de acortamiento). En la etapa compensada la mayoría de los pacientes permanecen asintomáticos, lo cual puede durar décadas. Sin embargo el incremento en el tamaño ventricular aunado al incremento del stress parietal conlleva a un incremento subsecuente de la postcarga de VI y una estimulación a un mayor desarrollo de hipertrofia 2
4 parietal, produciendo una combinación de sobrecarga de volumen y presión. 8 Es importante tener en cuenta que no existe una única medición hemodinámica que represente los limites absolutos entre la función sistólica normal y anormal y la transición a este ultimo estado puede ser insidiosa representando un continuun que acontece una vez que se desequilibra el balance entre el exceso de postcarga, la reserva de precarga y la hipertrofia parietal. La gran mayoría de los trabajos científicos han identificado a la función sistólica de ventrículo izquierdo (fracción de eyección y/o fracción de acortamiento) y el tamaño de fin de sístole como los más importantes predictores de sobrevida y función ventricular postoperatoria en pacientes sometidos a reemplazo valvular por IA crónica Historia natural de la insuficiencia aórtica Si bien no existen estudios a gran escala de la historia natural de la IA podemos considerar que ésta depende de dos variables preponderantes: El estado de la función del ventrículo izquierdo. El estado sintomático del paciente. Pacientes con IA crónica grave pueden permanecer asintomáticos por muchos años, aun décadas, a pesar de la sobrecarga de volumen. Con el tiempo pueden aparecer síntomas de angina o disnea y en ese punto asociarse a un daño significativo e irreversible de la función ventricular izquierda. Por este motivo, los pacientes asintomáticos con función sistólica de VI preservada deben ser seguidos con una cuidadosa valoración clínica para evaluar la aparición de nuevos síntomas y con estudios no invasivos en forma seriada para determinar el estado la función ventricular. 12 La tabla 1 resume la relación entre la presencia de síntomas con el estado contráctil del ventrículo izquierdo basados en distintas series observacionales. 5 Tabla 1. Historia natural de la insuficiencia aórtica Asintomáticos con función de VI normal Progresión de síntomas y/o disfunción de VI Progresión a disfunción de VI asintomáticos Muerte súbita Asintomáticos y disfunción de VI Progresión a síntomas cardiacos Pacientes sintomáticos (angina) no sometidos a RVA Mortalidad Pacientes sintomáticos (ICC) no sometidos a RVA Mortalidad 4.3%/año 1.2%/año <0.2%/año >25%/año >10%/año >20%/año VI: ventrículo izquierdo, ICC: insuficiencia cardiaca congestiva; RVA: reemplazo valvular aórtico Además, los pacientes en riesgo de eventos cardiovasculares futuros pueden ser identificados en base a las siguientes variables: Edad Diámetro o volumen de fin de sístole de VI 3
5 Diámetro o volumen de fin de diástole de VI Fracción de eyección de reposo y durante el ejercicio En el grupo de pacientes asintomaticos, Bonow y col. observaron en un periodo de seguimiento de 8 años, que aquellos con un diámetro de fin de sístole inicial mayor de 50 mm tenían una probabilidad de muerte, síntomas y/o disfunción ventricular del 19%, mientras que en los que tenían una dimensión de 40 a 50 mm la probabilidad fue de 6% por año y esta fue del 0% con un diámetro menor a 40 mm. 13 (Figura 1) Con el advenimiento de la ecocardiografía Doppler, gracias a su sensibilidad para lograr la detección de reflujos aun en válvulas estructuralmente normales, hoy en día es posible reconocer grados leves de compromiso valvular y poder evaluar su progresión en relación con la gravedad del reflujo (ver pronostico y progresión hemodinámica). Diagnóstico En la IA, la evaluación clínica inicial provee importante información para arribar a su diagnóstico. Habitualmente la presentación clínica es variable y depende de un complejo interjuego de un número de factores que incluyen: su tiempo de evolución (aguda vs. crónica), la complacencia aórtica y de la cámara ventricular, las condiciones hemodinámicas y la severidad de la lesión. 14 Una variedad de signos clínicos han sido descriptos en la IA. La presencia del soplo diastólico, el desplazamiento del latido apexiano y los hallazgos periféricos característicos que reflejan la amplitud en la presión del pulso son datos relevantes en la evaluación clínica inicial. 5 En algunos pacientes, un soplo meso y tele-diastólico puede ser escuchado, posiblemente a causa de la vibración de la valva anterior mitral cuando esta recibe el chorro del jet de reflujo de IA dirigido posteriormente. 15 Clínicamente, pulsos arteriales prominentes, una incrementada presión de pulso con baja presión diastólica, un soplo diastólico intenso 16 y la presencia de un tercer ruido cardíaco son signos de IA grave, pero no siempre específicos. 17 En la IA aguda el soplo diastólico puede estar ausente a causa de la rápida equilibración de las presiones diastólicas aórtica y de ventrículo izquierdo. Frente a la sospecha clínica de IA se debe realizar una ecocardiograma para confirmar o excluir su presencia. La ecocardiografía Doppler es la técnica disponible más sensible para la detección de insuficiencia valvular en válvulas nativas. 18 También es el método de elección en la re-evaluación de las lesiones regurgitantes y en la determinación del momento de la intervención quirúrgica. 19 Así, la ecocardiografía en la IA crónica esta indicada para: (figura 2) Confirmar el diagnostico de IA si existen dudas basadas en el examen físico Evaluar la causa de la IA y evaluar la morfología valvular Proveer una valoración semicuantitativa y cuantitativa de la gravedad de la IA Evaluar la dimensión ventricular izquierda, la masa ventricular, la función sistólica y el grado de hipertensión pulmonar 4
6 Evaluar la raíz aórtica Estimación de la gravedad de la insuficiencia aórtica La determinación de la gravedad del reflujo es el primer paso en la evaluación de pacientes con IA y puede ser determinada mediante la ecocardiografía. La evaluación ecocardiográfica de los pacientes con insuficiencia valvular aórtica esta basada en la utilización completa y pormenorizada de la combinación de la ecocardiografía bidimensional, las imágenes de flujo color y las técnicas de Doppler continuo y pulsado. 5 De este modo, estas modalidades son usadas través de una combinación de determinaciones cuali y cuantitativas, donde no solo se debe evaluar la presencia de la IA, sino también la determinación de su origen y gravedad así como la repercusión de la lesión sobre el tamaño y la función ventricular izquierda y pueden ser extraídas en un único examen. Estas determinaciones tienen sus ventajas y limitaciones. Si bien las mediciones cualitativas o semicuantitativas con la medición del área y ancho del jet por Doppler color son usadas en forma habitual y generalizada, las mediciones cuantitativas usualmente exigen mayor tiempo y experiencia por los cual son usadas de manera más selectiva. 18 Las mediciones indirectas de la severidad de la IA, la pendiente de descenso del flujo diastólico, el flujo diastólico reverso en aorta torácica y abdominal, el tiempo de hemipresión del reflujo diastólico y la velocidad del flujo en el tracto de salida de VI son complementarias y útiles para ayudar a la valoración del reflujo valvular. 20 Ecocardiografía modo M y bidimensional En la ecocardiografía modo M es posible observar hallazgos característicos como son el incremento de la separación entre el punto E y el movimiento más posterior del septum interventricular que se observa cuando el jet de regurgitación impacta sobre la valva anterior mitral produciendo su abombamiento (doming reverso) con restricción de su apertura. Del mismo modo, también como consecuencia de impacto del jet sobre la valva anterior mitral, es posible observar el temblor diastólico fino de de alta frecuencia más notorio con el modo M que en imágenes bidimensionales. La evaluación con la ecocardiografía bidimensional en la IA es la modalidad que nos permite una valoración más adecuada de la estructura valvular, la posible etiología de la lesión así como el impacto de la sobrecarga de volumen sobre las cámaras cardiacas, su función y la presencia de otras lesiones asociadas. La IA puede estar relacionada a alteraciones de la raíz o a anomalías de las valvas. 19 Una observación inicial que permita detectar anomalías estructurales congénitas, el grado de calcificación, dilatación del anillo, movimiento flail de las valvas o la presencia de masas adheridas nos orientan rápidamente hacia la posible etiología y nos da pautas indirectas de la severidad del reflujo. Las alteraciones estructurales de la válvula que derivan en compromiso estenótico también pueden ocasionar IA secundaria a la perdida de flexibilidad de las valvas o una alteración estructural que genera una inadecuada coaptación valvar. El compromiso mixoide, que puede asociarse al de la válvula mitral, produce un engrosamiento y redundancia de las valvas con abombamiento de estas con convexidad hacia el tracto de salida de VI en diástole. Las masas asociadas nos inclinan a la posibilidad de estar frente a un compromiso infeccioso que afecte el cierre valvar o produzca una perforación de las mismas 5
7 con el consiguiente reflujo. En cuanto a la raíz aórtica, la ecocardiografía bidimensional, permite estimar sus diámetros para evaluar la presencia de dilatación anular que puede ser secundaria a hipertensión arterial crónica, necrosis cística de la media o síndrome de Marfan. Este último, a diferencia de la necrosis cística de la media, se caracteriza por dilatación de la raíz con borramiento de la unión sinotubular y la dilatación anular y de los senos de Valsalva. La disección aórtica puede dar lugar a IA por compromiso del anillo, por el mismo proceso disecante con afectación de las valvas o por prolapso del flap de disección que condiciona la coaptación valvar. Otro aspecto importante que permite definir la ecocardiografía bidimensional se refiere al compromiso de la cámara cardiaca que recibe el flujo regurgitante. Los cambios adaptativos que ocurren a nivel del ventrículo izquierdo están en relación a la duración (aguda o crónica) y severidad de la regurgitación. En una primera instancia el ventrículo izquierdo aumenta sus diámetros sin incremento significativo del grosor parietal que deriva en un aumento del stress parietal. Posteriormente, la IA crónica significativa, da lugar a una dilatación de la cámara ventricular izquierda con mayor desarrollo de hipertrofia parietal. En forma característica, el tamaño ventricular izquierdo incrementa lentamente a largo de los años sin generar necesariamente un deterioro de la función sistólica. En este punto, hay que tener en cuenta que, en forma aislada la progresiva dilatación observada durante el seguimiento ha demostrado ser un predictor de la necesidad de cirugía. 13 En esta etapa, la fracción de eyección permanece dentro de límites normales (pero no con comportamiento hipernormal), puesto que el volumen expulsivo ventricular izquierdo es eyectado a través de la válvula aórtica a la vasculatura sistémica de alta impedancia (a diferencia de lo que ocurre en la insuficiencia mitral). Gsaach y col. observaron que a través de la estimación una relación entre el radio de la cavidad y el espesor de la pared multiplicado por la presión sistólica de VI >600 mmhg (stress pico sistólico) junto con un diámetro de fin de sístole de VI >2.6 cm/m 2 permitían identificar a aquellos pacientes en los cuales se observaba persistencia de la dilatación ventricular en el periodo postoperatorio del reemplazo valvular. 21 De este modo, la ecocardiografía bidimensional provee importante información considerando la anatomía valvular y las deformidades estructurales, la presencia y severidad de la dilatación de la raíz aórtica y la adaptación del ventrículo izquierdo a la sobrecarga de volumen por lo cual se ha transformado en una herramienta indispensable para el seguimiento de los pacientes con diagnostico de IA. Su uso en forma seriada permite evaluar la progresión de la regurgitación y su impacto sobre la estructura y función de las cámaras cardiacas y ayuda a determinar las estrategias de manejo y el momento de la intervención quirúrgica. Doppler color La valoración de la gravedad de la IA por medio de la utilización del Doppler color es ampliamente usada mayormente por su simplicidad y disponibilidad en tiempo real. 22 El flujo regurgitante puede ser examinado por el Doppler color en múltiples planos de imágenes que permiten definir su largo, ancho y altura y reconocer los 3 componentes fundamentales del mismo que pueden ser visualizados: la región del flujo de convergencia en la aorta, la vena contracta a través del orificio regurgitante y la dirección y 6
8 tamaño del jet que penetra al ventrículo izquierdo. 23 Tanto las vistas de eje largo y corto paraesternal así como las de 4 cámaras y eje largo apical son útiles para evaluar el origen, dirección y longitud del jet (Figura 3). La distancia que este penetra en la cámara ventricular izquierda es frecuentemente usada como indicador de la severidad de la IA, sin embargo en forma similar a otras valvulopatías, podemos reconocer limitaciones relativas a su utilización en forma aislada. 24 Es dependiente del operador ya que pequeñas angulaciones del transductor pueden variar la visualización del jet y su tamaño La morfología de la válvula aórtica afecta el ancho y dirección del jet ya que el orificio regurgitante no es perfectamente circular y puede haber suficiente variabilidad en la estimación de la gravedad derivado también de la forma del jet. Si esta no esta bien definida, con bordes paralelos al tracto de salida de VI, es difícil conocer donde realizar la medición como su excentricidad puede también afectar una adecuada valoración de la severidad. 25 Utilizando este método, la evaluación más adecuada es la medición de la relación porcentual entre el ancho de la base del jet en la vista de eje largo paraesternal y el diámetro del tracto de salida de VI y entre el área del jet en el eje corto paraesternal y su relación con el área del tracto de salida de VI, ya que presenta una buena correlación con la valoración angiográfica por medio del cateterismo cardiaco. 26 Las vistas paraesternales son preferidas sobre las apicales a causa de su mejor resolución axial. El criterio utilizado para estimar la severidad de la IA son una relación 65% para el ancho del jet y 60% para el área de jet (Tabla 4). Sin embargo, en la práctica diaria, la evaluación de la IA basada en estas estimaciones recae mayormente sobre la estimación visual más que en una medición cuantitativa directa y sirve como un indicador grosero del grado de IA. Otra valoración útil derivada del análisis de la IA con el Doppler color es la medición del diámetro de la vena contracta. Esta se define como la región más estrecha del flujo al nivel de la válvula aórtica, inmediatamente debajo de la región de flujo de convergencia. Este diámetro es significativamente más pequeño que aquel medido a nivel del tracto de salida de VI, analizado previamente, a causa de que el jet se expande inmediatamente después de la vena contracta. En forma similar a la estimación del ancho del jet en el tracto de salida de VI, la vista paraesternal es útil para su valoración. 27 La vena contracta permite obtener una estimación próxima al tamaño del área del orificio regurgitante efectivo (AORE). Entre las ventajas de la medición de la vena contracta esta el hecho que es simple, reproducible y factible de realizar tanto por medio de la ecocardiografía transtorácica como transesofágica, 28 con una mayor confiabilidad que la medición del ancho y área del jet regurgitante a nivel del tracto de salida de VI. Ante la presencia de jets múltiples o irregulares, la estimación desde la vista de eje corto podría ser más útil. 29 Los criterios utilizados para definir severidad con el uso de la vena contracta son un diámetro mayor de 0.5 cm (priorizando una mayor sensibilidad), 0.7 cm si deseamos una mayor especificidad y un punto de corte de 0.6 combinando una sensibilidad y especificidad adecuadas. 18 (Figura 4) 7
9 La valoración de la severidad de la IA por medio de la cuantificación del AORE con el método del flujo de convergencia proximal (PISA) no está tan diseminada como en la insuficiencia mitral. En forma similar a esta ultima, es necesario ajustar el limite Nyquist y magnificar la imagen mediante el uso del zoom en la vista apical fundamentalmente (o bien utilizar vistas alternativas como la para-apical o desde el borde esternal derecho) para lograr una buena definición del flujo de convergencia proximal. Este método ha demostrado proveer una estimación cuantitativa precisa de la IA a través de la estimación del AORE. 30 Sin embargo, su factibilidad en mucho menor que para los pacientes con insuficiencia mitral, básicamente derivado en la dificultad de obtener imágenes de alta calidad de la región del flujo de convergencia. Otras alteraciones estructurales de la válvula o la raíz pueden afectar la exactitud de la valoración. Las guías actuales proponen un valor de AORE 0.30 cm 2, un volumen regurgitante 60 ml/latido y una fracción regurgitante 50% para definir a una IA como grave. 5, 31, 32 (tabla 4) Doppler pulsado Una primera aproximación con la utilización del Doppler pulsado en la IA se basa en la valoración de la profundidad de la señal del flujo diastólico dentro de la cavidad de VI, método que es ampliamente aplicable y reproducible pero con baja especificidad. Normalmente es posible observar la presencia de un breve flujo reverso en la aorta. La valoración de la IA mediante la evaluación del flujo reverso a nivel aórtico con la utilización del Doppler pulsado permite una estimación confiable para valorar la gravedad de la lesión (figura 5). La presencia de flujo reverso holo-diastólico en la aorta abdominal usando una vista subcostal longitudinal es altamente sensible y específica. 18 Su presencia a nivel de la aorta descendente torácica a nivel del istmo usando una vista supraesternal o en la aorta descendente inferior.también tiene una alta sensibilidad pero poca especificidad para la determinación de la gravedad de la IA ya que es también posible de observarlo en presencia de un reflujo moderado. El incremento del reflujo genera un aumento en la duración y la velocidad del flujo reverso. 33 Índices relacionados como: la velocidad del flujo reverso al final de la diástole, la integral de la velocidad/tiempo del flujo reverso y la relación de flujo reverso a la velocidad del flujo anterógrado en la aorta descendente han sido propuestos como valoraciones semi-cuantitativas útiles para estimar la gravedad de la IA. 34 Un flujo reverso holo-diastólico prominente con una integral de tiempo diastólico similar al tiempo sistólico es un adecuado signo cualitativo de IA severa. Con el Doppler pulsado también es posible evaluar las diferencias entre el flujo trans-aórtico y transmitral o pulmonar para la cuantificación del volumen y la fracción regurgitante de la IA. 35 El volumen expulsivo total también puede ser derivado de la medición cuantitativa del volumen de fin de diástole y del fin de sístole por ecocardiografía bidimensional. El AORE puede ser calculado del volumen expulsivo regurgitante y la integral velocidad tiempo del jet regurgitante por medio del Doppler continuo. Como con el método de PISA, un volumen regurgitante 60 ml, una fracción regurgitante 50% y un AORE 0.30 cm 2 son consistentes con IA grave. La existencia de insuficiencia mitral significativa (superior a leve) 8
10 impide una determinación adecuada por medio del Doppler cuantitativo a menos que el flujo pulmonar sea usado para el cálculo del flujo sistémico. 18 Finalmente, las características del llenado ventricular pueden alterarse con la gravedad de la regurgitación: mientras que en la IA leve a moderada habitualmente se observa un patrón de llenado ventricular a predomino telediastólico, en las formas graves el patrón es del tipo restrictivo (relación E/A >2). 36 A pesar de la utilidad del Doppler pulsado debemos conocer sus limitaciones: Reflujos excéntricos que no se puedan rastrear adecuadamente son subestimados. Necesidad de alto grado de experiencia del operador para las determinaciones cuantitativas. El estudio consume demasiado tiempo. Los estados de bajo gasto y/o presión diastólica elevada no permiten la propagación del jet dentro de la cavidad VI y suele ser subestimados. Un VI muy complaciente permite que el jet de alta velocidad de la insuficiencia aórtica penetre en la cavidad ventricular y puede ser sobrevalorado. La complacencia reducida de la aorta presente en pacientes con edad avanzada puede prolongar el flujo diastólico reverso normal en ausencia de IA significativa. La estenosis mitral asociada que presenta un jet turbulento en diástole y puede diagnosticarse erróneamente como IA. La presencia de insuficiencia mitral significativa impide una adecuada valoración por medio del Doppler cuantitativo (se puede usar el flujo pulmonar) Doppler continuo Con el Doppler continuo se pueden medir altas velocidades, sacrificando resolución en el rango Desde la vista apical se obtiene imágenes de la señal de Doppler continuo en la IA con un ángulo de intersección paralelo entre el flujo regurgitante y la dirección del flujo sanguíneo. Ocasionalmente, en presencia de reflujos excéntricos, con dirección anterior o posterior, es necesario utilizar las vistas paraesternales. El patrón espectral del Doppler continuo en la IA comienza con el cierre de la válvula aórtica, incrementa rápidamente su velocidad hasta un máximo de 3 a 5 m/s y declina en forma gradual durante la diástole. La densidad de la señal de Doppler continuo espectral en pacientes con IA refleja el volumen de la regurgitación, especialmente cuando se compara con la densidad del espectro anterógrado. Mientras que un espectro débil es compatible con IA leve o trivial, existe significativa superposición entre regurgitación moderada y severa. Por esto, la densidad por Doppler continuo es un indicador grosero de la severidad de la IA. La tasa de desaceleración y el tiempo de hemipresión del jet diastólico regurgitante reflejan la tasa de igualación de las presiones diastólicas de VI y aórtica. (Figura 6) El grado de declinación de la velocidad del flujo regurgitante de la IA medido por el Doppler continuo se utiliza para evaluar su gravedad y también su cronicidad. Una rápida declinación en la velocidad 9
11 (pendiente de desaceleración pronunciada) esta en relación con IA grave. Esto se basa en el principio que en la IA leve el gradiente de presión entre la aorta y el VI se mantiene durante toda la diástole y que cuando es grave este gradiente rápidamente se disipa por el aumento de la presión diastólica en el VI y la disminución de la presión aórtica. Un tiempo de desaceleración >4 m/s sugiere IA grave. El tiempo de hemipresión es el tiempo requerido para que el gradiente de presión máxima diastólica decaiga un 50%. Este se acorta a medida que se incrementa la gravedad de la IA, la velocidad del jet diastólico tardío es mas baja, y por esto el tiempo de hemipresión es mas corto. Hay una relación inversa entre la velocidad de hemipresión y el grado angiográfico de la IA. Un tiempo de hemipresión >500 mseg. es usualmente compatible con IA leve mientras que un valor <200 mseg se considera asociado a IA severa. 18 Hay que tener en cuenta que la velocidad diastólica de la IA está también determinada por la complacencia y la presión ventricular izquierda, por lo tanto el tiempo de hemipresión puede estar todavía más acortado por una elevada presión diastólica o por el tratamiento con drogas vasodilatadoras que reducen el grado de IA. Asimismo, el tiempo de hemipresión puede estar incrementado o bien, normalizado, con la adaptación crónica del VI a la IA severa. Papel del ecocardiograma transesofágico El ecocardiograma transesofágico (ETE) raramente es necesario para evaluar la gravedad de la IA dado que la proximidad de la válvula aórtica al tórax desde las distintas ventanas transtorácicas permiten en general una buena definición de la válvula y su flujo. En ocasiones, sin embargo, el ETE tiene un valor adicional cuando estamos frente a pacientes con pobres ventanas acústicas y es preciso evaluar en forma adecuada la anatomía, la etiología de la lesión (figura 7), un registro Doppler preciso o el diámetro de la aorta ascendente. Esta última valoración es una información relevante para definir la técnica, el tamaño de prótesis valvular o de aorta ascendente que requiere el paciente. 37 Recientemente ha sido descripta una clasificación funcional de la IA, de modo similar a aquella de la válvula mitral realizada por Carpentier, que hace foco en los mecanismos de la disfunción valvular y provee al cirujano una descripción funcional de las lesiones aórticas que le pueden ayudar a elegir la técnica quirúrgica más apropiada, entre ellas la posibilidad de reparar la válvula sin necesidad del reemplazo. 38 La tabla 2 resume esta clasificación combinando la información derivada de la visión quirúrgica directa y del ETE y la figura 8 muestra ejemplos de ella. 10
12 Tabla 2. Clasificación quirúrgica y por ecocardiografía transesofágica de las lesiones aórticas regurgitantes Descripción Ejemplos Tipo 1 Dilatación de la raíz aórtica con Dilatación del anillo, raíz, senos de cúspides normales Valsalva o unión sino-tubular Tipo 2 Prolapso parcial, total y válvula Prolapso de las cúspides o flail (completa eversión de la fenestración cúspide al TSVI) Tipo 3 Pobre calida y cantidad del tejido de las cúspides con retracción y engrosamiento Calcificación severa, endocarditis TSVI: tracto de salida de VI. Modificado de El Khoury G, et al. Opin Cardiol. 2005;20: A menos que estén severamente calcificadas, muchas IA con lesiones del tipo 1 y 2 son consideradas potenciales reparables, esto es por medio de alguna forma de cirugía conservadora. En este sentido un trabajo reciente concluyó que el ETE provee una altamente precisa valoración funcional y anatómica de todos los tipos de lesiones que originan IA, además de ser un predictor fuerte e independiente de reparabilidad valvular y evolución postoperatoria. 39 Los criterios utilizados para definir la gravedad de la lesión valvular con el ETE se aplican en forma similar a aquellos usados con la ecocardiografía transtorácica, incluso tanto el ancho del jet regurgitante como la vena contracta pueden mostrar una calidad de imagen mejorada en algunos pacientes. Solo es necesario tener especial atención a la ubicación paralela del haz de ultrasonido con la dirección del jet regurgitante debido a la mayor dificultad que presenta el ETE en este sentido y pueda dificultar una adecuada valoración con el Doppler pulsado y continuo para la estimación del volumen y fracción regurgitante. Con la angulación apropiada se puede medir la magnitud del flujo de convergencia proximal y registrar el flujo reverso diastólico en la aorta ascendente. Las siguientes son las recomendaciones de indicación de ecocardiograma transesofágico en la IA propuestas por el Consenso de Valvulopatias de la Sociedad Argentina de Cardiología. 32 (Tabla 3) Tabla 3. Indicación de ecocardiograma-transesofágico en la insuficiencia aórtica (Consenso de la Sociedad Argentina de Cardiología) Clase I - Frente a un ecocardiograma transtorácico inadecuado para precisar el diagnóstico y/o para evaluar la gravedad de una insuficiencia aórtica. (C) - Con un ecocardiograma transtorácico inadecuado para evaluar la posibilidad de efectuar una reparación valvular. (B) 11
13 - En pacientes con insuficiencia aórtica en la que se sospecha disección aórtica como mecanismo productor. (A) - En la evaluación intraoperatoria durante una reparación plástica valvular, operación de Ross u homoinjerto. (B) Clase III - Seguimiento de rutina de una insuficiencia aórtica severa. Integración de los recursos de evaluación de insuficiencia aórtica por Ecocardiografía La evaluación de la IA por ecocardiografía Doppler es un proceso integral y comprehensivo basado en toda la información recolectada durante el examen. Los pasos a seguir en forma rutinaria en todos los casos de pacientes portadores de IA deben estar basados en una evaluación anatómica y funcional de la válvula aórtica, el tamaño y la función ventricular, una evaluación del flujo color de ancho del jet proximal y si es posible de la vena contracta. Deben registrase la velocidad del jet regurgitante a nivel del tracto de salida de VI y la velocidad en la aorta descendente proximal y/o abdominal para evaluar la presencia de flujo diastólico reverso (Doppler pulsado). La señal de Doppler continuo del jet de IA es útil en la medida que sea de buena calida para evaluar su densidad, la pendiente de desaceleración y el tiempo de hemipresión. La tabla 4 resume los criterios usados para definir la gravedad de la IA. Tabla 4. Criterios ecocardiográficos de gravedad en la insuficiencia aórtica crónica Leve Moderada Grave Tamaño de VI Normal Incrementado Mapeo del reflujo Tracto de salida del VI Hasta el vértice de la Hasta la mitad apical válvula mitral del VI Flujo holodiastólico reverso en aorta descendente No-Sí Sí Sí Flujo holodiastólico reverso en aorta abdominal No No Sí Pendiente de desaceleración del jet regurgitante <2 m/s Valores intermedios >4 m/s Tiempo de hemipresión >500 ms Valores intermedios <200 ms Diámetro de la base del jet <25% del TSVI 25%-65% del TSVI >65% del TSVI Vena contracta (cm) > >0.6 Volumen regurgitante (ml/latido) < >60 Fracción regurgitante (%) < AORE (cm 2 ) < VI: ventrículo izquierdo; AORE: Área del orificio regurgitante efectivo; TSVI: tracto de salida de ventrículo izquierdo 12
14 Si la IA es determinada como leve o menos usando esos signos, no son necesarias más determinaciones. Si esos parámetros son sugestivos de IA más que leve y la calidad de datos primarios permite una cuantificación, es razonable determinar cuantitativamente la severidad de la IA, incluyendo el volumen, la fracción regurgitante y el área del orificio regurgitante efectivo así como los índices de sobrecarga de volumen de VI. El volumen y la fracción regurgitante se corresponden mas adecuadamente con el grado angiográfico de reflujo en pacientes con IA aislada. Desde el punto de vista pronostico, las estimaciones cuantitativas han demostrado ser en conjunto poderosas predictores independientes de evolución clínica en pacientes con IA grave asintomáticos, por lo cual la 40, 41, 42 recomendación de su valoración en esta población debe ser fuertemente sugerida. Sin embargo estas estimaciones presentan algunas limitaciones: Son mediciones que consumen tiempo y pueden dar lugar a errores en la estimación derivadas de la posibilidad de error de medición de las variables que se incluyen en su determinación No es adecuado utilizarlas en presencia de derivaciones intracardiacas o extracardiacas ya que afectan el flujo transvalvular La estimación está afectada en presencia de obstrucción del tracto de salida VI, por ejemplo, lesiones estenóticas. También se utiliza la estimación de la fracción regurgitante comparando el área del flujo reverso diastólico y el flujo sistólico en la aorta torácica, con una buena correlación (0,9) con la fracción regurgitante angiográfica. El AORE es un índice del grado de lesión valvular y se calcula con el principio de la continuidad, correspondiendo al área de la vena contracta. Es más pequeña que el área anatómica y se correlaciona bien con el área estimada por la fórmula de Gorlin. Teóricamente, es independiente de la frecuencia cardiaca, de la complacencia del VI y de las condiciones de carga en el momento del examen. Sin embargo esta estimación no esta exenta de limitaciones: En la dilatación de la aorta ascendente >48 mm de diámetro ya que la ecuación de continuidad asume un perfil plano del flujo retrógrado supravalvular. No es totalmente independiente de las condiciones de carga. Es dependiente del incremento de la presión aórtica ya que si esta aumenta, el AORE también se incrementa. Es necesario contar con familiaridad con el método, experiencia y conlleva un consumo de tiempo excesivo Su factibilidad esta limitada por la calidad de las imágenes En forma similar a la insuficiencia mitral cuando la evidencia de los distintos parámetros es congruente, es sencillo estimar la gravedad de la IA. Cuando los diferentes parámetros son contradictorios, uno deben mirar cuidadosamente razones técnicas y fisiológicas para explicar esas discrepancias teniendo en cuenta los componentes que tienen la mejor calidad de datos primarios y son los mas precisos considerando la condición clínica subyacente. También, deben tenerse en cuenta otras alternativas de 13
15 evaluación de la IA fundamentalmente cuando existe discordancia entre la valoración clínica y los 43, 44 métodos ecocardiográficos, e incluyen los estudios de reposo y apremio con radionucleidos, el cateterismo cardiaco, 45 la tomografía computada 46, 47 y la resonancia nuclear magnética. 48 Progresión hemodinámica y pronostico de la insuficiencia aórtica Pocos estudios evaluaron la progresión hemodinámica de la IA. En un trabajo con 127 pacientes con IA y, por lo menos, dos estudios ecocardiográficos en el seguimiento, la gravedad de la IA aumentó un 30%, siendo el principal factor pronóstico de la progresión, el grado de reflujo en el examen basal. 49 Los pacientes con IA grave presentan la mayor tendencia a la dilatación ventricular progresiva, con gran incremento de los volúmenes y la masa ventricular. En este estudio, los pacientes con válvula bicúspide presentaban mayor prevalencia de IA grave que los que presentaban válvula tricúspide (52% comparado con el 4%, p<0,001). Estas afirmaciones pueden apreciarse en la figuras 9a y 9b. Insuficiencia aórtica leve Los grados de reflujo leves se pueden detectar por la ecocardiografía en los pacientes que consultan por otras indicaciones clínicas. Si bien la historia natural de la IA leve no es del todo conocida, la gran mayoría de los pacientes no desarrollan grados severos de compromiso valvular en el seguimiento. Aun así, es posible identificar grupos de pacientes en mayor riesgo de progresión del reflujo aórtico leve: Pacientes jóvenes con válvula bicúspide. Pacientes con dilatación de la raíz aórtica. Pacientes con enfermedad aórtica (estenosis e insuficiencia). Insuficiencia aórtica de grado moderado a grave Muchos de los pacientes con IA significativa permanecen asintomáticos durante largos períodos de tiempo sin deterioro de la función contráctil del ventrículo izquierdo. En un estudio prospectivo con 104 pacientes asintomáticos con IA crónica grave y función ventricular normal, 19 fueron sometidos a un reemplazo valvular por presentar síntomas, cuatro desarrollaron disfunción ventricular asintomática y dos murieron súbitamente. 13 La tasa global de eventos fue de 5%/año con una sobrevida libre de eventos a los 11 años de 58% 9%. En el análisis multivariado por regresión de Cox, los factores pronósticos independientes fueron el diámetro de fin de sístole inicial y la tasa de cambio en el tiempo de la fracción de eyección de reposo evaluada por radionucleidos. Otro estudio reciente que incluyó 104 pacientes asintomáticos con IA grave seguidos durante años, demostró la presencia de síntomas y necesitaron un RVA en 28 (72%), siete pacientes 14
16 desarrollaron dilatación del VI (18%) y cuatro (10%) tuvieron una muerte súbita. 50 La tasa global de eventos fue de 6.2%/año. En el análisis multivariado los factores pronósticos que se asociaron a los eventos fueron el cambio en la fracción de eyección del VI de reposo al máximo del ejercicio, normalizada por el cambio del estrés de fin de sístole en el ejercicio (Figura 10). Dujardin evaluó 246 pacientes con IA moderada y grave diagnosticadas por medio del ecocardiograma Doppler. El 50% de los pacientes se encontraba en clase funcional I, 26% en clase funcional II y 24 % en clase funcional III-IV cuando ingresaron al estudio. 51 A 10 años el 75 3% de los pacientes murieron o necesitaron cirugía y el 83 3 % presentaron eventos cardiacos como se observa en las figuras 11 y 12. En el análisis multivariado, los factores pronósticos fueron la edad (p <0,001), clase funcional (p <0,001), índice de comorbilidad (p =0,033), fibrilación auricular (p =0,002) y el índice de diámetro de fin de sístole (p =0,025). La fracción de eyección también fue un factor predisponente de mortalidad y de sobrevida postoperatoria (p <0,001). Recientemente, Falconi y col. evaluaron 254 pacientes con IA grave aislada asintomáticos al ingreso. 40 Los predictores de disfunción ventricular izquierda y/o desarrollo de síntomas fueron el: AORE >60 mm 2, el diámetro de fin de diástole corregido por superficie corporal >36 mm/m 2, el diámetro de fin de sístole corregido por superficie corporal (DFSSC) >24mm/m 2, cambio en la fracción de eyección con ejercicio <5%, edad >70 años y el diámetro de raíz aórtica >45 mm. La figura 13 presenta la relación de la progresión del AORE y el DFSSC con el desarrollo de síntomas, disfunción de VI y reemplazo valvular. Derivado del estudio citado previamente, el mismo grupo consideró aplicar un score de riesgo para identificar pacientes con IA grave susceptibles de una peor evolución. Para tal fin fueron evaluados 294 pacientes consecutivos con IA grave asintomática (edad media: 63±7 años; 71% sexo masculino y Fey: 64% ± 5%), con la aplicación de un score basado en : l) diámetro de fin de sístole >24 mm/m 2 ; 2) diámetro de fin de diástole >36 mm/m 2 ; 3) área del orificio regurgitante efectivo (AORE) > 60 mm2; 4) diámetro de la raíz aórtica (DRA) > 45 mm; 5) edad > 70 años y 6) cambio de la Fey de reposo al ejercicio (delta FEVI) > 5%). Pizarro Los puntos finales fueron: 1) sobrevida a largo plazo, 2) presencia de síntomas en el seguimiento, 3) caída de la Fey >5% y/o 4) cirugía valvular. El punto final primario fue combinado (muerte, síntomas y/o disfunción VI). Durante un seguimiento promedio de 6.7±4,2 años, 4.8% de los pacientes fallecieron, 30% presentaron síntomas, 36% disminución de la Fey >5% y 37% fueron operados. El 39% de los pacientes desarrollaron el punto final combinado. La tasa de eventos combinados (muerte, síntomas y/o caída de la Fey) con un score <2 fue del 0.6±0.1%, con un score de 2-3 fue del 37±5% y con un score >3 fue del 73±9%. A su vez, la tasa de cirugía valvular fue del 29±5% con score <2, del 61±7% con score 2-3 y del 89±7% con score >3. De esta manera, se concluyó que en pacientes con IA grave asintomáticos, la utilización de un score que considera variables clínicas, 15
17 ecocardiográficas y de ejercicio permite establecer una identificación adecuada del riesgo a largo plazo. 41 En forma similar, un estudio reciente, también observó que la cuantificación ecocardiográfica de la gravedad de la IA (volumen y fracción regurgitante y AORE) junto a la valoración del índice de volumen sistólico de VI fueron predictores independientes y superiores de evolución clínica en pacientes asintomaticos con IA y fracción de eyección 50%. 42 Pacientes asintomaticos con fracción de eyección 50% pero IA grave definida cuantitativamente (volumen regurgitante 60 ml/latido o AORE 30 mm 2 ) y diámetro de fin de sístole 45 ml/m 2 demostraron tener un alto riesgo de mortalidad y de desarrollar eventos cardiacos. Una vez que los síntomas se manifiestan afectan significativamente la evolución. Klodas y col. evaluaron la presencia de síntomas en CF I-II (grupo 1= 161 pacientes) comparados con aquellos pacientes con síntomas CF III-IV (grupo 2= 128 pacientes) sometidos a reemplazo valvular y observaron que la presencia de síntomas CF III-IV preoperatorios fueron predictores de riesgo independiente para exceso de mortalidad inmediata (grupo 1: 1.2% vs. grupo 2: 7.8%, p = 0.005, OR ajustado: 5.5, p = 0.036), y a largo plazo (45%±5% [grupo 2] vs. 78%±4% [grupo 1], p <0.0001, OR justado: 1.81, p = ). 52 Seguimiento y evaluación seriada El objetivo general de la evaluación seriada de pacientes con IA crónica es detectar el comienzo de los síntomas y evaluar objetivamente cambios en el tamaño y la función ventricular izquierda que pueden ocurrir aún en ausencia de síntomas. 5 En líneas generales la estabilidad y la cronicidad de la lesión regurgitante y la respuesta a la sobrecarga de volumen del VI necesitan ser establecidas en el primer contacto medico. Las siguientes son las recomendaciones de estudios ecocardiográficos seriados para el seguimiento de pacientes con distintos grados de gravedad de la IA. (Tabla 5) 16
18 Tabla 5. Seguimiento ecocardiográfico en la insuficiencia aórtica crónica* Gravedad de la IA Leve Función ventricular izquierda Normal c/ leve o sin dilatación de VI Frecuencia de ecocardiogramas c/ 2-3 años Moderada Fey normal y DFS<45 mm c/ 2-3 años Severa (cronicidad incierta) Normal Fey y DFS Dentro de los 2-3 meses de la evaluación inicial Severa Fey normal y DFD >60 mm c/ 6-12 meses Severa (riesgo de síntomas o disfunción de VI 10-20%/año) Fey normal y DFD >70 mm y/o DFS >50 mm c/ 4 a 6 meses Fey: Fracción de eyección de ventrículo izquierdo. DFS: diámetro de fin de sístole. DFD: diámetros de fin de diástole. VI: ventrículo izquierdo. *Está sujeto a cambios en el estado sintomático ó hallazgos del examen físico, nueva fibrilación auricular, evidencia de progresiva dilatación ó disfunción ventricular izquierda ó derecha, o progresivo incremento de la presión sistólica pulmonar. Enfermedad de la raíz aórtica y válvula bicúspide La historia natural de los pacientes que presentan dilatación de la raíz aórtica es diferente de la IA crónica sin este hallazgo, ya que la necesidad de intervención está basada en el grado de dilatación de la raíz más que en la respuesta de la función ventricular. Uno de los puntos a considerar son los pacientes con enfermedad de Marfan ya que presentan una dilatación de la aorta ascendente y raíz aórtica combinada con reflujos variables. En esta población la evaluación periódica ecocardiográfica para evaluar el grado de dilatación de la raíz aórtica es importante para definir el momento quirúrgico apropiado. Los factores de riesgo clínico para la disección aórtica en este grupo son: la historia familiar de eventos cardiovasculares y el grado de dilatación de la raíz aórtica. En el síndrome de Marfan hay que tener en cuenta las siguientes circunstancias: La dilatación de la raíz (en el Marfan) no esta en función de la edad. Se debe considerar la indicación de intervención cuando la raíz es >50 mm a diferencia de otras etiologías. La tasa de progresión anual de la dilatación de la raíz aórtica es de alrededor 0.19 mm/año. Es posible identificar grupos de bajo riesgo en los cuales la relación dimensión actual/preestablecida de los senos aórticos es <1.3 con <5% de cambio anual en esta relación. Otra consideración a tener en cuenta es la presencia de la válvula aórtica bicúspide (VAB) ya que se asocia a anormalidades del tejido conectivo, incluido la pérdida del tejido elástico, que resulta en dilatación de la raíz aórtica y la aorta ascendente. 53 Esto incrementa el riesgo de disección de la pared aórtica, pudiendo ocurrir en pacientes con dilatación <50mm y representan el 6 al 10% de todas las disecciones
19 Las recomendaciones de intervención quirúrgica en este subgrupo de pacientes para un manejo más adecuado de su riesgo son las siguientes: 5 Pacientes con VAB conocida deben realizarse un ecocardiograma transtorácico para medir la raíz y aorta ascendente (indicación clase I, nivel de evidencia B) La resonancia nuclear magnética o tomografía computada están indicadas para medir la raíz aórtica cuando el ecocardiograma no es evaluable (indicación clase I, nivel de evidencia C) Pacientes con VAB y dilatación de la raíz aórtica o de la aorta ascendente >40 mm deben realizarse anualmente un ecocardiograma, resonancia nuclear magnética ò tomografía computada (indicación clase I, nivel de evidencia C) La cirugía de la aorta ascendente ò reparación de la raíz aórtica está indicada en pacientes con dilatación >50 mm ò un incremento anual del grado de dilatación 0.5 cm (indicación clase I, nivel de evidencia C) En paciente con VAB que se le realiza un reemplazo valvular por estenosis ò insuficiencia aórtica, la cirugía de la raíz ò aorta ascendente está indicada si el tamaño es 45 mm (indicación clase I, nivel de evidencia C) Es razonable indicar beta bloqueantes en pacientes con VAB y raíz aórtica dilatada (>40 mm), cuando no son candidatos a corrección quirúrgica ni presentan insuficiencia aórtica moderada ò severa (Indicación clase IIa, nivel de evidencia C) Es razonable realizar una resonancia nuclear magnética ò tomografía computada en pacientes con VAB cuando la dilatación de la raíz aórtica se identifico por ecocardiografía para definir el compromiso de la aorta ascendente (Indicación clase IIa, nivel de evidencia B) Tratamiento de la insuficiencia aórtica La IA presenta diferentes etiologías y, por lo tanto, una terapéutica diferente para cada caso. Sin embargo, en la IA crónica con buena tolerancia al esfuerzo, los vasodilatadores demostraron ser eficaces. Los que presentan intolerancia al ejercicio ó diámetros cavitarios de VI exageradamente aumentados se benefician con la cirugía (ver tabla 7). Tratamiento médico Varios estudios evaluaron la eficacia de distintas drogas, fundamentalmente vasodilatadoras, en pacientes con IA definiendo como puntos finales aquellos asociados con la mejoría clínica, la reducción de los diámetros y volúmenes ventriculares, el retardo en la necesidad de la cirugía y mortalidad. La terapia con drogas vasodilatadoras esta diseñada para mejorar el volumen expulsivo anterógrado y reducir el volumen regurgitante. 5 Un ensayo clínico de 143 pacientes asintomáticos con insuficiencia crónica grave y función sistólica normal, fueron seleccionados en forma aleatoria y tratados con nifedipina (n=69) y digoxina (n=74) y evaluados cada seis meses. 55 A los seis años 34 6% de los tratados con digoxina y 15 3 % de los 18
20 tratados con nifedipina se les realizó reemplazo valvular aórtico (RVA). Es decir, 19 RVA menos por cada 100 pacientes tratados con nifedipina. A su vez, los tratados con nifedipina en comparación con el grupo de digoxina presentaron reducción de volúmenes y masa del ventrículo izquierdo. Hay que notar, que si bien el trabajo fue criticado por la ausencia de grupo placebo, en el grupo de digoxina, el 85% de los pacientes presentaron disfunción de VI. Por esta razón, la digoxina fue similar al placebo. Un estudio mas reciente comparó nifedipina de acción prolongada, enalapril y placebo en 95 pacientes consecutivos que fueron seguidos por 7 años. Ni la nifedipina ni el enalapril redujeron el desarrollo de síntomas o disfunción ventricular izquierda. 56 Scognamiglio y col. evaluaron en una población de pacientes con IA asintomáticos y Fey disminuida (<50%) el efecto de la nifedipina (134 pacientes) comparada con 132 pacientes que no recibían medicación y tenían indicación de reemplazo valvular por disminución de la función sistólica. 57 La mortalidad quirúrgica de ambos grupos fue similar (0.75% vs 0.76%, p = NS), así como la sobrevida a 5 años (94±2% vs 94±3%, p = NS) a pesar de una mejor Fey en el seguimiento en el grupo tratado con nifedipina. Solo a los 10 años se observó una diferencia significativo en la sobrevida a favor del grupo con tratamiento activo (85±4% vs 78±5%, p <0.001). De esta manera, no se pueden hacer recomendaciones definitivas acerca de la indicación de drogas vasodilatadoras en la IA. 58 Sin embargo podemos considerar 3 usos de los agentes vasodilatadores en la IA grave: 1. tratamiento a largo plazo para aquellos pacientes con síntomas y/o disfunción ventricular izquierda considerados pobres candidatos para una intervención quirúrgica, 2. como terapia a corto plazo para la mejoría hemodinámica en aquellos pacientes con IA grave y síntomas de insuficiencia cardiaca previo a la cirugía de reemplazo valvular y 3. para mantener la fase compensada en pacientes asintomaticos con sobrecarga de volumen pero función sistólica preservada. 5 El tratamiento de la hipertensión arterial en pacientes con IA y la disfunción sistólica posterior al reemplazo valvular se consideran indicaciones independientes de la gravedad de la lesión valvular. Tratamiento quirúrgico Los pacientes con IA grave con síntomas y/o disfunción o dilatación ventricular izquierda (Fey <50% o dimensiones ventriculares >75 mm de fin de diástole o >55 mm de fin de sístole) deben ser considerados candidatos para cirugía de reparación o reemplazo valvular. La mortalidad quirúrgica para 59, 60 el reemplazo valvular aórtico aislado se ubica en alrededor del 4%. Ante la presencia de un aneurisma de la raíz aórtica aorta asociado, la cirugía debe abarcar el reemplazo de la aorta ascendente con re-implantación de las arterias coronarias, combinado con el reemplazo o alguna técnica de preservación valvular. 31 La cirugía en pacientes con función sistólica normal en el preoperatorio se beneficia con la reducción de los volúmenes y la masa del ventrículo izquierdo. La sobrevida es mejor en pacientes sintomáticos con función sistólica normal o levemente deteriorada, que en aquellos que presentan un importante deterioro 19
21 de la fracción de eyección por debajo de 45%. 61 Los que presentan disfunción de VI en el preoperatorio (Fey 25% a 49%) reducen la masa y el tamaño ventricular. Sólo normalizan la función ventricular si la disfunción previa fue <12 meses. 62 Recientes observaciones dan cuenta de una mejor evolución en la población operada con deterioro severo de la función sistólica en los últimos años (Fey <30%) pero aun la evidencia es escasa para definir una recomendación. 63. En un trabajo reciente, pacientes con IA moderada o grave fueron seguidos por 10 años. Con el tratamiento conservador la mortalidad y morbilidad fue más elevada que la esperada para esa población (34 5%, p<0,001). 4 El 47 6% desarrolló insuficiencia cardiaca. En el análisis multivariado, los factores pronósticos de sobrevida fueron la edad, la clase funcional, el índice de comorbilidad, la existencia de fibrilación auricular, el diámetro de fin de sístole y la fracción de eyección. Durante el seguimiento, la cirugía aórtica mostró una reducción de la mortalidad (riesgo relativo ajustado 0.54; p<0,04). A su vez, en otro estudio de 192 pacientes con IA fueron seguidos durante 13.8 años, con una mortalidad perioperatoria inicial del 2.6%. En el análisis multivariado las variables independientes de los resultados desfavorables a largo plazo fueron: edad, clase funcional avanzada, incremento del diámetro ventricular de fin de sístole y el antecedente de endocarditis. 64 Los factores pronósticos resultaron ser los síntomas y la función ventricular sistólica preoperatoria, como puede apreciarse en la tabla 6. Tabla 6. Factores pronósticos preoperatorios de malos resultados postoperatorios Preoperatorio Predictor Postoperatorio Disfunción sistólica de VI Fey <50% y/o Fac <25% y/o Dilatación de VI permanente R/E fin sístole >3.8 Sobrevida disminuida Disfunción grave de VI DFS 55 mm y/o DFD 75 mm Dilatación de VI permanente y/o VFS >200ml/m 2 Sobrevida disminuida Disfunción sistólica de VI Dilatación de VI permanente prolongada (>12 meses) Sobrevida disminuida Pobre tolerancia al esfuerzo Sobrevida disminuida Disfunción VI permanente Trascendencia de los síntomas CF avanzada Sobrevida disminuida Disfunción VI permanente VI: ventrículo izquierdo; Fac: fracción de acortamiento de ventrículo izquierdo; R/E: relación radio/espesor parietal; DFS: diámetro de fin de sístole. DFD: diámetro de fin de diástole; CF: clase funcional. Por lo tanto, la indicación del reemplazo valvular aórtico en la IA relaciona la información clínica, del estado funcional y ecocardiográfica. (Tabla 7) 20
22 De acuerdo a esta evidencia, se pueden resumir los siguientes conceptos: En los pacientes asintomáticos con función contráctil del VI dentro de límites normales, el seguimiento clínico y ecocardiográfico es perentorio, ya que permite objetivar la función sistólica y la progresiva dilatación ventricular izquierda. Ante la presencia de disfunción contráctil y/o dilatación importante del VI, la cirugía valvular ha demostrado mejorar la sobrevida. En los pacientes sintomáticos es recomendable el reemplazo/reparación valvular ya que disminuye el riesgo de eventos adversos en el seguimiento y la sobrevida mejora a mediano y largo plazo. Aquellos pacientes que presentan una disminución significativa de la función sistólica (Fey <25%) tiene un riesgo significativamente superior a la población con menor deterioro de la función sistólica. Sin embargo hay escasa evidencia disponible en este grupo. Tabla 7. Indicaciones de cirugía en la insuficiencia aórtica crónica Indicación Clase 1- Pacientes sintomáticos independiente de la función sistólica ventricular izquierda I (B) 2- Pacientes asintomaticos con IA severa crónica y disfunción de VI en reposo (Fey I (B) <50%) 3- Pacientes con IA severa crónica que realizan cirugía coronaria o de aorta u otras I (C) válvulas 4- Pacientes asintomaticos con IA severa y función de VI normal en reposo (Fey VI IIa (B) >50%) con severa dilatación de VI (DFD >75 mm o DFS >55 mm) 5- Pacientes con moderada IA y cirugía de la aorta ascendente. IIb (C) 6- Pacientes con moderada IA y cirugía de revascularización coronaria. IIb (C) 7- Pacientes asintomaticos con IA severa y función VI normal en reposo (Fey VI >50%) con DFD >70 mm y/o DFS >55 mm, cuando hay evidencia de progresiva dilatación, IIb (C) disminución de la intolerancia al ejercicio ò respuesta hemodinámica anormal al ejercicio. 8- La cirugía no está indicada en pacientes con leve, moderada, severa IA con función ventricular normal en reposo (Fey VI >50%) cuando el grado de dilatación no es III (B) moderado ni severo (DFD <70 mm y/o DFS <50 mm). IA: insuficiencia aórtica, VI: ventrículo izquierdo, Fey: fracción de eyección de ventrículo izquierdo, DFD: diámetro de fin de diástole; DFS: diámetro de fin de sístole. Modificado de Bonow R, et al. ACC/ AHA Task Force J Am Coll Cardiol 2006; 48; e 1-e
23 Figura 1. Evolución de pacientes con insuficiencia aórtica grave asintomáticos en relación a los diámetros ventriculares, fracción de eyección en reposo y ejercicio y fracción de acortamiento. Modificado de Bonow R, Circulation 1991; 84;1625. Figura 2. Imágenes de eje largo por ecocardiografía transesofágica en pacientes con insuficiencia aórtica por endocarditis (izquierda) y secundaria a absceso del anillo aórtico (derecha) Figura 7. Imágenes de eje corto de la válvula aórtica por ecocardiografía transesofágica (transductor multiplanar a 60 ) en pacientes con insuficiencia aórtica con válvula bicúspide (A), cuadricúspide (B) y secundaria a disección (C). A B 22
24 C Figura 8. Ejemplos de la clasificación funcional de las lesiones de insuficiencia aórtica por ecocardiografía transesofágica A, cúspide anterior flail. B, cúspide con prolapso parcial. C, prolapso de toda la cúspide. D, fenestración del borde libre de la valva. Modificado de le Polain de Waroux JB, et al. Circulation 2007;116:I-264 I-269 Figura 9a. Volúmenes de fin de sístole y fin de diástole en pacientes con diferentes grados de insuficiencia aórtica. 100 % IA severa IA moderada 80 IA leve <100 cm cm 3 >150 cm
25 Figura 10. Sobrevida libre de eventos en pacientes con IA sintomáticos o escasamente sintomáticos y la relación del cambio de la fracción de eyección / cambio del estrés parietal en el máximo del ejercicio. Modificado de Borer JS, Circulation 1998;97:525. Figura 9b. Volumen de Fin de Diástole al Ingreso del Estudio 100% <75 cm 3 >75 cm 3 Padial y col, Am J Cardiol 1997;80:306 Figura 11. Sobrevida con tratamiento conservador en pacientes con insuficiencia aórtica grave estratificados en relación al índice del diámetro de fin de sístole. Modificado de Dujardin KS, Circulation 1999;99:1851, 24
26 Figura 12. Eventos en pacientes con insuficiencia aórtica grave bajo tratamiento conservador ICC: Insuficiencia cardiaca. Modificado de Dujardin KS, et al. Circulation 1999; 99:
27 Figura 3. Imágenes de Doppler color en vista de 5 cámaras apical en un paciente con insuficiencia aórtica severa Figura 4. Imágenes de Doppler color del jet de regurgitación por ecocardiografía transesofágico en eje largo (izquierda) y eje corto (derecha) para la valoración de la vena contracta Figura 5. Flujo reverso holo-diastólico en aorta descendente torácica y aorta abdominal 26
28 Figura 6. Registros de Doppler continuo en pacientes con insuficiencia aórtica moderada (A) y grave (B). A B Figura 13. Desarrollo de los puntos finales de acuerdo a la progresión anual del área del orificio regurgitante efectivo (mayor ó menor a 15 mm²) y el diámetro de fin de sístole corregido por superficie corporal (mayor ó menor a 5 mm/m²) % a n u a l % a n u a l a: En relación a la tasa de cambio del AORE >15mm2 70 AORE mm2 AORE > 60 mm Síntomas Disfunción VI Reemplazo Valvular AORE: área del orificio regurgitante efectivo. DFSSC: diámetro de fin de sístole corregido por superficie corporal % a 50 n 40 u a 30 l b: En relación a la tasa de cambio del AORE 15mm2 0 3 AORE 60 mm2 AORE > 60 mm2 6 Síntomas Disfunción VI Reemplazo Valvular c: En relación a la tasa de cambio del DFSSC >5mm/m 2 d: En relación a la tasa de cambio del DFSSC 5mm/m DFSSC 24 mm/m2 DFSSC > 24mm/m2 Síntomas Disfunción VI Reemplazo Valvular 60 % a 50 n 40 u a 30 l Síntomas Disfunción VI Reemplazo Valvular 3 12 DFSSC 24 mm/m2 DFSSC > 24 mm/m
29 Bibliografía 1 Singh JP, Evans JC, Levy D, et al. Prevalence and clinical determinants of mitral, tricuspid, and aortic regurgitation (the Framingham Heart Study) [published correction appears in Am J Cardiol. 1999;84:1143]. Am J Cardiol. 1999;83: Michel PL, Acar J, Chomette G, Iung B. Degenerative aortic regurgitation. Eur Heart J. 1991;12: Borer JS, Hochreiter C, Herrold EM, Supino P, Aschermann M, Wencker D, Devereux RB, Roman MJ, Szulc M, Kligfield P, Isom OW. Prediction of indications for valve replacement among asymptomatic or minimally symptomatic patients with chronic aortic regurgitation and normal left ventricular performance. Circulation. 1998;97: Dujardin KS, Enriquez-Sarano M, Schaff HV, Bailey KR, Seward JB, Tajik AJ. Mortality and morbidity of aortic regurgitation in clinical practice: a long-term follow-up study. Circulation. 1999;99: Bonow RO, Carabello BA, Kanu C, et al. ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Writing Committee to Revise the 1998 Guidelines for the Management of Patients With Valvular Heart Disease). J Am Coll Cardiol 2006;48:e Cigarroa JE, Isselbacher EM, DeSanctis RW, Eagle KA. Diagnostic imaging in the evaluation of suspected aortic dissection: old standards and new directions. N Engl J Med 1993;328: Nienaber CA, von KY, Nicolas V, et al. The diagnosis of thoracic aortic dissection by noninvasive imaging procedures. N Engl J Med 1993;328: Carabello BA. Aortic regurgitation: a lesion with similarities to both aortic stenosis and mitral regurgitation. Circulation 1990;82: Gaasch WH, Andrias CW, Levine HJ. Chronic aortic regurgitation: the effect of aortic valve replacement on left ventricular volume, mass and function. Circulation 1978;58: Borer JS, Rosing DR, Kent KM, et al. Left ventricular function at rest and during exercise after aortic valve replacement in patients with aortic regurgitation. Am J Cardiol 1979;44: Tornos P, Sambola A, Permanyer-Miralda G, Evangelista A, Gomez Z, Soler-Soler J. Long-term outcome of surgically treated aortic regurgitation: influence of guideline adherence toward early surgery. J Am Coll Cardiol 2006;47: Bonow RO. Management of chronic aortic regurgitation. N Engl J Med 1994;331: Bonow RO, Lakatos E, Maron BJ, Epstein SE. Serial long-term assessment of the natural history of asymptomatic patients with chronic aortic regurgitation and normal left ventricular systolic function. Circulation 1991;84: Bekeredjian R, Grayburn PA. Valvular heart disease. Aortic regurgitation. Circulation. 2005;112: Rahko PS. Doppler and echocardiographic characteristics of patients having an Austin Flint murmur. Circulation. 1991;83:
30 16 Desjardins VA, Enriquez-Sarano M, Tajik AJ, Bailey KR, Seward JB. Intensity of murmurs correlates with severity of valvular regurgitation. Am J Med 1996;10: Enriquez-Sarano M. Aortic regurgitation. N Engl J Med 2004;351: Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003;16: Cheitlin MD, Armstrong WF, Aurigemma GP, et al. ACC/AHA/ ASE 2003 guideline update for the clinical application of echocardiography: summary article: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASE Committee to Update the 1997 Guidelines for the Clinical Application of Echocardiography). J Am Coll Cardiol 2003;42: Teague SM, Heinsimer JA, Anderson JL, et al. Quantification of aortic regurgitation utilizing continuous wave Doppler ultrasound. J Am Coll Cardiol 1986;8: Gaasch WH, Carroll JD, Levine HJ, Criscitiello MG. Chronic aortic regurgitation: prognostic value of left ventricular end-systolic dimension and end-diastolic radius/thickness ratio J Am Coll Cardiol. 1983;1: Grayburn PA, Smith MD, Handshoe R, Friedman BJ, De Maria AN. Detection of aortic insufficiency by standard echocardiography, pulsed Doppler echocardiography, and auscultation: a comparison of accuracies. Ann Intern Med 1986; 104: Perry GJ, Helmcke F, Nanda NC, Byard C, Soto B. Evaluation of aortic insufficiency by Doppler color flow mapping. J Am Coll Cardiol 1987;9: Enriquez-Sarano M, Tajik AJ, Bailey KR, Seward JB. Color flow imaging compared with quantitative Doppler assessment of severity of mitral regurgitation: influence of eccentricity of jet and mechanism of regurgitation. J Am Coll Cardiol 1993; 21: Cape EG, Yoganathan AP, Weyman AE, Levine RA. Adjacent solid boundaries alter the size of regurgitant jets on Doppler color flow maps. J Am Coll Cardiol 1991;17: Reynolds T, Abate J, Tenney A, Warner MG. The JH/LVOH method in the quantification of aortic regurgitation: how the cardiac sonographer may avoid an important potential pitfall. J Am Soc Echocardiogr 1991;4: Tribouilloy CM, Enriquez-Sarano M, Bailey KR, Seward JB, Tajik AJ. Assessment of severity of aortic regurgitation using the width of the vena contracta: a clinical color Doppler imaging study. Circulation 2000;102: Willet DL, Hall SA, Jessen ME, et al. Assessment of aortic regurgitation by transesophageal color Doppler imaging of the vena contract: validation against an intraoperative aortic flow probe. J Am Coll Cardiol 2001;37:
31 29 Taylor AL, Eichhorn EJ, Brickner ME, Eberhart RC, Grayburn PA. Aortic valve morphology: an important in Vitro determinant of proximal regurgitant jet width by Doppler color flow mapping. J Am Coll Cardiol 1990;16: Tribouilloy CM, Enriquez-Sarano M, Fett SL, Bailey KR, Seward JB, Tajik AJ. Application of the proximal flow convergent method to calculate the effective regurgitant orifice area in aortic regurgitation. J Am Coll Cardiol 1998;32: Vahanian A, Baumgartner H, Bax J, et al. Guidelines on the management of valvular heart disease. The Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology. European Heart Journal 2007;28: Consenso de Valvulopatías - Actualización Rev Arg Cardiol 2007; 75: Touche T, Prasquier R, Nitenberg A, de Zuttere D, Gourgon R. Assessment and follow-up of patients with aortic regurgitation by an updated Doppler echocardiographic measurement of the regurgitant fraction in the aortic arch. Circulation 1985;72: Tribouilloy C, Avinee P, Shen WF, Rey JL, Slama M, Lesbre JP. End diastolic flow velocity just beneath the aortic isthmus assessed by pulsed Doppler echocardiography: a new predictor of the aortic regurgitant fraction. Br Heart J 1991;65: Enriquez-Sarano M, Bailey KR, Seward JB, Tajik AJ, Krohn MJ, Mays JM. Quantitative Doppler assessment of valvular regurgitation. Circulation 1993;87: Insuficiencia aórtica. Recursos diagnósticos: Ecocardiografía. Sección 4- Valvulopatias. En Bertolasi C y col. Ed. Medica Panamericana, Buenos Aires, Judge DP, Dietz HC. Marfan s syndrome. Lancet 2005;366: El Khoury G, Glineur D, Rubay J, Verhelst R, d Acoz Y, Poncelet A, Astarci P, Noirhomme P, Van Dyck M. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Curr Opin Cardiol. 2005;20: le Polain de Waroux JB, Pouleur AC, Goffinet C, et al. Functional anatomy of aortic regurgitation accuracy, prediction of surgical reparability, and outcome implications of transesophageal echocardiography. Circulation 2007;116[suppl I]:I-264 I-269.) 40 Falconi ML, Oberti PF, Tewel F, Pizarro R, Krauss JG, Cagide AM. Evaluación seriada de pacientes asintomáticos con insuficiencia aórtica grave y función ventricular normal: estudio basado en el tamaño ventricular y en la lesión valvular. Rev Arg Cardiol 2006;74: Pizarro R, Parcerisa F, Oberti PF, Falconi M, Achilli F, Arias A, Tewel SF, Krauss J, Cagide A. Estratificación de riesgo en la insuficiencia aórtica grave asintomática: cómo podemos identificar a los pacientes con evolución adversa? Rev Argent Cardiol 2007;75: Detaint D, Messika-Zeitoun D, Maalouf J, et al. Quantitative echocardiographic determinants of clinical outcome in asymptomatic patients with aortic regurgitation. J Am Coll Cardiol Img 2008;1: Bonow RO. Radionuclide angiography in the management of asymptomatic aortic regurgitation. Circulation 1991;84:I
32 44 Borer JS, Bacharach SL, Green MV, et al. Exercise-induced left ventricular dysfunction in symptomatic and asymptomatic patients with aortic regurgitation: assessment with radionuclide cineangiography. Am J Cardiol 1978;42: Penn MS, Smedira N, Lytle B, Brener SJ. Does coronary angiography before emergency aortic surgery affect in-hospital mortality? J Am Coll Cardiol 2000;35: Alkadhi H, Desbiolles L, Husmann L, et al. Aortic regurgitation: Assessment with 64-Section CT. Radiology.2007; 245: Jassal DS, Shapiro MD, Neilan TG, et al. 64-slice multidetector computed tomography (MDCT) for detection of aortic regurgitation and quantification of severity. Invest Radiol. 2007; 42: Debl K, Djavidani B, Buchner S, et al. Assessment of the anatomic regurgitant orifice in aortic regurgitation: a clinical magnetic resonance imaging study. Heart 2008;94:e8. 49 Padial LR, Oliver A, Vivaldi M, et al: Doppler echocardiographic assessment of progression of aortic regurgitation. Am J Cardiol 1997;80: Borer JS, Hochreiter C, Herrold EM, et al. Prediction of indications for valve replacement among asymptomatic or minimally symptomatic patients with chronic aortic regurgitation and normal left ventricular performance. Circulation 1998;97: Dujardin KS, Enriquez-Sarano M, Schaff HV, Bailey KR, Seward JB, Tajik AJ. Mortality and morbidity of aortic regurgitation in clinical practice: a long-term follow-up study. Circulation 1999;99: Klodas E, Enriquez-Sarano M, Tajik AJ, Mullany CJ, Bailey KR, Seward JB. Optimizing timing of surgical correction in patients with severe aortic regurgitation: role of symptoms. J Am Coll Cardiol. 1997;30: Grotenhuis HB, Ottenkamp J, Estenberg JJM, Bax JJ, Kroft LJM, de Roos A. Reduced aortic elasticity and dilation area associated with aortic regurgitation and left ventricular hypertrophy in nonstenotic bicuspid aortic valve disease. J Am Coll Cardiol 2007;49: Erbel R, Eggelbrecht H. Aortic dimensions and the risk of dissection. Heart 2006;137: Scognamiglio R, Rahimtoola SH, Fasoli G, Nistri S, Dalla VS. Nifedipine in asymptomatic patients with severe aortic regurgitation and normal left ventricular function. N Engl J Med 1994;331: Evangelista A, Tornos P, Sambola A, Permanyer-Miralda G, Soler-Soler J. Long-term vasodilator therapy in patients with severe aortic regurgitation. N Engl J Med 2005;353: Scognamiglio R, Negut C, Palisi M, Fasoli G, Dalla-Volta S. Long-term survival and functional results alter aortic valve replacement in asymptomatic patients with chronic severe aortic regurgitation and left ventricular dysfunction. J Am Coll Cardiol 2005;45: Carabello BA. Vasodilators in aortic regurgitation what is the evidence of their effectiveness? N Engl J Med 2005;353: Edwards FH, Peterson ED, Coombs LP, et al. Prediction of operative mortality after valve replacement surgery. J Am Coll Cardiol. 2001;37:
33 60 Florath I, Rosendahl UP, Mortasawi A, et al.. Current determinants of operative mortality in 1400 patients requiring aortic valve replacement. Ann Thorac Surg. 2003;76: Chaliki HP, Mohty P, Avierinos JF, et al. Outcomes after aortic valve replacement in patients with severe aortic regurgitation and markedly reduced left ventricular function. Circulation. 2002;106: Bonow RO, Dodd JT, Maron BJ, et al. Long-term serial changes in left ventricular function and reversal of ventricular dilatation after valve replacement for chronic aortic regurgitation. Circulation 1988;78: Bhudia SK, McCarthy PM, Kumpati G, et al. Improved outcome alter aortic valve surgery for chronic aortic regurgitation with severe left ventricular dysfunction. J Am Coll Cardiol 2007;49: Turina J, Milincic J, Seifert B, Turina M. Valve replacement in chronic aortic regurgitation. True predictors of survival alter extended follow-up. Circulation 1998;98 Suppl 19:II
34 ESTENOSIS AÓRTICA Dra Verónica Volberg Médica de Planta de la Sección EcoDoppler Del Servicio de Cardiología del Hospital de Clínicas. 1. Introducción 2. Definición 3. Etiología 4. Fisiopatología 5. Historia natural 6. Recomendaciones para ecocardiograma Doppler en la estenosis aórtica 7. Estudio de ecocardiográfico y Doppler 7.a. Ecocardiografía bidimensional y modo M 7.b. Estudio transesofágico 7.c. Doppler 7.d. Cálculo de área valvular 8. Definición de Estenosis aórtica grave 9. Por qué cambió el punto de corte de gravedad 10. Comportamiento hemodinámica (Fenómeno de recuperación de presión, trabajo sistólico, resistencia valvular) 11. Función ventricular (respuesta a la sobrecarga crónica de presión) 11.a. Hipertrofia 11.b. Función diastólica 11.c. Función sistólica 12. Estenosis aórtica bajo flujo/ bajo gradiente 12.a. Recomendaciones para realización de eco-estrés 12.b. Protocolo eco-estrés dobutamina 12.c. Interpretación 13. Seguimiento/ Progresión 14. Situaciones especiales 14.a. Estenosis aórtica dinámica/ Gradiente subvalvular concomitante 14.b. Valvulopatías concomitantes 14.c. Fibrilación auricular/ extrasistolia 14.d. Hipertensión arterial 15. Conclusiones 16. Bibliografía 33
35 1. Introducción La comprensión de la fisiopatología de una valvulopatía es fundamental para la posterior toma de conducta en cada paciente individual, tanto el ecocardiografista como el médico clínico y/o cardiólogo tratante. Dado que el manejo de paciente con estenosis aórtica (Estenosis aórtica) es artesanal, se debe comprender la fisiopatología y no aferrarse a un número para la toma de decisión, en especial en estos tiempos donde se han modificado las normativas cambiando los puntos de corte de gravedad. 2. Definición La definición de una valvulopatía se basa en la alteración de la función valvular. En el caso de la estenosis aórtica es la limitación a la eyección del ventrículo izquierdo (VI), con lo cual esta puede ser valvular, subvalvular ó supravalvular. A pesar de que este capítulo desarrollará principalmente la primera, se darán algunas consideraciones y lineamientos acerca de los diagnósticos diferenciales y las implicancias clínicas de las entidades individuales como su combinación. (1) 3. Etiología La estenosis aórtica es una valvulopatía resultante de un estrés mecánico que lleva a la inflamación inicial y calcificación posterior. Las etiologías pueden ser congénitas y/ó adquiridas, y de estas últimas más frecuentes son la etiología reumática y la degenerativa, aunque otras causas que originen inflamación del endocardio (como el lupus eritematoso sistémico, la artritis reumatoidea, secuelas de endocarditis, etc.), pueden transitar el mismo camino. (1-4) 1) De las primeras, las más frecuentes son las alteraciones de la válvula con sus diferentes variantes: bicúspide, trivalva con una valva rudimentaria etc, donde el flujo turbulento que traumatiza las valvas, de una válvula anatómicamente anormal, que lleva a la calcificación de la misma. Es un defecto congénito relativamente frecuente comprendiendo un 3-6% de los defectos congénitos cardiovasculares. Se estima que alrededor del la mitad de los pacientes adultos más jóvenes que la edad esperada para una Estenosis aórtica senil ó degenerativa (<65-70 años), se originaron en una válvula bicúspide aórtica, a diferencia de pacientes añosos (> 70 años) donde la mitad son Estenosis aórtica degenerativas. Para el ecocardiografista es importante sospechar este origen, aunque muchas veces es indistinguible de otras etiologías en su fase final, en primer lugar por asociarse en un 20% a otras alteraciones congénitas como coartación de aorta, ductus ú otras alteraciones valvulares. Y en segunda instancia se relaciona con dilatación de la aorta ascendente que se origina por necrosis quística de la media. (1) 2) En la Estenosis aórtica reumática la primera válvula que se afecta por la fiebre reumática es siempre la válvula mitral, sin su afectación se descarta el origen reumático de la Estenosis aórtica. Esta etiología produce inflamación y luego calcificación de los bordes libres de las valvas y fusión comisural. 3) La llamada Estenosis aórtica degenerativo ó senil, prefiere llamarse actualmente inflamatoria, postulándose un origen similar al de la ateromatosis vascular, que lleva a la placa ateromatosa 34
36 fibrocálcica. Alrededor del 90% de pacientes mayores a 65 años, tendrían diagnóstico de Estenosis aórtica degenerativa por resultados de autopsias. (1-4). 4. Fisiopatología La evolución de esta valvulopatía transcurre por décadas. El VI se adapta al progresivo aumento de poscarga impuesto por el cierre progresivo del área valvular aórtica (AVA). El mecanismo de adaptación a esta situación es la hipertrofia concéntrica del VI (HTVI). Esto es necesario para poder mantener un estrés parietal (SP) adecuado. Teniendo en cuenta que, por ley de La Place, el estrés parietal es directamente proporcional a la presión intraventricular (P) y al radio (r), e inversamente proporcional al espesor (E), entonces: SP = P x r / E Por lo tanto con espesores aumentados se mantiene el SP dentro de límites normales, como también es necesario el radio (diámetro ventricular/2) pequeño. El VI mantiene su gasto cardíaco en la Estenosis aórtica grave por tiempo prolongado gracias a la presencia de la HTVI. A medida que la contracción se hace cada vez más isométrica, aumenta la presión de fin de diástole (PFD) para mantener el gasto cardíaco. El estrés parietal sistólico (pos-carga) se mantiene en rangos normales, manteniendo una relación inversa entre estrés parietal sistólico y fracción de eyección, en tanto el estrés se mantiene normal también lo será la fracción de eyección. El volumen de fin de diástole (VFD) se conserva normal hasta tardíamente en el curso de la enfermedad, sin embargo aumenta la masa ventricular (MVI), a expensas de los espesores, en respuesta a la sobrecarga crónica de presión con aumento de la relación MVI/volumen. Sin embargo el proceso de hipertrofia es inadecuado y el grosor parietal relativo no aumento en la misma proporción a la PFD. El SP se incrementa llevando, inicialmente al aumento del VFD (con disfunción diastólica) y luego a la disminución de la función sistólica. Tardíamente en el curso de la evolución se compromete y disminuye el gasto cardíaco, volumen sistólico y consecuentemente los gradientes entre VI y aorta. La disminución de la fracción de eyección, en este punto, puede deberse a compromiso de la contractilidad ó excesiva poscarga, lo cual es difícil de diferenciar clínicamente. Se deberá evaluar el beneficio de la cirugía correctiva evaluando la reserva contráctil (ver ESTENOSIS AÓRTICA bajo flujo/ bajo gradiente ). La contracción de al aurícula juega un importante papel en la contribución al llenado ventricular. Su ausencia, por ejemplo en la fibrilación auricular, contribuye a aumentar la presión auricular y por lo tanto pulmonar capilar, llevando al paciente hacia un rápido deterioro clínico. El gasto cardíaco se mantiene conservado en la mayoría de los pacientes con Estenosis aórtica grave en reposo, sin embargo puede presentar disnea con el ejercicio por aumento del volumen de fin de diástole con disfunción diastólica. La aparición de insuficiencia mitral per se ó por dilatación de la aurícula agrava el cuadro por aumento de presiones en la aurícula y el circuito pulmonar. (1-4) 35
37 5. Historia natural El paciente con Estenosis aórtica evoluciona lentamente por décadas hacia la gravedad hasta llegar a una Estenosis aórtica grave que permanece, generalmente, por períodos prolongados asintomático y en el cual la morbimortalidad por esta valvulopatía es muy baja (< 1%) y no supera los riesgos de la cirugía correctiva (< 1% en paciente < 55 años en contraposición con un 7-24 % en paciente > 85 años con factores de riesgo coronarios). La progresión parecería ser más rápida en la Estenosis aórtica degenerativa que en la congénita ó reumática. (7) En algún momento de la evolución, en estadio de gravedad, aparecen los síntomas: angor, síncope y/o falla de bomba. La aparición de los síntomas implica un pobre pronóstico, con riesgo de muerte súbita en 2-3 años en promedio. La sobrevida se estima desde el comienzo del síntoma en promedio de 2 años para la falla de bomba, 3 años para el síncope y 5 años para la angina de pecho. La identificación de síntomas, por lo tanto, es crucial en la historia natural de en una Estenosis aórtica moderada a grave, ya que determina un pronóstico ominoso. Dado que en su mayoría son pacientes adultos, muchas veces añosos con factores de riesgo cardiovasculares, debe diferenciarse cuidadosamente si los síntomas son por la Estenosis aórtica ó de otro origen, como la enfermedad coronaria. (1-4) 6. Recomendaciones para ecocardiograma Doppler en la Estenosis aórtica (2) Clase I 1 Soplo sistólico sugestivo de estenosis aórtica en un paciente con síntomas y signos cardiorrespiratorios o sin ellos. (B) 2 Establecer diagnóstico diferencial entre estenosis aórtica valvular, subvalvular y supravalvular. (B) 3- Paciente con sospecha clínica ó por ecocardiograma en modo M/2D de estenosis valvular aórtica de grado significativo (moderada-grave). (B) 4- Embarazada con estenosis valvular aórtica conocida, para definir el manejo terapéutico y en caso de Estenosis aórtica grave para monitoreo de gradientes transvalvulares en forma frecuente. (B) 5- Paciente con estenosis valvular aórtica conocida que va a ser sometido a cirugía: a) mayor, no cardíaca. (C), b) cardíaca, por patología diferente de la estenosis valvular aórtica. (C) 6- Paciente con estenosis valvular aórtica que realiza deportes competitivos o tareas que pueden comprometer la seguridad propia o la de terceros. (C) 7- Paciente con estenosis aórtica moderada según estudio de eco-doppler, que carece de revaluación por un período superior a 18 meses. (C) Clase II 1 Pacientes con coartación aórtica, debido a su frecuente asociación con válvula aórtica bicúspide. (B) 2- Pacientes con estenosis valvular aórtica grave, para evaluar su progresión. (C) 3- Pacientes con estenosis aórtica moderada sin evidencias clínicas de progresión en el último año. (C) 36
38 Clase III 1 Pacientes con soplo eyectivo aórtico caracterizado como funcional o asociado con un estado de hiperdinamia circulatoria. (B) 2- Pacientes cuya estenosis valvular aórtica se haya cuantificado como de grado no significativo dentro del último año. (C) 3 Pacientes con estenosis aórtica leve sin evidencias clínicas de progresión. (C) Las guías de valvulopatías norteamericanas agregan (3): Clase I 1. Para diagnósticar y establecer la gravedad de la estenosis aórtica. (B) 2. Para determinar el grado de grosor parietal, tamaño ventricular y función. (B) 3. En paciente con diagnóstico de Estenosis aórtica con cambio de estatus sintomático. (B) 4. Para evaluación por cambio hemodinámica durante el embarazo en una estenosis aórtica conocida. (B) 5. Para reevaluación de pacientes con est6enosis aórtica asintomática, anual en caso de grave, cada 1-2 años en caso de moderada, y cada 3-5 años en caso de leve (B) 7. Estudio de ecocardiográfico y Doppler Cuando se inicia el estudio ecocardiográfico de un paciente con estenosis aórtica, se debe partir de la base que es, probablemente, el estudio más largo de esta subespecialidad. Conviene iniciar el examen con el examen clínico y un interrogatorio escueto acerca del estatus sintomático del paciente. La auscultación guiará el estudio ecocardiográfico. La presencia de un soplo eyectivo en el área aórtica y aórtica accesoria con un 2 o ruido preservado al igual que un pulso con adecuada amplitud, prácticamente descarta la presencia de una Estenosis aórtica significativa. La presencia de un 2 o ruido disminuido ó ausente es altamente sugestiva de gravedad de esta valvulopatía, principalmente en la Estenosis aórtica degenerativa donde, por la extensa calcificación, la movilidad de las valvas se encuentra restringida en el cierre. Por lo contrario la normalidad de este descarta una Estenosis aórtica grave valvular. El pulso tardus parvus es un signo muy especifico en la Estenosis aórtica aislada, pero puede tener características diferente en coexistencia con hipertensión arterial y/ó rigidez vascular de otra causa. (1, 2). 7.a. Ecocardiografía bidimensional y modo M La válvula aórtica presenta 3 valvas. Desde la vista paraesternal izquierda eje largo podremos apreciar 2 de ellas: lindando con las cavidades derechas (anterior) estará la valva coronariana derecha y hacia el lado auricular veremos la valva no-coronariana (fig.1a). Al girar 90 o, en eje corto veremos la válvula cerrada (en diástole) con la imagen invertida del signo de Mercedes Benz, visualizando la válvula coronariana derecha lindando con las cavidades derechas en su parte superior e izquierda de la pantalla, la válvula coronariana izquierda en la parte superior y derecha cercana al tracto de salida derecho (TSVD), y la válvula no-coronariana hacia abajo en la pantalla lindando con las aurículas. Las 37
39 valvas se hallan separadas por comisuras. (Fig. 1D y E) El cierre de las 3 valvas debe ser céntrico. (Fig. 1.A) (4) A B C CD CD NC CI NC CI D E E F Fig.1. Panel A: Válvula aórtica cerrada en vista paraesternal eje largo. Panel B y C: Válvula aórtica abierta en eje para esternal eje largo, las flechas señalan sitio de inserción de valva coronariana derecha (superior) y no coronariana (inferior), donde se realiza medición del TSVI. Panel D: Eje corto de válvula aórtica cerrada con bordes libres de válvula que forman la imagen invertida de Mercedes Benz, y Panel E con válvula abierta. Panel F: Modo M donde se visualiza el cajón aórtico con la valva coronariana derecha y no- coronariana (flechas). El cierre excéntrico de la válvula en paraesternal largo es sugestivo de válvula bicúspide u otra variante congénita que afecta el cierra céntrico. Al evaluar la válvula en modo M visualizamos el cajón aórtico representando la apertura valvular en sístole y por lo tanto su tiempo de apertura se correlaciona con el tiempo eyectivo. (fig. 1F) Una separación > 13 mm descarta una Estenosis aórtica grave con un valor predictivo del 96% (4) Estas 2 vistas le dan al operador una apreciación de la morfología y eventual etiología de la Estenosis aórtica (por ej. bicúspide, degenerativa ó reumática) y una impresión subjetiva estar en presencia de una valvulopatía significativa ó no. Dado que el orificio es generalmente muy anfractuoso, con abundante calcio que dificulta la delimitación del orificio valvular, la planimetría por el estudio transtorácico se halla sujeta a error. Se examinará también la repercusión hemodinámica sobre las cavidades evaluando el mecanismo de adaptación del ventrículo izquierdo, tanto el grado de hipertrofia concéntrica como la función sistólica del mismo. Antes de pasar al examen con Doppler, se realizará una evaluación y medición de diámetro del tracto de salida del ventrículo izquierdo (TSVI) (Fig. 1B y C) (se detalla en el apartado de Doppler). (4) 7.b. Estudio transesofágico La necesidad de completar el estudio de un paciente con Estenosis aórtica con un estudio transesofágico (ETE) es poco frecuente. Aunque en caso, por ej de ventana ultrasónica dificultosa, 38
40 Estenosis aórtica bajo flujo, asociación de gradiente dinámico ó asociación con otras valvulopatías, el ETE puede ser de gran ayuda al poder visualizar la válvula con mayor precisión. Con la sonda desde esófago con cortes a nivel de la base del corazón, entre 25 a 30cm de la arcada dental, en corte transversal a, aproximadamente 45 o, se puede visualizar una eje corto de la válvula. En esta vista puede realizarse una planimetría del orificio anatómico. (Fig. 2A) Rotando el multiplano a 90 o de despliega la aorta ascendente. (Fig. 2B) Es muy difícil lograr alinearse con el flujo en el ETE. La vista de elección es la transgástrica alineándose con el TSVI. (4) A B Fig. 2 Panel A: Planimetría de válvula aórtica; se dibuja meticulosamente el contorno de la apertura valvular obteniendo el área valvular. En este ejemplo el área valvular mide 1,45cm². Panel B: Muestra eje largo de válvula aórtica y aorta ascendente. 7.c. Doppler La evaluación con Doppler investiga fundamentalmente el comportamiento de los fluidos. El flujo de sangre a nivel del TSVI presenta flujo laminar hasta llegar a la válvula estenótica donde se genera turbulencia, aumenta la velocidad del mismo que debe pasar por un orificio disminuido. El máximo gradiente se produce a unos milímetros de válvula, sitio llamado vena contracta (VC). En este lugar el estudio Doppler registra la mayor velocidad, llamado gradiente instantáneo (GI), ya que registra el gradiente entre VI y Aorta ascendente (AA) (Fig. 3), a diferencia del estudio hemodinámica que calcula el gradiente pico- pico (GPP) entra VI y la AA en forma diferida, primero a nivel del VI y luego a nivel de la AA por retiro del catéter. Esto determina la discordancia entre el estudio hemodinámica que infravalora y el Doppler que sobreestime el gradiente transvalvular aórtico. (Fig. 3) (4) GPP GI AO VI 39
41 Fig. 3 Muestra curvas de presión de la aorta (AO) y del ventrículo (VI). La flecha más grande marca el gradiente instantáneo (GI) registrado por el Doppler y la flecha más pequeña el gradiente del pico ventricular y del pico aórtico. Para obtener, entonces el máximo gradiente transvalvular aórtico conviene inicialmente ubicarse en 5 cámaras apical y colocar el flujo Doppler color que permitirá visualizar el flujo color con la ubicación de la VC (sitio de mayor gradiente, que coincide con el orificio valvular efectivo), como también turbulencia a nivel del TSVI ó por insuficiencia mitral concomitante que requerirá diagnóstico diferencial por tener un flujo que se dirige en la misma dirección al flujo aórtico que se aleja del operador. Es importante poder visualizar el flujo color desde TSVI, a nivel de la válvula y también a nivel supravalvular/ aorta ascendente (AA) (Fig. 4), lo cual es indicativo de una adecuada alineación para obtener una onda espectral con el Doppler espectral fidedigna. Ubicamos entonces el Doppler continúo, sospechando velocidades mayores a 2m/s, tratando de alinearse lo más posible con el flujo color visualizando la válvula. Dado que el orificio valvular generalmente es anfractuoso, el jet del flujo anterógrado es excéntrico, lo que dificulta la toma de una onda espectral adecuada. El ángulo entre el flujo el haz ultrasónico no debe superar los 20 o para minimizar el error. (4) Fig.4 Se muestra vista apical en 5 cámaras con flujo color. Nótese que se visualiza flujo color a ambos lados de la válvula, que indica una buena alineación con el flujo. Se debe obtener una onda espectral bien delineada, sin visualizarse flujo en la parte superior de la línea de base con imagen deflecada, lo que denota una inadecuada alineación. (Fig.5A). También debemos poder identificar los movimientos valvulares de apertura y cierre en el Doppler en forma de líneas perpendiculares a la línea de base que delimitaran a cada lado los tiempos isovolúmicos de contracción y de relajación a cada lado del flujo aórtico (Fig. 5B). Estos últimos son invadidos por el flujo de insuficiencia mitral, representando una de las diferencias, conjuntamente con la morfología de un jet ancho con velocidades mayores a las aórticas (Fig. 5C). La morfología de la curva espectral está determinada por 3 componentes: la velocidad pico (Vp), el periodo eyectivo y el tiempo al pico. La primera depende de la gravedad de la estenosis y el volumen 40
42 sistólico (VS). El periodo eyectivo puede prolongarse en la Estenosis aórtica grave, y el tiempo al pico, que evidencia el tiempo que requiere el VI para en abrir la válvula, y que a su vez depende de la rigidez valvular, grado de calcificación y área. Si la Estenosis aórtica es leve a moderada la velocidad al pico se alcanza precozmente a diferencia de la Estenosis aórtica grave donde el pico se produce más tardíamente con descenso más lento. Esto último determina un aumento del gradiente medio (por una onda más ancha) que podría relacionarse con mayor gravedad. (5). Se debe ser muy meticuloso para la obtención de la máxima velocidad aórtica y no dejar de interrogar todas las ventanas posibles como la paraesternal derecha con el paciente en decúbito lateral derecho, supraesternal, supraclavivular y subxifoidea. Es de gran utilidad si se cuenta con el transductor ciego de Doppler continuo (Peedof) que facilita la obtención del flujo adecuado por su tamaño, pudiéndose ubicar mejor entre los espacios intercostales, supraclavicular y supraesternal. Se recuerda que este punto es de fundamental importancia dado que va determinar la gravedad, y consecuente toma de conducta por parte del médico tratante en base al resultado obtenido, donde debe lograse el máximo gradiente. La velocidad máxima de la onda espectral determinará el gradiente máximo, y trazando el contorno de la misma obtenemos el promedio de la sumatoria de las velocidades de la onda espectral que, por ecuación modificada de Bernoulli, arrojará los gradientes máximo y medio como también la integral velocidad tiempo (VTI). A B C Fig. 5 Panel A Muestra flujo aórtico inadecuado con flujo en la parte superior de la línea de base (flecha) con una curva espectral mal delimitada. Panel B Flujo aórtico adecuado donde se visualizan los movimientos valvulares de apertura y cierre (flechas). Panel C: Flujo de insuficiencia mitral que invade los períodos isovolúmicos (flechas). 7.d. Cálculo de área valvular Cuando se realiza una evaluación por Doppler se está evaluando el comportamiento hemodinámica de los fluidos. Por dinámica de los mismos un volumen x que pasa por un sitio debe ser el mismo que el que pasa por uno diferente del mismo circuito/ sistema circulatorio, y, sabiendo que flujo es igual a velocidad por área, entonces el volumen que pasa por el TSVI debería ser el mismo que el que pasa por la válvula aórtica, entonces: Flujo = Velocidad x Área Flujo V Ao = Flujo TSVI Velocidad Ao x área Ao = Velocidad TSVI x área TSVI 41
43 La relación entre velocidades máximas entre el TSVI y la válvula aórtica son similares a la relación de las integrales de los mismos, se puedo utilizar velocidad pico en la fórmula aunque es más fidedigno reemplazar estos datos por las integrales velocidad tiempo (VTI) respectivas que corresponde al promedio de la sumatoria de todas las velocidades de la onda espectral. Todos los datos requeridos en la fórmula pueden obtenerse por ecocardiograma bidimensional y Doppler a excepción del área valvular. (Fig.6) Se despeja en la fórmula el mismo: Área Ao = Velocidad TSVI x área TSVI Área Ao = VTI TSVI x área TSVI Velocidad Ao VTI Ao El numerador de la fórmula no es otro dato que el volumen sistólico (VS). El valor normal se encuentra entre ml en un paciente hemodinamicamente estable con función sistólica conservada. Este dato debe servir de control durante el estudio, dado que si algún componente de la fórmula resultara erróneo, el área valvular resultante lo será también. La velocidad del TSVI se registra con la gota del Doppler pulsado a nivel del TSVI, inmediatamente a nivel supravalvular, teniendo en cuenta lo antedicho. (4) Se contornea la onda espectral del TSVI para obtener la integral de la misma. El diámetro (D) del TSVI se toma desde la ventana paraesternal, realizando un acercamiento de la imagen ( zoom ), y luego trazando una línea entre la base de inserción de las cúspides aórticas: el ángulo que se forma entre el septum interventricular y la valva coronariana derecha, y el ángulo que se forma entre la válvula no coronariana y la valva anterior mitral (Fig. 1B y C, flechas). Es aconsejable realizar varias mediciones y calcular un promedio de las mismas debido a la variabilidad intra e interobservdor. (4) Conviene entonces corroborar el VS en este momento para saber si las mediciones han sido tomados en forma adecuada, concordante con la función sistólica del VI. (Fig.6) A veces estos datos son muy difíciles de recavar, en especial el diámetro (D) del TSVI, No se aconseja asumir un valor estándar dada la variabilidad y superposición que existe entre ambos sexos y la edad, teniendo más correlación de acuerdo a la superficie corporal. Si es aconsejable, una vez obtenido, registrar y repetir en estudios individuales el valor del TSVI para el seguimiento longitudinal, dado que este tendrá poca variación anatómica. Para obtener el área del TSVI, se divide el diámetro obtenido por 2 para obtener el radio (r), el cual se elevará al cuadrado y se multiplicará por 3,14 ( ). Área = r 2 x 3,14 ó D 2 x 0,785 Área Ao = VTI TSVI x área TSVI Área Ao = VTI TSVI x (r TSVI 2 x 3,14) VTI Ao VTI Ao 42
44 Todos los datos deben coincidir llegando a este punto en cuanto a la gravedad de la valvulopatía: semiología, clínica, gradientes y área valvular. Si no llegara a ser el caso debe buscarse algún error el algún punto del desarrollo. (4,5) 2,1cm 3,14 x (r)² x (VTI) TSVI VTI 28cm (VTI) Ao VTI 114cm Fig. 6 Fórmula de continuidad. Ejemplo: El diámetro del TSVI mide 2,1cm, y el VTI del TSVI recavado es de 28 cm, el VTI aórtico registra 114cm. El radio (2,1 cm / 2 = 1,05 cm y luego al cuadrado 1,05 2 = 1,10 cm². Este resultado se multiplica por 3,14 y el VTI TSVI resultando un volumen sistólico de 97 cm 3, que concuerda con un paciente con función sistólica conservada. 97 cm 3 / 114 cm = Area valvular de 0,85 cm². Una forma simplificada de la fórmula de continuidad es la relación entre la velocidad del TSVI y la aórtica, reflejando la relación de tamaño valvular con respecto al área del TSVI. (4, 7, 11) Relación velocidades = Vmax TSVI / Vmax Ao Una relación TSVI/ Ao de 1 equivale a una válvula normal, una relación de < 0,25 corresponde al 25% de un área valvular esperada, equivalente a grave. Aunque esta determinación no requiere del diámetro del TSVI, pero si de la meticulosa búsqueda de los gradientes máximos. (4, 6) 8. Definición de Estenosis aórtica grave El diagnóstico de Estenosis aórtica grave se basa no solamente en uno sino varios hallazgos hemodinámicas y en la historia natural de la enfermedad (1, 4, 6) utilizando velocidad del flujo aórtico, gradiente medio y área valvular (cuadro 1): (2, 3, 6) Esclerosis valvular aórtica: calcificación y engrosamiento valvular con adecuada motilidad valvar con velocidad máxima de flujo (Vmax) 2,5m/s. Leve: área 1,5 cm 2, gradiente medio (GMd) < 25 mm Hg ó Vmax entre 2,6-3,0 m/seg. Moderada: área 1,0 a 1,5 cm 2, GMd 25 a 40mm Hg, ó Vmax 3,0 a 4,0 m/seg. Grave: área menor a 1,0 cm 2, GMd mayor a 40 mm Hg, o Vmax mayor a 4,0 m/seg. Los gradientes citados son concordantes a una situación hemodinámica estable con un volumen minuto (VM) y una función sistólica conservada. En una Estenosis aórtica grave generalmente se encuentran 43
45 GMd superiores a 40 mm Hg. Sin embargo cuando el VM se halla comprometido, el VI no logrará los gradientes citados, como en la disfunción sistólica, que de desarrollará en un apartado posterior (ver Estenosis aórtica bajo flujo/ bajo gradiente). En presencia de una insuficiencia mitral significativa también podemos infravaloras los gradientes. Por lo contrario hallaremos gradientes superiores a los esperados para la Estenosis aórtica en casos hiperdinámicos, teniendo en cuenta fundamentalmente la presencia de anemia, sobretodo por ser una entidad predominante de la población añosa. Estas situaciones, nos pueden llevar a conclusiones erróneas. (1, 4, 6) Sin embargo no debe olvidarse que la conducta quirúrgica no depende del diagnóstico de estenosis aórtica grave sino de aparición de los síntomas (angor, sincope y/o insuficiencia cardiaca) (ver Historia natural ), excepto en situaciones especiales como cirugía de revascularización miocárdica en presencia de estenosis aórtica moderada. La mayoría de los pacientes con estenosis aórtica grave permaneces asintomáticos por tiempo prolongado cuando otros se tornan sintomáticos con estenosis aórtica solo moderada. Existe gran superposición entre los cuadros y los diferentes puntos de corte para gravedad, no pudiendo predecir con el área valvular la aparición de síntomas y la evolución clínica, incluso corregido al gasto cardíaco y superficie corporal. Esto se debe que con el área valvular anatómica y/o hemodinámica no tiene en cuenta en un todo la interacción entre la respuesta del ventrículo, el área valvular y el sistema vascular periférico. (4, 6) Existen otros parámetros alternativos para estimar la gravedad descriptos como el 1) cociente entre Velocidad máximas del TSVI y Ao (ya descripto) con punto de corte <0,25 con Sensibilidad (S) y especificidad (E) para estenosis aórtica grave de 100% y 89% respectivamente reportado por Lax y colaboradores (4, 6, 7), 2) el cociente fracción de acortamiento (F ac)/ Gradiente máximo instantáneo <0,7 con sensibilidad y especificidad de 100% y 89% respectivamente, tomando la F ac, desde el modo M en paraesternal, 3) el cociente entre tiempo de aceleración del flujo Doppler del TSVI / tiempo eyectivo del mismo tomado ambos con Doppler pulsado a nivel del TSVI con un punto de corte de > 0,5, con S del 63% y E del 89%. Este grupo de trabajo encontró una S del 100% en el subgrupo de paciente con función sistólica deprimida. (2, 7) 4) Resistencia valvular máxima > 500 dinas/seg/cm -5 (2) (ver Comportamiento hemodinámica ). Leve Moderado Grave Velocidad pico (m/seg) < 3,0 3,0-4,0 > 4,0 Gradiente medio (mm Hg) < > 40 Área valvular (cm) > 1,5 1,0 1,5 < 1,0 Área valvular indexada (cm 2 /m 2 ) < 0,6 Relación Vmax TSVI/ Ao < 0,25 Cuadro 1. Gravedad de la ESTENOSIS AÓRTICA (2,3) 9. Por qué cambió el punto de corte de gravedad 44
46 Hasta 2005, mundialmente, se definía una estenosis aórtica grave con gradiente máximo > 80 mmhg medio > 50 mmhg con un área valvular <0,75cm 2. La conducta quirúrgica dependía, del mismo modo que en la actualidad, de la aparición de los síntomas. En los últimos años aparecieron trabajos que mostraban evolución adversa con puntos de corte inferiores. Otto CM y colaboradores publican en 1997 el seguimiento de pacientes asintomáticos con estenosis aórtica con evento final muerte ó reemplazo valvular (RVA). En aquellos con aquellos con jet inicial <3m/seg la tasa de muerte ó inicio de síntomas que determinaban el RVA era de 8 %/año, comparado con 17 %/año aquellos con Vmax entre 3-4m/seg y del 40% aquellos que superaban los 4 m/seg de Vmax (Fig.6) (8). Bermejo y colaboradores (9) publican en 2003 análisis comparativo de la eficacia de diferentes índices ecocardiográficos en pacientes con estenosis aórtica basados en la evolución, hallando una sobrevida similar de pacientes con área valvular aórtica menor a 0,75 cm² y aquellos con área entre 0,75 cm² y 1,0cm².(Fig. 7) El único predictor independiente fuera de la gravedad, fue la aparición de síntomas. Vp <3,0 m/s Vp 3,0-4,0 m/s Vp >4,0 m/s A B Fig.7 El panel A muestra la curva de sobrevida en meses de pacientes asintomáticos con estenosis aórtica en función de evento final muerte ó reemplazo valvular (RVA) de acuerdo a la Vp.(8) El panel B muestra curvas de sobrevida del trabajo de Bermejo J y colaboradores de acuerdo a área valvular. Nótese que la sobrevida de pacientes con área valvular < 1cm² es similar a aquellos < 0,75cm².(9) 10. Comportamiento hemodinámico El estudio Doppler fundamentalmente es una evaluación del comportamiento hidráulico del fluido sanguíneo en el sistema circulatorio. La gravedad de la estenosis aórtica se establece por las velocidades y gradientes transvalvulares, sin embargo estos tienen una pobre correlación con la aparición de los síntomas que son los que van a determinar la conducta quirúrgica (1-4). Existen pacientes con estenosis aórtica grave que permanecen tiempos prolongados asintomáticos y otros que con estenosis aórtica moderadas evolucionan precozmente con síntomas. Esto se debe a que las velocidades y los gradientes como el área valvular dan una información parcial del comportamiento hemodinámica, no teniendo en cuenta la interacción del ventrículo y el sistema vascular periférico con la misma. Fenómeno de recuperación de presión (RP) (Fig. 8): A nivel del VI y del TSVI el flujo sanguíneo presenta un comportamiento laminar. A medida que se acerca al orificio valvular estrechado el flujo se acelera hasta producirse una desaceleración del flujo inmediatamente posterior a orificio anatómico 45
47 donde se produce la máxima velocidad y el máximo gradiente entre el VI y la AA, sitio llamado Vena contracta (VC), que es el área hidráulica ó orificio valvular efectivo. Con esta desaceleración del flujo se pierde energía cinética y calórica, traduciéndose en un flujo turbulento que pasando la VC genera vórtices a nivel de la AA (senos valsalva). El Doppler registra la Vmax con el máximo gradiente (Gradiente instantáneo) en la VC, siendo esta el orificio valvular efectivo. A nivel de la AA, trascurriendo algunos centímetros (porción medio de AA) corriente arriba, el flujo recupera parte de la energía dinámica perdida, determinando un gradiente neto con una perdida de energía neta. (Fig. 8) (4, 6, 10) La hemodinamia registra la presión pico a nivel del TSVI y luego, retirando el catéter, a nivel de AA. Si este último no fue inmediatamente pasando la válvula sino con mayor retiro ( pull back ) del catéter, es posible que el gradiente de presión sea menor al tomar la presión luego de haberse recuperado ya parcialmente. Esto aumenta aún más la discordancia entre ambos estudios. (4, 6, 11) La segunda implicancia es la repercusión clínica de la recuperación de presión. En válvulas normales este fenómeno es despreciable. Sin embargo cobra trascendencia en paciente con estenosis aórtica y AA más dilatadas (>30mm) donde habría menos recuperación con mayor gradiente neto. (4,11). Garcia y col. presentan una fórmula simplificada de la perdida de energía (la inversa a la RP), como su valor indexado a superficie corporal (SC) basándose en el área valvular aórtica (AVA) y el área de la AA a nivel sinotubular (10): IPE = [(AVA x A AA )]/ (A AA AVA) SC Donde IPE es índice de perdida de energía, AVA es área valvular aórtica, A AA área de AA medida a nivel de la unión sinotubular y SC es superficie corporal. Este índice expresaría mejor la carga de trabajo ventricular que el área valvular efectiva. Un IPE menor (con punto de corte 0,52cm²/ m²) fue mejor predictor de evento adverso (muerte ó requerimiento de reemplazo valvular) que el AVA efectiva. (10). En la practica es importante comprender este fenómeno, aunque no se calculará en forma rutinaria, saber que pacientes con aortas más dilatadas tendrán peor pronóstico que aquellos con AA más pequeñas con consecuente mayor RP. También tendrá implicancia en la discordancia con el estudio hemodinámica que registra el gradiente pico- pico. (10,11) En los comienzos de la historia natural de esta entidad, las valvas son flexibles, por lo que un incremento de fuerza de contracción ventricular resulta en un aumento del VS con apertura de las valvas y solo pequeño incremento de las velocidades transvalvulares. A medida que las valvas se tornan más rígidas el VI requiere más trabajo sistólico, necesario para abrir la válvula e impulsar el flujo sanguíneo. (4, 6) La perdida de trabajo sistólico (PTS) es una forma para evaluar la carga de trabajo ventricular que junto con el IPE sería un fuerte predictor de evolución clínica en la estenosis aórtica. (9,10). La PTS se puede calcular como cociente entre gradiente medio transvalvular y la presión medio del VI. Se expresa como porcentaje: 46
48 PTS = 100 x Grad medio / (Grad medio + TAS) Bermejo y colaboradores (9) concluyen en su trabajo que los paciente que presentaban un PTS 25% sintomáticos sufrieron en un >95% muerte ó requirieron reemplazo valvular aórtico (RVAo) en los 3 años subsiguientes. Por otro lado aquellos con PTS >23% en un 80% presentan síntomas atribuibles a la estenosis aórtica. Si es >26% la probabilidad de evento en los próximos 3 meses es del 30%, que aumenta al 87% en presencia de síntomas. Dado que la PTS no requiere la medición de flujo evidencia más precisión la probabilidad de evento que el AVA como la RVAo, en particular en pacientes con fibrilación auricular. El concepto de resistencia valvular (RV) se ha utilizado en varios trabajos. Sería un índice menos flujo dependiente a diferencia de los gradientes máximo y medio y el AVA, que son los parámetros clásicos establecidos para gravedad. La resistencia se define como cociente entre gradiente de presión y flujo. (4/9/12) RV= (Gradiente medio /Flujo medio) x 1,333 Donde gradiente medio se expresa en mm Hg, y el flujo es el VS dividido tiempo eyectivo (Tey), y 1,333 es un factor de conversión de mm Hg a din seg cm -5, unidad que expresa la RV. Este parámetro, que fue introducido en los años 50, sin embargo no logró imponerse en la práctica, por la dificultad para establecer un punto de corte por las amplias desviaciones standard en los resultados. (4,12) Aunque recobra particularmente valor en los estados de bajo VM por lo que se ha utilizado en varios trabajos de eco-estrés en la evaluación de estenosis aórtica. (9,13) Una RV < 200 din seg cm -5 se relaciona con estenosis no significativa ó pseudoestenosis aórtica en el estudio de eco-estrés. El 3 er componente es la impedancia vascular, una variante del concepto de acoplamiento ventrículoarterial. Esto recobra importancia clínica dado que la estenosis aórtica generalmente se encuentra asociada a alteraciones que afectan el ventrículo ó el sistema vascular periférico como la insuficiencia aórtica, la cardiopatía isquémica ó la hipertensión arterial. La elasticidad arterial se encuentra reducida y/ó la resistencia vascular periférica aumentada. En pacientes con hipertensión arterial aislada el componente de valvular es despreciable pero en la estenosis aórtica el VI debe soportar una doble carga, la de la Estenosis aórtica y la vascular. Briand M y colaboradores proponen una fórmula modificada para el cálculo de impedancia válvula- arterial (Zav) donde incorpora grado de estenosis valvular y complacencia arterial sistémica. Dicho cálculo se basa en el Gradiente neto (Gnet), la presión arterial sistémica (PAS) y el VS indexado (14) (Fig. 8) Zav = (PAS + Gnet) /VSi El Gnet tiene en cuenta la recuperación de presión (RP) basado en la medición del diámetro aórtico: Gnet = G med - 4V 2 x 2 (AVA/ AA) x (1- AVA/ AA) Donde el G med es el gradiente medio medido por Doppler, AVA el área valvular y AA la aorta ascendente. Un valor 5,0 mm Hg/ml/m2 indicaría excesiva carga ventricular, y uno fuerte predictor de disfunción ventricular. 47
49 TAS PE inicial GMax Presión Gnet Carga valvular Carga vascular Distancia VI VAo VC AA Fig. 7 El cuadro muestra comportamiento de presiones del flujo en función de la distancia recorrida en el circuito vascular. El Flujo se acerca al plano valvular (VAo) donde se produce una desaceleración del flujo produciéndose la máxima caída de presión a nivel de la vena contracta (VC) ó sea el máximo gradiente entre VI y AA, con generación de flujo turbulento con pérdida de energía cinética y calórica A medida que avanza el flujo por la AA recupera progresivamente la presión hasta estabilizarse permaneciendo un gradiente neto (G net), menor al Gmax, que va de la mano de la perdida de energía. 11. Función ventricular (respuesta a la sobrecarga crónica de presión) 11.a. Hipertrofia: La respuesta inicial a la sobrecarga progresiva y lenta es la hipertrofia concéntrica como mecanismo de adaptación a fin de disminuir el estrés parietal, según la ley de Laplace (ver Fisiopatología ), aumentando la masa ventricular. Aunque este mecanismo de adaptación tiene su límite en el punto donde no puede acompañar el grado de aumento de presión intraventricular, iniciando su camino hacia la disfunción ventricular. Se describen en varios trabajos diferencias de sexo en la respuesta a la sobrecarga de presión con diferencias de grosor parietal y masa ventricular. Las mujeres tienden a tener ventrículos más pequeños, con espesores parietales aumentados y por lo tanto menos estrés parietal y función sistólica conservada, a diferencia de los hombres que tienden a dilatar el VI más precozmente con menores espesores parietales y mayor estrés y disfunción ventricular. (1-4, 6) 11.b. Función diastólica: En respuesta al aumento de pos-carga progresiva, como también esperable en la población de mayor prevalencia de esta valvulopatía, que son pacientes añosos en su gran mayoría, el llenado ventricular evidencia un patrón de retraso en la relajación. Este último se caracteriza por una disminución de la relación onda E/ onda A, prolongación del tiempo de la onda E, prolongación del tiempo de relajación isovolúmico entre otros parámetros de identificación cada uno de los patrones. Este patrón en estos pacientes es esperable para la edad y a una pos-carga aumentada, con lo que se encuentran asintomáticos, infiriendo un VFD adecuado al ventrículo (por lo menos en reposo y al momento del estudio). 48
50 El volumen de fin de diástole (VFD) se mantiene normal hasta tardíamente en el curso de la enfermedad, sin embargo aumenta la masa ventricular (MVI) en respuesta a la sobrecarga crónica de presión con aumento de la relación MVI/ volumen. Sin embargo el proceso de hipertrofia es inadecuado y el grosor parietal relativo no aumento en la misma proporción a la PFD. Cuando el ventrículo llega a no poder adaptarse a la pos-carga, produciéndose un aumento del volumen de fin de diástole, este se transmitirá a la aurícula izquierda y consecuentemente al circuito pulmonar. El esta situación se modifica el patrón transmitral inicialmente hacia un patrón pseudonormal y luego restrictivo, según VFD. Esto se evidenciará con una relación onda E/ onda A > 1, un tiempo de desaceleración de la onda E acortado entre otros parámetros que identifican cada uno de los patrones. El Doppler tisular permite en forma adecuada desenmascarar estos patrones, como también informa acerca de la función miocárdica. Una relación E/ Ea (onda E transmitral con respecto a la onda precoz del Doppler tisular) aumentada (> 10 15) tendría correlación la presión sistólica pulmonar, con los síntomas (15,16) y el dosaje de péptido natriurético en paciente con estenosis aórtica grave con función sistólica conservada (17), indicando un aumento de VFD, sugestivo de disfunción miocárdica. 11.c. Función sistólica: Como ya se dijo, el VI se adapta a la sobrecarga de presión a través de la HTVI manteniendo el estrés parietal (pos-carga), manteniendo su función sistólica por tiempo prolongado, acorde a la ley de Laplace. En el momento que la HTVI ya no es concordante a la presión intraventricular, aumenta el estrés parietal, el grosor parietal relativo (GPR) con alteración de la geometría del VI y disminuye la fracción de eyección. (18) Esta última se altera por exceso de poscarga, aunque también se combina con alteración de la contractilidad que contribuye a la disminución de la función sistólica. El GPR muestra la relación entre los espesores y las dimensiones de la cámara, y por lo tanto ponen en evidencia el cambio en la geometría ventricular. Su cálculo es muy sencillo relacionando los 2 parámetros citados. EPR = 2 x PPd / DDVI Donde PPd es la el espesor parietal de la pared posterior del VI tomado desde modo M paraesternal y DDVI es el diámetro VI en diástole en la misma vista. El parámetro más utilizado para evaluar la función ventricular es la fracción de eyección sin embargo los índices de función de cámara tienden a sobreestimar la función miocárdica, en especial en ventrículos hipertróficos secundario a sobrecarga de presión donde la masa VI y EPR se hallan aumentados, en especial en aquellos con EFR > 0,50 (18). La mejor forma de evaluar la función miocárdica es la evaluación de la fibra medioparietal con la fracción de acortamiento mesoparietal (FAm).(18) FAm = DDVI + h) - (DSVI + 2a ) x 100 Área Ao = VTI TSVI x área TSVI (DDVI + h) VTI Ao A partir de las mediciones en modo M donde h: espesor diastólico combinado (PPd +SIVd / 2), hfs: espesor sistólico combinado (PPs +SIVs / 2), a : punto mesoparietal en sístole calculado a partir de la siguiente fórmula: - DSVI] 49
51 Se sabe que la aparición de síntomas y/ó disfunción ventricular son los determinantes para la toma de conducta activa en el curso de esta valvulopatía dado que en este punto de inflexión en la historia natural de la estenosis aórtica la sobrevida de estos pacientes se acorta dramáticamente. El poder anticiparse en la selección de aquellos pacientes que se encuentran en riesgo es fundamental. La aparición de insuficiencia mitral en estos pacientes, agrava la sobrecarga de volumen y aumenta el estrés parietal. (4) 12. Estenosis aórtica bajo flujo/ bajo gradiente (BFBG) Los parámetros citados hasta el momento para evaluación de gravedad presentan buena correlación en ventrículos con adecuado gasto cardíaco capaces de vencer el aumento de pos-carga impuesto por la estenosis aórtica. Sin embargo en un 5% el VI evoluciona hacia la claudicación, con lo que este no será capaz de lograr los gradientes para determinar la gravedad por los mismos (ver Historia natural ) (7). Un ventrículo disfuncionante tendrá mayor dificultad de abrir la válvula aórtica por bajo gasto. En estos casos se dificulta el diagnóstico de gravedad. Muchas veces el estudio comenzará en pacientes con disfunción sistólica y/ ó como estudio de una insuficiencia cardiaca en los que se encuentra una apertura valvular reducida. Es crucial diferenciar aquellos pacientes con miocardiopatía de otra causa en los que la apertura valvular se encuentra reducida por bajo flujo, de aquellos que presentan disfunción ventricular secundario al aumento de la pos-carga por la estenosis aórtica. La identificación de estos últimos con estenosis aórtica grave verdadera es clave ya que se podrán beneficiar con una cirugía correctiva/rvao. Por el otro lado, los pacientes con afección miocárdica de otro origen (primaria, isquémica, etc) y/ó con estenosis aórtica solo leve a moderada requerirán otro tipo de tratamiento.(1-4, 6, 13, 19, 20). La determinación del AVA en pacientes con disfunción ventricular es dificultosa dado que el cálculo del área es directamente proporcional al VM/ volumen minuto por ser tanto los gradientes como el AVA flujo dependiente. Esto lleva a que el área valvular puede sobreestimar la gravedad de la estenosis aórtica, por lo que un área valvular grave y una relación entre gradientes ó VTI TSVI/Ao < 0,25, probablemente se relacione con estenosis aórtica grave.(3, 13, 20) Se define como estenosis aórtica BFBG aquella con gradiente medio <30 ó 40 mmhg, una fracción de eyección < 0,45 y estenosis aórtica grave por área (2, 3, 4, 13, 19, 20). La infusión gradual de dobutamina (DBT), aumentando el flujo transvalvular por aumento del inotropismo, permite diferenciar una estenosis valvular fija (verdadera) de una estenosis aórtica relativa ó pseudoestenosis aórtica.(13, 19, 20). También permite identificar un tercer grupo de paciente que no tienen reserva miocárdica, que independientemente de la causa tienen un pronóstico reservado. (13, 19) La infusión de DBT en pacientes con estenosis aórtica fija ó verdadera incrementa las velocidades pico y el VTI tanto de la válvula aorta como del TSVI, permaneciendo la relación TSVI/Ao. Por lo contrario un incremento de las velocidades y VTI del TSVI (por incremento del VS) sin aumento significativo de los de la válvula aórtica evidencia una pseudo-estenosis aórtica. 50
52 La evaluación de la válvula inicialmente en bidimensional como modo M, visualizar grosor valvular y/ó extensión de calcio, darán una primera impresión de la gravedad probable. 12.a. Recomendaciones para realización de eco-estrés: Clase I Eco estrés con dobutamina en un paciente con dificultad en la evaluación del grado de estenosis aórtica que presenta bajo gradiente transvalvular y deterioro significativo de la función sistólica ventricular. (B) 12.b. Protocolo eco-estrés dobutamina: El examen debe comenzar la evaluación global del VI con función global, fracción de eyección, búsqueda de otras causas de miocardiopatía como la isquémica, la evaluación de la extensión y/ó magnitud de la calcificación de la válvula aórtica en bidimensional, y realizar las mediciones convencionales como diámetro del TSVI, VTI de TSVI y transvalvular aórtico en basal. Se realiza una infusión gradual de de 5 γ/kg/min cada 3 a 5 min hasta 15 a 20 γ/kg/min. (4) En los últimos 2 minutos de cada etapa se tomarán las mediciones correspondientes de Velocidades y VTI en TSVI y AO (aunque se comparará el basal con la máxima dosis), presuponiendo que el diámetro del TSVI permanecerá constante. (14, 20) Los criterios de suspensión son cuando alcanza el 85% de la frecuencia máxima teórica, presencia de angor ú obstrucción dinámica del VI, taquiarritmias como hipotensión arterial. La estimación de la reserva contráctil se puede realizar de dos maneras: 1) a través del escore de motilidad (13), ó 2) el incremento de VS desde basal a la máximo dosis. (20) Se establece como reserva contráctil conservada ó positiva cuando se evidencia un incremento del mismo desde el basal en 20% del escore de motilidad parietal ó el VS. Dado que el VS es parte de la formula de continuidad y se está evaluando las condiciones hemodinámicas de la válvula, probablemente la evaluación con VS sea más objetiva. 12.c. Interpretación (ver cuardro 2): El incremento de velocidades pico (>0,6) y gradiente medio aórtico (>10mmHg) como también la resistencia valvular (RV) sin variación significativa del AVE es diagnóstico de estenosis aórtica fija ó verdadera. Por lo contrario, si las velocidades pico, gradiente medio como la RV aórtica no se modifican significativamente, con el consecuente aumento en el AVE > 0,3cm 2, se interpreta como pseudoestenosis aórtica. Solo los primeros se beneficiarán con un RVAo. Los segundos se beneficiarán con un tratamiento dirigido a recuperar el miocardio afectado por otra causa que no es la estenosis aórtica. (4, 13, 20) Diagnóstico Estenosis aórtica Estenosis aórtica Miocardiopatía fija relativa ó pseudosestenosis aórtica Reserva contractil Positiva Positiva Negativa Velocidad TSVI (Aumenta > 20%) Aumenta (> 20%) < 20%. 51
53 Velocidad pico Ao Aumenta NS NS Gradiente medio Aumenta NS NS Resistencia valvular Aumenta NS NS Área valvular < 0,29 cm 2 > 0,3 cm 2 NS Cuardro 2. Hallazgos en el eco- estrés dobutamina para evaluación de estenosis aórtica BFBG según la etiología 13. Seguimiento/ Progresión En el seguimiento de un paciente con estenosis aórtica debe tenerse mucho cuidado en la técnica y reproducibilidad del estudio. Al evaluar un paciente en el seguimiento, también hay que cuidar que aquel esté hemodinamicamente estable (normotenso, frecuencia cardiaca adecuada, adecuado recuento de glóbulos rojos, etc.), teniendo en cuenta que la mayor parte de los parámetros a rescatar son flujo dependiente. El valor de menor variabilidad intra- e interobservador es la Vp (3,2 y 3,1% respectivamente), similar a la velocidad del TSVI (3 y 3,9% respectivamente) y el valor de mayor variabilidad es la medición del TSVI (5,1 y 7,9% respectivamente). Debido a esto último, y teniendo en cuenta que el diámetro del TSVI no varía anatómicamente con la evolución, conviene realizar una medición adecuada en el estudio inicial y registrar la misma en el informe, para poder utilizar la misma medida en estudios consecutivos. Ya se dijo que el pronóstico dependerá del estatus sintomático, más que de la gravedad hemodinámica recavada en el estudio ecocardiográfico y/ó hemodinámico. Los predictores de gravedad ecocardiográficos serían la velocidad pico (Vp) y/ó gradiente máximo en estudio inicial, el grado de calcificación, magnitud de regurgitación y edad. En el paciente añoso la progresión es más rápida. Una Vp inicial > 4 m/s predice la aparición de síntomas en un 50% de los pacientes en próximos 2 años, cuando < 3m/s se correlaciona con ausencia de síntomas en los siguientes 5 años. (6) Sin embargo en promedio la Vp se incrementa en promedio en cm 0,3m/s (0,2 0,4m/s), 7 mm Hg (0-12 mm Hg) en el gradiente medio y 0,1cm 2 área valvular (0,02-0,3cm 2 ) Sin embargo se insiste en corroborar condiciones hemodinámicas estables, y por otro lado existe la posibilidad que el VI comience a disfuncionar con lo cual los gradientes disminuirán. (4) 14. Situaciones especiales: 14.a. Estenosis aórtica dinámica/ Gradiente subvalvular concomitante: Esta situación dificulta la evaluación de la estenosis aórtica. En primera instancia debe diagnosticarse ó descartar la presencia de gradiente subvalvular dinámico. La morfología del septum interventricular puede ser sugestiva en caso de abombarse sobre el TSVI como también el movimiento anterior sistólico de la mitral por efecto Venturi. El Doppler color es aquí de gran ayuda para identificar el ó los sitios de turbulencia (a nivel medioventricular, subvalvular, valvular y/ó supravalvular. En caso de hallarse turbulencia a nivel del TSVI ó medioventricular debe valorarse el grado de estenosis aórtica (valvular). Es importante aquí la 52
54 impresión subjetiva del operador de la válvula por bidimensional y modo M, visualizar la movilidad valvular, apertura, grado de calcificación. Realizando una valoración con Doppler pulsado, se puede mapear el VI, recorriendo el septum interventricular, para hallar el sitio de aumento de gradiente con la aparición de la imagen típica en daga de la obstrucción dinámica del VI en el Doppler de sonido, con un pico máximo telesistólico. Una vez identificada dicha imagen se procede al mapeo con Doppler continuo ó Pedoff (Doppler continuo ciego), recorriendo la válvula aórtica en 5 cámaras. El Doppler color puede ser de mucha ayuda en la diferenciación de la turbulencia subvalvular y valvular como de un tercer flujo que se aleja que pude ser la insuficiencia mitral. Cuando ambas estenosis coexisten, se dificulta la valoración, principalmente de la estenosis valvular. El flujo del TSVI no puede recabarse con lo que se podrán informar solo gradientes, en caso de poder diferenciarlos claramente. En caso contrario se recurrirá al estudio transesofágico para realizar una planimetría valvular. Hay que diferenciar cuidadosamente la morfología de cada uno de los flujos como también el sonido. Muchas veces el flujo subvalvular y el valvular no se encuentran perfectamente alineados, por la HTVI, pudiendo diferenciar ambos sitios de turbulencia y alinearse con cada uno de ellos. 14.b. Valvulopatías concomitantes: La coexistencia de insuficiencia aórtica, por presentar una sobrecarga de volumen, aumentará los gradientes, aunque, al aumentar tanto el VS como el volumen transvalvular, no interfiere en el cálculo de la ecuación de continuidad. La insuficiencia mitral significativa (ya mencionada), por flujo retrógrado, puede llevar a infravalorar los gradientes aórticos. Por otro lado, debe tenerse cuidado al valorar dos flujos que se dirigen en la misma dirección, tanto el de la estenosis aórtica como el de la insuficiencia mitral, las características ya han sido mencionadas en el apartado de Doppler. 14.c. Fibrilación auricular/ extrasistólia: Esta ocurre en el 5% de los pacientes con estenosis aórtica. La fibrilación auricular puede ser un signo de progresión de enfermedad (ver Fisiopatología), dado que el paciente pierde la contribución auricular. En la valoración ecocardiográfica, cuando el intervalo R-R se encuentra acortado, pude llevar a infravalorar el gradiente. Conviene realizar el estudio una vez compensado el paciente con una frecuencia cardíaca estable ó en caso contrario mencionar en el informe ecocardiográfico las condiciones y sugerir nueva valoración. En el caso que la arritmia se encuentre estabilizada, deben realizarse varias mediciones y realizar un promedia de estas. En cuanto a las extrasístoles, el latido pos-extrasistólico puede sobre-valorar en gradiente por prolongación del intervalo R-R. 14.d. Hipertensión arterial (HTA): Dado que la amplia mayoría de la población con estenosis aórtica es años, frecuentemente se asocia a otros factores de riesgo cardiovasculares. El 35 % al 45% de pacientes con estenosis aórtica tienen concomitantemente HTA. En este caso el VI tendría una doble pos-carga, el componente valvular y el aumento de la resistencia vascular periférica (ver Comportamiento hemodinamico, impedancia vascular). Clínicamente tiene dos implicancias: 1) en presencia de aumento de la resistencia vascular sistémica, las velocidades y gradientes transvalvulares se encuentran disminuidos, pudiendo sobre-estimar el AVA ó infra-estimar la gravedad. 2) En el otro 53
55 extremo se hallan los pacientes con HTA tratados. La vasodilatación periférica con la posibilidad de hipotensión, pude aumentar los gradientes entre VI y AA. Se debe titular cuidadosamente la presión arterial. El ecocardiografista en estos casos sobre-estimará la gravedad, y clínicamente el paciente podrá tornarse sintomático por aumento de los gradientes, por exceso de medicación. Por otro lado se postula que el tratamiento con vasodilatadores a largo plazo, al disminuir la pos-carga, no solo tratar la HTA sino prevenir el remodelado ventricular en la estenosis aórtica. (7) 15. Conclusión: Cuando se realiza un estudio ecocardiográfico Doppler deben, no solo registrarse las imágenes, sino tener en cuenta que se está realizando un estudio hemodinámica no invasivo del paciente que debe interpretarse cuidadosamente para comprender la información que se está recabando y la información que se transmitirá al médico tratante, desencadenando una conducta en base al resultado. En especial debe cuidarse que el paciente esté hemodinamicamente estable, si es factible, al momento del estudio. Y por otro lado, al concluir el estudio, deben coincidir los datos recogidos tanto con la clínica, síntomas, situación hemodinámica y gravedad de la valvulopatía. Abreviaciones: EAo: Estenosis aórtica VI: Ventrículo izquierdo AVA: Area valvular aórtica HTVI: Hipertrofia ventricular izquierda SP: estrés parietal MVI: Masa ventricular izquierda PFD: presión de fin de diástole VFD: Volumen de fin de diástole TSVI: Tracto de salida de VI AA: Aorta ascendente VC: Vena contracta GI: Gradiente instantaneo GPP: Gradiente pico- pico r: radio D: Diámetro VM: Volumen minuto RP: Recuperación de presión IPE: Índice de pérdida de energía PTS: Perdida de trabajo sistólico RVAo: Reemplazo valvular aórtico RV: Resistencia valvular Vp: Velocidad pico Bibliografía 1) Braunwald E. Valvular heart disease. En Braunwald s heart disease. A text book of cardiovascular medicine. Philadelphia : Sauders;2004: ) Consenso de Valvulopatías Actualización Lax J y col. Estenosis aórtica. Rev Arg Cardiol :42-3) ACC/AHA2006 Guidelines for Managemente of Patients with valvular disease. Bonow RO, Carabello BA, Chatterjee K y col. Circulation 2006;114:
56 4) Migliore RA. Estenosis aórtica. En: Piñeiro DJ, Bustamante Labarta MH, Guevara E, Migliore RA, Roisinblit JM, editores. Ecocardiografía para la toma de decisiones clínicas. Buenos Aires; Ed.Médica Panamericana;2005;18: ) Migliore RA. Evaluación de la estenosis aórtica mediante la relación gradiente pico/ gradiente medio: La forma permite ver el fondo? Rev Arg Cardiol.2006;74:95. 6) Otto CM. Valvular aortic stenosis: Disease severity nd timing of intervention. JACC 2oo6;47: ) Lax J, Ciunciulli T, Sacheri C y col. Criterios alternativos para evaluar la gravedad de la estenosis aortica mediante Doppler cardiaco Rev Arg Cardiol : ) Otto CM, Burwash IG, Legget ME, et al. Prospective study of asymptomatic valvular aortic stenosis: clinical, echocardiographic, and exercise predictors of outcome. Circulation 1997;95: ) Bermejo J, Odreman R, Feijoo J y col. Clinical Efficacy of Doppler-Echocardiographic Indices of Aortic Valve Stenosis: A Comparative Test-Based Analysis of Outcome. JACC 2003;41: ) Garcia D, Pibarot P, Dumesnil JG y col. Assessment of Aortic Valve Stenosis Severity: A New Index Based on the Energy. Loss Concept. Circulation 2000;101: ) Gjertsson P, Caidahl K, Svensson G y col. Important pressure recovery in patients with aortic stenosis and high Doppler gradients. Am J Cardiol 2001;88: ) Antonnini-Canterin F, Faggiano P y Zanuttini. Is aortic valve resistente more clinically meaningful than valve area In aortic stenosis? Heart 1999;82: ) defilippi CR, Willett DL, Brickner ME y col. Usefulness of dobutamine echocardiography in distinguishing severe from nonsevere valvular aortic stenosis in patients with depressed left ventricular function and low transvalvular gradients.am J Cardiol Jan 15;75(2): ) Briand M, Odreman R, Feijoo J y colaboradores. Reduced systemic arterial compliance impacts significantly on left ventricular afterload and function in aortic stenosis: implication for diagnosis and treatment. J Am Coll Cardiol 2005;46: ) Casaclang-Verzosa G, Nkomo VT, Sarano ME, Malouf JF, Miller FA Jr, Oh JK. E/Ea is the Major Determinant of Pulmonary Artery Pressure in Moderate to Severe Aortic Stenosis. J Am Soc Echocardiogr. 2008;25: in press. 16) Ommen SR, Nishimura RA, Appleton CP y col. Clinical Utility of Doppler Echocardiography and Tissue Doppler Imaging in the Estimation of Left Ventricular Filling Pressures. A Comparative Simultaneous Doppler-Catheterization Study. Circulation. 2000;102: ) Galema TW, Yap SC, Geleijnse ML, van Thiel RJ y col. Early detection of left ventricular dysfunction by Doppler tissue imaging and N-terminal pro-b-type natriuretic peptide in patients with symptomatic severe aortic stenosis. J Am Soc Echocardiogr ;21(3): ) Migliore RA, Chianelli OP, Adaniya ME y col. Evaluación de la función sistólica en la estenosis aórtica mediante la fracción de acortamiento mesoparietal. Su relación con la hipertrofiarev argent cardiol 2004;72:
57 19) Monin JL, Quéré JP, Monchi M y col. Low-Gradient Aortic Stenosis: Operative Risk Stratification and Predictors for Long-Term Outcome: A Multicenter Study Using Dobutamine Stress Hemodynamics. Circulation 2003;108; ; 20) Schwammenthal E, Vered Z, Moshkowitz Y y col. Dobutamine echocardiography in patients with aortic stenosis and left ventricular dysfunction. Predicting outcome as a function of management strategy. CHEST 2001;119:
58 INSUFICIENCIA MITRAL Dr. Rodolfo Pizarro Médico de Planta de la Unidad Coronaria del Servicio de Cardiología del Hospital Italiano de Buenos Aires. - Insuficiencia Mitral -Fisiopatología - Diagnóstico - Clínico - Pronóstico - Ecocardiográfico: -Criterios de severidad -Historia Natural de la Valvulopatía -Limitaciones y consideraciones -Análisis de los predictores más relevantes: - Parámetros clínico/ bioquìmico: -Clase funcional -Presencia de fibrilación auricular -Péptido natriurèticos. - Parámetros de función ventricular, sobrecarga de volumen y lesión valvular : -Función en reposo y tamaño de VI - -Volumen, Fracción regurgitante y Área del orificio regurgitante efectivo - - Válvula flail. - -Repercusión derecha - Parámetros quirúrgicos: - Pasibilidad de reparación ò preservar cuerdas - Coronariopatìa concomitante. - Tratamiento - Médico - Quirúrgico 57
59 Abreviaturas: AI: aurícula izquierda; AORE: área del orificio regurgitante efectivo; DFD: diámetro fin de diástole; DFS: diámetro fin de sístole; FA: fibrilación auricular; Fey: fracción de eyección; FR. Fracción regurgitante; HTP: hipertensión pulmonar; IM: insuficiencia mitral; PN: péptidos natriuréticos; SC: superficie corporal; VI: ventrículo izquierdo; VD: ventrículo derecho; VR: volumen regurgitante. La insuficiencia mitral es una enfermedad caracterizada por la incompetencia de la válvula mitral generando sobrecarga de volumen en las cámaras izquierdas. Es una enfermedad progresiva con pobre pronóstico a mediano y largo plazo y se asocia a arritmias, falla de bomba congestiva y muerte súbita si el paciente no es intervenido. Sin embargo, una de las cuestiones no del todo aclaradas en esta valvulopatía, así como en otras, es el tiempo quirúrgico adecuado, especialmente en pacientes asintomáticos. Por lo tanto, abordaremos este capítulo desde la etiología hasta las formas terapéuticas hoy aceptadas haciendo hincapié en la mejor evidencia disponible. 1- ETIOLOGÍA y MECANISMO DEL REFLUJO El aparato mitral es una unidad anatómica y funcional compleja compuesta por el anillo mitral, valvas, cuerdas tendinosas, músculos papilares y la pared ventricular subyacente. Diversos mecanismos de la IM están asociados con diferentes consecuencias clínicas y el tratamiento médico ó quirúrgico está destinado directamente al mecanismo específico de cada regurgitación en cada paciente individual 1. Por este motivo, podemos hacer una primera aproximación al diferenciar una regurgitación primaria causada por compromiso anatómico de las cuerdas ó valvas como en el caso de las formas degenerativas ó reumáticas, de una regurgitación secundaria que afecta primariamente el ventrículo izquierdo como es el caso de la etiología isquémica y la miocardiopatía dilatada Otra aproximación es incorporar el mecanismo del reflujo a la etiología (figura 1) que nos permita identificar dos grandes grupos: isquémicas y no isquémicas con mecanismos que influyen directamente sobre el aparato valvular (orgánicas) ó el ventrículo izquierdo (funcionales)
60 Figura 1: Mecanismo de reflujo en la IM funcional post isquémica. Esto queda expresado en la tabla 1 donde se relaciona el mecanismo y la etiología del reflujo: Tabla 1 Etiología y mecanismo de la insuficiencia mitral Etiología Mecanismo NO- ISQUEMICA ISQUEMICA Orgánica Degenerativa, reumática, Ruptura músculo papilar infecciosa, congénita. Funcional Miocardiopatía IM funcional posterior al infarto de miocardio Modificado de Sarano E.Heart 2002; 87: Tan importante como conocer la etiología del reflujo es identificar el mecanismo de la regurgitación ya que nos facilita una mejor comprensión de la valvulopatía en relación al pronóstico y estrategia quirúrgica a seguir 2. En la tabla 2 se relaciona la etiología con los mecanismos probables de la disfunción valvular: 59
61 Tabla 2. Relación entre el proceso de enfermedad valvular y el mecanismo probable de la IM Tipo de alteración Mecanismo probable de IM Enfermedad Mixomatosa Movimiento Excesivo de las valvas (ruptura ó elongación cordal, prolapso de las valvas) Enfermedad Reumática Movimiento restrictivo de las valvas ( acortamiento ó fusión cordal, engrosamiento y rigidez de las valvas) Endocarditis Destrucción del tejido valvular Isquémica - Infarto de la pared inferodorsal Anormal tironeamiento de cuerdas y valvas; alteración de la geometría ventricular con distorsión espacial del anillo y aparato subvalvular (figura 1). -Infarto del músculo papilar Anormal tironeamiento de cuerdas y valvas ( puede ser transitorio) -Ruptura del músculo papilar Avulsión del músculo papilar ; músculo pailar y valvas flail - Miocardiopatía Dilatada ( Isquémica / No Distorsión del ángulo entre le músculo papilar isquémica) y el anillo mitral, dilatación anular Fisiopatología Hay diferentes fases en la IM crónica donde se producen cambios en las cámaras izquierdas que permiten mantener la función contráctil del ventrículo 6-8. En una primera fase compensada, se desarrolla una hipertrofia excéntrica con una adición de sarcómeros en serie que incrementan el volumen total del VI. La precarga se incrementa y el VI se dilata para mantener un volumen anterógrado normal 6-8. Al ventrículo bombear gran parte de su volumen (volumen de regurgitación) a un circuito de baja impedancia mantiene la poscarga normal ó reducida. En la fase descompensada (etapa tardía de la enfermedad) el VI incrementa su tamaño considerablemente y la poscarga se incrementa como consecuencia de una alteración intrínseca de la contractilidad
62 Diagnostico Clínico En el examen físico un desplazamiento del choque de la punta de VI nos indica que el reflujo valvular es grave y crónico generando un agrandamiento cardíaco. No es infrecuente auscultar un tercer ruido ó rolido sistólico temprano que no siempre es indicativo de disfunción ventricular 7-8. La presencia de hipertensión pulmonar nos indica que la patología es avanzada y el pronóstico sombrío 7-8. Un ECG y una radiografía de congestión pulmonar. tórax nos ayudan a establecer el ritmo cardíaco y la presencia de Ecocardiográfico La evaluación por modo bidimensional permite visualizar la estructura valvular en toda su extensión así como el impacto de la sobrecarga de volumen en las cámaras cardíacas 9. La presencia de calcificaciones, retracción, estiramiento, vegetaciones nos permite conocer indirectamente la severidad del reflujo. La presencia de una valva flail se asocia a una significativa regurgitación valvular 9. Si bien el ecocardiograma transtorácico puede darnos una más que acabado diagnóstico de la severidad y el mecanismo del reflujo valvular, el eco transesofágico mejora la visualización del aparato valvular y determina con más precisión el mecanismo de la insuficiencia. La regurgitación crónica se acompaña de cambios significativos en las cámaras cardíacas con el incremento de su tamaño e hipertrofia adaptativa de la pared. Si bien el grado de la regurgitación no es específico en relación a la remodelación de las cámaras cardíacas, su ausencia infiere un grado de regurgitación no grave. En presencia de una IM aguda las condiciones son diferentes ya que no se asocia con un remodelamiento de las cámaras cardíacas como ocurre en la endocarditis infecciosa. Por lo tanto la duración (aguda ó crónica) y la severidad del reflujo son los condicionantes principales de los cambios adaptativos de las cavidades cardíacas. El ecocardiograma Doppler provee una estimación cualicuantitativa del grado de gravedad de la IM, el que es evaluado a través de 9 : Longitud del chorro de reflujo Área del chorro de reflujo en color Relación del chorro de reflujo con el área de la AI. Estimación de la imagen de la vena contracta, evaluando el ancho del chorro en color a través del orificio. Estimación del volumen regurgitante, fracción regurgitante y área del orificio regurgitante efectivo. Evaluación del flujo de las venas pulmonares. 61
63 En la tabla 3 se muestran los parámetros útiles para definir la severidad de la IM y los valores en cada subgrupo de severidad. Hay que tener en cuenta que la longitud y el área del reflujo en color es función de la diferencia de presión entre las dos cámaras: a mayor diferencia, mayor largo y área del reflujo 10. Si la presión en la cámara receptora es alta existe alta presión auricular en la IM aguda el área y largo del chorro son pequeños a pesar de la presencia de una lesión grave 11. Hay que tener en cuenta que estas mediciones (área y longitud del chorro de reflujo) presentan limitaciones técnicas y hemodinámicas El ancho de la vena contracta se define como la región más pequeña y de más alta velocidad del jet de flujo que se localiza en el nivel ó corriente abajo del orificio de regurgitación (figura 2) El área del jet y la vena contracta presentan buenas correlaciones con el grado de gravedad y el volumen de reflujo angiográfico Si bien se demostró que la vena contracta in vitro es independiente de las condiciones de carga, en condiciones in vivo es relativamente independiente de la carga. Por eco- transesofágico se evaluó el tamaño de la imagen de la vena contracta 16 en relación al volumen regurgitante y AORE. Un ancho de la vena contracta >0,5 cm predice un volumen de reflujo de 60 ml y unaore >0,4 cm 2, y un diámetro <0,3 cm. un volumen de reflujo menor a 45 ml y un AORE <0,35 cm 2. Hay estudios que evaluaron con nitroprusiato las características dinámicas de la vena contracta en relación a la reducción de la poscarga demostrando que es dependiente de las condiciones de carga siendo los cambios concordantes con los del volumen del reflujo y el AORE 13. La estimación del volumen, fracción regurgitante y del área del orificio regurgitante efectivo se realiza por dos metodologías, a saber: cuantitativa (volumétrica) y por el área de isovelocidad proximal (método PISA) La medición cuantitativa se realiza de la siguiente manera 18 : los diámetros del anillo aórtico en sístole y el anillo mitral en diástole se miden en el punto de inserción de las valvas, en el borde interno. La vista apical de cuatro cámaras es utilizada para almacenar y digitalizar la señal del Doppler pulsado del anillo mitral y aórtico y, a su vez, calcular las integrales velocidad-tiempo. Se obtiene el promedio de por lo menos tres mediciones de cada variable; deben ser seis en los pacientes con fibrilación auricular. El Doppler continuo se utiliza para estimar la integral velocidad-tiempo del chorro de reflujo Una vez que todos los datos fueron obtenidos, se mide la máxima velocidad de la señal espectral. La medición cuantitativa permite estimar el volumen regurgitante restando el volumen de expulsión de la válvula competente (aórtico) al volumen de expulsión del anillo de la vávula regurgitante (mitral), a saber 18 : Volumen regurgitante = VE válvula reg. VE válvula competente VE= volumen de expulsión 62
64 El AORE es igual al valor del volumen regurgitante dividido por la integral velocidad- tiempo de la regurgitación estimado por doppler continuo, a saber: AORE: volumen regurgitante / IVT velocidad del jet regurgitante IVT: integral velocidad - tiempo El método PISA (sigla en ingles de proximal isovelocity surface area) o área de isovelocidad proximal utiliza la convergencia proximal del flujo. Se estima el flujo regurgitante y se calcula el AORE dividiendo el flujo regurgitante y la velocidad pico de la regurgitación 18 : Flujo a través del orificio: 2 r 2 *Va 2 r 2 : radio de superficie de la hemiesfera Va: velocidad de aliasing donde, a partir de esto se calcula el AORE: 6.28 r 2 * Va/ velocidad pico del jet de regurgitación La estimación del flujo venoso pulmonar 23 es otro parámetro de utilidad a evaluar en pacientes con reflujo mitral. La disminución de la onda sistólica y su reversión indican incremento de la gravedad del reflujo valvular. Otras consideraciones para estimar la severidad de la insuficiencia mitral son las siguientes: con el doppler continuo se pueden evaluar el grado de insuficiencia mediante la intensidad del perfil de flujo y la pendiente de desaceleración 9. La IM se demuestra con la presencia de un espectro intenso, brillante, con las mismas características que el flujo anterógrado 9. Otro método para determinar la severidad de la IM es la medición del pico de velocidad de la onda de llenado temprano (E) del flujo mitral que se incrementa en proporción a la grado de la IM 24. Una velocidad pico E >1,2 m/s presenta una sensibilidad y especificidad de 86%, mientras que un flujo con onda A predominante excluye la presencia de IM grave 24 Limitaciones y consideraciones de la medición ecocardiográfica (tabla 3) Las limitaciones que hay que tener en cuenta en la medición del área y largo del chorro de reflujo son las siguientes 10 : Reflujo excéntrico. Gran dilatación de la aurícula izquierda (la fracción ocupada por el chorro de reflujo puede ser relativamente pequeña). Factores técnicos: hay que tener en cuenta la ganancia, el pulso de repetición, frecuencia y la calidad de la imagen. 63
65 La determinación del grado del reflujo no se debe tomar en base al color solamente El doppler pulsado evalúa semicuantitativamente la IM. Este método se reemplazó completamente por el color. Una de sus limitaciones es subestimar la gravedad de los reflujos excéntricos 25. Los métodos cuantitativos (AORE, volumen y fracción regurgitante) utilizan el modo 2-D junto con la ecocardiografía Doppler. El volumen y la fracción regurgitante se correlacionan bien con la angiografía; sin embargo, la medición derivada de la ecocardiografía Doppler tiende a sobrestimar el volumen de expulsión mitral, y por consiguiente, la jerarquía del reflujo mitral... A su vez, ambos se afectan por las condiciones de carga 20. El AORE es menos influenciado por las variables hemodinámicas. Hay una alta correlación entre éste y la fracción regurgitante, pero con una fracción de regurgitación mayor al 40%, el AORE permite una cuantificación más detallada 20. No obstante, hay limitaciones de estos métodos cuantitativos 20,26 : Son afectados por las condiciones de carga y particularmente el volumen y la fracción regurgitante) Inducen a considerar que el anillo mitral es circular. En los casos de calcificación anular extensa, la se puede producir una distorsión de la geometría del anillo. La presencia de insuficiencia aórtica impide la adecuada medición de los índices. El AORE se incrementa a través de la sístole, lo que lleva a sobrestimar el valor del reflujo (figura 3). El volumen regurgitante se incrementa inicialmente y luego decrece en el final de la sístole. Tabla 3 Ventajas y limitaciones de los parámetros ecocardiográficos en la estimación de la severidad de la IM Parámetro Utilidad Limitaciones Tamaño de cavidades izquierdas El tamaño normal excluye IM grave. El agrandamiento es sensible para determinar la cronicidad de la IM y Puede ser normal en la IM aguda. El agrandamiento es inespecífico, puede verse en otras condiciones. tiene valor pronóstico Área del jet con doppler color Simple, visualización rápida de la gravedad de la IM ; evalúa la orientación espacial del jet Infraestima significativamente jets eccéntricos. Limitaciones técnicas y hemodinámicas. Ancho de la vena contracta Simple, cuantitativo, identifica adecuadamente reflujo leve ó grave Inadecuado en múltiples jets; valores intermedios requieren confirmación; debido a que se miden 64
66 Método PISA Método Cuantitativo (doppler pulsado) Perfil de flujo (doppler continuo) Velocidad pico de la onda E Flujo de la vena pulmonar Cuantitativo. Flujo de convergencia a un límite Nyquist de cm/seg pone en evidencia una probable IM significativa. Se puede estimar la severidad de la lesión (AORE) y la sobrecarga de volumen (VR). Cuantitativo. Válido en jets múltiples y excéntricos. Se puede estimar la severidad de la lesión (AORE) y la sobrecarga de volumen (VR). Simple, fácilmente disponible Simple, fácilmente disponible. La predominancia de la onda A excluye IM grave. Simple. Alta especificidad del flujo reverso para determinar IM grave. valores pequeños, pequeños errores conllevan grandes % de error. No es preciso en jets excéntricos y no es válido en jets múltiples. No es confiable con insuficiencia aórtica asociada. Menos confiable la medición cuando está calcificada la válvula y/ó el anillo mitral. Cualitativo, necesita de información complementaria Influenciada por la presión de AI, relajación VI, área de la válvula mitral y fibrilación auricular. No cuantifica la severidad del reflujo. Influenciada por la presión de AI y fibrilación auricular. No es precisa la medición si el jet se dirige directamente a la vena interrogada. Modificado de Zoghbi WA, Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003; 16:
67 Figura 2 Relación del flujo de isovelocidad proximal con el sitio de mapeo de la vena contracta Nos muestra la relación entre el flujo de convergencia proximal y el sitio de medición de la vena contracta (entre flechas en la imagen en color). Figura 3: Cambios del volumen regurgitante y el área del orificio regurgitatnte efectivo (AORE) en la fase sistólica Tabla 3: Evaluación de la gravedad de la insuficiencia mitral Evaluación de la insuficiencia mitral Leve Moderada Grave Estructurales Tamaño de AI Normal * Normal ó Dilatada Usualmente dilatada** Tamaño de VI Normal * Normal ó Dilatada Usualmente dilatado** Semicuantitativo Área del reflujo (Jet pequeño de 4-8cm 2 8 cm
68 orientación central) <4 cm 2 Área del reflujo/área AI <20% 20-40% 40% Vena contracta <0,3 cm. 0,3-0,69cm 0,7cm Moderadamente Intensidad del intensa (20-50% de la reflujo por Tenue (incompleto) intensidad del flujo Doppler color anterógrado) Flujo de convergencia proximal Intensa (50-70% de la intensidad del flujo anterógrado) 0,5cm 0,5-1,0 1,0 cm. Velocidad Pico E Normal Normal Flujo venoso pulmonar Normal Disminución de la onda sistólica Incrementada (>1,2 m/s) Aplanamiento o reversión de la onda sistólica Cuantitativo Vena contracta(cm) <0,3 0,3-0,69 0,7 Volumen Regurgitante (ml/lat) < Fracción Regurgitante(%) < AORE(mm2) < AORE: Área del orificio regurgitante efectivo. *los valores normales: VI en el eje menor 28mm/m2 ; volumen de fin de diástole 82 ml/m2; diámetro máximo anteroposterior de AI 2 cm/m2; volumen máximo de AI 36 ml/m2. **con excepción de la IM aguda. Modificado de Zoghbi WA, Sarano M, Foster E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. J Am Soc Echocardiogr 2003;16: Puntos clave a tener en cuenta en la medición de la severidad de la IM - Se necesita de múltiples parámetros para determinar la severidad de la IM - El área del jet en color está limitado por consideraciones técnicas y hemodinámicas, por lo tanto, su valor es limitado. - El ancho de la vena contracta discrimina IM leve (< 0.3 cm) de grave (> 0.7 cm) en la mayoría de los casos. - La cuantificación del reflujo por medio del AORE es útil realizarla en la práctica clínica diaria ya sea por el método PISA ó el volumétrico. - Cuando se integra la información de la severidad del reflujo mitral hay que tener en cuenta el tamaño de las cavidades izquierdas (VI, AI), el ancho de la vena contracta, el AORE, VR, FR, flujo venoso pulmonar, y la anatomía valvular. 67
69 PRONOSTICO -Historia Natural La historia natural de la IM está escasamente definida, con rangos amplios de estimación de la sobrevida a mediano y largo plazo En cuanto a la progresión de la IM, son escasos los informes, ya que no se han evaluado con precisión los parámetros hoy conocidos de gravedad del reflujo mitral. Enriquez Sarano y col, demostraron recientemente que la progresión de la IM orgánica se debe a un incremento en la sobrecarga de volumen de reflujo y del área del orificio de reflujo efectivo. Esta progresión es variable y está determinada por la progresión de las lesiones, nueva ruptura valvular o el grado de dilatación del anillo mitral 27. La tasa promedio anual de progresión de la IM fue de 7,4 ml, 2.9% y 5,9 mm 2 para el volumen de reflujo, fracción de reflujo y AORE, respectivamente 27. Los pacientes con insuficiencia mitral pueden permanecer asintomáticos por años, con un promedio del tiempo desde el diagnóstico hasta el comienzo de los síntomas que varía entre los 10 y 20 años 28. Al mismo tiempo, algunos pacientes que presentan IM grave asintomático desarrollan una disfunción ventricular irreversible, que es enmascarada por la reducción de la poscarga generada por el flujo regurgitante 28,30. Hay que destacar, que si bien la causa más frecuente de mortalidad es la insuficiencia cardiaca congestiva, en algunos casos lo es la muerte súbita, aun en ausencia de disfunción ventricular sistólica significativa; sugiriendo que las arritmias juegan un papel importante en el proceso de la enfermedad. Los síntomas y la fracción de eyección (Fey), también deben considerarse al evaluar al paciente con IM, ya que los que presentan clase funcional III-IV tienen una mortalidad considerable, que llega al 34% anual, si no son intervenidos 28. Los que presentan una Fey menor al 60%, tienen una evolución más desfavorable que aquellos con función conservada, es decir una Fey mayor al 60%. Ling y col. reportaron una tasa anual de mortalidad de 6.3 % y los predictores más importantes fueron la edad, presencia de síntomas y baja Fey VI 28. En este trabajo la tasa promedio a 10 años de falla de bomba, fibrilación auricular, y muerte ó cirugía fue de 63 ±8, 30 ±12 y 90 ±3 %, respectivamente figura Sarano y col, evaluaron en un estudio posterior pacientes con función ventricular normal e IM grave orgánica definida por un AORE 40 mm 2 donde la tasa de mortalidad a 5 años fue de 36± 9% y la tasa de eventos cardíaco s de 62 ±8%, aún peor que lo previamente asumido por el mismo grupo 29. Sin embargo, Rosenhek y col. evaluaron en pacientes asintomáticos con IM grave degenerativa una estrategia de seguimiento cercano (clínico y ecocardiográfico) cada 3 a 6 meses y una vez por año en el post- quirúrgico
70 La decisión quirúrgica se tomaba si el paciente presentaba alguno de estos parámetros:dfs > 45 mm (> 26 mm/m 2 ); PSP > 50 mmhg; Fey < 0.60 ; FAC < 0.32; FA recurrente. De los 132 pts, fallecieron 8 (6%) en el preoperatorio y 2 en el postoperatorio tardío, por lo tanto, la sobrevida global fue de 99±1%, 96±2% y 91±3% a los 2, 4 y 8 años, respectivamente 30. Nuestra experiencia en el Hospital Italiano de Buenos Aires, en 128 pacientes asintomáticos con IM grave (85% por prolapso valvular), la tasa libre de síntomas, disfunción del ventrículo izquierdo(una Fey<50%) y/o empeoramiento de la tolerancia a las pruebas ergométricas (SDFVI), fue de 52 7% a los 5 años 31, como se ve en la figura 5. Treinta y siete pts. (29%) presentaron el punto final primario del estudio. Fallecieron 2 pts. en el seguimiento y la mortalidad fue de 0.3%/año 31. Los predictores independientes de SDFVI fueron el DFS > 22mm/m2 y el AORE > 55mm2. A su vez, se estimó el cambio anualizado ( ) de los predictores y el AORE > 5 mm/m2 tuvo implicancias pronósticas en este trabajo 31. En relación a la IM de causa isquémica, un reciente trabajo de Grigioni evaluó la evolución a largo plazo de los pacientes afectados por un IAM de más de 16 días de evolución, en relación a la presencia o no de IM. Los que presentaban una IM a posteriori de un IAM, mostraban peores resultados a largo plazo en relación a los que no la tenían. A su vez, un AORE 20 mm2 discriminó pacientes con evolución adversa en relación a aquellos con < 20 mm2 32. Figura 4. Morbilidad en pacientes tratados médicamente con insuficiencia mitral orgánica ICC: Insuficiencia cardiaca; Fib. A: Fibrilación auricular. Modificado de Ling, et el: N Engl J Med 1996;335:1417 Figura 5: Sobrevida libre de síntomas y/o disfunción VI en pacientes asintomáticos con IM grave.a los 5 años 52 % de los pts. permanecen asintomáticos. Modificado de Krauss J y col. Am Heart J 2006; e1-e
71 %Pts. Asintomáticos con Función VI normal Riesgo promedio anual de síntomas/ disfunción VI: 6.7% Meses - Análisis de los predictores más relevantes en la IM En la evolución de la insuficiencia mitral hay parámetros bioquímicos, clínicos y ecocardiográficos que determinan su evolución, a saber: -Parámetros clínico/ bioquìmico Se destaca la edad, clase funcional (CF), la presencia de fibrilación auricular (FA) y la incorporación de los marcadores plasmáticos (pèptidos natriuréticos): La CF es un predictor independiente de riesgo en la evolución de esta patología como lo demostraron diversos estudios ya que la sobrevida libre de eventos en pacientes en CF I-II es netamente superior a los de CF más avanzada 33. A su vez, la fibrilación auricular (permanente ò paroxística) en el seguimiento se presenta relativamente frecuente. La tasa de FA fue de 18 3 % y de 48 6%, a los 5 y 10 años, con una tasa promedio de 5 0.7% / año
72 Los predictores que se asocian con la FA son la edad 65 años y el diámetro de AI 50 mm.el desarrollo de FA en el seguimiento se asoció a mayor mortalidad cardiaca ó falla de bomba (riesgo relativo ajustado: 2,23, p=0.025) 34. En relación a los péptidos natriuréticos (PN), estos se relacionan con el grado de dilatación auricular y la severidad del reflujo valvular mitral, sin encontrar asociación significativa con las dimensiones y la Fey VI. L a discriminación de los síntomas de los PN evaluada por el área bajo la curva operador receptor (área ROC) fue mejor que otros parámetros clásicos 35,36. En un trabajo reciente, que evaluó pacientes con IM orgánica crónica y Fey VI normal, los PN se relacionaron con el volumen de fin de sístole, volumen auricular izquierdo, FA y síntomas.en el seguimiento, pacientes con BNP 31 versus <31 pg/ml presentaron tasas de sobrevida más reducidas (a 5 años, 72+/-10% versus 95+/-5%, P=0.03) y alta tasa de de muerte y/o ICC (a 5años, 42+/-10% versus 16+/-7%, P=0.03) 37. En relación al valor pronóstico en pacientes asintomáticos con IM grave y FVI conservada, aquellos con NT pro- BNP 105 pg/ml presentaron un riesgo mayor de síntomas y/o disfunción VI en el seguimiento (HR: 4.6; IC 95%: ) 37. La utilización de los péptidos natriuréticos depende del subgrupo a evaluar, es decir, que permitan detectar con precocidad aquellos que evolucionaran en forma más adversa. -Parámetros de función VI y VD, sobrecarga de volumen y lesión valvular -Función y tamaño VI La función ventricular en las valvulopatías es de capital importancia ya que la estrategia con el paciente depende del estado de la función contráctil. Pacientes con Fey < 60%presentan una sobrevida postoperatoria a mediano y largo plazo más reducida, así como mayor incidencia de falla de bomba en el posquirúrgico 28-30, 38,39. También se evaluó el valor del eco estrés con ejercicio en pacientes asintomáticos con IM severa para determinar la capacidad de predicción de la disfunción VI. Aquellos con reserva contráctil + presentaban menor disfunción VI postoperatoria en el seguimiento
73 En la IM orgánica, en pacientes con Fey VI menor al 60% y/o con el diámetro de fin DFS igual o mayor a 40 mm deben ser tenidos en cuenta con para indicar la cirugía. Se considera que con estos parámetros existe una evidente disfunción ventricular. Estudios recientes han demostrado que el DFS igual o mayor a 40 mm es un valor útil para discriminar pacientes con disfunción ventricular oculta Matsumura y col. 42 estudiaron 171 pacientes con IM moderada a severa que realizaron reparación mitral. La incidencia de disfunción VI post-operatoria fue mas frecuente en pacientes con Fey VI <55% y DFS 40 mm y la incidencia de disfunción de VI en pacientes con DFS 40 mm versus DFS < 40 mm fue de 23% vs. 6%. Un trabajo de nuestro hospital 43, demuestra que pacientes con DFS 40 mm presentan una incidencia de muerte y/o disfunción VI postoperatoria elevada. La sobrevida libre de muerte en el grupo I (DFS < 40 mm) fue de 83 4%, en el grupo II (DFS 40-44mm) de 65 4% y grupo III (DFS 45mm) de 67 7%, log-rank p< También se evaluó la falla de bomba congestiva en el seguimiento presentando los grupos I, II y III a los 10 años una sobrevida libre de falla de bomba de 75 6%, 60 5 % y 50 6%, respectivamente, log rank p< Estudios previos han reportado que el diámetro de fin de diástole (DFD) >70 mm y la fracción de acortamiento <31% predicen resultados desfavorables post-quirúrgicos 44,45. El remodelamiento auricular estimado por el índice AI corregido por SC ( 40 ml/m2) es un predictor independiente de muerte y necesidad de cirugía valvular mitral Lesión valvular La cuantificación de la IM mediante el volumen, fracción regurgitante y área del orificio regurgitante efectivo (AORE) es de valor diagnostico y pronóstico 29,47. Un punto importante es la determinación del grado de lesión valvular por intermedio del AORE es que permite evaluar la patología desde otro punto de vista. La probabilidad de eventos cardíacos con un AORE 40 mm2 se asoció a mal pronóstico, como se enunció previamente 29. En nuestro centro se llevó a cabo una investigación en pts. con IM grave asintomática que demuestra la asociación independiente del AORE en la predicción de disfunción ventricular izquierda y mala tolerancia al ejercicio en el seguimiento. Nuevamente, en este trabajo, el AORE se asocia a los parámetros de función y sobrecarga de volumen VI para mejorar la predictibilidad de eventos postquirúrgicos
74 En el análisis multivariado, los predictores independientes de la progresión a síntomas y/o la disfunción de VI en el seguimiento fueron: el DFS >22mm/m 2 [RR: 4.5; 95%CI: ; p<0.02); p<0,02]; AORE> 55 mm 2 [RR: 6.3; 95% CI: ; p<0.001] y el cambio anualizado del AORE >15 mm 2 [RR:4.3 (IC 95%:2,2-6.4); p<0.001]. 31 Es de considerar la probabilidad de disfunción VI y/o síntomas en relación al DFS y AORE al ingreso del estudio, como se expresa en la tabla Tabla 4. Estratificación del riesgo basado en las mediciones del DFS y AORE al ingreso Variable Valor Probabilidad de PSDVI DFS >22mm/m 2 15%/año 16-22mm/m 2 5%/año <16 mm/m 2 0.5%/año AORE >55 mm 2 25%/año 45-55mm 2 3%/año <45 mm 2 0%/año DFS: diámetro de fin de sístole basal. AORE: Área del orificio de reflujo efectivo basal. PSDVI: progresión de síntomas y/o disfunción del ventrículo izquierdo en el seguimiento. Krauss J. Am Heart J 2006; : e1-e8. Un estudio reciente de Enriquez Sarano y col. evaluó el valor pronóstico del AORE en 456 pacientes asintomático con IM (80% con prolapso mitral). 29 Un AORE > 40 mm 2 en relación a aquellos con AORE < 20 mm 2 presentaron un incremento del riesgo de muerte por cualquier causa ( riesgo relativo ajustado 2.9; IC 95% : ; p<0.01), muerte por causa cardíaca (riesgo relativo ajustado 5.21; IC 95% : ; p<0.01) y eventos cardíacos ( muerte cardíaca, insuficiencia cardíaca y nueva fibrilación auricular) (riesgo relativo ajustado 5.66; IC 95% : ; p<0.01), ajustado a edad, sexo, Fey VI, diabetes y fibrilación auricular. 29 Por lo tanto, podemos afirmar que es necesario una adecuada cuantificación del grado de reflujo valvular ya que resulta una información valorable no sólo desde el punto de vista de la severidad de la lesión sino desde la estratificación del riesgo, especialmente en la IM grave asintomatica. -- -Repercusión cavidades derechas La repercusión del VD con la consecuente sobrecarga y alteración de la función contráctil es un hecho no muy frecuente en pacientes asintomáticos con FVI conservada, aparece en estados avanzados de la enfermedad y se asocian a reflujo grave y disfunción sistólica de VI. La respuesta del VD al ejercicio ha sido evaluada como predictor de eventos adversos en la IM asintomática grave. La presencia de HT pulmonar (> 50 mmhg) se asocia a un empeoramiento clínico y mala evolución 8, 47,48. - Parámetros quirúrgicos (se detallan a continuación) 73
75 Tratamiento Médico No hay tratamiento médico que afecte directamente el proceso de enfermedad primaria de la válvula mitral. 49 Los vasodilatadores reducen la poscarga con el consiguiente aumento del flujo aórtico y disminución del grado de reflujo, favoreciendo a retardar la remodelación ventricular. En este sentido, se realizaron estudios pequeños a corto plazo con disminución de la resistencia vascular sistémica y modestas reducciones del VR y FR La idea de utilizar vasodilatadores en la IM orgánica en pacientes asintomáticos y función ventricular normal para mejorar el pronóstico no ha sido consistente. Por un lado se postuló que pueden retrasar la aparición de síntomas y el reconocimiento de la disfunción VI y por otro que se genera un estado de baja poscarga crónico. Sólo ha sido beneficioso el uso de vasodilatadores en pacientes sintomáticos con dilatación y disfunción VI. Faltan ensayos clínicos controlados para determinar el verdadero impacto pronóstico de los vasodilatadores en pacientes asintomáticos con IM grave y función ventricular conservada Quirúrgico El tratamiento quirúrgico en pacientes con IM grave impacta favorablemente en el pronóstico de este grupo 8, 49, La reparación mitral es otro de los avances en esta valvulopatìa ya que permite preservar la estructura valvular- subvalvular favoreciendo a una mejor conservación de la función ventricular izquierda. Esto preferentemente en la IM degenerativa donde el éxito de la técnica es mayor que en otras etiologías. La reparación ofrece una menor disfunción contráctil y una menor dilatación postoperatoria. La sobrevida a largo plazo en pacientes con reparación mitral es mejor que los que han sufrido un reemplazo valvular, independientemente del grado de disfunción ventricular preoperatoria y la presencia de coronariopatía asociada 53,55.La incidencia de endocarditis y de fenómenos tromboembólicos es menor y los pacientes reparados no se anticoagulan a largo, salvo alguna indicación precisa, como la fibrilación auricular y el antecedente de accidente cerebrovascular embólico En relación a la IM funcional, aún grados moderados de reflujo ( 30 ml/ lat ó AORE 20 mm 2 ) presentan serias consecuencias clínicas 32, 57. Sin embargo, en relación a la evidencia, la IM funcional isquémica no parece mejorar con su resolución ya que no revierte el remodelamiento y no mejora la 74
76 sobrevida en relación a la cirugía coronaria aislada 58,59. En la IM funcional secundaria a miocardiopatía la reparación no parece ofrecer una mejor sobrevida en relación al tratamiento medico 60. En este contexto, la cirugía mitral tiene limitaciones ya que el reflujo recurre frecuentemente ya que el remodelamiento ventricular persiste generando la reaparición del tironeamiento de las valvas después de la anuloplastia 61. Por lo tanto, faltan estudios controlados en los cuales la única diferencia entre casos y controles sea el tratamiento de la IM funcional En la tabla 5 y 6 se expone los parámetros de mayor riesgo de eventos y las indicaciones del tratamiento quirúrgico. Tabla 5: Parámetros que se relacionan con un mayor riesgo quirúrgico y peor pronóstico alejado: Parámetro Valor Referencia Edad > 60 años * 54 Péptidos natriuréticos NT pro- BNP 105 pg/ml 37 BNP 31 pg/ml Fracción de eyección <60% 38 Diámetro de fin de sístole 40mm i43 Diámetro de fin de sístole/ Superficie corporal >22mm/m 2 definido. Tasa de cambio del DFS / año >5 mm/m 2 31 Diámetro de fin de diástole >70mm ii44,45 Estrés de fin de sístole >195mmHg 44,45 Índice de AI / SC 40 ml/ m 2 46 Volumen de AI > 120 cm3 31 Volumen de fin de sístole/ Superficie >50ml/m 2 46 corporal Área del orificio regurgitante efectivo > 55 mm 2 (orgánica) mm2 ( isquémica) 32 Tasa de cambio del AORE / año > 15 mm2 31 Respuesta del VD al ejercicio Incremento del la FEy 47 VD con el ejercicio Elevación de la presión sistólica > 50 mmhg 48 pulmonar *la presencia de coronariopatía concomitante eleva el riesgo Error! Marcador no Tabla 6: Indicaciones del tratamiento quirúrgico en la IM crónica de causa orgánica según la ACC/ AHA de 2006: Recomendaciones de cirugía valvular en pacientes con insuficiencia mitral grave no isquémica Indicación 1.Pacientes sintomàticos con IM aguda I ( B) 2.Pacientes con IM crònica severa en CF II, II, IV en la ausencia de severa disfunciòn VI ( FEYVI <30%) 75
77 y/ò DFS >55 mm. I (B) 3.Pacientes asintomàticos con IM crònica severa y leve a moderada disfunciòn VI, FEYVI entre 30%-60%, y/ò DFS 40 mm I(B) 4.La plàstica mitral es recomendada en la mayorìa de los pacientes con IM crònica que requieren cirugìa valvular y deben ser referidos a un centro de complajidad para realizareste procedimiento.i(c) 5. La plàstica mitral es razonable realizarla en centro quirùrgicos de experiencia, en pacientes asintomàticos con funciòn ventricular preservada ( FEYVI > 60% y DFS < 40 mm ), en donde el éxito del procedimiento sea > 90% II a (B) 6. La cirugìa mitral es razonable en pacientes asintomàticos que presentan IM crònica severa con funciòn ventricular preservada y fibrilaciòn auricular de apariciòn reciente. IIa( C) 7. La cirugìa mitral es razonable en pacientes asintomàticos que presentan IM crònica severa con funciòn ventricular preservada e hipertensiòn pulmonar ( presiòn sistòlica pulmonar > 50 mmhg en reposo ò > 60 mmhg con el ejercicio).iia (C) 8. La cirugìa mitral es razonable en pacientes con anormalidad primaria de la vàlvula mitral que presentan IM crónica severa en CF III-IV y disfunciòn ventricular izquierda severa ( FEYVI < 30% y/ò DFS > 55 mm) en quienes la reparaciòn valvular es altamente posible. IIa(C) 9.La reparaciòn mitral se debe considerar en apcientes con IM crònica severa secundaria a severa disfunciòn VI ( FEYVI < 30% ) y sìntomas en CF III-IV persistentes, a pesar de la terapia medicamentosa completa y el marcapaseo biventricular.iib(c) 10.La cirugìa mitral no està indicada en acpeintes asintomàticos con funciòn VI preservada ( FEYVI > 60% y DFS < 40 mm) en quienes la posibilidad de reparaciòn valvular es dudosa.iii(c) 11. La cirugìa mitral no està indicada en pacientes con IM aislada leve a moderada. III(C) FEYVI:fracciòn de eyecciòn VI;DFS:diàmetro de fin de sìstole;cf:clase funcional. 76
78 Modificado de Bonow y col. ACC/AHA Task Force report. J Am Coll Cardiol 2006;48 e1 e
79 i Bibliografía 1- Otto CM. Valvular regurgitation: diagnosis, quantification and clinical approach. In Otto CM, Textbook of clinical echocardiography, 2 nd. Ed. Philadelphia:WB Saunders, 2000: Sarano M.Timing of mitral valve surgery. Heart 2002; 87: Hung J, Otsuji Y, Handschumacher MD, et al. Mechanism of dynamic regurgitant orifice area variation in functional mitral regurgitation. J Am Coll Cardiol 1999;33: Yiu SF, Enriquez Sarano M, Tribouilloy C, et al. Determinants of the degree of functional mitral regurgitation in patients with systolic left ventricular dysfunction. Circulation 2000;102: Levien RA, Schwammenhtal E.Ischemic mitral regurgitation on the threshold of a solution: from paradoxes to unifying concepts.circulation. 2005;112: Borer JS, Bonow RO. Xontemporary approach to aortic and mitral regurgitation. Circulation 2003 ; 108: Braunwald E: Mitral insufficiency. E Braunwald (ed):heart Disease, a text book of cardiology, Philadelphia WB Saunders, 4th edition 1992; pg Bonow RO, CarabelloBA, Chaterjee K, et al. ACC/AHA Guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/ American Heart Association. J Am Coll Cardiol 2006; 48: Zoghbi WA, Sarano M, Foster E, et al. Recommendations of evaluation of native valvular regurgitation with two dimensional and doppler echocardipgraphy. J Am Soc Echocardiogr 2003; 16: Sahn DJ. Instrumentation and physics factors related to visualization of stenotic and regurgitant jets by color Doppler flow mapping. J Am Coll Cardiol 1988; 12: Levine HJ, Gaasch WH. Vasoactive drugs in chronic regurgitant lesions of the mitral and aortic valves. J Am Coll Cardiol 1996; 28: Yoran C. Dynamic aspects of acute mitral regurgitation : effects on ventricular volume, pressure, and contractility on the effective regurgitant orifice area. Circulation 1979; 60: Kizilbash AM, et al. Effects of afterload reduction on vena contracta width in mitral regurgitation. J Am Coll Cardiol 1998; 32: Hall SA, Brickner ME, Willet DL et al. Assessment of mitral regurgitation severity by Doppler color flow mapping of the vena contracta. Circulation 1997;95: Heinle SA, Hall SA,Brickner ME, et al. Comparison of vena contracta width by multiplane transesophageal echocardiography with quantitative Doppler assessment of mitral regurgitation. Am J Cardiol 1998; 81: Grayburn PA, Freske W, Omran H, et al. Multiplane transesophageal echocardiographic assessment of mitral regurgitation by Doppler color flow mapping of the vena contracta.am J Cardiol ;74: Enriquez Sarano M, Bailey KR, Seward JB,et al. Quantitative doppler assessment of valvular regurgitation.circulation 1993;87: Enriquez-Sarano M, Seward JB, Bailey KR, et al. Effective regurgitant orifice area: a noninvasive Doppler development of an old hemodynamic concept. J Am Coll Cardiol 1994;23: Enriquez Sarano M, Tajik AJ, Bailey KS, et al. Colr flow imaging compared with quantitative doppler assessment of severity of mitral regurgitation:influence of eccentricity jet and mechanism of regurgitation. J Am Coll Cardiol 1993;21: Enriquez Sarano M, Miller FA, Jr, HayesSN, et al Effective regurgitant orifice area ; clinical use and pitfalls of the proximal isovelocity surface area method. J Am Coll Cardiol 1995; 25: Pu M, Prior DL, Fan X, et al. Calculation of mitral regurgitant orifice area with use of simplified proximal convergence method : initial clinical applications. J Am Soc Echocardiogr 2001; 14: Dujardin KS, Enriquez Sarano M,Bailey KR, et al. Grading ofmitral regurgitation by quantitative dopplerechocardiography. Calibration by left ventricular angiography in routine clinincal practice. Circulation 1997;96:
80 23-Pu M, Griffin PB, Vandervoot PM, et al. The value of assessing venous flow velocity for predicting severity of mitral regurgitation: a quantitative assessment integrating left ventriuclar function. J Am Soc Echocardiogr 1999; 12: Thomas L, Foster E, Schiller NB. Peak mitral inflow velocity predicts mitral regurgitation severity. J Am Coll Cardiol 1998; 31: Chen C, Thomas JD, Anconina J, et al. Impact of impinging wall jet on color doppler quantification of mitral regurgitation. Circulation 1991; 84: Enriquez Sarano M, Sinak LJ, Tajik AJ, et al. Changes in rergurgitant orifice throughout systole in patinta with mitral valve prolapse. Circulation 1995; 92: Enriquez-Sarano M, Basmadjijan AJ,Rossi A, et al. Progression of mitral regurgitation. A prospective doppler echocardiographic study. J Am Coll Cardiol 1999;34: Ling LH, En riquez Sarano M, Seward JB, et al. Clinical outcome of mitral reguritation due to flail leaflet.n Engl J Med 1996;335: Enriquez Sarano M, Avierinos DMZ, Detaint D, et al. Quantitative determinants of the outcome of asymptomatic mitral regurgitation. N Engl J Med 2005 ; 352: Rosenhek R, Rader F, Klaar V, et al: Outcome of watchful waiting in asymptomatic mitral regurgitation. Circulation 2006; 113: Krauss J, Pizarro R, Oberti PF, et al. Prognostic implication of valvular lesion and left ventricular size in asymptomatic patients with chronic organic mitral regurgitation and normal left ventricular performance. Am heart J 2006;152:e Grigioni F, Enriquez Sarano M, Zehr KJ, et al. Ischemic mitral regurgitation: Long- term outcome and prognostic implications with quantitative doppler assessment.circulation 2001;103: Triboulloy CM, Enriquez-Sarano M, Schaff HV, et al. Impact of preoperative symptoms on survival after surgical correction of organic mitral regurgitation. Circulation 1999;99: Grigioni F, Avierinos JF, Ling LH, et al. Atrial fibrillation complicating the course of degenerative mitral regurgitation. J Am Coll Cardiol 2002; 40: Sutton TM, Stewart RA, Gerber IL, et al.plasma natriuretic peptide levels increase with symptoms and severity of mitral regurgitation. J Am Coll Cardiol 2003 ; 41: Detaint D, Messika Zeitoun D, Avierinos JF, et al. B-type natriuretic peptide in organic mitral regurgitation: determinants and impact on outcome. Circulation. 2005;111: Arias A, Oberti P, Falconi M y col. Utilidad pronóstica de los péptidos natriuréticos en la insuficiencia mitral grave asintomática: Su asociación a las variables clínicas y ecocardiográficas. Rev Arg Cardiol 2007 ( abstr.). 38- Enriquez-Sarano M, Tajik AJ, Schaff HV, et al. Echocardiographic prediction of left ventricular function after correction of mitral regurgitation: results and clinical implications. J Am Coll Cardiol. 1994;24: Leung D, Griffin B, Stewart W, et al. Left ventricular function after valve repair for chronic mitral regurgitation: predictive value of preoperative assessment of contractile reserve by exercise echocardiography. J Am Coll Cradiol 1996, 28: Lee R, Haluska B, Leung DY, et al. Fubctional and porgnostic implications of left ventricular contractile reserve in patients with asymptomatic severe mitral regurgitation. Heart 2005; 91: Flemming MA, Oral H, Rothman ED, et al. Echocardiographic markers for mitral valve surgery to preserve left ventriuclar performance in mitral regurgitation. Am Heart J 2000; 140: Matsumura T, Ohtaki E, Tanaka K, et al. Echocardiographic prediction of left ventricular dysfunction after mitral valve repair as an indicator to decide the optimla timing of repair.j Am Coll Cardiol 2003; 42: Pizarro R,Oberti P F, Falconi, M y col. Predictibilidad de los resultados posquirúrgicos en la insuficiencia mitral severa orgánica: revaluación de los índices de tamaño y función ventricular izquierda y lesión valvular. Rev Arg Cardiol 2003; 71:409-16, 44-Zile MR, Gaasch WH, Carroll JD, et al. Chronic mitral regurgitation: predictive value of preoperative echocardiographic indexes of left ventricular function and wall stress. J Am Coll Cardiol 1984;3: Ross J Jr. Left ventricular and the timing of surgical treatment in valvular heart disease. Ann Intern Med 1981;94: Messika- Zeituon D, Bellamy M, Avierinos JF, et al.left atrial remodelling in mitral regurgitation-- methodologic approach, physiological determinants, and outcome implications: a prospective quantitative 79
81 Doppler-echocardiographic and electron beam-computed tomographic study.eur Heart J ;28(14): Rosen SE, Borer JS, Hochreiter C, et al. Natural history of the asymptomatic/ minimally symptomatic patient with severe mitral regurgitation secondary to mitral valve prolapse and normal right and left ventricular performance. Am J Cardiol 1994;74: Borer JS, Hochreiter C, Rosen S. Right ventricular function in severe non-ischaemeic mitral insufficiency. Eur Heart J 1991; 12(sup.): Otto C. Timing of surgery in mitral regurgitation. Heart 2003; 89: Henning K, Jan A, Knud S, et al. Pre-load and afterload reduction in chronic mitral regurgitation : a double blind randomized placebo-controlled trial of the acute and 2 weeks effect of nifedipine or isosorbide dinitrate treatment on left ventricular function and the severity of mitral regurgitation. British Journal of Clinical Pharmacology 1996;41: Tischler M, Rowan M, Michaelanne RN, et al. Effect of enalapril therapy on left ventricular mass and volumes in asymptomatic chronic, severe mitral regurgitation secondary to mitral valve prolapse. Am J Cardiol 1998;82: Dujardin KS, Enriquez Sarano M, Bailey KS, et al. Effect of losartan on degree of mitral regurgitation quantified by echocardiography. Am J Cardiol 2001; 87: Enriquez Sarano M, Schaff HV, Orszulak TA, et al. Valve repair improves the outcome of surgery for mitral regurgitation. Amultivariate analysis.circulation 1995;91: Thourani VH, Weintraub WS, Guyton RA, et al. Outcomes and long-term survival for patients undergoing mitral valve repair versus replacement: effect of age and concomitant coronary artery bypass grafting.circulation 2003; 108: Enriquez Sarano M, Schaff HV, Frye RL. Mitral regurgitation: what causes the leakage is fundamental to the outcome of valve repair.circulation. 2003;108: Russo A, Grgioni F, Avierinos JF, et al. Thromboembolic complications after surgical correction of mitral regurgitation. J Am Coll Cardiol 2008;51: Craig Miller D. Ischeic mitral regurgitation redux-to repair or to replace? Journal of Thorac Cardiovas Surg 2001;122: Byrne JG, Aklog L, Adams DH. Assessment and management of functional or ischemic mitral regurgitation. Lancet 2000; Prifti E, Bonacchi M, Giunti G, et al. Ischemic mitral valve regurgitation grade II-III: correction in patients with impaired left ventricular function undergoing simultaneous coronary revascularization. J Heart Valve Dis 2001;10: WuAH, Aaronson KD, Bolling SF, et al. Impact of mitral valve annuloplasty on mortality risk in aptients with mitral regurgitation and left ventricular systolic dysfunction. J Am Coll Cardiol 2005; 45: Gorman JH III, Gorman RC. Mitral valve surgery for heart failure: a failed innovation? Semin Thorac Cardiovasc Surgery 2006;18:
82 Estenosis Mitral Dra. María Elena Adaniya Fisiopatología e historia natural La estenosis mitral es una obstrucción al tracto de entrada del ventrículo izquierdo como resultado de una anormalidad estructural en el aparato valvular mitral, que en condiciones normales provee una adecuada apertura durante la diástole permitiendo un efectivo llenado ventricular izquierdo. La causa más frecuente de EM es la carditis reumática. La EM aislada ocurre en el 22% de todos los pacientes con enfermedad reumática, y en aquellos con EM aislada la carditis reumática se halla presente en el 60% de los casos (1-2). La malformación congénita de la VM ocurre raramente y es detectada principalmente en la infancia y en la adolescencia (3). Causas adquiridas de obstrucción de la válvula mitral fuera de la enfermedad reumática son raras. Estas incluyen el mixoma de la aurícula izquierda, trombo valvular en bola, mucopolisacaridosis, extensa calcificación del anillo mitral. En pacientes con EM debido a fiebre reumática, es el proceso inflamatorio quien recrea cambios histopatológicos causante del engrosamiento, fusión comisural, fusión cordal, calcificación ó combinación de todos ellos (3,4). El resultado es un aparato valvular en forma de túnel cuyo orificio, se halla disminuído de tamaño. La fusión intercordal oblitera el orificio secundario y la fusión comisural estrecha el orifico principal (3,4). El área valvular mitral normal es de 4 cm² a 5 cm². El Estrechamiento gradual del área valvular mitral a 2,0 cm² ó menos, los síntomas comienzan a desarrollarse generalmente promovidos por ejercicios moderado ó excesivo (5). Con la reducción del área valvular mitral mediado por el proceso reumático, la columna sanguínea fluye desde la aurícula al ventrículo izquierdo durante la diástole movido por un gradiente de presión. El gradiente de presión diastólico transmitral es la resultante de un incremento de la presión de la aurícula izquierda el cual se refleja en forma retrógrada hacia la circulación venosa pulmonar (6). La disminución de la complacencia venosa pulmonar, que resulta en parte del incremento de la tasa de endotelina-1, podría contribuir al incremento de la presión venosa pulmonar (7). Incremento de la presión y distensión de las venas pulmonares y capilares llevarían al edema pulmonar como expresión de un exceso de presión venosa sobre la presión oncótica plasmática. Sin embargo en pacientes con obstrucción crónica valvular mitral con presiones venosa pulmonares elevadas el edema pulmonar podría no ocurrir debido a una marcada disminución de la permeabilidad microvascular. Las arteriolas pulmonares pueden reaccionar con vasoconstricción, hiperplasia intimal e hipertrofia medial, conduciendo a la hipertensión arterial pulmonar. Con una reducción del área valvular a 1,5 cm² ó menos, generalmente los síntomas raramente se manifiestan en reposo (8). Sin embargo el primer síntoma de disnea en pacientes con EM leve es usualmente precipitado por el ejercicio, el estrés emocional, infecciones, el embarazo, ó la fibrilación auricular con rápida respuesta ventricular (8) disminuyendo la tolerancia al esfuerzo. Por lo tanto si se 80
83 produce un incremento de la frecuencia cardíaca con incremento del flujo y disminución de tiempo de llenado diastólico se producirá un aumento de la presión de la aurícula izquierda consecuentemente el desarrollo de síntomas. A partir de consideraciones basadas en principios de hidráulica donde para un orificio con una dimensión dado el gradiente (transmitral) se halla en función de la raíz cuadrada del flujo (transvalvular) y es dependiente del tiempo de llenado (diastólico) (5). Por lo tanto inicialmente los síntomas de disnea en una estenosis mitral leve se precipitan por el ejercicio, los procesos febriles infecciosos, la anemia, el estrés emocional, el embarazo ó la presencia de fibrilación auricular de alta respuesta ventricular (8). Con incremento de la severidad de la estenosis, el gasto cardíaco comienza a ser subnormal en reposo (8) y claudica ante una demanda mayor, con el esfuerzo (9). El grado de enfermedad vascular pulmonar es un importante determinante de los síntomas en pacientes con estenosis mitral (7, 8, 10). Una segunda obstrucción al flujo desarrollada a partir del incremento de la resistencia arteriolar pulmonar (10,11) puede proteger al pulmón del edema pulmonar (10, 11), así como en algunos pacientes, se suma el desarrollo de una obstrucción a nivel de las venas pulmonares (12,13). En paciente con estenosis mitral severa, el bajo gasto cardíaco y el incremento de la resistencia arteriolar pulmonar resultan de cambios funcionales y estructurales (engrosamiento de la membrana basal alveolar, adaptación de los neuroreceptores, e incremento del nivel endotelina transpulmonar) los cuales contribuyen a mantenerse mínimamente sintomático por períodos prolongados de tiempo (8, 10, 11). La historia natural de pacientes con estenosis mitral no tratada han sido definidas a partir de estudios en 1950 y 1960 (1, 2). La estenosis mitral es una continua, lenta y progresiva enfermedad, de curso estable en los primeros años seguida de una progresiva aceleración en los períodos más tardíos (1, 2). En países desarrollados, manifiestan largos período de latencia desde los 20 a los 40 años a partir de la ocurrencia de la fiebre reumática al comienzo de los síntomas. Una vez que se desarrollan los síntomas un período de al menos una década antes que los mismos sean incapacitantes (1). Del conjunto total, la sobreviva a los 10 años de pacientes con EM no tratados es del 50% y 60% dependiendo de los síntomas a la presentación (1,2, 12). En pacientes sintomáticos ó mínimamente sintomáticos la sobrevida es mayor en el 80% a los 10 años, un 60% de los pacientes no presentan progresión de los síntomas (2,12,13), sin embargo una vez que síntomas limitantes significativos aparecen, la tasa de sobrevida a los 10 años alcanza la penosa cifra de 0 a 15 %. (1,2, 13). Sin embargo una vez que la hipertensión pulmonar se presenta la sobreviva media cae a 3 años (14). La mortalidad de los pacientes con EM no tratados es debido a la progresiva congestión pulmonar en el 60% al 70%, embolismo sistémico en el 20% al 30%, el embolismo pulmonar en el 10%, infecciones en 1% a 5% (2, 15). En Norteamérica y Europa, ésta clásica historia de EM han sido reemplazada con un leve retardo en el curso con declinación en la incidencia de la fiebre reumática (13,16). La edad promedio de presentación es ahora en la quinta a la sexta década de la vida (13,16); más de un tercio de los pacientes sometidos 81
84 a valvulotomía son mayores de 65 años (17). En algunas áreas geográficas, la EM progresa más rápidamente, presumiblemente debido a tanto ó más severo insulto reumático ó repetidos episodios de carditis reumática debido a nuevas infecciones estreptocócica resultando en una EM severa sintomática a fines de la adolescencia y a los tempranos 20 años (13). Varios estudios hemodinámicos y de ecocardiográfia-doppler han reportado una disminución anual del área mitral con un rango de 0,09 a 0,32 cm² (18, 19). La severidad de la EM se ha basado en la variedad hemodinámica y datos de la historia natural utilizando el gradiente medio, la presión sistólica de la arteria pulmonar, y el área valvular mitral a saber: leve: área mayor de 1,5 cm² gradiente medio menor de 5 mm Hg, presión sistólica de arteria pulmonar menor de 30 mm Hg, moderada (área valvular: 1,0 a 1,5 cm², gradiente medio de 5 a 10 mm Hg ó la presión sistólica de arteria pulmonar de 30 a 50 mmhg), y severa ( área valvular: menor de 1,0 cm², gradiente medio mayor de 10 mm Hg, presión sistólica de arteria pulmonar mayor de 50 mm Hg).(tabla 1) El diagnóstico de EM debe ser realizado sobre la base de la historia clínica, exámen físico, Radiografía de tórax y ECG. Si bien algunos pacientes no manifiestan síntomas, presentan anormalidades al exámen físico (13, 16). Aunque algunos pacientes pueden presentar fatiga disnea ó franco edema pulmonar, en otros la manifestación inicial es la fibrilación auricular ó un evento embólico (1). Con menor frecuencia pueden presentar hemóptisis ó disfagia, ronquido. Los hallazgos auscultatorios en la EM reumática son los siguientes el primer ruido aumentado, el chasquido de apertura, el rolido diastólico, y el refuerzo presistólico. Estos hallazgos, sin embargo pueden estar presentes en pacientes con obstrucción no reumática (Ej, mixoma auricular), ó ausentes en pacientes con hipertensión pulmonar severa, bajo gasto cardíaco, con asiento sobre una válvula mitral densamente calcificada e inmóvil. El acortamiento del intervalo A2-Ch con prolongación del rolido diastólico es un indicador de mayor severidad de la EM. Un intervalo A2-Ch menor de 0,08 segundos es indicativo de una EM severa (20) (Fig1). Los hallazgos físicos de Hipertensión pulmonar como un sonoro P2 ó un ventrículo derecho con impulso paraesternal derecho sostenido también sugieren la presencia de una severa EM. La Ecocardiografia bidimensional y Doppler en la evaluación de la Estenosis Mitral La herramienta diagnóstica de elección en la evaluación de pacientes con estenosis mitral es la ecocardiografía Doppler (21-26). La ecocardiografía es capaz de identificar la restricción en la apertura diastólica de las hojuelas valvulares, debido a la presencia del domo, cúpula ó doming de la valva anterior mitral, e inmovilidad de la valva posterior (21,23, 25, 26). Otras entidades pueden simular los hallazgos clínicos de la estenosis mitral reumática como el mixoma de la aurícula izquierda, la mucopolisacaridosis, la calcificación no reumática de la válvula mitral, cor triatiatum, ó una válvula en paracaídas pero todas ellas pueden se identificadas claramente mediante la ecocardiografía 2D. La ecocardiografía bidimensional puede ser utilizado para evaluar los aspectos morfológicos del aparato 82
85 valvular mitral incluyendo la movilidad valvar, la flexibilidad, el engrosamiento el grado de calcificación valvar, fusión subvalvular así como aspectos de las comisuras(21,23,25) (figs 2,3,4,). La ecocardiogafía en modo M a nivel ll permite visualizar el engrosamiento valvar así como el acompañamiento de la valva posterior a la anterior indicio de fusión comisural (fig 5) La planimetría del orificio valvular mitral se puede realizar desde las vistas paraesternales en eje corto (26) (fig 6). Estos hallazgos pueden ser importantes a la hora de tomar decisiones tales como momento y tipo de intervenciones a ser llevados a cabo (27-33). Pacientes con valvas no calcificada, sin calcificación comisural y pequeña fusión subvalvular podrían ser candidatos tanto para una valvulotomía mitral con balón ó quirúrgica (27-32). Varios métodos han sido utilizados para valorar la factibilidad de realizar una valvulotomía incluye el Score de Wilkins, (33) (tabla 2) un agrupamiento de hallazgos ecocardiográficos basados sobre la flexibilidad valvar, la fusión subvalvular, la calcificación valvar (31) y la presencia ó ausencia de calcificación comisural (28). La dimensión de las cámaras cardíacas así como la función de las mismas, el comportamiento del resto de las estructuras valvulares, miocárdicas y pericárdicas pueden ser evaluadas por ecocardiografía bidimensional. Severidad de la estenosis Mitral La ecocardiorafía Doppler puede ser utilizada para valorar la severidad hemodinámica de la obstrucción (22, 24, 34). -El gradiente medio diastólico de la válvula mitral es medido en forma certera y reproducible con la señal espectral del obtenido mediante el Doppler continuo del flujo de la válvula basados sobre la ecuación modificada de Bernoulli (22, 24) (fig. 7). Los gradientes medios transvalvulares mitrales obtenidos por Doppler en la pre y post comisurotomía mitral con balón comparado con los gradientes derivados de hemodinamia presentan una correlación r = 0,70 y 0,89 respectivamente. El gradiente existente a nivel de una válvula estenótica se halla sujeto al volumen y al tamaño del orificio (fig. 8). Los gradientes del flujo son dependientes del estado hemodinámico del paciente, ante el aumento del volumen del flujo, por ejemplo el ejercicio, incrementa el gradiente contrariamente si el paciente está deshidratado el gradiente disminuye. La dependencia del flujo a estos factores impone el cálculo del área mitral. -Area Valvular mitral -.Ecocardiografía bidimensional: Planimetría del orificio válvular mitral El orificio válvular mitral puede ser planimetrado mediante la ecocardiografía bidimensional a través de la vista en eje corto del paraesternal izquierdo(26). Una cuidadosa evaluación del aparato válvular mitral deber ser llevada a cabo con selección del orifico mas pequeño ó mas restrictivo, junto al ajuste de la 83
86 ganancia importante a la hora de determinar el grado de calcificación valvular; la correlación del método en determinar el área valvular mitral precomisurotomía con balón y el área determinado por hemodinamia presentan una buena correlación r= 0,71a 0,81; la correlación postcomisurotomía disminuye r = 0,51 a 0,75, así como la comisurotomía quirúrgica el orifico comienza a ser muy irregular y técnicamente dificultoso para planimetrar en especial si la calcificación está presente. Por la certeza diagnóstica el área del orificio válvular mitral debe ser planimetrado mediante la ecocardiografía bidimensional en todos los pacientes candidatos a una comisurotomía con balón, en que la misma sea factible (fig..9). -.Ecocardiografía Doppler Mediante la ecocardiografía Doppler el área valvular mitral puede ser derivado en forma no invasiva tanto como por el método del tiempo de Hemipresión (34-36) como por la Ecuación de la continuidad (35). - Método de tiempo de Hemipresión (THP): Area válvula mitral En presencia de estenosis mitral la obstrucción al flujo desde la aurícula al ventrículo genera incremento de la presión de la AI así como la magnitud y la duración del gradiente transvalvular mitral durante la diástole. En lesiones leves el incremento del gradiente puede persistir solo en parte de la diástole en tanto en obstrucciones severas el gradiente persiste a lo largo de todo el llenado diastólico. El tiempo de hemipresión (THP) es un índice cuantitativo de caída del gradiente diastólico para estimar el área valvular mitral que fuera descripto primero por Libanoff y Rodbard en el laboratorio de hemodinamia a fines de 1960, definido como el tiempo requerido para que el gradiente diastólico temprano máximo caiga a la mitad de su valor, índice relativamente independiente de la frecuencia cardíaca, del gasto cardíaco, ó del grado de regurgitación. El THP posteriormente desarrollado por Hatle y col. en 1979 (34), cuyo reconocimiento basado en la ecuación de Bernoulli estableció que la velocidad instantánea del flujo transmitral es proporcional a la raíz cuadrada del gradiente de presión ( p= 4v², v = p/2), definiendo al tiempo de hemipresión por Doppler como el tiempo requerido para que la velocidad pico transmitral cayera a un valor igual a la raíz cuadrada de la mitad de la velocidad pico. (fig 10) Por definición el tiempo de hemipresión (t ½) es igual al tiempo requerido por el gradiente de presión en alcanzar la mitad de su valor inicial P 0 Pt ½ = (1) El gradiente de presión al THP es igual a la mitad de su valor pico. 2 La relación entre el gradiente de presión y la velocidad al tiempo de hemipresión puede ser derivado como sigue: P (t ) = 4 {v(t)}² (2) El gradiente de presión en cualquier (t) es igual a 4v² por la ecuación de Bernoulli modificada. 84
87 Por lo cual la ecuación puede ser escrita como 4V 0² 4 {vt½}² = (3) 2 Luego se puede extraer la velocidad al tiempo de hemipresión: V 0 V0 Vt½ = = = 0,71 V0 (4) Hatle y Angelsen posteriormente proveyeron mediante una expresión matemática empírica relacionando el tiempo de hemipresión por Doppler al área valvular mitral : AVM (cm ²) = 220 / T½ (msec) (5) 220 es una constante empírica La validación mostró una buena correlación realizada con áreas calculadas por Doppler mediante el tiempo de hemipresión y la ecuación de Gorlin, con cateterismo en 20 pacientes con estenosis mitral y regurgitación mitral asociada (Fig. 11,12, 13). Aunque el método ha probado su utilidad en estimar el AVM en válvulas nativas como protésicas el método podría ser inexacto en determinadas situaciones clínicas tal como el ejercicio, fiebre, el embarazo, insuficiencia valvular aórtica, evaluación postcomisurotomía con balón sugiriendo que el cálculo del área mediante el THP es sensible a otros factores hemodinámicas. El Tiempo de Hemipresión es dependiente no solo del AVM misma sino también de la complacencia neta auriculoventricular así como del gradiente transmitral pico hallazgos descriptos por Flachskampf y Thomas et al.(37) El tiempo de hemipresión por Doppler es una medida que expresa la velocidad con que cae el gradiente de presión transvalvular mitral durante la diástole, determinado por el volumen de flujo que atraviesa la válvula mitral y los efectos de su transferencia (en volumen) desde la aurícula al ventrículo sobre sus respectivas presiones de cámara lo cual se halla determinado por la respectivas rigidez de cámara ó complacencia (complacencia es la inversa de rigidez), la complacencia neta de las dos cámaras que es una variable importante porque la transferencia de 1 ml de sangre desde la aurícula al ventrículo resultará en la caída de la presión auricular ello determinado por la complacencia característica de la aurícula seguido de un incremento de la presión ventricular lo cual se halla determinado por la complacencia del ventrículo; la suma de éstos dos cambios se llama complacencia neta (Cn) la cual representaría el efecto neto sobre el gradiente. Para entender la relación del tiempo de hemipresión con estas variables hemodinámicas es necesario considerar los determinantes primarios del flujo instantáneo mitral. Pues el flujo (Q) en ml/seg que pasa a través de un orificio es simplemente la velocidad (v) multiplicada por el área efectiva del orificio: Q = v x AVM Por el principio de Bernoulli la velocidad (v) se halla relacionada a la presión (p) por = ½ v² ( : es la densidad de la sangre) por la variedad de formas y tamaños de los orificios. Si (p) mm Hg y (v) m/seg la relación p = 4 v² (la constante es actualmente 3,94) resolviendo v = pv/2 si (v) m/seg y 85
88 multiplicando por 100 (v) cm/seg, por lo tanto v = 50 p 8 (utilizando 3,94 en vez de 4 v = 50.4 p). Q = v x AVM = 50.4 p AVM Los cambios en velocidad y del flujo se hallan determinadas por las complacencia (dv/dp) auriculares y ventriculares y porque ambos volumen y presión se hallan en función del tiempo, la complacencia auricular izquierda (CA) (ó complacencia neta) puede ser expresada en término derivados del tiempo dv dv/dt -Q C net = = = dp dp/dt dp/dt donde dv/dt = -Q (negativo porque el flujo se halla fuera de la aurícula causando disminución de V). Expresando dp/dt como función de p: dp -Q -v AVM 0.4 AVM p = = = dt Cnet Cnet Cnet A partir de la ecuación diferencial se deduce que la presión cae más rapidamente si el orificio es mas grande, si el gradiente de presión es mayor ó si la complacencia es baja. La incorporación de una variable que especifica la presión inicial Po descripta por Thomas resuelve la ecuación : p(t)= ( Po 25.2 avm t/ Cnet) p(t) = ( P avm t/ Cnet)² el cual es tiempo total del curso de la despresurización. El tiempo de hemipresión luego es el tiempo a presión (p[t]) que es igual a la mitad de la presión inicial (Po/2), ó 11.6 Cnet ( P0) ² T½ = AVM En ésta última ecuación muestra una relación inversa del tiempo de hemipresión con respecto al AVM, y su dependencia de la Complacencia auricular izquierda y de la raíz cuadrada del gradiente pico de presión. A partir de esta ecuación se puede determinar en forma no invasiva la complacencia Auriculoventricular neta descripta por Thomas et al. ( T½ ) (AVM efectiva) Cnet = Cnet ( P0) ² 86
89 T½: expresado mseg, el AVM efectiva: cm² y la Cnet en ml/mm Hg Incrementos de la presión en la aurícula izquierda causan su correspondiente disminución de la complacencia, llevando a THP a una dependencia del AVM. La exactitud del THP en predecir los cambios en el área mitral cae inmediatamente posterior a la realización de la valvuloplastia con balón pues, cambios dramáticos se suceden en el volumen y la presión auricular, cambiando su posición en la curva presión-volumen. En pacientes con regurgitación valvular aórtica aguda el incremento abrupto de la presión del ventrículo izquierdo acorta el tiempo de hemipresión, sobrestimándose el AVM. En pacientes con regurgitación valvular aórtica crónica la situación es mas compleja por la dilatación del VI. Si la complacencia ventricular aumenta y el volumen regurgitante se acomoda lo suficiente sin incrementos significativos de la presión ventriculares, el THP podría retornar a su valor basal. Las consideraciones hemodinámicas que afectan la aplicación del THP incluye los efectos de la coexistencia de enfermedades valvulares incluyendo variaciones de la frecuencia cardíaca. Los factores que influencian la exactitud del método del Tiempo de Hemipresión son técnicos y hemodinámicos. La Ecuación de la Continuidad El principio de la ecuación de la continuidad basado en la ley de conservación de la masa y de la energía establece que en ausencia de cortocircuito ó regurgitación, el flujo a lo largo de un tubo, y en cualquier sección del mismo es constante, por ello el volumen de sangre que atraviesa diferentes sitios del corazón es el mismo, por lo tanto el pasaje del flujo a nivel de la válvulas la mitral y de otra contigua de referencia, es el mismo. Asumiendo un flujo de perfil laminar, éste resulta del producto de la velocidad media y el área de sección transversal por el cual pasa el mismo, siendo el principio de la continuidad, útil para derivar la siguiente relación: Q = V1 x A1 = V2 x A2 Donde Q es el flujo, A1 y A2 son las áreas de los sitios contiguos y V1 y V2 las velocidades correspondientes a las mismas áreas; V1 y A1 velocidad y área del sitio de referencia en tanto V2 y A2 corresponden al sitio de estenosis. Para determinar el área del orificio estenótico (A2) la ecuación es reordenada como A2 = A1 x V1/V2 ó el área valvular mitral IVT 1 AVM = A1 x IVT m 87
90 Donde el AVM es el área de la válvula mitral, IVTm es la integral velocidad tiempo del flujo transmitral. Cuando la continuidad es utilizada para el flujo mitral, el flujo de referencia es el del volumen sistólico (VS) pasando a través de la válvula aórtica ó pulmonar. (Fig 14,15) Una de las ventajas en la utilización de la ecuación de la continuidad es menos dependiente del gradiente transvalvular y de la complacencia auriculoventricular y por tanto menos sensible a los cambios hemodinámicos. La ausencia de cambios en la determinación del AVM demostrados con la ecuación de la continuidad con el ejercicio, expresa la mayor confiabilidad del método con menor afectación ante cambios hemodinámicas tales como incremento de la frecuencia, del gradiente ó disminución de la complacencia neta. -. Limitaciones: Una de las limitaciones de la técnica incluyen las dificultades en la exactitud de la medición de los diámetros de los anillo aórtico y pulmonar, por lo cual se recomienda los aspectos metodológicos en la adquisición de los mismos, utilización del zoom de los tractos en mesosístole a fin de minimizar los errores en la medición de los mismos. La determinación del AVM por el método de la continuidad en presencia de regurgitación mitral ó del flujo de referencia, el flujo que atraviesa ambas valvas es diferente por lo tanto la ecuación de la continuidad debe ser invalidada. En presencia de regurgitación mitral más que leve, la medición del volumen sistólico sería inexacto derivando en una infraestimación del AVM. La coexistencia de regurgitación valvular aórtica resulta en el incremento del volumen sistólico medido a nivel del tracto de salida del ventrículo izquierdo lo cual conlleva a la sobreestimación del AVM verdadera. En presencia de insuficiencia aórtica moderada debería seleccionarse como flujo de referencia la velocidad el flujo del tracto de salida pulmonar para el cálculo del volumen sistólico. Ante la coexistencia de estenosis mitral con comunicación interauricular se seleccionará el volumen sistólico aórtico a fin de evitar los efectos de la sobrecarga volumétrica del cortocircuito a nivel pulmonar. En estudios clínicos el área valvular mitral calculada derivada del Doppler utilizando el flujo aórtico ó pulmonar presenta una buena correlación con mediciones obtenidas mediante cateterismo (r =.91 con un error estándar estimado [DS=.26cm²], las áreas derivadas de la continuidad infraestiman levemente el área obtenidas por hemodinamia. (35). Las áreas obtenidas por fórmula de Gorlin sobrestiman aquellas obtenidas por la continuidad de 12 al 13 % en caso de la mitral. La ecuación de la continuidad sobrestima un 3% sobre aquellas áreas obtenidas in vitro. La fórmula de Gorlin Si bien matemáticamente la fórmula de Gorlin y de la continuidad se hallan basados en el mismo principio hemodinámico, el intento original de la fórmula de Gorlin fue la medición del área valvular anatómica más que el área fisiológica ocupada por el flujo. Con tal propósito el coeficiente de contracción fue introducido para cuantificar la diferencia entre las dos áreas; un coeficiente con valor de 1 tomado en forma arbitraria para la determinación del área valvular aórtica equivalente a asumir que 88
91 tanto el área anatómica como la efectiva es una, la misma. Para la válvula mitral el coeficiente de 0,85 fue introducido basado en las diferencias observadas por Gorlin y Gorlin entre las áreas calculadas por la fórmula utilizando la constante de 44.3 y de aquellas medidas en cirugía ó en anatomía patológica, por ello la constante aplicada en la fórmula de Gorlin para la mitral: 44.3 x 0.85 ó 37.7, equivalente a asumir una relación constante de 0,85 entre el área efectiva y la anatómica; el resultado final es una estimación mas cercana al área anatómica que a la efectiva. Extrapolando los rangos de las áreas de válvulas estenóticas se observa las diferencias entre aquellas obtenidas por ecuación de continuidad y por la fórmula de Gorlin, para las válvulas aórticas (<0.80cm²) la diferencia es 0.10cm² mayor de los obtenidos por la fórmula de Gorlin que aquellos por la continuidad, para áreas mitrales entre 0,6 y 1,5 cm² por ecuación de continuidad alcanzarían valores de 0,09 y 0,20 cm² mas altos mediante la fórmula de Gorlin. Por ello las áreas obtenidas por fórmula de Gorlin sobrestiman aquellas obtenidas por la continuidad de 1 al 2 % para las aórticas y 12 al 13 % en caso de la mitral. Para la fórmula de Gorlin dos pequeños errores descriptos en su formulación a saber la utilización del flujo medio en vez de la raíz cuadrada del flujo medio y el uso de la constante 44.3 en vez de 50.5 para el flujo de la válvula mitral. (5). Las fórmulas hidráulicas se hallan primariamente relacionadas a las áreas de los orificios efectivos más que a los anatómicos, pero son los áreas de los orificios efectivos cuyas variables directamente relacionadas a la presión y el flujo reflejan mejor la clínica del pacientes y su estado hemodinámico que el orificio anatómico. Aceleración proximal del flujo Basado en el método de la continuidad para determinar el área valvular mitral se utiliza la zona de convergencia proximal a la válvula para derivar el flujo instantáneo. Esta aproximación se halla basado sobre la observación donde el flujo converge uniforme y radialmente hacia un orificio que es relativamente pequeño a la cámara proximal formando capas concéntrica de isovelocidad (fig. 16). Cuando el orifico es circular ó relativamente pequeño a la región de aceleración éstas superficies de isovelocidad son hemiesféricas y el flujo que atraviesa cualquier capas de isovelocidad resulta del producto del área de superficie y su velocidad. Por conservación de la masa el flujo en cada capa debe igualar al flujo que atraviesa el orifico porque todos pasan a través del mismo. Si el flujo de un orifico es conocido el área del orificio puede ser determinado dividiendo el flujo instantáneo por la velocidad instantánea. Con el display del mapa de color, el contorno de isovelocidad y la distancia desde el orifico son más fácilmente identificable por la banda del primer aliasing del flujo que se acelera próximo al orificio. El flujo que atraviesa esta superficie de isovelocidad puede ser calculada por la multiplicación el área de superficie (2 r²: superficie de la hemiesfera) por la velocidad de aliasing. Para un flujo que atraviesa un orificio elíptico ó circular con igual área puede ser aplicada la misma fórmula 2 r² porque el flujo padece el mismo gradiente de presión axial para un área restringida dada (fig.17). En la práctica el registro de Doppler color a nivel del influjo mitral es obtenido desde las vistas apicales 89
92 de 4 cámaras y el radio a nivel de la zona de aceleración proximal es medido como la distancia pico diastólico desde el orificio hasta el primer aliasing del flujo color. El flujo es registrado a baja velocidad de aliasing a fin de localizar la banda inicial de aliasing lo más lejano al orificio que fuere posible, por lo tanto incrementando la exactitud de la medición disminuyendo cualquier imprecisión de localización del orificio, limitando cualquier inexactitud propia a un orificio finito( fig. 18,19). La velocidad de flujo pico es calculado asumiendo un flujo de convergencia radial uniforme con dirección hacia el orificio modificado por un factor que toma en cuenta el ángulo del embudo formado por las válvulas de la mitral. Éste factor es el ángulo del embudo dividido por 180 ( fig.20). El área de la válvula mitral es calculada: Vny AVM = 2 r² x x V pico 180 El AVM es calculada como el flujo / velocidad pico La velocidad pico del flujo mitral es obtenido desde la vista apical de 4 cámaras utilizando el Doppler continuo. Estimación PSVD y PSAP La ecocardiografía Doppler pueden ser de utilidad para estimar la presión sistólica de VD (PSVD) y la presión sistólica de arteria pulmonar (PSAP), ésta calculada (en ausencia de obstrucción en el TSVD) a través del trazado de la señal espectral de la insuficiencia tricúspídea, como resultante de la sumatoria de la presión sistólica del ventrículo derecho sumado la presión estimada de la AD, ésta acorde a la repercusión a nivel de la vena cava inferior (con colapso >50%: 0-5 mm Hg, <50% 10 mm Hg, sin colapso 15 ó más), PSAP = PSVD + PAD. (38,39) (Fig.22) La repercusión sobre las cavidades derechas por la sobrecarga de presión secundario a hipertensión pulmonar pueden ser manifiestas a través del análisis del flujo de la Vena cava inferior ó de sus subsidiarias la venas suprahepáticas, (fig 23) desde las vistas subxifoidea permiten, flujo reverso sistólico ante la presencia de insuficiencia tricuspídea severa, así como reversión e incremento de la velocidad de la onda de contracción auricular como expresión de Hipertensión pulmonar. La evaluación sobre la imagen espectral del flujo pulmonar del tiempo de aceleración (Tac) permite estimar el tiempo desde el comienzo del Flujo hasta que éste alcanza la velocidad máxima, el mismo se correlaciona con la presión media de la arteria pulmonar.(fig 24) Ecocardiografía transesofágica La ETE ha mostrado ser más sensible que la ecocardiografía transtorácica (ETT) en la identificación de los trombos alojados en la Aurícula izquierda en especial por su frecuente localización en la 90
93 orejuela izquierda (OAI).La identificación del trombo en la AI es especialmente importante en aquellos que serán sometidos a la comisurotomía mitral con balón (CMB) por el riesgo de embolización sistémica, pues la colocación de catéteres, catéteres balón deberan atravesar la aurícula izquierda para su posterior asiento a nivel del orificio mitral manipuleo que puede incrementar el riesgo de embolización sistémica si un trombo se hallara presente en la AI. El rol del ETE previo a la comisurotmía con balón es controvertido pues la valoración morfológica hemodinámica de la severidad de la enfermedad valvular mitral puede ser realizada en forma apropiada en la mayoría de los pacientes mediante la ecocardiografía transtorácica, solo el ETE podrá excluir en forma certera la presencia de trombos la AI, pero ello no es una contraindicación absoluta de VMB, pues en pacientes con alto riesgo para una comisurotomía mitral quirúrgica la CMB podría ser considerado factible. El monitoreo mediante la ETE durante la CMB podría ser de ayuda guiando el desplazamiento de los catéteres a fin de evitar los trombos. La presencia trombos que subyacen a lo largo del tabique interauricular son de alto riesgo, por el sitio de la punción transeptal. Si no existe contraindicación a la anticoagulación se indicará de uno a tres meses de tratamiento anticoagulante previo al CMB. Se realizará un ETE inmediatamente previo a la realización de la CMB. En presencia de trombos en la AI en pacientes estables podrían someterse a la anticoagulación ú/ó optar por la comisurotomía quirúrgica. La evaluación tanto de la VM así como de la AI y su OAI útiles serán las vistas medioesofágicas de 2 cámaras (90 ) para la visualización la AI y del cuerpo de la OAI, 4cámaras (0 ) y longitudinal ( ) permitirá visualizar la cavidad aurícula izquierda así como la VM (fig 25-26), útiles serán las vistas transgástricas eje corto (0 ) para visualizar la válvula mitral en eje corto la valva anterior y posterior sus comisuras, mediante la vista 2cámaras ( ) se apreciará el aparato subvalvular mitral cuerdas tendinosas y músculo papilares, OAI. Ecocardiografía Doppler de estrés La ecocardiografía de Estrés en pacientes con EM puede ser realizada en bicicleta supina ó stress farmacológico lo cual permite registros de la velocidad del flujo Doppler el cálculo del área valvular mitral mediante el Doppler es controvertido y la veracidad del tiempo de hemipresión en ese contexto es cuestionable. El cálculo del área por el método de la continuidad en este contexto si bien es técnicamente dificultoso es confiable. La severidad de la estenosis mitral puede ser evaluada mediante el gradiente transmitral y la presión sistólica de arteria pulmonar, ésta calculada a través de la trazado de la señal espectral de la insufiencia tricúspídea, como la resultante de la sumatoria de la presión sistólica del ventrículo derecho sumado la presión estimada de la AD, ésta acorde a la repercusión a nivel de la vena cava inferior (con colapso >50%: 0-5 mm Hg, <50% 10 mm Hg, sin colapso 15 ó mas), PSAP = PSVD+ PAD.(40,41) La objetiva evaluación de la capacidad funcional en pacientes con vida sedentaria mediante la ecocardiografia de estres es de gran utilidad (42). 91
94 La limitación de la tolerancia al esfuerzo es evaluada en forma objetiva mediante éste test hemodinámico, la presencia de incrementos en el gradiente medio transmitral mayor a 15 mm Hg ásí como de la PSAP mayor a 60 mm Hg traduce la severidad de la estenosis y plantea la estrategia terapéutica: la indicación de la valvuloplastia con balón si la morfología valvular lo permite, si así no lo fuere la opción será la quirúrgica, reparación ó reemplazo valvular (43). (fig. 27) Eco tridimensional Ha demostrado su utilidad en el cáculo del area valvular mitral así como la detección de la separación comisural y el desgarro valvar posteror a la comisurotomía con balón. Presentación y manejo clínico Pacientes asintomáticos quienes tienen documentada EM leve: área mitral de 1,5 cm² y gradiente medio menor que 5 mm Hg, (tabla 2) permanecen estables por años (2, 12, 13). En el progresivo y lento curso de la EM, los pacientes con severa estenosis pueden permanecer minimamente sintomáticos sólo porque ajustan sus estilos de vida a un nivel más sedentario, se suma el incremento de la resistencia pulmonar y el bajo gasto cardíaco pueden jugar un rol adaptativo en prevenir los síntomas de congestión pulmonar en estos pacientes (8, 10,11). La elevación de la resistencia vascular es un importante evento fisiológico en estenosis mitral (11), y el nivel de presión pulmonar es un indicador del total de las consecuencias hemodinámicas. Pacientes con moderada hipertensión pulmonar en reposo (presión de la arteria pulmonar mayor que 50 mmhg) y las hojuelas valvulares pliables pueden ser considerados para una valvulotomía mitral percutánea, a pesar que niegue la presencia de síntomas. En pacientes que lleva una vida sedentaria, la evaluación acertada de la capacidad funcional es una evaluación hemodinámica con esfuerzo a realizar mediante la ecocardiografía de stress con ejercicio. La evaluación objetiva de la limitación de la tolerancia al ejercicio con incremento del gradiente transmitral mayor de 15 mm Hg y de la presión sistólica de la arteria pulmonar mayor de 60 mm Hg al esfuerzo sería indicación de valvulotomía mitral percutánea siempre si los aspectos morfológicos valvulares conllevan el escenario adecuado para la mima. Se han descripo un subgrupo de pacientes asintomáticos portadores de EM severa (área valvular menor de 1 cm²) e hipertensión pulmonar severa mayor que el 75 % de la presión sistémica tanto en reposo como con ejercicio. Si éstos pacientes no presentaran una morfología valvular favorable para valvulotomía mitral percutánea ó quirúrgica, la propuesta del reemplazo valvular a fin prevenir la disfunción ventricular derecha es controvertido en ausencia de síntomas, si bien la cirugía es generalmente indicada en éstos pacientes. Tratamiento médico: a) Consideraciones generales: En pacientes con EM, el problema se halla circunscripto en la obstrucción mecánica al ingreso del flujo a 92
95 nivel de la VM, por lo cual la terapia médica no alivia una obstrucción fija. El ventrículo izquierdo se halla protegido de una sobrecarga de volumen y de presión, no requiriéndose una terapéutica médica específica en pacientes asintomáticos. Debido a que la fiebre reumática es la causa primaria de EM es recomendable la profilaxis para fiebre reumática. La ocurrencia de endocarditis infecciosa en presencia EM es aislada sin embargo la profilaxis adecuada es también recomendada. Las advertencias a pacientes quienes padecen más que una estenosis mitral leve, deben recomendar evitar esfuerzo físico inusuales desmedidos. La obstrucción a nivel de la VM recrea en presencia de taquicardia el aumento del flujo con acortamiento del período de llenado diastólico lo cual conlleva al incremento de la presión de la aurícula izquierda cámara antepuesta a dicho obstáculo. Agentes con propiedades cronotrópicas negativas como los betabloqueantes, los bloqueantes cálcicos pueden ser beneficiosos en pacientes con ritmo sinusal, quienes ante esfuerzos presentan síntomas relacionados al elevado incremento de la frecuencia cardíaca (44). La mayor eficacia de los betabloqueantes ante el bloqueo los bloqueantes cálcico ha sido demostrado, en estudios comparativos (45,46). Algunos pacientes manifiestan un hiperreactividad bronquial por lo cual los corticoterapia inhalatoria es la recomendada (47). La restricción de sal y la administración intermitente de diuréticos es de utilidad si hay evidencia de congestión pulmonar. La adminitración de digitálicos no presenta beneficio alguno a menos que la disfunción ventricular izquierda y ó derecha se hallen instalados (48). Aunque la EM tenga una evolución lenta y progresiva, el edema pulmonar agudo puede presentarse en forma súbita en pacientes asintomáticos con EM severa especialmente con el comienzo de la fibrilación auricular con alta respuesta ventricular, esto podría ser fatal, a menos que una adecuada atención médica sea instituída inmediatamente. b) Fibrilación auricular Pacientes con estenosis mitral son proclives a padecer arritmias auriculares, particularmente fibrilación auricular y aleteo auricular. Un treinta a cuarenta por ciento de los pacientes con EM sintomática desarrollan fibrilación auricular (1, 2). La presencia de cambios estructurales a partir de la sobrecarga de presión y de volumen altera las propiedades electrofisiológicas de la aurícula izquierda (13), pudiendo el proceso reumáticos en sí mismo llevar a la fibrosis de lo tractos internodales, interauriculares así como del nodo sinusal. Las consecuencias hemodinámica podrían llegar a ser significativas resultante del desarrollo de fibrilación auricular de alta respuesta ventricular, con acortamiento del período de lleno diastólico e incremento de la presión de la aurícula izquierda. La Fibrilación auricular es mas frecuente en pacientes mayores y se halla asociado a un pobre pronóstico con una sobreviva del 25 % a 10 años comparado con el 46% en pacientes con ritmo sinusal (2). El riesgo de embolización arterial, especialmente el stroke se halla significativamente incrementado en pacientes con fibrilación auricular (1, 2, 49-51,). El tratamiento de un episodio agudo de de fibrilación auricular rápida consiste en al anticoagulación con heparina y control de la frecuencia cardíaca(52). La administración de la digoxina endovenosa, 93
96 bloqueantes de los canales de calcio ó los betabloqueantes pueden ser utilizados para controlar la respuesta ventricular por enlentecimiento de la conducción a nivel del nodo auriculo ventricular. La administración de Amiodarona endovenosa ú oral puede ser utilizado cuando los betabloqueantes ó los bloqueantes cálcicos no pueden ser administrados. Ante la presencia de inestabilidad hemodinámica, la cardioversión eléctrica puede ser tomada urgentemente, bajo la administración previa de heparina, durante y posterior al procedimiento. En pacientes quienes han padecido fibrilación auricular por más de 24 a 48 hs sin anticoagulación tienen un incrementado riesgo de eventos embólicos luego de la cardioversión, pero la embolización también puede ocurrir con menos de 24 hs. de fibrilación auricular. La decisión de proceder a una cardioversión electiva depende de múltiples factores incluyendo la duración de la fibrilación auricular, la respuesta hemodinámica al comienzo de la fibrilación auricular, una documentada historia de episodios de fibrilación auricular así como de eventos embólico previos. Si la decisión de proceder a una cardioversión eléctrica electiva en un paciente con fibrilación auricular con instalación mayor de 24 a 48 hs y sin anticoagulación previa, surgen dos opciones propuestas basados a partir de datos de pacientes con fibrilación auricular no reumática. La primera es anticoagulación con warfarina por más de 3 semanas, seguido por la cardioversión electiva (52-60). La segunda es anticoagulación con heparina y la realización de la ecocardiografía transesofágica con el de fin de evaluar la presencia de trombos en la aurícula izquierda. En ausencia de trombos en la aurícula izquierda, la cardioversión es llevado a cabo con heparina previa durante y posterior al procedimiento (50), continuando con la anticoagulación a largo plazo. Ante la recurrencia de fibrilación auricular paroxística la mantención del ritmo sinusal podría hallarse indicado en un grupo seleccionado de pacientes con drogas antiarrítmica clase IC en conjunción con agentes dromotrópicos negativos ó drogas antiarrítimicas clase III; ahora bien cuando la fibrilación auricular comienza a resistir la cardioversión el control de la respuesta ventricular tiene un rol principal en la terapéutica. Para lo cual las drogas propuestas como la digoxina que enlentece la respuesta cardíaca en pacientes con fibrilación auricular y EM, siendo los betabloqueantes y los bloqueantes cálcicos más efectivos en prevenir el incremento de la frecuencia cardíaca inducida por el ejercicio. Los pacientes con fibrilación auricular tanto paroxística ó sostenida deberán hallarse bajo un régimen de anticoagulación de largo plazo con warfarina a fin de prevenir los eventos embólicos, a no ser que existiera una contraindicación válida para la misma (51, 52). Posturas aún controvertidas surgen ante un nuevo episodio de FA la propuesta de la valvulotomía mitral percutánea en portadores de EM moderada a severa quienes de otro modo permanecerían asintomáticos, si bien como contraparte a ello se alegue que la valvulotomía percutánea con balón existosa no prevendría el desarrollo de la fibrilación auricular, también es de considerar la dimensión de la AI en adultos mayores como un importe predictor del desarrollo de la fibrilación auricular (53). c) Prevención del embolismo sistémico. La embolización sistémica puede ocurrir en el 10 al 20 % de los pacientes con EM (1, 2, 46) El riesgo de 94
97 embolización se halla relacionado a la edad y a la presencia de fibrilación auricular (1, 2, 46, 48). Un tercio de los eventos embólicos ocurren dentro del primer mes de comienzo de la fibrilación auricular y dos tercios ocurren dentro del primer año. La frecuencia de eventos embólicos no parecerían estar relacionados al grado de severidad de la EM, gasto cardíaco, tamaño de la aurícula, ó de la presencia ó ausencia de síntomas (2, 51, 54).Un evento embólico puede ser la manifestación inicial de la presencia de EM (1). En pacientes quienes han experimentado un evento embólico, la frecuencia de recurrencia es tan alta como 15 a 40 eventos por 100 pacientes-mes (51-52). Ante la ausencia de estudios randomizados que examinen la eficacia de la terapia de anticoagulación en prevenir los fenómenos embólico especificamente en pacientes con EM, se debe referir a estudios retrospectivos que han mostrado disminuir de 4 a 15 veces la incidencia de eventos embólicos mediante la anticoagulación en estos pacientes (52). Este beneficio aplicado tanto al embolismo sistémico como pulmonar: la mayoría de los estudios involucran pacientes quienes padecieron una embolia previa al inicio de la terapia anticoagulante (52). Sin embargo grandes ensayos han demostrado una reducción significativa de los eventos embólicos por tratamiento con anticoagulación en sujetos con fibrilación auricular no asociado a EM (58,59). En estos ensayos randomizados los pacientes que mas fueron beneficiados a partir de la anticoagulación fueron aquellos con alto riesgo de padecer eventos embólicos (55, 56). Pacientes con EM con alto riesgo de padecer futuros eventos embólicos son aquellos con eventos embólicos previos y aquellos con fibrilación auricular paroxística (1, 2, 49-52). La detección de Fibrilación auricular paroxística puede ser puesta de manifiesto con la utilización del monitoreo ECG ambulatorio en aquellos que refieren palpitaciones. No hay estudios que avalen los beneficios de la anticoagulación en pacientes sin FA ni eventos embólicos previos. Es controvertido si pacientes sin FA ó eventos embólicos con alto riesgo de padecer futuros eventos embólicos por ej. pacientes con EM severa deberían ser considerados para tratamiento con terapia a largo plazo con warfarina sódica.(57, 58). Aunque los eventos embólicos sugieren la presencia de trombos en la aurícula izquierda, la presencia ó ausencia de un trombo en la AI no parecería correlacionarlo (53). La presencia de trombos en aurícula izquierda hallados durante la cirugía alcanza el 15 al 20% de pacientes con eventos embólicos previos así un similar número de pacientes sin eventos embólico. La siguientes son las recomendaciones basadas sobre un nivel C de evidencia de la cuarto conferencia de Consenso de terapia antitrombótica del American College of physicians (57). Clase I 1. La anticoagulación está indicada en pacientes con EM y fibrilación auricular (paroxística, persistente, ó permanente: Nivel de evidencia B) 2. La anticoagulación está indicada en pacientes con EM y eventos embólicos previos, también con ritmo sinusal.(nivel de evidencia B) 3. La anticoagulación está indicada en pacientes con EM con trombos en la aurícula izquierda. 95
98 (Nivel del evidencia B) Clase IIb 1. La anticoagulación puede ser considerada para pacientes asintomático con EM severa y una dimensión ecocardiográfica de aurícula izquierda mayor de 55 mm. (Nivel de evidencia B) 2. La anticoagulación podría se considerada para pacientes con EM severa, agrandamiento de la aurícula izquierda, y contraste espontáneo en la ecocardiografía ( Nivel de evidencia C) Evaluación de pacientes sintomáticos Indicaciones de la evaluación hemodinámica Clase I 1. El cateterismo cardíaco para la evaluación hemodinámica pude ser llevado a cabo para evaluar la severidad de la EM cuando los test no invasivos no son concluyentes ó cuando hay discrepancia entre test no invasivos los hallazgos clínicos severidad de la EM (Nivel de evidencia C) 2. El cateterismo para la evaluación hemodinámica incluyendo la ventriculografía izquierda ( para evaluar la severidad de la IM) para pacientes con EM está indicada cuando existe discrepancia entre los gradientes medio derivados del Doppler y el área valvular (Nivel de evidencia C) Clase II a 1. El cateterismo cardíaco es razonable para valorar la respuesta hemodinámica de la presión de arteria pulmonar y la presión de la aurícula izquierda al esfuerzo cuando los síntomas clínicos y la hemodinamia de reposo son discordantes (Nivel de evidencia C) 2. El cateterismo cardíaco es rasonable en pacientes con EM para valorar la cusa de la severa Hipertensión arterial pulmonar cuando no hay proporción con la severidad de la EM determinado por los métodos no invasivos.(nivel de evidencia C) Clase III El cateterismo cardíaco diagnóstico no es recomendado para valorar la hemodinamia de la VM cuando los datos proporcionados por la ecocardiografía Doppler son concordantes con los hallazgos clínicos.(nivel de evidencia C) las mediciones hemodinámica por cateterización cardíaca pueden ser utilizados para determinar la severidad d la EM. Mediciones directas de la Aurícula izquierda y presiones del ventrículo izquierdo determinan el gradiente transmitral, el cual es la principal expresión de la severidad de la EM (6). Indicación de la valvulotomía mitral con balón Clase I 1. La valvulotomía percutánea mitral con balón es efectiva para pacientes sintomáticos (Clase funcional 96
99 II, III, o IV de la NYHA) con moderado a severa EM y morfología favorable para la valvulotomía percutánea en ausencia de trombos en al aurícula izquierda o regurgitación mitral a severa (Nivel de evidencia A). 2. La valvulotomía percutánea mitral con balón es efectiva para pacientes asintomáticos con moderada o severa EM morfología favorable para la valvulotomía percutánea en quienes tienen hipertensión pulmonar (presión sistólica de arteria pulmonar mayor de 50 mmhg en reposos ó mayor de 60 mmhg con el ejercicio) en ausencia de trombos en la aurícula izquierda o regurgitación mitral a severa. (Nivel de evidencia C) Clase IIa La valvulotomía percutánea mitral con balón es razonable para pacientes con moderada ó severa EM quienes tienen una válvula calcificada pliable en clase funcional III-IV, y no son candidatos para cirugía ó son de alto riesgo para la cirugía. (Nivel de evidencia C) Clase IIb 1. La valvulotomía percutánea mitral con balón podría ser considerada en pacientes asintomático con moderada o severa EM con morfología favorable para la valvulotomía mitral percutánea quienes tienen un nuevo episodio de fibrilación auricular en ausencia de trombos en aurícula izquierda y ó moderada insuficiencia mitral. (Nivel de evidencia: C) 2. La valvulotomía percutánea mitral con balón podría ser considerada en pacientes sintomáticos (Clase funcional II de la NYHA, III, o IV ) con un área VM mayor a 1,5 cm² ante la evidencia de EM hemodinámicamente significativa basado en PSAP mayor de 60 mmhg, presión capilar wedge de 25 mmhg ó mas, y un gradiente medio mayor de 15 mmhg durante el ejercicio.(nivel de evidencia: C) 3. La valvulotomía percutánea mitral con balón podría ser considerada en pacientes como una alternativa a la cirugía para pacientes con moderada o severa EM quienes tienen válvula calcificada no pliable y se hallan en clase funcional III-IV.( Nivel de evidencia.c) Clase III 1. La valvulotomía percutánea mitral con balón no está indicada en pacientes con EM leve. (Nivel de evidencia: C) 2. La valvulotomía percutánea mitral con balón no debería realizarse en pacientes con IM moderada a severa ó con trombos en aurícula izquierda. (Nivel de evidencia: C) Ver tabla 1 grado de severidad de las valvulopatías El concepto de comisurotomía mitral fue propuesto primero por Brunton en 1902, y la primera comisurotomía quirúrgica mitral exitosa fue levada a cabo en Por los años 1940 y 1950 fuera 97
100 aceptada como procedimiento clínico la comisurotomía quirúrgica cerrada mediante ambos abordajes: transatrial y ó transventricular. Con el desarrollo de del by pass cardiopulmonar, la comisurotomía y el reemplazo de la válvula mitral comienzan a ser los procedimientos de elección para el tratamiento de la EM. La valvulotomía percutánea mitral con balón surge a mediados de los años Este procedimiento en el cual uno ó más balones son inflados a nivel de la VM comenzó a ser un procedimiento de elección comparado con los procedimientos quirúrgicos. La valvulotomía percutánea mitral con balón llevada a cabo en inicios de 1980 y la técnica comenzó a mejorar en En la década pasada la técnica del doble balón fue inicialmente la más utilizada por la mayoría de los investigadores. Actualmente, mediante un solo balón en reloj de arena (balón de Inoue) es utilizado en la mayoría de los centros en donde realizan éstas técnicas. La introducción de la comisurotomía mecánica mitral que utiliza un valvótomo cuyos resultados parecen ser similares, la ventaja de ésta técnica que este dispositivo metálico permite su esterilización y posterior reutilización lo cual conlleva a la reducción de los costos del tratamiento (76); sin embargo ésta técnica no está disponible abiertamente y la experiencia con ella es escasa. La técnica de la valvulotomía con balón es la técnica de elección e involucra una curva de aprendizaje. Alta tasa de éxitos y bajas complicaciones acompañan a ésta técnica, en centros con experiencia en la misma y manejo de gran volumen de pacientes (77). Sin embargo el resultado del procedimiento depende casi exclusivamente de la experiencia del operador lo cual debe ser considerado a la hora de recomendar éste procedimiento. Los resultados inmediatos de la VMPB valvulotomía percutánea mitral con balón son similares a aquellos con comisurotomía mitral (76-86). El área válvula mitral se duplica (de 1 a 2 cm²), con reducción del 50 al 60 % del gradiente transmitral. De los pacientes sometidos a éste procedimiento el 80 a 95 % obtienen resultados exitoso, siendo esto definido AVM mayor de 1,5 cm² y la disminución de la presión de la AI menor de 18 mm Hg en al ausencia de complicaciones (Fig 28). La complicación aguda más común registrada en series de estudios incluye la regurgitación mitral severa, lo cual ocurre en el 2 al 10% (tabla3), y la comunicación interauricular residual. La ocurrencia poco frecuente de grandes defectos interariculares (Shunt izquierda derechas mayor de 1,5:1) alcanza al 12 % observada con la utilización de la técnica de doble balón y menor del 5% con la técnica con el balón de Inoue. La presencia de pequeños defectos interauriculares son detectados con la ecocardiografía transesofágica en un gran númenro de pacientes. Otras complicaciones menores incluyen la perforación del ventrículo izquierdo (0,5 a 4,0%), eventos embólicos (0,5 a 3,0%), e infarto de miocardio (0,3 a 0,5%). La mortalidad con la VMB en largas series se halla dentro del 1 al 2% (77-79,85); el incremento en experiencia y la selección mas acotada de pacientes alcance una tasa de mortalidad menor de l % con la utilización de éste procedimiento (80). La ecocardiografía simultánea es de gran utilidad en el posicionamiento del catéter balón y de la valoración hemodinámica. Si bien la información sobre el seguimiento de pacientes es limitada, del total la sobreviva libre de eventos (libre de muerte, repetición de nueva valvulotomía, ó de reemplazo valvular) es de 50 al 65 % entre 3 a 7 años; ahora bien en aquellos pacientes con anatomía favorable de la VM la sobrevida libre 98
101 de eventos es del 80 al 90% (28,,79,80-87). De aquellos pacientes libres de evento, más del 90% mantienen una clase funcional I o II después de la VMPB. Estudios randomizados han comparado la VMPB contra la comisurotomía mitral quirúrgica cerrada y abierta; estos estudios no han demostrado diferencias significativas en los resultado hemodinámicas ó complicaciones entre la VMPB y la quirúrgica, en los datos iniciales no hay diferencia s clínica hemodinámica ó tiempo de ejercicios entre los mismos; sin embargo en el seguimiento tardío entre los 3 y 7 años indican una hemodinamia, clínica a favor de la VMPB que la comisurotomía mitral cerrada. En otros dos estudios compararon la VMPB y la comisurotomía abierta, uno reportó resultados similares y otro a favor de la comisurotomía abierta, debiéndose considerar que en éste se hallan incluídos pacientes añosos con alto score valvular. Los resultados inmediatos las complicaciones agudas, y los resultados del seguimiento de la VMPB dependen de múltiples factores. Primero es de considerar el procedimiento en si mismo el cual debería ser llevado a cabo en centro con operadores experimentados. Otros factores incluyen como la edad, clase funcional, severidad de la estenosis, la presión de fin de diástole del VI, gasto cardíaco, la presión capilar y arterial pulmonar (79,80,81,86,) la morfología subyacente de la VM es el factor de mayor importancia en los determinantes del seguimiento, (27-33,79,82,85,85,94) y la hemodinamia inmediata a VMPB son predictivos de los resultados en el seguimiento clínico alejado (80,82,85). Los pacientes con calcificación valvular, engrosamiento fibróticos de las valvas con disminución en su movilidad y fusión subvalvular tienen una alta incidencia de complicaciones agudas y alta tasa de recurrencia de la estenosis en el seguimiento (tabla 2). Debido a que el éxito del procedimiento depende de la capacidad de desplegar las comisuras fusionadas la presencia de marcada fusión y severa calcificación de las comisuras se halla asociado con incremento de las complicaciones y alta incidencia de recurrencia de los síntomas (31,28). En pacientes con válvulas no calcificada flexibles móviles, con leve fusión comisural, y sin calcio en las comisuras, el procedimiento puede llevarse a cabo con un alta tasa de éxito (mayor del 90%), bajas complicaciones (menor del 3%), junto a una sostenida mejoría en el 80 a 90% en 3 a 7 años de seguimiento (31,28,33,79,80,82,86). Las contraindicaciones relativas para la VMPB incluye la presencia de trombos en la aurícula izquierda, insuficiencia mitral (3+ a 4+). La ecocadiografía transeofágica es indicada previa al procedimiento para determinar la presencia de trombos en la aurícula izquierda, con especial énfasis en la orejuela de la aurícula izquierda. Ante la evidencia de trombos se indican 3 meses de anticoagulación con warfarina pudiendo éste resolverse y posteriormente luego de la confirmación de la resolución del mismo mediante un ETE la VMPB puede ser realizada. Un modelo pronóstico ha sido sugerido como predictor de la resolución del trombos en candidatos para la VMPB donde se combinan la clase funcional y las características del trombos en aurícula izquierda en el seguimiento de la anticoagulación oral (87). Parámetros ecocardiografícos pueden predecir el riesgo de desarrollo de severa regurgitación después de la VMPB por la técnica de Inoue y sobretodo la valoración ecocardiográfica identifica pacientes con una evolución desfavorable (31, 28, 33) (tabla 3). Ante la sospecha de regurgitación mitral grado 3+ ó 4+ basada en el exámen físico ecocardiografico, un 99
102 ventriculograma podría llevarse a cabo, pero no la VMPB ó la comisurotomá mitral quirúrgica. Indicaciones de la cirugía en la Estenosis Mitral Clase I 1.- La cirugía mitral ( si la reparación es posible) se halla indicada en pacientes sintomáticos (Clase funcional III-IV de la NYHA) con EM moderada a severa cuando 1) la VMPB no es factible, 2) la VMPB se halla contraindicada por la presencia de trombos en la AI a pesar de la anticoagulación ó por la presencia de moderada a severa regurgitación mitral, 3) la morfología valvular no es favorable para la VMPB en pacientes con aceptable riesgo quirúrgico. (Nivel de evidencia C) 2.- Pacientes sintomáticos con moderada a severa EM con moderada a severa regurgitación mitral quienes podría recibir un reemplazo mitral, a menos que la reparación valvular sea posible al momento de la cirugía. (Nivel de evidencia C) Clase IIa El reemplazo de la VM sería lo razonable en pacientes con EM severa y severa Hipertensión pulmonar (Presión sistólica de arteria Pulmonar mayor de 60 mm Hg) con clase funcional NYHA I-II quienes no son candidatos para una VMPB ó una reparación valvular. (Nivel de evidencia C) Clase IIb La reparación debe ser considerada para pacientes asintomáticos con moderada ó severa En quienes tienen recurrentes eventos embólicos mientras reciben una adecuado tratamiento anticoagulante y quienes tienen una morfología para reparar. (Nivel de evidencia C) Clase III 1- La reparación de la VM para la EM no se halla indicada en pacientes con EM leve. (Nivel de evidencia C) 2- La comisurotomía cerrada no debe llevarse a cabo en pacientes en quienes se les realizará una reparación de la VM; siendo la comisurotomía mitral abierta el procedimiento de preferencia. (Nivel de evidencia C). El reemplazo de la VM es el procedimiento quirúrgico aceptado para pacientes con EM quienes no son candidatos a la comisurotomía quirúrgica ni percutánea. La mortalidad perioperatoria del reemplazo de la VM depende de múltiples factores incluyendo la edad, la función del VI, el gasto cardíaco, problemas médicos concomitantes, enfermedad coronaria asociada. En jóvenes saludables el reemplazo de la VM puede realizarse con un riesgo menor del 5%, sin embargo en pacientes mayores con problemas médicos concomitantes ó hipertensión pulmonar de niveles sistémicos la mortalidad perioperatoria para el reemplazo de la VM asciende al 10 y al 20% (72,73) el reemplazo de la VM con preservación del aparato subvalvular ayuda al mantenimiento de la función ventricular (74) pero puede ser dificultosa en 100
103 pacientes con EM reumática. Existen abordajes alternativos para la preservación de la función ventricular como la reconstrucción cordal artificial previo al reemplazo valvular mitral (75, 76).Complicaciones del reemplazo VM incluyen la trombosis valvular, la dehiscencia valvular, la infección valvular, la disfunción valvular, y los eventos embólicos. También debe considerarse el riesgo del tratamiento anticoagulante a largo plazo en los pacientes portadores de prótesis mecánicas. Si existe una calcificación valvular significativa, fibrosis, ó fusión comisural del aparato de subvalvular de la VM, no siendo candidatos a la comisurotomía ó la valvulotomía con balón es necesario el reemplazo de la VM. En pacientes en clase Funcional NYHA III con EM severa ó una combinada EM/IM, el reemplazo de VM es la indicación pues mejora aquellos pacientes sintomáticos. Se debe evitar posponer la cirugía hasta que el paciente alcance la Clase funcional IV porque la mortalidad operatoria es alta y la sobreviva a largo plazo es subóptima. En pacientes con insuficiencia cardíaca en clase funcional IV la cirugía no debería ser denegada pues las perspectivas serían negativas sin la intervención quirúrgica. Si bien es conocido que pacientes con hipertensión pulmonar severa raramente son asintomático, aquellos con EM severa e Hipertensión Pulmonar severa (presión sistólica mayor de 60 a 80 mm Hg) asintomáticos ó levemente sintomáticos la controversia surge sí deberían someterse a un reemplazo de VM con la finalidad de prevenir la insuficiencia cardíaca derecha, la cirugía podría ser recomendada analizado cada caso en particular. Postvalvulotomía ó Comisurotomía Mitral, Seguimiento Aunque la mejoría sintomática ocurre inmediatamente después de la VMPB ó de la comisurotomía exitosa, mediciones objetivas de consumo máximo de Oxígeno mejora después de varios meses de realizado el procedimiento, debido a una mejoría del metabolismo muscular (100). Las mediciones hemodinámicas previas y posteriores a la VMPB ó a la comisurotomía quirúrgica han confirmado el descenso de la presión de la aurícula izquierda, la presión arterial pulmonar, y la resistencia arterial pulmonar y una mejoría del gasto cardíaco ( ). En aquellos pacientes con insuficiencia cardíaca derecha marcada después de un exitoso procedimiento percutáneo ó quirúrgico podrá administrase óxido nítrico inhalado, prostaciclinas endovenosas, ó antagonistas de la endotelina útiles en reducir la resistencia vascular pulmonar y la hipertensión pulmonar (105), con regresión gradual de la hipertensión pulmonar lograda después de meses ( ). La recurrencia de síntomas por estenosis es poco frecuente, 20% de los pacientes (83). En aquellos con resultados iniciales adecuados los responsables más frecuentes de la recurrencia de los síntomas son: la presencia de IM, el desarrollo de otras valvulopatías ó la coronariopatía asociada (83). Los síntomas de aparición tardía a la comisurotomía, merecerán una evaluación exhaustiva por otras causas. Aquellos sometidos a la VMPB con una morfología valvular desfavorable tienen alta incidencia de recurrencia de los síntomas al primero ó segundo año del seguimiento resultado de un inadecuado procedimiento ó de 101
104 reestenosis (84). La VMPB puede ser llevada a cabo en pacientes quienes tienen restenosis posterior a una valvulotomía con balón ó una comisurotomía quirúrgica, los resultados son adecuados en muchos pacientes pero menos satisfactorios que la valvulotomía inicial, por la presencia de mayor fibrosis, calcificación valvular que en los procedimientos iniciales. El reemplazo valvular mitral debe ser considerado ante la presencia de síntomas recurrentes y severa deformidad del aparato mitral. En pacientes con severa IM ó un gran CIA residual la cirugía deberá ser instituida tempranamente, si bien el shunt residual a nivel auricular es generalmente pequeño con cierre en forma espontánea dentro de los 6 meses del procedimiento. En pacientes con historia de fibrilación auricular la warfarina debe ser reestablecido a las 24 ó 48 hs del procedimiento. En pacientes asintomáticos ó minimamente sintomático tanto la actualización de su historia clínica como el exámen físico, Rx tórax, y ECG, deberán ser realizados anualmente. Ante la recurrencia de los síntomas el Doppler cardíaco deberá realizarse a fin de evaluar la hemodinamia de la VM, la presión de arteria pulmonar, y descartar la presencia de IM ó CIA residual. Un ecocardiograma basal debería se realizado previo y 72 hs posterior al procedimiento a fin de obtener los mediciones hemódinámicos basales y 72 hs posteriores al mismo, pues bruscos cambios de la complacencia auriculo-ventricular se producen alterando la legitimidad del tiempo de hemipresión para el cálculo del área valvular mitral. El eco Estrés con ejercicio podrá ser indicado en portadores de EM con discrepancia entre los hallazgos clínicos y hemodinámicas. La profilaxis para endocarditis infecciosa y de recurrencia de la fiebre reumática deberán ser instituídas. EM Pacientes ancianos Cambios en la historia natural generan incremento del número de pacientes ancianos con EM sintomática. Los pacientes añosos presentan con mayor incidencia calcificación y fibrosis de las hojuelas valvulares de la VM, con significativa fusión comisural. El resultado de la VMPB con éxito en pacientes mayores de 65 años, mostró un descenso a menos del 50% comparado con los iniciales referido a sujetos jóvenes. La mortalidad del procedimiento alcanza al 3% asociado con incremento en las complicaciones, taponamiento pericárdico 5%, tromboembolismo 3%, sin embargo en pacientes seleccionados con favorable morfología valvular, los resultados son apropiados. La mejoría clínica en el seguimiento a largo plazo es menos manifiesta y se acompaña de mayor mortalidad comparado con los pacientes jóvenes (110). EM y Embarazo La EM afecta frecuentemente a mujeres jóvenes en edad gestacional. El incremento del volumen, gasto cardíaco, y la taquicardia asociada al embarazo incrementa la complejidad del cuadro hemodinámico. En pacientes con EM severa con deterioro de la clase funcional III-IV la VMPB puede ser llevado a cabo 102
105 con poco ó sin complicaciones para la madre ó el feto con excelentes resultados hemodinámicas (111). Bibliografía 1. Wood P. An appreciation of mitral stenosis, I: clinical features. BrMed J 1954;4870: Olesen KH. The natural history of 271 patients with mitral stenosis under medical treatment. Br Heart J 1962;24: Roberts WC, Perloff JK. Mitral valvular disease: a clinicopathologic survey of the conditions causing the mitral valve to function abnormally. Ann Intern Med 1972;77: Rusted IE, Scheifley CH, Edwards JE. Studies of the mitral valve,ii: certain anatomic features of the mitral valve and associated structures in mitral stenosis. Circulation 1956;14: J. Dusmenil Yoganathan et al. Theoretical and practical differences between the Gorlin formula and the continuity equation for calculating aortic and mitral valve areas Am J Cardiol 1991; 67: ) 6. Braunwald E, Moscovitz HL, Mram SS, et al. The hemodynamics of the left side of the heart as studied by simultaneous left atrial, left ventricular, and aortic pressures; particular reference to mitral stenosis. Circulation 1955;12: Snopek G, Pogorzelska H, Rywik TM, Browarek A, Janas J, Korewicki J. Usefulness of endothelin-1 concentration in capillary blood in patients with mitral stenosis as a predictor of regression of pulmonary hypertension after mitral valve replacement or valvuloplasty.am J Cardiol 2002;90: Hugenholtz PG, Ryan TJ, Stein SW, Belmann WH. The spectrum of pure mitral stenosis: hemodynamic studies in relation to clinical disability. Am J Cardiol 1962;10: Kasalicky J, Hurych J, Widimsky J, Dejdar R, Metys R, Stanek V.Left heart haemodynamics at rest and during exercise in patients with mitral stenosis. Br Heart J 1968;30: Bonow et al ACC/AHA Practice Guidelines e Gorlin R. The mechanism of the signs and symptoms of mitral valve disease. Br Heart J 1954;16: Wood P. An appreciation of mitral stenosis, II: investigations and results. Br Med J 1954;4871: Rowe JC, Bland EF, Sprague HB, White PD. The course of mitral stenosis without surgery: tenand twenty-year perspectives. Ann Intern Med 1960;52: Selzer A, Cohn KE. Natural history of mitral stenosis: a review.circulation 1972;45: Ward C, Hancock BW. Extreme pulmonary hypertension caused by mitral valve disease: natural history and results of surgery. Br Heart J 1975;37: Halperin JL, Rothlauf EB, Brooks KM, Mindich BP, Ambrose JA. Effect of nitroglycerin during hemodynamic estimation of valve orifice in patients with mitral stenosis. J Am Coll Cardiol 1987;10: Carroll JD, Feldman T. Percutaneous mitral balloon valvotomy and the new demographics of mitral stenosis. JAMA 1993;270:
106 17. Tuzcu EM, Block PC, Griffin BP, Newell JB, Palacios IF. Immediate and long-term outcome of percutaneous mitral valvotomy in patients 65 years and older. Circulation 1992;85: Dubin AA, March HW, Cohn K, Selzer A. Longitudinal hemodynamic and clinical study of mitral stenosis. Circulation 1971;44: Gordon SP, Douglas PS, Come PC, Manning WJ. Twodimensional and Doppler echocardiographic determinants of the natural history of mitral valve narrowing in patients with rheumatic mitral stenosis: implications for follow-up. J Am Coll Cardiol 1992;19: Craige E. Phonocardiographic studies in mitral stenosis. N Engl J Med 1957;257: Henry WL, Griffith JM, Michaelis LL, McIntosh CL, Morrow AG, Epstein SE. Measurement of mitral orifice area in patients with mitral valve disease by real-time, two-dimensional echocardiography.circulation 1975;51: Holen J, Aaslid R, Landmark K, Simonsen S. Determination of pressure gradient in mitral stenosis with a non-invasive ultrasound Doppler technique. Acta Med Scand 1976;199: Nichol PM, Gilbert BW, Kisslo JA. Two-dimensional echocardiographic assessment of mitral stenosis. Circulation 1977;55: Hatle L, Brubakk A, Tromsdal A, Angelsen B. Noninvasive assessment of pressure drop in mitral stenosis by Doppler ultrasound.br Heart J 1978;40: Wann LS, Weyman AE, Feigenbaum H, Dillon JC, Johnston KW, Eggleton RC. Determination of mitral valve area by cross-sectional echocardiography. Ann Intern Med 1978;88: Martin RP, Rakowski H, Kleiman JH, Beaver W, London E, Popp RL. Reliability and reproducibility of two dimensional echocardiograph measurement of the stenotic mitral valve orifice area. Am J Cardiol 1979;43: Reid CL, McKay CR, Chandraratna PA, Kawanishi DT, Rahimtoola SH. Mechanisms of increase in mitral valve area and influence of anatomic features in double-balloon, catheter balloon valvuloplasty in adults with rheumatic mitral stenosis: a Doppler and two-dimensional echocardiographic study. Circulation 1987;76: Cannan CR, Nishimura RA, Reeder GS, et al. Echocardiographic assessment of commissural calcium: a simple predictor of outcome after percutaneous mitral balloon valvotomy. J Am Coll Cardiol 1997;29: Rediker DE, Block PC, Abascal VM, Palacios IF. Mitral balloon valvuloplasty for mitral restenosis after surgical commissurotomy. J Am Coll Cardiol 1988;11: Fatkin D, Roy P, Morgan JJ, Feneley MP. Percutaneous balloon mitral valvotomy with the Inoue single-balloon catheter: commissural morphology as a determinant of outcome. J Am Coll Cardiol 1993;21: Iung B, Cormier B, Ducimetiere P, et al. Functional results 5 years after successful percutaneous mitral commissurotomy in a series of 528 patients and analysis of predictive factors. J Am Coll Cardiol 1996;27: Reid CL, Chandraratna PA, Kawanishi DT, Kotlewski A, Rahimtoola SH. Influence of mitral valve morphology on double-balloon catheter balloon valvuloplasty in patients with mitral stenosis: analysis of factors predicting immediate and 3-month results. Circulation 1989;80: Wilkins GT, Weyman AE, Abascal VM, Block PC, Palacios IF. Percutaneous balloon dilatation of the mitral valve: an analysis of echocardiographic variables related to outcome and the mechanism of dilatation. Br Heart J 1988;60: Hatle L, Angelsen B, Tromsdal A. Noninvasive assessment of atrioventricular pressure half-time by Doppler ultrasound. Circulation 1979;60: Nakatani S, Masuyama T, Kodama K, Kitabatake A, Fujii K, Kamada T. Value and limitations of Doppler echocardiography in the quantification of stenotic mitral valve area: comparison of the 104
107 pressure half-time and the continuity equation methods. Circulation 1988;77: Thomas JD, Wilkins GT, Choong CY, et al. Inaccuracy of mitral pressure half-time immediately after percutaneous mitral valvotomy.dependence on transmitral gradient and left atrial and ventricular compliance. Circulation 1988;78: Flachskampf FA, Weyman AE, Guerrero JL, Thomas JD. Influence of orifice geometry and flow rate on effective valve area: an in vitro study. J Am Coll Cardiol 1990;15: Currie PJ, Seward JB, Chan KL, et al. Continuous wave Doppler determination of right ventricular pressure: a simultaneous Dopplercatheterization study in 127 patients. J Am Coll Cardiol 1985;6: Himelman RB, Stulbarg M, Kircher B, et al. Noninvasive evaluation of pulmonary artery pressure during exercise by saline-enhanced Doppler echocardiography in chronic pulmonary disease. Circulation 1989;79: Tamai J, Nagata S, Akaike M, et al. Improvement in mitral flow dynamics during exercise after percutaneous transvenous mitral commissurotomy: noninvasive evaluation using continuous wave Doppler technique. Circulation 1990;81: Leavitt JI, Coats MH, Falk RH. Effects of exercise on transmitral gradient and pulmonary artery pressure in patients with mitral stenosis or a prosthetic mitral valve: a Doppler echocardiographicstudy. J Am Coll Cardiol 1991;17: Cheriex EC, Pieters FA, Janssen JH, de Swart H, Palmans-Meulemans A. Value of exercise Doppler-echocardiography in patients with mitral stenosis. Int J Cardiol 1994;45: Okay T, Deligonul U, Sancaktar O, Kozan O. Contribution of mitral valve reserve capacity to sustained symptomatic improvement after balloon valvulotomy in mitral stenosis: implications for restenosis. J Am Coll Cardiol 1993;22: Nakhjavan FK, Katz MR, Maranhao V, Goldberg H. Analysis of influence of catecholamine and tachycardia during supine exercise in patients with mitral stenosis and sinus rhythm. Br Heart J 1969;31: Bhatia ML, Shrivastava S, Roy SB. Immediate haemodynamic effects of a beta adrenergic blocking agent propranolol in mitral stenosis at fixed heart rates. Br Heart J 1972;34: Alan S, Ulgen MS, Ozdemir K, Keles T, Toprak N. Reliability and efficacy of metoprolol and diltiazem in patients having mild to moderate mitral stenosis with sinus rhythm. Angiology 2002;53: Cieslewicz G, Juszczyk G, Foremny J, et al. Inhaled corticosteroid improves bronchial reactivity and decreases symptoms in patients with mitral stenosis. Chest 1998;114: Beiser GD, Epstein SE, Stampfer M, Robinson B, Braunwald E. Studies on digitalis, XVII: effects of ouabain on the hemodynamic response to exercise in patients with mitral stenosis in normal sinus rhythm. N Engl J Med 1968;278: Coulshed N, Epstein EJ, McKendrick CS, Galloway RW, Walker E. Systemic embolism in mitral valve disease. Br Heart J 1970;32: Abernathy WS, Willis PW III. Thromboembolic complications of rheumatic heart disease. Cardiovasc Clin 1973;5: August 1, Daley R, Mattingly TW, Holt CL, Bland EF, White PD. Systemic arterial embolism in rheumatic heart disease. Am Heart J 1951;42: Laupacis A, Albers G, Dunn M, Feinberg W. Antithrombotic therapy in atrial fibrillation. Chest 1992;102:426S 33S. 53. Manning WJ, Silverman DI, Keighley CS, Oettgen P, Douglas PS. Transesophageal echocardiographically facilitated early cardioversion from atrial fibrillation using short-term anticoagulation: final results of a prospective 4.5-year study. J Am Coll Cardiol 1995;25:
108 54. Adams GF, Merrett JD, Hutchinson WM, Pollock AM. Cerebral embolism and mitral stenosis: survival with and without anticoagulants. J Neurol Neurosurg Psych 1974;37: Krasuski RA, Assar MD, Wang A, et al. Usefulness of percutaneous balloon mitral commissurotomy in preventing the development of atrial fibrillation in patients with mitral stenosis. Am J Cardiol 2004;93: Levine HJ, Pauker SG, Eckman MH. Antithrombotic therapy in valvular heart disease. Chest 1995;108:360S 70S. 57. Caplan LR, D Cruz I, Hier DB, Reddy H, Shah S. Atrial size, atrial fibrillation, and stroke. Ann Neurol 1986;19: Gohlke-Barwolf C, Acar J, Oakley C, et al. Guidelines for prevention of thromboembolic events in valvular heart disease: Study Group of the Working Group on Valvular Heart Disease of the European Society of Cardiology. Eur Heart J 1995;16: Cribier A, Eltchaninoff H, Koning R, et al. Percutaneous mechanical mitral commissurotomy with a newly designed metallic valvulotome: immediate results of the initial experience in 153 patients. Circulation 1999;99: Multicenter experience with balloon mitral commissurotomy: NHLBI Balloon Valvuloplasty Registry Report on immediate and 30-day follow-up results: the National Heart, Lung, and Blood Institute Balloon Valvuloplasty Registry Participants. Circulation 1992;85: Complications and mortality of percutaneous balloon mitral commissurotomy: a report from the National Heart, Lung, and Blood Institute Balloon Valvuloplasty Registry. Circulation 1992;85: Palacios IF, Sanchez PL, Harrell LC, Weyman AE, Block PC. Which patients benefit from percutaneous mitral balloon valvuloplasty? Prevalvuloplasty and postvalvuloplasty variables that predict long-term outcome. Circulation 2002;105: Orrange SE, Kawanishi DT, Lopez BM, Curry SM, Rahimtoola SH. Actuarial outcome after catheter balloon commissurotomy in patients with mitral stenosis. Circulation 1997;95: Cohen DJ, Kuntz RE, Gordon SP, et al. Predictors of long-term outcome after percutaneous balloon mitral valvuloplasty. N Engl J Med 1992;327: Dean LS, Mickel M, Bonan R, et al. Four-year follow-up of patients undergoing percutaneous balloon mitral commissurotomy: a report from the National Heart, Lung, and Blood Institute Balloon Valvuloplasty Registry. J Am Coll Cardiol 1996;28: Iung B, Garbarz E, Michaud P, et al. Late results of percutaneous mitral commissurotomy in a series of 1024 patients: analysis of late clinical deterioration: frequency, anatomic findings, and predictive factors. Circulation 1999;99: Kang DH, Park SW, Song JK, et al. Long-term clinical and echocardiographic outcome of percutaneous mitral valvuloplasty: randomized comparison of Inoue and double-balloon techniques. J Am Coll Cardiol 2000;35: Tokmakoglu H, Vural KM, Ozatik MA, Cehreli S, Sener E, Tasdemir O. Closed commissurotomy versus balloon valvuloplasty for rheumatic mitral stenosis. J Heart Valve Dis 2001;10: Palacios IF, Tuzcu ME, Weyman AE, Newell JB, Block PC. Clinical follow-up of patients undergoing percutaneous mitral balloon valvotomy. Circulation 1995;91: Hernandez R, Banuelos C, Alfonso F, et al. Long-term clinical and echocardiographic follow-up after percutaneous mitral valvuloplasty with the Inoue balloon. Circulation 1999;99: Padial LR, Freitas N, Sagie A, et al. Echocardiography can predict which patients will develop severe mitral regurgitation after percutaneous mitral valvulotomy. J Am Coll Cardiol 1996;27: Bonow et al ACC/AHA Practice Guidelines e217silaruks S, Thinkhamrop B, Tantikosum W, Wongvipaporn C,Tatsanavivat P, Klungboonkrong.prognostic model for predicting the disappearance of left atrial thrombi among candidates for percutaneous transvenous mitral commissurotomy. J Am 106
109 Coll Cardiol 2002;39: Padial LR, Abascal VM, Moreno PR, Weyman AE, Levine RA, Palacios IF. Echocardiography can predict the development of severe mitral regurgitation after percutaneous mitral valvuloplasty by the Inoue technique. Am J Cardiol 1999;83: Birkmeyer JD, Siewer Ae, Finayson E, et al. Hospital volume and surgical mortality in the Unites States. N Engl J Med 2002;346: Goodney PP, OConnors GT, Wennberg DE, Birkmayer JD, Do Hospitals with low mortality rate in coronary artery bypass also perform well in valve replacement? Ann Thorac Surg 2003; 76: Wu ZK, Sun PW, Zhang X, Zhong FT, Tong CW, Lu K. Superiority of mitral valve replacementincronary artery bypass with preservation of subvalvular structure to conventional replacement in severe rheumatic mitral valve disease: a modified technique and results of one-year follow up. J Heart Valve Dis 2000;9: David TE. Artificial chordae. Semin Thorac Cardiovasc Surg2004;16: Privitera S, Butany J, Silversides C, Leask RL, David TE. Artificial chordae tendinae: long-term changes. J Card Surg 2005;20: Yasu T, Katsuki T, Ohmura N, et al. Delayed improvement in skeletal muscle metabolism and exercise capacity in patients with mitral stenosis following immediate hemodynamic amelioration by percutaneous transvenous mitral commissurotomy. Am J Cardiol 1996;77: Braunwald E, Braunwald NS, Ross JJ, Morrow AG. Effects of mitral valve replacement on the pulmonary vascular dynamics of patients with pulmonary hypertension. N Engl J Med 1965;273: Rihal CS, Schaff HV, Frye RL, Bailey KR, Hammes LN, Holmes DR Jr. Long-term follow-up of patients undergoing closed transventricular mitral commissurotomy: a useful surrogate for percutaneous balloon mitral valvuloplasty? J Am Coll Cardiol 1992;20: Mahoney PD, Loh E, Blitz LR, Herrmann HC. Hemodynamic effects of inhaled nitric oxide in women with mitral stenosis and pulmonary hypertension. Am J Cardiol 2001;87: McKay CR, Kawanishi DT, Kotlewski A, et al. Improvement in exercise capacity and exercise hemodynamics 3 months after doubleballoon, catheter balloon valvuloplasty treatment of patients with symptomatic mitral stenosis. Circulation 1988;77: Dalen JE, Matloff JM, Evans GL, et al. Early reduction of pulmonary vascular resistance after mitral-valve replacement. N Engl J Med 1967;277: Higgs LM, Glancy DL, O Brien KP, Epstein SE, Morrow AG. Mitral restenosis: an uncommon cause of recurrent symptoms following mitral commissurotomy. Am J Cardiol 1970;26: Abascal VM, Wilkins GT, Choong CY, et al. Echocardiographic evaluation of mitral valve structure and function in patients followed for at least 6 months after percutaneous balloon mitral valvuloplasty. J Am Coll Cardiol 1988;12: Shaw TR, Sutaria N, Prendergast B. Clinical and haemodynamic profiles of young, middle aged, and elderly patients with mitral stenosis undergoing mitral balloon valvotomy. Heart 2003;89: Gupta A, Lokhandwala YY, Satoskar PR, Salvi VS. Balloon mitral valvotomy in pregnancy: maternal and fetal outcomes. J Am Coll Surg 1998;187:
110 Tabla I Estenosis mitral Criterios de severidad Leve Moderada Severa Area valvular cm² > 1,5 1,0-1,5 1 Gradiente medio mm Hg < Presión sistólica de arteria < >50 pulmonar (mm Hg) Tabla 2 Score de la válvula mitral. Determinantes Ecocardiográficos de los resultados con la dilatación percutánea con balón de la válvula mitral. Grado Movilidad 1 Valva muy móvil, con restricción limitada al borde. 2 La porción medial y basal de las valvas tienen movilidad normal. 3 La valva continúa moviéndose hacia adelante desde su base 4 Escaso ó nulo movimiento anterior de las hojuelas en diástole Engrosamiento subvalvular 1 Mínimo engrosamiento justo debajo de las hojuelas valvulares 2 Engrosamiento de la estructura cordal extensivo al primer tercio del largo cordal 3 Engrosamiento extensivo al tercio distal de las cuerdas 4 Engrosamiento extensivo y acortamiento de la estructura cordal con extensión hacia los músculos papilares. Engrosamiento 1 Valvas con engrosamiento cercano a lo normal (4-5 mm) 2 Considerable engrosamiento en los márgenes (5-8 mm) con respeto de la porción medial 3 Engrosamiento extensivo hacia toda la valva (5 a 8 mm). 4 Considerable engrosamiento del todo el tejido valvar (mayor de 8 a 10 mm) Calcificación 1 Area única con brillo aumentado 2 Areas dispersas de brillo confinadas al margen valvar 3 Brillo extensivo a la porción medial de las hojuelas valvulares 4 Brillo extensivo al resto del tejido valvular. Wilkins Gt, Weyman AE, Abascal VM, Block PC, Palacios IF. Percutaneous balloon dilatation of the mitral valve: an analysis of echocardiographic variables related to outcome and the mechanism of dilatation. Br Heart J 1988,60:
111 Tabla 3 Score predictor de insuficiencia mitral severa posterior a la valvulotomía mitral percutánea I-II grosor valvular (puntaje por cada valva por separado) 1 Valva casi normal (4-5 mm) ó con un segmento engrosado) 2 Valva uniformemente fibrosada y ó calcificada sin áreas adelgazadas. 3 Valva heterogeneamente fibrosada y ó calcificada las áreas menos comprometidas se hallan engrosadas (4-8 mm) 4 Valva heterogeneamente fibrosada y ó calcificada las áreas adelgazadas se hallan normales (4-5 mm) III Calcificación comisural 1 Fibrosis y ó calcificación de una sola comisura. 2 Ambas comisuras levemente afectadas 3 Calcificación de ambas comisuras, una de ellas más afectada. 4 Calcificación de ambas comisuras, ambas marcadamente afectadas. IV Compromiso subvalvular 1 Mínimo engrosamiento de las cuerdas adyacentes a la valva. 2 Engrosamiento extendido hacia el tercio medio de las cuerdas. 3 Engrosamiento que alcanza el tercio distal de las cuerdas. 4 Extenso engrosamiento y acortamiento de todas las cuerdas hasta los músculo papilares. Padial LR, Freitas N, Sagie A, Newell JB, Weyman AE, Levine RA, Palacios IF. Echocardiography can predict which patients will develop severe mitral regurgitation afer percutaneous mitral valvulotomy. J Am Coll Cardiol.1996; 27:
112 Figuras VI AO QR1 AI QR1 PAI PAI ECG PVI A2CH A2CH Figura 1. Gráfico que representa los cambios hemodinámicas en presencia de estenosis mitral con incremento de las presiones de AI ejemplificada mediante 2 curvas de presión de AI una de ellas se halla en un nivel mas alto, determinantes en los hallazgos auscultatorios, rolido diastólico generado por la presencia de gradiente diastólico entre la AI y el VI; con prolongación del, Q-primer ruido (QR 1), así como el acortamiento en la duración A2-chasquido de apertura (A2CH)debido al entrecruzamiento temprano diastólico de la curva de PVI con de curva de PAI, la cual se halla en niveles mas altos. Curvas de presión ventricular izquierdo(vi) presión de aurícula izquierda(ai), presión de aorta (Ao). Figura 2. Ecocardiograma 2D paresternal izquierdo eje longitudinal, se visualiza el compromiso mitral reumático, con engrosamiento de ambas valvas, y dilatación de la AI. Eje corto VM VD VI VI AD AI 4C Apical Figura 3. Ecocardiograma 2D paresternal izquierdo eje corto, se visualiza el compromiso mitral reumático por engrosamiento de los bordes así como del cuerpo de ambas valvas, fusión comisural, observe el orificio restringido, vista útil para realizar la planimetría mitral. Figura 4. Ecocardiograma 2D 4cámaras apical, se visualiza el compromiso mitral reumático por engrosamiento de los bordes así como del cuerpo de ambas valvas, obsérvese el orificio restringido, con dilatación n de la AI con desplazamiento del tabique interauricular hacia la AD. AI= aurícula izquierda, AD=aurícula derecha,vi= ventrículo izquierdo, VD= ventrículo derecho
113 Planimetría eco 2D AVM=0,75cm² ECG Figura 5. Ecocardiograma en modo M a nivel II, se observa la válvula mitral con ecos densos a nivel de ambas valvas, la valva posterior acompaña en su movimiento diastólico a la valva anterior, indicativos de la fusión comisural conformando la imagen en guarda griega. Figura 6. Ecocardiograma 2D paresternal izquierdo eje corto, se visualiza el compromiso mitral reumático por engrosamiento de los bordes así como del cuerpo de ambas valvas, fusión comisural, observe el orificio restringido, vista útil para realizar la planimetría mitral. Gradiente medio mitral Gradiente Medio GM=16 mmhg AVM=0,73 cm2 PAI PVI ECG Figura7.. Registro hemodinámico del Gradiente medio con las curvas de presión de VI de AI, el gradiente g medio resulta de la sumatoria de los gradientes instantáneos divididos por el N de muestra, de igual modo se homologa al registro Doppler (DC) donde el gradiente se asimila a partir de la conversión de la velocidad del Flujo a través de la ecuación modificada de Bernouille. Figura 8. El gradiente medio obtenido mediante el registro Doppler (DC) el cual resulta de la medición de la sumatoria de los gradientes instantáneos divididos por el N de muestra, gradiente que surge de la conversión de la velocidad del Flujo a través de la ecuación modificada de Bernouille; el mismo se logra obtener en forma automática circuscribiendo la imagen espectral del FM
114 Eje corto VM Planimetría VI AVM=0,75cm² ECG ECG Figura 9. El área válvular mitral medido por planimetría se obtiene con registro 2D eje corto paraesternal izquierdo, a nivel de la válvula mitral en diástole recorriendo cuidadosamente los bordes del orificio. THP VI AI Figura 10. Panel superior registro hemodinámico con curvas de presión de AI y de VI durante el lleno diastólico y el tiempo de hemipresión es calculado como el tiempo en alcanzar la mitad de su gradiente inicial, a partir del cual se puede inferir el AVM de igual modo con el Doppler (panel inferior), se puede determinar mediante el trazado de una pendiente sobre la imagen espectral del flujo mitral desde su inicio, y las máquinas calculará el mismo, en forma automática derivará el área valvular mitral. THP AVM (cm²)= 220 THP THP=250ms AVM=220/THP AVM= 220/250 AVM= 0,9 cm² 112
115 Tiempo de Hemipresión AVM = 220 THP GM= 19 mm Hg THP= 332 msec AVM= 0,66 cm 2 THP: 203 ms THP: 203 ms AVM: 220 THP AVM:1.08cm :1.08cm² GM: 4,7 mmhg THP ECG IM Figura 11.. El THP es obtenido mediante el trazado de la pendiente desaceleración eración sobre la imagen espectral del flujo mitral desde su inicio, y el software del ecógrafo calculará culará el mismo en forma automática derivará el área valvular mitral a partir del mismo. Con THP=332 ms le corresponde área valvular mitral de 0, 66 cm². AVM: área valvular mitral, THP: tiempo de hemipresión,, GM: gradiente medio. Figura 12. Registro del Flujo mitral mediante Doppler, pudiéndose estimar el AVM mediante el THP. El THP es obtenido mediante el trazado de la pendiente desaceleración sobre la imagen espectral del flujo mitral desde su inicio, y el software del equipocalculará el mismo, en forma automática derivará el área valvular mitral a partir del mismo. Estenosis mitral reumática con ritmo sinusal, conthp:203ms, le corresponde AVM: 1,08 cm². AVM: área valvular mitral, THP: tiempo de hemipresión, GM: gradiente medio. A THP = 203 ms AVM = 220 THP AVM = AVM =1.08cm² B B THP = 275ms AVM a = 220 THP AVM = AVM = 0,8cm² GM = 4,7 mmhg THP = 203 ms AVM = 1,08 cm ² GM = 16 mm Hg THP = 275ms AVM = 0,8 cm² C C THP = 300 ms AVM = 220 THP AVM = AVM = 0,72 cm2 D THP = 332 ms AVM = 220 THP AVM = AVM = 0,66 cm2 GM = 19 mm Hg THP = 300 msec AVM = 0,72 cm ² GM =19 mmhg THP = 332 msec AVM = 0,66 cm ² Figura 13. Registro Doppler (DC) del FM en estenosis mitral (EM) medición del tiempo Hemipresión(THP), a partir del cual se calcula el área valvular mitral, AVM:220/THP. GM: gradiente medio. A. THP: 203ms; AVM:1,08cm², GM:4,7 mmhg. EM moderada. B. THP:275ms; AVM:0,8 cm², GM:16 mmhg. C. THP:300ms; AVM:0,73 cm², GM:16 mmhg. D. THP: 332ms; AVM: 0,66ms², GM: 19 mmhg. B,C,D corresponden a Estenosis mitral severa
116 Estenosis Mitral Ecuación n de Continuidad Q= A 1.V 1 =A 2. V 2 A 2 = A 1.V 1 V 2 AVM= A TSVI TSVI.IVT TSVI IVT M Figura 14. Determinación del área valvular mitral (AVM) mediante la Ecuación de la Continuidad AVM= ATSVI (.r²). IVTTSVI /IVTFM Q=flujo, A= área, V=velocidad; siendo el flujo de referencia el FTSVI; los componentes de la eq. continuidad, se hallan representados mediante las ilustraciones. ATSVI = área del tracto de salida del VI, r² =radio, =3,14; IVTTSVI integral velocidad tiempo del flujo del TSVI, IVTM= integral velocidad tiempo del flujo mitral; TSVI= tracto de salida del VI. VTIM: 67cm ECG Q1= Q2 Q1= = A1 A.V 1= = A2 A. V2 A2 = A1 A. V1 V2 AVM= ATSVI.IVT IVTM Figura 15. Determinación del AVM mediante la Ecuación de la Continuidad. Q=flujo, A= área, V=velocidad; siendo el flujo de referencia el FTSVI; radiotsvi=1cm, IVTTSVI= 19 cm² IVTM= 67cm ATSVI =(.r²) = 3,14. 1²=3,14 AVM= ATSVI (.r²). IVTTSVI /IVTM AVM=3, / 67= 60/67 AVM= 0,9 cm² ATSVI = área del tracto de salida del VI, r² =radio, =3,14; IVTTSVI integral velocidad tiempo del flujo del TSVI, IVTM= integral velocidad tiempo del flujo mitral; AVM = área valvular mitral, TSVI= tracto de salida del VI
117 PISA PISA Figura 16. Aceleración proximal del Flujo (PISA) :.ver texto Figura17. Ilustraciones que representan la vista de 4 c apical-doppler Color: La Aceleración proximal del flujo (PISA) representa el área de isovelocidad circunscripta al orificio estenótico permite estimar el AVM que resulta de multiplicar la superficie de la hemiesfera del PISA por la velocidad del límite Nyquist dividido la velocidad máxima del flujo mitral, corregido por el ángulo conformado por ambas valvas: ((2 r²x VNy)/ Velocidad máxima FM) / 180. El zoom, permite determinar en forma apropiada el radio del PISA medido desde la zona lindante al plano del orificio valvular. El ángulo, cuyo vértice orientado a nivel del orificio es obtenido mediante la delimitación de ambas valvas. PISA ángulo: VI r AI ECG Figura19. Vista de 4 c apical focalizado en el tracto de entrada del VI mediante la utilización del zoom, permite determinar en forma apropiada el valor del ángulo, para el cálculo del AVM mediante la aceleración proximal del flujo. El ángulo, cuyo vértice orientado a nivel del orificio es obtenido mediante la delimitación de ambas valvas. Figura18. Vista de 4 c apical-doppler Color: La Aceleración proximal del flujo (PISA) representa el área de isovelocidad circunscripta al orificio estenótico permite estimar el AVM que resulta de multiplicar la superficie de la hemiesfera del PISA por la velocidad del límite Nyquist dividido la velocidad máxima del flujo mitral, corregido por el ángulo conformado por ambas valvas: ((2 r²x VNy)/ Velocidad máxima FM) / 180. El zoom, permite determinar en forma apropiada el radio del PISA medido desde la zona lindante al plano del orificio valvular. El ángulo, cuyo vértice orientado a nivel del orificio es obtenido mediante la delimitación de ambas valvas
118 ECG Figura 20. Registro Doppler Color en modo M: obsérvese la Aceleración proximal del flujo (PISA) que representa el área de isovelocidad circunscripta al orificio estenótico. Figura 21. Registro espectral Doppler del flujo de la vena pulmonar superior derecha (FVPSD), obsérvese la onda diastólica (D) con pendiente de desacelelración enlentecida expresión del impedimento del lleno ventricular secundario a la obstrucción a nivel del orificio mitral. S=onda sistólica, Vpa= onda a. Flujo vena suprahepática FT FVSH A IT V:4m/s:4(4)²:64mmHg PAD=10 mmhg PSAP= PSAP= 74 mm Hg ECG S D ECG Figura 22.. Registro espectral del flujo tricuspídeo obtenido mediante el Doppler CW, se observa el flujo anterógrado diastólico y flujo sistólico reverso correspondiente a la insuficiencia tricúspidea (IT) cuya conversión de velocidad máxima (V) a gradiente máximo mediante la ecuación de Bernouille, el cual sumado a la Presión estimada de Aurícula derecha (PAD) =10 mmhg, permite calcular la presión sistólica de arteria pulmonar (PSAP). PSAP= 4(4)² + PAD= 64+10= 74 mm Hg. Figura 23. Registro Doppler con la imagen espectral del Flujo de la vena suprahepática normal, en paciente portador de estenosis mitral reumática leve, sin signos indicativos de incremento de la presión de ventrículo derecho ó de insuficiencia tricuspídea significativa. S= onda sistólica, D= onda diastólica, A = onda a reversa
119 IP PAD= 5 mm Hg PDAP=10 mmhg Figura 24. Panel Izquierda imagen espectral del flujo pulmonar, obsérvese la medición de los tiempos sistólico: PPey= período preeyectivo pulmonar, PEy= Período Eyectivo pulmonar; PPey/Pey = Weissler derecho. Tac= tiempo de aceleración, tiempo desde el inicio del flujo hasta que éste alcance su velocidad máxima, se correlaciona con la Presión media de arteria pulmonar. Panel derecho imagen espectral de DC de la regurgitación pulmonar, permite calcular la presión diastólica de la arteria pulmonar (10 mm Hg) resultante de la sumatoria del gradiente telediastólico (5 mmhg) más la presión estimada de la AD (5 mmhg). PDAP= Grad.teled + PAD. PDAP=10+5=15 mm Hg. PAD= presión de aurícula derecha. Ecocardiografía Transesofágica Ecocardiografía Transesofágica AI AD AI AO A Catéter VD VI GM= 11 mm Hg THP= 230 msec AVM= 0,96 cm2 Figura 25. A- Ecocardiograma transesofágico vista medioesofágica 4 cámaras ( 0 ) se visualiza el compromiso mitral reumático por engrosamiento de los bordes así como del cuerpo de ambas valvas, obsérvese nódulos de calcificación a nivel del cuerpo de la valva anterior mitral, el orificio con apertura diastólica restringido, dilatación de la AI así como de su orejuela, con desplazamiento del tabique interauricular hacia la AD. Presencia de catéter endocavitario en AD y a nivel del tracto de entrada de Ventrículo derecho. B-Ecocardiograma transesofágico vista medioesofágica eje longitudinal (120 ) se visualiza el compromiso mitral reumático con engrosamiento de los bordes así como nódulos de calcificación del cuerpo de la valva anterior mitral obsérvese el orificio valvular restringido, dilatación de AI. AI= aurícula izquierda, AD=aurícula derecha, VI= ventrículo izquierdo, VD= Ventrículo derecho. AO=aorta B VI 117
120 Ecocardiografía transesofágica Ecocardiografía transesofágica AI AD AI OAI Ao VI VD OAI ECG ECG Figura 26.A-Ecocardiograma transesofágico vista medioesofágica de 2 cámaras ( 90 ) se visualiza el compromiso mitral reumático por engrosamiento de los bordes así como del cuerpo valvar de ambas valvas, obsérvese el orificio restringido, dilatación de la AI así como de su orejuela. B- Ecocardiograma transesofágico vista esofágica alta eje corto de la válvula aórtica (55-75 ) dilatación de de la AI y de su orejuela, obsérvese presencia de catéter endocavitario en AD. AI= aurícula izquierda, OAI= orejuela de AI, AD=aurícula derecha, VD= Ventrículo derecho, Eco estrés-esfuerzo PSAP D P FT VD VI Las imágenes fluoroscópicas registrado durante la VPB, con Balón de Inoue Figura 28. Imagen fluoroscópica registrada durante la valvulaoplastia con balón utilizando el balón de Inoue. A. El balón distal ha sido insuflado a fin de asegurar la posición a nivel valvular. B. El segmento proximal ha sido también insuflado. C. La dilatación segmentaria es sostenida durante un corto lapso. IT Vel. Max:4,2m/s PSAP= 80 mmhg PSAP= ITGM + PAD PSAP= 4(4,2)²+10 = 70+10= 80 mmhg Figura 27. La ecocardiografía de Estrés realizada en bicicleta supina permite registros de la velocidad del flujo Doppler para el cálculo del área valvular mitral mediante el método de la continuidad en este contexto si bien es técnicamente dificultoso es confiable. La severidad de la estenosis mitral puede ser evaluada mediante el gradiente transmitral y la presión sistólica de arteria pulmonar. Con registro PSAP basal: 59 mmhg, GM:7 mmhg AVM=1,1cm. A la izquierda carga 600Kgm/min Registro espectral del flujo tricuspídeo obtenido mediante el Doppler CW, se observa el flujo anterógrado diastólico y flujo sistólico reverso correspondiente a la insuficiencia tricúspidea (IT) cuyo gradiente máximo sumado a la Presión estimada de Aurícula derecha (PAD) =10 mmhg) permite calcular la presión sistólica de arteria pulmonar (PSAP). PSAP= 4(4,2)²+PAD= 70+10= 80 mmhg. A la derecha se observa vista de 4 cámaras apical con el cursor del Doppler a nivel del tracto de entrada del Ventrículo derecho y AD. AI= aurícula izquierda, AD=aurícula derecha, VI= ventrículo izquierdo, VD= Ventrículo derecho. AD AI 118
121 VALVULOPATIAS DERECHAS Dr. Eduardo A. Fernández Rostello INSUFICIENCIA TRICUSPIDEA El aparato valvular tricuspídeo es una compleja estructura compuesta por tres valvas, cuerdas tendinosas, tres músculos papilares, un anillo de soporte y el miocardio del ventrículo derecho (VD), por lo que cualquier alteración de alguna de estas estructuras puede ser causante de insuficiencia valvular. La insuficiencia tricuspidea ( I.T.) es relativamente común de encontrar. En un grado menor la presentan un 70 a 75 % de los pacientes adultos,(1) esta forma es denominada fisiológica o trivial y es aquella que encontramos en una zona muy pequeña justo por debajo del plano valvular, en general no ocupa toda la sístole y la densidad de la señal por Doppler es muy escasa. Sin embargo cuando la I.T. es de grado moderada a severa esta asociada a peor pronostico a largo plazo independientemente de la edad, función sistólica biventricular, diámetro del ventrículo derecho, y dilatación de la vena cava inferior (2). VARIEDADES: a) Funcional b) Orgánica a.- Funcional: Anatómicamente la válvula tricúspide es normal, por lo cual es secundaria a cambios del anillo y del tamaño del VD, por sobrecargas de presión y o volumen del mismo Los desórdenes más frecuentes, que inducen hipertensión pulmonar y secundariamente dilatación del VD son: a) Disfunción ventricular izquierda. b) Estenosis e insuficiencia valvular mitral c) Patología pulmonar primaria (cor pulmonar, embolismo de pulmón) d) Cortocircuitos de derecha a izquierda. e) Síndrome de Eisenmenger f) Estenosis e insuficiencia valvular pulmonar. g) Hipertiroidismo b.- Orgánica: Alteración intrínseca de la estructura de la válvula tricúspide, sus causas más frecuentes: 119
122 a) Valvulopatía Reumática b) Endocarditis Infecciosa c) Prolapso (enfermedad mixomatosa) d) Infiltración Tumor Carcinoide e) Enfermedad de Ebstein (congénita) f) Traumática (Relacionado con catéter: Marcapaso, Cardiodesfibriladores, Biótomos) g) Endomiocardiofibrosis h) Disfunción o ruptura de músculo Papilar A) Valvulopatía Reumática: Siempre asociada a valvulopatía reumática izquierda. Hay fusión comisural, retracción, fibrosis de las valvas, poca calcificación, dilatación del anillo por hipertensión pulmonar (valvulopatía izquierda: estenosis (EM) o insuficiencia mitral (IM) o secundario a la sobrecarga volumétrica que produce. VD VI AD AI Figura Nº 1: Válvula Tricúspide con agresión reumática, con apertura en domo (flechas),lo mismo que la válvula Mitral. AD: aurícula derecha; AI: aurícula izquierda; VD: ventrículo derecho; VI: ventrículo izquierdo. Si bien disminuyó su incidencia, de acuerdo a algunos trabajos basados en autopsias de EEUU, la disminución es más clínica que anatomopatológica, ya que por ecocardiografía la asociación es de un 5 a 10 % mientras que por anatomía patología oscila entre un 15 a 25 %. b.- Endocarditis infecciosa: 120
123 En los últimos tiempos ha aumentado la incidencia de endocarditis derecha relacionada con adicción a drogas endovenosas, catéteres marcapaso (CMP) y abortos sépticos. La endocarditis sobre válvula tricúspide, es de baja incidencia pero variable según las distintas series, En el estudio EIRA (3) (Endocarditis Infecciosa en la República Argentina) se observó el compromiso valvular derecho en el 14,6% del total de casos de EI) mientras que en estadísticas como la de la Fundación Favaloro sólo el 5,2% presentó EI derecha (8 de 153 casos documentados)(4) Hay que destacar que en infecciones de la válvula tricúspide relacionadas al CMP, invariablemente existió algún signo de inflamación y/o infección del bolsillo del CMP. Es probable que aumente la incidencia de este tipo de endocarditis dado que el aumento de sobrevida de la población general lleva a un consecuente mayor uso de CMP. La endocarditis derecha es de evolución lenta y presenta vegetaciones de gran tamaño (verdaderas masas móviles, a veces difíciles de diferenciar de tumores). De acuerdo a las series, la más frecuente localización de grandes vegetaciones es la superficie auricular de la valva anterior (Figura 2). AI AD VD VI Figura Nº 2: Corte Transesofágico de cuatro cámaras con gran vegetación en la válvula Tricúspide c.- Prolapso de VT: Otra causa de IT orgánica es el prolapso de válvula tricúspide,(pvt) definido como movimiento anormal de una o más valvas por encima del plano del anillo tricuspídeo. El eje largo paraesternal izquierdo de VD y la vista 4 cámaras apical y subxifoidea son las más adecuadas para su búsqueda. Es muy raro el diagnóstico aislado de PVT. Cuando existe acompaña al PVM y es de menor cuantía, rara vez es quirúrgico y no presenta ruptura cordal. La incidencia de PVT que coexiste con PVM varía según las series, (Wayman: 23%), y es más común en pacientes con Síndrome de Marfan (por mayor compromiso de la enfermedad mixomatosa). El PVT compromete fundamentalmente las valvas anterior y septal
124 d.- Tumor Carcinoide El síndrome carcinoide es una patología rara, pero importante causa de afección intrínseca de la válvula tricúspide y pulmonar. Presenta alta morbilidad y mortalidad por compromiso de cavidades derechas. Una vez que se declara el síndrome carcinoide, lo cual ocurre entre el 2 y 5% de los pacientes con tumores carcinoides, aproximadamente el 50% de estos pacientes desarrollará compromiso cardiovascular. Típicamente presenta afectación de cavidades derechas. Sólo los tumores carcinoides que comprometen el hígado presentan repercusión cardiaca, como así también aquellos cuyas secreciones, no drenan en el sistema porta. La repercusión cardiaca no está dada por la presencia de metástasis del tumor a nivel cardíaco, sino por sustancias vaso activas liberadas por el tumor, las cuales habitualmente son neutralizadas por el hígado, el cerebro y los pulmones. Pero al presentar el paciente metástasis hepáticas, grandes cantidades de estas sustancias arriban al corazón en su forma activa, desarrollándose así la patología cardiaca. Las características anatomopatológicas, están dadas por la presencia de placas de tejido fibroso, que comprometen las válvulas tricúspide y pulmonar. En el diagnóstico de esta patología, hay dos exámenes complementarios de utilidad, la búsqueda de 5 hidroxi indol acético en orina de 24 horas y el ecocardiograma trans torácico. La Ecocardiografía juega un papel muy importante tanto en el diagnóstico como en el pronóstico de esta patología. Existe dilatación de aurícula y ventrículo derecho en el 90% de los casos, además de alteraciones en la motilidad del septum interventricular, la cual se da en aproximadamente el 50% de los pacientes con afectación cardiaca. Hay engrosamiento tanto de las valvas de la tricúspide como de las estructuras del aparato subvalvular, las cuales usualmente están acortadas y retraídas, provocando la pérdida de la coaptación normal y la consiguiente regurgitación tricuspidea (Figura 3). Puede existir también estenosis sola, o asociada con insuficiencia. La válvula pulmonar también es afectada, y puede también presentar engrosamiento y rigidez, lo cual conduce al desarrollo de insuficiencia pulmonar y en raras ocasiones a la estenosis. La coexistencia de IT severa con estenosis pulmonar lleva a una falla ventricular derecha muy marcada.(5) 122
125 VD AD Figura Nº 3: eje largo de VD desde vista Paraesternal izquierda VT con fibrosis, retracción cordal y falta de coaptación valvar e.- Enfermedad de Ebstein Wilhelm Ebstein en 1866 describió por primera vez la enfermedad como una válvula tricúspide deformada y con tejido desplazado en la cavidad ventricular derecha. Recién en el año 1951 se realizo el primer diagnóstico no anatopatológico y fue mediante un estudio angiográfico.es una rara malformación congénita, que representa el 0,5 % de las cardiopatías congénitas del Recién Nacido, pero el 40 % de las malformaciones congénitas de la Válvula Tricúspide La anomalía de Ebstein es una alteración caracterizada por el desplazamiento apical de la valva septal (y posterior) de la válvula Tricúspide, dentro del ventrículo derecho, mayor o igual a 8 mm/m2 de superficie corporal. Entre sus características cabe mencionar: Implante bajo de la valva septal y posterior de la válvula tricúspide. Distancia Mitro-Tricuspidea > de 8 mm por m2 de superficie corporal. Valva anterior elongada, redundante. El desplazamiento de la valva septal genera una atrializacion de una parte del VD. VD anatómico o funcional de menor tamaño. Severa dilatación de aurícula derecha. Insuficiencia valvular. C.I.A. o foramen oval permeable % se asocia a síndrome de WPW. Patología asociada: EP.,Transposición corregida de grandes vasos Ductus, Endomiocardiofibrosis
126 No debemos olvidarnos que esta patología se encuentra asociada en un 39 % (6) con patología del ventrículo Izquierdo : Disfunción sistólica : 7 % Miocardio no compacto : 19 % Disfunción diastólica : 34 % Prolapso de válvula mitral: 16 % Dilatación del V.I.: 4% Válvula aórtica bicúspide: 8 % Si bien no existe en la actualidad ninguna clasificación que se encuentre mundialmente aceptada, probablemente la clasificación de Carpentier es la que mas se adapte a la ecocardiografía (ya que a partir dichos hallazgos se podrá en caso de ser necesario tomar una conducta quirúrgica adecuada). Tipo A: valva anterior redundante libre, porción atrializada gruesa y pequeña. El volumen VD es adecuado. Tipo B: Valva anterior redundante, libre. Porción atrializada grande delgada no contráctil. El volumen VD es pequeño. Tipo C: Valva anterior redundante, con adherencias a la pared libre,. Porción atrializada grande delgada no contráctil. El volumen VD es inadecuado. Tipo D: Valva anterior redundante, con adherencias a la pared libre, Porción atrializada grande delgada no contráctil. Valva septal y posterior completamente adheridas El volumen VD es inadecuado. El tratamiento quirúrgico de estos pacientes esta reservado únicamente para pacientes con síntomas y signos de severidad como cianosis e insuficiencia cardiaca CF III IV de la N.Y.H.A. Las técnicas quirúrgicas mas utilizadas en la actualidad y acorde al tipo de Enfermedad de Ebstein detectada son: 1.- Plástica valvular: unícúspide; 2.-Reemplazo valvular ( Biológica o Mecánica);3.- Danielson: plástica de la V.T., plicatura de la cámara atrializada, anuloplastia, plicatura de la aurícula derecha ( más procedimiento de Maze en paciente con aleteo o fibrilación auricular crónica);4.- Carpentier: plástica mas plicatura de la cámara atrializada; 5.- Derivación cavopulmonar parcial o total (Fontan-Kreutzer);6.- Transplante cardiaco.(7) Si bien el E.C.G. (Figura 4) como la radiografía de tórax (Figura 5) son útiles para la detección de esta enfermedad es sin duda la ecocardiografia (Figura 6), para un correcto diagnostico, seguimiento y eventual indicación de tratamiento quirúrgico
127 Figura Nº 4 E.C.G de una Enfermedad de Ebstein Figura Nº 5: Rx de Tórax con imagen en botellón con mega aurícula derecha característica de esta patología
128 VDF VI VDA AD 1 AI Figura Nº6: 1. distancia mitro tricuspidea mayor de 3 cm. por inserción baja de la valva septal Tricuspidea, valva anterior elongada y redundante VDF: ventrículo derecho funcional; VDA: Ventrículo derecho Atrializado f)traumática :Relacionado con catéter: Marcapaso, Cardiodesfibriladores, Biótomos. VD VI AD AI Figura Nº 7: Vista apical de cuatro cámaras con catéter marcapaso en cavidades derechas ( flechas) 126
129 Probablemente la causa mas frecuente de traumatismo cordal es el trauma no intencional cuando se utiliza el biótomo transcateter para realizar biopsias intramiocardicas a pacientes transplantados.(8-9) La presencia de catéteres marcapasos o de catéteres cardiodesfibriladores (Figura 7) genera algún grado de insuficiencia valvular y en ocasiones esta ultima es secundaria a endocarditis sobre catéter. g) Endomiocardiofibrosis: es patología sumamente infrecuente. Se trata de una miocardiopatía restrictiva que afecta solo al corazón derecho o también asociada al izquierdo. Puede hallarse fibrotrombo que se ubica en la porción trabeculizada y afecta a los músculos papilares, preferentemente al posterior, con retracción valvular e insuficiencia. Tiene la particularidad que el trombo se localiza sobre un miocardio contráctil a diferencia de la enfermedad coronaria (Figuras 8 y 9) VD T VI AD AI Figura Nº 8: 4 cámaras apicales con severa dilatación de aurícula derecha, falta de coaptación de válvula tricúspide por fibrotrombo ( flechas)ubicada en la porción trabeculizada que genera retracción valvar 127
130 AD TEVD AD AO AP TSVD AD Figura Nº 9: corte transversal subxifoideo a nivel de grandes vasos,, donde se observa solamente las porciones del tracto de entrada ( TEVD ) y del tracto de salida ( TSVD ) ya que la porción trabeculizada se encuentra reemplazada por fibrotrombo ( flechas) h) Disfunción o ruptura de músculo Papilar Se produce como consecuencia de un infarto del miocardio del ventrículo derecho o del septum interventricular, que puede también implicar la pared sobre la cual apoya el músculo papilar, minando su capacidad de mantener la tensión acorde sistólica y causando la regurgitación tricúspidea. El ecocardiograma bidimensional demuestra la falta de coaptación valvar, con la dislocación apical del punto del coaptación Objetivos de la evaluación ecocardiográfica de la Insuficiencia Tricuspidea Definir la anatomía valvular y el mecanismo etiológico de la Insuficiencia Tricuspidea. Cuantificar la severidad de la insuficiencia valvular. Evaluar la repercusión sobre el tamaño y la función auricular y ventricular. Evaluar la presión sistólica de la arteria pulmonar e identificar posibles lesiones asociadas. Valoración de la Severidad de la Insuficiencia Tricuspidea Rol del Ecocardiograma bidimensional: A.- Valoración del aparato valvular tricuspideo: para determinar la etiología de la Insuficiencia valvular (ver Etiologías) 128
131 B.- Tamaño de cavidades derechas : no existe insuficiencia tricuspidea crónica de grado moderado a severo que no presente dilatación de las mismas. Dada la morfología particular del VD, se hace muy difícil su evaluación ecocardiográfica, no habiendo en realidad ninguna ventana ecocardiográfica que muestre simultáneamente la porción de entrada, la porción trabeculizada y la del infundíbulo o del tracto de salida del ventrículo derecho. Por tal motivo para las mediciones del VD se sugiere seguir las recomendaciones del comité de la Sociedad Americana de Eco cardiografía (10) según el cual el tamaño del VD por encima del plano valvular tricuspídeo no debe ser mayor de 28 mm, la dilatación es leve hasta 33 mm.,moderada hasta 39 mm., y severa mayor de este valor. El diámetro de base a punta normal es hasta 79 mm, levemente dilatado hasta 85 mm., moderadamente dilatado hasta 91 mm, y severamente dilatado mayor o igual a 92 mm. En la vista apical de cuatro cámaras no se visualiza el tracto de salida del ventrículo derecho, por lo cual el mismo debe ser medido en vista de eje transversal paraesternal izquierdo siendo su valor normal de 29 mm, levemente dilatado, hasta 32 mm moderadamente y mayor de 36 mm severamente dilatado. ( Figura 10 A y B ) Figura Nº 10; A: mediciones del ventrículo derecho,1 por encima del plano del anillo Tricuspideo y 2 de base a punta B: 3 medición del TSVD. C.- Función: el diagnóstico de disfunción ventricular derecha (11) puede ser efectuado confiablemente en caso de encontrarse los siguientes valores: Ïndice de Tei (myocardial performance index) > 0,40 TAPSE (tricuspid annular plane systolic excursion) < 2.2 cm TDI-s (velocidad sistólica de la pared libre del VD con Doppler Tisular) < 10 cm/s. D.- Movimiento paradojal del septum: si bien es un signo poco sensible ya que existen otras patologías que lo presentan, excluidas las mismas la presencia de este movimiento es sinónimo de sobrecarga volumétrica significativa del VD. E.- Vena cava inferior: la dilatación de la misma, así como de las venas suprahepáticas) con latido sistólico positivo es un signo mas de IT severa
132 Rol del Doppler convencional y color para valorar una insuficiencia Tricuspidea Severa (12-13) A.- Doppler espectral pulsado y continuo: a) Velocidad del flujo transtricuspideo mayor de 1.0 m/s; b) con Doppler continuo densidad del flujo regurgitante similar al flujo anterógrado con bordes bien delimitados; c) configuración cóncava del flujo regurgitante al final de la sístole.( Figura 11) A B Figura Nº 11. A: Flujo de regurgitación Tricuspidea en un paciente con presión de Aurícula Derecha normal. B: configuración cóncava del flujo regurgitante al final de la sístole por aumento de la presión de la Aurícula Derecha. B.- Área Absoluta/Relativa del Jet Regurgitante: >30 % C.- Flujo en Venas Cavas o Suprahepáticas: flujo sistólico reverso en ambas. D.- Volumen Regurgitante (PISA y Doppler) >45 ml. E.- Radio de Pisa: >9 mm.(12) F.- Área del Orificio Regurgitante Efectivo (PISA y Doppler): > de 0.4 cm2. (13) G.-Vena contracta: >7 mm.(12) Rol del Eco Transesofágico La mayoría de las veces la IT puede ser bien evaluada con ecocardiograma transtorácico (ETT), aún en aquellos pacientes con mala ventana paraesternal y apical, ya que la vista subxifoidea permite una buena valoración de la válvula y de su repercusión en vena cava inferior y suprahepáticas. Por lo tanto salvo casos muy puntuales no es necesario realizar un ecocardiograma transesofágico (ETE) para valorar correctamente una IT. Cuando debe realizarse por otra causa (estudio de valvulopatias izquierdas) no aporta más datos que los encontrados por ETT., salvo y continúan siendo un tema controvertido- si el ETE es superior para detectar vegetación sobre la válvula tricúspide. (14) Tiempo quirúrgico de la IT. (15-16) 130
133 Clase I: La reparación de la válvula tricúspide es beneficiosa en aquellos pacientes con IT severa que deban requerir una cirugía por presenta una patología valvular mitral. (Nivel de evidencia: B) Clase II a: 1. Reemplazo valvular o anuloplastía es razonable en pacientes con IT primaria que se encuentren sintomáticos. (Nivel de evidencia: C) 2. El reemplazo de la válvula tricúspide es razonable en pacientes con IT secundaria que no son candidatos a reparación o anuloplastía. (Nivel de evidencia: C) Clase II b: La anuloplastía Tricuspidea esta indicada en pacientes que deban ser sometidos a corrección quirúrgica de su valvulopatía mitral, que presenten hipertensión pulmonar o dilatación del anillo tricuspideo. (Nivel de evidencia: C) Clase III: 1. El reemplazo valvular o la anuloplastia no esta indicado en un paciente asintomático, con una presión sistólica pulmonar menor de 60 mmhg, sin patología válvula mitral (Nivel de Evidencia: C) 2. El reemplazo valvular o la anuloplastia no esta indicado en un paciente con insuficiencia Tricuspidea moderada (Nivel de Evidencia: C) Estenosis Tricuspidea Si bien la causa más frecuente es la agresión reumática, esta forma de estenosis en nuestra población es una patología en extinción dado la baja incidencia que tiene en la Valvulopatía reumática múltiple. La Estenosis Tricuspidea acompaña siempre a la Valvulopatía reumática mitral (el 100% se asocia con estenosis mitral y el 75% con estenosis aórtica reumática). Salvo muy raras excepciones es de grado menor que la mitral. La respuesta inmunológica pos-inflamatoria en la válvula tricúspide es similar a la mitral (fusión comisural, fibrosis, engrosamiento valvar y retracción valvar) con menor calcificación que la válvula mitral. Etiología: 90%: reumática (siempre asociada a estenosis mitral). (Figura 12) Síndrome Carcinoide. Tumores. Trombos. Endocarditis con grandes vegetaciones
134 VT VMP Figura Nº 12: VT con apertura restringida en domo; VMP: válvula mitral protésica mecánica Objetivos de la evaluación ecocardiográfica de la Estenosis Tricuspidea Reumática Imagen en domo, fusión comisural, retracción valvar. Engrosamiento difuso, poca calcificación. Reducción del área normal (Valor normal: 5 a 7 cm 2 ). Dilatación de Aurícula Derecha. Dilatación de Vena Cava Inferior y de venas Suprahepáticas Medición de gradientes: gradiente medio > de 7 mmhg (13) es indicador de estenosis de grado severo. Importante: con 5 mmhg de gradiente medio el paciente comienza con signos de congestión venosa. Medición del Área: 190 / THP (Figura 13) Estenosis leve: > de 1.5 cm2 Moderada: cm2 Severa: < de 1 cm2 Valorar valvulopatias agregadas. Descartar otras causas de estenosis: síndrome Carcinoide; grandes vegetaciones; trombos o tumores en Aurícula Derecha
135 Figura Nº 13: Doppler continuo a través de VT con THP prolongado y área valvular menor de 1 cm2 (190 / 214) Indicación de tratamiento quirúrgico: No existen consensos de cual es el momento oportuno del tratamiento quirúrgico o por Valvuloplastía de una ET. Probablemente porque esta Valvulopatía siempre acompaña a valvulopatias del lado izquierdo, presentando en general con una evolución mas lenta que estas, por lo que cuando se evalúa el tratamiento quirúrgico de las mismas se debe incluir si corresponde o no agregar la corrección de la VT., o se espera hasta la aparición de signos de congestión venosa sistémica. ESTENOSIS PULMONAR La obstrucción se puede localizar a diferentes niveles Prevalvular: a) Medioventricular ( doble cámara ventricular derecha) b) Infundibular ( aislada o mas comúnmente asociada a la Tetralogía de Fallot) Valvular: a) Fusión comisural b) Displásica. Postvalvular: a) Tronco de arteria pulmonar. b) Ramas de arteria pulmonar. En lo referente a su etiología, la estenosis puede ser: Congénita: Por fusión comisural: unícúspide, bicúspide y tricúspide. Displásica: Síndrome de Noonan. Adquirida: Carcinoide. Reumática: Tumores. Vegetaciones
136 El 95% de las estenosis pulmonares (EP) son congénitas, y el 80% aisladas. (El 20% restante se asocia con Tetralogía de Fallot, infiltración carcinoide etc,), Las válvulas displásicas (Figura 14) macroscópicamente se caracterizan por presentar tres valvas muy gruesas y redundantes, sin fusión comisural, por lo que la obstrucción se produce por efecto de masa, cuando se analiza su microscopia se observa tejido mixomatoso y fibras elásticas desorganizadas y dispersas. Puede encontrarse en forma aislada o lo mas común que acompañe al Síndrome de Noonan. Esta caracterización es muy importante ya que estos pacientes no responden favorablemente a la Valvuloplastía. ao ap Figura Nº 14. Eje menor a nivel de grandes vasos; se observa válvula pulmonar displásica (Engrosada redundante, flecha), llamando la atención la falta de dilatación postestenotica de la arteria pulmonar, pero que es característico de este tipo de estenosis. Objetivos de la evaluación ecocardiográfica de la estenosis valvular pulmonar Valorar el grado de severidad de la Hipertrofia ventricular derecha ( secundaria a la sobrecarga de presión que presenta el mismo) Imagen en domo característica de la estenosis por fusión comisural versus válvula redundante de la variedad displásica. Medición del anillo pulmonar. Dilatación postvalvular de la arteria pulmonar ( variedad fusión comisural) Dilatación postvalvular de arteria pulmonar. Medición de gradientes: a.- Gradiente VD/AP: < de 50 mmhg: EP leve b.- Gradiente VD/AP: de 50 a 80 mmhg: EP Moderada c.- Gradiente VD/AP: > de 80 mmhg: EP Severa
137 Medición de la presión sistólica del VD a través del jet de regurgitación Tricuspidea. Indicación de tratamiento de las EP: El tratamiento de elección para la variedad fusión comisural (la gran mayoría) es la dilatación con balón, el mismo esta indicado en pacientes con un gradiente transvalvular pulmonar > de 50 mmhg., también ha sido utilizado con éxito en pacientes con EP reumática y por síndrome carcinoide El resultado de dicho tratamiento en general es muy satisfactorio, pero habrá que hacer un seguimiento a largo plazo para evaluar el grado de incidencia de Insuficiencia pulmonar secundario a dicho tratamiento. De no ser satisfactorio el resultado se evaluará el momento oportuno para realizar una comisurectomía o el reemplazo valvular, la prótesis ideal es el homoinjerto ya que las mecánicas tienen alta incidencia de trombosis y las porcinas degeneran. INSUFICIENCIA VALVULAR PULMONAR En la población general un gran porcentaje presenta insuficiencia pulmonar (IP) fisiológica en el marco de una válvula normal. (65%, pero con variación según las diferentes series)(17) Es infrecuente la IP patológica en adultos. La IP patológica se diferencia de la fisiológica por la duración (holodiastólicas), y por el ancho del jet. En pacientes con HTP (primaria o secundaria) la dilatación del anillo pulmonar es la causa de IP. Lo mismo ocurre en las sobrecargas de volumen (comunicación interauricular). Aún en estos casos no llegan a ser severas. La causa que con mayor frecuencia requiere por su severidad intervención quirúrgica en adultos, es la complicación alejada de una cirugía de corrección de la tetralogía de Fallot, que han requerido de un parche transanular para ampliar el tracto de salida y el anillo pulmonar. Es menos frecuente pero va en aumento la insuficiencia pulmonar secundario a valvuloplastía con balon por EP. 1- Orgánica : alteración intrínseca de la estructura de la Válvula Pulmonar. a.- Congénita: b.- Adquirida: 1) Agenesia de válvula pulmonar (muy raro). 1) Post Valvuloplastía Pulmonar. 2) Tetralogía de Fallot operada con parche transanular. 3) Síndrome Carcinoide. 4) Endocarditis Bacteriana
138 2- Funcional: anatómicamente la Válvula Pulmonar es normal, es secundario a cambios del anillo (Dilatación ideopática de Arteria Pulmonar) y por sobrecargas de presión (HTTP) que es lo más frecuente. Objetivos de la evaluación ecocardiográfica de la Insuficiencia Pulmonar Definir la anatomía valvular y el mecanismo etiológico de la IP.( vegetaciones, valvas rígidas en el síndrome carcinoide, falta de coaptación valvar en la tetralogía de Fallot operada o post valvuloplastía) Evaluar la repercusión sobre el tamaño y la función ventricular, ya que no existe IP. moderada a severa sin dilatación del ventrículo derecho. Evaluar presión sistólica y diastólica de la Arteria Pulmonar. Identificar posibles lesiones asociadas. Cuantificar la severidad de la IP ( 12). Signos de severidad: a.- Doppler espectral pulsado y continuo 1.- El tiempo de hemipresión determina el grado de severidad de IP en adultos, luego de la tetralogía de Fallot (18. Un valor menor de 100 mseg tiene una muy buena correlación con una fracción regurgitante por resosnancia magnética nuclear. de un 40 %. 2.- La densidad del flujo regurgitante por Doppler continuo es un signo cualitativo de severidad de la IP (densidad similar al flujo anterógrado con bordes bien limitados) (12) b.- Flujo en tronco y ramas de la arteria pulmonar (flujo reverso holodiastolico en ramas de la arteria pulmonar como signo de severidad de la IP.) c.- Volumen Regurgitante (PISA y Doppler) > 60 ml. d.- Radio de Pisa: > 9 mm. e.- Orificio Regurgitante Efectivo (PISA y Doppler) : > de 0.35cm2. (Figura 15). f.- Fracción regurgitante: >40 % g.- Vena contracta: >7 mm
139 TSVD PISA AP Figura Nº 15 medición de Vena Contracta ( flecha) y del radio del Pisa en un paciente con IP severa. En la actualidad no existe consenso de las variables a estudiar en pacientes portadores de IP, tanto es así que prácticamente no se menciona la válvula pulmonar en el ultimo consenso Americano ni Europeo de valvulopatias ( 12 y 15) de los años 2006 y 2007 respectivamente. La insuficiencia pulmonar es realmente una patología benigna?, En la actualidad, hay trabajos (19) que muestran en un seguimiento a largo plazo que a 40 años de detectada la insuficiencia pulmonar la mitad de los pacientes se encuentran ya sintomáticos y que a los 50 años solo están libres de síntomas menos del 40 %. Cuando valoramos predictores del resultado del reemplazo de válvula pulmonar en pacientes operados de Tetralogía de Fallot por IP severa, los trabajos que fueron publicados recientemente en el 2007 (20-21) muestran lo siguiente: 1.- La severidad de la IP no predice la función ni el tamaño del VD después del reemplazo valvular. 2.- El volumen de fin de sístole es el mejor predictor cuando el mismo es menor de 82 ml/m El volumen de fin de diástole es un buen predictor cuando es menor de 160 ml/m2. (medidos por RMN) 4.- La fracción de eyección no cambia significativamente después de la cirugía. A posterior de la lectura de estos trabajos la pregunta que nos hacemos es por qué efectivamente la fracción de eyección y el tamaño del VD no mejoran después de la cirugía?. La respuesta más razonable sería porque estamos llegando tarde a la cirugía, ya que no hay parámetros bien delimitados como en las valvulopatias del lado izquierdo. Por ello, este debe ser el gran reto de los ecocardiografistas para los próximos años. En conclusión el ventrículo derecho existe y las valvulopatias derechas también 137
Estenosis aortica Insuficiencia mitral
 Estenosis aortica Insuficiencia mitral Estenosis aortica La esclerosis de la válvula aórtica se define como el engrosamiento y la calcificación de la válvula aórtica sin un gradiente significativo (definido
Estenosis aortica Insuficiencia mitral Estenosis aortica La esclerosis de la válvula aórtica se define como el engrosamiento y la calcificación de la válvula aórtica sin un gradiente significativo (definido
INSUFICIENCIA MITRAL CRÓNICA
 INSUFICIENCIA MITRAL CRÓNICA 1 GENERALIDADES La identificación del mecanismo de la regurgitación mitral es esencial ya que el pronóstico, la terapia médica y la potencial necesidad de intervención quirúrgica
INSUFICIENCIA MITRAL CRÓNICA 1 GENERALIDADES La identificación del mecanismo de la regurgitación mitral es esencial ya que el pronóstico, la terapia médica y la potencial necesidad de intervención quirúrgica
VALVULOPATÍAS ESTENOSIS AÓRTICA
 VALVULOPATÍAS ESTENOSIS AÓRTICA ETIOPATOGENIA Congénita Casi siempre el origen es una válvula bicúspide que produce un flujo turbulento, lesiona las valvas y genera fibrosis y calcificación. Suele dar
VALVULOPATÍAS ESTENOSIS AÓRTICA ETIOPATOGENIA Congénita Casi siempre el origen es una válvula bicúspide que produce un flujo turbulento, lesiona las valvas y genera fibrosis y calcificación. Suele dar
Protocolo Asistencial: Trasplante Cardíaco
 Elaborado por: Jesús Palomo Loreto Bravo Aprobado por: Dr. Francisco Fernández-Avilés Modificaciones Fecha de presentación: 07/07/2007 Aprobación: Francisco Fernández-Avilés (jefe de Servicio) Fecha de
Elaborado por: Jesús Palomo Loreto Bravo Aprobado por: Dr. Francisco Fernández-Avilés Modificaciones Fecha de presentación: 07/07/2007 Aprobación: Francisco Fernández-Avilés (jefe de Servicio) Fecha de
CIE -10: Enfermedades del sistema circulatorio I00-I99 I060 Estenosis aórtica reumática
 CIE -10: Enfermedades del sistema circulatorio I00-I99 I060 Estenosis aórtica reumática GPC: Prevención, diagnóstico y criterios de referencia de la estenosis aórtica en el primer nivel de atención Definición
CIE -10: Enfermedades del sistema circulatorio I00-I99 I060 Estenosis aórtica reumática GPC: Prevención, diagnóstico y criterios de referencia de la estenosis aórtica en el primer nivel de atención Definición
Dr. Gustavo Pereiro ANATOMIA NORMAL APARATO VALVULAR MITRAL VALVAS CUERDAS TENDINOSAS MUSCULOS PAPILARES MIOCARDIO ADYACENTE
 2003 ANATOMIA NORMAL APARATO VALVULAR MITRAL VALVAS CUERDAS TENDINOSAS MUSCULOS PAPILARES MIOCARDIO ADYACENTE Una alteración en cualquiera de estos componentes es capaz de generar un cierre defectuoso
2003 ANATOMIA NORMAL APARATO VALVULAR MITRAL VALVAS CUERDAS TENDINOSAS MUSCULOS PAPILARES MIOCARDIO ADYACENTE Una alteración en cualquiera de estos componentes es capaz de generar un cierre defectuoso
Las definiciones básicas (ACC/AHA)
 Las definiciones básicas (ACC/AHA) Qué es la? Cuáles son sus modalidades y criterios de diagnóstico? Qué significa IC con fracción de eyección reducida o preservada? El American College of Cardiology y
Las definiciones básicas (ACC/AHA) Qué es la? Cuáles son sus modalidades y criterios de diagnóstico? Qué significa IC con fracción de eyección reducida o preservada? El American College of Cardiology y
Casos Clínicos. Válvula Aórtica Bicuspide. Dr. Pablo Marcelo Alvarenga Posadas- Misiones. IOT Sanatorio Integra
 IOT Sanatorio Integra Casos Clínicos Válvula Aórtica Bicuspide Dr. Pablo Marcelo Alvarenga Posadas- Misiones pmalvarenga@hotmail.com Introducción La VAB es la malformación cardiaca congénita mas frecuente
IOT Sanatorio Integra Casos Clínicos Válvula Aórtica Bicuspide Dr. Pablo Marcelo Alvarenga Posadas- Misiones pmalvarenga@hotmail.com Introducción La VAB es la malformación cardiaca congénita mas frecuente
Endocardiosis Mitral Fisiopatología y Diagnóstico
 AUTOR: MV Pablo Carle Endocardiosis Mitral Fisiopatología y Diagnóstico La endocardiosis mitral, es la principal causa de insuficiencia mitral crónica en el perro, su etiología que si bien es desconocida
AUTOR: MV Pablo Carle Endocardiosis Mitral Fisiopatología y Diagnóstico La endocardiosis mitral, es la principal causa de insuficiencia mitral crónica en el perro, su etiología que si bien es desconocida
Ecocardiografía y riesgo cardiovascular. Enrique Rodilla Sala Gonzalo García de Casasola Grupo de Trabajo Ecografía Clínica SEMI
 Ecocardiografía y riesgo cardiovascular Enrique Rodilla Sala Gonzalo García de Casasola Grupo de Trabajo Ecografía Clínica SEMI HTA y riesgo cardiovascular Factores de riesgo adicionales y comorbilidades
Ecocardiografía y riesgo cardiovascular Enrique Rodilla Sala Gonzalo García de Casasola Grupo de Trabajo Ecografía Clínica SEMI HTA y riesgo cardiovascular Factores de riesgo adicionales y comorbilidades
ESTENOSIS MITRAL. ECOCARDIOGRAMA Leve Moderada Severa Grad medio (mmhg) < > 10 PSAP (mmhg) < > 50 Area (cm 2 ) 1, ,5 < 1
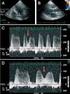 ESTES MITRAL 1 GENERALIDADES El orificio mitral normal mide 4-5 cm 2.y se precisan reducciones inferiores a 2.5 cm 2 para que provoque repercusión fisiopatológica. Hay tres grados de Estenosis : ECOCARDIOGRAMA
ESTES MITRAL 1 GENERALIDADES El orificio mitral normal mide 4-5 cm 2.y se precisan reducciones inferiores a 2.5 cm 2 para que provoque repercusión fisiopatológica. Hay tres grados de Estenosis : ECOCARDIOGRAMA
VALORACIÓN CLÍNICA DE LOS SOPLOS CARDIACOS. María Villalba Orero Cardiología Equina
 VALORACIÓN CLÍNICA DE LOS SOPLOS CARDIACOS María Villalba Orero Cardiología Equina Las enfermedades cardiacas en los caballos son relativamente poco frecuentes en relación con las patologías que sufren.
VALORACIÓN CLÍNICA DE LOS SOPLOS CARDIACOS María Villalba Orero Cardiología Equina Las enfermedades cardiacas en los caballos son relativamente poco frecuentes en relación con las patologías que sufren.
VÁLVULA MITRAL. Velocidad Gradiente Área Valvular cm2/m2. Leve < 5 mmhg < 30 ml < 30 % Moderada 5-10 mmhg ml %
 VÁLVULA MITRAL Velocidad Gradiente Área Valvular cm2/m2 Volumen Regurgitante Fracción Regurgitación Normal 0 90 m/seg (0 6-1 3) 4-6 Leve < 5 mmhg 1 6-3 9 < 30 ml < 30 % Moderada 5-10 mmhg 1 0-1 5 30-59
VÁLVULA MITRAL Velocidad Gradiente Área Valvular cm2/m2 Volumen Regurgitante Fracción Regurgitación Normal 0 90 m/seg (0 6-1 3) 4-6 Leve < 5 mmhg 1 6-3 9 < 30 ml < 30 % Moderada 5-10 mmhg 1 0-1 5 30-59
Disfunción Diastólica y Geométrica Ventricular Izquierda en Pacientes con Preeclampsia Eclampsia. Apaza Coronel, Hector Williams.
 DISCUSION Durante el embarazo normal acontecen un gran número de cambios hemodinámicos, tales como un incremento en el volumen sanguíneo, volumen de stroke y frecuencia cardíaca, asimismo una disminución
DISCUSION Durante el embarazo normal acontecen un gran número de cambios hemodinámicos, tales como un incremento en el volumen sanguíneo, volumen de stroke y frecuencia cardíaca, asimismo una disminución
Válvula aórtica bicúspide Cuando el número importa. Dr Alejandra Vaello Paños Servicio de Cardiología Hospital de Mérida
 Válvula aórtica bicúspide Cuando el número importa Dr Alejandra Vaello Paños Servicio de Cardiología Hospital de Mérida Epidemiología -Prevalencia 0.5-2%. -Predominancia masculina 3:1 -Desorden genético
Válvula aórtica bicúspide Cuando el número importa Dr Alejandra Vaello Paños Servicio de Cardiología Hospital de Mérida Epidemiología -Prevalencia 0.5-2%. -Predominancia masculina 3:1 -Desorden genético
Dr. Juan Pablo Albisu ECOCARDIOGRAFÍA CON SPECKLE TRACKING
 Dr. Juan Pablo Albisu ECOCARDIOGRAFÍA CON SPECKLE TRACKING Ecocardiografía con Speckle Tracking (STE)es una nueva técnica de imagen ultrasónica no invasiva, que permite evaluar en forma objetiva y cuantitativa
Dr. Juan Pablo Albisu ECOCARDIOGRAFÍA CON SPECKLE TRACKING Ecocardiografía con Speckle Tracking (STE)es una nueva técnica de imagen ultrasónica no invasiva, que permite evaluar en forma objetiva y cuantitativa
Estenosis valvular aórtica Jueves, 03 de Mayo de :16 - Actualizado Sábado, 03 de Diciembre de :37
 Qué es la? La estenosis valvular aórtica es aquella situación en la que se produce una anomalía de la válvula aórtica que lleva a un progresivo estrechamiento del área del orificio de apertura de la misma,
Qué es la? La estenosis valvular aórtica es aquella situación en la que se produce una anomalía de la válvula aórtica que lleva a un progresivo estrechamiento del área del orificio de apertura de la misma,
Enfermedades del Corazón Derecho Ecocardiografia
 Sociedad de Cardiologia de Rosario Curso Bianaual 2016 2017 Valvulopatías del Corazón Derecho Dr Pablo Rodenas Estenosis Pulmonar La mayor parte suele ser congénita o bien aislada o asociada como en la
Sociedad de Cardiologia de Rosario Curso Bianaual 2016 2017 Valvulopatías del Corazón Derecho Dr Pablo Rodenas Estenosis Pulmonar La mayor parte suele ser congénita o bien aislada o asociada como en la
4/10/11 VALVULOPATÍAS. Distribución enfermedad valvular
 VALVULOPATÍAS Distribución enfermedad valvular 1 Etiología enfermedad valvular Edad de diagnóstico 2 Incremento de valvulopatías con la edad Burden of valvular Heart disease Prevalencia Estudio comunitario:
VALVULOPATÍAS Distribución enfermedad valvular 1 Etiología enfermedad valvular Edad de diagnóstico 2 Incremento de valvulopatías con la edad Burden of valvular Heart disease Prevalencia Estudio comunitario:
Enfermedad Valvular. Servicio de Cardiología. Argentina.
 Enfermedad Valvular Servicio de Cardiología Dr. Félix F Hurtado Argentina Agenda Fisiología a Básica B Cardiovascular Valvulopatia Mitral Valvulopatia Aortica Valvulopatia Pulmonar Valvulopatia Tricúspidea
Enfermedad Valvular Servicio de Cardiología Dr. Félix F Hurtado Argentina Agenda Fisiología a Básica B Cardiovascular Valvulopatia Mitral Valvulopatia Aortica Valvulopatia Pulmonar Valvulopatia Tricúspidea
RESONANCIA MAGNETICA
 Curso regional de capacitación en técnicas de imagen para el diagnóstico y pronóstico de pacientes con insuficiencia cardíaca RESONANCIA MAGNETICA PAPEL EN EL MANEJO DE LA INSUFICIENCIA CARDIACA DE CAUSAS
Curso regional de capacitación en técnicas de imagen para el diagnóstico y pronóstico de pacientes con insuficiencia cardíaca RESONANCIA MAGNETICA PAPEL EN EL MANEJO DE LA INSUFICIENCIA CARDIACA DE CAUSAS
VALVULOPLASTIA AÓRTICA CON BALÓN
 VALVULOPLASTIA AÓRTICA CON BALÓN ROL EN LA ERA DEL REEMPLAZO VALVULAR PERCUTÁNEO ADOLFO G. LOPEZ CAMPANHER SERVICIO DE HEMODINAMIA Y CARDIOANGIOLOGIA INTERVENCIONISTA INSTITUTO DE CARDIOLOGIA DE CORRIENTES
VALVULOPLASTIA AÓRTICA CON BALÓN ROL EN LA ERA DEL REEMPLAZO VALVULAR PERCUTÁNEO ADOLFO G. LOPEZ CAMPANHER SERVICIO DE HEMODINAMIA Y CARDIOANGIOLOGIA INTERVENCIONISTA INSTITUTO DE CARDIOLOGIA DE CORRIENTES
Disfunción cardiaca producida por lesiones o alteraciones funcionales de una o varias válvulas, dando lugar a un flujo anómalo a su través.
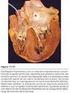 Cuidados de Enfermería en valvulopatías E.U Rosa Contreras y E. Jofré R ENFERMEDADES DE LAS VÁLVULAS DEL CORAZON Definición: Disfunción cardiaca producida por lesiones o alteraciones funcionales de una
Cuidados de Enfermería en valvulopatías E.U Rosa Contreras y E. Jofré R ENFERMEDADES DE LAS VÁLVULAS DEL CORAZON Definición: Disfunción cardiaca producida por lesiones o alteraciones funcionales de una
TÉCNICAS DE EXPLORACIÓN COMPLEMENTARIA: ECOCARDIOGRAMA, ECG DE HOLTER, ESTUDIOS ISOTÓPICOS, RNM Maite Doñate Rodríguez
 Técnicas de exploración complementaria 1 TÉCNICAS DE EXPLORACIÓN COMPLEMENTARIA: ECOCARDIOGRAMA, ECG DE HOLTER, ESTUDIOS ISOTÓPICOS, RNM Maite Doñate Rodríguez EXPLORACIONES COMPLEMENTARIAS Son necesarias
Técnicas de exploración complementaria 1 TÉCNICAS DE EXPLORACIÓN COMPLEMENTARIA: ECOCARDIOGRAMA, ECG DE HOLTER, ESTUDIOS ISOTÓPICOS, RNM Maite Doñate Rodríguez EXPLORACIONES COMPLEMENTARIAS Son necesarias
ESTENOSIS AÓRTICA. Dra. Dafne Viliani
 ESTENOSIS AÓRTICA Dra. Dafne Viliani Prevalencia y etiología. Historia clínica y exploración física. Diagnóstico ecocardiográfico y problemas asociados. Pronostico Tratamiento. Manejo de la Eao severa
ESTENOSIS AÓRTICA Dra. Dafne Viliani Prevalencia y etiología. Historia clínica y exploración física. Diagnóstico ecocardiográfico y problemas asociados. Pronostico Tratamiento. Manejo de la Eao severa
TRATAMIENTO PERCUTÁNEO DE LA ESTENOSIS AÓRTICA SEVERA
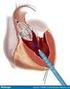 TRATAMIENTO PERCUTÁNEO DE LA ESTENOSIS AÓRTICA SEVERA Este concepto consiste en implantar una prótesis sobre la válvula nativa, técnica que se realiza de forma percutánea a través de la arteria. El tratamiento
TRATAMIENTO PERCUTÁNEO DE LA ESTENOSIS AÓRTICA SEVERA Este concepto consiste en implantar una prótesis sobre la válvula nativa, técnica que se realiza de forma percutánea a través de la arteria. El tratamiento
Qué vemos en una ecocardiografía?
 Qué vemos en una ecocardiografía? Pedro P. Esteve Beatriz Aguilar www.cardiosonic.es comunicacón comunicaci n Utilidades de la ecocardiografía Estructuras cardiacas Miocardio Estruct. Valvulares Estruct.
Qué vemos en una ecocardiografía? Pedro P. Esteve Beatriz Aguilar www.cardiosonic.es comunicacón comunicaci n Utilidades de la ecocardiografía Estructuras cardiacas Miocardio Estruct. Valvulares Estruct.
Válvula Aórtica Normal
 MODULO VALVULOPATÍAS ESTENOSIS VALVULAR AORTICA Dr. Válvula Aórtica Normal Paredes Finas Área 3-4 cm 2 Apertura > 15 mm y de forma triangular en el eje corto La apertura se mantiene durante toda la sístole
MODULO VALVULOPATÍAS ESTENOSIS VALVULAR AORTICA Dr. Válvula Aórtica Normal Paredes Finas Área 3-4 cm 2 Apertura > 15 mm y de forma triangular en el eje corto La apertura se mantiene durante toda la sístole
Estudios complementarios cardiovasculares. Tomás Schwaller
 Estudios complementarios cardiovasculares Tomás Schwaller Ecocardiografía Ecocardiografía bidimensional Se basa en la reflexión de los ultrasonidos sobre las estructuras cardíacas Usos clínicos Cavidades
Estudios complementarios cardiovasculares Tomás Schwaller Ecocardiografía Ecocardiografía bidimensional Se basa en la reflexión de los ultrasonidos sobre las estructuras cardíacas Usos clínicos Cavidades
16/11/11 ENFERMEDADES DEL MIOCARDIO, ASOCIADAS A DISFUNCIÓN CARDÍACA.
 ENFERMEDADES DEL MIOCARDIO, ASOCIADAS A DISFUNCIÓN CARDÍACA. 1 MIOCARDIOPATIAS CLASIFICACION (WHO/ISFC) DILATADA HIPERTROFICA RESTRICTIVA ARRITMOGENICA DEL Ventrículo Derecho NO CLASIFICADA 2 FRECUENTES
ENFERMEDADES DEL MIOCARDIO, ASOCIADAS A DISFUNCIÓN CARDÍACA. 1 MIOCARDIOPATIAS CLASIFICACION (WHO/ISFC) DILATADA HIPERTROFICA RESTRICTIVA ARRITMOGENICA DEL Ventrículo Derecho NO CLASIFICADA 2 FRECUENTES
CASO CLÍNICO: Insuficiencia cardíaca en una paciente portadora de prótesis mitral por enfermedad reumática previa
 CASO CLÍNICO: Insuficiencia cardíaca en una paciente portadora de prótesis mitral por enfermedad reumática previa Paciente de 53 años, de sexo femenino que acude a urgencias en Noviembre 2012. Procedente
CASO CLÍNICO: Insuficiencia cardíaca en una paciente portadora de prótesis mitral por enfermedad reumática previa Paciente de 53 años, de sexo femenino que acude a urgencias en Noviembre 2012. Procedente
SOPLO CARDIACO FACTORES QUE PRODUCEN UN FLUJO TURBULENTO
 Mismo sueño, mismo conocimiento SOPLO CARDIACO En condiciones normales el flujo sanguíneo tiene un solo frente de ondas que se dirige de sentido anterógrado, que se denomina FLUJO LAMINAR y es silencioso.
Mismo sueño, mismo conocimiento SOPLO CARDIACO En condiciones normales el flujo sanguíneo tiene un solo frente de ondas que se dirige de sentido anterógrado, que se denomina FLUJO LAMINAR y es silencioso.
INSUFICIENCIA CARDIACA EN EL ANCIANO. ACTUALIZACIÓN EN EL DIAGNÓSTICO: Papel De La Ecocardiografía
 INSUFICIENCIA CARDIACA EN EL ANCIANO ACTUALIZACIÓN EN EL DIAGNÓSTICO: Papel De La Ecocardiografía Mª Victoria Mogollón Jiménez Complejo Hospitalario de Cáceres Introducción La prevalencia de la IC se
INSUFICIENCIA CARDIACA EN EL ANCIANO ACTUALIZACIÓN EN EL DIAGNÓSTICO: Papel De La Ecocardiografía Mª Victoria Mogollón Jiménez Complejo Hospitalario de Cáceres Introducción La prevalencia de la IC se
CURSO DE ACTUALIZACION EN CARDIOLOGÍA PRÁCTICA VALVULOPATIAS. Javier López Díaz. Hospital Clínico de Valladolid.
 CURSO DE ACTUALIZACION EN CARDIOLOGÍA PRÁCTICA VALVULOPATIAS Javier López Díaz insuficienciacardiaca.hcuv@yahoo.es Hospital Clínico de Valladolid Caso clínico Varón de 57 años Padre intervenido de corazón
CURSO DE ACTUALIZACION EN CARDIOLOGÍA PRÁCTICA VALVULOPATIAS Javier López Díaz insuficienciacardiaca.hcuv@yahoo.es Hospital Clínico de Valladolid Caso clínico Varón de 57 años Padre intervenido de corazón
Miocardiopatía restrictiva Lunes, 29 de Octubre de :20 - Actualizado Miércoles, 24 de Febrero de :42
 Qué es la miocardiopatía restrictiva? La miocardiopatía restrictiva es una cardiopatía primaria que produce signos clínicos de fallo cardíaco en presencia de un ventrículo izquierdo no dilatado ni hipertrófico,
Qué es la miocardiopatía restrictiva? La miocardiopatía restrictiva es una cardiopatía primaria que produce signos clínicos de fallo cardíaco en presencia de un ventrículo izquierdo no dilatado ni hipertrófico,
ESTENOSIS AÓRTICA LO QUE HAY QUE SABER. DAVID VIVAS, MD, PhD
 ESTENOSIS AÓRTICA LO QUE HAY QUE SABER DAVID VIVAS, MD, PhD PREGUNTAS 1. Es muy frecuente? 2. Es una enfermedad de viejos? 3. Cuándo la sospecho? 4. Cómo es la confirmación diagnóstica? 5. Qué tratamientos
ESTENOSIS AÓRTICA LO QUE HAY QUE SABER DAVID VIVAS, MD, PhD PREGUNTAS 1. Es muy frecuente? 2. Es una enfermedad de viejos? 3. Cuándo la sospecho? 4. Cómo es la confirmación diagnóstica? 5. Qué tratamientos
GUÍA DE PRÁCTICA CLÍNICA. Ecocardiografía en la Práctica Clínica. Dra. Laura Flor
 Cli-136 Dra. Laura Flor Año 2013 - Revisión: 0 Página 1 de 13 Introducción La ecocardiografía se ha convertido en la actualidad en la técnica de elección para el diagnostico y seguimiento de la mayoría
Cli-136 Dra. Laura Flor Año 2013 - Revisión: 0 Página 1 de 13 Introducción La ecocardiografía se ha convertido en la actualidad en la técnica de elección para el diagnostico y seguimiento de la mayoría
Ductus arterioso persistente Sábado, 23 de Febrero de :17 - Actualizado Sábado, 19 de Marzo de :58
 Qué es el arterioso persistente? El arterioso es un corto segmento arterial del feto que conecta el origen de la arteria pulmonar principal con la aorta por debajo de la arteria subclavia izquierda. Habitualmente,
Qué es el arterioso persistente? El arterioso es un corto segmento arterial del feto que conecta el origen de la arteria pulmonar principal con la aorta por debajo de la arteria subclavia izquierda. Habitualmente,
Modulo de Cardiología 2010 MIOCARDIOPATÍA HIPERTRÓFICA
 Modulo de Cardiología 2010 MIOCARDIOPATÍA HIPERTRÓFICA Miocardiopatia Hipertrofica La miocardiopatia hipertrofica es la mas comun de las enfermedades Geneticas Cardiovasculares, Es causada por una multitud
Modulo de Cardiología 2010 MIOCARDIOPATÍA HIPERTRÓFICA Miocardiopatia Hipertrofica La miocardiopatia hipertrofica es la mas comun de las enfermedades Geneticas Cardiovasculares, Es causada por una multitud
Enfrentamiento racional del paciente con Estenosis Aórtica Severa y Disfunción Ventricular Izquierda
 Enfrentamiento racional del paciente con Estenosis Aórtica Severa y Disfunción Ventricular Izquierda Dr. Hugo Londero Sanatorio Allende Córdoba -Argentina Diferentes Patrones de Estenosis Aórtica FE Normal
Enfrentamiento racional del paciente con Estenosis Aórtica Severa y Disfunción Ventricular Izquierda Dr. Hugo Londero Sanatorio Allende Córdoba -Argentina Diferentes Patrones de Estenosis Aórtica FE Normal
CRITERIOS DE USO APROPIADO EN ECOCARDIOGRAFÍA TRANSTORÁCICA. Dra. Ana Testa Fernández
 CRITERIOS DE USO EN ECOCARDIOGRAFÍA TRANSTORÁCICA Dra. Ana Testa Fernández Se conderan 5 escenarios para el poble uso de la ecocardiografía: 1.Para el diagnóstico inicial 2.Para guiar el tratamiento o
CRITERIOS DE USO EN ECOCARDIOGRAFÍA TRANSTORÁCICA Dra. Ana Testa Fernández Se conderan 5 escenarios para el poble uso de la ecocardiografía: 1.Para el diagnóstico inicial 2.Para guiar el tratamiento o
TEMA 19. CICLO CARDÍACO
 TEMA 19. CICLO CARDÍACO En el apartado 16.1.5 vimos globalmente las fases del ciclo cardíaco, y en el apartado anterior el electrocardiograma. En este apartado veremos algunos aspectos del ciclo cardiaco
TEMA 19. CICLO CARDÍACO En el apartado 16.1.5 vimos globalmente las fases del ciclo cardíaco, y en el apartado anterior el electrocardiograma. En este apartado veremos algunos aspectos del ciclo cardiaco
FALLO CARDIACO CONGESTICO EN UN CABALLO CON INSUFICIENCIA MITRAL SEVERAY FIBRILACIÓN AURICULARR CON CONDUCCIÓN ABERRANTE
 13º Congresoo Internacional de Medicina y Cirugía Equina FALLO CARDIACO CONGESTICO EN UN CABALLO CON INSUFICIENCIA MITRAL SEVERAY FIBRILACIÓN AURICULARR CON CONDUCCIÓN ABERRANTE CASO CLÍNICO María Villalba
13º Congresoo Internacional de Medicina y Cirugía Equina FALLO CARDIACO CONGESTICO EN UN CABALLO CON INSUFICIENCIA MITRAL SEVERAY FIBRILACIÓN AURICULARR CON CONDUCCIÓN ABERRANTE CASO CLÍNICO María Villalba
Indicaciones principales y utilidad de la Imagencardiaca y vascular por Resonancia Magnética
 Indicaciones principales y utilidad de la Imagencardiaca y vascular por Resonancia Magnética Dra. Mónica Alcántara Razo Médico Radiólogo Instituto Nacional de Cardiología Ignacio Chávez Corazón morfológico
Indicaciones principales y utilidad de la Imagencardiaca y vascular por Resonancia Magnética Dra. Mónica Alcántara Razo Médico Radiólogo Instituto Nacional de Cardiología Ignacio Chávez Corazón morfológico
ANOMALÍA DE EBSTEIN insuficiencia tricuspídea Dr. Ignacio Lugones
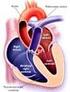 ANOMALÍA DE EBSTEIN Definición: La anomalía de Ebstein es una cardiopatía congénita infrecuente caracterizada por la implantación anormalmente baja de las valvas septal y posterior de la válvula tricúspide.
ANOMALÍA DE EBSTEIN Definición: La anomalía de Ebstein es una cardiopatía congénita infrecuente caracterizada por la implantación anormalmente baja de las valvas septal y posterior de la válvula tricúspide.
Antonio Salvador Servicio de Cardiología, Hospital UniversitarioLa Fe, Valencia
 Valvulopatías: Ecocardiografía- Doppler y selección del momento quirúrgico Antonio Salvador Servicio de Cardiología, Hospital UniversitarioLa Fe, Valencia Doppler Contínuo en la Estenosis Aórtica. Ecuación
Valvulopatías: Ecocardiografía- Doppler y selección del momento quirúrgico Antonio Salvador Servicio de Cardiología, Hospital UniversitarioLa Fe, Valencia Doppler Contínuo en la Estenosis Aórtica. Ecuación
CASO CLÍNICO EN VALVULOPATÍA
 REHABILITACIÓN CARDIACA, PRÁCTICA CLÍNICA EN FASE II: TRASPLANTE, VALVULOPATÍAS E HIPERTENSIÓN PULMONAR. Ángel Montiel Trujillo Adela Gómez González Unidad de Rehabilitación Cardiaca Hospital Virgen de
REHABILITACIÓN CARDIACA, PRÁCTICA CLÍNICA EN FASE II: TRASPLANTE, VALVULOPATÍAS E HIPERTENSIÓN PULMONAR. Ángel Montiel Trujillo Adela Gómez González Unidad de Rehabilitación Cardiaca Hospital Virgen de
ECOCARDIOGRAFIA BIDIMENSIONAL - FORMULAS - INTERPRETACION
 ECOCARDIOGRAFIA BIDIMENSIONAL - FORMULAS - INTERPRETACION CAMBIOS BIDIMENSIONALES DURANTE LA SISTOLE A) Contraccion radial B) Contraccion longitudinal C) Torsion Apex-base FA% Fracción de Acortamiento
ECOCARDIOGRAFIA BIDIMENSIONAL - FORMULAS - INTERPRETACION CAMBIOS BIDIMENSIONALES DURANTE LA SISTOLE A) Contraccion radial B) Contraccion longitudinal C) Torsion Apex-base FA% Fracción de Acortamiento
ECG CURSO DE ELECTROCARDIOGRAFÍA CARDIOLOGÍA
 ECG CURSO DE ELECTROCARDIOGRAFÍA CLÍNICA CARDIOLOGÍA C. H. LA MANCHA - CENTRO 08-06-2010 DR. PAZOS CRECIMIENTO DE CAVIDADES Aurícula derecha Aurícula izquierda Biauricular Ventrículo derecho Ventrículo
ECG CURSO DE ELECTROCARDIOGRAFÍA CLÍNICA CARDIOLOGÍA C. H. LA MANCHA - CENTRO 08-06-2010 DR. PAZOS CRECIMIENTO DE CAVIDADES Aurícula derecha Aurícula izquierda Biauricular Ventrículo derecho Ventrículo
Caso Clínico. Datos Personales Paciente.-M.C. Edad.-63 años. Sexo.- Femenino. Peso.-75 kg. Talla: 1,68 m. IMC: 26 Kg/m2
 Año2010 Servicio de Cardiología Hospital Bernardino Rivadavia Caso Clínico Datos Personales Paciente.-M.C. Edad.-63 años. Sexo.- Femenino. Peso.-75 kg. Talla: 1,68 m. IMC: 26 Kg/m2 Factores de Riesgo CV
Año2010 Servicio de Cardiología Hospital Bernardino Rivadavia Caso Clínico Datos Personales Paciente.-M.C. Edad.-63 años. Sexo.- Femenino. Peso.-75 kg. Talla: 1,68 m. IMC: 26 Kg/m2 Factores de Riesgo CV
Válvula aórtica. Patología, procedimientos quirúrgicos y complicaciones.
 Válvula aórtica. Patología, procedimientos quirúrgicos y complicaciones. Poster no.: S-1532 Congreso: SERAM 2012 Tipo del póster: Presentación Electrónica Educativa Autores: B. NIETO BALTAR, C. Saborido
Válvula aórtica. Patología, procedimientos quirúrgicos y complicaciones. Poster no.: S-1532 Congreso: SERAM 2012 Tipo del póster: Presentación Electrónica Educativa Autores: B. NIETO BALTAR, C. Saborido
Indicaciones. Apropiadas Inciertas Inapropiadas
 XLVI Curso Anual de Radiología e Imagen 2012 Sociedad Mexicana de Radiología Indicaciones de la angiotomografía cardiovascular: lo que el radiólogo debe saber Gabriela Meléndez Ramírez Instituto Nacional
XLVI Curso Anual de Radiología e Imagen 2012 Sociedad Mexicana de Radiología Indicaciones de la angiotomografía cardiovascular: lo que el radiólogo debe saber Gabriela Meléndez Ramírez Instituto Nacional
Servicio de Cardiología Unidad Coronaria
 Procedimientos Hoja 1 de 7 Terapiaa de Re sincronización Cardiaca La insuficiencia cardiaca tiene un impacto considerable sobre los costos de salud; se calcula que aproximadamente 2/3 de los gastos destinados
Procedimientos Hoja 1 de 7 Terapiaa de Re sincronización Cardiaca La insuficiencia cardiaca tiene un impacto considerable sobre los costos de salud; se calcula que aproximadamente 2/3 de los gastos destinados
MICA NO INVASIVA POR ECOCARDIOGRAFÍA
 EVALUACIÓN HEMODINÁMICA MICA NO INVASIVA POR ECOCARDIOGRAFÍA Carlos Palanco Vázquez Médico residente de Cardiología Hospital Infanta Cristina Servicio de Cardiología 31 de Marzo de 2006 INDICE 1. Concepto
EVALUACIÓN HEMODINÁMICA MICA NO INVASIVA POR ECOCARDIOGRAFÍA Carlos Palanco Vázquez Médico residente de Cardiología Hospital Infanta Cristina Servicio de Cardiología 31 de Marzo de 2006 INDICE 1. Concepto
COMUNICACIÓN INTERVENTRICULAR (CIV)
 COMUNICACIÓN INTERVENTRICULAR (CIV) Dra. G-Cuenllas Álvarez Pediatría, Unidad de Cardiología infantil Hospital Clínico Universitario de Salamanca Octubre 2014 DEFINICIÓN Orificio en el tabique interventricular
COMUNICACIÓN INTERVENTRICULAR (CIV) Dra. G-Cuenllas Álvarez Pediatría, Unidad de Cardiología infantil Hospital Clínico Universitario de Salamanca Octubre 2014 DEFINICIÓN Orificio en el tabique interventricular
Clasificaciones en la falla cardíaca
 Clasificaciones en la falla cardíaca Dr. Mario Speranza Falla cardíaca vs. Insuficiencia cardíaca congestiva Debido a que no todos los pacientes tienen sobrecarga de volumen al momento del diagnóstico
Clasificaciones en la falla cardíaca Dr. Mario Speranza Falla cardíaca vs. Insuficiencia cardíaca congestiva Debido a que no todos los pacientes tienen sobrecarga de volumen al momento del diagnóstico
CASO MEDICO Transposición Corregida de Grandes Vasos TCGV
 CASO MEDICO Transposición Corregida de Grandes Vasos TCGV Realizado por: Luisa Fernanda Gómez Especialista en Medicina Fetal Juan Carlos Restrepo Director Medico- Especialista en Fetologia Juan Felipe
CASO MEDICO Transposición Corregida de Grandes Vasos TCGV Realizado por: Luisa Fernanda Gómez Especialista en Medicina Fetal Juan Carlos Restrepo Director Medico- Especialista en Fetologia Juan Felipe
Insuficiencia cardiaca Martes, 03 de Diciembre de :31 - Actualizado Miércoles, 28 de Diciembre de :12
 Qué es la insuficiencia cardiaca? La insuficiencia cardíaca se define como un síndrome clínico (conjunto de síntomas y signos) que es consecuencia de la incapacidad del corazón para bombear la sangre en
Qué es la insuficiencia cardiaca? La insuficiencia cardíaca se define como un síndrome clínico (conjunto de síntomas y signos) que es consecuencia de la incapacidad del corazón para bombear la sangre en
Módulo I de valvulopatias. Presentación de casos clínicos
 Módulo I de valvulopatias Presentación de casos clínicos Dr. Diego Hernán Toledo Ecocardiografìa Cardiologìa clìnica Centro Integral de Cardiologìa Sanatorio Integral IOT Sanatorio Posadas Caso nº 1: A.V.D.
Módulo I de valvulopatias Presentación de casos clínicos Dr. Diego Hernán Toledo Ecocardiografìa Cardiologìa clìnica Centro Integral de Cardiologìa Sanatorio Integral IOT Sanatorio Posadas Caso nº 1: A.V.D.
INSUFICIENCIA AÓRTICA (IA)
 Sección Cardiología Capítulo 12 -VALVULOPATÍAS Carmen Ros Tristán, Fernando Rodero Álvarez, Ramón Fernández Madruga Las valvulopatías son una patología frecuente y a menudo requieren tratamiento quirúrgico.
Sección Cardiología Capítulo 12 -VALVULOPATÍAS Carmen Ros Tristán, Fernando Rodero Álvarez, Ramón Fernández Madruga Las valvulopatías son una patología frecuente y a menudo requieren tratamiento quirúrgico.
Cardiopatias en el embarazo
 Cardiopatias en el embarazo Dra. Jessica e. Moreira l. 24-10-14. Rev Esp Cardiol. 2012;65(2):171.e1-e44 Adaptaciones cardilogicas en el embarazo 1. Aumento del gasto cardiaco. 2. Aumentos del volumen de
Cardiopatias en el embarazo Dra. Jessica e. Moreira l. 24-10-14. Rev Esp Cardiol. 2012;65(2):171.e1-e44 Adaptaciones cardilogicas en el embarazo 1. Aumento del gasto cardiaco. 2. Aumentos del volumen de
Estenosis mitral. Martes, 21 de Agosto de :20 - Actualizado Sábado, 24 de Diciembre de :26
 Qué es la? La es la situación en la que se produce un estrechamiento del orificio de apertura de la válvula mitral, lo que dificulta el flujo diastólico que pasa desde la aurícula izquierda al ventrículo
Qué es la? La es la situación en la que se produce un estrechamiento del orificio de apertura de la válvula mitral, lo que dificulta el flujo diastólico que pasa desde la aurícula izquierda al ventrículo
Cintya Borroni G. MV Msc
 Sistema cardiovascular Cintya Borroni G. MV Msc cintyab@gmail.com CICLO CARDIACO Eventos que ocurren desde el inicio de un latido hasta el inicio de otro. Consta de un periodo de contracción : Sístole
Sistema cardiovascular Cintya Borroni G. MV Msc cintyab@gmail.com CICLO CARDIACO Eventos que ocurren desde el inicio de un latido hasta el inicio de otro. Consta de un periodo de contracción : Sístole
Ecocardiografía y Doppler Cardíaco
 Capítulo2 Ecocardiografía y Doppler Cardíaco Dr. Héctor Bueno Zamora Servicio de Cardiología. Hospital General Universitario Gregorio Marañón 1. INTRODUCCIÓN El estudio mediante la ecocardiografía - Doppler
Capítulo2 Ecocardiografía y Doppler Cardíaco Dr. Héctor Bueno Zamora Servicio de Cardiología. Hospital General Universitario Gregorio Marañón 1. INTRODUCCIÓN El estudio mediante la ecocardiografía - Doppler
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO
 ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
ANEXO III MODIFICACIONES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Y DEL PROSPECTO 42 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTENGAN CABERGOLINA 4.2 Posología y forma
Valvulopatías aórticas
 38 REVISTA ARGENTINA DE CARDIOLOGÍA / VOL 71 SUPLEMENTO 2 / JULIO-AGOSTO 2003 Valvulopatías aórticas El envejecimiento progresivo de la población plantea grandes desafíos sanitarios, sociales y económicos.
38 REVISTA ARGENTINA DE CARDIOLOGÍA / VOL 71 SUPLEMENTO 2 / JULIO-AGOSTO 2003 Valvulopatías aórticas El envejecimiento progresivo de la población plantea grandes desafíos sanitarios, sociales y económicos.
POR QUÉ HACEMOS SPECT CARDIACO?
 Usted está aquí POR QUÉ HACEMOS SPECT CARDIACO? SVMN DEBATES 30-Noviembre-2012 Cristina Ruiz Llorca Facultativo Especialista Medicina Nuclear Hospital Universitario y Politécnico La Fe 2 UN POCO DE HISTORIA
Usted está aquí POR QUÉ HACEMOS SPECT CARDIACO? SVMN DEBATES 30-Noviembre-2012 Cristina Ruiz Llorca Facultativo Especialista Medicina Nuclear Hospital Universitario y Politécnico La Fe 2 UN POCO DE HISTORIA
Caso Clínico. Datos Personales Paciente.-Fem. Edad.-83 años. Sexo.- Femenino. Peso.-75 kg. Factores de Riesgo CV HTA
 Año2010 Servicio de Cardiología Hospital Bernardino Rivadavia Caso Clínico Datos Personales Paciente.-Fem. Edad.-83 años. Sexo.- Femenino. Peso.-75 kg. Factores de Riesgo CV HTA Antecedentes Cardiovasculares
Año2010 Servicio de Cardiología Hospital Bernardino Rivadavia Caso Clínico Datos Personales Paciente.-Fem. Edad.-83 años. Sexo.- Femenino. Peso.-75 kg. Factores de Riesgo CV HTA Antecedentes Cardiovasculares
I. Relacione letras con números:
 Guía de Estudio de Fisiopatología Cardiovascular: Hipertensión Pulmonar (Sept 2011) Alumnos Mario Zanolli, Tamara Ventura, Valentina de Petris, Dr. Jorge Jalil I. Relacione letras con números: 1) Hipertensión
Guía de Estudio de Fisiopatología Cardiovascular: Hipertensión Pulmonar (Sept 2011) Alumnos Mario Zanolli, Tamara Ventura, Valentina de Petris, Dr. Jorge Jalil I. Relacione letras con números: 1) Hipertensión
CAE Vimedix Simulador para ecografía. Dominando la valoración ecográfica de las cavidades torácica, abdominal y pélvica
 CAE Vimedix Simulador para ecografía Dominando la valoración ecográfica de las cavidades torácica, abdominal y pélvica Integra animación en 3D en tiempo real que enriquece espectacularmente el aprendizaje
CAE Vimedix Simulador para ecografía Dominando la valoración ecográfica de las cavidades torácica, abdominal y pélvica Integra animación en 3D en tiempo real que enriquece espectacularmente el aprendizaje
SÍNDROME DE LA CIMITARRA
 SÍNDROME DE LA CIMITARRA Definición: El síndrome de la cimitarra es una malformación congénita compleja e infrecuente de las estructuras vasculares (arterias y venas), bronquiales y del tejido propio del
SÍNDROME DE LA CIMITARRA Definición: El síndrome de la cimitarra es una malformación congénita compleja e infrecuente de las estructuras vasculares (arterias y venas), bronquiales y del tejido propio del
Unidad I: Función Ventricular. Dr. Ricardo Curcó
 Unidad I: Función Ventricular Dr. Ricardo Curcó Fisiología de los Ventrículos Cardíacos Conceptos Clave Precarga ventricular: corresponde al volumen telediastólico o bien longitud de las fibras. Postcarga
Unidad I: Función Ventricular Dr. Ricardo Curcó Fisiología de los Ventrículos Cardíacos Conceptos Clave Precarga ventricular: corresponde al volumen telediastólico o bien longitud de las fibras. Postcarga
Pulso arterial: Pulso normal: - A.1) Amplitud: menor o mayor. - A.2) Forma de la onda: Pamela Escobar Patricia Lozano Kimberly Pallauta Paz Palma
 Pulso arterial: - A.1) Amplitud: menor o mayor expansión de la pared arterial (mayor o menos volumen de expulsión del VI). Pulso amplio o Magnus: Volumen expulsivo aumentado. EJ: en bloqueo cardíaco completo.
Pulso arterial: - A.1) Amplitud: menor o mayor expansión de la pared arterial (mayor o menos volumen de expulsión del VI). Pulso amplio o Magnus: Volumen expulsivo aumentado. EJ: en bloqueo cardíaco completo.
ECO DOPPLER ARTERIAL MIEMBROS INFERIORES
 ECO DOPPLER ARTERIAL MIEMBROS INFERIORES SOCIEDAD DE CARDIOLOGIA DE ROSARIO 15 DE SETIEMBRE 2017 ROBERTO CUARANTA CENTRO DE ECO DOPPLER PARANA ARTERIAS DE MIEMBROS INFERIORES FEMORAL COMÚN FEMORAL SUPERFICIAL
ECO DOPPLER ARTERIAL MIEMBROS INFERIORES SOCIEDAD DE CARDIOLOGIA DE ROSARIO 15 DE SETIEMBRE 2017 ROBERTO CUARANTA CENTRO DE ECO DOPPLER PARANA ARTERIAS DE MIEMBROS INFERIORES FEMORAL COMÚN FEMORAL SUPERFICIAL
1. El pericardio limita la dilatación brusca de las cavidades cardíacas que pudiera resultar de hipervolemia o de sobrecargas agudas
 Guía de Estudio de Fisiopatología Cardiovascular: Fisiopatología del pericardio (Sept 2011). Alumnos Mario Zanolli, Tamara Ventura, Valentina de Petris, Dr Jorge Jalil I. Defina: 1) Tamponamiento cardíaco
Guía de Estudio de Fisiopatología Cardiovascular: Fisiopatología del pericardio (Sept 2011). Alumnos Mario Zanolli, Tamara Ventura, Valentina de Petris, Dr Jorge Jalil I. Defina: 1) Tamponamiento cardíaco
Fig. 1. La ecocardiografía 3D estuvo basada originalmente en la reconstrucción de una secuencia de adquisición multiplanar,
 IMPACTO DE LA ECOCARDIOGRAFÍA 3D / Karima Addetia y cols. 1 Fig. 1. La ecocardiografía 3D estuvo basada originalmente en la reconstrucción de una secuencia de adquisición multiplanar, gatillada por electrocardiografía
IMPACTO DE LA ECOCARDIOGRAFÍA 3D / Karima Addetia y cols. 1 Fig. 1. La ecocardiografía 3D estuvo basada originalmente en la reconstrucción de una secuencia de adquisición multiplanar, gatillada por electrocardiografía
Clasificación y Definición Actual de las Miocardiopatías. Módulo Miocardiopatías SCOB 2003 Dr. A. J. Pasca
 Clasificación y Definición Actual de las Miocardiopatías Módulo Miocardiopatías SCOB 2003 Dr. A. J. Pasca Enfermedad de las proteínas contráctiles del sarcómero Thierfelder, Cell 1994 INCIDENCIA 0.2%
Clasificación y Definición Actual de las Miocardiopatías Módulo Miocardiopatías SCOB 2003 Dr. A. J. Pasca Enfermedad de las proteínas contráctiles del sarcómero Thierfelder, Cell 1994 INCIDENCIA 0.2%
PAPEL DEL ECOCARDIOGRAMA DE ESTRÉS EN LA EVALUACIÓN DE VALVULOPATÍAS
 PAPEL DEL ECOCARDIOGRAMA DE ESTRÉS EN LA EVALUACIÓN DE VALVULOPATÍAS DR. EDUARDO FRANCO DÍEZ 11 Julio 2011 INTRODUCCIÓN. POR QUÉ HACER ECO DE ESTRÉS: Dificultad de evaluar la gravedad de las valvulopatías
PAPEL DEL ECOCARDIOGRAMA DE ESTRÉS EN LA EVALUACIÓN DE VALVULOPATÍAS DR. EDUARDO FRANCO DÍEZ 11 Julio 2011 INTRODUCCIÓN. POR QUÉ HACER ECO DE ESTRÉS: Dificultad de evaluar la gravedad de las valvulopatías
Piskorz D. Capítulo78 El ecocardiograma doppler en la evaluacion de la funciondiastolicaylarespuesta terapeutica En Gómez Llambí H, Piskorz D.
 Piskorz D. Capítulo78 El ecocardiograma doppler en la evaluacion de la funciondiastolicaylarespuesta terapeutica En Gómez Llambí H, Piskorz D. Hipertensión Arterial, epidemiología, fisiología, fisiopatogenia,
Piskorz D. Capítulo78 El ecocardiograma doppler en la evaluacion de la funciondiastolicaylarespuesta terapeutica En Gómez Llambí H, Piskorz D. Hipertensión Arterial, epidemiología, fisiología, fisiopatogenia,
TEMA 8 FISIOLOGÍA CARDIOVASCULAR EL CIRCUITO DE LA CIRCULACIÓN SANGUÍNEA. HEMODINÁMICA
 TEMA 8 FISIOLOGÍA CARDIOVASCULAR EL CIRCUITO DE LA CIRCULACIÓN SANGUÍNEA. HEMODINÁMICA 2016/2017 SISTEMA CARDIOVASCULAR Funciones: Transporte - O 2 /CO 2 - Nutrientes - Deshechos metabólicos Regulación
TEMA 8 FISIOLOGÍA CARDIOVASCULAR EL CIRCUITO DE LA CIRCULACIÓN SANGUÍNEA. HEMODINÁMICA 2016/2017 SISTEMA CARDIOVASCULAR Funciones: Transporte - O 2 /CO 2 - Nutrientes - Deshechos metabólicos Regulación
VALVULOPATIA MITRAL DEFINICION
 VALVULOPATIA MITRAL DEFINICION Es la afectación de la válvula Mitral, pudiéndose presentar como : - Estenosis Mitral - Insuficiencia Mitral - Doble lesión Mitral RECUERDO ANATOMICO - FISIOLOGICO La válvula
VALVULOPATIA MITRAL DEFINICION Es la afectación de la válvula Mitral, pudiéndose presentar como : - Estenosis Mitral - Insuficiencia Mitral - Doble lesión Mitral RECUERDO ANATOMICO - FISIOLOGICO La válvula
REMPLAZO VALVULAR AORTICO PERCUTANEO
 REMPLAZO VALVULAR AORTICO PERCUTANEO Lic. Alejandro D Aiello Hospital Naval P. Mallo Hospital Universitario CEMIC Definición de estenosis aortica Es una obstrucción al flujo sanguíneo desde el ventrículo
REMPLAZO VALVULAR AORTICO PERCUTANEO Lic. Alejandro D Aiello Hospital Naval P. Mallo Hospital Universitario CEMIC Definición de estenosis aortica Es una obstrucción al flujo sanguíneo desde el ventrículo
De qué sistemas se dispone para evaluar el riesgo vascular? A qué población y con qué frecuencia se le debe evaluar el riesgo vascular?
 4. Riesgo vascular Preguntas para responder: De qué sistemas se dispone para evaluar el riesgo vascular? A qué población y con qué frecuencia se le debe evaluar el riesgo vascular? 4.1. Importancia del
4. Riesgo vascular Preguntas para responder: De qué sistemas se dispone para evaluar el riesgo vascular? A qué población y con qué frecuencia se le debe evaluar el riesgo vascular? 4.1. Importancia del
En qué momento se desestabilizan las principales cardiopatías congénitas?: Crónica de una insuficiencia cardíaca anunciada.
 En qué momento se desestabilizan las principales cardiopatías congénitas?: Crónica de una insuficiencia cardíaca anunciada. Ismael Martín de Lara Cardiología Pediátrica Respecto a esta conferencia En qué
En qué momento se desestabilizan las principales cardiopatías congénitas?: Crónica de una insuficiencia cardíaca anunciada. Ismael Martín de Lara Cardiología Pediátrica Respecto a esta conferencia En qué
Revisión Bibliográfica
 MIOCARDITIS EN LA PRACTICA CLINICA Revisión Bibliográfica Dr. Agustín Cordero Unidad Cardiovascular Sanatorio Allende Introducción Enfermedad inflamatoria del miocardio Heterogénea (Presentación clínica
MIOCARDITIS EN LA PRACTICA CLINICA Revisión Bibliográfica Dr. Agustín Cordero Unidad Cardiovascular Sanatorio Allende Introducción Enfermedad inflamatoria del miocardio Heterogénea (Presentación clínica
Criterios Electrocardiográficos de Crecimiento de Cámaras Cardiacas
 Criterios Electrocardiográficos de Crecimiento de Cámaras Cardiacas Congreso Médico Nacional Dr. David Villegas Agüero Cardiología/Medicina Interna Activación de las Aurículas Onda P Registro de la activación
Criterios Electrocardiográficos de Crecimiento de Cámaras Cardiacas Congreso Médico Nacional Dr. David Villegas Agüero Cardiología/Medicina Interna Activación de las Aurículas Onda P Registro de la activación
Lucas Ramírez Gil, MD Cirujano Cardiovascular Clínica Cardiovascular y Corporación Cordial Profesor de Cirugía U de A y UPB
 Indicaciones de Cirugía Cardíaca Lucas Ramírez Gil, MD Cirujano Cardiovascular Clínica Cardiovascular y Corporación Cordial Profesor de Cirugía U de A y UPB Septiembre 16 de 2011 Historia Alexis Carrel
Indicaciones de Cirugía Cardíaca Lucas Ramírez Gil, MD Cirujano Cardiovascular Clínica Cardiovascular y Corporación Cordial Profesor de Cirugía U de A y UPB Septiembre 16 de 2011 Historia Alexis Carrel
Ecocardiografía en el paciente crítico. Dra. Mª Teresa Gonzàlez-Alujas
 Ecocardiografía en el paciente crítico Dra. Mª Teresa Gonzàlez-Alujas Routine transthoracic echocardiography in a general Intensive Care Unit: an 18 month survey in 704 patients. o Severe, previously unknown
Ecocardiografía en el paciente crítico Dra. Mª Teresa Gonzàlez-Alujas Routine transthoracic echocardiography in a general Intensive Care Unit: an 18 month survey in 704 patients. o Severe, previously unknown
Arteriopatía de miembros inferiores: algoritmos diagnósticos.
 Arteriopatía de miembros inferiores: algoritmos diagnósticos. Dr. Ignacio Bluro MTSAC Jefe Unidad Angiología Clínica y Eco Doppler Vascular Servicio de Cardiología Hospital Italiano de Buenos Aires Director
Arteriopatía de miembros inferiores: algoritmos diagnósticos. Dr. Ignacio Bluro MTSAC Jefe Unidad Angiología Clínica y Eco Doppler Vascular Servicio de Cardiología Hospital Italiano de Buenos Aires Director
CARDIOPATIAS CONGÉNITAS EN EL ADULTO
 CARDIOPATIAS CONGÉNITAS EN EL Dr. Miguel De La Rosa Martínez Pediatra Cardiólogo delarosa@cardiologos.com CARDIOPATÍAS CONGÉNITAS DESARROLLO DEL CORAZÓN: 22 día de desarrollo comienza la formación de las
CARDIOPATIAS CONGÉNITAS EN EL Dr. Miguel De La Rosa Martínez Pediatra Cardiólogo delarosa@cardiologos.com CARDIOPATÍAS CONGÉNITAS DESARROLLO DEL CORAZÓN: 22 día de desarrollo comienza la formación de las
INSUFICIENCIA CARDÍACA ETIOLOGÍA Y DIAGNÓSTICO
 INSUFICIENCIA CARDÍACA ETIOLOGÍA Y DIAGNÓSTICO JOAQUÍN LLORENTE GARCÍA R1 MEDICINA INTERNA COMPLEJO ASISTENCIAL DE LEON 19 de Septiembre de 2011 síndrome clínico que ocurre en pacientes que, a causa de
INSUFICIENCIA CARDÍACA ETIOLOGÍA Y DIAGNÓSTICO JOAQUÍN LLORENTE GARCÍA R1 MEDICINA INTERNA COMPLEJO ASISTENCIAL DE LEON 19 de Septiembre de 2011 síndrome clínico que ocurre en pacientes que, a causa de
Ecocardiografía. Planos básicos
 Ecocardiografía. Planos básicos Ventana supraesternal 1. Válvula Tricúspide 2. Válvula Mitral 3. Válvula Aortica 4. Válvula Pulmonar Ventana paraesternal Eje longitudinal paraesternal largo Ventanas Subxifoideassubcostal
Ecocardiografía. Planos básicos Ventana supraesternal 1. Válvula Tricúspide 2. Válvula Mitral 3. Válvula Aortica 4. Válvula Pulmonar Ventana paraesternal Eje longitudinal paraesternal largo Ventanas Subxifoideassubcostal
2-modulo 2 urgencias cardiología
 2-modulo 2 urgencias cardiología Pregunta 1 El patrón electrocardiográfico en la taquicardia sinusal es el siguiente: a. Frecuencia auricular y ventricular mayor de 100 latidos por minuto, ritmo auricular
2-modulo 2 urgencias cardiología Pregunta 1 El patrón electrocardiográfico en la taquicardia sinusal es el siguiente: a. Frecuencia auricular y ventricular mayor de 100 latidos por minuto, ritmo auricular
Definición TROMBOEMBOLIA PULMONAR. Epidemiología. >40 años >riesgo y se duplica con cada década posterior.
 Definición? TROMBOEMBOLIA PULMONAR Evelyn Aldana RII Medicina Interna Epidemiología Es la tercera enfermedad cardiovascular mas frecuente, incidencia anual global 100-200/100000 habitantes. Se estima que
Definición? TROMBOEMBOLIA PULMONAR Evelyn Aldana RII Medicina Interna Epidemiología Es la tercera enfermedad cardiovascular mas frecuente, incidencia anual global 100-200/100000 habitantes. Se estima que
COMPETENCIAS CLÍNICAS EN EL ÁREA DE PATOLOGÚIA CARDIOVASCULAR ASIGNATURAS: PATOLOGÍA CARDIOVASCULAR
 COMPETENCIAS CLÍNICAS EN EL ÁREA DE PATOLOGÚIA CARDIOVASCULAR ASIGNATURAS: PATOLOGÍA CARDIOVASCULAR 74. COMPETENCIAS MECES: Marco Español de Cualificaciones para la Educación Superior Competencia: COMPETENCIAS
COMPETENCIAS CLÍNICAS EN EL ÁREA DE PATOLOGÚIA CARDIOVASCULAR ASIGNATURAS: PATOLOGÍA CARDIOVASCULAR 74. COMPETENCIAS MECES: Marco Español de Cualificaciones para la Educación Superior Competencia: COMPETENCIAS
