Nuevo Marco Regulatorio Nacional en el contexto Andino y Latinoamericano
|
|
|
- Carlos Enrique Ortega de la Cruz
- hace 7 años
- Vistas:
Transcripción
1 Nuevo Marco Regulatorio Nacional en el contexto Andino y Latinoamericano Foro: Nueva Reglamentación sobre Registro, Control y Vigilancia de Medicamentos en el Perú Dra. Carmen Fajardo Ugaz Noviembre
2
3
4 UNASUR: MAPA ESTRATEGICO VISION CONSOLIDAR SURAMERICA COMO ESPACIO DE INTEGRACION QUE CONTRIBUYA A LA SALUD DE TOD@S
5 Líneas Estratégicas de la Política Andina de Medicamentos ACCESO MEDICAMENTOS 2. CALIDAD, EFICACIA Y SEGURIDAD 3. USO RACIONAL 4. INVESTIGACIÓN Y DESARROLLO
6 LÍNEAS ESTRATÉGICAS DE LA POLÍTICA ANDINA DE MEDICAMENTOS 1. ACCESO a) SELECCIÓN Todos los países cuentan con su Listado de Medicamentos Esenciales. b) GENERICOS Se promueve el uso de genéricos Se obliga el uso del DCI Ampliar oferta de genéricos: Farmacias privadas deben ser consideradas como extensiones de las instituciones de salud c) TRANSPARENCIA Se cuenta con el Observatorio Andino de Precios de Medicamentos d) GESTION Se han realizado dos Negociaciones Conjuntas para la adquisición de Antirretrovirales Se ha iniciado la Compra Regional Conjunta de medicamentos prioritarios (Oncológicos, ARV, etc.)
7 SOBRE SELECCIÓN: Ley y Acceso a los Medicamentos Artículo 27. Del acceso universal a los productos farmacéuticos El Estado promueve el acceso universal a los productos farmacéuticos, dispositivos médicos y productos sanitarios como componente fundamental de la atención integral en salud. Asimismo, dicta y adopta medidas para garantizar el acceso de la población a los medicamentos y dispositivos médicos esenciales. Artículo 28. Fundamentos del acceso universal Son fundamentos básicos del acceso universal los siguientes: 1)Selección racional, con la finalidad de promover y difundir los conceptos y el uso de los medicamentos esenciales y genéricos, en particular los medicamentos que constituyen el Petitorio Nacional de Medicamentos Esenciales. Artículo 34. De la aprobación del Petitorio y Formulario Nacional La Autoridad Nacional.elabora el Petitorio Nacional Único de Medicamentos Esenciales de aplicación en el país.y se actualiza bianualmente
8 Ley y Acceso a los Medicamentos SOBRE GENÉRICOS: Artículo 28. Fundamentos del acceso universal 2) Promoción y fortalecimiento de la fabricación, la importación y la prescripción de medicamentos genéricos como parte de la Política Nacional de Medicamentos. Artículo 31. De la prescripción La prescripción de medicamentos debe hacerse consignando obligatoriamente la denominación Común Internacional (DCI), la forma farmacéutica, dosis, duración del tratamiento, vía de administración y opcionalmente el nombre de marca si lo tuviere, teniendo en consideración las Buenas Prácticas de Prescripción que apruebe la Autoridad nacional de Salud
9 PERU ESTABLECE LA ESCALA DE SANCIONES PARA LOS QUE NO PRESCRIBAN EN DCI
10 GENERICOS CHILE OBLIGA A RECETAR EN DCI ACCESO
11 SOBRE TRANSPARENCIA: Ley y Acceso a los Medicamentos Artículo 26. De la obligación de brindar facilidades para el control y vigilancia sanitaria Los establecimientos regulados en la presente ley están obligados a brindar todas las facilidades a las autoridades para realizar las acciones de control y vigilancia sanitaria. En caso de no brindarse dichas facilidades, pueden solicitar a la autoridad judicial la autorización para el ingreso. Artículo 28. Fundamentos del acceso universal 4) Transparencia de la información, con el objeto de que se adopten decisiones informadas que cautelen el derecho de los usuarios y como mecanismo de difusión de información a los profesionales de la salud y a la población, se implementa el Observatorio de Precios, disponibilidad y calidad de medicamentos.
12 OBSERVATORIO ANDINO DE PRECIOS DE MEDICAMENTOS
13 TRANSPARENCIA OBSERVATORIO PERUANO DE PRECIOS DE MEDICAMENTOS ACCESO
14 TRANSPARENCIA ACCESO LISTA DE PRECIOS EN FARMACIAS
15 Ley y Acceso a los Medicamentos SOBRE GESTIÓN: Artículo 28. Fundamentos del acceso universal Son fundamentos básicos del acceso universal los siguientes: 3) Precios asequibles, promoviendo y desarrollando mecanismos para lograr economías de escala mediante compras corporativas y diversas modalidades de compra, implementando un sistema de información de precios de productos farmacéuticos que contribuya a prevenir prácticas monopólicas y la segmentación del mercado. Artículo 47. Del Grupo Técnico Multisectorial de Lucha contra el Comercio Ilegal El Grupo Técnico Multisectorial.elabora y propone el plan nacional de lucha contra el comercio ilegal de estos productos y establece la estrategia para su implementación.
16 COMPRAS CORPORATIVAS CON AHORROS CONSIDERABLES PROCESO DE COMPRA FEBRERO 2011
17
18 RESULTADOS ACCESO Aproximación de la Distribución del Mercado Farmacéutico Nacional en unidades SECTOR PÚBLICO 59.49% MINSA; 24.84% ESSALUD; 29.13% EPS; 7.93% SECTOR PRIVADO 40.51% Farm y/o Boticas; 14.22% Cadenas; 18.36% MINDEF; 3.00% MININTER; 1.67% INPE; 0.75% HMLO; 0.07% TOTAL: 6,500 Millones Unidades Fuente: Sector Público: Compras Públicas Registradas en el SEACE Sector Privado: IMS health del Perú e Información pública de las SEPS Otras Entidades; 0.03% Elaboración Propia DIGEMID J.Castro
19 GESTION BOLIVIA CAMINA A UNA COMPRA UNICA DE MEDICAMENTOS ACCESO
20 ESTA EN PROCESO LA COMPRA CONJUNTA ANDINA PERIÓDICA DE MEDICAMENTOS A TRAVÉS DEL FONDO ESTRATEGICO DE LA OPS
21 LÍNEAS ESTRATÉGICAS DE LA POLÍTICA ANDINA DE MEDICAMENTOS 2. CALIDAD a) SISTEMA DE VIGILANCIA DE LA CALIDAD b) CUMPLIMIENTO DE BUENAS PRACTICAS c) LABORATORIOS DE CONTROL DE CALIDAD d) FORTALECER PROCESOS DE AUTORIZACIÓN Este año 2011 se terminará de Implementar una Red de información relacionada a problemas de calidad, alertas, medicamentos ilícitos y falsificados con designación de contrapartes técnicas y difusión de información Los países avanzan en las certificación de los establecimientos de la cadena de suministro interna, Algunos países están certificando laboratorios en los países de origen (Colombia, Perú) Laboratorios de Control de Calidad vienen siendo acreditados por la OMS/OPS (Perú, Bolivia, Colombia) Certificación de Autoridades Sanitarias, Colombia certificó con OPS, Perú cuenta con ISO Actualización de la base regional de Normas, requerimientos, estándares y herramientas sobre registro y BPM de medicamentos de los países de la subregión. Perú aprobó una Ley especifica para productos farmacéuticos.
22 Ley y Control de la Calidad de los Medicamentos SOBRE EL REGISTRO: Artículo 8. De la obligatoriedad y vigencia Todos los productos comprendidos en la clasificación de la presente ley requieren de registro sanitario. El registro sanitario faculta a su titular para la fabricación, importación, almacenamiento, distribución, comercialización, promoción, dispensación, expendio o uso de dichos productos.. El registro sanitario es temporal y renovable cada cinco años. Artículo 10. Clasificación en el Registro Sanitario Para los efectos del registro, los medicamentos se clasifican en: 1.Productos que se encuentran en el Petitorio Nacional. 2.Productos que no se encuentran en el Petitorio Nacional y que se encuentran registrados en países de alta vigilancia sanitaria. 3.Productos que no se encuentran en las categorías 1y 2. (El Reglamento de Productos Farmacéuticos establece los requisitos en cada caso)
23 Ley y Control de la Calidad de los Medicamentos SOBRE EL REGISTRO: Artículo 16. De las autorizaciones excepcionales La Autoridad Nacional provisionalmente autoriza la importación, fabricación y el uso de productos farmacéuticos, dispositivos médicos y productos sanitarios sin registro sanitario, en los siguientes casos: 1. Situaciones de urgencia o emergencia declarada. 2. Fines exclusivos de investigación y capacitación. 3. Prevención y tratamiento individual. 4. Situaciones de salud pública en las que se demuestre la necesidad y no disponibilidad del producto en el mercado nacional. (El Reglamento de Productos Farmacéuticos, en su artículo 20, reglamenta estas excepciones estableciendo que dicha autorización excepcional no impide la comprobación de calidad; y que la Autoridad puede denegar, suspender o cancelar dicha autorización)
24 CERTIFICACIÓN DE LA AUTORIDAD AUTORIDAD REGULADORA CERTIFICADA CALIDAD
25 Ley y Control de la Calidad de los Medicamentos SOBRE LAS BUENAS PRÁCTICAS DE MANUFACTURA, DE LABORATORIO, DE DISTRIBUCIÓN, DE ALMACENAMIENTO, DE DISPENSACIÓN Y SEGUIMIENTO FARMACOTERAPÉUTICO: Artículo 22. De la obligación de cumplir las Buenas Prácticas Para desarrollar sus actividades, las personas naturales o jurídicas, públicas y privadas que se dedican para sí o para terceros a la fabricación, importación, distribución, almacenamiento, dispensación o expendio de productos farmacéuticos deben cumplir con los requisitos establecidos en el Reglamento respectivo y en las Buenas Prácticas aprobadas por la Autoridad. La Ley y el Reglamento establecen que la certificación de Buenas Prácticas de Manufactura tiene tres formas: Para la producción en el país la responsabilidad es de la Autoridad Nacional de Medicamentos; Para los productos importados de países con alta vigilancia sanitaria se reconoce la certificación de la Autoridad del país de origen; y En el caso de otros países, la certificación debe ser realizada por la Autoridad Nacional de Medicamentos en el sitio
26 BPM CALIDAD PROFESIONALES DE DIGEMID VIAJAN A CHINA A CERTIFICAR LABORATORIOS Un equipo certificador está conformado por 17 especialistas que viajarán por etapas a China para visitar los 29 laboratorios cuya inscripción ha sido aprobada por la Digemid. Foto: Saúl Vilchez.
27 Ley y Control de la Calidad de los Medicamentos SOBRE EL CONTROL DE CALIDAD DE TODOS LOS PRODUCTOS: Artículo 45. De las acciones de control El titular del registro sanitario y del certificado de registro sanitario de productos considerados en la presente ley, con excepción del instrumental y equipo de uso médico quirúrgico u odontológico, debe presentar a la ANM, previo a su comercialización o distribución, los resultados de control de calidad de todos y cada uno de los lotes que se comercializan en el mercado peruano, con excepciones que son autorizadas por resolución ministerial. El control de calidad del primer lote que ingrese al mercado, después de una inscripción o reinscripción se realiza en el Centro Nacional de Control de Calidad o laboratorio acreditado de la Red. Para los otros lotes, el titular del registro sanitario, puede optar por el contrario con un laboratorio de control de calidad propio o contratado, público o privado, acreditado por la ANM. (El Reglamento reitera exactamente lo mismo en su artículo 166)
28 LABORATORIO CERTIFICADO CENTRO DE CONTROL DE CALIDAD ACREDITADOS POR OMS CALIDAD
29 LÍNEAS ESTRATÉGICAS DE LA POLÍTICA ANDINA DE MEDICAMENTOS 3. USO RACIONAL a) FARMACO- VIGILANCIA b) PROMOCIÓN c) FORTALECER PROCESOS d) INFORMACIÓN CIENTIFICA El 1º de Abril 2011 se aprobó el Programa Andino de Farmacovigilancia Implementación del Programa Andino de Farmacovigilancia Se ha concluido la Guía Criterios Éticos Andinos para la Promoción de Medicamentos, se ha programado su edición, impresión y distribución. Elaborar el Plan de Monitoreo de los Criterios Éticos Andinos para la Promoción de Medicamentos Se ha iniciado el Análisis de la Situación Farmacéutica en la Subregión y su Tendencia. Se esta trabajando con el apoyo de la OPS en la creación de Centros Nacionales de Información Científica independiente Se desarrollará un Centro Regional de Información
30 Ley y el Uso Racional de Medicamentos SOBRE LA FARMACOVIGILANCIA: Artículo 35. Del Sistema Peruano de Farmacovigilancia y Tecnovigilancia La ANM conduce el Sistema Peruano de Farmacovigilancia de productos farmacéuticos, dispositivos médicos y productos sanitarios y promueve la realización de los estudio de farmacoepidemiología necesarios para evaluar la seguridad de los medicamentos autorizados; como consecuencia de sus acciones adopta las medidas sanitarias en resguardo de la salud de la población. El Sistema Peruano de Farmacovigilancia incluye la tecnovigilancia de dispositivos médicos y productos sanitarios. Artículo 36. De la obligación de reportar reacciones adversas Es obligación del fabricante o importador, titular del registro sanitario, reportar a la ANM sobre sospechas de reacciones o eventos adversos.
31 Ley y el Uso Racional de Medicamentos SOBRE LA PROMOCIÓN: Artículo 39. Del alcance de la promoción y publicidad Solamente pueden ser objeto de publicidad a través de medios que se encuentren al alcance del público en general los productos farmacéuticos, dispositivos médicos y productos sanitarios que cuentan con registro sanitario del país y están autorizados para su venta sin receta médica. La publicidad debe contener, además del nombre del producto, la dosis, concentración o forma farmacéutica del mismo, según sea el caso. Artículo 40. De las prohibiciones Queda prohibida la publicidad que se realice a través de: 1.Envases, etiquetas o prospectos que acompañen a productos de venta bajo receta médica. 2.Entrega directa de muestras de productos a pacientes y público en general. 3.Cualquier actividad que incentive la venta en los establecimientos farmacéuticos de dispensación. 4.Otros considerados en el Reglamento.
32 SE APROBO EL PROGRAMA ANDINO DE FARMACOVIGILANCIA
33 FARMACO VIGILANCIA SE APROBO EL PROGRAMA ANDINO DE FARMACOVIGILANCIA URM 1. GENERACIÓN DE MODELOS (Recomendaciones para la implementación de la farmacovigilancia, en el nivel regulatorio como operativo): Modelo Regulatorio Modelo RED Nacional Modelo RED Subregional 2. GENERACIÓN DE BUENA S PRÁCTICAS. 3. MAPEO PUNTOS FOCALES E INFORMACIÓN DISPONIBLE 4. POTENCIAR INTERCOMUNICACIÓN SUBREGIONAL (RED ANDINA FVG) 5. INCREMENTO DE CAPACIDADES TÉCNICAS 6. APOYAR LOS PROCESOS LOCALES (Ecuador y Bolivia)
34 CREACIÓN DE CENTROS DE INFORMACIÓN CIENTIFICA INDEPENCIENTES BIBLIOTECA VIRTUAL EN PERU
35 LÍNEAS ESTRATÉGICAS DE LA POLÍTICA ANDINA DE MEDICAMENTOS 4. INVESTIGACIÓN Y DESARROLLO a) LISTA DE MEDIC. HUERFANOS Se cuenta con la lista regional de medicamentos huérfanos b) PRODUCCIÓN Se cuenta con el Análisis de las Capacidades de los Países de la Sub Región Andina para la Producción Pública de Medicamentos c) SITUACION DE I & D Elaborar el análisis de la situación de Investigación y Desarrollo en la Subregión Andina
36 Ley y la Investigación Científica SOBRE LOS MEDICAMENTOS HUÉRFANOS: Ley Enfermedades Raras o Huérfanas Artículo Las enfermedades raras o huérfanas, incluidas las de origen genético, son aquellas enfermedades con peligro de muerte o de invalidez crónica, que tienen una frecuencia baja, presentan muchas dificultades para ser diagnosticadas y efectuar su seguimiento, tienen un origen desconocido en la mayoría de los casos que conllevan múltiples problemas sociales y con escasos datos epidemiológicos. 2.2 Medicamentos huérfanos son aquellos que se utilizan para la prevención, diagnóstico o tratamiento de enfermedades raras o huérfanas. Artículo 4. Diagnóstico de las enfermedades raras o huérfanas El Poder Ejecutivo dicta las medidas necesarias para garantizar el diagnóstico de las enfermedades raras o huérfanas; asimismo, dispone que se incluyan en los programas universitarios educación a los estudiantes y profesionales sobre estas enfermedades.
37 INVESTIGACIÓN Y DESARROLLO Capacidad de producción pública de medicamentos: Los países de la Subregión Andina carecen de centros de manufactura públicos de medicamentos con capacidad de producción a escala industrial, con excepción de Venezuela. Ecuador es el segundo país comprometido en viabilizar la producción pública, en estos momentos se encuentra en fase de diseño de la misma Posibles estrategias a seguir por los países de la Subregión Andina: 1: Producción Pública en cada uno de ellos. 2: Producción Pública concentrada en algunos países de la Subregión Andina 3: Producción por Asociación Pública Privada Medicamentos a producir: Medicamentos huérfanos, Medicamentos para el tratamiento de la malaria, la tuberculosis, el Chagas, Medicamentos antirretrovirales, Presentaciones pediátricas (ARV) Medicamentos para enfermedades crónicas (HTA, DM) en países donde la oferta sea reducida.
38 Ley y la Investigación Científica SOBRE LA INVESTIGACIÓN Y EL DESARROLLO: Artículo 43. De la promoción de la investigación La Autoridad Nacional de Salud autoriza y vigila los estudios clínicos de los productos considerados en la presente ley y promueve la investigación científica y tecnológica, en este campo, salvaguardando los derechos de los pacientes de acuerdo con la Buenas Prácticas Clínicas y los requisitos que establece el Reglamento respectivo.
39 INVESTIGACIÓN Y DESARROLLO QUË? MEDICAMENTOS ESENCIALES, HUÉRFANOS PARA QUIEN? PARA LOS PAISES ANDINOS Y OTROS CÓMO? EN CONSTRUCCIÓN, ASOCIACIÓN CON MERCOSUR Y UNASUR
40 GRACIAS 40
Expositor Q.F. Alfredo A. Castillo Calle
 Expositor Q.F. Alfredo A. Castillo Calle Elaborado por: Q.F. Vicky Flores Valenzuela Mayo 2010 ANTECEDENTES La Ley General de Salud Ley Nº 26842 se aprobó en 1997, Título II incluye: Capítulo III referido
Expositor Q.F. Alfredo A. Castillo Calle Elaborado por: Q.F. Vicky Flores Valenzuela Mayo 2010 ANTECEDENTES La Ley General de Salud Ley Nº 26842 se aprobó en 1997, Título II incluye: Capítulo III referido
Consejo Nacional de Salud PROPUESTAS PARA MEJORAR EL ACCESO Y USO DE PRODUCTOS FARMACÉUTICOS Y DISPOSITIVOS MÉDICOS ESENCIALES Y DE CALIDAD EN EL PERÚ
 Comité Nacional de Medicamentos PROPUESTAS PARA MEJORAR EL ACCESO Y USO DE PRODUCTOS FARMACÉUTICOS Y DISPOSITIVOS MÉDICOS ESENCIALES Y DE CALIDAD EN EL PERÚ Q.F. Pedro L. Yarasca Purilla Presidente 21
Comité Nacional de Medicamentos PROPUESTAS PARA MEJORAR EL ACCESO Y USO DE PRODUCTOS FARMACÉUTICOS Y DISPOSITIVOS MÉDICOS ESENCIALES Y DE CALIDAD EN EL PERÚ Q.F. Pedro L. Yarasca Purilla Presidente 21
POLÍTICAS Y ESTRATEGIAS PARA EL ACCESO A MEDICAMENTOS. Q.F. Pedro L. Yarasca Purilla Director General DIGEMID
 POLÍTICAS Y ESTRATEGIAS PARA EL ACCESO A MEDICAMENTOS Q.F. Pedro L. Yarasca Purilla Director General DIGEMID Agosto 2013 1 Contexto ACTUAL 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007
POLÍTICAS Y ESTRATEGIAS PARA EL ACCESO A MEDICAMENTOS Q.F. Pedro L. Yarasca Purilla Director General DIGEMID Agosto 2013 1 Contexto ACTUAL 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007
SELECCIÓN DE MEDICAMENTOS ESENCIALES
 Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS ESENCIALES EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección General de Medicamentos,
Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS ESENCIALES EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección General de Medicamentos,
Sistema Peruano de Información Jurídica
 Jueves, 26 de noviembre de 2009 CONGRESO DE LA REPUBLICA Ley de los productos farmacéuticos, dispositivos médicos y productos sanitarios EL PRESIDENTE DE LA REPÚBLICA POR CUANTO: El Congreso de la República
Jueves, 26 de noviembre de 2009 CONGRESO DE LA REPUBLICA Ley de los productos farmacéuticos, dispositivos médicos y productos sanitarios EL PRESIDENTE DE LA REPÚBLICA POR CUANTO: El Congreso de la República
EL CONGRESO DE LA REPÚBLICA; Ha dado la Ley siguiente:
 EL CONGRESO DE LA REPÚBLICA; Ha dado la Ley siguiente: LEY DE LOS PRODUCTOS FARMACÉUTICOS, DISPOSITIVOS MÉDICOS Y PRODUCTOS SANITARIOS CAPÍTULO I DISPOSICIONES GENERALES Artículo 1º.- Objeto de la Ley
EL CONGRESO DE LA REPÚBLICA; Ha dado la Ley siguiente: LEY DE LOS PRODUCTOS FARMACÉUTICOS, DISPOSITIVOS MÉDICOS Y PRODUCTOS SANITARIOS CAPÍTULO I DISPOSICIONES GENERALES Artículo 1º.- Objeto de la Ley
Cuestiones de Protección al Consumidor en el sector de medicamentos
 Cuestiones de Protección al Consumidor en el sector de medicamentos Anahí Chávez Ruesta Directora de la Autoridad Nacional de Protección del Consumidor 1 Problemas que afectan a los consumidores 2 Qué
Cuestiones de Protección al Consumidor en el sector de medicamentos Anahí Chávez Ruesta Directora de la Autoridad Nacional de Protección del Consumidor 1 Problemas que afectan a los consumidores 2 Qué
LINEAMIENTOS Y MEDIDAS DE REFORMA DEL SECTOR SALUD
 Consejo Nacional de Salud LINEAMIENTOS Y MEDIDAS DE REFORMA DEL SECTOR SALUD EN MEDICAMENTOS PROPUESTA PRELIMINAR JUNIO DE 2013 SITUACIÓN ACTUAL SITUACIÓN ACTUAL (DISPONIBILIDAD) SITUACIÓN ACTUAL PROBLEMÁTICA
Consejo Nacional de Salud LINEAMIENTOS Y MEDIDAS DE REFORMA DEL SECTOR SALUD EN MEDICAMENTOS PROPUESTA PRELIMINAR JUNIO DE 2013 SITUACIÓN ACTUAL SITUACIÓN ACTUAL (DISPONIBILIDAD) SITUACIÓN ACTUAL PROBLEMÁTICA
CONSUMO y PRECIOS DE MEDICAMENTOS EN EL PAIS
 DIGEMID CONSUMO y PRECIOS DE MEDICAMENTOS EN EL PAIS CLINICAS PRIVADAS Q.F. Pedro L. Yarasca Purilla Director General DIGEMID El mercado farmacéutico peruano se ha duplicado en los últimos 15 años, principalmente
DIGEMID CONSUMO y PRECIOS DE MEDICAMENTOS EN EL PAIS CLINICAS PRIVADAS Q.F. Pedro L. Yarasca Purilla Director General DIGEMID El mercado farmacéutico peruano se ha duplicado en los últimos 15 años, principalmente
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia. Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional
 Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
Marco normativo para el desarrollo de la Farmacovigilancia en Colombia Shirley Chapetón Montes Coordinadora Grupo Apoyo Jurídico Institucional CONTENIDO Conceptos Básicos Normatividad Guía de farmacovigilancia
AUTORIZACION EXCEPCIONAL DE PRODUCTOS SANITARIOS
 DIRECCION GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS AUTORIZACION EXCEPCIONAL DE PRODUCTOS SANITARIOS Q.F. ROSA L. GUEVARA DE LA CRUZ Unidad Funcional de Productos Sanitarios-DDMP DIGEMID PRODUCTOS SANITARIOS:
DIRECCION GENERAL DE MEDICAMENTOS INSUMOS Y DROGAS AUTORIZACION EXCEPCIONAL DE PRODUCTOS SANITARIOS Q.F. ROSA L. GUEVARA DE LA CRUZ Unidad Funcional de Productos Sanitarios-DDMP DIGEMID PRODUCTOS SANITARIOS:
LEY Nro EL PRESIDENTE DE LA REPUBLICA POR CUANTO: El Congreso de la República Ha dado la Ley siguiente: EL CONGRESO DE LA REPUBLICA; Ha dado
 LEY Nro. 29459 EL PRESIDENTE DE LA REPUBLICA POR CUANTO: El Congreso de la República Ha dado la Ley siguiente: EL CONGRESO DE LA REPUBLICA; Ha dado la Ley siguiente: LEY DE LOS PRODUCTOS FARMACEUTICOS,
LEY Nro. 29459 EL PRESIDENTE DE LA REPUBLICA POR CUANTO: El Congreso de la República Ha dado la Ley siguiente: EL CONGRESO DE LA REPUBLICA; Ha dado la Ley siguiente: LEY DE LOS PRODUCTOS FARMACEUTICOS,
ROL DEL PROFESIONAL QUÍMICO FARMACÉUTICO EN LA SALUD EN EL CONTEXTO DE LA ATENCIÓN PRIMARIA DE LA SALUD RENOVADA
 ROL DEL PROFESIONAL QUÍMICO FARMACÉUTICO EN LA SALUD EN EL CONTEXTO DE LA ATENCIÓN PRIMARIA DE LA SALUD RENOVADA Mayo 2013, Lima, Perú Q.F. Jaime Villegas Chiguala DIGEMID MARCOS REFERENCIALES D.S.
ROL DEL PROFESIONAL QUÍMICO FARMACÉUTICO EN LA SALUD EN EL CONTEXTO DE LA ATENCIÓN PRIMARIA DE LA SALUD RENOVADA Mayo 2013, Lima, Perú Q.F. Jaime Villegas Chiguala DIGEMID MARCOS REFERENCIALES D.S.
MESA REDONDA Promoción del uso adecuado de los Medicamentos en Latinoamérica
 MESA REDONDA Promoción del uso adecuado de los Medicamentos en Latinoamérica Iván Torres Marquina Presidente de la Asociación Peruana de Facultades y Escuelas de Farmacia y Bioquímica (ASPEFEFB) Decano
MESA REDONDA Promoción del uso adecuado de los Medicamentos en Latinoamérica Iván Torres Marquina Presidente de la Asociación Peruana de Facultades y Escuelas de Farmacia y Bioquímica (ASPEFEFB) Decano
SELECCIÓN DE MEDICAMENTOS EN EL MARCO DEL SUMINISTRO PUBLICO
 Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS EN EL MARCO DEL SUMINISTRO PUBLICO EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección
Dirección General de Medicamentos, Insumos y Drogas SELECCIÓN DE MEDICAMENTOS EN EL MARCO DEL SUMINISTRO PUBLICO EQUIPO DE SELECCIÓN Y EVALUACION DE MEDICAMENTOS Y OTRAS TECNOLOGIAS SANITARIAS Dirección
Dirección Ejecutiva de Salud Individual. CUSCO CAPITAL HISTORICA DEL PERU AÑO DE LA DIVERSIFICACIÓN PRODUCTIVA Y DEL FORTALECIMIENTO DE LA EDUCACIÓN
 DIRESA CUSCO DIRECCION DE MEDICAMENTOS, INSUMOS Y DROGAS EQUIPO DE USO RACIONAL DE MEDICAMENTOS RESULTADOS DE INDICADORES DE USO RACIONAL DE MEDICAMENTOS ESTRE Cusco - Perú ÁREA USO RACIONAL DE MEDICAMENTOS
DIRESA CUSCO DIRECCION DE MEDICAMENTOS, INSUMOS Y DROGAS EQUIPO DE USO RACIONAL DE MEDICAMENTOS RESULTADOS DE INDICADORES DE USO RACIONAL DE MEDICAMENTOS ESTRE Cusco - Perú ÁREA USO RACIONAL DE MEDICAMENTOS
Dirección Ejecutiva de Salud Individual. DECENIO DE LA IGUALDAD DE OPORTUNIDADES PARA MUJERES Y HOMBRES AÑO DEL DIAGOLO Y LA RECONCILIACION NACIONAL
 DIRESA CUSCO DIRECCION DE MEDICAMENTOS, INSUMOS Y DROGAS EQUIPO DE USO RACIONAL DE MEDICAMENTOS RESULTADOS DE INDICADORES DE USO RACIONAL DE MEDICAMENTOS II SEMESTRE 2017 Cusco - Perú ÁREA USO RACIONAL
DIRESA CUSCO DIRECCION DE MEDICAMENTOS, INSUMOS Y DROGAS EQUIPO DE USO RACIONAL DE MEDICAMENTOS RESULTADOS DE INDICADORES DE USO RACIONAL DE MEDICAMENTOS II SEMESTRE 2017 Cusco - Perú ÁREA USO RACIONAL
DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA MINISTERIO DE SALUD PÚBLICA Y BIENESTAR SOCIAL
 DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA MINISTERIO DE SALUD PÚBLICA Y BIENESTAR SOCIAL Paraguay Farm. María Auxiliadora Vargas de Dentice Directora General Basandonos en la Vision y Misión de la Red
DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA MINISTERIO DE SALUD PÚBLICA Y BIENESTAR SOCIAL Paraguay Farm. María Auxiliadora Vargas de Dentice Directora General Basandonos en la Vision y Misión de la Red
"Por tu salud, ponle ojo al medicamento"
 SUSTENTO TÉCNICO DE LA CAMPAÑA NACIONAL DE DIFUSIÓN Y PREVENCIÓN CONTRA EL COMERCIO ILEGAL DE PRODUCTOS FARMACÉUTICOS Y AFINES DIGEMID - DCVS 2007 SLOGAN "Por tu salud, ponle ojo al medicamento" I. MINISTERIO
SUSTENTO TÉCNICO DE LA CAMPAÑA NACIONAL DE DIFUSIÓN Y PREVENCIÓN CONTRA EL COMERCIO ILEGAL DE PRODUCTOS FARMACÉUTICOS Y AFINES DIGEMID - DCVS 2007 SLOGAN "Por tu salud, ponle ojo al medicamento" I. MINISTERIO
XXIX RESSCAD. Msc. Rosibel Vargas Gamboa Asuntos Internacionales en Salud Ministerio de Salud Costa Rica
 XXIX RESSCAD Fortalecimiento de Autoridades Reguladoras Nacionales y del marco normativo y regulatorio para la evaluación y acceso a tecnologías de salud Msc. Rosibel Vargas Gamboa Asuntos Internacionales
XXIX RESSCAD Fortalecimiento de Autoridades Reguladoras Nacionales y del marco normativo y regulatorio para la evaluación y acceso a tecnologías de salud Msc. Rosibel Vargas Gamboa Asuntos Internacionales
SECOND WHO GLOBAL FORUM ON MEDICAL DEVICES
 PERU LATINO AMERICA PERÚ CAMINO A LA ARMONIZACIÓN EN EL TEMA DE DISPOSITIVOS MÉDICOS MOVING TOWARDS HARMONIZATION OF MEDICAL DEVICES IN PERU SECOND WHO GLOBAL FORUM ON MEDICAL DEVICES http://www.digemid.minsa.gob.pe
PERU LATINO AMERICA PERÚ CAMINO A LA ARMONIZACIÓN EN EL TEMA DE DISPOSITIVOS MÉDICOS MOVING TOWARDS HARMONIZATION OF MEDICAL DEVICES IN PERU SECOND WHO GLOBAL FORUM ON MEDICAL DEVICES http://www.digemid.minsa.gob.pe
CONOCIENDO MAS SOBRE REGULACIONES Y MEDICAMENTOS BIOLOGICOS
 CONOCIENDO MAS SOBRE REGULACIONES Y MEDICAMENTOS BIOLOGICOS Expositor: Q. F. DR. MOISES MENDEZ Presidente de CEQUIFAR PERU Auditorio N 2 del Hospital Edgardo Rebagliati Martins de EsSalud 15 de Marzo del
CONOCIENDO MAS SOBRE REGULACIONES Y MEDICAMENTOS BIOLOGICOS Expositor: Q. F. DR. MOISES MENDEZ Presidente de CEQUIFAR PERU Auditorio N 2 del Hospital Edgardo Rebagliati Martins de EsSalud 15 de Marzo del
AVANCES RESOLUCIONES REMSAA
 BOLIVIA AVANCES CHILE RESOLUCIONES COLOMBIA REMSAA ECUADOR PERÚ COMISIÓN TÉCNICA SUBREGIONAL PARA LA POLÍTICA DE ACCESO A MEDICAMENTOS VENEZUELA Lima, Perú, 9 de febrero 2009 Dando cumplimiento al mandato
BOLIVIA AVANCES CHILE RESOLUCIONES COLOMBIA REMSAA ECUADOR PERÚ COMISIÓN TÉCNICA SUBREGIONAL PARA LA POLÍTICA DE ACCESO A MEDICAMENTOS VENEZUELA Lima, Perú, 9 de febrero 2009 Dando cumplimiento al mandato
CURSO REGULACION SANITARIA DE PRODUCTOS BIOLOGICOS Y BIOTECNOLOGICOS
 CURSO REGULACION SANITARIA DE PRODUCTOS BIOLOGICOS Y BIOTECNOLOGICOS 1.- Introducción Programa General Fase Virtual de Autoaprendizaje y Fase Presencial Edición 2017 Los medicamentos biológicos y biotecnológicos
CURSO REGULACION SANITARIA DE PRODUCTOS BIOLOGICOS Y BIOTECNOLOGICOS 1.- Introducción Programa General Fase Virtual de Autoaprendizaje y Fase Presencial Edición 2017 Los medicamentos biológicos y biotecnológicos
El Instituto de Salud Pública P
 El Instituto de Salud Pública P de Chile es un servicio público, que posee autonomía a de gestión n y está dotado de personalidad jurídica y de patrimonio propio, dependiente del Ministerio de Salud, para
El Instituto de Salud Pública P de Chile es un servicio público, que posee autonomía a de gestión n y está dotado de personalidad jurídica y de patrimonio propio, dependiente del Ministerio de Salud, para
Elizabeth Carmelino García
 Elizabeth Carmelino García MINSA ENTIDAD REGULATORIA EN MEDICAMENTOS DEL PERU DIGEMID DIRECCION DE ACCESO Y USO RACIONAL DIRECCION DE AUTORIZACIONES SANITARIAS DIRECCION DE CONTROL Y VIGILANCIA SANITARIA
Elizabeth Carmelino García MINSA ENTIDAD REGULATORIA EN MEDICAMENTOS DEL PERU DIGEMID DIRECCION DE ACCESO Y USO RACIONAL DIRECCION DE AUTORIZACIONES SANITARIAS DIRECCION DE CONTROL Y VIGILANCIA SANITARIA
ORIENTACIÓN GENERAL SOBRE AUTORIZACIÓN EXCEPCIONAL DE DISPOSITIVOSMÉDICOS
 ORIENTACIÓN GENERAL SOBRE AUTORIZACIÓN EXCEPCIONAL DE DISPOSITIVOSMÉDICOS Q.F. VILMA ROSA MAIHUIRE SERRANO Unidad Funcional de Dispositivos Médicos-UFDM DDMP Base legal para solicitar Autorización Excepcional
ORIENTACIÓN GENERAL SOBRE AUTORIZACIÓN EXCEPCIONAL DE DISPOSITIVOSMÉDICOS Q.F. VILMA ROSA MAIHUIRE SERRANO Unidad Funcional de Dispositivos Médicos-UFDM DDMP Base legal para solicitar Autorización Excepcional
Datos Generales de Panamá. Organización del Sector Salud. Políticas del Sector Salud. Competencias y Capacidades
 Datos Generales de Panamá Organización del Sector Salud Financiamiento del Sector Salud Políticas del Sector Salud Dirección Nacional de Farmacia y Drogas Competencias y Capacidades Proyectos Población
Datos Generales de Panamá Organización del Sector Salud Financiamiento del Sector Salud Políticas del Sector Salud Dirección Nacional de Farmacia y Drogas Competencias y Capacidades Proyectos Población
TÉRMINOS DE REFERENCIA
 TÉRMINOS DE REFERENCIA Consultoría para realizar un estudio diagnóstico de la gestión de suministros de los medicamentos Antirretrovirales Pediátricos, selección (presentaciones), programación, adquisición,
TÉRMINOS DE REFERENCIA Consultoría para realizar un estudio diagnóstico de la gestión de suministros de los medicamentos Antirretrovirales Pediátricos, selección (presentaciones), programación, adquisición,
DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA -PARAGUAY-
 DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA -PARAGUAY- Iturbe N 883 e/ Manuel Domínguez y Fulgencio R. Moreno. Asunción - Paraguay La Dirección Nacional de Vigilancia Sanitaria, es un organismo dependiente
DIRECCIÓN NACIONAL DE VIGILANCIA SANITARIA -PARAGUAY- Iturbe N 883 e/ Manuel Domínguez y Fulgencio R. Moreno. Asunción - Paraguay La Dirección Nacional de Vigilancia Sanitaria, es un organismo dependiente
REUNIÓN TÉCNICA INTERNACIONAL SERVICIOS FARMACÉUTICOS BASADOS EN ATENCIÓN PRIMARIA DE SALUD RENOVADA. Lima, Perú 2 y 3 de mayo de 2013
 REUNIÓN TÉCNICA INTERNACIONAL SERVICIOS FARMACÉUTICOS BASADOS EN ATENCIÓN PRIMARIA DE SALUD RENOVADA Lima, Perú 2 y 3 de mayo de 2013 SERVICIOS FARMACÉUTICOS BASADOS EN ATENCIÓN PRIMARIA DE SALUD EN EL
REUNIÓN TÉCNICA INTERNACIONAL SERVICIOS FARMACÉUTICOS BASADOS EN ATENCIÓN PRIMARIA DE SALUD RENOVADA Lima, Perú 2 y 3 de mayo de 2013 SERVICIOS FARMACÉUTICOS BASADOS EN ATENCIÓN PRIMARIA DE SALUD EN EL
3.- Cuáles son los requisitos para el permiso de funcionamiento de Farmacias y botiquines?
 NORMATIVA TÉCNICA SANITARIA PARA EL CONTROL Y FUNCIONAMIENTO DE FARMACIAS Y BOTIQUINES 1.- La Resolución ARCSA 008 2017-JCGO a que establecimientos es aplicable? Esta resolución es aplicable a todas las
NORMATIVA TÉCNICA SANITARIA PARA EL CONTROL Y FUNCIONAMIENTO DE FARMACIAS Y BOTIQUINES 1.- La Resolución ARCSA 008 2017-JCGO a que establecimientos es aplicable? Esta resolución es aplicable a todas las
Estrategias para Combatir la Falsificación y el Comercio Ilegal en el Perú
 Estrategias para Combatir la Falsificación y el Comercio Ilegal en el Perú Q.F MARISA PAPEN BERNAOLA Jefe de Unidad Funcional Contra el Comercio Ilegal Dirección de Medicamentos Insumos y Drogas DIGEMID.
Estrategias para Combatir la Falsificación y el Comercio Ilegal en el Perú Q.F MARISA PAPEN BERNAOLA Jefe de Unidad Funcional Contra el Comercio Ilegal Dirección de Medicamentos Insumos y Drogas DIGEMID.
SALUD NORMAS LEGALES DECRETO SUPREMO Nº SA EL PRESIDENTE DE LA REPÚBLICA CONSIDERANDO:
 El Peruano / Miércoles 22 de agosto de 2018 SALUD Decreto Supremo que modifica el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos
El Peruano / Miércoles 22 de agosto de 2018 SALUD Decreto Supremo que modifica el Reglamento para el Registro, Control y Vigilancia Sanitaria de Productos Farmacéuticos, Dispositivos Médicos y Productos
PERU. Formas para Resumir la Situación de la Divulgación de Datos. La Alianza para la Transparencia en Medicamentos Peru.
 Formas para Resumir la Situación de la Divulgación de Datos PERU Abril 2010 La Alianza para la Transparencia en Medicamentos Peru -1- instrumento de recolección de datos desarrollada por: WHO Harvard Collaborating
Formas para Resumir la Situación de la Divulgación de Datos PERU Abril 2010 La Alianza para la Transparencia en Medicamentos Peru -1- instrumento de recolección de datos desarrollada por: WHO Harvard Collaborating
Mgtra. Jenny Vergara Sibauste Directora
 Mgtra. Jenny Vergara Sibauste Directora Fundamento Legal Constitución de la República de Panamá 1972 Ley 1 de 10 de enero de 2001 Sobre Medicamentos y Otros Productos para la Salud Humana Política Nacional
Mgtra. Jenny Vergara Sibauste Directora Fundamento Legal Constitución de la República de Panamá 1972 Ley 1 de 10 de enero de 2001 Sobre Medicamentos y Otros Productos para la Salud Humana Política Nacional
HERNÁNDEZ ATÚNCAR NANCY CRISTINA Av. Venezuela 1620-Dpto 704-A Breña
 HERNÁNDEZ ATÚNCAR NANCY CRISTINA Av. Venezuela 1620-Dpto 704-A Breña Teléfono 998827702 Fecha de Nacimiento 24 de agosto 1975 Documento Nacional de Identidad 21875469 Número de Colegiatura CQFP 08148 E-mail
HERNÁNDEZ ATÚNCAR NANCY CRISTINA Av. Venezuela 1620-Dpto 704-A Breña Teléfono 998827702 Fecha de Nacimiento 24 de agosto 1975 Documento Nacional de Identidad 21875469 Número de Colegiatura CQFP 08148 E-mail
DIRECTIVA SANITARIA QUE REGULA LA DIRECCIÓN TECNICA DE FARMACIAS, BOTICAS Y BOTIQUINES EN ZONAS RURALES
 DIRECTIVA SANITARIA QUE REGULA LA DIRECCIÓN TECNICA DE FARMACIAS, BOTICAS Y BOTIQUINES EN ZONAS RURALES I. FINALIDAD Contribuir al acceso de la población a productos farmacéuticos, dispositivos médicos
DIRECTIVA SANITARIA QUE REGULA LA DIRECCIÓN TECNICA DE FARMACIAS, BOTICAS Y BOTIQUINES EN ZONAS RURALES I. FINALIDAD Contribuir al acceso de la población a productos farmacéuticos, dispositivos médicos
Modelo de Servicios Farmacéuticos en Atención Primaria en Salud en la Caja Costarricense de Seguro Social
 Modelo de Servicios Farmacéuticos en Atención Primaria en Salud en la Caja Costarricense de Seguro Social Octubre 2014 Sistemas de Salud basados en la APS: evolución del marco estratégico Sistemas de Salud
Modelo de Servicios Farmacéuticos en Atención Primaria en Salud en la Caja Costarricense de Seguro Social Octubre 2014 Sistemas de Salud basados en la APS: evolución del marco estratégico Sistemas de Salud
Reunión de Autoridades Nacionales Reguladoras Latinoamérica Caribe Santo Domingo-República Dominicana Junio del 2008
 Reunión de Autoridades Nacionales Reguladoras Latinoamérica Caribe Santo Domingo-República Dominicana 12 13 Junio del 2008 Dra. Leonor Suárez de Cozzarelli Ecuador Instituto Nacional de Higiene y Medicina
Reunión de Autoridades Nacionales Reguladoras Latinoamérica Caribe Santo Domingo-República Dominicana 12 13 Junio del 2008 Dra. Leonor Suárez de Cozzarelli Ecuador Instituto Nacional de Higiene y Medicina
FORTALECIMIENTO DE LA UPSS FARMACIA
 V REUNION TECNICA NACIONAL FORTALECIMIENTO DE LA FARMACIA HOSPITALRIA EN ESTABLECIMIENTOS DEL SECTOR SALUD DEL 22 AL 24 DE OCTUBRE 2014 FORTALECIMIENTO DE LA UPSS FARMACIA Q.F J.VALLOSKA SALCEDO GUEVARA
V REUNION TECNICA NACIONAL FORTALECIMIENTO DE LA FARMACIA HOSPITALRIA EN ESTABLECIMIENTOS DEL SECTOR SALUD DEL 22 AL 24 DE OCTUBRE 2014 FORTALECIMIENTO DE LA UPSS FARMACIA Q.F J.VALLOSKA SALCEDO GUEVARA
Cannabis medicinal y fines científico: PERU Observatorio Peruano de Drogas
 Cannabis medicinal y fines científico: PERU Observatorio Peruano de Drogas 7 de agosto 2018 Ley sobre Drogas: Naciones Unidas Los Tratados proponen requisitos a los países sobre cómo pueden permitir el
Cannabis medicinal y fines científico: PERU Observatorio Peruano de Drogas 7 de agosto 2018 Ley sobre Drogas: Naciones Unidas Los Tratados proponen requisitos a los países sobre cómo pueden permitir el
REGLAMENTO A LA LEY ORGANICA DE SALUD. Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPUBLICA
 REGLAMENTO A LA LEY ORGANICA DE SALUD NORMA: Decreto Ejecutivo 1395 STATUS: Vigente PUBLICADO: Registro Oficial 457 FECHA: 30 de Octubre de 2008 Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPUBLICA
REGLAMENTO A LA LEY ORGANICA DE SALUD NORMA: Decreto Ejecutivo 1395 STATUS: Vigente PUBLICADO: Registro Oficial 457 FECHA: 30 de Octubre de 2008 Rafael Correa Delgado PRESIDENTE CONSTITUCIONAL DE LA REPUBLICA
LIBERACIÓN DE LOTES DE BIOLOGICOS: PARTE FUNDAMENTAL DEL SISTEMA DE VIGILANCIA POSTCOMERCIALIZACION
 LIBERACIÓN DE LOTES DE BIOLOGICOS: PARTE FUNDAMENTAL DEL SISTEMA DE VIGILANCIA POSTCOMERCIALIZACION Palacios, Andreina 1, Ibarz, Ma. Teresa 2, Martínez, Angélica 3, Castro, Verónica 4, Guevara, Amelin
LIBERACIÓN DE LOTES DE BIOLOGICOS: PARTE FUNDAMENTAL DEL SISTEMA DE VIGILANCIA POSTCOMERCIALIZACION Palacios, Andreina 1, Ibarz, Ma. Teresa 2, Martínez, Angélica 3, Castro, Verónica 4, Guevara, Amelin
Política de Acceso a Medicamentos. Indicadores de OMS. Lima 6 al 8 de Abril de Victoria de Urioste. OPS/OMS Subregión Andina
 Reunión de la Comisión Técnica ca Subregional para a Política de Acceso a Medicamentos Indicadores de OMS Lima 6 al 8 de Abril de 2010 Victoria de Urioste Medicamentos y Tecnología en Salud OPS/OMS Subregión
Reunión de la Comisión Técnica ca Subregional para a Política de Acceso a Medicamentos Indicadores de OMS Lima 6 al 8 de Abril de 2010 Victoria de Urioste Medicamentos y Tecnología en Salud OPS/OMS Subregión
1.1.RPM ANMAT ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS ALIMENTOS Y TECNOLOGÍA MEDICA A.- DATOS A COMPLETAR EN EL FORMULARIO.
 DE ESPECIALIDADES MEDICINALES ÍNDICE DE LA PRESENTACIÓN - TEMA / DOCUMENTO A.- DATOS A COMPLETAR EN EL FORMULARIO. 1. DEL SOLICITANTE. 1.1 Carácter. 1.2. Nombre o Razón Social. 1.3. Número de legajo. 1.4.
DE ESPECIALIDADES MEDICINALES ÍNDICE DE LA PRESENTACIÓN - TEMA / DOCUMENTO A.- DATOS A COMPLETAR EN EL FORMULARIO. 1. DEL SOLICITANTE. 1.1 Carácter. 1.2. Nombre o Razón Social. 1.3. Número de legajo. 1.4.
Dirección General de Medicamentos, Insumos y Drogas del MINSA
 Dirección General de Medicamentos, Insumos y Drogas del MINSA JUNIO 2014 Dra. Elvira Rojas Torres Dirección de Acceso y Uso de Medicamentos DIGEMID - Ministerio de Salud. Problemas de ciudadanos y sector
Dirección General de Medicamentos, Insumos y Drogas del MINSA JUNIO 2014 Dra. Elvira Rojas Torres Dirección de Acceso y Uso de Medicamentos DIGEMID - Ministerio de Salud. Problemas de ciudadanos y sector
CERTIFICACIÓN EN BUENAS PRÁCTICAS DE MANUFACTURA EN LABORATORIOS NACIONALES Y EXTRANJEROS
 CERTIFICACIÓN EN BUENAS PRÁCTICAS DE MANUFACTURA EN LABORATORIOS NACIONALES Y EXTRANJEROS Q.F. José Luis Medrano A. Área de Inspección y Control de Laboratorios DIRECTIVA DE CERTIFICACIÓN EN BUENAS PRÁCTICAS
CERTIFICACIÓN EN BUENAS PRÁCTICAS DE MANUFACTURA EN LABORATORIOS NACIONALES Y EXTRANJEROS Q.F. José Luis Medrano A. Área de Inspección y Control de Laboratorios DIRECTIVA DE CERTIFICACIÓN EN BUENAS PRÁCTICAS
SALUD RESOLUCIÓN MINISTERIAL Nº /MINSA. Lima, 2 de marzo de 2015
 El Peruano Jueves 5 de marzo de 2015 547969 SALUD Aprueban Documento Técnico: Manual de Buenas Prácticas de Almacenamiento de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios en Laboratorios,
El Peruano Jueves 5 de marzo de 2015 547969 SALUD Aprueban Documento Técnico: Manual de Buenas Prácticas de Almacenamiento de Productos Farmacéuticos, Dispositivos Médicos y Productos Sanitarios en Laboratorios,
ORGANISMO ANDINO DE SALUD
 REUNIÓN DE LA COMISIÓN TÉCNICA SUBREGIONAL PARA LA POLÍTICA DE ACCESO A MEDICAMENTOS I. INTRODUCCIÓN El acceso a los medicamentos constituye un grave problema de salud pública en los países de la Subregión
REUNIÓN DE LA COMISIÓN TÉCNICA SUBREGIONAL PARA LA POLÍTICA DE ACCESO A MEDICAMENTOS I. INTRODUCCIÓN El acceso a los medicamentos constituye un grave problema de salud pública en los países de la Subregión
QF. CESAR PAVON FABIAN DISA IV LIMA ESTE
 NORMATIVIDAD VIGENTE QUE QUE REGULA LAS ACTIVIDADES DE FARMACOVIGILANCIA Y TECNOVIGILANCIA DE PRODUCTOS FARMACEUTICOS, DISPOSITIVOS MEDICOS Y PRODUCTOS SANITARIOS QF. CESAR PAVON FABIAN DISA IV LIMA ESTE
NORMATIVIDAD VIGENTE QUE QUE REGULA LAS ACTIVIDADES DE FARMACOVIGILANCIA Y TECNOVIGILANCIA DE PRODUCTOS FARMACEUTICOS, DISPOSITIVOS MEDICOS Y PRODUCTOS SANITARIOS QF. CESAR PAVON FABIAN DISA IV LIMA ESTE
LISTADO DE ARANCELES VIGENTES DE MEDICAMENTOS
 LISTADO DE ARANCELES VIGENTES DE MEDICAMENTOS códigos A) ESPECIALIDADES MEDICINALES ARTÍCULO 3º DECRETO Nº 150/92 (T.O. 1993) 1) AUTORIZACIÓN Y/O MODIFICACION 2000 REGISTRO INICIAL (ARTÍCULO 3º) $ 7.100,00
LISTADO DE ARANCELES VIGENTES DE MEDICAMENTOS códigos A) ESPECIALIDADES MEDICINALES ARTÍCULO 3º DECRETO Nº 150/92 (T.O. 1993) 1) AUTORIZACIÓN Y/O MODIFICACION 2000 REGISTRO INICIAL (ARTÍCULO 3º) $ 7.100,00
UNIDAD DE DISPENSACIÓN DE PRODUCTOS EN INVESTIGACION PARA ENSAYOS CLÍNICOS
 UNIDAD DE DISPENSACIÓN DE PRODUCTOS EN INVESTIGACION PARA ENSAYOS CLÍNICOS Q.F. Maria Genoveva Vargas H. Equipo de Farmacoepidemiologia y Farmacovigilancia www.digemid.minsa.gob.pe Calle Coronel Odriozola
UNIDAD DE DISPENSACIÓN DE PRODUCTOS EN INVESTIGACION PARA ENSAYOS CLÍNICOS Q.F. Maria Genoveva Vargas H. Equipo de Farmacoepidemiologia y Farmacovigilancia www.digemid.minsa.gob.pe Calle Coronel Odriozola
AVANCES DE LA MESA DE TRABAJO ENCARGADA DE LA REVISION DE LOS ASPECTOS TECNICOS Y ECONOMICOS DEL MODELO ACTUAL DE MEDICAMENTOS sector privado
 AVANCES DE LA MESA DE TRABAJO ENCARGADA DE LA REVISION DE LOS ASPECTOS TECNICOS Y ECONOMICOS DEL MODELO ACTUAL DE MEDICAMENTOS sector privado Dra. Flor Philipps Superintendente Setiembre 2013 Creación
AVANCES DE LA MESA DE TRABAJO ENCARGADA DE LA REVISION DE LOS ASPECTOS TECNICOS Y ECONOMICOS DEL MODELO ACTUAL DE MEDICAMENTOS sector privado Dra. Flor Philipps Superintendente Setiembre 2013 Creación
Medicamentos en el Sub Sistema Privado de Salud. Dra. Flor de María Philipps Superintendente
 Medicamentos en el Sub Sistema Privado de Salud Dra. Flor de María Philipps Superintendente Abril 2013 El marco regulatorio El rol de las Instituciones en el tema de medicamentos DIGEMID : Órgano técnico-normativo
Medicamentos en el Sub Sistema Privado de Salud Dra. Flor de María Philipps Superintendente Abril 2013 El marco regulatorio El rol de las Instituciones en el tema de medicamentos DIGEMID : Órgano técnico-normativo
PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES. Dr. Leandro Huayanay Falconi Dirección General de Medicamentos, Insumos y Drogas
 PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES Dr. Leandro Huayanay Falconi Dirección General de Medicamentos, Insumos y Drogas INSTITUCIONES Ministerio de Salud Dirección General de Medicamentos,
PETITORIO NACIONAL ÚNICO DE MEDICAMENTOS ESENCIALES Dr. Leandro Huayanay Falconi Dirección General de Medicamentos, Insumos y Drogas INSTITUCIONES Ministerio de Salud Dirección General de Medicamentos,
C.1. ORGANIZACIÓN DEL OBSERVATORIO PERUANO DE MEDICAMENTOS
 C.1. ORGANIZACIÓN DEL OBSERVATORIO PERUANO DE MEDICAMENTOS Lima, 18 Set 2009 www.metaperu.org Producto esperado Organización que oferta servicios de información de precios, disponibilidad y calidad de
C.1. ORGANIZACIÓN DEL OBSERVATORIO PERUANO DE MEDICAMENTOS Lima, 18 Set 2009 www.metaperu.org Producto esperado Organización que oferta servicios de información de precios, disponibilidad y calidad de
Implementación ley de fármacos a un año de su promulgación. Q.F. Sergio Muñoz Quezada, PhD Jefe del Subdepto de farmacia Mayo 2015
 Implementación ley de fármacos a un año de su promulgación Q.F. Sergio Muñoz Quezada, PhD Jefe del Subdepto de farmacia Mayo 2015 Publicación 14 de febrero 2014. 2 Convenio con SEREMIS por 3 años. 3 Visión
Implementación ley de fármacos a un año de su promulgación Q.F. Sergio Muñoz Quezada, PhD Jefe del Subdepto de farmacia Mayo 2015 Publicación 14 de febrero 2014. 2 Convenio con SEREMIS por 3 años. 3 Visión
Reunión Técnica: REVISIÓN Y PROGRAMACIÓN DEL PLAN ANDINO y DE ACCIONES PARA LA PREVENCIÓN DE LA OBESIDAD
 COMITÉ SUBREGIONAL ANDINO PARA LA ERRADICACIÓN DE LA MALNUTRICIÓN INFANTIL Lima, 11 de Mayo 2012 Reunión Técnica: REVISIÓN Y PROGRAMACIÓN DEL PLAN ANDINO y DE ACCIONES PARA LA PREVENCIÓN DE LA OBESIDAD
COMITÉ SUBREGIONAL ANDINO PARA LA ERRADICACIÓN DE LA MALNUTRICIÓN INFANTIL Lima, 11 de Mayo 2012 Reunión Técnica: REVISIÓN Y PROGRAMACIÓN DEL PLAN ANDINO y DE ACCIONES PARA LA PREVENCIÓN DE LA OBESIDAD
DIRECCIONES EJECUTIVAS-DIGEMID 08/05/2014
 AGENDA DE REUNION DE DIRECTORES TECNICOS (Comsalud, Alafarpe, Alafal) - DIRECCIONES EJECUTIVAS-DIGEMID 08/05/2014 1).- INFORME DEL AVANCE DE LA MODIFICATORIA DE LOS D.S.-016-11--SA Y D.S-014-2011-SA, DIGEMID.-Ofreció
AGENDA DE REUNION DE DIRECTORES TECNICOS (Comsalud, Alafarpe, Alafal) - DIRECCIONES EJECUTIVAS-DIGEMID 08/05/2014 1).- INFORME DEL AVANCE DE LA MODIFICATORIA DE LOS D.S.-016-11--SA Y D.S-014-2011-SA, DIGEMID.-Ofreció
DE LA DOCUMENTACION Q.F. MARY RODRIGUEZ AGUILAR
 PROCESO DE CERTIFICACION DE FARMACIAS Y BOTICAS EN BUENAS PRACTICAS DE OFICINA FARMACEUTICA DE LA DOCUMENTACION Q.F. MARY RODRIGUEZ AGUILAR DOCUMENTACION R.M. Nº 585-99-SA-DM (Manual de Buenas Prácticas
PROCESO DE CERTIFICACION DE FARMACIAS Y BOTICAS EN BUENAS PRACTICAS DE OFICINA FARMACEUTICA DE LA DOCUMENTACION Q.F. MARY RODRIGUEZ AGUILAR DOCUMENTACION R.M. Nº 585-99-SA-DM (Manual de Buenas Prácticas
Regulación de Dispositivos Médicos y proyecciones para reactivos de diagnóstico in vitro
 Regulación de Dispositivos Médicos y proyecciones para reactivos de diagnóstico in vitro BQ. María Graciela Rojas Donoso Jefa del Subdepartamento Dispositivos Médicos Agencia Nacional de Medicamentos mrojas@ispch.cl
Regulación de Dispositivos Médicos y proyecciones para reactivos de diagnóstico in vitro BQ. María Graciela Rojas Donoso Jefa del Subdepartamento Dispositivos Médicos Agencia Nacional de Medicamentos mrojas@ispch.cl
INDICADORES DE USO RACIONAL DE MEDICAMENTOS EVALUACIÓN Equipo de Uso Racional de Medicamentos DAUM - DIGEMID
 INDICADORES DE USO RACIONAL DE MEDICAMENTOS EVALUACIÓN 2013 Equipo de Uso Racional de Medicamentos DAUM - DIGEMID POLÍTICA NACIONAL DE MEDICAMENTOS Resolución Ministerial No 1240-2004/MINSA 24 Diciembre
INDICADORES DE USO RACIONAL DE MEDICAMENTOS EVALUACIÓN 2013 Equipo de Uso Racional de Medicamentos DAUM - DIGEMID POLÍTICA NACIONAL DE MEDICAMENTOS Resolución Ministerial No 1240-2004/MINSA 24 Diciembre
Presentación. 1. País: BOLIVIA
 1. País: BOLIVIA Presentación 2. Nombre de la Entidad: Unidad de Medicamentos y Tecnología en Salud (UNIMED) 3. Fecha de creación: 11/07/1978 4. Tipo de entidad gubernamental: Dirección/Unidad de Ministerio
1. País: BOLIVIA Presentación 2. Nombre de la Entidad: Unidad de Medicamentos y Tecnología en Salud (UNIMED) 3. Fecha de creación: 11/07/1978 4. Tipo de entidad gubernamental: Dirección/Unidad de Ministerio
OBSERVATORIO PERUANO DE PRECIOS DE MEDICAMENTOS
 OBSERVATORIO PERUANO DE PRECIOS DE MEDICAMENTOS R.M. Nº 040-2010/MINSA DICTAN NORMAS REFERENTES AL SISTEMA DE INFORMACIÓN DE PRECIOS DE PRODUCTOS FARMACÉUTICOS QUE DEBEN SER PROPORCIONADA POR LOS ESTABLECIMIENTOS
OBSERVATORIO PERUANO DE PRECIOS DE MEDICAMENTOS R.M. Nº 040-2010/MINSA DICTAN NORMAS REFERENTES AL SISTEMA DE INFORMACIÓN DE PRECIOS DE PRODUCTOS FARMACÉUTICOS QUE DEBEN SER PROPORCIONADA POR LOS ESTABLECIMIENTOS
Política de Medicamentos de Centroamérica y República Dominicana Antecedentes. Licda. Juana M. de Rodríguez Asesora Subregional Medicamentos OPS/OMS
 Política de Medicamentos de Centroamérica y República Dominicana Antecedentes Licda. Juana M. de Rodríguez Asesora Subregional Medicamentos OPS/OMS La Política de Medicamentos de Centroamérica y República
Política de Medicamentos de Centroamérica y República Dominicana Antecedentes Licda. Juana M. de Rodríguez Asesora Subregional Medicamentos OPS/OMS La Política de Medicamentos de Centroamérica y República
ADQUISICIÓN DE MEDICAMENTOS Y DISPOSITIVOS MÉDICOS
 Página 1 de 10 Página 2 de 10 1. OBJETIVO Describir el proceso de Adquisición de insumos medico quirúrgicos, dispositivos médicos y medicamentos, requeridos para la prestación de cada uno de los servicios
Página 1 de 10 Página 2 de 10 1. OBJETIVO Describir el proceso de Adquisición de insumos medico quirúrgicos, dispositivos médicos y medicamentos, requeridos para la prestación de cada uno de los servicios
FORTALECIMIENTO DE AUTORIDADES SANITARIAS Y DEL MARCO NORMATIVO Y REGULATORIO PARA LA EVALUACIÓN Y ACCESO A TECNOLOGIAS DE SALUD.
 Ministerio de Salud FORTALECIMIENTO DE AUTORIDADES SANITARIAS Y DEL MARCO NORMATIVO Y REGULATORIO PARA LA EVALUACIÓN Y ACCESO A TECNOLOGIAS DE SALUD. MINSAL EL SALVADOR Antigua Guatemala, julio 2013 1
Ministerio de Salud FORTALECIMIENTO DE AUTORIDADES SANITARIAS Y DEL MARCO NORMATIVO Y REGULATORIO PARA LA EVALUACIÓN Y ACCESO A TECNOLOGIAS DE SALUD. MINSAL EL SALVADOR Antigua Guatemala, julio 2013 1
Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana
 Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana Dialogo con las Agencias Regulatorias Extranjeras Bio Latin America Mercedes Soriano 26 de octubre 2016 São Paulo,
Dirección General de Medicamentos, Alimentos y Productos Sanitarios, República Dominicana Dialogo con las Agencias Regulatorias Extranjeras Bio Latin America Mercedes Soriano 26 de octubre 2016 São Paulo,
Situación de la regulación de los dispositivos médicos en las Américas
 VIII Conferencia Panamericana para la Armonización de la Reglamentación Farmacéutica (CPARF) México. 19 al 21 de octubre de 2016 Situación de la regulación de los dispositivos médicos en las Américas Ing.
VIII Conferencia Panamericana para la Armonización de la Reglamentación Farmacéutica (CPARF) México. 19 al 21 de octubre de 2016 Situación de la regulación de los dispositivos médicos en las Américas Ing.
Entidades de distribución Entidades de intermediación
 Entidades de distribución Entidades de intermediación M Luisa Tarno DICM AEMPS 17/12/2013 Índice Requisitos Funciones Obligaciones Marco legal anterior Ley 29/2006,de 26 de julio, de garantías y uso racional
Entidades de distribución Entidades de intermediación M Luisa Tarno DICM AEMPS 17/12/2013 Índice Requisitos Funciones Obligaciones Marco legal anterior Ley 29/2006,de 26 de julio, de garantías y uso racional
NORMATIVA SANITARIA PARA DONACIONES DE MEDICAMENTOS CONSUMO HUMANO
 NORMATIVA SANITARIA PARA DONACIONES DE MEDICAMENTOS CONSUMO HUMANO Resolución 14 Registro Oficial 759 de 20-may.-2016 Estado: Vigente No. ARCSA-DE-014-2016-GGG LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL
NORMATIVA SANITARIA PARA DONACIONES DE MEDICAMENTOS CONSUMO HUMANO Resolución 14 Registro Oficial 759 de 20-may.-2016 Estado: Vigente No. ARCSA-DE-014-2016-GGG LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL
Análisis del Contexto Social para el desarrollo de la Farmacia en el Perú
 Análisis del Contexto Social para el desarrollo de la Farmacia en el Perú Q.F. Gisela Espejo Yep Sub Gerente de Farmacia 02. Mayo.2013 Nuestros Pacientes Primero Clínica Internacional Farmacia en Clínica
Análisis del Contexto Social para el desarrollo de la Farmacia en el Perú Q.F. Gisela Espejo Yep Sub Gerente de Farmacia 02. Mayo.2013 Nuestros Pacientes Primero Clínica Internacional Farmacia en Clínica
SITUACIÓN ACTUAL DE LA GESTIÓN DEL SISTEMA DE SUMINISTRO DE PRODUCTOS FARMACEUTICOS, DISPOSITIVOS MEDICOS Y PRODUCTOS SANITARIOS
 Dirección Ejecutiva de Atención Integral de Salud. Dirección de Medicamentos, Insumos y Drogas SITUACIÓN ACTUAL DE LA GESTIÓN DEL SISTEMA DE SUMINISTRO DE PRODUCTOS FARMACEUTICOS, DISPOSITIVOS MEDICOS
Dirección Ejecutiva de Atención Integral de Salud. Dirección de Medicamentos, Insumos y Drogas SITUACIÓN ACTUAL DE LA GESTIÓN DEL SISTEMA DE SUMINISTRO DE PRODUCTOS FARMACEUTICOS, DISPOSITIVOS MEDICOS
PROCEDIMIENTO COMERCIALIZACION MEDICAMENTOS EN GENERAL Y BIOLOGICOS
 PROCEDIMIENTO COMERCIALIZACION MEDICAMENTOS EN GENERAL Y BIOLOGICOS Resolución 56 Registro Oficial 609 de 16-oct.-2015 Estado: Vigente No. ARCSA-DE-056-2015-GGG LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL
PROCEDIMIENTO COMERCIALIZACION MEDICAMENTOS EN GENERAL Y BIOLOGICOS Resolución 56 Registro Oficial 609 de 16-oct.-2015 Estado: Vigente No. ARCSA-DE-056-2015-GGG LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL
Unidad Productora de Servicios de Farmacia (Propuesta)
 Norma Técnica: Unidad Productora de Servicios de Farmacia (Propuesta) Q.F. Susana Vásquez Lezcano Equipo de Uso Racional lde Medicamentos Dirección de Acceso y Uso de Medicamentos MINISTERIO DE SALUD Modernización
Norma Técnica: Unidad Productora de Servicios de Farmacia (Propuesta) Q.F. Susana Vásquez Lezcano Equipo de Uso Racional lde Medicamentos Dirección de Acceso y Uso de Medicamentos MINISTERIO DE SALUD Modernización
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH
 REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH REGLAMENTO DEL FORMULARIO NACIONAL DE MEDICAMENTOS DECRETO N 264/03 Publicado en el Diario Oficial de 16 de marzo de 2004 REPUBLICA
REPUBLICA DE CHILE MINISTERIO DE SALUD DPTO. ASESORIA JURIDICA FMP/ARC/AMSCH REGLAMENTO DEL FORMULARIO NACIONAL DE MEDICAMENTOS DECRETO N 264/03 Publicado en el Diario Oficial de 16 de marzo de 2004 REPUBLICA
PROCESO PARA LA APROBACIÓN REGULATORIA Y DONACIONES DE TECNOLOGÍAS SANITARIAS EN CASO
 PROCESO PARA LA APROBACIÓN REGULATORIA Y DONACIONES DE TECNOLOGÍAS SANITARIAS EN CASO DE EMERGENCIA Y SITUACIONES ESPECIALES: DE MEDICAMENTOS, VACUNAS Y ENSAYOS CLÍNICOS Y PARA LA APROBACIÓN DE URGENCIA
PROCESO PARA LA APROBACIÓN REGULATORIA Y DONACIONES DE TECNOLOGÍAS SANITARIAS EN CASO DE EMERGENCIA Y SITUACIONES ESPECIALES: DE MEDICAMENTOS, VACUNAS Y ENSAYOS CLÍNICOS Y PARA LA APROBACIÓN DE URGENCIA
REAL DECRETO 2208/1994, DE 16 DE NOVIEMBRE, POR EL QUE SE REGULAN LOS MEDICAMENTOS HOMEOPATICOS DE USO HUMANO DE FABRICACION INDUSTRIAL
 REAL DECRETO 2208/1994, DE 16 DE NOVIEMBRE, POR EL QUE SE REGULAN LOS MEDICAMENTOS HOMEOPATICOS DE USO HUMANO DE FABRICACION INDUSTRIAL (BOE núm. 284, de 28 noviembre [RCL 1994, 3288]) Editorial Aranzadi
REAL DECRETO 2208/1994, DE 16 DE NOVIEMBRE, POR EL QUE SE REGULAN LOS MEDICAMENTOS HOMEOPATICOS DE USO HUMANO DE FABRICACION INDUSTRIAL (BOE núm. 284, de 28 noviembre [RCL 1994, 3288]) Editorial Aranzadi
Colegio Químico Farmacéutico Departamental de Lima PLAN TACTICO - OPERATIVO
 Asesoría legal permanente a los agremiados en temas laborales Exigencia y vigilancia del cumplimiento de normas vigentes en aspectos laborales, tecnicos y desarrollo profesional a los agremiados. Suscripción
Asesoría legal permanente a los agremiados en temas laborales Exigencia y vigilancia del cumplimiento de normas vigentes en aspectos laborales, tecnicos y desarrollo profesional a los agremiados. Suscripción
Función comercial. Función asistencial RELACIÓN CON EL PACIENTE RELACIÓN CON EL CLIENTE
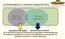 Función comercial Función asistencial RELACIÓN CON EL CLIENTE RELACIÓN CON EL PACIENTE MANUAL DE BUENAS PRÁCTICAS DE DISPENSACIÓN R. M. N 013-2009-MINSA Q.F. DANIEL CESAR GUERRA TUDELA SUPERVISOR II DEMID
Función comercial Función asistencial RELACIÓN CON EL CLIENTE RELACIÓN CON EL PACIENTE MANUAL DE BUENAS PRÁCTICAS DE DISPENSACIÓN R. M. N 013-2009-MINSA Q.F. DANIEL CESAR GUERRA TUDELA SUPERVISOR II DEMID
PROCESO DE CERTIFICACION DE FARMACIAS Y BOTICAS EN BUENAS PRACTICAS DE OFICINA FARMACEUTICA DISA II LIMA SUR
 PROCESO DE CERTIFICACION DE FARMACIAS Y BOTICAS EN BUENAS PRACTICAS DE OFICINA FARMACEUTICA DISA II LIMA SUR Q.F. VICKY FLORES VALENZUELA Directora Ejecutiva DEMID MAYO 2016 NORMAS LEGALES Ley Nº 29459,
PROCESO DE CERTIFICACION DE FARMACIAS Y BOTICAS EN BUENAS PRACTICAS DE OFICINA FARMACEUTICA DISA II LIMA SUR Q.F. VICKY FLORES VALENZUELA Directora Ejecutiva DEMID MAYO 2016 NORMAS LEGALES Ley Nº 29459,
LEGISLACIÓN, DEONTOLOGÍA Y GESTIÓN FARMACÉUTICA CURSO
 LEGISLACIÓN, DEONTOLOGÍA Y GESTIÓN FARMACÉUTICA CURSO 2014-2015 Departamento de Farmacia y Tecnología Farmacéutica Facultad de Farmacia. Universidad de Granada Profesorado responsable: Sección de Historia
LEGISLACIÓN, DEONTOLOGÍA Y GESTIÓN FARMACÉUTICA CURSO 2014-2015 Departamento de Farmacia y Tecnología Farmacéutica Facultad de Farmacia. Universidad de Granada Profesorado responsable: Sección de Historia
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España
 Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
Conceptos Jurídicos y Normativa sobre las RAM de uso humano en España Vamos a realizar una muy breve aproximación a conceptos jurídicos y normativa asociada a las Reacciones Adversas a los Medicamentos
IX Reunión Anual de Evaluación XIV Reunión de Coordinación Iniciativa Amazónica Contra la Malaria
 IX Reunión Anual de Evaluación XIV Reunión de Coordinación Iniciativa Amazónica Contra la Malaria Asistencia técnica en gestión de suministro de medicamentos e insumos para el control de la malaria Santa
IX Reunión Anual de Evaluación XIV Reunión de Coordinación Iniciativa Amazónica Contra la Malaria Asistencia técnica en gestión de suministro de medicamentos e insumos para el control de la malaria Santa
Registro Sanitario. Ministerio de Salud y Deportes
 Registro Sanitario Ministerio de Salud y Deportes Ley del Medicamento No. 1737 17 de diciembre de 1996 Definición Se entiende por registro sanitario, el procedimiento por el cual un producto farmacéutico
Registro Sanitario Ministerio de Salud y Deportes Ley del Medicamento No. 1737 17 de diciembre de 1996 Definición Se entiende por registro sanitario, el procedimiento por el cual un producto farmacéutico
RESOLUCIÓN ARCSA-DE FMRH LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL DE REGULACIÓN, CONTROL Y VIGILANCIA SANITARIA- ARCSA CONSIDERANDO
 RESOLUCIÓN ARCSA-DE-033-2017-FMRH LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL DE REGULACIÓN, CONTROL Y VIGILANCIA SANITARIA- ARCSA CONSIDERANDO Que, la Constitución de la República del Ecuador en su
RESOLUCIÓN ARCSA-DE-033-2017-FMRH LA DIRECCION EJECUTIVA DE LA AGENCIA NACIONAL DE REGULACIÓN, CONTROL Y VIGILANCIA SANITARIA- ARCSA CONSIDERANDO Que, la Constitución de la República del Ecuador en su
1. NOMBRE CONCENTRACION 2. R.S.N 3. ORIGEN. Artículo Nº DOMICILIO LEGAL AV./Calle/Jr. 11. Nº 12. R.U.C. N
 MINISTERIO DE SALUD SOLICITUD-DECLARACIÓN JURADA PARA EL REGISTRO SANITARIO DE OTROS PRODUCTOS FARMACEUTICOS DISTINTOS A MEDICAMENTOS CERTIFICADO DE LIBRE COMERCIALIZACION CERTIFICADO DE CONSUMO DIRECCIÓN
MINISTERIO DE SALUD SOLICITUD-DECLARACIÓN JURADA PARA EL REGISTRO SANITARIO DE OTROS PRODUCTOS FARMACEUTICOS DISTINTOS A MEDICAMENTOS CERTIFICADO DE LIBRE COMERCIALIZACION CERTIFICADO DE CONSUMO DIRECCIÓN
DISPENSACION, DISTRIBUCION Y UTILIZACION DE MEDICAMENTOS DRA. MONICA RAMOS CH.
 DISPENSACION, DISTRIBUCION Y UTILIZACION DE MEDICAMENTOS DRA. MONICA RAMOS CH. Es el acto profesional farmacéutico de proporcionar uno o más medicamentos a un paciente o al profesional responsable de su
DISPENSACION, DISTRIBUCION Y UTILIZACION DE MEDICAMENTOS DRA. MONICA RAMOS CH. Es el acto profesional farmacéutico de proporcionar uno o más medicamentos a un paciente o al profesional responsable de su
ANEXO DE LA CIRCULAR SUNAT/A
 ANEXO DE LA CIRCULAR 001-2011-SUNAT/A Actualizado al 17 de febrero del 2011 Ítem Entidad Competente 1 MTC 2 MTC 3 PRODUCE 4 DIGESA Denominación del Procedimiento Permisos de internamiento definitivo de
ANEXO DE LA CIRCULAR 001-2011-SUNAT/A Actualizado al 17 de febrero del 2011 Ítem Entidad Competente 1 MTC 2 MTC 3 PRODUCE 4 DIGESA Denominación del Procedimiento Permisos de internamiento definitivo de
«LA MEJOR TERAPIA ES DAR INFORMACIÓN AL PACIENTE Y CREAR UNA NUEVA RELACIÓN MÉDICO FARMACÉUTICO - PACIENTE» (O.M.S.1995)
 CONTENIDO 1. Perfil ocupacional del Tecnólogo en Regencia de Farmacia 1.2. Campo del ejercicio profesional 1.3. Requisitos para el ejercicio profesional 2. Competencias del programa Tecnología en Regencia
CONTENIDO 1. Perfil ocupacional del Tecnólogo en Regencia de Farmacia 1.2. Campo del ejercicio profesional 1.3. Requisitos para el ejercicio profesional 2. Competencias del programa Tecnología en Regencia
LA SALUD EN EL PERÚ. Premisas para colocar a las personas en el centro del debate sobre el sector
 LA SALUD EN EL PERÚ Premisas para colocar a las personas en el centro del debate sobre el sector Premisas para una política de salud centrada en las personas Introducción La salud es un derecho universal
LA SALUD EN EL PERÚ Premisas para colocar a las personas en el centro del debate sobre el sector Premisas para una política de salud centrada en las personas Introducción La salud es un derecho universal
Plantilla para la Identificación de la Información. Instituto Nacional de Vigilancia de Medicamentos y Alimentos Salud y Protección Social
 Direcciones de Medicamentos y, Alimentos y Bebidas, Dispositivos Médicos y Otra tecnologías y Cosméticos, Nombre de la DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS Instituciones Certificadas en Buenas
Direcciones de Medicamentos y, Alimentos y Bebidas, Dispositivos Médicos y Otra tecnologías y Cosméticos, Nombre de la DIRECCIÓN DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS Instituciones Certificadas en Buenas
III. FECHA 14 al 16 de diciembre de Quito, Ecuador
 III Reunión Subregional de la Red Suramericana de Vigilancia y Respuesta en Salud de UNASUR IX Foro Andino de Vigilancia Epidemiológica y Salud en las Fronteras I. PROPÓSITO Contribuir en la consolidación
III Reunión Subregional de la Red Suramericana de Vigilancia y Respuesta en Salud de UNASUR IX Foro Andino de Vigilancia Epidemiológica y Salud en las Fronteras I. PROPÓSITO Contribuir en la consolidación
l futuro de la regulación de medicamentos y dispositivos médicos en Colombia Javier Guzman Cruz Director General INVIMA
 l futuro de la regulación de medicamentos y dispositivos médicos en Colombia Javier Guzman Cruz Director General INVIMA INVIMA Fecha de inicio de labores: 01 Feb 1995 Funcionarios: 1320 Presupuesto anual:
l futuro de la regulación de medicamentos y dispositivos médicos en Colombia Javier Guzman Cruz Director General INVIMA INVIMA Fecha de inicio de labores: 01 Feb 1995 Funcionarios: 1320 Presupuesto anual:
TEMARIO QUIMICA Y FARMACIA 2017
 TEMARIO QUIMICA Y FARMACIA 2017 1. MEDICAMENTOS Origen, características, presentación y dispensaciones que no necesitan receta médica. 2. DISPENSACIÓN DE MEDICAMENTOS CON PRESCRIPCIÓN MÉDICA. Vías de administración
TEMARIO QUIMICA Y FARMACIA 2017 1. MEDICAMENTOS Origen, características, presentación y dispensaciones que no necesitan receta médica. 2. DISPENSACIÓN DE MEDICAMENTOS CON PRESCRIPCIÓN MÉDICA. Vías de administración
