Trabajo Práctico Nº 1. CONTROL MICROBIOLÓGICO DE MATERIAS PRIMAS Y PRODUCTOS FARMACÉUTICOS NO ESTÉRILES Fundamento
|
|
|
- Raúl Maestre Caballero
- hace 7 años
- Vistas:
Transcripción
1 Introducción Objetivo Trabajo Práctico Nº 1 CONTROL MICROBIOLÓGICO DE MATERIAS PRIMAS Y PRODUCTOS FARMACÉUTICOS NO ESTÉRILES Fundamento Materiales Procedimiento Resultados Conclusiones Actividades adicionales Bibliografía INTRODUCCIÓN Los productos no estériles son susceptibles de contaminarse con microorganismos tales como bacterias, mohos y levaduras durante el proceso de manufactura: pesada, fabricación, llenado, almacenamiento, así como durante su uso. La contaminación de los productos farmacéuticos, puede tener el potencial de reducir o inactivar la actividad terapéutica del principio activo y por ende representar un riesgo para la salud del paciente; adicionalmente la presencia de estos microorganismos dependiendo de su patogenicidad puede ocasionar infecciones o enfermedades que afecten al paciente o consumidor. Por otra parte, el deterioro microbiano podría conllevar a cambios en las características físicas y químicas que conducirían a que el producto deteriorado no sea apto para ser usado, afectando con ello la imagen del laboratorio productor. Es por ello, que las materias primas y los productos farmacéuticos terminados, deben ser sometidos a un análisis microbiológico que demuestre que cumplen con las especificaciones establecidas por los organismos oficiales, para garantizar que los productos son adecuados para el uso al que están destinados.
2 Este análisis o control microbiológico de las materias primas y de los productos o medicamentos no estériles, involucra la realización de dos tipos de ensayos: a. Recuentos microbianos, referidos básicamente al recuento total de microorganismos aerobios y el recuento total de mohos y levaduras. b. Investigación de microorganismos específicos: bacterias Gram negativas tolerantes a bilis, Escherichia coli, Salmonella, Pseudomonas aeruginosa, Staphylococcus aureus, Clostridium, y Candida albicans. OBJETIVO Al finalizar el trabajo práctico, el estudiante estará en capacidad, mediante la consulta bibliográfica y la aplicación de las técnicas microbiológicas, de realizar el control microbiológico de materias primas y productos farmacéuticos no estériles, utilizando metodologías oficiales (USP). FUNDAMENTO Estas pruebas se basan en la capacidad de determinar la presencia de microorganismos a través del uso de medios de cultivo: nutritivos, de enriquecimiento, selectivos y/o diferenciales, capaces de permitir su recuperación a partir de materias primas o productos no estériles y/o de evidenciar ciertas características bioquímicas, producto del metabolismo de los diferentes microorganismos a investigar. 1. Recuento de microorganismos aerobios totales. Recuento en placa (Método del vaciado en placa o siembra en profundidad). MATERIALES Muestras a analizar (materias primas y/o medicamentos) Placas estériles Pipetas estériles de 1 ml y de 10 ml Propipetas Cintas indicadoras de ph Pipetas Pasteur Tubos de agar soya-caseína fundido y enfriado a 45-50ºC Frascos de dilución con buffer fosfato ph 7,2 Baño de María a 45-50ºC Estufa o incubadora a 32,5 ± 2,5º C Contador de colonias PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 estéril. Agitar el frasco vigorosamente (25 veces) o hasta homogenizar. Rotular
3 2. Con una pipeta Pasteur y con el uso de las tiras indicadoras de ph determinar el ph de la dilución anterior. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 10 ml de la dilución 10-1 a un frasco de dilución con 90 ml de buffer fosfato ph 7,2 estéril. Agitar. Rotular Transferir con una pipeta estéril, 10 ml de la dilución 10-2 a un frasco de dilución con 90 ml de buffer fosfato ph 7,2 estéril. Agitar. Rotular Con una pipeta estéril, transferir porciones de 1 ml de la dilución 10-1 a cada una de 2 placas de Petri estériles. 6. Con una pipeta estéril, transferir porciones de 1 ml de la dilución 10-2 a cada una de 2 placas de Petri estériles. 7. Con una pipeta estéril, transferir porciones de 1 ml de la dilución 10-3 a cada una de 2 placas de Petri estériles. 8. Verter en cada una de las placas, 15 ml de Agar Soya Caseína, fundido y enfriado a 45ºC, mezclando cuidadosamente las muestras con el agar. Dejar solidificar e incubar en posición invertida a 32,5 ± 2,5º C por 3 a 5 días. Esquema para el Recuento de Microorganismos Aerobios Totales. 1. 3
4 RESULTADOS Seleccionar aquellas placas con el número más alto de ufc, pero menor de 250 ufc por placa. Contar el número de colonias en las placas seleccionadas usando el contador de colonias. Calcular el número de microorganismos viables por ml de muestra, expresado como unidades formadoras de colonias por ml (ufc/ml) (ver Anexo de notación científica y diluciones). Anotar los resultados: Placa 1: Placa 2: Promedio: Factor de dilución correspondiente a las placas seleccionadas: Número de ufc/ml de muestra: CONCLUSIONES 2. Recuento Total de Mohos y Levaduras. Recuento en placa (Método del vaciado en placas o siembra en profundidad) MATERIALES Muestras a analizar: (materias primas y/o medicamentos) Placas estériles Pipetas estériles de 1 ml y 10 ml Propipetas Cintas indicadoras de ph Pipetas Pasteur Tubos de agar Sabouraud Dextrosa fundido y enfriado a 45-50ºC. Frascos de dilución con buffer fosfato ph 7,2 Mechero Baño de María a 45-50ºC Estufa o incubadora a 22,5 ± 2,5º C Contador de colonias 1. 4
5 PROCEDIMIENTO Proceder de la misma forma descrita para el Recuento de Microorganismos Aerobios Totales, pero utilizando Agar Sabouraud Dextrosa, en vez de Agar Soya Caseína, e incubar las placas (sin invertir) a 22,5 ± 2,5º C por 5 a 7 días. RESULTADOS Seleccionar aquellas placas con el número más alto de ufc, pero menor de 50 ufc por placa. Contar el número de colonias en las placas seleccionadas usando el contador de colonias. Calcular el número de microorganismos viables por ml de muestra, expresado como unidades formadoras de colonias por ml (ufc/ml) (ver Anexo de notación científica y diluciones). Anotar los resultados: Placa 1: Placa 2: Promedio: Factor de dilución correspondiente a las placas seleccionadas: Número de ufc/ml de muestra: CONCLUSIONES 3. Investigación de Microorganismos Específicos 3.a. Investigación de bacterias Gram negativas tolerantes a bilis Pipetas de 10 ml Propipetas Placas estériles Cintas indicadoras de ph Pipetas Pasteur Caldo Soya Caseína Caldo Mossel para Enriquecimiento de Enterobacterias (90mL) Estufa o incubadora a 22,5 ± 2,5º C Estufa o incubadora a 32,5 ± 2,5º C Asa de platino Agar Violeta Rojo Bilis Glucosa 1. 5
6 Mechero PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un balón o fiola que contiene 90 ml de Caldo Soya Caseína (CSC) y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Incubar a 22,5 ± 2,5º C por un periodo de 2 a 5 horas. 4. Agitar la mezcla incubada (CSC) y transferir 10mL a un balón o fiola con 90 ml de Caldo Mossel para Enriquecimiento de Enterobacterias (CMEE). Incubar a 32,5 ± 2,5º C por 24 a 48 horas. Aislamiento de bacterias Gram negativas tolerantes a bilis 5. Agitar la mezcla incubada (CMEE) y con el uso del asa hacer un aislamiento a partir del Caldo Mossel para Enriquecimiento de Enterobacterias al Agar Violeta Rojo Bilis Glucosa. Incubar a 32,5 ± 2,5º C por horas. Si no hay crecimiento, la muestra cumple los requisitos en cuanto ausencia de bacterias Gram negativas tolerantes a bilis. 3.b. Investigación de Escherichia coli MATERIALES Pipetas de 10 ml y de 1 ml Propipetas Placas estériles Tiras indicadoras de ph Pipetas Pasteur Buffer fosfato ph 7,2 Caldo Soya Caseína Caldo MacConkey Agar MacConkey 1. 6
7 Agar soya Caseína Agar Triple Azúcar Hierro (TSI) Asa y filamento de platino Mechero Equipo para coloración de Gram Estufa a 32,5 ± 2,5º C Estufa a 42-44º C PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 10 ml de la mezcla anterior a un balón o fiola que contiene 90 ml de Caldo Soya Caseína y agitar. 4. Incubar a 32,5 ± 2,5º C por 18 a 24 horas. 5. Agitar la mezcla anterior (CSC) y transferir 1 ml a un balón o fiola con 100 ml de Caldo MacConkey (CMcC). Incubar a 42-44º C por horas. Aislamiento de E. coli. 6. Agitar la mezcla incubada (CMcC) y con el uso del asa hacer un aislamiento a partir del Caldo MacConkey a una placa con Agar MacConkey. Incubar a 32,5 ± 2,5º C por horas. 7. El crecimiento de colonias indica la posible presencia de E.coli. Las colonias de coliformes en agar MacConkey son de color rojo ladrillo, eventualmente rodeadas de zonas de bilis precipitada. 8. Si no hay colonias típicas, la muestra cumple los requisitos en cuanto a ausencia de coliformes. 9. Si hay colonias típicas, transplantar una de ellas a un tubo con Agar Soya Caseína inclinado. Incubar a 32,5 ± 2,5º C por horas. 10. Hacer una coloración de Gram: E. coli es un bacilo Gram negativo. 11. Transferir el crecimiento de Agar Soya Caseína a un tubo con agar TSI. Incubar a 32,5 ± 2,5º C por 24 horas. Los cultivos típicos de E. coli en agar TSI presentan el bisel y el taco amarillo, sin oscurecimiento y con formación de gas. 1. 7
8 Lactosa positivo Bisel Taco Lactosa negativo H 2 S positivo Agar TSI (sin inocular) Glucosa positivo 12. Confirmar la presencia de E. coli por medio de pruebas bioquímicas adicionales como por ejemplo el Test del IMViC, o utilizando sistemas miniaturizados tales como API o MicroID. 3.c. Investigación de Salmonella (género) MATERIALES Pipetas de 10 ml y de 1 ml Propipetas Placas estériles Tiras indicadoras de ph Pipetas Pasteur Buffer fosfato ph 7,2 Caldo Soya Caseína Caldo de Enriquecimiento para Salmonella Rappaport Vassiliadis Agar Desoxicolato Lisina Xilosa (XLD) Agar Soya Caseína Agar Triple Azúcar Hierro (TSI) Asa y filamento de platino Mechero Equipo para coloración de Gram Estufa a 32,5 ± 2,5º C PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 10 ml de la mezcla anterior a un balón o fiola que contiene 90 ml de Caldo Soya Caseína (CSC) y agitar. 4. Incubar a 32,5 ± 2,5º C por 18 a 24 horas. 1. 8
9 5. Agitar la mezcla incubada (CSC) y transferir 0,1 ml a un tubo con 10 ml de Caldo de Enriquecimiento para Salmonella Rappaport Vassiliadis (CESRV). Incubar a 32,5 ± 2,5 º C por horas. Aislamiento de Salmonella 6. Agitar la mezcla incubada (CESRV) y con el uso del asa hacer un aislamiento en Agar Desoxicolato Lisina Xilosa. Incubar a 32,5 ± 2,5º C por horas. 7. Notar la presencia de colonias típicas del género Salmonella: Colonias rojas con o sin. 8. Si no hay colonias típicas, la muestra cumple los requisitos en cuanto a ausencia de Salmonella. 9. Si se encuentran colonias típicas, transferir una de ellas a un tubo con Agar Soya Caseína inclinado. Incubar a 32,5 ± 2,5º C por horas. 10. Hacer una coloración de Gram: los miembros del género Salmonella, son bacilos Gram negativos. 11. Transferir el crecimiento de Agar Soya Caseína a un tubo con agar TSI. Incubar a 32,5 ± 2,5º C por 24 horas. Los cultivos típicos de Salmonella en agar TSI presentan el taco amarillo (formación de ácido) y el bisel rojo (alcalino), con o sin oscurecimiento y/o con formación de gas. Bisel Taco Agar TSI (sin inocular) Salmonella en agar TSI Lactosa negativo H 2 S positivo Glucosa positivo 1. 9
10 12. Confirmar la presencia de Salmonella por pruebas bioquímicas convencionales y/o por sistemas miniaturizados tales como API o MicroID y mediante pruebas serológicas. 3. d. Investigación de Pseudomonas aeruginosa MATERIALES Pipetas de 10 ml Propipetas Placas estériles Tiras indicadoras de ph Pipetas Pasteur Buffer fosfato ph 7,2 Caldo Soya Caseína Agar Soya Caseína Agar Cetrimide Papel de filtro Reactivo Taxo N (p-aminodimetilanilina clorhidrato) Asa y filamento Mechero Equipo para coloración de Gram Estufa o incubadora a 32,5 ± 2,5º C PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 10 ml de la mezcla anterior a un balón o fiola que contiene 90 ml de Caldo Soya Caseína (CSC) y agitar. 4. Incubar a 32,5 ± 2,5º C por 18 a 24 horas. Aislamiento de Pseudomonas aeruginosa. 5. Agitar la mezcla incubada (CSC) y con el uso del asa hacer un aislamiento a Agar Cetrimide. Incubar a 32,5 ± 2,5º C por horas. 6. Las colonias típicas de Pseudomonas aeruginosa en Agar Cetrimide son pequeñas, generalmente de color verdoso, con fluorescencia verdosa a la luz ultravioleta
11 7. Si no hay colonias típicas, la muestra cumple el requisito en cuanto a ausencia de Ps. aeruginosa. 8. Si hay colonias típicas, transferir una de ellas a un tubo de Agar Soya Caseína inclinado. Incubar a 32,5 ± 2,5º C por horas. 9. A partir del Agar Soya Caseína hacer una coloración de Gram: la Ps. aeruginosa es un bacilo Gram negativo. 10. Realizar la prueba de oxidasa a partir del cultivo puro: En una placa de Petri colocar un disco de papel de filtro. Impregnar con el reactivo Taxo N y dejarlo secar en la estufa. Con una pipeta Pasteur estéril con la punta cerrada, transferir una pequeña cantidad del cultivo del tubo de agar inclinado, al papel de filtro. El desarrollo de un color rosado, casi púrpura, se considera una prueba de oxidasa positiva. Oxidasa positiva Si la prueba de oxidasa es negativa, la muestra cumple el requisito en cuanto a ausencia de Ps. aeruginosa. Oxidasa negativa 11. Si la prueba de oxidasa es positiva, la presencia de Ps.aeruginosa debe confirmarse por pruebas bioquímicas adicionales. 12. Realizar la prueba de crecimiento a 42º C: 1. 11
12 Inocular un tubo de Agar Soya Caseína con el cultivo puro, e incubar en la estufa a una temperatura de 42º C por horas. La Ps.aeruginosa es capaz de crecer a esta temperatura y es una prueba adicional para su identificación. 13. Confirmar la presencia de Ps.aeruginosa por pruebas bioquímicas convencionales y/o por sistemas miniaturizados tales como API 3.e. Investigación de Staphylococcus aureus. MATERIALES Pipetas de 10 ml Propipetas Placas estériles Tiras indicadoras de ph Pipetas Pasteur Buffer fosfato ph 7,2 Caldo Soya Caseína Agar Manitol Sal Agar Soya Caseína Plasma EDTA (para coagulasa) Caldo Cerebro Corazón Baño de María a 37º ± 1º C Asa y filamento Mechero Equipo para coloración de Gram Estufa o incubadora a 32,5 ± 2,5º C PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 10 ml de la mezcla anterior a un balón o fiola que contiene 90 ml de Caldo Soya Caseína (CSC) y agitar. 4. Incubar a 32,5 ± 2,5º C por 18 a 24 horas Aislamiento de Staphylococcus aureus 5. Agitar la mezcla incubada (CSC) y mediante un asa hacer aislamiento a Agar Manitol Sal. Incubar a 32,5 ± 2,5º C por horas
13 6. La posible presencia de colonias típicas de S.aureus en Agar Manitol Sal, se observan como colonias amarillas o blancas, rodeadas por una zona amarilla. 7. Si no hay colonias típicas, la muestra cumple el requisito en cuanto a ausencia de Staphylococcus aureus. 8. Si hay colonias típicas, con ayuda de un filamento, transferir una de ellas a un tubo de Agar Soya Caseína inclinado. Incubar a 32,5 ± 2,5º C por horas. 9. A partir del tubo de Agar Soya Caseína, hacer coloración de Gram: el S. aureus es un coco Gram positivo. Preparar un cultivo en Caldo Cerebro Corazón. Incubar a 32,5 ± 2,5º C por 24 horas. 10. Realizar la prueba de coagulasa de la siguiente forma: En un tubo de Wassermann colocar 0,5 ml de Plasma EDTA (para coagulasa); añadir 2 gotas (0,1 ml) del cultivo del microorganismo cultivado en Caldo Cerebro Corazón. Incubar en baño de agua a 37 ± 1º C, durante 4 horas. Examinar al cabo de este tiempo y luego periódicamente durante 24 horas, para comprobar la formación de coágulos; cualquier grado de coagulación, por pequeño que sea, se considera un resultado positivo. Si no se observa coagulación, la muestra cumple el requisito en cuanto a ausencia de Staphylococcus aureus. Si se observa coagulación confirmar la presencia de S. aureus por pruebas bioquímicas convencionales y/o por sistemas miniaturizados tales como API 3. f. Investigación de Clostridium. MATERIALES Pipetas de 10 ml 1. 13
14 Propipetas Placas estériles Tubos estériles con tapa de rosca Tiras indicadoras de ph Pipetas Pasteur Buffer fosfato ph 7,2 Caldo Soya Caseína Agar Columbia Agar Soya Caseína Medio Reforzado para Clostridium Caldo de Carne Cocida Jarra Gaspak Sobre para anaerobiosis Baño de agua a 80º C Baño de hielo Asa y filamento de platino Mechero Equipo para coloración de Gram Estufa o incubadora a 32,5 ± 2,5º C PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 2 porciones de 10 ml cada una de la mezcla anterior a dos tubos estériles con tapa de rosca. 4. Calentar una porción a 80º C durante un periodo de 10 minutos y enfriar rápidamente en baño de hielo. No calentar la otra porción. 5. Transferir 10 ml de cada una de las porciones anteriores (calentada y no calentada) a dos frascos de dilución con 100 ml de Medio Reforzado para Clostridium respectivamente. 6. Incubar bajo condiciones de anaerobiosis a una temperatura de 32,5 ± 2,5º C durante 48 horas. Aislamiento de Clostridium 7. Después del periodo de incubación, realizar los aislamientos con un asa de platino a partir de cada frasco, en Agar Columbia
15 8. Incubar en condiciones anaeróbicas a una temperatura de 32,5 ± 2,5º C durante 48 horas. 9. Transferir el crecimiento en Agar Columbia a un tubo con Caldo de Carne Cocida. Incubar a 32,5 ± 2,5º C en condiciones de anaerobiosis de horas. 10. A partir del tubo con Caldo de Carne Cocida, hacer coloración de Gram. 11. El crecimiento anaeróbico de bacilos Gram positivo (con o sin endosporas) que dan una reacción de catalasa negativa indica la presencia de Clostridium. Si por el contrario no se detecta crecimiento anaeróbico o la prueba de catalasa es positiva, el producto cumple con la ausencia de Clostridium. 12. Realizar la prueba de Catalasa, utilizando para ello cualquiera de los siguientes procedimientos: a) Transferir con ayuda de una pipeta Pasteur el crecimiento obtenido en Caldo de Carne Cocida a un tubo con 1 ml de peróxido de hidrógeno al 3%. Una reacción positiva es indicada por la aparición de burbujas de oxígeno. b) Transferir con ayuda de un asa de platino el crecimiento obtenido en Caldo de Carne Cocida a un tubo de Agar Columbia inclinado, e incubar a 32,5 ± 2,5º C en condiciones de anaerobiosis de horas. Transfiera con ayuda de una pipeta Pasteur parte del crecimiento obtenido en Agar Columbia e inocule un tubo con 1mL de peróxido de hidrógeno al 3%. Una reacción positiva es indicada por la aparición de burbujas de oxígeno. 3.g. Investigación de Candida albicans. MATERIALES Pipetas de 10 ml Propipetas Placas estériles Tiras indicadoras de ph Pipetas Pasteur Buffer fosfato ph 7,2 Caldo Sabouraud Dextrosa Agar Sabouraud Dextrosa Asa y filamento de platino Mechero Estufa o incubadora a 32,5 ± 2,5º C Lámina y laminilla 1. 15
16 PROCEDIMIENTO 1. Transferir 10 g o 10 ml de la muestra y añadirlos a un frasco de dilución que contiene 90 ml de buffer fosfato ph 7,2 y agitar. 2. Determinar el ph de la dilución anterior con el uso de una pipeta Pasteur y de tiras indicadoras de ph. El mismo debe estar entre 6 y Transferir con una pipeta estéril, 10 ml de la mezcla anterior a un balón o fiola que contiene 100 ml de Caldo Sabouraud Dextrosa (CSD) y agitar. 4. Incubar a 32,5 ± 2,5º C por 3 a 5 días. Aislamiento de Candida albicans 5. Agitar la mezcla incubada (CSD) y mediante un asa hacer aislamiento a Agar- Sabouraud Dextrosa. Incubar a 32,5 ± 2,5º C por horas. 6. Realizar una observación al microscopio entre lámina y laminilla, empleando el objetivo 40-45X. 7. El crecimiento de colonias blancas en Agar Sabourud Dextrosa, puede indicar la posible presencia de Candida albicans. Confirmar la presencia de la misma a través de las pruebas de identificación o sistemas miniaturizados. 8. El producto pasa la prueba si no hay crecimiento en el Agar Sabouraud Dextrosa o si las pruebas de identificación son negativas. La validez de los resultados de los ensayos descritos, dependerá de la demostración de que las muestras bajo ensayo no presentan de por sí, efectos inhibidores de la multiplicación de los microorganismos que pudieran estar presentes en ella. Por consiguiente, para demostrar el efecto inhibidor de las muestras, se realiza un ensayo preliminar que no es más que las pruebas de Validación del producto, que consiste en inocular el Buffer fosfato ph 7,2; y los caldos de enriquecimiento en el momento en que se hace la preparación de la muestra (técnicas descritas anteriormente), con un inóculo no mayor a 100 ufc/ml de cada uno de los microorga
17 nismos en investigación (hacer cada microorganismo por separado), añadir la cantidad apropiada de muestra y proceder de la misma forma como se describió para el análisis de la muestra sola. Cabe resaltar que el volumen de la suspensión del microorganismo a inocular no debe ser mayor del 1% del volumen del producto diluido. RESULTADOS Anotar los resultados: CONCLUSIONES ACTIVIDADES ADICIONALES 1. Escoja un medio selectivo de los que Ud. utilizó en el trabajo asignado. Explique porqué fue seleccionado ese medio. 2. Qué significa el test del IMViC y cuáles microorganismos nos permite identificar? 3. Por qué en el medio agar TSI, se puede observar fermentación de azúcares y la producción de H 2 S? 4. En qué caso se considera que una placa proveniente de un recuento de microorganismos es contable? 5. Señale si existe alguna (s) diferencia (s) entre el método del recuento en placa por incorporación y el método del recuento en superficie. 6. Cuándo se considera que un producto está deteriorado y cuáles son las causas? 1. 17
18 ANEXO 10 ml o 10 g DÍA LUNES * Según tipo de muestra Inocular 10 ml en: Recuento de Microorganismos totales Incubar a 30º - 35º CSD MRC CSC Incubar a 30º - 35º C. albicans Clostridium S. aureus Ps. aeuriginosa E. coli Salmonella Recuento de Mohos y Levaduras Incubar a 20º 25 º Investigación de Microorganismos Específicos 10 ml o 10 g * CSC Incubar a 20º - 25º 2 5 h CMEE Incubar a 30º - 35º Prueba de Microorganismos tolerantes a bilis CSD: Caldo Sabouraud Dextrosa MRC: Medio Reforzado para Clostridium CSC: Caldo Soya Caseína CMEE: Caldo Mossel para Enriquecimiento de Enterobacterias * Ajustar ph
19 REFERENCIAS Brock T.D. Madigan M.T. Martenko J.J. y Parker J. (Eds) Biología de los microorganismos. 8ª Edición. Prentice Hall International. (1999). Prescott, L.M. y col. Microbiology. W.C. Brown Publishers. 4ª Edición. (1998). United States Pharmacopeia. Microbiological test. <61> Microbiological Examination of Nonsterile Products: Microbiological Enumeration Test. 32 ed. Rockville: USP; United States Pharmacopeia. Microbiological test. <62> Microbiological Examination of Nonsterile Products: Test for Specified Microorganisms. 32 ed. Rockville: USP; United States Pharmacopeia. General Informaction. <1111> Microbiological Examination of Nonsterile Products: Acceptance Criteria for Pharmaceutical Preparations And Substances for Pharmaceutical Use. 32 ed. Rockville: USP; 2009 De Castro Norma De Curtis María Luisa Enero 2002 Actualizado por: Garcés Alessandra Gutiérrez Sofía Infante Wilson Saravia Katiuska Junio 2009
Trabajo Práctico Nº 2
 Introducción Objetivo Fundamento Trabajo Práctico Nº 2 MÉTODO DE LA MEMBRANA FILTRANTE PARA EL ANÁLISIS MICROBIOLÓGICO DEL AGUA Materiales Procedimiento Resultados Conclusiones Actividades Adicionales
Introducción Objetivo Fundamento Trabajo Práctico Nº 2 MÉTODO DE LA MEMBRANA FILTRANTE PARA EL ANÁLISIS MICROBIOLÓGICO DEL AGUA Materiales Procedimiento Resultados Conclusiones Actividades Adicionales
PROCEDIMIENTO RECUENTO DE COLIFORMES EN MEDIO SÓLIDO
 PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
PRT-712.03-008 Página 1 de 6 1. OBJETIVO Este método es utilizado para realizar recuento de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento
PROCEDIMIENTO DETECCIÓN Y ENUMERACIÓN POR NUMERO MAS PROBABLE (NMP) CON ETAPA DE PRE- ENRIQUECIMIENTO DE ENTEROBACTERIACEAE EN ALIMENTOS
 Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
Página 1 de 5 1. OBJETIVO Estimar el número de Enterobacteriaceae presentes en el alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos de consumo humano
PROCEDIMIENTO DE METODO CUALITATIVO DE DETECCION DE SHIGELLA SPP EN MATRIZ AGUA
 PRT-712.02-065 Página 1 de 5 1. OBJETIVO Detectar en forma cualitativa la presencia de Shigella spp en muestras de aguas. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento es aplicable a las muestras
PRT-712.02-065 Página 1 de 5 1. OBJETIVO Detectar en forma cualitativa la presencia de Shigella spp en muestras de aguas. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento es aplicable a las muestras
ENUMERACIÓN DE ENTEROBACTERIACEAE EN ALIMENTOS SIN RESUSCITACIÓN. TÉCNICA RECUENTO EN PLACA
 PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
PRT-712.03-040 Página 1 de 6 1. OBJETIVO Determinar el número de Enterobactereaceae presentes en un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
RECOPILADO POR: EL PROGRAMA UNIVERSITARIO DE ALIMENTOS
 NXM-F-248-1975. ALIMENTOS. DETERMINACIÓN DE MICROORGANISMOS EN ESPECIAS Y CONDIMENTOS. FOODS. DETERMINATION OF MICROORGANISMS IN SPECIES AND CONDIMENTS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. 1.
NXM-F-248-1975. ALIMENTOS. DETERMINACIÓN DE MICROORGANISMOS EN ESPECIAS Y CONDIMENTOS. FOODS. DETERMINATION OF MICROORGANISMS IN SPECIES AND CONDIMENTS. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. 1.
NMP PARA LA DETERMINACION DE COLIFORMESY COLIFORMES FECALES EN AGUAS
 PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
PRT-712.03-005 Página 1 de 6 1. OBJETIVO Este método es utilizado para estimar la densidad de bacterias del grupo coliformes y conocer la calidad sanitaria en aguas crudas 2. CAMPO DE APLICACIÓN Y ALCANCE
DETERMINACION DE BACTERIAS COLIFORMES: COLIMETRIA
 DETERMINACION DE BACTERIAS COLIFORMES: COLIMETRIA En esta práctica, vamos a centrarnos en determinar las bacterias coliformes presentes en un agua mediante el Método de los tubos múltiples ó colimetria
DETERMINACION DE BACTERIAS COLIFORMES: COLIMETRIA En esta práctica, vamos a centrarnos en determinar las bacterias coliformes presentes en un agua mediante el Método de los tubos múltiples ó colimetria
1 MATERIALES Y MÉTODOS
 1 MATERIALES Y MÉTODOS 1.1 ESQUEMA DE TRABAJO Toma de muestras mesofílicos aerobios por cuenta en placa (UFC*). coniformes fecales mediante NMP * Vibrio cholerae O1 Salmonella Staphyloccoccus aureus *NMP,
1 MATERIALES Y MÉTODOS 1.1 ESQUEMA DE TRABAJO Toma de muestras mesofílicos aerobios por cuenta en placa (UFC*). coniformes fecales mediante NMP * Vibrio cholerae O1 Salmonella Staphyloccoccus aureus *NMP,
Determinación de coliformes totales por cuenta en placa
 Camacho, A., M.Giles, A.Ortegón, M.Palao, B.Serrano y O.Velázquez. 2009. Técnicas para el Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química, UNAM. México. Determinación de coliformes totales
Camacho, A., M.Giles, A.Ortegón, M.Palao, B.Serrano y O.Velázquez. 2009. Técnicas para el Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química, UNAM. México. Determinación de coliformes totales
CULTIVO DE MICROORGANISMOS
 CULTIVO DE MICROORGANISMOS OBJETIVO: El alumno aprenderá las técnicas más utilizadas para sembrar bacterias en diferentes medios de cultivo. GENERALIDADES En la naturaleza los microorganismos se presentan
CULTIVO DE MICROORGANISMOS OBJETIVO: El alumno aprenderá las técnicas más utilizadas para sembrar bacterias en diferentes medios de cultivo. GENERALIDADES En la naturaleza los microorganismos se presentan
ADIESTRAMIENTO EN LAS TÉCNICAS DE ANÁLISIS RUTINARIAS DEL LABORATORIO DE CONTROL DE CALIDAD DE LA EMPRESA LABORATORIOS ELMOR S.A.
 Universidad de Carabobo Facultad Experimental de Ciencia y Tecnología Departamento de Química Informe de Pasantías ADIESTRAMIENTO EN LAS TÉCNICAS DE ANÁLISIS RUTINARIAS DEL LABORATORIO DE CONTROL DE CALIDAD
Universidad de Carabobo Facultad Experimental de Ciencia y Tecnología Departamento de Química Informe de Pasantías ADIESTRAMIENTO EN LAS TÉCNICAS DE ANÁLISIS RUTINARIAS DEL LABORATORIO DE CONTROL DE CALIDAD
PARTE EXPERIMENTAL 1 MATERIALES, EQUIPOS Y REACTIVOS 1.1 MATERIAL Y EQUIPOS
 II PARTE EXPERIMENTAL El presente trabajo se realizó en el laboratorio del Centro Latino Americano de Enseñanza e Investigación de Bacteriología Alimentaria (CLEIBA), con sede en la Facultad de Farmacia
II PARTE EXPERIMENTAL El presente trabajo se realizó en el laboratorio del Centro Latino Americano de Enseñanza e Investigación de Bacteriología Alimentaria (CLEIBA), con sede en la Facultad de Farmacia
NMX-F-254-1977. CUENTA DE ORGANISMOS COLIFORMES. COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS.
 NMX-F-54-977. CUENTA DE ORGANISMOS COLIFORMES. COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO. En la elaboración de la presente Norma participaron los siguientes Organismos:
NMX-F-54-977. CUENTA DE ORGANISMOS COLIFORMES. COLIFORM ORGANISMS COUNT. NORMAS MEXICANAS. DIRECCIÓN GENERAL DE NORMAS. PREFACIO. En la elaboración de la presente Norma participaron los siguientes Organismos:
USP FEUM ÍFICO CIENT Límites microbianos ENCUENTRO MEMORIAS
 Límites microbianos Origen de técnicas de cultivo en medios sólidos En 1881 dentro del Congreso Médico Internacional en Londres, Robert Koch describió un método de cultivo de microorganismos empleando
Límites microbianos Origen de técnicas de cultivo en medios sólidos En 1881 dentro del Congreso Médico Internacional en Londres, Robert Koch describió un método de cultivo de microorganismos empleando
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente
 Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
Técnicas de monitoreo para la detección de microorganismos en el medio ambiente Gloria Alicia Figueroa Aguilar Condiciones Ambientales REQUISITO: El laboratorio debe asegurarse que las condiciones ambientales,
PROCEDIMIENTO NMP PARA LA DETERMINACION DE COLIFORMES FECALES EN AGUAS POR METODO A-1 PRT-712.02-006
 Página 1 de 6 1. OBJETIVO Este análisis se realiza para estimar la densidad de coliformes fecales en agua, con una incubación de 24 hrs. por lo cual se obtienen resultados en menor tiempo que el método
Página 1 de 6 1. OBJETIVO Este análisis se realiza para estimar la densidad de coliformes fecales en agua, con una incubación de 24 hrs. por lo cual se obtienen resultados en menor tiempo que el método
NMP PARA LA DETERMINACION DE COLIFORMES Y ESCHERICHIA COLI EN ALIMENTOS PRT
 Página 1 de 8 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
Página 1 de 8 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar este procedimiento a todas las muestras de alimentos
Placas para Recuento de Coliformes
 Petrifilm Placas para Recuento de Coliformes Guía de Interpretación Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de Coliformes (CC). Para más
Petrifilm Placas para Recuento de Coliformes Guía de Interpretación Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de Coliformes (CC). Para más
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA
 PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
PRACTICA Núm. 22 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN DESECHOS SOLIDOS Y COMPOSTA I. OBJETIVO Determinar la presencia de coliformes totales y fecales en un desecho sólido por el método del
Curso Microbiología de los alimentos: Un enfoque práctico para la inocuidad alimentaría
 UNIVERSIDAD DE INGENIERIA UNI- Sede Estelí Curso Microbiología de los alimentos: Un enfoque práctico para la inocuidad alimentaría Sesión práctica Método de detección de mesófilos aerobios Método de detección
UNIVERSIDAD DE INGENIERIA UNI- Sede Estelí Curso Microbiología de los alimentos: Un enfoque práctico para la inocuidad alimentaría Sesión práctica Método de detección de mesófilos aerobios Método de detección
VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS Y BIOLÓGICOS
 VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS Y BIOLÓGICOS Referencia USP 29, Farmacopea Mexicana Validación de métodos analíticos AEFI 1de 21 Ensayos biológicos Los métodos biológicos se emplean para determinar
VALIDACIÓN DE MÉTODOS MICROBIOLÓGICOS Y BIOLÓGICOS Referencia USP 29, Farmacopea Mexicana Validación de métodos analíticos AEFI 1de 21 Ensayos biológicos Los métodos biológicos se emplean para determinar
PROCEDIMIENTO TECNICA DE COAGULASA EN TUBO PRT
 Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
Página 1 de 7 1. OBJETIVO Comprobar la facultad de las unidades formadoras de colonias de S. aureus presentes en una muestra de alimento, de coagular el plasma de conejo por acción de la enzima coagulasa
CÓDIGO DENOMINACIÓN MATRIZ TÉCNICA RANGO LÍMITES ESTADO EQUIPAMIENTO PARÁMETROS ANALIZADOS
 ANÁLISIS FÍSICO QUÍMICOS DE AGUAS ITE/LabSA-HD/31-00 Determinación de Amoniaco Fotometría ---- físico química Amoniaco ANÁLISIS MICROBIOLÓGICOS AGUAS ITE-M/076-01 Enumeración de microorganismos cultivables.
ANÁLISIS FÍSICO QUÍMICOS DE AGUAS ITE/LabSA-HD/31-00 Determinación de Amoniaco Fotometría ---- físico química Amoniaco ANÁLISIS MICROBIOLÓGICOS AGUAS ITE-M/076-01 Enumeración de microorganismos cultivables.
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUANTITATIVO DE ORINA ANÁLISIS CUALITATIVO DE ORINA M-1 M-2 M-3 M-4 Lectura de la placa de Agar CLED Identificación presuntiva
PROCEDIMIENTO TECNICA NMP STAPHYLOCOCCUS AUREUS EN ALIMENTOS. BAM ONLINE 2001
 PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
PRT-712.02-025 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias S. aureus en matrices de alimento o agua como indicador sanitario 2. CAMPO DE APLICACIÓN Y ALCANCE El método de NMP es recomendado
Petrifilm Recuento de Enterobacteriaceae
 3 Petrifilm Recuento de Enterobacteriaceae Guía de Interpretación 1 2 3 1 2 Recuento de Enterobacteriaceae = 13 Es fácil contar las colonias de Enterobacteriaceae en placas Petrifilm Recuento de Enterobacteriaceae.
3 Petrifilm Recuento de Enterobacteriaceae Guía de Interpretación 1 2 3 1 2 Recuento de Enterobacteriaceae = 13 Es fácil contar las colonias de Enterobacteriaceae en placas Petrifilm Recuento de Enterobacteriaceae.
Objetivos. S Determinar la presencia de bacterias coliformes en una muestra de agua
 Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
Análisis del agua S Objetivos S Determinar la presencia de bacterias coliformes en una muestra de agua Introducción S Las tres pruebas básicas para determinar la presencia de bacterias coliformes (asociada
MICROBIOLOGÍA DE ALIMENTOS. Resumen de las prácticas de Microbiología de Alimentos
 MICROBIOLOGÍA DE ALIMENTOS Resumen de las prácticas de Microbiología de Alimentos 1 Ingeniero Técnico Agrícola Industrias Agrarias y Alimentarias CURSO 2004-2005 Profesora: Cristina Solano Goñi e-mail:
MICROBIOLOGÍA DE ALIMENTOS Resumen de las prácticas de Microbiología de Alimentos 1 Ingeniero Técnico Agrícola Industrias Agrarias y Alimentarias CURSO 2004-2005 Profesora: Cristina Solano Goñi e-mail:
APÉNDICE G. Identificación bioquímica de enterobacterias por el sistema API 20E
 APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
APÉNDICE G Identificación bioquímica de enterobacterias por el sistema API 20E OBJETIVO: - Establecer la metodología en la identificación de enterobacterias por medio de pruebas bioquímicas estandarizadas
Trabajo Práctico Nº 5
 Introducción Objetivo Procedimiento Resultados Trabajo Práctico Nº 5 INFLUENCIA DE LAS CONDICIONES AM- BIENTALES EN EL CRECIMIENTO MICRO- BIANO Conclusiones Bibliografía INTRODUCCIÓN Las diferentes especies
Introducción Objetivo Procedimiento Resultados Trabajo Práctico Nº 5 INFLUENCIA DE LAS CONDICIONES AM- BIENTALES EN EL CRECIMIENTO MICRO- BIANO Conclusiones Bibliografía INTRODUCCIÓN Las diferentes especies
MGA LÍMITES MICROBIANOS
 EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua. Lic Soria José
 Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
Trabajo Práctico Nº4: Análisis Bacteriológico del Agua Lic Soria José Las fuentes del Agua Se considera agua potable de suministro público y agua potable de uso domiciliario la que es apta para la alimentación
Agar Salmonella Shigella (SS) Agar Sulfito Bismuto (SB)
 Agares utilizados Agar Salmonella Shigella (SS) Medio de siembra selectivo para aislar Salmonella y Shigella, diferencia organismos fermentadores de lactosa de los que no lo hacen e inhiben organismos
Agares utilizados Agar Salmonella Shigella (SS) Medio de siembra selectivo para aislar Salmonella y Shigella, diferencia organismos fermentadores de lactosa de los que no lo hacen e inhiben organismos
NMP PARA LA DETERMINACION DE COLIFORMES Y Escherichia coli EN ALIMENTOS BASADO EN BAM on line
 COLIFORMES Y Escherichia coli EN ME-712.02-004 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario en alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar
COLIFORMES Y Escherichia coli EN ME-712.02-004 Página 1 de 9 1. OBJETIVO Estimar la densidad de bacterias del grupo coliformes, como indicador sanitario en alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicar
MGA LÍMITES MICROBIANOS
 EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del
EL TEXTO EN COLOR ROJO HA SIDO MODIFICADO Con fundamento en el numeral 4.11.1 de la Norma Oficial Mexicana NOM-001-SSA1-2010, se publica el presente proyecto a efecto de que los interesados, a partir del
PAUTA DE INSPECCIÓN DE LABORATOROS MICROBIOLÓGICOS-VERIFICACION DE ETAPAS DE UN ANALISIS
 REGIÓN : PAUTA N : FECHA : PAUTA DE INSPECCIÓN DE LABORATOROS MICROBIOLÓGICOS-VERIFICACION DE ETAPAS DE UN ANALISIS La presente pauta es aplicable en laboratorios bromatológicos, con el fin de verificar
REGIÓN : PAUTA N : FECHA : PAUTA DE INSPECCIÓN DE LABORATOROS MICROBIOLÓGICOS-VERIFICACION DE ETAPAS DE UN ANALISIS La presente pauta es aplicable en laboratorios bromatológicos, con el fin de verificar
BIPLACA HYCHECK. Diseñadas para evaluar la contaminación Microbiológica tanto de Superficies (Paredes, techos y equipos) como de Líquidos.
 BIPLACA HYCHECK Diseñadas para evaluar la contaminación Microbiológica tanto de Superficies (Paredes, techos y equipos) como de Líquidos. Son estadísticamente comparables a una Torunda (Hisopo) y Placa
BIPLACA HYCHECK Diseñadas para evaluar la contaminación Microbiológica tanto de Superficies (Paredes, techos y equipos) como de Líquidos. Son estadísticamente comparables a una Torunda (Hisopo) y Placa
DETERMINACION DE BACTERIAS AEROBIAS TOTALES EN UNA MUESTRA DE AGUA
 DETERMINACION DE BACTERIAS AEROBIAS TOTALES EN UNA MUESTRA DE AGUA Por bacterias aerobias totales se entienden todas las bacterias aerobias y anaerobias facultativas, heterótrofas, mesófilas y criófilas
DETERMINACION DE BACTERIAS AEROBIAS TOTALES EN UNA MUESTRA DE AGUA Por bacterias aerobias totales se entienden todas las bacterias aerobias y anaerobias facultativas, heterótrofas, mesófilas y criófilas
PROCEDIMIENTO PARA DETERMINAR NMP DE E. coli EN MOLUSCOS BIVALVOS ENFRIADOS Y CONGELADOS. METODO LST-MUG
 PRT-712.02-011 Página 1 de 7 1. OBJETIVO Determinar presuntivamente E coli dentro de 24 h en caldo. 2. CAMPO DE APLICACIÓN Y ALCANCE Se aplica a muestras de moluscos bivalvos enfriados y congelados. 3.
PRT-712.02-011 Página 1 de 7 1. OBJETIVO Determinar presuntivamente E coli dentro de 24 h en caldo. 2. CAMPO DE APLICACIÓN Y ALCANCE Se aplica a muestras de moluscos bivalvos enfriados y congelados. 3.
ANEXO 2 MODELO DE OFERTA ECONÓMICA Métodos de detección y recuento en placa
 CODIGO ANEXO 2 MODELO DE OFERTA ECONÓMICA Métodos de detección y recuento en placa...... (nombre y apellidos), con DNI., con domicilio en, c/pl....... número.., CP, y teléfono.., DECLARO: Que estoy informado/da
CODIGO ANEXO 2 MODELO DE OFERTA ECONÓMICA Métodos de detección y recuento en placa...... (nombre y apellidos), con DNI., con domicilio en, c/pl....... número.., CP, y teléfono.., DECLARO: Que estoy informado/da
Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias
 Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias Objetivos Aplicar las diferentes técnicas de siembra que se emplean para el estudio y asilamiento
Unidad 3. Estudio de cultivos bacterianos puros Práctica 4. Técnicas de siembra y cultivo de bacterias Objetivos Aplicar las diferentes técnicas de siembra que se emplean para el estudio y asilamiento
Preparación y dilución de muestras de alimentos para su análisis microbiológico
 Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química,. México. Preparación y dilución de muestras de alimentos para su análisis microbiológico OBJETIVOS Preparar adecuadamente las muestras
Análisis Microbiológico de Alimentos. 2ª ed. Facultad de Química,. México. Preparación y dilución de muestras de alimentos para su análisis microbiológico OBJETIVOS Preparar adecuadamente las muestras
TEMA 10. Cultivo y aislamiento de patógenos viables
 TEMA 10 Cultivo y aislamiento de patógenos viables Tema 10. Cultivo y aislamiento de patógenos viables 1. Medios de cultivo 2. Preparación de medios de cultivo artificiales 3. Condiciones para el aislamiento
TEMA 10 Cultivo y aislamiento de patógenos viables Tema 10. Cultivo y aislamiento de patógenos viables 1. Medios de cultivo 2. Preparación de medios de cultivo artificiales 3. Condiciones para el aislamiento
PROCEDIMIENTO RECUENTO MOHOS Y LEVADURAS EN ALIMENTOS NORMA ISO 7954
 PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
PRT- 712.02-031 Página 1 de 9 1. OBJETIVO Conocer el número de Mohos y Levaduras que contiene un alimento. 2. CAMPO DE APLICACIÓN Y ALCANCE Este procedimiento se aplica a todos los alimentos de consumos
MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS. Dra. Flor Teresa García Huamán
 MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS 1 1. AISLAMIENTO DE BACTERIAS PRODUCTORAS DE AMILASAS. 2. TÉCNICAS DE SEMBRADO. 3. DETERMINACIÓN DE BACTERIAS DE UNA MUESTRA: RECUENTO
MICROBIOLOGÍA AGROINDUSTRIAL I- UNIDAD REPASO DE CLASES PRÁCTICAS 1 1. AISLAMIENTO DE BACTERIAS PRODUCTORAS DE AMILASAS. 2. TÉCNICAS DE SEMBRADO. 3. DETERMINACIÓN DE BACTERIAS DE UNA MUESTRA: RECUENTO
NMX-BB-040-SCFI-1999 MÉTODOS GENERALES DE ANÁLISIS - DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA EN PRODUCTOS GERMICIDAS
 MÉTODOS GENERALES DE ANÁLISIS - DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA EN PRODUCTOS GERMICIDAS GENERAL METHODS FOR ANALYSIS - ANTIMICROBIAL ACTIVITY DETERMINATION TO GERMICIDAL PRODUCTS PREFACIO
MÉTODOS GENERALES DE ANÁLISIS - DETERMINACIÓN DE LA ACTIVIDAD ANTIMICROBIANA EN PRODUCTOS GERMICIDAS GENERAL METHODS FOR ANALYSIS - ANTIMICROBIAL ACTIVITY DETERMINATION TO GERMICIDAL PRODUCTS PREFACIO
AISLAMIENTO DE MICROORGANISMOS
 PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
PRÁCTICA5 AISLAMIENTO DE MICROORGANISMOS Introducción En la naturaleza, la mayoría de los microorganismos no se encuentran aislados, sino integrados en poblaciones mixtas. Para llevar a cabo el estudio
Análisis Microbiológico de aguas.
 Análisis Microbiológico de aguas. Laboratorio. Dolores Garvi Higueras. sedceroya@us.es www.aguapedia.org Índice. 1. Legislación 2. Toma de muestras 3. Medios de cultivo 4. Esterilización 5. Material 6.
Análisis Microbiológico de aguas. Laboratorio. Dolores Garvi Higueras. sedceroya@us.es www.aguapedia.org Índice. 1. Legislación 2. Toma de muestras 3. Medios de cultivo 4. Esterilización 5. Material 6.
Aislamiento de Microorganismos (1ª Sesión)
 Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para el aislamiento
Aislamiento de Microorganismos (1ª Sesión) Objetivos Al finalizar esta práctica el alumno será capaz de: Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación para el aislamiento
Aislamiento, identificación n bioquímica y tipificación n de Shigella
 I Curso Avanzado WHO Global Salmonella Surveillance Costa Rica, 26 de abril 2 de mayo 2009 Aislamiento, identificación n bioquímica y tipificación n de Shigella Elena Campos Chacón Centro Nacional de Referencia
I Curso Avanzado WHO Global Salmonella Surveillance Costa Rica, 26 de abril 2 de mayo 2009 Aislamiento, identificación n bioquímica y tipificación n de Shigella Elena Campos Chacón Centro Nacional de Referencia
METODO DE FILTRACIÓN POR MEMBRANA PARA DETERMINACION DE COLIFORMES Y E. coli EN AGUA
 PRT-712.03-009 Página 1 de 7 1. OBJETIVO Este método se utiliza para medir la calidad sanitaria del agua potable. 2. CAMPO DE APLICACIÓN Y ALCANCE Se aplica a agua clorada o agua naturales de muy baja
PRT-712.03-009 Página 1 de 7 1. OBJETIVO Este método se utiliza para medir la calidad sanitaria del agua potable. 2. CAMPO DE APLICACIÓN Y ALCANCE Se aplica a agua clorada o agua naturales de muy baja
1. LEVINE EMB AGAR FOTO 6. Medios de cultivo Levine EMG Agar.
 1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
1. LEVINE EMB AGAR. El Agar EMB Levine es un medio selectivo y diferencial, adecuado para el crecimiento de Enterobacterias. Es un medio adecuado para la búsqueda y diferenciación de bacilos entéricos,
PRACTICA Núm. 18 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN AGUA RESIDUAL
 I. OBJETIVO PRACTICA Núm. 18 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN AGUA RESIDUAL Determinar la presencia de coliformes totales y fecales en agua residual por el método del Número Más Probable,
I. OBJETIVO PRACTICA Núm. 18 INVESTIGACION DE COLIFORMES TOTALES Y FECALES EN AGUA RESIDUAL Determinar la presencia de coliformes totales y fecales en agua residual por el método del Número Más Probable,
CONTROL HIGIENICO DE PRODUCTOS NO OBLIGATORIAMENTE ESTERILES. FUENTE: Centro de Documentación e Información del Ministerio de Economía - Argentina
 CONTROL HIGIENICO DE PRODUCTOS NO OBLIGATORIAMENTE ESTERILES FUENTE: Centro de Documentación e Información del Ministerio de Economía - Argentina En este artículo se especifican los ensayos necesarios
CONTROL HIGIENICO DE PRODUCTOS NO OBLIGATORIAMENTE ESTERILES FUENTE: Centro de Documentación e Información del Ministerio de Economía - Argentina En este artículo se especifican los ensayos necesarios
CÓDIGO DENOMINACIÓN MATRIZ TÉCNICA RANGO LÍMITES ESTADO EQUIPAMIENTO PARÁMETROS ANALIZADOS. Método fotométrico ---- Método electroquímico.
 ANÁLISIS FÍSICO QUÍMICOS DE AGUAS ITE/LabSA-HD/31 Determinación de Amoniaco Fotometría físico química Amoniaco ITE/LabSA/HD/10 Determinación del cloro libre, total y combinado y piscinas Método fotométrico
ANÁLISIS FÍSICO QUÍMICOS DE AGUAS ITE/LabSA-HD/31 Determinación de Amoniaco Fotometría físico química Amoniaco ITE/LabSA/HD/10 Determinación del cloro libre, total y combinado y piscinas Método fotométrico
Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos.
 Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos. Objetivos Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación
Unidad 5. Técnicas de aislamiento de microorganismos Práctica 6. Técnicas de aislamiento de microorganismos. Objetivos Explicar el fundamento de diferentes medios de cultivo y condiciones de incubación
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO
 PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
PRACTICA Núm. 12 AISLAMIENTO DE 2 MICROORGANISMOS Y OBTENCION DE UN CULTIVO AXENICO I. OBJETIVO Aislar dos microorganismos por la técnica de siembra de dilución por estría en placa de agar y obtener un
MICROBIOLOGÍA AGRÍCOLA
 MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
MICROBIOLOGÍA AGRÍCOLA CONTROL DE LA CALIDAD DE ALIMENTOS Año 2015 TRABAJO PRÁCTICO N 9 PRÁCTICO N 9 CONTROL DE LA CALIDAD DE ALIMENTOS Objetivos: Conocer posibles contaminantes en alimentos. Conocer la
DESCRIPCION DE BIOCOUNTER
 DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
DESCRIPCION DE BIOCOUNTER BIOCOUNTER es un Laminocultivo para Control Microbiológico Industrial utilizado ampliamente en el campo alimentario y áreas relacionadas. El análisis microbiológico realizado
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA
 PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
PRACTICA Núm. 19 DETERMINACION DE ESTREPTOCOCOS FECALES EN AGUA I. OBJETIVO Investigar la presencia de Estreptococos fecales en una muestra de agua mediante la técnica del Número Más Probable (NMP) usando
USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA.
 AGAR CHOCOLATE SUPLEMENTADO USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA. AGAR 10.0 g FOSFATO DIPOTASICO ALMIDON DE 1.0 g FOSFATO
AGAR CHOCOLATE SUPLEMENTADO USO: MEDIO ENRIQUECIDO QUE PERMITE EL CRECIMIENTO DE MICROORGANISMOS EXIGENTES COMO HAEMOPHILUS, NEISSERIA Y LISTERIA. AGAR 10.0 g FOSFATO DIPOTASICO ALMIDON DE 1.0 g FOSFATO
MICROBIOLOGIA APLICADA Manual de Laboratorio APENDICE C PREPARACION DE SOLUCIONES Y REACTIVOS
 APENDICE C PREPARACION DE SOLUCIONES Y REACTIVOS 200 1. AGUA DE DILUCION CON SOLUCION BUFFER. Solución I Disolver 34 g de fosfato monobásico de potasio (KH 2 PO 4 ) en 500 ml de agua destilada. Ajustar
APENDICE C PREPARACION DE SOLUCIONES Y REACTIVOS 200 1. AGUA DE DILUCION CON SOLUCION BUFFER. Solución I Disolver 34 g de fosfato monobásico de potasio (KH 2 PO 4 ) en 500 ml de agua destilada. Ajustar
PRÁCTICA No. 2 Métodos de cultivo y aislamiento de bacterias
 PRÁCTICA No. 2 Métodos de cultivo y aislamiento de bacterias Objetivos. Que el alumno conozca las diferentes técnicas de aislamiento en medios de cultivo sólido para la obtención de cultivos puros de bacterias.
PRÁCTICA No. 2 Métodos de cultivo y aislamiento de bacterias Objetivos. Que el alumno conozca las diferentes técnicas de aislamiento en medios de cultivo sólido para la obtención de cultivos puros de bacterias.
EXÁMENES MÍNIMOS PARA LABORATORIOS DE AGUAS, ALIMENTOS, FARMACÉUTICOS, DISPOSITIVOS MÉDICOS Y SUS REQUERIMIENTOS
 EXÁMENES MÍNIMOS PARA LABORATORIOS DE AGUAS, ALIMENTOS, FARMACÉUTICOS, DISPOSITIVOS MÉDICOS Y SUS REQUERIMIENTOS La Junta Directiva del Colegio de Microbiólogos y Químicos Clínicos Considerando que: Los
EXÁMENES MÍNIMOS PARA LABORATORIOS DE AGUAS, ALIMENTOS, FARMACÉUTICOS, DISPOSITIVOS MÉDICOS Y SUS REQUERIMIENTOS La Junta Directiva del Colegio de Microbiólogos y Químicos Clínicos Considerando que: Los
MANUAL DE PREPARACIÓN DE MEDIOS DE CULTIVO
 Rev. 02 Hoja: 1 de 14 MANUAL DE PREPARACIÓN DE MEDIOS DE Elaboró: Revisó: Autorizó: Puesto QUÍMICO JEFE DEL LABORATORIO SUBDIRECTOR DE INVESTIGACIÓN Firma Hoja: 2 de 14 1. Propósito Definir y describir
Rev. 02 Hoja: 1 de 14 MANUAL DE PREPARACIÓN DE MEDIOS DE Elaboró: Revisó: Autorizó: Puesto QUÍMICO JEFE DEL LABORATORIO SUBDIRECTOR DE INVESTIGACIÓN Firma Hoja: 2 de 14 1. Propósito Definir y describir
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias.
 Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Unidad 6. Nutrición microbiana y caracterización de bacterias. Práctica 9 Metabolismo de bacterias. Objetivos Relacionar la actividad metabólica de los microorganismos con los cambios producidos en diferentes
Morfología Agua peptonada. 37 C/ h. investigar: Agar Salmonella. Bacilos gran Shigella. negativos, con Agar Xilosa Lactosa selectivos
 Práctica No. 7 Nombre la práctica: Método para la terminación Salmonella en alimentos Objetivo: Intificación Salmonella en una muestra carne NOM: NOM-114-SSA1-1994 Muestra utilizada: Carne picada Características
Práctica No. 7 Nombre la práctica: Método para la terminación Salmonella en alimentos Objetivo: Intificación Salmonella en una muestra carne NOM: NOM-114-SSA1-1994 Muestra utilizada: Carne picada Características
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FAULTAD DE CIENCIAS QUÍMICAS MAESTRIA EN CIENCIAS EN CIENCIA Y TECNOLOGIA DE ALIMENTOS
 UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FAULTAD DE CIENCIAS QUÍMICAS MAESTRIA EN CIENCIAS EN CIENCIA Y TECNOLOGIA DE ALIMENTOS LABORATORIO DE MICROBIOLOGÍA DE ALIMENTOS Recuento de bacterias mesófilas, psicrófilas
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FAULTAD DE CIENCIAS QUÍMICAS MAESTRIA EN CIENCIAS EN CIENCIA Y TECNOLOGIA DE ALIMENTOS LABORATORIO DE MICROBIOLOGÍA DE ALIMENTOS Recuento de bacterias mesófilas, psicrófilas
revolucionario Simplemente Une los puntos La fascinante historia detrás del pequeño punto rojo Une los puntos. Soluciones Punto-a-punto
 revolucionario La fascinante historia detrás del pequeño punto rojo Las placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo y la colaboración con otros científicos, condujo a nuevos descubrimientos
revolucionario La fascinante historia detrás del pequeño punto rojo Las placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo y la colaboración con otros científicos, condujo a nuevos descubrimientos
Petrifilm. Placas para Recuento de E. coli y Coliformes. Guía de Interpretación. E. coli : E. coli es capaz de crecer en medios conteniendo
 Guía de Interpretación Petrifilm Placas para Recuento de E. coli y Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de E. coli y Coliformes
Guía de Interpretación Petrifilm Placas para Recuento de E. coli y Coliformes Esta guía sirve para familiarizarse con los resultados obtenidos en las placas M Petrifilm para Recuento de E. coli y Coliformes
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO. OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico.
 GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
GUÍA DE LABORATORIO Nº 1 MEDIOS DE CULTIVO OBJETIVO Comprender la utilidad de los medios de cultivo en el trabajo microbiológico. MATERIALES Placas de agar sangre y agar McConkey. Tubos con agar TSI, agar
100 años. 3M en. Queridos lectores: más de. éxito. Historia. Visítenos en: www.com.mx/microbiologia
 Micro Recuento de microorganismos coliformes en productos lácteos Buenas Prácticas de laboratorio para maximizar los beneficios de las Placas Petrifilm Ficha coleccionable: 3M Placas Petrifilm de Alta
Micro Recuento de microorganismos coliformes en productos lácteos Buenas Prácticas de laboratorio para maximizar los beneficios de las Placas Petrifilm Ficha coleccionable: 3M Placas Petrifilm de Alta
M I C R O B I O L O G Í A D E A L I M E N T O S 1588 DEPARTAMENTO DE BIOLOGÍA. 5o. NÚMERO DE HORAS/SEMANA Teor. 3 Pract.
 M I C R O B I O L O G Í A D E A L I M E N T O S 1588 DEPARTAMENTO DE BIOLOGÍA UBICACIÓN SEMESTRE 5o. TIPO DE ASIGNATURA TEÓRICO-PRÁCTICA NÚMERO DE HORAS/SEMANA Teor. 3 Pract. 4 CRÉDITOS 10 INTRODUCCIÓN.
M I C R O B I O L O G Í A D E A L I M E N T O S 1588 DEPARTAMENTO DE BIOLOGÍA UBICACIÓN SEMESTRE 5o. TIPO DE ASIGNATURA TEÓRICO-PRÁCTICA NÚMERO DE HORAS/SEMANA Teor. 3 Pract. 4 CRÉDITOS 10 INTRODUCCIÓN.
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO )
 PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
PRÁCTICAS DE MICROBIOLOGÍA CLÍNICA (CURSO 2012 2013) PRÁCTICAS A REALIZAR ANÁLISIS CUALITATIVO DE ORINA PRUEBA DE BAUER KIRBY (ANTIBIOGRAMA) PRUEBA DE EPSILON (DETERMINACIÓN DE LA CMI) ANÁLISIS CUALITATIVO
MICROBIOLOGÍA SANITARIA
 MANUAL DE Laboratorio de Análisis Clínicos FCQ.UACH ELABORÓ REVISÓ APROBÓ Nombre Q.B.P. David Quiroz Cardoza M.A. Carmen Alicia Murillo Nevárez M.A. Oscar René Valdez Domínguez Puesto Departamento de Microbiología
MANUAL DE Laboratorio de Análisis Clínicos FCQ.UACH ELABORÓ REVISÓ APROBÓ Nombre Q.B.P. David Quiroz Cardoza M.A. Carmen Alicia Murillo Nevárez M.A. Oscar René Valdez Domínguez Puesto Departamento de Microbiología
COLEGIO DE BACHILLERES PLANTEL 5
 COLEGIO DE BACHILLERES PLANTEL 5 LABORATORIO DE QUIMICA III PLAN 2009 PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Reconocer que los cambios están acompañados de cambios de energía a partir de
COLEGIO DE BACHILLERES PLANTEL 5 LABORATORIO DE QUIMICA III PLAN 2009 PRACTICA # 1 CAMBIOS QUÍMICOS OBJETIVO DE LA PRÁCTICA: Reconocer que los cambios están acompañados de cambios de energía a partir de
PROCEDIMIENTO RECUENTO DE E COLI EN ALIMENTOS UTILIZANDO AGAR VRB-MUG
 PRT-712.02-037 Página 1 de 8 1. OBJETIVO Enumerar los microorganismos E. coli presentes en una muestra de alimento 2. CAMPO DE APLICACIÓN Y ALCANCE Muestras de alimentos que se requiera realizar método
PRT-712.02-037 Página 1 de 8 1. OBJETIVO Enumerar los microorganismos E. coli presentes en una muestra de alimento 2. CAMPO DE APLICACIÓN Y ALCANCE Muestras de alimentos que se requiera realizar método
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA
 UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
UNIVERSIDAD INTERAMERICANA DE PUERTO RICO RECINTO DE ARECIBO DEPARTAMENTO DE CIENCIAS Y TECNOLOGÍA BIOL 3405: LABORATORIO DE INMUNOLOGÍA I. TÍTULO Dilución II. OBJETIVOS Repasar el concepto de dilución
Revista Cubana de Plantas Medicinales. 2013;47(2):
 ARTÍCULO ORIGINAL Validación e implementación de una metodología para el análisis microbiológico de un producto líquido preservado, elaborado en una industria farmacéutica Validation and implementation
ARTÍCULO ORIGINAL Validación e implementación de una metodología para el análisis microbiológico de un producto líquido preservado, elaborado en una industria farmacéutica Validation and implementation
EXAMEN PRACTICO NIVEL II Tema: Microbiología General
 EXAMEN PRACTICO NIVEL II Tema: Microbiología General Puntaje Total: 50 puntos Introducción Una de las principales áreas de la Microbiología es la Microbiología diagnóstica, en la cual un microbiólogo aísla
EXAMEN PRACTICO NIVEL II Tema: Microbiología General Puntaje Total: 50 puntos Introducción Una de las principales áreas de la Microbiología es la Microbiología diagnóstica, en la cual un microbiólogo aísla
Cultivo Puro. Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica
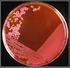 Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
Cultivo Puro Técnicas de aislamiento Mantenimiento y preservación de cultivos puros Morfología macroscópica Morfología microscópica Definición El cultivo puro representa las condiciones artificiales para
PROCEDIMIENTO EVALUACION DE MEDIOS DE CULTIVO PRT-712.00-105
 PRT712.00105 28102008 10012012 Página 1 de 25 1. OBJETIVO Asegurar la calidad de los medios de cultivos preparados en la Sección Microbiología de utilizados en los análisis microbiológicos de alimentos
PRT712.00105 28102008 10012012 Página 1 de 25 1. OBJETIVO Asegurar la calidad de los medios de cultivos preparados en la Sección Microbiología de utilizados en los análisis microbiológicos de alimentos
PROCEDIMIENTO ENUMERACION LISTERIA MONOCYTOGENES EN ALIMENTOS ISO 11290-2. MODIFICADO. PRT-712.02-093 Página 1 de 20
 PRT-712.02-093 Página 1 de 20 1. OBJETIVO Determinar el número de unidades formadoras de colonias (UFC) de Listeria monocytogenes en matrices de alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicable a
PRT-712.02-093 Página 1 de 20 1. OBJETIVO Determinar el número de unidades formadoras de colonias (UFC) de Listeria monocytogenes en matrices de alimentos. 2. CAMPO DE APLICACIÓN Y ALCANCE Aplicable a
SISTEMAS INTEGRALES DE CALIDAD
 SISTEMAS INTEGRALES DE CALIDAD Prácticas de empresa Sheila Estévez Martín SISTEMAS INTEGRALES DE CALIDAD Memoria de prácticas Las enfermedades provocadas por los alimentos en mal estado son, en el menor
SISTEMAS INTEGRALES DE CALIDAD Prácticas de empresa Sheila Estévez Martín SISTEMAS INTEGRALES DE CALIDAD Memoria de prácticas Las enfermedades provocadas por los alimentos en mal estado son, en el menor
UNIVERSIDAD DE EL SALVADOR FACULTAD DE QUÍMICA Y FARMACIA
 1 UNIVERSIDAD DE EL SALVADOR MANUAL PARA LA CONSERVACIÓN DE CEPAS BACTERIANAS DE TRABAJO SAN SALVADOR, EL SALVADOR, CENTRO AMERICA UNIVERSIDAD DE EL SALVADOR DEPARTAMENTO DE BIOQUIMICA Y Código CONTAMINACIÓN
1 UNIVERSIDAD DE EL SALVADOR MANUAL PARA LA CONSERVACIÓN DE CEPAS BACTERIANAS DE TRABAJO SAN SALVADOR, EL SALVADOR, CENTRO AMERICA UNIVERSIDAD DE EL SALVADOR DEPARTAMENTO DE BIOQUIMICA Y Código CONTAMINACIÓN
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS. Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011
 UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011 LECHE PASTEURIZADA DE VACA Leche de vaca para consumo humano, producto proveniente
UNIVERSIDAD AUTÓNOMA DE CHIHUAHUA FACULTAD DE CIENCIAS QUÍMICAS Dr. Iván Salmerón María A. Anaya Castro 4 de abril de 2011 LECHE PASTEURIZADA DE VACA Leche de vaca para consumo humano, producto proveniente
Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos.
 BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
BIPLACA HYCHECK Biplaca que se utiliza para evaluar la contaminación microbiológica de las superficies (Paredes, Techos, Equipos, Pisos, etc.) o Líquidos. Son estadísticamente comparables a una Torunda
Control de Esterilidad para medicamentos de terapias avanzadas. Susana López Hernández División de Productos Biológicos y Biotecnología AEMPS
 Control de Esterilidad para medicamentos de terapias avanzadas Susana López Hernández División de Productos Biológicos y Biotecnología AEMPS Control de la Esterilidad para medicamentos de terapias avanzadas
Control de Esterilidad para medicamentos de terapias avanzadas Susana López Hernández División de Productos Biológicos y Biotecnología AEMPS Control de la Esterilidad para medicamentos de terapias avanzadas
Título de la gráfica: Crecimiento/ No crecimiento
 Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
Resultados de la semana anterior (TSB) Título de la gráfica: # tubo TSB 1-24 Crecimiento/ No crecimiento Descripción del crecimiento Resultados de la semana anterior (TSA slant) Título de la gráfica: tubo
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I
 PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
PRÁCTICAS DEL LABORATORIO DE MICROBIOLOGÍA GENERAL Trimestre 14-I P # 1 P # 2 P # 3 P # 4 P # 5 P # 6 Uso y cuidados en el manejo del Microscopio Esterilización de materiales y medios Técnicas de Tinción
Objetivo Describir el efecto de los factores ambientales, su concentración, así como de agentes químicos en el crecimiento de los microorganismos.
 Unidad 8. Condiciones ambientales para el desarrollo, inhibición y destrucción de microorganismos. Práctica 8. Crecimiento Microbiano. Efecto de los factores ambientales y químicos Objetivo Describir el
Unidad 8. Condiciones ambientales para el desarrollo, inhibición y destrucción de microorganismos. Práctica 8. Crecimiento Microbiano. Efecto de los factores ambientales y químicos Objetivo Describir el
CAPÍTULO 2 MATERIALES Y MÉTODOS. En los experimentos de desinfección conducidos en este proyecto se utilizaron
 CAPÍTULO 2 MATERIALES Y MÉTODOS 2.1 Preparación de Microorganismos En los experimentos de desinfección conducidos en este proyecto se utilizaron esporas de B. subtilis. La Tabla 2.1 muestra una relación
CAPÍTULO 2 MATERIALES Y MÉTODOS 2.1 Preparación de Microorganismos En los experimentos de desinfección conducidos en este proyecto se utilizaron esporas de B. subtilis. La Tabla 2.1 muestra una relación
Placas Petrifilm MR Aspectos Técnicos Relevantes
 Placas Petrifilm MR Aspectos Técnicos Relevantes Placas Petrifilm MR Qué son y para que se usan? Son medios de cultivo en formato listo para sembrar la muestra Constituidas de adhesivos, películas y nutrientes
Placas Petrifilm MR Aspectos Técnicos Relevantes Placas Petrifilm MR Qué son y para que se usan? Son medios de cultivo en formato listo para sembrar la muestra Constituidas de adhesivos, películas y nutrientes
3M Petrifilm Simplemente rápidas, precisas y productivas
 3M Petrifilm Simplemente rápidas, precisas y productivas Simplemente revolucionario El pequeño punto rojo que cambió la microbiología Las Placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo
3M Petrifilm Simplemente rápidas, precisas y productivas Simplemente revolucionario El pequeño punto rojo que cambió la microbiología Las Placas 3M Petrifilm comenzaron con la curiosidad de un microbiólogo
Clostridium perfringens
 Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Clostridium perfringens Introducción Cuando se lanza un producto alimentario al mercado se deben tener en cuenta varios parámetros que le otorgan calidad al producto, uno de ellos es la inocuidad. Los
Laboratorio de Ensayo Acreditado Nº LE-079. Suplilab S.A. Acreditación inicial otorgada el 31 de Agosto del 2010.
 Laboratorio de Ensayo Acreditado Nº LE-079 El Ente Costarricense de Acreditación, en virtud de la autoridad que le otorga la ley 8279, declara que Suplilab S.A. Ubicado en las instalaciones indicadas en
Laboratorio de Ensayo Acreditado Nº LE-079 El Ente Costarricense de Acreditación, en virtud de la autoridad que le otorga la ley 8279, declara que Suplilab S.A. Ubicado en las instalaciones indicadas en
Medición del crecimiento Microbiano
 Medición del crecimiento Microbiano Determinación del número de microorganismos en una muestra. Determinación de la actividad metabólica, biomasa y proteínas. Métodos para el conteo de microorganismos
Medición del crecimiento Microbiano Determinación del número de microorganismos en una muestra. Determinación de la actividad metabólica, biomasa y proteínas. Métodos para el conteo de microorganismos
