Int. Cl. 6 : A61K 31/14
|
|
|
- María del Pilar Toledo Nieto
- hace 8 años
- Vistas:
Transcripción
1 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES k Número de solicitud: k Int. Cl. 6 : A61K 31/14 A61K 31/16 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación: k Solicitante/s: María Rosaĺıa García Núñez Porto Cristo, 9 B Alcorcón, Madrid, ES k 43 Fecha de publicación de la solicitud: k 72 Inventor/es: García Núñez, María Rosaĺıa k 43 Fecha de publicación del folleto de la solicitud: k 74 Agente: Esteban Pérez-Serrano, M ā Isabel k 4 Título: Composiciones antirretrovirales que contienen compuestos iodados. k 7 Resumen: Composiciones antirretrovirales que contienen compuestos iodados. Composiciones antivirales útiles para tratar la infección causada por un retrovirus comprenden unos compuestos iodados de fórmulas generales (I y II) donde n y m son n os enteros (de a y de 1 a respectivamente) y R es un grupo alquilo o alquenilo de hasta átomos de carbono. Estas composiciones son capaces de reducir o inhibir el poder infeccioso del virus de la inmuno deficiencia humana (VIH) in vitro, por lo que pueden ser potencialmente útiles para la elaboración de medicamentos aplicables en el tratamiento combinado del SIDA y otras enfermedades causadas por retrovirus. O // R-C CH 3 \ NH-(CH 2 ) m N-CH 3 + I (II) CH 3 Venta de fascículos: Oficina Española de Patentes y Marcas. C/Panamá, Madrid
2 DESCRIPCION Composiciones antirretrovirales que contienen compuestos iodados Campo de la invención La invención se refiere, en general, al tratamiento de infecciones virales. Más particularmente, la invención proporciona composiciones antivirales capaces de reducir o inhibir el efecto infeccioso del Virus de la Inmunodeficiencia Humana (VIH), agente etiológico del Síndrome de la Inmunodeficiencia Adquirida (SIDA), por lo que pueden ser utilizadas para la formulación de composiciones farmacéuticas útiles en el tratamiento de dicha enfermedad. Antecedentes de la invención El Virus de la Inmunodeficiencia Humana (VIH) es el agente causante reconocido del Síndrome de la Inmunodeficiencia Adquirida (SIDA). El VIH pertenece al grupo de virus denominado retrovirus, los cuales contienen ácido ribonucleico (ARN) como material genético y la enzima transcriptasa reversa (TR) que se encarga de convertir el ARN vírico en ADN (ácido desoxirribonucleico). El virión del VIH consta de una membrana formada por una bicapa lipídica procedente de la membrana externa de la célula hospedadora. De dicha membrana sobresalen unas glicoproteínas que poseen dos componentes, el gp41 (que atraviesa la membrana de un lado a otro) y el gp1 (que sobresale). La cubierta formada por la membrana y las glicoproteínas engloba el núcleo del virión que está formado por las proteínas P24 (o P2) y P18. En dicho núcleo se encuentra además el ARN vírico y la TR [Gallo R. C., Libros de Investigación y Ciencia, El SIDA, 1 ā Ed.(1989), pág.31-41, Editorial Prensa Científica S.A.]. El genoma del VIH contiene, al menos, 9 genes flanqueados por las repeticiones terminales largas (LTR), regiones que no codifican para ninguna proteína pero que sirven para iniciar la expresión de otros genes víricos [Haseltine W. A. et al., Libros de Investigación y Ciencia, El SIDA, 1 ā Ed.(1989), pág. 42-1, Editorial Prensa Científica SA]. El VIH se une a los linfocitos T4 debido a que la proteína CD4, situada en la superficie de los linfocitos T4, sirve como receptor o sitio de unión al VIH [Dalgleish A. G. et al., Nature 312: (198)]. Adicionalmente, el VIH también puede unirse a los macrófagos [Gallo R. C. citado supra]. El ciclo vital del VIH requiere que el virus entre en el paciente huésped a través de la actividad sexual o por medio de una transfusión sanguínea o vía materno-filial y después se una a los receptores situados en las células diana (linfocitos T4). A continuación, la cubierta del virus se funde con la membrana del linfocito y se libera el contenido del virión en el citoplasma donde la TR sintetiza una cadena de ADN complementariaaladearnvírico. Más adelante, y a medida que se degrada el ARN, se elabora la segunda cadena de ADN y ahora el ADN bicatenario migra al núcleo de la célula hospedadora, adopta una estructura circular y se integra al azar en los cromosomas de dicha célula hospedadora. Posteriormente, el ADN vírico se transcribe en ARN que se traduce en proteínas. Las proteínas sintetizadas y el ARN vírico se ensamblan y forman un nuevo virión que, tras incorporar material lipídico de la membrana celular externa, sale al medio extracelular [Gallo R. C., citado supra, pág ]. El SIDA es una enfermedad que se caracteriza por una disminución inexorable de las células T coadyuvantes/ inductoras (CD4+). La patología del SIDA se manifiesta, entre otras causas, por pérdida de la respuesta proliferativa de células T in vitro, producción excesiva de inmunoglobulina por células B y pérdida de respuesta de las células T citotóxicas in vitro. Como consecuencia de estas alteraciones se reduce drásticamente la respuesta inmune mediada por células T y se presentan infecciones oportunistas y/o tumores que, en la mayoría de los casos, conducirán a la muerte del paciente de SIDA. No obstante, a medida que se ha ido conociendo la biología molecular del VIH, agente etiológico del SIDA, se han ido desarrollando diferentes líneas de investigación con la esperanza de detener y revertir la inmunodeficiencia progresiva observada en los pacientes de SIDA y de encontrar un agente antiviral capaz de impedir la replicación del VIH y su citopatogenicidad de las células del sistema inmune. Mitsuya y Broder [Nature (1987) Vol. 32, págs ] han realizado una excelente revisión sobre las estrategias para la terapia antiviral en SIDA. Más recientemente, González Lahoz y Adrados de Llanos [Revista Clínica Española, Vol. 190, N 1, Junio 1992] han actualizado una revisión sobre el tratamiento del SIDA y de su patología asociada. En particular, estos autores mencionan los agentes anti-vih conocidos y/o que se están ensayando tanto in vitro como in vivo. Se conocen muchos fármacos que tienen la capacidad de inhibir al VIH, aunque pocos son capaces de demostrar una eficacia clínica que haga aconsejable su empleo en los pacientes de SIDA. Entre los agentes anti-vih de los que se tiene mayor experiencia clínica se encuentran: azido- 2
3 timidina (zidovudina o AZT), didesoxinosina (ddi), didesoxicitidina (ddc), ribavirina y alfa-interferón El AZT, que actúa inhibiendo la TR, es el agente antiretroviral más habitualmente utilizado, aunque produce efectos tóxicos que afectan a la médula ósea y produce cuadros de hipocelularidad que provocan anemia, leucopenia y neutropenia. La ddi es el primer anti-retroviral alternativo al AZT, produce menos efectos secundarios y se utiliza en pacientes en los que el AZT no produce efecto. La ddc tiene un efecto antivírico in vitro más potente que el del AZT aunque su uso clínico se ha visto muy restringido por su toxicidad ya que produce graves cuadros de neuropatías periféricas. Los resultados obtenidos en diferentes ensayos realizados con ribavirina y con alfainterferón han sido poco esperanzadores. Actualmente algunos grupos de investigadores están trabajando en fármacos a base de CD4 soluble recombinante, que actúa bloqueando la unión del VIH al receptor CD4 del linfocito T4 o del macrófago e impide la formación de sincitios. Esta alternativa presenta la ventaja adicional de que el CD4 soluble recombinante es capaz de atravesar la placenta, por lo que puede controlar la transmisión de la infección por la vía materno-fetal aunque presenta el inconveniente de que su vida media es muy corta. Otra alternativa, actualmente en estado embrionario, que se cree puede resultar útil para combatir al VIH consiste en combinar distintos medicamentos anti-vih que actúen a distinto nivel del ciclo vital del VIH. Aunque se han ido aportando soluciones y se prevén nuevas alternativas, sigue existiendo la necesidad de encontrar un agente antiretroviral que sea efectivo y carezca de los efectos tóxicos indeseables previamente citados. En este sentido la presente invención proporciona nuevas composiciones que han demostrado poseer un potente efecto inhibidor del VIH in vitro. Algunas de las composiciones antivirales proporcionadas por esta invención son conocidas, ya que han sido descritas en la solicitud de Patente española n P963, a nombre del titular de esta solicitud de Patente, donde se describe su empleo como desinfectante industrial, en composiciones germicidas y/o fungicidas así como para combatir la infección nosocomial en hospitales. Más aún, la solicitud de patente PCT publicada con el n WO 93/00813, así como la solicitud de patente Europea publicada con el n , ambas a nombre del titular de esta solicitud de patente, mencionan la efectividad de dichas composiciones frente a tres tipos distintos de microorganismos: bacterias, levaduras y hongos (Staphylococcus aureus, Saccharomyces ellipsoideus y Penicillum crysogenum). Ninguno de los antecedentes citados sugiere que dichas composiciones germicidas fueran capaces de inactivar la infección causada por el VIH. Ahora se ha encontrado, sorprendentemente, que algunas de las composiciones previamente citadas son capaces de inhibir o inactivar la expresión de VIH in vitro, como lo ponen de manifiesto los ensayos realizados sobre células MT4 en las que se ha evaluado (i) el efecto citopatogénicoen dichas células cuando se sometían a una sobre-exposición con VIH tratado con una composición antiviral de las proporcionadas por esta invención y (ii) la expresión de VIH medida en los sobrenadantes de los cultivos celulares como expresión de actividad transcriptasa reversa y como detección y medida del antígeno P2. Como es conocido, el antígeno P2 se libera cuando se produce la lisis del VIH, por lo que puede detectarse mediante una reacción de complejamiento con un anticuerpo anti-p2 y a partir de ahí evaluarla cantidad de virus. Por consiguiente, la presente invención tiene por objeto el empleo de ciertas composiciones iodadas para inhibir o inactivar el poder infeccioso de los retrovirus en general y del VIH en particular, y consecuentemente, el empleo de dichas composiciones en la elaboración de un medicamento útil para tratar la infección causada por los retrovirus y especialmente por el VIH y para colaborar en la terapia contra el SIDA. Adicionalmente, la invención también proporciona nuevas composiciones antivirales útiles en el tratamiento del SIDA y capaces de contrarrestar la infección causada por el VIH y por otros retrovirus. Breve descripción de las figuras La figura 1 muestra la cantidad de antígeno P2 presente en los sobrenadantes de los cultivos de células MT4 inoculadas con virus VIH-1 tratado con una composición antiviral proporcionada por esta invención y en los sobrenadantes de cultivos de células MT4 inoculadas con testigos positivos y testigos negativos. La figura 2 muestra una curva de referencia del antígeno P2 que permite cuantificar el antígeno P2 eventualmente presente en los sobrenadantes de los cultivos probados. 3
4 Descripción detallada de la invención La invención proporciona composiciones antiretrovirales capaces de, particularmente, reducir o inactivar el poder infeccioso del VIH que, por consiguiente, pueden ser utilizadas en el tratamiento del SIDA. Las composiciones antivirales proporcionadas por esta invención están constituidas por: a) al menos, un ioduro de alquildimetilbencilamonio de fórmula general (I) 2 donde n es un número entero comprendido entre y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el 0%, preferentemente del 4%; b) al menos, un ioduro de una amida de amonio cuaternario de fórmula general (II) 3 O // R-C CH 3 \ NH-(CH 2 ) m N-CH 3 + I (II) CH donde R es un radical alquilo de hasta átomos de carbono, o un radical alquenilo de hasta átomos de carbono; y m es un número entero comprendido entre 1 y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %, preferentemente del %; c) al menos, un alcohol graso con 8 grupos oxietilenados en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el y el %, preferentemente del %; d) iodo metálico sublimado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 2% y el 6%, preferentemente del 4%; e) al menos, un monoglicérido de un ácido graso polioxietilenado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el y el %, preferentemente del %; f) glicerina, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 3% y el 7%, preferentemente del %; g) hexilenglicol, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %, preferentemente del 16%; y h) al menos, un ácido inorgánico, en una cantidad adecuada para situar el ph de la composición en un intervalo comprendido entre 4 y 6, preferentemente a 4.. 4
5 2 La expresión grupo alquilo de hasta átomos de carbono, en el sentido utilizado en esta descripción, se refiere a restos de hidrocarburos de cadena lineal, cíclica o ramificada que puede contener de 1 a átomos de carbono. Análogamente, la expresión grupo alquenilo de hasta átomos de carbono, se refiere a restos de hidrocarburos de cadena lineal, cíclica o ramificada que puede contener de 1 a átomos de carbono y que presenta al menos, una insaturación en cualquier posición del radical. Por alcohol graso con 8 grupos oxietilenados debe entenderse un alcohol de 12 a átomos de carbono, ambos inclusive, que contiene 8 grupos epoxi en cualquier posición de su molécula. Ejemplos de estos alcoholes, aunque sin limitarse exclusivamente a ellos, son los comercializados por ICI, PULCRA, KAO y REWO bajo las marcas Synperonic A7/A9, Pulcra KQ33/KQ, Findet 1618/13/ y Rewopal LA3/TA11 respectivamente. Asimismo, por monoglicérido de un ácido graso polioxietilenado debe entenderse un compuesto formado por una molécula de glicerol que tiene esterificada uno de sus grupos hidroxilo con un resto de un ácidograsode12aátomos de carbono que contiene de 4 a grupos oxietilenados en cualquier posición permitida de la molécula. Ejemplos de este tipo de monoglicéridos son los compuestos comercializados por KAO, REWO y PULCRA bajo las denominaciones Findet OR/16/22, Rewoderm LI 4/ES90 y Pulcra KC11/LC respectivamente, aunque sin limitarse exclusivamente a los mismos. Como ácido inorgánico puede utilizarse cualquier ácido capaz de proporcionar a la composición antiviral un valor de ph comprendido entre 4 y 6 preferentemente de 4.. Entre estos ácidos pueden utlilizarse el ácido nítrico, el sulfúrico y similares, excepto el ácido clorhídrico, preferentemente el ácido fosfórico. Como se ha mencionado anteriormente, estas composiciones pueden prepararse según el procedimiento general descrito en la solicitud de patente española n ES 963 o en la solicitud de patente Europea publicada n Una composición antiviral particularmente preferida es la constituida por: a) Ioduro de estearil-dimetil-bencil-amonio 4% b) Ioduro de N-1-(3-trimetilamonio)-propil-undecilenamida % c) Alcohol graso con 8 grupos oxietilenados % d) Iodo metálico sublimado 4% e) Monoglicérido de ácido graso polioxietilenado % f) Glicerina % g) Hexilenglicol 16% h) Acido fosfórico, en cantidad suficiente para situar el ph de la composición a 4.; donde todas las proporciones expresadas son en % respecto al peso total de la composición antiviral. Al objeto de determinar si las composiciones de esta invención son capaces de inactivar al menos partículas infecciosas del VIH, lo que demostraría su potencial aplicación en el tratamiento del SIDA, se realizaron una serie de tests tendentes a demostrar si virus VIH tratados con alguna de las composiciones antivirales de esta invención cuando se inoculaban sobre células apropiadas y se cultivaban en condiciones adecuadas producíanlamuertededichascélulas y si en los sobrenadantes de dichos cultivos se detectaba (i) actividad transcriptasa reversa (TR) y/o (ii) antígeno P2. Por tanto, se hicieron unas pruebas de infectividad que básicamente consistían, en una 1 ā etapa, en tratar virus VIH, con alguna de las composiciones antivirales de esta invención a diferentes concentraciones y tiempos de contacto y, en una 2 ā etapa, inocular dichos virus VIH tratados sobre células MT4, línea de células linfoides T transformadas con HTLV-1 (Human T-Lymphotropic Virus-1), que manifiestan un efecto citopatogénico y la muerte,al cabo de 8- días post-infección, de más del 80% cuando se someten a una sobre-exposición con VIH. La prueba sobre células MT4 proporciona una respuesta rápida ya que días después de la infección de las células MT4 por el VIH se puede observar (i) un efecto citopatogénico y (ii) detectar actividad TR en los sobrenadantes de los cultivos de las muestras infectadas. Dicho efecto citopatogénico se relaciona directamente con la cantidad de virus utilizado para la infección, con su replicación y con la expresión de antígenos virales por las células. La inhibición de este efecto se corresponde con una inhibición de la multiplicación del virus que se sigue midiendo la actividad de TR en los sobrenadantes del cultivo. Las células MT4 se cultivan en un medio constituido por RPMI 16 (WITTAKER) suplementado con
6 un % de suero de ternera fetal (LABSYSTEM), 1% de antibióticos (PSN GIBCO) y 1% de glutamina (GIBCO). 2 Las composiciones proporcionadas por esta invención han demostrado ser capaces de inactivar o reducir el efecto infeccioso del VIH in vitro en células MT4, como se pone de manifiesto en el Ejemplo 2 que acompaña a esta descripción. Asimismo, se demuestra que el tratamiento del virus durante 1 minuto con una de las composiciones antivirales preferidas de la presente invención diluida al 1% ó al % es capaz de reducir veces el poder infeccioso del VIH en células transformadas de origen linfocitario CD4+. El mecanismo por el cual estas composiciones antivirales son capaces de reducir o inactivar el poder infeccioso del VIH no se conoce completamente, aunque los resultados obtenidos hipotéticamente sugieren que actúa inhibiendo la acción de la transcriptasa reversa (TR), probablemente provocando un cambio conformacional en dicha enzima bien porque cambie la conformación de la polimerasa o de la ribonucleasa constituyentes de la TR. De confirmarse esta suposición, las composiciones de esta invención podrían ser útiles para reducir o inhibir el poder infeccioso de cualquier retrovirus ya que dichos virus tienen en común la presencia de la enzima TR con actividad polimerasa y ribonucleasa. Por consiguiente, la invención también proporciona composiciones antiretrovirales que pueden utilizarse para reducir o inhibir el poder infeccioso de cualquier retrovirus. Las composiciones antivirales de esta invención pueden utilizarse para la elaboración de medicamentos y composiciones farmacéuticas para el tratamiento de la infección causada por retrovirus, especialmente por el VIH y para colaborar en el tratamiento del SIDA. Dichos medicamentos o composiciones farmacéuticas pueden prepararse combinando una cantidad terapéuticamente efectiva de composición antiviral proporcionada por esta invención junto con los correspondientes vehículos farmacéuticamente aceptables. A continuación se describen algunos ejemplos que sirven para ilustrar una forma concreta de realizar la invención sin que deba ser considerada en sentido limitativo del alcance de la misma. Ejemplos Ejemplo Tratamiento de virus VIH 1.A Caracterización de los virus utilizados El VIH-1 (cepa LAI) utilizado en estos Ejemplos ha sido suministrado por el Institut Pasteur, que lo produce sobre células linfoblastoides T crónicamente infectadas (línea CEM-VIH-1/LAI). Cada 3 ó 4 días, se centrifugan las células, se mantienen en suspensión en medio de cultivo fresco (RPMI 16 conteniendo % de suero de ternera fetal, 1% de antibióticos y 1% de glutamina) y se mezclan al 0% con células CEM (linfocitos CD4+ inmaduros) no infectadas hasta alcanzar una concentración final de 0,. 6 células/ml, al objeto de mantener la producción viral. El virus presente en el sobrenadante se concentra por centrifugación a rpm durante 3 horas y el residuo se resuspende en tampón NTE, se reparte en volúmenes pequeños y se almacena a -80 C. El virus VIH-1/cepa LAI (en adelante virus VIH-1) utilizado en los experimentos que siguen a continuación tiene un título de: (i) 7 UI/ml (Unidades Infecciosas) para las células MT4, y de (ii) 4. 9 cpm/ml en actividad de transcriptasa reversa (TR). 1.B Caracterización de las composiciones antivirales utilizadas para el tratamiento del virus VIH-1 Para el tratamiento de los virus VIH-1 caracterizados en el Ejemplo 1.A se ha utilizado la composición antiviral, proporcionada por esta invención, constituida por: 6
7 a) Ioduro de estearil-dimetil-bencil-amonio 4% b) Ioduro de N-1-(3-trimetilamonio)-propil-undecilenamida % c) Alcohol graso con 8 grupos oxietilenados % d) Iodo metálico sublimado 4% e) Monoglicérido de ácido graso polioxietilenado % f) Glicerina % g) Hexilenglicol 16% h) Acido fosfórico en cantidad suficiente para situar el ph a 4., donde todas las proporciones expresadas son en % respecto al peso total de la composición antiviral. mezcla de varios productos de los citados en la memoria. 2 1.C Tratamiento del VIH-1 con una composición antiviral El virus VIH-1 caracterizado en el Ejemplo 1.A se diluyó hasta una dilución 1/12, (con un título teórico de 0,8. 6 UI/ml sobre células MT4) utilizando soluciones al 0%, %, % y 1% de la composición antiviral descrita en el Ejemplo 1.B. Los tiempos de contacto con dichas soluciones fueron de 1 y 3 minutos, a temperatura ambiente. Se prepararon las muestras de virus tratados con la composición antiviral descrita previamente que se mencionan a continuación, utilizándose en cada caso 80 µl de VIH-1 que se diluyeron en 1 ml de composición antiviral a distintas concentraciones. Después de dejar en contacto la mezcla virus/composición antiviral durante un período de 1 ó 3 minutos(según el caso) a temperatura ambiente, se añadieron ml de tampón NTE (excepto en la muestra NG12 ya que se utilizaron ml de medio de cultivo RPMI). A continuación se identifican las muestras preparadas conteniendo virus y composición antiviral, indicando en cada caso, el tiempo de contacto y la concentración de la composición antiviral Código muestra Tiempo contacto Concentración de la (min) composición antiviral (%) NG8 1 1 NG9 1 NG 1 NG NG NG13 3 NG14 3 NG 3 0 Inmediatamente después de la segunda dilución, las muestras se centrifugaron durante 3 minutos a.000 rpm, al objeto de concentrar el virus residual y de eliminar la composición antiviral tóxica para las células del test de infectividad. Después de la centrifugación, el residuo se recoge en 0, ml de medio de cultivo (RPMI), se reparte en pequeños volúmenes y se almacena a -80 C. Adicionalmente se prepararon unos testigos positivos y unos testigos negativos. Los testigos positivos (virus sin composición antiviral) fueron los siguientes: NG1: formado por el virus VIH-1 diluido al 1/12, en medio de cultivo y congelado a -80 C; NG2: formado por el virus VIH-1 diluido al 1/12, en medio de cultivo y posteriormente diluido y centrifugado de la misma manera que las muestras de virus tratados con la composición antiviral (NG8 a NG), al objeto de evaluar la pérdida de infectividad durante la etapa de centrifugación; y NG3: formado por el virus VIH-1 diluido al 1/12, en medio de cultivo, dejado a temperatura ambiente durante la duración máxima de la experiencia (3 minutos) y posteriormente diluido y centrifugado de la 7
8 misma manera que las muestras tratadas (NG8 a NG), al objeto de evaluar la pérdida de infectividad debida a las condiciones experimentales. Los testigos negativos (composición antiviral sin virus) fueron los siguientes: NG4: 1 ml de composición antiviral al 1% se diluyó en ml de medio de cultivo y posteriormente se centrifugó en las mismas condiciones que las descritas arriba para las muestras de los virus tratados con la composición antiviral, al objeto de controlar la toxicidad eventual sobre las células del test de infectividad que fuera debida a trazas de composición antiviral residual no eliminada durante la centrifugación; NG: como NG4 pero utilizando una composición antiviral con una concentración del %; NG6: como NG4 pero utilizando una composición antiviral con una concentración del %; y NG7: como NG4 pero utilizando una composición antiviral con una concentración del 0%. Las células del test de infectividad, no infectadas. 2 Ejemplo 2 Evaluación del poder infeccioso residual de las muestras de virus tratadas sobre células MT4 Para evaluar el poder infeccioso residual de las muestras de VIH-1 tratadas con la composición antiviral del Ejemplo 1.B, sobre células MT4, se realizaron las siguientes pruebas: A. Determinación del efecto citopatogénico in vitro sobre células MT4 sometidas a una sobreexposición del virus; B. Determinación de la actividad transcriptasa reversa (TR) presente en los sobrenadantes de los cultivos celulares; y C. Detección y medida del antígeno P2 presente en los sobrenadantes de los cultivos celulares. 3 2.A Determinación del efecto citopatogénico in vitro Se depositaron 3. células de MT4 en los pocillos de placas COSTAR de 24 pocillos, y se añadieron 0,2 ml ó 0,1 ml de cada muestra de virus tratado con la composición antiviral del ejemplo 1.B al 1% o al % respectivamente (día 0 o de infección). Los pocillos se rellenaron hasta 1 ml con medio de cultivo (RPMI 16), obteniéndose unas diluciones finales de las muestras de 1/4 y de 1/. Las muestras de virus tratados con la composición antiviral al % y al 0%, se probaron de la misma manera pero a diluciones finales de 1/0 y de 1/0. 4 Las tres muestras de los testigos positivos (NG1, NG2 y NG3) se probaron de forma idéntica, pero a diluciones de 4 a 6. Cada muestra se probó por duplicado. 0 Al cabo de 3 días (día +3 post-infección) a 37 C, se reemplazaron 70 µl de sobrenadante por medio de cultivo fresco y las célulassediluyeronde3a4veces para ajustarlas a una concentración de 3. células/ml. El día +6 (post-infección), se observaron las células al microscopio y el efecto citopatogénico, y la concentración célular se ajustó denuevoa3. células/ml. El día + (post-infección) se evaluó el efecto citopatogénico y la mortalidad célular por observación al microscopio tras tinción con azul de tripano. Se apreció una fuerte toxicidad sobre las células MT4 con la dilución 1/4 de los testigos negativos (sin virus) NG4 y NG, con las diluciones 1/4 y 1/ de NG6 y con las diluciones 1/4, 1/ y 1/0 de NG7. Como podrá apreciarse a continuación, sólo se presentan los resultados obtenidos a partir de las muestras inoculadas con diluciones no tóxicas para las células, es decir 1/ para los tratamientos al 1% y al %; 1/0 para el tratamiento al % y 1/0 para el tratamiento al 0%. 8
9 En la Tabla I, puede apreciarse el efecto citopatogénico observado sobre células MT4 inoculadas con las muestras de los virus testigo o las muestras de los virus tratados con una de las composiciones antivirales proporcionadas por esta invención, concretamente la descrita en el Ejemplo 1.B. Tabla I Infectividad del VIH-1, tratado o no tratado con una composición antiviral, para la línea célular NT4: Análisis del efecto citopatogénicoalosdías post-infección. Muestra Dilución ECP A NG NG NG B NG4 1/4 1/ NT NG 1/4 1/ NT NG6 1/4 1/ 1/0 NT NG7 1/4 1/ 1/0 1/0 NT C D NG8 1/ NG9 1/ NG 1/0 NG11 1/0 NG12 1/ NG13 1/ NG14 1/0 NG 1/0 4 0 ECP 0 : Efecto Citopatogénico, detectado al cabo de los días post-infección tras tinción con azul de tripano. Significados: : sin efecto citopatogénico; + : alrededor del 70% de las células muertas; y ++ : 0% de las células muertas. NT: No tóxico A: Testigos positivos (virus sin composición antiviral) B: Testigos negativos (sin virus) C: Testigo de células normales D: Muestras de los virus tratados con la composición antiviral A la vista de los resultados mostrados en la Tabla I no se observa ningún efecto citopatogénico cuando las células se han inoculado con las diluciones al 1/, o al 1/0 o al 1/0 de las muestras de virus tratados con la composición antiviral (NG8-NG), cualquiera que fuera la concentración de la composición 9
10 antiviral probada y los tiempos de contacto. Por el contrario, las muestras de los virus testigos (NG1, NG2 y NG3) provocaron el 0% de la mortalidad célular al día + post-infección, incluso cuando la inoculación de las células se realizó con una dilución más elevada ( 6 ). 2 2.B Medida de la actividad de Transcriptasa Reversa (TR) en los sobrenadantes de los cultivos celulares. La expresión de virus por las células MT4 inoculadas con las diferentes muestras ha sido seguida por la medida de la actividad TR en los sobrenadantes de los cultivos, y adicionalmente, por medida y detección del antígeno P2 en dichos sobrenadantes. La medida de la actividad TR se ha realizado a partir de los sobrenadantes de los cultivos celulares previamente obtenidos (Ejemplo 2.A) conservados a cada pasaje celular (días 3, 6 y ) para cada muestra (por duplicado). La actividad TR ha sido medida en 0, ml de los sobrenadantes citados arriba, concentrados 0 veces por ultracentrifugación a rpm durante min., en una centrífuga BECKMAN TL 0. El residuo se resuspendió en µl de NTE y 0,1% de Triton X0. La actividad enzimática se reveló por adición de µl de la mezcla reaccional siguiente: Tris 0mM ph 7,9; KCl mm, MgCl 2 mm, ditiotreitol 1 mm, poly ra 0,0 D.O./ml, oligo dt 12 18, 0,0 D.O./ml y 3 HTTP µci (actividad específica: Ci/mmol). Después de 1 hora a 37 C, se precipitaron los productos insolubles en medio ácido por adición de ácido tricloroacético al %, se filtró sobre un filtro Millipore 0,4 um y se midió la radiactividad β con la ayuda de un contador de centelleo (BETAmatic; KONTRON). En la Tabla II se muestran los resultados de la titulación de los testigos positivos (NG1-NG3) que han sido valorados a distintas diluciones al objeto de evaluar sus títulos infecciosos y de poder estimar la pérdida de poder infeccioso debida al tratamiento con la composición antiviral. En dicha Tabla II puede apreciarse que, a la dilución 6, los dos pocillos son positivos, bien el día6(ng2)obieneldía (NG1 y NG3). En estas condiciones experimentales, el título del virus se define como la inversa de la dilución infecciosa al 0% para las células MT4, por lo que el título de las soluciones virales NG1, NG2 y NG3 es superior o igual a 6 UI/ml. 3 (La Tabla II se muestra en la página siguiente) 4 0
11 Tabla II Test de infectividad sobre células MT4 in vitro Titulación de las diluciones de las muestras de virus no tratados con composición antiviral (testigos Positivos) Actividad TR en cpm/0, ml adía: Muestra Dilución ECP NG NG NG Células solas ECP 0 : Efecto Citopatogénico, detectado al cabo de los días post-infección tras tinción con azul de tripano. Significados: : sin efecto citopatogénico; + : alrededor del 70% de las células muertas; y ++ : 0% de las células muertas. 0 (*): La expresión viral ha sido evaluada por medida de la actividad TR en 0, ml de sobrenadantes de cultivo a los días 3, 6 y post-infección. Se considera positiva cuando la actividad TR es superior a 000 cpm/0, ml (cifras en negrilla). En la Tabla III se recogen los resultados de la expresión de actividad TR viral en los sobrenadantes de los cultivos celulares realizados inoculando células MT4 con las muestras de virus tratados con la composición antiviral (NG8 a NG). En esta tabla III se observa que todos los sobrenadantes de las células inoculadas con las muestras de los virus tratados son negativas en actividad TR independientemente de la concentración de la composición y del tiempo de contacto. 11
12 Tabla III Infectividad de VIH-1 tratado para la línea célular MT4 Expresión de la actividad TR viral en los sobrenadantes Actividad TR en cpm/0, ml adía: Muestra Dilución ECP NG8 1/ NG12 1/ NG9 1/ NG13 1/ NG 1/ NG14 1/ NG11 1/ NG 1/ Células solas ECP 0 : Efecto Citopatogénico, detectado al cabo de los días post-infección tras tinción con azul de tripano. Significados: : sin efecto citopatogénico; + : alrededor del 70% de las células muertas; y ++ : 0% de las células muertas. 0 (*): La expresión viral ha sido evaluada por medida de la actividad TR en 0, ml de sobrenadantes de cultivo a los días 3, 6 y post-infección. Se considera positiva cuando la actividad TR es superior a 000 cpm/0, ml. A la vista de los resultados negativos del efecto citopatogénico y de la expresión de virus extracelular detectado por medida enzimática, se puede concluirafirmando que la composición probada es eficaz para inactivar el poder infeccioso del virus VIH-1. 2.C Detección del antígeno P2 de VIH-1 en los sobrenadantes del cultivo célular. Como se ha mencionado antes, la expresión de virus por las células MT4 inoculadas con las muestras de virus tratados ha sido seguida además de por actividad TR por medida del antígeno P2 en los sobrenadantes de los cultivos celulares conservados a cada pasaje. 12
13 2 3 4 La medida del antígeno P2 se ha realizado a partir de los sobrenadantes de los cultivos inoculados con los virus tratados con la composición antiviral descrita en el Ejemplo 1.B a diferentes tiempos y concentraciones (Muestras NG8 a NG), y a partir de los sobrenadantes de los cultivos de las células infectadas con los virus testigo positivo (Muestras NG1, NG2 y NG3), conservadas a cada pasaje célular (días 3, 6 y ). Se ha aplicado una técnica inmunoenzimática altamente sensible, al objeto de confirmar los resultados obtenidos por la medida de la actividad TR en los mismos sobrenadantes. Para ello, se ha utilizado el kit ELAVIA AgI comercializado por la Société Diagnostics Pasteur que permite la detección de 0 a 0 picogramos de antígeno P2 por ml. El antígeno P2, liberado después de la lisis del virus eventualmente presente en las muestras probadas se acompleja con un anticuerpo monoclonal anti-p2 inmovilizado en los pocillos de las microplacas. El antígeno se revela entonces añadiendo anticuerpos policlonales anti-p2 marcados con biotina que son reconocidos por un conjugado estreptavidina-peroxidasa. La presencia del complejo se revela por medio de una reacción enzimática tras la adición de o-fenilendiamina. El producto de esta reacción es coloreado y posteriormente puede detectarse por medida de la densidad óptica a 492 nm. La cantidad de producto formado en el curso de la reacción enzimática es directamente proporcional a la cantidad de antígeno presente en la muestra probada. Como se ha podido apreciar (Ejemplo 2.B) los sobrenadantes en los que se evaluó la actividad TR dieron resultado negativo. Sin embargo, se ha podido comprobar que esos mismos sobrenadantes que dieron negativo en actividad TR contienen antígeno P2 (Figura 1). No obstante, se puede comprobar que la cantidad de antígeno P2 disminuye a medida que aumenta el número de pasajes celulares, lo que sugiere que la presencia de antígeno viral residual correspondiente al inóculo es eliminada progresivamente en el curso de dichos pasajes celulares. A la vista de la ausencia de efecto citopatogénico y de ausencia de actividad enzimática retroviral en los sobrenadantes, esta hipótesis parece probable. El antígeno detectado no se corresponde con una replicación activa del virus tratado con composición antiviral en las células MT4. En dicha Figura 1, la cantidad de antígeno se expresa en pg/ml y se evalúa con ayuda de una solución de antígeno P2 de referencia facilitada por el fabricante del kit de diagnóstico. A partir de esa solución se establece una curva patrón (Figura 2) que permite cuantificar el antígeno eventualmente presente en los sobrenadantes según el valor de la densidad óptica medida a 492 nm. A la vista de los resultados obtenidos, concretamente, ausencia de efecto citopatogénico en células MT4, ausencia de expresión de virus extracélular detectada por actividad retroviral en los sobrenadantes de los cultivos celulares y disminución de la cantidad de antígeno P2 conforme avanza el número de pasajes celulares se puede afirmar que la composición antiviral descrita en el Ejemplo 1.A y probada al 1%, %, % y 0% es eficaz para inactivar el poder infeccioso del VIH-1 en células MT4 in vitro. Según los títulos de los virus utilizados y las diluciones empleadas en el test de infectividad se puede estimar que el tratamiento del virus durante 1 minuto con soluciones de composición antiviral al 1% y al % son suficientes para reducir en unidades logarítmicas el poder infeccioso del virus VIH-1 en células transformadas de origen linfocitario CD4+. Las soluciones al % y al 0% inactivan en las mismas condiciones al menos 4 unidades logarítmicas de virus infeccioso. 0 13
14 REIVINDICACIONES 1. Empleo de una composición antiviral formada por: a) al menos, un ioduro de alquildimetilbencilamonio de fórmula general (I) donde n es un número entero comprendido entre y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el 0%: b) al menos, un ioduro de una amida de amonio cuaternario de fórmula general (II) + O // R-C CH 3 \ I NH-(CH 2 ) m N-CH 3 CH 3 (II) donde R es un radical alquilo de hasta átomos de carbono, o un radical alquenilo de hasta átomos de carbono; y m es un número entero comprendido entre 1 y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; c) al menos, un alcohol graso con 8 grupos oxietilenados, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; d) iodo metálico sublimado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 2% y el 6%; e) al menos, un monoglicérido de un ácido graso polioxietilenado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; f) glicerina, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 3% y el 7%; g) hexilenglicol, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; y h) al menos, un ácido inorgánico en cantidad suficiente para situar el ph de la composición en un intervalo comprendido entre 4 y 6; para la elaboración de un medicamento para tratar la infección causada por un retrovirus. 14
15 2. Empleo según la reivindicación 1 de una composición formada por: a) Ioduro de estearil-dimetil-bencil-amonio 4% b) Ioduro de N-1-(3-trimetilamonio)-propil-undecilenamida % c) Alcohol graso con 8 grupos oxi-etilenados % d) Iodo metálico sublimado 4% e) Monoglicérido de ácido graso polioxi-etilenado % f) Glicerina % g) Hexilenglicol 16% h) Acido fosfórico en cantidad suficiente para situar el ph a 4., donde todas las proporciones expresadas son en % respecto al peso total de la composición antiviral, para la preparación de un medicamento para tratar la infección causada por un retrovirus. 3. Empleo de una composición antiviral formada por: a) al menos, un ioduro de alquildimetilbencilamonio de fórmula general (I) 2 3 donde n es un número entero comprendido entre y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el 0%; b) al menos, un ioduro de una amida de amonio cuaternario de fórmula general (II) 4 O // R-C CH 3 \ NH-(CH 2 ) m N-CH 3 + I (II) CH 3 0 donde R es un radical alquilo de hasta átomos de carbono, o un radical alquenilo de hasta átomos de carbono; y m es un número entero comprendido entre 1 y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; c) al menos, un alcohol graso con 8 grupos oxietilenados, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; d) iodo metálico sublimado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 2% y el 6%; e) al menos, un monoglicérido de un ácido graso polioxietilenado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %;
16 f) glicerina, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 3% y el 7%; g) hexilenglicol, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; y h) al menos, un ácido inorgánico en cantidad suficiente para situar el ph de la composición en un intervalo comprendido entre 4 y 6; para la elaboración de un medicamento capaz de inactivar o reducir el poder infeccioso del Virus de la Inmunodeficiencia Humana (VIH). 4. Empleo según la reivindicación 3 de una composición formada por: 2 a) Ioduro de estearil-dimetil-bencil-amonio 4% b) Ioduro de N-1-(3-trimetilamonio)-propil-undecilenamida % c) Alcohol graso con 8 grupos oxi-etilenados % d) Iodo metálico sublimado 4% e) Monoglicérido de ácido graso polioxi-etilenado % f) Glicerina % g) Hexilenglicol 16% h) Acido fosfórico en cantidad suficiente para situar el ph a 4., donde todas las proporciones expresadas son en % respecto al peso total de la composición antiviral, para la elaboración de un medicamento capaz de inactivar o reducir el poder infeccioso del Virus de la Inmunodeficiencia Humana (VIH).. Empleo de una composición antiviral formada por: a) al menos, un ioduro de alquildimetilbencilamonio de fórmula general (I) donde n es un número entero comprendido entre y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el 0%; b) al menos, un ioduro de una amida de amonio cuaternario de fórmula general (II) O // R-C CH 3 \ NH-(CH 2 ) m N-CH 3 + I (II) CH 3 16
17 donde R es un radical alquilo de hasta átomos donde R es un radical alquilo de hasta átomos de carbono, o un radical alquenilo de hasta átomos de carbono; y m es un número entero comprendido entre 1 y, ambos inclusive; en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; c) al menos, un alcohol graso con 8 grupos oxietilenados, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; d) iodo metálico sublimado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 2% y el 6%; e) al menos, un monoglicérido de un ácido graso polioxietilenado, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; f) glicerina, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el 3% y el 7%; g) hexilenglicol, en una proporción en peso, respecto al total de la composición antiviral, comprendida entre el % y el %; y h) al menos, un ácido inorgánico en cantidad suficiente para situar el ph de la composición en un intervalo comprendido entre 4 y 6; 2 para la elaboración de un medicamento adecuado para el tratamiento del SIDA. 6. Empleo según la reivindicación de una composición formada por: a) Ioduro de estearil-dimetil-bencil-amonio 4% b) Ioduro de N-1-(3-trimetilamonio)-propil-undecilenamida % c) Alcohol graso con 8 grupos oxi-etilenados % d) Iodo metálico sublimado 4% e) Monoglicérido de ácido graso polioxi-etilenado % f) Glicerina % g) Hexilenglicol 16% h) Acido fosfórico en cantidad suficiente para situar el ph a 4., donde todas las proporciones expresadas son en % respecto al peso total de la composición antiviral, para la elaboración de un medicamento adecuado para el tratamiento del SIDA. 7. Una composición farmacéutica para tratar la infección causada por un retrovirus que comprende una cantidad terapéuticamente efectiva de una composición antiviral como la mencionada en las reivindicaciones 1 ó 2 junto con un vehículo farmacéuticamente aceptable. 8. Una composición farmacéutica para inactivar o reducir el poder infeccioso del Virus de la Inmunodeficiencia Humana (VIH) que comprende una cantidad terapéuticamente efectiva de una composición antiviral como la mencionada en las reivindicaciones 3 ó4juntoconunvehículo farmacéuticamente aceptable. 9. Una composición farmacéutica para el tratamiento del SIDA que comprende una cantidad terapéuticamente efectiva de una composición antiviral como la mencionada en las reivindicaciones ó 6 junto con un vehículo farmacéuticamente aceptable. 17
18 18
19 19
20 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 ES k 21 N. solicitud: 9042 k 22 Fecha de presentación de la solicitud: k 32 Fecha de prioridad: INFORME SOBRE EL ESTADO DE LA TECNICA k 1 Int. Cl. 6 : A61K 31/14, 31/16 DOCUMENTOS RELEVANTES Categoría Documentos citados Reivindicaciones afectadas E ES-3792-A (MARIA ROSALIA GARCIA NUÑEZ) ,8,9 *Pág. 9, líneas * Y EP-0864-A (ATLANTIC PHARMACEUTICAL PRODUCTS LIMITED) * Pág. 3, líneas 3-4; reivindicaciones * Y EP-0338-A (MERRELL DOW PHARMACEUTICALS INC.) *Pág. 2, columna 2, líneas -18,-; pág. 3, columna 3, líneas 1-4,-23,28-,43-8; pág. 3, columna 4, líneas 1-6 * Categoría de los documentos citados X: de particular relevancia Y: de particular relevancia combinado con otro/s de la misma categoría A: refleja el estado de la técnica O: referido a divulgación no escrita P: publicado entre la fecha de prioridad y la de presentación de la solicitud E: documento anterior, pero publicado después de la fecha de presentación de la solicitud El presente informe ha sido realizado para todas las reivindicaciones para las reivindicaciones n : Fecha de realización del informe Examinador Página S. González Peñalba 1/1
Medicamentos biológicos y biosimilares
 Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
Medicamentos biológicos y biosimilares folleto biosimilares FILMAR.indd 1 24/10/12 10:09 En qué se diferencian los medicamentos biológicos de los medicamentos tradicionales? Introducción Gracias a la investigación
UNIDAD 15: EL SISTEMA IMNUNITARIO
 UNIDAD 15: EL SISTEMA IMNUNITARIO Lee atentamente. 1. EL ORGANISMO RECONOCE A LOS ELEMENTOS EXTRAÑOS Las células de una persona introducidas en otra son reconocidas por el organismo como algo extraño no
UNIDAD 15: EL SISTEMA IMNUNITARIO Lee atentamente. 1. EL ORGANISMO RECONOCE A LOS ELEMENTOS EXTRAÑOS Las células de una persona introducidas en otra son reconocidas por el organismo como algo extraño no
Diagnóstico microbiológico de la infección por HIV
 Diagnóstico microbiológico de la infección por HIV Juan Carlos Rodríguez Díaz S. Microbiología Hospital General Universitario de Alicante E-mail: rodriguez_juadia@gva.es http://microbiología-alicante.umh.es
Diagnóstico microbiológico de la infección por HIV Juan Carlos Rodríguez Díaz S. Microbiología Hospital General Universitario de Alicante E-mail: rodriguez_juadia@gva.es http://microbiología-alicante.umh.es
Agentes Antivirales Los virus
 Los virus Los virus son elementos genéticos conteniendo AD o AR que pueden encontrarse alternadamente en dos estados: extracelular y intracelular. Los virus se apropian y reacondicionan la maquinaria biosintética
Los virus Los virus son elementos genéticos conteniendo AD o AR que pueden encontrarse alternadamente en dos estados: extracelular y intracelular. Los virus se apropian y reacondicionan la maquinaria biosintética
ALBERTO JIMÉNEZ BENÍTEZ 1º BACH
 ALBERTO JIMÉNEZ BENÍTEZ 1º BACH 1.) Las características principales del virus (estructura, genoma ) A pesar de su pequeño tamaño, el genoma es muy complejo. El ARN del VIH contiene instrucciones genéticas
ALBERTO JIMÉNEZ BENÍTEZ 1º BACH 1.) Las características principales del virus (estructura, genoma ) A pesar de su pequeño tamaño, el genoma es muy complejo. El ARN del VIH contiene instrucciones genéticas
Tipos de células madre
 Biología Bachillerato IES Fuentesnuevas 1 CÉLULAS MADRE O TRONCALES (STEM CELLS) Las células madre son células que tienen capacidad de renovarse continuamente por sucesivas divisiones por mitosis y de
Biología Bachillerato IES Fuentesnuevas 1 CÉLULAS MADRE O TRONCALES (STEM CELLS) Las células madre son células que tienen capacidad de renovarse continuamente por sucesivas divisiones por mitosis y de
Int. Cl. 7 : A01N 57/06. 22 kfecha de presentación: 10.03.1999 71 k Solicitante/s: Rafael Rodríguez Ramos Apartado de Correos, 8.
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 164 18 21 k Número de solicitud: 009900490 1 k Int. Cl. 7 : A01N 7/06 A01N 37/34 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 164 18 21 k Número de solicitud: 009900490 1 k Int. Cl. 7 : A01N 7/06 A01N 37/34 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
Int. Cl. 7 : A01G 25/02
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 184 605 21 k Número de solicitud: 200100858 51 k Int. Cl. 7 : A01G 25/02 A01G 25/06 k 12 SOLICITUD DE PATENTE A1 22 kfecha
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 184 605 21 k Número de solicitud: 200100858 51 k Int. Cl. 7 : A01G 25/02 A01G 25/06 k 12 SOLICITUD DE PATENTE A1 22 kfecha
C02F 1/02 F28G 9/00 //A61L 11/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES 2 060 38 21 k Número de solicitud: 9202661 1 k Int. Cl. : C02F 9/00 C02F 1/02 F28G 9/00 //A61L 11/00 k 12 SOLICITUD DE PATENTE
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES 2 060 38 21 k Número de solicitud: 9202661 1 k Int. Cl. : C02F 9/00 C02F 1/02 F28G 9/00 //A61L 11/00 k 12 SOLICITUD DE PATENTE
B23K 23/00 //E01B 29/42 B60M 5/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES 2 036 42 21 k Número de solicitud: 91412 1 k Int. Cl. : H01R 4/02 B23K 23/00 //E01B 29/42 BM /00 k 12 SOLICITUD DE PATENTE A2
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES 2 036 42 21 k Número de solicitud: 91412 1 k Int. Cl. : H01R 4/02 B23K 23/00 //E01B 29/42 BM /00 k 12 SOLICITUD DE PATENTE A2
Practica la genética Ficha didáctica del profesorado Bachillerato
 Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Ficha didáctica del profesorado Bachillerato www.eurekamuseoa.es Extracción de ADN Cuál es la función de cada uno de los ingredientes utilizados para realizar la disolución tampón para la visualización
Int. Cl. 5 : A61K 31/445
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES 2 06 290 21 k Número de solicitud: 9301714 1 k Int. Cl. : A61K 31/44 C07D 211/60 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k N. de publicación: ES 2 06 290 21 k Número de solicitud: 9301714 1 k Int. Cl. : A61K 31/44 C07D 211/60 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación:
ES 2 187 295 A1 G06F 17/60. Número de publicación: 2 187 295 PATENTES Y MARCAS. Número de solicitud: 200102423. Int. Cl. 7 : G06F 19/00 16.05.
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 187 29 21 k Número de solicitud: 200102423 1 k Int. Cl. 7 : G06F 19/00 G06F 17/60 k 12 SOLICITUD DE PATENTE A1 22 kfecha
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 187 29 21 k Número de solicitud: 200102423 1 k Int. Cl. 7 : G06F 19/00 G06F 17/60 k 12 SOLICITUD DE PATENTE A1 22 kfecha
11 Número de publicación: 2 284 312. 21 Número de solicitud: 200500732. 51 Int. Cl.: 72 Inventor/es: Gubertini Ciriza, Raúl
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 284 312 21 Número de solicitud: 200500732 51 Int. Cl.: B65F 1/00 (2006.01) 12 PATENTE DE INVENCIÓN B1 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 284 312 21 Número de solicitud: 200500732 51 Int. Cl.: B65F 1/00 (2006.01) 12 PATENTE DE INVENCIÓN B1 22 Fecha de presentación:
ES 2 388 275 B1. Aviso: ESPAÑA 11. Número de publicación: 2 388 275. Número de solicitud: 201130353 H04B 7/00 (2006.01)
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 2 388 27 Número de solicitud: 20113033 1 Int. CI.: H04B 7/00 (2006.01) 12 PATENTE DE INVENCIÓN B1 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 2 388 27 Número de solicitud: 20113033 1 Int. CI.: H04B 7/00 (2006.01) 12 PATENTE DE INVENCIÓN B1 22 Fecha de presentación:
INTRODUCCION La Fitopatología es el estudio de:
 INTRODUCCION La Fitopatología es el estudio de: Los organismos y las condiciones del ambiente que ocasionan enfermedades en plantas Los procesos mediante los cuales estos factores producen enfermedades
INTRODUCCION La Fitopatología es el estudio de: Los organismos y las condiciones del ambiente que ocasionan enfermedades en plantas Los procesos mediante los cuales estos factores producen enfermedades
DANAGENE RNA PURIFICATION KIT
 DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
DANAGENE RNA PURIFICATION KIT REF.0801.1 100 EXTRACCIONES REF.0801.2 500 EXTRACCIONES 1.INTRODUCCION Este kit permite la permite la obtención de ARN total a partir de cultivos celulares, tejidos animales,
Int. Cl. 6 : F16C 11/04
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 133 06 21 k Número de solicitud: 9601130 1 k Int. Cl. 6 : F16C 11/04 A61G 7/002 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 133 06 21 k Número de solicitud: 9601130 1 k Int. Cl. 6 : F16C 11/04 A61G 7/002 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
(Estudios in vivo y estudios in vitro)
 (Estudios in vivo y estudios in vitro) IN VIVO: es la experimentación con un todo, que viven organismos en comparación. Ensayos con animales y ensayos clínicos son dos formas de investigación in vivo.
(Estudios in vivo y estudios in vitro) IN VIVO: es la experimentación con un todo, que viven organismos en comparación. Ensayos con animales y ensayos clínicos son dos formas de investigación in vivo.
turbidez en los medios de cultivo. La duración de la prueba de esterilidad es de 14 días. Las pruebas de toxicidad (específica y general), llamadas
 Para que una prueba se considere validada deberá cumplir los requisitos siguientes: Precisión: es la variación de los resultados de acuerdo a la desviación estándar o al coeficiente de variación. Exactitud:
Para que una prueba se considere validada deberá cumplir los requisitos siguientes: Precisión: es la variación de los resultados de acuerdo a la desviación estándar o al coeficiente de variación. Exactitud:
ES 2 192 897 A1 B42F 5/00. Número de publicación: 2 192 897 PATENTES Y MARCAS. Número de solicitud: 200000528. Int. Cl. 7 : B42D 1/08 16.10.
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 192 897 21 k Número de solicitud: 200000528 51 k Int. Cl. 7 : B42D 1/08 B42F 5/00 k 12 SOLICITUD DE PATENTE A1 22 kfecha
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 192 897 21 k Número de solicitud: 200000528 51 k Int. Cl. 7 : B42D 1/08 B42F 5/00 k 12 SOLICITUD DE PATENTE A1 22 kfecha
Test de activació n de basó filós.
 Test de activació n de basó filós. Se trata de una técnica ya utilizada hace años, pero que gracias a su más reciente combinación con la citometría de flujo ha mejorado su sensibilidad y especificidad.
Test de activació n de basó filós. Se trata de una técnica ya utilizada hace años, pero que gracias a su más reciente combinación con la citometría de flujo ha mejorado su sensibilidad y especificidad.
Aspectos Básicos sobre Antimicrobianos I. Actividad y resistencia
 Aspectos Básicos sobre Antimicrobianos I Dr. Alberto Fica C. Sección de Infectología, Departamento de Medicina, Hospital Clínico Universidad de Chile. En esta presentación se tratará el concepto de actividad
Aspectos Básicos sobre Antimicrobianos I Dr. Alberto Fica C. Sección de Infectología, Departamento de Medicina, Hospital Clínico Universidad de Chile. En esta presentación se tratará el concepto de actividad
COMBATIENDO EL CANCER DE PIEL
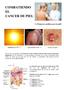 COMBATIENDO EL CANCER DE PIEL Primeros auxilios para la piel! Radiación UVB Quemadura solar Cancer de piel El sol no es un enemigo, es la fuente de la vida y durante miles de años tuvimos tiempo para adaptarnos
COMBATIENDO EL CANCER DE PIEL Primeros auxilios para la piel! Radiación UVB Quemadura solar Cancer de piel El sol no es un enemigo, es la fuente de la vida y durante miles de años tuvimos tiempo para adaptarnos
ES 2 302 587 A1 H04Q 7/22 (2006.01) G06F 9/445 (2006.01) OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA. 11 Número de publicación: 2 302 587
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 302 587 21 Número de solicitud: 200503019 51 Int. Cl.: H04Q 7/22 (2006.01) G06F 9/445 (2006.01) 12 SOLICITUD DE PATENTE A1 22
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 302 587 21 Número de solicitud: 200503019 51 Int. Cl.: H04Q 7/22 (2006.01) G06F 9/445 (2006.01) 12 SOLICITUD DE PATENTE A1 22
Entendiendo la resistencia a los
 Competencias Esenciales: VIH/SIDA: -los Efectos Secundarios & la Resistencia Entendiendo la resistencia a los medicamentos* sobre esta actividad Tiempo: 65 minutos Objectivos: Al finalizar esta sesión,
Competencias Esenciales: VIH/SIDA: -los Efectos Secundarios & la Resistencia Entendiendo la resistencia a los medicamentos* sobre esta actividad Tiempo: 65 minutos Objectivos: Al finalizar esta sesión,
Algoritmos diagnósticos para VIH
 Algoritmos diagnósticos para VIH ALGORITMOS DIAGNÓSTICOS PARA VIH Los avances tecnológicos de los distintos ensayos para el tamizaje y diagnóstico de la infección por VIH, conjuntamente con la necesidad
Algoritmos diagnósticos para VIH ALGORITMOS DIAGNÓSTICOS PARA VIH Los avances tecnológicos de los distintos ensayos para el tamizaje y diagnóstico de la infección por VIH, conjuntamente con la necesidad
Anomalías Cromosómicas
 12 Unique Grupo de apoyo para enfermedades cromosómicas raras del Reino Unido Teléfono: + 44 (0) 1883 330766 Email: info@rarechromo.org www.rarechromo.org Anomalías Cromosómicas Orphanet Información gratuita
12 Unique Grupo de apoyo para enfermedades cromosómicas raras del Reino Unido Teléfono: + 44 (0) 1883 330766 Email: info@rarechromo.org www.rarechromo.org Anomalías Cromosómicas Orphanet Información gratuita
11 kn. de publicación: ES 2 038 571. 51 kint. Cl. 5 : C12P 21/08
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 038 571 51 kint. Cl. 5 : C12P 21/08 A61K 39/395 A61K 49/00 G01N 33/577 //(C12P 21/08 C12R 1/91) 12 k TRADUCCION DE REIVINDICACIONES
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 kn. de publicación: ES 2 038 571 51 kint. Cl. 5 : C12P 21/08 A61K 39/395 A61K 49/00 G01N 33/577 //(C12P 21/08 C12R 1/91) 12 k TRADUCCION DE REIVINDICACIONES
Test de hipótesis. Si H0 es cierta el estadístico. sigue una distribución t de Student con n grados de libertad: s n
 Un diseño experimental que se utiliza muy a menudo es el de un grupo control y uno de tratamiento. En el caso de que los datos sean cuantitativos y sigan una distribución normal, la hipótesis de interés
Un diseño experimental que se utiliza muy a menudo es el de un grupo control y uno de tratamiento. En el caso de que los datos sean cuantitativos y sigan una distribución normal, la hipótesis de interés
LA LOGÍSTICA COMO FUENTE DE VENTAJAS COMPETITIVAS
 LA LOGÍSTICA COMO FUENTE DE VENTAJAS COMPETITIVAS Los clientes compran un servicio basandose en el valor que reciben en comparacion con el coste en el que incurren. Por, lo tanto, el objetivo a largo plazo
LA LOGÍSTICA COMO FUENTE DE VENTAJAS COMPETITIVAS Los clientes compran un servicio basandose en el valor que reciben en comparacion con el coste en el que incurren. Por, lo tanto, el objetivo a largo plazo
Los objetivos de las terapias contra VIH se centran en:
 I N T R O D U C C I Ó N Una vez que se identificó al VIH como causante del Síndrome de Inmunodeficiencia Adquirida (SIDA), el principal objetivo científico se convirtió en la búsqueda de algún medio para
I N T R O D U C C I Ó N Una vez que se identificó al VIH como causante del Síndrome de Inmunodeficiencia Adquirida (SIDA), el principal objetivo científico se convirtió en la búsqueda de algún medio para
ES 2 146 184 A1. Número de publicación: 2 146 184 PATENTES Y MARCAS. Número de solicitud: 009802270. Int. Cl. 7 : A62C 27/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 146 184 21 k Número de solicitud: 009802270 51 k Int. Cl. 7 : A62C 27/00 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 146 184 21 k Número de solicitud: 009802270 51 k Int. Cl. 7 : A62C 27/00 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
k 11 N. de publicación: ES 2 047 221 k 51 Int. Cl. 5 : G01R 21/133
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 047 221 k 1 Int. Cl. : G01R 21/133 G11C 7/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90116348.
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA k 11 N. de publicación: ES 2 047 221 k 1 Int. Cl. : G01R 21/133 G11C 7/00 12 k TRADUCCION DE PATENTE EUROPEA T3 86 knúmero de solicitud europea: 90116348.
Int. Cl. 7 : A63H 29/22
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 177 43 21 k Número de solicitud: 20000293 1 k Int. Cl. 7 : A63H 29/22 A63H 17/26 A63H 18/12 k 12 SOLICITUD DE PATENTE A1
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 177 43 21 k Número de solicitud: 20000293 1 k Int. Cl. 7 : A63H 29/22 A63H 17/26 A63H 18/12 k 12 SOLICITUD DE PATENTE A1
S OCIEDAD VERSIÓN PARA IMPRIMIR
 Médicos de Barcelona descubren una mutación que fortalece e... http://www.eldia.es/2012-01-23/sociedad/sociedad2prn.htm S OCIEDAD VERSIÓN PARA IMPRIMIR LUNES, 23 DE ENERO DE 2012 Médicos de Barcelona descubren
Médicos de Barcelona descubren una mutación que fortalece e... http://www.eldia.es/2012-01-23/sociedad/sociedad2prn.htm S OCIEDAD VERSIÓN PARA IMPRIMIR LUNES, 23 DE ENERO DE 2012 Médicos de Barcelona descubren
Int. Cl. 7 : B30B 9/30
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 11 417 21 k Número de solicitud: 00980190 1 k Int. Cl. 7 : B30B 9/30 B30B 1/04 B30B 1/06 k 12 SOLICITUD DE PATENTE A1 22
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 11 417 21 k Número de solicitud: 00980190 1 k Int. Cl. 7 : B30B 9/30 B30B 1/04 B30B 1/06 k 12 SOLICITUD DE PATENTE A1 22
Int. Cl. 7 : A61C 3/00. k 71 Solicitante/s: CORPORACIÓN O.I.B., S.L. k 72 Inventor/es: Rodríguez del Val, José María
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 195 742 21 k Número de solicitud: 200102098 51 k Int. Cl. 7 : A61C 3/00 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 195 742 21 k Número de solicitud: 200102098 51 k Int. Cl. 7 : A61C 3/00 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
Qué es un Análisis Genético?
 12 Qué es un Análisis Genético? Elaborado a partir de folletos originales de Guy s and St Thomas Hospital, London. Enero de 2008 Este trabajo se ha realizado bajo el auspicio de EuroGentest, Contrato Nº
12 Qué es un Análisis Genético? Elaborado a partir de folletos originales de Guy s and St Thomas Hospital, London. Enero de 2008 Este trabajo se ha realizado bajo el auspicio de EuroGentest, Contrato Nº
STOP. Mira por ti, controla tu colesterol. Campaña Nacional para el Control del Colesterol. www.controlatucolesterol.org
 Mira por ti, controla tu Campaña Nacional para el Control del Colesterol www.controlatu.org Qué es el? El es una grasa que circula por la sangre y que interviene en muchos procesos del organismo, como
Mira por ti, controla tu Campaña Nacional para el Control del Colesterol www.controlatu.org Qué es el? El es una grasa que circula por la sangre y que interviene en muchos procesos del organismo, como
Identificación y caracterización de células madres cancerígenas (CMCs) en Sarcoma de Ewing
 Identificación y caracterización de células madres cancerígenas (CMCs) en Sarcoma de Ewing Introducción Una célula madre o célula troncal es una célula que tiene capacidad de autorrenovarse mediante divisiones
Identificación y caracterización de células madres cancerígenas (CMCs) en Sarcoma de Ewing Introducción Una célula madre o célula troncal es una célula que tiene capacidad de autorrenovarse mediante divisiones
Capítulo IV. Manejo de Problemas
 Manejo de Problemas Manejo de problemas Tabla de contenido 1.- En qué consiste el manejo de problemas?...57 1.1.- Ventajas...58 1.2.- Barreras...59 2.- Actividades...59 2.1.- Control de problemas...60
Manejo de Problemas Manejo de problemas Tabla de contenido 1.- En qué consiste el manejo de problemas?...57 1.1.- Ventajas...58 1.2.- Barreras...59 2.- Actividades...59 2.1.- Control de problemas...60
CONSENTIMIENTO INFORMADO PARA ANÁLISIS PRENATAL NO INVASIVO DE TRISOMÍAS FETALES
 Ejemplar para el Solicitante CONSENTIMIENTO INFORMADO PARA ANÁLISIS PRENATAL NO INVASIVO DE TRISOMÍAS FETALES Propósito El análisis prenatal no invasivo analiza ADN fetal libre, circulante en la sangre
Ejemplar para el Solicitante CONSENTIMIENTO INFORMADO PARA ANÁLISIS PRENATAL NO INVASIVO DE TRISOMÍAS FETALES Propósito El análisis prenatal no invasivo analiza ADN fetal libre, circulante en la sangre
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
Unidad Curricular: Virología y Micología Veterinaria 1 TRABAJO PRÁCTICO No. 3 AMPLIFICACIÓN DE GENES VIRALES Reacción en Cadena de la Polimerasa, conocida como PCR (por sus siglas en inglés: Polimerase
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Manifestaciones clínicas. Cuadro mononucleósido asociado a la primoinfección. Clasificación de la infección VIH.
 Manifestaciones clínicas. Cuadro mononucleósido asociado a la primoinfección. Clasificación de la infección VIH. Jose Maria Kindelán. Hospital Universitario Reina Sofía. Córdoba I. Historia natral de la
Manifestaciones clínicas. Cuadro mononucleósido asociado a la primoinfección. Clasificación de la infección VIH. Jose Maria Kindelán. Hospital Universitario Reina Sofía. Córdoba I. Historia natral de la
DE VIDA PARA EL DESARROLLO DE SISTEMAS
 MÉTODO DEL CICLO DE VIDA PARA EL DESARROLLO DE SISTEMAS 1. METODO DEL CICLO DE VIDA PARA EL DESARROLLO DE SISTEMAS CICLO DE VIDA CLÁSICO DEL DESARROLLO DE SISTEMAS. El desarrollo de Sistemas, un proceso
MÉTODO DEL CICLO DE VIDA PARA EL DESARROLLO DE SISTEMAS 1. METODO DEL CICLO DE VIDA PARA EL DESARROLLO DE SISTEMAS CICLO DE VIDA CLÁSICO DEL DESARROLLO DE SISTEMAS. El desarrollo de Sistemas, un proceso
Oferta tecnológica: Nueva familia de moléculas para combatir bacterias, virus y cáncer
 Oferta tecnológica: Nueva familia de moléculas para combatir bacterias, virus y cáncer Oferta tecnológica: Nueva familia de moléculas para combatir bacterias, virus y cáncer. RESUMEN El grupo de investigación
Oferta tecnológica: Nueva familia de moléculas para combatir bacterias, virus y cáncer Oferta tecnológica: Nueva familia de moléculas para combatir bacterias, virus y cáncer. RESUMEN El grupo de investigación
Dr. José Raúl Recinos Deras
 http://www.medicosdeelsalvador.com Este artículo salió de la página web de Médicos de El Salvador. Fue escrito por: Dr. José Raúl Recinos Deras Clínica Médico Psiquiátrica y de Salud Mental Todos los derechos
http://www.medicosdeelsalvador.com Este artículo salió de la página web de Médicos de El Salvador. Fue escrito por: Dr. José Raúl Recinos Deras Clínica Médico Psiquiátrica y de Salud Mental Todos los derechos
La MEDICINA del SIGLO XXI
 La MEDICINA del SIGLO XXI Ginés Morata Pérez Ex-Director del Centro de Biología Molecular del CSIC Carlos Martínez-A. Jefe del Departamento de Inmunología y Oncología del Centro Nacional de Biotecnología
La MEDICINA del SIGLO XXI Ginés Morata Pérez Ex-Director del Centro de Biología Molecular del CSIC Carlos Martínez-A. Jefe del Departamento de Inmunología y Oncología del Centro Nacional de Biotecnología
ES 2 264 860 A1 G07C 9/00 (2006.01) H04M 1/725 (2006.01) H04M 11/00 (2006.01) OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 860 21 Número de solicitud: 200402000 51 Int. Cl.: G07C 9/00 (2006.01) H04M 1/725 (2006.01) H04M 11/00 (2006.01) 12 SOLICITUD
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 264 860 21 Número de solicitud: 200402000 51 Int. Cl.: G07C 9/00 (2006.01) H04M 1/725 (2006.01) H04M 11/00 (2006.01) 12 SOLICITUD
PRUEBA RAPIDA EN EMBARAZADAS (n=62,214 2009-Junio 2010) NO REACTIVO n=218 REACTIVO INDETERMINADO. Tabla 9: Resultados Prueba rápida
 11-RESULTADOS 11.1-Interpretación y análisis de resultados Un total de de 62,214 mujeres embarazadas se realizaron la prueba rápida de VIH durante años 2009 hasta junio 2010 (Tabla 9). De ellas, 61,808
11-RESULTADOS 11.1-Interpretación y análisis de resultados Un total de de 62,214 mujeres embarazadas se realizaron la prueba rápida de VIH durante años 2009 hasta junio 2010 (Tabla 9). De ellas, 61,808
CONTROL DE LA ACTIVIDAD CELULAR
 CONTROL DE LA ACTIVIDAD CELULAR Sumario Las Moléculas de los Seres Vivos Control de la actividad celular 1. Las reacciones celulares básicas 2. El control de las reacciones celulares 3. Los modelos de
CONTROL DE LA ACTIVIDAD CELULAR Sumario Las Moléculas de los Seres Vivos Control de la actividad celular 1. Las reacciones celulares básicas 2. El control de las reacciones celulares 3. Los modelos de
11 Número de publicación: 2 288 447. 21 Número de solicitud: 200702102. 51 Int. Cl.: 72 Inventor/es: Cabre Roige, Luis
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 288 447 21 Número de solicitud: 200702102 51 Int. Cl.: A01G 9/02 (2006.01) A01G 27/04 (2006.01) 12 SOLICITUD DE PATENTE A2 22
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 288 447 21 Número de solicitud: 200702102 51 Int. Cl.: A01G 9/02 (2006.01) A01G 27/04 (2006.01) 12 SOLICITUD DE PATENTE A2 22
ES 2 196 968 A1 A23L 1/318 A23L 1/315 A22C 11/00. Número de publicación: 2 196 968 PATENTES Y MARCAS. Número de solicitud: 200101862
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 196 968 21 k Número de solicitud: 200101862 1 k Int. Cl. 7 : A23L 1/314 A23L 1/318 A23L 1/31 A22C 11/00 k 12 SOLICITUD DE
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 196 968 21 k Número de solicitud: 200101862 1 k Int. Cl. 7 : A23L 1/314 A23L 1/318 A23L 1/31 A22C 11/00 k 12 SOLICITUD DE
Preguntas que se hacen con frecuencia sobre los estudios clínicos
 Preguntas que se hacen con frecuencia sobre los estudios clínicos Son seguros? Todos los ensayos clínicos deben ser aprobados por el gobierno federal y deben cumplir con una reglamentación estricta que
Preguntas que se hacen con frecuencia sobre los estudios clínicos Son seguros? Todos los ensayos clínicos deben ser aprobados por el gobierno federal y deben cumplir con una reglamentación estricta que
Biotecnología. Historia y aplicaciones Su utilización en el INTA Alto Valle. investigación
 Alejandro Giayetto Técnico INTA agiayetto@correo.inta.gov.ar Mirta Rossini Técnico INTA mrossini@correo.inta.gov.ar Diana Vera Biotecnóloga labfitopatologia@correo.inta.gov.ar investigación 10 Biotecnología
Alejandro Giayetto Técnico INTA agiayetto@correo.inta.gov.ar Mirta Rossini Técnico INTA mrossini@correo.inta.gov.ar Diana Vera Biotecnóloga labfitopatologia@correo.inta.gov.ar investigación 10 Biotecnología
Int. Cl. 7 : G01N 33/04
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 144 36 21 k Número de solicitud: 009800009 1 k Int. Cl. 7 : G01N 33/04 A23C 11/10 k 12 SOLICITUD DE PATENTE A1 22 kfecha
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 144 36 21 k Número de solicitud: 009800009 1 k Int. Cl. 7 : G01N 33/04 A23C 11/10 k 12 SOLICITUD DE PATENTE A1 22 kfecha
Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz
 IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
IDEXX VetLab Suite IDEXX SNAP Tests Laboratorio de Referencia IDEXX Nuevos paneles de PCR Real Time: El diagnóstico molecular más rápido, fiable y eficaz Obtenga respuestas definitivas con la IDEXX RealPCR
LIMPIEZA Y DESINFECCIÓN EN LA INDUSTRIA LÁCTEA
 LIMPIEZA Y EN LA INDUSTRIA LÁCTEA LD EN LAS INDUSTRIAS DE ALIMENTOS La sanitización/higienización es un concepto general que comprende la creación y mantenimiento de las condiciones óptimas de higiene
LIMPIEZA Y EN LA INDUSTRIA LÁCTEA LD EN LAS INDUSTRIAS DE ALIMENTOS La sanitización/higienización es un concepto general que comprende la creación y mantenimiento de las condiciones óptimas de higiene
PAREJAS SERODISCORDANTE
 PAREJAS SERODISCORDANTE Las parejas serodiscordantes son aquellas en las que uno de los dos miembros es seropositivo al virus de la inmunodeficiencia humana (VIH). La elevada incidencia del VIH en pacientes
PAREJAS SERODISCORDANTE Las parejas serodiscordantes son aquellas en las que uno de los dos miembros es seropositivo al virus de la inmunodeficiencia humana (VIH). La elevada incidencia del VIH en pacientes
Anomalías Cromosómicas
 12 Teléfono: + 44 (0) 1883 330766 Email: info@rarechromo.org www.rarechromo.org Anomalías Cromosómicas Orphanet Información gratuita sobre enfermedades raras, ensayos clínicos, medicamentos y enlaces a
12 Teléfono: + 44 (0) 1883 330766 Email: info@rarechromo.org www.rarechromo.org Anomalías Cromosómicas Orphanet Información gratuita sobre enfermedades raras, ensayos clínicos, medicamentos y enlaces a
11 Número de publicación: 2 229 868. 21 Número de solicitud: 200202865. 51 Int. Cl. 7 : A01K 23/00. 72 Inventor/es: Balliu Falgueras, Carme
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 229 868 21 Número de solicitud: 200202865 51 Int. Cl. 7 : A01K 23/00 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 13.12.2002
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 229 868 21 Número de solicitud: 200202865 51 Int. Cl. 7 : A01K 23/00 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación: 13.12.2002
PROYECTO MEDICINA PERSONALIZADA PARA EL CÁNCER INFANTIL CÁNCER INFANTIL. Javier Alonso
 Página: 1 de 8 PROYECTO MEDICINA PERSONALIZADA PARA EL Javier Alonso Jefe de Área de Genética Humana. Jefe de la Unidad de Tumores Sólidos Infantiles del Instituto de Investigación de Enfermedades Raras,
Página: 1 de 8 PROYECTO MEDICINA PERSONALIZADA PARA EL Javier Alonso Jefe de Área de Genética Humana. Jefe de la Unidad de Tumores Sólidos Infantiles del Instituto de Investigación de Enfermedades Raras,
Análisis e interpretación de estados financieros INTERPRETACIÓN DEL ANÁLISIS FINANCIERO
 INTERPRETACIÓN DEL ANÁLISIS FINANCIERO Método de razones simples, cálculo e interpretación de los indicadores 1 Liquidez 1. Capital neto de trabajo (CNT)=Activo circulante - Pasivo circulante. Se define
INTERPRETACIÓN DEL ANÁLISIS FINANCIERO Método de razones simples, cálculo e interpretación de los indicadores 1 Liquidez 1. Capital neto de trabajo (CNT)=Activo circulante - Pasivo circulante. Se define
Int. Cl. 7 : B28B 7/22
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 161 621 21 k Número de solicitud: 00990196 1 k Int. Cl. 7 : B28B 7/22 B28B 7/36 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 161 621 21 k Número de solicitud: 00990196 1 k Int. Cl. 7 : B28B 7/22 B28B 7/36 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
DETERMINACIÓN DEL FACTOR Rh por PCR
 Ref.PCRRh DETERMINACIÓN DEL FACTOR Rh por PCR 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Ref.PCRRh DETERMINACIÓN DEL FACTOR Rh por PCR 1.OBJETIVO DEL EXPERIMENTO El objetivo de este experimento es introducir a los estudiantes en los principios y práctica de la Reacción en Cadena de la Polimerasa
Int. Cl. 6 : B42D 15/10. k 71 Solicitante/s: Juan Antonio García Geira. k 72 Inventor/es: García Geira, Juan Antonio
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 117 949 21 k Número de solicitud: 9601769 1 k Int. Cl. 6 : B42D 1/10 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 117 949 21 k Número de solicitud: 9601769 1 k Int. Cl. 6 : B42D 1/10 k 12 SOLICITUD DE PATENTE A1 k 22 Fecha de presentación:
6 INFECCIÓN POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) Y SIDA. TRATAMIENTO Y PREVENCIÓN DE LAS INFECCIONES OPORTUNISTAS ASOCIADAS
 6 INFECCIÓN POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) Y SIDA. TRATAMIENTO Y PREVENCIÓN DE LAS INFECCIONES OPORTUNISTAS ASOCIADAS Introducción.................... 663 Clasificación de la infección
6 INFECCIÓN POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) Y SIDA. TRATAMIENTO Y PREVENCIÓN DE LAS INFECCIONES OPORTUNISTAS ASOCIADAS Introducción.................... 663 Clasificación de la infección
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
www.elesapiens.com GLOSARIO DE QUÍMICA ABONO: Es cualquier sustancia orgánica o inorgánica que mejora la calidad de la tierra.
 GLOSARIO DE QUÍMICA ABONO: Es cualquier sustancia orgánica o inorgánica que mejora la calidad de la tierra. ANTIBIÓTICO: Es una sustancia química que mata o impide el crecimiento de ciertas clases de microorganismos
GLOSARIO DE QUÍMICA ABONO: Es cualquier sustancia orgánica o inorgánica que mejora la calidad de la tierra. ANTIBIÓTICO: Es una sustancia química que mata o impide el crecimiento de ciertas clases de microorganismos
TEMA 2. FILOSOFÍA DE LOS GRÁFICOS DE CONTROL. Principios básicos de los gráficos de control. Análisis de patrones.
 TEMA 2. FILOSOFÍA DE LOS GRÁFICOS DE CONTROL. Principios básicos de los gráficos de control. Análisis de patrones. La herramienta que nos indica si el proceso está o no controlado o Estado de Control son
TEMA 2. FILOSOFÍA DE LOS GRÁFICOS DE CONTROL. Principios básicos de los gráficos de control. Análisis de patrones. La herramienta que nos indica si el proceso está o no controlado o Estado de Control son
Qué es un gen? EXPRESION GÉNICA 01/05/2013
 Qué es un gen? Es una secuencia de nucleótidos en la molécula de ADN, equivalente a una unidad de transcripción. Contiene la información, a partir de la cual se sintetiza un polipéptido, una enzima, un
Qué es un gen? Es una secuencia de nucleótidos en la molécula de ADN, equivalente a una unidad de transcripción. Contiene la información, a partir de la cual se sintetiza un polipéptido, una enzima, un
mos con... Las células DPPSCs son estables genéticamente y se pueden controlar in vitro investigador en regeneración con células madre
 bl Vea el vídeo de la entrevista. mos Doctor Maher Atari, investigador en regeneración con células madre Las células DPPSCs son estables genéticamente y se pueden controlar in vitro MAXILLARIS ENERO 2013
bl Vea el vídeo de la entrevista. mos Doctor Maher Atari, investigador en regeneración con células madre Las células DPPSCs son estables genéticamente y se pueden controlar in vitro MAXILLARIS ENERO 2013
La investigación y la observación de la bio-corección de la diabetes del tipo 2 con la aplicación del producto Nanovit Metabolic KLINOMED
 La investigación y la observación de la bio-corección de la diabetes del tipo 2 con la aplicación del producto Nanovit Metabolic KLINOMED Ensayos clínicos de control (Bio-corrección de la diabetes mellitus
La investigación y la observación de la bio-corección de la diabetes del tipo 2 con la aplicación del producto Nanovit Metabolic KLINOMED Ensayos clínicos de control (Bio-corrección de la diabetes mellitus
Los principales conceptos para mejorar la gestión de Marketing: preguntas clave
 Los principales conceptos para mejorar la gestión de Marketing: preguntas clave Luis Muñiz Economista y Consultor en sistemas de información y estrategia Nos puede describir que es la gestión de Marketing
Los principales conceptos para mejorar la gestión de Marketing: preguntas clave Luis Muñiz Economista y Consultor en sistemas de información y estrategia Nos puede describir que es la gestión de Marketing
Int. Cl. 7 : A61K 38/46
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 181 92 21 k Número de solicitud: 01383 1 k Int. Cl. 7 : A61K 38/46 A61P 17/12 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación:
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 181 92 21 k Número de solicitud: 01383 1 k Int. Cl. 7 : A61K 38/46 A61P 17/12 k 12 SOLICITUD DE PATENTE A1 22 kfecha de presentación:
Int. Cl. 7 : G08G 1/0965
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 161 180 21 k Número de solicitud: 009902774 1 k Int. Cl. 7 : G08G 1/096 BQ 1/2 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 161 180 21 k Número de solicitud: 009902774 1 k Int. Cl. 7 : G08G 1/096 BQ 1/2 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
Introducción Desde el comienzo de los tiempos, el hombre ha desarrollado características que diferencian a un hombre de otro. Dichas características,
 Introducción Desde el comienzo de los tiempos, el hombre ha desarrollado características que diferencian a un hombre de otro. Dichas características, son adoptadas por el hombre para poder sobrevivir.
Introducción Desde el comienzo de los tiempos, el hombre ha desarrollado características que diferencian a un hombre de otro. Dichas características, son adoptadas por el hombre para poder sobrevivir.
Int. Cl. 7 : A62C 13/00
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 149 67 21 k Número de solicitud: 009800216 1 k Int. Cl. 7 : A62C 13/00 A62C 13/62 A62C 13/76 k 12 SOLICITUD DE PATENTE A1
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 149 67 21 k Número de solicitud: 009800216 1 k Int. Cl. 7 : A62C 13/00 A62C 13/62 A62C 13/76 k 12 SOLICITUD DE PATENTE A1
PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN DE LAS COMPETENCIAS PROFESIONALES CUESTIONARIO DE AUTOEVALUACIÓN PARA LAS TRABAJADORAS Y TRABAJADORES
 MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
MINISTERIO DE EDUCACIÓN SECRETARÍA DE ESTADO DE EDUCACIÓN Y FORMACIÓN PROFESIONAL DIRECCIÓN GENERAL DE FORMACIÓN PROFESIONAL INSTITUTO NACIONAL DE LAS CUALIFICACIONES PROCEDIMIENTO DE EVALUACIÓN Y ACREDITACIÓN
FICHA PÚBLICA DEL PROYECTO
 FICHA PÚBLICA DEL PROYECTO PROGRAMA DE ESTÍMULOS A LA INNOVACIÓN NUMERO DE PROYECTO: 214028 EMPRESA BENEFICIADA: PHARMACOS EXAKTA S.A. DE C.V. TÍTULO DEL PROYECTO: DESARROLLO DE UN MINI-ARREGLO DE ANTIGENOS
FICHA PÚBLICA DEL PROYECTO PROGRAMA DE ESTÍMULOS A LA INNOVACIÓN NUMERO DE PROYECTO: 214028 EMPRESA BENEFICIADA: PHARMACOS EXAKTA S.A. DE C.V. TÍTULO DEL PROYECTO: DESARROLLO DE UN MINI-ARREGLO DE ANTIGENOS
ES 1 097 480 U ESPAÑA 11. Número de publicación: 1 097 480. Número de solicitud: 201331388 A47G 29/00 (2006.01) 03.12.2013
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 1 097 480 Número de solicitud: 1331388 1 Int. CI.: A47G 29/00 (06.01) 12 SOLICITUD DE MODELO DE UTILIDAD U 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 1 097 480 Número de solicitud: 1331388 1 Int. CI.: A47G 29/00 (06.01) 12 SOLICITUD DE MODELO DE UTILIDAD U 22 Fecha de presentación:
11 Número de publicación: 2 195 764. 21 Número de solicitud: 200200188. 51 Int. Cl. 7 : A61K 35/80. 72 Inventor/es: Gasso Casademunt, Francisco
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 19 764 21 Número de solicitud: 00188 1 Int. Cl. 7 : A61K 3/80 A61K 31/1 A61K 31/2 12 PATENTE DE INVENCIÓN B1 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 19 764 21 Número de solicitud: 00188 1 Int. Cl. 7 : A61K 3/80 A61K 31/1 A61K 31/2 12 PATENTE DE INVENCIÓN B1 22 Fecha de presentación:
CÓMO REDACTAR UNA SOLICITUD DE PATENTE
 CÓMO REDACTAR UNA SOLICITUD DE PATENTE ESQUEMA DE LA MEMORIA PARA SOLICITUD DE PATENTE TITULO Designación técnica de la invención. Debe estar en congruencia con las reivindicaciones. El título debe ser
CÓMO REDACTAR UNA SOLICITUD DE PATENTE ESQUEMA DE LA MEMORIA PARA SOLICITUD DE PATENTE TITULO Designación técnica de la invención. Debe estar en congruencia con las reivindicaciones. El título debe ser
11 Número de publicación: 2 209 573. 21 Número de solicitud: 200101531. 51 Int. Cl. 7 : B68G 7/00. 72 Inventor/es: Lucía Monforte, Pedro
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 209 573 21 Número de solicitud: 200101531 51 Int. Cl. 7 : B68G 7/00 B29C 44/14 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 209 573 21 Número de solicitud: 200101531 51 Int. Cl. 7 : B68G 7/00 B29C 44/14 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación:
y la alimentacíon del lactante Introducción
 El SIDA y la alimentacíon del lactante Declaración política conjunta del ONUSIDA, la OMS y el UNICEF Introducción El número de lactantes que nacen infectados por el VIH está aumentando día tras día. La
El SIDA y la alimentacíon del lactante Declaración política conjunta del ONUSIDA, la OMS y el UNICEF Introducción El número de lactantes que nacen infectados por el VIH está aumentando día tras día. La
1. Cuáles son las diferencias en los componentes químicos del ADN y ARN?
 ACTIVIDADES TEMA 4 - BIOTECNOLOGÍA 1. Cuáles son las diferencias en los componentes químicos del ADN y ARN? Las cadenas de ADN están formadas por fosfato y desoxirribosa y la del ARN por fosfato y ribosa.
ACTIVIDADES TEMA 4 - BIOTECNOLOGÍA 1. Cuáles son las diferencias en los componentes químicos del ADN y ARN? Las cadenas de ADN están formadas por fosfato y desoxirribosa y la del ARN por fosfato y ribosa.
51 Int. CI.: H04M 1/22 (2006.01) H04M 1/725 (2006.01) TRADUCCIÓN DE PATENTE EUROPEA. 72 Inventor/es: 74 Agente/Representante:
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 44 869 1 Int. CI.: H04M 1/22 (2006.01) H04M 1/72 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación y número
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 44 869 1 Int. CI.: H04M 1/22 (2006.01) H04M 1/72 (2006.01) 12 TRADUCCIÓN DE PATENTE EUROPEA T3 96 Fecha de presentación y número
SÍNTESIS Y PERSPECTIVAS
 SÍNTESIS Y PERSPECTIVAS Los invitamos a observar, a identificar problemas, pero al mismo tiempo a buscar oportunidades de mejoras en sus empresas. REVISIÓN DE CONCEPTOS. Esta es la última clase del curso.
SÍNTESIS Y PERSPECTIVAS Los invitamos a observar, a identificar problemas, pero al mismo tiempo a buscar oportunidades de mejoras en sus empresas. REVISIÓN DE CONCEPTOS. Esta es la última clase del curso.
CAPÍTULO 7. CONCLUSIONES FINALES
 CAPÍTULO 7. CONCLUSIONES FINALES Conclusiones finales El grado de protección, UPF, que un tejido proporciona contra el paso de radiación ultravioleta viene influenciado por todos los parámetros de los
CAPÍTULO 7. CONCLUSIONES FINALES Conclusiones finales El grado de protección, UPF, que un tejido proporciona contra el paso de radiación ultravioleta viene influenciado por todos los parámetros de los
PROCEDIMIENTO PARA LA UTILIZACIÓN DEL POLIMORFISMO DEL GEN COMT (CATECOL-OXI-METILTRANSFERASA) EN EL DIAGNÓSTICO DEL SÍNDROME DE FIBROMIALGIA
 2 PROCEDIMIENTO PARA LA UTILIZACIÓN DEL POLIMORFISMO DEL GEN COMT (CATECOL-OXI-METILTRANSFERASA) EN EL DIAGNÓSTICO DEL SÍNDROME DE FIBROMIALGIA D E S C R I P C I Ó N OBJETO DE LA INVENCIÓN La presente
2 PROCEDIMIENTO PARA LA UTILIZACIÓN DEL POLIMORFISMO DEL GEN COMT (CATECOL-OXI-METILTRANSFERASA) EN EL DIAGNÓSTICO DEL SÍNDROME DE FIBROMIALGIA D E S C R I P C I Ó N OBJETO DE LA INVENCIÓN La presente
AQUAGESTION. ISAv: Un acercamiento actualizado en la detección de sus variantes en la región. Departamento de Desarrollo y Laboratorio Diagnóstico.
 AQUAGESTION ISAv: Un acercamiento actualizado en la detección de sus variantes en la región. Departamento de Desarrollo y Laboratorio Diagnóstico. Noviembre 2011 ACTUALIDAD Este año Sernapesca confirma
AQUAGESTION ISAv: Un acercamiento actualizado en la detección de sus variantes en la región. Departamento de Desarrollo y Laboratorio Diagnóstico. Noviembre 2011 ACTUALIDAD Este año Sernapesca confirma
Entrevista a: ESTHER LIÑÁN. Coordinadora TIC del IES Griñón y Sección de Torrejón de la Calzada.
 Entrevista a: ESTHER LIÑÁN. Coordinadora TIC del IES Griñón y Sección de Torrejón de la Calzada. P: Según he oído, el IES Griñón representa un buen ejemplo de uso e integración de TIC en la Educación.
Entrevista a: ESTHER LIÑÁN. Coordinadora TIC del IES Griñón y Sección de Torrejón de la Calzada. P: Según he oído, el IES Griñón representa un buen ejemplo de uso e integración de TIC en la Educación.
TRAZABILIDAD. Trazabilidad y Etiquetado La trazabilidad y etiquetado son conceptos distintos tanto en su naturaleza como en su objetivo.
 TRAZABILIDAD Se define como: aquellos procedimientos preestablecidos y autosuficientes que permiten conocer el histórico, la ubicación y la trayectoria de un producto o lote de productos a lo largo de
TRAZABILIDAD Se define como: aquellos procedimientos preestablecidos y autosuficientes que permiten conocer el histórico, la ubicación y la trayectoria de un producto o lote de productos a lo largo de
Int. Cl. 7 : G04B 45/00. 22 kfecha de presentación: 12.03.1998 71 k Solicitante/s: GHESA INGENIERIA Y TECNOLOGIA, S.A. Magallanes, 3 28015 Madrid, ES
 k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 143 941 21 k Número de solicitud: 00980030 1 k Int. Cl. 7 : G04B 4/00 B0B 17/08 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
k 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 k Número de publicación: 2 143 941 21 k Número de solicitud: 00980030 1 k Int. Cl. 7 : G04B 4/00 B0B 17/08 k 12 SOLICITUD DE PATENTE A1 22 kfecha de
ES 2 244 309 A1 E04D 1/36 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA. 11 Número de publicación: 2 244 309. 21 Número de solicitud: 200400215
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 244 309 21 Número de solicitud: 20040021 1 Int. Cl. 7 : B32B 27/32 E04D 1/36 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 Número de publicación: 2 244 309 21 Número de solicitud: 20040021 1 Int. Cl. 7 : B32B 27/32 E04D 1/36 12 SOLICITUD DE PATENTE A1 22 Fecha de presentación:
RESUMEN La industria alimentaria, en respuesta a la demanda por parte de los consumidores de alimentos naturales, frescos y libres de conservantes
 RESUMEN La industria alimentaria, en respuesta a la demanda por parte de los consumidores de alimentos naturales, frescos y libres de conservantes químicos, ha desarrollado tecnologías de conservación
RESUMEN La industria alimentaria, en respuesta a la demanda por parte de los consumidores de alimentos naturales, frescos y libres de conservantes químicos, ha desarrollado tecnologías de conservación
Naturaleza y educación
 Novedades en la investigación de la EH. En lenguaje sencillo. Escrito por científicos. Para toda la comunidad EH. El ejercicio aumenta el reciclaje celular El ejercicio aumenta el reciclaje celular en
Novedades en la investigación de la EH. En lenguaje sencillo. Escrito por científicos. Para toda la comunidad EH. El ejercicio aumenta el reciclaje celular El ejercicio aumenta el reciclaje celular en
Calculadora de Tamaño muestral GRANMO
 Calculadora de Tamaño muestral GRANMO Versión 7.12 Abril 2012 http://www.imim.es/ofertadeserveis/software-public/granmo/ Entre las distintas ofertas que existen para el cálculo del tamaño muestral, ofrecemos
Calculadora de Tamaño muestral GRANMO Versión 7.12 Abril 2012 http://www.imim.es/ofertadeserveis/software-public/granmo/ Entre las distintas ofertas que existen para el cálculo del tamaño muestral, ofrecemos
