ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS
|
|
|
- Victoria Camacho Santos
- hace 8 años
- Vistas:
Transcripción
1 . Estructura secundaria, terciaria y cuaternaria de las proteínas. Fuerzas débiles que estabilizan la estructura tridimensional. Geometría del enlace peptídico. Estructura secundaria: hélices alfa, hojas beta y giros beta. Proteínas fibrosas: alfa-queratina, colágeno. Proteínas globulares. Estructura terciaria. Desnaturalización y plegamiento. Chaperonas moleculares. Estructura cuaternaria. Ventajas estructurales y funcionales de la asociación cuaternaria. Hemoglobina: estructura y función. Efecto Bohr y anemia falciforme BIOQUÍMICA-1º de Medicina Dpto. Biología Molecular Jesús Navas ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEINAS Cada proteína posee una única estructura 3D. La estructura 3D de una proteína depende de la secuencia de aacs. La función de una proteína depende de su estructura 3D. La estructura 3D se estabiliza mediante enlaces disulfuro y fuerzas no covalentes. Dentro de la gran variedad de las proteínas se reconocen algunos patrones estructurales comunes. 2
2 FUERZAS QUE ESTABILIZAN LA ESTRUCTURA TERCIARIA 1 Cys S S Cys Asp 2 COO - + NH 3 Lys 3 Glu CO O - H O Ser Tyr Phe OH 4 Val CH 3 CH 3 CH 3 Ile CH 3 1. Puentes di-sulfuro 2. Atracción electrostática 3. Puentes de hidrógeno 4. Interacción hidrofóbica 3 Proteínas nativas son las que se encuentran en su conformación funcional plegada (la más estable). Las interacciones que estabilizan la conformación nativa de una proteína son los puentes disulfuro y las interacciones no covalentes. La conformación más estable es la que permite la formación del máximo número de puentes de hidrógeno dentro de la proteína. En general los residuos hidrofóbicos quedan orientados hacia el interior de la proteína, lejos del contacto con el entorno acuoso. Los residuos hidrofílicos quedan orientados hacia el exterior. 4
3 EL ENLACE PEPTÍDICO ES PLANO Y RÍGIDO Los seis átomos del grupo peptídico en el mismo plano debido al carácter de doble enlace parcial del enlace peptídico ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 5 La resonancia de electrones confiere al enlace peptídico carácter de doble enlace parcial Un doble enlace puro C-O permitiría la rotación alrededor del C-N Un doble enlace C=N impediría la rotación pero en ese caso habría una carga neta negativa en el O - La verdadera densidad electrónica es intermedia. La barrera para la rotación C-N es de unos 88 kj/mol, que es suficiente para mantener el grupo amido en un plano ("Biochemistry" 2nd ed. Garrett, R.H. and Grisha C.M. Saunders College Publishing ) 6
4 (casi siempre, excepto con Pro) Prolina ("Biochemistry" 5th ed. Berg, Tymoczko and Stryer. Freeman and Co. 2002) 7 Hay libre rotación alrededor de los enlaces Ca-CO y Ca-N ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 8
5 Planos del enlace amida Un péptido tiene muchas conformaciones según los ángulos Phi y Psi (Adopta la más favorable desde el punto de vista energético = menores impedimento estérico y repulsión electrostática Cadena lateral Aminoácidos ("Biochemistry" 2nd ed. Garrett, R.H. and Grisha C.M. Saunders College Publishing ) 9 Hélice alfa: un puente de H entre el CO de un aminoácido y el NH del cuarto aminoácido (i+4) por detrás ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 10
6 Hélice alfa: Un puente de H entre el CO de un aminoácido y el NH del cuarto por detrás 3,6 AA por vuelta de hélice 1,5 Amstrong (0,15 nm) de distancia entre vuelta y vuelta Dextrógira ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 11 Hélice alfa ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham C.M. Saunders College Publishing ) 12
7 Las cadenas laterales sobresalen de manera perpendicular al eje de la hélice Hélice anfipática: un lado apolar y otro hidrófobo (flavodoxina) Hélice apolar (citrato sintasa) Hélice polar (calmodulina) ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 13 FACTORES QUE AFECTAN A LA ESTABILIDAD DE LA HELICE ALFA Repulsión o atracción electrostática entre residuos. Impedimento estérico (entre residuos adyacentes y entre residuos separados por 3 ó 4 aminoácidos). La prolina y la glicina tienen un efecto desestabilizador de la alfa hélice. 14
8 Dos proteínas formadas mayoritariamente por hélices alfa Mioglobina Bacteriodopsina ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 15 CONFORMACION EN LAMINA BETA Esqueleto de la cadena polipeptídica extendido en zig-zag. Las cadenas polipeptídicas en zig-zag se disponen de manera adyacente formando una lámina estabilizada por puentes de H. Láminas beta paralelas (cadenas orientadas en la misma dirección) y antiparalelas (orientadas en direcciones opuestas). 16
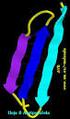
9 Hoja beta paralela Hoja beta antiparalela ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 17 CONFORMACION EN LAMINA BETA Esqueleto de la cadena polipeptídica extendido en zig-zag. Las cadenas polipeptídicas en zig-zag se disponen de manera adyacente formando una lámina estabilizada por pp de H. Láminas beta paralelas (cadenas orientadas en la misma dirección) y antiparalelas (orientadas en direcciones opuestas). 18
10 Hoja beta antiparalela C N N C C N ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 19 Hoja beta paralela N N N ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 20
11 Hélice alfa: Representación del esqueleto N- Cα -CO Cadena beta Representación del esqueleto N- Cα - CO y de los Cβ. Los planos amida quedan perpendiculares a la página Hélice alfa Cadena beta: una hoja beta requiere al menos dos cadenas 21 GIROS BETA Son elementos de conexión entre hélices alfa y/o láminas beta. Determinan un cambio de dirección de las cadenas polipeptídicas. Se forma un puente de hidrógeno entre un residuo (n) y el situado tres aminoácidos después (n + 3) La prolina y la glicina abundan en los giros beta 22
12 Antiparalela Giro beta 2 3 Paralela 1 4 ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 23 La probabilidad de formar helice alfa o lámina beta es en cierta medida predecible a partir de la secuencia de aminoácidos, según los angulos Φ y Ψ ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 24
13 Frecuencias relativas de la aparición de aminoácidos en estructuras secundarias Hélice alfa Lámina beta Giro beta Glu, Met, Ala, Leu, Lys Phe, Trp, Tyr, Ile, Val, Thr, Cys ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 25 Puede haber largos fragmentos de proteína sin estructura secundaria definida Quimotripsina ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 26
14 ESTRUCTURA TERCIARIA Estructura espacial de la proteína. Depende de la secuencia de aacs y puede predecirse. Se determina por difracción de RX. Motivo: patrón de plegamiento característico que aparece en varias proteínas. Dominio: región de la cadena polipeptídica que puede plegarse de manera estable e independiente 27 La secuencia de aminoácidos permite predecir con cierta aproximación la estructura tridimensional de dominios no muy grandes de proteínas ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 28
15 Ortólogos y parálogos tienen estructuras terciarias semejantes (Stryer, 2002) 29 30
16 31 Proteínas fibrosas y globulares Fibrosas: constan de un solo tipo de estructura secundaria. Función estructural. Insolubles en agua. Alfa-queratinas, colágeno y elastina. Globulares: constan de varios tipos de estructura secundaria. Solubles en agua. Enzimas y proteínas reguladoras. 32
17 COLAGENO Se encuentra en el tejido conjuntivo de tendones, cartílagos, matriz orgánica de huesos y córnea del ojo. Hélice levógira más compacta que la alfa hélice. Superhélice dextrógira formada por enrollamiento de 3 hélices (tropocolágeno) Gli, Ala, 4-0H-Pro, 5-0H-Lys muy abundantes. El tripéptido Gly-X-Pro aparece repetido numerosas veces a lo largo de la cadena del colágeno 33 Triple hélice del colágeno Colágeno tipo I: [α1(i)] 2 α2(i): tendones, huesos y piel Colágeno tipo II: [α1(ii)] 3 : cartílago Colágeno tipo III: [α1(iii)] 3 vasos, piel recién nacido, pared intestinal ("Biochemistry" TEMA 2nd 5 ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 34
18 Hélice del colágeno Triple hélice del colágeno Triple hélice del colágeno (corte sagital) ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 35 36
19 Hélice alfa Cadena de colágeno Hélice de colágeno ( Lehninger TEMA Principles 5 of Biochemistry Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 37 Fibras de colágeno ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 38
20 Modificaciones postraduccionales de aminoácidos del colágeno 4-Hidroxi-Pro 3-Hidroxi-Pro 5-Hidroxi-Lys Lys Lys ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) Puentes de Lys entre cadenas de colágeno 39 ENFERMEDADES DEL COLAGENO Escorbuto: fragilidad capilar, hemorragias, lesiones cutáneas. Déficit de Vitamina C. Síndrome de osteogénesis imperfecta. Mutación Gly 988 /Cys en el colágeno tipo I. Huesos quebradizos, deformaciones en el esqueleto (niños de cristal). Síndrome de Ehler-Danlos. Piel hiperextensible, exceso de movilidad en las articulaciones. Rotura de arterias y vejiga (más graves). Latirismo. Inhibición de la lisil oxidasa. Deformación de la columna vertebral, luxación de articulaciones, desmineralización de huesos, hemorragias articulares. 40
21 41 42 Molecular Biology of the Cell Alberts et el. Garland. 1994
22 GLOBINAS ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 43 Grupo hemo: grupo prostético de la mioglobina y hemoglobina Anillo plano, hidrófobo ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 44
23 MIOGLOBINA: 153 aac,17200 Da ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 45 Puente de H entre el O 2 y el H de la His 46 (Mattews and van Holde. Bioquímica. McGraw-Hill)
24 Los aminoácidos hidrofóbicos están en el interior de la globina Hidrofóbicos en rojo Hidrofílicos en verde 47 (Mattews-van Holde) 48
25 ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 49 The tetrameric structure of hemoglobin 50
26 Curvas de saturación de Mb y Hb con oxígeno Presión parcial de O 2 en capilares de tejidos y músculo Mioglobina Presión parcial de O 2 en sangre arterial de pulmones 1,0 - Saturación con O 2 0,8-0,6-0,4 - Hemoglobina 0, P O 2 (mm Hg) 51 La unión del oxígeno provoca un cambio conformacional en aminoácidos cercanos al grupo hemo... 52
27 ... Que se transmite a toda la cadena y a las cuatro cadenas (+O 2 ) 53 Efecto Bohr y efecto del BPG Tejidos Pulmones mm Hg ( Lehninger Principles of Biochemistry 3th.ed. 54 Nelson, DL and Cox, M.M. Worth Publishers, 2000.)
28 (Mathews -van Holde) 55 ( Bioquímica 3ª ed. T.M.Devlin56 Ed. Reverté. 1999))
29 Hb fetal (α 2 γ 2 ): His 143 / Ser. Menor afinidad por el 2,3-BPG y por tanto mayor afinidad por el O 2 (Mathews -van Holde) 57 Formación de fibras de hemoglobina S Saliente hidrofóbico (Glu 6 Val 6 de β-globina) ( Lehninger Principles of Biochemistry 3th.ed. Nelson, TEMA DL and 5 Cox, M.M. Worth Publishers, 2000.) 58
30 Anemia falciforme (Mathews -van Holde) 59 ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 60
31 Identificación de HbS por electroforesis ( Modern Genetic Analysis. A.J. Griffiths et al. Freeman and Co. 1999) Patología molecular de la hemoglobina 62
32 DESNATURALIZACION DE PROTEINAS Pérdida de la estructura 3D de una proteína. Cambian las propiedades físicas, químicas y biológicas. Se produce por tratamiento con agentes físicos y agentes químicos. 63 Agentes desnaturalizantes Ácidos y bases fuertes Disolventes orgánicos (alcoholes, cetonas, cloroformo) Detergentes (SDS) Agentes reductores (mercaptoetanol) Compuestos polares neutros (urea, guanidina) Sales a elevada concentración Aumento de temperatura Agresión mecánica (agitación, trituración) 64
33 Desnaturalizacion y renaturalización de la RNasa ( Lehninger Principles of Biochemistry 3th.ed. Nelson, DL and Cox, M.M. Worth Publishers, 2000.) 65 PLEGAMIENTO DE LAS PROTEINAS Para que las proteínas funcionen correctamente han de plegarse y alcanzar el estado nativo, su conformación más estable. En el proceso de plegamiento de algunas proteínas intervienen las chaperonas (HSPs, disulfuro-isomerasa), que ayudan a plegarse a otras proteínas. Enfermedades por plegamiento anormal de proteínas: Creutzfeldt-Jacob (encefalopatía espongiforme), Alzheimer, esclerosis lateral amiotrófica, Parkinson. 66
34 Formación rápida de estructuras secundarias locales Formación de dominios a través de la agregación cooperativa de núcleos de plegamiento Formación de glóbulo fundido Ruta de plegamiento de proteínas Ajuste de la conformación de los dominios Proteína plegada final ("Biochemistry" 2nd ed. Garrett, R.H. and Grisham, C.M. Saunders College Publishing ) 67
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares.
 Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4c Estructura tridimensional de las proteínas. Proteínas fibrosas. Proteínas globulares. Proteínas fibrosas Estructura y función de las queratinas Estructura y función del colágeno Triple hélice de
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria.
 Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
Tema 4b Estructura tridimensional de las proteínas. Estructura supersecundaria y terciaria. Estructura supersecundaria Motivos Dominios Estructura terciaria Fuerzas que la estabilizan Plegamiento de proteínas
Bioquímica Estructural y Metabólica. Tema 3. Proteínas: composición y estructura
 TEMA 3. Proteínas: composición y estructura. Enlace pep)dico. Pép0dos. Niveles de organización estructural de las proteínas. Estructura primaria. Proteínas homólogas. Estructura secundaria, terciaria y
TEMA 3. Proteínas: composición y estructura. Enlace pep)dico. Pép0dos. Niveles de organización estructural de las proteínas. Estructura primaria. Proteínas homólogas. Estructura secundaria, terciaria y
Bioquímica Estructural y Metabólica. TEMA 4. Proteínas estructurales y globulares
 TEMA 4. Proteínas: estructurales y globulares. Clasificación de las proteínas según su estructura. El colágeno como paradigma de las proteínas estructurales. Enfermedades del colágeno. Dos proteínas globulares:
TEMA 4. Proteínas: estructurales y globulares. Clasificación de las proteínas según su estructura. El colágeno como paradigma de las proteínas estructurales. Enfermedades del colágeno. Dos proteínas globulares:
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 03 Semestre: 13-I Este material es exclusivamente para uso
Proteínas fibrosas. Alfa Queratinas Beta-Queratinas Fibroína Colágeno Elastina
 Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Proteínas Fibrosas La mayor parte o casi toda la proteína está organizada de manera paralela a un sólo eje Las proteínas fibrosas son generalmente fuertes mecánicamente Son generalmente insolubles Generalmente
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de las proteínas
 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
PROTEÍNAS. Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas:
 PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
PROTEÍNAS Largas cadenas de aminoácidos que se pliegan con una estructura definida Son responsables de la mayoría de las funciones bioquímicas: Tipos de Proteínas ESTRUCTURA DE LAS PROTEÍNAS Estructura
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
AMINOÁCIDOS SE PUEDEN UNIR POR ENLACES PEPTÍDICOS
 Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
TEMA PROTEINAS.
 TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
TEMA 2.3.- PROTEINAS. Contenido: ü Niveles estructurales de las proteínas. ü Estructura primaria: Relación estructura función y evolución molecular. ü Estructura secundaria. ü Estructura terciaria: La
Proteínas fibrosas. α-queratinas
 Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Hélices α entrecruzadas por puentes disulfuro Proteínas fibrosas α-queratinas Estructura Características Localización Estructuras resistentes e insolubles de dureza y flexibilidad variables Estructura
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
TEMA 5. LAS PROTEÍNAS.
 TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
TEMA 5. LAS PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES. Son macromoléculas formadas por C, H, O y N. (en algunas ocasiones S). Son importantes porque son las biomoléculas más abundantes en peso seco (50%)
BIOQUÍMICA-1º de Medicina Dpto. Biología Molecular Jesús Navas ENZIMAS
 Tema 6. ENZIMAS. Clasificación. Principios de la catálisis enzimática. Energía de activación. Velocidad de reacción y equilibrio de reacción. Cinética enzimática: ecuación de Michaelis- Menten. Ecuación
Tema 6. ENZIMAS. Clasificación. Principios de la catálisis enzimática. Energía de activación. Velocidad de reacción y equilibrio de reacción. Cinética enzimática: ecuación de Michaelis- Menten. Ecuación
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupo: 07 Semestre: 17-I Este material es exclusivamente para uso educativo
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN
 UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
UT1. BIOMOLÉCULAS PRESENTES EN LOS SERES VIVOS. RELACIÓN ESTRUCTURA/FUNCIÓN Tema 1: Introducción a la Bioquímica. Composición del cuerpo humano. Tema 2: Proteínas, Glúcidos, Lípidos y Ácidos Nucleicos.
H N CH COOH. dipéptido
 CLASE : PROTEINAS Fuerzas que influyen en estructura Proteica Papel de secuencia de aminoácidos en estructura de la proteína Estructura Secundaria de las Proteínas Plegamiento (Folding) de proteínas y
CLASE : PROTEINAS Fuerzas que influyen en estructura Proteica Papel de secuencia de aminoácidos en estructura de la proteína Estructura Secundaria de las Proteínas Plegamiento (Folding) de proteínas y
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 16-I Este material es exclusivamente para uso
ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO
 ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO Todos los aminoácidos tienen, como mínimo, dos grupos titulables o ionizables, cada uno con un pka característico y, por tanto, con dos zonas tampón
ESTRUCTURA GENERAL DE LOS AMINOACIDOS A ph FISIOLOGICO Todos los aminoácidos tienen, como mínimo, dos grupos titulables o ionizables, cada uno con un pka característico y, por tanto, con dos zonas tampón
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
AMINOÁCIDOS, PÉPTIDOS Y PROTEINAS. M.Sc. GABY MÓNICA FELIPE BRAVO
 AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
AMINÁCIDS, PÉPTIDS Y PRTEINAS M.Sc. GABY MÓNICA FELIPE BRAV AMINÁCIDS C H 2 N C H R TDS LS AMINÁCIDS QUE FRMAN PARTE DE LAS PRTEÍNAS SN L-AMINÁCIDS CLASIFICACIÓN DE LS AMINÁCIDS ALIFÁTICS N PLARES ARMÁTICS
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
Copyright (c) Marina González, Gabriela Gómez
 PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
PROTEÍNAS Los aminoácidos AMINOÁCIDOS ESENCIALES Aquellos que no pueden ser sintetizados y deben incorporarse con la dieta. Aminoácidos polares Aminoácidos no polares Aminoácidos sin carga Aminoácidos
I) Biomoléculas 6) Proteínas I-6 PROTEÍNAS
 I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-6 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería.
 Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
Aminoácidos y Proteínas Tema 6 Licenciatura en Enfermería. Proteínas. Características Generales. Las proteínas son macromoléculas formadas por cadenas lineales de aminoácidos y compuestas por carbono (C),
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
Tema 5 Estructura cuaternaria de proteínas
 Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
Tema 5 Estructura cuaternaria de proteínas Estructura y función de la Hemoglobina Unión de la Hemoglobina a ligandos Curva unión O 2 a la Hemoglobina Efectores alostéricos Efecto del ph sobre la saturación
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
PROTEÍNAS. Las proteínas están constituidas por la unión de numerosas moléculas sencillas (monómeros) denominados aminoácidos.
 PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
PROTEÍNAS 1. INTRODUCCIÓN Las proteínas son los constituyentes químicos fundamentales de la materia viva. Constituyen alrededor del 50% en peso seco del cuerpo. Los glúcidos y lípidos se encuentran en
7.012 Serie de ejercicios 1
 ombre Grupo 7.01 Serie de ejercicios 1 Pregunta 1 a) uáles son los 4 tipos principales de moléculas biológicas mencionadas en clase? ite una función importante de cada tipo de molécula biológica celular.
ombre Grupo 7.01 Serie de ejercicios 1 Pregunta 1 a) uáles son los 4 tipos principales de moléculas biológicas mencionadas en clase? ite una función importante de cada tipo de molécula biológica celular.
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
Funciones biológicas de las proteínas. 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica.
 Funciones biológicas de las proteínas 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica. 2.- Proteínas de transporte. Proteínas de transporte en el
Funciones biológicas de las proteínas 1.- Enzimas. Las proteínas más variadas y de mayor especialización son aquéllas con actividad catalítica. 2.- Proteínas de transporte. Proteínas de transporte en el
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA PROTEÍNAS.- FUNCIONES BIOLÓGICAS a) Enzimas.- Actividad catalítica b) Hormonas c) Anticuerpos d) Receptores en membranas Reconocimiento
Estructura secundaria de las proteínas
 Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
QUIMICA BIOLOGICA INTRODUCCION GENERAL
 QUIMICA BIOLOGICA INTRODUCCION GENERAL 1 BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número
QUIMICA BIOLOGICA INTRODUCCION GENERAL 1 BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 5) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS
 INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación
INTRODUCCION A LA ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS Lic. Claudio Vidos Departamento de investigación de DEMIK Electromedicina Director del INSTITUTO CAV Rehabilitación Departamento de investigación
Holoproteínas (sólo contienen aa)
 TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
TEMA 4: P ROTEÍNAS 1. Concepto y clasificación Las proteínas son biomoléculas orgánicas formadas por C, H, O, N y en menor medida P y S y otros elementos (Fe,Cu, Mg, ). Son polímeros no ramificados de
ESTRUCTURA DE LAS PROTEÍNAS. La conformación de las proteínas viene definida por cuatro estructuras: Enlaces sencillos de rotación libre
 ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE LAS PROTEÍNAS La existencia de enlaces en la cadena polipeptídica que permiten la libre rotación de sus átomos, posibilita que (en teoría ) cualquier proteína puede adoptar un elevado número
ESTRUCTURA DE PROTEÍNAS
 ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
ESTRUCTURA DE PROTEÍNAS PROTEINAS Polipéptidos cuya secuencia aminoacídica está determinada genéticamente. Poseen entre 50 y mas de 20,000 residuos aa. (PM entre 5,500 y 220,000). Macromoléculas mas versátiles
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
La palabra "Bioquímica" fué utilizada por primera vez. número de "Hoppe-Seylers Zeitschrift für Physiologische Chemie" (la primera revista de
 BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número de "Hoppe-Seylers Zeitschrift für Physiologische
BIOQUIMICA: La química de los seres vivos. La palabra "Bioquímica" fué utilizada por primera vez por Félix Hoppe-Seyler en 1877, en el prólogo al primer número de "Hoppe-Seylers Zeitschrift für Physiologische
Metodologías básicas del procesamiento de Proteinas
 Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
Metodologías básicas del procesamiento de Proteinas Alejandra Kun Departamento de Proteínas y Ácidos Nucleicos-IIBCE Unidad Asociada Sección Bioquímica Facultad de Ciencias 13 de octubre 2014 Curso Introducción
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas.
 Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
Unidad 5 (Parte 6) Aminoácidos, Péptidos y Proteínas. Las proteínas se encuentran en todos los organismos vivos, son de muchos tipos diferentes y desempeñan muchas funciones biológicas distintas. La queratina
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
TEMA 5: ARQUITECTURA DE PROTEINAS. Parte 2
 TEMA 5: ARQUITECTURA DE PROTEINAS. Parte 2 Estructura Cuaternaria Estructuras Cuaternarias -Homotípicas: asociación entre dos o mas cadenas polipeptídicas iguales o muy similares -Heterotípicas: interacción
TEMA 5: ARQUITECTURA DE PROTEINAS. Parte 2 Estructura Cuaternaria Estructuras Cuaternarias -Homotípicas: asociación entre dos o mas cadenas polipeptídicas iguales o muy similares -Heterotípicas: interacción
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
Aminoácidos, péptidos y proteinas
 Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Aminoácidos, péptidos y proteinas Generalidades sobre los aminoácidos Compuestos que contienen un grupo -NH 2 y un grupo -CO 2 H esos grupos en realidad están presentes como -NH 3+ and -CO 2 respectivamente.
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Estructura y estabilidad de un dominio proteico BRCT. Obregón Mansilla, Alexandra J. I. CAPÍTULO II ANTECEDENTES
 CAPÍTULO II ANTECEDENTES Frecuentemente se observa alteraciones en la abundancia de proteínas reguladoras críticas en células cancerosas (20). La pérdida de proteínas supresoras de tumores o el incremento
CAPÍTULO II ANTECEDENTES Frecuentemente se observa alteraciones en la abundancia de proteínas reguladoras críticas en células cancerosas (20). La pérdida de proteínas supresoras de tumores o el incremento
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
BIOQUÍMICA ESTRUCTURAL Y BIOLÓGICA José Carlos Rodríguez Rey, Javier León Serrano, Mª Dolores Delgado Villar y Jesús Navas Méndez
 EXAMEN DE BIOQUÍMICA ESTRUCTURAL Y METABÓLICA Apellidos... Nombre... EXAMEN TIPO 0 A. Preguntas test (3 puntos). respuesta acertada: 0,1 puntos; respuesta errónea: 0,025 puntos; pregunta sin contestar:
EXAMEN DE BIOQUÍMICA ESTRUCTURAL Y METABÓLICA Apellidos... Nombre... EXAMEN TIPO 0 A. Preguntas test (3 puntos). respuesta acertada: 0,1 puntos; respuesta errónea: 0,025 puntos; pregunta sin contestar:
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
Biomoléculas. Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos
 Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
Biomoléculas Se clasifican básicamente en 4 grandes grupos: Hidratos de carbono Proteínas Lípidos Ácidos nucleicos Aminoácidos, péptidos y proteínas Las proteínas cumplen importantes funciones biológicas:
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
Lehninger Principles of Biochemistry Fourth Edition
 David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
David L. Nelson and Michael M. Cox Lehninger Principles of Biochemistry Fourth Edition Capítulo 3: Amino Acidos, Péptidos, y Proteínas Copyright 2004 by W. H. Freeman & Company Estereoquímica de Aminoácidos
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS
 PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
PROPIEDADES FUNCIONALES DE LAS PROTEÍNAS Que es una Propiedad Funcional? Propiedades físicas y químicas que derivan del comportamiento de proteínas en sistemas alimenticios durante procesado, almacenamiento,
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Teoría de repulsión de pares electrónicos de la capa de Valencia
 Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
Teoría de repulsión de pares electrónicos de la capa de Valencia La estructura del Lewis muestra las moléculas en dos dimensiones generalmente con una representación plana de ellos y los pares de electrones
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M.
 COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
COLEGIO SAN CRISTOBAL Av. Diego Portales N 1.520. La Florida Guía de Biología I Medio Departamento de Ciencias Profesora NATALIA URQUIETA M. MOLÉCULAS ORGANICAS. Los componentes orgánicos de la materia
Lección 21. Proteínas de membrana Objetivos:
 Lección 21. Proteínas de membrana Objetivos: 1. Enumerar las funciones de las proteínas de membrana 2. Clasificar las proteínas de membrana 3. Describir las interacciones de las proteínas con la bicapa
Lección 21. Proteínas de membrana Objetivos: 1. Enumerar las funciones de las proteínas de membrana 2. Clasificar las proteínas de membrana 3. Describir las interacciones de las proteínas con la bicapa
Dra. Carmen Aída Martínez
 Dra. Carmen Aída Martínez Hemoproteínas Más abundantes en el ser humano. Función de almacenamiento y transporte de oxigeno. Valores normales: Hombres: 13 18 gr/dl Mujeres: 12-16 gr/dl Globina ESTRUCTURA
Dra. Carmen Aída Martínez Hemoproteínas Más abundantes en el ser humano. Función de almacenamiento y transporte de oxigeno. Valores normales: Hombres: 13 18 gr/dl Mujeres: 12-16 gr/dl Globina ESTRUCTURA
I) Biomoléculas 2) El agua I-2 EL AGUA
 I-2 EL AGUA IMPRTANCIA DEL AGUA PARA LS SERES VIVS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
I-2 EL AGUA IMPRTANCIA DEL AGUA PARA LS SERES VIVS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
TEMA 5 PROTEÍNAS. 4. Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas
 TEMA 5 PROTEÍNAS 1. Clasificación de las proteínas y niveles estructurales 2. Proteínas Fibrosas. Queratinas 4. Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas 1. Clasificación de las proteínas
TEMA 5 PROTEÍNAS 1. Clasificación de las proteínas y niveles estructurales 2. Proteínas Fibrosas. Queratinas 4. Proteínas Globulares. Mioglobina, Hemoglobina, Inmunoglobulinas 1. Clasificación de las proteínas
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno
 Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
Proteínas Globulares: Hemoglobina. Proteínas Fibrosas: Colágeno Tema 3 Proteínas Fibrosas y Proteínas Globulares Fibrosas Globulares Forma alargada Unidades repetidas de un solo tipo de estructura secundaria
TEMA 8: PROTEÍNAS. 1.-INTRODUCCIÓN. 2.-COMPOSICIÓN DE LAS PROTEÍNAS. 3.-CLASIFICACIÓN DE LAS PROTEÍNAS.
 TEMA 8: PROTEÍNAS. 1 1.-INTRODUCCIÓN. El término proteína deriva del griego "proteos" (lo primero, lo principal) y habla de su gran importancia para los seres vivos. La importancia de las proteínas es,
TEMA 8: PROTEÍNAS. 1 1.-INTRODUCCIÓN. El término proteína deriva del griego "proteos" (lo primero, lo principal) y habla de su gran importancia para los seres vivos. La importancia de las proteínas es,
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Bioquímica Estructural y Metabólica. Tema 2. Aminoácidos
 TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
REPASANDO CONCEPTOS : LAS PROTEÍNAS
 REPASANDO CONCEPTOS : LAS PROTEÍNAS Drqf. Manuel Fontboté A. Consultor en Ciencias Cosméticas CHILE El uso de materias activas de naturaleza proteica en los cosméticos no es un hecho reciente, antes bien,
REPASANDO CONCEPTOS : LAS PROTEÍNAS Drqf. Manuel Fontboté A. Consultor en Ciencias Cosméticas CHILE El uso de materias activas de naturaleza proteica en los cosméticos no es un hecho reciente, antes bien,
Tema 4: METABOLISMO DE PROTEINAS
 Tema 4: METABOLISMO DE PROTEINAS Introducción Generalidades sobre el metabolismo de proteínas Recambio proteico Fuentes de proteína en AA Calidad proteica Digestión. Metabolismo de aminoácidos Ciclo de
Tema 4: METABOLISMO DE PROTEINAS Introducción Generalidades sobre el metabolismo de proteínas Recambio proteico Fuentes de proteína en AA Calidad proteica Digestión. Metabolismo de aminoácidos Ciclo de
TEMA. Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras
 TEMA Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras Primaria Terciaria Cuaternaria Secundaria NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
TEMA Conformación tridimensional de proteínas Niveles estructurales Tipos de enlaces y fuerzas que estabilizan estas estructuras Primaria Terciaria Cuaternaria Secundaria NIVELES ESTRUCTURALES DE LAS PROTEÍNAS
TEMARIO PARA EL EXAMEN DE BIOQUÍMICA
 TEMARIO PARA EL EXAMEN DE BIOQUÍMICA PARTE I. ESTRUCTURA BIOLÓGICA Y QUÍMICA DE LAS PROTEÍNAS 1. CARACTERÍSTICAS QUÍMICAS DE LA MATERIA VIVA 1. La mayoría de los organismos están compuestos solamente de
TEMARIO PARA EL EXAMEN DE BIOQUÍMICA PARTE I. ESTRUCTURA BIOLÓGICA Y QUÍMICA DE LAS PROTEÍNAS 1. CARACTERÍSTICAS QUÍMICAS DE LA MATERIA VIVA 1. La mayoría de los organismos están compuestos solamente de
El huevo duro del Everest I
 Wolframio, un tipo con química 1 Wolframio, un tipo con química 2 El huevo duro del Everest I Wolframio, el protagonista de nuestras historias, tiene una cita en su pisolaboratorio. Su objetivo es seducir
Wolframio, un tipo con química 1 Wolframio, un tipo con química 2 El huevo duro del Everest I Wolframio, el protagonista de nuestras historias, tiene una cita en su pisolaboratorio. Su objetivo es seducir
Singularidad del carbono
 Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
Singularidad del carbono Su configuración electrónica y su tamaño determinan que sea el único elemento químico que puede: Formar enlaces covalentes sencillos, dobles o triples con otros átomos de carbono.
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
La Absorción del Agua
 La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
La Absorción del Agua Importancia del Agua en las Plantas Es el cons5tuyente principal del protoplasma celular, en ocasiones representa hasta el 95% del peso total de la planta. Es el solvente en el que
FUNCIONES. Gran parte de la información genética de las células se expresa en forma de proteínas, las cuales desempeñan muy diversas funciones:
 Bioquímica CONCEPTO Son polímeros formados por monómeros llamados aminoácidos. Hay 20 aminoácidos en la naturaleza, que se combinan para formar miles de proteínas (muchos grupos funcionales: alcoholes,
Bioquímica CONCEPTO Son polímeros formados por monómeros llamados aminoácidos. Hay 20 aminoácidos en la naturaleza, que se combinan para formar miles de proteínas (muchos grupos funcionales: alcoholes,
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
Como transportamos el Oxigeno a los tejidos. A través de proteínas asociadas a metales de transición como el hierro y el cobre.
 Como transportamos el Oxigeno a los tejidos A través de proteínas asociadas a metales de transición como el hierro y el cobre. Grupo Hemo Los anillos pirrol tiene puentes a-metileno y grupos M, V, M,
Como transportamos el Oxigeno a los tejidos A través de proteínas asociadas a metales de transición como el hierro y el cobre. Grupo Hemo Los anillos pirrol tiene puentes a-metileno y grupos M, V, M,
