CHILLERA BA 2º Biología
|
|
|
- María Isabel Ruiz Cano
- hace 7 años
- Vistas:
Transcripción
1 2º BACHILLERATO
2 Introducción Las Notas amplían o complementan los contenidos explicados en las clases. Después de cada clase y antes de realizar las actividades propuestas en las Prácticas es conveniente que consulte las Notas correspondientes. ÍNDICE Notas 1: Componentes químicos de la materia viva... 4 Notas 2: El agua y las sales minerales... 7 Notas 3 y 4: Los glúcidos Notas 5 y 6: Los lípidos Notas 7 y 8: Las proteínas Notas 9: Las enzimas Notas 10 y 11: Los ácidos nucleicos Notas 12: La célula Notas 13: La membrana plasmática Notas 14: El citoplasma y sus componentes Notas 15: Orgánulos de membrana simple Notas 16: Orgánulos de membrana doble Notas 17 y 18: El núcleo Notas 19 y 20: La división celular Notas 21 a 24: El metabolismo celular. El catabolismo Notas 25: El anabolismo autótrofo La célula, unidad de vida 3
3 Notas 1 Componentes químicos de la materia viva 1. Concepto de Biología La Biología es la ciencia que estudia a los seres vivos. Su nombre proviene del griego bios, que significa vida, y de logos, que significa estudio. Si analizamos los términos de esta definición, encontramos que: Se llama ciencia al estudio razonado de la materia. Por lo tanto, la ciencia necesita de la materia para desarrollarse y para avanzar. Cuando no hay nada que pesar, medir, observar, etc., no hay lugar para la ciencia. Se considera ser vivo a aquel que tiene las siguientes características: posee una estructura material compleja, se nutre, se relaciona y se reproduce. 2. Características de los seres vivos El atributo más sobresaliente de los seres vivos es, quizá, su complejidad y su alto grado de organización. Poseen estructuras internas intrincadas, que contienen muchas clases de moléculas complejas. Se presentan, además, en una variedad asombrosa de especies diferentes. Por contraste, la materia inanimada de su entorno, representada por el suelo, el agua y las rocas, está constituida, habitualmente, por mezclas casuales de compuestos químicos sencillos, y su organización estructural es más bien sencilla. Los seres vivos presentan gran variedad y diversidad de formas y organización, pero hay unas características que son comunes a todos ellos: A) Todos los seres vivos tienen una composición química semejante: agua, sales minerales, glúcidos, lípidos, prótidos y ácidos nucleicos (semejantes pero no idénticas, pues puede haber componentes iguales para grupos amplios de especies, o géneros, o clases, y, sin embargo, hay otros que son diferentes para miembros de la misma especie, e incluso del mismo clan familiar.) B) Todos los seres vivos realizan una serie de funciones vitales, que se pueden agrupar en tres: Nutrición: entendida genéricamente como la capacidad de intercambiar materia y energía con el medio. Relación: en sentido amplio, sería la capacidad de intercambiar información con el medio; es decir, recibir estímulos y generar respuestas. Reproducción: entendida como la capacidad de crear réplicas semejantes a sí mismos. C) Finalmente todos los seres vivos están compuestos por unas unidades básicas llamadas células. 3. Niveles de organización Al observar la materia, podemos distinguir en ella varios grados de complejidad estructural, que son los llamados niveles de organización. 4 La célula, unidad de vida
4 - Nivel subatómico: Lo integran las partículas más pequeñas de materia, como protones, neutrones y electrones. A su vez, estas unidades se encuentran organizadas en un nivel superior o nivel atómico. - Nivel atómico: Los átomos son la parte más pequeña de un elemento químico que puede intervenir en una reacción. Por ejemplo, un átomo de hierro (Fe), un átomo de oxígeno (O), etc. - Nivel molecular: Es el que incluye a las moléculas, que son unidades materiales formadas por la agrupación de dos o más átomos mediante enlaces químicos. Por ejemplo, una molécula de oxígeno (O 2 ), una de carbonato cálcico (CaCO 3 ), etc. A las moléculas que forman parte de los seres vivos se las denomina biomoléculas o principios inmediatos. Las macromoléculas son el resultado de la unión de distintas moléculas, como es el caso de algunos aminoácidos y nucleótidos, que dan lugar a las proteínas y los ácidos nucleicos, respectivamente. La unión de varias macromoléculas puede dar lugar a asociaciones supramoleculares. Estas, a su vez, pueden asociarse formando orgánulos celulares, como las mitocondrias y los cloroplastos, etc., sin que estos puedan ser considerados como individuos, ya que no gozan de autonomía. Los virus son asociaciones supramoleculares. - Nivel celular: Es el primer nivel que se puede considerar que incluye seres vivos. Abarca las células. Estas son unidades de materia viva constituidas por una membrana, un citoplasma y un núcleo. Se distinguen dos tipos de células: las células procariotas, que son las que carecen de envoltura nuclear y que, por lo tanto, el contenido del núcleo se haya disperso en el citoplasma (Ej.: las bacterias), y las células eucariotas, que son las que sí tienen envoltura nuclear y un núcleo bien diferenciado (células de los animales, los vegetales y los protozoos). - Nivel pluricelular: Abarca aquellos seres vivos que están constituidos por más de una célula. Dentro de este nivel se pueden distinguir varios grados de complejidad o subniveles: los conjuntos de células especializadas reciben el nombre de tejido, como el tejido muscular o el nervioso. Los tejidos se reúnen para formar órganos, como el corazón. El conjunto de todos los órganos que, de forma coordinada, desempeñan una función constituye un aparato, como el digestivo. - Nivel de población: Es un conjunto de individuos de la misma especie, que viven en una misma zona y que se influyen mutuamente. - Nivel ecosistema: Las distintas poblaciones que habitan en una misma zona forman una comunidad o biocenosis. Las condiciones físico-químicas de una zona y las características de la misma forman el biotopo. El conjunto formado por la biocenosis, el biotopo y las relaciones que entre ellos se establecen forman los ecosistemas. 4. Bioelementos y biomoléculas 4.1 Los bioelementos: Son los elementos que entran a formar parte de la materia viva con alguna función o utilidad para los organismos. Hay diversas clasificaciones de los bioelementos; la más utilizada es la siguiente: - Bioelementos primarios: se presentan en elevada proporción en la materia viva (>95%). Son C, H, O, N, P y S. Son los bioelementos plásticos, ya que forman parte de la estructura de los principios inmediatos orgánicos. La célula, unidad de vida 5
5 - Bioelementos secundarios: son abundantes pero menos y representan aproximadamente un 4,5% del total de la materia viva. Son Ca, Na, K, Mg y CI Dentro de los bioelementos secundarios, los que se presentan en proporciones mínimas (inferiores al 0,1%) se denominan oligoelementos y representan en total un 0,5% aproximadamente de la materia viva. Son: Fe, Mn, Cu, Zn, F, I, B y Si. 4.2 Las biomoléculas o principios inmediatos: Los átomos se unen para formar moléculas por medio de enlaces químicos. Las moléculas que forman parte de los seres vivos reciben el nombre de biomoléculas o principios inmediatos. Entre ellas cabe distinguir las siguientes: - Simples: formados por átomos iguales: gases (O 2, N 2 ). - Compuestos: formados por átomos distintos. - Inorgánicos: agua (H 2 O), CO 2 y sales minerales. - Orgánicos: glúcidos, lípidos, proteínas y ácidos nucleicos. 6 La célula, unidad de vida
6 Notas 2 El agua y las sales minerales Los bioelementos se encuentran en los seres vivos formando parte de las moléculas, que pueden ser inorgánicas u orgánicas. Las moléculas inorgánicas son sustancias que pueden encontrarse también fuera de los seres vivos. Son el agua y las sales minerales. 1. El agua El agua es la molécula más abundante en los seres vivos, y representa entre el 70 y 90% del peso de la mayor parte de los organismos. El contenido varía de una especie a otra; también en función de la edad del individuo (su porcentaje disminuye al aumentar la edad) y el tipo de tejido. 1.1 Características de la molécula de agua La molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno unidos por enlaces covalentes simples. El papel primordial del agua en el metabolismo de los seres vivos se debe a sus propiedades físicas y químicas, derivadas de la estructura molecular. A temperatura ambiente es líquida, al contrario de lo que cabría esperar, ya que otras moléculas de parecido peso molecular (SO 2, CO 2, H 2 S, etc.) son gases. Este comportamiento se debe a que los dos electrones de los dos hidrógenos están desplazados hacia el átomo de oxígeno, por lo que en la molécula aparece un polo negativo, donde está el oxígeno, debido a la mayor densidad electrónica, y dos polos positivos, donde están los dos hidrógenos, debido a la menor densidad electrónica. Las moléculas de agua son dipolos. Entre los dipolos del agua se establecen fuerzas de atracción llamadas puentes de hidrógeno, formándose grupos de 3-9 moléculas. Con ello se consiguen pesos moleculares elevados y el agua se comporta como un líquido. Estas agrupaciones le confieren al agua sus propiedades de fluido. Los enlaces por puentes de hidrógeno son, aproximadamente, 1/20 más débiles que los enlaces covalentes, el hecho de que alrededor de cada molécula de agua se dispongan otras moléculas unidas por puentes de hidrógeno, permite que se forme en el seno del agua una estructura ordenada de tipo reticular, responsable en gran parte del comportamiento anómalo y de sus propiedades físicas y químicas. La célula, unidad de vida 7
7 Dipolo de agua Unión de los dipolos por puentes de hidrógeno 1.2 Propiedades físico-químicas del agua a) Acción disolvente El agua es el líquido que más sustancias disuelve (disolvente universal). Esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias que presentan grupos polares o con carga iónica (alcoholes, aldehídos, cetonas, aminoácidos y proteínas), provocando su dispersión o disolución. En el caso de las disoluciones iónicas, los iones de las sales son atraídos por los dipolos del agua, quedando "atrapados" y recubiertos de moléculas de agua que impiden su unión. Este fenómeno se conoce como solvatación iónica. La capacidad disolvente es la responsable de dos funciones: 1. Medio donde ocurren las reacciones del metabolismo. 2. Sistemas de transporte de sustancias, aporte de nutrientes y la eliminación de desechos. b) Elevada fuerza de cohesión entre sus moléculas Los puentes de hidrógeno mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incomprensible. Al no poder comprimirse, puede tener la función, en algunos animales, de esqueleto hidrostático, como ocurre en algunos gusanos y permite dar volumen a las células. También explica la función mecánica amortiguadora que ejerce en las articulaciones (líquido sinovial). c) Elevada fuerza de adhesión Esta fuerza está en relación con los puentes de hidrógeno que se establecen entre las moléculas de agua y otras moléculas polares y es responsable, junto con la cohesión, del llamado fenómeno de la capilaridad. Cuando se introduce un capilar (tubo de pequeño diámetro) en un recipiente con agua, esta asciende por el capilar como si trepase agarrándose por las paredes, hasta alcanzar un nivel superior al del recipiente. A este fenómeno se debe, en parte, la ascensión de la savia bruta desde las raíces hasta las hojas, a través de los vasos leñosos. d) Gran calor específico El agua puede absorber grandes cantidades de "calor" que utiliza para romper los puentes de hidrógeno, por lo que la temperatura se eleva muy lentamente. Esto permite que el citoplasma acuoso sirva de protección ante los cambios de temperatura. Así se mantiene la temperatura constante (función termorreguladora). 8 La célula, unidad de vida
8 e) Elevado calor de vaporización Para evaporar el agua, primero hay que romper los puentes y, posteriormente, dotar a las moléculas de agua de la suficiente energía cinética para pasar de la fase líquida a la gaseosa. Cuando el agua se evapora en la superficie de un ser vivo, absorbe calor del organismo actuando como regulador térmico. Gracias a esta propiedad se puede eliminar gran cantidad de calor con poca pérdida de agua. f) Elevada tensión superficial Las moléculas de la superficie del agua experimentan fuerzas de atracción hacia el interior del líquido. Esto favorece que dicha superficie oponga una gran resistencia a ser traspasada y origina una película superficial que permite, por ejemplo, el desplazamiento sobre ella de algunos organismos. g) Densidad El agua en estado líquido es más densa que en estado sólido Esto permite la vida acuática en climas fríos; ya que, al descender la temperatura, se forma una capa de hielo en la superficie que flota y protege el agua líquida que queda bajo ella. Por tanto, a modo de resumen, las funciones del agua en los seres vivos derivadas de sus propiedades físico-químicas son: Disolvente universal de las sustancias de la materia viva: todas las reacciones bioquímicas ocurren en medio acuoso. Función estructural o plástica: la forma de las células se mantiene gracias a la presión del agua contenida en ellas, que es su componente mayoritario. De transporte de sustancias disueltas en ella. Termorreguladora: se opone a los cambios de temperatura o elimina el exceso de calor al ser evaporada (transpiración). Mecánica amortiguadora: en el movimiento amortigua el rozamiento de órganos con movilidad constante. 1.3 Ionización del agua y ph Disociación del agua: El agua pura tiene la capacidad de disociarse en iones: Agua molecular (H 2 O) Protones hidratados (H 3 O + ) o hidrogeniones (se utiliza H + ) Iones hidroxilo (OH - ) En realidad, esta disociación es muy débil en el agua pura, y así el producto iónico del agua a 25 o C es: Como en el agua pura la concentración de hidrogeniones y de hidroxilos es la misma, significa que la concentración de hidrogeniones es de 1 x [H + ] = [OH - ] = 10-7 = 7 moles/litro La célula, unidad de vida 9
9 Para simplificar los cálculos, Sorensen ideó expresar dichas concentraciones utilizando logaritmos, y así definió el ph como: logaritmo decimal con signo negativo de la concentración de iones hidrogeniones. ph agua = - log 10-7 = 7 El ph del agua es igual a 7. Como al agua se la considera neutra, ya que se disocia en igual número de OH - que de H +, el ph 7 es asimismo el ph neutro. Una disolución ácida es aquella cuya concentración de H + es mayor que la del agua, y básica si contiene menos H + que esta, de manera que las disoluciones cuyo ph es menor que 7 son ácidas y, mayores que 7, básicas. Disolución neutra ph = 7 Disolución ácida ph < 7 Disolución básica ph > 7 Los organismos vivos soportan muy mal las variaciones del ph, aunque tan solo se trate de unas décimas de unidad, y por ello han desarrollado en la historia de la evolución sistemas tampón o buffer que mantienen el ph constante, mediante mecanismos homeostáticos. Las variaciones de ph afectan a la estabilidad de las proteínas y, en concreto, a la actividad catalítica de los enzimas; pues, en función del ph, pueden generar cargas eléctricas que modifiquen su actividad biológica. Los sistemas tampón que tienden a impedir la variación del ph cuando se añaden pequeñas cantidades de iones H + u OH - consisten en un par ácido-base conjugado que actúan como dador y aceptor de protones, respectivamente. 2. Las sales minerales Las sales minerales son moléculas inorgánicas presentes en todos los seres vivos que se encuentran disueltas o en estado sólido (precipitadas). 2.1 Sales minerales disueltas Son las sales minerales solubles en agua; se encuentran disociadas en sus iones y forman parte de los medios internos intracelulares y extracelulares. Los iones con carga negativa o aniones más frecuentes en la materia viva son: los cloruros (Cl - ), fosfatos (PO 4 3- ), carbonatos (CO 3 2- ), bicarbonatos (HC0 3- ) y nitratos (N0 3- ). 10 La célula, unidad de vida
10 Los iones con carga positiva o cationes más abundantes en la materia viva son: sodio (Na + ), calcio (Ca 2+ ), magnesio (Mg 2+ ), hierro (Fe 2+ y Fe 3+ ) y potasio (K + ). Funciones: Las sales minerales hidrosolubles, a través de sus iones, cumplen diversas funciones de tipo general, colaborando en el mantenimiento de la homeostasis o equilibrio del medio interno o de tipo específico, que dependen del sistema biológico en el que se encuentran. Además pueden asociarse con otras moléculas orgánicas, como lípidos, proteínas o glúcidos. Mantener el grado de salinidad en los organismos. Las concentraciones iónicas de sales minerales se mantienen constantes, dentro de unos ciertos límites, en los distintos organismos. En un mismo organismo las concentraciones pueden variar de unos compartimentos a otros; por ejemplo, en el interior celular la concentración salina varía considerablemente respecto al plasma sanguíneo. Asimismo, existen diferencias importantes en las concentraciones de unos organismos a otros. Regular la presión osmótica y el volumen celular. La presencia de sales en el medio interno celular es determinante para que se verifique la entrada o salida de agua a través de la membrana. Los medios con alta concentración salina son hipertónicos con respecto a los que tienen una concentración salina menor, e hipotónicos en el caso contrario. Si el medio interno celular es hipertónico con respecto al exterior se producirá entrada de agua, que ocasionaran aumento del volumen celular; si la concentración iónica en el interior es menor, se producirá el efecto contrario, salida del agua y disminución del volumen celular. Regulación del ph. La actividad biológica en el medio interno celular se produce a un determinado valor de ph. Las reacciones químicas que se verifican en los organismos producen variaciones del ph y algunas sales minerales disueltas contribuyen a disminuir estas variaciones, manteniendo el ph constante. Las disoluciones de sales que tienen esta función se denominan tampones o disoluciones amortiguadoras. Existen disoluciones amortiguadoras en todos los fluidos biológicos. Las más importantes son: el sistema tampón fosfato (H 2 PO 4- / HPO 4 2- ) en el medio intracelular y el sistema tampón bicarbonato (HCO 3- / H 2 C0 3 ) en el medio extracelular. Generar potenciales eléctricos. Los iones que se encuentran en el interior de las células no son los mismos que los del medio externo; por esto, a ambos lados de la membrana existe una diferencia de cargas eléctricas. Esta irregular distribución de iones provoca la existencia de un potencial de membrana que ejerce una fuerza sobre cualquier molécula con carga eléctrica. 2.2 Sales minerales precipitadas Las sales minerales insolubles en la materia viva se encuentran en estado sólido. En cada organismo se forman diversos cristales de una o varias especies minerales con formas y tamaños específicos. Las sales minerales precipitadas que se encuentran en los seres vivos presentan diferencias importantes con respecto a las que se encuentran en la materia inorgánica. Se pueden asociar a macromoléculas, generalmente de tipo proteico, con las que interaccionan a través de grupos iónicos comunes y regulan el crecimiento de los cristales. Los cristales más abundantes en los organismos son de silicatos, carbonatos y fosfatos, estos últimos de calcio y magnesio. La célula, unidad de vida 11
11 Funciones: Su función es de tipo plástico, formando estructuras de protección y sostén, como por ejemplo: Forman parte de los caparazones de crustáceos y moluscos (CaCO 3 ) y caparazones silíceos de radiolarios y diatomeas. Esqueleto interno en vertebrados (fosfato, cloruro, fluoruro y carbonato de calcio) y los dientes. El carbonato de calcio también se puede encontrar en el oído interno, formando los otolitos que intervienen en el mantenimiento del equilibrio interno, o partículas de magnetita que, al parecer, pueden utilizar algunos animales con función de brújula para orientarse en sus desplazamientos. 3. Disoluciones y dispersiones coloidales Ni el agua ni las sales, y mucho menos el resto de las biomoléculas, se encuentran aisladas en los organismos, sino que están mezcladas formando disoluciones donde el agua actúa como fase dispersante, y en ese medio ocurren todos los procesos bioquímicos de los seres vivos. Una disolución o dispersión es una mezcla homogénea de moléculas distintas, que son las del disolvente o fase dispersante y las de soluto o fase dispersa. En las disoluciones acuosas, la fase dispersante es el agua. Estas disoluciones se clasifican según la naturaleza de las moléculas de la fase dispersa, que serán las responsables de sus propiedades. Disoluciones verdaderas: el soluto está formado por moléculas de bajo peso molecular (sales minerales, azúcares, aminoácidos, etc.). Dispersiones coloidales: los solutos son moléculas de gran peso molecular y tamaño. En estas dispersiones, los solutos son macromoléculas, como las proteínas, los ácidos nucleicos y los polisacáridos. Las dispersiones coloidales pueden presentarse en dos estados: en forma de sol o estado líquido, y en forma de gel o estado semisólido. El sol se produce cuando la fase dispersa es un sólido y la fase dispersante es un líquido. Tiene aspecto de líquido. El gel se produce cuando la fase dispersa es un líquido y la dispersante un conjunto de fibras entrelazadas. Tiene aspecto gelatinoso. 3.1 Propiedades de las disoluciones - La ósmosis La ósmosis es un fenómeno en el que se produce el paso o difusión de un disolvente a través de una membrana semipermeable (permite el paso de disolventes, pero no de solutos) desde una disolución más diluida a otra más concentrada. El agua es la molécula más abundante en el interior de todos los seres vivos y es capaz de atravesar las membranas celulares, que son semipermeables, para penetrar en el interior celular o salir de él. Esta capacidad depende de la diferencia de concentración entre los líquidos extracelular e intracelular, determinada por la presencia de sales minerales y moléculas orgánicas disueltas. Los medios acuosos separados por membranas semipermeables se denominan: Hipertónicos: los que tienen una elevada concentración de solutos con respecto a otros en los que la concentración es inferior. Hipotónicos: los que contienen una concentración de solutos baja con respecto a otros que la tienen superior. 12 La célula, unidad de vida
12 Isotónicos: si ambos lados tienen la misma concentración. Las moléculas de agua difunden desde los medios hipotónicos hacia los hipertónicos provocando un aumento de presión sobre la cara de la membrana del compartimiento hipertónico, denominada presión osmótica. Como consecuencia del proceso osmótico se puede alcanzar el equilibrio, igualándose las concentraciones y, entonces, los medios serán isotónicos. La membrana plasmática de la célula puede considerarse como semipermeable y, por ello, las células deben permanecer en equilibrio osmótico con los líquidos que las bañan. Cuando las concentraciones de los fluidos extracelulares e intracelulares son iguales, ambas disoluciones son isotónicas. Según entre o salga agua de las células se habla de dos fenómenos: - Plasmólisis: Efecto de salida de agua desde el interior de la célula al exterior, por un proceso de ósmosis, cuando se encuentra en un medio hipertónico (alta concentración salina), para igualar las concentraciones interna y externa. La célula perderá agua, se deshidratará y podrá llegar a morir (lisará) si el proceso es muy acusado. - Turgencia: Efecto de entrada de agua al interior de la célula cuando se encuentra en un medio hipotónico (baja concentración salina) por un proceso de ósmosis. La célula se hinchará, aumentando de volumen, y podrá llegar a estallar si el proceso es muy acusado. - La difusión y la diálisis Los líquidos presentes en los organismos son dispersiones de diversas sustancias en el seno del agua. Según el tamaño de las partículas, se formarán dispersiones moleculares o disoluciones verdaderas como ocurre con las que se forman con las sales minerales o por sustancias orgánicas de moléculas pequeñas, como los azúcares o aminoácidos. Las partículas dispersas pueden provocar, además del movimiento de ósmosis, estos otros dos: - La diálisis: en este caso pueden atravesar la membrana, además del disolvente, moléculas de bajo peso molecular y estas pasan atravesando la membrana desde la solución más concentrada a la más diluida. Es el fundamento de la hemodiálisis, que intenta sustituir la filtración renal deteriorada. - La difusión: sería el fenómeno por el cual las moléculas disueltas tienden a distribuirse uniformemente en el seno del agua. Puede ocurrir también a través de una membrana si es lo suficientemente permeable. Así se realizan los intercambios de gases y de algunos nutrientes entre la célula y el medio en el que vive. La célula, unidad de vida 13
13 Notas 3 y 4 Los glúcidos 1. Definición y clasificación 1.1. Definición de glúcidos Los glúcidos, también denominados azúcares, son compuestos químicos formados por carbono (C), hidrógeno (H) y oxígeno (O). Su fórmula empírica es parecida a C n H 2n O n, es decir, (CH 2 O) n. Por ello, se les suele llamar también hidratos de carbono o carbohidratos. Este nombre es, en realidad, poco apropiado; ya que no se trata de átomos de carbono hidratados, es decir, enlazados a moléculas de agua, sino de átomos de carbono unidos a grupos alcohólicos (-OH), llamados también hidroxilos, y a radicales hidrógeno (-H). Además, siempre hay un grupo cetónico o un grupo aldehído. Así, los glúcidos pueden definirse como un monómero o polímeros de polialcoholes con una función aldehído (polihidroxialdehídos) o cetona (polihidroxicetona). 1.2 Clasificación Monosacáridos u osas: poseen de 3 a 8 átomos de carbono en su molécula. Ósidos: están formados por la unión de varios monosacáridos, pudiendo existir además otros compuestos en su molécula. Holósidos: están formados solo por monosacáridos. Oligosacáridos: si está formado entre 2 y 10 monosacáridos. Polisacáridos: si su número es superior a 10 monosacáridos. - Homopolisacáridos: si son todos iguales. - Heteropolisacáridos: si hay más de un tipo de monosacáridos. Heterósidos: están formados por monosacáridos y otros compuestos no glucídicos. 2. Los monosacáridos Los monosacáridos son los azúcares más simples (monómeros) y, por lo tanto, no son hidrolizables. Químicamente son polihidroxialdehídos o polihidroxicetonas, pueden tener entre tres y siete átomos de carbonos en su molécula y responden a la fórmula general C n H 2n O n. La presencia del grupo aldehído o cetona les confiere carácter reductor. 2.1 Composición y nomenclatura Según posean la función aldehído o cetona, se clasifican en dos familias: en el primer caso, se denominan aldosas (poseen la función aldehído en el primer carbono) y, en el segundo, cetosas (localizándose el grupo cetona en el segundo carbono, siempre). Dentro de cada familia, se clasifican en distintos grupos, dependiendo del número de átomos que posean. Se nombran anteponiendo el prefijo aldo- o ceto- al prefijo que indica el 14 La célula, unidad de vida
14 número de carbono (tri, tetra, etc.) y añadiendo el sufijo -osa. Se denominan triosas (3 átomos de carbono), tetrosas (4), pentosas (5), hexosas (6), heptosas (7). 2.2 Propiedades de los monosacáridos - Son cristalizables, sólidos. - De color blanco. - Sabor dulce. - Solubles en agua. - Con poder reductor, debido a la presencia del grupo aldehído o cetona. - No son hidrolizables. - Presentan actividad óptica. - Isomería. 2.3 Isomería Cuando dos o más compuestos presentan la misma fórmula molecular y distintas fórmulas estructurales, se dice que cada uno de ellos es isómero de los demás. Los isómeros se diferencian por presentar distintas propiedades, ya sean físicas o químicas. En los monosacáridos podemos encontrar isomería de función, isomería espacial e isomería óptica. Isomería de función: Los isómeros se distinguen por tener distintos grupos funcionales. Las aldosas son isómeros de las cetosas. Isomería espacial: Los isómeros espaciales, o estereoisómeros, se producen cuando la molécula presenta uno o más carbonos asimétricos (carbono unido a cuatro radicales químicos distintos). Los radicales unidos a estos carbonos pueden disponerse en el espacio en distintas posiciones. Cuantos más carbonos asimétricos tenga la molécula, más tipos de isomería se presentan. El carbono asimétrico más alejado del grupo funcional sirve como referencia para nombrar la isomería de una molécula. Cuando el grupo alcohol de este carbono se encuentra representado a su derecha en la proyección lineal, se dice que esa molécula es D. Cuando el grupo alcohol de este carbono se encuentra representado a su izquierda en la proyección lineal, se dice que esa molécula es L. Enantiómeros: son moléculas que tienen los grupos -OH de todos los carbonos asimétricos, en posición opuesta, reflejo de la otra molécula isómera. Epímeros: son moléculas isómeras que se diferencian en la posición de un único -OH en un carbono asimétrico. 2.4 Actividad óptica o isomería óptica Cuando se hace incidir un plano de luz polarizada sobre una disolución de monosacáridos que poseen carbonos asimétricos, el plano de luz se desvía. Si la desviación se produce hacia la derecha, se dice que el isómero es dextrógiro y se representa con el signo (+). Si la desviación es hacia la izquierda, se dice que el isómero es levógiro y se representa con el signo (-). La célula, unidad de vida 15
15 2.5 Fórmulas lineales Las fórmulas con estructura en forma de cadena abierta de los monosacáridos se denominan "proyección de Fischer", se sitúa el grupo funcional principal en la parte superior y los grupos hidroxilos a la derecha o a la izquierda. 2.6 Fórmulas cíclicas Las aldopentosas y las hexosas en disolución no presentan estructura lineal, sino que presentan estructuras cerradas o cíclicas llamadas proyección de Hawort. El enlace de ciclación se genera entre el grupo carbonilo (=O), y el hidroxilo (-OH) del carbono asimétrico más alejado del grupo funcional, el carbono 4, en las aldopentosas, o del carbono 5, en las hexosas. Si la reacción es entre un alcohol y un grupo aldehído, el enlace se llama hemiacetal, y si es entre un alcohol y una cetona, se llama hemicetal. El ciclo resultante puede tener forma pentagonal (furano) o hexagonal (pirano), denominándose los monosacáridos furanosas o piranosas, respectivamente. En esta representación se sitúan hacia abajo todos los grupos situados hacia la derecha en la representación lineal y hacia arriba los situados hacia la izquierda (exceptuando, claro está, el - OH implicado en la formación del puente hemiacetal o hemicetal). 16 La célula, unidad de vida
16 Cuando se produce la ciclación de la molécula, aparece un nuevo átomo de carbono asimétrico, el carbono 1 en las aldosas o el 2 en las cetosas. Este carbono recibe el nombre de carbono anomérico. Existen dos formas anoméricas: Alfa (α): el OH del carbono anomérico queda hacia abajo. Beta (ß): el OH del carbono anomérico queda hacia arriba. 2.7 Principales monosacáridos Los monosacáridos más corrientes reciben nombres vulgares distintos a los científicos. Los más importantes son la glucosa, la fructosa, la ribosa y la desoxirribosa. Glucosa: también llamada azúcar de la uva, es una aldohexosa. Es el azúcar más utilizado por las células como fuente de energía. Se encuentra en forma libre en la sangre. Se puede obtener de la digestión de los glúcidos que tomamos con el alimento (los almacenamos en el hígado y en los músculos, como un polisacárido de reserva llamado glucógeno). Al degradarse en CO 2 y H 2 O, proporciona la energía que nuestras células necesitan para sus múltiples actividades. En los vegetales se encuentra formando parte de polisacáridos de reserva (amilosa y amilopectina) o estructurales (celulosa). Fructosa: es una cetohexosa que se encuentra en estado libre en las frutas y que forma parte, junto con la glucosa, del disacárido sacarosa. En el hígado se transforma en glucosa, por lo que posee para nuestro organismo el mismo valor energético que esta. Ribosa: es una aldopentosa que forma parte de la estructura de los ácidos nucleicos (ARN o ácido ribonucleico). Desoxirribosa: es un monosacárido que se origina por reducción de la ribosa en el carbono 2. Es el azúcar que forma parte del ADN o ácido desoxirribonucleico. 3. Los oligosacáridos. El enlace O-glicosídico Los oligosacáridos están formados por la unión de 2 a 10 monosacáridos mediante un enlace O-glucosídico. Los más importantes son los disacáridos. 3.1 Enlace O-glucosídico Es el enlace que se establece entre dos grupos hidroxilos (OH) de diferentes monosacáridos con la pérdida de una molécula de agua. La unión de los monosacáridos puede dar origen a oligosacáridos o polisacáridos. La célula, unidad de vida 17
17 Si en el enlace interviene el hidroxilo del carbono anomérico del primer monosacárido y otro grupo alcohol del segundo monosacárido, se establece un enlace monocarbonílico. Estos enlaces pueden ser o -glucosídicos, dependiendo de la posición que ocupa el grupo -OH del primer carbono (en la posición, el grupo -OH del primer carbono está hacia abajo en la representación de Haworth, y en la, hacia arriba). enlace glucosídico 1-4 enlace glucosídico Disacáridos Son oligosacáridos formados por dos monosacáridos. Son solubles en agua, dulces y cristalizables. Pueden hidrolizarse y ser reductores cuando el carbono anomérico de alguno de sus componentes no está implicado en el enlace entre los dos monosacáridos. La capacidad reductora de los glúcidos se debe a que el grupo aldehído o cetona puede oxidarse dando un ácido. Sacarosa: está formada por la unión (1-2) de una molécula de -Dglucopiranosasa con una molécula de -D-fructofuranosa. No posee poder reductor al no tener libre ningún grupo -OH de los carbonos anoméricos. Es el azúcar que consumimos normalmente, se obtiene principalmente a partir de la caña de azúcar y de la remolacha. Maltosa: formada por dos moléculas de -D-glucopiranosa (1-4). Recibe el nombre de azúcar de malta, se obtiene de la hidrólisis parcial del almidón y del glucógeno. Es un azúcar reductor, pues tiene libre el carbono 1 de la segunda glucosa. Lactosa: formada por la unión (1-4) de la -D-galactopiranosa y la -Dglucopiranosa. Es un disacárido con poder reductor al conservar libre el -OH del C anomérico de la glucosa. Se encuentra en la leche de los mamíferos, siendo esta su única fuente natural. 4. Polisacáridos Los polisacáridos son polímeros formados por la unión de muchos monosacáridos mediante enlaces O-glucosídicos. En el proceso de unión de n monosacáridos se liberan (n-1) moléculas de agua. Poseen características diferentes a las de los azúcares más sencillos, son insolubles en agua, insípidos y amorfos. Algunos, como el almidón, pueden formar dispersiones coloidales en el agua. Ninguno de ellos posee carácter reductor. Desempeñan generalmente funciones de reserva 18 La célula, unidad de vida
18 o estructurales; los que realizan funciones estructurales presentan enlaces -glucosídicos (celulosa, quitina), mientras que los que actúan como reserva energética presentan enlaces - glucosídicos (almidón, glucógeno). Almidón: es un polisacárido de reserva de los vegetales, se acumulan en los amiloplastos. Es especialmente abundante en semillas y tubérculos. Estructuralmente es un polímero de alto peso molecular formado por miles de moléculas de -D-glucopiranosa, unidas por enlaces O glucosídicos (1-4) y (1-6). Los granos de almidón constan de dos unidades estructurales, la amilosa y la amilopectina. Amilosa. Está constituida por unas 200 o 300 moléculas de glucosa unidas por enlaces (1-4). Esta cadena, a su vez, adopta una disposición helicoidal, con 6 glucosas cada vuelta. Amilopectina. La molécula adopta una disposición en hélice, dando una vuelta por cada 6 moléculas de glucosa; además, cada 12 glucosas, presenta ramificaciones por uniones (1-6). Glucógeno: es la molécula de reserva energética que poseemos los animales. Se acumula en el hígado y los músculos donde, cuando es necesario, se moviliza convirtiéndose en glucosa. Posee una estructura molecular helicoidal ramificada de hasta moléculas de glucosa con enlaces (1-4), y con gran cantidad de ramificaciones con enlaces (1-6), cada 8 o 10 glucosas. Celulosa: se encuentra exclusivamente en las células vegetales, formando parte de la pared celular (función esquelética o estructural). Es una molécula de estructura lineal, no ramificada, constituida por más de mil moléculas de glucosa, unidas por enlaces (1-4). Debido al tipo de enlace, cada molécula de glucosa está girada 180 respecto a la anterior. Varias cadenas paralelas se unen entre sí por puentes de hidrógeno, formando las microfibrillas, estas a su vez se unen formando fibrillas, y estas forman fibras. Esta estructura hace que las fibras sean muy rígidas e insolubles en agua, por lo que es un importante elemento estructural en las plantas. Nuestra especie no tiene enzimas capaces de hidrolizar los enlaces (1-4) y, por lo tanto, no puede utilizarla como alimento; sin embargo, la ingestión de celulosa genera residuos que facilitan el buen funcionamiento del aparato digestivo. Los animales herbívoros tienen microorganismos como bacterias que producen celulasa, enzima que hidroliza la celulosa. Quitina: es un polisacárido que realiza una función estructural. Se encuentra ampliamente difundido entre los hongos (en los que forma la membrana de secreción), y entre los artrópodos, en los que es el principal constituyente de su exoesqueleto. Es decir, desempeña en estos seres la misma acción protectora que tiene la celulosa en las células vegetales. Su estructura es un polímero cuyos monómeros son un derivado de la glucosa. 5. Funciones principales de los glúcidos Las principales funciones que realizan los glúcidos, en las que radica su importancia biológica, son: Energética Constituye el material energético de uso inmediato para los seres vivos; entre ellos, la glucosa es el azúcar más utilizado para este fin. Su oxidación libera energía que nos permite la realización de los procesos vitales. La célula, unidad de vida 19
19 De reserva Actúan como material de reserva energética, como ocurre con el almidón (vegetales) y el glucógeno (animales). Cuando las células lo necesitan, movilizan estas reservas, liberando moléculas de glucosa. Estructural Algunos azúcares forman parte esencial de las paredes celulares de los vegetales (celulosa, pectina, hemicelulosa), de las paredes bacterianas (peptidoglicanos), del exoesqueleto de los artrópodos, de los caparazones de los crustáceos (quitina) y de los ácidos nucleicos (ribosa y desoxirribosa). 20 La célula, unidad de vida
20 Notas 5 y 6 Los lípidos 1. Definición y clasificación 1.1 Definición Los lípidos son biomoléculas orgánicas, compuestas por carbono, hidrógeno y oxígeno. Presentan, en ciertas ocasiones, otros elementos como nitrógeno, fósforo y azufre. Este grupo incluye moléculas de estructuras muy diferentes, aunque todas ellas se caracterizan, sin embargo, por su insolubilidad en agua y por su solubilidad en disolvente orgánico (no polares), como el alcohol, benceno, acetona, éter, cloroformo Clasificación 2. Ácidos grasos Constituyen el grupo de lípidos más sencillos. Participan en la constitución de otros lípidos y son una importante fuente de energía química. Generalmente, no aparecen libres en la naturaleza sino que forman parte de lípidos saponificables. 2.1 Estructura Los ácidos grasos son moléculas que poseen una larga cadena lineal hidrocarbonada (alifática), por regla general de un número par de átomos de carbono, que oscila entre 10 y 22, (aunque los más abundantes tienen 16 o 18) y con un grupo carboxílico (-COOH) en el primer carbono de la molécula. La célula, unidad de vida 21
21 2.2 Clasificación Existen dos tipos de ácidos grasos: Saturados, en los que la cadena hidrocarbonada posee únicamente enlaces simples. Insaturados, si la cadena hidrocarbonada, además de enlaces simples, posee uno o varios dobles enlaces. 2.3 Propiedades La estructura y propiedad de los ácidos grasos depende del tipo y de la posición de los enlaces que poseen y de la longitud de la cadena de átomos de carbono. Son moléculas bipolares o anfipáticas (del griego amphi, doble). La cabeza de la molécula (-COOH) es polar o iónica y, por tanto, hidrófila y puede unirse a otros grupos similares por medio de enlaces del tipo puente de hidrógeno. La cadena (grupos -CH 2 - y -CH 3 terminal) es apolar o hidrófoba, mostrando tendencia a establecer enlaces de Van der Waals con otras cadenas semejantes. Estas características justifican dos importantes propiedades de los ácidos grasos: En un medio acuoso, los grupos hidrófilos se orientan hacia las moléculas de agua, mientras que los hidrófobos se alejan de estas. Este hecho explica la formación de películas superficiales, bicapas y micelas. El punto de fusión de los ácidos grasos insaturados es menor que el de los saturados. Este hecho explica el que, entre los animales homeotermos (entre los que la temperatura del cuerpo es constante), predominen los compuestos que derivan de los ácidos grasos saturados; mientras que, en aquellos en los que la temperatura es variable, abundan los ácidos grasos insaturados. El punto de fusión asciende cuando aumenta el número de átomos de carbono que posee la molécula; ya que, entre las cadenas de ácidos grasos, se establecen enlaces intermoleculares por fuerzas de Van del Waals y, al incrementarse el número de carbonos, aumenta el número de enlaces (requiriéndose más energía para romperlos y conseguir su fusión). A su vez, la presencia de dobles enlaces provoca una disposición espacial que impide la formación de estos enlaces, por lo que sus puntos de fusión serán más bajos. 22 La célula, unidad de vida
22 3. Acilglicéridos Las grasas son los lípidos más abundantes en la naturaleza, tanto en el reino animal como en el vegetal. Forman parte de los llamados lípidos saponificables, los cuales poseen enlaces de tipo éster y forman jabones por medio de hidrólisis alcalina (de ahí su nombre). 3.1 Estructura Los acilglicéridos son ésteres de la glicerina en los que uno, dos o los tres grupos alcohol de la misma han sido sustituidos por ácidos grasos. De esta forma dan lugar, respectivamente, a los monoacilglicéridos, los diacilglicéridos y los triacilglicéridos (también llamados triglicéridos o grasas). 3.2 Propiedades Esterificación Es una reacción entre un ácido carboxílico (-COOH) y un alcohol en la que se obtiene un éster y agua. Al reaccionar tres moléculas de ácidos grasos (por ejemplo, ácido palmítico) con una molécula de glicerina, dan lugar a una molécula de grasa más tres de agua. Esta reacción recibe el nombre de esterificación, y el producto de la misma es un éster. Saponificación Los ésteres se descomponen hirviéndolos con soluciones diluidas de hidróxido sódico (NaOH) o potásico (KOH). A esta reacción inversa se la conoce como saponificación, obteniéndose como producto resultante glicerol y sales sódicas o potásicas de los ácidos grasos, que reciben el nombre de jabones. Los acilglicéridos no poseen carga eléctrica, de ahí que también se las denomine grasas neutras. Los grupos polares que poseen (radicales =O) no se encuentran en el exterior de la molécula, por lo que son absolutamente insolubles en agua. Se disuelven en disolventes orgánicos y son malas conductoras del calor. Las grasas con ácidos grasos insaturados son líquidas a temperatura ambiente y reciben el nombre de aceites. Por su parte, si los ácidos grasos son saturados, los triglicéridos correspondientes son sólidos, de aspecto céreo blanquecino, y se denominan sebos (grasa de oveja o ternera). Las mantecas son grasas semisólidas (grasa de cerdo). El punto de fusión de las grasas depende de la longitud de las cadenas hidrocarbonadas (alifáticas) y de su grado de insaturación. La célula, unidad de vida 23
23 3.3 Función biológica de las grasas Constituyen la reserva energética de los seres vivos. Se acumulan en las células adiposas de los animales y en las vacuolas de las células vegetales (principalmente en los frutos y semillas de plantas como el girasol, el olivo, etc.). Los mamíferos almacenamos la grasa en el tejido adiposo, debajo de la piel, en el llamado panículo adiposo. Cuando se consumen alimentos abundantes, el exceso ingerido es transformado en grasas que se almacenan en este panículo. En épocas de escasez, el organismo recurre a estas reservas: metaboliza las grasas almacenadas y obtiene de ellas la energía que necesita. Además, en los organismos de temperatura constante, el panículo adiposo constituye un eficaz aislante térmico y da protección a distintas zonas del cuerpo del efecto de golpes o contusiones. La insolubilidad de las grasas en agua permite que estas sean utilizadas también por las aves y los mamíferos, como impermeabilizante de las plumas y los pelos, respectivamente. 4. Ceras Son ésteres de monoalcoholes de cadena larga con ácidos grasos también de cadena larga; por ello, los dos extremos de la molécula son de naturaleza hidrófoba. Son insolubles en agua, lo que explica sus funciones protectoras y de revestimiento. Se localizan en la piel, pelo, plumas, epidermis de las hojas, etc. 5. Lípidos de membrana Son moléculas anfipáticas con una zona hidrófoba, en la que los ácidos grasos están unidos mediante enlaces éster a un alcohol (glicerina o esfingosina), y una zona hidrófila, originada por los restantes componentes no lipídicos que también están unidos al alcohol. Encontramos los siguientes tipos: 5.1. Glicerolípidos Poseen dos moléculas de ácidos grasos unidas mediante enlaces éster a dos grupos alcohol de la glicerina. Según sea el sustitúyete unido al tercer grupo alcohol de la glicerina, se forman los: a) Gliceroglucolípidos. Si se une un glúcido: lípidos que se encuentran en membranas de bacterias y células vegetales. b) Fosfolípidos. Se une el ácido fosfórico y constituye el ácido fosfatídico. Los fosfolípidos son lípidos saponificables que también se denominan fosfoglicéridos o glicerofosfolípidos. Constituyen la mayor parte de los lípidos que podemos encontrar en las membranas celulares. Poseen una glicerina esterificada en el carbono 3 con un grupo fosfato y en los carbonos 1 y 2 por sendos ácidos grasos. Generalmente, el ácido que esterifica en el C 1 es insaturado, mientras que 24 La célula, unidad de vida
24 el del C 2 es saturado. El grupo fosfato está unido mediante enlace éster a un sustituyente polar que puede ser aminoalcohol (formando un fosfoaminolípido) o polialcohol. Los fosfolípidos, cuando se encuentran en un medio acuoso, se asocian formando varios tipos de estructuras. En ellas, los grupos hidrófilos se orientan hacia las moléculas de agua y los hidrófobos se alejan, ocultándose dentro de la estructura. Esto explica que formen bicapas y micelas, que son estructuras básicas en las membranas biológicas. 5.2 Esfingolípidos Todos ellos poseen una estructura derivada de la ceramida, formada por un ácido graso unido por enlace amida a la esfingosina y una sustancia polar que puede ser un aminoalcohol o un glúcido. a) Esfingoglucolípidos: el grupo polar que se les une es un glúcido. Cerebrósidos. Tienen un monosacárido (glucosa o galactosa) unida a la ceramida. Son abundantes en las membranas de las células nerviosas del cerebro y del sistema nervioso periférico. Gangliósidos. Poseen un oligosacárido unido a la ceramida. Estas moléculas forman parte de las membranas celulares y especialmente de la plasmática, donde se intercalan con los fosfolípidos. b) Esfingofosfolípidos. El grupo alcohol de la ceramida se une a una molécula de ácido fosfórico que, a su vez, lo hace con otra de etanolamina o de colina. Así se originan las esfingomielinas, muy abundantes en el tejido nervioso, donde forman parte de las vainas de mielina. 6. Esteroides Son lípidos complejos, derivados del ciclo pentano-perhidro-fenantreno. Dentro de este grupo, los más importantes son los esteroles, que poseen en el tercer carbono una función alcohol (-OH). Un esterol muy abundante en los vertebrados es el colesterol, que es un componente muy importante de las membranas celulares a las que confiere fluidez, siendo esencial para el crecimiento en los organismos superiores. En estados patológicos, se presentan problemas con el colesterol, al depositarse este en las paredes de los vasos sanguíneos, causando así la enfermedad conocida como arteriosclerosis. El colesterol es también precursor de otros esteroles, como son: - Vitamina D: su ausencia provoca el raquitismo, al impedir la correcta mineralización de los huesos. - Hormonas sexuales andrógenas, como la testosterona que se forma en los testículos. - Hormonas de las cortezas suprarrenales, como la aldosterona, que incrementan la reabsorción de iones sodio, cloruro y bicarbonato en el riñón. 7. Terpenos (o isoprenoides) Son derivados del isopreno, formados por la unión de muchas unidades del mismo. Son muy abundantes entre los vegetales, formando parte de los aceites esenciales de las plantas, a las que dan su olor característico, como el geraniol del geranio, el limoneno del limón, o el mentol de la menta. Los carotenoides están formados por ocho unidades de isopreno; son, por tanto, tetraterpenos. Tienen una gran importancia biológica y están ampliamente difundidos en la naturaleza. Dentro de este grupo se encuentran muchos pigmentos vegetales, como la xantofila, responsable del color amarillo de la mayoría de las plantas, el β-caroteno, pigmento de color rojo anaranjado que da su color característico a la zanahoria, etc. La célula, unidad de vida 25
25 8. Funciones biológicas de los lípidos - Energéticas: almacenan gran cantidad de energía por unidad de masa (recuerde que, al oxidarse las grasas neutras, desprenden 9 4 Kcal/g), por lo que constituyen un excelente material de reserva energético que, al no almacenarse con agua, resulta relativamente ligero. - Estructurales: la naturaleza anfipática (bipolar) de algunos lípidos (ácidos grasos, fosfolípidos y glicolípidos) les permite organizarse en bicapas en medios acuosos, por ello, constituyen el material ideal para formar los sistemas de membranas de las células animales y vegetales. La particular estructura del colesterol es utilizada para conferir fluidez a estas membranas. - Protectoras: la insolubilidad en agua de grasas y ceras les permite desempeñar funciones de aislante de la humedad. Asimismo, la escasa conductividad térmica de las grasas del panículo adiposo (capa de grasa bajo la piel) de aves y mamíferos posibilita su uso como aislante térmico. También, el tejido adiposo que rodea algunas vísceras actúa como protección y amortiguador de golpes. - Reguladoras: ciertas hormonas, como las sexuales (andrógenos, estrógenos y progesterona) y las hormonas de la corteza suprarrenal, son derivados del colesterol, lo que les permite atravesar la membrana celular con facilidad ya que ejercen su acción desde el interior de la célula (a diferencia de otras hormonas como la adrenalina que lo hacen sin atravesarla). Algunas vitaminas como la A, E, K y D también tienen naturaleza lipídica. 9. Las hormonas Las hormonas son sustancias segregadas por células especializadas, localizadas en glándulas endocrinas, o también por células epiteliales e intersticiales cuyo fin es influir en la función de otras células. Según su naturaleza química, se encuentran dos tipos de hormonas: - Hormonas peptídicas: están constituidas por cadenas de aminoácidos, bien oligopéptidos (como la vasopresina), bien polipéptidos (como la hormona del crecimiento). En general, este tipo de hormonas no pueden atravesar la membrana plasmática de la célula diana, por lo cual los receptores para estas hormonas se hallan en la superficie celular. - Hormonas lipídicas: son esteroides (como la testosterona) o eicosanoides (como las prostaglandinas). Dado su carácter lipófilo, atraviesan sin problemas la bicapa lipídica de las membranas celulares y sus receptores específicos se hallan en el interior de la célula diana. Las hormonas tienen la característica de actuar sobre las células, que deben disponer de una serie de receptores específicos. Hay dos tipos de receptores celulares: - Receptores de membrana: los usan las hormonas peptídicas. Las hormonas peptídicas (1 er mensajero) se fijan a un receptor proteico que hay en la membrana de la célula, y estimulan la actividad de otra proteína (unidad catalítica), que hace pasar el ATP (intracelular) a AMP (2º mensajero) que, junto con el calcio intracelular, activa la enzima proteína quinasa (responsable de producir la fosforilación de las proteínas de la célula, que produce una acción biológica determinada). - Receptores intracelulares: los usan las hormonas esteroideas. La hormona atraviesa la membrana de la célula diana por difusión. Una vez dentro del citoplasma, se asocia con su receptor intracelular, con el cual viaja al núcleo atravesando juntos la membrana nuclear. En el núcleo se fija al DNA y hace que se sintetice ARNm, que induce a la síntesis de nuevas proteínas, que se traducirán en una respuesta 26 La célula, unidad de vida
26 fisiológica, o bien, pueden ubicarse en el lugar de la maquinaria biosintética de una determinada proteína para evitar su síntesis. La célula, unidad de vida 27
27 Notas 7 y 8 Las proteínas 1. Definición y clasificación 1.1 Definición Las proteínas son polímeros lineales de moléculas de aminoácidos que desempeñan múltiples funciones específicas. Estas dependen de su estructura tridimensional, que puede presentar cuatro niveles de plegamientos, de complejidad creciente. Las proteínas son muy abundantes, pues constituyen casi la mitad del peso en seco de la célula. Las proteínas están compuestas por átomos de carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N), aunque pueden contener también azufre (S). En algunas proteínas complejas (heteroproteínas) también están presentes el fósforo (P) y, en menor proporción, hierro (Fe), cobre (Cu), magnesio (Mg), yodo (I), etc. 1.2 Clasificación Holoproteínas Holoproteínas (Formadas solo por aminoácidos) Heteroproteínas Heteroproteínas (Grupo proteico+grupo prostético) Filamentosas Globulares Glucoproteínas Lipoproteínas Nucleoproteínas Cromoproteínas Fosfoproteínas 2. Los aminoácidos Los aminoácidos son las unidades estructurales básicas de las proteínas. Se caracterizan por tener un grupo carboxilo (-COOH) y un grupo amino (-NH 2 ) unidos al carbono que ocupa la posición α (C contiguo al grupo carboxilo). Unidos también a ese carbono tenemos un átomo de hidrógeno (H) y una cadena lateral, de mayor a menor complejidad, llamada radical o cadena (R). Las características de esa cadena son las que distinguen unos aminoácidos de otros. H HN 2 C COOH R Fórmula general 28 La célula, unidad de vida
28 2.1 Clasificación de los aminoácidos Todas las proteínas de todas las especies se construyen a partir de un conjunto de veinte aminoácidos diferentes. De la serie fundamental de 20 aminoácidos (aa), once se pueden sintetizar a partir de intermediarios del ciclo de Krebs o de otros metabolismos, mediante reacciones sencillas. Estos once aminoácidos reciben el nombre de aminoácidos no esenciales. Por el contrario, los humanos debemos obtener los nueve aminoácidos restantes a partir de los alimentos de la dieta y, por eso, reciben el nombre de aminoácidos esenciales. Atendiendo al grupo R, los aminoácidos se clasifican en: Hidrófobos: grupo R no polar formado por cadenas hidrocarbonadas. Hidrófilo: grupo R polar pero sin carga. Ácidos: con carga negativa, poseen dos grupos ácidos. Básicos: con carga positiva, poseen dos grupos aminos. 2.2 Propiedades de los aminoácidos Los aminoácidos son compuestos sólidos, incoloros, cristalizables, de elevado punto de fusión, solubles en agua, con actividad óptica y con un comportamiento anfótero. El comportamiento anfótero se refiere a que, en disolución acuosa, los aminoácidos pueden comportarse como ácido o como base (captar o ceder protones al medio), dependiendo del ph de la disolución en la que se encuentren. Si la disolución es ácida, los aminoácidos captan protones y se comportan como una base. Si la disolución es básica, ceden protones y se comportan como un ácido. Gracias a esto regulan el ph del medio. El ph en el cual un aminoácido tiende a adoptar una forma dipolar neutra (igual número de cargas positivas que negativas) se denomina punto isoeléctrico. 3. Péptidos Los aminoácidos se unen entre sí mediante enlaces peptídicos, un tipo de enlace covalente, constituyendo de este modo los péptidos. Dos aminoácidos reaccionan entre sí, perdiendo una molécula de agua; la molécula resultante recibe el nombre de dipéptido. Cuando son tres tripéptidos, cuatro tetrapéptidos. Un oligopéptido contiene menos de 50 y, en general, se denomina polipéptidos a las cadenas que poseen entre 50 Y 100 aa. Cuando se unen más de 100 aminoácidos se forman las proteínas. La célula, unidad de vida 29
29 3.1 El enlace peptídico Este enlace se establece entre el grupo carboxilo (-COOH) del primer aminoácido y el grupo amina (-NH 2 ) del segundo aminoácido y se libera una molécula de agua. Características del enlace peptídico: 1ª) El enlace peptídico es un enlace covalente que se establece entre un átomo de carbono y un átomo de nitrógeno. Es un enlace muy resistente, lo que hace posible el gran tamaño y estabilidad de las moléculas proteicas. 2ª) Los estudios de rayos X de las proteínas han llevado a la conclusión de que el enlace C-N del enlace peptídico se comporta en cierto modo como un doble enlace y no es posible, por lo tanto, el giro libre alrededor de él. 3ª) Todos los átomos que están unidos al carbono y al nitrógeno del enlace peptídico mantienen unas distancias y ángulos característicos y están todos ellos en un mismo plano. El enlace peptídico puede ser hidrolizado por acción de las proteasas. Estas son enzimas hidrolíticas presentes en los lisosomas celulares y en los jugos digestivos. 4. Estructura de las proteínas Las proteínas están compuestas por cadenas de aminoácidos (más de 100) unidos mediante enlaces peptídicos. La estructura de las proteínas es la composición y forma que adopta dicha cadena en el espacio. Tal conformación responde a cuatro niveles de organización, cada uno de los cuales se construye a partir del nivel anterior. A estos niveles se los denomina, respectivamente, estructura primaria, secundaria, terciaria y cuaternaria. Estructura primaria: es la secuencia de los aminoácidos de la proteína. Nos dice qué aminoácidos componen la proteína y el orden en que se encuentran. Una característica de esta estructura es la disposición en zigzag de los radicales R. El primer aminoácido tiene siempre libre el grupo amino. El último aminoácido siempre tiene libre el grupo carboxilo. Estructura secundaria: hace referencia a la disposición espacial de los aminoácidos que componen una proteína. Mediante estudios de difracción de rayos X, se ha determinado que la estructura primaria de los péptidos se pliega según dos estructuras secundarias posibles, denominadas α-hélice y β-laminar (u hoja plegada). La ordenación α-hélice: la cadena polipeptídica se enrolla en espiral sobre sí misma, la estructura se mantiene estable gracias a los enlaces de hidrógeno intracatenarios entre el -C=O de un aminoácido y el -NH- del cuarto aminoácido que le sigue. 30 La célula, unidad de vida
30 Las cadenas laterales de los aminoácidos quedan hacia el exterior de la hélice. La ordenación β-laminar o de hoja plegada: la cadena polipeptídica conserva su estructura en zigzag y se asocian entre sí estableciendo uniones mediante puentes de hidrógeno intercatenarios entre grupos C=O y -N-H. Los radicales R van quedando alternativamente hacia arriba y hacia abajo. Las cadenas polipeptídicas se pueden unir de formas paralelas, las cadenas se disponen en el mismo sentido; y antiparalelas, en sentido contrario (N-C y C-N). Las cadenas laterales de los aminoácidos se encuentran situadas por encima y por debajo del plano en zigzag de la lámina plegada. Esta ordenación forma grandes regiones en la mayoría de las proteínas globulares, y constituye una especie de trama laminar sobre la que se construye la proteína. Una molécula no tiene que estar constituida exclusivamente por un tipo de conformación. Lo normal es que las moléculas proteicas presenten porciones con hélices α, otras partes con conformaciones ß y partes que no tienen una conformación definida y que se llaman zonas irregulares. Estructura terciaria. Es la configuración definitiva que adopta la estructura secundaria de la proteína en el espacio. Esta estructura es estable gracias a las uniones que se producen entre los radicales R de los diferentes aminoácidos que se sitúan en posiciones muy alejadas el uno del otro. Estas uniones pueden ser: Enlaces de hidrógeno entre grupos peptídicos. Atracciones eléctricas entre grupos con carga opuesta. Atracciones hidrofóbicas. Fuerzas de Van der Waals entre radicales aromáticos. Puentes disulfuros entre radicales de aminoácidos que contienen azufre (cisteína). Son enlaces covalentes entre dos grupos (-SH) de dos cisteínas. Atendiendo a su configuración, se distinguen dos tipos de estructuras terciarias: las fibrosas (o filamentosas) y las globulares, aunque muchos autores consideran que las proteínas filamentosas son proteínas que carecen de estructura terciaria. Las proteínas fibrosas (o filamentosas) poseen una forma de haces lineales o de cuerda. Suelen tener función estructural, de protección o ambas a la vez y son insolubles en agua. Por ejemplo, tienen esta conformación: la queratina del pelo, plumas, uñas, cuernos; el colágeno de los huesos y el tejido conjuntivo; y la elastina de la piel y los vasos sanguíneos. Las proteínas globulares presentan una forma esférica o de ovillo, son solubles en agua y una gran parte desempeña funciones de transporte, como la hemoglobina contenida en los glóbulos rojos; otras actúan de biocatalizadores, como las enzimas, etc. Estructura cuaternaria. Muchas proteínas de gran tamaño están formadas por la asociación de varias cadenas polipeptídicas. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero. Cada proteína componente de la asociación conserva su estructura terciaria. La unión se realiza mediante gran número de enlaces débiles, como puentes de hidrógeno o interacciones hidrofóbicas. Este tipo de enlaces facilita enormemente tanto su formación como su disgregación. La estructura cuaternaria no la poseen todas las proteínas. Algunas que sí la presentan son: la hemoglobina y los anticuerpos. La célula, unidad de vida 31
31 Estructura de las proteínas 5. Propiedades de las proteínas Las propiedades de las proteínas están estrechamente relacionadas con su estructura: Solubilidad: las proteínas fibrosas suelen ser insolubles en agua, mientras que las globulares generalmente son solubles en medios acuosos. La solubilidad depende del tamaño y la forma de las moléculas y de la disposición de los radicales R. Así, si la proteína se rodea de una capa de moléculas de agua (capa de solvatación) que impide que se pueda unir a otras proteínas, se provoca su precipitación (insolubles). Desnaturalización: la desnaturalización de las proteínas supone el que estas pierdan sus estructuras secundarias y terciarias, es decir, su forma tridimensional, aunque mantengan su estructura primaria mediante los enlaces peptídicos. Con la desnaturalización desaparece la disposición espacial de la proteína, perdiendo de esta forma muchas de sus propiedades fundamentales, y no pudiendo realizar, por tanto, a partir de este momento, sus funciones biológicas. Los agentes que producen la desnaturalización de las proteínas son, entre otros, cambios de temperatura, o en el ph, alteraciones en la concentración; alta salinidad; agitación molecular. Si la desnaturalización es breve y suave, la proteína puede recuperar de nuevo la conformación original una vez se han restablecido las condiciones iniciales (renaturalización). Por el contrario, si el cambio es drástico y persistente, la desnaturalización se hace irreversible, las largas moléculas se entrecruzan y amontonan, la proteína se coagula y se hace insoluble. Especificidad: es una de las propiedades más características y se refiere a que cada una de las especies de seres vivos es capaz de fabricar sus propias proteínas (diferentes de las de otras especies) y, aún dentro de una misma especie, hay diferencias proteicas entre los distintos individuos. La enorme diversidad proteica interespecífica e intraespecífica es la consecuencia de las múltiples combinaciones entre los aminoácidos, lo cual está determinado por el ADN de cada individuo. La especificidad de las proteínas explica algunos fenómenos biológicos como: la compatibilidad o no de trasplantes de órganos, injertos biológicos, sueros sanguíneos, etc. O los procesos alérgicos e incluso algunas infecciones. Por otra parte, cada proteína desempeña una función específica. La función de una proteína depende de su estructura tridimensional, una proteína no puede desempeñar su función si no tiene la forma adecuada para hacerlo o no puede unirse de forma complementaria a otras moléculas sobre las que debe actuar. 32 La célula, unidad de vida
32 Capacidad amortiguadora: las proteínas tienen un comportamiento anfótero y esto las hace capaces de neutralizar las variaciones de ph del medio, ya que pueden comportarse como un ácido o una base y, por tanto, liberar o retirar protones (H + ) del medio donde se encuentran. 6. Funciones biológicas de las proteínas Las proteínas son los componentes orgánicos más abundantes en la célula por su participación imprescindible y trascendental en casi la totalidad de los procesos biológicos. La importancia de las proteínas estriba tanto en la enorme cantidad de funciones que desempeñan (de ahí su gran diversidad), como en la calidad de estas funciones. Entre estas funciones, cabe citar: Funciones enzimáticas o catalíticas: las enzimas son proteínas que regulan el metabolismo celular, aumentan la velocidad de las reacciones y permanecen inalteradas en el transcurso de estas. Funciones reguladoras u hormonales: algunas hormonas son también proteínas. Las hormonas son fabricadas por las células glandulares y son transportadas por la sangre para que puedan actuar sobre otras células del organismo. Por ejemplo, la insulina, la tiroxina, la hormona del crecimiento, etc. Funciones defensivas e inmunológicas: muchas proteínas desempeñan funciones protectoras en el organismo. Las más importantes son las inmunoglobulinas de la sangre. Estas proteínas son anticuerpos, se forman como respuesta del organismo a la presencia de sustancias extrañas o antígenos, a los que aglutinan o precipitan. Funciones de transporte: entre ellas destaca la hemoglobina, que transporta el oxígeno por la sangre de los vertebrados. Funciones estructurales: algunas glucoproteínas forman parte de las membranas celulares. El colágeno y la elastina son proteínas que en el tejido conjuntivo forman las fibras colágenas y elásticas, respectivamente. La queratina es un constituyente de las uñas, los pelos, las escamas de los reptiles, las plumas de las aves, etc. Funciones homeostáticas: las proteínas son capaces de mantener el equilibrio del medio interno. Además, dado su carácter anfótero (capaz de disociarse como ácido y como base) pueden actuar como tampón y ayudar a mantener constante el ph. Funciones contráctiles: los músculos deben su capacidad de contraerse a la existencia de dos proteínas contráctiles, la actina y la miosina. Funciones de reserva: como la ovoalbúmina en el huevo, o la caseína de la leche. La célula, unidad de vida 33
33 Notas 9 Las enzimas 1. Definición Las enzimas son proteínas con una función catalítica, es decir, proteínas que regulan las reacciones químicas en los seres vivos. Permiten que reacciones, que nunca podrían producirse o que lo harían a velocidades muy bajas en condiciones celulares, puedan tener lugar y a una velocidad suficiente, a las temperaturas habituales de los organismos. Intervienen en estas reacciones en muy pequeñas concentraciones, ya que no se consumen ni se alteran durante la reacción y pueden, por lo tanto, actuar sucesivas veces. 1.1 Nomenclatura de las enzimas Los nombres que originalmente se dieron a las enzimas, lo fueron a gusto de sus descubridores: así, tenemos la pepsina del jugo gástrico, la tripsina del jugo intestinal, o la ptialina de la saliva, nombres que nada nos indican acerca del tipo de sustrato sobre el que actúan, ni del tipo de reacción que catalizan. Posteriormente, se les dio nombres que indicaban el sustrato sobre el que actuaban, al que se añadía el sufijo asa. Así se designaron ureasa, amilasa, maltasa, etc. Pero, dado el gran número de enzimas que han terminado por descubrirse, en la actualidad alrededor de dos mil, ha sido preciso adoptar una nomenclatura más sistematizada. En esta nueva nomenclatura, primero se indica el sustrato y a continuación el nombre de la acción típica acabado en el sufijo -asa. Así, la enzima que interviene en el paso de ácido 3-fosfoglicérico a ácido 2-fosfoglicérico se denomina fosfoglicero-mutasa y la enzima que cataliza la reacción de polimerización del RNA RNA-se llama polimerasa. 1.2 Mecanismo de acción enzimática Las reacciones químicas (incluso las termodinámicamente posibles) no suceden espontáneamente si las moléculas reaccionantes carecen de la energía de activación suficiente. Las enzimas, como catalizadores que son, actúan disminuyendo la energía de activación. El mecanismo de actuación es el siguiente. Las enzimas (E) se unen de manera específica al sustrato (S) (molécula sobre la que actúa) como una llave se encaja en la cerradura que le corresponde. Se forma así un complejo transitorio llamado enzima-sustrato. La unión con el sustrato se realiza en una zona específica de la enzima, que recibe el nombre de centro activo. En un primer paso se forma un complejo enzima-sustrato (ES). Aquí la enzima induce cambios en la molécula de sustrato (ruptura o redistribución de enlaces, cambios en los grupos funcionales, etc.), que hacen disminuir su energía de activación y conducen a la formación del producto final (P) y la liberación de la enzima (E), inalterada, que puede actuar de nuevo. Sustrato Centro activo Productos 34 La célula, unidad de vida Enzima Enzima Complejo enzima-sustrato E + S E S E + P
34 Si nos detenemos a considerar un momento la forma en que actúan este tipo de catalizadores, podemos deducir las características principales de los mismos, o sea, las características de las enzimas: 1.- Especificidad: una enzima que no tenga la configuración adecuada al sustrato no ofrecerá la posibilidad de que este se una a su centro activo y, por tanto, no llegará a formarse el complejo enzima-sustrato que facilitará la reacción. Aunque como veremos más adelante, en determinados casos, la enzima puede ser engañada. 2.- No forman nunca parte del producto o productos. 3.- Debido a las circunstancias anteriores, no se consumen. 4.- Son necesarios, por tanto, solo en una pequeña cantidad. El centro activo de una enzima es una zona de la proteína constituido por una serie de aminoácidos. Estos pueden estar muy alejados entre sí en la estructura primaria, pero cercanos, en cambio, en la terciaria. De todo lo que acabamos de exponer se desprende que la desnaturalización de la enzima produce su inactivación. Pierde su forma, no existe centro activo o, mejor dicho, está desperdigado, y no existe así la posibilidad de formación del complejo enzima-sustrato. El grado de especificidad varía de unas a otras enzimas. Existen enzimas muy estrictas que, incluso, son capaces de distinguir formas isómeras de la serie D y L. Determinadas enzimas son activas con un L-aminoácido e inactivas con su isómero D. Otras enzimas, sin embargo, no llevan su especificidad hasta ese punto, y actúan sobre una serie de sustratos de estructura similar; así, por ejemplo, la sacarasa actúa sobre la sacarosa facilitando la reacción de hidrólisis que origina glucosa y fructosa, pero también lo puede hacer con la maltosa, molécula muy relacionada con la anterior, si bien la velocidad de reacción varía de uno a otro caso. 1.3 Factores que influyen en la actividad enzimática - Temperatura El aumento de la temperatura provoca en las moléculas un incremento de su energía cinética, los movimientos de las mismas son más rápidos, y la frecuencia de las colisiones entre moléculas aumenta, lo que propicia una mayor velocidad de reacción. Se ha comprobado que un aumento de 10 o C puede llegar a duplicar, y en ciertos casos a cuadriplicar, la velocidad de una reacción. Aunque esta característica solamente es aplicable a las reacciones catalizadas por las enzimas hasta una temperatura crítica, que coincide con la temperatura óptima, en la que la velocidad de la reacción catalizada por una determinada enzima es máxima. A partir de esta temperatura óptima se produce un brusco descenso de la velocidad de reacción, hecho que -a la luz de nuestros conocimientos- tiene fácil explicación. Recordemos nuevamente que las enzimas son proteínas, moléculas frágiles, sensibles y que, a altas temperaturas, sufren lo que conocemos como su desnaturalización, y que una enzima desnaturalizada, es decir, en la que solo se mantiene su estructura primaria, no tiene capacidad para catalizar una reacción metabólica. En general, la temperatura crítica de las enzimas oscila entre los 55 y los 60 o C, aunque las enzimas de algunas bacterias que viven en aguas termales llegan a tener temperaturas críticas de 80 a 90 o C. - ph Cada enzima necesita unos valores límites (máximos y mínimos) para poder desarrollar su actividad. Traspasados estos valores, la enzima se desnaturaliza y pierde su actividad. La célula, unidad de vida 35
35 Dentro de estos límites existe, como en el caso de la temperatura, un valor determinado del ph en el que la enzima desarrolla su actividad máxima, valor al que se le da el nombre de ph óptimo, y que varía de unas enzimas a otras. Así, la pepsina del jugo gástrico posee un ph óptimo de 2, muy ácido, mientras que el ph óptimo de la tripsina presente en el jugo pancreático es de 7 8, ligeramente básico. La mayoría de las enzimas intracelulares poseen, sin embargo, un ph óptimo cercano a la neutralidad. - Concentración del sustrato En toda reacción enzimática, si se incrementa la concentración del sustrato, se produce un aumento de la velocidad de formación del producto hasta llegar un momento en el que la velocidad no aumenta, debido a que se ha producido una saturación de la enzima. Actividad enzimática Enzima 1 Enzima 2 Velocidad máxima Vmax Desnaturalización ph óptimo Velocidad de reacción Temperatura óptima Velocidad ph Temperatura Sustrato 2. Las vitaminas Las vitaminas son compuestos heterogéneos imprescindibles para la vida que, al ingerirlos de forma equilibrada y en dosis esenciales, promueven el correcto funcionamiento fisiológico. La mayoría de las vitaminas esenciales no pueden ser sintetizadas por el organismo, por lo que este no puede obtenerlas más que a través de la ingesta equilibrada de vitaminas contenidas en los alimentos naturales. Las vitaminas son nutrientes que junto con otros elementos nutricionales actúan como catalizadoras de todos los procesos fisiológicos. Las frutas y verduras son fuentes importantes de vitaminas. Las vitaminas son precursoras de coenzimas, grupos prostéticos de las enzimas. Los requisitos mínimos diarios de las vitaminas no son muy altos, se necesitan tan solo dosis de miligramos o microgramos contenidas en grandes cantidades de alimentos naturales. Tanto la deficiencia como el exceso de los niveles vitamínicos corporales pueden producir enfermedades que van desde leves a graves y muy graves, como la pelagra o la demencia, entre otras, e incluso provocar la muerte. Algunas pueden servir como ayuda a las enzimas que actúan como cofactor, como es el caso de las vitaminas hidrosolubles. La deficiencia de vitaminas se denomina hipovitaminosis, mientras que el nivel excesivo de vitaminas se denomina hipervitaminosis. Está demostrado que las vitaminas del grupo B son imprescindibles para el correcto funcionamiento del cerebro y el metabolismo corporal. Este grupo es hidrosoluble (solubles en agua). Debido a esto son eliminadas principalmente por la orina, lo cual hace que sea necesaria la ingesta diaria y constante de todas las vitaminas del complejo B (contenidas en los alimentos naturales). Las vitaminas se pueden clasificar según su solubilidad: si lo son en agua, se denominan hidrosolubles y si lo son en lípidos, liposolubles. En los seres humanos hay La célula, unidad de vida
36 vitaminas que se clasifican en dos grupos: 9 hidrosolubles (8 del complejo B y la vitamina C) y 4 liposolubles (A, D, E y K). Vitaminas liposolubles Las vitaminas liposolubles - A, D, E y K - se consumen junto con alimentos que contienen grasa. Son las que se disuelven en grasas y aceites. Se almacenan en el hígado y en los tejidos grasos. Debido a que se pueden almacenar en la grasa del cuerpo, no es necesario tomarlas todos los días; por lo que es posible, tras un consumo suficiente, subsistir una época sin su aporte. Si se consumen en exceso (más de 10 veces las cantidades recomendadas) pueden resultar tóxicas. Esto les puede ocurrir sobre todo a los deportistas que, aunque mantienen una dieta equilibrada, recurren a suplementos vitamínicos en dosis elevadas, con la idea de que así pueden aumentar su rendimiento físico. Esto es totalmente falso, así como la creencia de que los niños van a crecer más si toman más vitaminas de las necesarias. Las vitaminas liposolubles son: Vitamina A (retinolftalina) Vitamina D (calciferol) Vitamina E (tocoferol) Vitamina K (antihemorrágica) Vitaminas hidrosolubles Las vitaminas hidrosolubles son aquellas que se disuelven en agua. Se trata de coenzimas o precursores de coenzimas, necesarias para muchas reacciones químicas del metabolismo. Se incluyen las vitaminas B 1 (tiamina), B 2 (riboflavina), B 3 (niacina o ácido nicotínico), B 5 (ácido pantoténico), B 6 (piridoxina), B 7 /B 8 (biotina), B 9 (ácido fólico), B 12 (cobalamina) y vitamina C (ácido ascórbico). Estas vitaminas contienen nitrógeno en su molécula (excepto la vitamina C) y no se almacenan en el organismo, a excepción de la vitamina B 12, que lo hace de modo importante en el hígado. El exceso de vitaminas ingeridas se excreta en la orina, por lo cual se requiere una ingesta prácticamente diaria; ya que, al no almacenarse, se depende de la dieta. Por otro lado, estas vitaminas se disuelven en el agua de cocción de los alimentos con facilidad, por lo que resulta conveniente aprovechar esa agua para preparar caldos o sopas. Hipervitaminosis Las vitaminas, aunque son esenciales, pueden ser tóxicas en grandes cantidades. Unas son muy tóxicas y otras son inocuas incluso en cantidades muy altas. La toxicidad puede variar según la forma de aplicar las dosis. Como ejemplo, la vitamina D se administra en cantidades suficientemente altas como para cubrir las necesidades para 6 meses; sin embargo, no se podría hacer lo mismo con vitamina B 3 o B 6, porque sería muy tóxica. Otro ejemplo es el que la suplementación con vitaminas hidrosolubles a largo plazo se tolera mejor debido a que los excedentes se eliminan fácilmente por la orina. Las vitaminas más tóxicas son la D y la A. También lo puede ser la vitamina B 3. Otras vitaminas, sin embargo, son muy poco tóxicas o prácticamente inocuas. La B 12 no posee toxicidad, incluso en dosis muy altas. Con la tiamina ocurre algo parecido, sin embargo, con dosis muy altas y durante mucho tiempo puede provocar problemas de tiroides. En el caso de la vitamina E, solo es tóxica con suplementos específicos de vitamina E y con dosis muy elevadas. También se conocen casos de intoxicaciones en esquimales al comer hígado de mamíferos marinos (el cual contiene altas concentraciones de vitaminas liposolubles). La célula, unidad de vida 37
37 Notas 10 y 11 Los ácidos nucleicos 1. Definición Los ácidos nucleicos son macromoléculas constituidas por la unión, mediante enlaces químicos, de unidades menores llamadas nucleótidos. Los ácidos nucleicos son compuestos de elevado peso molecular que están presentes en el núcleo de las células (también en determinados orgánulos como mitocondrias y cloroplastos). Son las moléculas encargadas de almacenar, transmitir y expresar la información genética. Existen dos tipos: ADN (ácido desoxirribonucleico) y ARN (ácido ribonucleico), presentes ambos en toda clase de células animales, vegetales o bacterianas. 2. Composición química de los ácidos nucleicos Los ácidos nucleicos son macromoléculas poliméricas formadas por subunidades llamadas nucleótidos. Están formados por la unión de una base nitrogenada, una pentosa y una molécula de ácido fosfórico (H 3 PO 4 ). Bases nitrogenadas: compuestos cíclicos formados por carbono y nitrógeno. Existen dos tipos: - Bases pirimidínicas, derivadas de la pirimidina. Son la citosina (C), que se encuentra tanto en el ADN como en el ARN; la timina (T), que se presenta solo en el ADN; y el uracilo (U), componente del ARN. - Bases púricas, derivadas de la purina. Las más importantes son la adenina (A) y la guanina (G). Las dos se encuentran en ambos tipos de ácidos nucleicos. Pentosa: ribosa en el ARN y desoxirribosa en el ADN. Ácido ortofosfórico (H 3 PO 4 ). Nucleósidos La unión de una pentosa con una base nitrogenada da lugar a un nucleósido. El enlace se forma entre el carbono anomérico del azúcar y uno de los nitrógenos de la base nitrogenada. En la unión se crea una molécula de agua. Este enlace recibe el nombre de enlace N-glucosídico. Si la pentosa es una ribosa, tenemos un ribonucleósido. Estos tienen como bases nitrogenadas la adenina, guanina, citosina y uracilo. Si la pentosa es una desoxirribosa, tenemos un desoxirribonucleósido. Estos tienen como bases nitrogenadas la adenina, citosina, guanina y timina. Se nombran añadiendo la terminación -osina, si derivan de una base púrica; o -idina, si esta es pirimidínica, al nombre de la base que los forman: adenosina, guanosina, citidina, timidina, etc. Si la pentosa es la desoxirribosa, se antepone el prefijo desoxi-; por ejemplo, desoxiaguanosina, desoxicitidina, etc. 38 La célula, unidad de vida
38 Nucleótidos Los nucleótidos se forman por la unión de un nucleósido con el ácido fosfórico. Es una unión fosfoéster entre un OH del ácido fosfórico y el OH situado en el carbono 5 del azúcar, con formación de una molécula de agua. Según el azúcar sea la ribosa o la desoxirribosa, tendremos ribonucleótidos o desoxirribonucleótidos. La nomenclatura de los nucleótidos es compleja. Los nucleótidos se nombran como el nucleósido del que proceden eliminando la a final y añadiendo la terminación monofosfato, por ejemplo, adenosin monofosfato (AMP). Llevan el prefijo desoxi-, en el caso de estar formados por la pentosa desoxirribosa (damp). Al grupo fosfato de los nucleótidos monofosfato puede unirse un segundo fosfato, y a este un tercero, para formar los nucleótidos mono-, di- y trifosfatos (AMP, ADP y ATP). La unión de dos nucleótidos mediante enlaces fosfodiéster (entre el OH del ácido fosforito de un nucleótido y el OH del carbono 3' del siguiente formándose una molécula de agua) da lugar a un dinucleótido; si se une varios, forman un polinucleótido. Los ácidos nucleicos son precisamente largas cadenas polinucleotídicas. 3. Nucleótidos no nucleicos No forman parte de los ácidos nucleicos. Se encuentran libres en las células e intervienen en el metabolismo y en su regulación de enzimas, aportando energía química en las reacciones celulares, como coenzimas o como intermediarios activos en la síntesis de biomoléculas. Entre estos, tenemos: Adenosín trifosfato (ATP): actúa como coenzima en diversas reacciones metabólicas implicadas en la transferencia de fosfato y energía siendo el intermediario energético celular por excelencia. Al hidrolizarse a ADP+P, libera la energía que es utilizada por la célula para realizar diversas funciones como movimiento, síntesis de moléculas, producción de calor, transmisión nerviosa, transporte activo, etc. Por tanto, en los seres vivos actúan como un almacén de energía. Adenosín monofosfato cíclico (AMP-c), que actúa como segundo mensajero en el interior de la célula. El NAD (nicotín-adenín-dinucleótido) y el FAD (flavín-adenín-dinucleótido) son dinucleótidos formados por la unión de un nucleótido de adenina a un nucleótido de nicotinamida y flavina, respectivamente, y el NADP (nicotín-adenín-dinucleótido fosfato) posee además un fosfato; actúan como coenzimas en procesos metabólicos de transferencia de electrones (reacción de óxido-reducción). Estas coenzimas actúan aceptando o cediendo electrones (reduciéndose u oxidándose) al tiempo que el sustrato se oxida o reduce. La célula, unidad de vida 39
39 El NADH se une a enzimas que catalizan reacciones catabólicas, mientras que el NADPH lo hace con las que catalizan reacciones de biosíntesis. 4. Ácido desoxirribonucleico (ADN) El ADN es un polímero lineal formado por desoxirribonucleótidos de adenina, guanina, citosina y timina. El ADN fue aislado por primera vez en 1869, pero hasta 1950 no se empezó a conocer su estructura. Se encuentra en el núcleo de las células eucariotas asociado a proteínas (histonas y otras) formando la cromatina, sustancia que constituye los cromosomas y a partir de la cual se transcribe la información genética. También hay ADN en ciertos orgánulos celulares (por ejemplo: cloroplastos y mitocondrias). El estudio de su estructura se puede hacer a varios niveles, presentan estructuras primaria y secundaria, aunque -asociado o no a proteínas nucleares- adoptan estructuras seperenrolladas que equivalen a una estructura terciaria. Estructura primaria Es la secuencia de nucleótidos de una cadena o hebra. Para indicar la secuencia de una cadena de ADN es suficiente con los nombres de las bases o su inicial (A, T, C, G) en su orden correcto y los extremos 5' y 3' de la cadena nucleotídica. Por ejemplo: 5' ACGTTTAACGACAAGTATTAAGACAAGTATTAA 3' Estructura secundaria De acuerdo con el modelo de doble hélice propuesto por Watson y Crick, la estructura secundaria del ADN consiste en: Una doble hélice formada por dos cadenas helicoidales de polinucleótidos, enrolladas la una alrededor de la otra a lo largo de un eje imaginario común. El enrollamiento es dextrógiro (sentido de las agujas del reloj). Las cadenas son antiparalelas: se disponen en sentido opuestos. Una va en sentido 3' 5' y la otra en sentido 5' 3'. Las bases nitrogenadas se sitúan en el interior de la doble hélice, mientras que el azúcar (la pentosa) y el ácido fosfórico forman el esqueleto externo; los planos de las bases quedan perpendiculares al eje de la hélice. Las dos cadenas están unidas por puentes de hidrógenos formados entre los pares adenina-timina (A=T), dos puentes, y guanina-citosina (G C), tres puentes. Esta correspondencia entre las bases explica el hecho de que las dos cadenas de la doble hélice posean secuencias complementarias. Esta estructura secundaria hace posible explicar el papel del ADN como molécula que posee el mensaje genético, capaz de duplicarse o replicarse para transmitir este mensaje a las dos células hijas y transcribir, por otra parte, este mensaje para formar moléculas de ARN responsables de la síntesis de proteínas. Estas dos importantes funciones se basan, como veremos más adelante, en la complementariedad de sus bases. 40 La célula, unidad de vida
40 Estructura terciaria La disposición que adopta la doble hélice de ADN al asociarse con proteínas se conoce como estructura terciaria. 4.1 Funciones del ADN El ADN contiene la información celular heredable, es decir, información genética que se transmite en la reproducción. El modelo de la doble hélice permite comprender cómo puede desempeñar esta función atendiendo a las características que requiere esta misión: 1º: Capacidad de replicación. 2º: Capacidad de contener información. 3º: Posibilidad de mutación. La replicación de la molécula original para formar dos moléculas hijas idénticas se explica mediante la complementariedad de las bases: si las dos cadenas se separan, cada una puede servir de molde para la síntesis de una nueva cadena complementaria. De esa manera, la información genética en la secuencia de bases puede transmitirse fielmente. La información está contenida en la secuencia de bases. Una determinada secuencia de nucleótidos del ADN puede traducirse en una secuencia determinada de aminoácidos de acuerdo con la hipótesis un gen-una enzima. Mediante el proceso de transcripción se transfiere la información (secuencia de bases) a otra molécula, el ARNm (mensajero), que traslada sus órdenes al citoplasma donde los ribosomas traducen esta información fabricando una determinada cadena polipeptídica. La mutación (cambio en la información genética) que hace posible el hecho evolutivo se explica como un cambio en la secuencia de las bases; esto implica la sustitución de un aminoácido por otro en la proteína que, a su vez, puede significar un cambio en la función de esta. Las mutaciones pueden producirse por errores en el proceso de replicación. Aunque este fenómeno se produce con mucha frecuencia, la mayoría de las mutaciones son inviables, es decir, el resultado es incompatible con la vida. Por ello, las células poseen mecanismos de reparación de errores sustituyendo el fragmento equivocado y colocando las bases complementarias correctas en la cadena inicial. 4.2 Desnaturalización del ADN Si una disolución de ADN se calienta suficientemente, ambas cadenas se separan, pues se rompen los enlaces de hidrógeno que unen las bases y el ADN se desnaturaliza. La temperatura de desnaturalización depende de la proporción de bases. A mayor proporción de C-G, mayor temperatura de desnaturalización, pues la citosina y la guanina establecen tres puentes de hidrógeno, mientras que la adenina y la timina solo dos y, por lo tanto, a mayor proporción de C- G, más puentes de hidrógeno unirán ambas cadenas. La desnaturalización se produce también variando el ph o a concentraciones salinas elevadas. Si se restablecen las condiciones, el ADN se renaturaliza y ambas cadenas se unen de nuevo. 5. Ácido ribonucleico (ARN) 5.1 Estructura Los ácidos ribonucleicos (ARN) están formados por ribonucléotidos (nucleótido de ribosa). Sus bases nitrogenadas son adenina, guanina, citosina y uracilo, compuesto este último que sustituye a la timina del ADN. Estos ribonucleótidos se unen entre sí mediante enlaces fosfodiéster en sentido 5 3, al igual que el ADN. A diferencia del ADN, el ARN es casi siempre monocatenario (excepto en los reovirus, donde es bicatenario). La célula, unidad de vida 41
41 Poseen, no obstante, zonas con estructura de doble hélice, denominadas horquillas. Cuando las zonas complementarias están separadas por regiones no complementarias se forman lazos o bucles. 5.2 Tipos y función Por su localización celular, su estructura y la función que desempeñan, se distinguen varios tipos de ARN: ARNm (mensajero), ARNr (ribosómico), ARNt (transferente) y el ARNhn (heterogéneo nuclear). ARN mensajero (ARNm): forma cadenas cortas y lineales que poseen únicamente estructura primaria y que pueden llegar a estar formadas hasta por nucleótidos. Sintetizado como copia complementaria de un segmento de ADN, lleva la información desde el núcleo al hialoplasma para la síntesis de proteínas. ARN de transferencia (ARNt): está formado por moléculas relativamente pequeñas que contienen entre 70 y 90 nucleótidos y constituyen una única hebra o cadena. Esta cadena presenta zonas con doble hélice, que dan lugar a la estructura secundaria en hoja de trébol. Los distintos ARNt dispersos en el hialoplasma se encargan de recoger los diferentes aminoácidos y de transportarlos hasta los ribosomas. En el ARNt podemos distinguir un brazo aceptor de aminoácidos abierto y un bucle anticodón formado por un triplete de bases nitrogenadas y que es complementario del correspondiente triplete codón del ARNm. ARN ribosómico (ARNr): es el más abundante (90-95 % de los ARN). Al igual que el ARNt presenta zonas con estructura de doble hélice. Se encuentra en los ribosomas asociado a proteínas, formando parte de subunidades que los integran. Los ribosomas son los orgánulos encargados de la biosíntesis de proteínas; concretamente, traducen la secuencia de bases del ARNm en la secuencia correspondiente de aminoácidos. ARN heterogéneo nuclear (ARNhn): está localizado en el núcleo. Presenta gran variedad de tamaños, de ahí su nombre. Es el precursor de los ARNm, en los que se transforma tras un proceso de maduración que implica la eliminación de secuencias de nucleótidos no codificantes. 42 La célula, unidad de vida
42 Notas 12 La célula 1. Concepto de célula 1.1 Historia del estudio de las células El holandés A. Van Leeuwenhoek (1674) construye el primer microscopio. Observa espermatozoides, protozoos y bacterias. El microscopista inglés R. Hooke (1665) describe la estructura de una laminilla de corcho vista al microscopio, señala que está formada por celdas e introduce así el término célula. Dutrochet (1824) llega a la conclusión de que todos los seres, animales y vegetales, están compuestos de unidades pequeñas, células. En 1831, el botánico escocés R. Brown demostró la existencia de un corpúsculo en el interior de las células vegetales al que denominó núcleo. En 1839, el checo Purkinje introdujo el término protoplasma para definir el contenido vivo de las células En el mismo año, los alemanes Schleiden y Schwann formularon la teoría celular y llegan a la conclusión de que la célula es una unidad estructural y funcional de todos los seres vivos. Sin embargo, mantenían ideas equivocadas sobre el origen de las células. En 1858, R. Virchow completó la teoría celular con sus estudios sobre el origen de las células, problema que queda zanjado con la frase: toda célula procede de otra célula. 1.2 La teoría celular Con las aportaciones de todos los científicos desde el siglo XVII y con los postulados de Schleiden y Schwann en el siglo XIX, se desarrolló la llamada teoría celular. Esta teoría enuncia los siguientes principios: 1. La célula es la unidad morfológica de los seres vivos. 2. La célula es la unidad fisiológica de los seres vivos. Con la aportación de Virchow quedó expreso el tercer principio de la teoría celular: 3. Las células solo pueden existir a partir de células preexistentes. Y con las aportaciones de numerosos científicos del campo de la investigación genética (Sutton y Boveri) se fijó el llamado cuarto postulado: 4. La célula es la unidad genética autónoma de los seres vivos. En resumen, la teoría celular enuncia que: La célula es la unidad morfológica, fisiológica y genética de todos los seres vivos. 2. Tipos de organización celular No todas las células poseen el mismo grado de organización. Las primeras células que surgen en el curso de la evolución son células muy simples y primitivas, sus representantes actuales son las bacterias y algas verde-azuladas, ambas constituyen el nivel procariota (pro = primitivo, carión = núcleo) y poseen, de acuerdo con su nombre, un núcleo muy sencillo. El resto de los seres vivos poseemos células más complejas, con un núcleo bien diferenciado, constituyendo el nivel eucariota (eu = verdadero). Las células eucariotas pueden ser animales o vegetales. La célula, unidad de vida 43
43 44 La célula, unidad de vida
Agua, carbohidratos y Lípidos
 Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Agua, carbohidratos y Lípidos Biomoléculas Inorgánicas Características del agua El agua es el principal e imprescindible componente del cuerpo humano. Aproximadamente el 60 % de este agua se encuentra
Principios inmediatos orgánicos. Glúcidos
 Principios inmediatos orgánicos. Glúcidos Los glúcidos son biomoléculas o principios inmediatos orgánicos, formados mayoritariamente por carbono (C), hidrógeno (H) y oxígeno (O), aunque en ocasiones especiales
Principios inmediatos orgánicos. Glúcidos Los glúcidos son biomoléculas o principios inmediatos orgánicos, formados mayoritariamente por carbono (C), hidrógeno (H) y oxígeno (O), aunque en ocasiones especiales
BIOMOLÉCULAS. Son moléculas fundamentales para la constitución y funcionamiento de todo ser vivo. Se clasifican en dos grupos:
 FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
FICHA N 2 UNIDAD III: CÉLULAS A ORGANISMOS Profesora Verónica Abasto Córdova Ciencias Naturales 8 Básico Nombre : Curso : Fecha : Revisión BIOMOLÉCULAS Son moléculas fundamentales para la constitución
EL AGUA Y LAS SALES MINERALES
 EL AGUA Y LAS SALES MINERALES 1. EL AGUA DE LA MATERIA VIVA El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua
EL AGUA Y LAS SALES MINERALES 1. EL AGUA DE LA MATERIA VIVA El agua es la molécula más abundante de la materia viva La cantidad de agua en los seres vivos es variable Según el tipo de tejido: más agua
Biología. 2º Bachillerato LAS MOLÉCULAS DE LA VIDA. Los lípidos
 I. LAS MOLÉCULAS DE LA VIDA 3 Los lípidos 1. Los lípidos: propiedades generales 2. Ácidos grasos 3. Triacilglicéridos 4. Ceras 5. Lípidos de membrana 6. Lípidos sin ácidos grasos 1. Los lípidos: propiedades
I. LAS MOLÉCULAS DE LA VIDA 3 Los lípidos 1. Los lípidos: propiedades generales 2. Ácidos grasos 3. Triacilglicéridos 4. Ceras 5. Lípidos de membrana 6. Lípidos sin ácidos grasos 1. Los lípidos: propiedades
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Acilglicéridos Ceras Fosfolípidos. Grasas. Esfingolípidos. Terpenos (isoprenoides) Lípidos eicosanoides
 UNIDAD 5: LÍPIDOS. 1.- CARACTERÍSTICAS GENERALES Y CLASIFICACIÓN. Los lípidos son un grupo muy heterogéneo en cuanto a su composición química, aunque todos contienen C, H, O y algunos también P y N. Todos
UNIDAD 5: LÍPIDOS. 1.- CARACTERÍSTICAS GENERALES Y CLASIFICACIÓN. Los lípidos son un grupo muy heterogéneo en cuanto a su composición química, aunque todos contienen C, H, O y algunos también P y N. Todos
Biomoléculas orgánicas: Carbohidratos y Lípidos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
Biología Biomoléculas orgánicas: Carbohidratos y Lípidos Repaso Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan
LOS LÍPIDOS. Realizado por José Mayorga Fernández
 LOS LÍPIDOS Realizado por José Mayorga Fernández Concepto de lípido Son un conjunto heterogéneo de biomoléculas orgánicas que se caracterizan por: Ser insolubles en agua Ser solubles en disolventes orgánicos
LOS LÍPIDOS Realizado por José Mayorga Fernández Concepto de lípido Son un conjunto heterogéneo de biomoléculas orgánicas que se caracterizan por: Ser insolubles en agua Ser solubles en disolventes orgánicos
HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos
 1. Definición y clasificación HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) Son compuestos esenciales de los organismos vivos y son
1. Definición y clasificación HIDRATOS DE CARBONO Carbohidratos, sacáridos y glucidos Los carbohidratos o sacáridos (del griego: sakcharón, azúcar) Son compuestos esenciales de los organismos vivos y son
Tema 3.- Biomoléculas orgánicas I: Glúcidos.
 Tema 3.- Biomoléculas orgánicas I: Glúcidos. A.- Introducción: los principales grupos funcionales de las biomoléculas orgánicas. B.- Concepto de Glúcido y clasificación. C.- Los Monosacáridos. -Descripción
Tema 3.- Biomoléculas orgánicas I: Glúcidos. A.- Introducción: los principales grupos funcionales de las biomoléculas orgánicas. B.- Concepto de Glúcido y clasificación. C.- Los Monosacáridos. -Descripción
Actividades de los lípidos Tema 1
 Actividades de los lípidos Tema 1 parte 3 BLOQUE 1: TEST 1. Qué tipo de lípidos son los más abundantes en la membrana plasmática de la mayoría de las células? a) Fosfolípidos b) Acidos grasos esenciales
Actividades de los lípidos Tema 1 parte 3 BLOQUE 1: TEST 1. Qué tipo de lípidos son los más abundantes en la membrana plasmática de la mayoría de las células? a) Fosfolípidos b) Acidos grasos esenciales
Los lípidos 1. CARÁCTERÍSTICAS GENERALES Y CLASIFICACIÓN
 TEMA 3 Los lípidos 1. CARÁCTERÍSTICAS GENERALES Y CLASIFICACIÓN Son biomoléculas formadas por C, H siempre y O casi siempre; a veces llevan P y/o N. Son un grupo muy heterogéneo No son solubles en agua,
TEMA 3 Los lípidos 1. CARÁCTERÍSTICAS GENERALES Y CLASIFICACIÓN Son biomoléculas formadas por C, H siempre y O casi siempre; a veces llevan P y/o N. Son un grupo muy heterogéneo No son solubles en agua,
a. Características generales b. Monómeros, dímeros, trímeros y polímeros c. Grupos funcionales d. Compuestos orgánicos más importantes
 1. Compuestos Orgánicos b. Monómeros, dímeros, trímeros y polímeros c. Grupos funcionales d. Compuestos orgánicos más importantes 2. Hidratos de Carbono b. Monosacáridos c. Disacáridos d. Polisacáridos
1. Compuestos Orgánicos b. Monómeros, dímeros, trímeros y polímeros c. Grupos funcionales d. Compuestos orgánicos más importantes 2. Hidratos de Carbono b. Monosacáridos c. Disacáridos d. Polisacáridos
Niveles de organización biológica. La composición de los seres vivos
 Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
Niveles de organización biológica. La composición de los seres vivos Imagen de Fondo bajo licencia Creative Commons, autor: René Ehrtardt. Animación ADN de dominio público, fuente:wikipedia Con este tema
BIOQUIMICA Y FISIOLOGÍA MICROBIANA. Dra. Yenizey Merit Alvarez Cisneros
 BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
BIOQUIMICA Y FISIOLOGÍA MICROBIANA Dra. Yenizey Merit Alvarez Cisneros Moléculas importantes para la vida Compuestos Orgánicos (contienen carbono e hidrógeno) y forma enlaces covalentes Azucares Aminoácidos
NIVEL QUÍMICO DE ORGANIZACIÓN DEL CUERPO HUMANO
 NIVEL QUÍMICO DE ORGANIZACIÓN DEL CUERPO HUMANO ACTIVIDADES 1. Defina qué es un bioelemento. Cite cinco ejemplos e indica la importancia biológica de cada uno de ellos. 2. Enuncie diferencias entre moléculas
NIVEL QUÍMICO DE ORGANIZACIÓN DEL CUERPO HUMANO ACTIVIDADES 1. Defina qué es un bioelemento. Cite cinco ejemplos e indica la importancia biológica de cada uno de ellos. 2. Enuncie diferencias entre moléculas
GUÍA Nº3 BIOMOLÉCULAS ORGÁNICAS GLÚCIDOS Y LÍPIDOS
 SUBSECTOR Biología PROFESOR Iris Gaete Carolina Oteiza: NIVEL 1 medio 2016 Estructura y función de la : célula UNIDAD SEMESTRE I : : GUÍA Nº3 BIOMOLÉCULAS ORGÁNICAS GLÚCIDOS Y LÍPIDOS Nombre: Curso: Fecha:
SUBSECTOR Biología PROFESOR Iris Gaete Carolina Oteiza: NIVEL 1 medio 2016 Estructura y función de la : célula UNIDAD SEMESTRE I : : GUÍA Nº3 BIOMOLÉCULAS ORGÁNICAS GLÚCIDOS Y LÍPIDOS Nombre: Curso: Fecha:
Niveles de Organización Conceptos, átomos y enlaces
 Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Niveles de Organización Conceptos, átomos y enlaces Cómo se organiza la materia viva? NIVELES DE ORGANIZACIÓN ÁTOMO MOLÉCULA (ELEMENTO- COMPUESTO) MACROMOLÉCULA CÉLULA TEJIDO ÓRGANO SISTEMA ORGANISMO MULTICELULAR
Tema 1: Los seres vivos: composición y función
 Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Tema 1: Los seres vivos: composición y función https://www.youtube.com/watch?v=-s28cydwauo El nivel atómico El nivel atómico Bioelementos: elementos que constituyen la materia viva Fundamentales: C, H,
Carbono, hidrógeno y oxígeno En ocasiones tienen azufre y fósforo La cantidad de oxígeno es muy inferior a la de carbono e hidrógeno
 TEMA 3 LÍPIDOS COMPOSICIÓN QUÍMICA Carbono, hidrógeno y oxígeno En ocasiones tienen azufre y fósforo La cantidad de oxígeno es muy inferior a la de carbono e hidrógeno PROPIEDADES Untuosas al tacto Poco
TEMA 3 LÍPIDOS COMPOSICIÓN QUÍMICA Carbono, hidrógeno y oxígeno En ocasiones tienen azufre y fósforo La cantidad de oxígeno es muy inferior a la de carbono e hidrógeno PROPIEDADES Untuosas al tacto Poco
Estructura Química, absorción y digestión
 Estructura Química, absorción y digestión CARBOHIDRATOS Sacáridos (del griego: sakcharon = azúcar) Moléculas biológicas más abundantes. Químicamente (CH 2 O)n = carbono hidratado CARBOHIDRATOS Características
Estructura Química, absorción y digestión CARBOHIDRATOS Sacáridos (del griego: sakcharon = azúcar) Moléculas biológicas más abundantes. Químicamente (CH 2 O)n = carbono hidratado CARBOHIDRATOS Características
1. CONCEPTO DE GLÚCIDO Y CLASIFICACIÓN
 1. CONCEPTO DE GLÚCIDO Y CLASIFICACIÓN Biomoléculas formadas por C n H 2n O n (Mal llamados hidratos de carbono) La palabra proviene del griego glykos que significa dulce. En realidad son polihidroxicetonas
1. CONCEPTO DE GLÚCIDO Y CLASIFICACIÓN Biomoléculas formadas por C n H 2n O n (Mal llamados hidratos de carbono) La palabra proviene del griego glykos que significa dulce. En realidad son polihidroxicetonas
Concepto de Lípido. Es un grupo de sustancias muy heterogéneas que sólo tienen en común estas dos características:
 Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
Lípidos Sesión 01 Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas
 Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
Las moléculas que forman los seres vivos, o las sustancias que provienen de ellos, la madera o los alimentos. Son muy grandes, ya que están formadas por miles, o millones de átomos. MACROMOLÉCULAS Son
BIOLOGÍA 2º BACHILLERATO 1. BASE FISICO QUÍMICA DE LA VIDA (2) Clara Benhamú 3.1. CONCEPTO Y CLASIFICACIÓN DE LOS GLÚCIDOS 3.
 3. GLÚCIDOS 3.1. CONCEPTO Y CLASIFICACIÓN DE LOS GLÚCIDOS Los glúcidos son biomoléculas orgánicas formadas por una o varias cadenas de carbono, hidrógeno y oxígeno. Todos presentan grupos funcionales carbonilo
3. GLÚCIDOS 3.1. CONCEPTO Y CLASIFICACIÓN DE LOS GLÚCIDOS Los glúcidos son biomoléculas orgánicas formadas por una o varias cadenas de carbono, hidrógeno y oxígeno. Todos presentan grupos funcionales carbonilo
Tema I: Biomoléculas
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. Colegio Santo Tomás de Villanueva Departamento de Ciencias Cátedra: Ciencias Biológicas 3 Año Tema I: Biomoléculas
Clasificación de los lípidos
 LIPIDOS Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden contener
LIPIDOS Concepto de Lípido Los lípidos son biomoléculas orgánicas formadas básicamente por carbono e hidrógeno y generalmente también oxígeno; pero en porcentajes mucho más bajos. Además pueden contener
UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas
 UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas 1. BIOELEMENTOS O ELEMENTOS BIOGÉNICOS Son los elementos químicos que se encuentran en
UD 1. LA MATERIA VIVA: BIOELEMENTOS Y BIOMOLÉCULAS. ANEXO: Tipos de enlaces y formas de representar las moléculas 1. BIOELEMENTOS O ELEMENTOS BIOGÉNICOS Son los elementos químicos que se encuentran en
PAG. 134 LIBRO BIOMOLÉCULAS ORGÁNICAS
 PAG. 134 LIBRO BIOMOLÉCULAS ORGÁNICAS Formadas por cadenas de carbono (C) El carbono pude formar 4 enlaces covalentes con otros 4 átomos, como el H, N, O, etc. Esta multitud de enlaces posibles con una
PAG. 134 LIBRO BIOMOLÉCULAS ORGÁNICAS Formadas por cadenas de carbono (C) El carbono pude formar 4 enlaces covalentes con otros 4 átomos, como el H, N, O, etc. Esta multitud de enlaces posibles con una
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua
 Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
Bioelementos y Biomoléculas 1-Moléculas inorganicas : Agua Técnico Professor: Verónica en masoterapia Pantoja. Lic. MSP. Objetivos Reconocer los bioelementos en los seres vivos Reconocer el agua como biomolécula
Moléculas más abundantes en la tierra. Oxidación de los CHO es la fuente de energía central en células que no realizan fotosíntesis
 CARBOHIDRATOS Moléculas más abundantes en la tierra Fotosíntesis Dieta Oxidación de los CHO es la fuente de energía central en células que no realizan fotosíntesis Funciones Fuente de energía (glucosa)
CARBOHIDRATOS Moléculas más abundantes en la tierra Fotosíntesis Dieta Oxidación de los CHO es la fuente de energía central en células que no realizan fotosíntesis Funciones Fuente de energía (glucosa)
1 SATURADOS (Ligaduras sencillas entre cada carbón) 1 INSATURADOS (Dobles ligaduras en 2 ESFINGOLÍPIDOS 2 LIPOPROTEÍNAS
 LÍPIDOS DIVISIÓN N DE LOS LÍPIDOSL 1 SATURADOS (Ligaduras sencillas entre cada carbón) 1 INSATURADOS (Dobles ligaduras en algún n sitio de la molécula) 11 SIMPLES SIMPLES 2 FOSFOLÍPIDOS 2 GLUCOLÍPIDOS
LÍPIDOS DIVISIÓN N DE LOS LÍPIDOSL 1 SATURADOS (Ligaduras sencillas entre cada carbón) 1 INSATURADOS (Dobles ligaduras en algún n sitio de la molécula) 11 SIMPLES SIMPLES 2 FOSFOLÍPIDOS 2 GLUCOLÍPIDOS
Estructura Química, absorción y digestión
 Estructura Química, absorción y digestión CARBOHIDRATOS Sacáridos (del griego: sakcharon = azúcar) Moléculas biológicas más abundantes. Químicamente (CH 2 O)n = carbono hidratado CARBOHIDRATOS Características
Estructura Química, absorción y digestión CARBOHIDRATOS Sacáridos (del griego: sakcharon = azúcar) Moléculas biológicas más abundantes. Químicamente (CH 2 O)n = carbono hidratado CARBOHIDRATOS Características
TEORIA CELULAR. En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS
 TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
TEORIA CELULAR En el mundo vivo, la unidad fundamental es la célula. DECUBRIMIENTO DE LAS CELULAS El nombre de célula significa celda, así las llamo Robert Hooke. En 1839 el zoólogo alemán Theodore Schwann
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales. Verónica Pantoja. Lic. MSP.
 Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Bases Químicas de la Vida II
 Bases Químicas de la Vida II Macromoléculas Moléculas de gran tamaño formadas de unidades variadas de compuestos hechos a base de esqueletos del elemento carbono. A estos compuestos con esqueletos a base
Bases Químicas de la Vida II Macromoléculas Moléculas de gran tamaño formadas de unidades variadas de compuestos hechos a base de esqueletos del elemento carbono. A estos compuestos con esqueletos a base
LOS GLÚCIDOS 1. CARACTERÍSTICAS GENERALES 2. CLASIFICACIÓN
 LOS GLÚCIDOS 1. CARACTERÍSTICAS GENERALES Los glúcidos son biomoléculas orgánicas que están formadas principalmente por C, H y O. Su formula general empírica es C n H 2n O n y por ello se les conoce con
LOS GLÚCIDOS 1. CARACTERÍSTICAS GENERALES Los glúcidos son biomoléculas orgánicas que están formadas principalmente por C, H y O. Su formula general empírica es C n H 2n O n y por ello se les conoce con
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Glúcidos o hidratos de carbono.
 Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
Glúcidos o hidratos de carbono. Son también denominados carbohidratos, hidratos de carbono, glúcido o azúcares. Los componentes químicos estructurales de los glúcidos son los azúcares simples o monosacáridos.
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO
 COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
COMPLEJO EDUCACIONAL JOAQUIN EDWARDS BELLO GUÍA REFORZAMIENTO 1 MEDIO NOMBRE: PJE. TOTAL: FECHA: CURSO: 1 MEDIO PJE. OBTENIDO: CALIFICACION: ASIGNATURA: BIOLOGIA UNIDAD: I - II OBJETIVO (S): CONTENIDO
LÍPIDOS 1. INTRODUCCIÓN Propiedades Insolubles en agua, solubles en disolventes no polares. Están compuestos por C, H, O, P y N.
 LÍPIDOS 1. INTRODUCCIÓN 1.1. Propiedades Insolubles en agua, solubles en disolventes no polares. Están compuestos por C, H, O, P y N. 1.2. Funciones -Estructural: Componentes estructurales de membranas.
LÍPIDOS 1. INTRODUCCIÓN 1.1. Propiedades Insolubles en agua, solubles en disolventes no polares. Están compuestos por C, H, O, P y N. 1.2. Funciones -Estructural: Componentes estructurales de membranas.
1. Clasificación. 2. Monosacáridos. 2.1 Nomenclatura y propiedades. Nomenclatura
 TEMA 2: LOS GLÚCIDOS 1. Clasificación Los glúcidos también se conocen como carbohidratos, glícidos, azúcares y sacáridos. Son biomoléculas orgánicas formadas por C, H y O y su fórmula empírica es Cn(H
TEMA 2: LOS GLÚCIDOS 1. Clasificación Los glúcidos también se conocen como carbohidratos, glícidos, azúcares y sacáridos. Son biomoléculas orgánicas formadas por C, H y O y su fórmula empírica es Cn(H
Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas
 Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas 1. Concepto de Biología: Es la ciencia que estudia todos los fenómenos y procesos relacionados con los seres vivos. 2. Características de los
Tema 1. Introducción. Bioelementos y Biomoléculas Inorgánicas 1. Concepto de Biología: Es la ciencia que estudia todos los fenómenos y procesos relacionados con los seres vivos. 2. Características de los
Composición química de los seres vivos
 Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Composición química de los seres vivos Elementos químicos de la materia viva BIOELEMENTOS Se clasifican por su abundancia En proporcion superior al 96% PRIMARIOS En una proporción aprox. 3,9% SECUNDARIOS
Glúcidos. Cajón de Ciencias. Qué son los glúcidos?
 Glúcidos Qué son los glúcidos? Los glúcidos son una de las moléculas orgánicas básicas, junto con los lípidos, proteínas y ácidos nucleicos. Son los llamados comúnmente azúcares. Antiguamente también se
Glúcidos Qué son los glúcidos? Los glúcidos son una de las moléculas orgánicas básicas, junto con los lípidos, proteínas y ácidos nucleicos. Son los llamados comúnmente azúcares. Antiguamente también se
ORGANIZACIÓN DE LOS SERES VIVOS
 ORGANIZACIÓN DE LOS SERES VIVOS LOS BIOELEMENTOS Elementos químicos que forman parte de los seres vivos. Son unos 70. Primarios: 96% de la materia viva. C, H, O, N, P y S. Forman biomoléculas. Secundarios:
ORGANIZACIÓN DE LOS SERES VIVOS LOS BIOELEMENTOS Elementos químicos que forman parte de los seres vivos. Son unos 70. Primarios: 96% de la materia viva. C, H, O, N, P y S. Forman biomoléculas. Secundarios:
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS.
 REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
REACCIONES DE POLIMERIZACIÓN DE CARBOHIDRATOS Y AMINOÁCIDOS. PRESENTACIÓN Los animales incluyendo al hombre, recibimos pocas moléculas sencillas y una gran cantidad de macromoléculas, como almidones, proteínas
Repaso: Química celular (biomoléculas)
 Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
Repaso: Química celular (biomoléculas) Hay 4 tipos principales de biomoléculas: 1) glúcidos o hidratos de carbono, 2) lípidos o grasas, 3) proteínas y 4) ácidos nucleicos. Las biomoléculas más grandes,
1. Definir glúcidos y clasificarlos. Diferenciar monosacáridos, disacáridos y polisacáridos.
 BIOLOGÍA DE 2º DE BACHILLERATO 1. BASE FÍSICO QUIMICA DE LA VIDA. 1. 3. GLÚCIDOS CONTENIDOS 1.3.1. Concepto y clasificación 1.3.2. Monosacáridos: estructura y funciones. 1.3.3. Enlace glucosídico. Disacáridos
BIOLOGÍA DE 2º DE BACHILLERATO 1. BASE FÍSICO QUIMICA DE LA VIDA. 1. 3. GLÚCIDOS CONTENIDOS 1.3.1. Concepto y clasificación 1.3.2. Monosacáridos: estructura y funciones. 1.3.3. Enlace glucosídico. Disacáridos
UNIVERSIDAD DEL QUINDÍO UNIDAD 3: LÍPIDOS
 UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 3: LÍPIDOS Los lípidos son biomoléculas orgánicas formadas
UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 3: LÍPIDOS Los lípidos son biomoléculas orgánicas formadas
1. Representar utilizando las formulas de proyección de Fischer a) D-Glucosa, y sus dos epímeros. b) D-Fructosa c) D-Ribosa d) L-Manosa
 DEPARTAMENTO DE BIOLOGIA MOLECULAR FACULTAD DE MEDICINA Isabel Andrés PROBLEMAS TEMA 7. ESTRUCTURA DE GLÚCIDOS. 1. Representar utilizando las formulas de proyección de Fischer a) D-Glucosa, y sus dos epímeros.
DEPARTAMENTO DE BIOLOGIA MOLECULAR FACULTAD DE MEDICINA Isabel Andrés PROBLEMAS TEMA 7. ESTRUCTURA DE GLÚCIDOS. 1. Representar utilizando las formulas de proyección de Fischer a) D-Glucosa, y sus dos epímeros.
La organización del cuerpo humano. Punto 1: Los niveles de organización.
 La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
La organización del cuerpo humano Punto 1: Los niveles de organización. ATOMO MOLECULA Unidad constituyente más pequeña de la materia ordinaria. Conjunto de al menos dos átomos enlazados covalentes que
Hidratos de carbono. Qué son los hidratos de carbono?
 Hidratos de carbono Qué son los hidratos de carbono? Los Hidratos de carbono, carbohidratos, glícidos o glúcidos, son moléculas compuestas principalmente por Carbono e hidrogeno a su vez también contienen
Hidratos de carbono Qué son los hidratos de carbono? Los Hidratos de carbono, carbohidratos, glícidos o glúcidos, son moléculas compuestas principalmente por Carbono e hidrogeno a su vez también contienen
LOS COMPONENTES QUÍMICOS DE LA CÉLULA
 LOS COMPONENTES QUÍMICOS DE LA CÉLULA 1. Los enlaces químicos Unen elementos para formar moléculas o estas entre sí. COVALENTES (Se comparten electrones) NO POLARES (Entre elementos de igual electronegatividad
LOS COMPONENTES QUÍMICOS DE LA CÉLULA 1. Los enlaces químicos Unen elementos para formar moléculas o estas entre sí. COVALENTES (Se comparten electrones) NO POLARES (Entre elementos de igual electronegatividad
Organización básica del cuerpo humano
 Organización básica del cuerpo humano I. Niveles de organización del cuerpo humano El ser humano es un organismo extremadamente complejo. Existen diferentes niveles de complejidad o de organización en
Organización básica del cuerpo humano I. Niveles de organización del cuerpo humano El ser humano es un organismo extremadamente complejo. Existen diferentes niveles de complejidad o de organización en
9.- Polisacáridos: Composición, localización y función de los homopolisacáridos de reserva: almidón y glucógeno y estructurales: celulosa y quitina.
 Tema 2.- Biomoléculas que constituyen las células: glúcidos, lípidos y prótidos. Objetivo: Distinguir las biomoléculas orgánicas en base a las unidades que las constituyen, tipos de enlace y función que
Tema 2.- Biomoléculas que constituyen las células: glúcidos, lípidos y prótidos. Objetivo: Distinguir las biomoléculas orgánicas en base a las unidades que las constituyen, tipos de enlace y función que
Biología General y Metodología de las Ciencias 2016 BIOMOLÉCULAS
 BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOMOLÉCULAS Objetivos: Reconocer los distintos niveles de organización de la materia. Diferenciar las propiedades constreñimiento, emergentes y colectivas. Identificar las principales Biomoléculas según
BIOLOGÍA 2º BACHILLERATO 1. BASE FISICO QUÍMICA DE LA VIDA (2) Clara Benhamú BIOELEMENTOS
 PROGRAMACIÓN: BLOQUE I. CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA Base físico-química 1. Composición de los seres vivos: bioelementos y biomoléculas. 2. El agua. 2.1. Estructura.
PROGRAMACIÓN: BLOQUE I. CUÁL ES LA COMPOSICIÓN DE LOS SERES VIVOS? LAS MOLÉCULAS DE LA VIDA Base físico-química 1. Composición de los seres vivos: bioelementos y biomoléculas. 2. El agua. 2.1. Estructura.
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
Las funciones de los seres vivos. Fisiología celular
 Las funciones de los seres vivos Fisiología celular La célula, como unidad funcional de los seres vivos, está capacitada para llevar a cabo las funciones características de éstos: nutrición, reproducción
Las funciones de los seres vivos Fisiología celular La célula, como unidad funcional de los seres vivos, está capacitada para llevar a cabo las funciones características de éstos: nutrición, reproducción
OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo.
 1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
1 OBJETIVO Describir las moléculas orgánicas e inorgánicas en cuanto a su estructura y función nuestro organismo. 2 3 4 Son las moléculas que forman a los organismos o participan de su metabolismo. Orgánicas
TEMA 7: LA MEMBRANA PLASMÁTICA.
 TEMA 7: LA MEMBRANA PLASMÁTICA. 1.-La membrana plasmática como unidad estructural. 2.- Características de la membrana plasmática. 2.1. Estructura y composición. 2.2. Propiedades de la membrana plasmática.
TEMA 7: LA MEMBRANA PLASMÁTICA. 1.-La membrana plasmática como unidad estructural. 2.- Características de la membrana plasmática. 2.1. Estructura y composición. 2.2. Propiedades de la membrana plasmática.
Triacilglicéridos y fosfolípidos: estructura, propiedades y funciones.
 BIOLOGÍA DE 2º DE BACHILLERATO 1. BASE FÍSICO QUIMICA DE LA VIDA. 1. 4. LÍPIDOS CONTENIDOS 1.4.1. Concepto y clasificación. 1.4.2. Ácidos grasos: estructura y propiedades. 1.4.3. Triacilglicéridos y fosfolípidos:
BIOLOGÍA DE 2º DE BACHILLERATO 1. BASE FÍSICO QUIMICA DE LA VIDA. 1. 4. LÍPIDOS CONTENIDOS 1.4.1. Concepto y clasificación. 1.4.2. Ácidos grasos: estructura y propiedades. 1.4.3. Triacilglicéridos y fosfolípidos:
Profesor(a): C.D. María Isabel Pérez Aguilar
 Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
Área Académica: Biología Básica Tema: Bioelementos Profesor(a): C.D. María Isabel Pérez Aguilar Periodo: Enero- Julio 2012 Abstract Bioelements Bioelements are the essential components of life. This topic
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS
 BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS LÍPIDOS Son biomoléculas orgánicas, compuestas básicamente por carbono, hidrógeno y oxígeno y, en determinadas ocasiones también por otros elementos, como
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS LÍPIDOS Son biomoléculas orgánicas, compuestas básicamente por carbono, hidrógeno y oxígeno y, en determinadas ocasiones también por otros elementos, como
UNIDAD II. MECANISMOS CELULARES DE TRANSPORTE E INTEGRACIÓN DE SUSTANCIAS EXTRACELULARES
 UNIDAD II. MECANISMOS CELULARES DE TRANSPORTE E INTEGRACIÓN DE SUSTANCIAS EXTRACELULARES La membrana plasmática: Se encuentra rodeando a la célulac Delimita el territorio de la célula c y controla el
UNIDAD II. MECANISMOS CELULARES DE TRANSPORTE E INTEGRACIÓN DE SUSTANCIAS EXTRACELULARES La membrana plasmática: Se encuentra rodeando a la célulac Delimita el territorio de la célula c y controla el
ANATOMIA. La vida es química. Los principios básicos de anatomía y fisiología se basan en principios dela química: la bioquímica.
 T 2. Química de la vida ANATOMIA 1. Niveles de organización química. Átomos Elementos, moléculas y compuestos 2. Enlaces químicos Enlaces iónicos Enlaces covalentes Puentes de hidrógeno 3. Química inorgánica
T 2. Química de la vida ANATOMIA 1. Niveles de organización química. Átomos Elementos, moléculas y compuestos 2. Enlaces químicos Enlaces iónicos Enlaces covalentes Puentes de hidrógeno 3. Química inorgánica
Triacilglicéridos y fosfolípidos: estructura, propiedades y funciones.
 Bloque I: Lípidos BIOLOGÍA DE 2º DE BACHILLERATO 1. BASE FÍSICO QUIMICA DE LA VIDA. 1. 4. LÍPIDOS CONTENIDOS 1.4.1. Concepto y clasificación. 1.4.2. Ácidos grasos: estructura y propiedades. 1.4.3. Triacilglicéridos
Bloque I: Lípidos BIOLOGÍA DE 2º DE BACHILLERATO 1. BASE FÍSICO QUIMICA DE LA VIDA. 1. 4. LÍPIDOS CONTENIDOS 1.4.1. Concepto y clasificación. 1.4.2. Ácidos grasos: estructura y propiedades. 1.4.3. Triacilglicéridos
LA ORGANIZACIÓN DEL CUERPO HUMANO
 LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
LA ORGANIZACIÓN DEL CUERPO HUMANO RICARDO, ALBERTO, PABLO Y JORGE 1º Los niveles de organización Todos los seres vivos estamos dotados de un conjunto de estructuras con sus funciones específicas. Ordenados
C A R B O H I D R A T O S Y L Í P I D O S
 BIOLOGIA MENCIÓN BM-04 C A R B O H I D R A T O S Y L Í P I D O S Estradiol Hembra Testosterona Macho INTRODUCCIÓN Al estudiar la composición química de la materia viva se observa que los carbohidratos
BIOLOGIA MENCIÓN BM-04 C A R B O H I D R A T O S Y L Í P I D O S Estradiol Hembra Testosterona Macho INTRODUCCIÓN Al estudiar la composición química de la materia viva se observa que los carbohidratos
Biología 2º Bachillerato Tema 1(primera parte): Bioquímica o química de los seres vivos
 Biología 2º Bachillerato Tema 1(primera parte): Bioquímica o química de los seres vivos Los componentes químicos de los seres vivos Los seres vivos están hechos de los mismos elementos químicos que el
Biología 2º Bachillerato Tema 1(primera parte): Bioquímica o química de los seres vivos Los componentes químicos de los seres vivos Los seres vivos están hechos de los mismos elementos químicos que el
EL AGUA Y LAS SALES MINERALES
 EL AGUA Y LAS SALES MINERALES El agua es el componente molecular más abundante en los seres vivos. La cantidad varía con la edad de los animales: Por ejemplo en el embrión el porcentaje aproximado es del
EL AGUA Y LAS SALES MINERALES El agua es el componente molecular más abundante en los seres vivos. La cantidad varía con la edad de los animales: Por ejemplo en el embrión el porcentaje aproximado es del
TAMBIÉN RECIBEN EL NOMBRE DE GRASAS REPRESENTAN EL 18 A 25 % DE LA MASA MAGRA CORPORAL EN EL ADULTO.
 LÍPIDOS TAMBIÉN RECIBEN EL NOMBRE DE GRASAS REPRESENTAN EL 18 A 25 % DE LA MASA MAGRA CORPORAL EN EL ADULTO. AL IGUAL QUE LOS HIDRATOS DE CARBONO CONTIENEN CARBONO, HIDRÓGENO Y OXÍGENO. LA MAYORÍA SON
LÍPIDOS TAMBIÉN RECIBEN EL NOMBRE DE GRASAS REPRESENTAN EL 18 A 25 % DE LA MASA MAGRA CORPORAL EN EL ADULTO. AL IGUAL QUE LOS HIDRATOS DE CARBONO CONTIENEN CARBONO, HIDRÓGENO Y OXÍGENO. LA MAYORÍA SON
CARBOHIDRATOS CLASIFICACIÓN
 CARBOHIDRATOS CLASIFICACIÓN CLASIFICACIÓN Biomoléculas mas abundantes Sakkharon=azúcar Hidratos de carbono (C:H:O) Son polihidroxialdehídos o polihidroxicetonas Algunos cumplen la formula empírica (CH
CARBOHIDRATOS CLASIFICACIÓN CLASIFICACIÓN Biomoléculas mas abundantes Sakkharon=azúcar Hidratos de carbono (C:H:O) Son polihidroxialdehídos o polihidroxicetonas Algunos cumplen la formula empírica (CH
CARBOHIDRATOS. Azúcares, en castellano
 CARBOHIDRATOS Azúcares, en castellano CARBOHIDRATOS Compuestos orgánicos constituidos por C, H y O, cuya fórmula molecular general es: C x (H 2 O) y También llamados: HIDRATOS DE CARBONO, GLÚCIDOS o AZÚCARES.
CARBOHIDRATOS Azúcares, en castellano CARBOHIDRATOS Compuestos orgánicos constituidos por C, H y O, cuya fórmula molecular general es: C x (H 2 O) y También llamados: HIDRATOS DE CARBONO, GLÚCIDOS o AZÚCARES.
Tema 2 GLÚCIDOS.
 Tema 2 GLÚCIDOS www.recursos.cnice.mec.es/biosfera GLÚCIDOS Biomoléculas formadas por C, H, O en la proporción: C n H 2n O n También se conocen como hidratos de carbono Se denominan OSAS o MONOSACÁRIDOS
Tema 2 GLÚCIDOS www.recursos.cnice.mec.es/biosfera GLÚCIDOS Biomoléculas formadas por C, H, O en la proporción: C n H 2n O n También se conocen como hidratos de carbono Se denominan OSAS o MONOSACÁRIDOS
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD
 Lectura 1: el agua El agua es el principal componente de muchos alimentos, teniendo cada alimento su propio y característico contenido de este componente. El agua en la cantidad, localización y orientación
Lectura 1: el agua El agua es el principal componente de muchos alimentos, teniendo cada alimento su propio y característico contenido de este componente. El agua en la cantidad, localización y orientación
DR. CARLOS HIDALGO QUEVEDO 08:56
 DR. CARLOS HIDALGO QUEVEDO GLÙCIDOS Llamados Hidratos de carbono o carbohidratos Compuestos orgánicos ternarios (constituidos básicamente por C,H,O) Químicamente son considerados polialcoholes con grupo
DR. CARLOS HIDALGO QUEVEDO GLÙCIDOS Llamados Hidratos de carbono o carbohidratos Compuestos orgánicos ternarios (constituidos básicamente por C,H,O) Químicamente son considerados polialcoholes con grupo
01. INTRODUCCION. Conceptos previos. Verónica González Núñez Universidad de Salamanca
 01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
01. INTRODUCCION. Conceptos previos Verónica González Núñez Universidad de Salamanca ESQUEMA. Introducción. Conceptos previos I. Principales grupos funcionales en Bioquímica II. Formación de compuestos
SUGAR TRANSFER POLISACÁRIDOS Y ÁC. ORGÁNICOS
 SUGAR TRANSFER POLISACÁRIDOS Y ÁC. ORGÁNICOS 1. INTRODUCCIÓN SUGAR TRANSFER es un producto que incorpora carbohidratos y ácidos orgánicos de origen natural en su composición. El término "hidrato de carbono"
SUGAR TRANSFER POLISACÁRIDOS Y ÁC. ORGÁNICOS 1. INTRODUCCIÓN SUGAR TRANSFER es un producto que incorpora carbohidratos y ácidos orgánicos de origen natural en su composición. El término "hidrato de carbono"
1.2. PROPIEDADES FÍSICO QUÍMICAS Y FUNCIONES BIOLÓGICAS DEL AGUA
 1. EL AGUA Es el componente mayoritario de todos los seres vivos, representando por término medio un 70% de su peso total. Está en continua renovación. El contenido en agua varía según el tipo de organismo,
1. EL AGUA Es el componente mayoritario de todos los seres vivos, representando por término medio un 70% de su peso total. Está en continua renovación. El contenido en agua varía según el tipo de organismo,
Polímero corto Monómero. síntesis. degradación
 Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
Polímero corto Monómero síntesis degradación Hidratos de carbono. Glúcidos o azúcares. Monómeros Glúcidos. Dímeros. Glu+Glu= Maltosa (azúcar presente en la malta, un grano) Glu+Frc= Sacarosa (azúcar de
TEMA 4: LÍPIDOS. Clasificación: Saponificables: contienen ácidos grasos que, al someterlos a una hidrólisis alcalina, forman jabones.
 TEMA 4: LÍPIDOS Departamento de Biología CONCEPTO Y CLASIFICACIÓN Químicamente están constituidos por C, H, O, y en ocasiones P y S. No son solubles en agua pero si son solubles en disolventes apolares
TEMA 4: LÍPIDOS Departamento de Biología CONCEPTO Y CLASIFICACIÓN Químicamente están constituidos por C, H, O, y en ocasiones P y S. No son solubles en agua pero si son solubles en disolventes apolares
Resultado de aprendizaje:
 Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Objetivo: Describir composición y arquitectura de las membranas biológicas Resultado de aprendizaje: Explicar la dinámica de las membranas biologicas y su implicación funcional. INTRODUCCION La mayoría
Lípidos. Año Año Año El dibujo muestra la forma común de representar esquemáticamente a un tipo de biomoléculas.
 Año 2001 El dibujo muestra la forma común de representar esquemáticamente a un tipo de biomoléculas. a) Indique de qué biomoléculas se trata [0,2] y cuál es la naturaleza química de los componentes señalados
Año 2001 El dibujo muestra la forma común de representar esquemáticamente a un tipo de biomoléculas. a) Indique de qué biomoléculas se trata [0,2] y cuál es la naturaleza química de los componentes señalados
TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR
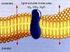 TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR Introducción Compartimientos Acuosos separados por Barreras Biológicas Organelos selectivos, autocatalíticos, autoreproductivos, competitivos, adaptativos...
TRANSPORTE A TRAVÉS DE LA MEMBRANA CELULAR Introducción Compartimientos Acuosos separados por Barreras Biológicas Organelos selectivos, autocatalíticos, autoreproductivos, competitivos, adaptativos...
UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO
 UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO 1. LA COMPOSICIÓN DE LOS SERES VIVOS. Todos los seres vivos están formados por: - materia inorgánica: agua y sales minerales - materia
UNIDAD 1. D. Borja Blanco Vives. Profesor de Biología y Geología 4ºESO 1. LA COMPOSICIÓN DE LOS SERES VIVOS. Todos los seres vivos están formados por: - materia inorgánica: agua y sales minerales - materia
BLOQUE 1. BASE MOLECULAR Y FISICOQUÍMICA PARA LA VIDA
 BLOQUE 1. BASE MOLECULAR Y FISICOQUÍMICA PARA LA VIDA 1.3 Glúcidos Germán Tenorio Biología 12º Idea Fundamental: Se emplean compuestos de carbono, hidrógeno y oxígeno para suministrar energía y almacenarla.
BLOQUE 1. BASE MOLECULAR Y FISICOQUÍMICA PARA LA VIDA 1.3 Glúcidos Germán Tenorio Biología 12º Idea Fundamental: Se emplean compuestos de carbono, hidrógeno y oxígeno para suministrar energía y almacenarla.
I) Biomoléculas 3) El agua I-3 EL AGUA
 I-3 EL AGUA IMPORTANCIA DEL AGUA PARA LOS SERES VIVOS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
I-3 EL AGUA IMPORTANCIA DEL AGUA PARA LOS SERES VIVOS El agua es el líquido más abundante de la corteza y uno de los pocos líquidos naturales. No es de extrañar entonces que el agua sea una sustancia esencial
TEMA 3. GLÚCIDOS. 1.1. 1.2. 2.1. 2.2. 2.3. 2.4. 2.5. 2.5.1. 2.5.2. 3.1. 3.2.
 TEMA 3. GLÚCIDOS. 0. Introducción 1. Definición y clasificación 1.1. Definición de glúcidos. 1.2. Clasificación 2. Los monosacáridos. 2.1. Composición y nomenclatura. 2.2. Propiedades de los monosacáridos
TEMA 3. GLÚCIDOS. 0. Introducción 1. Definición y clasificación 1.1. Definición de glúcidos. 1.2. Clasificación 2. Los monosacáridos. 2.1. Composición y nomenclatura. 2.2. Propiedades de los monosacáridos
Tema 7: Características generales de los seres vivos
 Tema 7: Características generales de los seres vivos Constituyentes químicos Bioelementos-Elementos biogénicos: elementos que forman a los seres vivos. Primarios: (98%) C,H,O;N;P y S. Secundarios: Ca,
Tema 7: Características generales de los seres vivos Constituyentes químicos Bioelementos-Elementos biogénicos: elementos que forman a los seres vivos. Primarios: (98%) C,H,O;N;P y S. Secundarios: Ca,
Unidad uno (Bioquímica) Parte tres: los lípidos
 Lípidos Unidad uno (Bioquímica) Parte tres: los lípidos Constituyen un grupo de principios inmediatos con una estructura química muy variada, que tienen como característica común ser insolubles en agua
Lípidos Unidad uno (Bioquímica) Parte tres: los lípidos Constituyen un grupo de principios inmediatos con una estructura química muy variada, que tienen como característica común ser insolubles en agua
T3 GLÚCIDOS. 1. Concepto y clasificación 2. Osas o Monosacáridos
 1. Concepto y clasificación 2. Osas o Monosacáridos Características físicas y químicas Propiedades Isomería Actividad óptica Ciclación 3. Importancia biológica de los monosacáridos 4. Derivados de los
1. Concepto y clasificación 2. Osas o Monosacáridos Características físicas y químicas Propiedades Isomería Actividad óptica Ciclación 3. Importancia biológica de los monosacáridos 4. Derivados de los
Pág ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales:
 TEMA 1 Pág. 160 1ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales: Pág. 10 2ª ) Qué reinos de seres vivos habitan en la tierra? Moneras, protoctistas,
TEMA 1 Pág. 160 1ª) Qué es un ser vivo? Un ser formado por células que es capaz de desempeñar las tres funciones vitales: Pág. 10 2ª ) Qué reinos de seres vivos habitan en la tierra? Moneras, protoctistas,
Composición química de la materia viva. Componentes orgánicos. Glúcidos
 Composición química de la materia viva. Componentes orgánicos. Glúcidos Tema 1 Componentes orgánicos, los glúcidos: Glúcidos: Clasificación general, propiedades químicas, estructura y funciones biológicas.
Composición química de la materia viva. Componentes orgánicos. Glúcidos Tema 1 Componentes orgánicos, los glúcidos: Glúcidos: Clasificación general, propiedades químicas, estructura y funciones biológicas.
I) Biomoléculas 4) Lípidos I-4 LÍPIDOS
 I-4 LÍPIDS CNCEPT, PRPIEDADES Y FUNCINES GENERALES Concepto: Los lípidos son sustancias químicamente muy diversas. Sólo tienen en común el ser insolubles en agua u otros disolventes polares y solubles
I-4 LÍPIDS CNCEPT, PRPIEDADES Y FUNCINES GENERALES Concepto: Los lípidos son sustancias químicamente muy diversas. Sólo tienen en común el ser insolubles en agua u otros disolventes polares y solubles
La Célula. Membrana celular. UNIVERSIDAD NACIONAL DE GRAL. SAN MARTÍN ECyT BIOLOGÍA. Biología I
 La Célula. Membrana celular UNIVERSIDAD NACIONAL DE GRAL. SAN MARTÍN ECyT BIOLOGÍA Biología I Los seres vivos están formados por células Organismos unicelulares: bacterias, plantas (algas unicelulares),
La Célula. Membrana celular UNIVERSIDAD NACIONAL DE GRAL. SAN MARTÍN ECyT BIOLOGÍA Biología I Los seres vivos están formados por células Organismos unicelulares: bacterias, plantas (algas unicelulares),
Una mezcla es un compuesto formado por varias sustancias con distintas propiedades
 COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
COMPOSICIÓN DE LA MATERIA Mezclas homogéneas y heterogéneas Una mezcla es un compuesto formado por varias sustancias con distintas propiedades Algunos sistemas materiales como la leche a simple vista parecen
Biomoléculas orgánicas: Proteínas y Ácidos nucleicos. Propiedad Intelectual Cpech
 Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
Biología Biomoléculas orgánicas: Proteínas y Ácidos nucleicos Repaso Moléculas orgánicas Carbohidratos Lípidos 1. Monosacáridos: glucosa 2. Disacáridos: maltosa 3. Polisacáridos: glucógeno 1. Ácidos grasos.
SESIÓN 3 LA QUÍMICA DE LA VIDA
 Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
Biología SESIÓN 3 LA QUÍMICA DE LA VIDA 1. Las Bases Químicas De La Vida Los organismos vivos y el mundo en el que viven están sometidos a las leyes de la física y de la química. En los organismos vivos
