BLOQUE TEMÁTICO 6 Alcoholes, fenoles, éteres y epóxidos Problemas
|
|
|
- Vicente Álvarez Vega
- hace 6 años
- Vistas:
Transcripción
1 1 BLQUE TEMÁTIC 6 Problemas Problema 6.1. Deduzca cuáles serán las estructuras de los compuestos A, B, C y D en los siguientes esquemas de reacción: En la secuencia a el alcohol, que es de configuración R, se tosila en el grupo hidroxilo formando el tosilato A, que tiene la misma configuración que el alcohol de partida. En la segunda reacción el tosilato experimenta un desplazamiento SN2 por ataque del anión cianuro. Como el ataque se produce desde el lado opuesto al que ocupa el grupo saliente se obtiene el nitrilo B de configuración S. En la secuencia b el alcohol se trata con Br. Con este reactivo el alcohol se protona, generando la estructura indicada entre corchetes. Esta especie es atacada por el anión bromuro mediante el mecanismo SN2 originando el bromuro C de configuración S, opuesta a la del alcohol de partida. En la segunda reacción el bromuro C experimenta una reacción SN2 por ataque del anión cianuro, dando lugar al nitrilo D de configuración R debido a la inversión de configuración en el estereocentro atacado. Problema 6.2. Proponga mecanismos que expliquen las siguientes reacciones: El producto de la reacción a se forma mediante un mecanismo de tipo SN1 en el cual el carbocatión, generado como consecuencia de la protonación del alcohol y su subsiguiente deshidratación, experimenta transposición 1,2-. La fuerza que impulsa la transposición es la formación de un carbocatión más estable (se pasa de un carbocation secundario a un carbocation terciario bencílico). El carbocatión resultante de la transposición es atacado por el bromuro para dar lugar al producto final, tal y como se indica en el siguiente esquema:
2 2 El producto de la reacción b se forma también mediante un mecanismo de tipo SN1 en el cual el carbocatión experimenta una transposición 1,2-C3. La fuerza que impulsa la transposición es la formación de un carbocatión más estable (se pasa de un carbocation secundario a un carbocation terciario bencílico). El carbocatión resultante de la transposición es atacado por el bromuro para dar lugar al producto final, como se indica en el siguiente esquema:
3 3 Problema 6.3. En contacto con Na acuosa el (R)-butan-2-ol, ópticamente activo, retiene indefinidamente su actividad. Por el contrario cuando el (R)-butan-2-ol se trata con una disolución acuosa que contiene 2S 4 diluido y se mide la rotación óptica se observa que con el paso del tiempo esta decrece hasta desaparecer. Proponga una explicación para los anteriores hechos experimentales. Cuando el alcohol se pone en contacto con la disolución acuosa de hidróxido sódico su pureza óptica no se ve afectada, porque no se puede producir la ruptura del enlace C-. Sin embargo, en medio ácido se produce la protonación del alcohol seguida de formación de un carbocatión secundario por deshidratación (paso 1 del esquema que se indica más abajo). El carboacatión es plano y es atacado desde ambos lados por el agua (paso 2). Después de la desprotonación se forma una mezcla de los alcoholes enantioméricos. Cuando la reacción alcanza el equilibrio termodinámico la mezcla de los alcoholes R/S tiene una relación 1:1, ya que los dos alcoholes son de igual estabilidad, formándose una mezcla racémica que no tiene actividad óptica. 1) Protonación del alcohol y deshidratación 2 S 4 2 (R)-butan-2-ol + 2 Carbocatión secundario 2) Ataque del agua al carbocatión 2 3 C 2 C 3 - C 3 3 C (R)-butan-2-ol 3 C C C C C C 3 (S)-butan-2-ol Problema 6.4. La reacción del tosilato A con etóxido de sodio en etanol a reflujo proporciona una mezcla de alquenos B + C, en la que sólo el alqueno C contiene deuterio. Por el contrario, la misma reacción sobre el tosilato D proporciona una mezcla de alquenos E + F, en la que sólo el alqueno E contiene deuterio. C 3 Ts Et 3 C 3 C + NaEt + D C 3 D C 3 A B C C 3 D C 3 Ts Et 3 C 3 C + NaEt + D C 3 C 3 D E F C 3 Explique mecanísticamente los anteriores hechos experimentales.
4 4 Para resolver adecuadamente este problema es muy conveniente convertir la proyección de Fischer de A en una proyección de caballete. Este proceso se indica en el esquema que se da a continuación. Una vez obtenida la conformación de caballete hay que dibujar las conformaciones reactivas en el proceso E2, que son las que colocan al (o al deuterio) en posición anticoplanar con respecto al grupo saliente, que es el anión tosilato. El proceso E2 sobre cada una de las conformaciones reactivas dibujadas en el esquema conduce a los respectivos alquenos B y C. El mismo método de resolución se aplica sobre el compuesto D, tal y como se indica a continuación:
5 5 Problema 6.5. Proponga un mecanismo que explique la siguiente transformación: 3 C C 3 C3 2 S 4 3 C C 2 C3 + 2 El mecanismo que explica la reacción anterior tiene como paso clave una reacción de transposición, tal y como se explica en el siguiente esquema. Problema 6.6. Cuando el alcohol A (C 8 18), ópticamente activo, se somete a la siguiente secuencia de reacciones se obtiene el nitrilo C: Qué tipo de reacción será la conversión de B en C? Cuál será la estructura del alcohol A y la del tosilato B? A tiene que ser un alcohol puesto que experimenta una reacción de tosilación para dar el compuesto B que tiene que ser un tosilato. La reacción de B con cianuro sódico debe ser una reacción SN2 en la que el tosilato es desplazado por el anión cianuro. En esta reacción se produce una inversión de configuración. Por tanto, el nitrilo C, que es de configuración S, debe provenir de un tosilato de configuración R y éste a su vez tiene que formarse del respectivo alcohol que tendrá también configuración R, como el tosilato, ya que en la reacción de tosilación no se produce cambio de configuración. De acuerdo con este proceso deductivo se dibujan en el siguiente esquema las estructuras de A y de B.
6 6 Problema 6.7. Cuando el trans-4-clorociclohexanol se trata con K se obtiene una mezcla formada por 3-ciclohexen-1-ol (compuesto A) y por el compuesto bicíclico B. Por el contrario, cuando el cis-4-clorociclohexanol se trata con K se obtiene una mezcla formada por 3-ciclohexen-1-ol (A) y por el trans-ciclohexano-1,4-diol (C). Explique mecanísticamente la formación de A, B y C Será el compuesto A ópticamente activo? Explique su respuesta. Formación de A (3-ciclohexen-1-ol) a partir del trans-4-clorociclohexanol. El compuesto A se forma mediante una reacción de eliminación tipo E2, ya que la base empleada (anión hidróxido) es una base fuerte. ay que tener en cuenta que la reacción de eliminación E2 forma una mezcla racémica de ciclohexenoles, tal y como se indica en el siguiente esquema: Formación de B a partir del trans-4-clorociclohexanol. El trans-4-clorociclohexanol experimenta un equilibrio conformacional que tiene lugar a través de una conformación de bote, tal y como se indica a continuación: En medio básico una parte de las moléculas de trans-4-clorociclohexanol se encuentran ionizadas en el grupo hidroxilo por reacción con el anión hidróxido. La ionización de la conformación de bote hace que esta estructura contenga un buen nucleófilo (el grupo alcóxido) y un buen grupo saliente (el anión cloruro). Además, se dan otras condiciones para que se produzca una reacción SN2 intramolecular (SNi): a) la conformación de bote acerca al oxígeno alcóxidico al átomo de carbono que contiene el grupo saliente; b) el oxígeno alcóxidico puede desplazar al anión cloruro porque éste se encuentra colocado en el lado opuesto al del oxígeno. Como consecuencia, el ataque intramolecular del alcóxido forma el compuesto B, como se indica a continuación:
7 7 Formación de A (3-ciclohexen-1-ol) a partir del cis-4-clorociclohexanol. El compuesto A se forma a partir del isómero cis de manera similar a la explicada en el caso del isómero trans, tal y como se explica en el siguiente esquema: Formación de C (trans-ciclohexano-1,4-diol) a partir del cis-4-clorociclohexanol. En el compuesto cis no se puede formar el éter cíclico B, porque el grupo alcóxido se encuentra colocado en el mismo lado en el que se encuentra el grupo saliente, como se puede apreciar en el siguiente esquema: En su lugar se produce la reacción SN2 intermolecular en la cual el anión hidróxido desplaza al cloruro, con inversión de configuración, para dar lugar al trans-ciclohexano-1,4-diol C: Cl Formación de C (trans-ciclohexano-1,4-diol) S N 2 Na cis-4-clorociclohexanol Compuesto C Problema 6.8. Deduzca las estructuras de los compuestos A, B, C y D que se forman en el siguiente esquema sintético: El compuesto A debe ser el correspondiente tosilato. LDA es el acrónimo de diisopropilamiduro de litio que es un compuesto fuertemente básico pero no nucleofílico. El compuesto B debe ser el alqueno resultante de un proceso de eliminación E2 con disposición anti entre el hidrógeno que captura la base y el tosilato (grupo saliente). Si se dibuja la estructura del tosilato A desde el plano molecular se puede apreciar que hay un único átomo de hidrógeno que está colocado
8 8 en anti respecto del tosilato. La eliminación E2 dará lugar al compuesto B, como se indica en el siguiente esquema El compuesto C debe ser el yoduro resultante de un proceso de desplazamiento SN2 del tosilato, que transcurre además con inversión de configuración. El yoduro C contiene dos átomos de hidrógeno colocados en anti con respecto al grupo saliente (anión yodcuro). Por ello, la reacción con la base LDA formará la mezcla de alquenos constituida por B y por D, tal y como se describe en el siguiente esquema: Problema 6.9. El calentamiento de un alcohol en ácido sulfúrico es un buen método para la preparación de un éter simétrico. Por ejemplo, el di-n-propil éter se puede obtener calentando el n-propanol en presencia de cantidades catalíticas de ácido sulfúrico: Sin embargo, este no es un buen método si se quiere conseguir un éter asimétricamente sustituido. Por ejemplo, si se quiere sintetizar el isopropil n-propil éter calentando una mezcla equimolecular de n-propanol y de isopropanol en presencia de ácido sulfúrico se obtiene una mezcla de 3 éteres. Prediga mecanísticamente las estructuras de estos tres éteres. Cómo se podría obtener el isopropil n-propil éter?
9 9 Cuando una mezcla de n-propanol y de isopropanol se trata con cantidades catalíticas de ácido sulfúrico se genera una mezcla constituida por los dos alcoholes y por los dos alcoholes protonados, como se indica en el siguiente esquema: Reacciones de protonación de los alcoholes n-propanol isopropanol + 2 S S 4 + S 4 + S 4 En la mezcla de reacción coexisten dos especies nucleofílicas (los dos alcoholes) y dos especies electrofílicas (los dos alcoholes protonados). Cada nucleófilo reacciona, mediante mecanismos tipo SN2, con cada uno de los electrófilos, como se indica a continuación: Reacciones S N 2 de los alcoholes sobre los alcoholes protonados Cada especie protonada pierde el protón para dar lugar al éter neutro: El resultado es una mezcla formada por tres éteres: el di-n-propil éter, el di-isopropil éter y el isopropil n-propil éter. Por tanto, este no es un buen método de síntesis para la obtención del isopropil n-propil éter porque se obtendría mezclado junto con los dos éteres que se dibujan en el esquema a anterior. Cómo se podría obtener el isopropil n-propil éter puro?
10 10 Una forma de obtener este éter puro sería hacer reaccionar un solo nucleófilo con un solo electrófilo en la reacción SN2. Por ejemplo, a partir del alcohol n-propanol se obtendría el correspondiente tosilato, que sería el electrófilo de la reacción SN2. n-propanol + TsCl + Tosilación del n-propanol N Ts + A partir de isopropanol se obtendría el isopropóxido, que sería el nucleófilo de la reacción SN2: Formación del isopropóxido N + Cl + Na + Na + 2 isopropanol La reacción SN2 del isopropóxido sódico sobre el tosilato formaría el isopropil n-propil éter, sin la formación de los otros dos éteres que si se obtienen en el proceso anterior. Formación del isopropil n-propil éter Na + Ts + Ts Na isopropil n-propil éter Problema El calentamiento de una mezcla de t-butanol y Me, en presencia de cantidades catalíticas de ácido sulfúrico, proporciona fundamentalmente un único éter, de fórmula molecular C Cuál debe ser la estructura de este éter? Cuando una mezcla de t-butanol y de metanol se trata con cantidades catalíticas de ácido sulfúrico se genera una mezcla constituida por los dos alcoholes y los dos alcoholes protonados, como se indica en el siguiente esquema: Reacciones de protonación de los alcoholes 3 C metanol + 2 S 4 3 C + S4 + 2 S 4 + S 4 t-butanol El t-butanol protonado se deshidrata para generar el carbocatión t-butilo, que es relativamente estable. El metanol protonado no experimenta deshidratación porque generaría el carbocatión metilo que es muy inestable. Por tanto, la mezcla de reacción contiene en su seno carbocationes t-butilo que son atacados por las moléculas de metanol dando lugar al correspondiente éter protonado. La desprotonación de esta especie forma el t-butil metil éter, como se indica a continuación:
11 11 Problema Cuando el sec-butil metil éter, ópticamente activo, se hace reaccionar con Br anhidro se obtiene bromuro de metilo y alcohol sec-butílico ópticamente activo. Proponga un mecanismo para la reacción anterior. La protonación del éter por reacción con Br genera un intermedio que es atacado por el bromuro mediante el mecanismo SN2. El ataque es regioselectivo y se produce sobre el carbono menos sustituido, con la consiguiente formación del bromuro de metilo y la preservación del estereocentro: Problema La reacción del fenil metil éter con Br lleva a la formación de fenol y de bromuro de metilo. C 3 + Br + Br C 3 Por otra parte, cuando el fenil t-butil éter reacciona con Br se obtiene fenol y bromuro de t-butilo. Proponga un mecanismo para cada una de las dos reacciones anteriores y explique por qué en ninguna de ellas se forma bromuro de fenilo (C 6 5Br).
12 12 El mecanismo de la ruptura ácida del fenil metil éter consta de dos etapas. En la primera de ellas se produce la protonación del éter y en la segunda el ataque nucleofílico SN2 del anión bromuro al grupo metilo. El anillo aromático no es atacado por el bromuro porque los ataques SN2 no se producen sobre carbonos con hibridación sp 2. El mecanismo de la ruptura ácida del t-butil fenil éter no es de tipo SN2 sino de tipo SN1 y consta de tres etapas. En la primera de ellas se produce la protonación del éter. En la segunda el éter protonado se rompe, sin asistencia del nucleófilo, generando el carbocatión t-butilo y fenol. En la tercera etapa el carbocatión t-butilo es atacado por el anión bromuro para dar lugar al bromuro de t-butilo. Este mecanismo no puede tener lugar sobre el fenil metil éter porque este compuesto no puede generar carbocationes estables. Problema Proponga un mecanismo para la siguiente reacción: El anión metóxido es un nucleófilo fuerte y ataca al epóxido mediante una reacción de tipo SN2. El ataque es regioselectivo y se produce sobre el carbono oxiránico menos sustituido. El producto de esta reacción experimenta un desplazamiento intramolecular del bromuro (SNi) para dar lugar al producto final de la reacción.
13 13 Problema La reacción del bromoalcohol A con Na proporciona un compuesto B (C 8 14). Cuando este compuesto se trata con Br se obtiene una mezcla formada por los bromoalcoholes A y C: Deduzca la estructura del compuesto B y explique mecanísticamente la formación de A y C a partir de B. El compuesto A experimenta un equilibrio conformacional que tiene lugar a través de una conformación de bote, tal y como se indica a continuación: En medio básico una parte de moléculas de A se encuentran ionizadas en el grupo hidroxilo por reacción con el anión hidróxido. La ionización de la conformación de bote hace que esta estructura contenga un buen nucleófilo (el grupo alcóxido) y un buen grupo saliente (el anión bromuro). Además, se dan otras condiciones para que se produzca una reacción SN2 intramolecular (SNi): a) la conformación de bote acerca el oxígeno alcoxidico al átomo de carbono que contiene el grupo saliente; b) el oxígeno alcoxidico puede desplazar al anión bromuro porque éste se encuentra colocado en el lado opuesto al del oxígeno. Como consecuencia, el compuesto B debe ser el éter cíclico cuyo mecanismo de formación se indica en el siguiente esquema: Cuando el éter cíclico B se trata con Br se produce, en primer lugar, la protonación del átomo de oxígeno. El producto resultante es atacado nucleofílicamente por el anión bromuro. El ataque desde ambos lados explica la formación de los compuestos A y C.
14 14 Problema La reacción del trans-2-clorociclohexanol con Na acuoso proporciona una mezcla de trans-ciclohexano-1,2-diol en forma racémica (compuestos B y C). Proponga una explicación mecanística para los anteriores hechos experimentales. Cuando el trans-2-clorociclohexanol se trata con hidróxido sódico se produce la ionización del grupo hidroxilo y el subsiguiente desplazamiento intramolecular del cloruro. Este proceso forma el óxido de ciclohexeno, que en el medio básico de la reacción es atacado nucleofílicamente por el anión hidróxido en un proceso de tipo SN2. La apertura del anillo oxiránico se produce desde ambos lados, lo que origina la mezcla enantiomérica formada por los dos transciclohexano-1,2-dioles B y C.
15 15 Problema Cuando el bromoalcohol A se trata con metóxido sódico en metanol se obtiene un epóxido B, ópticamente activo, de fórmula molecular C 4 8. Cuando el epóxido B se hace reaccionar con K acuoso se obtiene un compuesto C (C ). a) Deduzca mecanísticamente la estructura del epóxido B. b) Deduzca mecanísticamente la estructura del compuesto C Será el compuesto C ópticamente activo? a) Estructura del epóxido B Para resolver adecuadamente este problema se dibuja en primer lugar el compuesto A en una proyección de caballete. A continuación, se dibuja un isómero conformacional de A que coloque al grupo hidroxilo y al bromo en posición anticoplanar. La ionización del grupo hidroxilo provoca el desplazamiento intramolecular del bromo y la formación del epóxido B, tal y como se indica en el siguiente esquema:
16 16 b) Estructura del compuesto C El compuesto C debe es el producto resultante de la apertura del anillo oxiránico por ataque SN2 del anión hidróxido. Después de la protonación se forma el compuesto C que es el (2R,3S)-butano-2,3-diol. Este compuesto es ópticamente inactivo. En el esquema se dibuja una conformación eclipsada que pone de manifiesto la existencia de un plano de simetría en el (2R,3S)-butano-2,3-diol. El ataque del anión hidróxido al otro átomo de carbono oxiránico proporciona también el compuesto C. Problema Cuando A se trata con Na en TF se convierte en un éter cíclico B (C 11 21Br). Deduzca mecanísticamente la estructura del compuesto B. El sustrato A se ionizará en el grupo hidroxilo por reacción con el hidruro sódico. El alcóxido resultante es un buen nucleófilo y provocará el desplazamiento SN2 intramolecular (SNi) de uno de los átomos de bromo. El nucleófilo atacará al átomo de carbono que presente menor impedimento estérico. En base a este razonamiento el mecanismo de la reacción y la estructura del compuesto B se indican a continuación:
17 17 Problema Cuando el (+)-2-octanol, de rotación específica +8.24º, se trata con hidruro sódico y después con yoduro de etilo, se obtiene el 2-etoxioctano, de rotación específica +15.6º. Cuando el (+)-2-octanol se trata con Br se obtiene el correspondiente bromuro de alquilo. Cuando este compuesto se hace reaccionar con etóxido sódico, el producto obtenido también es 2-etoxioctano. Cuál será la rotación óptica del 2-etoxioctano obtenido mediante este segundo procedimiento? No existe ninguna relación entre el signo de la rotación óptica y la configuración del estereocentro, de tal manera que compuestos dextrorrotatorios pueden tener configuración R o S y, del mismo modo, compuestos levorrotatorios pueden tener configuración R o S. El (+)-2- octanol es dextrorrotatorio, pero este dato no permite saber si su configuración es R o es S. No obstante, para resolver el problema se dibujará arbitrariamente una configuración para el (+)-2- octanol, por ejemplo R. En la primera secuencia de reacciones el (+)-2-octanol se ioniza con hidruro sódico y el alcóxido resultante actúa como nucleófilo en la reacción SN2 con el yoduro de etilo. En esta secuencia la configuración del (+)-2-octanol, que se ha elegido arbitrariamente como R, se mantiene en la secuencia sintética y el producto de la reacción, el 2-etoxioctano será de configuración también R, como se indica en el siguiente esquema: En la segunda secuencia sintética se producen dos reacciones SN2 consecutivas, tal y como se indica a continuación:
18 18 1) Protonación del 2-octanol (R) (+)-2-ctanol Segunda secuencia de reacciones + Br 2 + Br 2) Ataque S N 2 del bromuro (inversión de la configurción) 2 + Br S N 2 Br (S) 2-bromooctano + 2 3) Desplazamiento del bromo por ataque S N 2 del anión etóxido (inversión de la configurción) Br (S) 2-bromooctano + NaEt S N 2 (R) 2-etoxioctano + NaBr El resultado de esta segunda secuencia de reacciones es la formación del 2-etoxioctano con configuración igual a la del 2-etoxioctano que se obtiene en la primera secuencia sintética. Por tanto, el poder rotatorio del 2-etoxioctano obtenido en la segunda secuencia tiene que tener el mismo valor absoluto y el mismo signo que el obtenido en la primera secuencia, esto es αd= +15.6º. El mismo resultado se obtendría se en lugar de elegir arbitrariamente la configuración R para el (+)-2-octanol se hubiese elegido la configuración S. Problema Cuando el epóxido A se trata con t-butóxido de potasio en t-butanol no se obtiene el producto S N2, resultante de la apertura del anillo oxiránico, sino el alcohol B. 3 C C 3 t-buk C 3 C 3 t-bu 2 C C 3 A B Explique mecanísticamente la formación del compuesto B. Los aniones básicos como el anión hidróxido, metóxido o etóxido son relativamente poco voluminosos y pueden actuar como bases, capturando protones, o como nucleófilos, atacando a los átomos de carbono de las estructuras orgánicas. Por el contrario, el anión t-butóxido es muy voluminoso y, aunque puede actuar como base, su enorme tamaño bloquea su acción como nucleófilo. Así, el volumen estérico del anión t-butóxido impide su acercamiento a los átomos de carbono oxiránicos del epóxido A. En su lugar, el anión t-butóxido actúa como una base capturando un protón en una reacción de tipo E2, tal y como se indica en el esquema que se dibuja a continuación. El producto de la reacción E2 se protona, por reacción con el t- butanol, y forma el compuesto B. 1) Reacción tipo E2 C 3 C 3 C 3 C K 2) Protonación K C C C 3 Mecanismo de formación de B K C 3 C 3 C 3 2 C C 3 A 3 C 3 C 3 C C 3 2 C C 3 B C 3 C 3 C 3 C 3 C 3 C K
19 19 Problema Explique mecanísticamente la siguiente reacción: NC + Cl 1) NaN 2 (exceso) tolueno 2) 3 + NC La base amiduro sódico ioniza al fenilacetonitrilo mediante captura de un protón del metileno. Esta reacción es posible porque se emplea una base fuerte y porque la base conjugada del fenilacetonitrilo deslocaliza la carga negativa sobre el grupo nitrilo. El anión resultante de la anterior reacción ácido-base ataca al anillo oxiránico y genera un alcóxido que desplaza intramolecularmente al cloro para formar un nuevo compuesto oxiránico. Este compuesto posee un hidrógeno ácido que es capturado por un segundo equivalente de NaN2 y el anión resultante ataca intramolecularmente al anillo oxiránico para formar el producto final de la reacción en su forma de alcóxido, tal y como se describe en el siguiente esquema: La acidificación de la mezcla de reacción proporciona el producto final: Problema Explique mecanísticamente la formación de los compuestos B y C en la siguiente reacción: El mecanismo se inicia con la protonación de uno de los grupos hidroxilo en el compuesto A. Luego se produce la eliminación de agua con la consiguiente formación de un carbocatión. Esta especie sigue dos vías de reacción. Por un lado experimenta una transposición 1,2-C3,
20 20 lo que lleva al compuesto B. Por otro lado, el carbocatión experimenta una transposición de enlace sigma C-C y forma el compuesto C, tal y como se indica a continuación: Problema La amitriptilina es un fármaco empleado en el tratamiento de la depresión. En una síntesis de amitriptilina se llevó a cabo la siguiente reacción: Cl, Ac A B Cl Proponga un mecanismo que explique la conversión de A en B. El mecanismo de conversión de A en B se inicia con la protonación del grupo hidroxilo (paso 1 del esquema que se da más abajo). A continuación se produce una reacción de deshidratación, lo que genera un carbocatión de tipo bencílico (paso 2). Este intermedio es atacado nucleofílicamente por el anión cloruro en el anillo ciclopropánico formándose el producto B (paso 3). Esta reacción está favorecida porque en ella se libera la tensión angular y la tensión torsional asociada al anillo ciclopropánico,
21 21 Problema Un tipo de resinas epoxi se obtienen empleando el denominado bisfenol- A y la epiclorhidrina. Cuando el bisfenol-a se trata con dos equivalentes de epiclorhidrina, en presencia de hidróxido sódico acuoso, se obtiene el prepolímero B. C 3 C 3 Bisfenol-A + 2 Cl Epiclorhidrina Na 2 C 3 C 3 Prepolímero B Explique mecanísticamente la formación del prepolímero B. La reacción del bisfenol con Na provoca la ionización de los grupos hidroxilo fenólicos. Los grupos fenóxido atacan nucleofílicamente, mediante un proceso de tipo SN2, al anillo oxiránico de la epiclorohidrina. Esta reacción genera un sistema de cloroalcóxido el cual, por desplazamiento intramolecular del anión cloruro, forma el prepolímero B, tal y como se indica en el siguiente esquema:
22 22 Problema Si dos equivalentes de bisfenol se hacen reaccionar con tres equivalentes de epiclorhidrina, en presencia de Na, se obtiene el dímero C, cuya estructura se indica a continuación: Explique mecanìsticamente la formación de C. La reacción de 1 equivalente de bisfenol con 2 equivalentes de epiclorhidrina, en presencia de Na, forma el prepolímero C, como se ha explicado en el problema anterior. Como en la reacción hay un tercer equivalente de epiclorhidrina éste reacciona con bisfenol ionizado para formar el compuesto que se indica a continuación y que se ha nombrado como D: El compuesto D contiene en su estructura una función fenóxido que se ataca nucleofílicamente al prepolímero B. Esta reacción provoca la apertura del anillo oxiránico y la formación, después de la protonación, del dímero C, como se indica en el siguiente esquema:
23 23 Mecanismo de formación del dímero C C 3 C 3 Prepolímero B Na C 3 C 3 Compuesto D C 3 C 3 Na 2 C 3 C 3 C 3 C 3 Dímero C C 3 C 3 Problema La estructura de la resina epoxi se indica a continuación. Cuál debe ser la relación bisfenol-a/epiclorhidrina para obtener este polímero? La relación bisfenol-a/epiclorhidrina debe ser n/n+1. Problema La reacción del (R)-2-metiloxirano con agua en medio básico proporciona el (R)-propano-1,2-diol. Sin embargo, la reacción del (R)-2-metiloxirano con agua en medio ácido proporciona el (S)-propano-1,2-diol. Proponga una explicación para los anteriores hechos. La apertura de epóxidos en medio básico sigue un mecanismo de tipo SN2. El (R)-propano-1,2- diol se forma por ataque nucleofílico regioselectivo del anión hidróxido al átomo de carbono del anillo oxiránico que tiene menor impedimento estérico. La subsiguiente etapa de protonación forma el diol, tal y como se indica en el siguiente esquema:
24 24 En medio ácido cambia la regioselectividad en el ataque del nucleófilo. La especie reactiva es el epóxido protonado que se puede representar, a efectos de entender la regioselectividad en el ataque del nucleófilo, mediante las tres estructuras resonantes que se dan a continuación: La estructura I es la convencional para el epóxido protonado, mientras que en las estructuras II y III se aprecia cómo los carbonos oxiránicos comparten parte de la carga positiva. Sin embargo, la contribución al híbrido de la resonancia de las estructuras resonantes II y III no es igual. De hecho la estructura II es de tipo carbocatión primario y contribuye mucho menos al híbrido de resonancia que la estructura III, que es de tipo carbocatión secundario. El ataque nucleofílico al epóxido protonado se produce sobre el átomo de carbono con más carga positiva (estructura III) pero el ataque es de tipo SN2 y tiene lugar con inversión de la configuración del estereocentro atacado, tal y como se indica en el etapa 2 del esquema anterior. La etapa final de protonación conduce al (S)-propan-1,2-diol Problema Deduzca mecanísticamente la estructura del compuesto A que se formará en la siguiente reacción: El compuesto A será el producto resultante del proceso de apertura del anillo oxiránico por ataque nucleofílico del metanol. La reacción se lleva a cabo en medio ácido y la especie electrofílica reactiva es el epóxido protonado. La regioselectividad y la estereoselectividad del ataque nucleofílico seguirán las mismas pautas explicadas en el problema anterior, esto es: se atacará el carbono oxiránico más sustituido con inversión de la configuración. La estructura de A y su mecanismo de formación se indican en el siguiente esquema:
25 25 Problema La reacción de A ó B con Cl proporciona el mismo compuesto C: 3 C 3 C S S B C 3 A C 3 Cl 3 C S C Cl C 3 Proponga una explicación mecanística para las reacciones anteriores. + 2 El compuesto C se forma a partir de A mediante un mecanismo en 3 etapas. En la primera de ellas se produce la protonación del grupo hidroxilo. A continuación, el átomo de azufre desplaza intramolecularmente al agua y forma un catión episulfonio. Luego, el anión cloruro provoca la apertura del catión y forma el compuesto C, tal y como se indica en el siguiente esquema: Mecanismo de formación de C a partir de A 1) Protonación del hidroxilo 3 C S C 3 A + Cl 3 C S 2) Desplazamiento nucleofílico intranolecular de 2 C 3 + Cl 3 C S C 3 3 C S C ) Apertura nucleofílica del anillo de tiiranio 3 C S C 3 Cl 3 C El compuesto C se forma a partir de B mediante un mecanismo similar al anterior. Así, en el primer paso mecanístico se produce la protonación del grupo hidroxilo. A continuación, el atomo de azufre desplaza intramolecularmente al agua y forma el mismo catión episulfonio que en la reacción anterior. La apertura del anillo forma el compuesto C, tal y como se indica en el siguiente esquema: S C Cl C 3
26 26 1) Protonación del hidroxilo Mecanismo de formación de C a partir de B 3 C S B C 3 + Cl 2) Desplazamiento nucleofílico intranolecular de 2 3 C S 3 C S + 2 C 3 C 3 3) Apertura nucleofílica del anillo de tiiranio 3 C S C 3 Cl 3 C S C Cl C 3 Por qué el anión cloruro ataca al catión episulfonio en el átomo de carbono más sustituido? La explicación es la misma que se da en el problema 6.26 para el ataque del nucleófilo al átomo de carbono más sustituido en los anillos oxiránicos protonados. Problema El compuesto A reacciona con Na para dar el epóxido B. El compuesto C reacciona con Na para formar el epóxido D, pero la formación del epóxido es mucho más lenta que en el caso anterior. C 3 + Na rápida C NaBr A Br B C 3 C 3 lenta + Na Br C D Proponga una explicación para la diferencia de reactividad NaBr Los compuestos A y B son trans-decalinas sobre las cuales no tiene lugar el movimiento conformacional propio de los anillos ciclohexánicos. Si se dibuja el compuesto A desde la perspectiva del plano molecular se puede observar la colocación en trans-diaxial del grupo hidroxilo y del átomo de bromo. Esta colocación es ideal para que tenga lugar la formación del epóxido mediante desplazamiento intramolecular del bromo, tal y como se indica en el siguiente esquema:
27 27 En el compuesto B los grupos hidroxilo y bromo están en posición trans-diecuatorial y en esta colocación no puede tener lugar el desplazamiento intramolecular. Para que esto ocurra, el anillo ciclohexánico deber retorcerse y adoptar una conformación de bote, en la cual el grupo hidroxilo ionizado ya puede desplazar dorsalmente al átomo de bromo. Esta conformación de bote, y su estado de transición asociado, tiene mucha más energía que la conformación sin tensión que lleva al epóxido B, y por esta razón la formación del epóxido C transcurre con mucha menor velocidad.
Desconexión del cloruro de t-butilo
 Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Síntesis rgánica 1 Tema 1.- El método de la desconexión. Concepto de análisis retrosintético. Sintón y equivalente sintético. Desconexiones de un grupo C-X. Síntesis de ésteres y amidas. Síntesis de éteres
Tarea. Sustitución Nucleofílica Alifática
 Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica TESM-ca, Depto. C.B. Academia Química Tarea. Sustitución Nucleofílica Alifática Objetivos Describir e identificar las
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica TESM-ca, Depto. C.B. Academia Química Tarea. Sustitución Nucleofílica Alifática Objetivos Describir e identificar las
BLOQUE TEMÁTICO VI. ALCOHOLES, FENOLES Y ÉTERES (Problemas)
 LQUE TEMÁTI VI LLES, FENLES Y ÉTERES (Problemas) Química rgánica I-www.sinorg.uji.es 3 Problema 6.1. Proponga mecanismos que expliquen las siguientes reacciones: a) b) Problema 6.2. eduzca cuáles serán
LQUE TEMÁTI VI LLES, FENLES Y ÉTERES (Problemas) Química rgánica I-www.sinorg.uji.es 3 Problema 6.1. Proponga mecanismos que expliquen las siguientes reacciones: a) b) Problema 6.2. eduzca cuáles serán
DERIVADOS HALOGENADOS. Estructura
 TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
TEMA 13.- Derivados halogenados. Reacciones S N. Clasificación y características generales. Sustitución nucleofílica. Mecanismos S N 2 y S N 1. Estereoquímica de las reacciones S N. Factores con influencia
Reacciones de Adición
 Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica Reacciones de Adición ITESM-cq, Depto. C.B. Academia Química Reacciones de Adición Objetivos Diferenciar entre una reacción
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica Reacciones de Adición ITESM-cq, Depto. C.B. Academia Química Reacciones de Adición Objetivos Diferenciar entre una reacción
Tema 9. Alquenos. Esther Lete Centro Asociado Bizkaia Curso
 Tema 9. Esther Lete Centro Asociado Bizkaia Curso 2011-12 Objetivo Relacionar la estructura con las propiedades físicas y el comportamiento químico de los alquenos, centrado en las REACCIONES de ADICIÓN
Tema 9. Esther Lete Centro Asociado Bizkaia Curso 2011-12 Objetivo Relacionar la estructura con las propiedades físicas y el comportamiento químico de los alquenos, centrado en las REACCIONES de ADICIÓN
Cómo Reaccionan los Alquenos?, Adición de diferentes Reactivos.
 Cómo Reaccionan los Alquenos?, Adición de diferentes Reactivos. Mario Manuel Rodas Morán Universidad de San Carlos de Guatemala Faculta de Ciencias Químicas y Farmacia Departamento de Química Orgánica
Cómo Reaccionan los Alquenos?, Adición de diferentes Reactivos. Mario Manuel Rodas Morán Universidad de San Carlos de Guatemala Faculta de Ciencias Químicas y Farmacia Departamento de Química Orgánica
Tema 11. CONCEPTOS FUNDAMENTALES EN QUÍMICA ORGÁNICA
 Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Tema 11. EPTS FUDAMETALES E QUÍMIA RGÁIA o metales con electronegatividad similar (,,, ). Uniones covalentes debilmente polares o apolares Reactividad: interacciones entre áreas o zonas de las moléculas
Prueba de proceso I ( ) Alumno:... DNI:...
 Prueba de proceso I (27-11-2012) Alumno:.............................................. DNI:............. 1) Escribir el nombre IUPAC de los siguientes compuestos: (0,4 puntos) (S,E)-4-hexen-2-ol trans-3-bromociclohexanol
Prueba de proceso I (27-11-2012) Alumno:.............................................. DNI:............. 1) Escribir el nombre IUPAC de los siguientes compuestos: (0,4 puntos) (S,E)-4-hexen-2-ol trans-3-bromociclohexanol
Termodinámica de las Reacciones, Propiedades Químicas y Adición Electrofílica a Carbono sp 2
 Termodinámica de las Reacciones, Propiedades Químicas y Adición Electrofílica a Carbono sp 2 Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad
Termodinámica de las Reacciones, Propiedades Químicas y Adición Electrofílica a Carbono sp 2 Mario Manuel Rodas Morán Departamento de Química Orgánica Facultad de Ciencias Químicas y Farmacia Universidad
Adición. Eliminación. Sustitución
 Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
Adición Eliminación Sustitución Mitad de un enlace Enlace Unido con fuerza Mitad de un enlace Paso 1. Ataque del enlace en el electrófilo (un carbocatión) en el carbono más sustituído Paso 2. El ataque
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS ORGÁNICA II
 UNIVERIDAD CENTRAL DEL ECUADR FACULTAD DE CIENCIA QUÍMICA RGÁNICA II INTEGRANTE: CARRERA: Calderón Varela Ana QUÍMICA Durán Jácome Lorena QUÍMICA Y FARMACIA 16.27 La oxidación del 4-terc-butilsulfuro con
UNIVERIDAD CENTRAL DEL ECUADR FACULTAD DE CIENCIA QUÍMICA RGÁNICA II INTEGRANTE: CARRERA: Calderón Varela Ana QUÍMICA Durán Jácome Lorena QUÍMICA Y FARMACIA 16.27 La oxidación del 4-terc-butilsulfuro con
o 0.96A o 1.43A 0.96A O O H CH 3 H
 Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
Química rgánica 1. Estructura. Nomenclatura de los alcoholes. Acidez de los alcoholes. xidación de alcoholes. Alcoholes como nucleófilos y electrófilos. Formación y uso de los ésteres de ácidos sulfónicos:
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES
 GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
GUÍA DE EJERCICIOS # 17 PRINCIPIOS DE REACTIVIDAD EN QUÍMICA ORGÁNICA Y TIPOS DE REACCIONES 1. Clasifica cada una de las siguientes reacciones de acuerdo a los tipos estudiados. (Si es necesario escribe
ALQUENOS Estructura. Dobles enlaces: C=C 1,34 Å, Kcal/mol. Isomería geométrica: cis/trans
 TEMA 8.- Alquenos. Propiedades generales. Reacciones de adición. Estereoquímica de las reacciones de adición. Reacciones de oxidación. Reacciones en posición alílica. ALQUENOS Estructura C n H 2n Dobles
TEMA 8.- Alquenos. Propiedades generales. Reacciones de adición. Estereoquímica de las reacciones de adición. Reacciones de oxidación. Reacciones en posición alílica. ALQUENOS Estructura C n H 2n Dobles
Tema 6.-Compuestos orgánicos halogenados
 Tema 6.-Compuestos orgánicos halogenados Reacciones de Sustitución y Eliminación La trans-rodofitina es un compuesto halogenado producido por las algas rojas, capaz de disuadir de acercarse a los herbívoros
Tema 6.-Compuestos orgánicos halogenados Reacciones de Sustitución y Eliminación La trans-rodofitina es un compuesto halogenado producido por las algas rojas, capaz de disuadir de acercarse a los herbívoros
F FA AC C U ULTAD LTAD D D E
 FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
FACULTAD DE QUÍMICA 4.1 Adición electrofílica a enlaces múltiples C-C 4.2 Adición de radicales libres a enlaces múltiples C-C 4.3 Adición nucleofílica a enlaces múltiples C-C 4.4 Adición nucleofílica a
Departamento de Química del Cinvestav
 Departamento de Química del investav Preguntas tipo examen de admisión de Química rgánica onteste con una sola respuesta a cada pregunta. Si una pregunta tiene más de una respuesta, será anulada. El uso
Departamento de Química del investav Preguntas tipo examen de admisión de Química rgánica onteste con una sola respuesta a cada pregunta. Si una pregunta tiene más de una respuesta, será anulada. El uso
Comparación entre los calores de hidrogenación del 1-penteno y del trans-2-penteno. 2.6 Kcal/mol. Hº = kcal/mol
 Química rgánica Tema 8. Dienos 1 Tema 8. Dienos conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de al 1,3- butadieno.
Química rgánica Tema 8. Dienos 1 Tema 8. Dienos conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de al 1,3- butadieno.
Comparación entre los calores de hidrogenación del 1-penteno y del trans-2-penteno. 2.6 Kcal/mol. Hº = kcal/mol
 Química rgánica 1 conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de Br al 1,3- butadieno. Reacciones de desplazamiento
Química rgánica 1 conjugados: estructura y estabilidad. Reacciones de adición a dienos conjugados. ontrol cinético y control termodinámico en la adición de Br al 1,3- butadieno. Reacciones de desplazamiento
Reacciones de Eliminación 26/06/2012
 Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Las reacciones de eliminación de los halogenuros de alquilo y la deshidratación de alcoholes constituyen los métodos principales de síntesis de alquenos Básicas ITESM, campus qro. 1 Una reacción de eliminación
Benceno y compuestos aromáticos
 Benceno y compuestos aromáticos Aparte de las características físicas del benceno, que no resultan explicadas por las estructuras de 1,3,5-ciclohexatrieno, existen una serie de propiedades químicas del
Benceno y compuestos aromáticos Aparte de las características físicas del benceno, que no resultan explicadas por las estructuras de 1,3,5-ciclohexatrieno, existen una serie de propiedades químicas del
Trabajo 3. Éteres y Epóxidos.
 Universidad Central del Ecuador 1 Trabajo 3. Éteres y Epóxidos. - Resolución de Problemas Francis Carey Cap. 16 (pág. 706 710) 16.26 Cuando se deja reposar el (R)-(+)-2-fenil-2-butanol en metanol que contienen
Universidad Central del Ecuador 1 Trabajo 3. Éteres y Epóxidos. - Resolución de Problemas Francis Carey Cap. 16 (pág. 706 710) 16.26 Cuando se deja reposar el (R)-(+)-2-fenil-2-butanol en metanol que contienen
Reacciones de adición
 erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
erramientas de la Química rgánica erramientas de la Química rgánica eacciones de adición en los alquenos : adición polar (I) eacciones de adición + + - δ+ δ- - 1 2 erramientas de la Química rgánica eacciones
Estructura del grupo carbonilo
 TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
TEMA 19.- Compuestos carbonílicos. Clasificación y propiedades generales. Reacciones de adición. Características generales y factores con influencia en la velocidad de la adición. Adiciones de Michael.
1. LA HIDROGENACIÓN 2. LA HALOGENACIÓN: REACCIONES DE ALQUENOS ADICIÓN AL DOBLE ENLACE
 REACCIONES DE ALQUENOS ADICIÓN AL DOBLE ENLACE 1 EN PRINCIPIO SE PODRÍAN AGREGAR MUCHOS REACTIVOS DISTINTOS A UN DOBLE ENLACE PARA FORMAR PRODUCTOS MÁS ESTABLES, ESTO ES LAS REACCIONES SON FAVORABLES ENERGÉTICAMENTE.
REACCIONES DE ALQUENOS ADICIÓN AL DOBLE ENLACE 1 EN PRINCIPIO SE PODRÍAN AGREGAR MUCHOS REACTIVOS DISTINTOS A UN DOBLE ENLACE PARA FORMAR PRODUCTOS MÁS ESTABLES, ESTO ES LAS REACCIONES SON FAVORABLES ENERGÉTICAMENTE.
3.- Cuál de las siguientes formulaciones es la correcta para la sal trioxoclorato (V) de litio (clorato de litio)?
 UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
UNIVERSIDAD DE ALCALÁ PRUEBA DE ACCESO A LOS ESTUDIOS UNIVERSITARIOS MAYORES DE 25 AÑOS (2010) MATERIA: QUIMICA INSTRUCCIONES GENERALES Y VALORACIÓN El examen de Química consiste en 30 preguntas de tipo
Reacciones de Sustitución de los Halogenuros de Alquilo
 Reacciones de Sustitución de los Halogenuros de Alquilo Que es una reacción de sustitución? Una reacción de sustitución grupo saliente Una reacción de eliminación El átomo o grupo que es sustituído o eliminado
Reacciones de Sustitución de los Halogenuros de Alquilo Que es una reacción de sustitución? Una reacción de sustitución grupo saliente Una reacción de eliminación El átomo o grupo que es sustituído o eliminado
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS
 Nombre: Mayra Morales Carrera: Bioquímica y Farmacia ACIDEZ UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS Los ácidos carboxílicos son compuestos
Nombre: Mayra Morales Carrera: Bioquímica y Farmacia ACIDEZ UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUIMICAS QUÍMICA ORGÁNICA III ACIDOS CARBOXILICOS Los ácidos carboxílicos son compuestos
4. Escribir los productos de reacción esperados para cada una de las siguientes reacciones:
 PA-2C-1/ Curso 2014-2015 (05-Febrero 2015) 1. Nombrar los siguientes compuestos por el sistema de la IUPAC. 2. El orden decreciente de estabilidad de los siguientes compuestos 1-propinilciclopentano (A),
PA-2C-1/ Curso 2014-2015 (05-Febrero 2015) 1. Nombrar los siguientes compuestos por el sistema de la IUPAC. 2. El orden decreciente de estabilidad de los siguientes compuestos 1-propinilciclopentano (A),
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Junio 2008 PRIMERA PARTE
 1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
1 PAU Química. Junio 2008 PRIMERA PARTE Cuestión 1. Dados los elementos Na, C, Si y Ne: a) Escriba sus configuraciones electrónicas. Cuántos electrones desapareados presenta cada uno en su estado fundamental?
ORGÁNICA II Escribe la reacción de cloruro de hidrógeno con el propeno, nombrando el producto de la reacción: enuncia la regla que has aplicado.
 ORGÁNICA II 13.- Escribe y nombra todos los hidrocarburos de cinco átomos de carbono que tengan un doble enlace. Qué les ocurrirá cuando se hidrogenen?. 14.- _Escribe la fórmula estructural de un ácido
ORGÁNICA II 13.- Escribe y nombra todos los hidrocarburos de cinco átomos de carbono que tengan un doble enlace. Qué les ocurrirá cuando se hidrogenen?. 14.- _Escribe la fórmula estructural de un ácido
REACTIVIDAD DE LOS COMPUESTOS ORGÁNICOS
 REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
REATIVIDAD DE LS MPUESTS RGÁNIS 1. Reacciones inorgánicas / Reacciones orgánicas 2. Representación general de una reacción orgánica 3. Algunos aspectos a tener en cuenta en las reacciones orgánicas 4.
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2006 PRIMERA PARTE
 1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
1 PAU Química. Septiembre 2006 PRIMERA PARTE Cuestión 1. La configuración electrónica del último nivel energético de un elemento es 4s 2 4p 3. De acuerdo con este dato: a) Deduzca la situación de dicho
ESTRUCTURA DE COMPUESTOS ORGÁNICOS
 ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
ESTRUCTURA DE COMPUESTOS ORGÁNICOS La Química orgánica es el estudio de los compuestos que contienen carbono, en química inorgánica se estudian todos los demás elementos y compuestos. La cantidad de compuestos
a) El compuesto de formula es el 2-cloro-3-metil-2-buteno.
 Modelo 201. Pregunta 3A.- Considere los compuestos orgánicos de fórmula C 3 H 8 O. a) Escriba y nombre los posibles alcoholes compatibles con esa fórmula. b) Escriba y nombre los isómeros de función compatibles
Modelo 201. Pregunta 3A.- Considere los compuestos orgánicos de fórmula C 3 H 8 O. a) Escriba y nombre los posibles alcoholes compatibles con esa fórmula. b) Escriba y nombre los isómeros de función compatibles
ALCOHOLES. Estructura: grupo
 TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 16.- Alcoholes, fenoles y tioles. Clasificación y propiedades generales. Carácter ácido. Reacciones de desplazamiento y eliminación. Reacciones de oxidación. R- Ar- R-SH alcohol fenol tiol ALCOLES
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS
 TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
TEMA 8. MECANISMOS DE LAS REACCIONES ORGÁNICAS Tipos de reacciones orgánicas. Procesos homolíticos y heterolíticos. Reactivos nucleófilos y electrófilos. Estructura y estabilidad de los principales intermedios
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre 2009 PRIMERA PARTE
 1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
1 PAU Química. Septiembre 2009 PRIMERA PARTE Cuestión 1. Considere los elementos A (Z = 12) y B (Z = 17). Conteste razonadamente: a) Cuáles son las configuraciones electrónicas de A y de B? Cuál es el
IES Atenea (S.S. de los Reyes) Departamento de Física y Química. PAU Química. Septiembre Fase específica OPCIÓN A
 1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
1 PAU Química. Septiembre 2010. Fase específica OPCIÓN A Cuestión 1A. Considere las sustancias: cloruro de potasio, agua, cloro y sodio. a) Indique el tipo de enlace que presenta cada una de ellas. b)
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos. Adición sigue la ley de Markovnikov No presenta estéreoselectividad.
 Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
Unidad 1 (Parte XXIII) Adición de Alcoholes a Alquenos Adición sigue la ley de Markovnikov No presenta estéreoselectividad Primera Etapa: Lic. Walter de la Roca 1 Segunda Etapa: Lic. Walter de la Roca
ORGÁNICA I. 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua.
 ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
ORGÁNICA I 1.- Escribir y nombrar el compuesto obtenido por reacción entre a) el ácido acético y el 2-propanol. b) cloruro de acetilo con agua. 2.- Escribir y nombrar el producto principal obtenido en
EN PRESENCIA DE UN CATALIZADOR ADECUADO, EL HIDRÓGENO SE AGREGA AL ALQUINO, REDUCIÉNDOLO PARA DAR UN ALCANO.
 REACCIONES DE ADICIÓN ELECTROFÍLICA EN ALQUINOS (X 2, HX, H3O+). MUCHAS DE LAS REACCIONES DE LOS ALQUINOS SON SEMEJANTES A LAS REACCIONES CORRESPONDIENTES DE LOS ALQUENOS, PORQUE AMBAS IMPLICAN ENLACES
REACCIONES DE ADICIÓN ELECTROFÍLICA EN ALQUINOS (X 2, HX, H3O+). MUCHAS DE LAS REACCIONES DE LOS ALQUINOS SON SEMEJANTES A LAS REACCIONES CORRESPONDIENTES DE LOS ALQUENOS, PORQUE AMBAS IMPLICAN ENLACES
PROFESOR JANO QUÍMICA
 ω2estforg20000702 En el análisis elemental por combustión de una sustancia orgánica se obtuvieron los siguientes resultados: 52 7 % de carbono, 3 04 % de hidrógeno y 34 79 % de oxígeno. a) Deduzca la fórmula
ω2estforg20000702 En el análisis elemental por combustión de una sustancia orgánica se obtuvieron los siguientes resultados: 52 7 % de carbono, 3 04 % de hidrógeno y 34 79 % de oxígeno. a) Deduzca la fórmula
ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN INTRODUCCIÓN
 Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
Revista de Química. Vol. X. No l. Junio de 1996 ARCO IRIS DE JUGO DE TOMATE, UNA COLOREADA E INSTRUCTIVA DEMOSTRACIÓN Maribel Guzmán C.* INTRODUCCIÓN Los alquenos suelen comportarse como nucleófílos, dado
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES PRPUESTAS EN EL INTERIR DE LA UNIDAD 1. Explica el efecto inductivo de los siguientes compuestos: a) propil litio; b) etanol. a) Propil litio:
JUNIO FASE GENERAL QUÍMICA. OPCIÓN A
 JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
JUNIO 2011. FASE GENERAL 1. (2,5 puntos) QUÍMICA. OPCIÓN A La nitroglicerina, C 3 H 5 N 3 O 9 (l), descompone a 1 atm y 25 ºC para formar N 2 (g), CO 2 (g), H 2 O(l) y O 2 (g), desprendiendo 1541,4 kj/mol
Reacciones de reducción
 idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
idrogenación catalítica: reactivos y condiciones eacciones de reducción 1. atalizadores: metales nobles (Pt) ó seminobles (Pd), Ni-raney, en matriz o soporte inerte (, sulfatos, carbonatos) que adsorbe
Reacciones de Sustitución Electrofílica Aromática (S E Ar) Halogenación: Bromación y Cloración. Alquilación de Friedel-Crafts
 TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
TEMA 12.- Sustitución electrofílica aromática. Naturaleza y mecanismo de la reacción. Efecto de los sustituyentes sobre la reactividad y la orientación. Hidrocarburos condensados. Reacciones de Sustitución
ACIDEZ DE LOS ACIDOS CARBOXILICOS
 ACIDEZ DE LOS ACIDOS CARBOXILICOS Un ácido carboxílico se puede disociar en agua para dar lugar a un protón y a un ión carboxilato. A la constante de equilibrio de esta reacción, K a, se le denomina constante
ACIDEZ DE LOS ACIDOS CARBOXILICOS Un ácido carboxílico se puede disociar en agua para dar lugar a un protón y a un ión carboxilato. A la constante de equilibrio de esta reacción, K a, se le denomina constante
TEORÍA Y PROBLEMAS RESUELTOS DE QUÍMICA ORGÁNICA HACIA UNA QUÍMICA PARA EL SIGLO XXI
 TEORÍA Y PROBLEMAS RESUELTOS DE QUÍMICA ORGÁNICA HACIA UNA QUÍMICA PARA EL SIGLO XXI Proyecto editorial BiBlioteca de Químicas director: Carlos Seoane Prado catedrático de Química orgánica universidad
TEORÍA Y PROBLEMAS RESUELTOS DE QUÍMICA ORGÁNICA HACIA UNA QUÍMICA PARA EL SIGLO XXI Proyecto editorial BiBlioteca de Químicas director: Carlos Seoane Prado catedrático de Química orgánica universidad
Ejercicios PAU orgánica
 Ejercicios PAU orgánica 1- Dado el 1-butanol, escriba su estructura semidesarrollada. Escriba la estructura semidesarrollada de un isómero de cadena, uno de posición y otro de función. Nombre los compuestos
Ejercicios PAU orgánica 1- Dado el 1-butanol, escriba su estructura semidesarrollada. Escriba la estructura semidesarrollada de un isómero de cadena, uno de posición y otro de función. Nombre los compuestos
Ecuación de Hammett 1
 Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
Ecuación de Hammett 1 Hammett 2 ECUACION DE HAMMETT Es un intento para cuantificar los efectos que tienen grupos electrodonadores o electroatractores sobre el estado de transición o un intermediario durante
EJERCICIOS PARA EL PRIMER EXAMEN PARCIAL
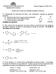 UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
UNIVERSIDAD SIMÓN BLÍVAR Departamento de Química Química rgánica II (QM-2422) EJERCICIS PARA EL PRIMER EXAMEN PARCIAL 1.- Considerando las estructuras del fenol y del ciclohexanol, responda las siguientes
Ácido carboxílico Halogenuro de ácido Anhídrido de ácido Ester Amida O O R SR' O - R O O -
 X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
X ' ' N 2 Ácido carboxílico alogenuro de ácido Anhídrido de ácido Ester Amida S' Tioéster P - - Fosfato de acilo Tienen un sustituyente que es un buen grupo saliente en una reacción de sustitución en el
Química del Carbono, Curso /05/2014. Tema 9. Química del Carbono. El carbono: Z=6 A=12. C =1s 2 2s 2 p 2
 Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 9 Química del Carbono El carbono: Z=6 A=12 C =1s 2 2s 2 p 2 C 1 Se puede representar como En el espacio, la segunda capa: 2 Orbitales del carbono en conjunto ORBITALES QUE EL CARBONO EMPLEA EN SUS
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL
 Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
Tema 7.- Alcoholes, fenoles y tioles. RESVERATROL Nomenclatura de los alcoholes En el sistema de la IUPAC,los alcoholes se nombran añadiendo la terminación ol al hidrocarburo de referencia e, indicando
C Cl 2sp 3 3p. C Br 2sp 3 4p C X = C X
 Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
Química Orgánica Tema 2. aluros de alquilo 1 Tema 2. aluros de alquilo. Estructura. Nomenclatura. Reacciones de los compuestos orgánicos halogenados. oncepto de electrófilo y nucleófilo. Reacciones de
acetileno enlace σ C sp -C sp enlace σ C sp -H 1s H C C H C C sistema de orbitales π del acetileno Química Orgánica Tema 7.
 Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. eacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de hidrácidos
Química rgánica Tema 7. Alquinos 1 Tema 7. Alquinos. Estructura. Nomenclatura de los alquinos. Acidez de los alquinos. eacciones de los alquinos: adiciones electrofílicas al triple enlace. Adición de hidrácidos
REACCIONES EN QUÍMICA ORGÁNICA (I)
 (I) INTRODUCCIÓN * Debido al carácter covalente de los compuestos orgánicos, no aparecen en la Química orgánica reacciones iónicas, que tan frecuentes son en Química inorgánica. *Los enlaces son fuertes,
(I) INTRODUCCIÓN * Debido al carácter covalente de los compuestos orgánicos, no aparecen en la Química orgánica reacciones iónicas, que tan frecuentes son en Química inorgánica. *Los enlaces son fuertes,
ENLACE QUÍMICO 2º BACH EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. H-CHO H C = O : CH 3 OH H C O H H H H C O C H H H CH 3 OCH 3
 EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
EJERCICIOS DE ENLACE QUÍMICO DEL LIBRO 28. -CO C = O : C 3 O C O C 3 OC 3 C O C a) La longitud de enlace CO es menor en el formaldehido, ya que tiene un doble enlace. b) El metanol puede formar enlaces
NOTAS DEL CAPITULO 16: QUIMICA DEL BENCENO:
 NTAS DL CAPITUL 16: QUIMICA DL BNCN: Sustitución electrofílica aromática 1 alogenación: omación: 2 Fe 3 Mecanismo: 1 Fe Fe 3 equivale a ( Fe 4 ) 3 2 Fe 3 Ión Benzenonio Fe 4 Resonancia del ión bencenonio
NTAS DL CAPITUL 16: QUIMICA DL BNCN: Sustitución electrofílica aromática 1 alogenación: omación: 2 Fe 3 Mecanismo: 1 Fe Fe 3 equivale a ( Fe 4 ) 3 2 Fe 3 Ión Benzenonio Fe 4 Resonancia del ión bencenonio
Hibridación de orbitales.
 Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Hibridación de orbitales. REACCIONES ORGANICAS Las formas características de enlace del átomo de carbono en los compuestos orgánicos se describe frecuentemente de acuerdo con el modelo de hibridación de
Tema 12. PREPARACIÓN DE ALQUENOS
 Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
Tema 12. PREPARACIÓN DE ALQUENOS 2.- Principales familias de compuestos orgánicos: Tema 11. Alcanos Tema 12. Alquenos (I) Tema 13. Alquenos (II) Tema 14. Alquinos. Tema 15. Hidrocarburos aromáticos (I).
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS
 UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
UNIVERSIDAD CENTRAL DEL ECUADOR FACULTAD DE CIENCIAS QUÍMICAS QUIMICA FARMACÉUTICA ORGANICA III ACIDOS CARBOXILICOS 1.- ESTRUCTURA La combinación de un grupo carboxilo y un grupo hidroxilo en el mismo
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II
 SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
SOLUCIONARIO Guía Estándar Anual Reactividad en química orgánica II SGUICES040CB33-A16V1 Ítem Alternativa Habilidad 1 B Comprensión 2 E Comprensión 3 D Aplicación 4 B Aplicación 5 A Aplicación 6 E Comprensión
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol
 COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
COLECCIÓN DE PROBLEMAS TEMA 0 QUÍMICA 2º BACHILLERATO. SANTILLANA. Dónde habrá mayor número de átomos, en 1 mol de metanol o en 1 mol de ácido metanoico (ácido fórmico)? Si tenemos en cuenta las fórmulas
QUÍMICA. 2º Bachilerrato orgánica Estereoisomería:
 TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
TEMA 10: QUÍMICA ORÁNICA. 1.- Isomerías. En química orgánica es usual encontrar compuestos químicos diferentes que poseen igual fórmula molecular. Estos compuestos se denominan isómeros. 1.1. Isómeros
EJEMPLOS DE PREGUNTA. Prueba de QUÍMICA. febrero 2010
 EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
EJEMPLS DE PREGUNTA 2010 Prueba de QUÍMICA febrero 2010 PREGUNTAS DE SELECCIÓN MÚLTIPLE CN ÚNICA RESPUESTA. (TIP I) Las preguntas de este tipo constan de un enunciado y de cuatro opciones de respuesta,
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO
 QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) DOMINGO
QUÍMICA de 2º de BACHILLERATO QUÍMICA DEL CARBONO PROBLEMAS RESUELTOS QUE HAN SIDO PROPUESTOS EN LOS EXÁMENES DE LAS PRUEBAS DE ACCESO A ESTUDIOS UNIVERSITARIOS EN LA COMUNIDAD DE MADRID (1996 2010) DOMINGO
REACTIVIDAD DE LOS COMPUESTOS DE CARBONO
 12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES DE FINAL DE UNIDAD Desplazamientos electrónicos 1. Explica, mediante algún ejemplo, qué significa que el ejerza efecto inductivo, I, y efecto
12 REATIVIDAD DE LS MPUESTS DE ARBN SLUINES A LAS ATIVIDADES DE FINAL DE UNIDAD Desplazamientos electrónicos 1. Explica, mediante algún ejemplo, qué significa que el ejerza efecto inductivo, I, y efecto
INFORME LABORATORIO, QUÍMICA ORGANICA DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA DEISY CAROLINA CORDOBA (JUEVES 10-1)
 INFORME LABORATORIO, QUÍMICA ORGANICA DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA DEISY CAROLINA CORDOBA (JUEVES 10-1) PROPIEDADES QUIMICAS DE LOS ALCOHOLES Y FENOLES PROFESORA SOL HELENA GIRALDO UNIVERSIDAD
INFORME LABORATORIO, QUÍMICA ORGANICA DEYMER GÓMEZ CORREA FERNEY OSORIO BARAHONA DEISY CAROLINA CORDOBA (JUEVES 10-1) PROPIEDADES QUIMICAS DE LOS ALCOHOLES Y FENOLES PROFESORA SOL HELENA GIRALDO UNIVERSIDAD
PRACTICA DE LABORATORIO SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES Elaborado por: Licda. Lilian Judith Guzmán Melgar
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS-CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MEDICAS-CUM UNIDAD DIDACTICA QUIMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 19 y 20 PROPIEDADES FÍSICAS Y QUÍMICAS DE ALCOHOLES Y FENOLES
Tema 3: Estructura y química de los compuestos heterocíclicos hexatómicos.
 Tema 3: Estructura y química de los compuestos heterocíclicos hexatómicos. Bibliografía sugerida: RGAI EMISTRY. Marc Loudon and David Allen 2nd. Ed.Benjamin RGAI EMISTRY Jonathan ayden,ick Greeves, Stuart
Tema 3: Estructura y química de los compuestos heterocíclicos hexatómicos. Bibliografía sugerida: RGAI EMISTRY. Marc Loudon and David Allen 2nd. Ed.Benjamin RGAI EMISTRY Jonathan ayden,ick Greeves, Stuart
18 Reacciones orgánicas
 Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
Facultad de Farmacia. Universidad de Alcalá 181 18 Reacciones orgánicas 18.1 Reacciones de adición 18.2 Reacciones de eliminación 18.3 Reacciones de sustitución 18.4 Reacciones entre ácidos y bases 18.1
1. Ponga dos ejemplos de poliésteres indicando los monómeros y la estructura del polímero. - H2 O
 1. Ponga dos ejemplos de poliésteres indicando los monómeros y la estructura del polímero. De la reacción del ácido maleico con etilenglicol o propilenglicol n + n 2-2 2 2 estas moléculas lineales copolimerizan
1. Ponga dos ejemplos de poliésteres indicando los monómeros y la estructura del polímero. De la reacción del ácido maleico con etilenglicol o propilenglicol n + n 2-2 2 2 estas moléculas lineales copolimerizan
Materia: FÍSICA Y QUÍMICA Curso
 ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
ACTIVIDADES DE REFUERZO FÍSICA Y QUÍMICA 3º ESO. JUNIO 2015. 1.- Realizar las configuraciones electrónicas de todos los elementos de los tres primeros periodos de la tabla periódica. 2.- Razonar cuales
2x = x = M. 100 = α = % NOCl eq K C =
 1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
1 Universidad de Castilla la Mancha Selectividad Septiembre.013 Opción A SEPTIEMBRE 013 1.- El cloruro de nitrosilo es un gas utilizado en la síntesis de productos farmacéuticos. Se descompone a altas
CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS?
 CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS? TEMA 3. REACCIONES DE FUNCIONES ORGÁNICAS OXIGENADAS 1. REACCIONES DE ALCOHOLES El grupo 0H puede
CUÁLES SON LAS REACCIONES PRINCIPALES Y LOS MÉTODOS DE OBTENCIÓN MÁS COMUNES DE LOS COMPUESTOS ORGÁNICOS? TEMA 3. REACCIONES DE FUNCIONES ORGÁNICAS OXIGENADAS 1. REACCIONES DE ALCOHOLES El grupo 0H puede
CLASIFICACIÓN DE LOS ALQUINOS FÓRMULA GENERAL:
 Alquinos CLASIFICACIÓN DE LOS ALQUINOS FÓRMULA GENERAL: C n H 2n-2 Fórmula general para los alcanos: C n H 2n+2, por lo que el etano es C 2 H 6 Fórmula general para los alquenos: C n H 2n, por lo que el
Alquinos CLASIFICACIÓN DE LOS ALQUINOS FÓRMULA GENERAL: C n H 2n-2 Fórmula general para los alcanos: C n H 2n+2, por lo que el etano es C 2 H 6 Fórmula general para los alquenos: C n H 2n, por lo que el
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica ITESM-cq, Depto. C.B. Academia Química.
 Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica ITESM-cq, Depto. C.B. Academia Química Estereoquímica Objetivos Describir y explicar el concepto de estereoquímica y
Química Orgánica Química Orgánica Química Orgánica Química Orgánica Química Orgánica ITESM-cq, Depto. C.B. Academia Química Estereoquímica Objetivos Describir y explicar el concepto de estereoquímica y
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97
 TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH 2 + HBr b) CH 3 CH 2 CH 2 OH + H 2 SO 4 c) C 6 H 6 (benceno)
TEMA 7: QUÍMICA DEL CARBONO EJERCICIOS DE SELECTIVIDAD 96/97 1. Complete las siguientes reacciones e indique de qué tipo son: a) CH 3 CH=CH 2 + HBr b) CH 3 CH 2 CH 2 OH + H 2 SO 4 c) C 6 H 6 (benceno)
PRUEBA ESPECÍFICA PRUEBA 201
 PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
PRUEBA DE ACCESO A LA UNIVERSIDAD MAYORES PRUEBA ESPECÍFICA PRUEBA 201 PRUEBA SOLUCIONARIO Aclaraciones previas Tiempo de duración de la prueba: 1 hora Contesta 4 de los 5 ejercicios propuestos (Cada ejercicio
GUÍA DE EJERCICIOS. 5) Cuáles de los compuestos del problema anterior pueden existir como un par de enantiómeros? H 3 C CH 3 CH 3
 República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. olegio Santo Tomás de Villanueva Departamento de iencias átedra: Química Orgánica Año: 5 A, B Prof. Luis Aguilar GUÍA
República Bolivariana de Venezuela Ministerio del Poder Popular para la Educación U.E. olegio Santo Tomás de Villanueva Departamento de iencias átedra: Química Orgánica Año: 5 A, B Prof. Luis Aguilar GUÍA
ÉTERES O H H H CH H 3 C
 Teoría de Química rgánica I ÉTERES Estructura y enlace en éteres y epóxidos Los éteres pueden considerarse derivados orgánicos del agua en el que los átomos de hidrógeno han sido reemplazados por fragmentos
Teoría de Química rgánica I ÉTERES Estructura y enlace en éteres y epóxidos Los éteres pueden considerarse derivados orgánicos del agua en el que los átomos de hidrógeno han sido reemplazados por fragmentos
FORMULACIÓN. Clasificación de los compuestos orgánicos. Hidrocarburos. Alcoholes y fenoles Éteres Aldehídos y cetonas Ácidos carboxílicos Esteres
 FORMULACIÓN Clasificación de los compuestos orgánicos Hidrocarburos. Alcoholes y fenoles Éteres Aldehídos y cetonas Ácidos carboxílicos Esteres CLASIFICACIÓN DE LOS COMPUESTOS ORGÁNICOS Clasificación de
FORMULACIÓN Clasificación de los compuestos orgánicos Hidrocarburos. Alcoholes y fenoles Éteres Aldehídos y cetonas Ácidos carboxílicos Esteres CLASIFICACIÓN DE LOS COMPUESTOS ORGÁNICOS Clasificación de
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS, CUM UNIDAD DIDÁCTICA QUÍMICA, PRIMER AÑO. Guías de Estudio Química 2010
 HIDROCARBUROS AROMÁTICOS Y COMPUESTOS ORGÁNICOS HALOGENADOS ELABORADO POR: LICDA. VIVIAN MARGARITA SANCHEZ GARRIDO. HIDROCARBUROS AROMATICOS (contienen anillos bencénicos) Benceno y sus derivados Hidrocarburos
HIDROCARBUROS AROMÁTICOS Y COMPUESTOS ORGÁNICOS HALOGENADOS ELABORADO POR: LICDA. VIVIAN MARGARITA SANCHEZ GARRIDO. HIDROCARBUROS AROMATICOS (contienen anillos bencénicos) Benceno y sus derivados Hidrocarburos
3.4.3- Adición de agua. Hidratación. Ejemplo:
 Química rgánica Biología 3.4.3- Adición de agua. idratación. Ejemplo: En el caso de los alquinos la adición de agua ocurre de manera semejante a los alquenos con la única salvedad de que el producto que
Química rgánica Biología 3.4.3- Adición de agua. idratación. Ejemplo: En el caso de los alquinos la adición de agua ocurre de manera semejante a los alquenos con la única salvedad de que el producto que
ANIONES ENOLATO, CONDENSACIONES ALDÓLICAS Y OTRAS
 ALDEHÍDOS Y CETONAS II ANIONES ENOLATO, CONDENSACIONES ALDÓLICAS Y OTRAS REACCIONES DE ALDEHÍDOS Y CETONAS Enolización de aldehídos y cetonas. Como ya hemos mencionado a lo largo del curso,los hidrógenos
ALDEHÍDOS Y CETONAS II ANIONES ENOLATO, CONDENSACIONES ALDÓLICAS Y OTRAS REACCIONES DE ALDEHÍDOS Y CETONAS Enolización de aldehídos y cetonas. Como ya hemos mencionado a lo largo del curso,los hidrógenos
 REACCIONES DE TRANSFERENCIA DE PROTONES 1.-junio 1997 a) El ph de una disolución 0.2 M de ácido fórmico (ácido metanoico) cuya K a = 10-4 b) El ph y el grado de disociación del ácido fórmico cuando a 40
REACCIONES DE TRANSFERENCIA DE PROTONES 1.-junio 1997 a) El ph de una disolución 0.2 M de ácido fórmico (ácido metanoico) cuya K a = 10-4 b) El ph y el grado de disociación del ácido fórmico cuando a 40
QUÍMICA ORGÁNICA MODELO 2015
 QUÍMICA ORGÁNICA MODELO 2015 1- Un alcohol insaturado A, de fórmula C 5 H 10 O, se oxida y se obtiene 3 penten 2 ona, mientras que la deshidratación del alcohol A con ácido sulfúrico conduce a 1,3 pentadieno.
QUÍMICA ORGÁNICA MODELO 2015 1- Un alcohol insaturado A, de fórmula C 5 H 10 O, se oxida y se obtiene 3 penten 2 ona, mientras que la deshidratación del alcohol A con ácido sulfúrico conduce a 1,3 pentadieno.
ISOMERÍA. Isómeros con fórmula molecular C4H10
 ISOMERÍA 2º BACHILLER 1. Definición de isomería Los isómeros son dos o más compuestos que tienen igual fórmula molecular, pero distinta fórmula desarrollada o espacial, es decir, se distinguen en las diversas
ISOMERÍA 2º BACHILLER 1. Definición de isomería Los isómeros son dos o más compuestos que tienen igual fórmula molecular, pero distinta fórmula desarrollada o espacial, es decir, se distinguen en las diversas
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES
 Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
Práctica 2 IDENTIFICACION Y REACCIÓN DE ALCOHOLES OBJETIVOS: 1. Identificar las propiedades físicas y químicas que presentan los alcoholes. 2. Aprender a reconocer entre los alcoholes primarios, secundarios
Especialista en Química Orgánica para Ciencias de la Salud
 Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
Especialista en Química Orgánica para Ciencias de la Salud Titulación certificada por EUROINNOVA BUSINESS SCHOOL Especialista en Química Orgánica para Ciencias de la Salud Especialista en Química Orgánica
9. LA ENERGÍA RETICULAR
 La energía reticular U (o energía de red) es la energía necesaria para separar totalmente los iones que forman una red cristalina hasta una distancia infinita donde ya no interactúan eléctricamente. También
La energía reticular U (o energía de red) es la energía necesaria para separar totalmente los iones que forman una red cristalina hasta una distancia infinita donde ya no interactúan eléctricamente. También
TEMA 4. ESTRUCTURA DE LAS MOLÉCULAS ORGÁNICAS
 W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
W 0 J. Martínez y. Iriondo TEMA. ESTRUTURA DE LAS MLÉULAS RGÁIAS EJERIIS A. Estructuras. Dibuje las estructuras de Lewis correspondientes a los siguientes compuestos: Acetona 6 Acetonitrilo 7 Br loruro
2. ACIDOS Y BASES, REACCIONES DE GRUPOS FUNCIONALES. (6 h)
 NOMBRE DE LA MATERIA: Síntesis Orgánica Avanzada CODIGO DE LA MATERIA: I6996 DEPARTAMENTO: Química CARGA TOTAL DE HORAS DE TEORIA: 68 CARGA TOTAL DE HORAS DE TRABAJO: INDEPENDIENTE: 64 TOTAL DE HORAS:
NOMBRE DE LA MATERIA: Síntesis Orgánica Avanzada CODIGO DE LA MATERIA: I6996 DEPARTAMENTO: Química CARGA TOTAL DE HORAS DE TEORIA: 68 CARGA TOTAL DE HORAS DE TRABAJO: INDEPENDIENTE: 64 TOTAL DE HORAS:
EL BENCENO Y SUS DERIVADOS II
 EL BENCENO Y SUS DERIVADOS II El benceno, al igual que un alqueno, tiene nubes electrónicas pi por arriba y por debajo del plano molecular que forman los enlaces sigma. Aunque los electrones pi del benceno
EL BENCENO Y SUS DERIVADOS II El benceno, al igual que un alqueno, tiene nubes electrónicas pi por arriba y por debajo del plano molecular que forman los enlaces sigma. Aunque los electrones pi del benceno
Tema 9. Química Orgánica
 Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
Tema 9. Química Orgánica ÍNDICE 1. Enlace covalente en las moléculas orgánicas 1.1. ibridaciones del carbono 1.2. Resonancia 1.3. Polaridad de enlace 2. Representación de moléculas orgánicas 3. idrocarburos
