CARDIOLOGÍA MÉDICA. Comisión de Apuntes 07/08
|
|
|
- Luis Alcaraz González
- hace 8 años
- Vistas:
Transcripción
1 CARDIOLOGÍA MÉDICA Comisión de Apuntes 07/08 Abellán Huerta, José Aledo Serrano, Ángel Cárceles García, Carlos Carrasco Torres, Rubén Cerdán Sánchez, María Flores Blanco, Pedro García Egea, Esther García-Escribano García, Irene Azenaia (etc.) Sánchez Galián, María José
2
3 TEMA AN - 1 CARDIOLOGÍA CMG PATOLOGÍA AÓRTICA: ANEURISMAS AÓRTICOS & Síndrome AÓRTICO AGUDO J. A., M.J.S., C.C. Valdés 1
4 TEMA AN - 1 CARDIOLOGÍA CMG ANEURISMAS AÓRTICOS INTRODUCCIÓN Para no perdernos y sentirnos seres estratosféricos, comencemos con los benditos recuerdos anatómicos. La aorta es un vaso central, a través del cual la sangre expulsada por el ventrículo izquierdo es distribuida al árbol arterial general. En los adultos mide aproximadamente 3 cm de diámetro en su origen, 2,5 cm en la porción descendente en el tórax y de 1,8 a 2 cm en el abdomen. AMPLIACIÓN DE CONTENIDO DE INTERÉS. A consecuencia de su continua exposición a una elevada presión pulsátil y a la fricción, la aorta es especialmente proclive a las lesiones y enfermedades relacionadas con traumatismos mecánicos: aneurisma aórtico, disección aórtica, oclusión aórtica y aortitis. La aorta es también más propensa a romperse que cualquier otro vaso debido a que la tensión de su pared, según la ley de Laplace (es decir, la tensión es proporcional al producto de la presión y el radio), estaría incrementada. FIN DEL CONTENIDO AMPLIADO La patología de la aorta engloba el aneurisma y el síndrome aórtico agudo. CONCEPTO El aneurisma de aorta es una dilatación patológica, localizada y permanente. de una parte de la aorta, con un diámetro 1,5 veces el diámetro normal de la aorta. 1 1 El aneurisma verdadero afecta a las tres capas del vaso y el pseudoaneurisma afecta sólo a las capas intima y media. Figura AN1-1 La morfología de los aneurismas es variable, pueden ser fusiformes (afectan a toda la circunferencia del segmento vascular, originando una lesión dilatada difusa) o saculares (afectan a una porción de la circunferencia, y son una evaginación de la pared aórtica). Generalmente, se observa una señal de afectación difusa aórtica, aunque la ateroesclerosis, entidad anatomopatológica que se asocia con más frecuencia a los aneurismas aórticos, también produce dilatación localizada. La localización del aneurisma puede ser torácica o abdominal, aunque éstas no son excluyentes. En efecto, el 25-28% de los pacientes con aneurismas torácicos también posee aneurisma abdominal. El 13% de los casos son múltiples. AMPLIACIÓN DE CONTENIDO DE INTERÉS. La etiología puede ser ateroesclerosis, necrosis quística de la media, sífilis, tuberculosis, infecciones estafilocócicas, estreptocócicas o salmonela, vasculitis, traumas, congénitas. FIN DEL CONTENIDO AMPLIADO J. A., M.J.S., C.C. Valdés 2
5 TEMA AN - 1 CARDIOLOGÍA CMG ANEURISMAS ABDOMINALES INTRODUCCIÓN Constituyen el tipo de aneurisma más frecuente y la mayoría son infrarrenales. La causa de producción más común es la arteriosclerosis, de hecho, actualmente está aumentando su frecuencia por aumento de la arteriosclerosis 2. Aparecen en adultos mayores (V >55 años, M >70 años) 3, su prevalencia en sujetos > 50 años es del 3%. CLÍNICA La mayoría de los aneurismas abdominales son asintomáticos, aparecen como un hallazgo casual en una exploración de rutina. Sin embargo, en jóvenes (<50 años) son más frecuentemente sintomáticos. Suelen ser infrarrenales, es decir, la localización más frecuente es por debajo de las arterias renales. Este tipo de aneurismas son menos sintomáticos que los localizados en el tórax, esto se debe a que el abdomen es más laxo y no se nota la distensión. No obstante, de existir síntomas, el más frecuente es el dolor, localizado en hipogastrio o espalda lumbar, constante y duradero (horas, días), inespecífico y no se modifica con el movimiento. Estamos ante una patología en la que la presencia de estos síntomas inespecíficos debe despertar un alto índice de sospecha. ETIOLOGÍA A continuación se expone en varios puntos la posible etiología del aneurisma abdominal: La capa media de la aorta infrarrenal no posee riego adecuado por afección de los vasa vasorum, lo que provoca su debilitamiento. La ateroesclerosis es en gran parte la responsable de este hecho. HTA que dilata la zona afectada. Incidencia familiar: Un 28 % de los pacientes posee familiares de 1ª línea con aneurisma. Mecanismos celulares que hacen posible la dilatación: enzimas proteolíticas, actividad elastolítica, inflamación. Figura AN1-2 EXPLORACIÓN FÍSICA En primer lugar, se ha de tumbar al paciente para intentar palpar la parte media (central) del abdomen. El aneurisma se palpa como una masa pulsátil, de extensión variable 4. El 2 De 8,7 en 1960 hasta 36,5 en la actualidad. 3 En la mujer es más tardía porque la arteriosclerosis se manifiesta en ésta más tardíamente. Al ser una enfermedad progresiva, la frecuencia de los aneurismas aumenta con la edad. 4 Recordad: (palpación + pulsatilidad) J. A., M.J.S., C.C. Valdés 3
6 TEMA AN - 1 CARDIOLOGÍA CMG tamaño suele estar subestimado 5 y se provoca cierto dolorimiento a su palpación. Es difícil diferenciarlo de ectasia (dilatación de una parte u órgano) y tortuosidad. En esta exploración se hallan también datos relativos a la arteriosclerosis subyacente, como son los Bruits ó soplos, que son producidos por el paso de la sangre por una porción estrechada. El dolor por aneurisma anuncia su rotura, y es una urgencia médica. TC. Se usa para la valoración del tamaño, la localización y el seguimiento. Es sensible y fiable. Es la segunda prueba solicitada. DIAGNÓSTICO Con las siguientes pruebas pretendemos medir el tamaño y la localización del aneurisma, pues de ello depende el pronóstico y el tratamiento del paciente. Radiografía simple de abdomen. Sólo sirve para apreciar si hay calcificación en las paredes de la aorta, hecho muy común en la arterioesclerosis. Ultrasonidos abdominales. Es la exploración más importante, resulta la primera opción diagnóstica. Sirve para la medición seriada del tamaño del aneurisma y para examinar a enfermos con riesgo de aneurisma aórtico (screening). Además, no irradia al paciente. Figura AN1-4 RMN. Es aplicable lo dicho para el TAC. Aortografía. Proporciona información sobre la extensión del aneurisma y la extensión de la enfermedad ateroesclerótica vascular asociada. Hoy día prácticamente no se emplea. Cuidado, no hay que caer en el error de pensar que una prueba es mejor que otra. En una ecografía sólo se ve la luz del vaso, con TAC y RMN se ve el vaso en su totalidad. Casi siempre, los aneurismas se localizan con ecografía (US) y posteriormente, se visualizan con TAC y RMN. HISTORIA NATURAL Figura AN1-3 El peor problema de los aneurismas abdominales es la ruptura 6. Esta situación provoca la aparición de nuevo dolor o aumento del mismo: inespecífico, constante, intenso y localizado en la espalda o abdomen bajo. El dolor puede irradiarse hacia las piernas, glúteos e ingles, confundiéndose en ocasiones 5 Puesto que las vísceras abdominales van a disimular el verdadero tamaño de la dilatación. 6 IMPORTANTE: El riesgo de ruptura es proporcional al tamaño del aneurisma. J. A., M.J.S., C.C. Valdés 4
7 TEMA AN - 1 CARDIOLOGÍA CMG con un cólico nefrítico. La ruptura puede provocar además un hematoma retroperitoneal en los flancos. El paciente percibe sensación de extrema gravedad. Dada la localización abdominal, puede producirse distensión abdominal o hemorragia digestiva. En esta patología, también es frecuente la aparición de hipotensión (aparece en un tercio de los pacientes), desencadenando un shock hipovolémico. Por tanto, ante una ruptura de aneurisma, debemos identificar la tríada clásica característica: dolor - masa pulsátil - hipotensión (esta última, como ya se ha dicho, sólo aparece en 1/3 de los pacientes). Los dos primeros síntomas (dolor masa pulsátil) también aparecen en los aneurismas no complicados. Se debe hacer el diagnóstico diferencial con cólico nefrítico, diverticulitis, y hemorragia digestiva. Es preciso reseñar que el diagnóstico inicial es erróneo en un 30% de los pacientes, hecho muy grave cuando se trata de una patología que tiene una mortalidad total del 80%. 7 Un 60% de los pacientes mueren antes de iniciar el tratamientom, mientras que un 50 % fallecen durante el tratamiento quirúrgico. Riesgo de ruptura aumenta El riesgo de ruptura aumenta de forma directa con el tamaño del aneurisma, de modo que: I. cuando es <4 cm, el riesgo de ruptura es del 0-2%. II. cuando es >5 cm, el riesgo de ruptura es del 22% (aneurisma de 2 años). Cuando el aneurisma crece rápidamente (> 0.5 cm/año), el paciente ha de ser revisado cada año, pues se acercará poco a poco al tamaño de riesgo. En conclusión, el riesgo de ruptura aumenta con el tamaño grande y/o expansión rápida. 7 Ante ruptura hacer TAC y tratamiento de urgencia siempre. TRATAMIENTO TTO. QUIRÚRGICO Mortalidad operatoria electiva 4-6%. Indicación clara si el tamaño > 5 cm. Entre 4-5 cm, depende del riesgo y mortalidad operatoria. Riesgo aumenta con arteriosclerosis generalizada. Evaluación preoperatoria coronaria. Supervivencias a 1, 5 y 10 años: 93, 63 y 40 % respectivamente. Si el paciente padece enfermedad coronaria concomitante, 10 % menos de supervivencia. TTO. INTERVENCIONISTA (NO QUIRÚRGI- CO) Es el tratamiento de elección, pero no siempre es posible. Se realiza colocando una endoprótesis (o tubo-stent). La intervención consiste en introducir a través de la arteria femoral, un tubo conectado a dos stents en sus extremos (proximal y distal). Dicho tubo es introducido en la porción de aorta afecta, actuando como una segunda pared, para lo cual ha de tener el tamaño correspondiente a la dilatación. La función de los stent es anclar la endoprótesis a la parte proximal y distal, mediante un aumento de presión. Al ser el tubo rígido, no siempre se introduce bien, ya que la aorta puede estar curvada. TTO. MÉDICO Modificación de los factores de riesgo. Beta bloqueantes. Seguimiento con TAC. J. A., M.J.S., C.C. Valdés 5
8 TEMA AN - 1 CARDIOLOGÍA CMG ANEURISMAS TORÁCICOS INTRODUCCIÓN Son menos frecuentes que los abdominales. Los clasificamos en ascendentes (del arco aórtico) y descendentes, cuya etiología es diferente, como veremos a continuación. ETIOLOGÍA Aneurisma Ascendente: S. de Marfan 8, necrosis medio quística (NMQ), conectivopatías, enfermedades de la aorta. Aneurisma del Arco: Enfermedades de la aorta, ateroesclerosis, NMQ, sífilis, infecciones. Aneurisma Descendente: Ateroesclerosis, principalmente. Cabe destacar que en los aneurismas ascendentes y del arco aórtico la afectación recae principalmente en la capa muscular de la Aorta. CLÍNICA El 40% de los pacientes se muestra asintomático en el momento del diagnóstico. Como ya se señaló, en comparación con los aneurismas abdominales, los torácicos son más sintomáticos. Esto se explica por la mayor facilidad de afectación de estructuras situadas en el tórax. Las consecuencias vasculares del aneurisma torácico son la isquemia miocárdica, la insuficiencia aórtica (IA), la ruptura del seno de las válvulas y las embolias cerebrales, viscerales o periféricas. Estos aneurismas presentan, además, un efecto compresivo de masa en diferentes estructuras como la vena cava (dando lugar al síndrome de la vena cava superior), la tráquea, el esófago, etc. Esta compresión puede desencadenar dolor torácico en el 37% de los casos, de columna en el 21%, disnea, tos, disfonía o disfagia. COMPLICACIONES La principal complicación del aneurisma torácico es la ruptura, en la que hay mayor riesgo de muerte 9. También es típica la aparición brusca del dolor en la misma localización de un dolor previo (en aquellos casos en los que lo hubo). Así mismo, es muy frecuente que el aneurisma rompa a pleura o pericardio, y menos frecuentemente a esófago. Por último, es importante señalar que la expansión aguda puede ser el primer signo de ruptura. DIAGNÓSTICO Figura AN1-5 8 Síndrome de Marfan: trastorno congénito del tejido conjuntivo, que se caracteriza por longitud anormal de las extremidades, con miembros largos, anomalías óseas y extrema laxitud articular. Se altera también el tejido de conjuntivo de los vasos sanguíneos, se rompen las fibras elásticas y se produce insuficiencia de las válvulas cardíacas, sobre todo de la aórtica. Radiografía de tórax. Es una exploración muy útil, pues en ella se observa un ensanchamiento del mediastino y desplazamiento o compresión de la tráquea o 9 Pues sale mayor cantidad de sangre y a mayor velocidad, recordemos que estamos en Aorta Torácica. J. A., M.J.S., C.C. Valdés 6
9 TEMA AN - 1 CARDIOLOGÍA CMG bronquio principal izquierdo. En ocasiones también se puede visualizar la Aorta ensanchada. Ecografía transesofágica (ECO TE). Es muy útil, sobretodo para valorar la aorta ascendente proximal y la aorta torácica descendente. Ecografía transtorácica (ECO TT). Poco útil. TC Y RMN. Son útiles en diagnóstico y seguimiento. INDICACIÓN OPERATORIA 1. Aquellos con tamaños >6 cm o >7 cm Aquellos que son más pequeños pero poseen una rápida expansión, insuficiencia aórtica severa o síntomas del aneurisma (causados por comprensión). 3. En pacientes que tengan el Síndrome de Marfan, si el tamaño >5,5 cm o son de alto riesgo 12. En este caso se indica cirugía porque en estos pacientes la pared se daña precozmente. Sin operación la supervivencia a los 1, 3, 5 años es del 65%, 36%, 20% respectivamente. TRATAMIENTO Figura AN1-6 Aortografía. No se emplea. HISTORIA NATURAL Como ya se comentó anteriormente, una de las principales complicaciones en la historia natural del aneurisma torácico es la ruptura, situación que se da entre el 32 y 68% de los pacientes. Como bien sabemos, y nunca está mal recordar, a mayor expansión (tamaño) del aneurisma siempre habrá mayor riesgo de ruptura, lo que explica que este riesgo sea mayor en aquellos casos con una expansión anual de 0,43 cm/año 10 y con un tamaño (diámetro aórtico) >5 cm. 10 Aunque Harrison indica >1 cm/año TTO. QUIRÚRGICO Supervivencia a corto plazo en aneurismas no complicados del 90-95%, y una mortalidad del 5%. Complicaciones mayores: hemorragia, paraplejia 13 (5-6%), accidente cerebrovascular si el aneurisma es de arco (3-7%). La supervivencia estará en función del grado de ateroesclerosis. TTO. INTERVENCIONISTA (DE 1ª ELECCIÓN) Al igual que el tratamiento de los aneurismas abdominales, también se basa en la colocación de un tubo percutáneo. Debemos destacar que esta técnica es más compleja en el aneurisma ascendente. 11 Si fueran de muy alto riesgo, en este caso, se podría implantar la prótesis desde la ingle 12 Se entiende como pacientes con síndrome de Marfan de alto riesgo aquellos con alguna de las siguientes características: rápida y progresiva dilatación aneurismática, historia familiar de Marfan con dilatación aórtica, o embarazo. 13 Por lesión de arterias espinales. J. A., M.J.S., C.C. Valdés 7
10 TEMA AN - 1 CARDIOLOGÍA CMG TTO. MÉDICO Beta bloqueantes, para disminuir la TA y contractibilidad 14. Controlar la hipertensión, pues acelera el progreso del aneurisma. Y POR INSISTIR QUE NO SEA Para finalizar, recordar que una buena parte de los aneurismas son asintomáticos, no hay que dejar que crezcan. Debe tenerse en cuenta que el tratamiento intervencionista es de 1ª elección (preferencia), es importante controlar la TA. Los beta bloqueantes son el tratamiento médico más indicado. 14 Deben ser administrados a largo plazo. J. A., M.J.S., C.C. Valdés 8
11 ARRITMIAS
12 Arritmias I CARDIOLOGÍA CMG Arritmias ARRITMIAS I. INTRODUCCIÓN S ISTEMA CARDIONECTOR El corazón posee un sistema de excitoconducción específico cuya función es la de generar impulsos eléctricos rítmicos y distribuirlos. Este sistema comienza en un grupo de células especiales que forman un marcapasos fisiológico llamado nódulo sinusal. Se sitúa en la parte alta de la aurícula derecha, cerca de la vena cava superior, y se encarga de generar el impulso eléctrico en situación normal con un ritmo, aproximadamente de unos 70 l.p.m., que es denominado por razones obvias ritmo sinusal. Para conducir el impulso desde las aurículas a los ventrículos necesita de otra agrupación de células especializada, denominada nódulo aurículo-ventricular (nodo A-V). En condiciones normales, el impulso pasa por el nodo A-V y sólo a través de él debido a que las válvulas tricúspide y mitral forman un anillo fibroso que no transmite el impulso. El paso por el nodo A- V produce un retraso en la conducción, facilitando que se terminen de contraer totalmente las aurículas antes de que se comiencen a despolarizar y contraer los ventrículos. El nódulo aurículo-ventricular emite un fascículo, el haz de His, el cual se dividirá en dos ramas, una para cada ventrículo, y terminará en unas arborizaciones llamadas fibras de Purkinje. El sistema de excito-conducción cardiaca tiene las siguientes propiedades funcionales: 1. AUTOMATISMO (cronotropismo): Capacidad que poseen ciertas agrupaciones de células cardíacas para generar estímulos periódicamente, capaces de propagarse y generar un nuevo ciclo cardíaco. Existen diversas zonas en el corazón con esta propiedad marcapasos, cada una de ellas con un ritmo diferente. Lo que permite que el corazón funcione de manera coherente es que siempre predomina el ritmo del marcapasos más rápido (marcapasos dominante), quedando los otros como marcapasos de escape cuando éste falla. o Nódulo sinusal: lpm, lo que constituye el ritmo sinusal. o Nódulo aurículo-ventricular: lpm, denominado ritmo nodal. o Células de His-Purkinje: lpm, a este ritmo se le denomina ritmo ventricular. 2. EXCITABILIDAD (batmotropismo): Se trata de la capacidad que tienen las células cardiacas de responder a un estímulo o impulso eléctrico. Dicho de otra manera, la capacidad de una célula cardiaca polarizada en reposo para despolarizarse en respuesta a un estímulo eléctrico. Tras la despolarización de un miocardiocito se produce un periodo refractario durante el cual la célula es incapaz de volver a despolarizarse. 3. CONDUCTIBILIDAD (dromotropismo): Es la capacidad del músculo cardiaco de transmitir el impulso eléctrico. Podemos diferenciar entre dos familias de células o estructuras con dos diferentes formas de conducción: A. En las estructuras cuya excitación es calcio-dependiente (el Ca +2 es el ion dominante en su despolarización), como ocurre en el nódulo aurículo-ventricular, se produce una conducción decremental. Este tipo de conducción tiene una velocidad diferente según el tiempo que transcurre entre un im- A.A., E. G., R. C. A. García-Alberola 1
13 Arritmias I CARDIOLOGÍA CMG E pulso y el siguiente, de tal modo que, cuando el tiempo transcurrido es largo la conducción es rápida, y viceversa. B. Cuando la despolarización de una estructura es sodio-dependiente, como ocurre en el haz de His o en las fibras de Purkinje, la conducción es no decremental. Estas estructuras conducen siempre a la misma velocidad, independientemente del tiempo que dure la diástole. LECTROCARDIOGRAMA Complejo QRS: Producido por la despolarización de los ventrículos. Abarca tres ondas: la primera, producida por la despolarización del septo interventricular y representada por un vector dirigido de izquierda a derecha en sentido casi transversal; la segunda, de gran amplitud, producida por la excitación de las paredes ventriculares, cuyo vector de despolarización está orientado hacia la izquierda y abajo; y la última, de baja intensidad por la despolarización de las bases ventriculares y con un vector orientado hacia arriba. La onda de despolarización de las paredes ventriculares es negativa en V1 y progresivamente va haciéndose positiva hasta que llega a su máxima expresión en V5-V6. El complejo QRS suele durar entre 0,080 y 0,095 segundos (80-95 mseg.) y en su duración normal se denomina estrecho. Cuando su duración es mayor de 100 mseg existe bloqueo incompleto de rama, y cuando es mayor de 120 el bloqueo es completo. En cuanto a la nomenclatura de las ondas del QRS es la siguiente: La primera onda negativa se denomina con la letra Q. Por su parte, a la primera onda positiva se le asigna la letra R, mientras que si hay una onda negativa tras una onda R se le adjudica la letra S. Si hubiese una onda positiva tras una onda S se nombra como R y en caso de encontrarnos con una onda negativa tras una onda R, la llamaremos S. Además, puede que observemos una onda negativa aislada (no acompañada de una onda R), a la que marcaremos como QS. Por último, aquellas ondas que predominen sobre las demás o tengan un tamaño superior a 5mm, en altura o profundidad, se escribirán con mayúsculas y, en caso contrario, con minúsculas. Onda P: Producida por la despolarización auricular, se debe a un vector que se dirige hacia la izquierda y hacia abajo. Es siempre positiva en las derivaciones I y II, negativa en avr, y en V1 tiene un comienzo positivo y luego se hace negativa (bifásica). Su duración normal es de 0,05 a 0,10 segundos. Intervalo PR: Es el lapso medido entre el inicio de la onda P y el inicio del QRS. Está producido por el retraso del impulso que viene de las aurículas al pasar por el nodo A-V y, en menor medida, por el retraso que se produce al pasar el impulso por el Haz de His. Su duración normal oscila entre los 0,12 y 0,20 segundos. El párrafo anterior está sacado del tema 12 de la comisión de PG 06/07 El ECG normal. Como es comprensible no se pretende con esta página de introducción sobre el ECG exponer aquella larga explicación de nuevo. Aunque se intentará explicar detenidamente el por qué de la expresión electrocardiográfica de cada arritmia en su debido momento, recomendamos leer el susodicho tema para refrescar la memoria y comprender mejor el bloque de arritmias en su conjunto. A.A., E. G., R. C. A. García-Alberola 2
14 Arritmias I CARDIOLOGÍA CMG Onda T: Se produce por la repolarización ventricular. La auricular no es visible porque se solapa con el complejo QRS. Su vector está orientado de manera muy similar a la onda P, hacia la izquierda y abajo. Suele ser positiva en aquellas derivaciones en las que el complejo QRS es positivo y negativa en las que el QRS es negativo. A RRITMIAS Pese a la complejidad del término arritmia, lo definiremos como todo ritmo no originado en el nódulo sinusal. También serán considerados como arrítmicos, aquellos ritmos sinusales con frecuencias superiores a 100 lpm o inferiores a 60 lpm. Dicho esto, las arritmias se pueden clasificar en dos grandes familias: o o o Bradiarritmias o bradicardias: déficit de latidos o disminución de frecuencia cardiaca. Taquiarritmias o taquicardias: exceso de latidos o aumento de frecuencia cardiaca. Otras arritmias con frecuencia cardiaca normal, pero con alteraciones en el ritmo. ETIOLOGÍA Si el corazón es estructuralmente normal pero genera arritmias, nos encontramos ante arritmias primarias. Sin embargo, si el corazón es estructuralmente anormal debido, por ejemplo, a un infarto de miocardio, o bien la arritmia se debe a patologías extracardíacas como hipertiroidismo, embolismo pulmonar, etc. nos hallamos ante arritmias secundarias. MECANISMO El mecanismo de producción de una arritmia puede darse por dos tipos de alteraciones: 1. Alteraciones del automatismo: por déficit o exceso de generación de impulsos. 2. Alteraciones de conducción: distinguimos dos tipos diferentes de alteraciones: - Bloqueos simples (20%): se produce una dificultad o stop al paso del estímulo por una estructura o zona cardiaca. - Reentradas (80%): el impulso eléctrico da vueltas alrededor de un obstáculo anatómico o funcional, como puede ser una zona necrosada o cicatriz producida por un infarto de miocardio. Se producirá un ritmo periódico ventricular. Para que se produzca una reentrada serán necesarias dos condiciones: Una zona de bloqueo que no conduzca el impulso, alrededor de la cual girará. Por ejemplo una válvula, o una zona necrosada. Un trayecto de conducción lenta, que dará tiempo a que pase el periodo refractario. Se permite así la recuperación del circuito, de modo que el estímulo pueda seguir activando posteriormente. Fig 1. Esquema de un tipo de mecanismo de reentrada con dos zonas necróticas y un trayecto de conducción lenta entre ellas. CLÍNICA La clínica de las arritmias es muy variable. Según su forma de presentación podemos distinguir entre: A.A., E. G., R. C. A. García-Alberola 3
15 Arritmias I CARDIOLOGÍA CMG o o o Aisladas: Se trata de episodios únicos, que se relacionan con alguna patología aguda como puede ser un infarto de miocardio. Recurrentes: Son las más frecuentes. Dentro de este grupo se diferencian: Paroxísticas: Se inician y terminan de forma brusca, apareciendo cada cierto tiempo. Incesantes: Se dan constantemente. Se alternan la arritmia y el ritmo sinusal normal en tiempos muy cortos: arritmia, ritmo sinusal, arritmia, ritmo sinusal, arritmia, ritmo sinusal, arritmia (Cada 10 seg. por ejemplo). Permanentes: Aparecen y se mantienen durante semanas, meses o años. Es fundamental no confundirlas con las incesantes. Cuando una taquiarritmia se manteniene durante un tiempo demasiado prolongado puede llevar a una lesión estructural en el miocardio, llamada taquimiocardiopatía. A la larga, ésta puede acabar en insuficiencia cardiaca. Esta patología puede ser reversible. Si tratamos y solucionamos la arritmia, el corazón volverá a la normalidad. 1. Síntomas: o o o o Asintomáticas: Muchas arritmias son descubiertas por casualidad en una revisión rutinaria con un ECG o una simple exploración física. Palpitaciones: Se produce una sensación subjetivamente anormal y desagradable del latido cardiaco. Angor: En las taquiarritmias severas, al acortarse la diástole, se puede producir un disbalance entre oferta y demanda de oxígeno. Recordemos que el miocardio se nutre cuando el músculo se relaja en diástole, y que en una taquicardia la demanda de oxígeno aumenta. Esto puede conllevar el clásico dolor torácico anginoso. Bajo gasto: Síntomas relacionados con esta circunstancia son la palidez y la sudoración. o Mareo y síncope o Insuficiencia cardiaca congestiva (ICC) o 2. Signos: Muerte súbita El signo fundamental es la alteración del pulso arterial, el cual puede ser rápido o lento y regular o irregular. En ocasiones también se puede observar alteración en el pulso venoso, aunque esto último es más bien un concepto académico que práctico. MÉTODOS DIAGNÓSTICOS Para diagnosticar una arritmia podemos valernos de los siguientes métodos diagnósticos: o o o o o ECG Maniobras vagales o adenosina Holter Estudio electrofisiológico Pruebas de esfuerzo Electrocardiograma (ECG) El primer electrocardiograma en humanos se realizó a finales del siglo XIX. Como podemos observar en la imagen el paciente debía introducir las extremidades en frascos de vidrio con suero salino. Actualmente se utilizan los electrodos para realizar ECG de 12 derivaciones. Siempre que exista la posibilidad debemos hacerlo porque será la prueba que más información nos proporcione sobre el tipo de arritmia frente a la que nos encontramos. A.A., E. G., R. C. A. García-Alberola 4
16 Arritmias I CARDIOLOGÍA CMG Maniobras vagales o adenosina Las maniobras vagales producen un estímulo intenso del parasimpático que disminuirá la velocidad de conducción de la arritmia al producir enlentecimiento de la conducción en las estructuras calcio-dependientes, como el nódulo aurículo-ventricular. Tanto éstas como la adenosina sirven como métodos diagnósticos y terapéuticos en determinados casos. Algunos ejemplos de maniobras vagales son: la maniobra de Valsalva, el masaje del seno carotídeo, la compresión de los globos oculares (no debe utilizarse este método pues podría producir desprendimientos de retina e incomodidades en el paciente). Otras técnicas menos utilizadas son la inmersión brusca de la cabeza en agua fría o la inducción del vómito. La adenosina produce, farmacológicamente, el mismo efecto que una maniobra vagal. Es un nucleósido de vida media muy corta que se administra en forma de bolos intravenosos. Holter Consiste en el registro electrocardiográfico del corazón durante un periodo de 24 a 48 horas. En su origen, el paciente tenía que ir cargado con un gran aparato que iba conectado a un emisor de radio. Actualmente, el Holter es mucho más pequeño y cómodo, y registra en una memoria magnética la actividad cardiaca que se leerá después en un ordenador. Se suelen registrar tres derivaciones. El Holter implantable es una variante del anterior. Se utiliza cuando las arritmias se producen con poca frecuencia, pero su detección es imperiosa. Es electrónico y se coloca subcutáneamente en la zona pectoral. La batería que tiene suele durar unos 2 ó 3 años. En el momento en el que el paciente tenga la sensación de estar padeciendo una arritmia pulsa un botón situado en el exterior para que quede registrada la misma. AMPLIACIÓN DE CONTENIDO DE INTERÉS. Fisiológicamente, la adenosina realiza algunas acciones en el organismo como la vasodilatación o la broncoconstricción. Como curiosidad decir que algunas metilxantinas como la teofilina o la cafeína del café pueden minimizar los efectos de la adenosina debido a que son antagonistas de su receptor. En cuanto a la posibilidad de realizar una maniobra vagal, la más recomendable de todas ellas es el masaje carotídeo. La técnica a utilizar en esta maniobra es la siguiente: El paciente debe estar acostado y la cabeza girada hacia el lado opuesto del seno carotídeo que se vaya a estimular. Debe hacerse de forma unilateral con un máximo de cinco segundos de duración, bajo control electrocardiográfico y con disponibilidad de un equipo de reanimación, previa colocación de una vía venosa periférica debiendo tener disponible atropina y lidocaína para su uso inmediato. La maniobra, de ser necesario, puede repetirse después de varios minutos de la primera (con o sin administración de fármacos). Esta maniobra debe ser evitada en pacientes con un soplo carotídeo, con antedentes de ACV o con intoxicación digitálica. FIN DEL CONTENIDO AMPLIADO Estudio electrofisiológico Es un método invasivo orientado radiológicamente. Consiste en la introducción de electrocatéteres (de plástico con terminaciones metálicas) normalmente por la vena femoral derecha hacia el corazón. Los electrodos de estos catéteres especiales registran variables como la cantidad de estímulos que reciben o la velocidad de los estímulos. Con este método es posible estudiar la arritmia en detalle, creando mapas de activación muy sofisticados. A.A., E. G., R. C. A. García-Alberola 5
17 Arritmias I CARDIOLOGÍA CMG Antiarrítmicos Clase I: Son bloqueantes de los canales de sodio. Existen subgrupos dentro de esta clase: Fig 2. En esta imagen podemos observar un ejemplo de estudio electrofisiológico. Tocando en las diferentes zonas de la pared miocárdica con la punta del catéter podemos ir coloreando la arquitectura cardiaca, y así dibujando su estructura de activación eléctrica en el monitor del ordenador. De este modo podemos, por ejemplo, localizar y ablacionar zonas de génesis de arritmias. o o o I a: quinidina (no disponible en el mercado), procainamida. I b: lidocaína. I c: flecainida y propafenona (son los más usados actualmente). Disminuyen la velocidad de conducción y aumentan el período refractario en células sodiodependientes como el músculo auricular, el músculo ventricular, las vías accesorias, y el haz de His y sus ramas. Clase II: Son beta-bloqueantes como el propranolol, atenolol o el bisoprolol. Antagonizan los efectos del sistema nervioso simpático: disminuyen el automatismo y la velocidad de conducción, y aumentan el período refractario en los nodos sinusal y aurículoventricular. No actúan sobre las células Na + - dependientes. TRATAMIENTO Los agentes terapéuticos disponibles son los siguientes: o o o o o o Maniobras vagales o adenosina Antiarrítmicos Cardioversión o desfibrilación Marcapasos Desfibrilador implantable Ablación por radiofrecuencia Maniobras vagales o adenosina Como se dijo anteriormente, consisten en provocar un estímulo intenso del sistema parasimpático, que bloqueará el nódulo aurículoventricular. Clase III: Dentro de este grupo se encuentra el sotalol (que también pertenece a la clase II) y la amiodarona (que es mixto, mezcla acciones de todas las clases). Su mecanismo de acción consiste en el bloqueo de los canales de K +, con lo que aumentan los períodos refractarios de todas las estructuras y disminuyen el automatismo y la velocidad de conducción en los nodos sinusal y aurículo-ventricular. Clase IV: Son antagonistas de los canales de calcio como el verapamil o el diltiazem. Disminuyen el automatismo y la velocidad de conducción. También aumentan el período refractario en los nodos sinusal y aurículoventricular. No actúan sobre las células sodiodependientes. Cardioversión eléctrica o desfibrilación Consiste en la generación de una corriente eléctrica de alto voltaje, intensa y de corta duración aplicada sobre la superficie torácica. Se realiza con dos electrodos amplios o palas, A.A., E. G., R. C. A. García-Alberola 6
18 Arritmias I CARDIOLOGÍA CMG colocadas una en el lado derecho del esternón y la otra en la punta del corazón. Este mecanismo consta de tres pasos: poner en marcha, carga y descarga. Causa una despolarización simultánea y momentánea de la mayoría de células cardiacas, por lo que es terapéutico en aquellas arritmias cuyo mecanismo de producción es la reentrada. Dicho vulgarmente sería como resetear el corazón, como si se tratase de un ordenador. Marcapasos Es un dispositivo colocado a nivel subcutáneo que emite impulsos eléctricos periódicamente para comenzar la despolarización cardiaca. Actualmente no son dolorosos y mejoran mucho la calidad de vida. Los primeros modelos, alrededor de 1958, eran gigantes y terroríficos, una verdadera tortura para el paciente. Desfibrilador implantable Es similar al marcapasos, pero además es capaz de producir una descarga eléctrica en caso de parada cardiaca, con lo que trata arritmias potencialmente mortales de manera inmediata. Ablación por radiofrecuencia Técnica basada en el mismo mecanismo que el bisturí eléctrico. Genera una corriente de alta frecuencia que produce el aumento de la temperatura, lo que se usa en cirugía para producir hemostasia. En el caso de arritmias, se busca un punto crítico (un foco anormal, o una vía que produce un mecanismo de reentrada), se aplica la alta frecuencia y se calienta dicho punto. La alta temperatura lo quema y llega a necrosarlo, evitando así que continúe produciéndose la arritmia. El área de necrosis no supera unos milímetros. Es un tratamiento normalmente definitivo y con un riesgo de complicaciones bajo. A.A., E. G., R. C. A. García-Alberola 7
19 Arritmias II CARDIOLOGÍA CMG Arritmias II ES SUPRAVENTRICULARES, TAQUICAR- DIA SINUSAL, TAQUICARDIA AURICULAR CLASIFICACIÓN DE LAS ARRITMIAS Taquiarritmias Supraventriculares: Extrasístoles supraventriculares Taquicardias supraventriculares Fibrilación auricular Ventriculares: Extrasístoles ventriculares Taquicardia ventricular Flutter-fibrilación ventricular Bradiarritmias Bradicardia sinusal + bloqueos sinoauriculares disfunción sinusal Bloqueos aurículo-ventriculares Al margen de las arritmias arriba clasificadas, debemos recordar que el ritmo sinusal normal no es absolutamente estable. Existen oscilaciones en reposo. Un ejemplo de esta inestabilidad es la arritmia sinusal: Se trata de una condición en la que la frecuencia cardiaca varía con la respiración, es decir, aumenta en inspiración y disminuye en espiración. La arritmia sinusal suele aparecer comúnmente en niños o jóvenes. Frecuentemente, las personas adultas también pueden tenerla, aunque este fenómeno suele disminuir con la edad. Suele ser generalmente un fenómeno normal y no tiene por qué haber síntomas o problemas asociados a ella. También las hay no respiratorias. (Fig. 1, al final del tema, en la zona ECG ) ES SUPRAVENTRICULARES Entrando de lleno en el estudio de las arritmias supraventriculares, es decir, aquellas que necesitan de estructuras superiores al haz de His para mantenerse, comenzamos con las extrasístoles supraventriculares. Se puede definir una extrasístole como la alteración del ritmo cardiaco producida por un latido ectópico prematuro o adelantado con respecto al latido sinusal esperado. Dicho de manera más sencilla, es un latido anticipado. Cuando se producen a nivel auricular (o nodal, tipo especial que no trataremos) se conocen como supraventriculares y cuando lo hacen a nivel ventricular, ventriculares. Si encontramos una onda p anticipada, la extrasístole podrá ser considerada auricular (supraventricular). La morfología de esta onda p se asemejará en mayor medida a la de la p normal cuanto más cercano sea su foco de origen al nódulo sinusal. Si se encuentra a otro nivel, la morfología de dicha onda variará en función del origen. Según el origen, diferente en cada caso, se producirá un vector resultante de despolarización de las aurículas con magnitud, dirección y sentido distintos al que se deriva de la activación en el nódulo sinusal. Si la extrasístole supraventricular no encuentra al nódulo aurículo-ventricular (nodo) en periodo refractario, ésta se conducirá a los ventrículos dando un QRS estrecho igual al producido en ritmo sinusal. (Fig. 2) A.A., E. G., R. C. A. García-Alberola 1
20 Arritmias II CARDIOLOGÍA CMG Si por el contrario, la onda p aparece muy precozmente al anterior latido, se encontrará un nodo en periodo refractario que no conducirá. Veamos como se puede visualizar una extrasístole bloqueada electrocardiográficamente: ETIOLOGÍA Suelen darse en población normal. Casi el 100% de los ancianos a los que se les realiza un Holter de 24 h. las presentan. Son muy frecuentes. Aumentan su frecuencia de aparición factores tales como el estrés, el tabaco o el alcohol. También cualquier hecho que produzca sobrecarga auricular, la inflamación, la isquemia En la siguiente imagen podemos ver cómo afecta la diferencia de duración del periodo refractario de las ramas del haz de His en la conducción de las extrasístoles. Normalmente, la rama derecha del haz de His tiene un periodo refractario un poco más prolongado, esto puede producir lo que se denomina un bloqueo funcional de rama derecha. Ocurre cuando la despolarización que proviene de la extrasístole supraventricular alcanza al ventrículo cuando la rama izquierda ya ha acabado su periodo refractario, pero no lo ha concluído la derecha (concepto de aberrancia de conducción): CLÍNICA Los pacientes que presentan extrasístoles no suelen mostrar síntomas. En los casos en que aparecen, suelen estar definidos como un vuelco o una pausa, incluso como vuelco y pausa conjuntamente. Cuanto más frecuentes son las extrasístoles, más susceptibles son de mostrar clínica. Esto se da sobre todo en los casos de bigeminismo (serie compuesta por latido normal + extrasístole), trigeminismo (serie compuesta por 2 latidos normales + extrasístole), cuatrigeminismo También ocurre en casos de parejas, pareados o dobletes (estos tres términos son sinónimos) que son dos extrasístoles seguidas. Cuando aparecen seguidas 3 ó más extrasístoles se habla de taquicardia auricular no sostenida. Respecto a la exploración física, tras una extrasístole hay una pausa postextrasistólica. En ocasiones, debido a que la extrasístole tiene una diástole muy corta, se eyecta una cantidad muy pequeña de sangre y no existe pulso periférico en ese latido,. En estos casos sí se puede objetivar la pausa. De manera muy somera e infantil (además de poco válida y rigurosa, aunque bastante didáctica), la auscultación de una extrasístole sería algo como: pum, pum/ pum, pum/ pum, pupupum. DIAGNÓSTICO La sospecha diagnóstica proviene de la clínica y la auscultación, mientras que el diagnóstico definitivo se realiza con el ECG o un dispositivo Holter. A.A., E. G., R. C. A. García-Alberola 2
21 Arritmias II CARDIOLOGÍA CMG Significado clínico No tienen particular relevancia. Suelen ser benignas, con la excepción de que estén asociadas a alguna patología auricular más grave. En personas susceptibles pueden desencadenar taquicardias paroxísticas supraventriculares. TRATAMIENTO Generalmente no se tratan. Si el paciente es muy sensible a notarlas podrían emplearse beta-bloqueantes a dosis bajas que, aunque no disminuyen mucho la frecuencia de aparición de extrasístoles, sí disminuyen la sensibilidad del paciente. Sólo se deben administrar a pacientes muy quejicas. TAQUICARDIAS SUPRAVENTRICULARES Como ya hemos dicho, todo es normal excepto la frecuencia cardiaca. El QRS será estrecho siempre y cuando el paciente no presente un bloqueo de rama, en cuyo caso mostrará un QRS ancho. ETIOLOGÍA Cualquier proceso que aumente la demanda puede llevar a una taquicardia sinusal. Didácticamente podemos clasificar las taquicardias sinusales en causadas por: Procesos fisiológicos: Fenómenos estresantes como el ejercicio físico, la fiebre, o las emociones intensas producen este tipo de taquicardia por aumento de demandas. Patologías no cardiacas: Se han de buscar siempre debido a su trascendencia. Algunos ejemplos son el hipertiroidismo y el embolismo pulmonar. Patologías cardiacas: La insuficiencia cardiaca también puede ser una posible etiología de taquicardia sinusal, que se produce como mecanismo de compensación, y que puede ser el primer síntoma de la patología. Se clasifican de la siguiente forma: T Sinusal Auricular TAM-RAC (taquicardia auricular multifocal o ritmo auricular caótico) No paroxística de la unión AV Paroxística supraventricular Flutter o aleteo auricular AQUICARDIA SINUSAL Se trata de un ritmo sinusal acelerado, del orden de más de 100 lpm. Son importantes, aunque parezca obvio, las condiciones en las que se valora, puesto que factores como la fiebre, el ejercicio físico, etc. pueden propiciar su aparición sin que haya una causa de patología, cardiaca o no, subyacente. CLÍNICA Es importante la valoración del desencadenante. Normalmente, sea cual sea éste, la arritmia es no paroxística, ya que no tiene un comienzo brusco, sino que se instaura de manera gradual. DIAGNÓSTICO Para el diagnóstico de la taquicardia sinusal se emplea la clínica y el ECG. Es de gran utilidad el uso de las maniobras vagales o adenosina. El empleo de cualquiera de las dos provoca un enlentecimiento progresivo y transitorio de la frecuencia cardiaca para después volver a la frecuencia inicial (taquicárdica). Respecto a la adenosina, destacamos su efecto sobre el nódulo sinusal y el nodo AV, donde es frecuente que se produzcan bloqueos de ondas p. Su vida media es muy corta (unos 10 segundos). (Fig. 3) A.A., E. G., R. C. A. García-Alberola 3
22 Arritmias II CARDIOLOGÍA CMG TRATAMIENTO El tratamiento es el de la causa. Esto implica que no se debe intentar disminuir la frecuencia cardiaca sin conocer la causa subyacente porque probablemente el paciente necesite dicha frecuencia para mantener un gasto cardiaco adecuado, tal como ocurre en el caso de una insuficiencia cardiaca o un shock. T AQUICARDIA AURICULAR CONCEPTO Es una arritmia rápida que se produce en cualquier punto de las aurículas. MECANISMO Puede ser producida por: o o Automatismo: Una región (foco) adquiere automatismo. Reentradas: Alrededor de un obstáculo (vena pulmonar, vena cava ). ETIOLOGÍA Puede darse en corazones normales, aunque también puede aparecer como manifestación de cardiopatías que sobrecarguen la aurícula o estropeen el músculo auricular (valvulopatías, miocardiopatía dilatada, cardiopatía isquémica, EPOC ). Otra situación que puede ser causa de taquicardia auricular es la intoxicación digitálica. ECG Actividad auricular Respecto a la morfología de la onda p, será igual o distinta a la onda p sinusal según el origen o foco. Lo más frecuente es que sea distinta. La frecuencia cardiaca en esta arritmia oscila entre lpm. Conducción AV Una de las propiedades del nódulo aurículoventricular es la conducción decremental (cuando el tiempo transcurrido entre un estímulo y el siguiente es largo la conducción es rápida, y viceversa); por tanto, si la taquicardia auricular no es muy rápida, la conducción a nivel del nodo será 1:1 (todas la ondas p se conducirán a ventrículos). Si por el contrario, la arritmia es muy rápida, puede ocurrir que algunas ondas p sean bloqueadas (la distancia entre ondas p será constante pero estarán ausentes algunos QRS). En general, el intervalo PR será algo más largo porque, por poco que sea, se está estimulando el nodo más rápido de lo normal, con el retraso que eso conlleva (este retraso se manifiesta a nivel electrocardiográfico en la duración del PR). En conclusión, el ritmo ventricular podrá ser regular, en taquicardias no muy rápidas, e irregular o regular, en taquicardias con muy alta frecuencia. En taquicardias rápidas el ritmo ventricular puede ser regular en el caso de que siga un patrón de conducción periódico como 2:1 (se conduce una de cada dos ondas p), 3:1, 4:1 etc. (Fig. 4). Respuesta a maniobras vagales y adenosina Con el empleo de estas técnicas se observa que, en ocasiones, la arritmia desaparece. Esto sólo sucede en un pequeño porcentaje de casos, siendo lo más común que la taquicardia no responda a la adenosina aunque sí que se afecte la conducción en el nódulo aurículoventricular. Al suceder esto se pueden visualizar ondas p con un ritmo de aparición constante, a la misma frecuencia de la taquicardia (por ello decimos que la arritmia no responde a adenosina en estos casos) pero sin QRS que las sigan (por el bloqueo del nodo AV). Esto nos permite a menudo, aunque no se solucione el problema, tener una herramienta diagnóstica cuando, por ejemplo, la onda p se camufla en la onda T del latido anterior y se generan bastantes dudas acerca de si la taquicardia es auricular o no, al no poder verse con claridad las ondas p por una frecuencia demasiado alta. Al poner la adenosina, se bloquea el nodo A-V, desaparecen los QRS y se ven las ondas p que despejarán A.A., E. G., R. C. A. García-Alberola 4
23 Arritmias II CARDIOLOGÍA CMG cualquier tipo de incertidumbre sobre el origen del evento. (Fig.5) CLÍNICA Las taquicardias auriculares pueden presentarse como: o o o No paroxísticas: Aparecen gradualmente ( fenómeno de calentamiento ). Paroxísticas: Son menos frecuentes. Incesantes: Empieza, termina, empieza, termina, empieza, termina Y así de manera incesante, como su propio nombre indica. (Fig. 6) DIAGNÓSTICO Se debe realizar el diagnóstico diferencial con taquicardia sinusal en base a: Contexto clínico (sospecharemos que es sinusal cuando aparezca en situaciones de aumento de demanda). Morfología y frecuencia de la onda p (respecto a la frecuencia, podrá ser sinusal si no supera el valor 220-edad). Conducción AV (que será normal en la taquicardia sinusal y variará, según los criterios comentados anteriormente, en la taquicardia auricular). M. vagales / Adenosina (tienen diferentes respuestas respecto a estas técnicas). Llegados a este punto es interesante plantear la siguiente pregunta: Por qué en una taquicardia sinusal no hay alargamiento del intervalo PR o bloqueo de algunas ondas p y en la taquicardia auricular sí? La respuesta es que las catecolaminas responsables de la taquicardia sinusal afectan tanto al nódulo sinusal como al aurículoventricular, y así estimulan la conducción a través de éste también, además de aumentar el automatismo en el nódulo sinusal. En una taquicardia auricular no existe aumento de catecolaminas que ejerzan dicha estimulación, con lo que el nodo AV, debido a su característica conducción decremental, puede producir retardo del intervalo PR y bloqueo de algunas ondas P. TRATAMIENTO El tratamiento tiene dos variantes bien diferenciadas: tratamiento de la crisis y prevención de recurrencias, siendo necesarias ambas para realizar un tratamiento correcto. De la crisis Suspender el tratamiento digitálico si se sospecha como posible etiología la intoxicación digitálica. Frenar la respuesta ventricular mediante el uso de fármacos que afecten al nodo AV. Así la arritmia continúa, pero se normaliza la FC: o o Beta-bloqueantes (clase II). Antagonistas de los canales de Ca ++ (clase IV). Terminar con la taquicardia con antiarrítmicos tipo I, II ó III. También podemos probar con adenosina, aunque como se dijo antes en muy pocos casos es eficaz. Como última opción realizar una cardioversión sincronizada, que a menudo no resulta eficaz, puesto que sólo es útil en caso de que el mecanismo de producción sea por reentrada. Preventivo de recurrencias La prevención de futuras recurrencias puede abarcarse desde dos vías distintas: Antiarrítmicos de clase I, II ó III de forma crónica. Ablación por radiofrecuencia, como tratamiento curativo definitivo. A.A., E. G., R. C. A. García-Alberola 5
24 Arritmias II CARDIOLOGÍA CMG ZONA ECG Fig. 1: ECG de una arritmia sinusal. Se puede observar claramente la modificación de la FC que aparece con aumento de la FC en inspiración, y disminución con la espiración, lo que es totalmente fisiológico. Fig. 2: ECG en el que se muestran algunas extrasístoles que son conducidas (marcadas en su inicio con una flecha) al ventrículo. Vemos latidos regulares con aparición brusca de un latido adelantado, el cuál se corresponde con la extrasístole. Las dos primeras son un pareado o doblete. Fig. 3: ECG en el que se muestra la acción de la adenosina sobre una taquicardia sinusal. Como se indica con las líneas de color rojo existe un cambio progresivo enlenteciéndose la FC, el intervalo PR, y produciéndose bloqueo de algunas ondas p, por ejemplo la que se ve a la izquierda de la línea roja de la derecha. Posteriormente a esto retornará a una FC como la que tenía antes de la administración de adenosina, ya que la adenosina tiene una vida media muy corta. Fig. 4: Dos ECG en los que se ven ejemplos de taquicardia auricular con conducción 1:1 (arriba) y con conducción variable (abajo). En la imagen inferior están marcadas algunas ondas p con una flecha vertical negra (algunas marcadas están escondidas tras complejos QRS). Como A.A., E. G., R. C. A. García-Alberola 6
25 Arritmias II CARDIOLOGÍA CMG se aprecia las ondas p tienen un ritmo regular de aparición. Esto no pasa con los QRS, los cuales aparecen de manera irregular, cuando una de las ondas p es capaz de conducir. Fig. 5: ECG en el que se puede observar un ejemplo electrocardiográfico de uso de una maniobra vagal en una taquicardia auricular. El efecto es similar al producido por adenosina, proporciona ayuda diagnóstica normalmente. El efecto de la maniobra se encuadra entre las flechas. Fig. 6: ECG en el que se puede ver un ejemplo de taquicardia auricular incesante: A.A., E. G., R. C. A. García-Alberola 7
26
27 Arritmias III CARDIOLOGÍA CMG Arritmias III TAQUICARDIA AURICULAR MULTIFOCAL (O RAC), TAQUICARDIA NO PAROXÍSTICA DE LA UNIÓN AV, TAQUICARDIA PAROXÍSTICA SUPRAVENRICULAR TAQUICARDIA MULTIFOCAL AURICULAR La Taquicardia Auricular Multifocal (TAM), también conocida con el nombre de Ritmo Auricular Caótico (RAC), se fundamenta en la existencia de múltiples focos auriculares que emiten impulsos de forma irregular y desordenada, con una frecuencia variable, de cualquier valor >100 lpm, que raramente supera los 180 lpm. La definición electrocardiográfica de esta arritmia consta de 3 premisas: Ondas p de 3 ó más morfologías diferentes en ECG de superficie. Esto se explica por la multifocalidad de los focos. Intervalos PP y RR irregulares. El intervalo PP representa el ritmo auricular, y el RR, el ventricular. Ausencia de ritmo sinusal de base. Este criterio permite diferenciar esta entidad de la presencia de extrasístoles con focos diferentes. ETIOLOGÍA Lo más frecuente es que se asocie a EPOC, debido a que esta enfermedad produce sobrecarga auricular e hipoxia, y se trata con teofilina (broncodilatador) y/o β-estimulantes (por ejemplo el salbutamol), sustancias que participan en la génesis de esta taquiarritmia 1. Suele aparecer en ancianos con graves patologías respiratorias (como la EPOC ya comentada) o cardiacas, como la ICC (Insuficiencia Cardiaca Congestiva) en la fase de descompensación. CLÍNICA La clínica suele estar enmascarada por la enfermedad de base, es decir, el paciente cuenta su EPOC, su ICC, etc. DIAGNÓSTICO El diagnóstico es electrocardiográfico, teniendo en cuenta el diagnóstico diferencial con FA (fibrilación auricular). TRATAMIENTO Respecto al abordaje terapéutico del paciente con TAM lo esencial es mejorar la enfermedad de base. Para ello se deben corregir los desencadenantes, cesando la administración de teofilina, o corrigiendo el desequilibrio electrolítico (la hipopotasemia también se asocia esta entidad), o la hipoxia. Se han usado distintos fármacos al respecto como el verapamil (calcio-antagonista) o la amiodarona, pero su eficacia es dudosa. En referencia a la cardioversión, no es efectiva en ningún caso 2. (Fig. 1, zona ECG). 1 Más y más razones para no fumar. Carcinoma anaplásico de céls. gigantes, EPOC, IAM Vale, pero Alguien quiere tener un RITMO AURICULAR CAÓTICO?! 2 De ahí la importancia del diagnóstico diferencial con la FA, en la que sí es eficaz la cardioversión. A.A., E.G., R.C. A. García-Alberola 1
28 Arritmias III CARDIOLOGÍA CMG TAQUICARDIA NO PAROXÍS- TICA DE LA UNIÓN AV También conocida como Ritmo Nodal Acelerado, consiste en un ritmo generado en la unión aurículo-ventricular con una frecuencia que oscila entre 70 y 130 lpm. Pese a que el rango de valores de frecuencia cardiaca que define esta patología incluye algunas no consideradas como taquicardia (las que van de 70 a 100 lpm), se debe reflexionar sobre el nivel anatomofisiológico en el que se genera dicha arritmia. La razón por la que se encuadra en el grupo de las taquiarritmias es que el nódulo AV, cuya frecuencia de descarga normalmente se mueve en valores de lpm, genera aquí un ritmo de 70 a 130 lpm, produciéndose una taquicardia nodal. El mecanismo de producción de esta arritmia es un aumento del automatismo. ETIOLOGÍA Las etiologías más frecuentes son: IAM inferior en fase aguda Miocarditis Cirugía extracorpórea Intoxicación digitálica También puede aparecer en individuos sanos. ECG En cuanto a su manifestación electrocardiográfica existen dos posibilidades: 1. El nodo AV conduce a aurícula y ventrículo a la vez. Por esto la onda P suele quedar oculta tras el QRS. 2. Conduce únicamente al ventrículo y las ondas P siguen un ritmo sinusal (ritmos disociados). En general el ritmo ventricular es regular y el QRS estrecho (a no ser que exista bloqueo de rama concomitante). CLÍNICA Suele ser asintomática. TRATAMIENTO Nos hallamos ante una arritmia benigna que, por lo general, no requiere tratamiento. Únicamente se deben controlar los factores etiológicos. No debemos realizar cardioversión ya que sólo es eficaz en arritmias por reentrada, y esta arritmia se produce por aumento del automatismo. Ejemplos de ECG: Figs. 2 y 3. TAQUICARDIA PAROXÍSTICA SUPRAVENTRICULAR 3 Es una clasificación que incluye una miscelánea de entidades que tienen en común un inicio y terminación súbitos, y un mecanismo de producción por reentrada. La reentrada, en el 90% o más de los casos, es perinodal (taquicardia producida por reentradas nodales, o TRN) o por vía accesoria (taquicardia ortodrómica). En el 10% restante se corresponde con una taquicardia auricular 4. Este tipo de arritmias se asocian en general a corazón estructuralmente normal. Tipos de reentrada Como ya hemos visto con anterioridad los dos tipos principales son la reentrada perinodal y la reentrada por existencia de vía accesoria. Detallemos algo más estos dos conceptos: 1. Reentrada perinodal: La gran mayoría de las personas poseen únicamente una vía de conducción en el nodo AV, sin embargo, 3 Alberola dijo que las taquicardias paroxísticas supraventriculares siempre caen en el examen. 4 Recordemos del tema anterior que la taquicardia auricular puede también, en su forma de presentación, ser paroxística. A.A., E.G., R.C. A. García-Alberola 2
29 Arritmias III CARDIOLOGÍA CMG hay pacientes que poseen dos caminos funcionales de conducción: uno rápido, y otro lento. En el ritmo sinusal normal sólo utilizan la vía rápida, lo que impide la reentrada. Pero tras una extrasístole auricular, que alcance a la vía rápida en periodo refractario, el estímulo pasará ahora por la lenta, pudiéndose entonces generar una reentrada que conducirá anterógradamente por la vía lenta, y retrógradamente por la rápida. De este modo, el latido auricular retrógrado será simultáneo con el ventricular, y la onda P quedará escondida tras el QRS. En la siguiente imagen se puede ver gráficamente el mecanismo funcional normal del nódulo AV [figura A] y a continuación, el de una reentrada perinodal [figura D]: ECG El ECG muestra una arritmia regular, de QRS estrecho 6, a una frecuencia de 130 a 280 lpm donde la onda P, o está oculta tras el QRS, o se ve mínimamente (como en el ejemplo superior de la reentrada por vía accesoria). (Fig. 4) 2. Vía accesoria 5 : En situación normal, el músculo auricular y el ventricular están separados por un tejido fibroso (anillo fibroso) que impide la comunicación eléctrica entre ellos excepto a través del nódulo AV. La vía accesoria consiste en un haz muscular que se salta este tejido fibroso y produce una comunicación anómala aurículo-ventricular. Se trata de un defecto congénito. En la imagen mostrada a continuación (a la izquierda) se observan los haces musculares (en rojo) que atraviesan el anillo fibroso creando la vía accesoria. En la imagen de la derecha se puede observar el ciclo de reentrada con conducción por la vía accesoria (retrógradamente) y por el nodo AV (anterógradamente) y el ECG que se produce: CLÍNICA La taquicardia paroxística supraventricular puede aparecer a cualquier edad, incluso en el feto, siendo más frecuente su presentación en jóvenes con el corazón estructuralmente normal. Como su nombre indica es paroxística en su presentación, es decir, de inicio y terminación bruscos. A veces puede tener relación con maniobras autonómicas como respirar profundamente o levantarse después de agacharse. Son típicamente recurrentes, aunque este hecho es muy variable, al igual que su duración (puede prolongarse desde unos minutos hasta horas o días), y tolerancia (desde sensación de palpitaciones hasta síncope). Fuera de las crisis, el paciente se encuentra asintomático. DIAGNÓSTICO El diagnóstico variará según se disponga de un registro de ECG o no: 5 Sobre vías accesorias se hablará más extensamente en el próximo tema (Arritmias IV). 6 Y la coletilla de siempre: si no existe bloqueo de rama. A.A., E.G., R.C. A. García-Alberola 3
30 Arritmias III CARDIOLOGÍA CMG Con documentación de ECG Se puede establecer el diagnóstico con los criterios electrocardiográficos que se corresponden con la taquicardia paroxística supraventricular si se registra un ECG en el periodo de crisis. Sin documentación de ECG Si la taquicardia es bien tolerada por el paciente, sería conveniente que acudiese a hacerse un ECG en el mismo momento que detecte una crisis. No obstante, si el paciente se sincopa y tolera pobremente la arritmia, se debe realizar un estudio electrofisiológico preferente 7. Estos pacientes son tratados con frecuencia de ansiosos debido a que al realizar el ECG, éste no refleja ninguna alteración manifiesta fuera de las crisis. Por esto, es de especial relevancia poseer un mínimo de tacto y valorar correctamente al paciente, teniendo en cuenta la existencia de patologías como la que nos ocupa. TRATAMIENTO El tratamiento varía en función de que el paciente se encuentre en crisis o, por el contrario, se pretenda establecer una profilaxis de recurrencias. De la crisis En pacientes que presentan una mala tolerancia, lo que es bastante excepcional, el tratamiento más oportuno es la cardioversión eléctrica sincronizada de inmediato. Para aquellas personas cuya tolerancia sea aceptable, es decir, que no se sincopen ni tengan otro tipo de complicaciones ante la arritmia, se debe realizar un ECG de 12 derivaciones para, a continuación, realizar uno de los siguientes procedimientos: 7 Debería ser urgente, pero no existe la posibilidad, hoy en día, de hacer estudios electrofisiológicos urgentes. Esto es debido a la falta de personal, de infraestructura o o o Maniobras vagales como una respiración profunda o un masaje carotídeo. Debe considerarse que el masaje no se aplicará en caso de detectar un soplo en el cuello o si se sospecha o verifica una intoxicación digitálica. También puede realizarse una maniobra de Valsalva. Administración de adenosina (Adenocor ) en dosis de 6, 12 ó 18 mg (según se precise) en bolo, sin diluir y rápidamente. El motivo de esta forma de aplicación es que la vida media de la adenosina es de unos segundos y si se administrara paulatinamente no sería efectiva. Se comienza con 6 mg y si no es efectiva se va aumentando la dosis. La vía de aplicación es la intravenosa (procurar que sea una vena de gran flujo). Al inyectarla, el paciente sentirá una opresión en el pecho que durará unos 10 segundos (lo que tarda la adenosina en perder su efecto farmacológico). Es importante informar al paciente de lo que va a experimentar con el fármaco para evitar situaciones de ansiedad o miedo. En el caso de que el paciente no note dicha sensación de opresión pensaremos que no hemos administrado la suficiente cantidad, o la hemos administrado mal. Existen pocas contraindicaciones para la administración de la adenosina. Una de ellas son los pacientes asmáticos, en los que el fármaco produce broncoespasmo. Cuando la adenosina está contraindicada, se emplea como alternativa el verapamil. Este fármaco se presenta en ampollas de 5 mg. Suelen administrarse 1 ó 2 unidades por vía intravenosa. A diferencia de la adenosina se administra de forma lenta (la perfusión debe durar de 5 a 10 minutos). Tras el verapamil, repetiremos las maniobras vagales. Si la adenosina o el verapamil no funcionan, lo más probable es que el diagnóstico de taquicardia paroxística supraventricular sea erróneo, ya que estos fármacos son eficaces en casi el 100% de los casos. A.A., E.G., R.C. A. García-Alberola 4
31 Arritmias III CARDIOLOGÍA CMG El patrón electrocardiográfico normal de la aplicación de la adenosina es la terminación brusca de la arritmia, seguida de una parada o pausa que dura unos segundos tras la administración del fármaco, y la restauración del ritmo sinusal. En la zona ECG puede verse este patrón con un ejemplo real de la maniobra terapéutica (Fig.5). En caso de dar una dosis más alta de lo establecido respecto a la adenosina, los efectos indeseados que aparecerán en consecuencia serán prácticamente nulos debido a la escasa vida media de la sustancia. Preventivo de recurrencias 2 Ablación por radiofrecuencia: Es un tratamiento que sí es curativo y consiste, como ya ha sido comentado, en la introducción de un catéter por vía femoral y la ablación por radiofrecuencia de la estructura causante de la arritmia, calentando a unos ºC la vía accesoria o de reentrada perinodal hasta destruirla. La eficacia de la técnica ronda en torno al 90% y su tasa de complicaciones es menor al 1%. Este tratamiento se realiza en taquicardias mal toleradas, cuando no se controlan bien con fármacos o éstos tienen múltiples efectos secundarios, o por preferencia del paciente, si desea una opción curativa antes de recibir medicación de por vida. Ante todo, debe evaluarse la necesidad de dicho tratamiento. Por ejemplo, en un paciente anciano con periodo intercrítico prolongado y taquicardia bien tolerada no se precisa intervención alguna. En caso de establecerse un tratamiento existen dos alternativas: 1 Antiarrítmicos de perfil seguro (es decir, aquellos con mínimos efectos secundarios) como son los beta-bloqueantes o el verapamil, los cuales, no son curativos. Con éstos se controlan únicamente el 50% de los pacientes. A.A., E.G., R.C. A. García-Alberola 5
32 Arritmias III CARDIOLOGÍA CMG ZONA ECG Fig. 1: ECG de un paciente con taquicardia auricular multifocal o ritmo auricular caótico (TAM o RAC). Obsérvese la frecuencia irregular, tanto de los intervalos PP, como de los RR, y la irregularidad entre ellos. Si se analizan varias ondas p (círculos rojos), se puede observar cómo cada una posee una morfología diferente. Este hecho refleja la multifocalidad que da nombre a la arritmia. Como puede verse, no existe ritmo sinusal de base. Fig. 2 y 3: ECG de una taquicardia no paroxística de la unión aurículo-ventricular o ritmo nodal acelerado. En el primer caso existe conducción simultánea hacia aurícula y ventrículos, con lo que las ondas P son indistinguibles debido a que están camufladas tras el QRS. En el segundo ECG se puede observar un ritmo disociado en el que se muestran ondas P con ritmo sinusal (que son bloqueadas) y complejos QRS con un ritmo totalmente diferente. La etiología en este segundo caso puede ser la intoxicación digitálica, ya que se puede observar la clásica cubeta digitálica, que consiste en un segmento ST deprimido (señalado con una flecha). A.A., E.G., R.C. A. García-Alberola 6
33 Arritmias III CARDIOLOGÍA CMG Fig. 4: ECG de una taquicardia paroxística supraventricular. Se ve una arritmia regular, de QRS estrecho, a una frecuencia de unos 200 lpm donde las ondas P, o no se ven, o es muy difícil de verlas.. Fig. 5: ECG que muestra el patrón electrocardiográfico normal de la aplicación de la adenosina o de una maniobra vagal en una taquicardia paroxística supraventricular. Se ve como la arritmia termina de forma brusca, seguido esto de una parada o pausa que dura unos segundos y la restauración del ritmo sinusal. El efecto del tratamiento con administración de adenosina o maniobra vagal comienza en el momento indicado por la flecha: A.A., E.G., R.C. A. García-Alberola 7
34
35 Arritmias IV CARDIOLOGÍA CMG Arritmias IV PATRÓN DE PREEXCITACIÓN (WPW), FLUTTER O ALETEO AURICULAR VÍA ACCESORIA Una vía accesoria, como ya se vio en el tema anterior, es una banda de músculo cardiaco que, tras el desarrollo embriológico, queda conectando las aurículas y los ventrículos de manera anormal, en un punto donde el anillo fibroso no debería permitir el paso de ningún estímulo de despolarización. De este modo, no necesita del nódulo aurículo-ventricular para conducir hacia el ventrículo (cuando permite conducción anterógrada), y consecuentemente omite su habitual retraso en el paso del estímulo. Existen dos tipos de vías accesorias: Vías accesorias ocultas: Únicamente permiten una conducción retrógrada, de ventrículo a aurícula. Por ello, no producen cambios en el ECG en ritmo sinusal. Pueden producir taquicardias paroxísticas supraventriculares, como ya vimos en el tema anterior. Vías accesorias abiertas: Son capaces de conducir de manera anterógrada y retrógrada, es decir, de aurícula a ventrículo y viceversa. En este caso, el ECG en ritmo sinusal muestra una morfología característica llamada patrón de preexcitación. El lugar por el que conduce de aurícula a ventrículo es la ubicación de esta vía accesoria, en la imagen inferior señalada por las flechas. La conducción por el nódulo AV no deja de producirse, sino que ocurre posterior a la ocurrida por la vía accesoria. Por tanto, el patrón electrocardiográfico es consecuencia de la fusión que se produce entre la activación de los ventrículos a través de la vía accesoria y la activación de éstos por el nódulo AV y el sistema His-Purkinje. Este patrón se caracteriza por: (Figs. 1 y 2, zona ECG) o Disminución del intervalo PR (<0,12 sg) debido a la ausencia del retraso fisiológico que produce el nódulo AV. o Presencia de una onda delta (línea verde sobre el punteado en la figura), que consiste en una deflexión de la pendiente al inicio del complejo QRS, y un QRS ancho. o En ocasiones se puede ver afectada la repolarización: ondas T negativas PATRÓN DE PREEXCITACIÓN La presencia de una vía accesoria abierta propicia la posibilidad de que el ventrículo comience su despolarización antes de lo que sería habitual con una conducción a través del nódulo AV y en diferente lugar. A.A., E.G., R.C. A. García-Alberola 1
36 Arritmias IV CARDIOLOGÍA CMG SÍNDROME DE WOLFF-PARKINSON- WHITE (WPW) Encuadrado en las entidades que producen preexcitación, se encuentra el síndrome de Wolff-Parkinson-White. El término académico se refiere a un cuadro de preexcitación con presencia de taquiarritmias, aunque en la práctica se utiliza como sinónimo de preexcitación en general. Este síndrome fue descrito por tres pediatras (por ellos la denominación del mismo) en los años 50, ya que es la causa más frecuente de taquiarritmias en bebés y niños. A veces, las variaciones en el ECG pueden ser muy sutiles, debido a que el perfil de la onda delta depende del grado de discordancia entre la velocidad de paso de la vía accesoria y el nodo AV. Cuanto mayor es la discordancia, más aparente es la onda delta. Así, si la velocidad de paso es similar, el complejo QRS es prácticamente normal. En caso de un ECG dudoso existe la posibilidad de administrar adenosina, con la que se bloquea el nódulo AV temporalmente, y se hace más patente la onda delta. EPIDEMIOLOGÍA La incidencia de preexcitación en general es de 1 a 3 por cada mil nacimientos. ETIOLOGÍA Las vías accesorias son congénitas y casi siempre se asocian a corazón estructuralmente normal, aunque el patrón de preexcitación se puede asociar también a patologías como la enfermedad de Ebstein 1. CLÍNICA Asintomáticos: El diagnóstico se realiza por el hallazgo de forma casual en un ECG de rutina. Representan la ½ de los casos. 1 La enfermedad de Ebstein consiste en una implantación baja de la válvula tricúspide en el interior del ventrículo derecho, en vez de hacerlo a nivel del anillo auriculoventricular. Sintomáticos: Los síntomas pueden presentarse a cualquier edad. La clínica consiste en la presencia de arritmias: taquicardia paroxística supraventricular (la mayoría de las arritmias, aproximadamente un 80%, asociadas a preexcitación) o fibrilación auricular (FA, que representa del 15 al 20 %) 2. DIAGNÓSTICO Durante un episodio de taquicardia paroxística supraventricular el ECG de un corazón con vía accesoria abierta muestra las mismas características que el producido por una vía accesoria oculta: complejo QRS estrecho, ritmo rápido y regular y onda P invisible o difícil de diferenciar porque se oculta tras el complejo QRS. (fig. 3) En cambio, en ritmo sinusal podremos diferenciar entre vía accesoria oculta o abierta observando si existe patrón de preexcitación (onda delta etc.) o no. Si existen dudas administraremos adenosina para verificar la existencia de preexcitación. Taquicardias paroxísticas supraventriculares ortodrómicas y antidrómicas Cuando la taquicardia se produce por un mecanismo en el que la vía accesoria conduce retrógradamente, que es lo más frecuente, se denomina taquicardia ortodrómica. Pero también existe la posibilidad de un circuito inverso, que utilice el nódulo AV para pasar retrógradamente de ventrículo a aurícula, y la vía accesoria para la conducción anterógrada. Este tipo de taquicardia, denominada taquicardia antidrómica, es muy poco frecuente (por ello no vamos a entrar en detalles). Por qué es rara la taquicardia antidrómica? La razón es que el nódulo AV es una estructura fisiológicamente preparada para el paso de aurícula a ventrículo, y no al contrario, con lo que es raro el paso rápido retrógrado a través de él. 2 La FA se explicará extensamente en Arritmias V. A.A., E.G., R.C. A. García-Alberola 2
37 Arritmias IV CARDIOLOGÍA CMG Como podemos observar, el mecanismo de la taquicardia paroxística supraventricular es el mismo, ya sea generado por vías ocultas o por vías abiertas (pues en la inmensa mayoría de los casos son ortodrómicas). Recapitulando Aún a riesgo de resultar obstinadamente cansino, recapitulo lo concerniente a las taquicardias paroxísticas supraventriculares: Recordemos que se trataba de una clasificación que puede denominarse como cajón de sastre, en la que se incluían entidades, todas supraventriculares, con dos puntos básicos en común: comienzo brusco (paroxístico) y mecanismo de producción por reentrada. En cuanto a la clasificación de las taquicardias paroxísticas supraventriculares, existían tres tipos básicos: taquicardias auriculares con inicio paroxísitco (Arritmias II), taquicardias por reentrada nodal (Arritmias III), y taquicardias con reentrada por vía accesoria. Estas últimas incluyen las producidas por vías accesorias ocultas, que sólo permiten conducción retrógrada, y las producidas por vías accesorias abiertas, que producen patrón de preexcitación en ritmo sinusal debido a su capacidad para conducir anterógradamente. Recordemos que las vías accesorias abiertas podían dar clínica de taquiarritmias y entonces se encuadraban dentro del llamado síndrome de Wolff-Parkinson- White. Estas taquiarritmias pueden consistir en taquicardias paroxísticas supraventriculares (ortodrómicas o antidrómicas) o fibrilación auricular (Arritmias V). Fibrilación auricular en preexcitación Como ya señalamos con anterioridad, en los pacientes con preexcitación también es frencuente la fibrilación auricular (FA). Estos casos tienen especial relevancia, ya que la vía accesoria no posee la cualidad del nódulo AV de frenar la conducción ante un ritmo auricular acelerado (propiedad de conducción decremental). De este modo, en pacientes con FA y WPW pasará una gran cantidad de estímulos de aurícula a ventrículo, lo que puede desembocar en una fibrilación ventricular, y ésta a su vez en una muerte súbita. La muerte súbita es muy poco frecuente en estos casos, se da sobre todo en jóvenes (es raro que ocurra en la enfermedad de Ebstein). También existen vías accesorias incapaces de conducir tan rápido (tienen mayor periodo refractario) y no producen esta circunstancia. En el ECG de WPW con FA se observa una frecuencia cardiaca extremadamente rápida, irregular (RR irregulares) y caótica, y un complejo QRS ancho, que suele ser de duración variable, dependiendo del lugar por el que se produzca la conducción. (Fig. 4) Dada la secuencia: Fibrilación aurícular Fibrilación ventricular Parada cardiaca Muerte súbita, el resultado ECG está expuesto en la fig. 5. TRATAMIENTO Como siempre, diferenciaremos entre el tratamiento de la crisis y el tratamiento para prevenir las recurrencias: De la crisis Si existe taquicardia paroxística supraventricular: El mismo tratamiento que el visto en el tema anterior (Arritmias III, pág. 4). Si el paciente nos comunica que tiene una vía accesoria, nos ahorraremos las maniobras y técnicas diagnósticas. Recordemos resumidamente que el tratamiento en situación de mala tolerancia consistía en la cardioversión sincronizada, y con buena tolerancia en maniobras vagales o adenosina. Si existe FA con preexcitación: Se dan 2 situaciones diferentes: A.A., E.G., R.C. A. García-Alberola 3
38 Arritmias IV CARDIOLOGÍA CMG o o Mal tolerada: Se realiza una cardioversión eléctrica sincronizada, es decir, realizada sobre la onda R, lo que previene que la cardioversión se efectúe sobre la repolarización, provocando una fibrilación ventricular. La cardioversión no sincronizada sólo se utiliza para la fibrilación ventricular, ya que en ésta no hay ondas R definidas. Bien tolerada: Se intenta tratar con antiarrítmicos. Lo que nos interesa en la FA común es enlentecer el paso por el nodo AV para disminuir la frecuencia ventricular. Sin embargo, ante la existencia de una vía accesoria lo que buscamos son fármacos que actúen sobre el músculo, enlenteciendo el paso por la vía accesoria, y así también la frencuencia ventricular. Fármacos que cumplen este requisito son los antiarrítmicos tipo I (AAI), como la flecainida, que actúan sobre la musculatura auricular, ventricular, el haz de His y la vía accesoria. Si nos halláramos ante una fibrilación auricular sin preexcitación, la trataríamos con digoxina o verapamil, que retrasan el paso del estímulo por el nódulo aurícula ventricular, lo que reduce las posibilidades de que derive en una fibrilación ventricular. Obviamente estos fármacos están radicalmente contraindicados en WPW con FA. F asintomático no se suele hacer la ablación. LUTTER AURICULAR El flutter o aleteo auricular es una taquicardia supraventricular que se produce por un mecanismo de reentrada alrededor de la válvula tricúspide, como se puede ver en la imagen inferior, es una reentrada auricular derecha. En el fondo no es más que una taquicardia auricular que presenta características singulares, con un ECG muy llamativo: (Fig. 7) No se observa línea isoeléctrica. Ondas F o en diente de sierra, con una frecuencia de 250 a 350 lat. por minuto. QRS estrecho. Ritmo ventricular regular o irregular, según la conducción del nódulo AV. Preventivo de recurrencias En preexcitación sintomática: o La ablación por radiofrecuencia de la vía accesoria es de primera elección. Es un método que consigue la curación permanente. (Fig. 6) En preexcitación asintomática: o o Pacientes de alto riesgo, como deportistas de alta competición, pilotos, bomberos o policías se debe hacer ablación. De hecho, para ellos es condición necesaria para recibir la capacitación profesional. También existe la posibilidad de tratarlos con fármacos AAI, pero no sería lo más adecuado. En el resto de casos se debe individualizar la valoración. Si el paciente supera los 35 ó 40 años y se encuentra A continuación podéis ver dos imágenes ejemplificadoras de la singularidad electrocardiográfica del flutter auricular con respecto a una taquicardia auricular, en la cual existe línea isoeléctrica y no hay ondas F. La frecuencia de la taquicardia a nivel auricular es de 250 a 350 ondas F por minuto. Por otra parte, en cuanto a la frecuencia ventricular, A.A., E.G., R.C. A. García-Alberola 4
39 Arritmias IV CARDIOLOGÍA CMG ésta dependerá de la conducción por el nódulo AV, que podrá conducir de forma irregular o regular (una conducción cada dos ondas F, 2:1, cada tres, 3:1 etc.). La frecuencia ventricular suele ser de unos 150 lpm debido a que la conducción más frecuente es la 2:1. ETIOLOGÍA El flutter auricular suele aparecer asociado a dilatación o sobrecarga de la aurícula derecha (como en una enfermedad pulmonar crónica), sin embargo, también puede darse en un corazón normal. CLÍNICA Es más frecuente en edades avanzadas. La tolerancia es variable, ya que puede que la FC sea incluso normal si la conducción del nódulo AV es poco eficaz. Aún así, la conducción más usual, como se dijo antes, es la 2:1. El riesgo embólico es similar al de la fibrilación auricular, ya que la aurícula nunca llega a contraerse del todo y esto produce cierto estasis de sangre que favorece la coagulación. EXPLORACIÓN FÍSICA El pulso puede ser regular o irregular, según la conducción del nódulo AV. Se pueden visualizar ondas auriculares en el pulso yugular (unas 300 veces por minuto). DIAGNÓSTICO DIFERENCIAL Ante una taquicardia de 150 lpm podemos pensar en una taquicardia paroxística supraventricular o en un flutter. Los diferenciaremos según sea su respuesta a las maniobras vagales o a la administración de adenosina. En ambos casos se bloquea el nódulo AV. En efecto, el creciente enlentecimiento y bloqueo a nivel del nódulo AV nos ayudará a determinar con más claridad la presencia de ondas F o en diente de sierra. Además, en el caso de las taquicardias paroxísticas supraventriculares, las maniobras vagales o la adenosina servirán de tratamiento y resolverán la arritmia, mientras que el flutter auricular no remitirá. (Fig.8) TRATAMIENTO Una vez más, diferenciaremos entre el tratamiento de la crisis y el tratamiento cuyo objetivo es la prevención de recurrencias. De la crisis Mal tolerada: No es lo habitual. Se realiza una cardioversión sincrónica con energías bajas ( J 3 ). De este modo se revierten prácticamente el 100% de los casos. Bien tolerada: En este caso el objetivo es el control de la frecuencia cardiaca. Se deben utilizar fármacos que disminuyen la conducción por el nódulo AV, como los antagonistas del calcio, los β-bloqueantes o la digoxina, aunque en muchos casos no son efectivos. Quitar un flutter con fármacos es muy difícil. Los únicos fármacos realmente efectivos, que producen cardioversión química, son algunos del grupo de los antiarrítmicos tipo III (como el ibutilide), no comercializados en España 4. La cardioversión eléctrica sincronizada es de elección en los casos de menos de 48 horas de evolución, o si se ha anticoagulado correctamente durante cuatro semanas, para evitar la suelta de émbolos. Preventivo de recurrencias Si se trata del primer episodio recurrente y es bien tolerado, podemos no hacer nada. Esto dependerá de la edad y situación basal del paciente. La otra alternativa es realizar una ablación por radiofrecuencia. Si es el segundo episodio o el primero y es mal tolerado, se realizará una ablación por radiofrecuencia entre la vena cava inferior y la válvula tricúspide (istmo cavotricuspídeo). Si se prevén recidivas y el paciente no ha querido someterse a una ablación, se mantendrá, al igual que en la FA, la anticoagulación. 3 El profesor comentó que ante la duda de si es flutter o FA (que requiere mayor energía) se le arrea con cardioversión de alta energía que seguro que se le quita 4 Qué tipical spanish esto de no tener lo más máximo, lo más último y más mejor Eso sí, vacunas de cáncer de cervix sin efectividad probada para prevenir el cáncer de cervix para todos, eh? Que no falte. A.A., E.G., R.C. A. García-Alberola 5
40 Arritmias IV CARDIOLOGÍA CMG ZONA ECG Fig. 1 y 2: Patrones de preexcitación: En las siguientes figuras vemos dos ECG con ritmo sinusal y patrón de preexcitación: QRS ancho con onda delta, intervalo PR corto y posibilidad de alteración de la repolarización: onda T negativa (no presente en la imagen superior). La onda delta es más aparente en la imagen inferior (flecha en DI, tras el PR corto), posiblemente debido a la mayor discordancia entre la velocidad de paso por el nódulo AV y por la vía accesoria en este ECG, ya que el ritmo es más lento, y el nódulo AV conduce con menor velocidad. A.A., E.G., R.C. A. García-Alberola 6
41 Arritmias IV CARDIOLOGÍA CMG Fig. 3: En este ECG podemos ver un patrón de preexcitación en ritmo sinusal que desemboca en una taquicardia paroxística supraventricular en el punto señalado por la flecha. Como se puede ver, a partir de ese punto se pasa de un QRS ancho (por la preexcitación con onda delta) a un QRS estrecho durante la taquicardia. En la taquicardia se esconde la onda P tras el QRS. Fig. 4: En el siguiente ECG podemos observar un WPW con FA. Como se observa, el ritmo es totalmente anárquico (los intervalos RR nunca son iguales), obviamente no hay onda P (característica típica de la FA), y la frecuencia es extremadamente elevada, debido a que la conducción se salta el nódulo AV y su capacidad de conducción decremental. Esta situación es muy peligrosa, como se puede ver en la Fig. 5. A.A., E.G., R.C. A. García-Alberola 7
42 Arritmias IV CARDIOLOGÍA CMG Fig. 5: Estamos en este ECG ante una situación preocupante. La FA (en la imagen B) en este paciente con WPW produce una taquicardia de enorme FC que termina en fibrilación ventricular (FV) en C, estadio que es preliminar a la muerte súbita. El tratamiento urgente en la FV es una cardioversión eléctrica no sincronizada. En la imagen A (lo explico para que no os liéis pero no hay que saberlo), se trata de una taquicardia paroxística supraventricular con bloqueo de rama derecha (que se caracteriza por QRS ancho y morfología rsr : la r es la primera onda positiva del complejo de activación ventricular, después viene una onda negativa, S, y después una positiva de mayor amplitud, R ). Para más info ver tema de ECG de la comisión de PG Fig. 6: Ejemplo de tratamiento con ablación por radiofrecuencia. Este tratamiento es tan increíblemente maravilloso que podemos ver claramente cómo antes de la ablación de la vía accesoria existe QRS ancho con onda delta, y después aparece un QRS estrecho. La destrucción de la vía accesoria se realiza aproximadamente en el momento indicado por la flecha, y el primer QRS tras ella ya, casi como por arte de magia, es estrecho. A.A., E.G., R.C. A. García-Alberola 8
43 Arritmias IV CARDIOLOGÍA CMG Fig. 7: ECG de un paciente con flutter auricular, con QRS estrecho, sin línea isoeléctrica observable, con sus características ondas F, y un QRS cada dos ondas F, es decir, una conducción 2:1. Fig. 8: En este ECG podemos observar la respuesta del flutter auricular del paciente ante la administración de adenosina. El efecto comienza a aparecer en el momento indicado por la flecha, y vemos cómo los QRS se distancian entre sí (se enlentece el paso por el nódulo AV y se bloquean algunos estímulos), prevaleciendo las ondas F. Cuando el efecto de la adenosina finaliza, el flutter auricular vuelve a aparecer como antes de la administración. P.D.: Fijaos dónde se realiza el tratamiento por ablación en el flutter auricular: en el lugar de acceso más estrecho y cómodo, entre la desembocadura de la vena cava inferior y la válvula tricúspide. A.A., E.G., R.C. A. García-Alberola 9
44
45 Arritmias V CARDIOLOGÍA CMG Arritmias V FIBRILACIÓN AURICULAR I NTRODUCCIÓN La fibrilación auricular (FA) es la arritmia de mayor trascendencia y de mayor frecuencia en la clínica habitual. Se produce por una activación desordenada, irregular, y muy rápida de la aurícula, que impide su actividad mecánica eficaz. La conducción a los ventrículos es irregular, por lo que el ritmo ventricular será también irregular y habitualmente rápido 1. En el ECG tiene una forma de presentación singular, con las siguientes características: (Figs. 1 y 2): No se observa línea de base. En su lugar, aparecen las denominadas ondas f, 2 que tienen una frecuencia de aparición tremendamente alta y son difícilmente contables (normalmente superan las 350 por minuto). El ritmo ventricular es muy irregular, lo que se puede observar comparando los intervalos RR. El QRS es estrecho 3, ya que la ola de despolarización sigue el sistema de conducción normal. La frecuencia ventricular dependerá de la conducción por el nódulo AV. Sin tratamiento, puede variar de unos 120 lpm hasta superar los 200 lpm si la conducción por el nódulo AV es muy eficaz (por ejemplo con alta presencia de catecolaminas). 1 Esta incoordinada actividad cardiaca ya llevó a los antiguos a denominar a la FA como delirium cordis. 2 NUNCA debemos confundir las ondas F del flutter auricular (tema anterior) con las ondas f de la FA. 3 Con la coletilla de siempre: Si no existe bloqueo de rama. E PIDEMIOLOGÍA Como ya hemos dicho, la FA es la taquiarritmia más relevante, ya que se da con mucha frecuencia. La sufre el 0,4 % de la población general. Su prevalencia aumenta con la edad: 0,1 % en menores de 55 años. 4 % en mayores de 70 años. 10 % en mayores de 85 años. Presenta alta prevalencia en pacientes con cardiopatías, en especial en insuficiencia cardiaca congestiva. Tiene gran importancia sanitaria por las siguientes características: o o o o o Tiene alta prevalencia. Tiene alta tasa de complicaciones graves. Es predictor independiente de mortalidad. Origina más ingresos hospitalarios que cualquier otra arritmia. Consume una importante cantidad de recursos sanitarios. M ECANISMO Actualmente, existen dos hipótesis que intentan explicar el mecanismo de producción de la FA: 1 Hipótesis de reentradas múltiples Esta hipótesis explica la génesis de la FA mediante la existencia de gran cantidad de reentradas coexistentes, que chocan entre sí produciendo un cambio constante en la actividad eléctrica auricular. A.A., E.G., R.C. A. García-Alberola 1
46 Arritmias V CARDIOLOGÍA CMG Esta hipótesis se ve apoyada por el hecho de que la cardioversión eléctrica es eficaz para su tratamiento 4. Otro hecho que apoya esta hipótesis es que la aparición de FA en las distintas especies va en relación con el tamaño del corazón 5. Así, en especies con el corazón pequeño, como son gatos o ratas, la FA es muy rara, mientras que en animales con corazón de mayor tamaño, como es el caballo, la FA es muy frecuente. En la imagen inferior se ve una ilustración de las múltiples reentradas que según esta hipótesis generarían la FA: sos. Sin embargo, esta hipótesis no explica la eficacia de la cardioversión eléctrica como tratamiento, ya que ésta sólo es eficaz en arritmias por reentrada, y no en arritmias por aumento del automatismo. En la imagen inferior se muestra el foco que produce la FA en la región de desembocadura de las venas pulmonares (PV s) y su posterior conducción: 2 Hipótesis focal Esta hipótesis se basa en la existencia de un foco en el que la frecuencia de despolarización es muy elevada. Este foco no deja el tiempo necesario al resto del tejido auricular para que se repolarice adecuadamente. De este modo, la conducción no será homogénea, se fragmentará, y producirá la fibrilación auricular. Esta hipótesis se abandonó a principios de los 90, pero en los últimos años está cobrando importancia debido a la aparición de diversos estudios que han puesto de manifiesto el papel de las venas pulmonares como foco disparador de la FA. Esto ha motivado el desarrollo de técnicas de ablación por radiofrecuencia, dirigidas a los anillos de desembocadura de estos vasos, que han demostrado ser efectivas en un alto porcentaje de los ca- 4 Recordemos que la cardioversión eléctrica sólo es eficaz para el tratamiento de arritmias producidas por reentrada. 5 Un corazón de mayor tamaño tiene mayor cantidad de músculo auricular, y así mayor susceptibilidad a la generación de múltiples reentradas en él. Como nada es negro ni blanco, y la FA no es una excepción, en la actualidad se piensa que ambas hipótesis tienen algo de razón, de tal modo que, existiría un foco con un ritmo de estimulación muy rápido, el cual sería la causa de las reentradas múltiples. Esta explicación aúna ambas hipótesis y da plausibilidad teórica al hecho de que sean eficaces tanto la cardioversión eléctrica, como la ablación de un foco específico. ETIOLOGÍA Las causas que producen esta arritmia son muy heterogéneas y numerosas. Se asocia a: 1 Sobrecarga o dilatación auricular de causa cardiaca: o Cardiopatía valvular o Insuficiencia cardíaca o Isquemia (con o sin infarto de miocardio) o Miocardiopatías (dilatada o hipertrófica) o Cardiopatía hipertensiva o Cardiopatías congénitas o Patología pericárdica o Situación post-cirugía cardíaca A.A., E.G., R.C. A. García-Alberola 2
47 Arritmias V CARDIOLOGÍA CMG 2 Causas extracardiacas: Causas metabólicas y tóxicas: o o Hipertiroidismo Consumo de alcohol, tanto crónico como agudo 6 Otras enfermedades extracardiacas pueden producir FA: infecciones, neoplasias y enfermedades del tejido conectivo. 3 Enfermedades eléctricas del corazón: o Síndrome de Wolff-Parkinson-White (como ya se comentó en Arritmias IV) o Enfermedad del nodo sinusal 4 Sobrecargas auriculares de causa extracardiaca: o o EPOC Embolia pulmonar 5 Otras causas: o o o o o Hipertonía vagal. FA familiar, en la que debemos pensar cuando aparece en niños. Factores físicos, como pueden ser la electrocución o el trauma torácico. Picaduras de diversos animales como escorpiones o serpientes. Un largo etc. Incluso existen pacientes que se provocan la FA mentalmente 7 F ISIOPATOLOGÍA La fisiopatología se puede dividir en dos puntos de vista diferentes, según sus efectos: Efecto hemodinámico Las alteraciones de la fisiología normal con repercusión hemodinámica son las siguientes: El ritmo ventricular es rápido e irregular, debido a la sobreexcitación anárquica que sufre la aurícula. Esta sobreexcitación produce consecuentemente un aumento en el consumo de oxígeno por parte del miocardio. Se pierde la contribución de la contracción auricular al llenado ventricular debido a que ésta es desordenada e ineficaz. Esto es muy relevante en situaciones de dificultad de llenado, como es la hipertrofia ventricular. Efecto sobre la coagulación Como ya se ha comentado en repetidas ocasiones, la FA produce una contracción anárquica de la aurícula que provoca irremediablemente cierta estasis sanguínea, sobre todo en la orejuela. El remanso de sangre pone en marcha los mecanismos de coagulación y da pie a la generación de futuribles émbolos. Aunque en el 70% de los casos existe alguna causa objetivable, en el 30% no se encuentra causa, y se denomina FA idiopática. 6 Existe el llamado síndrome del holiday heart, producido por el consumo agudo de alcohol en fines de semana o vacaciones, que se manifiesta con arritmias como la FA (he encontrado artículos que también asocian el consumo de cannabis con este síndrome). No es extraño que algunos pacientes aparezcan un lunes con FA por este hecho sin que exista ninguna repercusión. Así que estad al loro si tenéis que haceros un ECG en lunes y no os asustéis si no os veis la línea isoeléctrica. 7 Por último y a modo de curiosidad, ya que ahora somos todos expertos preventivólogos, decir que en el estudio Framingham se encontraron los siguientes factores de riesgo para la FA: la edad, la enfermedad valvular cardíaca, la insuficiencia cardíaca congestiva, la hipertensión arterial y la diabetes. C LÍNICA La tolerancia de los pacientes con esta arritmia puede ser muy diversa, ya que puede variar desde un paciente asintomático a una parada cardiaca. Los síntomas pueden ser los siguientes: o o o o Palpitaciones, sobre todo cuando es una FA aguda. Astenia o cansancio, por la falta de funcionalidad. Insuficiencia cardiaca congestiva, que puede llevar a edema agudo de pulmón. Dolor torácico de tipo anginoso. A.A., E.G., R.C. A. García-Alberola 3
48 Arritmias V CARDIOLOGÍA CMG o o Síntomas relacionados con bajo gasto: síncope, mareos Embolias, que pueden aparecer como primera manifestación de la FA. Presentación clínica La presentación clínica de la FA es muy caprichosa y la nomenclatura referida a sus tipos de presentación clínica es difícil de manejar: A. El primer episodio aparece un buen día y puede no continuar, siendo un episodio aislado, esto ocurre si es secundario a una causa aguda que cesa. Ejemplos de episodios aislados son aquellos secundarios a un infarto de miocardio, o una pericarditis. Pero si la FA continúa tras este primer episodio, podemos encontrarnos ante: B. Una FA recurrente, que puede ser: I. Paroxística: Dura horas o días y tiene un comienzo y un final definidos y bruscos. Puede finalizar espontáneamente o merced a un tratamiento con fármacos o cardioversión eléctrica (CVE). II. Persistente: Se prolonga durante días o semanas. Con una CVE podemos recuperar el ritmo sinusal, pero es común que se reinicie la FA tras pasar algo de tiempo. Así, puede derivar a una FA crónica. C. Una FA crónica o permanente, la cual se prolonga meses o años, pudiendo permanecer de por vida. La CVE, en este caso, no es efectiva, pues no recupera el ritmo sinusal, y si lo recupera, pronto es sustituido de nuevo por FA. Exploración física Datos específicos de FA, dejando al margen los clásicos relacionados con el bajo gasto, son: Pulso irregular y de frecuencia relativamente alta. Fenómeno del déficit de pulso, que consiste en la ausencia de algunos latidos al tomar el pulso radial o pedio, debido a intervalos RR cortos a expensas de diástoles muy cortas que no permiten un llenado ventricular mínimo que haga evidente el latido en la periferia. Por esto, no debemos fiarnos del pulso periférico, y sí de la auscultación central, para determinar la frecuencia ventricular en la FA. D IAGNÓSTICO Es sencillo mediante ECG (fig. 3, 4 y 5) cuando nos encontramos al paciente durante una crisis. Sin embargo, el diagnóstico se complica cuando: La FA se presenta con una frecuencia ventricular muy alta, por ejemplo en una situación de ejercicio físico con la conducción por el nodo AV aumentada por las catecolaminas, ya que será complicado ver la irregularidad en el ritmo 8. Hay un bloqueo del nódulo AV completo, ya que el ritmo irregular y rápido no llegará al ventrículo y la actividad caótica se limitará a la aurícula. Mientras, el ventrículo funcionará con el marcapasos de emergencia, a ritmo nodal (40-45 lpm). En ocasiones, existen gran cantidad de ondas, y más organizadas aparentemente que en la FA clásica. Así, nos podemos confundir con las ondas en diente de sierra del flutter. Es tanta la similitud, que se ha definido una entidad intermedia llamada fibriloflutter, que en realidad no existe: si las ondas auriculares son regulares estamos ante un flutter, y si son irregulares ante una FA. 8 Se debe utilizar un compás para comprobar la irregularidad en el ritmo en el ECG. A.A., E.G., R.C. A. García-Alberola 4
49 Arritmias V CARDIOLOGÍA CMG En caso de duda, se pueden realizar las maniobras vagales o administración de adenosina para bloquear momentáneamente el nódulo AV y observar más claramente el ECG. Diagnóstico etiológico Una manera de abordarlo es a través de la anamnesis, sobre todo centrándonos en las cardiopatías y el consumo de alcohol 9. El ecocardiograma nos ayuda a descartar cardiopatías estructurales, y el análisis de las hormonas tiroideas a descartar un hipertiroidismo. Se realizarán otras pruebas complementarias enfocadas según la anamnesis: por ejemplo, si sospechamos preexcitación: prueba electrofisiológica etc. zar sólo para el control de FA aguda, ya que a largo plazo ocasiona graves efectos adveros). También podemos bloquear el nódulo AV mediante ablación, pero este método sólo se utilizará en casos extremos, para una FA crónica no controlada. Tras la ablación deberemos colocar un marcapasos para que se mantenga un ritmo normal en el ventrículo. 2 Restaurar el ritmo sinusal Se puede conseguir mediante: Cardioversión eléctrica sincronizada, con una energía de 300J. Es la más eficaz, pero no es útil en pacientes crónicos porque tienen la aurícula muy dilatada. Cardioversión farmacológica T RATAMIENTO Control de la frecuencia cardiaca 2. Restaurar el ritmo sinusal 3. Prevención de recurrencias 4. Profilaxis de las complicaciones embólicas 1 Control de la frecuencia cardiaca Debemos procurar la mejora hemodinámica del paciente aunque la aurícula siga fibrilando. Comenzaremos bloqueando el nódulo AV, aumentando su periodo refractario, para que la frecuencia ventricular se mantenga más o menos normal. Se puede conseguir este objetivo con terapia farmacológica, con antiarrítimicos (AA) que inciden sobre el nódulo AV como β- bloqueantes, calcio-antagonistas (como el verapamil o el diltiazem), digital (aunque no lo incluimos en los AA, tiene cierta acción de frenado, aunque es menos eficaz que los anteriores), amiodarona (AA tipo III, se debe utili- 9 Debemos preguntar por cualquier tipo de consumo reciente, ya que hasta únicamente dos cervezas pueden provocar FA en una persona sensible. 10 Aunque el tratamiento se divida en cuatro apartados, es sólo para hacerlo más masticable didácticamente, ya que se deben tratar todos conjuntamente. Con AA tipo I como la flecainida o la propafenona. La propafenona tiene un efecto más rápido (unas horas), por lo que se empleará en urgencias y en domicilio en caso de crisis frecuentes 11. Con AA tipo III como la amiodarona. Su efecto es lento, tardando de días a semanas en actuar. 3 Prevención de recurrencias Es diferente si el corazón es estructuralmente normal o si existe cardiopatía: A. Corazón normal : En el caso de que el corazón sea estructuralmente normal, podemos administrar antiarrítmicos de clase I, como la flecainida o la propafenona. También AA de clase III, como el sotalol. La amiodarona es más potente, pero es poco aconsejable debido a sus efectos secundarios a largo plazo. B. Corazón con cardiopatía: evitaremos los AA I. En cuanto al sotalol deberemos valorar la situación, ya que no se puede utilizar en caso de miocardiopatía hipertrófica. La amiodarona es el único fármaco seguro, pero da problemas a largo plazo. 11 Los AA tipo I NUNCA se deben utilizar en enfermos con cardiopatía isquémica, ya que aumentan la probabilidad de muerte súbita. A.A., E.G., R.C. A. García-Alberola 5
50 Arritmias V CARDIOLOGÍA CMG Si el paciente es refractario a los AA debemos proceder con una ablación por radiofrecuencia del foco que origina la FA. A pesar de tener entre un 70 y un 80% de eficacia en corazón sin cardiopatía, es un proceso que está aún en desarrollo debido a la dificultad que conlleva: se debe evitar el tránsito eléctrico desde las venas pulmonares hacia la aurícula izquierda ablacionando cada anillo de desembocadura con ayuda de un soporte tecnológico que nos pinte la electrofisiología de la zona en discordia. El procedimiento es dificultoso y peligroso ya que puede originar estenosis de la vena pulmonar 12. En la imagen inferior se observa un estudio electrofisiológico donde se ven los cuatro anillos de desembocadura de las venas pulmonares, los cuales debemos ablacionar. horas antes de realizar una cardioversión eléctrica para ver si la FA termina espontáneamente, o podemos cardiovertir directamente sin esperar. Si la FA comenzó hace más de 48 horas y no existe anticoagulación crónica existe riesgo de suelta de émbolos, por lo que se le anticoagulará durante un mes para luego practicarle una cardioversión diferida, cuando presumiblemente ya se han disuelto los trombos formados. Ahora, para los amantes de los algoritmos, presentaremos unos cuantos dedicados al manejo del paciente con FA: Tratamiento del episodio agudo Nos encontramos con un paciente que tiene un episodio agudo FA. Lo primero que debemos hacer es valorar la estabilidad hemodinámica: Si no está estable se debe proceder a una cardioversión eléctrica. Esto es muy poco frecuente. Si la hemodinámica permanece estable, controlaremos la frecuencia cardiaca (con mayor o menor urgencia según la gravedad del paciente) y comenzaremos la anticoagulación para evitar embolias: Si la FA se ha iniciado hace menos de 24 ó 48 horas o está anticoagulado de forma crónica, podemos esperar En el HUVA actualmente no se realiza este procedimiento, aunque Alberola nos ha comentado que los Reyes Magos le han traído esta navidad la tecnología necesaria para la ablación en FA, y que quizás este verano comiencen a realizar esta fabulosa intervención. A largo plazo en FA recurrente En pacientes con FA recurrente, a largo plazo, se pueden seguir dos estrategias (individualizaremos según el paciente y el hospital): Estrategia A Consiste en intentar mantener el ritmo sinusal con AA o ablación. Se utilizará en pacientes jóvenes, a los que esperamos que les queden muchos años de vida. Estrategia B En este caso asumimos que el paciente tendrá FA de por vida, y nos conformaremos con controlar la frecuencia cardiaca con AA como los β-bloqueantes, verapamil o diltiazem. Esta pauta se suele seguir en pacientes ancianos con difícil reversión al ritmo sinusal. A.A., E.G., R.C. A. García-Alberola 6
51 Arritmias V CARDIOLOGÍA CMG Curiosidades sobre los anticoagulantes orales... Para terminar el tema, y de manera distendida, comentaremos algunas curiosidades sobre los anticoagulantes orales inhibidores de la vitamina K, los dicumarínicos: 4 Profilaxis de las complicaciones embólicas Aplicaremos anticoagulación para poder realizar la cardioversión, eléctrica o farmacológica, sin riesgos de embolia. Para ello debe existir anticoagulación, con INR>2 13 al menos 3 ó 4 semanas antes de la cardioversión. Se realiza mediante la adminitración de anticoagulantes orales, como los dicumarínicos (antagonistas de la vitamina K), como el acenocumarol (Sintrom ). Se debe mantener al paciente con anticoagulación aunque se mantenga en ritmo sinusal al menos hasta un mes después de la cardioversión. En cuanto a la anticoagulación crónica en una persona con FA, se emplea cuando el paciente tiene uno o más factores de riesgo embólico mayores o cuando posee dos o más factores de riesgo moderado. Los factores de riesgo embólico se clasifican de la siguiente manera: o o Alto riesgo: (1 ó más) Embolia previa Estenosis mitral reumática Prótesis valvular mecánica Riesgo moderado: (2 ó más) Edad > 75 años HTA ICC Función VI deprimida (FE < 35 %) Diabetes mellitus Si el paciente sólo posee un factor de riesgo moderado, se valorará su situación y se pautará anticoagulación o tratamiento con ácido acetilsalicílico (AAS). Los dicumarínicos, como tantos otros fármacos, tienen un origen vegetal. Veamos cómo se llegó a su descubrimiento: En los años 20 se describe en Canadá y EE UU la enfermedad del trébol dulce fermentado, que afectaba al ganado bovino y ovino alimentado con dicho producto en mal estado, produciendo hemorragias digestivas. A partir de este hecho, y viendo que el problema subyacente a esta patología estaba relacionado con alteraciones en la coagulación, un avispado científico, Paul Karl Link consigue en 1941 aislar el dicumarol, un compuesto volátil (es el olor que notamos al cortar la hierba) y comienza a tratar con esta sustancia a pacientes con patología trombótica. En 1953, Link con un grupo de alumnos desarrolla la warfarina, otro anticoagulante oral muy utilizado actualmente en el mundo anglosajón, cuyo nombre son las siglas de Wisconsin Alumnae Research Foundation Coumarin. Por último ya -y no menos simpático- es que varios compuestos del grupo de las cumarinas, son usados como raticidas desde hace años, provocando la muerte de los roedores por hemorragias internas que ocurren varios días después de la ingesta del producto, lo que permite que el resto de ratas tomen el raticida sin asociar la muerte de sus congéneres con él. 13 El INR es International Normalized Ratio, que tiene la misma utilidad que el tiempo de protrombina, y su valor normal es 1. A.A., E.G., R.C. A. García-Alberola 7
52 Arritmias V CARDIOLOGÍA CMG ZONA ECG Fig. 1 y 2: Ejemplos típicos de ECGs con FA: En ambos (especialmente en el inferior) se ve claramente, sin necesidad de utilizar un compás, cómo la distancia entre las ondas R (intervalo RR) es irregular. Además se ven las otras características principales de la FA: como la ausencia de línea isoeléctrica (ondas f, más aparentes en el ECG inferior) o el QRS estrecho. Además, en la figura inferior se trata de un episodio agudo, donde podemos observar el ritmo sinusal anterior y posterior, y el inicio y final de la FA señalados ambos por las flechas. A.A., E.G., R.C. A. García-Alberola 8
53 Arritmias V CARDIOLOGÍA CMG Fig. 3: En la siguiente imagen tenemos 3 ECGs diferentes con FA. La diferencia más sustancial entre ellos es la velocidad de conducción del nódulo AV. En el tercer ECG es muy dudoso el diagnóstico de FA, debido a que la frecuencia ventricular es muy alta. Sería conveniente en este caso la administración de adenosina o la realización de una maniobra vagal para enlentecer el paso por el nódulo AV y así ver mejor la irregularidad de los intervalos RR y la ausencia de línea isoeléctrica (como en las otros dos ECGs). Fig. 4: En estos ECG volvemos a ver FA. En la 2ª imagen llama la atención la espiga correspondiente a la estimulación producida por un marcapasos (obsérvese la regularidad en las espigas, algunas señaladas por flecha). El marcapasos colocado para solucionar un bloqueo AV completo en la pared ventricular derecha provoca que la despolarización comience en un lugar diferente al fisiológico, lo que provoca un bloqueo de rama izquierda funcional (debido a que el estímulo no utiliza la vía más eficaz de conducción, las ramas del haz de His, y la despolarización izquierda es más lenta), y consecuentemente un QRS ancho que es fácilmente observable en la imagen. A.A., E.G., R.C. A. García-Alberola 9
54
55 Arritmias VI (A) CARDIOLOGÍA CMG Arritmias VI (A) TAQUIARRITMIAS VENTRICULAR ENTRICULARES ES: EXTRASÍSTOLES VENTRICULARES Nota de comisionistas La sección de taquiarritmias ventriculares se dio en clase en clase y media, con lo que aparece en las diapositivas de Arritmias VI y mitad de las de Arritmias VII. La otra mitad de estas últimas corresponde a la primera mitad de bradiarritmias, que se terminaron en la mitad de la siguiente clase (en las diapositivas Arritmias VIII). La otra mitad de las diapositivas de Arritmias VIII corresponde a marcapasos, DAI y muerte súbita. En la comisión, para que haya más coherencia a la hora de estudiar lo hemos dividido en: Arritmias VI (Taquiarritmias ventriculares, en 3 partes, A, B y C, porque es muy gordo), Arritmias VII (Bradiarritmias), y Arritmias VIII (Marcapasos, DAI y muerte súbita). TAQUIARRITMIAS VENTRICULARES Las taquiarritmias ventriculares, aquellas que se generan sin la participación de estructuras superiores al haz de His, son de tres tipos: Extrasístoles ventriculares (EV ó ESV) Taquicardia ventricular (TV ó TCV) Fibrilación ventricular (FV) Ánimo! EXTRASÍSTOLES VENTRI- CULARES Las extrasístoles ventriculares no son más que, como sucede a nivel supraventricular, latidos anticipados, que en este caso tienen origen en el miocardio ventricular. Sus características electrocardiográficas principales son: (Fig. 1, zona ECG) QRS ancho: Ya que el estímulo no sigue el camino más eficaz de despolarización, y ésta se hace más lentamente. Ausencia de onda P precedente: Porque el origen del latido extra se produce en el ventrículo. Pueden aparecer aisladas o de forma repetitiva (recurrentes). (Fig. 2) Al igual que ocurría en las extrasístoles supraventriculares, se pueden observar fenómenos de bigeminismo, trigeminismo, etc., así como pareados o dobletes (cuando aparecen dos seguidas). Sin embargo, cuando se producen 3 ó más latidos ventriculares de manera consecutiva hablamos de taquicardia ventricular no sostenida, de forma equivalente a la taquicardia auricular no sostenida en las supraventriculares (Arritmias II). En cuanto al foco de génesis de las extrasístoles, si es siempre el mismo, la morfología electrocardiográfica será la misma, produciéndose EV monomorfas. Cuando las extrasístoles son originadas en distintos puntos se denominan EV polimorfas. A.A., E.G., R.C. A. García-Alberola 1
56 Arritmias VI (A) CARDIOLOGÍA CMG Fenómeno R sobre T (R/T): Consiste en la aparición de una EV en la cúspide de una onda T o al inicio de la misma. Se puede visualizar en la monitorización de una isquemia aguda por IAM y puede ser causa de arritmia maligna (fibrilación ventricular). El diagnóstico diferencial entre extrasístole supraventricular con aberrancia de conducción (bloqueo funcional de rama derecha) y extrasístole ventricular puede generar problemas, ya que ambas son latidos extra con QRS ancho. La diferencia entre éstas es la presencia de onda P en la ES supraventricular. Todas estas variantes y consideraciones de las EV serán ilustradas para su correcta comprensión en la zona ECG. (Figs. 3, 4 y 5) ETIOLOGÍA Suelen aparecer en personas con un corazón normal, y su frecuencia de aparición aumenta con la edad, sobre todo en mayores de 65 años. También pueden producirse debido a: a) Causas funcionales como el estrés, el embarazo o la falta de sueño. b) Irritación miocárdica debida a alteraciones electrolíticas, cirugía, enfermedades infecciosas, fármacos, tabaco, alcohol... c) Afectación miocárdica debida a cardiopatía isquémica, miocardiopatías, miocarditis, hipertrofia ventricular izquierda, valvulopatías, etc. CLÍNICA En relación a los síntomas que el paciente puede referir, lo más frecuente es que los afectados sean personas totalmente asintomáticas o que dicen sentir palpitaciones, aisladas o frecuentes. Si las extrasístoles son continuas (por ejemplo un bigeminismo incesante) pueden llegar a originar una taquimiocardiopatía. En cuanto a los signos que se pueden presentar en la exploración física, tanto el pulso periférico como la auscultación, son similares a los de las extrasístoles supraventriculares. Además, se puede hallar un segundo ruido desdoblado en el latido extrasistólico. SIGNIFICADO CLÍNICO En personas con un corazón normal, la presencia de extrasístoles ventriculares carece de valor pronóstico. En caso de cardiopatía isquémica (IAM), las EV son de valor pronóstico negativo cuando son frecuentes, y se asocian a baja FEVI 1. Sin embargo, en otras cardiopatías el valor pronóstico independiente es dudoso. MANEJO DEL PACIENTE CON EV Para tener una visión rápida y sencilla del manejo del paciente con EV, véase el siguiente algoritmo: Si se observa el esquema superior, se puede ver que las EV no son lo primordial, lo es la patología cardiaca de base. En caso de cardiopatía estructural no se deben tratar las extrasístoles, sino únicamente la patología de base. Además los antiarrítmicos de clase I están totalmente contraindicados, ya que aumentan el riesgo de muerte súbita. Si no existe cardiopatía estructural y las EV son frecuentes y producen síntomas, se puede plantear el tratamiento con β-bloqueantes, lo que normalmente resuelve el cuadro, o incluso un tratamiento con ablación por radiofrecuencia. 1 Fracción de eyección del ventrículo izquierdo. A.A., E.G., R.C. A. García-Alberola 2
57 Arritmias VI (A) CARDIOLOGÍA CMG ZONA ECG Fig. 1: ECG con una extrasístole ventricular. Obsérvese la extrasístole, señalada por la flecha vertical, que no va precedida de onda P (la deflexión positiva que la precede es la onda T del latido anterior) y posee un QRS ancho. (No os emparanoyéis con las flechas horizontales que hay, ya que son para explicar otra cosa que nosotros no tenemos que saber.) Fig. 2: Extrasístoles ventriculares repetitivas. Extrasístoles señaladas con flecha. Fig. 3: Bigeminismo en el contexto de EV. Como vemos se alterna un latido normal (QRS estrecho) con una EV (QRS ancho, flecha vertical) y una pausa posterior (intervalo con flecha horizontal) de manera constante. A.A., E.G., R.C. A. García-Alberola 3
58 Arritmias VI (A) CARDIOLOGÍA CMG Fig. 4: De arriba a abajo: Bigeminismo, pareados, TVNS, EV polimorfos y fenómeno R/T. BIGEMINISMO PAREADOS: Dos EV seguidas. TVNS (Taquicardia Ventricular No Sostenida), ya que son 3 o más latidos ventriculares seguidos. EV POLIMORFOS. Vemos que ambas EV señaladas por flechas son de diferente morfología. FENÓMENO R SOBRE T (R/T): Una EV que aparece durante la deflexión de la onda T. Fig. 5: Diferencia entre extrasístole supraventricular con aberrancia y extrasístole ventricular. Como vemos en la imagen de la izquierda la ES-SV va precedida de onda P (señalada por flecha). A.A., E.G., R.C. A. García-Alberola 4
59 Arritmias VI (B) CARDIOLOGÍA CMG Arritmias VI (B) TAQUIARRITMIAS VENTRICULARES ENTRICULARES: TAQUICARDIAS VENTRICULARES MONOMÓRFICAS TAQUICARDIA VENTRICULAR Una taquicardia ventricular (TV) se trata de una arritmia rápida que se mantiene en los ventrículos. Las taquicardias ventriculares se dividen, según su morfología, en monomórficas y polimórficas, como se observa en el siguiente esquema. A su vez, las monomórficas se clasifican, según su grado de perpetuación, en no sostenidas (cesan) y sostenidas (se mantienen en el tiempo). Las polimórficas sólo pueden ser no sostenidas, porque si alguna se transformase en sostenida, ya no hablaríamos de una taquicardia ventricular sino de una fibrilación ventricular. TV MONOMÓRFICA NO SOSTENIDA Consiste en la sucesión de 3 ó más latidos ventriculares consecutivos, con una duración menor de 30 segundos. (Figs. 6 y 7) En general es una arritmia asintomática. Se produce normalmente en corazón con cardiopatía. Es rara en corazón normal. Tiene un significado pronóstico negativo en: o o o Enfermedad coronaria con disfunción ventricular, como un IAM con fracción de eyección baja. Miocardiopatía hipertrófica. En otras cardiopatías no es indicador pronóstico independiente, es decir, se asocia normalmente a peor pronóstico porque suele presentarse en corazones con cardiopatía, pero no tiene valor pronóstico por sí misma. El tratamiento se centra en la enfermedad de base, sin atender específicamente a la arritmia. TV MONOMÓRFICA SOSTENIDA Se trata de un ritmo ventricular rápido con una duración mayor de 30 segundos o que provoca la necesidad de terminarla antes por mala tolerancia. Electrocardiográficamente muestra QRS ancho, con un ritmo regular y una frecuencia que oscila entre 120 y 250 lpm. (Fig. 8) El diagnóstico se puede hacer con la presencia de una de las siguientes situaciones: disociación AV, capturas y fusiones, aunque su ausencia no tiene ningún valor diagnóstico. Expliquemos detenidamente estos últimos tres conceptos. (En zona ECG figs. 9, 10 y 11) Disociación aurículo-ventricular Se muestra en el ECG con QRS anchos y rápidos (llevan el ritmo de la taquicardia ventricular) y ondas P a un ritmo totalmente diferente marcado por el marcapasos fisiológico (ritmo sinusal). A.A., E.G., R.C. A. García-Alberola 1
60 Arritmias VI (B) CARDIOLOGÍA CMG Como ya se comentó antes: Si aparece disociación AV TV monomórfica sostenida. Si no aparece, también podría haberla, ya que, como se dijo, la ausencia no tiene valor diagnóstico. (Fig. 9) Capturas En el ECG de un paciente con una TV monomórfica sostenida con ritmo auricular independiente, si uno de los estímulos generados en el nódulo sinusal consigue conducir a los ventrículos, se verá un QRS estrecho que se intercala entre el resto de QRS anchos. Dicho de otra manera, una onda P se cuela por el nodo aurículo-ventricular 1 y así conduce a ventrículos, dando un QRS estrecho aislado. (Fig. 10) La presencia de capturas también es diagnóstica de TV monomórfica sostenida, ya que ningún otro mecanismo electrofisiológico razonable 2 produce algo así. Fusiones Se trata de una situación parecida a la anterior, en la que se cuela un estímulo auricular y, en este caso, se fusiona el QRS de éste con el producido por el ritmo ventricular, de tal modo que aparece un QRS entre ancho y estrecho. (Fig. 11) Diagnóstico diferencial con taquicardia supraventricular + bloqueo de rama En algunas ocasiones se puede establecer una duda diagnóstica en la que se baraje la posibilidad de una taquicardia ventricular monomórfica sostenida, frente a la de una taquicardia supraventricular con bloqueo de rama, debido a que ambas entidades son similares en el ECG. En estos casos, la manera correcta de actuar es la siguiente: Si es un paciente con cardiopatía se considerará taquicardia ventricular. Esta consideración es un acierto en el 95% de los casos, y este porcentaje es francamente difícil de superar por otros medios diagnósticos. Si es un paciente sin cardiopatía (que es raro) se puede plantear la administración de adenosina. La taquicardia ventricular no se verá afectada por el freno impuesto en el nodo AV por la adenosina. En caso de duda, debemos actuar como si se tratase de una taquicardia ventricular. IMPORTANTE: El grado de tolerancia del paciente no es un criterio diagnóstico. Muchas veces se confunde bien tolerado con supraventricular y mal tolerado con ventricular. Esto es un error. * Siempre que sea posible se debe buscar un ECG anterior del paciente en ritmo sinusal para poner en evidencia el posible bloqueo de rama. ETIOLOGÍA Las etiologías de esta arritmia, por orden de frecuencia, son: o o o o 60% por cardiopatía isquémica de larga evolución, es decir, infarto crónico. Es rara en fase aguda del infarto. 20% por miocardiopatías no isquémicas tales como miocardiopatía dilatada o miocardiopatía hipertrófica. 10% por otras miocardiopatías (valvulares, congénitas ). 10% asientan sobre un corazón estructuralmente normal. 1 Cuando se dice que se cuela una onda P, en realidad es una forma gráfica de decir que se conduce, a través del nodo, un impulso eléctrico auricular. La onda P es una entidad electrocardiográfica que no se cuela por ningún sitio. 2 Alberola comentó lo de mecanismo razonable porque dice que existen mecanismos muy muy exóticos descritos en el apasionante mundo de la electrofisiología. MECANISMO El mecanismo de producción más frecuente es la reentrada. En la imagen inferior, que corresponde a un estudio electrofisiológico, se puede observar la presencia de dos áreas necróticas (zonas grises) y un área de músculo funcional entre ambas, el cual haría las A.A., E.G., R.C. A. García-Alberola 2
61 Arritmias VI (B) CARDIOLOGÍA CMG veces de camino de conducción lenta en la génesis de la reentrada. (Ver Arritmias I). CLÍNICA Los síntomas más frecuentes son el dolor torácico, la disnea, los relativos al bajo gasto, palpitaciones 3 Pueden degenerar en fibrilación ventricular y de ahí, entrar en muerte súbita. La exploración física puede basarse en la búsqueda de signos de bajo gasto (poco fiable), y la evidencia de disociación aurículoventricular. PRONÓSTICO Si el paciente presenta cardiopatía es preocupante, ya que existe un alto riesgo de recurrencias y de muerte súbita. Si no existe cardiopatía (que es raro, menor del 10%), generalmente es benigna. TRATAMIENTO De la crisis Debe realizarse bajo monitorización y con disponibilidad de reanimación cardiopulmonar (RCP) avanzada. Se hará siguiendo las siguientes pautas: o o Si la tolerancia a la arritmia es mala, se practicará una cardioversión eléctrica (CVE) sincronizada. Basta con aplicar unos 50 Julios. Si el paciente tolera bien la arritmia, tenemos dos opciones: - Hacer directamente una CVE y no probar con fármacos, aunque la tolerancia sea buena. - Tratar con antiarrítmicos como procainamida o amiodarona. La procainamida es un antiarrítmico de clase I y no es útil para tratamientos crónicos. Como el paciente está monitorizado, podemos permitirnos este tratamiento, pero si la situación se complica, se seda y se cardiovierte sin más dilación. Preventivo de las recurrencias En pacientes con cardiopatía, si es mal tolerada y/o presentan una FE (fracción de eyección) baja, se colocará un desfibrilador automático implantable (DAI). Si la tolerancia es buena, al igual que la FE, se practicará una ablación, cuya efectividad es menor que en las taquicardias supraventriculares. Para los pacientes sin cardiopatía, la ablación será el tratamiento de elección. TV MONOMÓRFICAS ESPECIALES (RIVA) El RIVA, siglas provenientes de Ritmo Idio- Ventricular Acelerado, es una taquicardia ventricular lenta, es una arritmia que tiene muy poco que ver con el resto de taquicardias ventriculares. Se mueve en frecuencias entre 100 y 120 lpm. Se produce por un mecanismo automático (al contrario que las anteriores, cuyo mecanismo era predominantemente la reentrada). (Fig. 12) 3 Las palpitaciones son raras, suelen aparecer en los pocos casos de TV monomórfica sostenida en jóvenes sin cardiopatía, ya que en pacientes con cardiopatía no aparecen normalmente. A.A., E.G., R.C. A. García-Alberola 3
62 Arritmias VI (B) CARDIOLOGÍA CMG Su etiología se corresponde con: o o o Fase aguda del IAM (sobre todo en el momento de la reperfusión). Post-cirugía extracorpórea (CEC). En individuos normales con un tono vagal elevado. Generalmente es un proceso asintomático que no requiere tratamiento. TV MONOMÓRFICAS IDIOPÁTICAS Existen varios tipos característicos que se corresponden con la descripción de taquicardia ventricular monomórfica idiopática. (Fig. 13) El mecanismo de producción de estas arritmias puede ser por automatismo anormal o por reentrada. La clínica es generalmente de buena tolerancia. A veces, pueden presentarse como un proceso incesante y algunas pueden ser sensibles a catecolaminas. Presentan un buen pronóstico, salvo que la arritmia se produzca con demasiada frecuencia y genere una taquimiocardiopatía. El tratamiento de elección es la ablación, aunque también se puede dar tratamiento farmacológico con β-bloqueantes. A.A., E.G., R.C. A. García-Alberola 4
63 Arritmias VI (B) CARDIOLOGÍA CMG ZONA ECG Fig. 6 y 7: Taquicardias ventriculares monomórficas no sostenidas. Se trata de episodios de taquicardia ventricular monomórfica que terminan espontáneamente antes de 30 segundos. El inicio y el final de las mismas están señalados con flechas. Fig. 8: Taquicardia ventricular monomórfica sostenida. Como vemos, la morfología que producen los latidos es constante, debido a que el foco (lugar donde se produce la reentrada) no cambia. A.A., E.G., R.C. A. García-Alberola 5
64 Arritmias VI (B) CARDIOLOGÍA CMG Fig. 9: Disociación aurículo-ventricular en una taquicardia ventricular monomórfica sostenida. El ritmo auricular va marcado en círculos azules y el ventricular en cuadrados rojos. Como vemos, no van a la par. Fig. 10: Captura en taquicardia ventricular monomórfica sostenida. En la zona marcada con la flecha se observa un QRS estrecho, resultado de la captura. Fig. 11: Fusión en taquicardia ventricular monomórfica sostenida. En las zonas que marcan los puntos rojos, se han fusionado el QRS del ritmo sinusal y el del ritmo ventricular y aparece un QRS de morfología entre ancho y estrecho. A.A., E.G., R.C. A. García-Alberola 6
65 Arritmias VI (B) CARDIOLOGÍA CMG Fig. 12: RIVA (Ritmo IdioVentricular Acelerado). Taquicardia ventricular lenta ( lpm). Inicio y final señalados con flechas. Fijaos en que las ondas P van despareciendo, el QRS se ensancha y la repolarización se altera, mientras que el ritmo no cambia apenas. Además, el primer latido ventricular tras el inicio de la arritmia es algo que hemos estudiado en este tema. A ver piensa... QRS entre ancho y estrecho, y aparece onda P antes y está señalado con flecha oblicua... (pág. 2 del tema ) Fig. 13: Taquicardia idiopática: Presentación en rachas (para diferenciar las rachas del ritmo sinusal ver QRS ancho y ausencia de onda P como siempre). A.A., E.G., R.C. A. García-Alberola 7
66
67 Arritmias VI (C) CARDIOLOGÍA CMG Arritmias VI (C) TAQUIARRITMIAS VENTRICULARES ENTRICULARES: TAQUICARDIAS VENTRICULARES POLIMÓRFICAS Y FIBRILACIÓN VENTRICULAR TV POLIMÓRFICA Recordemos que la TV polimórfica SIEMPRE es no sostenida, ya que, de no serlo, se hablaría de una fibrilación ventricular (FV). (Fig. 14) Este tipo de arritmia puede asentar sobre un corazón que presente una cardiopatía estructural, en cuyo caso será similar a una taquicardia ventricular monomórfica no sostenida. También puede aparecer en pacientes con un corazón aparentemente normal, en cuyo caso hablaremos de canalopatías. CANALOPATÍAS Las canalopatías son enfermedades genéticas de los canales iónicos, es decir, un grupo de enfermedades congénitas (con agrupación familiar obviamente) asociadas a la presencia de mutaciones en los genes que codifican las subunidades de los canales iónicos. Estos canales son estructuras extremadamente complejas que se encuentran embebidos en la membrana celular, y que regulan las cargas iónicas entre el exterior y el interior celular. Estas enfermedades no sólo afectan al corazón, ya que existen canalopatías, según el gen afectado, que producen procesos de muy diversa índole como epilepsia, parálisis muscular, diabetes, fibrosis quística Se pueden manifestar en niños o jóvenes, aunque algunas de ellas se manifiestan más tardíamente. 1 1 En el QT largo congénito subyace una alteración en los canales de potasio o de sodio de las células miocárdicas que afecta a la repolarización. En Estados Unidos se estima que afecta a una de cada personas, produ- Respecto a la clínica, se presentan como arritmias ventriculares tales como la taquicardia ventricular polimórfica o la fibrilación ventricular, pudiendo llevar a síncope e incluso a muerte súbita. El diagnóstico inicial suele establecerse en base a una sospecha clínica de síncopes recurrentes o de antecedentes familiares de síncope o muerte súbita y por supuesto, como en todas las arritmias, mediante el ECG. A nivel cardiaco, hay dos formas típicas de canalopatías que serán explicadas con más detalle a continuación: Síndrome de QT largo. Síndrome de Brugada. SÍNDROME DE QT LARGO Se da cuando el QTc (QT corregido para la frecuencia cardiaca) es mayor de 450 milisegundos. (Fig. 15) El QTc se calcula del siguiente modo: En ocasiones son muy llamativos, pero otras veces no lo son tanto y hay que medir meticulosamente. El diagnóstico de sospecha se establece en: o Síncopes recurrentes, especialmente en niños, asociados a esfuerzo (frecuente en natación) o estrés (típico del ciendo cada año hasta muertes inesperadas en niños y adultos jóvenes. A.A., E.G., R.C. A. García-Alberola 1
68 Arritmias VI (C) CARDIOLOGÍA CMG o estrés auditivo como, por ejemplo, el despertador). También están asociados a sordera congénita. Antecedentes familiares de síncope o de muerte súbita. Hay varios tipos de QT largo (8 ó 9, aunque los tipos 1, 2 y 3 cubren hasta el 95% de los casos), según el canal iónico afectado. UN POQUITO DE HISTORIA. En 1957 Jervell y Lange Nielsen describieron un síndrome hereditario muy raro, con una incidencia alrededor de 1-6 casos por millón, caracterizado por sordomudez congénita, síncopes de repetición tras esfuerzos o emociones, alta probabilidad de muerte súbita y prolongación del intervalo QT en el ECG. Posteriormente, Romano en 1963 y Ward en 1964, describieron otro síndrome similar al anterior, pero sin sordomudez. En la década de los 80, se identifican los patrones de herencia distintos para estas dos enfermedades, y a partir de entonces en el síndrome del QT largo pueden distinguirse dos formas: a- Síndrome de Jervell y Lange Nielsen, con presencia de sordomudez y que se transmite de forma autosómica recesiva. b- Síndrome de Romano Ward, sin sordomudez y que se transmite mediante herencia autosómica dominante. Hay que decir que 1/3 de los pacientes permanecen asintomáticos durante toda su vida. FIN DE UN POQUITO DE HISTORIA Síndrome de QT largo adquirido Estos pacientes presentan un ECG basal normal, sin prolongación del segmento QT. Consiste en la suma de QT largo + arritmias que se produce por un desencadenante como: o o o Bradicardias: Como el bloqueo AV de tercer grado (Arritmias VII). Alteraciones electrolíticas: Como la hipokaliemia o la hipomagnesemia. Fármacos (hasta 100 ó 150 fármacos pueden provocarlo): - Antiarrítmicos: La quinidina fue el primer antiarrítmico de clase I que se utilizó. Producía el llamado síndrome quinidínico que es un torsades de pointes. - Antibióticos como los macrólidos. - Antihistamínicos como la terfenadina. - Psicotrópicos: Como los antidepresivos tricíclicos. 2 Para más información, visitar: Esta canalopatía predispone a la aparición de arritmias ventriculares que pueden desembocar en muerte súbita, como la FV o la "torsades de pointes" (significa literalmente torcedura de las puntas), que es una taquiarritmia ventricular polimórfica potencialmente amenazante, que aparece típicamente en presencia de un intervalo QT prolongado. En ella podemos observar que las puntas de los complejos QRS van cambiando, por encima y por debajo de la línea isoeléctrica indistintamente. (Fig.16) 2 Además de las vistas, se puede producir por un largo etcétera de situaciones, entre ellas algunos procesos cerebrales o incluso problemas de desnutrición como la anorexia nerviosa (causa frecuente de muerte súbita en mujeres jóvenes, observándose un intervalo QT prolongado en hasta un 15% de los casos) o dietas proteínicas líquidas. En general, la mujer tiene mayor susceptibilidad a sufrir un síndrome de QT largo adquirido. A.A., E.G., R.C. A. García-Alberola 2
69 Arritmias VI (C) CARDIOLOGÍA CMG SÍNDROME DE BRUGADA El síndrome de Brugada, descrito por el famoso arritmiólogo de Girona, Pedro Brugada Terradellas (junto con sus hermanos Josep y Ramón), en 1992, consiste en una arritmia con un patrón electrocardiográfico característico que presenta una elevación del ST en derivaciones precordiales derechas. Los anglosajones la llaman coved-typed. 3 (Figs de la 17, 18 y 19). La prevalencia es muy diferente según la población, ya que es una enfermedad de corte genético. En Murcia existe una alta prevalencia de esta arritmia 4. ESTRATIFICACIÓN DEL RIESGO El riesgo de estos eventos sigue una caprichosa e inquietante variabilidad. Puede haber unos pacientes que sólo muestran un ECG raro en un momento dado y otros que pueden llegar a morir súbitamente antes de los 15 años. La estratificación implica problemas éticos muy importantes que deben valorarse con unidades especializadas de tratamiento. La estratificación del riesgo se basa en: Síntomas: presencia, ausencia, y cómo aparecen. Patrón electrocardiográfico: Mayor evidencia electrocardiográfica comporta mayor riesgo. Antecedentes familiares: Variable, no siempre implican un alto riesgo. Tipo de mutación: Unas son más peligrosas que otras, y no todas sabemos reconocerlas. 3 Esta enfermedad se caracteriza en el ECG por un patrón que simula bloqueo incompleto de rama derecha, elevación del segmento ST persistente de V1 a V3 y muerte súbita en ausencia de enfermedad estructural miocárdica. Se produce por mutaciones que afectan a los canales de sodio cardiacos y es de herencia dominante. 4 Las diferencias entre poblaciones son abismales. Alberola dice que ellos ven en el HUVA 1 ó 2 casos de Sd. de Brugada por semana, en cambio, un cardiólogo finlandés al que conoce dice no haber visto un caso en su vida. TRATAMIENTO Síndrome de QT largo Tratamiento con beta-bloqueantes y DAI en los casos severos y/o refractarios. Síndrome de Brugada Si es sintomático, se coloca un DAI. Si es asintomático, se actúa según el riesgo (esto está en discusión). Curiosidades sobre el Sd. de Brugada El Sd. de Brugada es una enfermedad que se considera endémica asiática (donde es la segunda causa de muerte en hombres jóvenes después de los accidentes de tránsito). La muerte súbita suele presentarse en jóvenes varones durante el periodo de sueño, por lo que los nativos de Tailandia y Guam la conocían como Bangungot, que es la palabra en tagalog para pesadillas. Para ellos, estos hombres saludables morían bajo la influencia de terribles pesadillas. En muchas tribus, la enfermedad cobró una popularidad legendaria. Como casi todas las víctimas eran hombres, los nativos inventaron el fantasma de una viuda para responsabilizarlo por la muerte de todos estos hombres jóvenes, y el miedo a la enfermedad contagió a muchos nativos que comenzaron a vestirse de mujer antes de dormir, para engañar al fantasma de la muerte. Además, he encontrado otra cosa curiosa en un periódico colombiano on-line: se han reportado dos casos de síndrome de Brugrada en población aborigen en Cali (Colombia) que han hecho saltar la alarma, ya que esta enfermedad genética no es usual en América, y menos entre la población autóctona. Cito textualmente el artículo: Los dos casos detectados en Cali despertaron la alerta sobre el síndrome que atacaría a la raza indígena. Esta condición revive la hipótesis de que al parecer los primeros inmigrantes de América serían asiáticos que llegaron por el estrecho de Bering. De acuerdo con esta teoría los aborígenes por descendencia ancestral portarían el gen que ocasiona la letal enfermedad. A.A., E.G., R.C. A. García-Alberola 3
70 Arritmias VI (C) CARDIOLOGÍA CMG F IBRILACIÓN VENTRICULAR Se trata de una activación ventricular desorganizada y muy rápida, que provoca en el ECG la ausencia de complejos y de línea de base. Así, la actividad mecánica ventricular es totalmente ineficaz. (Figs ) ETIOLOGÍA Arritmias terminales: La fibrilación ventricular es la forma habitual de morirse como consecuencia del desenlace de arritmias terminales, es decir, las arritmias terminales acaban en FV, que es mortal. Isquemia aguda severa: IAM. Arritmia inesperada en cardiopatía estructural. Arritmia inesperada en canalopatía. Preventivo de las recurrencias Pueden darse diferentes situaciones en las que se precise una profilaxis para evitar esta temible arritmia. Se tendrá en cuenta que: o o La aparición de un episodio de FV durante una isquemia aguda no precisa tratamiento profiláctico. Cuando se da por una causa reversible clara, se debe evitar dicha causa. Por ejemplo, si hay hipokaliemia, se administrará potasio. o Si aparece como arritmia inesperada, se debe proceder a la colocación de un DAI. Éste disminuye en más de un 95% los casos de FV. CLÍNICA Se presenta con una situación de parada cardiorrespiratoria. TRATAMIENTO Se establece en base a dos situaciones bastante distintas. Éstas son, el momento de la crisis (tratamiento agudo), o la profilaxis de recurrencias. De la crisis Debe practicarse una desfibrilación inmediata, no sincronizada, puesto que no hay QRS sobre los que sincronizar (no apretar nunca el botón de sincronizar para evitar problemas), y con una energía de unos 200 Julios. Si no funciona, se debe iniciar RCP (Reanimación Cardio-Pulmonar), con choques repetidos. A.A., E.G., R.C. A. García-Alberola 4
71 Arritmias VI (C) CARDIOLOGÍA CMG ZONA ECG Fig. 14: Taquicardia ventricular polimórfica. Véase cómo la morfología de los QRS correspondientes a la taquicardia ventricular, es variable en cada latido. Fig. 15: Síndrome de QT largo. Se observa que el intervalo QT es de 500 milisegundos en la imagen A, y de 600 milisegundos en la B (ambas >450 milisegundos). A.A., E.G., R.C. A. García-Alberola 5
72 Arritmias VI (C) CARDIOLOGÍA CMG Fig. 16: Torsades de pointes, también llamada taquicardia helicoidal en el Harrison. Se ve cómo las puntas de los complejos cambian su orientación (arriba y abajo, indistintamente). Fig. 17: Síndrome de Brugada. Véase la elevación del ST característica en derivaciones precordiales derechas (V1 y V2, señalado por flecha). Cuidado con el diagnóstico diferencial con IAM anterior. A.A., E.G., R.C. A. García-Alberola 6
73 Arritmias VI (C) CARDIOLOGÍA CMG Fig. 18: Síndrome de Brugada. Detalles en V1 y V2 Elevaciones del ST señaladas en la imagen anterior. Fig. 19: Síndrome de Brugada (aunque no lo indica la derivación que vemos debe ser V1 o V2, ya que vemos la típica elevación del ST) degenerando en un torsades de pointes (inicio en flecha). Fig. 20, 21, 22 y 23: Fibrilación ventricular. Puede observarse como la activación ventricular es desorganizada y muy rápida. En ella, no existen complejos ni línea de base en ECG. La presencia de actividad mecánica ventricular eficaz es nula. A.A., E.G., R.C. A. García-Alberola 7
74 Arritmias VI (C) CARDIOLOGÍA CMG A.A., E.G., R.C. A. García-Alberola 8
75 Arritmias VII CARDIOLOGÍA CMG Arritmias VII BRADIARRITMIAS: DISFUNCIÓN SINUSAL (ENS) BLOQUEO AURÍCULO-VENTRICULAR (BAV) B RADIARRITMIAS Una bradiarritmia es una anormalidad en los latidos del corazón. En los adultos se define como un ritmo cardiaco de menos de 60 latidos por minuto 1. Los diferentes tipos de bradiarritmia incluyen: Disfunción sinusal o Enfermedad del Nódulo Sinusal (ENS). Bloqueos aurículo-ventriculares (BAV). D ISFUNCIÓN SINUSAL La disfunción sinusal o ENS (Enfermedad del Nódulo Sinusal) es el conjunto de manifestaciones clínicas y electrocardiográficas resultantes de un mal funcionamiento crónico del nodo sinusal, a menudo con afectación asociada del resto del sistema de excito-conducción del corazón. (Fig. 1) MANIFESTACIONES o o o Pueden observarse bradicardias sinusales inapropiadas, es decir, si se está realizando un ejercicio físico intenso (correr por ejemplo), 40 lpm sería una frecuencia inapropiada. En ocasiones, la ENS se manifiesta en forma de pausas sinusales, que son especialmente significativas si duran más de 3 segundos. En individuos normales, las pausas de hasta 2 segundos, sobre todo por la noche, son frecuentes. (Fig. 2) Éstas, aumentan aún más su frecuencia, si se trata de deportistas. Si la pausa se mantiene mucho tiempo, aparecerá un ritmo de escape nodal. Si éste último fallase, se establecería un ritmo ventricular, y si también el ritmo ventricular fallase se encontraría en asistolia. (Fig. 3) Por último, también puede presentarse como un Síndrome bradicardiataquicardia (bradi-taqui). El paciente que experimenta este evento siente una taquicardia intensa y, de pronto, se sincopa por una bradicardia. (Fig. 4) ETIOLOGÍA Las etiologías más comunes son: 1 Aunque se habla de bradicardia a una FC menor de 60 lpm, existen grandes variaciones de una persona a otra, y frecuencias menores a 60 no indican siempre patología. Por ejemplo, los deportistas tienen frecuencias de menos de 50 lpm en reposo debido a un aumento en el tono vagal, lo que es rigurosamente normal. La afectación degenerativa: Aumenta con la edad. La ENS es más frecuente cuanto más añoso es el paciente. A.A., E.G., R.C. A. García-Alberola 1
76 Arritmias VII CARDIOLOGÍA CMG En ocasiones, enfermedades infiltrativas (por ejemplo la amiloidosis), cirugía, cardiopatía isquémica pueden estar relacionadas. Los principales factores que pueden actuar como desencadenantes son 2 : fármacos (antiarrítmicos como los β-bloqueantes ) que pueden llegar a dar una bradicardia sinusal extrema, y las alteraciones hidroelectrolíticas. CLÍNICA Lo más frecuente es que la ENS curse de forma asintomática. No obstante, también puede mostrarse como una situación de cansancio, disnea, apatía (en ocasiones se asemeja a la demencia) y demás hallazgos inespecíficos. Pueden observarse episodios de presíncope o síncope cuando las pausas llegan a ser muy prolongadas. Es muy raro que el proceso debute con una muerte súbita, sobre todo gracias a la existencia de los marcapasos de emergencia (nodal o ventricular). DIAGNÓSTICO Suele establecerse en base a pruebas complementarias. Destacan el ECG, el registro Holter y un EEF (Estudio Electro-Fisiológico). El Holter resulta el más preciso de los 3, mientras que el EEF se usa cada día menos. TRATAMIENTO Si la ENS cursa de forma asintomática, deben evitarse los factores desencadenantes. Si lo hace de manera sintomática, y en ausencia de factores desencadenantes reversibles, la implantación de un marcapasos con posibilidad de estimulación auricular (AAI ó DDD 3 ) es el tratamiento de elección. 2 La lista de posibles factores desencadenantes es interminable: hipotiroidismo, enfermedad hepática avanzada, hipotermia, hipervagotonía, hipoxia grave, acidosis, hipertensión aguda, brucelosis (que también puede ser etiología produciendo afectación del nodo sinusal, aparte de ser factor desencadenante), fiebre tifoidea 3 Se explicarán en Arritmias VIII. BLOQUEOS AURÍCULO- VENTRICULARES (BAV) Un bloqueo aurículo-ventricular o BAV no es más que la dificultad o detención en la conducción del impulso desde las aurículas a los ventrículos. Se clasifican en tres grados: BAV de primer grado BAV de segundo grado: - Wenckebach o Mobitz tipo 1 - Mobitz tipo 2 BAV de tercer grado BAV DE PRIMER GRADO En el BAV de 1 er grado, todas las ondas P (estímulos que provienen en realidad del nódulo sinusal 4 ) conducen al ventrículo, pero con cierto retraso. Este hecho se evalúa mediante el intervalo PR, que es normal cuando oscila entre 0,12 y 0,20 segundos, existiendo un retraso y por tanto, un BAV de primer grado, cuando supera los 0,20 segundos. A veces, incluso la onda P y la T precedente se fusionan debido al gran PR y la onda P se esconde en la T. Si ocurre lo anterior y no se observa la onda P claramente, no se diagnostica directamente un BAV de primer grado porque habría que hacer el diagnóstico diferencial con un ritmo nodal. (Fig. 5) BAV DE SEGUNDO GRADO En este tipo de bloqueo lo que ocurre es que algunas ondas P son conducidas, mientras que otras no lo son. Existen dos tipos: 4 Como ya se dijo en Arritmias VI, la onda P no se conduce por ninguna parte ya que sólo tiene entidad electrocardiográfica, con lo que ésta es una manera errónea de expresarse. La cosa no conlleva demasiado problema porque, por suerte, el examen no es escrito. Qué maravilla si pudiera ser que el enfermo viniera tipo test A.A., E.G., R.C. A. García-Alberola 2
77 Arritmias VII CARDIOLOGÍA CMG Tipo Wenckebach o Mobitz tipo 1 En esta situación, el PR se alarga progresivamente hasta que una onda P no conduce a ventrículos. Así, se establece un sistema fraccional (X:Y) que define el nivel de bloqueo. Un ejemplo puede ser un bloqueo 4:3, que significa que de cada 4 ondas P, 3 son conducidas a ventrículos. Así, pueden presentarse bloqueos 5:4, 3:2, 2:1, etc. (Fig. 6) Mobitz tipo 2 En el BAV de segundo grado, Mobitz tipo 2, el intervalo PR es constante hasta que, de repente, una onda P no conduce. Por tanto, se trata de un fallo periódico de la conducción sin alargamiento previo de PR. (Fig. 7) BAV DE TERCER GRADO En este tipo de bloqueo, ninguna onda P conduce a los ventrículos. De no existir ningún ritmo de escape, el paciente moriría. Afortunadamente, suele existir dicho ritmo de escape, que se caracteriza por ser regular, independiente y más lento que el de las ondas P. A la hora de diagnosticar un BAV de tercer grado debe tenerse en cuenta que, si sólo se observan 2 ó 3 complejos, la probabilidad de un diagnóstico erróneo es bastante alta. De hecho, casualmente puede coincidir una onda P delante de un complejo QRS e inducir a error, diagnosticando así un bloqueo de segundo grado cuando se trata de un tercer grado. (Fig. 8) Otra forma de clasificar los bloqueos es de acuerdo a su localización anatómica, distinguimos pues: BAV suprahisianos o nodales. BAV intrahisianos (se comportan como infrahisianos). BAV infrahisianos. Como el intrahisiano y el infrahisiano se comportan de manera similar, hablaremos de nodales e infrahisianos. A. Nodal Se trata de un bloqueo que, a menudo, es funcional. Suele tener un buen ritmo de escape 5 (40-45 lpm). Presenta en el ECG un QRS estrecho. Puede tratarse de un primer grado, un segundo grado tipo Wenckebach (o Mobitz tipo 1) o un tercer grado. Generalmente, tiene buen pronóstico y sólo requiere marcapasos en caso de que sea de primer o segundo grado y sea sintomático, o sea de tercer grado 6. B. Infrahisiano Suele tratarse de un bloqueo de carácter estructural con un ritmo de escape inestable. Puede corresponderse con un primer grado, un segundo grado Mobitz tipo 2 o un tercer grado 7. El pronóstico es malo y suele requerir marcapasos aun siendo asintomático. 5 Recordemos que el ritmo de escape es de peor calidad conforme bajamos en el sistema de excito-conducción. 6 En el caso de bloqueos AV de tercer grado SIEMPRE (sea o no sintomático) se coloca un marcapasos. 7 Obsérvese que la diferencia estriba en que ambos dan formas diferentes de BAV de segundo grado. A.A., E.G., R.C. A. García-Alberola 3
78 Arritmias VII CARDIOLOGÍA CMG ETIOLOGÍA A. Nodal El bloqueo nodal, como ya se ha dicho con anterioridad, suele ser de tipo funcional. Las causas más frecuentes que pueden producirlo son, entre otras: o o o o o Fármacos: β-bloqueantes, diltiazem, digital, verapamil Hipertonía vagal, que aparece en deportistas o jóvenes, o en cualquier persona durante el sueño. IAM inferior agudo 8 : Produce isquemia en el nodo. Es muy típico 9. Procesos inflamatorios tales como endocarditis reumática Procesos degenerativos (estructurales) de carácter irreversible, por destrucción del tejido del nodo AV. B. Infrahisiano Como ya se comentó anteriormente, suelen producirse por causas estructurales. Pueden estar relacionados con: o o o o Miocardiopatías. Calcificación aórtica en la estenosis, en la que el calcio invade y termina afectando al sistema de excito-conducción. IAM anteriores (o anteroseptales), donde es posible que se necrose parte del tabique interventricular, pudiendo afectarse irreversiblemente el sistema His- Purkinje. Procesos degenerativos: más habituales en ancianos. CLÍNICA La clínica de un BAV dependerá, evidentemente, del grado de bloqueo y del ritmo de 8 Recuérdese que la arteria del nódulo AV viene en el 80% de los casos de la arteria coronaria derecha, que, a su vez, en el 80% de los casos, irriga la cara inferior del corazón. 9 Podemos ver un ejemplo de bloqueo AV por isquemia en IAM inferior en la Zona ECG del tema de Infarto con onda Q de esta comisión. En la figura 10. escape que se establezca, en caso de que fuese necesario. De esta forma, pueden existir BAV que se comporten de manera totalmente asintomática y otros que lleguen a sincopar al paciente, suponiendo una situación bastante delicada. Al margen de lo anterior, un BAV puede ser paroxístico (inicio y terminación bruscos, y de una duración determinada), o crónico (mantenido en el tiempo). Por último, debe tenerse en cuenta que un síncope en un paciente con bloqueo de rama debe remitirse a una unidad especializada, ya que puede existir un bloqueo intermitente de la otra rama que conlleve un bloqueo completo. TRATAMIENTO El manejo será diferente dependiendo de si el BAV es sintomático o no: BAV sintomático Ante la situación de un BAV sintomático deben eliminarse los factores que puedan estar actuando como desencadenantes. Si el BAV se soluciona no haremos nada más 10. Si el BAV (sea cual sea el grado) persiste tras eliminar los factores desencadenantes, se procederá a la colocación de un marcapasos definitivo. BAV asintomático 1 Si es un BAV de 1 er grado ó de 2º grado Wenckebach: Un bloqueo de estas características es sugerente de ser considerado un bloqueo funcional. Por esto, se evitarán los fármacos que puedan empeorarlo y, en principio, no se colocará un marcapasos mientras no sea sintomático. 2 Si es un BAV de 2º grado Mobitz tipo 2 ó de 3 er grado: En estos casos se colocará siempre un marcapasos definitivo, aunque el BAV sea asintomático. 10 Si el BAV es por un IAM u otra causa temporal, se puede colocar un marcapasos transitorio. A.A., E.G., R.C. A. García-Alberola 4
79 Arritmias VII CARDIOLOGÍA CMG ZONA ECG Fig. 1: Véase el gráfico de registro de la frecuencia cardiaca de una bradicardia sinusal inapropiada. La frecuencia cardiaca del paciente ronda en torno a los 40 lpm, sobrepasando en escasas ocasiones los 50 lpm. Fig. 2: ECG que muestra la existencia de pausas sinusales. Recuérdese, que éstas son especialmente significativas si superan los 3 segundos. Para evaluarlas numéricamente, se mide el espacio existente entre una onda P y la siguiente, quedando la pausa entre ambas. Fig. 3: ECG de una pausa sinusal (línea roja) que desencadena la aparición de un ritmo de escape nodal (puntos rojos). El ritmo sinusal se representa en cuadrados azules. A.A., E.G., R.C. A. García-Alberola 5
80 Arritmias VII CARDIOLOGÍA CMG Fig. 4: ECG de un síndrome de bradicardia-taquicardia (bradi-taqui). Observad como pasa de la taquicardia a una bradicardia con una pausa muy prolongada. Fig. 5: ECG de un BAV de primer grado. Se puede observar como el intervalo PR es superior a los 0.20 segundos que corresponden el límite superior para dicho intervalo. Además, en algunos ciclos, la onda P y la T se fusionan debido al gran PR, y la onda P se esconde en la T, o aparecen dando una onda bífida. (Algunas ondas P señaladas con flecha). Fig. 6: ECG de un BAV de segundo grado, tipo Wenckebach. El intervalo PR se va alargando cada vez más hasta que llega un momento en el que la onda P no conduce a ventrículos. (Señalados los PR, no de manera muy precisa, que van creciendo, y con flecha la onda P que no conduce). A.A., E.G., R.C. A. García-Alberola 6
81 Arritmias VII CARDIOLOGÍA CMG Fig. 7: ECG de un BAV de segundo grado, Mobitz tipo 2. En él, el intervalo PR es constante hasta que, de pronto, una onda P no conduce. (Ondas P que no conducen señaladas con flecha). Fig. 8: ECG de un BAV de tercer grado. En este tipo de bloqueo, ninguna onda P conduce a ventrículo. Por ello, y para que el paciente pueda sobrevivir, se establece un ritmo de escape nodal. Así, el ritmo auricular (señalado con líneas verticales rojas) es constante, más rápido, y va totalmente disociado del de los QRS (más lento, aunque también regular, señalado con círculos azules). Muchas ondas P quedan escondidas o no se ven claramente. Por ejemplo, la primera se superpone a una onda T, o la segunda aparece como una línea de menor pendiente que se fusiona después con un QRS. La tercera aparece aislada y por ello se ve claramente. A.A., E.G., R.C. A. García-Alberola 7
82
83 Arritmias VIII CARDIOLOGÍA CMG Arritmias VIII MARCAPASOS DESFIBRILADOR AUTOMÁTICO IMPLANTABLE (DAI) MUERTE SÚBITA M ARCAPASOS (MP) Un marcapasos consiste en un dispositivo electrónico que sirve para estimular el corazón. Existen dos tipos de marcapasos: Transitorios: - Transtorácicos - Transvenosos Definitivos. MP EXTERNO TRANSTORÁCICO Es un marcapasos transitorio que se usa para emergencias, en intervalos de tiempo de minutos u horas. La estimulación que efectúa sobre el paciente resulta dolorosa para éste, por lo que es necesario el uso de sedación. Es muy fácil de usar y además no requiere punción. Se colocan los electrodos sobre el pecho, como si de un desfibrilador se tratase, se selecciona la frecuencia e intensidad y comienza a realizar su función. Como ya hemos dicho, ésta es transitoria, mientras se prepara la colocación del marcapasos definitivo. En la imagen inferior vemos un modelo, con los electrodos señalados con flechas: MP EXTERNO TRANSVENOSO Consiste en un dispositivo conectado a un electrodo que se introduce por una vena (yugular, subclavia, femoral ) y se enclava en el ápex del ventrículo derecho bajo control radiológico. La petaca (batería y dispositivo electrónico, etc.) se sitúa exteriormente al paciente. No es doloroso, aunque requiere punción y exposición a radiaciones ionizantes. El riesgo de infección es notable, por lo que no se recomienda usar más allá de 3 a 5 días. En la imagen inferior podemos observar, a la izquierda, la petaca que queda exterior al paciente. A la derecha el sistema de cableado que conducirá el estímulo hasta su lugar de implantación en el ápex del VD. MP DEFINITIVO Este dispositivo sustituirá de forma definitiva, en caso de que fuese necesario, a los dos anteriores. Aquí, el aparato se coloca en el tejido celular subcutáneo y los electrodos se introducen por punción de la vena subclavia o disección de la cefálica. Éstos se enclavan en el ápex del ven- A.A., E.G., R.C. A. García-Alberola 1
84 Arritmias VIII CARDIOLOGÍA CMG trículo derecho mediante unos anclajes que, con el tiempo, se incluirán por fibrosis en el endocardio. La batería dura entre 6-7 y años, requiriendo su sustitución pasado este periodo de tiempo 1. En la imagen inferior vemos la situación habitual de los marcapasos definitivos: MARCAPASOS EN EL ECG El marcapasos se observa en el ECG como una espiga de duración variable y un voltaje que también puede ser variable. En realidad, la estimulación se visualizaría (a la adecuada velocidad de registro del ECG) como un rectángulo (ver figura a continuación), pero a las velocidades que habitualmente se utilizan en clínica el estímulo del marcapasos se ve en el ECG como una espiga. (Fig. 1) Aquí se observa un ejemplo que describe dicha estimulación: En la siguiente imagen se puede ver el sistema de anclaje, con las anclitas que se adhieren y hacen que después de un tiempo el artefacto quede pegado a la pared endocárdica ventricular por fibrosis: FUNCIONES DEL MARCAPASOS El marcapasos cumple, fundamentalmente, una función de estimulación. Además puede detectar la estimulación fisiológica del corazón del paciente y, en base a ello, realizar otras funciones. La estimulación, que puede hacerse a nivel: - A: auricular - V: ventricular. - D: auricular y ventricular. 1 Como curiosidad, decir que los marcapasos han evolucionado y cambiado tanto a lo largo del tiempo que, Arne Larsson, el primer paciente que recibió un marcapasos implantado, falleció en 2001 tras haber usado 22 marcapasos distintos a lo largo de su vida. El primero se le implantó en Palabras del mismo Arne 25 años después en El País fueron: Seguí tratamientos con atropina, isprenalina, café, champán y mucho whisky, que de hecho fue la mejor medicina (y aún así seguía con FC de 20 lpm ). Pero un día los médicos le dijeron a mi mujer que ya no podían hacer nada más por mí. Si en aquellos momentos me hubiera dicho alguien que ahora estaría aquí, disfrutando de la vida, le hubiera contestado: 'Amigo, ya no ocurren milagros". La detección de un estímulo fisiológico, que puede ser: - A: auricular - V: ventricular. - D: auricular y ventricular. - O: no detecta. Otras funciones a cumplir por el marcapasos pueden ser: - Adaptación de la frecuencia cardiaca. A.A., E.G., R.C. A. García-Alberola 2
85 Arritmias VIII CARDIOLOGÍA CMG - Funciones de control (lógica interna). - Funciones de diagnóstico. En relación a estas funciones, el marcapasos se identifica por una serie compuesta de 3 letras que se corresponden con la siguiente tabla: La primera letra hace referencia a la estimulación y la segunda a la detección. Como se observa en la explicación anterior, la estimulación puede ser auricular, ventricular o en ambas localizaciones. La detección puede darse en lugares similares a la estimulación. Los marcapasos modernos tienen todos incorporada la función de detección 2. (Fig. 2) En lo referente a la tercera letra: o o o o I: inhibe al detectar un latido del paciente. T (Trigger: gatillo): estimula cuando detecta un latido del paciente. D: estimula cuando detecta una onda P sola y se inhibe cuando detecta una onda P que conduce a ventrículo. Es decir, según donde detecte, estimula o inhibe. O: ni detecta, ni estimula. Así, por ejemplo, un marcapasos AAI realiza la estimulación a nivel auricular, puede detectar estímulos fisiológicos también a nivel auricular y, cuando los detecta, inhibe el estímulo del aparato y deja funcionar el estímulo espontá- 2 Aunque ésta se puede desactivar en un momento oportuno si, por ejemplo, el paciente va a ser intervenido quirúrgicamente, ya que la función de detección puede confundir el estímulo de un bisturí eléctrico con un latido fisiológico. neo del paciente, lo que es útil, por ejemplo, en la enfermedad del nódulo sinusal (ENS). Por otro lado, un VVI, realiza la misma función que el anterior, pero estimula y detecta a nivel ventricular, con lo que es útil ante patologías como una fibrilación auricular + BAV. Otro ejemplo que podemos comentar es el del marcapasos con modo VDD, el cuál puede detectar una onda P: si ésta es bloqueada y no conduce a ventrículo, el MP generará un QRS; si la onda P conduce, el MP se inhibirá. Esto es útil, por ejemplo, para un bloqueo AV. Pero, por qué no colocar siempre un DDD, que parece ser el más completo y mejor? Muy sencillo: a más cables, más problemas (infecciones, complicaciones, etc.). Sólo se debe utilizar cuando sea necesario. Respecto a la interferencia de los marcapasos con ondas electromagnéticas, decir que éstos van protegidos frente a todo tipo de campos electromagnéticos normales. De los elementos de uso cotidiano, el único que puede dar algún problema, debido a interferencias con el dispositivo, es el teléfono móvil 3. DESFIBRILADOR AUTO- MÁTICO IMPLANTABLE (DAI) Un Desfibrilador Automático Implantable o DAI es un marcapasos especializado que es capaz de detectar y corregir los trastornos del ritmo. Está formado por dos componentes: el generador de pulso, formado por moduladores electrónicos y una batería, situado debajo de la piel cerca de la clavícula; y los cables (derivaciones) que se conectan dentro del corazón. Es un dispositivo que puede cumplir las siguientes funciones: Marcapasos. Detección de taquicardia ventricular (TV). 3 Así de buenos serán Alberola dijo que a estos pacientes se les recomienda que no usen el móvil en el oído izquierdo. A.A., E.G., R.C. A. García-Alberola 3
86 Arritmias VIII CARDIOLOGÍA CMG Detección de fibrilación ventricular (FV). Tratamiento de TV. Choques de desfibrilación. Funciones diagnósticas. Todas estas características convierten al DAI en un elemento que puede ser vital para pacientes que padezcan una taquicardia ventricular o que entren en FV. Terapia de TV por sobreestimulación Si el DAI detecta una taquicardia ventricular, envía una serie rápida de pequeños impulsos eléctricos al corazón. Esto se denomina sobreestimulación y suele ser suficiente para restaurar el ritmo normal, además no es doloroso para el paciente. Si la sobreestimulación no es eficaz, el DAI intenta terminar la taquicardia ventricular aplicando un choque eléctrico controlado, de forma similar a una cardioversión eléctrica. (Fig. 3) Terapia de choque para FV En caso de que el DAI detecte una FV (mortal si no se establece una medida desfibrilatoria urgente), se efectuará una descarga de Julios (equivalente a los Julios que descargaría un desfibrilador externo) que será suficiente para desfibrilar el ventrículo, ya que el dispositivo se halla implantado en el mismo corazón. Es eficaz en el 99% de los casos. Ésto sí molesta al paciente y, además, le provoca estrés psicológico, porque desconoce cuándo puede sufrir la descarga. (Fig. 4) Como vemos en la imagen, el aparato es muy similar a un marcapasos común: M UERTE SÚBITA La muerte súbita se define como una muerte natural de carácter inesperado que acontece rápidamente (se considera habitualmente un tiempo menor a 1 hora entre la aparición de los primeros síntomas y la muerte). Supone, en términos de incidencia, el 10% de las muertes. MECANISMO El mecanismo de producción de la muerte súbita no se conoce con exactitud. Sin embargo, en un estudio realizado en Europa hace años, analizando personas fallecidas por muerte súbita que estaban siendo monitorizadas por un Holter, se evidenció lo siguiente: o o o En el 50% de los casos se vio que la muerte súbita era precedida por una taquicardia ventricular que desembocaba en fibrilación ventricular. En un 25% se debía a fibrilación ventricular como tal, por ejemplo, en el curso de un IAM. En el 25% restante se debía a bradicardias extremas que terminaban en asistolia. Éstas podían ser consecuencia de miocardiopatías muy evolucionadas, o A.A., E.G., R.C. A. García-Alberola 4
87 Arritmias VIII CARDIOLOGÍA CMG producirse en el seno de una catástrofe hemodinámica (una rotura de aorta, por ejemplo). ETIOLOGÍA En adultos, la enfermedad coronaria supone el 80%, mientras que el 20% restante lo constituyen otras enfermedades miocárdicas u otras patologías como el embolismo pulmonar masivo. Respecto a niños y jóvenes, las causas más frecuentes son MCH (Miocardiopatía Hipertrófica), canalopatías, WPW (Sd. de Wolff- Parkinson-White) y patologías congénitas (como la implantación coronaria anómala 4 ). La actuación más eficaz en este sentido es a nivel de población general, pues es en este marco (el primer estrato de la pirámide inferior) donde hay más personas susceptibles de sufrir un episodio de muerte súbita (aunque el riesgo individual sea más bajo a este nivel que en los superiores): PRONÓSTICO El pronóstico es fatal si no se interviene inmediatamente. Aun practicando una correcta intervención, los resultados no son nada alentadores, ya que sólo llegan vivos al hospital un 10-15% y de éstos, sólo el 2% se va de alta. PREVENCIÓN Una vez comentadas la etiología, las características y el pronóstico de esta dramática situación, se puede concluir que lo más interesante a la hora de evitar la muerte súbita es la prevención. Por último, comentar una noticia que ha aparecido en los últimos días al respecto: El ministro de Sanidad, Bernat Soria (el amigo de Lozano xd), ha anunciado que para 2008 los lugares públicos donde se concentren numerosas personas (aeropuertos, centros comerciales ) contarán con desfibriladores semiautomáticos que permitirán «salvar muchas vidas». Con esto, el ministerio de sanidad y consumo pretende poner coto a las muertes que se producen cada año por paradas cardiacas en España fuera de los centros sanitarios, una cifra cuatro veces superior a los fallecimientos registrados en accidentes de tráfico, en palabras del mismo ministro. 4 Como curiosidad: Las anomalías de las arterias coronarias constituyen el 2.2% de las cardiopatías congénitas. La implantación de la arteria coronaria izquierda (ACI) desde el tronco de la arteria pulmonar, también conocida como síndrome de Bland-White-Garland o ALCAPA (anomalous left coronary artery from the pulmonary artery) es la anormalidad coronaria más frecuente. Las manifestaciones clínicas son derivadas de la isquemia miocárdica, consecuencia del cortocircuito arteriovenoso. La presencia de cardiomegalia asociada a falla cardiaca es un hallazgo común en neonatos y lactantes mientras que en niños mayores y adultos son más frecuentes el infarto agudo de miocardio, arritmias, signos de falla cardiaca o muerte súbita. A.A., E.G., R.C. A. García-Alberola 5
88 Arritmias VIII CARDIOLOGÍA CMG Zona ECG Fig. 1: En esta imagen se puede observar cómo aparecen las espigas de un marcapasos en el ECG. Se ven como una línea delgada que precede al QRS. Fig. 2: En este ECG puede observarse cómo el marcapasos estimula y tras esto, aparece un QRS (espigas marcadas con círculos rojos). No obstante, cuando el paciente genera una onda P que conduce (cuadrado azul), el marcapasos se inhibe y deja que sea esa onda P la que estimule los ventrículos. Obsérvese cómo el QRS fisiológico es estrecho y el producido por el marcapasos es ancho, debido al lugar donde estimula. A.A., E.G., R.C. A. García-Alberola 6
89 Arritmias VIII CARDIOLOGÍA CMG Fig. 3: ECG que recoge la acción de un DAI en el marco de una terapia de TV por sobreestimulación. La línea roja representa la taquicardia que va a una frecuencia de unos 200 lpm. A continuación, se activa el DAI (rayo ) y estimula, con su función marcapasos, a unos 300 lpm (círculos rojos). Tras esto, el paciente recupera una FC aceptable (cuadrados azules). Fig. 4: En este ECG se muestra una FV en un paciente que, afortunadamente, lleva implantado un DAI. El aparato detecta la FV y da un choque de unos julios (rayo rojo) que desfibrila el corazón del paciente. A.A., E.G., R.C. A. García-Alberola 7
90
91 Seminario-1 CARDIOLOGÍA CMG Arritmias SEMINARIO DE ARRITMIAS I I NTERPRETACIÓN DE ECG Para la interpretación de un ECG podemos seguir una serie de pasos haciéndonos preguntas (es como jugar al Quién es quién ) que nos irán guiando, eliminando posibilidades y delimitando el diagnóstico del evento que queremos reconocer. Comenzaremos con la siguiente pregunta 1 : Estamos ante una taquiarritmia o una bradiarritmia? Nos fijamos para ello en la frecuencia cardiaca. Según ante qué clase de arritmia nos encontremos procederemos de diferente manera: TAQUIARRITMIAS Una vez comprobado que estamos ante una taquiarritmia, nos centraremos en el complejo QRS y nos haremos dos preguntas: Tiene un QRS ancho o estrecho? Para contestar a esta pregunta analizaremos su duración, de tal manera que: QRS estrecho (80-95 mseg.), y ancho (> mseg.). A continuación, ya conociendo esta respuesta, nos haremos otra pregunta al respecto: 1 Siguiendo con la analogía sería como el clásico Es hombre o mujer? La pregunta que más posibilidades elimina, y que en este caso es muy fácil de contestar. El ritmo es regular o irregular? Esta pregunta es muy fácil de contestar. Basta con que nos fijemos si el intervalo entre los QRS permanece constante o va cambiando. Una vez contestadas estas sencillas preguntas podemos delimitar mucho la incertidumbre, de tal modo que reducimos las posibilidades a: TAQUIARRITMIAS DE QRS ESTRECHO Entre las taquiarritmias de QRS estrecho, éstas pueden ser regulares o irregulares: Regulares Taquicardia sinusal Taquicardia auricular Taquicardia paroxística supraventricular Flutter con conducción 2:1 Para diferenciar entre estas taquiarritmias deberemos analizar otra serie de cuestiones: Cuáles son las características clínicas del paciente? Podremos diferenciar así si su presentación es paroxística o no, y otras características clínicas del paciente. Cuál es la morfología y localización de la onda P? Recordemos las ondas F del flutter, y la disociación del ritmo o la onda P escondida tras el QRS en la taquicardia paroxística supraventricular por ejemplo. Cuál es el efecto que se produce al administrar adenosina? Recordemos, por ejemplo, que la taquicardia paroxística supraventricular se resuelve normalmente con adenosina, mientras que en el caso del flutter su administración sólo sirve para el diagnóstico. A.A., E.G., R.C. A. García-Alberola 1
92 Seminario-1 CARDIOLOGÍA CMG Irregulares Fibrilación auricular (son la mayoría) Taquicardia auricular / flutter con conducción variable Taquicardia auricular multifocal (TAM) Extrasístoles frecuentes (no son arritmias sostenidas, pero se pueden confundir con ellas) Cómo es la actividad auricular? Podemos ver ausencia de línea isoeléctrica (FA), u ondas P con morfología cambiante (TAM), u ondas F (flutter) Es siempre el mismo ritmo? Podemos ver que el ritmo es regular y se trunca debido a la aparición de extrasístoles, por ejemplo. TAQUIARRITMIAS DE QRS ANCHO Como en las de QRS estrecho las posibilidades serán diferentes si la arritmia es regular o irregular: Regulares Taquicardia ventricular monomórfica Cualquier taquicardia supraventricular regular con bloqueo de rama Debemos pensar ahora en el contexto clínico: Existe cardiopatía? Si existe cardiopatía, como ya se dijo en Arritmias VI consideraremos que es ventricular, y en efecto no nos equivocaremos en el 95% de los casos. También atenderemos a otros aspectos como: Disponemos de un ECG en ritmo sinusal? Podremos ver en éste si el paciente ya tenía un bloqueo de rama. Hay disociación AV, capturas o fusiones? Como recordaréis, la aparición de cualquiera de éstas es diagnóstica de TV. Recordemos que, en caso de duda, debemos suponer siempre que es ventricular. Irregulares Taquicardia ventricular polimórfica Flutter / Fibrilación auricular con bloqueo de rama Fibrilacion auricular con preexcitación Cuál es la morfología del QRS? Si es cambiante, estaremos ante una TV polimórfica (recordemos que ésta sólo es no sostenida, y si es sostenida se trata de FV). Tenemos acceso a un ECG en ritmo sinusal del paciente? Esto nos pondría en evidencia un bloqueo de rama. BRADIARRITMIAS Disfunción sinusal (ENS) Bloqueos aurículo-ventriculares (BAV). Para diferenciar las bradicardias nos pueden ayudar preguntas como: Cuál es la actividad auricular? Debemos fijarnos si existen pausas sinusales, si el ritmo auricular se corresponde con el de los QRS Cuál es el grado de conducción a los ventrículos? Recordemos que la conducción es diferente en los distintos tipos de BAV. El paciente lleva un marcapasos? Debemos saber reconocerlo en el ECG. Aunque en la vida real podremos preguntarle al paciente Por supuesto, no son todas las que están, ni están todas las que son; podéis inventaros mil preguntas para atajar e ir eliminando posibilidades con el fin de averiguar lo antes posible ante qué entidad arrítmica estamos. Ha llegado la hora de poneros a prueba. A.A., E.G., R.C. A. García-Alberola 2
93 Seminario-1 CARDIOLOGÍA CMG D IAGNÓSTICO ELECTROCARDIOGRÁFICO CASO 1 Se trata de una taquiarritmia con QRS estrecho (la mayoría) y ritmo irregular. Como vemos se ven siempre dos latidos seguros y después una pausa A qué os suena esto? Se trata de extrasístoles supraventriculares que siempre se presentan tras un latido normal, es decir, estamos ante un bigeminismo (se alternan latido normal y extrasístole, con pausa posterior). La flecha azul nos indica un bloqueo funcional de rama derecha, con el complejo rsr en V1, en este caso se deberá a una aberrancia de conducción, ya que la rama izquierda ya ha terminado su periodo refractario y conduce el impulso, pero no ocurrirá lo mismo con la rama derecha, que suele tener un periodo refractario más prolongado. CASO 2 Se trata de una mujer de 32 años, sin antecedentes de interés. Desde hace varios años presenta episodios de palpitaciones paroxísticas con ligero mareo al inicio del cuadro. Le suelen durar entre 10 y 15 minutos y a veces ceden con cambios posturales. Acude a urgencias por cuadro más prolongado (1 hora). A continuación se expone el ECG obtenido en urgencias: A.A., E.G., R.C. A. García-Alberola 3
94 Seminario-1 CARDIOLOGÍA CMG Comencemos contestando a las preguntas que hemos indicado al inicio: se observa un ECG con una taquiarritmia de QRS estrecho y regular. Ante esto, nos preguntamos por la clínica, y de ella podemos extraer otro dato importante, la presentación de la arritmia es paroxística, pues sus episodios se inician y terminan de forma brusca. Después nos preguntamos por la onda P Se ve claramente? No, es difícil verla. Estos datos nos hacen pensar en una taquicardia paroxística supraventricular. Vale, ya tenemos un muy probable diagnóstico. Qué hacemos con la paciente? El manejo más adecuado para esta paciente, que tolera bien la arritmia, es realizar el ECG de 12 derivaciones viendo los efectos que produce la administración de adenosina. Si la taquiarritmia cesa nos confirmará el diagnóstico, si no cesa, nos servirá para establecer otro diagnóstico al enlentecer el ritmo (un flutter por ejemplo). Se comienza administrando un bolo de 6 mg de adenosina i.v.. Tras el bolo, la paciente refiere ahogo y dolor torácico, pero la taquicardia no presenta cambios. Así que se aumenta la dosis de adenosina a 12mg. en bolo i.v., obteniéndose el siguiente resultado: La terminación brusca de la arritmia, acompañada de una pausa que dura unos segundos, seguida de la restauración del ritmo sinusal nos confirma la sospecha clínica: nos encontramos con una taquicardia paroxística supraventricular. Tras ver los resultados, cómo deberíamos actuar: realizamos un ingreso hospitalario, pedimos una cita urgente con el cardiólogo o le ponemos un tratamiento a largo plazo? El ingreso hospitalario no será necesario mientras sea bien tolerada, sería conveniente pedir una cita con el cardiólogo, pero no urgente (la paciente deberá llevar el ECG realizado en urgencias durante la crisis). Le pondremos un tratamiento a largo plazo para evitar las recurrencias. A la paciente se le podrá dar a elegir entre tratamiento farmacológico no curativo (verapamil o β-bloqueantes) o una ablación, un tratamiento más agresivo, pero curativo. A.A., E.G., R.C. A. García-Alberola 4
95 Seminario-1 CARDIOLOGÍA CMG CASO 3 Diagnóstico electrocardiográfico: Nos hacemos la pregunta capital: Bradi o taquiarritmia? En este ECG se observa una bradiarritmia. Fijándonos posteriormente en la onda P, vemos que casi no se aprecian (flechas naranjas, las ondas P son negativas), y no siempre preceden a los QRS. Estamos ante una enfermedad del nódulo sinusal (ENS), en la que se ha establecido un ritmo nodal (fijaos que los QRS que no van precedidos de onda P siguen un ritmo lento pero regular). Los latidos precedidos de onda P que rompen el ritmo son latidos anticipados auriculares, es decir, extrasístoles supraventriculares que conducen perfectamente al ventrículo, con lo que estamos ante un problema del nodo sinusal, una ENS. CASO 4 Atención, este caso es muy importante, ya que es el pan de cada día en la clínica. Se trata de una mujer de 62 años, con HTA y asma intrínseco. Está en tratamiento con IECA, corticoides y β2 inhalados. Tiene una ecocardiografía normal de hace 2 años. Sufre palpitaciones ocasionales de duración poco definida. Acude a urgencias por aumento de disnea y palpitaciones (de 3 días). El ECG obtenido en urgencias es el siguiente: A.A., E.G., R.C. A. García-Alberola 5
96 Seminario-1 CARDIOLOGÍA CMG Taqui o bradi? Taquiarritmia QRS estrecho o ancho? Estrecho Ritmo regular o irregular? Irregular. Con estos datos cuál es el diagnóstico más frecuente? Fibrilación auricular!!!! Máxime cuando no se observa línea isoeléctrica. Además no presenta ondas F de flutter. En la exploración física se observa que presenta taquipnea moderada con ortopnea, su PA es 160/80 mm Hg, tiene sibilancias finas con crepitantes en las bases, ingurgitación yugular positiva y edemas maleolares. Se le realiza una radiografía en la que aparece una ingurgitación hiliar con edema intersticial. Todos estos hallazgos nos indican que existe incompetencia en la función de la bomba con aumento de la presión retrógradamente, insuficiencia cardiaca. Tendremos que instaurar el tratamiento para el episodio agudo, lo primero en plantearnos es si comenzaremos con CVE o tratamiento farmacológico. La CVE no se aplica, ya que la arritmia es bien tolerada por el momento y no sabemos cuanto tiempo lleva en FA la paciente, por lo que podríamos soltar émbolos al cardiovertirla. Dentro del tratamiento médico tenemos: - Flecainida: es un AA tipo I utilizado para la cardioversión química, no nos interesa quitar la FA hasta que no hayamos anticoagulado correctamente a la paciente. - Propranolol: es un β-bloqueante. Sería bueno para controlar la frecuencia cardiaca, pero no tenemos que olvidar que esta paciente es asmática, por lo que no será el fármaco más adecuado. - Digoxina: es un digitálico con bajo rango terapéutico (fácil alcanzar la toxicidad). Se podría utilizar, de hecho, Alberola dijo que él lo utilizaría en este caso. - Verapamil: es un AA tipo IV, mejor no administrarlo de entrada ya que, aunque frena la conducción en el nodo AV (que es lo que perseguimos), también deprime la contractilidad, que es algo que debemos evitar en casos de insuficiencia cardiaca aguda. - Amiodarona: es un AA tipo III con acción mixta, y es seguro en insuficiencia cardiaca. Se utilizará para el control de la FA aguda, ya que frena el nodo AV y, aunque también es antifibrilador, esta función tarda días o semanas en realizarla. Por esto es útil para el tratamiento agudo, aunque no así para el tratamiento crónico debido a sus devastadores efectos secundarios. - Diltiazem: es un AA tipo IV, se empleará principalmente para controlar la frecuencia cardiaca a largo plazo, en FA recurrentes. Según Alberola, éste tampoco nos hace gracia. xd - Otros como diuréticos, vasodilatadores, dieta sin sal, oxigenación Pueden mejorar el estado de la paciente, sobre todo con vistas a mejorar el cuadro de IC. A los 3 días la mujer está asintomática y con este ECG en reposo: A.A., E.G., R.C. A. García-Alberola 6
97 Seminario-1 CARDIOLOGÍA CMG Se observa una taquiarritmia irregular con QRS estrecho, sigue la FA porque aún no hemos querido eliminarla, para evitar posibles embolias. Aún así, se ha frenado la conducción al ventrículo, por lo que se ha conseguido el objetivo de controlar la frecuencia cardiaca. Ahora podemos abordar el siguiente paso: anticoagulación durante un mes para luego practicarle una CVE diferida, la química sería poco eficaz. Al mes se le practica una CVE de 200 J y se obtiene el siguiente resultado: No ha sido efectiva porque sólo ha quitado la FA durante un latido, el de la flecha roja, y después ha reaparecido. Entonces, cuál será el plan a seguir? Podríamos plantearnos el realizar una CVE con más energía, pero no sería efectivo, nos encontraríamos con el mismo resultado que con una carga de 200J. La mejor opción sería administrarle amiodarona y volver a repetir la CVE pasado un tiempo: (recordad que el DAI no se utiliza para la FA ya que es inhumano para el paciente recibir descargas cada vez que recae en FA). A continuación vemos el ECG correspondiente a la CVE tras un mes tomando amiodarona: Como vemos, se ha resuelto la FA, pero deberemos mantener la anticoagulación. Siempre que existan posibles dudas de recurrencia se mantendrá la coagulación. A los 2 meses de la CVE, aparece la misma mujer con una recurrencia de FA. El plan a seguir será el siguiente: Asumimos la FA como crónica y le prescribimos un tratamiento para controlar la frecuencia cardiaca con verapamil (ya que no está en IC), digital, y broncodilatadores para el asma. A los dos meses vuelve de nuevo y está clínicamente muy mal. Presenta palpitaciones y disnea a pequeños esfuerzos. Se le coloca un Holter que muestra una FC máxima de 208 lpm y una FA con frecuencia ventricular de alrededor de 130 lpm. No estamos consiguiendo el objetivo de controlar la frecuencia cardiaca con tratamiento médico: A.A., E.G., R.C. A. García-Alberola 7
98 Seminario-1 CARDIOLOGÍA CMG Nos podemos plantear entonces una ablación de venas pulmonares, lo que sólo se puede hacer en 20 centros de toda Europa (como ya se dijo, el HUVA estará entre los elegidos a partir de este verano), o una ablación del nodo AV que frene la anárquica funcionalidad auricular, y la colocación de un marcapasos definitivo que estimule directamente en el ventrículo. Como esta paciente es refractaria a los AA se opta por esta segunda opción, se ablaciona el nodo AV, obteniendo el siguiente cambio, marcado con una flecha verde, en la colocación del marcapasos: CASO 5 Diagnóstico de un registro Holter: Se trata de una taquiarritmia, con QRS estrecho y ritmo irregular. Ya sabemos que en estos casos lo más frecuente es la FA, así que a las malas siempre podríamos arriesgarnos en este sentido. Siendo rigurosos, vemos que la morfología de las ondas que preceden a los QRS es bastante irregular, intermedia entre ondas f de FA y ondas F de flutter auricular. Estamos ante un fibriloflutter, que en realidad no es más que una FA. En la imagen vemos que existe un cambio en el ritmo y la morfología. Es una taquiarritmia de QRS ancho, con ritmo regular. Necesariamente se trata de una taquicardia ventricular no sostenida. Si tuviera un ritmo irregular podría ser una FA con aberrancia de conducción. A.A., E.G., R.C. A. García-Alberola 8
99 Seminario-2 CARDIOLOGÍA CMG Arritmias SEMINARIO DE ARRITMIAS II CASO 6 Se trata de un varón de 42 años, que presenta palpitaciones paroxísticas en los últimos meses, le suelen durar unos segundos o minutos. El corazón y el ECG es normal: El ECG superior tiene una FC normal, un QRS estrecho y el ritmo es regular, a excepción de la aparición de dos extrasístoles (pareado) señaladas por flechas. Las extrasístoles no van a ser habitualmente la causa de la clínica de la paciente. En esta situación, podríamos ponerle al paciente un registro Holter porque podríamos registrar que sufre taquicardias paroxísticas supraventriculares. Aún así, si la tolerancia es buena no habrá que hacer nada, y tampoco es seguro que lo detectemos con el Holter, ya que puede que justo ese día no tenga un episodio. CASO 7 Una mujer de 82 años, con cuadros de palpitaciones y mareos, fue sometida a un implante de marcapasos definitivo hace 15 días, del cual no tenemos informes. Acude a urgencias por cansancio, apatía y palpitaciones, con el siguiente resultado electrocardiográfico: Se observa la espiga del MP, que no siempre captura, el ventrículo no está estimulado correctamente (marcadas algunas espigas que no capturan con una flecha naranja). La función de detección del MP tampoco es correcta, pues en ocasiones la paciente hace un latido propio, pero el MP estimula de todas formas (marcado un ejemplo con una estrella azul).por tanto, este MP no detecta ni estimula correctamente. A.A., E.G., R.C. A. García-Alberola 1
100 Seminario-2 CARDIOLOGÍA CMG Probablemente este problema se deba a que el electrodo está suelto y contacta con la superficie ventricular endocárdica de vez en cuando. La paciente está en ritmo nodal, con lo que el diagnóstico será bradiarritmia por disfunción sinusal. La pauta a seguir es colocar un MP transitorio si la paciente tolera mal la situación, para posteriormente recolocarle correctamente el electrodo. Si la tolera bien, no haremos nada hasta colocar el definitivo. CASO 8 Un varón de 65 años que padece HTA, tratada con un IECA, acude a urgencias por presentar palpitaciones desde hace 6 horas. En el ECG se puede apreciar una taquiarritmia con QRS estrecho y regular. Aunque no se ve línea isoeléctrica, al ser el ritmo regular descartamos la FA. Además se pueden ver ondas F, con lo que el diagnóstico es flutter auricular con una conducción constante 2:1, que de este modo produce un ritmo regular. Al mismo paciente se le realiza un registro ECG continuo: Igual que antes, nos encontramos con una taquiarritmia con QRS estrecho y regular. Intercalado entre los QRS estrechos aparece un QRS ancho, marcado con un rectángulo. A qué se debe? Puede ser producido por una extrasístole o por un bloqueo de rama, lo más probable es que sea una extrasístole. El tratamiento más adecuado será controlar la frecuencia cardiaca, frenando el nodo AV, con β-bloqueantes o verapamil. También se puede realizar una CVE de 100J, ya que no es necesario anticoagular al paciente porque la evolución es de sólo seis horas. A.A., E.G., R.C. A. García-Alberola 2
101 Seminario-2 CARDIOLOGÍA CMG CASO 9 Es un varón de 35 años, con soplo cardíaco en la infancia. Consulta por palpitaciones bien toleradas de 2 horas de evolución. Se le realiza un ECG con el siguiente resultado: Es una taquiarritmia irregular con QRS ancho, estaremos ante una taquicardia ventricular polimórfica o una fibrilación auricular. Descartamos el primer supuesto, ya que la taquicardia ventricular polimórfica es no sostenida, y por tanto resulta incompatible con un cuadro de 2 horas de evolución con palpitaciones bien toleradas. Recordemos que si alguna taquicardia ventricular polimórfica se convierte en sostenida, hablaríamos de fibrilación ventricular, que no es tolerable. Este ECG es característico de una FA con preexcitación (WPW): los intervalos RR nunca son iguales, no aparecen ondas p y la frecuencia es muy elevada. Comenzamos el tratamiento de la crisis con AA tipo I como la flecainida, que actúan sobre la vía accesoria de conducción, pero no en el nodo AV. En el caso de que no existiera vía accesoria, se emplearían beta-bloqueantes o verapamil, pero no en este caso, ya que no evitarán que la FA derive en FV. Con los AA clase I no logramos solucionar la arritmia, se realiza entonces una CVE de 300J, tras la cual obtenemos el siguiente ECG: A.A., E.G., R.C. A. García-Alberola 3
102 Seminario-2 CARDIOLOGÍA CMG Tras la cardioversión eléctrica hemos conseguido volver al ritmo sinusal, en el que se observa claramente el patrón de preexcitación con onda delta (señalada con flecha a la izquierda en la imagen extraída del ECG anterior). Como ya se ha dicho, estamos ante un síndrome de Wolff-Parkinson-White: QRS ancho con onda delta y disminución del intervalo PR. El tratamiento más recomendado sería realizar una ablación para evitar posibles recurrencias de FA. CASO 10 Mujer de 52 años que padece asma bronquial y diabetes mellitus. Sufre episodios de palpitaciones desde hace 20 años, con carácter paroxístico (duración de minutos u horas), sigue un tratamiento con flecainida crónico. Acude a urgencias por episodio prolongado, de 4 horas, pero bien tolerado. Se obtiene el siguiente ECG: Se puede observar una taquiarritmia regular de QRS estrecho. Pensamos en una taquicardia paroxística supraventricular guiados por la anamnesis y el ECG. Se intentará el tratamiento con verapamil (recordemos que la adenosina produce broncoespasmos y está contraindicada en pacientes asmáticos). A.A., E.G., R.C. A. García-Alberola 4
103 Seminario-2 CARDIOLOGÍA CMG Se le administran 5 mg de verapamil y se realiza el siguiente ECG a los 3 minutos: La taquicardia ha desaparecido, hemos conseguido un ritmo sinusal, pero para evitar recurrencias el único tratamiento curativo sería la ablación por radiofrecuencia. CASO 11 Un varón de 85 años está siendo tratado con broncodilatadores y corticoides inhalados, por EPOC con disnea a pequeños esfuerzos. En la exploración nos encontramos con un pulso irregular y le realizamos el siguiente ECG: El pulso es irregular porque existe algún grado de bloqueo en el nodo AV, ya que aparecen en el ECG muchas ondas P que no van seguidas de QRS. Se trata de una taquicardia auricular en la que la frecuencia ventricular es de unos lpm. Este defecto en el nodo AV protege al paciente de que la taquicardia auricular produzca una alta FC. Lo más lógico sería no hacer nada, aunque no sería descabellado plantear la posibilidad de una ablación (ésta conllevaría más riesgos debido al estado basal del paciente). A.A., E.G., R.C. A. García-Alberola 5
104 Seminario-2 CARDIOLOGÍA CMG CASO 12 Una mujer de 72 años que tiene HTA, diabetes y disnea de grandes esfuerzos, presenta un pulso irregular en un reconocimiento casual, se le hace el siguiente ECG: Se observa una taquiarritmia con QRS estrecho e irregular. No se observan ondas P. Estas características suelen referirse a una FA, no obstante, no se observan las ondas f, que aparecen en los típicos ECG de FA, mostrando una actividad auricular caótica. Los clásicos hablaban de FA de onda gruesa o fina, de tal modo que, cuando la onda es fina (como en este caso) es porque a la aurícula ya no le queda apenas músculo (atrofia y fibrosis en el anciano), y en el ECG se ve prácticamente como una línea de base. CASO 13 Un varón de 65 años que tiene una EPOC evolucionada y recibe tratamiento crónico con teofilina y β-agonistas inhalados, presenta una disnea de pequeños esfuerzos y el siguiente ECG: Estamos ante una taquiarritmia, de QRS estrecho y de ritmo irregular. Fijándonos en la actividad auricular, vemos que las ondas P cambian de morfología constantemente y no se distingue línea de base. Podemos fijar fácilmente el diagnóstico de taquicardia auricular multifocal (TAM). También ayudaría en este diagnóstico la historia clínica del paciente, ya que recordemos que la TAM se asociaba frecuentemente a EPOC. A.A., E.G., R.C. A. García-Alberola 6
105 Seminario-2 CARDIOLOGÍA CMG CASO 14 Un niño de 12 años tiene una infección respiratoria, con pulso ligeramente irregular y el siguiente ECG registrado por su médico: Este es un caso de arritmia sinusal fisiológica, debemos recordar que es normal en niños y jóvenes las variaciones en el ritmo sinusal con la respiración. CASO 15 Realicemos el diagnóstico del siguiente ECG: A.A., E.G., R.C. A. García-Alberola 7
106 Seminario-2 CARDIOLOGÍA CMG Aparece una taquicardia con QRS estrecho y regular, al no conocer la clínica del paciente no podemos descartar ninguna de las posibilidades: taquicardia sinusal, taquicardia auricular, taquicardia paroxística supraventricular o flutter. Para llegar al diagnóstico deberíamos comprobar qué efecto produce la administración de adenosina. Parece que la onda T se negativiza, pero en realidad se trata de la bajada de una onda F. CASO 16 Una mujer de 70 años lleva un marcapasos VVI por un bloqueo AV completo. Está en tratamiento con losartán (un ARA-II) por HTA. Acude asintomática a la revisión programada del MP, se le realiza el siguiente ECG: Se observan las típicas espigas del MP, no aparecen ondas P ya que la estimulación del MP es al ventrículo. La línea de base nos muestra una actividad auricular anormal. Se encuentra en fibrilación auricular, con lo que deberíamos comenzar con un tratamiento de anticoagulación. A.A., E.G., R.C. A. García-Alberola 8
107 Seminario-2 CARDIOLOGÍA CMG CASO 17 Se trata de un varón de 35 años sin antecedentes de interés. Desde hace 2 semanas nota palpitaciones rápidas, especialmente en relación con esfuerzos. La exploración física es normal, excepto un pulso irregular. Se le realiza el siguiente ECG: Estamos ante una taquiarritmia con QRS estrecho y ritmo irregular. Se trata de una taquicardia auricular con conducción irregular. Existe una pausa (indicada en rojo). Es una taquicardia auricular incesante (ver definición en Arritmias II) producida por un mecanismo de automatismo. Por esto, cuando hay aumento de catecolaminas (con el ejercicio) se desencadena la arritmia. El tratamiento con adenosina no es eficaz (vemos que la arritmia termina momentáneamente para volver a empezar), y la amiodarona administrada de forma crónica (como tendría que ocurrir en este paciente) produce numerosos efectos adversos. Se podría tratar crónicamente con propranolol (β-bloqueante), que antagoniza los efectos de las catecolaminas, impidiendo las recidivas de manera efectiva únicamente en el 30-50% de los casos. El tratamiento ideal en este caso (un chico joven con mucha vida por delante) es la ablación por radiofrecuencia del foco que produce el aumento del automatismo. Este tratamiento sí es curativo. A.A., E.G., R.C. A. García-Alberola 9
108 Seminario-2 CARDIOLOGÍA CMG CASO 20 Una mujer de 41 años sufre palpitaciones paroxísticas ocasionales desde hace 2 años. Se le realiza un registro Holter en el que se observa una taquicardia de inicio súbito. Estamos ante una taquiarritmia regular en la que aparecen al principio QRS anchos y luego estrechos. Es una taquicardia paroxística supraventricular, la aparición de complejos QRS anchos se debe a un bloqueo de rama derecha transitorio por aberrancia. CASO 21 Un varón de 72 años está ingresado en la unidad de cardiología por un infarto de miocardio. Mientras se le realiza el ECG que se muestra a continuación, permanece asintomático: Presenta un ritmo sinusal en el que aparecen complejos QRS anchos de manera regular, extrasístoles ventriculares (una, que además es una R sobre T, señalada con una flecha diagonal azul). Además, se observa un ritmo idioventricular acelerado (típico de fase aguda del IAM) con QRS ancho, cuyo inicio y final están señalados con una línea vertical negra. A partir de aquí, aunque el contenido está en las diapositivas, no se dio en clase porque al profesor no le dio tiempo. Nosotros lo incluimos para que aprendais más. (Recordad que toda la parte de Arritmias está revisada por Alberola). A.A., E.G., R.C. A. García-Alberola 10
109 Seminario-2 CARDIOLOGÍA CMG CASO 22 Un varón de 35 años presenta síncopes de repetición, cada 1-2 años, desde los 15 años. Algunos de ellos aparecen tras realizar un esfuerzo. Tiene antecedentes familiares, un tío paterno, con muerte súbita de joven. Acude a urgencias por sufrir un síncope mientras corría para coger un autobús. Se le realiza un ECG en urgencias con el siguiente resultado: El ECG muestra que ya ha finalizado la arritmia, ya que se ve un ritmo regular y con una FC normal. Por otro lado, la anamnesis es sugestiva de canalopatía (por los síncopes de repetición y los antecedentes familiares). Además, al ver el ECG llama la atención el largo intervalo entre la onda Q y la T. Lo más probable es que estemos ante un síndrome de QT largo congénito. A.A., E.G., R.C. A. García-Alberola 11
110 Seminario-2 CARDIOLOGÍA CMG CASO 23 Diagnóstico del siguiente ECG: Nos encontramos ante una taquiarritmia irregular de QRS estrecho, y la línea isoeléctrica no es visible. Para poder observar con más claridad la actividad auricular, se administra adenosina 12 mg en bolo i.v. y se realiza el siguiente ECG: Al enlentecerse la conducción por el nodo AV con la adenosina podemos observar con mayor claridad las ondas F de flutter auricular. A.A., E.G., R.C. A. García-Alberola 12
111 CARDIOPATÍA ISQUÉMICA
112 TEMA Car-1 CARDIOLOGÍA CMG CARDIOPATÍA ISQUÉMICA ARTERIOSCLEROSIS CARDIOPATÍA ISQUÉMICA Se entiende por síndrome isquémico o cardiopatía isquémica a la falta de oxígeno por perfusión insuficiente a las células musculares cardiacas, secundaria a un desequilibrio entre el aporte y la demanda de oxígeno que llevan las coronarias al miocardio. Vamos a empezar a estudiar este tema explicando la causa más frecuente de cardiopatía isquémica, la aterioesclerosis. I ARTERIOSCLEROSIS NTRODUCCIÓN La arteroesclerosis es la primera causa de muerte e incapacidad en el mundo desarrollado 1, por ser la causa fundamental de la Cardiopatía isquémica. Se trata de una enfermedad vascular sistémica y constituye la principal causa de trombosis y hemorragias vasculares. Cuando aparece, lo hace de manera difusa por todo el territorio vascular, aunque tiene localizaciones preferentes como son el corazón (mostrando predilección por la parte proximal de la arteria descendente anterior izquierda), el SNC (donde causa isquemia transitoria e ictus), el sistema vascular periférico (claudicación intermitente y gangrena), la aorta 1 Aunque en Preventiva digan que no, en Valdeslandia es que sí. descendente, el riñón (enfermedad aterotrombótica), etc. Se cree que la enfermedad se desarrolla de manera intermitente, no sólo en el espacio, sino también en el tiempo, extendiéndose la aterogénesis durante varios decenios. Se alternan, en la formación de la placa, periodos de inactividad con otros de rápida formación. Las manifestaciones clínicas de la enfermedad aparecen a partir de los 45 años, pero la enfermedad se inicia mucho antes, de hecho, se estima el inicio de la enfermedad entre los 10 y 20 años, momento en el cual es totalmente asintomática. Es a esta edad (10 20 años), cuando aparecen las primeras lesiones, que consisten en la Estría Grasa, la cual evoluciona hacia Estría Fibrosa (a los años), llegando posteriormente a desembocar en la lesión típica de la enfermedad, la placa ateromatosa. Todo esto puede conllevar el desarrollo de una lesión crónica hacia los 45 años, tal y como ocurre en el caso de la Angina de pecho estable (que es la que se asocia al esfuerzo) y/o en la claudicación intermitente. Este proceso también puede darse de forma brusca (aguda) en cuyo caso causa un IAM, accidente cerebrovascular o muerte súbita de origen cardiaco. Dado este comienzo tan precoz toman especial relevancia el conocer, corregir y evitar los numerosos factores de riesgo que llevan a la aparición de Ateroesclerosis. Se dice que la arteriosclerosis es una enfermedad de la íntima (la capa más interna de las tres que constituyen la pared arterial), aunque en realidad, participa la arteria en su J. A., C. C., M.J.S. Valdés 1
113 TEMA Car-1 CARDIOLOGÍA CMG totalidad, siendo demostrada, por ejemplo, la implicación de la célula muscular lisa (CML). Ésta pertenece a la capa media, pero la lesión induce su crecimiento y transporte a la capa íntima. L A ARTERIA NORMAL Es vital recordar la estructura normal de la pared arterial para comprender perfectamente el proceso. Como ya se ha dicho, está compuesta de tres capas: Se localiza entre la elástica interna y externa. Contiene células musculares lisas incluidas en una matriz extracelular rica en colágeno y elastina. Su disposición varía en las arterias elásticas (Aorta), donde las CML se disponen concéntricamente emparedadas entre bandas de elastina; y las arterias musculares, donde las CML se disponen de forma más laxa dentro de la matriz. ADVENTICIA Es una estructura colágena densa, con fibras elásticas, colágenas y muchos fibroblastos. Posee escasas CML y muchos vasos y nervios (vasa vasorum, vasa nervorum). C ÉLULAS IMPLICADAS EN LA AE CÉLULA ENDOTELIAL INTIMA FIGURA CA1-1 Es la capa más interna. Sus componentes principales son el endotelio, su membrana basal y la elástica interna. Es una capa delgada, tapizada por fuera por células endoteliales y por células musculares que se incluyen en la matriz extracelular. Bajo su membrana basal, la elástica interna constituye el borde de la íntima y la separa de la capa media. Aquí es donde se forma la placa arteroesclerótica. Podemos decir que se trata de una capa constituida por tejido conectivo con escasas células. MEDIA Cuando está en perfecto estado tiene una función protectora gracias a la gran cantidad de efectos que produce. Posee tres características muy importantes. Es anticoagulante (de modo que las plaquetas y hematíes no se pegan en las paredes de los vasos), es antiinflamatoria (los leucocitos y los monocitos tienden a no adherirse a estas células) y regula el tono vascular. Esto se consigue por la producción de sustancias vasodilatadoras, como las prostaciclinas y sobre todo NO, quizás el vasodilatador más importante en la regulación del flujo; y sustancias vasoconstrictoras, como las endotelitas y la angiotensina II. CÉLULA MUSCULAR LISA En los vasos sanos, se localiza en la capa media, donde se comporta como una célula funcional y no mitógena. Las sustancias liberadas por los monocitos y plaquetas fijadas a la pared vascular, activan a las CML, que adquieren la capacidad de proliferar. Las plaquetas (al liberar sus sustancias), la convierten en una célula inestable que atrae a más plaquetas y a leucocitos. Finalmente la CML pasa de la capa media a la íntima. J. A., C. C., M.J.S. Valdés 2
114 TEMA Car-1 CARDIOLOGÍA CMG MACRÓFAGOS Como bien sabemos, proceden de los monocitos circulantes en sangre. Liberan gran cantidad de sustancias quimioatrayentes, y cuando se cargan de lípidos se convierten en células espumosas, de gran importancia en el desarrollo de la enfermedad arteroesclerótica. PLAQUETAS Cuando se adhieren, se activa su gran cantidad de organelas internas. Inducen la fagocitosis y liberan fibrinógeno. LINFOCITOS T Se observan en todas las fases de la enfermedad. L A AE Debemos tener claro, antes de comenzar, que la lesión característica de la AE es la placa ateromatosa, y queda constituida por los siguientes elementos: Celulares: CML, macrófagos, linfocitos T. Matriz conectiva: compuesta por colágeno, fibras elásticas y proteoglicanos. Lipídicos: colesterol. Según la clasificación de Stary, las lesiones de esta enfermedad son de tres tipos. Éstos son la Estría Grasa (grados I y II), el engrosamiento difuso de la íntima (grado III) y la placa fibrosa o ateromatosa (grados IV y V), siendo esta última la lesión más importante. A continuación veremos cada una más detenidamente: ESTRÍA GRASA Su desarrollo puede diferenciarse en una serie de etapas: 1. FORMACIÓN DE LA ESTRÍA GRASA Se ha demostrado en estudios experimentales con animales y humanos, que ésta representa la lesión inicial de la enfermedad, observándose en niños y jóvenes. Su formación parece deberse a la acumulación localizada de lipoproteínas en ciertas regiones de la íntima. Este depósito se da por la combinación de múltiples factores, tales como el aumento de permeabilidad del endotelio 2 (que actuaría como una gotera, permitiendo el paso de las lipoproteínas), y alteraciones de la matriz extracelular (que facilita la adhesión en la pared arterial). Constituye una formación longitudinal, con cierto relieve. El proceso parece ser que se cronifica debido a que las lipoproteínas, una vez que atraviesan la íntima, se van a localizar en el espacio extracelular de la íntima y se van a asociar con moléculas de proteoglicanos de la matriz extracelular arterial. También se ha visto un desequilibrio en los componentes de la matriz extracelular en aquellas zonas donde se inicia la lesión. Aparece sobre todo en zonas donde el flujo es turbulento como ocurre justo antes de las ramificaciones arteriales, o en las curvaturas vasculares. RECLUTAMIENTO DE LEUCOCITOS Tras la acumulación de lípidos extracelulares, el segundo paso en la formación de la estría grasa es el reclutamiento de leucocitos, destacando sobre todo los monocitos y linfocitos. Una vez las lipoproteínas se encuentran estables en el espacio extracelular de la íntima, van a sufrir dos tipos de alteraciones 3, de las que destacamos la oxidación. Los LDL van a pasar a ser LDLox gracias a los proteoglicanos y glucosaminoglicanos del tejido conectivo existente. Estos LDLox, entre los que señalamos la lisofosfatidilcolina, pueden desencadenar una pequeña respuesta inflamatoria, que hará aparecer en la íntima a los monocitos y linfocitos T. 2 Como factores que debilitan el endotelio conocemos la hipercolesterolemia, el tabaquismo, la HTA o la DM. 3 la Oxidación de lipoproteínas y la Glucosilación no enzimática. J. A., C. C., M.J.S. Valdés 3
115 TEMA Car-1 CARDIOLOGÍA CMG Se cree que en el reclutamiento, también intervienen una serie de moléculas de adherencia o receptores que se expresan en la superficie de las células endoteliales. El número de estos receptores aumenta con la oxidación de las LDL, por lo que así se relacionan la acumulación lipídica con el reclutamiento leucocitario. Dentro de estos receptores, destacan la molécula de adherencia vascular 1 (VCAM- 1), la de adherencia intercelular (ICAM-1) y Selectina P. Concretamente, la lisofosfatidilcolina (resultado de la oxidación de LDL) aumenta la expresión de VCAM-1. Normalmente la VCAM-1 no se expresa en aquellas regiones con flujo laminar, de ahí que las zonas con AE sean zonas con flujo turbulento 4. Además, en estas zonas laminares, el endotelio produce NO, que, además de ser un potente vasodilatador, puede actuar como un autacoide antiinflamatorio, limitando también la expresión de VCAM-1. La expresión de estos receptores también se ve inducida por ciertas citocinas tales como TNF alfa e IL-1. Estas citocinas van a ser secretadas por los macrófagos y linfocitos, al ser estimuladas primeramente por las LDLox, y posteriormente entre sí. La función de esas citocinas es atraer a más leucocitos, estimular la proliferación de CML 5 y atraer plaquetas, además de estimular la creación de receptores. AMPLIACIÓN DE CONTENIDO DE INTERÉS. Se ha demostrado que en esta captación no interviene siempre el receptor de LDL (como podría pensarse, pues la LDL es una liporpoteina), ya que en pacientes con carencia congénita de estos receptores (como en la hipercolesterolemia familiar) aparecen estas células. Otra razón que lo justifica, es que el receptor LDL dimisnuye mucho su expresión en situaciones de hipercolesterolemia (pues el colesterol exógeno suprime la expresión del receptor de LDL). Los receptores que pueden mediar el proceso son los receptores depuradores o carroñeros que captan lipoproteínas modificadas, y los receptores de las LDL oxidasas que captan las betalipoproteinas de muy baja densidad. FIN DEL CONTENIDO AMPLIADO Los macrófagos cargados de lípidos pueden abandonar la pared arterial y cumplir una función limpiadora de lípidos de la arteria. Por tanto, la formación de un ateroma por el cúmulo de lípidos se da cuando los lípidos penetran en la pared arterial por medio de los fagocitos mononucleares y por otras vías en mayor cantidad de los que salen. El proceso de reclutamiento es el siguiente: una vez adheridos a la superficice de la célula endotelial (por medio de la interacción con un receptor del tipo VCAM-1), los monocitos y linfocitos penetran en la capa endotelial y se estabilizan en la íntima. FORMACIÓN DE CÉLULAS ESPUMOSAS Una vez dentro de la íntima, los monocitos se transforman en macrófagos, y comenzarán a fagocitar partículas lipoproteínicas mediante una endocitosis mediada por receptores. Pasarán a ser células espumosas cuando se carguen de lípidos. Figura CA1-2. Por último, decir, que los macrófagos cargados de lípidos pueden liberar citocinas y factores de crecimiento, que desencadenan los acontecimientos celulares que complican la lesión (estimulando, por ejemplo, la producción de células musculares lisas ) 4 Es esta una de las causas de que la arteriosclerosis se de en las bifurcaciones y curvaturas de las arterias. 5 Y su migración a la capa íntima de la arteria. J. A., C. C., M.J.S. Valdés 4
116 TEMA Car-1 CARDIOLOGÍA CMG PLACA FIBROSA O ATEROMATOSA Es la lesión más importante de la AE. Va a estar causada por la evolución de las estructuras pertenecientes a la estría grasa y el engrosamiento difuso de la íntima. - Las lesiones son de color blanco, elevadas y obstructivas (muy importante) - Suelen localizarse en la aorta abdominal y en las arterias coronarias. CRECIMIENTO Y REMODELAMIENTO La placa de ateroma crece, pero lo hace alejándose de la luz (crecimiento abluminal). A la vez que crece, se va remodelando, induciendo a los vasos afectados a aumentar su diámetro (fenómeno que se conoce como agrandamiento compensador ), y permitiendo así que la luz de estos no disminuya significativamente. La luz del vaso comienza a estrecharse tardíamente, se estima que a partir de que la placa cubra el 40% de la circunferencia de la elástica interna. Esto hay que tenerlo muy en cuenta, pues hay casos en los que una obstrucción avanzada (del 30%) no presenta ningún síntoma. Figura CA1-3 Las CML que proliferan en la íntima van a dedicarse a producir proteínas, perdiendo su capacidad contráctil. Las fibras colágenas y elásticas, y los proteoglicanos sintetizados van a incrementar la cantidad de tejido conectivo de la íntima. Debido a este aumento de células (CML, macrófagos y linfocitos) y tejido conjuntivo, se va a formar la cápsula fibrosa. Ésta rodea al cúmulo de lípidos y células espumosas, y constituye el límite de la placa, limitando por tanto su crecimiento. Llegado este punto, la cápsula puede romperse y provocar un proceso agudo, o bien puede seguir creciendo, poniendo de manifiesto un proceso crónico. Las características de la placa fibrosa o ateromatosa son: - Tiene crecimiento abluminal: no crecen hacia la luz arterial - Posee tres componentes, la cápsula fibrosa (que la envuelve), el centro lipídico (donde se almacena la grasa, por lo que veremos células espumosas) y células (como las CMLy células de la sangre entre las que se incluyen a los macrófagos, linfocitos T ). Lesion initiation No symptoms Figura CA1-4 + Symptoms AMPLIACIÓN DE CONTENIDO DE INTERÉS. Evolución y complicación del Ateroma. Se ha observado que no todas las estrías grasas conducen a ateroma, de hecho, la característica esencial de la estría grasa es el depósito de macrófagos cargados de lípidos, mientras que en la placa fibrosa es la acumulación de tejido fibroso, por tanto, si en la estría grasa no se almacena tejido fibroso no evolucionará a placa fibrosa. Las CML sintetizan la mayor parte de la matriz extracelular de la lesión arterioesclerótica. J. A., C. C., M.J.S. Valdés 5
117 TEMA Car-1 CARDIOLOGÍA CMG Las últimas investigaciones han puesto de manifiesto que los mecanismos que podrían favorecer la emigración y proliferación de CML en la lesión inicial, y desencadenar la acumulación de matriz extracelular, son las citocinas y algunos factores de crecimiento estimulados por lipoproteínas modificadas (que regulan las funciones de las CML). Por ejemplo, el PDGF (factor de crecimiento de origen plaquetario) sintetizado por células activas del endotelio, pueden estimular la emigración de las CML, lo que permitiría que las CML de la túnica media emigren a la íntima. EL TGF Beta (factor de crecimiento transformador) puede estimular la producción de colágeno intersticial por parte de las CML. Observamos, poco a poco, la evolución de la estría grasa a una lesión fibrosa donde hay más CML y matriz extracelular. FASES PATOGÉNICAS DE STARY Debemos detallar un poco más el proceso patogénico de esta enfermedad. Como hemos visto, todo comienza con un daño endotelial, el cual puede deberse a diversos causas. Así, puede darse por lípidos oxidados que se introducen en las células endoteliales, por la producción de radicales libres que oxidan al colesterol, por problemas en la TA, etc. En definitiva, dicha lesión va a provocar que monocitos, linfocitos T y plaquetas se adhieran a la pared arterial, penetrando en el interior de la misma. Aquí, liberan sustancias que estimulan la producción de más monocitos, plaquetas, linfocitos T, CML, las cuales proliferan y se van acumulando. Poco a poco, se produce la emigración de las CML que facilitan la formación de la placa fibrosa, la cual puede continuar creciendo o bien, revertirse con el tratamiento adecuado. Veamos pues fase a fase la patogenia de la arterioesclerosis: Fase I -II: En este estadío, los lípidos se van almacenando progresivamente. Esta fase es asintomática. Fase III: Supone el engrosamiento difuso de la íntima, y es una fase poco importante clínicamente. Figura CA1-5 El ateroma puede evolucionar y complicarse con la trombosis y coagulación de la sangre. Así, la estría grasa avanzada producen pequeñas fisuras endoteliales, apareciendo microtrombos ricos en plaquetas, por la exposición de la matriz (muy trombógena) de la membrana basal subyacente, a la sangre. También se ha observado que las placas de ateroma establecidas tienden a acumular calcio, y de hecho, en las placas de AE se han identificado proteinas especializadas en la unión al calcio como osteopontina, osteocalcina, etc. FIN DEL CONTENIDO AMPLIADO Fase IV - V: Una vez acumulada la grasa, el proceso da un giro, de tal manera, que la placa fibrosa se rompe y contacta directamente con la sangre. El contenido de la placa es procoagulante y proagregante, lo que, al contactar con la sangre, dará lugar a un trombo. Dependiendo del tamaño del trombo, las consecuencias serán mayores o menores. A Si el trombo no obstruye totalmente el vaso, sino que estrecha su luz, se produce una súbita hipoxia del miocardio afectado, desencadenándose un síndrome agudo, que es la angina inestable o un infarto no Q. Con el tiempo, progresará hacia un síndrome crónico, el cual podrá sufrir futuras roturas. Este J. A., C. C., M.J.S. Valdés 6
118 TEMA Car-1 CARDIOLOGÍA CMG síndrome crónico no es más que la Angina Estable. B En cambio, es posible que el fragmento sea de gran tamaño, de modo que el coágulo sea tal que obstruya el vaso súbitamente al 100%. Esto ocasiona, como es de suponer, un Síndrome Agudo (sin sintomatología previa en la mayoría de casos). La principal consecuencia de este síndrome, es la detención brusca del flujo coronario, lo que ocasiona un déficit de aporte de oxigeno, Angina inestable (que tiene una mortalidad del 5% en el primer año), IAM o infarto Q (cuya mortalidad es del 20% en ese momento) o incluso Muerte súbita. Los IAM se producen cuando no hay circulación colateral desarrollada (pues recordemos que el estímulo hipóxico de crisis isquémicas repetidas induce el desarrollo de circulación colateral). Si el paciente sobrevive a la obstrucción, el trombo formado se organizará, (concepto de AP). CONCEPTOS DE PLACA SIMPLE Y COMPLICADA, ESTABLE Y VULNE- RABLE No todos los ateromas muestran la misma tendencia a la rotura, y de hecho, las placas se clasifican en vulnerables y estables según su facilidad para romperse o no. Esta capacidad depende del contenido lipídico (la cantidad de lípidos) y del grosor de la capa fibrosa (la cantidad de tejido fibroso). A Placa Estable. Así, si tenemos una capa fibrosa densa y gruesa, ésta se romperá con más dificultad y si lo hace, ocasionará un síndrome crónico. Es, por tanto, una placa estable. Este tipo de placa dará sintomatología cuando la luz de la arteria se reduzca ostensiblemente, existiendo personas asintomáticas aún con tan sólo un 30% de la luz vascular normal libre. Estas placas crecen más lentamente que las inestables., y van a producir procesos crónicos (anginas estables o de esfuerzo). B Placa Inestable. Por el contrario, si la placa fibrosa (ó casquete) es delgada, con gran cantidad de grasa y de macrófagos, tenderá a romperse con facilidad, ocasionando cuadros agudos. Es una placa inestable. Suele tener un crecimiento más rápido que la estable. Al romperse, ocasinará trombos, que llevarán a procesos agudos, más peligrosos que los crónicos. Se ha observado que en la zona de rotura de la placa predominan macrófagos y Lt, con escasas CML. También, que las células localizadas en la zona de rotura poseen marcadores de inflamación, como el Ag HLA-DR, que no aparecen en células de arterias sanas. Estas zonas suelen ser la zona de transición entre el endotelio normal y la placa ateromatosa. Por otra parte, se pueden clasificar las placas en simples y complicadas. A Placa Simple. La placa fibrosa simple es aquella que obstruye el flujo, de forma crónica. La magnitud de los síntomas viene dada por la estenosis en la luz del vaso, y no por el tamaño de la cápsula. B Placa Complicada. La placa de tipo complicada va a producir la obstrucción aguda del flujo. Entre los responsables de la mayor o menor vulnerabilidad de la placa fibrosa se incluyen los mediadores de la inflamación. Así, la citosina IFN-gamma (derivada de los Lt, y que induce la expresión del Ag HLA-DR) inhibe el crecimiento y la síntesis de colágeno por la CML, resultando una placa fibrosa débil, que se rompe con relativa facilidad. RESUMEN CONCEPTUAL Por si acaso nos hemos liado con tanto término, conviene, una vez expuestos los conceptos en los que puede evolucionar una placa, verlos conjuntamente para aclararnos. La AE es la principal causa de Cardiopatía Isquémica. Dependiendo de que la placa fibrosa sea simple o complicada, las manifestaciones y síntomas de la enfermedad serán diferentes. Ante una placa estable, se va a ir produciendo un crecimiento progresivo de la placa, que obstruirá cada vez más la arteria coronaria J. A., C. C., M.J.S. Valdés 7
119 TEMA Car-1 CARDIOLOGÍA CMG en cuestión. Esto va a permitir un flujo coronario en reposo, pero ante un aumento de la demanda, el miocardio recibirá menos oxígeno del que necesita. Es un Síndrome Crónico, una Angina Estable. Ante una placa inestable, ésta tenderá a romperse. Se formará un trombo, que puede ocluir total o obstruir parcialmente a la arteria coronaria. Se ocasionará un Síndrome Coronario Agudo. MANIFESTACIÓN DE LA ROTURA EN EL ECG La rotura de la placa puede reflejarse en el ECG de dos maneras: ELEVACIÓN DEL SEGMENTO ST Indica que el vaso está obstruido, por lo que no hay aporte de oxígeno, con la consiguiente isquemia. Estamos ante un síndrome coronario agudo. Es preciso intervenir rápidamente. DESCENSO DEL SEGMENTO ST Aquí la placa fragmentada da lugar a un trombo, que permite el paso de la sangre. No hay obstrucción total, y tampoco isquemia. Es también un síndrome coronario agudo, pues ocurre de repente. Volviendo a la cardiopatía isquémica, hay que señalar que esta enfermedad es causada por la isquemia miocárdica, debido a la obstrucción del flujo por la AE. Sus manifestaciones pueden ser cronicas (que es la angina estable) o agudas (angina inestable, infarto). Este punto se tratará mas adelante. E TIOLOGÍA DE LA AE Concretamente, no se conoce una causa clara de la AE hasta el día de hoy. No obstante, sí tenemos evidencia de una serie de factores de riesgo cardiovasculares. Se podría decir que influyen directamente en las posibilidades que tiene un individuo de sufrir la clínica de un episodio arteriosclerótico. Se clasifican en: 1. Modificables y no modificables 2. Mayores y menores en función de la importancia que tengan en la producción de la AE Los no modificables son aquellos que no podemos evitar ni cambiar. Nos referimos a : la edad (a más edad, peor estado arterial), los factores genéticos (los antecedentes de cardiopatía en familiares de primer orden), el sexo (es posible que los estrógenos de la mujer la protejan hasta la menopausia) Los modificables son aquellos sobre los cuales podemos tomar el control, y cambiarlos. Por ejemplo: la obesidad, el tabaco, el sedentarismo... Sin duda alguna, los que mayor importancia tienen son los modificables mayores. Esto es debido a que son aquellos sobre los que podemos influir, y que además demuestran una amplia causalidad en la evolución de la AE. Los modificables mayores más importantes son: La diabetes mellitus. Es, sin duda, el más importante. Un diabético va a ver elevadas sus posibilidades de sufrir un episodio AE mucho más que un no diabético similar. Los niveles de LDL/HDL Los niveles de colesterol El tabaco La HTA Estos factores de riesgo alteran las funciones normales del endotelio vascular, que son: el control local del tono vascular, el mantenimiento de una superficie anticoagulante y la J. A., C. C., M.J.S. Valdés 8
120 TEMA Car-1 CARDIOLOGÍA CMG defensa contra las células inflamatorias. La pérdida de estas defensas conlleva una constricción inadecuada, formación de coágulos luminales e interacciones anormales con monocitos y plaquetas. Este último fenómeno conduce al desarrollo de placas ateroscleróticas, que producen una disminución de la sección transversal de los vasos, una estenosis. NIVELES DE COLESTEROL El colesterol total mide la cantidad de las diferentes partículas ricas en colesterol que circulan por el plasma, que son, entre otras, las HDL, las LDL, las VLDL, incluso los TAG (triacilgliceridos libres)... A causa de esto, el colesterol total tiene poco interés en este aspecto. Se deben analizar los niveles de HDL y LDL, los dos más importantes, pues, como veremos más adelante, el riesgo de sufrir los síntomas de la AE está en proporción a la cantidad de estas lipoproteínas en sangre. Centrándonos en los niveles de colesterol, podemos ver que una población cambia, con el tiempo, sus niveles de colesterol al migrar a un país determinado. Esto indica que este parámetro se encuentra influenciado por el ambiente. Analizando cada tipo de lipoproteínas, se ha comprobado que unos niveles de HDL bajos predisponen a enfermedad AE. Se ha establecido como factor de riesgo tener unos niveles inferiores a 55 mg/dl en la mujer, mientras que en el hombre se establece ese límite en los 45 mg/dl. Con los niveles de LDL funciona al revés que con los de HDL. Por ello, unos niveles bajos de LDL van a dar una menor probabilidad de sufrir un accidente AE, así como uno niveles altos de LDL van a aumentar el riesgo de sufrirlo. Cuanto más bajos sean los niveles de LDL, mejor. No obstante, cabe añadir que los niveles de LDL que se toman como moderadamente patológicos son, en la población sana, los que superan los 130 mg/dl TABACO Se ha comprobado que el tabaco tiene efectos perjudiciales para el flujo sanguíneo. Varios de sus componentes van a producir vasoconstricción, y van a limitar el flujo sanguíneo, pues dañan a la célula endotelial. Ya se han enumerado las características e importancia de las células endoteliales, y sabemos cómo su mal funcionamiento afecta al proceso AE. Con un solo cigarrillo ya dañamos algunas células endoteliales de nuestro cuerpo. El tabaco podría favorecer la trombosis o algún otro determinante de la estabilidad de la placa aterosclerótica, así como la evolución de la propia lesión aterosclerótica. Además en los fumadores se muestran altos niveles de fibrinógeno. No debemos olvidar que los fumadores pasivos sufren también de los perjuicios que los cigarros causan al sistema vascular. De cada tres cigarros que te fumas a mi lado, uno es mío también HTA Cuanto mayor sea el tiempo de evolución de la HTA mayor alteración se producirá. La localización de los efectos varía con la enfermedad. Se ha demostrado que el tratamiento de la HTA conlleva un descenso de los niveles de AE. DIABETES MELLITUS Es el factor de riesgo más importante. Acelera la aterogénesis. Provoca una alta mortalidad. Las dislipemias asociadas a la diabetes fomentan también la aterogénesis. La combinación de resistencia a la insuliuna elevación de los triglicéridos y disminución de las HDL, acompañada por lo general de obesidad central e hipertensión (tan común en diabéticos tipo II) parece acelerar el desarrollo de aterogénesis. La hiperglucemia favorece la glucosilación no enzimática de las LDL. Estas LDL modificadas, al igual que las LDL oxidadas, desencadenarían los episodios iniciales de la aterogénesis. Se puede correlacionar la cantidad de hidratos de carbono en sangre con el riesgo a sufrir un J. A., C. C., M.J.S. Valdés 9
121 TEMA Car-1 CARDIOLOGÍA CMG accidente cardiovascular por AE. A más glucosa en sangre, mayor riesgo. OTROS FR Se sabe que hay otros factores de riesgo que se encuentran ligados a una mayor incidencia del síndrome AE, de entre los cuales, los más científicamente probados son: Síndrome metabólico Inflamatorios: Fbng, PCR Obesidad Sedentarismo Otros son: Lipídicos: TAG, LpA (inhibe fibrinólisis por competición), VLDL Homocisteína (estimula la trombosis). Infecciosos: clamidia, citomegalovirus, HP, virus herpético Hematológicos Conducta y estrés Oxidantes Hormonales: estrógenos Alcohol Prevención primaria: tratar al paciente actuando sobre los factores de riesgo antes de sufrir la enfermedad aterosclerótica. Prevención secundaria: tratar al paciente actuando sobre los factores de riesgo cuando ya ha sufrido la enfermedad aterosclerótica. Es más agresiva. Suma de Factores de Riesgo CV: Efecto Multiplicativo del Riesgo Tabaco Hipertensión (TAS 195 mmhg) x3 X4.5 x9 x16 X1.6 x6 x4 Figura CA1-6. Colesterol (300 mg/dl) PESO DE LOS DISTINTOS FR El riesgo al que está expuesto un individuo es linealmente proporcional al grado de exposición a un determinado factor de riesgo. No todos los factores de riesgo tienen el mismo peso ante una determinada lesión. Sabemos que la HTA actúa sobre todo en los accidentes cerebrales, mientras que el tabaco tiene especial relevancia en los accidentes AE a nivel de las coronarias. Según diversos estudios, como el Framingham, se sabe que los efectos de sufrir varios factores de riesgo no siempre son sumatorios, sino que, en determinadas situaciones, pueden ser incluso mucho más que exponenciales. Para terminar, cabe destacar los tipos de prevención que podemos llevar a cabo: J. A., C. C., M.J.S. Valdés 10
122 TEMA Car-1 CARDIOLOGÍA CMG ANEXO En último lugar, hemos añadido un par de gráficas que puso Valdés en clase, y con las que se puede determinar el riesgo individual que una persona tiene de sufrir un accidente arterioscleroso, según los distintos FR que tenga el individuo Varones Riesgo de enfermedad coronaria mg/dl mmol/l No fumador mg/dl mmol/l CARDIOVASCULAR Fumador mg/dl mmol/l Mujeres Riesgo de enfermedad coronaria No fumadora mg/dl mmol/l Fumadora edad edad Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) edad edad mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol Varones con diabetes Riesgo de enfermedad coronaria mg/dl mmol/l No fumador mg/dl mmol/l Fumador mg/dl mmol/l Mujeres con diabetes Riesgo de enfermedad coronaria No fumadora mg/dl mmol/l Fumadora edad edad Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) edad edad mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol J. A., C. C., M.J.S. Valdés 11
123 TEMA Car-2 CARDIOLOGÍA CMG CARDIOPATÍA ISQUÉMICA ANGINA ESTABLE Como ya sabéis esta porción del temario la explica el profesor Valdés. Para el que no lo sepa aún, este señor nos viene repitiendo con cierta periodicidad que el contenido de las clases (que nosotros incluimos en la comisión) sólo sirve de mera presentación del contenido, y NO es el contenido que va para examen. El contenido de examen no es ni más ni menos que la parte referida a su tema de la última edición del Harrison en inglés, que a día de hoy ( ), es la 17ª, y aún no está traducida al castellano, ni a la venta en tiendas (por lo que sé, sólo se puede conseguir por Internet). Deduciríamos de esto (o querríamos deducir), con sano juicio, que el contenido de examen es dicho temario de la edición 16ª... I NTRODUCCIÓN La angina de pecho estable es un síndrome clínico causado por la isquemia miocárdica transitoria. La palabra angina está tomada del latín y significa estrechamiento, con lo que angina de pecho significa literalmente estrechamiento del pecho, denominación que resulta muy apropiada para referirse al tipo de dolor que forma parte de este síndrome, como veremos más adelante. La angina estable conlleva un dolor opresivo, generado durante un esfuerzo que produce un aumento de las demandas del músculo cardiaco. El desequilibrio entre la oferta y la demanda de O 2 produce la sintomatología en estos pacientes. La angina de pecho se puede clasificar según su severidad. La clasificación más utilizada es la de la CCS 1 : Calificación de la angina de pecho según la CCS...? I: La actividad física ordinaria no causa angina, por ejemplo, caminar o subir escaleras. La angina aparece con el ejercicio laboral o recreativo que es extenuante, rápido o prolongado. II: Limita ligeramente las actividades ordinarias. La angina aparece al caminar o subir escaleras rápidamente; caminar en una pendiente; caminar o subir escaleras después de comer; cuando hace frío o viento o bajo el estrés emocional; o únicamente durante las primeras horas después de despertar. Aparece al caminar más de dos cuadras y subir más de un tramo de escaleras regulares a paso normal y en las circunstancias acostumbradas. III: Limita considerablemente la actividad física ordinaria. La angina aparece al caminar una o dos cuadras y subir un tramo de escaleras bajo las circunstancias acostumbradas y a paso normal. IV: Impide cualquier actividad física, algunas veces aparece incluso durante el reposo. 1 Canadian Cardiovascular Society. (tomada del Harrison) A.A., C.C., M.J.S. M. Valdés 1
124 TEMA Car-2 CARDIOLOGÍA CMG Las clases I y II corresponden a la angina estable (o síndrome coronario crónico), mientras que las clases III y IV pertenecen a la angina inestable (una de las formas del sd. coronario agudo), ya que esta última no tiene por qué ir acompañada de esfuerzo. El umbral de esfuerzo para que aparezca la angina de pecho varía según la hora del día y el estado emocional. De este modo, se denomina angina de primoesfuerzo a la que aparece con el primer esfuerzo de la mañana y no vuelve a darse durante el resto del día. Este fenómeno es debido a la mayor vasoconstricción existente por la mañana en relación a la de la tarde o la noche. Cuadro de ampliación de especial interés, no es del Harrison, no para examen Cronobiología de la cardiopatía isquémica Los acontecimientos patológicos en el sistema cardiovascular no ocurren aleatoriamente en el tiempo. Como ya hemos visto, la angina estable se produce con más frecuencia por la mañana, pero es ésta la única patología cardiovascular con un patrón circadiano de aparición? Lo cierto es que, por ejemplo, el inicio de infartos de miocardio, fatales o no, predomina en torno a las 6:00-12:00 horas. Al igual, se ha observado un patrón similar en la muerte súbita, en la presencia de arritmias ventriculares, en la incidencia de embolia arterial y en la aparición de síntomas de isquemia en pacientes con enfermedad coronaria. El mecanismo fisiopatológico de este predominio matutino en la enfermedad cardiovascular es multifactorial. De este modo, en estas horas hay aumento de la presión arterial, del tono simpático, así como de la concentración de hormonas vasopresoras. Además, los estudios cronobiológicos demuestran una menor actividad fibrinolítica y una mayor agregabilidad plaquetaria en esta franja horaria. Estos fenómenos deben ser conocidos por el clínico, no sólo por el tratamiento de las crisis agudas en su momento de aparición, sino también por la importancia de la terapéutica de prevención de los eventos coronarios, que debe tener en cuenta estos ritmos en su fisiopatología. La disciplina que trata de dilucidar estas cuestiones, en cualquier ámbito de la terapéutica, es la cronofarmacología. Para más información: Cronobiología básica y clínica (Juan Antonio Madrid et al) La trascendencia epidemiológica y de salud pública de este síndrome es enorme. Por e- jemplo, su prevalencia es de 11 millones de afectados en EEUU. Además, produce más muertes, incapacidades y pérdidas de trabajo que cualquier otra enfermedad. Por último, señalar que su incidencia aumenta con la edad, con lo que el progresivo envejecimiento de la población en los países desarrollados acrecienta aún más el problema. E TIOLOGÍA En el 95% de los casos, la etiología de la angina estable es la arteriosclerosis coronaria. El 5% restante corresponde a una miscelánea de entidades entre las que destacan la estenosis aórtica o la miocardiopatía hipertrófica. F ISIOPATOLOGÍA Depende del equilibrio entre ingresos y gastos del corazón. Los ingresos los aporta el flujo coronario, el cual puede aumentar por vasodilatación en determinadas ocasiones. Los gastos vienen determinados por tres factores: la contractilidad, la frecuencia cardiaca (una FC de 120 lpm dobla en consumo a una de 60 lpm) y el estrés de la pared (depende de la precarga y la postcarga). Cuando este equilibrio se rompe se produce la isquemia, que provoca en el músculo una serie de alteraciones. Éstas son, por orden de aparición: 1. Alteraciones a nivel celular: Como consecuencia del déficit de oxígeno, el metabolismo celular pasa a ser anaerobio, cayendo el rendimiento energético de forma brusca (de las 36 moléculas de ATP que se obtienen de una molécula de glucosa en presencia de oxígeno se pasa a 2 únicas moléculas en anaerobiosis). 2. Alteraciones de la función: - Diastólica: Existen modificaciones en el llenado, aunque éstas no se buscan para el diagnóstico. A.A., C.C., M.J.S. M. Valdés 2
125 TEMA Car-2 CARDIOLOGÍA CMG - Sistólica: Disminuye la contractilidad de la zona isquémica. Este hecho se puede cuantificar con técnicas diagnósticas, como la ecocardiografía. 3. Alteraciones de la perfusión: Disminuye el aporte de oxígeno al miocardio. Se puede valorar también en la práctica clínica, por ejemplo con estudios isotópicos. 4. Cambios eléctricos del corazón: Se objetivan mediante el ECG. Ninguna manifestación electrocardiográfica es patognomónica, aunque lo más típico es el descenso del segmento ST. C LÍNICA En algunos casos no aparece clínica. Se trata de pacientes que pueden sufrir un episodio de isquemia sin ser conscientes de ello. Aún así, casi todos los pacientes presentan clínica (90%). Para poder entender las manifestaciones clínicas debemos recordar por qué se produce la angina. Cuando un paciente realiza un esfuerzo aumenta la TA y la FC, aumentando consecuentemente la demanda de oxígeno del músculo cardiaco. En este caso, si existe alguna coronaria obstruida, no se podrá aumentar la oferta de oxígeno, ya que no será posible elevar el flujo. Aparecerá así un desequilibrio entre oferta y demanda, y por tanto, una isquemia. Esto genera unos cambios eléctricos, de perfusión y de contractibilidad que se pondrán de manifiesto mediante técnicas diagnósticas El paciente típico de esta patología suele ser un varón de años, o una mujer de años que acuden a la consulta refiriendo molestias torácicas de pesadez, compresión, constricción o sensación de asfixia. Estos síntomas suelen durar entre 1 y 5 minutos, teniendo una duración máxima de 10 minutos, y en el 99% de lo casos se relacionan con un esfuerzo. Normalmente desaparecen con el reposo, y con la administración de NTG (nitroglicerina) sublingual a los 2-3 minutos. Cuando se le pide al paciente que localice la sensación, es característico que la ubique presionando el esternón, a veces con el puño cerrado, indicando sensación de opresión retroesternal. La molestia suele irradiarse al hombro izquierdo y a ambos brazos (más al izquierdo), predominando la irradiación a los bordes cubitales de la mano y antebrazo. También puede extenderse a espalda, cuello, mandíbula, dientes y epigastrio. A diferencia de lo que ocurre en el síndrome coronario agudo, en el crónico no existe sintomatología vegetativa acompañante. Es obvio que cada paciente tiene un umbral a partir del cual se desarrolla la angina. Este umbral puede permanecer fijo en el paciente, o ser variable (en el mismo día o de un día a otro). Así, hay pacientes que refieren los síntomas con un pequeño esfuerzo matinal (como afeitarse), mientras que a mediodía son capaces de realizar esfuerzos mayores sin ninguna molestia (recordemos el ejemplo de la angina de primoesfuerzo). En el interrogatorio del paciente es importante descubrir los antecedentes familiares positivos de cardiopatía isquémica prematura (familiares de primer grado varones menores de 45 años y mujeres menores de 55), diabetes, HTA, hiperlipidemia, tabaquismo etc. En cuanto a la naturaleza de la consulta, el paciente no suele ir a urgencias en el primer episodio anginoso, ni tampoco en episodios posteriores. Le quita importancia a su dolor dado que éste remite con el simple reposo, y finalmente suele acudir tras varias crisis anginosas a su consulta de atención primaria. A continuación podemos ver un cuadro resumen con la clásica clínica de un episodio de angina estable: A.A., C.C., M.J.S. M. Valdés 3
126 TEMA Car-2 CARDIOLOGÍA CMG EXPLORACIÓN FÍSICA Con frecuencia, la exploración es normal, sobre todo si el paciente está en periodo intercrítico. En la exploración entre crisis debemos prestar mucha atención, ya que a través de ella podemos identificar signos de factores de riesgo asociados a arteriosclerosis coronaria, como xantelasmas (por el cúmulo de lípidos), xantomas o lesiones cutáneas diabéticas. También se suelen observar manchas de nicotina en los fumadores. Además, en la palpación se puede notar un engrosamiento o ausencia del pulso en las arterias periféricas, signos de dilatación cardiaca o contracción anormal de la punta cardiaca. En la auscultación (que se realiza mejor con el paciente en decúbito lateral izquierdo) se pueden observar soplos arteriales, 3º y 4º ruidos. En plena crisis, se puede observar un aumento de la TA y de la FC y el 4º ruido (signos totalmente inespecíficos). También podría existir una insuficiencia ventricular transitoria, soplo sistólico por regurgitación mitral, edema pulmonar, etc CUADRO CLÍNICO Según la clínica, podemos clasificar a los pacientes en tres grupos en función de la sintomatología que presenten. El cuadro clínico puede ser: Típico: Se relaciona con el esfuerzo, dura entre 5-10 minutos, cursa con el clásico dolor retroesternal opresivo, y cesa con el reposo. En estos pacientes la probabilidad de que estén sufriendo realmente un episodio isquémico de angina estable depende del sexo y de la edad. En mayores de 70 años, por ejemplo, la probabilidad si el paciente es hombre es del 90%, y si es mujer del 50-60%. Las mujeres dan más falsos positivos, ya que tienen una menor incidencia de angina estable antes de una edad avanzada, con lo que el valor predictivo positivo de esta clínica típica es mayor en hombres que en mujeres para una misma edad. Atípico: El dolor en estos cuadros puede ser muy localizado, o agudo y migratorio, o sordo y prolongado En hombres mayores de 70 años, el 50 % de estos cuadros será debido a angina estable. En mujeres sólo el 20%. Inespecífico: Es un cuadro sin relación con el esfuerzo, sin la duración típica, etc. En definitiva, un dolor torácico inespecífico que conlleva, en mayores de 70 años, una probabilidad de estar sufriendo una angina estable del 20% en hombres y del 5% en mujeres. En resumen, con todo lo anterior se quiere dejar claro que no es oro todo lo que reluce en el diagnóstico de la angina estable. De hecho, existen, como habéis podido comprobar, varias posibilidades de clínica muy distantes del típico cuadro que tantas veces se nos ha explicado y, por otra parte, este cuadro típico no siempre implica existencia de un evento isquémico. D IAGNÓSTICO La clínica, ya estudiada, nos orienta y nos hace sospechar una angina estable pero, como es lógico, es necesario un diagnóstico de certeza. Para llegar a él se emplean diferentes pruebas en las que se persigue objetivar la isquemia. La isquemia se pone de manifiesto en tres tipos de pruebas que se combinan usualmente con una prueba de esfuerzo para inducir en el paciente la crisis anginosa. Con lo que tenemos que: Tipo eléctrico: ECG Clínica Objetivar la isquemia con pruebas de: De perfusión: Isotópicas De movilidad de la pared: ECO Sospecha Diagnóstico En cuanto al modus operandi, cada una de las pruebas se debe hacer siempre en dos situaciones diferentes, una en reposo (que presu- A.A., C.C., M.J.S. M. Valdés 4
127 TEMA Car-2 CARDIOLOGÍA CMG miblemente será normal), y otra bajo condiciones de estrés (que a priori será patológica, y en consecuencia diagnóstica). Las pruebas requeridas son las que siguen: 1 De tipo eléctrico: Se basa en la realización de un ECG. Lo que esperamos encontrar en un ECG durante un episodio de angina estable (prueba de estrés) es un descenso del segmento ST que desparece tras la finalización del esfuerzo. Sin embargo, si el paciente posee descenso del segmento ST en reposo, hecho que no es patognomónico y que se puede dar en trastornos pericárdicos, valvulares o miocárdicos, el ECG no será válido para el diagnóstico, ya que no habrá diferencias entre la prueba basal y la de estrés 2. AMPLIACIÓN DE CONTENIDO DE INTERÉS. El segmento ST suele estar deprimido durante la angina, pero a veces puede estar elevado, como se da en la angina de Prinzmetal. Se trata de un trastorno cardíaco poco frecuente, caracterizado por ciclos de dolor anginoso, generalmente después de un evento estresante como la abstinencia de bebidas alcohólicas o la exposición al frío. Se produce por un tipo de oclusión arterial que no está relacionada con la aterosclerosis. Está asociada a espasmos de la musculatura que envuelve a la arteria coronaria, una arteria que irriga al corazón, haciendo que ésta se ocluya, disminuyendo o deteniendo temporalmente el flujo sanguíneo que nutre al corazón. FIN DEL CONTENIDO AMPLIADO 2 De perfusión: Se trata de estudios con isótopos radiactivos que utilizan Tc 99m sestamibi o Talio 201 como trazadores. Cuando la perfusión está reducida en un área del miocardio, la gammagrafía muestra un defecto o zona fría que permite localizar la zona isquémica. Mediante la prueba efectuada bajo condiciones de esfuerzo, se detectan los defectos reversibles de perfusión en caso de isquemia 3. 2 La incidencia de falsos + aumenta en pacientes tratados con F cardioactivos, en alteraciones de la conducción A- V, hipertrofia ventricular, descenso del ST (Harrison) 3 Las imágenes se toman inmediatamente después de que cese el ejercicio y 4h más tarde para confirmar la isque- 3 De movilidad de la pared: La prueba que se realiza es un ecocardiograma. Éste diagnostica defectos segmentarios de la motilidad y propicia una evaluación global de la función ventricular a través de la medición de la fracción de eyección. PRUEBA DE ESFUERZO Su finalidad es inducir isquemia mediante un aumento progresivo de la carga de trabajo externo, mientras se vigila de forma continua el ECG, los síntomas y la presión arterial en el brazo. Para ello se realiza un registro electrocardiográfico de 12 derivaciones antes, durante y después del ejercicio en una cinta sin fin (treadmill) o utilizando una bicicleta ergométrica. La prueba dura 9-12 minutos e incluye varias etapas o estadios con esfuerzo creciente y aumento progresivo de la carga en cada estadio (cada 3 min aprox.). Se producirán cambios en la frecuencia cardiaca y la tensión arterial. En caso de que el paciente no pueda realizar ejercicio, se pueden administrar fármacos como la dobutamina (para un ecocardiograma de esfuerzo), el dipiridamol (utilizado en el estudio de perfusión con radioisótopos + esfuerzo), o la adenosina (estudio de perfusión + esfuerzo) 4. La prueba suele interrumpirse ante la aparición de síntomas de molestias torácicas, disnea importante, mareos, fatiga o depresión del segmento ST superior a 0.2 mv (2 mm), disminución de la presión arterial sistólica superior a 10 mmhg o taquiarritmias ventriculares. La respuesta isquémica del segmento ST se define como una depresión plana del ST superior a 1mV (1mm) por debajo de la línea basal (segmento PR) que dura más de 0,08segundos. mia reversible y las regiones de ausencia persistente de captación, que significarían infarto. 4 La dobutamina es un beta-agonista que produce un aumento de la contractilidad (inotropismo +), y que así eleva las demandas del músculo cardiaco. Mientras que el dipiridamol es un vasodilatador e inhibe la agregación plaquetaria, ambas acciones mediadas por un aumento de los niveles de adenosina, la cual se puede administrar directamente. Los vasos coronarios de la zona isquémica no son afectados (no se dilatan) por el dipiridamol, probablemente por estar ya dilatados al máximo, lo que se puede objetivar con estas pruebas diagnósticas. A.A., C.C., M.J.S. M. Valdés 5
128 TEMA Car-2 CARDIOLOGÍA CMG actitud terapéutica dependiendo de algunos aspectos como: patologías de base, función ventricular, localización de la lesiones (proximal, media y distal), número de vasos coronarios afectados, grado de estenosis que produce la lesión etc. Por ello se realiza una división de los pacientes en bajo riesgo y alto riesgo 5. Para aumentar la eficacia de la prueba de esfuerzo (con electrocardiografía, se sobreentiende), se combina con la ecocardiografía, que desenmascara regiones de acinesia o discinesia, y con un estudio de imagen con perfusión miocárdica, que permite observar un defecto pasajero de perfusión. Esta combinación de pruebas se realiza para aumentar la sensibilidad, especificidad y valor predictivo positivo del estudio diagnóstico global. Estas pruebas no tienen un 100% de sensibilidad, ya que pueden ser negativas aún existiendo isquemia, debido al desarrollo de ramas colaterales, riego muy abundante por otra arteria coronaria, tratamiento con fármacos cardioactivos, etc. El valor predictivo positivo (VPP) aumentará conforme aumente el número de vasos afectados, es decir, con 1 vaso afectado el 50% de los pacientes tendrá un verdadero resultado positivo para la isquemia, con 2, el VPP aumentará hasta el 60% y así sucesivamente. Es importante señalar que estos valores serán diferentes según la clínica del paciente, teniendo valores predictivos positivos máximos con la clínica clásica, y menores en clínicas atípicas o inespecíficas. En la práctica, se utiliza la combinación prueba de esfuerzo (con ejercicio o dobutamina) con ECG y ecocardiografía, ya que estas dos exploraciones complementarias son muy accesibles para el cardiólogo, mientras que el estudio isotópico requiere de la participación de otros servicios del hospital. Los resultados son muy similares comparando ambos métodos. P RONÓSTICO Una vez objetivada la isquemia, debemos clasificar a los pacientes según el pronóstico. Como es obvio, es distinto el pronóstico y la Los pacientes de alto riesgo tendrán pruebas diagnósticas que demostrarán una isquemia más marcada (mayor descenso ST, mayor precocidad en la positividad de la prueba, etc.) y tendrán una mayor probabilidad de infarto y muerte. PROBAR LESIONES ARTERIOESCLERÓ- TICAS OBSTRUCTIVAS EN ARTERIAS CO- RONARIAS Una vez clasificados los pacientes en grados de bajo o alto riesgo, sólo a los de alto riesgo se les hará una prueba anatómica. Los que sean etiquetados de bajo riesgo, recibirán directamente tratamiento médico. Recapitulando, recordemos que nos llegó un paciente con una clínica determinada (normalmente a una consulta programada y no a la puerta de urgencias como en los síndromes agudos). Sospechamos de un síndrome coronario crónico (es decir, angina estable), le realizamos una serie de pruebas para objetivar la isquemia, lo clasificamos en un pronóstico de bajo o alto riesgo. Si después de todo esto, el paciente tiene un pronóstico de alto riesgo, le realizamos una prueba anatómica que nos indicará la presencia o ausencia de arteriosclerosis coronaria obstructiva, y la ubicación de la misma. Importante: las pruebas anatómicas NUNCA demuestran isquemia. Existen dos posibilidades de pruebas anatómicas: TC multicorte: Método no invasivo que irradia 10 veces más que la coronariografía. Consiste en la realización de 64 cortes a gran velocidad, venciendo el handicap del movimiento cardiaco. Otros métodos no invasivos son la Rx simple de tórax (sólo permite la visualización de placas calcificadas) o la resonancia magnética nuclear, ambas menos útiles que el TC multicorte. 5 Los pacientes de BR con profesiones muy estresantes (pilotos, policías ) deben considerarse de alto riesgo. A.A., C.C., M.J.S. M. Valdés 6
129 TEMA Car-2 CARDIOLOGÍA CMG Coronariografia: Método invasivo (cateterismo cardiaco). Consiste en la introducción de un catéter en las arterias coronarias a través de una arteria periférica e inyección de un contraste yodado que opacifica el árbol coronario y permite analizar las lesiones coronarias. Otro método invasivo es el uso de ultrasonidos intracoronarios. Ninguna de las dos técnicas debe repetirse varias veces porque la TC emite mucha radiación y la coronariografia entraña cierto riesgo. Tampoco se deben realizar las dos pruebas, sino elegir entre una y otra. Es de elección la coronariografia, ya que, si se encuentra la lesión, se puede actuar sobre ella en el mismo momento. T RATAMIENTO Los pacientes con un síndrome isquémico crónico tienen buen pronóstico en general, pues la mortalidad se produce cuando éstos pasan a desarrollar síndromes coronarios agudos (como el IAM o angina inestable) que, además de muerte, causan disfunción permanente (por necrosis). El tratamiento de la angina estable puede ser médico o quirúrgico. Comenzaremos por el primero: TRATAMIENTO MÉDICO El objetivo básico de dicho tratamiento es el control global de la angina estable, mediante el control de la progresión de la arterioesclerosis y los síntomas anginosos. 1 Control de las enfermedades precipitantes o agravantes: consiste sobre todo en el retraso de la progresión de la arteriosclerosis mediante el control de los factores de riesgo cardiovascular, como el tabaco, la tensión arterial (especialmente la sistólica), los niveles de colesterol LDL y HDL y de TAG, el valor del IMC Además se aconsejan medidas beneficiosas como la realización de ejercicio aeróbico según las posibilidades del paciente. 2 Control de los síntomas anginosos: Se realiza mediante el uso de fármacos, como son los antiagregantes y los antianginosos. 1) ANTIAGREGANTES PLAQUETARIOS: Son fármacos que pueden incluirse tanto en el control de los síntomas como en el control de la arteriosclerosis. Como su propio nombre indica, impiden la agregación plaquetaria y la formación trombos tras la rotura de la placa, evitando de este modo que el paciente con síndrome crónico sufra síndromes coronarios agudos (angina inestable e IAM). El antiagregante que se usa actualmente es el ácido acetilsalicílico (AAS o Adiro 100mg/día). Si el AAS no es tolerado por el paciente se deben administrar otros fármacos antiagregantes como clopidogrel, ticlopidina o trifusal 6. 2) ANTIANGINOSOS: Estos fármacos pretenden disminuir las demandas del músculo cardiaco, impidiendo la isquemia, y así el dolor anginoso. Buscando esta finalidad, actúan disminuyendo la contractilidad, la FC, la precarga o la postcarga. Por lo tanto son tratamientos que persiguen reducir la aparición de síntomas. Entre éstos encontramos cuatro grupos de fármacos: A. β-bloqueantes: Este grupo de fármacos disminuye la contractibilidad cardiaca, la FC y la TA, antagonizando los efectos del sistema nervioso simpático. Sin embargo, al descender la FC, la presión de llenado al final de la diástole será mayor, lo que se traducirá en un aumento de la precarga. Aún así, el efecto neto es de disminución de las demandas. Ejemplos de este grupo son el propranolol o el atenolol. 6 El clopidogrel es inactivo in vitro y requiere una activación hepática para ejercer sus efectos como antiagregante plaquetario. El metabolito activo inhibe selectiva e irreversiblemente la agregación plaquetaria inducida por el ADP, impidiendo la unión de la adenosina difosfato al receptor plaquetario. El mecanismo de acción de la ticlopidina es similar, mientras que el del trifusal es análogo al del AAS. A.A., C.C., M.J.S. M. Valdés 7
130 TEMA Car-2 CARDIOLOGÍA CMG Se ha demostrado que el uso de estos fármacos en las horas de máxima incidencia de episodios coronarios (ver cuadro sobre cronobiología de la C. Isquémica) elimina el predominio matinal de esta enfermedad. B. Antagonistas del Calcio: Los antagonistas de los canales de calcio son un grupo muy heterogéneo según sus efectos, pero homogéneo en su mecanismo de acción. Distinguimos tres grupos de bloqueantes de estos canales útiles en la angina estable: las fenilalquilaminas (tipo verapamil), que hacen predominar la acción inhibitoria de la conducción cardiaca sobre la acción vasodilatadora periférica; las dihidropiridinas (por ejemplo el nifedipino), que se caracterizan por intensa vasodilatación periférica y escasa acción en la conducción cardiaca; y las benzotiazepinas (tipo diltiazem), con unas características intermedias entre los anteriores. En general sus acciones tienden a mejorar el aporte sanguíneo mediante vasodilatación y a disminuir las demandas inhibiendo la conducción cardiaca, lo que aumenta el umbral de aparición de angina. C. Nitratos: Son vasodilatadores, fundamentalmente venosos, lo que se traduce en un descenso de la precarga y postcarga, manteniéndose la contractibilidad invariable y aumentando la FC (pues ha disminuido la precarga) de forma moderada. Se administra tanto en parches (acción prolongada) como en pastillas orales, que se han de colocar sublinguales (acción casi instantánea). También existe la opción de grageas ingeridas o masticadas, o la administración transmucosa mediante spray. Uno de los preparados más famosos y más ampliamente utilizados es la cafinitrina, una gragea de administración sublingual que consta de nitroglicerina, el nitrato que produce vasodilatación a través del aumento de GMP c en la célula muscular lisa vascular, y citrato de cafeína. Actualmente se tiende a usar más un preparado denominado vernies, presentado en una gragea más blanda que la cafinitrina, que se deshace mejor en la boca. Uno de los efectos secundarios más importantes de este grupo es la cefalea, la cual se puede combatir con el ajuste individual de la posología del fármaco. D. Ivabradina: Es un fármaco de reciente aparición que disminuye la FC. Su mecanismo de acción es la inhibición selectiva y específica de la corriente If en el nódulo seno-auricular, marcapasos fisiológico cardiaco, que controla la despolarización diastólica espontánea y regula la frecuencia cardiaca. Se administra en angina de pecho estable crónica, en pacientes con un ritmo sinusal normal que no puedan utilizar betabloqueantes (por ejemplo en asmáticos). La medicación se ajustará en función de las características de cada paciente, por ejemplo, según la frecuencia de las crisis. Si las crisis son muy puntuales no debemos prescribir tratamiento crónico, bastará con la toma de nitratos de acción rápida (NAR) en el momento del evento anginoso. Normalmente se le indica al paciente que tome el NAR en el comienzo de la crisis (no cuando el dolor se haga insoportable), pues su efecto comienza aproximadamente a los 2 minutos, mientras que, por ejemplo, el de los β-bloqueantes comienza a los 20 minutos. Además, existen otros aspectos a considerar. Por ejemplo, si el paciente es bradicárdico de por sí, estarían contraindicados aquellos fármacos que bajan la FC, como son los β- bloqueantes, la ivabradina y los antagonistas del calcio. Con esto se quiere resaltar que el tratamiento ha de ser siempre lo más individualizado posible. El objetivo a conseguir con el tratamiento es la desaparición de los síntomas con los mínimos efectos secundarios. Sin embargo, esta cláusula no siempre puede cumplirse. Por ejemplo, los antagonistas del calcio pueden provocar hinchazón de pies y de cara (edema) o los nitritos pueden causar cefalea, como se citó anteriormente. A.A., C.C., M.J.S. M. Valdés 8
131 TEMA Car-2 CARDIOLOGÍA CMG Por último, recordar que es muy importante la adecuada conservación de los fármacos, en especial la de los nitratos, que son muy lábiles a la luz y al calor, y caducan en poco tiempo. Manejo de los pacientes con crisis aisladas Los pacientes con crisis poco frecuentes pueden no necesitar tratamiento permanente antianginoso, indicándoseles únicamente el control de los factores de riesgo, un antiagregante de manera crónica (AAS), y un NAR en los momentos de crisis. En pacientes con crisis aisladas: CONTROL DE FACTORES DE RIESGO + ANTIAGREGANTE + NAR Cuando un paciente con la sintomatología típica se autoadministra la pastilla de NAR en la crisis y el cuadro no cede, se ha de tomar la segunda pastilla de NAR camino del hospital, pues es probable que estemos ante un síndrome coronario agudo. No es preciso que haya dolor, simplemente que la molestia perdure más tiempo del habitual. A veces, los pacientes se marean, puede descenderle la TA y sincoparse. Consideraciones prácticas comentadas por el profesor en clase Supongamos un paciente con una frecuencia de crisis de 2 por semana. Este paciente necesita un tratamiento de mantenimiento que descienda la relación consumo/demanda de oxígeno. Pero, qué fármaco elegimos?, todos tienen el mismo efecto, pero como ya se ha indicado, la elección ha de hacerse en función de las características de cada paciente, y de la tolerancia que tenga al fármaco en cuestión. A pesar de que el paciente ya siga un tratamiento, si tiene una crisis puntual ha de tomarse el NAR siempre (por ejemplo cafinitrina). Además, si no responde correctamente al tratamiento establecido, se le puede sumar otro fármaco, pero asumiendo que los efectos secundarios se multiplican. Siguiendo con el mismo razonamiento, no se pueden dar dos fármacos que causen el mismo efecto, como ocurre con los β-bloqueantes y la ivabradina, que reducen ambos la FC. En casos puntuales también se pueden combinar 3 fármacos diferentes. También hay que vigilar si el tratamiento está controlando correctamente la patología del paciente. En este sentido, un paciente con un tratamiento establecido que sufre dos crisis al día, obviamente está mal controlado y es preciso añadir fármacos o modificar la pauta de tratamiento. Si no se consigue controlar la patología médicamente habrá que realizar una revascularización mediante angioplastia o cirugía. TRATAMIENTO DE REVASCULARIZACIÓN Recapitulando, este tratamiento se indica en aquellos pacientes de bajo riesgo que no son controlables con medicación farmacológica y en aquellos de alto riesgo en los que se detectó arteriosclerosis severa al realizar la prueba diagnóstica anatómica (normalmente coronariografía). En este caso, la única opción posible para evitar el desequilibrio oferta/demanda es aumentar el aporte de oxígeno (la oferta), lo cual se realiza mediante la revascularización. La revascularización puede hacerse de dos maneras diferentes: una forma menos invasiva, que es la angioplastia (ACTP) mediante técnica percutánea; y otra más invasiva, que es el pontaje aortocoronario o bypass mediante cirugía. Por poner un ejemplo práctico cercano, en el HUVA, Valdés y compañía, hacen entre 1900 y 2000 angioplastias al año, mientras que los cirujanos cardiovasculares realizan unos 150 bypass en el mismo periodo. En general, más del 90% de las revascularizaciones se hacen hoy en día por angioplastia, mientras que el resto se realizan por cirugía. A.A., C.C., M.J.S. M. Valdés 9
132 TEMA Car-2 CARDIOLOGÍA CMG Angioplastia Es una intervención que se realiza con anestesia local. Vía radial o femoral se alcanzan las arterias coronarias, donde se introduce una estructura de alambre, que se dilata e implanta un muelle metálico denominado stent. Este artefacto mantiene abierta la pared arterial y evita que vuelva a colapsarse. Además, está recubierto de antiproliferativos que disminuyen el riesgo de reestenosis. Es un método poco invasivo y el paciente regresa a su domicilio a las 24 horas. Su mortalidad es inferior al 0.5% y se produce un 5% de reestenosis al año. Pontaje aortocoronario o Bypass Consiste en una circunvalación de las arterias parcialmente bloqueadas realizada con segmentos de otras venas o arterias, o incluso con materiales sintéticos. De esta forma se restaura la circulación normal. El conducto venoso o arterial se comunica con el vaso lesionado después de la obstrucción. Esta técnica no elimina la estrechez pero aporta otro vaso permeable, con lo que revasculariza la zona postestenosis. Cuando se emplean segmentos venosos, normalmente proceden de las venas safenas, que se unen por un extremo a la coronaria afecta y por otro, a la aorta. Sin embargo, se obtienen mejores resultados utilizando segmentos arteriales, sobre todo la arteria mamaria interna, pues se ha observado que es la arteria más resistente a la arteriosclerosis. Las safenas se ocluyen más precozmente (un 60 ó 70% a los 10 años). La mortalidad de la cirugía es muy superior a la de la angioplastia, llegando al 5-10%. El bypass sólo se indica en detrimento de la angioplastia en pacientes muy puntuales, como son los que tienen afectado el tronco proximal, o los que padecen la enfermedad de tres vasos y son diabéticos. Sin embargo, aún en estos casos, si el paciente tiene un alto riesgo quirúrgico vuelve automáticamente a ser subsidiario de angioplastia. Por último, es esencial señalar que los pacientes que reciben tratamiento de revascularización deben seguir recibiendo tratamiento médico y controlando los factores de riesgo de forma crónica tras la intervención. A.A., C.C., M.J.S. M. Valdés 10
133 TEMA Car-2 CARDIOLOGÍA CMG ESQUEMA DE ACTUACION ANTE PACIENTE DE ALTO O BAJO RIESGO Pacientes de alto riesgo PACIENTE DE ALTO RIESGO Prueba anatómica (coronariografía) Arterioesclerosis severa: Revascularización Leve o ninguna afectación: Tto. médico Si fracasa: Revascularización Pacientes de bajo riesgo PACIENTE DE BAJO RIESGO Tto. médico directamente Si fracasa: Prueba anatómica + Revascularización A.A., C.C., M.J.S. M. Valdés 11
134
135 TEMA Car-3 CARDIOLOGÍA CMG CARDIOPATÍA ISQUÉMICA SÍNDROMES CORONARIOS AGUDOS & SDCA SIN ELEVACIÓN DEL SEGMENTO ST SÍNDROMES CORONARIOS AGUDOS (SDCA) Recordemos que los pacientes con cardiopatía isquémica constituyen dos grandes grupos: - Pacientes que presentan una angina de pecho estable, a causa de arteriopatía coronaria crónica. - Pacientes que padecen síndromes coronarios agudos (SdCA). En este tema vamos a tratar detenidamente los síndromes coronarios agudos, centrándonos concretamente en la angina inestable y el infarto no Q. E TIOLOGÍA DEL SdCA Como ya sabemos, el Síndrome Coronario Agudo puede producirse por disminución del aporte de oxígeno, por incremento de la necesidad de oxígeno por parte del miocardio, o bien por ambos factores. No obstante, en la mayoría de los casos, existe una causa que subyace a lo anteriormente citado, no es otra sino la existencia de una placa arteroesclerótica en las arterias coronarias. Esta causa es predominante también en el caso de la angina estable. La ruptura de la placa va a promover la formación de un trombo, que es el responsable de la sintomatología. F ISIOPATOLOGÍA En efecto, la placa arteroesclerótica puede romperse (ó complicarse ). De este modo, el contenido necrótico de su interior entra en contacto con la sangre y, dado su alto poder proagregante, conlleva la formación de un trombo. Se define como placa complicada, toda aquella placa obstructiva o que no se rompe, y que provoca estrechez. Repetimos que esta placa afecta a la coagulación sanguínea (hematíes y plaquetas) y, al romperse, da lugar a la formación de un trombo. Este proceso es bastante desconocido, no se sabe la causa exacta de la rotura de la placa, así como tampoco lo que determina que el trombo sea oclusivo o no. Cuando dicho trombo se forma rápidamente, no Q. Si, al contrario, la oclusión es total y permanente dará lugar a un Infarto agudo de miocardio. Las características clínicas del SdCA son similares a las de la angina estable. Entre ellas destacamos el angor o angina de pecho, que se presenta como un dolor torácico repentino, intenso y prolongado que puede irradiarse a brazos, hombros, espalda y cuello. No obstante, el SdCA también puede cursar de manera asintomática. J. A., C. C., M.J.S. Valdés 1
136 TEMA Car-3 CARDIOLOGÍA CMG En consecuencia, el diagnóstico debe ser en buena medida clínico, pero también electrocardiográfico y de laboratorio. Como estudiaremos más adelante, la angina inestable se prolonga en el tiempo y no responde a los fármacos (nitroglicerina) ni al reposo. Es importante tener en cuenta que, a veces, sobre todo en ancianos y diabéticos, el angor no se presenta como el típico dolor torácico. En estos casos puede definirse como una molestia no muy intensa y puede aparecer asociado a disnea, mareos, palpitaciones... CLASIFICACIÓN ELECTROCARDIOGRÁFICA Ante la sospecha de SdCA resulta primordial hacer una valoración electrocardiográfica de urgencias. Según los resultados del ECG, los pacientes se clasifican en dos grupos: b) ECG con elevación del segmento ST, La elevación del segmento ST es propia del Infarto con onda Q, también denominado Infarto Q o Infarto Agudo de Miocardio (IAM). En este caso se produce una necrosis transmural. Anatomopatológicamente, la elevación indica la existencia de un trombo oclusivo, que impide totalmente el paso del flujo por el vaso en cuestión. Esta situación supone una gravedad extrema, el paciente ha de ser tratado de inmediato. 1. Paciente SdCA sin elevación del segmento ST(SdCA SEST) 2. Paciente SdCA con elevación del segmento ST(SdCA CEST) a) ECG sin elevación del segmento ST. Esta morfología del ST es característica de dos procesos: la Angina Inestable (AI) y el Infarto no Q. Un infarto no Q puede equipararse a una Angina Inestable, pero en un estadio más evolucionado. En el caso del infarto no Q tendremos siempre necrosis subendocárdica, mientras que en la angina inestable no se manifiesta nunca necrosis considerable. Desde el punto de vista anatomopatológico, la ausencia de elevación del ST indica generalmente la presencia de un trombo no oclusivo. En ocasiones, en el ECG pueden observarse el descenso del ST o la presencia de una onda T invertida (estos factores son de importante valor pronóstico). J. A., C. C., M.J.S. Valdés 2
137 TEMA Car-3 CARDIOLOGÍA CMG SÍNDROMES CORONARIOS AGUDOS SIN ELEVACIÓN DEL SEGMENTO ST (SDCASEST) Como ya hemos comentado, esta morfología del segmento ST es característica de la Angina Inestable (AI) y el Infarto Agudo de Miocardio no Q (IAM no Q). Insistimos en que la diferencia entre ambos cuadros reside en la presencia o ausencia de necrosis miocárdica. En el caso del IAM no Q, existe necrosis subendocárdica 1 (no afecta a la totalidad del grosor de la pared miocárdica). Al contrario, en la AI no existe necrosis, o ésta es mínima. Ambos síndromes muestran una serie de parámetros que los definen: 1. Los pacientes suelen llegar a urgencias porque sienten una molestia o dolor anginoso en el pecho. Dicho dolor se caracteriza por: F ISIOPATOLOGÍA El SdCASEST supone una brusca disminución de flujo sanguíneo, sin aumento de las demandas. Desde la perspectiva anatomopatológica, el SdCA se asocia a la presencia de una placa fibrosa rota o complicada. Cuando el centro lipídico de la placa queda expuesto al torrente sanguíneo, provoca un aumento de la agregación plaquetaria y se incrementa la quimioatracción y producción de factores de coagulación. La acción de dichos factores, junto con la de las plaquetas, da lugar a la formación de un trombo suboclusivo. Este último no cierra del todo el vaso, deja al menos una apertura del 30% 2. También cabe la posibilidad de que se trate de un trombo oclusivo temporal, es decir, el vaso permanece cerrado durante 30 minutos 3 como máximo, y después la luz se desobstruye por la acción de la fibrinólisis. a. Cualidad: opresiva, peso, agobio b. Intensidad: Variable, aunque suele ser fuerte, sobre todo en el infarto. c. Duración: dura más que el dolor de la angina estable (>10min). d. Comienzo reciente: En las 4 a 6 semanas anteriores. e. Intensificación constante: El dolor va adquiriendo mayor intensidad, duración o frecuencia en los sucesivos episodios. 2. En estos pacientes el dolor anginoso aparece EN REPOSO (95%), es decir, no hay factores precipitantes de las molestias. También puede presentarse por la ejecución de mínimos esfuerzos. 3. El pronóstico es mucho peor que en el caso de la angina estable, con una alta tasa de infarto y muerte. La repercusión cardiaca que tiene el SdCASEST se sitúa en un nivel intermedio entre la de la AE (angina estable) y la del SdCACEST. La AE y el SdCASEST tienen en común que, en ambos casos, la alteración de la función cardiaca es reversible. 1 El subendocardio es la parte menos irrigada del corazón, y por ello, la primera que estará expuesta a sufrir isquemia. 2 Suelen producir AI 3 Suelen producir IAM no Q J. A., C. C., M.J.S. Valdés 3
138 TEMA Car-3 CARDIOLOGÍA CMG De manera similar a lo que ocurre en el SdCACEST, en el SdCASEST también puede producirse necrosis, sobre todo en el caso del infarto no Q y, en menor medida, en la AI. En este punto, es fundamental señalar que, en el caso que nos concierne, la necrosis suele ser subendocárdica. Sin embargo, en el SdCACEST se produce una necrosis transmural miocárdica irreversible que afecta a todo el grosor del músculo cardíaco. Tanto en el IAM Q como en el IAM no Q, como resultado de una obstrucción de larga evolución, se produce una macronecrosis, es decir, la muerte de una gran cantidad de células miocárdicas. La consecuencia de la muerte celular es la liberación de enzimas contenidas en el interior de las células: - CK-MB. Es la fracción MB de la enzima creatinquinasa. Su elevación indica muerte de numerosos cardiomiocitos (pérdida de músculo cardiaco), y por tanto necrosis importante. Esta enzima aparece muy aumentada en el SdCACEST y también en el Infarto no Q. - Troponinas: Se encuentran en el sarcómero de las células miocárdicas. Se van a liberar SIEMPRE que haya necrosis. (al contrario que la CK-MB, que sólo se libera cuando se produce una necrosis considerable). Vamos a hacer un Kit-Kat para tratar un poco más detenidamente el tema de los marcadores de necrosis en el suero, ya que conocerlos es de vital relevancia para comprender mejor su aparición en los distintos SdCA. MARCADORES CARDIACOS EN SUERO... Como acabamos de comentar, el tejido miocárdico, al necrosarse, libera a la sangre enzimas contenidas en su interior, también denominadas marcadores cardiacos. Estos marcadores se emplean para el diagnóstico del síndrome coronario agudo. Uno de ellos es la fosfocinasa de creatinina (CK). La elevación de esta enzima no es específica del SdCA ya que también puede estar aumentada en traumatismos de músculos estriados. Esto justifica que se emplee la isoenzima MB de la fosfocinasa de creatinina (CK-MB), que tiene la ventaja de no aparecer en concentraciones relevantes en el tejido extracardíaco y es mucho más específica del tejido cardiaco. Como inconveniente, cabe señalar que dicha enzima CK-MB puede aparecer elevada en miocarditis, tras realizar una cardioversión eléctrica y después de una operación cardiaca. Otros marcadores específicos son las troponinas cardioespecificas, cuyas secuencias de aminoácidos son diferentes a las del músculo estriado. Las troponinas cardiacas son proteínas presentes en las fibras miocárdicas, que forman parte de los mecanismos de regulación de la contracción del músculo cardiaco. Las isoformas cardiacas específicas son troponina T y troponina I, ambas pueden ser medidas en laboratorio utilizando sistemas inmunoenzimáticos, inmunocromatograficos y de quimioluminiscencia entre otros. Nos permiten distinguir entre los pacientes con IAM y aquéllos que presentan dolor en el pecho de origen no cardiaco. De tal manera, en un Síndrome coronario agudo con elevación del ST, los niveles de troponinas pueden estar aumentados hasta 20 veces por encima de los valores basales, lo que confirma que constituyen un excelente indicador en este caso. Además, al ser marcadores bioquímicos específicos, permiten detectar un infarto de pequeña magnitud, en el que los niveles de CK-MB son muy bajos, y quedarían por debajo del límite de detección del síndrome agudo. Hay que destacar que los niveles de troponinas pueden continuar elevados hasta 7-10 días después de un infarto agudo con elevación del ST. Además, son mucho mayores y más duraderos en suero que los de CK-MB (que aumentan en un plazo de 4 a 8 h y se normalizan entre las 48 y 72 h), aunque el pico máximo de CK-MB en suero aparece antes que el de las troponinas. La mioglobina también puede ser usada como marcador en los SdCACEST ya que su concentración aumenta en la sangre unas J. A., C. C., M.J.S. Valdés 4
139 TEMA Car-3 CARDIOLOGÍA CMG horas después de haber comenzado el episodio. No obstante, esta proteína no tiene especificidad cardiaca y se excreta rápidamente en orina (los niveles en sangre retornan a la normalidad en las primeras 24h de haber comenzado el infarto). La mioglobina es una proteína del músculo esquelético y cardiaco. El músculo en ejercicio consume el oxígeno disponible. La mioglobina tiene oxígeno fijado a ella, lo que supone una reserva extra de oxígeno lista para suministrase en el momento necesario. De este modo, el músculo en ejercicio puede mantener un nivel de actividad alto durante un mayor período de tiempo. Cuando se presenta un daño en el músculo, la mioglobina es liberada en el torrente sanguíneo y finalmente es excretada por la orina. Esta proteína permite por lo tanto detectar daño cardiaco....fin DE LOS MARCADORES CARDIACOS Un tercio de los pacientes que sufren Angina Inestable, sufren micronecrosis cardíacas. En una necrosis de pequeña magnitud las troponinas serán positivas (son más específicas) y la CK-MB negativa. Siempre que haya una gran necrosis, los marcadores CK-MB y troponinas serán ambos positivos. En efecto, cuando se desencadena un infarto, tanto no Q como IAM, se produce una macronecrosis y en consecuencia ambos marcadores serán positivos. Evidentemente, en el IAM aparecerán mucho más elevados que en el Infarto no Q. Dicho esto, la gran diferencia entre los dos subtipos de SdCASEST es que en la Angina Inestable las CK-MB serán negativas, mientras que en el Infarto no Q serán positivas. REPERCUSIONES CARDIACAS En la Angina inestable, la placa arteroesclerótica obstruye entre el 30 y el 40% de la luz del vaso. Al romperse de forma brusca, ocasiona la formación de un trombo que contribuye a disminuir aún más la luz del vaso. La repercusión fisiológica que tiene el episodio anginoso está en relación directa con la alteración de la función cardiaca, que a su vez depende de la actividad de las células cardiacas. La función cardiaca se ve reflejada en los marcadores cardiacos de la siguiente manera: a) Troponina negativa: la función cardiaca es normal. b) Troponina positiva: es probable que la función cardiaca esté algo alterada. c) Troponina positiva y CK-MB positiva: esto confirma la presencia de alteraciones funcionales. Es muy importante tener en cuenta que la repercusión clínica de los episodios agudos está también relacionada con la localización del trombo. Si el lugar donde se produce la obstrucción es una zona dotada de circulación colateral desarrollada, podemos deducir que el infarto no se producirá con tanta facilidad; si, al contrario, la zona carece de circulación colateral el infarto será más probable. También es fundamental considerar la implicación e importancia de la zona afectada en la contracción cardiaca. C LASIFICACIÓN DE LA AI La clasificación de la Angina Inestable atiende a dos tipos de factores: 1. La situación en la que aparece la AI (con esfuerzo progresiva; en reposo aguda). 2. La existencia de agravantes o episodios isquémicos anteriores (angina secundaria, primaria o post-iam). J. A., C. C., M.J.S. Valdés 5
140 TEMA Car-3 CARDIOLOGÍA CMG vuelto a formar. Como ya señalamos, ambos cuadros comparten características sintomáticas con la angina estable (AE). No obstante, hay varios puntos en los que difieren de ésta: Figura CA3-2 Traducción del cuadro: I. Angina de Reciente Comienzo o Progresiva 4 II. Angina Subaguda. Indica que el paciente acude a urgencias pasadas 48 horas de la crisis y ha sobrevivido. Esto resta gravedad al episodio isquémico III. Angina Aguda. El paciente acude a urgencias antes de que pasen 48 horas tras la crisis. A. Angina Secundaria. Otro proceso patológico subyacente ha acelerado la aparición de la AI. B. Angina Primaria. No existen procesos extracardíacos que aceleren la aparición de la isquemia C. Angina Post-IAM. Aparece en las 2 semanas después de un episodio de IAM. La duración en los SdCASEST es mayor que en la AE, supera los 10 minutos e incluso puede llegar aproximadamente a los 30 minutos 5. Si el dolor se prolonga durante más de 40 minutos y posee características isquémicas estaremos ante un infarto de onda Q. El paciente acude refiriendo dolor en el pecho de naturaleza opresiva, que puede ser intermitente. La localización suele ser retroesternal (o a veces en epigastrio), y a menudo irradia al cuello, al hombro izquierdo y al brazo izquierdo. En los SdCASEST esta sintomatología puede acompañarse de náuseas, vómitos, fatiga y disnea. De este modo, vamos a obtener 9 tipos de Angina Inestable, como vemos en la figura CA3-2. El tipo 1 será el que mejor pronóstico tenga, mientras que 9 muestra el peor pronóstico. C LÍNICA La Angina inestable y los infartos no Q son SdCA sin elevación del segmento ST. Se producen por rotura de una placa arteroesclerótica que, al ser inestable, se ha 4 SÍ, hay un tipo de AI que no se da en reposo, sino con esfuerzo. En realidad, ocurren en AE crónicas que van a variar la frecuencia y duración de sus síntomas. Quedaos con que la inmensa mayoría de las AI se dan en reposo. Figura CA3-3 Cuando la zona con falta de riego es de gran tamaño podemos apreciar diaforesis (sudoración profusa), piel pálida y fría, taquicardia sinusal, tercer o cuarto ruidos 5 Es raro que un SdCASEST se prolongue más allá de los 30 min. J. A., C. C., M.J.S. Valdés 6
141 TEMA Car-3 CARDIOLOGÍA CMG cardiacos (o ambos), estertores en bases pulmonares y a veces hipotensión. 6 En este caso, el paciente suele encontrarse mal y es él mismo el que pide que se le lleve al hospital (él no va puesto que no puede, lo llevan). A diferencia de lo que ocurre en la AE, en el SdCASEST el dolor aparece en reposo, y no hay factores precipitantes ni aliviantes. En lo que respecta a los fármacos, la administración de Nitroglicerina (Cafinitrina) resulta ineficaz, o bien alivia ligeramente el dolor. En cualquier caso, NUNCA es totalmente efectiva, su efecto es parcial, puesto que el dolor no desaparece y si lo hace vuelve a aparecer. EXPLORACIÓN FÍSICA La exploración física del SdCASEST es muy similar a la que se realiza en el caso de una Angina Estable. La aparición de la crisis anginosa en reposo nos orienta a pensar que se trata de un SdCASEST. En este caso, el dolor precordial dura más de 30 minutos y no desaparece con nitroglicerina (NTG), lo que resulta indicativo de isquemia. Si el paciente llega a urgencias cuando ya ha pasado la crisis, la exploración física será normal: - Se han de medir la TA y los pulsos, que pueden estar alterados o no. - En la auscultación pueden escucharse tercer y cuarto ruidos e incluso puede aparecer un soplo. Esto es debido a la insuficiencia valvular e insuficiencia cardiaca provocadas por la necrosis miocárdica. A pesar de ello, estos datos no son diagnósticos. - La placa de tórax es normal. 6 Prestad atención: Si el dolor torácico se da cuando el paciente respira profundamente y presenta fiebre, habrá que hacer un diagnóstico diferencial con una pleuresía. Si el paciente llega a urgencias en plena crisis, la exploración nos revelará datos importantes para el diagnóstico. Este punto lo explicamos en el siguiente apartado. D IAGNÓSTICO (Y GUÍA DE ACTUACIÓN) Un gran número de pacientes acuden a los servicios de urgencias con dolor retroesternal, en principio compatible con un accidente cardiovascular. Sin embargo, tan sólo en el 20 o 25% de los enfermos se corrobora tal diagnóstico. Por ello, la primera medida a valorar en un paciente susceptible de haber sufrido un episodio coronario será valorar la posibilidad de que la arteriopatía coronaria sea la causante de sus síntomas 7. Ante un paciente que llega a urgencias y nos relata una historia compatible con un SdCA, lo primero que debemos realizar es la historia clínica y la exploración física. A continuación, realizamos un ECG (en los primeros 5 minutos). Los resultados del ECG pueden ser los siguientes: 1. Elevación del segmento ST: Es esencial descartar la elevación del segmento ST porque, en caso de existir, hay que hacer un cateterismo urgente. 2. Sin elevación del segmento ST: En este caso debemos hacernos la siguiente pregunta: El ECG es normal o anormal? I. Normal: Todo es aparentemente correcto. II. Anormal: La aparición en el ECG de un descenso del segmento ST o de una onda T invertida indica cambios dinámicos susceptibles de retornar a la 7 Como bien sabemos, son factores de riesgo de la arteriosclerosis: tener más de 70 años, pertenecer al sexo masculino, tener DM, mostrar enfermedad cerebrovascular o arterial periférica y poseer antiguas anormalidades en el ECG. (Harrison) J. A., C. C., M.J.S. Valdés 7
142 TEMA Car-3 CARDIOLOGÍA CMG normalidad. 8 Además, está comprobado que un descenso del segmento ST se correlaciona con un aumento de la mortalidad y de la aparición de IAM (Figura CA3-4). Figura CA3-4 Tras interpretar el ECG, el siguiente paso a seguir es hacerle un análisis de sangre al paciente. La analítica general es obligada (estudiar diabetes, arritmias, etc.), pero además es primordial solicitar el análisis específico de marcadores coronarios de necrosis: CK-MB y troponinas. En principio, en situación basal, los niveles de dichos marcadores son normales en el 100% de los pacientes y tardan un tiempo en aumentar su valor en pacientes que han sufrido una crisis. De este modo, si el paciente ha acudido rápidamente a urgencias, la analítica inicial mostrará niveles normales para los marcadores coronarios. Estos datos nos servirán para compararlos con los de analíticas posteriores, pero no para diagnosticar el proceso isquémico del enfermo. Se precisan entre 6-12 horas para aumentar los niveles de manera representativa. 9 Otra evaluación a tener en cuenta es el llamado TIMI (Thrombolysis in Myocardial Ischemia Trial). Se trata de un examen en el que, atendiendo a una serie de características referentes al enfermo, podremos valorar el riesgo al que está expuesto y encasillarlo en un nivel determinado. 8 Destacamos que 1/3 de los pacientes de AI tiene un ECG normal, otro 1/3 presenta descenso del segmento ST, y el otro 1/3 muestra una onda T invertida. Esto nos puede dar el diagnóstico en pacientes asintomáticos. 9 Siempre que dudemos si un paciente tiene o no alguna patología isquémica, debemos tratarlo como si estuviera enfermo. Los 7 factores considerados son: Tener 65 años de edad o más. Poseer tres o más factores de riesgo para arteriopatía coronaria. Arteriopatía coronaria comprobada por medio de cateterismo. Aparición de angina inestable o infarto no Q durante el lapso en el que la persona recibió aspirina (antiagregante). Más de dos episodios de angina de pecho en las 24 horas anteriores. Desviación del segmento ST de 0.5 mm o más. Nivel de un indicador cardiaco aumentado. Según el valor resultante de este examen, podremos predecir el riesgo global que tiene el paciente de sufrir de nuevo un episodio isquémico importante. Un TIMI de 0 a 1 indica bajo riesgo; de 2 a 4 el riesgo es intermedio; y de 5 a 7 significa alto riesgo. Debe quedar claro que todo el proceso de atención al paciente descrito anteriormente no debe sobrepasar los primeros diez minutos de la consulta. Las pruebas diagnósticas de isquemia están contraindicadas en las primeras 24-48h. El paciente ha de ser evaluado cada 6 horas, realizándose un ECG y una analítica a las 6 y a las 12 horas. Tras los resultados de las exploraciones podremos englobar a los pacientes en dos grupos: 1. Si todas las enzimas se elevan, el análisis es positivo, y estaremos ante un SdCA de alto riesgo. Se continúa instaurando el tratamiento recomendado y se realiza una coronariografia urgente (preferiblemente antes de las primeras 48 horas) y revascularización (cirugía o radiología intervencionista). 2. Si a pesar del ECG y de la analítica no se evidencian datos que corroboren el episodio agudo, puede que estemos ante un paciente con un SdCA de bajo riesgo. En este caso se prosigue con la realización de un TAC multicorte y de una prueba de isquemia (eco de esfuerzo o con J. A., C. C., M.J.S. Valdés 8
143 TEMA Car-3 CARDIOLOGÍA CMG dobutamina 10 ). Si los resultados de ambas exploraciones son normales se puede dar el alta al paciente. 3. Puede ocurrir que el paciente tenga en un primer momento resultados negativos en los chequeos, pero que transcurrido el tiempo las pruebas de isquemia sean positivas (punto 2 de este esquema). En este caso se practica una coronariografía al paciente. Como comprenderemos, TODOS los Infartos no Q van a ser subsidiarios de coronariografía, puesto que en dicha situación las enzimas CK-MB y las troponinas están elevadas. Es destacable que el 6 10% de los pacientes con Infarto no Q mueren en el primer mes post episodio isquémico. 11 Heparina de bajo peso molecular: Se administra un bolo inicial de 0,75 mg/kg y después se mantiene 1 mg/kg/cada12h subcutánea. Estos fármacos, bien empleados, han reducido hasta en un 50% el infarto y la mortalidad por infarto. También se ha de aplicar un tratamiento antianginoso, con nitratos 12 y beta bloqueantes 13, que controlan los síntomas, pero no disminuyen la mortalidad ni el infarto. Las estatinas también están indicadas por disminuir la síntesis de colesterol. En cambio, sólo un tercio de los pacientes con Angina Inestable tendrá elevadas las troponinas. La Angina Inestable sólo será considerada de alto riesgo y tratada como tal cuando las troponinas sean positivas, y cuando la puntuación en el TIMI sea igual o superior a 3. En el Anexo I tenemos un bonito esquema de la guía de actuación. T RATAMIENTO Siempre que exista sospecha de isquemia debemos tratar el cuadro como si lo fuera. El tratamiento médico consta de fármacos antiagregantes y anticoagulantes combinados: Aspirina 500mg, o 100mg si el paciente ya tomaba previo al ingreso (esto es habitual) Clopidogrel mg 10 La dobutamina es un fármaco inductor del estrés, por lo que se usa en estos casos si el paciente no puede realizar un esfuerzo físico por su cuenta. 11 La mortalidad total de la AE es del 1-2%, la de los SdCASEST es del 5-6%, y la de los SDCACEST del 20% 12 Se da NTG intravenosa: 1 ampolla de 50mg en 500ml de suero glucosado a 12 ml/hora inicial. Hay que aumentar hasta controlar síntomas o TA baja. 13 Atenolol, Propranolol (Fc basal alrededor de 60 l/m) J. A., C. C., M.J.S. Valdés 9
144 TEMA Car-3 CARDIOLOGÍA CMG ANEXO I Guía de Actuación ante pacientes sugestivos de episodio isquémico agudo. J. A., C. C., M.J.S. Valdés 10
145 TEMA Car-3 CARDIOLOGÍA CMG ANEXO II Espectro de los SCA. En estas dos diapositivas tenemos un buen resumen de los distintos factores que intervienen en los SCA, y cómo varían según el enfermo sufra un episodio u otro. J. A., C. C., M.J.S. Valdés 11
146
147 TEMA Car-4 (A) CARDIOLOGÍA CMG CARDIOPATÍA ISQUÉMICA INFARTO CON ONDA Q O IAM (A) I NTRODUCCIÓN Entramos de lleno en el estudio de los síndromes coronarios agudos con elevación del segmento ST o SCACEST, cuya trascendencia no es posible obviar aún en la actualidad, a pesar de los grandes avances perpetrados por la cardiología intervencionista en los últimos años. A lo largo de este denso, pero significativo tema, veremos las nociones necesarias para todo médico general en este ámbito de la medicina, con el objetivo de concienciarnos de la importancia de la accesibilidad a un tratamiento rápido y efectivo para paliar esta relevante causa de muerte. Aún hoy, la tasa de mortalidad de los infartos agudos de miocardio (IAM) se aproxima al 20%. En la mitad de los casos, estas muertes ocurren antes de la llegada del paciente al hospital. Datos que objetivan la importancia de esta patología son: En EEUU ocurren 1,5 millones de infartos al año, lo que representa la aparición de 1 IAM cada 20 segundos. En la Comunidad Autónoma de la Región de Murcia la frecuencia es, aproximadamente, de 1000 IAM al año. Su mortalidad y costes son muy elevados. Para encuadrarlo dentro del resto de entidades de la cardiopatía isquémica, diremos que el IAM o infarto Q es un infarto transmural, es decir, que afecta a todo el grosor del músculo cardiaco (de endocardio a epicardio), a diferencia del No Q (infarto sin presencia de onda Q) en el que únicamente se ve afectado el subendocardio. E TIOLOGÍA La causa más frecuente del IAM es la arterioesclerosis (95-96% de los casos).. Otras causas de IAM mucho menos frecuentes que la arterioesclerosis son: 1 Causa coronaria diferente de arterioesclerosis (<5%): a) Por arteritis: por sífilis, periarteritis nodosa, enfermedad de Kawasaki, artritis reumatoide, espondilitis anquilosante, o arteritis de Takayasu. b) Por traumatismo. c) Por enf. metabólica: Enf. De Hurler, homocistinuria, enf. de Fabry o amiloidosis. d) Por espasmo. e) Otras: Como la disección de aorta o disección Coronaria. 2 Causa embólica: Como endocarditis infecciosa, prolapso de la valva mitral, ventilación mecánica (embolia gaseosa) 3 Anomalías coronarias congénitas. 4 Causas hematológicas: Como policitemia vera, CID o estados de hipercoagulabilidad. 5 Por desequilibrio del aporte/demanda: estenosis aórtica, insuficiencia aórtica, hipertiroidismo, intoxicación por CO A.A., C.C., M.J.S. M. Valdés 1
148 TEMA Car-4 (A) CARDIOLOGÍA CMG 6 Otras: Como el consumo de cocaína, la contusión torácica, las complicaciones de un cateterismo o la cirugía. De todo lo dicho con anterioridad, debemos recordar la relevancia de la cocaína que, produciendo un espasmo coronario mantenido, es la causa más frecuente de IAM en jóvenes de años, ya que estos pacientes no han tenido tiempo de desarrollar arterioesclerosis. que si el sistema sanitario consigue intervenir en esta primera hora (llamada por razones obvias la hora de oro), el pronóstico del paciente cambiará de manera radical. El 50% restante de miocardio a perder se necrosará en su mayoría en las 5 ó 6 horas subsiguientes. Es por esto la urgencia en su tratamiento, ya que minimizará la pérdida IRREVERSIBLE de músculo cardiaco. La gráfica de proporción de músculo sano de entre el músculo a perder con respecto al tiempo de evolución del IAM es: A NATOMÍA PATOLÓGICA En general, desde el punto de vista histológico, el IAM se produce cuando se rompe, fisura o ulcera una placa fibrosa (y cuando las circunstancias favorecen la trombogénesis). Se forma un trombo que ocluye la totalidad de la arteria coronaria 1. Se ha visto, que aquellas placas con un núcleo lipídico abundante y un casquete fibroso fino son más propensas a romperse. Tras la rotura, se forma una monocapa de plaquetas, que irá aumentando de tamaño, por la agregación de estos elementos formes, gracias a la ayuda de sustancias agonistas como colágeno, ADP, adrenalina, etc. Dichas sustancias, también inducen la liberación del tromboxano A2 (vasoconstrictor local), y parece generarse una resistencia a la trombolisis. Además, se produce un cambio en la conformación del receptor de la glicoproteína IIb/IIIa fundamental para la agregación plaquetaria (esta glicoproteína pertenece a la cascada de la coagulación). A este receptor se le unirán sustancias como el fibrinógeno y el factor de von Willebrand (FvW), que favorecen el entrecruzamiento y la agregación de las plaquetas. El evento característico del IAM es la necrosis, por tanto nos vamos a detener en este concepto. Uno de los aspectos principales de la necrosis es el temporal, pues la gravedad de la misma aumenta con el paso del tiempo. En efecto, en la primera hora se necrosa el 50% del músculo cardiaco afectado, por lo 1 No se sabe aún por qué en unos pacientes el trombo es suboclusivo, y en otros oclusivo totalmente. La necrosis, como ya se ha repetido incesantemente, se corresponde en el 90-95% de los pacientes con un SCA (síndrome coronario agudo) con un trombo oclusivo de la arteria coronaria. En un principio, este trombo es blanco (plaquetario); posteriormente, pasa a ser rojo (hemático), debido a la actuación de la cascada de la coagulación, y crece, incluso proximalmente en la coronaria. Además, en esta situación existe cierta resistencia a la trombolisis. Por último, señalar que la magnitud de la necrosis del músculo cardiaco se relaciona directamente con el pronóstico y mortalidad: o o o o Pérdidas menores al 5% de masa muscular miocárdica no producen alteraciones significativas. Con pérdidas del 8% el paciente tendrá alteraciones en la función diastólica. Pérdidas del 15% producirán alteraciones en la fracción de eyección y los volúmenes telediastólico y telesistólico. Ante una pérdida del 10% el paciente presentará una insuficiencia cardiaca A.A., C.C., M.J.S. M. Valdés 2
149 TEMA Car-4 (A) CARDIOLOGÍA CMG o o F compensada con sintomatología cuando éste haga ejercicio. Si pierde del 20 al 25%, el paciente presentará una insuficiencia cardiaca congestiva con graves síntomas. Por último, si el paciente pierde un 40% o más, la situación desembocará irremisiblemente en un shock cardiogénico, que tiene una mortalidad del 95% y pocas opciones de tratamiento: transplante o tratamiento muy precoz. ISIOPATOLOGÍA El mecanismo fisiopatológico ha sido ya explicado en el apartado de anatomía patológica. En cuanto a las alteraciones que provoca este mecanismo podemos decir que son de 3 tipos: metabólicas, funcionales (en diástole y en sístole) y eléctricas. Veámoslas individualmente: A. Metabólicas: El metabolismo pasa a ser anaerobio por la ausencia de oxígeno. Esto causa muerte celular si la isquemia dura más de 30 minutos, liberándose enzimas contenidas en el interior del miocardiocito, que se podrán cuantificar mediante pruebas de laboratorio. B. Funcionales: Se producen alteraciones en la diástole y en la sístole: 1. Diástole: Las alteraciones repercuten en la distensibilidad del músculo cardiaco, que estará disminuida, produciendo aumento de la presión en la aurícula, y obligando a ésta a realizar mayor trabajo para el llenado ventricular, lo que propicia la aparición de un 4º ruido. 2. Sístole: Las alteraciones se dan en la contractibilidad, que se ve disminuida en relación directa con el tamaño de la zona afectada. Con una ecocardiografía se puede objetivar, pues se observa una porción del músculo cardiaco que se mueve de forma anormal. Lugar de la oclusión y su repercusión Las alteraciones, en general, van estar marcadas por el grado de extensión del infarto, y éste por la arteria coronaria obstruida, el lugar de la obstrucción y la presencia de circulación colateral: I. En cuanto a la arteria obstruida, hemos de saber que el músculo del ventrículo izquierdo está irrigado en un 50% por la descendente anterior (rama de la coronaria izquierda), mientras que la coronaria derecha y la circunfleja (la otra rama de la coronaria izquierda) irrigan cada una un 25% del mismo. Así, cuando se afecta la arteria descendente anterior (produciéndose lo que se denomina infarto anterior ) el infarto, en general, será de mayor tamaño que si se obstruye cualquiera de las otras. II. En cuanto al punto de obstrucción en la coronaria, obviamente, las repercusiones del evento serán diferentes si la oclusión es en la arteria proximal, la media o la distal, pues en el primer caso, el territorio miocárdico sin irrigar será mucho mayor, siendo también mayor, la zona isquémica e infartada. III. En cuanto a la circulación colateral, hay que señalar que existen vasos que comunican la descendente anterior con la circunfleja y con la coronaria derecha. Estos vasos normalmente son milimétricos y están cerrados, pero se pueden desarrollar en personas de avanzada edad con enfermedad coronaria de larga evolución (como la angina estable), estando ausentes en jóvenes (lo que explica la mayor gravedad del IAM en éstos). Miocardio aturdido o hibernado Un concepto relacionado con las alteraciones funcionales en el IAM es el de miocardio aturdido, que se refiere a la pérdida temporal de la contractilidad en una porción afectada de miocardio que ha sufrido isquemia, pero no infarto (no necrosis). Aún después de la reperfusión, dicha porción tardará horas, días o semanas en recuperar la función. Importante es saber que este miocardio atontado o aturdido NO está muerto, y recuperará su función totalmente después de un tiempo tras la reperfusión. Se produce atontamiento miocárdico en situaciones en las cuales el corazón ha sido sometido a episodios transitorios de isquemia, tales co- A.A., C.C., M.J.S. M. Valdés 3
150 TEMA Car-4 (A) CARDIOLOGÍA CMG mo angina inestable, infarto de miocardio con reperfusión precoz, isquemia inducida por ejercicio, cirugía cardíaca en general, o trasplante cardíaco. Otra situación muy frecuente es la de miocardio hibernado. El miocardio hibernado es aquel que en una situación de isquemia queda afuncional, pero se mantiene viable hasta una futurible reperfusión. De este modo, las células hibernadas no han muerto, pero tampoco desempeñan ninguna función debido a la escasez de oxígeno, agravando así el descenso de contractilidad del miocardio. Este concepto implicaría que el corazón puede adaptarse espontáneamente a la baja perfusión mantenida crónicamente (teoría del corazón "astuto"). 2 Cuando el IAM es de pequeña magnitud, se recupera la función normal por compensación cardiaca, esto es, manteniendo la fracción de eyección a costa de aumentar la funcionalidad del resto del músculo cardiaco. A esto se le denomina compensación vicariante. Remodelado patológico del VI Otro evento fisiopatológico de relevancia es la posibilidad de remodelamiento patológico en la zona infartada del ventrículo izquierdo. Se da en casos de infarto de considerable extensión. Aunque el paciente permanezca asintomático, la distensibilidad alterada inicial, se va traduciendo progresivamente merced a un remodelado de la zona necrosada, en un adelgazamiento y posterior abombamiento de la pared, que provoca un ventrículo deformado con remanso de sangre en la zona de la cicatriz dilatada. C. Eléctricas: Los hallazgos en el ECG 3 dependen de factores relacionados con la naturaleza del proceso cardiaco, tales como la reversiblidad o irreversibilidad, la duración (aguda o crónica), la extensión (transmural o subendocárdica) y la localización (anterior o inferoposterior), así como de la presencia de otras complicaciones (hipertrofia de VI ) El criterio electrocardiográfico es el único del que disponemos para hacer un diagnóstico y un tratamiento precoz, y por ello es indispensable, a pesar de que no es una prueba 100% sensible, ni específica. Debido a su trascendencia, la manifestación de las alteraciones eléctricas propician la distinción entre sd. coronario agudo sin elevación del segmento ST (SCASEST) y con elevación del segmento ST (SCACEST) 4. Explicación electrofisiológica de la desviación del ST y la onda Q Para el que quiera comprender el por qué de estas desviaciones del segmento ST (ya sean elevaciones o descensos) y la génesis de la onda Q, y no aprenderse de memoria cómo aparecen en cada caso, aquí tiene una breve explicación que casi en su totalidad, y esto es importante, es del Harrison. La isquemia ejerce un efecto complejo que depende del tiempo, sobre las propiedades eléctricas de las células miocárdicas. La isquemia aguda y grave reduce el potencial de reposo de la membrana y acorta la duración del potencial de acción en los miocardiocitos afectados. Así, estos cambios determinan un gradiente de voltaje entre las zonas 2 En cuanto al significado conceptual de ambos, hemos de tener en cuenta que la hibernación indica adaptación, mientras que el atontamiento es consecuencia de una injuria. 3 El ECG, debido a su importancia, se verá con mayor detenimiento en la sección dedicada al diagnóstico. 4 Esta división es de gran utilidad, ya que el tratamiento basado en la reperfusión aguda es sólo eficaz en los SCACEST (Harrison). A.A., C.C., M.J.S. M. Valdés 4
151 TEMA Car-4 (A) CARDIOLOGÍA CMG normal e isquémica, lo que provoca un flujo de corriente entre ambas regiones. De este modo, las corrientes denominadas de lesión se representan en el ECG de superficie como una desviación del segmento ST Por lo que ya se ha explicado, el vector del segmento ST va dirigido normalmente hacia la zona isquémica. Cuando la isquemia aguda es transmural (como en el caso del IAM Q) el vector ST (que normalmente produce una línea isoeléctrica) suele desviarse en dirección a las capas externas (hacia el epicardio) lo que se traduce en una elevación del segmento ST, y en las primeras fases de isquemia en ondas T picudas y positivas en la zona isquémica. Cuando la necrosis se da en el subendocardio (como en el IAM no Q) el vector se dirige hacia el endocardio, lo que se manifiesta como depresión del segmento ST (como ya sabemos la cola del vector miraría hacia el electrodo y lo captaría como negativo) en las derivaciones situadas por encima (las precordiales derechas como V5, por ejemplo). La elevación o depresión profunda del ST se traducen en una isquemia muy grave. En cuanto a la onda Q, onda característica de infarto transmural que aparece en una fase evolutiva más avanzada, corresponde a la primera deflección negativa del QRS, y en los infartos se produce por ausencia del vector que se acerca al electrodo correspondiente a la derivación afectada y sirve para determinar la ubicación de los infartos trasmurales. La onda Q crece en tamaño en algunas derivaciones (las denominadas como afectadas, que no son más que las que miran directamente a la zona infartada) debido a la necrosis de una zona de miocardio que ya no recibe un flujo de corriente y no produce un vector de despolarización. La ausencia de este vector producirá un predominio del vector de despolarización dirigido en sentido contrario, con lo que en las derivaciones a las que mira la zona afectada se producirá una onda muy negativa, que se corresponde con la famosa onda Q. Como podéis deducir, en esta imagen la zona infartada es la zona negra, y se ve un claro predominio del vector dirigido en sentido contrario a su posición: C LÍNICA En casi la mitad de los pacientes se detecta un factor desencadenante previo al IAM, como un ejercicio físico intenso (8,7%), ejercicio físico moderado (14,1%), estrés emocional (18,4%) u otros, como la falta de sueño, una comida demasiado copiosa, una enfermedad médica o quirúrgica... Un 51% de los pacientes no tiene ningún factor desencadenante. El IAM se puede producir en cualquier momento del día, pero es más común en las primeras horas siguientes al despertar (por el aumento del tono simpático y el aumento de la capacidad de trombosis que se da entre las 6 y las 12 h de la mañana, recordemos la cronobiología de la cardiopatía isquémica). Aparte del patrón circadiano, también existe un patrón estacional, ya que se da más en los meses de invierno, debido a que el frío induce mayor vasoconstricción. El dolor es el síntoma de presentación más común, es un dolor profundo, visceral, opresivo ( en losa ), aunque a veces tiene un carácter punzante o hiriente. Es, en definitiva, similar al de las otras entidades de la cardiopatía isquémica, pero más intenso y duradero (más de 30 minutos), y no desaparece con nitroglicerina (aunque su administración conlleva cierto beneficio, pues es un vasodilatador coronario). Se localiza típicamente en la porción central del tórax, epigastrio, irradiándose hacia A.A., C.C., M.J.S. M. Valdés 5
152 TEMA Car-4 (A) CARDIOLOGÍA CMG los hombros, mandíbula, espalda y brazos (especialmente al izquierdo), región occipital, zona abdominal si se trata de un infarto inferior, pero nunca sobrepasa el ombligo. En ocasiones se confunde con una indigestión. Se acompaña de un cortejo de síntomas como debilidad, náuseas, vómitos, sudoración, ansiedad y sensación de muerte inminente. El dolor del IAM, se parece al de la pericarditis aguda, al de la embolia pulmonar, disección aguda de la aorta, trastornos digestivos y costocondritis, procesos con los que hay que hacer el diagnóstico diferencial. El dolor es la presentación típica del IAM, pero hay infartos indoloros (representan entre el 10 y el 30%), que son más frecuentes en pacientes diabéticos e hipertensos y aumentan con la edad. En los ancianos pueden debutar con una disnea brusca que progresa a edema agudo de pulmón. El IAM también se puede manifestar como una IC sin causa conocida previa, o como un empeoramiento de la misma. A veces se presenta como un síncope, mientras que en otras ocasiones puede debutar directamente con muerte súbita 5. En la siguiente figura tenemos el cuadro resumen clásico de la clínica del IAM: CALIDAD: Dolor Opresivo, como una losa y agobiante. Puede ser punzante, cortante, con sensación de quemazón o pesadez LOCALIZACION: Retroesternal, torácica (zona amplia), y brazo izdo. IRRADIACION: Hacia pecho, hombros, cuello y brazos. Hacia abdomen si el infarto es inferior. DURACION: Generalmente de >30 minutos a horas. FACTORES PRECIPITANTES: En el 50% de los casos ninguno. FACTORES ALIVIANTES: Con reposo: no cede. Con cafinitrina: alivio parcial o nulo. INTENSIDAD: Muy intenso, a veces insoportable. OTROS SINTOMAS: Vagales: como el sudor frío.,, vómitos. 5 Por esto la importancia del desfibrilador accesible. En ocasiones hay pródromos, es decir, signos y síntomas precoces inespecíficos que preceden a los característicos de una enfermedad. Así, un 33% de los pacientes tienen síntomas de angina inestable entre 1 y 4 semanas antes y un 20% presenta síntomas en las últimas 24 horas. Sin embargo, en el 50% de los casos el IAM es la primera manifestación de la cardiopatía isquémica. EXPLORACIÓN FÍSICA En lo que respecta a la exploración física, no se encuentra ningún signo patognomónico. En cuanto a su apariencia general, los pacientes se encuentran angustiados y agitados, tratando, sin éxito, de aliviar el dolor con el cambio continuo de postura. Frecuentemente el paciente está pálido, con las partes acras frías. Con respecto a la tensión arterial, muchos, presentan pulso y TA normales durante la primera hora pero, el 25% de los que sufren un infarto anterior tienen signos de hiperactividad simpática (taquicardia o HTA), y el 50% de los que padecen un infarto inferior presentan hiperactividad del parasimpático (bradicardia e hipotensión). Pueden presentar fiebre a las horas cuando el IAM es extenso. Se acepta, por tanto, una temperatura de 38 º durante la primera semana y, si ésta es más alta, hay que descartar otras causas. La frecuencia cardiaca suele ser normal (a veces, lpm) y por otra parte, la mayoría de los pacientes suelen tener una ligera taquipnea. En la auscultación, es frecuente auscultar el tercer y el cuarto ruido (que indica IC izquierda), disminución de la intensidad de los tonos cardiacos y, en casos muy graves, un desdoblamiento paradójico del segundo tono 6. Estos soplos pueden indicar alteraciones mecánicas secundarias a la necrosis, tales como: comunicación interventricular, insuficiencia mitral aguda, taponamiento cardiaco 6 Al igual que ocurre en el primer ruido, los dos componentes principales de este segundo ruido no son simultáneos en el tiempo, sino que ocurren con un escasa diferencia no perceptible. En condiciones anormales se puede acentuar esta diferencia, percibiéndose entonces separados (desdoblamiento del segundo ruido). A.A., C.C., M.J.S. M. Valdés 6
153 TEMA Car-4 (A) CARDIOLOGÍA CMG por rotura del miocardio, etc 7. También es común que estos pacientes presenten un roce pericárdico en cualquier momento de la evolución. Además se deben valorar: o o o Pulso yugular: Es especialmente importante si se trata de un IAM del ventrículo derecho Existen distensión y ondas v. Pulso carotídeo: Es un indicador del estado del ventrículo izquierdo. Hay que observar su amplitud y si es alternante. Campos pulmonares: Es esencial buscar estertores y/o sibilancias por una posible IC. IC y grado Killip La magnitud de la masa necrosada condiciona la aparición de insuficiencia cardíaca, que es el principal factor de riesgo de mortalidad a corto y largo plazo en el IAM. Existe una clasificación funcional de los pacientes con infarto de miocardio basada en el grado de insuficiencia cardíaca: Grado Killip. Éste se emplea como valor pronóstico y comprende cuatro categorías (I-IV), en función del grado de IC que presente el paciente. Para evaluarlo, es preciso medir la TA, realizar una auscultación cardiopulmonar, y una cuantificación del volumen de orina excretado: GRADO CARACTERÍSTICAS MORTALIDAD Killip I Killip II Killip III Killip IV Sin Insuficiencia Cardíaca (I.C.) I.C. moderada: congestión pulmonar basal; disnea; oliguria; galope (estertores y R3) I.C. grave: Edema pulmonar agudo I.C. y shock cardiogénico 6 % 17 % 38 % 81 % El último grado engloba a pacientes con shock cardiogénico, con un descenso de la TA, con hipoperfusión tisular (el paciente tiene la piel fría, no orina) y con edema agudo de pulmón. En este grado, menos del 50% de los pacientes salen del hospital. D IAGNÓSTICO Los criterios diagnósticos del IAM son diferentes según el momento, diferenciándose si el IAM es agudo o ya establecido 8 : A. El diagnóstico de infarto de miocardio agudo, reciente o en evolución está basado en dos hechos principales: I. Ascenso y descenso de los marcadores bioquímicos del IAM, con al menos uno de los siguientes hallazgos: Síntomas isquémicos. Desarrollo de ondas Q patológicas. Cambios isquémicos en el ECG, elevación o descenso del ST. Intervencionismo cardiaco. II. Hallazgos anatómicos de IAM. B. En cambio, cuando el infarto ya está establecido, se diagnostica con uno de los siguientes criterios: I. La aparición de ondas Q patológicas en ECG seriados. Hemos de tener en cuenta que el paciente puede recordar o no síntomas isquémicos y que los marcadores bioquímicos pueden ser normales. II. Hallazgos anatómicos de IAM en fase de cicatrización o cicatrizado. 9 7 Si en un paciente sin soplo, al cabo de los días aparece uno, puede ser sugestivo de que haya desarrollado una insuficiencia cardiaca. Los soplos pueden indicar alteración mecánica, por ejemplo, por comunicación interventricular o por rotura de cuerdas tendinosas. 8 Estos criterios se han extraido de las diapositivas del profesor, no del Harrison, y no sé hasta qué punto son importantes, preguntables en el examen o no 9 Por supuesto Valdés nos recomienda encarecidamente el criterio I en ambos casos, ya que no es de recibo quitarle un cachito de corazón para una biopsia al pobre paciente infartado. A.A., C.C., M.J.S. M. Valdés 7
154 TEMA Car-4 (A) CARDIOLOGÍA CMG En general, los tres pilares básicos en el diagnóstico del IAM son: 1) CLÍNICA: Ya descrita, es sugestiva, pero no confirmatoria. 2) MARCADORES SÉRICOS: Son la principal arma de diagnóstico definitivo de infarto de miocardio reciente, pero no son de utilidad en el diagnóstico de urgencia. Lo característico es la elevación de CK-MB (y de las troponinas, que aumentan también en el No Q). 3) ECG: Es esencial como herramienta diagnóstica de urgencia, y también es útil en el diagnóstico de IAM establecido, como ya se comentó. Entraremos ahora en detalle en el estudio de los marcadores séricos y del ECG, ya que la clínica ya se expuso con anterioridad. 2 MARCADORES SÉRICOS Las enzimas que se utilizan como marcadores séricos pasan a sangre tras la necrosis del músculo cardiaco. Su velocidad de liberación está condicionada, entre otros, por su localización intracelular y por su peso molecular. Los marcadores deben determinarse cuando el paciente llega a urgencias, tras 6 h, tras 12 h, etc Se intenta objetivar un ascenso de dichas enzimas, que deberá ir seguido de un posterior descenso. Los principales marcadores séricos son: A. CPK: Se eleva tras las primeras 4-8 horas, normalizándose a las horas. El principal inconveniente de la CPK es su falta de especificidad, ya que puede dar falsos positivos ante traumatismos musculares, intoxicación alcohólica o DM. Por ello se emplea la isoenzima MB, mucho más específica del músculo cardiaco. Cuando la relación (índice relativo): masa de CK-MB/actividad de CK es mayor de 2,5, indica que el aumento es de origen miocárdico. B. Troponinas: Las isoformas I y T son las específicas del corazón. Sus niveles no suelen estar elevados en pacientes sanos, en cambio, aumentan hasta 20 veces en pacientes con un infarto con elevación del ST. Los niveles elevados pueden mantenerse hasta 7-10 días después del IAM. Además, las troponinas son detectables incluso en infartos de pequeño tamaño, al contrario que la CK-MB, como ya se vio en el tema anterior. Estas enzimas también pueden aparecer elevadas en pericarditis, miocarditis, sepsis, hemodiálisis, embolismo pulmonar, insuficiencia cardiaca, disección aórtica, quimioterapia, miopatías, VIH + o ejercicio. C. Mioglobina: Es uno de los marcadores que aparece más precozmente en sangre. Sin embargo, carece de especificad cardiaca y se elimina rápidamente por la orina, de modo que sus niveles se normalizan a las 24 horas. Recapitulando, se produce un aumento de los niveles de estos tres marcadores, a diferencia de en el infarto no Q, donde la CK-MB es normal. Para confirmar el IAM, estos marcadores han de medirse en el momento del ingreso, a las 6-9 horas, y a las horas. Además, también se emplean la LDH (lactato deshidrogenasa) y la GOT (Glutamico oxalacetico transaminasa), aunque son bastante inespecíficas. Otro cambio analítico a detectar es una leucocitosis inespecífica de predominio PMN, que aparece a las pocas horas y persiste 3-7 días. IMPORTANTE: Hay que saber que cualquier comportamiento anormal de estas enzimas (siendo el normal que se eleven, para posteriormente volver a sus niveles basales) nos debe hacer pensar en otra patología. Por supuesto, no podemos esperar en urgencias el tiempo que necesita la determinación de estos marcadores, ya que cada minuto que pasa significa miocardio perdido. Por ello necesitaremos de la utilización de otra técnica diagnóstica de urgencia para decidir la intervención sobre el paciente: el ECG. En la imagen podemos observar la curva que representa los niveles de cada marcador sérico con respecto al tiempo en días tras el infarto: A.A., C.C., M.J.S. M. Valdés 8
155 TEMA Car-4 (A) CARDIOLOGÍA CMG 3 ECG Lo primero y principal es decir que el ECG es la primera herramienta diagnóstica del IAM. Una clínica sugestiva de IAM más una elevación del segmento ST en el ECG de urgencias hace que el paciente sea subsidiario directamente de un tratamiento de reperfusión. La explicación a algunos de los cambios electrofisiológicos del IAM ya se vio en la sección de fisiopatología del tema. Ahora nos centraremos en la diferenciación de lesión, isquemia y necrosis en el ECG. Estudiaremos la utilidad de los cambios eléctricos para el diagnóstico del IAM en cada estadio de su evolución y la ubicación del mismo en la anatomía cardiaca. I. Isquemia: Las manifestaciones en el ECG dependen de su localización: a) Isquemia subendocárdica: Produce una onda T más prominente, y simétrica 10. b) Isquemia subepicárdica: La isquemia en esta zona produce diversos patrones, aunque lo más típico es una onda T negativa. También puede dar una línea isoeléctrica (onda T aplanada) Isquemia, lesión y necrosis Durante la fase aguda del infarto de miocardio transmural se pueden diferenciar anatomopatológicamente tres zonas del miocardio afectadas: una zona central de necrosis, una zona circundante de lesión isquémica y una zona periférica de isquemia. Estas tres áreas de músculo dan patrones electrocardiográficos característicos: 10 Parece ser que la onda T en el ECG normal tiene una pendiente más acusada en la línea de descenso que en la de ascenso, que es más lenta. A.A., C.C., M.J.S. M. Valdés 9
156 TEMA Car-4 (A) CARDIOLOGÍA CMG El siguiente cuadro expone las situaciones en las que pueden darse los patrones anteriormente citados 11 : Causas de onda T aplanada o invertida: Isquemia Variante de la normalidad (sobre todo en niños, negros, atletas, o con hiperventilación) Dilatacion/hipertrofia de VI Bloqueo de rama, marcapasos o síndrome de WPW. Miocarditis o miopericarditis Alcoholismo Prolapso de la válvula mitral Displasia del ventriculo derecho Síndrome de Brugada Fármacos Post-taquicardia paroxística II. Lesión: Las manifestaciones de la lesión isquémica también dependen del lugar donde se producen: a) Lesión subendocárdica: Produce descenso del segmento ST. b) Lesión subepicárdica: Al contrario que la anterior, produce característicamente elevación del segmento ST (recordemos de la fisiopatología la dirección del vector hacia la zona lesionada). Causas de elevación del segmento ST Isquemia Variante de la normalidad (en atletas, por estimulación vagal, o deformidad tórax) Pericarditis aguda Hiperkaliemia Bloqueo de rama Hipotermia III. Necrosis: Se caracteriza por la aparición de una onda Q patológica, que es una onda Q profunda debida a la ausencia de despolarización del tejido necrosado, actuando éste como ventana sobre los vectores del lado contrario, es decir, amplificando la deflección que producen los vectores del lado contrario ( ). La necrosis produce onda Q patológica excepto cuando se trata de un infarto posterior. Para que hablemos de onda Q patológica deben verificarse los siguientes criterios: o Cualquier onda Q en las derivaciones V1-V3 se considera patológica. o Onda Q > 30ms en I, II, avl, avf, V4, V5 o V6. o Ondas Q presentes en dos derivaciones contiguas. o La onda Q deberá ser > 0,1 mv de profundidad o al menos igual al 25% de la onda R siguiente. 11 Tanto los cuadros grimosos siguientes (causas de elevación del ST, de descenso del ST y de onda Q), como las dos listas de onda Q sin IAM e IAM sin onda Q son de las diapositivas de Valdés y no sé hasta qué punto entran en el examen Con este hombre no se sabe A.A., C.C., M.J.S. M. Valdés 10
157 TEMA Car-4 (A) CARDIOLOGÍA CMG Además, es necesario conocer que hay ondas Q aparecen sin IAM, y que hay IAM que aparecen sin ondas Q: 1. Ondas Q sin IAM:: a) Pueden aparecer como variante de la normalidad: En avi en corazones verticales, en III/aVF en corazones horizontalizados (como en la obesidad), y en V1 ante un enfisema. b) En bloqueos interventriculares. c) En crecimiento ventricular izquierdo o derecho. d) En miocardiopatia hipertrófica. e) En el Sd. de Wolf-Parkinson-White (WPW). 2. IAM sin ondas Q: a) IAM no Q (que corresponden a SCA- SEST). b) Necrosis localizada en la aurícula, en el ventrículo derecho o en la pared posterior del VI (en este caso la onda R es positiva e igual o mayor que la onda S en V1). c) Ondas Q que quedan enmascaradas por el marcapasos. d) Bloqueos de rama, etc. ECG y evolución del IAM Podemos diferenciar las distintas fases del IAM electrocardiográficamente: 1) Hiperaguda: En esta fase, que corresponde a la primera hora u hora de oro del IAM aparecen ondas T picudas (por isquemia subendocárdica) de gran amplitud, que pasan fácilmente desapercibidas, ya que no son muy llamativas. Es en esta fase en la que se ha de tratar el paciente, pues es en la que mayor cantidad de músculo es salvable. 2) Aguda: Corresponde a las primeras horas del IAM, concretamente las seis primeras horas. En esta fase se da una elevación del segmento ST (por lesión subepicárdica), permaneciendo la onda T elevada. Con esta elevación ya tenemos datos suficientes para decidir el tratamiento en un paciente con dolor precordial. Es entonces cuando se piden las enzimas, aunque antes de conocer el resultado se inicia el tratamiento, no podemos esperar. A.A., C.C., M.J.S. M. Valdés 11
158 TEMA Car-4 (A) CARDIOLOGÍA CMG En esta fase aguda, si el cuadro sigue evolucionando, observaremos que la onda T se hace negativa (por isquemia subepicárdica) y el segmento ST sigue elevándose (por aumento de la lesión subepicárdica). Finalmente, en los últimos momentos de esta fase habrá elevación del segmento ST, T negativa y comienzo de aparición de una onda Q patológica. Por tanto, será más precoz aquel IAM cuyo ECG muestre la elevación del segmento ST y aún no haya desarrollado la T negativa 12. 3) Subaguda: Se trata de la fase que comienza a partir de las 6 horas de evolución del IAM. La onda Q se hace progresivamente más prominente (debido a la necrosis emergente) y el segmento ST va descendiendo, tiende a hacerse isoeléctrico. 4) Crónica: La onda Q permanece de manera crónica, mientras que la onda T puede o no volver a ser positiva. Es vital diferenciar si el paciente está en fase hiperaguda, aguda o subaguda, pues de ello va a depender el pronóstico. De este modo, en la fase subaguda, la reperfusión de urgencia es muy poco útil (aunque la indicación de angioplastia sigue vigente hasta las 12h), ya que no queda apenas miocardio susceptible de salvarse. 12 Pensaréis, al igual que yo, que lo lógico sería que tras la onda T picuda por isquemia subendocárdica apareciera en el ECG la manifestación de lesión subendocárdica o de isquemia subepicárdica, y no elevación del ST, que es manifestación de lesión subepicárdica directamente Pues bien, esto mismo se lo pregunté al doctor Alberola, y me contestó las siguientes sabias palabras: Ten en cuenta que los términos "isquemia, lesión y necrosis" y los términos "subepicárdica-subendocárdica" en terminología ECG no se corresponden de forma estricta con los términos fisiopatológicos o histológicos, y hay que entenderlos como intentos de explicar de forma didáctica algunas alteraciones de la repolarización en la cardiopatía isquémica, más que como deducciones estrictas a partir de los fenómenos reales. En la práctica, la T positiva picuda inicial no aparece siempre y además no es suficientemente específica para diagnosticar el IAM, por lo que no se utiliza como criterio para indicar la trombolisis o la angioplastia primaria. Sólo tiene un valor "de sospecha" y si aparece con dolor típico te obliga a repetir el ECG cada varios minutos hasta comprobar que sube el ST e iniciar el protocolo de manejo del SCA- CEST. Amén. Tipos de IAM según su localización Los IAM pueden producirse en diferentes lugares de la anatomía cardiaca según la coronaria ocluida y el nivel de la oclusión. Con el ECG podemos diferenciar los siguientes tipos de IAM en función de su localización: 1. Anterior: Se produce cuando la arteria afectada es la arteria descendente anterior. 2. Inferior: Se produce cuando se afecta la arteria coronaria derecha. 3. Posterior: Puede producirse por afectación tanto de la arteria coronaria derecha como de la arteria circunfleja. 4. Lateral: Del mismo modo que el anterior. 1 Infarto anterior: En este tipo de IAM, donde se obstruye la art. descendente anterior, la elevación del ST y las ondas T positivas se reflejan generalmente en una o varias derivaciones precordiales (V1 a V6) y en las derivaciones I y avl. Más concretamente, cuando el IAM es anteroseptal, se captará con más intensidad en las derivaciones de V1 a V3. Cuando es anterior (a secas), se percibe en las derivaciones comprendidas entre V2 y V4; y cuando es un infarto anterior y extenso, en las precordiales (V1 a V6) y en I y avl. Por último, cuando es anterior y lateral, se observan cambios en las precordiales de V3 a V6 y en I y avl. 2 Infarto inferior (por isquemia transmural inferior): La isquemia inferior, producida por afectación de la art. coronaria derecha, causa cambios en las derivaciones II, III y avf. Específicamente, en el IAM inferolateral las derivaciones importantes son II, III, avf, V5 y V6.; y en el infarto inferoposterior se aprecia onda Q en II, III, avf y R anómala en V1 (por la afectación posterior). La coronaria derecha irriga el nódulo AV, por tanto en un infarto inferior puede producirse un bloqueo completo al infartarse esta zona. El bloqueo completo produciría rápidamente un síncope debido a la falta de riego cerebral. A.A., C.C., M.J.S. M. Valdés 12
159 TEMA Car-4 (A) CARDIOLOGÍA CMG 3 Infarto posterior: Se puede producir por afectación de la coronaria derecha o de la circunfleja. La isquemia posterior se manifiesta indirectamente en el ECG como una depresión recíproca del segmento ST en las derivaciones V1 a V3 (el profesor dijo sólo V1). Este IAM no presenta onda Q en estas derivaciones (sobre todo en V1), sino que aparece un complejo distinto predominantemente positivo. Se observa pues un aumento de la intensidad de los vectores en la parte anterior (ya que la necrosis elimina la actividad eléctrica en la pared posterior, de modo que la actividad eléctrica de la parte anterior será más llamativa). Por esto la principal manifestación del infarto posterior es el aumento de la onda R en V1. La afectación inferoposterior ya se vio en el apartado anterior. 4 Infarto apical o lateral: Aparece cuando se afectan la coronaria derecha y/o la circunfleja, negando el riego a la región del ápex cardiaco. Se manifiesta en las derivaciones I y avl. El inferolateral ya se vio en el apartado 2. La elevación del segmento ST (que puede desaparecer en minutos) puede ir acompañada de una onda T invertida (que permanece durante horas o incluso días) secundaria a la isquemia en evolución, o a la isquemia crónica Junto a la elevación ST, pueden también aparecer ondas R de escasa amplitud y/u ondas Q (se dan ante necrosis importantes de tejido miocárdico), que son permanentes. Es importante señalar que hay infartos transmurales que cursan sin onda Q, e infartos subendocárdicos que SÍ la presentan. Si la elevación del ST persiste después de meses debemos pensar en un aneurisma de VI (recordemos el remodelado patológico). Para asentar vuestros conocimientos sobre el diagnóstico electrocardiográfico del IAM pasaos por la zona ECG al final de la segunda parte del tema, IAM-B. DIAGNÓSTICO DIFERENCIAL Debido a los riesgos que conllevan y a la importancia de su diagnóstico precoz 13, debemos diferenciar el IAM de las siguientes principales patologías: Disección aórtica: Se produce por la separación de las capas de la aorta, producida por una columna de sangre que se origina por una ruptura de la íntima. Al ocurrir el desgarro intimal la presión hidrostática empuja, separando la capa íntima de la media y produciendo una falsa luz, además de un sitio de reentrada a la luz verdadera. Así, se genera una compresión de la luz verdadera. Embolismo pulmonar: Como en el caso anterior, se trata de una patología muy grave, por lo que siempre hay que descartarla en un paciente con clínica de IAM. Pericarditis: Suele conllevar menores riesgos que las anteriores, salvo que aparezcan complicaciones. El ECG puede respondernos a tres cuestiones de relevancia Estoy ante un IAM? Debemos buscar la elevación del ST. En qué fase evolutiva está? Si está en fase aguda, hiperaguda o subaguda, lo sabremos buscando alteraciones de la repolarización y/u ondas Q anómalas. Dónde se localiza el IAM? Lo averiguamos en función de las derivaciones y las características que presenta. 13 El diagnóstico precoz adquiere vital importancia sobre todo en las dos primeras patologías comentadas. A.A., C.C., M.J.S. M. Valdés 13
160
161 TEMA Car-4 (B) CARDIOLOGÍA CMG CARDIOPATÍA ISQUÉMICA INFARTO CON ONDA Q O IAM (B) T RATAMIENTO El tratamiento del IAM se basa en la fisiopatología. La situación con la que se inicia el tratamiento es una arteria cerrada que niega el flujo al músculo cardiaco, con lo que el tratamiento, intuitivamente, será eliminar el obstáculo. Hasta hace 15 años el tratamiento solamente incidía sobre las complicaciones, pero no solucionaba el problema de raíz. Existen diferentes métodos para eliminar el trombo oclusivo, como: a) Métodos farmacológicos: fibrinolisis. b) Métodos mecánicos: angioplastia. c) Medios quirúrgicos: En la actualidad no se emplean, por sus graves complicaciones. Estas técnicas tienen en común que su aplicación es urgente, pues a cada minuto que pase el número de células miocárdicas que mueren es mayor, aumentado por tanto la mortalidad. 1 A. Fibrinólisis Se emplean fármacos fibrinolíticos, es decir, fármacos que inducen el paso de plasminógeno a plasmina, la cual ejercerá una acción lítica sobre la fibrina (que actúa como una malla uniendo las plaquetas agregadas y los factores de coagulación). Los fibrinolíticos fueron un gran avance ya que redujeron un 30% de la mortalidad del IAM. En la actualidad no se deberían utilizar, ya que tienen riesgos hemorrágicos importantes y existen técnicas muchísimo más efectivas como la angiopastia. 1 Recordad: Cada minuto cuenta. 1) Ventajas: Su aplicación es muy rápida, pues se da en forma de bolo vía intravenosa. En los primeros 60 minutos un 60% de las arterias ocluidas se abren. Mientras que de este 60% de arterias que conseguimos reperfundir, tan sólo un 50% van a tener un flujo normal, el resto quedarán con flujo disminuido. El tratamiento fibrinolítico será tanto más eficaz cuanto más precozmente se haga. 2) Inconvenientes: Este tratamiento está contraindicado en un 25-30% de los pacientes. El tener antecedentes de hemorragia cerebral en cualquier fecha, crisis cerebrovascular en los últimos 12 meses, HTA importante (PAS>180 mmhg y PAD>100 mmhg) durante el cuadro agudo inicial, sospecha de disección aórtica o hemorragia activa interna contraindican el empleo de esta técnica. La vejez conlleva una mayor frecuencia de complicaciones hemorrágicas, pero el beneficio de estos fármacos justifica su uso. Además, tras administrar el fibrinolítico, al cabo de un lapso de tiempo muchas arterias vuelven a cerrarse, pues el tratamiento fibrinolítico incide sobre el trombo y no sobre el problema de base, que es la placa. 3) Otras consideraciones: Se ha observado que los mayores beneficios de los fibrinolíticos se dan cuando éstos se administran en las tres primeras horas del cuadro (nunca se deben administrar más allá de las 3h), y pueden disminuir hasta en un 50% el riesgo de fallecer si se trata A.A., C.C., M.J.S. M. Valdés 1
162 TEMA Car-4 (B) CARDIOLOGÍA CMG o o o en la primera hora. Cuando el tratamiento eseficaz, los cambios producidos tras conseguir la reperfusión son: Desaparición del ST elevado. Desaparición del dolor. Aparición de arritmias de reperfusión, como el ritmo idioventricular acelerado (RIVA). 2 Fibrinolíticos (o antitrombóticos) disponibles: (Diap. de Valdés) Streptocinasa (1,5 MU, una hora de infusión i.v). Reteplasa (2 bolos de 10 MU separados 30 minutos). Tenecplasa: Un bolo único ajustado en función de peso del individuo (30-50mg). Anistreplasa: 30 U en bolo. Urocinasa: 1,5 MU bolo + 1,5 MU en infusión durante 90 minutos. Alteplasa (acelerada): 15 mg en bolo + infusión de 0,75 mg/kg (hasta máx. 50 mg) en ,50 mg/kg (hasta 35 mg) en 60. 4) Características del tratamiento fibrinolítico: Produce aperturas precoces del vaso en el 54-81% de los IAM. El flujo epicárdico normal (TIMI 3) se logra sólo en un 30-54%. Pueden aparecer reoclusiones precoces en un 5-10% y tardías en un 30%. El riesgo de hemorragia cerebral es de 0,3-0,5% 3. No se dispone de un método eficaz para saber si se ha conseguido abrir la arteria responsable del infarto (ARI). Escala TIMI 4 Cuando se hace una evaluación angiográfica, se describe la corriente sanguínea en la arteria afectada gracias a una escala sencilla denominada Escala de gradación de trombólisis en Infarto de miocardio o TIMI. Se distinguen 4 grados (del 0 al 3). Así, un TIMI O corresponde 2 Ver tema Arritmias VI de la comisión. 3 Según el Harrison este riesgo llega incluso al 0,9%. 4 Ampliación del Harrison. a la oclusión total de la arteria que regaba el tejido infartado. Un TIMI 1 indica una moderada entrada del contraste, sobrepasando el punto de obstrucción, aunque el flujo que llega al territorio distal es insuficiente. El TIMI 2 se da cuando pasa sangre por el vaso hacia el territorio distal, pero este flujo es tardío y lento en comparación con una arteria normal. Finalmente, el TIMI 3 es la corriente normal de sangre en el vaso afectado. B. Angioplastia primaria La angioplastia coronaria transluminal percutánea (ACTP) requiere la realización de una coronariografía para comprobar que realmente hay una arteria cerrada, cúal es, y a qué nivel se localiza. Esto es importante ya que el 6-8% de los pacientes con elevación del ST tienen las coronarias normales 5. Para el tratamiento con fibrinólisis no se realiza esta prueba. Este método consiste en la colocación de una prótesis o Stent tras limpiar previamente el vaso. El procedimiento es el siguiente: Se comienza introduciendo un catéter en la circulación arterial mediante punción con aguja y se hace avanzar hasta el corazón bajo control fluoroscópico. Estos catéteres contienen una guía metálica flexible que se introduce a lo largo de la arteria coronaria, a través de la estenosis, hasta la porción post-estenótica del vaso. Esta guía es el raíl sobre el cual se introduce el globo de angioplastia y otros dispositivos terapéuticos, con el fin de aumentar el calibre de la porción estenosada de la arteria. Se realiza con anestesia local y sólo requiere un día de hospitalización. Precisa de buen equipo profesional y mecánico. La angioplastia es muy efectiva, pues el 95% de las arterias se abren, recuperándose en un 90% de los casos el flujo normal. Además, no se corre el riesgo de que aparezcan hemorragias intracraneales. 5 Por esto la importancia de la coronariografía, que sirve para dar el diagnóstico de certeza. Pacientes con elevación del ST y coronarias normales son, por ejemplo, los que sufren angina de Prinzmetal. Estos pacientes, si no tienen la posibilidad de tratarse con ACTP, recibirán tratamiento fibrinolítico, exponiéndose a riesgo de hemorragia cerebral sin ninguna necesidad. A.A., C.C., M.J.S. M. Valdés 2
163 TEMA Car-4 (B) CARDIOLOGÍA CMG Características de la ACTP primaria: Aperturas precoces del vaso (90-95 %). Se consigue TIMI 3 entre %. Menor mortalidad y reinfarto. Reoclusiones precoces entre 1-3 %. Restenosis tardías entre %. Incidencia de hemorragia cerebral nula. Otros datos a tener en cuenta: Del 3 al 5 % de los pacientes son quirúrgicos. El 5% de pacientes tiene las coronarias normales o con lesiones no significativas (lo que se diagnostica gracias a la coronariografía previa a las ACTP) y no se tratan. Con la ACTP se realiza una mejor estratificación de riesgo, se consiguen altas precoces (3-5 días) y la mortalidad es baja (0,4%). Ante un paciente que sea tributario de recibir las dos pruebas (fibrinólisis o ACTP) siempre debemos decidirnos por la ACTP 6. Sin embargo, hay que valorar las características de cada paciente, en relación con su posibilidad de traslado al hospital y su riesgo de hemorragia cerebral. En el caso del HUVA, aquellos pacientes procedentes de Murcia capital o Cieza (por ejemplo) pueden llegar en poco tiempo al hospital, donde serían subsidiarios de una ACTP primaria. En cambio, los pacientes de ciudades 7 más alejadas como Cartagena o Lorca tienen un transporte más dificultoso, por lo que en ellos estaría recomendado el tratamiento fibrinolítico, que se les aplica en el hospital que les corresponde (Rosell de Cartagena etc). El por qué está claro, cada minuto cuenta y cuanto más se retrase el tratamiento, peor pronóstico tendrá el paciente. Aunque, como en todo, hay excepciones, por ejemplo, pacientes que llegan al hospital tres horas después de iniciarse el cuadro. En estos pacientes ya es demasiado tarde para dar fibrinolíticos, pues el daño miocárdico ya supera el 80% y la reperfusión es poco útil, por tanto el beneficio es mínimo y puede haber un alto riesgo de trastornos hemorrágicos. En este caso se transportaría al enfermo al hospital de referencia y se le practicaría un ACTP. También se les practicará ACTP siempre a aquellos pacientes que tengan contraindicada la fibrinólisis. MANEJO DEL PACIENTE CON IAM 1. Prehospitalario 2. Hospitalario 3. Posthospitalario 1. PREHOSPITALARIO El pronóstico en caso de infarto Q depende en gran medida de que surjan dos tipos generales de complicaciones: 1) en la conducción eléctrica del corazón (arritmias como la fibrilación ventricular) y 2) las de tipo mecánico ( fallo de la bomba ). Muchos de los fallecimientos en esta fase ocurren por fibrilación ventricular. Los principales elementos de atención prehospitalaria en personas con sospecha de infarto Q son: 1) identificación de los síntomas por parte del paciente y solicitud inmediata de atención médica; 2) contar en breve plazo con un grupo médico especializado en urgencias, capaz de emprender maniobras de reanimación, incluida la desfibrilación; 3) transporte inmediato del paciente al hospital que tenga servicio continuo de médicos/as y enfermeros/as expertos en el tratamiento de arritmias y que brinde apoyo vital avanzado de tipo cardíaco; y 4) emprender inmediatamente la reperfusión. El máximo retraso se produce desde el comienzo del dolor hasta la decisión de solicitar ayuda. Dicho retraso puede acortarse si se educa a la población en la trascendencia del dolor retroesternal y la importancia de solicitar tempranamente atención médica, ya que la mayoría de las muertes ocurren en la primera hora. La mortalidad en la fase prehospitalaria es del 10%. La praxis habitual del enfermo y la situación de asistencia y transporte hacen que lo más frecuente sea que el afectado tarde unas 2 horas en llegar al hospital, y que el 75% llegue por sus propios medios. 6 En el HUVA llevan más de 6 años sin tratar un IAM con fibrinolíticos. 7 Sí, CIUDADES! xd. (May) A.A., C.C., M.J.S. M. Valdés 3
164 TEMA Car-4 (B) CARDIOLOGÍA CMG Resumiendo, los mayores problemas en esta fase son: Retraso de los pacientes en llegar al hospital. Retraso en ser atendidos en urgencias. Retraso en poner en marcha el tratamiento. En el 10 % de los pacientes con IAM se da muerte súbita, debido a que una arteria al cerrarse produce arritmia, en este caso una taquicardia ventricular, la cual acaba produciendo fibrilación ventricular (FV), que si no recibe desfibrilación (único tratamiento para la FV) provoca la muerte. La mayoría de las muertes son debidas a FV con paro cardiaco. La FV se diagnostica por presencia de ondas características en el ECG sin complejos QRS (ver Arritmias VI). Además, el paciente pierde el pulso repentinamente y no respira, por lo que habrá que realizar inmediatamente una RCP (reanimación cardiopulmonar): 1º) Permeabilizar la vía aérea, 2º) Ventilar, y 3º) Masaje cardiaco. Es esencial la utilización de un desfibrilador, ya que la supervivencia se reduce entre un 7 y un 10% por cada minuto que el paciente pasa en parada cardiorrespiratoria, de este modo a los 5 minutos habrá un 50% de mortalidad. Medios para reducir la mortalidad en fase prehospitalaria: 1.- Concienciar a la población de la importancia de acudir precozmente al hospital ante un dolor precordial de características isquémicas. Hemos de recordar que en el 50% de los casos el IAM es la primera manifestación de cardiopatía isquémica. Importante: Dolor de más de 5 min que no cesa con una gragea de nitroglicerina, tomar una segunda gragea camino del hospital. 2.- La implementación de un sistema de asistencia al IAM 8 : Como ya se indicó, el 75% de los pacientes utilizan sus propios medios para ir al hospital, a pesar de la existencia en Murcia del sistema del 061. SIEMPRE es preferible el transporte en una ambulancia que ir por su propia cuenta. Las ambulancias han de contar con médicos y enfermeros, y con tecnología para diagnosticar una FV con ECG y tratarla con un desfibrilador. Parte esencial de este sistema debería ser la presencia de desfribiladores en lugares públicos y de gran concurrencia: hospitales, aeropuertos, grandes almacenes, campos de fútbol, etc. En Murcia no está establecido este sistema de desfibriladores en lugares públicos. En la Arrixaca, los cinco desfibriladores del hospital están en la planta de cardiología. Por otra parte, existen personas de alto riesgo que se compran desfibriladores (que cuestan unos 2000 ó 3000 euros) para tenerlos en su propia casa. 2. HOSPITALARIO Recordemos que el 90% de los pacientes ha conseguido llegar al hospital con vida. Bien, una vez llegado este paciente, con dolor isquémico de más de 30 min y elevación del ST en el ECG, la primera medida terapéutica a realizar es la reperfusión. Los métodos para la reperfusión del tejido isquémico son los ya comentados: angioplastia primaria 9 o fibrinólisis si el infarto tiene menos de 3 horas de evolución y el traslado al hospital para una ACTP tardaría más de 90 minutos. Cuanto 8 Actualmente en España sólo existen sistemas de esta índole en Murcia, Galicia y Aragón. Al fin una razón para sentirnos orgullosos de nuestra sanidad regional. 9 En urgencias sólo se reperfunde la coronaria ocluida. Aunque se vean otras coronarias afectadas durante la coronariografía, éstas se tratarán de manera diferida. A.A., C.C., M.J.S. M. Valdés 4
165 TEMA Car-4 (B) CARDIOLOGÍA CMG mayor sea el retraso en la reperfusión, mayor será la mortalidad. Las características de ambos tratamientos ya las tratamos con anterioridad. Medidas iniciales: Además de la reperfusión de urgencia, algunas medidas iniciales recomendadas son: Reposo en cama, ECG de 12 derivaciones, monitorización continua de ECG, FC y TA, historia y exploración física, colocación de una vía venosa, realización de análisis (enzimas, hematología y bioquímica), administrar ácido acetilsalílico (AAS, mg masticada y tragada), nitroglicerina sublingual como prueba de isquemia reversible, oxígeno en las 2-3 primeras horas y continuar más adelante si Sat O 2 < 90 %, morfina para el dolor (2-4 mg repetidos), clopidogrel 600mg (oral), β-bloqueantes (se deben administrar a todos los pacientes excepto a los que tienen contraindicaciones), IECAs, heparina, inhibidores del los receptores IIBIIIA 10, y estatinas. Todo ello se realiza en el servicio de urgencias. Importante: Ninguna de estas medidas iniciales debe demorar el comienzo de la reperfusión. Manejo para la reperfusión del paciente con IAM En resumen, ante un IAM hay que realizar una reperfusión. El tipo de reperfusión dependerá del tiempo de traslado, del tiempo de evolución del cuadro cuando el paciente llega y de la susceptibilidad a eventos hemorrágicos del paciente: I. Si el tiempo de traslado a un hospital con laboratorio de hemodinámica es <90 min SIEMPRE se realizará una ACTP 1ª. II. Si los síntomas comenzaron hace más de 3 h o está contraindicada la fibrinólisis, la reperfusión se llevará a cabo mediante una ACTP 1ª en un hospital con hemodinámica. III. Si los síntomas comenzaron hace menos de tres horas, el tiempo de traslado es >90 min y no hay contraindicaciones para la fibrinólisis, se comenza- 10 Estos fármacos son inhibidores muy potentes de la agregación plaquetaria, y así inciden directamente sobre la génesis del síndrome coronario agudo. rá con una fibrinolisis (extrahospitalaria o en hospitales sin servicio ACTP) lo antes posible. Ante esto pueden darse dos situaciones: a) Fracaso de la fibrinólisis: se tiene que solucionar con una ACTP de rescate (25%) en el hospital de referencia. b) Éxito de la fibrinólisis: Se debe realizar una ACTP lo antes posible ya que, aunque hemos eliminado la obstrucción, la lesión del vaso sigue presente (la placa sigue vulnerable) y si no se trata, volverá a formarse un trombo pronto. Obviamente el manejo será diferente según a qué tipo de hospital llegue el paciente: Hospital con disponibilidad para realizar ACTP las 24 h del día: En ellos siempre se realizará ACTP 1ª. Hospital con ACTP sólo a determinadas horas del día (de las 8 a las 15 h por ejemplo) o Si llega en esas horas con disponibilidad de hemodinámica (horas de trabajo): ACTP 1ª. o Fuera de horas de trabajo: Si tiempo de traslado es <90 min ACTP 1ª en un hospital con ACTP 24 h. Si tiempo de traslado >90 min: Y comienzo de síntomas hace >3 h ACTP 1ª en un hospital con ACTP 24h. Y comienzo de síntomas hace <3 h hacer fibrinólisis y después ACTP de rescate, si hay fracaso, o ACTP inmediata o facilitada, aún habiendo éxito. Hospital sin ACTP: El manejo de estos pacientes será el mismo que el realizado en el hospital anterior fuera de horas de trabajo de ACTP. A.A., C.C., M.J.S. M. Valdés 5
166 TEMA Car-4 (B) CARDIOLOGÍA CMG En cuanto al tratamiento farmacológico, las recomendaciones que se siguen son las siguientes: (diap. de Valdés) 1. Antiagregantes plaquetarios: Siempre se debe adminitrar AAS. Además: AAS+Clopidogrel o Ticlopidina si ACTP 1ª con stent. Y triflusal, ticlopidina o clopidogrel si intolerancia al AAS. 2. Beta-bloqueantes: Siempre en pacientes de menos de 12h de evolución sin contraindicaciones. Útil para dolor continuo o recurrente, taquiarritmias (como fibrilación auricular con ritmo ventricular rápido) e insuficiencia cardiaca moderada. 3. IECAs: Para IAM extenso y/o con FE<40 % en ausencia de hipotensión o contraindicaciones. Insuficiencia cardiaca clínica en ausencia de hipotensión o contraindicaciones. En general, administrar a todo paciente dentro de las primera 24 h en ausencia de contraindicaciones. 4. Antagonistas del calcio: Verapamil o Diltiazem si β-bloqueantes ineficaces o contraindicados con isquemia en curso. Para controlar la frecuencia ventricular en FA. En IAM sin elevación ST, puede añadirse diltiazem al tratamiento estándar. El nifedipino está contraindicado rutinariamente. 5. Nitritos: En las primeras 24 h en IAM con: HTA, insuficiencia cardiaca e isquemia persistente. Tras las primeras 24 h se administran en IAM con insuficiencia cardiaca o angina recurrente. Unidades de cuidado coronario 11 Dentro de la estancia hospitalaria entran en acción las unidades de cuidado coronario que proporcionan una vigilancia continua del ritmo cardíaco y monitorización hemodinámica. En estas unidades hay desfribriladores, respiradores, marcapasos y catéteres con punta de globo y arrastrados por el flujo. Los pacientes deben ser internados en fecha temprana de la evolución de la enfermedad. La duración de la estancia depende de la necesidad constante 11 Ampliación del Harrison. de medidas intensivas. Medidas a realizar en estas unidades: Actividad: No deben darse fármacos que incrementen el trabajo del corazón. Reposo absoluto en las primeras 12 horas. Si no hay complicaciones, los pacientes pueden estar en postura erecta o sentada. Si no hay complicaciones al cabo de 3-4 días caminarán, se ducharán, etc. Dieta: Ante el riesgo de vómito y broncoaspiración, se recomienda ayuno absoluto o ingesta de líquidos claros en las primeras 4 a 12 h. Alimentación con abundante potasio, magnesio y fibra vegetal, pero poco sodio. Intestino: El reposo y los narcóticos causan estreñimiento. Hay que dar fibra vegetal y reblandecedor de heces, como el dioctil sulfosuccinato sódico (200 mg/día). Sedación: Para tranquilizar: Diazepam (5mg), oxazepam (15-30mg) o lorazepam (0,5-2mg) 3 ó 4 veces al día. Puede darse una dosis por la noche para mejorar el sueño. La atropina, los bloqueadores de receptores H2 y los narcóticos producen estado de confusión, particularmente en el anciano. Ingreso hospitalario Tras el ingreso hospitalario, el paciente puede evolucionar de maneras muy distintas: A. El paciente puede quedar asintomático, porque la arteria ha quedado abierta precozmente y/o el infarto no ha sido muy grande. Se le puede dar el alta en 3-4 días. Medicación: control de los factores de riesgo (tabaco, diabetes,...), doble antiagregación plaquetaria: AAS de por vida, y clopidogrel, durante un año, aunque depende del stent que se coloque; para evitar el remodelado patológico ventricular a largo plazo administrar β- bloqueantes e IECAs, siempre que no tengan contraindicaciones ni efectos secundarios en el paciente. B. El paciente puede quedar asintomático, a pesar de haber sufrido un infarto de gran extensión (por ejemplo un infarto de 4 horas de A.A., C.C., M.J.S. M. Valdés 6
167 TEMA Car-4 (B) CARDIOLOGÍA CMG duración y grande en extensión, perdiendo un 20 % de la masa del ventrículo izquierdo). A los 2-3 días del infarto desaparece músculo y queda cicatriz, una zona adelgazada que poco a poco se remodela, su distensibilidad disminuye y finalmente genera un abombamiento. El ventrículo izquierdo pasa de elíptico a deforme y la sangre se almacena en un remanso en la zona infartada. Como ya hemos dicho, los β-bloqueantes y los IECAs mejoran la evolución del remodelado de la cicatriz. C. Paciente con o sin infarto de gran extensión que sufre complicaciones. Distinguimos complicaciones mayores y menores: COMPLICACIONES DEL IAM I. COMPLICACIONES MAYORES 1.- Arritmias 2.- Insuficiencia cardiaca HOSPITALARIAS 3.- Complicaciones isquémicas 1. Arritmias 12 A. Ventriculares Extrasístoles ventriculares: Son muy frecuentes en el IAM y no necesitan tratamiento. Ritmo idioventricular acelerado: Arritmia que suele presentarse durante la reperfusión del infarto y es marcadamente benigna. Aparece en el 25% de los pacientes con IAM. Si es necesario, es de fácil tratamiento con atropina (acelerador del ritmo). Taquicardia ventricular - Fibrilación ventricular: La más peligrosa. Ya se comentó la importancia del acceso a un desfibrilador para tratar la FV. La profilaxis con antiarrítmicos (lidocaína) en estos casos disminuye la frecuencia de aparición de TV y FV, pero no mejora la supervivencia global. La administración de β-bloqueantes y el acceso a desfibrilación es suficiente. Por otro lado, la supervivencia a largo plazo es muy diferente según la FV aparezca secundaria a la isquemia (buena supervivencia) o por fallo de la bomba (malos augurios a largo plazo). B. Bradiarritmias Bradicardia sinusal. Bloqueo AV: De distintos tipos, entre los que se incluye el bloqueo completo (con el corte de irrigación del nódulo AV). Bloqueos intraventriculares: Pueden ser hemibloqueo anterior de rama izquierda, hemibloqueo posterior de rama izquierda, bloqueo de rama derecha o bloqueo bifascicular. C. Arritmias supraventriculares 13 Taquicardia sinusal y extrasístoles auriculares. Taquicardia paroxística supraventricular. Flutter y fibrilación auricular (FA): normalmente consecuencia de la insuficiencia cardiaca del VI. Taquicardia de la unión AV: Se ha de descartar la causada por intoxicación digitálica. 2. Insuficiencia cardiaca Fisiopatológicamente se produce un fallo de la bomba, que puede provocar desde una IC ligera a un edema agudo de pulmón o un síndrome coronario. Para valorar el grado de fallo de la bomba se utilizan dos clasificaciones: el grado Killip (ya explicado anteriormente) y la de Forrester: 12 Valdés no comentó prácticamente nada de las arritmias en clase. Se limitó a poner la lista, a decir que ya las veríamos con Alberola, y a insistir en que el IAM es la causa más frecuente de arritmia maligna. Por supuesto, las cosas añadidas a la lista son del Harrison. 13 En general, en todas las supraventriculares basta con el tratamiento con β-bloqueantes. En caso de existir insuficiencia cardiaca: digoxina. A.A., C.C., M.J.S. M. Valdés 7
168 TEMA Car-4 (B) CARDIOLOGÍA CMG Clasificación de Forrester: I.- Normal III.- Hipoperfusión periferica II.- Congestión pulmonar Tratamiento con: diuréticos, NTG 14 i.v., morfina i.v. e IECAs. IV.- Congestión pulmonar e hipoperfusión periférica Tratamiento con: líquidos, dopamina o dobutamina. Tratamiento: NTP 15, NTG i.v. + dopamina/dobutamina y balón de contra-pulsación 16 Tipos de insuficiencia cardiaca, presencia o no de relación con el tamaño del infarto: 1- Relacionada con el tamaño del infarto: Las IC relacionadas con el tamaño del infarto son aquellas producidas por el fallo de la bomba, es decir, el músculo restante tras la necrosis del infarto es insuficiente en sus funciones de bomba. Puede ser compensada o no compensada. Depende de la extensión de miocardio necrótico, aturdido o hibernado, es decir de miocardio no funcionante en un momento determinado. Hay que señalar que todos los infartos producen una cierta IC. Recordemos lo siguiente de la parte anterior (A) del tema: La magnitud de la necrosis del músculo cardiaco se relaciona directamente con el pronóstico y mortalidad. Así: o o o o Pérdidas menores al 5% de masa muscular miocárdica no producen alteraciones significativas. Con pérdidas del 8% el paciente tendrá alteraciones en la función diastólica. Pérdidas del 15% producirán alteraciones en la fracción de eyección y los volúmenes telediastólico y telesistólico. Ante una pérdida del 10% el paciente presentará una insuficiencia cardiaca compensa- 14 Nitroglicerina. 15 NTP: Nitroprusiato sódico: Vasodilatador periférico que actúa sobre el músculo liso de los territorios venoso y arterial. 16 Explicado en el tema de insuficiencia cardiaca. o o da con sintomatología cuando éste haga ejercicio. Si pierde del 20 al 25% el paciente presentará una insuficiencia cardiaca congestiva con graves síntomas. Por último, si el paciente pierde un 40% o más, la situación desembocará irremisiblemente en un shock cardiogénico, que tiene una mortalidad del 95% y pocas opciones de tratamiento: transplante o tratamiento muy precoz. La IC puede tener una presentación aguda, después del infarto, o aparecer diferidamente como IC crónica tras el remodelamiento patológico de la cicatriz. Esta última aparece 2 ó 3 años después del IAM. Por último, decir que la IC en relación con el tamaño es la complicación más frecuente del IAM. En la IC aguda severa poco se puede hacer: como última opción el trasplante cardiaco. En la crónica (por remodelamiento) se dan β-bloqueantes, IECAs. 2- Sin relación con el tamaño del infarto: En este caso la IC es de origen mecánico, producida por la rotura de músculo cardíaco necrosado. Ocurre a los 3-4 días tras el IAM. Según la localización de la zona afectada: a) Septo, desembocará en un CIV (comunicación interventricular). b) Músculo papilar, provoca una insuficiencia mitral aguda. c) Pared, termina en muerte o taponamiento cardiaco. El cuadro de insuficiencia cardiaca se acompaña de soplos. Se debe realizar ecocardiografía inmediatamente tras la auscultación de un soplo para ver si es CIV o insuficiencia mitral, ya que la mortalidad es muy alta. RUPTURA DEL SEPTO (INTERVENTRICULAR) Características: En 1-2 % de los IAM. Aparece a los 3-5 días. Factores de riesgo: edad, HTA, fibrinólisis y ausencia de ramas colaterales. Aparece con igual frecuencia tanto en el IAM anterior como inferior. Soplo pansistólico (grado 3-4 de 6) en zona amplia. Aparece thrill en el 50 %. Produce una IC biventricular rápida. A.A., C.C., M.J.S. M. Valdés 8
169 TEMA Car-4 (B) CARDIOLOGÍA CMG Diagnóstico: Se realiza con eco-doppler o estudios isótopicos (estudios de perfusión con cardiología nuclear). Con cateterismo: Con el catéter de Swan-Ganz se puede objetivar un salto oximétrico entre las cavidades cardiacas. También se puede hacer una coronariografía. Tratamiento: Puede ser médico o quirúrgico (intervencionista con doble disco). Hoy día el 60 % de CIV se cierran de forma percutánea, con un mecanismo simple pero sofisticado: la colocación en el orificio de un doble paraguas. RUPTURA DEL MÚSCULO PAPILAR Características: En el 1% de los IAM. Aparece a los 3-5 días del IAM. FR: Edad, HTA, fibrinólisis y ausencia de colaterales Más frecuente en IAM inferoposterior. Aparición de soplo pansistólico de grado 3 sobre 6, puede ser suave o no. La presencia de thrill es rara. Aparece una insuficiencia mitral aguda que genera IC con edema agudo de pulmón. Diagnóstico: Con eco-doppler o estudios isotópicos. Con cateterismo se objetivan ondas V prominentes y como siempre, se puede realizar una coronariografía. Tratamiento: puede ser quirúrgico o médico. 17 RUPTURA DE LA PARED Responsable del 15 % de las muertes por IAM. La reperfusión precoz disminuye la incidencia. Aparición brusca, entre 1 y 3 semanas después del IAM. Aparece en la unión del tejido sano y el infartado. Más frecuente en ancianos, mujeres y pacientes con HTA. Es 7 veces más frecuente en VI que en VD. Suele aparecer en la pared lateral o en la anterior. 17 Ver el tema relativo a insuf. Mitral en la sección de valvulopatías de la comisión. En IAM extenso aparece en más del 20%. En la mayoría de los casos aparece en pacientes que no habían tenido IAM previo al que provoca la rotura. La muerte se produce por hemopericardio y taponamiento cardiaco. Mortalidad >90%. Si se rompe la pared poco hay que hacer: si hay taponamiento, sangre en pericardio, ésta comprime el corazón, la tensión cae y el paciente muere. Con cirugía la mortalidad es del 80 % y sin cirugía prácticamente del 100%. Con angioplastia primaria precoz estás complicaciones disminuyen en gran medida. 3. Complicaciones isquémicas o isquemia recurrente Dependiendo del tratamiento su incidencia varía entre el 5 y el 30% de los IAM. Puede ser debida a: o Reoclusión de la arteria abierta previamente: extensión o reinfarto. o Espasmo. o Zona diferente a la del primer infarto. Problemas diagnósticos: Las enzimas pueden estar elevadas y el ECG ser anormal desde el IAM previo. Las complicaciones isquémicas son de mal pronóstico siempre. Se debe hacer un nuevo tratamiento de reperfusión inmediato. La incidencia de esta complicación está disminuyendo debido a que siempre se tratan todas las coronarias afectadas, aunque sea de manera diferida, y también gracias a la mejora de los stent. II. Complicaciones menores 18 Estas complicaciones disminuyen mucho con la ACTP primaria. 1- Pericarditis: Es frecuente y afecta al miocardio. En fases iniciales aparece un roce pericárdico. 18 De todas las complicaciones menores el profesor sólo comentó el aneurisma de VI. La información del resto es de las diapositivas del Valdés. Pero las pasó sin ni siquiera mirarlas A.A., C.C., M.J.S. M. Valdés 9
170 TEMA Car-4 (B) CARDIOLOGÍA CMG 2- Aneurisma ventricular (de ventrículo izquierdo): El VI se dilata y la sangre se remansa en su interior. Es causa de IC, ya que el corazón no es efectivo. Produce arritmias malignas por reentradas, por diferencias eléctricas entre parte sana y dañada. También puede producir embolias por coágulos. 3- Pseudoaneurisma. 4- Trombos intracardíacos y émbolos sistémicos. 5- Trombosis venosa y pulmonar. 6- Síndrome de Dressler. PSEUDOANEURISMA Ruptura sellada Paredes: perforada y trombo Pueden ser tan grandes como el ventriculo Pueden dar embolias Diagnóstico por Eco-doppler Ruptura sintomática o no. Si compromiso, cirugía urgente. TROMBO INTRACARDIACO En 20 % sin anticoagulación oral. 60 % si IAM anterior. Ecocardiografía para diagnóstico. Mal pronóstico si aparece precoz. PERICARDITIS Derrame pericárdico En 25 % de los pacientes. La mayoría sin pericarditis. Más frecuente con IAM anterior, IAM extensos e IC. Mayoría asintomático. Resolución lenta. No se deben dar ACO (anticoagulantes orales). Pericarditis Desde el primer día a las 6 semanas posteriores aparece. Dolor parecido al isquémico. Roce pericárdico se da con más frecuencia que dolor o cambios ECG. ACO aumenta el riesgo de hemorragia. ANEURISMA VENTRICULAR Debemos pensar en él cuando persiste el ST elevado durante meses. Características En menos del 5-10 % de los IAM. Más frecuente en IAM anteriores. Pared más fina. Generalmente oclusión de la descendente anterior sin colateral. Mortalidad 6 veces mayor. Clínica IC Arritmias y muerte súbita. Embolias Diagnóstico ECG: persiste elevación ST Con eco-doppler, isótopos o angiografía. Tratamiento Quirúrgico EMBOLIAS SISTÉMICAS En 10 % de trombos intracardiacos Predispone: trombo móvil, sesil. Sobre zona acinéticas. Tratamiento para trombos y embolias Heparina+anticoagulantes orales (3-6 meses) 1.- Tras accidente embólico 2.- Con IAM anterior extenso 3.- Con evidencia en Eco de mal pronóstico SÍNDROME DE DRESSLER Síndrome post-iam Aparece 1-8 semanas tras IAM Incidencia: hoy menor que la citada (3-4%) Clínica: malestar, fiebre, pericarditis, leucocitosis, velocidad de sedimentación aumentada y derrame pericárdico. Probable origen inmunológico AAS como primera opción de tratamiento. Corticoides si no responde. TROMBOSIS VENOSA Y EMBOLIA PULMONAR Hoy en día casi inexistente por la movilización precoz del paciente. Más frecuente con IC, encamados y con IAM extensos complicados. Comentar por último el infarto de ventrículo derecho en el contexto del infarto Q: Aparece casi en el 50 % de los pacientes con IAM inferior, aunque es hemodinámicamente significativo sólo en el 10 % de los pacientes. La mortalidad hospitalaria es mayor que en el simple infarto. A.A., C.C., M.J.S. M. Valdés 10
171 TEMA Car-4 (B) CARDIOLOGÍA CMG La sospecha clínica de infarto de VD en pacientes con IAM inferior debe aparecer cuando existe: Hipotensión Campos pulmonares limpios Distensión yugular (PAD 10mmHg) Pulso yugular con y al valle X, es decir, un descenso muy pronunciado de la onda y de aurícula derecha. Signo de Kussmaul Soplo de insuficiencia tricuspídea Presencia de R3 y R4 derechos (R=ruido). Pulso paradójico Bloqueo AV de alto grado Diagnóstico: ECG: elevación ST en V4R u otras derivaciones derechas (V5R, V6R). Ecocardiograma: o Dilatación del VD y disminución de fracción de eyección del VD. o Ausencia de derrame pericárdico. Tratamiento: Reperfusión. Expansión del volumen para conservar en niveles adecuados la precarga de VD (con suero salino, HC). Dobutamina con cuidado. Contraindicados los diuréticos y los vasodilatadores. Tras este extenuante periplo por las insidiosas diapositivas de Valdés, volvemos a poner los pies sobre la tierra, entrando en una materia realmente dada en clase: Transplante de células madre 19 En los últimos años, algunos datos experimentales han mostrado la existencia de apoptosis celular en un 1-2 % de las células cardiacas y en un 1% de las células del SNC. Este dato, cuanto menos sorprendente, nos hace pensar que entonces estas células también deberían regenerarse. Así, se sabe que el corazón, al 19 El por qué de este apartado que parece introducido en el tema como con calzador es el siguiente: El señor Valdés, como cualquier ser humano que se precie, también tiene su corazoncito, de tal modo que, aunque su afición morbosamente satisfactoria y su pan de cada día es ponerle muellecitos stent a todo individuo con un dolorcillo pectoral que se asome la puerta del HUVA, el hombre también piensa en el futuro de los infartados y, ya sea por avidez de conocimiento y reconocimiento, ya sea por sentimientos altruistas, investiga sobre un futurible tratamiento del IAM que restituya totalmente la función del miocardio, es decir, un tratamiento con células madre. cabo de 6 ó 7 años, ha cambiado totalmente su población celular, con lo que debe haber células madre capaces de ir regenerando el músculo cardiaco para compensar la apoptosis. Otro dato que apoya este hecho es la presencia de cromosomas XX en el corazón de una mujer, cuando éste viene transplantado de un hombre. En este corazón, por lo tanto, ha habido reproducción celular. Se ha comprobado la factibilidad de un tratamiento con células pluripotenciales en el ratón, cuyo corazón pesa alrededor de 1g. Sin embargo, en un corazón humano, con un peso aproximado de 300g, sería muy complicado el tratamiento, por ejemplo, de un infarto extenso de un 30-40%, que supondría un peso a regenerar demasiado importante. Aún así, ya existen algunos resultados positivos en algunos pacientes en los que se ha ensayado el tratamiento. Las células con potencial regenerador tienen grandes poblaciones en la aurícula izquierda y ápex. Se han hecho ensayos obteniendo células madre de medula ósea, de células mesenquimales y de tejido adiposo, e inyectándolas en la arteria cerrada para que lleguen al miocardio afectado. No obstante, los resultados no son muy satisfactorios, ya que al cabo de 24 horas el 90% de las células introducidas han muerto. Valdés y compañía han probado 60 trasplantes de células madre en el HUVA, todavía sin arrojar resultados demasiado optimistas. Tratamiento: evaluación antes del alta Diferenciaremos el manejo de un paciente antes de darle el alta según haya recibido un tratamiento con angioplastia primaria o no: 1. Pacientes tratados con ACTP 1ª: En el primer cateterismo se debió valorar la fracción de eyección y las coronarias. Por tanto, a estos pacientes sólo se les hacen pruebas no invasivas: una ecocardiografia y una valoración funcional de otras lesiones si las hubiera. 2. Pacientes no tratados con ACTP 1ª: Valoración no invasiva: o Estado de la función ventricular (FE, viabilidad) con ecocardiografía. Si la FE resulta baja, habrá que hacer un cateterismo. A.A., C.C., M.J.S. M. Valdés 11
172 TEMA Car-4 (B) CARDIOLOGÍA CMG o o La viabilidad hace referencia a las zonas de músculo cardiaco, dependientes de la arteria obstruida, que siguen vivas y recobrarán su función si se las reperfunde (miocardio hibernado). VaIoración de isquemia espontánea o inducida. Valoración de inestabilidad eléctrica. Valoración invasiva: El cateterismo con coronariografía debería hacérsele a todos 20. embolia pulmonar, tiene un trombo mural objetivado con la ecocardiografía Antagonistas del calcio Antiarrítmicos Hormonal 3. POSTHOSPITALARIO Recordemos que estamos en el tratamiento del IAM, que ya hemos visto el modo de actuación en la fase prehospitalaria, que también hemos visto el modus operandi en el mismo hospital, y que ahora nos disponemos a ver cómo se va a su casa el paciente cuando se le da el alta hospitalaria. Prevención terciaria del IAM Aunque el paciente haya recibido un tratamiento por ACTP, debe seguir con un control exhaustivo de los factores de riesgo. 2.- El paciente continuará en casa con un tratamiento farmacológico como el siguiente: Antiagregantes: AAS y clopidogrel principalmente. IECAs: En insuficiencia cardiaca clínica, o en pacientes con fracción de eyección (FE) disminuida o anormalidad en movilidad regional extensa. β-bloqueantes: Indispensables en todos los pacientes, salvo contraindicaciones. Nitratos Anticoagulantes: Si paciente presenta trombosis venosa profunda, ha sufrido 20 Aunque en la práctica, cuando llevan mucho tiempo de evolución no se les hace. 21 En realidad en las diapositivas aparece este apartado como prevención secundaria. Al parecer, por suerte o por desgracia, tenemos más conocimientos sobre terminología de la medicina preventiva que Valdés. A.A., C.C., M.J.S. M. Valdés 12
173 TEMA Car-4 (ECG) CARDIOLOGÍA CMG ZONA ECG Fig. 1: Infarto anterior: Como podemos observar, hay ondas Q prominentes en casi todas las precordiales (sobre todo de V1 a V4). En este caso no existe onda Q en I y avl, ya que el infarto no ha llegado a la zona más lateral. La fase del IAM es tardía (está en fase subaguda, lleva de 6 a 12 horas de evolución), ya que la onda Q es muy prominente y existe una elevación del ST muy ligera. En este momento, la reperfusión (aunque está indicada y se realizaría hasta las 12 h de evolución) sería ya de poca utilidad. Fig. 2 y 3: Infarto anterolateral e infarto inferior: En el caso del ECG inferior izquierdo estamos ante un infarto anterolateral en fase subaguda o aguda avanzada. Se visualizan las características ondas Q patológicas en V1, V2, V3, V4 y V5 y en avr y ondas T negativas en avl, I y V5 y V6. En el ECG inferior derecho estamos ante un infarto inferior. En este caso podemos ver ondas Q patológicas claras en II, III y avf, lo que es diagnóstico del infarto inferior. A.A., C.C., M.J.S. M. Valdés 1
174 TEMA Car-4 (ECG) CARDIOLOGÍA CMG Fig. 4: Infarto posterior. El infarto posterior es el más atípico, ya que no se manifiesta con onda Q debido a su situación topológica. En este ejemplo podemos ver ondas R de gran amplitud (por ausencia del vector en sentido contrario) en las precordiales (especialmente nos tenemos que fijar en la positividad en V1) y onda T negativa en avl y V6, con lo que el IAM podría ser posterolateral. La positividad de R en V1 no es diagnóstica por sí misma de infarto posterior, pero sí lo es si va acompañada de dolor precordial. Fig. 5: En este caso tenemos dos ECG del mismo IAM. El superior es en fase hiperaguda y el segundo en fase aguda avanzada o subaguda. En el primer ECG vemos únicamente ondas T picudas en V2, V3 y algo menos en V4, lo que se correspondería con un IAM anteroseptal de poco tiempo de evolución. En este momento, el paciente se beneficiaría mucho de una reperfusión, sin embargo, la onda T picuda no es lo suficientemente específica y se espera a la elevación del ST para hacer una intervención por ACTP. A.A., C.C., M.J.S. M. Valdés 2
175 TEMA Car-4 (ECG) CARDIOLOGÍA CMG En el segundo ECG se muestra el mismo IAM pero en fase subaguda o aguda evolucionada. Este caso data de una época en la que no se hacían reperfusiones, con lo que el IAM ha evolucionado de manera implacable. Así, podemos observar onda Q prominente y onda T negativa en V1, V2, V3 y V4, así como pérdida de voltaje en la onda R, lo que certifica el diagnóstico de IAM anteroseptal. Fig. 6: En este ECG vemos elevaciones y descensos del ST en múltiples derivaciones. Las elevaciones del segmento se ven en las derivaciones II, III, avf, V5 y V6, lo que es diagnóstico de IAM inferolateral. Los descensos del ST en las derivaciones especulares (como V2 en este caso) son signo de mal pronóstico. A.A., C.C., M.J.S. M. Valdés 3
176 TEMA Car-4 (ECG) CARDIOLOGÍA CMG Fig. 7: Los dos ECGs siguientes corresponden a un paciente varón de 62 años con dolor torácico de 90 minutos de evolución. Llega a urgencias a las 4:20, el ECG de la izquierda es a las 4:30 y el de la derecha es a las 9:30. En el primero vemos elevación del ST y T picuda en V2, V3 y V4 (infarto anterior en fase aguda) y en el de la derecha vemos como las ondas T se han negativizado, lo que indica que estamos ante una fase más evolucionada y hay mayor grado de necrosis. Fig. 8: ECG de un paciente varón de 63 años fumador que llega a urgencias con dolor torácico de 3 horas de evolución. Diagnóstico de infarto anterior en fase aguda, por elevación del ST y ondas T picudas en V2, V3, V4 y V5. A.A., C.C., M.J.S. M. Valdés 4
177 TEMA Car-4 (ECG) CARDIOLOGÍA CMG Fig. 9: ECG de paciente de 73 años con dolor torácico de 2 horas de evolución. Este es el tiempo que suelen tardar los pacientes en llegar al hospital. Vemos elevación del ST en II, III y avf, por lo que estamos ante un infarto inferior en fase aguda. Fig. 10: ECG de una paciente de 65 años que llega a urgencias con un dolor torácico de 50 minutos y ha sufrido un síncope. Podemos ver elevación del ST clara en II, III y avf, y algo en V6 infarto inferior. Además se ven descensos del ST especulares (mal pronóstico). El síncope puede ser provocado por una isquemia del nodo AV (ocurre en ocasiones en los infartos inferiores), que generaría un bloqueo AV de primer grado (las ondas p, muy alejadas del QRS por el bloqueo están señaladas por flecha). Fig. 11: ECG de paciente varón de 66 años con dolor torácico de 10h de evolución. Vemos ligera elevación del ST y onda Q pronunciada en precordiales V1, V2 y V3. Menos pronunciada en V4. Es un infarto anterior en una fase muy evolucionada. A.A., C.C., M.J.S. M. Valdés 5
178 TEMA Car-4 (ECG) CARDIOLOGÍA CMG Fig. 12: ECG perteneciente a un paciente varón de 57 años con dolor torácico de 5 horas de evolución. Más de lo mismo, vemos elevación del ST y onda T picuda en precordiales desde V2 a V4 Infarto anterior en fase aguda. Fig. 13: ECG de un paciente varón que llega a urgencias con un dolor de 7h de evolución. Como vemos, a pesar de que el segmento ST aún continúa elevado, las ondas Q ya prominentes en V1- V3 (infarto anterior o anteroseptal) y el tiempo de evolución mayor a 6h, indican que el grado de necrosis muy alto, con lo que la reperfusión, aunque se realizaría, arreglaría poco. A.A., C.C., M.J.S. M. Valdés 6
179 TEMA Car-4 (ECG) CARDIOLOGÍA CMG Fig. 14: Estamos ante el ECG de un paciente varón de 71 años que llega a urgencias con dolor torácico de tan sólo 1 hora. El paciente ha entrado en shock cardiogénico, Por qué? La presencia de elevaciones del ST tanto en precordiales, como en II, III y avf, nos hace pensar en IAM anterior e inferior concomitantes, que pueden ser debidos a que exista una oclusión del tronco común de la coronaria izquierda, que corte el flujo tanto en la descendente anterior como en la circunfleja (existen otras posibilidades, como la oclusión de una coronaria derecha dominante que provoque necrosis extensa inferior y del VD, aunque la presencia de elevación del ST en precordiales derechas va más a favor de una oclusión del tronco común izquierdo). Estos pacientes suelen tener un nefasto pronóstico, como podemos ver en este caso, con un shock cardiogénico al poco tiempo de evolución del IAM. Fig. 15: Estamos ante el ECG de una paciente de 61 años que sufrió un dolor torácico 24 horas antes y que, por supuesto, no ha sido reperfundida. Como vemos, el infarto es anterior y existen ondas Q prominentes establecidas por la larga evolución del IAM. La onda Q quedará permanente y el segmento ST se irá normalizando con el tiempo. A.A., C.C., M.J.S. M. Valdés 7
180
181 TEMA CON 1 CARDIOLOGÍA CMG CARDIOPATÍAS CON- GÉNITAS DEL ADULTO Aviso para navegantes! Como muy poca gente asistió a esta clase os voy a dar un pequeño consejo porque el tema es un poco largo (en parte porque hemos puesto algunas imágenes para intentar amenizar un poco el tema) y seguramente cuando lleguéis a este punto de la comisión no tengáis muchas fuerzas. Leeros el tema tranquilamente y memorizad las características fundamentales (lo que aparece en los esquemas y resúmenes) haciendo especial hincapié en la comunicación interauricular (CIA), la persistencia del conducto arterioso (PCA) y la coartación aórtica (CoAo). Al final de estos tres defectos se adjunta una tabla resumen. Los consejos prácticos también son importantes, pero como veréis son muy simples. Dr. Why. INTRODUCCIÓN Las cardiopatías congénitas (CC) son aquellas alteraciones estructurales del corazón y de los grandes vasos presentes en el momento del nacimiento. Entre el 8 y 10 por mil de los nacidos vivos presentan algún tipo de cardiopatía congénita. Muchos de estos pacientes mueren en los primeros años de vida, o bien la CC se diagnostica y cura en el recién nacido. No obstante, algunas de estas enfermedades son compatibles con la vida al producir mínimas repercusiones sobre el individuo, e incluso otras son totalmente asintomáticas y se diagnostican casualmente en la juventud o edad adulta. En este tema estudiaremos justamente ese tipo de cardiopatías; aquellas que por sus características todavía podemos encontrar en el adulto. Esquema CON1-1 Consejos prácticos para los pacientes con cardiopatías congénitas. (The Lancet Ltd 1998). Cuando a un paciente se le diagnóstica una CC, lo normal es que desconozca totalmente las repercusiones que tal patología va a tener sobre su vida. Ese tipo de información que el paciente desea conocer fue publicado en el artículo The Lancet Ltd (1998) y cuyos principales argumentos resumimos a continuación en tres apartados: a) Consejos prácticos para el paciente; b) Tasas de recurrencia en la descendencia; y c) Tolerancia. A. CONSEJOS PRÁCTICOS PARA EL PACIENTE: Actividad sexual: el paciente puede tener una vida sexual completamente normal salvo que la patología que padezca se asocie J. A., P. F., M.C. Ruipérez 1
182 TEMA CON 1 CARDIOLOGÍA CMG a insuficiencia cardiaca con disnea de mínimos esfuerzos. B. TASAS DE RECURRENCIA EN LA DESCEN- DENCIA Anticoncepción: la mayor parte de las CC llevan asociadas un incremento del riesgo de padecer fenómenos tromboémbolicos. Es por ello que estos pacientes no deben utilizar anticonceptivos orales como método para evitar el embarazo. Gestación y asesoramiento genético: la gestación normalmente se suele llevar bien (en el último punto se expondrá más a fondo). Es importante realizar un buen asesoramiento genético para que los padres conozcan el riesgo que existe de que sus hijos hereden la CC del padre o madre. Debemos conceder a los padres la suficiente información como para que su decisión se tome desde el absoluto conocimiento. Esquema CON1-3 Podemos deducir de los datos anteriores que el riesgo de heredar una CC es mayor en caso de que la madre sea la afectada. C. TOLERANCIA Las mujeres gestantes pueden presentar problemas si la CC que padecen es un cortocircuito derecha izquierda. Tal hecho se debe a que con este tipo de cortocircuito parte de la sangre no oxigenada pasa directamente a la circulación sistémica y, por tanto, disminuye la presión parcial de oxígeno en la sangre arterial. Decimos que la tolerancia es mala en la gestación porque, en este periodo, se produce un aumento de los requerimientos energéticos y, por tanto, de oxígeno. Además, ello se ve agravado por el hecho de que en el embarazo suele aumentar la presión en la arteria pulmonar lo que exacerba el flujo sanguíneo a través del cortocircuito. Si la madre padeciese un cortocircuito izquierda-derecha la tolerancia sería buena. Los pacientes con cardiopatías de tipo regurgitante (por ejemplo, insuficiencias valvulares) suelen presentar una buena tolerancia pero no ocurre así en las de tipo estenosis y, sobre todo, en aquellas que se presentan asociadas con hipertensión arterial pulmonar. Esquema CON1-2 J. A., P. F., M.C. Ruipérez 2
183 TEMA CON 1 CARDIOLOGÍA CMG Esquema CON1 4 CLASIFICACIÓN En este tema estudiaremos las principales cardiopatías congénitas en el adulto. 1. Comunicación interauricular (CIA). 2. Comunicación interventricular (CIV). 3. Persistencia del conducto arterioso (PCA). 4. Coartación aórtica (CoAo). 5. Tetralogía de Fallot (4F). 6. Transposición de grandes vasos (TGV). J. A., P. F., M.C. Ruipérez 3
184 TEMA CON 1 CARDIOLOGÍA CMG 1 Comunicación Interauricular (CIA) CONCEPTO, CARACTERÍSTICAS quecas intensas. Sin embargo, recientemente esta alteración está tomando importancia por la posibilidad de constituir una vía para embolias paradójicas. Así pues, aunque la actitud terapéutica normal sea la vigilancia, si se tratase de un paciente que ha sufrido un ACV se recomendaría practicar un Amplatzer 3, mientras que si hubiese sufrido una embolia parcial, la recomendación sería la de antiagregar con AAS 4. La CIA consiste en un defecto en el tabique interauricular que permite el paso de sangre desde una zona de alta presión (aurícula izquierda) a una zona de baja presión (aurícula derecha); se trata pues de un shunt o cortocircuito izquierda-derecha 1. Esquema CON Ostium secundum: el defecto asienta en la zona de la fosa oval y representa el 75% de todos los defectos septales auriculares 5. Esquema CON1-5 La CIA es, junto con la CIV, la forma de CC más frecuentemente detectada en el adulto. Se da en mujeres 2 con una frecuencia dos o tres veces mayor que en hombres. 3. Ostium primum: se localiza en la parte baja del tabique, en la zona de inserción de las válvulas auriculoventriculares, y representa el 15% de los defectos septales auriculares. CLASIFICACIÓN Existen tres tipos anatómicos principales de CIA: 1. Agujero oval permeable: realmente se trata de una variante de la normalidad; el agujero oval permeable aparece en un 25% de los corazones sanos. Su repercusión es mínima y suelen cursar de forma totalmente asintomática; a veces, pueden producir ja- 1 Leer el anexo al final del tema ( Síndrome de Eisenmenger ) 2 Por eso lo de Ariel (Sé que hay en clase hay verdader@s fans de Disney) Esquema CON1-7 3 Se explicará en el tratamiento. 4 Antes se recomendaba anticoagular. 5 Claramente estamos considerando que el agujero oval permeable no es un defecto septal auricular, sino una variante de la normalidad. J. A., P. F., M.C. Ruipérez 4
185 TEMA CON 1 CARDIOLOGÍA CMG Otras localizaciones menos frecuentes: se describe un tipo de CIA en el que las venas pulmonares desembocan en la aurícula derecha o en las grandes venas de la misma (venas cavas, superior o inferior, seno venoso o seno coronario). Esta anomalía se denomina Drenaje Anómalo de las Venas Pulmonares o DAVP. A. Consecuencias sobre la estructura cardiaca: la sobrecarga de volumen en aurícula derecha y ventrículo derecho determina su dilatación. B. Consecuencias sobre los vasos pulmonares: la sobrecarga de volumen del ventrículo derecho hace que el volumen de eyección del mismo se encuentre aumentado. Este hiperaflujo pulmonar, además de producir un soplo eyectivo sistólico debido a la estenosis relativa de la válvula pulmonar, produce con el tiempo un aumento de las resistencias pulmonares e hipertensión pulmonar. En el 10% de los casos de pacientes con CIA se establece una HTP crónica, grave e irreversible. C. Consecuencias sobre el cortocircuito: con el paso del tiempo puede producirse la dilatación del orificio lo que explicaría la evolución del cuadro. CLÍNICA Esquema CON1-8 AMPLIACIÓN DE CONTENIDO DE INTERÉS. Cualquiera de las formas anatómicas de CIA puede asociarse a otros tipos de cardiopatía. Así, la CIA tipo ostium secundum puede asociarse a prolapso de válvula mitral, la CIA tipo ostium primum a insuficiencia mitral FISIOPATOLOGÍA FIN DEL CONTENIDO AMPLIADO Las consecuencias fisiopatológicas de la CIA son el resultado del shunt de una aurícula a otra. Lógicamente, el tamaño y otras características como la distensibilidad de las cámaras cardiacas determinaran la magnitud del shunt y, por extensión, de las consecuencias hemodinámicas. Esquemáticamente, podemos dividir las consecuencias en función de la estructura afectada, así tendremos: ANAMNESIS Y EXPLORACIÓN FÍSICA La CIA suele ser asintomática y en caso de presentar síntomas estos suelen ser anodinos. Cuando el cuadro empeora por su propia evolución podemos encontrar síntomas como intolerancia al esfuerzo (disnea) o palpitaciones (la dilatación auricular predispone a la ACxFA). Como ya hemos comentado, la embolia paradójica es posible y, en casos muy severos, podemos encontrar signos de insuficiencia ventricular derecha, pero nunca debemos permitir llegar a tal situación, pues existe un tratamiento adecuado. La inspección es importante debido a que este cuadro es típico de enfermedades genéticas fenotípicamente reconocibles. En el 90% de los casos de Síndrome de Down (trisomía 21) existen defectos de los cojines auriculoventriculares y del ostium primum que predisponen a la aparición de CIA. También se halla con relativa frecuencia en el Síndrome de Holt- J. A., P. F., M.C. Ruipérez 5
186 TEMA CON 1 CARDIOLOGÍA CMG Oram 6 cuya característica fenotípica más llamativa es la agenesia del dedo pulgar derecho. En la auscultación, en las fases de patología en las que no encontramos HTP, como ya hemos comentado, encontraremos un soplo sistólico eyectivo por la estenosis relativa de la válvula pulmonar y un retraso en el componente pulmonar del segundo ruido (S2 (P)) por prolongación del vaciado del ventrículo derecho al aumentar su volumen de llenado. El mecanismo de este desdoblamiento es el mismo que para el desdoblamiento fisiológico, a diferencia de que este retraso patológico es constante en su presentación (aparece siempre) y duración (siempre dura lo mismo y su duración no se modifica por la respiración; es fijo ). En caso de asociarse a HTP, la intensidad y duración del soplo diminuye (disminuye el gradiente). El desdoblamiento es más pequeño (ambos componentes, aórtico y pulmonar, son más próximos) pero sigue existiendo; además, el componente pulmonar está reforzado (S2 (P)). EXPLORACIONES COMPLEMENTARIAS Electrocardiograma: el dato más característico es la presencia de un bloqueo incompleto de rama derecha (BIRD), que es expresión de la sobrecarga sistólica del ventrículo derecho. Pueden también existir crecimientos auriculares con o sin ACxFA, bloqueos auriculoventriculares y ondas P negativas (derivaciones II, III y avf) en la CIA de tipo venoso cava superior. Además, el electrocardiograma nos permite diferenciar la CIA por ostium primum del resto. En el ostium primum encontramos una desviación del eje (QRS) a la izquierda, mientras que en el resto la desviación es a la derecha 7. Este dato es importante ya 6 El síndrome de Holt-Oram (heart-hand syndrome) es un trastorno de herencia autosómica dominante con alta penetrancia que presenta una gran variabilidad de expresión fenotípica, tanto intraindividual como intrafamiliar. Clínicamente asocia anomalías esqueléticas en la extremidad superior con anomalías cardiovasculares. Tiene una incidencia estimada de 1/ nacidos vivos. 7 El eje se desvía hacia la derecha porque el VD se hipertrofia; he buscado en la bibliografía el por qué de que el eje se desvía a la izquierda en el ostium primum pero no he encontrado nada, si decir que casi todos los libros y webs consultadas coincidían con ello. que nos va a determinar la actitud terapéutica. Radiología de tórax: encontraremos cardiomegalia por crecimiento de cavidades derechas (CAD Y CVD) y dilatación de la arteria pulmonar y campos pulmonares hipervascularizados por hiperaflujo pulmonar. Ecocardiograma: la ecocardiografía puede revelar las dilataciones en las cámaras y poner de manifiesto el defecto septal, identificando incluso el tipo. La mejor visualización la obtendremos con el ecocardiograma transesófagico. La modalidad Doppler permite medir el flujo a través del cortocircuito ( chorro turbulento en mosaico ). También se puede valorar el grado de HTP, determinar el tipo de actitud terapéutica (percutánea o quirúrgica) en función del estado del tabique y buscar embolias. TRATAMIENTO El optar al tratamiento quirúrgico depende de las repercusiones hemodinámicas del cuadro. Se ha consensuado que el tratamiento quirúrgico se realice a todo paciente con un cociente QP/QS mayor de 1,5; en otras palabras, operaremos a los pacientes cuyo flujo pulmonar (QP) sea un 50% superior al sistémico 8 (QS). Estos pacientes, en caso de no operarse, presentan las siguiente complicaciones: a) A los 40 años suelen padecer insuficiencia cardiaca congestiva ventricular (ICC) b) A los 40 años el 13% padece arritmias auriculares; a los 60 años el porcentaje aumenta hasta el 52% c) El 10% desarrollaran HTP pasados 20 años. En la actualidad se están utilizando sistemas de cierre con dispositivos Amplatzer in- 8 Se considera como flujo sistémico al flujo aórtico. J. A., P. F., M.C. Ruipérez 6
187 TEMA CON 1 CARDIOLOGÍA CMG troducidos por cateterismo percutáneo (vía femoral) bajo control ecocardiográfico. Por las características del defecto, el ostium primum no puede ser reparado mediante esta técnica porque no tenemos un tabique inferior donde apoyar el Amplatzer (podéis comprobarlo en el dibujo correspondiente que vimos para este defecto). PRONÓSTICO Los pacientes no operados con un QP/QS inferior a 1,5 siguen manteniendo un pronóstico excelente. En los pacientes operados, la edad al operarse y la presión sistólica de la arteria pulmonar fueron predictores significativos de la supervivencia a largo plazo. Lógicamente, a mayor edad y mayor grado de HTP los resultados son peores. Esquema CON1 9 J. A., P. F., M.C. Ruipérez 7
188 TEMA CON 1 CARDIOLOGÍA CMG J. A., P. F., M.C. Ruipérez 8
189 TEMA CON 1 CARDIOLOGÍA CMG 2 Comunicación Interventricular (CIV) 9 CONCEPTO, CARACTERÍSTICAS La CIV consiste en un defecto en el tabique interventricular que permite el paso de sangre desde una zona de alta presión (ventrículo izquierdo) a una zona de baja presión (ventrículo derecho); se trata pues de un shunt o cortocircuito izquierdaderecha 10. muscular tipo Roger o enfermedad de Roger). La CIV de la enfermedad de Roger suele ser de pequeño diámetro (menos de 1 cm) y, con el crecimiento, puede cerrarse espontáneamente antes de los 3 años en un 30 a 40% de los casos. Es excepcional el cierre posterior a esta edad. Clínicamente lo más característico de esta patología es la auscultación de un soplo holosistólico. Este soplo es más llamativo cuanto menor es el diámetro de la CIV 11 ; por ello, en la enfermedad de Roger encontramos un soplo intenso. Al igual que en la CIA, cuando el cociente QP/QS es superior a 1,5 se someten a cierre quirúrgico. Supone el 20% de las CC aisladas (como ya dijimos, es, junto a la CIA, la CC más frecuente en adultos). Al igual que la CIA, es más frecuente en mujeres. En el 95% de los casos la etiología es multifactorial, existiendo una interacción entre predisposición hereditaria y factores ambientales. Todos estos porcentajes se refieren a las CIV congénitas dado que las CIV más frecuentes son las secundarias a infartos (CIV postinfarto). TIPOS Esquema CON1-10 Los defectos del tabique interventricular se localizan principalmente en dos puntos: 1. En el 80% de los casos, en la parte alta del septo, en la zona correspondiente al tabique membranoso (CIV tipo membranoso) 2. Del 5 al 20% de los casos, en la parte baja del septo, en la porción muscular (CIV 9 El Dr. Ruipérez dijo que no explicaría esta enfermedad porque consideró que se nos explicaría como complicación del infarto de miocardio (CIV postinfarto). Sólo se limito a comentar algunas características que he resumido en el primer apartado. Como me entregó las diapositivas he añadido el resto como contenido ampliado. 10 Leer el anexo al final del tema ( Síndrome de Eisenmenger ) AMPLIACIÓN DE CONTENIDO DE INTERÉS. FISIOPATOLOGÍA Las consecuencias de la CIV vienen determinadas por el tamaño del defecto y las resistencias relativas de los lechos vasculares sistémico y pulmonar. Si el defecto es pequeño, la alteración funcional es escasa, ya que el flujo pulmonar se incrementará sólo mínimamente. Por el contrario, si el defecto es grande, el shunt izquierda-derecha será grande, y el flujo pulmonar estará incrementado. Según esto, las CIV se clasifican en tres tipos: 11 Cuanto menor es el diámetro, la sangre pasa más rápida. J. A., P. F., M.C. Ruipérez 9
190 TEMA CON 1 CARDIOLOGÍA CMG a) CIV pequeña: el diámetro es inferior a 1 cm b) CIV moderada: el diámetro se encuentra entre 1 y 1,5 cm c) CIV grande: el diámetro se encuentra entre 1,5 y 3 cm. Inicialmente, las resistencias pulmonares son bajas y el retorno sanguíneo a la parte izquierda del corazón provocará una sobrecarga de volumen de la aurícula y ventrículo izquierdo. En esta fase, puede aparecer un fallo ventricular izquierdo debido a la sobrecarga. Con el incremento de las resistencias pulmonares, se va a producir hipertensión pulmonar, sobrecarga sistólica del ventrículo derecho y disminución del shunt izquierda-derecha. Cuando la presión ventricular supera a la izquierda, el shunt se invierte, y se desarrolla el síndrome de Eisenmenger. Clínica: anamnesis y exploración física. La clínica va a depender fundamentalmente del tamaño del defecto, del cociente QP/QS y de la aparición de HTP. a) Electrocardiograma: puede ser normal inicialmente. Posteriormente, los cambios evolutivos reflejan la evolución del proceso y pueden mostrar crecimiento ventricular izquierdo, crecimiento biventricular e hipertrofia ventricular derecha. b) Radiología de tórax: también refleja la evolución del proceso. Inicialmente podemos encontrar signos de hiperaflujo pulmonar (hipervascularización pulmonar) y posteriormente de HTP (dilatación del arco pulmonar). c) Ecocardiograma: con el Doppler podemos detectar y estimar el shunt. Tratamiento El tratamiento es quirúrgico cuando el cociente QP/QS es superior a 1,5 y cuando las resistencias arteriales pulmonares (RAP) son inferiores a 7 unidades Wood. Cuando RAP no cumplen este criterio los pacientes presentan una elevada mortalidad quirúrgica por lo que su única opción es el tratamiento médico, el trasplante corazón-pulmón o el trasplante de pulmón con cierre del CIV. FIN DEL CONTENIDO AMPLIADO Los pacientes con defectos septales pequeños son frecuentemente asintomáticos y, en estos casos, es poco probable que se dé un incremento substancial de las resistencias pulmonares; además, en un alto porcentaje (75-80%) cierran espontáneamente. Contrariamente, en casos con defectos septales amplios, es posible la aparición temprana de insuficiencia ventricular izquierda y, si no se operan, la evolución es a la aparición de HTP y síndrome de Eisenmenger. Las CIV grandes tienen una supervivencia a 25 años inferior al 50%. Todas las CIV incrementan el riesgo de endocarditis bacteriana. En la exploración física, el dato más característico es el, ya comentado, soplo holosistólico. Este soplo tiene su máxima intensidad en la parte baja del borde izquierdo del esternón, donde también puede palparse como thrill. Con el incremento de las presiones del lado derecho, el shunt izquierdaderecha reduce su intensidad. Con la hipertensión pulmonar puede aparecer un soplo diastólico de insuficiencia pulmonar (Soplo de Graham Stell) 12. Con respecto a la inspección, determinadas etiologías de CIV pueden presentar alteraciones musculoesqueléticas asociadas, por lo que la deformidad torácica debe ser un dato a tener en cuenta. Exploraciones complementarias 12 Recordad que la principal etiología de la insuficiencia pulmonar es la dilatación del anillo secundaria a dilatación de la arteria pulmonar por HTP. J. A., P. F., M.C. Ruipérez 10
191 TEMA CON 1 CARDIOLOGÍA CMG 3 Persistencia del Conducto Arterioso (PCA) CONCEPTO, CARACTERÍSTICAS El conducto arterioso (ductus arterioso) es una estructura vascular presente durante la vida fetal que comunica la aorta con la arteria pulmonar. Este conducto se cierra antes o inmediatamente después del nacimiento 13, pero en algunos casos persiste abierto, lo que da lugar a la CC denominada persistencia del conducto arterioso o PCA. La persistencia del conducto arterioso constituye el 10% de las CC del adulto, es 2 o 3 veces, más frecuente en mujeres 14 que en hombres y se relaciona con partos prematuros 15, progenie de mujeres que sufrieron rubeola en el primer trimestre del embarazo 16 y nacimientos a gran altura, pues bien es sabido por todos que a mayor altitud, menor presión parcial de oxígeno. Por ello, la incidencia de PCA es muy alta en países con una elevada altitud media, como Perú o Méjico. Esquema CON1-11 En el 15% de los casos, la PCA se asocia a otras cardiopatías congénitas como coartación aórtica, CIV, estenosis pulmonar y estenosis aórtica, a veces actuando como agravante, complicando más aún otra cardiopatía y, otras veces, permitiendo la supervivencia del paciente 17. Los pacientes con PCA tienen riesgo aumentado de sufrir endocarditis bacteriana; además, algunos ductus pueden ser aneurismáticos o calcificarse, existiendo en estos casos peligro de ruptura. Por la propia evolución del proceso es muy frecuente que estos pacientes desarrollen insuficiencia cardiaca congestiva ventricular (ICCV) a partir de la tercera década de su vida. FISIOPATOLOGÍA 18 Ya que la presión sistólica y diastólica en aorta es superior a la presión pulmonar, habrá un flujo continuo aorta-arteria pulmonar a través del ductus. Este flujo da lugar a un soplo continuo (sistólico-diastólico) que ha sido denominado soplo en maquinaria de vapor o soplo de Gibson. El shunt aorta-arteria pulmonar da lugar a hiperaflujo pulmonar que, al retornar al lado izquierdo del corazón, provoca sobrecarga de volumen y dilatación del ventrículo izquierdo. Si el ductus es amplio, el incremento de la circulación pulmonar puede estimular el incremento de las resistencias vasculares pulmonares con la producción de HTP, sobrecarga de presión del ventrículo derecho e hipertrofia del mismo. Si llega a desarrollarse síndrome de Eisenmenger, la sangre venosa de la arteria pulmonar pasará a la aorta. En este caso, dada la localización del ductus distal a la salida de la arteria subclavia izquierda, la cianosis aparecerá únicamente en miembros inferiores. Este signo es la llamada cianosis diferencial. 13 El mecanismo de cierre es complejo, pero el estímulo inicial suele ser la elevación de la presión parcial de oxígeno que sucede cuando el niño comienza a respirar. 14 Esta vez Mafalda (Porque también sé que hay fans suyos en la clase) 15 Como vimos en Pediatría. 16 Como también vimos en Pediatría. 17 En la comisión de Cardiología del año pasado aparecía el siguiente mensaje al lado de este párrafo: siempre lo pregunta en el examen. Ahí queda eso. 18 Este apartado no se dio en clase, pero he preferido no ponerlo como contenido ampliado porque es muy sencillo y al mismo tiempo aclaratorio. Leedlo exclusivamente! J. A., P. F., M.C. Ruipérez 11
192 TEMA CON 1 CARDIOLOGÍA CMG CLÍNICA ANAMNESIS Y EXPLORACIÓN FÍSICA Como en otras CC, el curso clínico de la persistencia del ductus arterioso dependerá del tamaño del mismo. Los ductus pequeños pueden ser asintomáticos durante 20 o 30 años. Sin embargo, incluso en estos casos, el riesgo de endocarditis infecciosa es elevado. Los ductus grandes con mucho flujo pueden producir insuficiencia cardiaca ventricular izquierda temprana con mortalidad precoz. En la exploración física, los ductus amplios dan lugar a cuadros hipercinéticos con pulsos amplios y saltones. El soplo continuo de maquinaria de vapor o soplo de Gibson se ausculta característicamente en el segundo espacio intercostal izquierdo (foco pulmonar). Es un soplo crecento-decrecento con su máximo coincidiendo con el segundo ruido. Si se desarrolla HTP, en función de que sea predominantemente diastólica o sistólica, desaparecerá la parte diastólica o sistólica del soplo, respectivamente. Por ejemplo, si se desarrolla HTP diastólica, la presión diastólica de la arteria pulmonar superará la de la aorta y la sangre sólo circulará en sístole (soplo sistólico) y viceversa. Lógicamente, en casos de HTP severa el soplo puede desaparecer completamente. veces, de crecimiento de aurícula izquierda (CAI). Si se asocia a HTP encontraremos también signos de hipertrofia ventricular derecha (HVD) que predominaran sobre la izquierda. Radiología: muestra cardiomegalia a expensas de crecimiento auricular y ventricular izquierdo. La aorta y la arteria pulmonar suelen aparecer dilatadas y se observan signos de hiperaflujo pulmonar (hipervascularización en campos pulmonares). Ecocardiograma: el estudio eco-doppler es definitivo en la mayoría de los casos pues permite detectar el ductus y comprobar el flujo a su través. Cateterismo: no suele utilizarse salvo sospecha de otras lesiones TRATAMIENTO Dado el riesgo de endocarditis, la mayoría de los PCA, por pequeños que sean, deberían ser tratados por cirugía (ligadura del conducto, generalmente, sin necesidad de bypass cardiopulmonar) u oclusión con sistemas introducidos por cateterismo (cierre por cateterismo percutáneo con espiral de Gianturco). La eficacia de este último tratamiento es del 80% y, por ello, suele preferirse la cirugía 19. Esquema CON1-12 EXPLORACIONES COMPLEMENTARIAS Electrocardiograma: mostrará signos de hipertrofia ventricular izquierda (HVI) y, a Esquema CON Como se dice en México según el Dr. Ruipérez: PCA diagnosticada, PCA operada. J. A., P. F., M.C. Ruipérez 12
193 TEMA CON 1 CARDIOLOGÍA CMG J. A., P. F., M.C. Ruipérez 13
194 TEMA CON 1 CARDIOLOGÍA CMG 4 Coartación Aórtica (CoAo) 20 CONCEPTO, CARACTERÍSTICAS Se denomina coartación aórtica al estrechamiento congénito de la aorta. Dicho estrechamiento se considera significativamente importante si el gradiente a ambos lados de la estenosis es superior a 20 mmhg. Esta alteración representa del 6 a 8% de todas las CC del adulto. Es más frecuente en varones 21 (relación 3 a 1 con la mujer). La localización más frecuente del estrechamiento es en el cayado, después de la salida de la arteria subclavia izquierda 22. La CoAo suele presentarse con otras anomalías asociadas que son importantes conocer. La CoAo presenta un alto grado de coexistencia con el síndrome de Turner o con la disgenesia gonadal; se asocia también con CIV, aorta bicúspide (en un 40 a 85% de los casos) y con aneurisma sacular del polígono de Willis (en un 3 a 5% de los casos). Como veremos, una de las consecuencias fisiológicas de la CoAo es la HTA en el lecho cerebral que, junto al aneurisma sacular, predisponen al grave cuadro de hemorragia cerebral. AMPLIACIÓN DE CONTENIDO DE INTERÉS. FISIOPATOLOGÍA 23 La existencia de la coartación da lugar a una diferencia de presión arterial a ambos lados del estrechamiento. Así, en el tipo más común, se produce hipertensión en los miembros superiores y la circulación cerebral, mientras que existe hipotensión en la parte inferior del cuerpo que afecta a los miembros inferiores, así como a la circulación renal y mesentérica. La dificultad de paso de flujo a través de la coartación y el alto régimen tensional en la mitad del cuerpo dan lugar a la aparición de circulación colateral que deriva sangre de una a otra parte de la obstrucción. Esta circulación colateral se establece fundamentalmente a través de las arterias mamarias e intercostales y es la responsable de la aparición de las muescas costales (defectos en sacabocados en la parte inferior de las costillas que corresponden a la zona de paso de las arterias intercostales dilatadas). La propia coartación da origen a un soplo sistólico que se ausculta mejor en la espalda, entre la escapula izquierda y la columna. Entenderemos que se va a producir un cuadro de hipertensión arterial preestenótica, así como en la mitad superior del cuerpo. El ventrículo izquierdo experimentará una sobrecarga de presión con hipertrofia del mismo. FIN DEL CONTENIDO AMPLIADO Esquema CON El Dr. Ruipérez destacó la importancia de esta cardiopatía congénita; esto huele a examen, no? 21 Esta vez lo de Johnny Bravo es por otra razón que más adelante conoceréis. 22 Recordad esto pues de ello dependerá uno de los signos clínicos más importantes de esta patología. Esquema CON Al igual que ocurría con el apartado de fisiopatología de la PCA esto no se explicó en clase. Es que así me ahorro interminables notas a pie para explicar la clínica. J. A., P. F., M.C. Ruipérez 14
195 TEMA CON 1 CARDIOLOGÍA CMG CLÍNICA ANAMNESIS Y EXPLORACIÓN FÍSICA La mayoría de los adultos con coartación permanecen asintomáticos durante varias décadas. Frecuentemente, el diagnóstico se establece en una revisión rutinaria cuando se detecta la diferencia de pulsos y presión arterial entre miembros superiores e inferiores. Otra posibilidad de diagnóstico casual sucede en pacientes refractarios al tratamiento de hipertensión arterial dado que la hipertensión de estos pacientes es de tipo anatómico. En los sintomáticos, los síntomas son debidos a la propia hipertensión en mitad superior, la hipotensión en mitad inferior o a la aparición de complicaciones. La HTA puede causar dolores de cabeza o epistaxis. La disminución de flujo en miembros inferiores causa frialdad de los mismos, debilidad postesfuerzo y, ocasionalmente, claudicación intermitente. Las complicaciones de la CoAo son graves e incluyen fallo ventricular izquierdo, disección aórtica, endocarditis (sobretodo, de la válvula aórtica), hemorragia cerebral debida a ruptura de aneurismas intracerebrales y coronariopatía secundaria a la HTA. La exploración de estos paciente muestra las diferencias tensionales y de amplitud de pulso en mitad superior e inferior; así podemos palpar los pulsos de las arterias intercostales en la espalda pero no los de los miembros inferiores. La auscultación detecta el soplo sistólico en la espalda. Un signo curioso, aunque no siempre apreciable, es la peculiar constitución de estos pacientes. La mayor irrigación de la mitad superior del cuerpo y, por otro lado, la escasa irrigación de la mitad inferior hacen que estos pacientes muestren una gran corpulencia en su tórax y brazos, pero unas piernas muy delgadas 24. AMPLIACIÓN DE CONTENIDO DE INTERÉS. EXPLORACIONES COMPLEMENTARIAS Electrocardiograma: signos de hipertrofia ventricular izquierda (HVI) y, a veces, bloqueo incompleto de rama derecha (BIRD) Radiología: encontraremos dilatación de la aorta ascendente (dilatación preestenótica) y muescas intercostales, causadas por el ya citado desarrollo de vasos torácicos. Esquema CON1-16 Ecocardiograma: la modalidad Doppler nos permite visualizar la coartación y medir el gradiente. Tomografía computerizada y resonancia magnética: permiten el diagnóstico anatómico. Angiografía: permite localizarla, identificar el tipo, evaluar la gravedad y valorar la presencia o no de colaterales. TRATAMIENTO FIN DEL CONTENIDO AMPLIADO Una vez establecido el diagnóstico, la corrección quirúrgica no debería ser retrasada debido a la alta probabilidad y gravedad de las complicaciones propias de esta patología. En caso de grandes estenosis concéntricas se utilizan prótesis y si se trata de estenosis 24 Ajam!! Entonces Johnny Bravo debió padecer de CoAo. J. A., P. F., M.C. Ruipérez 15
196 TEMA CON 1 CARDIOLOGÍA CMG excéntricas se suelen utilizar parches 25. Cuando los pacientes se operan jóvenes es frecuente (5 al 10% de los casos) la necesidad de reoperación pues los puntos no crecen con la aorta. La angioplastia con balón es una alternativa a la cirugía cuando la estenosis es pequeña y concéntrica. Tras el tratamiento, pueden aparecer efectos secundarios de la nueva situación hemodinámica; a saber: a) HTA por activación del sistema renina-angiotensinaaldosterona que, esta sí, responde al tratamiento con IECAs, b) Amaurosis transitoria (por la disminución brusca de la perfusión cerebral), o c) Panarteritis necrosante de vasos pequeños gastrointestinales. Los pacientes no operados presentan el siguiente pronóstico: a) El 50% de los no operados mueren hacia los 30 años; y b) El 75% de los no operados mueren a los 50 años. Esquema CON En el Esquema CON1-15 se intenta esquematizar esta idea (Aunque verdaderamente esto no es muy importante). J. A., P. F., M.C. Ruipérez 16
197 TEMA CON 1 CARDIOLOGÍA CMG J. A., P. F., M.C. Ruipérez 17
198 TEMA CON 1 CARDIOLOGÍA CMG 5 Tetralogía de Fallot (4F) Y 6 Transposición de los Grandes Vasos (TGV) La transposición de los grandes vasos consiste en que la aorta sale del ventrículo derecho y la arteria pulmonar del ventrículo izquierdo. Lógicamente, si no fuese por la existencia de comunicaciones en los tabiques sería incompatible con la vida. Existe una variante de esta enfermedad denominada transposición de grandes vasos con inversión ventricular; es decir, ahora sí cada vaso sale de su ventrículo correspondiente y, por ello, se denomina también transposición corregida. Estos paciente sólo van a presentar un signo; el bloqueo auriculoventricular suprahisiano congénito. Estas dos últimas CC no las vamos a encontrar nunca en el adulto pues todas se operan en la infancia. La tetralogía de Fallot incluye cuatro alteraciones cardiacas concomitantes; a saber: estenosis pulmonar, crecimiento ventricular derecho, CIV y dextroposición de aorta (la aorta sale del VD). La estenosis pulmonar hace que los niños nazcan cianóticos. Y, lógicamente, el tratamiento será quirúrgico y muy complejo. Esquema CON1-16 Esquema CON1-17 J. A., P. F., M.C. Ruipérez 18
199 TEMA CON 1 CARDIOLOGÍA CMG ANEXO: Síndrome de Eisenmenger. Cuando una cardiopatía congénita que cursa inicialmente con shunt izquierda-derecha llega a invertir el shunt debido al desarrollo de hipertensión pulmonar, nos encontramos ante un síndrome de Eisenmenger. Esta condición se da en pacientes con CIV, PCA y, más raramente, en pacientes con CIA. El mecanismo por el cual el incremento del flujo pulmonar llega a producir el enorme incremento de las resistencias vasculares pulmonares es básicamente desconocido. Histológicamente, la capa media de las arteriolas pulmonares se hipertrofia y la íntima prolifera, lo que produce obstrucción valvular. Finalmente, los vasos pueden trombosarse. J. A., P. F., M.C. Ruipérez 19
200
201 TEMA END-1 CARDIOLOGÍA CMG ENDOCARDITIS INFECCIOSA CONCEPTO Qué es una endocarditis infecciosa? Se denomina endocarditis infecciosa (E.I.) 1 a la infección microbiana que afecta al endotelio de las estructuras del corazón, endotelio de grandes vasos intratorácicos 2 o cuerpos extraños intratorácicos y cuya lesión patognomónica es la verruga o vegetación. 1 A pesar que la mayoría de estas infecciones son causadas por bacterias (endocarditis bacterianas), se considera más apropiado denominarlas de forma global como endocarditis infecciosa debido a que también puede ser producida por hongos, rickettsias o clamidias. 2 La infección del endotelio de los grandes vasos correspondería más estrictamente a la definición de endarteritis. Sin embargo, dada la superponibilidad de los cuadros, esta definición es válida. 3 Por ello, y como apreciaréis a lo largo del tema, en muchas ocasiones hablaremos de E.I. como sinónimo de endocarditis valvular. 4 A pesar de los avances en Medicina preventiva, en las técnicas diagnósticas y en el tratamiento tanto médico como quirúrgico, las endocarditis infecciosas siguen presentando una alta incidencia (entre 1,7 y 6,2 por personas / año en Europa y EE.UU.) y una mortalidad al año que, excluyendo a las endocarta con la edad y es mayor en hombres que en mujeres. Otros dos grupos de riesgo serían los adictos a drogas por vía parenteral (ADVP 5 ) y los pacientes portadores de prótesis. Las endocarditis infecciosas, junto a las insuficiencias aórticas agudas severas, son las cardiopatías más letales, ya que pueden provocar tanto insuficiencia cardiaca como muerte súbita y, además, sepsis grave por el proceso infeccioso inherente. Según esta definición, la E.I. puede asentar sobre las válvulas cardiacas, cuerdas tendinosas, endocardio auricular o ventricular, en el corazón normal o sobre prótesis, cables de marcapasos, conductos sintéticos creados quirúrgicamente en el corazón de determinados pacientes. A pesar de que, como acabamos de ver, la E.I. se puede localizar sobre diferentes estructuras, el 95% de las endocarditis infecciosas afectan a las válvulas cardiacas 3. Por qué? Esta distribución preferencial tiene múltiples razones; dos de ellas serían la ubicación de las válvulas en lugares por donde la sangre pasa a alta velocidad y la presencia de bordes libres. La incidencia 4 de esta patología aumen- Esquema END1-1 A grosso modo el proceso es el siguiente: a partir de un foco infeccioso a distancia, los microorganismos, vía hematógena, infectan el corazón, para lo cual es necesario que esté presente lesiones predisponentes. La infección del corazón va a producir en él una serie de complicaciones más o menos graves y, una vez bien instaurado el foco infeccioso, éste puede convertirse en un emisor de émbolos sépticos a todo el organismo (SNC, retina, riñón, pulmón, al propio corazón y a otros órganos). La lesión endocárdica inicial (o lesión ditis tricuspídeas, se acerca al 40% en algunas series de pacientes. 5 Según la bibliografía encontraréis UDVP (usuarios de droga por vía parenteral) o ADVP (adictos a droga por vía parenteral). Nosotros utilizaremos la que el Dr. Soria empleó en sus clases y diapositivas. J. A., P. F., M.C. Soria 1
202 TEMA END-1 CARDIOLOGÍA CMG predisponente como antes comentábamos) puede ser directa (daño directo del endocardio) o indirecta (daño a través de mecanismos inmunológicos). Con posterioridad veremos detalladamente las lesiones endoteliales, pero para que vayáis tomando conciencia, una lesión directa sería, por ejemplo, la producida por un catéter, mientras que una de tipo indirecta sería la que vemos en la fiebre reumática. TERMINOLOGÍA DE INTERES. c) Endocarditis establecida, sospechada o posible: hablamos de endocarditis establecida cuando conseguimos demostrar la afectación endocárdica mediante ecocardiografía; de sospechada cuando existe una alta sospecha pero no llegamos a alcanzar el diagnóstico definitivo mediante un ecocardiograma y de posible cuando incluimos a la endocarditis como parte de un diagnóstico diferencial aunque no tengamos una alta sospecha. Antes de seguir con el estudio de las endocarditis, debemos dejar claros algunos conceptos básicos que irán apareciendo a lo largo del tema y que hacen referencia al proceso infeccioso 6. a) Endocarditis activa o curada: es especialmente importante diferenciar ambos tipos en aquellos pacientes que van a someterse a cirugía. Se denomina endocarditis activa a aquella que presenta cultivos positivos o fiebre en el momento de la cirugía o bien a aquella en la que la cirugía se va realiza antes de terminar el tratamiento antibiótico completo. La endocarditis curada se definiría como todo lo contrario. Esquema END1-3 Esquema END1-2 b) Endocarditis recurrente o persistente: hablamos de recurrente cuando la endocarditis reaparece después de la erradicación de la infección y de persistente cuando nunca hubo un control real de la infección que permitiera la erradicación. 6 Esto según dijo Soria es sólo a modo aclaratorio porque estos términos irán saliendo a lo largo del tema; pero vamos, que tampoco hay que darles muchas vueltas a las definiciones en sí, sino que más bien os quedéis con un concepto claro. d) Endocarditis nativa, protésica o en ADVP: denominamos nativa a la endocarditis que ocurre sobre la válvula orgánica y protésica a la que ocurre sobre una prótesis, tanto valvulares como de otro dispositivo (por ejemplo, sondas de marcapasos). Las endocarditis protésicas se clasifican a su vez en precoces o tardías en función de que aparezcan antes o después de que hayan transcurridos doce meses de la intervención. En el primer caso, se relacionan frecuentemente con factores vinculados al acto quirúrgico (endocarditis noso- J. A., P. F., M.C. Soria 2
203 TEMA END-1 CARDIOLOGÍA CMG comial 7 ), mientras que en el segundo, aunque no se excluyen los anteriores, se relacionan principalmente con los diversos factores que, en la población general, conducen a la presencia de gérmenes en el torrente sanguíneo (endocarditis adquirida en la comunidad ). Las peculiares características de la endocarditis en ADVP (como, por ejemplo, la afectación de la tricúspide como forma más frecuente) hace que sea necesaria una denominación especial. e) Endocarditis derechas o izquierdas: las endocarditis que afectan a las válvulas derechas (tricúspide fundamentalmente, pues la endocarditis pulmonar es muy rara) tienen mejor pronóstico que las que afectan a las válvulas izquierdas (entre ambas, mitral y aórtica, el peor pronóstico corresponde a la última) f) Endocarditis microbiológicamente positivas o microbiológicamente negativas: hablamos de microbiológicamente positivas cuando demostramos la existencia de gérmenes por cualquier método (cultivos, serología, histología, PCR ) y de microbiológicamente negativas cuando los resultados de los estudios anteriores son negativos 8. Esquema END1-4 Esquema END1-5 7 Se suele considerar también como nosocomial a aquella endocarditis sobre válvulas nativas que aparece después de las 72 horas del ingreso hospitalario. Las endocarditis nosocomiales representan el 5 a 30% de todas las endocarditis y suelen tener una alta mortalidad (40 a 50%). 8 En la práctica diaria, a pesar de que el resultado sea negativo, la endocarditis se sigue tratando como si la etiología fuese bacteriana. J. A., P. F., M.C. Soria 3
204 TEMA END-1 CARDIOLOGÍA CMG CLASIFICACIÓN 1 CLASIFICACIÓN EN FUNCIÓN DE LA FORMA DE PRESENTACIÓN Según la forma y tiempo de evolución hasta el momento del diagnóstico, distinguimos entre dos tipos de endocarditis infecciosas: E.I. aguda: también llamada endocarditis maligna o séptica, es producida por gérmenes de alta virulencia como staphylococcus aureus o streptococcus spp. El proceso y sus consecuencias se manifiestan en días o semanas 9 y sin tratamiento tiene un curso letal dado que en seis semanas el paciente suele fallecer bajo un cuadro séptico. coccus bovis y Staphylococcus epidermidis (coagulasa negativo). Aunque es menos frecuente, también podemos encontrar como causantes de ambos tipos de EI a los siguientes microorganismos: Haemophilus, Actinobacillus, Cardiobacterium, Eikenella y Kingella. Estos microorganismos son conocidos como grupo HACEK. Staphylococcus aureus y Streptococcus viridans son los microorganismos más frecuentes para cada uno de los tipos respectivamente. E.I. subaguda: también llamada endocarditis lenta, pues tiene un curso más larvado, se manifiesta en el ámbito de semanas o meses. En ellas, la puerta de entrada pasa casi siempre inadvertida y la vegetación en sí misma se convierte en el foco principal de la bacteriemia. 2 CLASIFICACIÓN ETIOLÓGICA Las E.I. se clasifican en función del tipo de microorganismo que las causó. Además, como cada microorganismo tiene tendencia a producir un tipo de E.I. podemos agruparlos en tres grupos. Los microorganismos causantes de la E.I. aguda son, principalmente, Staphylococcus aureus, Streptococcus pneumoniae, Streptococcus pyogenes, Neisseria y Haemophilus influenzae. Por otro lado, los principales causantes de la E.I. subaguda son Streptococcus viridans, Streptococcus faecalis 10, Strepto- 9 Producen IC muy precoz por destrucción valvular. 10 Como habréis notado, esto no coincide con lo que vimos el año pasado en Microbiología ya que, tanto faecalis como bovis, Esquema END1-6 PATOGENIA Y FISIOPATOLOGÍA 11 Vamos a dividir la patogenia E.I. en tres grandes fases. En una primera fase vamos a explicar cómo se establece la endocarditis y se forma la vegetación. En la segunda fase nosotros los estudiamos como Enterococcus. Actualmente se acepta esta doble nomenclatura dado que se pueden considerar a los Enterococcus como Streptococcus entéricos. 11 Este apartado ha sido ampliado con respecto a lo que se dio en clase. No os asustéis porque es muy sencillo; simplemente con leerlo lo más seguro es que se os quede la idea; vamos, en otras palabras, quedaros con el esquema del final. J. A., P. F., M.C. Soria 4
205 TEMA END-1 CARDIOLOGÍA CMG estudiaremos las consecuencias que sobre el propio corazón tiene la E.I., mientras que en la tercera y última fase, veremos el proceso de diseminación extracardiaca de la infección 12. Esquema END1-7 A ESTABLECIMIENTO DE LA ENDO- CARDITIS Y FORMACIÓN DE LA VE- GETACIÓN. El establecimiento de la endocarditis es el resultado de la concurrencia de tres circunstancias que, conjuntamente, favorecen la formación de la vegetación. Cuáles son esas tres circunstancias? Necesitamos que se produzca una lesión en el endotelio (lesiones predisponentes), que entren microorganismos en el torrente sanguíneo (bacteriemia) y que éstos colonicen el trombo formado sobre la lesión (colonización). A continuación revisaremos detalladamente cada uno de estos procesos. A.1) LESIONES PREDISPONENTES EN ENDOTE- LIO: Por qué se necesita una lesión endotelial? La respuesta es bien sencilla: porque el endotelio sano es resistente a la infección, es decir, los microorganismos no pueden colonizarlo de ningún modo 13. Por ello, para que se produzca la endocarditis, es necesaria una lesión sobre la que se forme un trombo fibrinoplaquetario que constituya un ambiente ideal para la colonización y crecimiento de los microorganismos. Al proceso de lesión endotelial que deja expuesto el colágeno subendotelial de alto poder trombogénico se ha dado en denominar denudación endotelial y al trombo formado, aún sin colonizar, endocarditis trombótica no bacteriana o ETNB. Ahora bien, Cómo se produce la lesión endotelial? Las situaciones son innumerables, pero de un modo didáctico las podemos agrupar en cuatro 14 : a) Situaciones de alto flujo hemodinámico en las que la lesión se produce por el impacto violento de la sangre que circula a alta velocidad. Así, podemos encontrar lesión endotelial en las valvulopatías, mitrales y aórticas fundamentalmente; cardiopatías congénitas como comunicación interventricular (CIV), tetralogía de Fallot (4F), persistencia del conducto arterioso (PCA); miocardiopatía hipertrófica, etc. b) Traumatismos directos sobre el endotelio producidos por actos médicos ( lesión iatrogénica ), como cateterismos o cirugía valvular, o por cuerpos microscópicos introducidos en el torrente sanguíneo, como el talco empleado para cortar algunas drogas intravenosas. c) Lesión indirecta por mecanismos inmunológicos. Es característica la lesión que se produce en la fiebre reumática como consecuencia de la reacción cruzada entre Esquema END Lógicamente, la primera fase siempre va a ser la primera, pero la segunda y tercera pueden intercambiar su orden o incluso no darse alguna de ellas. 13 Determinados microorganismo muy virulentos, como el gran Staphylococcus aureus pueden implantarse en válvulas aparentemente normales 14 Los ejemplos que aparecen se volverán a repetir como factores de riesgo para la indicación de profilaxis antibiótica. Memorizarlos mejor en el apartado de profilaxis porque allí se hace una gradación en función del riesgo. J. A., P. F., M.C. Soria 5
206 TEMA END-1 CARDIOLOGÍA CMG componentes cardiacos y la proteína M del streptococcus betahemolítico, es decir, los anticuerpos anti-m atacan al corazón. Otro grupo de enfermedades serían aquellas que cursan con inmunocomplejos circulantes que, al unirse al endotelio, activarían el complemento. La formación de los complejos de ataque de membrana dañarían el endotelio. d) Lesión endotelial en la enfermedad degenerativa valvular: la degeneración de las estructuras cardiacas que se produce en determinadas enfermedades y, sobre todo, con la edad, crearía sitios ideales para la formación de ETNB. También pueden formarse ETNB sin que medie lesión endotelial. Tal situación la encontramos en los estados de hipercoagulabilidad, como ocurre en pacientes con determinadas neoplasias (leucemias, por ejemplo), enfermedades crónicas caquectizantes (cirrosis, por ejemplo) o del tejido conjuntivo (lupus eritematoso sistémico, por ejemplo). En estos casos la ETNB recibe el nombre de endocarditis marasmática o marántica. El tratamiento con esteroides también aumenta el riesgo de ETNB. Por último, las prótesis y otros dispositivos intracardiacos son lugares ideales para la formación de ETNB por dos razones: por un lado su alto poder trombogénico (que dependerá del material de que estén hechas) y por otro por las lesiones endoteliales que se producen en el acto de colocación de las mismas (las E.I. en las prótesis suelen formarse en la periferia de sutura lo que aumentar el riesgo de dehiscencia). A.2.) ENTRADA DE GÉRMENES EN EL TO- RRENTE CIRCULATORIO (BACTERIEMIA) Puede existir bacteriemia en muchas circunstancias. La vía de entrada más frecuente es a través de un foco infeccioso (herida, ITUs, grandes quemados, ) o una maniobra invasiva que traumatice la piel y/o mucosas (técnicas diagnósticas y/o terapéuticas variadas, jeringuillas en ADVP, sondas, vías ). A.3) COLONIZACIÓN. La colonización de los trombos de fibrina y plaquetas (donde la fibronectina juega un papel muy importante) por los microorganismos va a ser casi inevitable y va a estar influida por una serie de circunstancias que incluyen: a) Lo más importante por parte del microorganismo es su capacidad de adherencia; ello explica el fenómeno de que algunos microorganismos nunca producen E.I., mientras que otros lo hacen con relativa facilidad (véase Staphylococcus aureus). La virulencia, capacidad de crecimiento, resistencia a antibióticos, definirán la magnitud de las consecuencias intra/extracardiacas así como la evolución del cuadro. b) Por parte del huésped, sus características idiosincrásicas y estado inmunitario son los principales factores. Como bien sabemos la inmunocompetencia suele disminuir con la edad, por lo que este será un factor de riesgo importante. Formación de la vegetación: endocarditis trombótica séptica o bacteriana. La concurrencia de estas tres circunstancias da lugar a la formación de una vegetación. Las vegetaciones más frecuentes son las valvulares (por presentar bordes libres). Por las condiciones hemodinámicas (estasis sanguíneo, fundamentalmente), las endocarditis suelen formarse en la vertiente auricular en el caso de las válvulas aurículo-ventriculares y hacia la vertiente ventricular en el caso de la válvula aórtica. El tamaño de la vegetación dependerá del tipo de germen, pero, al contrario de lo que se puede pensar, cuanto más virulentos son, menos crece la vegetación, ya que lo que hacen es destruir la válvula directamente 15. B DISEMINACIÓN INTRACARDIACA DEL PROCESO. La expansión del proceso infeccioso hacia la base de las válvulas o hacia las cuerdas ten- 15 Literalmente el Dr. Soria dijo: Si son muy virulentos, se pueden cargar la válvula en 2 semanas J. A., P. F., M.C. Soria 6
207 TEMA END-1 CARDIOLOGÍA CMG dinosas provoca la destrucción progresiva de las mismas, originando insuficiencia valvular y otras complicaciones locales como abscesos, pseudoaneurismas 16, fístulas intracardiacas, miocarditis, pericarditis séptica, también llamada purulenta, y alteraciones de la conducción por invasión del tabique interventricular. A partir de la vegetación inicial, la colonización por microorganismo también puede extenderse a otras valvular y dar lugar a vegetaciones secundarias. C. DISEMINACIÓN EXTRACARDIACA DEL PROCESO. En estadios más avanzados del proceso infeccioso pueden aparecer alteraciones extracardiacas que pueden ser debidas a la embolización de fragmentos de vegetaciones, a las infecciones metatásicas que utilizan como vehículo a esos mismos fragmentos o al depósito de inmunocomplejos generados cuando la bacteriemia se mantiene durante largo tiempo 17. En función de la válvula afectada la embolización o infección metastásica se podrá producir en el territorio sistémico o pulmonar 18. Una vez comprendido la patogenia del proceso es fácil establecer los tipos de consecuencias fisiopatológicas que encontraremos. Por un lado, tendremos las consecuencias derivadas de la respuesta inflamatoria sistémica a la infección, esto es, la que encontramos en todos los procesos infecciosos. Dada las características de la E.I., la magnitud de esta respuesta será elevada. Por otro lado, tendremos las consecuencias derivadas de la diseminación intracardiaca del proceso. Por último, encontraremos las consecuencias derivadas de la diseminación extracardiaca del proceso. El siguiente esquema resume lo que acabamos de explicar introduciendo otra variable más, el mecanismo fisiopatológico (consecuencia infecciosa o inmunitaria). Esquema 16 Los pseudoaneurismas se producen por la rotura de la capa endotelial (íntima, en un vaso) y muscular (media), pero la sangre queda contenida por el epicardio (adventicia) o por un trombo perivascular. En una fístula la rotura parietal es completa. 17 La bacteriemia se mantiene durante largo tiempo cuando la propia vegetación actúa de foco infeccioso. Una bacteriemia persistente es hoy en día algo muy poco frecuente porque estos pacientes son rápidamente tratados con antibióticos que eliminan fácilmente los microorganismos de la sangre ( ojo! De la sangre, no de la vegetación). Otra consecuencia de la bacteriemia persistente sería la hiperplasia del sistema fagocítico mononuclear (SFM). Más adelante comprobaréis la importancia de este último dato. 18 Como las E.I. izquierdas son mucho más frecuentes que las derechas, las alteraciones pulmonares por embolias y metástasis infecciosas serán menos frecuentes que las de otros órganos. Si serán frecuentes, sin embargo, en ADVP. Si se conoce, se deduce! J. A., P. F., M.C. Soria 7
208 TEMA END-1 CARDIOLOGÍA CMG ANATOMÍA PATOLÓGICA 1. MACROSCÓPICAMENTE. Qué vamos a ver? Por un lado la lesión patognomónica de la E.I., esto es, la vegetación o verruga, cuya localización fundamental ya sabemos (bordes libres valvulares, en la vertiente auricular o ventricular, respectivamente). En otras patologías también pueden aparecer lesiones valvulares (calcificaciones, fundamentalmente) que, a diferencia de la E.I., suelen localizarse en la periferia del anillo. También nos sabemos ya las lesiones que va a producir la diseminación intracardiaca del proceso: la insuficiencia valvular por destrucción progresiva y/o perforación de la válvula y de las cuerdas tendinosas y otras lesiones locales como abscesos miocárdicos, psudoaneurismas, fístulas intracardiacas, miocarditis y pericarditis séptica o purulenta 19 En el primer caso la pared no se rompe completamente, cosa que si ocurre en la fistula donde se crea una comunicación entre cámaras cardiacas. Aunque la lesión patognomónica de la E.I. es la verruga, se definen como criterios mayores de endocarditis cualquiera de las siguientes alteraciones que podemos observar macroscópicamente: 1) Fístulas intracardiacas; 2) Aneurimas; y 3) Destrucción o perforación valvular. antibióticos administrados por vía intravenosa irán atacando a la verruga desde el exterior 20. Este proceso puede ser observado microscópicamente (con técnicas de tinción especiales) pues la vegetación que analicemos, si pertenece a un paciente en tratamiento con antibióticos, tendrá más microorganismos en el centro que en la periferia 21. También podemos apreciar un alto contraste entre la reacción inflamatoria local y la circundante (por ejemplo, en el tejido conjuntivo subvalvular) pues como acabamos de comentar, al carecer la válvula de vascularización, su respuesta será menos manifiesta. Los fragmentos desprendidos de la vegetación constituyen émbolos que pueden causar microinfartos a distancia. Sí además dichos fragmentos contenían microorganismos podremos encontrar microabscesos. Como se comento en el primer apartado del presente tema, los émbolos pueden embolizar (valga la redundancia) en los diferentes órganos de la economía, pero también en el propio corazón y, por tanto, podremos tener microinfartos y/o microabscesos tanto sistémicos como cardiacos. 2. MICROSCÓPICAMENTE. Los principales hallazgos microscópicos son: Mediante técnicas histológicas podemos visualizar la vegetación como un agregado de colonias de microorganismos mezcladas con acúmulos de fibrina, plaquetas, eritrocitos e infiltrados de células inflamatorias La ausencia de vascularización propia por parte de la válvula hace que no podamos atacar a la verruga desde su seno. Los 19 Lógicamente, la alteración de la conducción no la veremos. 20 Irán pelando la verruga desde fuera hacia adentro. 21 Este fenómenos explica algunas peculiaridades del tratamiento: es necesaria un tratamiento largo para conseguir errradicar a todos los microrganismo, los síntomas de la bacteriemia (fiebre) desaparecen precozmente pues la bacteriemia se mantiene a expensas de la multiplicación de los microorganismos de las capas más externas y, por último, que si no se completa la pauta terapeútica antibiótica la recidiva será la regla pues los microorganismo del interior volverán a colonizar la periferia de la vegetación. J. A., P. F., M.C. Soria 8
209 TEMA END-1 CARDIOLOGÍA CMG Esquema END1-10 MANIFESTACIONES CLÍNICAS Las manifestaciones clínicas van a derivar de los distintos tipos de consecuencias fisiopatológicas que estudiamos en el apartado correspondiente. Así, tendremos: 1. MANIFESTACIONES GENERALES DERIVADAS DE LA RESPUESTA INMUNITARIA SISTÉMICA. Podemos encontrar fiebre, escalofríos, sudoración, pérdida de peso, anorexia, etc. La fiebre y escalofríos son las manifestaciones más frecuentes de la E.I. (90% de los casos). En los pacientes con presentación aguda, la fiebre suele encontrarse alta (entre 39º y 40º), mientras que en aquellos en los que la presentación es subaguda, rara vez supera los 39º (hablamos de febrícula). La anorexia y pérdida de peso pertenecen casi exclusivamente a las E.I. subagudas. 2. MANIFESTACIONES CARDIACAS DERIVADAS DE LA DISEMINACIÓN INTRACARDIACA DEL PROCESO. Las manifestaciones cardiacas son muy llamativas y podemos distinguir principalmente entre dos tipos de hallazgos: Soplos: aparecen en más del 95% de los casos, pero sólo tienen valor diagnóstico si son de nueva aparición 22, y ello, en la puerta de urgencias, es bastante difícil de comprobar. Insuficiencia cardíaca congestiva: aparece como consecuencia de procesos fisiopatológicos secundarios a E.I. 23 ; a saber: a) Destrucción valvular, sobre todo, 22 Estos nuevos soplos son debidos al establecimiento de insuficiencias valvulares normalmente, pero también pueden deberse a fístulas intracardiacas. 23 Podéis repasar el apartado de patogenia y fisiopatología y comprobar que todos ellos son posibles complicaciones de las E.I. Además, si comprobáis en cada uno de los temas referidos a dichas patologías concretas, comprobaréis como la I.C.C. es una de las vías finales de todas ellas. por valvulopatías mitrales o aórtica aguda que son los cuadros más frecuentes; b) Bloqueos auriculoventricular; c) IAM embólicos; d) Miocarditis, c) Pericarditis purulenta, etc. 3. MANIFESTACIONES SISTÉMICAS DERIVADAS DE LA DISEMINACIÓN EXTRACARDIACA DEL PROCESO. Lesiones cutáneo-mucosas 24 : se deben a microembólias y embolismo sépticos, aunque algunas también pueden deberse a depósito de inmunocomplejos en la dermis. Las principales lesiones son: Petequias localizadas principalmente en boca, faringe y conjuntivas. Hemorragias subungueales en astilla. Nódulos de Osler 25 : son lesiones cutáneas nodulares eritematosas dolorosas, localizadas preferentemente en el pulpejo de los dedos, aunque también las podemos encontrar en las palmas (eminencia tenar) y plantas de los pies. Manchas de Janeway: Son lesiones no dolorosas eritematosas, hemorrágicas o pustulosas que aparecen en plantas o palmas. Manchas de Roth: Se observan en la retina como hemorragias superficiales con centros pálidos o blancos al estudiar el fondo de ojo. Pueden deberse a microhemorragias o a embolismos sépticos. Embolias sépticas en el pulpejo de los dedos (digitales) y otras localizaciones (por ejemplo, palmares o plantares). 24 Por si queréis ver mejor las imágenes del esquema, éstas han sido extraídas de las diapositivas del Dr. Soria. Podéis también probar a buscarlas por google. 25 Si queréis saber más sobre los nódulos de Osler hay un trabajillo hecho por algunos de los médicos de Medicina Interna del Hospital Morales Meseguer; algunos de los cuales estuvieron con nosotros en las practicas de PG, y que es bastante interesante: Utilidad diagnóstica de los nódulos de Osler en la endocarditis infecciosa en usuarios de drogas por vía parenteral (UDVP). Anales de Medicina Interna. J. A., P. F., M.C. Soria 9
210 TEMA END-1 CARDIOLOGÍA CMG Esquema END1-11 Manifestaciones en otros órganos: las embolias sépticas, microinfartos y depósito de inmunocomplejos puede afectar a otros órganos y provocar manifestaciones en bazo (esplenomegalia por hiperplasia del SFM), renales 26, musculo-esqueléticas, neurológicas y pulmonares 27. Actualmente las manifestaciones que exigen una bacteriemia permanente (derivas de la formación de inmunocomplejos y metástasis sépticas) no suelen presentarse porque las pautas antibióticas se instauran de forma precoz. Además, muchos de estos pacientes están previamente en tratamiento antibiótico por otras causas que, aunque no a la dosis necesaria para curar la endocarditis, si para evitar la bacteriemia. 26 Son frecuentes en las E.I. las alteraciones renales leves (iones y sedimentos) pero no las formas más graves (glomerulonefritis) ya que estás últimas se deben fundamentalmente al depósito de inmunnocomplejos. 27 El Dr. Soria se limito a nombrar los tipos de manifestaciones. Si alguien está interesado en conocer las diferentes manifestaciones que se producen en cada órgano que revise la bibliografía. DIAGNÓSTICO En el diagnóstico de las E.I., lo más importante, es mantener siempre un alto índice de sospecha, pero sin olvidar que los síntomas que nos pueden hacer sospechar de esta patología pueden ser explicados por otras patologías más frecuentes. 1. DIAGNÓSTICO CLÍNICO. Los datos clínicos que nos orientan hacia E.I. son fundamentalmente tres; a saber: soplos, fiebre y situación predisponente 28. En todo enfermo que cumpla estos tres criterios, debemos considerar la situación como urgente y realizar el diagnóstico preciso lo más rápido posible ya que nos encontramos ante un proceso que puede comprometer la vida del paciente. 28 En un niño con fiebre, por ejemplo, no vamos a sospechar de E.I., pero si el paciente lleva una prótesis valvular, padece miocardiopatía o es UDVP, la sospecha deberá ser alta. J. A., P. F., M.C. Soria 10
211 TEMA END-1 CARDIOLOGÍA CMG 2. DIAGNÓSTICO POR MÉTODOS COMPLEMENTARIOS. Podemos dividir los métodos complementarios en dos tipos. Por un lado tenemos métodos de laboratorio (cultivo, serología, analítica, detección de inmunocomplejos circulantes ) y por otro métodos de imagen (ecocardiograma y radiografía). Los máximos representantes de cada grupo, el (hemo)cultivo y el ecocardiograma respectivamente, constituyen las dos pruebas diagnósticas fundamentales del diagnóstico. Su valor diagnóstico no sólo radica en su sensibilidad y especificidad sino también en su rapidez, pues no debemos olvidar que las endocarditis suelen ser una situación de urgencia. A continuación comentaremos detalladamente el cultivo y el ecocardiograma y, para finalizar, el resto de métodos usados menos frecuentemente. a) Cultivo: para el cultivo, lo ideal es que la toma de muestras se realice previa a la antibioterapia 29. Vale tanto la sangre arterial como la venosa y tanto si la extracción se produce en ausencia de fiebre como en picos febriles; sin embargo, se tiende a considerar mejores las muestras venosas extraídas en picos febriles. Un detalle muy importante, es que la sangre debe extraerse directamente del vaso, ya sea una vena o una arteria, pero nunca a través de un catéter, ya que estos pueden estar colonizados por microorganismos y falsear los resultados. Se deben obtener siempre tres muestras de sangre espaciadas, al menos, por 1 hora que se cultivaran en los medios habituales en búsqueda de las bacterias más frecuente. Cuando los cultivos habituales son negativos 30 o se sospecha de bacterias atípicas o poco frecuentes (por ejemplo, el grupo H.A.C.E.K.) emplearemos medios especiales. Se recomienda, para realizar el cultivo poner 10 ml de sangre en 50 ml de medio de cultivo adecuado, tanto para microorganismos aerobios como anaerobios, y realizar un antibiograma y determinación de C.M.I. (concentración mínima inhibitoria). 29 Aunque esto no siempre es posible; es lo ideal. 30 Si la muestra ha sido extraída con el paciente tratado antibióticamente la posibilidad de cultivo negativo es alta. b) Ecocardiograma transtorácico y transesofágico: es, junto al cultivo, el método diagnóstico más importante y debe realizarse sin retraso. Nos permite visualizar las lesiones patognomónicas de este proceso infeccioso, es decir, las verrugas 31. Además permite descartar, o no, que existan abscesos, fístulas o pseudoaneurismas. Pero, Cuándo y cómo decidimos qué tipo de ecocardiograma realizar? Normalmente, si existe material protésico (si el paciente es portador de una prótesis valvular, por ejemplo) va a ser más difícil identificar la endocarditis o las posibles complicaciones, por lo que haremos directamente un ecocardiograma transesofágico (E.T.E.) que nos ofrece mayor resolución. En pacientes sin prótesis, sólo la haremos si la calidad de visualización es excesivamente mala o si el resultado es negativo en la modalidad transtorácica (E.T.T.), pero se sigue manteniendo una alta sospecha. El siguiente algoritmo intenta resumir lo explicado anteriormente. Esquema END1-12 c) Otros métodos de imagen y de laboratorio: además del cultivo y del ecocardiograma 32, se pueden realizar otras pruebas complementarias como: 31 Si después de este tema, no queda claro cuáles son las lesiones patognomónicas de la endocarditis Perdonad la redundancia, pero seguro que así no se os olvida (esto también se puede aplicar a lo de la lesión patognomónica de la endocarditis). J. A., P. F., M.C. Soria 11
212 TEMA END-1 CARDIOLOGÍA CMG Radiografía de tórax: la semiología será diferente si se trata de una endocarditis derecha (tricuspídea 33 ) o izquierda. En caso de endocarditis tricuspídea, es posible que el pulmón reciba microémbolos sépticos y podamos observar infiltrados pulmonares diseminados en la placa. En caso de endocarditis izquierda podemos encontrar, si existe, signos de insuficiencia cardiaca izquierda. Pero, como hemos dicho, en cuanto a manifestaciones directamente relacionadas con la embolización o metástasis infecciosas, la placa de tórax, solo nos informa en el caso de las derechas. Serología: las técnicas serológicas permiten la identificación de microorganismos raros (Coxiellas, micoplasmas, legionellas, brucella, etc.) así como el despistaje de hongos. También nos permiten buscar ADN bacteriano mediante PCR. Análisis de sangre: podemos hallar anemia normocítica-normocrómica, sobre todo, en las formas subagudas 34 ; leucocitosis con desviación a la izquierda 35 ; factor reumatoide positivo (IgG IgM 36 ); hipergammaglobulinemia; disminución de las proteínas del complemento (C total y C3) por consumo excesivo; títulos elevados de inmunocomplejos circulantes (IMC); etc. Análisis de orina: podemos hallar sedimento urinarios en forma de piruria 37, microhematuria 38, proteinuria 33 Recordemos que la endocarditis de la válvula pulmonar es extremadamente rara. 34 La anemia sería consecuencia de la afectación de la médula ósea. 35 En ancianos, grupo de riesgo de endocarditis, la leucocitosis es poco manifiesta pero se sigue manteniendo el elevado porcentaje de formas inmaduras; esto es, la desviación a la izquierda. 36 El factor reumatoide (FR) es una prueba que mide la presencia y nivel de la IgM específica contra las inmunoglobulinas IgG anormales. 37 Se denomina así a la presencia de leucocitos en orina. Normalmente se considera como límite 10 leucocitos por mm 3. La piuria con bacteriuria nos orientaría hacia una ITU y no hacia una endocarditis. 38 La microhematuria se define, desde el punto de vista macroscópico, como la presencia de glóbulos rojos (detectados por tiras reactivas colorimétricas) en una orina aparentemente normal, esto es, sin alteración de su color (en la macrohematuria o hematuria macroscópica. Microscópicamente se acepta que existe microhematuria cuando se encuentran más de 3 eritrocitos por campo en el estudio de sedimento urinario (aunque los Criterios diagnósticos de Duke-Durack. El diagnóstico de las E.I. se establece con certeza únicamente mediante el estudio anatomopatológico y microbiológico de las vegetaciones. No obstante, sobre la base de los datos clínicos, de laboratorio y ecocardiográficos se ha desarrollado un esquema sumamente sensible y específico, denominado criterios de Duke 39. Actualmente sólo se consideran E.I. con diagnóstico definitivo las que cumplen dos criterios mayores, uno mayor y dos menores, o cinco menores. Ante una de estas tres situaciones, diremos que la endocarditis está establecida 40. I. Criterios mayores: Hemocultivo positivo: para considerar el hemocultivo positivo ha de cumplirse que: a) Se han realizado dos cultivos separados más de 1 hora para microorganismos típicos (S. viridans, S. bovis, S. aureus, enterococcus, grupo H.A.C.E.K., etc,) y ambos han resultado positivos; o b) Los distintos hemocultivos, realizados con más de una hora de separación entre ellos, para microorganismos no típicos han permanecido persistentemente positivos. Evidencia de afectación endocárdica: se considera que existe evidencia cuando se documenta una nueva insuficiencia valvular o se obtiene un ecocardiograma positivo. Se considera una ecocardiográfía positiva cuando se hallan lesiones valvulares compatibles con el proceso como son: vegetaciones, abscesos, dehiscencias de válvulas protésicas, pseudoaneurismas, fístula, etc. II. Criterios menores: El paciente padece una cardiopatia que lo hace predisponente a E.I. o es ADVP límites varían dependiendo del laboratorio, definiéndose en algunos hasta por encima de 10 eritrocitos). 39 Podéis encontrarlos nombrados de varias formas. Sabed que fueron propuestos por Durack et al. en la Universidad de Duke y que han sufrido numerosas revisiones. 40 Lógicamente, también se consideran E.I. establecidas las que se demuestran por estudios anatomopatológicos y microbiológicos de las vegetaciones. J. A., P. F., M.C. Soria 12
213 TEMA END-1 CARDIOLOGÍA CMG El paciente presenta fiebre superior a 38ºC. El paciente ha sufrido fenómenos vasculares (embolías, infartos, hemorragías conjuntivales, lesiones de Janeway...) El paciente ha sufrido fenómenos inmunológicos (glomerulonefritis, nódulos de Osler, manchas de Roth, factor reumatoide positivo...) El ecocardiograma es sugestivo de E.I. (si fuese positivo sería un criterio mayor). Existen evidencia microbiológica DIAGNÓSTICO DIFERENCIAL El diagnóstico diferencial debe realizarse principalmente frente a la edarteritis y al mixoma. La diferencia entre endarteritis y endocarditis es que la primera afecta al endotelio vascular y no al miocárdico o valvular, pero los cuadros son superponibles, sobretodo, mientras más cercana sea la vegetación al corazón La clínica compatible del mixoma (microembolias sitémicas, disnea, soplos, hemorragía cerebral ) con la E.I. subaguda, nos obliga al diagnóstico diferencial, que, normalmente, se obtiene mediante ecocardiografía. PRONÓSTICO El pronóstico varía mucho en función tipo de E.I. al que nos enfrentemos. El mejor de todos los pronósticos lo ofrece la E.I. de válvula tricúspide. Ello radica en tres hechos fundamentalmente: a) La afectación derecha suele ser menos grave que la izquierda; b) Suele darse en pacientes jóvenes que tienen menos taras orgánicas; y c) Producen 41 Los resultados obtenidos nos orientan hacia la E.I. pero no se cumplen los requisitos que explicamos en los criterios mayores. menos embolias sépticas sistémicas, pues los émbolos irán a parar a pulmón. En la E.I. de válvulas izquierdas nos encontramos ante un peor pronóstico, sobre todo, si se trata de una E.I. de la válvula aórtica 42. Las de peor pronóstico son las que asientan en prótesis, producidas por microorganismos gramnegativos o por hongos. Al diferenciar en las E.I. protésicas entre las formas tempranas y tardías se aprecia un peor pronóstico de las primeras. Además del tipo de E.I. se consideran factores que empeoran el pronóstico los siguientes: edad, retraso en el diagnóstico, formas polimicrobianas 43 o por microorganismos multirresistentes, afectación polivalvular y retraso en el inicio del tratamiento. Por este motivo, y como veremos más adelante, lo que se suele hacer es comenzar con un tratamiento empírico que posteriormente se ajusta cuando se reciben los resultados microbiológicos. TRATAMIENTO En el tratamiento de las E.I. es importante diferenciar entre la actitud profiláctica y terapéutica PROFILAXIS En el estudio de la profilaxis de las E.I. veremos varios apartados. Inicialmente veremos el fundamento fisiológico de la profilaxis para conocer cuándo debemos administrar los antibióticos. Seguidamente resumiremos algunas generalidades sobre el método profiláctico que nos ayuden a tomas conciencia sobre la realidad clínica. Por último, veremos las indicaciones para la profilaxis y la pauta que se indica en cada caso. 42 La mortalidad en pacientes con tratamiento con este tipo de E.I. se encuentra en torno al 35%. 43 Las formas polimicrobianas son más típicas de las E.I. en ADVP 44 El Dr. Soria incidió sobre ello bastante. J. A., P. F., M.C. Soria 13
214 TEMA END-1 CARDIOLOGÍA CMG a) FUNDAMENTO DE LA PROFILAXIS: CUÁN- DO ADMINISTRAMOS LOS ANTIBIÓTICOS? Nuestro objetivo al realizar el método profiláctico es que la concentración de antibióticos en sangre sea la más alta justo en el momento de la manipulación con riesgo de bacteriemia. Para conseguir tal objetivo, debemos administrar el antibiótico al menos una hora antes de la manipulación, pues se ha comprobado que el pico de antibiótico en sangre se alcanza en aproximadamente ese espacio de tiempo. Antes se solía dar una segunda dosis (a las 5 horas de la manipulación) del antibiótico para mantener la concentración elevada durante más tiempo, pero actualmente las guías excluyen esta segunda dosis. con las endocarditis que aparecen de forma aguda. Se acepta que ante la duda diagnóstica se debe indicar siempre la profilaxis. La higiene y cuidado de las potenciales puertas de entrada resulta fundamental. Por ejemplo, la higiene bucal. La comunidad médica es mala conocedora y poco colaboradora respecto a la profilaxis antibiótica de la E.I. Es de vital importancia concienciar a los dentistas. El mayor seguro es la educación del paciente. c) CUÁNDO DEBEMOS INDICAR PROFILAXIS EN UN PACIENTE? 46 Básicamente en dos situaciones: 1) Si el paciente padece una cardiopatía predisponente; y 2) Si el paciente va a ser sometido a procedimientos especialmente productores de bacteriemia. Asimismo, siempre deberemos considerar si existen situaciones extracardiacas de alto riesgo que nos indiquen la profilaxis. Esquema END1-13 b) GENERALIDADES DEL MÉTODO PROFILÁC- TICO. A continuación daremos algunos datos sobre la profilaxis de la E.I. que nos servirán para acercarnos a la realidad práctica. No existen estudios randomizados sobre el mismo. Todos los datos son totalmente empíricos 45. Ninguna pauta protege al 100%. Como el 50% de las E.I. no poseen una puerta de entrada clara no se puede practicar en ellas la profilaxis. Igualmente ocurre 45 Y esto va a seguir siendo así, ya que no sería ético realizar estudios exponiendo a propósito a un determinado grupo de personas. Los factores cardiacos predisponentes se dividen en tres grupos: factores de alto, medio y bajo riesgo. Todo paciente que presente factores de alto o medio riesgo será considerado como que padece una cardiopatía predisponente a la E.I. y estará indicada en él la profilaxis. Por el contrario, en los pacientes con bajo riesgo no se indicará la profilaxis. Factores predisponentes de alto riesgo: Estenosis valvulares, sobre todo, las izquierdas. Insuficiencias valvulares, sobre todo, las izquierdas. Comunicaciones circuitos de alta presión como la CIV o el conducto arterioso persistente, entre otros. Material protésico de toda índole. Endocarditis previa. 46 A continuación encontraréis múltiples listas interminables. Los ejemplos son los que el Dr. Soria dio en clase y que aparecían en sus diapositivas. Aprendérselos de memoria es toda una proeza, pero si entendisteis bien la patogenia y fisiopatología del proceso comprobaréis que sabéis el por qué de casi todos. J. A., P. F., M.C. Soria 14
215 TEMA END-1 CARDIOLOGÍA CMG Factores predisponentes de riesgo medio: Prolapso de Válvula Mitral (PVM) con insuficiencia y engrosamiento valvular. Miocardiopatía hipertrófica. Valvulopatía tricuspídea. Factores predisponentes de riesgo bajo: PVM sin insuficiencia Marcapasos Puentes aortocoronarios Comunicaciones circuitos de baja presión Insuficiencias fisiológicas, sobre todo si es tricuspídea. Cardiopatía isquémica Soplos fisiológicos Se consideran procedimientos predisponentes a la bacteriemia a todos aquellos en los que exista riesgo de sangrado a un ambiente no estéril; es por ello que, generalmente en estos casos, la bacteriemia, y por tanto la E.I., suelen producirse por la flora saprófita típica de la localización en la que se está trabajando. Estos procedimientos pueden ser tanto diagnósticos como terapéuticos; entre ellos, se incluyen los siguientes: Broncoscopia. Cistoscopia durante una ITU (infección del tracto urinario) Biopsia del tracto urinario o de la próstata Procedimientos dentales con riesgo de trauma de la mucosa o de la encía. Adenectomía y amigdalectomía. Dilatación esofágica/escleroterapia. Instrumentación de vía biliar obstruida. Resección transuretral de la próstata. Instrumentación uretral/dilatación. Litotripsia. Procedimientos ginecológicos en presencia de infección. Los microorganismos que con mayor frecuencia producen bacteriemia en función de la localización son. Dentales, orales y óticos: Streptococcus viridans. Urinarios y ginecológicos: Enterococo. Gastrointestinales: Enterococo y Streptococcus bovis. Cirugía cardiaca: Streptococcus viridans y Staphilococcus aureus A grosso modo, podemos decir que el microorganismo procedente de la mitad superior del cuerpo será principalmente S. viridans, mientras que si proviene de la mitad inferior, generalmente se tratará de un microorganismo más agresivo. Ello obliga a una profilaxis distinta en cada caso. Las situaciones extracardiacas asociadas a alto riesgo son difíciles de prevenir y entre ellas se describen las siguientes: Edad avanzada: la capacidad del sistema inmune esta disminuida y suelen presentar lesiones valvulares, por lo menos, degenerativas. Condiciones que promueven el crecimiento de una vegetación no bacteriana. Como ya vimos en el apartado de patogenia y fisiopatología se incluyen en este grupo a los pacientes con cirrosis, neoplasias (leucemias), lupus eritematoso sistémico, tratamiento con esteroides Pacientes con compromiso de la respuesta inmune local o sistémica. Por ejemplo, por aumento de la permeabilidad de la mucosa intestinal en la enfermedad inflamatoria intestinal. Individuos con incremento del riesgo/frecuencia/magnitud de la bacteriemia, como por ejemplo en la disrupción cutánea que sufren pacientes diabéticos o en los grandes quemados, pacientes muy instrumentalizados como los que se someten a diálisis o se encuentran en UCI, los ADVP d) PAUTA DE PROFILAXIS Si el riesgo de bacteriemia se supone que procede de microorganismos alojados en la cavidad bucal, aparato respiratorio o esófago la pauta será: J. A., P. F., M.C. Soria 15
216 TEMA END-1 CARDIOLOGÍA CMG Pauta estándar: amoxicilina (3 gramos, vía oral) 1 hora antes de la manipulación y ½ dosis 6 horas después. Paciente alérgico a penicilina: para estos individuos hay dos opciones: a) Eritromicina (1 gramo, vía oral) 1 hora antes de la manipulación y ½ dosis 6 horas después; o b) Clindamicina (600 miligramos, vía oral) 1 hora antes y ½ dosis 6 horas después. Resumiendo, daremos 1 dosis vía oral 1 hora antes y ½ dosis 6 horas después de amoxicilina, pero si el paciente es alérgico a la penicilina optaremos por eritromicina o clindamicina. Ahora bien, si los procedimientos de riesgo son gastrointestinales o genitourinarios 47 la pauta que indicaremos será: Pauta estándar: ampicilina (2 gramos, vía intravenosa) y gentamicina (1,5 miligramos por kilogramo, vía intravenosa o muscular) 1 hora antes y amoxicilina (1,5 gramos, vía oral) 6 horas después. Paciente alérgico a penicilina: vancomicina (1 gramo, vía intravenosa) y gentamicina (1,5 mg/kg, vía intravenosa o muscular) 1 hora antes y repetir pauta de vancomicina 6 horas después. 2. TRATAMIENTO El tratamiento de las E.I. puede ser de dos tipos: médico o quirúrgico. La mayoría de las endocarditis se tratan médicamente mediante antibióticos, pero en algunos casos las válvulas quedan tan afectadas que es obligatoria la sustitución quirúrgica por una válvula protésica. Como ya hicimos en la profilaxis, vamos a dividir el tratamiento en varios apartados. Diferenciaremos cuando debemos pautar un tratamiento empírico, así como resumiremos algunas generalidades del tratamiento. Por último, veremos los indicadores de respuesta al tratamiento y las indicaciones de tratamiento quirúrgico. 47 El Dr. Soria dijo que la pauta que teníamos que saber es la de microorganismos alojados en la cavidad bucal, aparato respiratorio o esófago. a) ACTITUD URGENTE VS NO URGENTE. Tras demostrar clínica y ecocardiográficamente la E.I debemos actuar terapéuticamente; sin embargo, nuestra actitud inicial se verá condicionada por la situación clínica del paciente. Si el paciente se encuentra en estado séptico, instauraremos un tratamiento empírico urgente que cubra el mayor número de microorganismos causantes de endocarditis de forma más o menos frecuente (por ejemplo, vancomicina, gentamicina y rifampicina). Mientras tanto esperaremos los resultados de los cultivos y una vez que los tengamos, ajustaremos el tratamiento. Si el paciente no está séptico, podemos demorar el tratamiento hasta identificar el microorganismo causante mediante las pruebas de laboratorio. Esta demora suele ser de entre 3 y 7 días, aunque puede variar, sobre todo, si el paciente llevaba tratamiento antibiótico previo. b) PILARES DEL TRATAMIENTO MÉDICO. Siempre debemos dar altas dosis, sobretodo, cuando se trate de un tratamiento empírico. Una vez dispongamos del antibiograma, con las C.M.I., ajustaremos las dosis. El inicio del tratamiento debe ser lo más precoz posible, aunque como ya comentamos, esto vendrá determinado en gran medida por la situación del paciente; si está estable, podemos demorar el tratamiento algún tiempo. La duración del tratamiento será de 4 a 8 semanas. El fundamento de esta duración ya fue comentada con anterioridad. Al carecer la vegetación de vasos, el antibiótico tiene que difundir desde la periferia hacia el interior. Debemos emplear agentes bactericidas, nunca agentes bacteriostáticos. Los bacteriostáticos pueden suprimir la bacteriemia, pero no erradican la infección porque los microorganismos que se alojan en el interior de la vegetación se encuentran en un estado metabólicamente inactivo, sin replicación celular. J. A., P. F., M.C. Soria 16
217 TEMA END-1 CARDIOLOGÍA CMG La vía de administración ha de ser intravenosa (Recientes estudios han demostrado que determinadas formas de E.I. derechas no complicadas por Staphylococcus aureus muestran buena respuesta al tratamiento oral; concretamente, con ciprofloxacino y rifampicina). El tipo de antibiótico y la pauta recomendada es muy variable, tanto si el tratamiento es empírico como si conocemos el microorganismo etiológico. En las guías protocolarias 48 se pueden consultar los antibióticos que debemos administrar en cada caso. c) CRITERIOS DE EVOLUCIÓN FAVORABLE DEL TRATAMIENTO. Básicamente son de dos tipos: a) Descenso de marcadores de infección en sangre como proteína C reactiva (PCR), leucocitos y velocidad de sedimentación glomerular (VSG). La PCR es muy utilizada en la práctica diaria, sin embargo, la VSG, por su lenta respuesta, es poco útil para valorar la evolución a corto plazo; b) Evolución favorable de las vegetaciones 49 evaluada mediante ecocardiografía. Se considera que la evolución es favorable si el tamaño de la vegetación disminuye, o por lo menos, si deja de aumentar. laxis sólo eliminará la bacteriemia, pero nunca la infección cardiaca. El paciente presenta embolias sistémicas graves de repetición (en más de una ocasión). Se considera a una embolia grave cuando el émbolo tiene un tamaño considerable y, por tanto, sus repercusiones también lo son. El paciente presenta signos de insuficiencia cardiaca congestiva (ICC). El paciente presenta fiebre persistente, de más de 8 día, y no mejora con tratamiento médico. El paciente sufre sepsis causada por microorganismos difíciles, como hongos, brucella, coxiella, etc. En pacientes con prótesis se suelen reintervenir quirúrgicamente en casos de E.I. temprana (de menos de 12 meses); en casos de E.I. tardías (de más de 12 meses), por su mejor evolución, muchas veces se puede prescindir de la cirugía. d) INDICACIONES DEL TRATAMIENTO QUIRÚRGICO. El tratamiento quirúrgico consiste en la sustitución valvular por un prótesis. Actualmente se disponen de muchos tipos de prótesis, pero no vamos a entrar a diferenciar cual se emplea en cada situación. Lógicamente, una hora antes del tratamiento, se aplicara profilaxis antibiótica que será en todo caso diferente a la que se emplea en otros tipos de manipulaciones menos agresivas. Las indicaciones para la cirugía se resumen en: El paciente presenta complicaciones intracardiacas como abscesos, fístulas o pseudoaneurimas. En estos casos la profi Que por si alguien todavía no se había enterado, el Dr. Soria volvió a dejar claro que es la l n p _a de la E.I.!!. J. A., P. F., M.C. Soria 17
218
219 HIPERTENSIÓN
220 TEMA HTA-1 CARDIOLOGÍA CMG HIPERTENSIÓN I CONCEPTO, CLÍNICA Y COMPLICACIONES HIPERTENSIÓN ARTERIAL I NTRODUCCIÓN La hipertensión arterial es probablemente el problema de salud pública más importante en los países desarrollados. La HTA es considerada al mismo tiempo una enfermedad y un factor de riesgo cardiovascular (FRCV). Presenta las siguientes características: Elevada frecuencia de presentación (35% de la población adulta en España). Puede cursar asintomática. Posee una alta tasa de complicaciones cardiovasculares (actúa como factor de riesgo de la cardiopatía hipertrófica, cardiopatía isquémica, insuficiencia cardiaca ) encima de 140 / 90 mmhg 1, debida a un aumento del gasto y/o aumento de las resistencias arteriolares periféricas. Su principal característica diferencial es la elevación de la tensión arterial diastólica. 2. Hipertensión sistólica aislada (HTA SA): elevación crónica de la tensión arterial sistólica por encima de 140 mmhg manteniéndose la tensión arterial diastólica por debajo de 90 mmhg. Este aumento aislado de la presión es debido, en la mayoría de los casos (90%), a un aumento de la rigidez de las paredes de las grandes arterias (aorta y grandes vasos), a consecuencia del proceso arteriosclerótico subyacente 2. Su principal característica diferencial es la elevación de la presión diferencial. Actualmente, existen diferentes tipos de clasificación de la HTA. De este modo, el documento de la Sociedad Europea de HTA y Sociedad Europea de Cardiología de 2007 consideran la HTA SD y la HTA SA como diferentes grados de severidad, tal y como se muestra en la siguiente tabla. C LASIFICACIÓN Podemos clasificar la hipertensión arterial en dos grandes grupos: 1. Hipertensión sistólico-diastólica (HTA SD): elevación crónica de la tensión arterial por 1 Ahora mismo se tiende a clasificar como paciente Prehipertenso a aquel que presenta mmhg de sistólica y mmhg de diastólica. 2 Quien quiera sentirse superior, puede recordar el fenómeno de onda reflejada, aquel en el que, debido al aumento de rigidez arterial, la sangre va a ser distribuida con más fuerza en la sístole, en vez de seguir llegando al territorio vascular en diástole. J. A., C. C., M.J.S. Soria 2
221 TEMA HTA-1 CARDIOLOGÍA CMG TAS TAD Optima <120 <80 Normal <130 <85 Normal-Alto Estadio1-Leve Estadio2- Moderado Estadio3- Severa >180 >110 HTA Sistólica aislada 140 <90 E TIOLOGÍA Vamos a distinguir las causas más importantes para cada tipo de HTA. A. HTA SISTÓLICO-DIASTÓLICA Se distinguen dos grupos etiológicos. 1. HIPERTENSIÓN ESENCIAL O IDIOPÁTICA (92-95%) Es el resultado de la interacción entre múltiples factores genéticos y ambientales 3 2. HIPERTENSIÓN SECUNDARIA A OTRA PATOLOGÍA (5-8%) En este caso se clasifica en función del órgano afectado en: 4 1. Renal: 1.1 Parenquimatosa (p.e: HTA secundaria a IR) 1.2 Renovascular (p.e: HTA secundaria a estenosis de arteria renal) 2. Endocrina: 2.1 Adrenal: cortical (HTA secundaria a síndrome de Cushing o síndrome de Cohn) o medular (Feocromocitoma) 2.2 Consumo de hormonas exógenas: estrógenos, mineralcorticoides, glucocorticoides 2.3 Otros: hipo e hipertiroidismo, hiperparatiroidismo 3. Cardiovascular: Miocardiopatía congénita, como la Coartación aórtica. 4. Neurogénica: Tal y como ocurre en el SAOS... B. HTA SISTÓLICA AISLADA 1. Aortoesclerosis Rigidez aumentada de la aorta y grandes arterias. Es con mucho la etiología más frecuente, sobre todo, en ancianos (aproximadamente el 90% de la HTA-SA en ancianos obedece a esta etiología) 5. Actualmente, se acepta que en el mecanismo etiológico intervienen varios factores (edad, factores de riesgo cardiovasculares, HTA SD de larga evolución ) que, conjuntamente, aumentan la rigidez de la aorta. 3 Entre los factores ambientales con más peso, podemos destacar la sensibilidad a la sal, la cantidad de renina sintetizada por el paciente o la resistencia a la insulina. 4 Clasificación simplemente nombrada y dada con errores graves. Este es el resultado de intentar compilar lo que se dio en clase con algo de coherencia 5 El factor más importante para que se dé la hipertensión sistólica aislada es la edad, ya que, a más edad, más tiempo de evolución de arterioesclerosis y mayor rigidez van a poseer las paredes arteriales (y a consecuencia más aumentará la presión sistólica). J. A., C. C., M.J.S. Soria 3
222 TEMA HTA-1 CARDIOLOGÍA CMG 2. Situaciones de aumento del gasto cardiaco Esta etiología es mucho menos frecuente (aproximadamente un 10%). Encontramos HTA SA por este mecanismo en insuficiencia aórtica, tirotoxicosis, fístulas arteriovenosas, déficit vitamínico (p.e: Beriberi ). RETINIANAS RENAL VASCULARES Retinopatía hipertensiva Disfunción hipertensiva Arteriopatía periférica Aneurisma de aorta Disección aórtica. renal C LÍNICA HTA ESENCIAL Puede diferenciarse en: NO COMPLICADA No produce síntomas. Es por ello que se hace obligatorio la toma sistemática de la TA a todos los pacientes en consulta. Por supuesto, debemos extremar la vigilancia en pacientes pertenecientes a grupos de riesgo. COMPLICADA Produce síntomas y signos derivados de la afectación de órganos diana (Tabla: Complicaciones de la HTA). COMPLICACIONES DE LA HTA Cardiopatía isquémica CARDIACAS (CI): 6 Hipertrofia ventricular izquierda (HVI) 7 Insuficiencia cardiaca (IC) 8 CEREBRALES ACV aterotrombótico y hemorrágico Leucoaraiosis e infartos lacunares 6 La HTA actúa como FR, no produciendo CI si la HTA aparece aislada 7 También denominada Cardiopatía hipertensiva. 8 Tanto la CI como la HVI evolucionan hacia ella. HTA SECUNDARIA Encontraremos, principalmente, los síntomas y signos derivados de la enfermedad subyacente D IAGNÓSTICO 1. DE LA PROPIA HTA Para detectar la hipertensión esencial no complicada, debemos realizar tomas sistemáticas de la presión sanguínea. En personas sanas, no deben pasar más de dos años sin medir la presión arterial. En el caso de encontrarnos frente a la forma complicada, podremos diagnosticarla detectando síntomas por afectación de órganos diana. Debemos buscar la forma y grado de afectación de estos órganos mediante métodos diagnósticos complementarios. 2. DE LAS COMPLICACIONES DE LA HTA Ante un paciente con HTA, debemos preguntarnos siempre: hay daño de órgano diana? Para poder responder correctamente a esta pregunta debemos seguir los siguientes pasos: J. A., C. C., M.J.S. Soria 4
223 TEMA HTA-1 CARDIOLOGÍA CMG Realizar una buena historia clínica (HC) 9, contemplando los signos y síntomas de cada forma de afectación concreta. Realizar una analítica dirigida (AD), encaminada al despistaje de algunas causas, principalmente las renales. Realizar exploraciones complementarias (EC). Esto es más costoso, por lo que no se podrá realizar a todos los pacientes 10, normalmente haremos uso de ellas en base a sospecha por las anteriores! Siempre se debe mantener un alto índice de sospecha, lo que conllevará un uso frecuente de exploraciones complementarias INDICACIONES DE EXPLORACIÓN DE FONDO DE OJO No esperar a la aparición de síntomas para realizar diagnóstico. Se recomienda chequeo rutinario cada dos años a todos los hipertensos. Si la HTA se asocia a diabetes o se trata de una hipertensión mal controlada, hay que realizar chequeos cada año. Sólo grados III y IV de la clasificación de Ketith-Wagener (hemorragias, exudados ) son pronósticamente informativos DX DE LA RETINOPATÍA HIPERTENSIVA DX DE LA NEFROPATÍA HIPERTENSIVA (NEFROANGIOESCLEROSIS) En este caso, la analítica no tiene ningún valor diagnóstico, y la historia clínica tampoco es muy relevante (en un 20% podemos encontrarnos con alguna manifestación). Por tanto, el diagnóstico se realiza principalmente por medio de técnicas complementarias (suponen un 80% de los casos Valor diagnóstico HC (20%) AD (0%) EC (80%) diagnosticados). En este caso se realiza la exploración del fondo de ojo, la oftalmoscopia directa. Desde aquí, hago un llamamiento para que le echéis un ojo al trabajo de mis compañeros comisionistas de oftalmología. En la clase del 30 de octubre viene bien explicada esta patología. El término nefroangioesclerosis suele aplicarse a la enfermedad renal que complica la hipertensión arterial esencial y que bajo el punto de vista morfológico se caracteriza por una afectación principal en la microvasculatura preglomerular. Probablemente, esta enfermedad es la expresión a nivel renal de la aterosclerosis que afecta a otros territorios vasculares. Nuevamente, la historia clínica nos va a ayudar muy poco (un 5% de los casos se captan por la historia). La analítica sí que nos ayuda (un 80% del total es detectable por analítica). Una vez detectada la afectación renal por medio de la analítica (función renal y examen de orina), Valor diagnóstico HC (5%) AD (80%) EC (15%) haremos uso de las exploraciones complementarias para determinar el grado de afectación renal. 9 El color se corresponde con las gráficas de valor diagnóstico que acompaña a cada una de las complicaciones. 10 Pero si lo hiciéramos, dice el profesor Soria que, hasta en los que aparentemente están sanos encontraríamos daño de órganos diana J. A., C. C., M.J.S. Soria 5
224 TEMA HTA-1 CARDIOLOGÍA CMG ESTADIOS DE AFECTACIÓN RENAL Y CARACTERÍSTICAS Microalbuminuria ( mg/24h); ó ESTADIO Hiperuricemia; ó INICIAL (*) Disminución insospechada del aclaramiento (65-80 ml/min). Macroalbuminuria (>300 mg/24h); ó ESTADIO Insuficiencia Renal AVANZANDO (Aclaramiento < 65 ml/min); ó Creatinina elevada: hombres >1,5 y mujeres > 1,4 (**) (*) Para situar a un paciente en uno u otro estadio deberá cumplir una o más características del mismo. Lógicamente, si cumple cualquiera del estadio avanzado pertenecerá a éste, aunque cumpla también otras del estadio inicial (**) Esta última condición debe ser estudiada meticulosamente pues recordemos que la creatinina va a depender mucho de diversos factores, aumentando con la masa muscular del individuo, el deporte que practica, etc. disponibles en todos los centros, debemos de extraer la máxima información de la historia clínica. Por otro lado, la analítica carece de valor. También podemos realizar tests psicotécnicos para valorar el grado de actividad mental. La encefalopatía consiste en el siguiente complejo sintomático: hipertensión grave, alteración de la conciencia, aumento de la presión intracraneal, retinopatía con edema de papila y convulsiones. No se conoce bien su patogenia. No obstante, la clínica de los pacientes dependerá del calibre de los vasos afectados. La clínica va a variar desde pacientes asintomáticos hasta otros con demencia: Pacientes asintomáticos Sólo tendrán síntomas sutiles como insomnio, pesadillas, dificultad de concentración y para recordar... pero, nada específico. En este grupo también se introduce un porcentaje de pacientes con lesiones más graves, pero que, simplemente, se manifiestan sin sus síntomas graves característicos. Pacientes con síntomas focales DX DE LA ENCEFALOPATÍA VASCULAR HIPERTENSIVA Las cefaleas occipitales, más frecuentes por la mañana, son uno de los síntomas precoces más notables de la hipertensión. También pueden observarse mareos, inestabilidad, vértigo, tinnitus, alteraciones visuales y síncope, pero las manifestaciones más graves se deben a oclusión vascular, hemorragias o encefalopatías. Estos aparecen por afectación de pequeñas arterias y dan lugar a: Infartos lacunares Leucoaraiosis Microhemorragias Pacientes con demencia A consecuencia del daño en grandes troncos arteriales, que puede conducir a: Para el diagnóstico de la afectación cerebral las pruebas complementarias son las de mayor utilidad; sin embargo, dado que las técnicas son muy costosas y no se encuentran Valor diagnóstico HC (30%) AD (0%) EC (70%) Infarto cerebral clásico Hemorragia cerebral! Es muy importante recordar la alta prevalencia (10-20%) de lesiones que cursan de forma asíntomática o con síntomas sutiles o poco específicos (como disminución de la concentración, insomnio ). J. A., C. C., M.J.S. Soria 6
225 TEMA HTA-1 CARDIOLOGÍA CMG En la tabla del Anexo I tenemos las causas de los síntomas anteriormente nombrados, brevemente explicadas. Respecto a las pruebas complementarias, dependiendo de que se trate de patología crónica o aguda realizaremos unas pruebas u otras: TAC: dada la menor sensibilidad del TAC este tiende a utilizarse para explorar las manifestaciones crónicas (ACV clásico), es decir, conocidas. A. Engrosamiento del complejo íntimamedia carotídeo. El grosor del complejo íntima-media se utiliza como indicador del nivel de afectación vascular de la HTA. Se considera normal, cuando su grosor, es menor de 9 mm. Como vemos en la figura HTA1-1, mediante una ecografía vascular se puede determinar fielmente el grosor del complejo íntima-media. RNM: la RNM se utiliza para el diagnóstico de lesiones silentes, o sea, lesiones nuevas o sospechadas sin aparición previa (infartos lacunares). Como ya hemos mencionado, estas pruebas aportan información muy útil, pero tienen escasa disponibilidad para su aplicación a gran escala, además de ser métodos caros. Por esto, sólo haremos uso de ellas cuando se trate de un paciente con disfunción cognitiva, o pérdida de memoria o MMSE 11 menor a 24. Figura HTA1-1 AFECTACIÓN CARDIACA EN HTA La HTA va a producir, sobre todo, Cardiopatía hipertensiva y Cardiopatía isquémica. Como las vamos a ver con detenimiento más adelante, no la explicamos aquí. DIAGNÓSTICO DE LA VASCULOPATÍA HIPERTENSIVA Hay distintas formas de afectación, y dependiendo de éstas haremos uso de una u otra prueba complementaria para su diagnóstico. A continuación vamos a nombrar las alteraciones más frecuentes: 11 Mini mental state examination (Mini examen del estado mental): permite determinar el grado del estado cognoscitivo del paciente y poder detectar demencia o delirium. Se considera normal un resultado igual o mayor a 27 puntos. B. Aterosclerosis carotidea La ateroesclerosis carotídea consiste en placas cálcico-lipídicas en la pared vascular cuyo crecimiento limita el paso de sangre, lo que produce turbulencias en el torrente sanguíneo tras atravesar la estrechez. Esto se traduce en la clínica en los soplos carotídeos, pudiendo detectar en la exploración fremito al palpar el cuello. El diagnóstico también se realiza por eco vascular. C. Aneurisma aórtico Un aneurisma se define como una dilatación patológica de un segmento de vaso sanguíneo, en este caso, de la aorta. La entidad anatomopatológica que se asocia con más frecuencia a aneurismas aórticos es la aterosclerosis. Por esto, el aneurisma es considerado una complicación de la HTA, en tanto en cuanto ésta favorece el proceso aterosclerótico. J. A., C. C., M.J.S. Soria 7
226 TEMA HTA-1 CARDIOLOGÍA CMG Los aneurismas de aorta son una complicación muy grave, aunque no producen casi nunca síntomas. Sin embargo a medida que se expanden pueden producir dolor. Los aneurismas en la aorta abdominal suelen detectarse durante una exploración de rutina como una masa palpable, pulsátil y no dolorosa. El diagnóstico de aneurisma se puede realizar por ecografía, radiografía de tórax, TC o RNM; es decir, casi cualquier técnica de imagen. D. Disección aórtica La disección aórtica se debe al desgarro circunferencial o, con menor frecuencia, transversal de la íntima, habitualmente en la pared lateral derecha de la aorta ascendente donde es mayor la fricción hidráulica. El diagnóstico es similar al del aneurisma. Sí se produce una obstrucción completa y aguda (isquemia aguda) la clínica suele ser más intensa (dolor muy intenso, frialdad y palidez de miembros inferiores y ausencia de pulsos) Una exploración sencilla y poco invasiva que nos permite valorar la arteriopatia periférica es el Indice Tobillo-Brazo (ITB). Ampliación de contenido de interés. El ITB es el resultado de dividir la presión arterial sistólica (PAS) de cada tobillo (se escogerá el valor más alto entre la arteria pedia y la tibial posterior) entre el valor de la PAS más alto de cualquiera de las arterias braquiales. Así se obtienen dos valores de ITB, uno para cada miembro inferior, seleccionando como definitivo el más bajo de los dos. La técnica se realiza en unos 20 minutos y sólo se precisa un esfigmomanómetro y un Doppler portátil con sonda de 8 Mhz. Se considera un ITB normal cuando su valor se encuentra entre 0,9 y 1,3. Si es menor a 0,9 se considera patológico e indica un endurecimientoengrosamiento de la pared en las arterias de los miembros inferiores; siendo una de las posibles causas la arterioesclerosis.. FIN DEL CONTENIDO AMPLIADO Sin embargo, las exploraciones que más información aportan para el diagnóstico son la ecografía, la angiorm y angiotc. Figura HTA1-2 E. Arteriopatia periférica La HTA actúa como factor de riesgo de la arterioesclerosis en las arterias periféricas (arteriopatía periférica). Se da, sobretodo, en las arterias de los miembros inferiores. El síntoma más característico es la claudicación intermitente, es decir, el dolor muscular, agudo e intenso, que se produce al andar o caminar en miembros inferiores y que cesa al parar. Se debe a la disminución del aporte sanguíneo a los músculos cuando éstos aumentan la demanda; consecuencia, de la estrechez arterioesclerótica de las arterias. F. Disfunción endotelial Las células endoteliales son células metabólicamente muy activas que participan activamente en la homeostasis. El estrés hemodinámico al que se ven sometidas durante el proceso hipertensivo altera de manera significativa sus diferentes funciones. El diagnóstico de esta situación se lleva a cabo por ecografía vascular y pletismografia. La pletismografía es una técnica diagnóstica que consiste en determinar las variaciones del flujo sanguíneo en una arteria o vena mediante el uso de un pletismógrafo. J. A., C. C., M.J.S. Soria 8
227 TEMA HTA-1 CARDIOLOGÍA CMG G. Disminución de la distensibilidad de grandes vasos (aumento de la rigidez vascular) Diferentes procesos estimulados por la HTA conllevan un aumento progresivo de la rigidez de los vasos. Este hecho conlleva que la presión sistólica vaya aumentando de un modo progresivo, al mismo tiempo que la presión diastólica va disminuyendo. El resultado es un aumento de la presión de pulso por incremento de la presión diferencial (Pdiferencial = Psistólica P diastólica). Vemos como una HTA-SD puede evolucionar a una HTA-SA. La exploración complementaria que nos va a ayudar al diagnóstico va a ser la ecografía vascular. J. A., C. C., M.J.S. Soria 9
228 TEMA HTA-1 CARDIOLOGÍA CMG ANEXO I FISIOPATOLOGÍA DE LAS FORMAS DE PRESENTACIÓN DE LA AFECTACIÓN CEREBRAL HIPERTENSIVA 1) AFECTACIÓN DE VASOS DE PEQUEÑO CALIBRE (INTRACRANEALES) Infartos lacunares La HTA produce microateromatosis 12 y lipohialinosis 13 de pequeños vasos cerebrales y al quedar ocluidos se producen pequeños infartos isquémicos. Se van a ver como apolillamiento o pequeñas cavidades en los ganglios basales principalmente 14. Estas lesiones poseen un marcado efecto acumulativo, es decir, que van a ir afectando al paciente progresivamente según van apareciendo. Leucoaraiosis Microhemorragias Consiste en una degeneración de la sustancia blanca debido a una isquemia crónica. El mecanismo fisiopatológico seria similar al del infarto. La HTA produce necrosis fibrinoide de pequeños vasos. La mayor debilidad de la pared los vasos propicia la aparición de microaneurismas 15 que pueden romperse con facilidad. 2) AFECTACIÓN DE VASOS DE GRAN CALIBRE (EXTRA e INTRACRANEALES) Infarto cerebral Clásico y hemorragia cerebral Infarto cerebral clásico: la hipertensión facilita la ateromatosis arterial (afectación arteria grande, intra- o extracraneal), que puede dar lugar al ictus, ya sea por estenosis-oclusión arterial, por fenómenos embólicos... Hemorragia cerebral: por ruptura arterial (microaneurismas y necrosis fibrinoide). 12 La microateromatosis es el depósito de placas de ateroma en territorio vascular cerebral. 13 La hipohialinosis es el depósito de material hialino, que también va a obstruir vasos cerebrales. 14 Otras disposiciones frecuentes son la protuberancia y la rama posterior de la cápsula interna. 15 De Charcot-Bouchard, en el que se va a producir una degeneración hialina de la pared arterial y defectos en la capa media vascular. (Concepto de AP, campeones). J. A., C. C., M.J.S. Soria 10
229 TEMA HTA-2 CARDIOLOGÍA CMG HIPERTENSIÓN II EVALUACIÓN DIAGNÓSTICA INTRODUCCIÓN Una vez realizado el diagnóstico de HTA a un paciente, qué debemos hacer? 1. Lo primero es descartar que la HTA sea secundaria, ya que ésta tiene una causa reconocible y por tanto podremos tratar y resolver la HTA. 2. Después, debemos estimar el riesgo global para este paciente, que es lo que más nos interesa. Ahora bien, cómo valoramos este riesgo? En pacientes con HTA esencial debemos: Valorar factores de riesgo asociados (ya que raramente la HTA se presenta de forma aislada) Valorar en qué medida existe daño o afectación de órganos diana. 1 DESCARTAR HTA SECUNDARIA. Para descartar la HTA secundaria, en primer lugar utilizaremos los datos que obtenemos de la historia clínica y de la exploración física. Aquellos datos 1 que nos orientan hacia el diagnóstico de HTA secundaria son: 1. HTA severa; porque generalmente las HTA primarias no suelen ser severas. 2. HTA de inicio muy precoz (antes de los 18 años) o muy tardío (después de los 55 años). 3. Cambio brusco o anormal del grado de HTA sin motivo aparente. 4. Resistencia a tratamiento adecuado. 5. Insuficiencia renal tras exposición a IECAs Soplo abdominal; pues también sería sugestivo de estenosis de arteria renal. 3. Por último, hay que estimar la comorbilidad. Por ejemplo, si el paciente sufre asma bronquial, no podremos dar cierto tipo de medicación para tratar la HTA (como es el caso de los betabloqueantes). En los siguientes apartados detallaremos cómo vamos a llevar a cabo cada uno de estos tres objetivos. 1 Son pistas, como las llamó el profesor Soria. 2 El desarrollo de insuficiencia renal aguda en el curso de tratamiento con IECAs es altamente sugestivo pero no específico de estenosis de arteria renal. La estenosis de la/s arteria/s renal/es es una causa conocida de HTA. Quizás sea menos conocido que es una causa importante de insuficiencia renal crónica, incluso de insuficiencia renal terminal. Nos encontraríamos en este caso ante una HTA asociada a nefropatía isquémica. Esquema HTA2-1 J. A., M.C., P.F. Soria 1
230 Los datos de máxima utilidad para descartar la causa secundaria de HTA son fundamentalmente: la determinación de creatinina (para descartar la HTA secundaria a insuficiencia renal) y el potasio (para descartar la HTA secundaria a hiperaldosteronismo) 4. Esquema HTA2-1 Seguidamente, emplearemos una analítica básica en la que deben ser rutinarios los siguientes datos: o Glucosa en ayunas Esquema HTA2-2 o o o o o o o o Colesterol total HDL-Colesterol Trigliceridos en ayunas Ácido úrico Creatinina Potasio Hb/Hto Sedimento urinario y detección rápida de proteinuria 3. Tras realizar la analítica, deberemos prestar atención a las pistas o datos clínicos. En el siguiente esquema se resumen algunas pistas sugerentes de HTA secundaria, la posible causa y las pruebas a realizar para descartar dicha etiología. En caso de que la historia clínica, la analítica y la exploración física aporten indicios de HTA secundaria, procederemos a las determinaciones analíticas y pruebas complementarias pertinentes. Sí no encontramos nada sugerente de HTA secundaria, pensaremos que se trata de HTA esencial. 3 La prueba de detección rápida de proteinuria o dipstick consiste en sumergir en la orina una tira reactiva. El inconveniente de esta prueba es que solo detecta macroalbuminuria, es decir, más de 300 mg de albumina en 24 horas. Por ello, si el dipstick es negativo debemos cuantificar la albuminuria por laboratorio para discriminar albuminurias de 30 a 300 mg/24 h. 4 Se sobreentiende que, en caso de HTA secundaria a insuficiencia renal, detectamos el nivel de creatinina elevado; por otra parte, en la HTA por hiperaldosteronismo apreciamos hipopotasemia. J. A., M.C., P.F. Soria 2
231 Esquema HTA2-3 2 ESTIMAR RIESGO GLOBAL (RG) Estimaremos el riesgo global en función de los factores de riesgo asociados y del grado de afectación de los órganos diana que exista. A) ESTIMACIÓN DEL RG EN FUNCIÓN DE LOS FR ASOCIADOS: FR clásicos 5. Tabaco 6. Diabetes mellitus 6 FR de nueva incorporación 7. Obesidad abdominal: Perímetro cintura >102 cm en hombres e >88 en mujeres. 8. Proteína C Reactiva de alta sensibilidad (PCR-hs 7 ) 1mg/dL. 1. Nivel de presión arterial 2. Edad: >55 años en hombres e >65 años en mujeres 3. Colesterol 5 Total >250 mg/dl; LDL-C >155 mg/dl y/o HDL-C <40 mg/dl en hombres e <48 mg/dl en mujeres 4. Antecedentes familiares: deben darse en familiares de 1 er orden y, además, la HTA debió comenzar a la misma edad Esquema HTA2-4 5 En el caso de que se encuentren elevados (o disminuido en el caso de la HDL) todos los valores, cuentan como un solo factor de riesgo, no como 3. 6 Es el FR más determinante. 7 High sensitivity. Actualmente, la PCR-hs no se valora rutinariamente. J. A., M.C., P.F. Soria 3
232 B) VALORACIÓN DEL RG EN FUNCIÓN DEL DAÑO/AFECTACIÓN DE ÓRGANOS DIANA: Las pruebas de estudio que emplearemos pueden agruparse en: 1. Rutinarias: historia clínica, exploración física, ECG y analítica de sangre y orina. 2. Recomendadas: ecocardiograma, ecografía de carótidas, fondo de ojo, detección de microalbuminuria. Si tras realizar las pruebas citadas (o alguna de ellas), tenemos sospecha (o demostración) de la existencia de daño en órgano/s, pasaremos al siguiente escalón diagnóstico: las exploraciones dirigidas. Para sistematizarlas, las agruparemos en función del órgano que principalmente estudian. 1. Corazón: ergometria o prueba de esfuerzo, técnicas de istopía, coronariografía, etc. 2. Cerebro: TC, RMN, ecografía, angiografía, etc. 3. Riñón: ECO-Doppler, técnicas de isotopía, arteriografía, biopsia, etc. 4. Vasos periféricos: ECO-Doppler, arteriografía, etc. Antes de continuar, debemos aclarar la diferencia entre daño de órgano diana y afectación del mismo. Hablaremos de DAÑO cuando las alteraciones en el órgano diana sean leves e indiquen el inicio de un proceso patológico. Del mismo modo, hablaremos de AFECTA- CIÓN cuando esas alteraciones sí supongan la presencia de enfermedad. Ahora podemos comprender cuáles son los datos que nos orientan hacia daño de órgano diana y cuáles hacia afectación de órgano diana. Datos que nos orientan hacia DAÑO de órgano diana : a) Hipertrofia ventricular izquierda, diagnosticada mediante ECG o ECO b) Microalbuminuria ( mg/24h) c) Creatinina elevada 8. Consideraremos, en este caso, que la creatinina está elevada cuando los valores se encuentren en 1,3 1,5 mg/dl, en hombres; y 1,2 1,4 mg/dl en mujeres. d) Aterosclerosis carotídea ó GIM 9 > 0,9 mm Datos que nos orientan hacia AFECTACIÓN de órgano diana : a) Enfermedad cerebrovascular. Sí el paciente ha sufrido ACV isquémico, AIT 10, hemorragia cerebral... b) Cardiopatía. Si ha padecido infarto de miocardio, angina de pecho, insuficiencia cardiaca; o se le ha realizado una revascularización previa. 8 En este caso la medición de la Creatinina debe de valorarse con cuidado, puesto que lo que esperamos es que la creatinina esté sensiblemente elevada, dado que una elevación muy intensa indicaría fallo renal primario, y no una afectación renal secundaria a la HTA. Por otro lado, sabemos de sobra que la creatinina puede verse incrementada fisiológicamente en individuos jóvenes, con mucha masa muscular... Cuidadín cuidadín con lo que valoramos puesto que... A. No le vayamos a decir a un deportista que tiene ya daño de órgano diana... o... B. No vayamos a pensar que un anciano chuchurrío está perfecto, argumentando que su elevación de la creatinina es debida a su gran masa muscular, de ir del sofá a la cama y de la cama al sofá... 9 Grosor Íntima Media o GIM: A la presencia, en la imagen ultrasonográfica, de 2 líneas ecodensas en la pared posterior arterial, se le denominó Patrón Doble Línea. A partir de este trabajo aparecieron otros que medían entre el inicio del borde delantero de la primera línea ecodensa y el borde delantero de la segunda línea, a esto se le denominó grosor íntima media (GIM), y se encontró que se relacionaba de manera proporcional con diferentes fases de desarrollo de aterosclerosis. Rev Cub Med 2003;42(3). Instituto de Cardiología y Cirugía Cardiovascular 10 Accidente Isquémico Transitorio J. A., M.C., P.F. Soria 4
233 c) Enfermedad Renal. En caso de que exista nefropatía, creatinina elevada (H> 1,5; M> 1,4) y/o macroalbuminuria (> 300 mg/24h) d) Retinopatía grado III o IV 11 e) Enfermedad Vascular periférica (EVP). Su manifestación más típica la claudicación intermitente. Independientemente de la tensión arterial del enfermo, si éste tiene afectación en órgano diana se le considera de alto riesgo. Resumiendo, para la evaluación diagnóstica del grado de hipertensión, además de los niveles de TA, hay que considerar: 1. El daño y afectación de órgano/s diana 2. Que la DM se valora como 3 factores de riesgo de los clásicos. 3. Que 3 factores de riesgo implican daño de órgano diana Una vez comprendido todo lo anteriormente expuesto, podremos comprender cómo las siguientes tablas nos ayudan a encuadrar a los pacientes según su grupo de riesgo. En función del riesgo de cada paciente, el tratamiento a seguir será distinto, pero este punto se tratará en el siguiente tema. Esquema HTA2-5 3 VALORACIÓN DE LA COMORBILI- DAD La valoración de la comorbilidad queda fuera del temario de esta asignatura. 11 Recordad: exudados, hemorragias, edema de papila... J. A., M.C., P.F. Soria 5
234
235 TEMA HTA-3 CARDIOLOGÍA CMG HIPERTENSIÓN III TRATAMIENTO INTRODUCCIÓN El principal objetivo del tratamiento de la HTA es evitar las complicaciones cardiovasculares, tanto las producidas directamente por la propia HTA como las secundarias al proceso de ateromatosis. La terapia aumenta significativamente la expectativa de vida del hipertenso, acercándola incluso a la del normotenso. En el paciente con daño orgánico establecido se podrá lograr atenuar o, incluso, revertir las lesiones. El tratamiento de la HTA se divide en dos bloques: el tratamiento no farmacológico y el farmacológico. Veremos a continuación cada uno de ellos de forma detallada. TRATAMIENTO TRATAMIENTO NO FARMACOLÓGICO Este tratamiento, fundamentado en medidas de tipo dietéticas y de cambios de estilo de vida, debe realizarse siempre en todos los pacientes hipertensos, incluso en el paciente con HTA normal-alta, hipertensos ocasionales e hipertensos en etapa inicial 1. Estas medidas consiguen reducir las cifras de tensión arterial, de modo que, en casos de hipertensiones leves, son suficientes 1 Se ha demostrado que en hipertensos en etapa 1 la terapia no farmacológica logra la disminución de 9 mmhg en ambas presiones. como tratamiento y evitan al paciente la toma de fármacos. En las hipertensiones más severas, actúan de manera sinérgica con los fármacos, permitiendo reducir la dosis de los mismos. Además, algunas de estas medidas son también eficaces para reducir otros factores de riesgo cardiovascular. Las medidas higiénico-dietéticas incluidas en este tratamiento son: 1. Reducción de peso. 2. Reducción consumo de alcohol. 3. Restricción de sal Ejercicio aeróbico regular. 5. Ingesta elevada de potasio y calcio. 6. Alivio del estrés, evitar tensiones innecesarias. 7. Restricción de grasas saturadas y colesterol. 8. Evitar tabaco. Las dos últimas medidas se consideran beneficiosas para el paciente hipertenso, aunque no reducen la TA per se, sino que su fin es evitar la aparición de factores de riesgo. 2 Como sabemos, esto no siempre ayuda a reducir la TA, dado el importante porcentaje de personas no sal sensibles. No obstante, en principio puede ser necesario indicarlo a los pacientes, para más adelante observar si se rebajan las cifras de TA. J. A., P.F., M.C. Soria 1
236 TEMA HTA-3 CARDIOLOGÍA CMG TRATAMIENTO FARMACOLÓGICO La primera pregunta que debemos plantearnos es, A qué pacientes debemos aplicar un tratamiento farmacológico? Hipertensos con riesgo alto/muy alto. El tratamiento farmacológico será expeditivo, esto es, urgente. Hipertensos con riesgo intermedio. Generalmente en la práctica clínica se instaurará tratamiento farmacológico, siempre teniendo en cuenta las cifras de TA y los FRCV. reducción tampoco puede ser muy lenta, porque es peligroso que los niveles de TA se mantengan tanto tiempo elevados. El objetivo es devolver la curva de autorregulación de la TA a la normalidad en un plazo de semanas a unos pocos meses. Tratamientos individualizados, que deben ser en función de la TA y del daño de órganos diana. Objetivos de presión arterial a alcanzar: Hipertensos con riesgo bajo. Se decidirá tratamiento farmacológico si tras un periodo de 6-12 meses de terapia no farmacológica y monitorización de la TA y de los FRCV, el paciente continúa con cifras de TA por encima de 140/90 mmhg. Si rebaja sus cifras, continuaremos con la monitorización. Los diferentes fármacos utilizados suelen actuar mediante alguno de los siguientes mecanismos de acción: A Reducción de la volemia (p.e., los diuréticos) B Reducción del tono simpático (p.e., los betabloqueantes) C Reducción de las resistencias periféricas vasculares (p.e.; los calcioantagonistas). Duración del tratamiento. A priori es indefinido, aunque en hipertensos leves, tras 1 año de excelente control (TA < 120/70), es posible disminuir lentamente el tratamiento, vigilando siempre las posibles recidivas. Esto será posible, sobre todo, en pacientes con drásticos cambios en el estilo de vida y peso corporal; además, siempre se mantendrán (o incluso se reforzarán) las medidas no farmacológicas. Lo más importante es bajar la tensión arterial; con qué lo hagamos es secundario 3 Como todos los fármacos, éstos también tienen efectos colaterales, que podrán ser más o menos graves dependiendo del daño orgánico del paciente, de sus trastornos metabólicos, de sus enfermedades asociadas así como de sus características particulares. Todo ello justifica que el tratamiento debe ser siempre individualizado. NORMAS GENERALES DEL TRATAMIEN- TO FARMACOLÓGICO Reducción gradual y progresiva de la TA. No debemos reducir la TA de forma brusca, porque el paciente tiene su propia autorregulación. Sin embargo, al mismo tiempo, la 3 Esta sentencia es cierta siempre y cuando no tengamos afectación de órgano diana. J. A., P.F., M.C. Soria 2
237 TEMA HTA-3 CARDIOLOGÍA CMG FÁRMACOS DISPONIBLES 4 4,5 5,6 6,7 7,8 8,9 9 En pacientes sin daño ni afectación de órgano diana, se puede usar cualquiera de los dos tipos de fármacos (clásicos 10 o modernos). La elección de uno u otro dependerá de cada especialista. En pacientes con daño o con afectación de órgano diana, habrá que tener en cuenta indicaciones específicas. 4 También hay un tipo de fármacos clásicos que ya casi no se usa: los simpaticolíticos de acción central. De entre ellos destacamos los Imidazolínicos como el Moxón Pero esto no se nombró en clase. 5 Los diuréticos también ejercen efecto vasodilatador. Esto explica por qué conservan su acción antihipertensiva a pesar de haber perdido su efecto diurético 6 Los betabloqueantes bloquean la renina, que es la enzima encargada de transformar el angiotensinógeno en angiotensina I. La enzima convertidora de angiotensina (ECA) transforma la angiotensina I en angiotensina II. La angiotensina II ejerce su efecto actuando sobre los receptores de angiotensina II, de los que existen dos tipos, AT1 y AT2. Vemos como los betabloqueantes, IECAs y ARAII actúan sobre diferentes puntos de una misma vía fisiológica, por lo que su efecto final es común (inhibir los efectos del eje). 7 La ECA rompe las BKs (bradiquininas), que son potentes vasodilatadores. Al inhibirse a la ECA, se produce un aumento de las BKs, y, por tanto, un fuerte estímulo vasodilatador. 8 Concretamente, son antagonistas de los receptores de angiotensina II tipo I (AT1) 9 Al bloquearse el receptor alfa1 vascular (postsináptico) se produce vasodilatación. Además, disminuyen los triglicéridos, lo cual es beneficioso. 10 Aunque ahora, el uso de beta bloqueantes está siendo cuestionado. J. A., P.F., M.C. Soria 3
238 TEMA HTA-3 CARDIOLOGÍA CMG ESCALONES DEL TRATAMIENTO En el tratamiento de la HTA se habla de 4 escalones del tratamiento. Los escalones del tratamiento son los diferentes estadios de tratamiento que vamos a ir recorriendo con cada paciente. Empezaremos por el primero y, si con éste no obtenemos los resultados deseados, pasaremos al siguiente, y así sucesivamente. # PRIMER ESCALÓN A la hora de iniciar el tratamiento de un hipertenso nos podemos plantear la siguiente cuestión; qué es mejor? monoterapia (un solo fármaco) a dosis moderadas, o la asociación de dos fármacos a dosis más bajas? Antiguamente se tendía a la monoterapia, pero ahora se recomienda la asociación de dos fármacos porque la TA se disminuye más lentamente. La asociación está especialmente indicada cuando la TA sobrepasa el nivel diana (nivel tensional que queremos alcanzar) en mmhg. Si elegimos monoterapia, debemos tener en cuenta: de asa), ya sea de acción prolongada, o bien requiera dosis repetidas. Si hay insuficiencia renal (creatinina mayor de 1,7 1,8 mg/dl o ClCr < 30 ml/min/m 2 ), sólo podremos usar diuréticos de asa, puesto que los otros son ineficaces o incluso pueden llegar a ser peligrosos. VALORACIÓN DEL EFECTO DEL PRIMER ES- CALÓN DEL TRATAMIENTO Tras haber fijado los objetivos tensionales a alcanzar, podemos encontrarnos ante las siguientes situaciones: a) Respuesta adecuada: es la que esperábamos y, por tanto, nos quedaremos en este escalón. b) Ausencia de respuesta. c) Respuesta insuficiente. d) Aparición de efectos secundarios. Qué hacer en los tres últimos casos? Pasaremos al segundo escalón del tratamiento. Cualquier fármaco es válido, salvo alfa bloqueantes (doxazosina), que sólo se indican para asociación. Todos tienen un efecto neto global similar sobre TA. Valorar presencia de indicaciones o contraindicaciones especiales (ver tabla subyacente 11 ). Valorar comorbilidades cardiovasculares y no cardiovasculares. Si decidimos prescribir un diurético (de primera línea en el tratamiento), hay que tener en cuenta la función renal del individuo. Si la función renal es normal, podremos usar cualquier tipo de diurético (tiazidas, sulfonamidas, ahorradores de potasio, diuréticos 11 En el Anexo I. Que nadie se asuste, pues esto no hay que sabérselo, según el profesor Gregorio Manzano digoo Soria. J. A., P.F., M.C. Soria 4
239 TEMA HTA-3 CARDIOLOGÍA CMG # SEGUNDO ESCALÓN Dependerá de si escogimos en el primer escalón monoterapia o asociación. 1 Si el primer escalón fue con un solo fármaco, actuaremos del siguiente modo: a) Si tuvimos ausencia de respuesta: debemos sustituir el fármaco. b) Si tuvimos una respuesta insuficiente: debemos aumentar la dosis. c) Si tuvimos efectos secundarios no deseados: debemos realizar una asociación con otro fármaco. 2 Si en el primer escalón usamos una asociación, las opciones que tendríamos serían: a) Aumentar la dosis de ambos fármacos b) Pasar al tercer escalón; es decir, realizar una asociación con un tercer fármaco ASOCIACIONES Las mejores asociaciones son aquellas en las que los fármacos están unidos por líneas gruesas. Asociaciones más habituales en el segundo escalón 1) ) + 12 Acumula las acciones de los dos fármacos sobre la glucemia (bajándola) y la relación HDL/ LDL (aumentándola). J. A., P.F., M.C. Soria 5
240 TEMA HTA-3 CARDIOLOGÍA CMG # TERCER ESCALÓN Como ya hemos mencionado, se trata simplemente de la asociación de tres fármacos. Asociaciones más habituales en el tercer escalón 1) / + + 2) + + Asociaciones alternativas en el tercer escalón 1) / + + 2) + + # CUARTO ESCALÓN Asociaciones habituales en el cuarto escalón 1) / ) ) / + / + J. A., P.F., M.C. Soria 6
241 TEMA HTA-3 CARDIOLOGÍA CMG HTA REFRACTARIA La HTA resistente o refractaria es convencionalmente definida como la HTA diastólica o sistólica que persiste incontrolada a pesar de una terapia sostenida con al menos tres diferentes clases de fármacos antihipertensivos a dosis altas, debiendo ser uno de ellos un diurético adecuado a las condiciones clínicas del paciente y a la dosis adecuada. La HTA refractaria afecta a menos del 5% de la población de hipertensos y su prevalencia aumenta con la severidad de la HTA. Los pacientes que presentan HTA refractaria han progresado usualmente desde una HTA leve a moderada y luego a severa, como consecuencia de la falta o un inadecuado tratamiento. Otros factores que contribuyen a la HTA refractaria incluyen obesidad, falta de adhesión al tratamiento, regímenes médicos subóptimos, excesiva ingesta de sal, formas secundarias de HTA, apnea del sueño y la ingestión de sustancias que interfieren con el tratamiento. No consideraremos la HTA como refractaria si damos los tres fármacos a dosis bajas o, aunque los demos a dosis altas, si ninguno de ellos es un diurético. POSIBLES CAUSAS DE HTA REFRACTA- RIA Y SOLUCIÓN 1. HTA secundaria no diagnosticada: Para descartar esta posibilidad, realizaremos una analítica completa a ciegas. 2. El paciente no está cumplimentado el tratamiento: Ante pacientes poco colaboradores, la única posibilidad que tenemos es el control de la toma de la medicación por terceros. 3. Pseudohipertensión: Se denomina así a aquellos casos en los que la tensión arterial es alta debido a que las arterias son rígidas 13 y no se ocluyen adecuadamente con el manguito. Se recomienda el uso de registros intraarteriales de TA (esta técnica no se debe utilizar en todos los hipertensos porque es un método invasivo), para obtener cifras reales. 4. Paciente hipertenso con pseudoresistencia: La pseudoresistencia puede deberse al uso manguitos de tamaño inadecuado 14, a que el paciente no esté tomando el tratamiento a dosis completas o al llamado fenómeno de bata blanca. La solución es el uso de manguitos de tamaño adecuado, el tratamiento a dosis completas y la toma de registros domiciliarios, respectivamente. 5. Paciente obeso 15 : La solución ideal será la reducción del peso. 6. Paciente que consume alcohol en exceso: La recomendación sería que disminuya el consumo. 7. Componente de volumen asociado: La mayoría de los pacientes resistentes tienen exceso de volumen intravascular, por lo que la solución irá encaminada a disminuir este volumen, tratándolo de forma diferente, según su etiología. Por tanto, si este exceso de volumen se debe a: a. Dosis insuficiente de diurético, aumentaremos la dosis. b. Ingesta elevada de sal, restringiremos el consumo. c. Daño parenquimatoso renal asociado. Lo diagnosticaremos mediante ECO, y lo trataremos bloqueando el 13 Suele ocurrir en personas ancianas con endurecimiento arterial (arteriosclerosis), pero sin signos de repercusión de la hipertensión arterial sobre los órganos nobles. 14 El manguito del tensiómetro debe tener el tamaño adecuado a cada paciente. En pacientes obesos, se precisaran manguitos mayores, ya que los convencionales no alcanzan a cubrir 2/3 de la circunferencia del brazo, y por ello no se pueden comprimir bien los vasos sanguíneos, obteniendo cifras tensionales superiores a las reales. 15 La HTA del obeso es muy lábil, sube y baja sin control. J. A., P.F., M.C. Soria 7
242 TEMA HTA-3 CARDIOLOGÍA CMG sistema renina-angiotensina-aldosterona farmacológicamente. d. Consumo de drogas con efecto mineralcorticoide 16, limitaremos su uso en la medida de lo posible. 8. Paciente con SAOS 17 : En estos casos se aconseja iniciar el tratamiento con CPAP En relación con los propios fármacos antihipertensivos, deberemos tener en cuenta: a. La posología o asociaciones que realicemos han de ser adecuadas. b. Evitar las posibles interacciones medicamentosas. c. En relación con otros fármacos: Si el paciente está tomando contraceptivos orales, deberemos suspenderlos Si el paciente está tomando esteroides, ciclosporina o eritropoyetina, deberemos aumentar el tratamiento antihipertensivo. También se aconseja evitar la ingesta de regaliz (Licorice) 19 Por último, destacaremos que un alto porcentaje de los pacientes refractarios lo son por un exceso de volumen (por disfunción renal sutil o causas leves parecidas). 16 Por lo que retendrán agua y sodio, aumentarán la volemia 17 Estos pacientes tienen despertares abruptos durante la noche, lo que estimula al SNS. Este exceso de activación del SNS es el responsable de la hipertensión que se asocia en muchas ocasiones a esta patología. 18 Continuous Positive Airway Pressure. La CPAP es un compresor que genera una presión positiva que evita el colapso inspiratorio de la vía respiratoria superior. 19 En los apuntes del Dr. Soria ponía que se aconsejaba a los hipertensos evitar la ingesta de Licorice (regaliz). El regaliz produce hipertensión por su efecto mineralcorticoide, a través, de la glicirrina (potente inhibidor de la HSD2). Actualmente, se venden productos normalizados sin este componente que se llaman Deglycyrrhizinated Licorice (DGL), o simplemente Licorice, o extracto de regaliz en castellano. Se ha comprobado que en los pacientes que consumen Licorice la hipertensión es menos severa y reversible. J. A., P.F., M.C. Soria 8
243 TEMA HTA-3 CARDIOLOGÍA CMG ANEXO I Indicaciones y contraindicaciones especiales de los fármacos antihipertensivos. J. A., P.F., M.C. Soria 9
244
245 TEMA HTA-4 CARDIOLOGÍA CMG HIPERTENSIÓN IV CRISIS HIPERTENSIVAS INTRODUCCIÓN Las crisis hipertensivas (CH) se definen como una elevación aguda de la presión arterial capaz de llegar a producir alteraciones estructurales o funcionales en diferentes órganos. Desde el punto de vista fisiopatológico y clínico, podemos diferenciar dos entidades diferentes: la urgencia hipertensiva (UH) y la emergencia hipertensiva (EH). Las CH pueden deberse a múltiples causas, aparecer en cualquier tipo de HTA y constituir una amenaza para la vida, por lo cual deben identificarse de forma rápida y recibir un tratamiento efectivo para evitar el daño de los órganos diana (cerebro, sistema cardiovascular y riñón). velocidad de elevación de la TA, que las cifras tensionales absolutas. Para entender bien el tema debemos tener claro el concepto de Lesión de Órgano Diana 2 (LOD), que es el que tipifica a la crisis hipertensiva (y no las cifras de presión arterial). Dependiendo de la gravedad de la LOD podemos clasificar las CH como emergencia o urgencia hipertensiva, así como el sitio de tratamiento (UCI, sala regular o ambulatoriamente). Resumiendo... EMERGENCIA Y URGENCIA HIPERTEN- SIVAS. Se considera emergencia hipertensiva (EH) la elevación súbita de la TA sistólica y diastólica, asociada con daño agudo de órgano diana (DOD). Del mismo modo, se habla de urgencia hipertensiva (UH) cuando no existe tal daño. La definición de CH depende más de la patología acompañante que de la cifras tensionales per se, aunque algunos autores hablan de CH a partir de 180/ Sin duda, más importante es el estado clínico del paciente, y la 1 El profesor ha insistido en que este valor no hay que saberlo, ya que lo que es verdaderamente importante es la repercusión de la TA en el paciente, y no las cifras tensionales per se. Puede darse el caso en el que, de dos pacientes hipertensos con cifras similares de TA, uno esté sufriendo una CH, mientras que el otro no. 2 Al hablar de lesión de órgano diana, estamos haciendo referencia a un concepto general, que englobaría tanto al daño como a la afectación ( Os acordáis de la diferencia entre ambas?? En caso de dudas, repasad el tema de evolución diagnóstica). El caso es que, para marear un poco la perdiz, Soria dice que, en este tema, al decir lesión, prácticamente, es como si dijéramos afectación, que es la que tiene lugar en las emergencias hipertensivas...todo este lío se puede resumir en dos afirmaciones: A Lesión de órgano diana engloba a los conceptos de daño de órgano diana y afectación de órgano diana B Las lesiones de órgano diana que ocurren en las CH se dan en las EH, y son de tipo afectación. J. A., P. F., M.C. Soria 1
246 TEMA HTA-4 CARDIOLOGÍA CMG REPERCUSIONES CLÍNICAS FORMAS DE REPERCUSIÓN VISCERAL DE LAS EMERGENCIAS HTA Las manifestaciones de las emergencias hipertensivas son el resultado de la lesión de órganos diana. Por tanto, como ya vimos en temas previos, las principales repercusiones serán: Cerebrales: Estupor, coma, encefalopatía hipertensiva, hemorragia cerebral... Oculares: Edema de papila (es la repercusión más fácil de observar, aunque no siempre está presente), lesiones retinianas agudas, espasmo arterial... Cardíacas: Edema agudo de pulmón 3, insuficiencia coronaria (que podría producir IAM si no se trata con rapidez). Vasculares: Disección de aorta... Renales: Insuficiencia renal aguda, IRC reagudizada... CASO CLÍNICO Paciente, varón, que llega a puerta de urgencias con una TA de 200/110. Se realiza exploración y no se detecta afectación de órganos diana. Se trata de una emergencia o de una urgencia? Cómo debemos tratarlo? TRATAMIENTO TRATAMIENTO DE LAS UH a) Administrar fármacos de vida media larga vía oral: IECA (como el captopril 4 ). Antagonistas de los receptores AT1 de la angiotensina II (ARA II). Antagonistas del calcio (como el nifedipino 5, V.O.). Beta-bloqueantes (como el atenolol). b) Usaremos diuréticos (por ejemplo, furosemida), si no hay respuesta a los fármacos anteriores a los 30 min. de la administración 6, o si existe evidencia de componente hidrópico como causante de la UH. c) Se recomienda, comenzar con antagonistas del calcio, si no responde, administraremos IECAS. Si, tras la administración de los fármacos anteriores, la tensión sigue elevada pasaremos al siguiente escalón: diuréticos 7. Si a pesar de esto, el paciente no responde, iremos administrando los demás (ARA II, B-Bloqueantes). d) Los ansiolíticos pueden estar indicados en algunos pacientes. e) La reducción debe realizarse gradualmente a fin de prevenir la isquemia orgánica (cardiaca, cerebral). 1. Dado que no existe afectación de órgano diana, diremos que se trata de una UH. 2. Manejo del paciente: llevaremos a cabo un tratamiento gradual. 3 Se encuentra dentro de las repercusiones cardiacas porque se produce como consecuencia de una IC. 4 Tiene la ventaja de que también es posible su administración sublingual. 5 Nombre comercial: ADALAT 6 Según: guias_clinicas/12.pdf 7 Que serían el primer paso, en el caso de que la causa de la UH fuera un exceso de volumen, como ya hemos comentado. J. A., P. F., M.C. Soria 2
247 TEMA HTA-4 CARDIOLOGÍA CMG TRATAMIENTO DE LAS EH En este caso, es preciso administrar fármacos 8 de acción inmediata, bien vía sublingual o parenteral: Nifedipino/ captopril sublingual. Diazóxido intravenoso. Nitroprusiato intravenoso.! A estos pacientes hay que tratarlos hasta la resolución de los síntomas, sin marcarnos un objetivo tensional predeterminado (en la mayoría de los casos, no es necesario normalizar la TA). 8 Que quede claro que no se administran todos a la vez, sino que se van dando escalonadamente. J. A., P. F., M.C. Soria 3
248
249 TEMA HTA-5 CARDIOLOGÍA CMG HIPERTENSIÓN V COMPLICACIONES CAR- DIACAS HIPERTENSIVAS COMPLICACIONES DE LA HTA La HTA es el factor de riesgo cardiovascular más importante cuantitativamente hablando 1. Puede causar afectación cardiaca grave, distinguiéndose, principalmente, dos entidades: 1. Cardiopatía hipertensiva (se manifestará como insuficiencia cardiaca de bajo gasto con distintos grados de severidad) 2. Cardiopatía isquémica 2 CARDIOPATÍA HIPERTENSIVA DEFINICIÓN Se aplica la denominación de cardiopatía hipertensiva (CH) al conjunto de modificaciones anatómicas, funcionales y clínicas que la hipertensión arterial determina en el corazón, y que llegan a manifestarse como un síndrome de insuficiencia cardiaca (IC). Desde un punto de vista diagnóstico 3, la CH es la demostración por métodos complementarios de afectación cardiaca presumiblemente secundaria a HTA, no pudiendo encontrar otra causa posible. EVOLUCIÓN FISIOPATOLÓGICA Desde el punto de vista fisiopatológico podemos distinguir tres fases en la evolución de la cardiopatía hipertensiva: Fase I (inicial): en esta fase todavía persiste el grosor normal de la pared. Sin embargo, el estudio más detallado revela infiltración fibrosa en la pared ventricular, que desencadena una disminución de la distensibilidad del ventrículo izquierdo (VI). Esta disminución de la distensión ventricular, hace que aumente la presión en la cavidad, por lo que se dificulta el llenado desde la aurícula, que sufrirá una sobrecarga de volumen. A consecuencia, se producirá una dilatación progresiva de la cavidad auricular izquierda. Fase II: la exposición crónica a este aumento de presión aumentada hace que el miocardio se hipertrofie 4. Esta hipertrofia, sumada a la mayor infiltración fibrosa que encontramos en esta fase, condicionan el aumento del grosor de dicha pared del VI, por lo que cada vez la distensibilidad será menor. En esta fase, además, el volumen de la cavidad ventricular es ya mu- 1 Cualitativamente la diabetes mellitus es el factor de riesgo más importante; pero, al ser la HTA mucho más prevalente, ésta es más importante desde el punto de vista cuantitativo. 2 La cardiopatía isquémica es explicada por el Dr. Valdés. 3 Esto es la definición? de Cardiopatía Hipertensiva según el Dr. Soria. 4 Concretamente, la hipertrofia es de tipo concéntrico; pues se trate de una sobrecarga por aumento de la poscarga. J. A., P. F., M. C. Soria 1
250 TEMA HTA-5 CARDIOLOGÍA CMG cho menor. Sin embargo, el volumen de la cavidad auricular, ha aumentado ya de forma importante. Pese a todos estos cambios que sufre el corazón, la contractilidad sigue siendo normal, por lo que la función sistólica se conserva. No podemos decir lo mismo de la relajación ventricular, que si se encuentra alterada 5. Hablamos entonces de que existe una Insuficiencia Cardiaca Diastólica o Insuficiencia Cardiaca con Función Sistólica Conservada. Fase III: el corazón continúa dilatándose y alcanza un gran tamaño 6. A diferencia de las fases previas, la cavidad ventricular empieza a dilatarse y la pared ventricular (en la que continúa el proceso de fibrosis) se adelgaza. Todo ello condiciona que se altere aún más la distensibilidad del VI y que el corazón pierda fuerza contráctil. Ambas situaciones hacen disminuir el gasto cardiaco 7, por lo que aparecen los síntomas característicos. Hablamos entonces de que existe una Insuficiencia Cardiaca Sistólica. DIAGNÓSTICO Primero se va a sospechar por la clínica, en función de la cual podremos dirigir las exploraciones complementarias necesarias, posteriormente. POR LA CLÍNICA: Síntomas Encontramos un amplio abanico de posibilidades; desde pacientes asintomáticos hasta aquellos que presentan un cuadro sintomático florido. Por tanto, podemos encontrarnos con: pacientes asintomáticos, pacientes con clínica de insuficiencia cardiaca izquierda 8 y pacientes con clínica de palpitaciones por arritmias rápidas, generalmente supraventriculares (es muy típica en estos pacientes la fibrilación auricular FA ). Signos Suelen aparecer en las fases más tardías. En la auscultación cardiopulmonar podemos hallar un cuarto ruido (S4) en el ápex 9 y crepitantes inspiratorios 10. El impulso apical es anormal 11. POR EXPLORACIONES COMPLEMENTARIAS: Radiografía de tórax: esta exploración es poco sensible y poco específica por sí sola para el diagnóstico de la cardiopatía hipertensiva en sus fases iniciales 12. Sólo será de utilidad en caso de que el cuadro Esquema HTA5-1 5 Por la disminución de la distensibilidad (por fibrosis endomiocárdica e hipertrofia) y disminución del volumen ventricular (por hipertrofia). 6 A expensas del crecimiento auricular y ventricular, obviamente, izquierdos. 7 Por ello, dentro de la clasificación de la insuficiencia cardíaca, encontramos la causada por la HTA sistémica como IC de bajo gasto. 8 Podéis consultar los síntomas característicos de la IC izquierda en el tema correspondiente de esta comisión. Fundamentalmente son aquellos derivados del bajo GC (cansancio, fatigabilidad ) y aquellos derivados de la congestión venosa pulmonar (disnea de esfuerzo ). 9 S4 aparece cuando el volumen de llenado ventricular es muy grande (se compara al que aparece cuando se llena una bolsa de plástico). Por tanto, aparecerá en las fases más tardías porque es cuando la dilatación ventricular es un hecho. 10 Es normal que la IC izquierda provoque aumento de la presión venocapilar pulmonar y, por tanto, el consecuente edema pulmonar. 11 El impulso apical está normalmente localizado en la línea medioclavicular a la altura del quinto espacio intercostal. La hipertrofia del ventrículo izquierdo hace que se desplace lateralmente y que aumente su área. 12 Tiene escasa especificidad y sensibilidad. Por otro lado, es barata y muy accesible. J. A., P. F., M. C. Soria 2
251 TEMA HTA-5 CARDIOLOGÍA CMG esté muy evolucionado, y el paciente tenga insuficiencia cardiaca; ya que nos permite medir el diámetro cardiotorácico, determinar si existe derrame pleural o hay afectación de la vasculatura pulmonar. Por otro lado, cabe destacar que es barata y muy accesible. el Anexo podréis ver unos ECG de hipertensos de ejemplo. Esquema HTA5-2 Imagen HTA5-1 Electrocardiograma: es el método actual de cribado de la hipertrofia ventricular izquierda (HVI). Es una prueba barata, accesible y presenta alta especificidad (80-90%). Pero, tiene como inconveniente la baja sensibilidad (20-30%). El ECG tiene una sensibilidad menor que el ecocardiograma para el diagnóstico de HVI, pero es una herramienta de extrema utilidad en las consultas externas. Aunque se han descrito un gran número de criterios ECG de HVI, el Criterio de Sokolow-Lyon y el propuesto por la Universidad de Cornell ( Criterio de Cornell ) son los más empleados en la práctica clínica 13. Ambos muestran una elevada especificidad para el diagnóstico de HVI, aunque, como hemos comentado, su sensibilidad es limitada. Dichos criterios, nos permiten identificar a los pacientes con hipertrofia ventricular izquierda (HVI) de distinto perfil y si hay asociación entre la severidad de la hipertrofia y la prevalencia de enfermedad cardiovascular. En Ecocardiograma-Doppler: actualmente es la técnica de elección por su elevada sensibilidad y especificidad (>90%) y por ser una técnica rápida y barata. Sin embargo, su accesibilidad es limitada; no todo hipertenso tiene acceso hoy en día a esta técnica. Además, se desconoce la periodicidad a la que debemos someter a los pacientes a esta prueba 14. Hoy en día, se admite que para un paciente con hipertensión leve de poco tiempo de evolución, con un electrocardiograma sin signos de hipertrofia ventricular izquierda, no precisará más pruebas. Pero, si existen signos o síntomas que nos hagan sospechar de afectación cardiaca deberemos realizar un ecocardiograma de control. Resonancia magnética nuclear: este es el método más exacto (sensibilidad y especificidad próximos 100%) pero tiene escasa disponibilidad (máximo 6-10 estudios/día) al tratarse de un método diagnóstico muy caro y que consume mucho tiempo. Además esta contraindica si el paciente tiene implantes y puede dar problemas si padece arritmias o fibrilación auricular. La prueba se realiza tras una apnea de 8 a 10 segundos. 13 Desde un punto de vista clínico, el diagnóstico de HVI constituye uno de los pilares de la estratificación del riesgo en hipertensos y su regresión debe ser un objetivo terapéutico. 14 ( Cuántas ecocardiografías debemos realizar a un paciente a lo largo de su vida? Una inicial? Una cada año?...) J. A., P. F., M. C. Soria 3
252 TEMA HTA-5 CARDIOLOGÍA CMG otras alteraciones que hacen disminuir las reservas coronarias se unen al incremento de las demandas metabólicas por el aumento de la masa miocárdica; pudiéndose decir, por tanto, que en la cardiopatía hipertensiva se dan las condiciones idóneas que justifican la aparición de isquemia, al menos en situaciones que favorezcan tal desequilibrio (esfuerzo, crisis HTA, taquiarritmias...). Esquema HTA5-3 TRATAMIENTO COMPLICACIONES Como ya comentamos al hablar de los síntomas de la cardiopatía hipertensiva, estos pacientes pueden presentar diversas complicaciones en los estadios finales. A saber: Insuficiencia cardiaca: es lo más frecuente. En este caso, el paciente se quejará de disnea de esfuerzo (síntoma cardinal de la cardiopatía hipertensiva), o incluso de episodios de ortopnea o disnea paroxística nocturna. Arritmias: en el curso de la enfermedad pueden aparecer arritmias, ya que tanto la distensión y estasis sanguíneo en la aurícula izquierda, como la hipertrofia ventricular izquierda, favorecen la arritmogénesis de arritmias supraventriculares y arritmias ventriculares, respectivamente. Las arritmias supraventriculares pueden iniciar o exacerbar el cuadro de insuficiencia cardiaca y, además, provocar fenómenos tromboembólicos (ACV ). Las ventriculares, aunque son muy poco frecuentes, pueden provocar muerte súbita arrítmica (muerte súbita por arritmia ventricular maligna). Con relativa frecuencia, la evolución de la cardiopatía hipertensiva se complica con la presentación y manifestación de cardiopatía isquémica. Se ha podido demostrar que en la cardiopatía hipertensiva se producen alteraciones del flujo coronario aun en ausencia de estenosis de los grandes vasos coronarios. Esta y En el tratamiento de la cardiopatía hipertensiva debemos: A. Tratar la insuficiencia cardiaca si esta existiera. B. Tratar la alteración estructural cardiaca. Para conseguir este último objetivo seguiremos: a. Medidas higiénico-dietéticas: controlar peso corporal para mantener un IMC inferior a 25, realizar restricción del consumo de sal a 3-4 gramos diarios como máximo y realizar ejercicio físico aeróbico de forma regular (nunca isométrico). b. Control exhaustivo de la tensión arterial: reducir tensión arterial por debajo de 130/85 (tensión arterial diana). El control de los niveles de tensión arterial se realizará mediante automedición domiciliaria de la presión arterial (AM- PA) y, si fuese necesario, mediante monitorización ambulatoria de la presión arterial (MAPA) durante 24 horas). c. Uso de fármacos con mayor efecto antihipertrofia: comenzar con fármacos que bloqueen el SRAA (IECA, ARAII ). En un segundo escalón asociar diuréticos y recurrir, si fuese necesario para alcanzar el objetivo marcado, a asociaciones con calcioantagonistas, betabloquentes o alfa-antagonistas (en ese orden). J. A., P. F., M. C. Soria 4
253 TEMA HTA-5 CARDIOLOGÍA CMG SEGUIMIENTO El seguimiento se realizará mediante electrocardiograma, intentado demostrar la caída de voltajes y/o la normalización en la repolarización (que es más raro que tenga lugar). En relación al seguimiento mediante ecocardiograma y RMN, el primero presenta el problema de la baja disponibilidad que ya mencionamos, y el segundo no está indicado actualmente como método de seguimiento. Esquema HTA5-4 J. A., P. F., M. C. Soria 5
254 TEMA HTA-5 CARDIOLOGÍA CMG ANEXO: Electrocardiogramas J. A., P. F., M. C. Soria 6
255 INSUFICIENCIA CARDIACA
256 TEMA IC-1 CARDIOLOGÍA CMG Insuficiencia Cardiaca CONCEPTO DE INSUFICIENCIA CARDIACA, INSUFICIENCIA CARDIACA CRÓNICA Nota de comisionistas Los 3 temas de este bloque están corregidos por el profesor que los impartió (Dr. Pascual). De hecho están corregidos 2 veces por él, porque los ampliamos para que dejara de amenazar con poner preguntas que no estuvieran en la comisión y se los volvimos a pasar para que los revisara, xd. Aún así, en palabras del mismo: Os recuerdo que son vuestros apuntes de las clases corregidos por mi. No son el temario del examen Aunque está claro que casi todo lo que se pregunte saldrá en ellos. Qué quiere? Que nos estudiemos la última edición del Harrison en inglés? xd. Según Esther este hombre va de duro pero en el fondo es un pedacico de pan Allá cada uno con su interpretación. Los síndromes de la insuficiencia circulatoria aguda son el Shock (aparición rápida) y el Síncope (aparición súbita). CONCEPTO La insuficiencia cardiaca es un síndrome clínico complejo que resulta de la incapacidad del corazón para ejercer su función, pues no es capaz de mantener un flujo sanguíneo adecuado a las necesidades nutritivas del organismo. INTRODUCCIÓN Un aporte pobre de sangre a los tejidos por incapacidad del aparato circulatorio se conoce como insuficiencia circulatoria. Este proceso patológico puede presentarse de dos formas: 1. Progresiva: aparece lentamente y permite la actuación de mecanismos compensatorios, estableciéndose la Insuficiencia Cardíaca Congestiva (o simplemente, Insuficiencia Cardíaca). 2. Aguda: surge de forma rápida o súbita y no da tiempo a que los mecanismos compensatorios aparezcan; por tanto, no se produce congestión. Es un proceso global que se divide en cuatro estadios: A. Ausencia de síntomas clínicos. Sin alteraciones funcionales ni estructurales del pericardio, válvulas cardíacas o miocardio. En este estadio únicamente encontramos factores de riesgo de desarrollar IC como: hipertensión arterial, arteriosclerosis, diabetes, obesidad, síndrome metabólico, fármacos cardiotóxicos o antecedentes familiares de miocardiopatía. B. Aparición de daños estructurales (cardiopatía) íntimamente ligados al desarrollo de IC, en ausencia de síntomas clínicos, A.A., E.G., R.C. Domingo A. Pascual Figal 1
257 TEMA IC-1 CARDIOLOGÍA CMG por ejemplo: infarto agudo de miocardio (IAM), hipertrofia ventricular izquierda (HVI), disfunción sistólica del ventrículo izquierdo (DSVI) o valvulopatías. C. Manifestaciones clínicas actuales o previas de IC asociadas a anomalía estructural subyacente: congestión e intolerancia al esfuerzo con disnea y astenia. D. IC refractaria con marcados síntomas en reposo a pesar de tratamiento óptimo. Requiere hospitalizaciones frecuentes. EPIDEMIOLOGÍA La prevalencia de la IC es de 1-2% de toda la población adulta, pero puede llegar hasta el 7 ó 10% en los mayores de 75 años. La prevalencia va en aumento, como se muestra en la siguiente gráfica que se refleja la diferencia entre y en la prevalencia por edades: COSTE ECONÓMICO 1 Los costes directos de la IC se estiman en el 2-3% del total del presupuesto sanitario en los países desarrollados. El 60% de estos costes se deben a hospitalizaciones. Las características con respecto a los costes económicos de la IC en España son las siguientes: ingresos anuales. - Primera causa de hospitalización en mayores de 65 años. - 5% de las hospitalizaciones en la población general. - Tras un primer diagnóstico, el 35% ingresa el primer año con una tasa de reingreso de hasta el 44% a 6 meses. PRONÓSTICO Es la tercera causa de muerte cardiovascular en nuestro país. Tras un primer ingreso, la mortalidad esperable es de 11-20% al primer mes y 30-45% al año. En estudios poblacionales, la supervivencia a los 5 años del diagnóstico es de sólo el 45-50%. Lo que demuestra la siguiente gráfica es que la insuficiencia cardiaca es una enfermedad con muy mal pronóstico, sólo superada por algunos tipos de cáncer como es el de ovario y pulmón en las mujeres y el de pulmón en los hombres. La incidencia de la IC es de 10/1000 después de los 65 años. La incidencia y la prevalencia aumentan con la edad porque muchos síndromes y enfermedades confluyen en dos vías finales comunes: la IC o la muerte súbita. 1 En este apartado en negrita aquello que el profesor dijo que podría ser pregunta de examen. A.A., E.G., R.C. Domingo A. Pascual Figal 2
258 TEMA IC-1 CARDIOLOGÍA CMG F ISIOPATOLOGÍA Desde este punto de vista, la IC se puede clasificar en sistólica y diastólica. En la IC sistólica existe un deterioro de la contracción, es decir, una pérdida de la capacidad cardiaca para vaciarse. Se debe a una dilatación global de las cavidades y un adelgazamiento de la pared ventricular (ver en la imagen inferior). Este tipo de IC se ve favorecida, por ejemplo, tras un infarto de miocardio o valvulopatías. RECORDATORIO DE FISIOLOGÍA En este apartado, recordaremos la curva de presión-volumen, la ley de Frank-Starling, la ley de Laplace y el gasto cardiaco. 2 Curva normal de presión-volumen La IC diastólica es una pérdida de la capacidad del corazón para llenarse. Por ejemplo, la hipertrofia del miocardio conlleva un empeoramiento de la relajación o la fibrilación auricular una pérdida de la contribución auricular al llenado. Como consecuencia se produce una dilatación de las aurículas con ventrículos de tamaño y contractilidad normal (ver imagen inferior). Los factores de riesgo que predisponen a padecer este tipo de IC son: edad (por el aumento de la rigidez que conlleva), hipertensión arterial e hipertrofia ventricular (por pérdida de la capacidad de distensión), fibrilación auricular, enfermedades infiltrativas del miocardio, la constricción y el taponamiento pericárdico y alteraciones valvulares como la estenosis mitral. Tras la sístole auricular, que se produce para completar el llenado de los ventrículos, se cierra la válvula mitral (en la gráfica C. mitral). Comienza entonces una fase de contracción isovolumétrica, el ventrículo permanece con las válvulas cerradas, por lo que no variará su volumen de sangre, pero debido a la contracción sí aumentará la presión. Cuando la presión dentro del ventrículo supera la presión que hay en la aorta, la válvula aórtica (A. Aorta) se abre y comienza la fase de eyección (vemos que esta fase se traduce en la gráfica con una línea horizontal, con lo que la presión no cambia, y que va de delante hacia atrás, 2 Lo siento por la calidad de las imágenes, pero es que el profesor Pascual no quería darnos las diapositivas, y al final accedió pero en papel y mal Aún así las coloco porque creo que son esquemáticas y sirven para entender los conceptos. A.A., E.G., R.C. Domingo A. Pascual Figal 3
259 TEMA IC-1 CARDIOLOGÍA CMG mostrando la disminución de volumen en el ventrículo hasta que se cierra la válvula aórtica, C. Aorta). El corazón expulsa la sangre que contiene y se vacía, con lo que se inicia una fase de relajación isovolumétrica, con las válvulas cerradas, en cuyo inicio al caer la presión intraventricular por debajo de la presión en la aorta se cierra la válvula aortica y cuando se hace menor a la de la aurícula, se produce la apertura de la válvula mitral. Se produce entonces el llenado ventricular, primero el pasivo (onda E) y despues el activo o sístole auricular (onda A) 3. Si hablamos del VD, se producirá congestión y edema en el resto de tejidos. 2. Aumento de la contractilidad. 3. Ascenso de la frecuencia cardíaca: Por consiguiente, la curva de presiónvolumen se desplaza a la derecha, pues se movilizan volúmenes mayores, y la presión de llenado también es mayor, para alcanzar un volumen sistólico igual al de un corazón sano. Por otro lado, la curva de contractilidad se desplaza hacia abajo; por tanto, la FEV 4 estará disminuida. Variaciones de la curva presión-volumen Disfunción diastólica En este caso, al estar dificultada la relajación tiene lugar un aumento de la presión ventricular al final de la diástole (como consecuencia, se producirá congestión y edema retrógrado 5 ). Por tanto, la curva presiónvolumen se desplaza hacia arriba; mientras que la curva de contractilidad no varía. En este caso la FEV y el volumen son normales, pero a expensas de un aumento de presiones telediastólicas. Ley de Frank-Starling Disfunción sistólica El mecanismo inicial es una disminución de la función miocárdica, que trae como consecuencia la disminución del volumen eyectivo sistólico. Tras esto, la acción de los mecanismos compensatorios, que veremos más adelante, produce: 1. Incremento de la precarga: esto provoca un aumento del gasto cardíaco por la ley de Frank-Starling, ya que llega más volumen de sangre al ventrículo, pero a expensas de aumentar la presión al final de la diástole; por tanto, también aumentará la presión en territorio pulmonar provocando congestión y edema, cuando hablemos del VI. 3 Recordemos que la sístole auricular supone el 25% del llenado ventricular. Cuanto peor es la relajación ventricular mayor es la contribución de la aurícula al llenado. Según esta ley, se observa que el gasto cardiaco aumenta en relación con la precarga. Existe una relación directa entre el grado de elongación y de acortamiento de la fibra miocárdica, es decir, cuanto mayor sea el volumen ventricular en diástole mayor será la fuerza de la siguiente contracción. Recordemos que el corazón habitualmente trabaja a volúmenes que elongan sus fibras a niveles subóptimos. Con lo que, aumentando el llenado del ventrículo, se elongarán más las fibras y trabajarán de manera más eficaz (este es el mecanismo de compensación en la IC sistólica). 4 Fracción de eyección ventricular. 5 Cuando esta presión de llenado supera un determinado límite la presión puede aumentar retrógradamente pudiendo provocar un edema y congestión retrógrados. A.A., E.G., R.C. Domingo A. Pascual Figal 4
260 TEMA IC-1 CARDIOLOGÍA CMG Ley de Laplace Define la relación de presiones necesaria para obtener un balance neutral, positivo o negativo entre dos espacios. Tanto la precarga como la postcarga se rigen por esta ley, según la cual: P = presión r = radio T = fuerza de tensión superficial o wall stress La postcarga es la fuerza contra la que se contrae el miocardio o wall stress durante la sístole ventricular. Vendrá determinada por: 1. La resistencia vascular. 2. Volumen telediastólico. 3. Grosor de la cavidad ventricular. Esta ley indica que la tensión de la fibra miocárdica es una función del producto de la presión ventricular y del radio del ventrículo dividido entre el grosor de la pared. Hablando en plata, la ley de Laplace determina que para una misma presión aórtica (resistencia periférica), la postcarga de un ventrículo izquierdo dilatado de grosor normal es más alta que la de un ventrículo de tamaño normal. Y viceversa, para una misma presión aórtica y el mismo volumen diastólico ventricular, la postcarga de un ventrículo de paredes gruesas es menor que la de una cavidad de paredes finas. La precarga es la fuerza que distiende el músculo relajado y condiciona el grado de elongación de la fibra miocárdica, viene determinada por la presión venosa. Es la wall stress al final de la diástole, y por tanto en la máxima longitud de reposo del sarcómero. AMPLIACIÓN DE CONTENIDO DE INTERÉS Según Mr. Harrison (16ª edición en español, lo siento ), la precarga depende de: 1. Volumen total de sangre (volemia). 2. Distribución del volumen sanguíneo: el volumen telediastólico depende de la distribución de la sangre en los compartimentos intratorácicos y extratorácicos. A su vez, ésta depende de: - Postura corporal: la postura erguida aumenta el volumen sanguíneo en el compartimento extratorácico a expensas del intratorácico y reduce el trabajo ventricular. - Presión intratorácica: por lo general es negativa, favoreciendo el retorno venoso. Su elevación ejerce el efecto contrario. - Presión intrapericárdica: cuando se eleva produce taponamiento cardíaco. - Tono venoso: la venoconstricción aumenta el volumen intratórácico. 3. Contracción auricular: la contracción enérgica y en el momento adecuado de las aurículas aumenta el llenado ventricular y el volumen telediastólico. La contribución auricular al llenado ventricular tiene especial importancia en los pacientes con hipertrofia ventricular concéntrica, en los que la pérdida de la sístole auricular (como en FA) tiende a disminuir el volumen telediastólico y puede ocasionar aumento de presiones auriculares y congestión retrograda. Gasto cardiaco FIN DEL CONTENIDO AMPLIADO El gasto cardiaco es el volumen latido por la frecuencia cardiaca (GC = V FC). El GC normal es de unos 5 l/min. Como sabéis también está influido por las resistencias periféricas. Si se aumenta la contractilidad (medida de la magnitud de la fuerza contráctil en una determinada fibra en reposo) o la precarga, se aumentará el volumen latido y aumentará así el gasto cardiaco. Si lo que aumenta es la postcarga, el volumen latido, y con ello el gasto cardiaco, disminuirá. A.A., E.G., R.C. Domingo A. Pascual Figal 5
261 TEMA IC-1 CARDIOLOGÍA CMG E TIOLOGÍA El 50% de las IC se debe a cardiopatía isquémica. Pero como veremos a continuación, casi cualquier cardiopatía puede causarla 6 : ICC DE VENTRÍCULO IZQUIERDO C LASIFICACIÓN Cuatro tipos de clasificaciones diferentes: A. Según la función que esté alterada se clasifica en: sistólica o diastólica. B. Según la evolución se clasifica en: aguda o crónica. C. Según el ventrículo afectado se clasifica en: izquierda, derecha o global (biventricular). D. Según el gasto cardiaco se clasifica en: IC de bajo o alto gasto. Disfunción sistólica: Alteración en la contractilidad: - IAM. - Isquemia miocárdica. - Sobrecarga de volumen por una insuficiencia mitral o aórtica. - Miocardiopatía dilatada (idiopática, familiar o alcohólica). Sobrecarga de presión: - Estenosis aórtica. - Hipertensión arterial mal controlada. Disfunción diastólica: - Taquiarritmias. - HTA, hipertrofia del VI. - Miocardiopatía hipertrófica. - Miocardiopatías infiltrativas. - Isquemia miocárdica. - Constricción pericárdica o taponamiento. Obstrucción al llenado: - Estenosis mitral. - Mixoma. ICC DE VENTRÍCULO DERECHO Disfunción sistólica: Alteración de contractilidad: - IAM inferior o en VD. - Sobrecarga de volumen por insuficiencia pulmonar o tricuspídea. 6 Las diapositivas con las listas que vienen a continuación (hasta ICC sistólica) las pasó muy rápido. A.A., E.G., R.C. Domingo A. Pascual Figal 6
262 TEMA IC-1 CARDIOLOGÍA CMG - Cortocircuitos (interventriculares o interauriculares). - Displasia VD. Sobrecarga de presión: - Insuficiencia cardiaca izquierda. - Hipertensión pulmonar primaria. - Cor pulmonale. Disfunción diastólica: - Constricción pericárdica o taponamiento. Obstrucción al llenado: - Estenosis tricuspídea. ICC SISTÓLICA 7 Puede deberse a los siguientes grupos de causas: Miopática, por una enfermedad primaria o secundaria del músculo miocárdico. Mecánica, por sobrecargas de presión o volumen. Arrítmica, por taquiarritmias o bradiarritmias. Si son progresivas y mantenidas causan IC, pero si son bruscas pueden causar muerte súbita. Las etiologías más frecuentes de IC sistólica en orden decreciente son 8 : Cardiopatía isquémica: Supone alrededor del 50% de los casos. Miocardiopatía dilatada: La mayoría de etiología idiopática o no aclarada. HTA: Su incidencia está descendiendo como etiología de IC sistólica, ya que cada vez se controla mejor a los hipertensos, quedando únicamente como causa de IC diastólica. Otras: como enfermedad valvular, estenosis hipercinéticas ICC DIASTÓLICA Es una ICC secundaria a una alteración de la función contráctil ventricular. La curva presión volumen se desplaza hacia la derecha, aumenta el volumen telediastólico, aumenta la presión telediastólica y se produce una acumulación retrógrada en aurícula izquierda y pulmón (dilatación de cavidades). Por otro lado, la recta de contractilidad se desplaza hacia abajo. La curva de presión-volumen se desplaza hacia arriba. A cualquier volumen diastólico, la presión es superior a la normal. 7 En este momento de la clase el profesor dijo: hasta ahora no he explicado casi cosas preguntables. Llevamos 7 páginas, así que ya veis que el tema parece muy largo pero en realidad no es para tanto. Tiene mucho relleno de recuerdo fisiopatológico. 8 Lista importante: EXAMEN! A.A., E.G., R.C. Domingo A. Pascual Figal 7
263 TEMA IC-1 CARDIOLOGÍA CMG El 40% de los casos de ICC se deben a una insuficiencia cardiaca diastólica. Ésta se produce habitualmente por una pérdida funcional en el llenado del corazón. Se puede deber a: - Una alteración en la relajación diastólica precoz, que es un proceso activo y demandante de oxígeno, por ejemplo en la isquemia miocárdica aguda. - Un aumento de la rigidez de la pared ventricular, es un proceso pasivo, por ejemplo en miocardiopatía hipertrófica o restrictiva. La etiología 9 de la IC diastólica es 10 : Edad, en la siguiente tabla se muestra la prevalencia de la IC diastólica según la edad: M ECANISMOS COMPENSATORIOS Entre los mecanismos compensatorios de la IC se encuentran los siguientes: o o o Mecanismo de Frank-Starling: dilatación ventricular. Hipertrofia ventricular. Activación del sistema neurohormonal: - Activación del SN simpático. - Activación del eje renina-angiotensinaaldosterona. - Liberación de hormona antidiurética. - Liberación de endotelinas. - Liberación de péptidos natriuréticos. MECANISMO DE FRANK-STARLING: DILATACIÓN VENTRICULAR HTA, sobretodo si es de larga evolución. Fibrilación auricular. Miocardiopatías hipertrófica e infiltrativas. El perfil del paciente con IC diastólica es una mujer (afecta más a éstas) de avanzada edad con HTA de larga evolución. La prevalencia de la ICC sistólica es 49 % y la de la diastólica, 51%. Con lo que ambas son prácticamente igual de prevalentes. Efectos positivos Aumenta el volumen telediastólico, es decir, la precarga. Como consecuencia aumenta la fuerza contráctil del miocardio y de la eficacia de la contracción ventricular, por lo que habrá mayor volumen de eyección para el mismo acortamiento de la fibra miocárdica. Pero atención: a partir de cierto grado de dilatación la fuerza contráctil no aumenta y puede empeorar. Efectos deletéreos Al aumentar el radio, aumenta la tensión de la pared (wall stress): 9 Aparte de la etiología primaria, en la IC en general suelen haber factores desencadenantes, entre los que se encuentran: infección, arritmias, excesos físicos, dietéticos, líquidos, ambientales o emocionales, anemia, insuficiencia renal, interacción de fármacos (AINES), 10 Otra lista importante, ya sabéis. También aumenta el consumo de oxígeno que, junto al aumento de la precarga y la retención de agua y Na +, provocan síntomas de congestión pulmonar y sistémica. Si se produce un remodelado ventricular tendrá peor pronóstico. A.A., E.G., R.C. Domingo A. Pascual Figal 8
264 TEMA IC-1 CARDIOLOGÍA CMG En un corazón normal, existe un grosor de la pared mayor en sístole para reducir la tensión parietal, pero en una IC sistólica se produce poco incremento del grosor de pared y aumenta de manera importante de tensión parietal. Esto, a la larga, dificulta el vaciado ventricular. La activación del SNS lleva a la liberación de noradrelanina (norepinefrina) que actuará sobre receptores adrenérgicos: - α1 producirá vasoconstricción periférica 11 y renal, con retención de Na + y agua. - β1 llevará al aumento del cronotropismo y del inotropismo cardiaco. HIPERTROFIA VENTRICULAR La hipertrofia ventricular tiene, como la dilatación ventricular, algunos efectos positivos y otros que son deletéreos para la fisiología cardiaca: Efectos positivos Aumenta el tamaño de los miocitos, las miofibrillas y las mitocondrias, así se incrementa la masa muscular. Así, sin incremento del número de unidades contráctiles aumenta la contractilidad y disminuye la tensión parietal. Efectos deletéreos Aumenta la presión auricular retrógradamente pudiendo provocar congestión pulmonar y sistémica (si la hipertrofia es derecha), al dificultarse el llenado del ventrículo hipertrofiado. El pronóstico de la IC empeora cuanto mayor sea el nivel de norepinefrina (noradrenalina), como se muestra (o se intenta mostrar, porque la imagen es pésima) abajo: ACTIVACIÓN DEL SISTEMA NEURO- HORMONAL Al disminuir el gasto cardiaco, disminuye la perfusión y se ponen en marcha una serie de mecanismos que ya nos han explicado en repetidas ocasiones pero que volveremos a ver en su relación con la fisiopatología de la IC: Activación del sistema nervioso simpático Los desencadenantes de la activación del SNS en ICC pueden ser: Hemodinámicos, por el descenso de la tensión en los barorreceptores del cayado aórtico y carotídeos. Metabólicos, por la activación de los quimiorreceptores por hipoxia, hipercapnia o acidosis. La opción terapéutica que tenemos para bloquear este nivel son los β-bloqueantes, que especialmente antagonizan al SN simpático en sus acciones cardiacas. 11 Falta decir hematopoyético!! jjj. Quien tiene que entenderlo lo entiende ;) A.A., E.G., R.C. Domingo A. Pascual Figal 9
265 TEMA IC-1 CARDIOLOGÍA CMG Activación del eje renina-angiotensinaaldosterona La renina 12 es liberada por el aparato yuxtaglomerular del riñón ante una disminución de la tensión arterial. La renina, una vez que está en la sangre, transforma el angiotensinógeno, segregado por el hígado, en angiotensina I. La angiotensina I, por la acción de la enzima convertidora de angiotensina (ECA), en el pulmón, pasa a angiotensina II. En la corteza suprarrenal, la angiotensina II estimula la producción de aldosterona. La angiotensina II 13 puede actuar en dos tipos de receptores: AT1: se encuentra en el adulto y es el receptor que se activa para la regulación de la tensión arterial. Se subdivide en AT1a y AT1b, y su activación produce principalmente vasoconstricción, aunque también aumento del inotropismo cardiaco, aumento del intercambio Ña + /H + renal, y estímulo de la proliferación y crecimiento de las células de la musculatura lisa. AT2: se encuentra principalmente en el embrión y no actúa como regulador. Su función es producir vasodilatación y disminución en la proliferación y crecimiento de las células de la musculatura lisa. La función de la aldosterona 14 es aumentar la reabsorción de Na + y agua y la excreción de K + y H +. Fisiológicamente aumenta su liberación a lo largo del día ante el estrés y el aumento del potasio sérico, para mantener normales los niveles séricos de electrolitos. En una IC, su liberación aumenta ante estímulos como la angiotensina II, endotelina, vaso- 12 Produce daño miócárdico. 13 He encontrado una página en internet en la que sale la cita de un médico hace unos años sobre la angiotensina II. La cita es la que sigue: No puedo comprender cómo Dios puso en la naturaleza una sustancia tan dañina como la Angiotensina II. jjj, la frase fue dicha tras la lectura por parte de este médico de numerosos estudios sobre la presencia de angiotensina II en procesos patológicos renales. Como en tantas otras ocasiones en la investigación biomédica, primero se descubrió lo dañina que era la angiotensina II disregulada, para descubrir a posteriori lo esencial de su papel fisiológico. 14 Recordamos de PG que produce daño miocárdico por fibrosis por un mecanismo que ahora veremos. presina (ADH) y norepinefrina, y al realizar su función ocasiona edemas, anasarca, hipopotasemia y alcalosis. Otra acción de la aldosterona es el remodelado vascular coronario (aumento de tejido fibroso) que se produce, por ejemplo, en un hiperaldosteronismo secundario. A nivel del SRAA tenemos varias opciones terapéuticas: Para actuar evitando la acción de la angiotensina II: los inhibidores de la ECA (IECA) y los antagonistas del receptor AT1 (ARA-II). Para evitar la acción de la aldosterona: antagonistas como la espironolactona. Estos tres tipos de fármacos tienen demostrada eficacia en el aumento de la supervivencia en los enfermos con IC. La eficacia de los IECA y de los ARA-II es similar. La primera elección en la IC sistólica debe ser un IECA, pues la evidencia científica es mayor. Sin embargo ambos se consideran equivalente, reservandose el ARA2 para aquellos casos en que los IECA dan efectos secundarios: por ejemplo la tos (que se presenta en un 10-15%), es el efecto adverso más frecuente de los IECA 15. Se pueden usar ambos a la vez, estando especialmente indicado este uso en pacientes que no toleran los β-bloqueantes. Liberación de hormona antidiurética (ADH) La angiotensina II, la epinefrina y la presión auricular producen la desensibilización de barorreceptores, lo que conduce al aumento de los niveles de ADH, ocasionando vasoconstricción, retención de agua y sed. 15 El mecanismo por el cual la producen es porque inhiben las quinasas que metabolizan las bradiquininas. Éstas de este modo se acumulan y producen tos. A.A., E.G., R.C. Domingo A. Pascual Figal 10
266 TEMA IC-1 CARDIOLOGÍA CMG La opción terapéutica para luchar con la ADH es la restricción de ingesta hídrica y de sodio. Liberación de endotelinas Las catecolaminas, la angiotensina II, la hipoxia y el estrés estimulan la producción de endotelina 1. La endotelina 1 produce: - Vasoconstricción arterial. - Aumento de la actividad del SNS que aumenta de las resistencias vasculares y disminuye el gasto cardiaco. - Hipertrofia cardiaca. - En el riñón, disminuye la secreción de sodio, disminuye la filtración glomerular y aumenta la vasoconstricción de la arteriola eferente, aumentando la volemia. - Estimula la secrección de aldosterona que produce la retención de Na + y agua, aumentando la volemia también. No existen opciones terapéuticas relacionadas con la endotelina. Liberación de peptidos natriuréticos Existen varios tipos de péptidos natriuréticos: ANP (Atrial natriuretic peptide), BNP (Brain natriuretic peptide), CNP (C-type natriuretic peptide): Producen un mecanismo contrario a los anteriormente explicados: aumenta la diuresis, disminuye las resistencias periféricas, suprime el SRAA y la endotelina. Como tratamiento se ha desarrollado un BNP recombinante, que aún no se encuentra aprobado en España y podría asociarse a insuficiencia renal. Sí se utiliza como marcador diagnóstico y pronóstico en sangre de IC, tanto el BNP (activo) como el NT-proBNP (porción inactiva). MEDIADORES INFLAMATORIOS Numerosas observaciones experimentales indican que los mediadores inflamatorios son importantes en la patogenia de la IC, contribuyendo al remodelado cardiaco patológico y a las alteraciones vasculares. Algunos de los mediadores inflamatorios implicados son: Factor de necrosis tumoral-α (TNF- α). Receptores solubles del TNF 1 y 2. IL-1 e IL-6. Vascular cell adhesión molecule-1 (VCAM-1). Intercellular cell adhesión molecule-1 (ICAM-1). Endotoxina. CD-14 soluble. Proteína C reactiva. A.A., E.G., R.C. Domingo A. Pascual Figal 11
267 TEMA IC-1 CARDIOLOGÍA CMG RESUMEN: OPCIONES TERAPÉUTICAS Las hemos ido diciendo en cada mecanismo compensatorio, pero a modo de resumen: SNS: β-bloqueantes. SRAA: IECA y ARA-II en relación a angiotensina II. Espironolactona evita la acción de la aldosterona. ADH: Restricción hídrica y de sodio. Endotelina: No tiene. Péptidos natriuréticos: No tienen. Mediadores inflamatorios: No tienen. C LÍNICA MANIFESTACIONES CLÍNICAS GE- NERALES Síntomas: Disnea de esfuerzo, ortopnea, disnea paroxística nocturna (DPN), tos, intolerancia al ejercicio, cansancio, confusión, insomnio, depresión, náuseas y pérdida de peso. Signos: Distensión venosa yugular, congestión pulmonar, estertores pulmonares, ritmo cardiaco de galope con tercer y cuarto ruido, congestión hepática, distensión abdominal, bajo volumen de pulso, pulso alternante, edema periférico. EN IC IZQUIERDA Síntomas 1. Retrógrados: se producen por la congestión pulmonar - Disnea de esfuerzo. - Ortopnea. - DPN. - Edema agudo pulmonar. 2. Anterógrados: debido al bajo gasto cardiaco, hipoperfusión Signos - Generales: fatigabilidad, astenia caquexia. Su presencia es de mal pronóstico. - Cerebrales: inespecíficos (insomnio, depresión, cefalea, deterioro cognitivo mareos o presíncopes). - Renales: nicturia (en casos leves) o oliguria (en casos severos). A. Inspección general: - Actitud general del paciente con IC: nerviosismo y ansiedad. - Coloración: palidez, diaforesis (sudoración profusa) y cianosis. - Perfusión periférica: frialdad y diaforesis. B. Estado nutricional: - Caquexia, que no hay que confundir con edema. C. Signos vitales: - Respiración: periódica y taquipnea - Pulso: taquicardia, presión pulso baja, alternante - Tensión arterial: hipotensión - Temperatura: hipotermia D. Venas yugulares: - Suele ser normal su exploración. A.A., E.G., R.C. Domingo A. Pascual Figal 12
268 TEMA IC-1 CARDIOLOGÍA CMG E. Exploración pulmonar: - Estertores crepitantes inspiratorios bilaterales (predominio en las bases). - Sibilantes ( asma cardial con predominio en las bases). - Semiología de derrame pleural. F. Exploración cardiaca: - Inspección y palpación: punta desplazada y discinesia. - Auscultación: - ruidos de galope (3º y 4º R de VI) - soplos: - de la valvulopatía causante - de la insuficiencia valvular mitral (funcional) por dilatación del anillo mitral. EN IC DERECHA Síntomas 1. Retrógrados: Debidos a la congestión hepática y ascitis: plenitud, anorexia, nauseas, estreñimiento, dolor en hipocondrio derecho y distensión abdominal. No existe disnea congestiva aunque sí dificultad respiratoria por: hipoperfusión de los músculos accesorios de la respiración, derrame pleural, hipoxemia 2. Anterógrados: debido al bajo gasto cardiaco, hipoperfusión - Generales: fatigabilidad, astenia caquexia (mal pronóstico). - Cerebrales: inespecíficos (insomnio, depresión, cefalea, deterioro cognitivo, mareos, presíncopes). - Renales: nicturia (en casos leves) o oliguria (en casos severos). Signos A. Inspección general: Signos variables según la severidad de la reducción del gasto cardiaco: - Congestión periférica. - Ascitis. - Ictericia por la cirrosis cardiaca. B. Estado nutricional: - Caquexia, más frecuente por: malabsorción intestinal (enteropatía pierdeproteínas) y anorexia mayor C. Signos vitales: - Respiración: taquipnea - Pulso: taquicardia - Tensión arterial: hipotensión - Temperatura: variable A.A., E.G., R.C. Domingo A. Pascual Figal 13
269 TEMA IC-1 CARDIOLOGÍA CMG D. Venas yugulares: - Reflujo hepato-yugular (RHY: +) - Ingurgitación yugular absoluta (IY) - Morfología del pulso y respuesta a inspiración (Kussmaul). E. Exploración pulmonar: - No estertores crepitantes. - Semiología de derrame pleural bilateral o derecho. F. Exploración cardiaca: - Inspección y palpación: latido en borde esternal izquierdo - Auscultación: - ruidos de galope (3º, 4º R de VD). - soplos: - de la valvulopatía causante. - de la insuficiencia valvular tricuspídea (funcionales). G. Abdomen: - Hepatomegalia (llega al lado izquierdo, es dolorosa a la palpación). - Reflujo hepatoyugular. - Ascitis y circulación colateral. H. Extremidades: - Edema bilateral con fóvea. Cuadro que muestra el balance perfusión/congestión, según se vea afectada la función anterógrada o retrógradamente: congestión perfusión FRÍO (astenia, hipotensión, oliguria, frialdad) MOJADO (disnea, DNP, edemas, IY, RHY) CALIENTE - - SECO PERSONA SANA *Los signos ( ) indican severidad de la descompensación. A.A., E.G., R.C. Domingo A. Pascual Figal 14
270 TEMA IC-1 CARDIOLOGÍA CMG D IAGNÓSTICO Los criterios diagnósticos de ICC para la Sociedad Española de Cardiología son: Primero se basa en la presencia de síntomas clínicos de IC en reposo o ejercicio. Después, en la evidencia objetiva de disfunción ventricular (generalmente mediante ecocardiografía) en reposo. Y si, tras estos dos pasos, el diagnóstico permanece dudoso, será esencial la respuesta positiva al tratamiento de la IC. Generalmente, se seguirá el siguiente algoritmo para el diagnóstico de IC: Se llegará a la sospecha clínica mediante la historia clínica y el examen físico, prestando especial atención a los criterios de Framingham: Criterios de Framingham Según éstos, el diagnóstico de IC requiere la presencia simultánea de al menos 2 criterios mayores ó de 1 criterio mayor junto a 2 criterios menores 16 : Mayores o o o o o o o o o Menores 17 o o o o o Disnea paroxística nocturna. Ingurgitación yugular. Estertores crepitantes. Cardiomegalia radiográfica. Edema agudo de pulmón. Galope con tercer ruido (S3). Reflujo hepato-yugular. Pérdida de peso > 4,5 kg en 5 días en respuesta al tratamiento. Aumento de la presión venosa central. Edema bilateral de miembros inferiores. Tos nocturna. Disnea de esfuerzo. Hepatomegalia. Derrame pleural. o Disminución de la capacidad vital a 1/3 de la máxima registrada. o Taquicardia (FC >120 lat/min). 16 La sensibilidad de estos criterios para el diagnóstico de ICC definitiva es prácticamente del 100%, mientras que la especificidad es del 78%. 17 Los criterios menores son sólo aceptables si no pueden ser atribuidos a otras condiciones médicas. A.A., E.G., R.C. Domingo A. Pascual Figal 15
271 TEMA IC-1 CARDIOLOGÍA CMG Exploraciones complementarias Para confirmar el diagnóstico de sospecha se realizarán diversas pruebas complementarias: ecocardiografía, radiografía de tórax y analítica. En el ECG aparecerán cambios inespecíficos: taquicardia, crecimiento de cavidades, arritmias (por ejemplo: fibrilación auricular, ondas Q de infarto previo ), y el 20-30% de los pacientes tienen bloqueo de la rama izquierda del haz de Hiss (BRIHH). IMPORTANTE!: El ECG normal sugiere la ausencia de IC, y debe revisarse el diagnóstico. En cambio, el ECG anormal apoya el diagnóstico, pero no nos lo asegura. En la Rx de tórax buscar cardiomegalia y congestión pulmonar con edema, derrame pleural y líneas B de Kerley, que apoyarían el diagnostico de IC. Una Rx torax normal no descarta la IC (por ejemplo el paciente con IC crónica puede no tener signos congestivos y en la IC diastólica no hay cardiomegalia). También puede darnos otros hallazgos que apoyen, por ejemplo, el diagnóstico de neumopatía crónica. En la analítica de un paciente con IC aparecerá el péptido natriurético tipo B o peptido natriurético cerebral (BNP) que es secretado en respuesta a la sobrecarga de presión y volumen y es el marcador cuantitativo de sufrimiento miocárdico. BNP es una hormona cardiaca, más concretamente ventricular, que presenta efectos beneficiosos cardiovasculares y se puede medir a través de dos métodos: con el BNP y con el NT-proBNP. Debemos tener en cuenta que el BNP presenta variaciones por influencias fisiológicas: estará aumentado con la edad y disminuido en el sexo femenino y en personas con obesidad. A diferencia de la ecocardiografía, el nivel de BNP en sangre es un método accesible y ampliamente aplicable. Además, es un reflejo de la fisiopatología común en IC sistólica y diastólica. Un dato a tener en cuenta es que la concentración de NT-proBNP es mayor que la de BNP en los cuatro estadíos de IC de la clasificación de la New York Heart Association (NYHA). Como vemos en la gráfica, a medida que disminuyen las presiones de llenado ventricular medidas con un catéter de Swanz-Ganz, disminuyen los niveles de BNP. A.A., E.G., R.C. Domingo A. Pascual Figal 16
272 TEMA IC-1 CARDIOLOGÍA CMG Utilidad del BNP La Sociedad Europea de Cardiología presentó en 2005 unas guías para el diagnóstico y tratamiento de IC: IC aguda Exclusión de IC en pacientes con disnea en puerta de urgencia, valor diagnóstico: Los valores límites excluyentes del marcador de sufrimiento miocárdico son: - BNP: 100 pg/ml - probnp: 300 pg/ml Si existe una IC el aumento de BNP y probnp tiene un valor pronóstico. IC Crónica Las concentraciones plasmáticas de BNP y NT-proBNP, son útiles en el diagnóstico de IC. Una concentración baja o normal en pacientes sin tratar indica que existen pocas probabilidades de que la IC sea la causa subyacente de los síntomas. El BNP y NT-proBNP tienen un potencial de evaluación pronóstica considerable. Si el ECG, la Rx y la analítica salen normales es improbable que exista una IC, pero si se manifiesta alguna anomalía deberemos seguir el estudio del paciente mediante ecocardiografía. Es importante tener claro que todo paciente con diagnóstico clínico de IC precisa un estudio ecocardiográfico. La ecocardiografía, además de ayudarnos en el diagnóstico, nos proporciona información para el tratamiento, por ejemplo, la fracción de eyección del ventrículo izquierdo (FEV), que nos es útil para diferenciar si es sistólica o diastólica, con los datos proporcionados definiremos la cardiopatía y su etiología. Posteriormente, la ecocardiografía nos servirá para monitorizar la evolución del paciente calculando las presiones de llenado y la fracción de eyección. Si un paciente presenta un estudio ecocardiografico normal, es improbable que nos encontremos ante un caso de IC. Si es anormal se diagnosticará IC y deberemos, a continuación, definir la cardiopatía: disfunción sistólica, etiología, factores agravantes y pronóstico. Esto nos servirá para instaurar el tratamiento más adecuado: farmacológico, educación sobre el estilo de vida y disminuir la exposición a factores agravantes. Una vez en tratamiento sólo queda monitorizar la evolución del paciente valorando su peso, presión arteria y signos congestivos y NYHA. P RONÓSTICO Para establecerlo nos fijaremos en los siguientes factores 18 : Edad. Causa isquémica e IAM previo. Tercer ruido. Disnea de esfuerzo de II-IV grado en la clasificación de la New York Heart Association. Volumen máximo de oxígeno bajo (<14ml/ kg/ min). Test de los 6 minutos (<300 metros) 19. Caquexia cardiaca. Descompensaciones recurrentes. Baja fracción de eyección. Mayor dilatación ventricular. Afectación biventricular. Insuficiencia mitral. Hiponatremia. BNP o NTproBNP elevado. Anemia. Insuficiencia renal. Anchura del QRS. 18 Sobre el pronóstico de la IC se habla extensamente en el tema de trasplante cardiaco. 19 Ahora veremos en qué consiste. A.A., E.G., R.C. Domingo A. Pascual Figal 17
273 TEMA IC-1 CARDIOLOGÍA CMG Valoración del deterioro funcional El deterioro funcional se valora a través del grado de disnea, el test de la marcha y la prueba del esfuerzo cardiopulmonar. Recordemos que la disnea se clasifica en cuatro grados según la New York Heart Association (NYHA): 1. GF-I: el paciente no presenta síntomas. 2. GF-ll: los síntomas aparecen sólo ante una actividad normal. 3. GF-lll: existen síntomas ante una actividad inferior a la normal. 4. GF-lV: los síntomas se producen incluso en reposo. El test de la marcha o de los 6 minutos evalúa la capacidad funcional de un paciente cardiaco o respiratorio. Consiste en hacer caminar a la persona durante un periodo de seis minutos y luego medir la distancia recorrida y compararla con valores de referencia normales según edad y sexo. Cuando la distancia recorrida es menor a 300 metros existirá un deterioro funcional cardiaco. En la prueba de esfuerzo cardiopulmonar se registra la actividad eléctrica cardiaca mientras la persona camina sobre una cinta sin fin o pedalea en una bicicleta estática. Esto mide la reacción del corazón a una mayor demanda de oxígeno. Se considerará deterioro funcional del corazón cuando el volumen máximo de oxígeno (VO 2 máx) es menor a 14ml/kg/min y la frecuencia respiratoria (VE/VC) es mayor a 35. La IC puede permanecer como insuficiencia cardiaca crónica o puede producir una muerte súbita. Esta forma de muerte es la predominante en pacientes con arritmias ventriculares no sostenidas o sostenidas, grado de disnea I ó II, FEVI <30% o IAM previo. T RATAMIENTO En los mecanismos compensatorios se vieron algunas opciones terapéuticas, pero será ahora cuando profundicemos en el tratamiento. El tratamiento de la IC tiene cuatro objetivos principales: 1. Mejorar los síntomas, la capacidad funcional y la calidad de vida. 2. Prevenir la progresión de la disfunción cardiaca. 3. Prevenir las complicaciones y la hospitalización. 4. Mejorar la supervivencia. Para alcanzar dichos objetivos se establecerá un tratamiento etiológico (recordemos que la insuficiencia es una entidad sindrómica, y no una enfermedad), medidas higiénico-dietéticas y tratamiento farmacológico (mejora el pronóstico de estos pacientes) con dispositivos o terapias alternativas según las necesidades de cada paciente. MEDIDAS NO FARMACOLÓGICAS 20 Educación de pacientes y familiares. Monitorización del peso: Los pacientes deben pesarse todos los días. Si aumentan más de 2 kg en 3 días deberán aumentar la dosis del diurético temporalmente. Dieta hiposódica. NO ingesta de alcohol: CUIDADO con esto, ya que el alcohol es cardiotóxico y deprime la contractilidad, lo que es perjudicial para estos pacientes. Restricción de la ingesta de líquidos (ingestas de 1,5 l/día, no más). Evitar malnutrición. Vacunación. Realizar actividad física: Los pacientes deben descansar tras las comidas, y realizar algún tipo de actividad física (en la me- 20 En negrita las principales. A.A., E.G., R.C. Domingo A. Pascual Figal 18
274 TEMA IC-1 CARDIOLOGÍA CMG dida de sus posibilidades) el resto del tiempo. Evitar fármacos como los AINEs 21 o los esteroides Se debe enseñar a los pacientes a identificar signos de alarma (como cansancio, aumento de peso, notarse más hinchado) y a autoajustarse los diuréticos. Interacciones a evitar: - AINE: Cuidado, retienen Na +. - Antiarrítmicos: Todos son peligrosos excepto la amiodarona (AA tipo III) y los β-bloqueantes. - Calcio-antagonistas: No se deben utilizar aquéllos que deprimen la contractilidad como el diltiazem o el verapamil. - Antidepresivos tricíclicos: Tienen efectos colaterales cardiotóxicos. - Corticoesteriodes. - Litio. TRATAMIENTO FARMACOLÓGICO DE LA IC SISTÓLICA IMPORTANTE: Existe probada evidencia de la utilidad de algunos fármacos para mejorar la supervivencia (además de los síntomas) en la IC sistólica. En cambio, no existe ningún fármaco que mejore la supervivencia en la IC diastólica. I. Fármacos que mejoran la supervivencia y los síntomas: - IECA si es intolerante a IECA se administrará ARA II. Ambos actúan sobre la angiotensina II. Como ya se comentó, se utilizará un IECA primero. Se da aunque la tensión arterial sea baja (por ejemplo sistólica de 100). Si aparece intolerancia se cambia por un ARA-II. 21 El profesor dijo que esto era pregunta de examen. Hay que evitar sobre todo los inhibidores de la COX-2 ( os acordáis del valdecoxib que tanto adoraba Cremades?). Estos fármacos son muy peligrosos. - β-bloqueantes: Actúan en el sistema nervioso simpático. Disminuyen la mortalidad, la incidencia de muerte súbita y la progresión de la disfunción ventricular. - Espironolactona: Actúa sobre la aldosterona. - Hidralazina 22 con nitritos: Se utilizan en intolerantes a IECA o ARAII. II. Fármacos que sólo mejoran los síntomas y no la supervivencia o pronóstico: - Digital. - Diuréticos. III. Contraindicados o no indicados: - Antagonistas del calcio: Como el verapamil, pero sobretodo prohibido el diltiazem. - α-bloqueantes: Aunque algunos α-β bloqueantes, como el carvedilol sí se utiliza en el tratamiento de la IC por sus características β-bloqueantes. - Inotrópicos orales: Aumentan la mortalidad. - Inhibidores de la fosfodiesterasa. - β-miméticos: Cuidado con el salbutamol (Ventolín.) Para el manejo de estos fármacos se seguirán las indicaciones de la tabla del final del tema, pág. 20 (Tabla 1). 22 La hidralazina es un vasodilatador periférico que debe sus efectos a una acción relajante sobre el músculo liso arteriolar mediante un efecto directo. Aunque se desconoce el mecanismo molecular de la hidralazina, sus efectos podrían ser similares a los nitratos orgánicos o a los del nitroprusiato. Sin embargo, a diferencia de estos, los efectos relajantes de la hidralazina son selectivos para las arteriolas. A.A., E.G., R.C. Domingo A. Pascual Figal 19
275 TEMA IC-1 CARDIOLOGÍA CMG A continuación, tenéis un esquema de los fármacos utilizados según la clasificación funcional de la NYHA: Los IECA y ARA II reducen la hipertrofia ventricular. TRATAMIENTO DE LA IC CON LA FEV DEL VI 23 PRESERVADA (IC DIASTÓLICA) Como ya se ha dicho anteriormente, no existen fármacos mágicos en el tratamiento de esta IC. Se basa principalmente en el control de la presión arterial, control de la frecuencia cardiaca en FA y los diuréticos (para que no haya congestión). Con todo esto los pacientes van a tener mayor calidad de vida, aunque no hay ningún estudio que haya probado que vayan a vivir más También mejoran los síntomas y la calidad de vida: la revascularización coronaria, mantenimiento RS, β-bloqueantes, IECA, ARA II, calcioantagonistas 24 y nitratos. Está contraindicada o no indicada la digoxina, excepto para controlar, si existe, la FA. Los diuréticos y nitratos actúan sobre la retención hidrosalina y aumento de precarga. Los calcioantagonistas y los β-bloqueantes reducen la frecuencia cardiaca y aumentan así el tiempo de diástole. 23 Fracción de eyección del VI. 24 En este caso no están contraindicados porque la FE es normal y no es tan peligroso que depriman la contractilidad. Su efecto beneficioso lo realizan al mejorar la relajación ventricular en diástole. TRATAMIENTOS ALTERNATIVOS 1. Terapia de resincronización o marcapasos biventricular Hasta hace unos años, no se fijó la atención en la importancia de la coordinación electromecánica interventricular e intraventricular en los enfermos con ICC. Hasta en el 30% de los pacientes con IC sistólica existen alteraciones en la conducción intraventricular. La asincronía intraventricular supone una desincronización de la contracción del septo con respecto a la pared lateral, lo que causa un peor rendimiento hemodinámico debido a ineficacia de la contracción de parte del ventrículo, y puede ocasionar una insuficiencia mitral por afectar a la contractilidad de los músculos papilares. Esto se traduce en una reducción de la fracción de eyección (FE), y promueve situaciones anormales de estrés de pared. La asincronía interventricular determina que la contracción del VI se demore respecto a la del ventrículo derecho (VD). La intensa investigación desarrollada en este campo ha permitido establecer que la resincronización interventricular e intraventricular en pacientes con complejo QRS ancho, especialmente con bloqueo de rama izquierda, mejora la capacidad funcional, disminuye el número de reingresos e incluso mejora su supervivencia, asociada o no con la implantación de un desfibrilador. A.A., E.G., R.C. Domingo A. Pascual Figal 20
276 TEMA IC-1 CARDIOLOGÍA CMG El marcapasos biventricular coloca electrodos en el ventrículo derecho (tal como se ve en la imagen inferior), y en la pared ventricular izquierda mediante un acceso por el seno coronario a una vena coronaria lateral. Este tratamiento está indicado sólo en pacientes con: IC con tratamiento médico optimizado. NYHA III ó IV persistente. FEVI <35% y diámetro telediastólico (DTD) >55mm. Bloqueo completo de rama izquierda y QRS >130mseg. Las ventajas de este tratamiento no médico son: Mejora de síntomas y calidad de vida. Mejora de la supervivencia. Permite aumento de la dosis de vasodilatadores. Permite la introducción de dosis elevadas de β-bloqueantes. Permite reducir el tratamiento diurético. 2. Desfibrilador implantable Se aplica en pacientes con IC con sustrato arritmogénico. Actuará como prevención primaria en pacientes con antecedentes de IAM y FE- VI<35%, síncope sin otra causa o taquicardias ventriculares sostenidas (TVS). Como prevención secundaria en pacientes con antecedente muerte súbita. Recordemos que los pacientes con IC mueren por fallo cardiaco o muerte súbita. Este dispositivo previene la segunda (que viene a representar un 50% y es la predominante en los estadios inciales según el Harrison). 3. Asistencias cardiacas (se explicará en el tema de IC aguda). 4. Trasplante cardiaco (Se explicará en el tema de trasplante cardiaco). TABLA 1 IECA ARA-II DSVI asintomática NYHA II NYHA III NYHA IV Indicado Indicado Indicado Indicado Si intolerante Indicado (con o sin IECA) Indicado (con o sin IECA) Indicado (con o sin IECA) β- bloqueantes Indicado (post-iam) Indicado Diurético No Si precisa Antialdosterónicos Post-IAM reciente Post-IAM reciente Digoxina FA FA, si deterioro clínico previo Indicado Indicado Indicado Indicado Indicado Indicado Indicado Indicado A.A., E.G., R.C. Domingo A. Pascual Figal 21
277 TEMA IC-1 CARDIOLOGÍA CMG En la siguiente imagen vemos el ECG de un paciente subsidiario de terapia de resincronización. Vemos que el QRS es ancho y existe bloqueo de rama izquierda. La siguiente imagen es un ECG del mismo paciente tras recibir la implantación del marcapasos biventricular: obsérvese la espiga que genera la estimulación del aparato y el estrechamiento del QRS (mejora de la sincronía eléctrico-mecánica): A.A., E.G., R.C. Domingo A. Pascual Figal 22
278
279 TEMA IC-2 CARDIOLOGÍA CMG Insuficiencia Cardiaca INSUFICIENCIA CARDIACA AGUDA I NTRODUCCIÓN La insuficiencia cardiaca se manifiesta con un conjunto de síntomas y signos de congestión venosa retrógrada y/o bajo gasto anterógrado, resultado de la incapacidad del corazón para ejercer su función circulatoria. La IC aguda o inestable suele ser resultado de un factor precipitante y tiene como consecuencia la hospitalización y tratamiento urgente del paciente. Todo episodio de IC aguda es una emergencia vital cuya evolución natural es la muerte del paciente. La identificación del factor precipitante y su corrección son determinantes pronósticos a corto y largo plazo. Recordemos un cuadro que utilizamos en las manifestaciones clínicas. Ahora añadiremos los tratamientos más apropiados en cada caso (recordemos que el número de - mostraba la gravedad, aunque en este caso, después de un tratamiento muestra también la indicación o no del mismo): Congestión Perfusión FRÍO (astenia, hipotensión, oliguria, frialdad) CALIENTE MOJADO (disnea, DNP, edemas, IY, RHY) Inotrópicos, BB 1 -, VD+ - - Diuréticos +++, VD++, BB++ SECO - - Diuréticos --- -, BB+, VD+ OK No fárm.+++, diuréticos +/- VD+++ BB+++ Cosas a tener en cuenta de la tabla anterior: Frío y seco: Normalmente indica que nos hemos pasado con la dosis de diuréticos. Caliente y mojado: Tiene buena perfusión. Normalmente se soluciona con aumentar la dosis de diurético. Tiene muy buen pronóstico. Frío y mojado: Tiene muy mal pronóstico (síntomas anterógrados y retrógrados). Habrá que ayudar al corazón a bombear (por ello los inotrópicos, por ejemplo la dobutamina), si no lo conseguimos, puede que desemboque en shock. Formas de presentación Las principales formas de presentación de IC aguda son una IC descompensada, un edema agudo de pulmón (EAP) o un shock. El shock presenta una mortalidad del 50-70% y va precedido de un IAM en el 7-10% de los casos, o de cardiotomía en el 6%. La mayor mortalidad aguda del shock se debe a su irreversibilidad. La IC descompensada y el EAP tienen ambos una mortalidad en torno al 6-10%, mientras que la IC descompensada presenta más incidencia. 1 BB: β-bloqueantes. VD: vasodilatadores. A.A., E.G., R.C. D. A. Pascual Figal 1
280 TEMA IC-2 CARDIOLOGÍA CMG En la siguiente gráfica vemos como la IC descompensada es la más incidente, pero la que menos mortalidad tiene, mientras que el shock presenta poca incidencia y mucha mortalidad. C LASIFICACIÓN FISIOPATOLÓGICA Las características del shock, el edema agudo de pulmón y de IC descompensada las vemos a continuación a modo de tabla: SHOCK EAP ICdesc. Severidad Edema pulmonar PCWP Edema periférico Volumen / peso - +/- ++ Bajo gasto / SNS PAs<80mmHg FC> Diuresis<0,5ml/kg/h /- Cardiomegalia FE deprimida +/- +/- ++ Remodelado Causa orgánica aguda IC<2l/min; PAs<90mmHg; PCWP>20mmHg Fracaso circulatorio: shock Producido por un daño cardiaco agudo, severo, que disminuye mucho el trabajo cardiaco, como un IAM o regurgitación valvular aguda. Su manifestación será una hipotensión e hipoperfusión renal y cerebral. Es severo, produce edema pulmonar, bajo gasto a pesar de la hiperestimulación del sistema nervioso simpático, PAs<80mmHg, FC>100, diuresis<0,5ml/kg/h y aumenta la presión capilar pulmonar. Suele tener una causa orgánica aguda. Puede aparecer la fracción de eyección disminuida y no suele aparecer edema periférico, cardiomegalia, ni remodelado patológico. IC inestable 1. Edema agudo de pulmón debido a una cardiopatía previa con arritmias, isquemia, anemia La reserva cardiaca 3 será limitada. Se disminuye el trabajo cardiaco a la vez que se aumentan las resistencias periféricas. Presenta normo- o hipertensión y perfusión normalmente conservada. 2. Crisis de HTA con una función sistólica normal y HTA severa. Como es lógico, aumenta mucho el trabajo cardiaco. 2 PCWP o PCP: presión de enclavamiento capilar pulmonar. 3 La reserva cardiaca es la capacidad extra del corazón para bombear la sangre. A.A., E.G., R.C. D. A. Pascual Figal 2
281 TEMA IC-2 CARDIOLOGÍA CMG M ANEJO TERAPÉUTICO En el manejo terapéutico de una IC inestable debemos seguir una serie de pasos. Como ya se dijo con anterioridad, es importante saber si existe shock, ya que este tiene un manejo diferente. También preguntarnos por el factor precipitante (IAM, arritmia ) e intentar solucionarlo. Una vez realizado esto, debemos primero solucionar los signos de congestión y, si vemos que existen signos de bajo gasto tras esto, trataremos con inotrópicos. Como tercer escalón terapéutico tenemos la posibilidad de la asistencia circulatoria, y como última el trasplante cardiaco. 1. Resolución de los signos de congestión Para ello debemos mejorar la oxigenación pulmonar y reducir la precarga y postcarga de ambos ventrículos. Cómo lo conseguimos? Se alcanzan por medio de la vasodilatación arterio-venosa. Debemos mantener siempre la perfusión renal (la diuresis debe ser al menos de 0,5 ml/kg/hora) y la presión arterial sistólica (Pas) >80 mmhg. La PA óptima será la menor posible capaz de mantener la perfusión renal sin síntomas secundarios. Los agentes terapéuticos utilizados serán: - O 2 : Mejora la oxigenación (obviamente), y produce vasodilatación a nivel de la vasculatura pulmonar. - Furosemida i.v.: Diurético de asa que inhibe de manera reversible la reabsorción de Na +, K + y Cl - en la rama ascedente gruesa del asa de Henle. - Cloruro mórfico: Este opiáceo disminuye su ansiedad y así permite que baje su gasto energético. También produce vasodilatación venosa. - Nitroglicerina y nitroprusiato: Son vasodilatadores principalmente venosos. 2. Utilización de inotrópicos Si no presenta mejoría clínica o aparece una recurrencia y signos de hipoperfusión (bajo gasto, con deterioro renal) utilizaremos inotrópicos como: dobutamina, dopamina, milrinona y levosimendán. - Los β-agonistas (como la dobutamina) y los inhibidores de fosfodiesterasa (como la milrinona) tienen un efecto no específico a nivel del AMPc y calcio y aumentan la frecuencia cardiaca. Son proarrítmicos dosis-dependiente (especialmente la milrinona). Además producen taquifilaxia 4 por desensibilización (sobre todo la dobutamina, por lo que se utiliza poco). Posiblemente su efecto sea menor en IC severa. - Los sensibilizantes del calcio (como el levosimendán) provocan un cambio en la configuración de tropina C y así aumentan la contracción con los mismos niveles de calcio intracelular, por lo que no favorecen la aparición de arritmias 5. Se pueden utilizar en IC sistólica. Son también vasodilatadores. A pesar de todo, no han demostrado una superioridad clínica sobre dobutamina 6. - La dopamina es útil por sus efectos heterogéneos. A dosis bajas produce vasodilatación mesentérica y renal (a través de receptores dopaminérgicos). A dosis intermedias es agonista de los adrenorreceptores β 1 cardiacos produciendo ligera taquicardia. A dosis altas funciona también como agonista α también, lo que no es beneficioso. Se debe utilizar a dosis bajas. 4 Se llama taquifilaxia a la necesidad de consumir dosis cada vez mayores de un fármaco para conseguir los mismos efectos que se consiguieron inicialmente. 5 Esto es debido a que al no aumentar el calcio intracelular no aumentan la velocidad de conducción. Sin embargo, producen un cambio en la configuración de la troponina C que permite la utilización más efectiva del calcio que entra en la célula. Es decir Aumento de la contractilidad sin aumento del Ca 2+ intracelular. 6 Aunque el profesor dice que con el tiempo sí demostrarán ser superiores a los β-agonistas en determinadas poblaciones de pacientes. A.A., E.G., R.C. D. A. Pascual Figal 3
282 TEMA IC-2 CARDIOLOGÍA CMG 3. Apoyo circulatorio Si con los medios terapéuticos anteriormente citados no presenta mejoría clínica o aparece una recurrencia con signos de hipoperfusión (con deterioro renal) daremos apoyo circulatorio a través de: hemofiltración, balón de contrapulsación intra-aórtico, resincronización (ya se vio en el tema anterior) o asistencia cardiaca. Fijaos en el mecanismo: A. Hemofiltración 7 : Es una técnica de depuración extracorpórea continua (similar a la diálisis). En la actualidad se hace con un acceso veno-venoso que requiere el uso de una bomba de sangre para impulsar la misma a través del circuito extracorpóreo. El fallo ventricular sostenido hace que el paciente se sobrehidrate, empeorando el cuadro y manteniendo un círculo vicioso. La ultrafiltración permite la extracción del volumen retenido, mejora el remodelado ventricular, disminuye la activación neurohumoral, y a veces restaura la diuresis. B. El balón de contrapulsación intraaórtico 8 (BCIAo): Este es un dispositivo bastante maravilloso que es muy útil cuando está bien indicado. Se coloca en la aorta, distal a la arteria subclavia izquierda (ver imagen inferior). Consiste en un globo alargado que se infla y desinfla según el ciclo cardiaco, de tal modo que: Efectos hemodinámicos: Mejora la perfusión de las arterias coronarias y reduce la demanda de oxígeno por el miocardio al disminuir el trabajo que éste tiene que hacer. IMPORTANTE: Este dispositivo es muy efectivo en la insuficiencia mitral, y está totalmente contraindicado en la insuficiencia aórtica 9. El inflado en diástole del balón dentro de la aorta descendente empuja la sangre en sentido anterógrado aumentando un 20% el gasto cardíaco (perfunde mejor cerebro y riñón), y también la empuja en sentido retrógrado aumentando el flujo coronario. La desinsuflación, en sentido anterógrado, disminuye las resistencias periféricas. En sentido retrógrado disminuye la postcarga, el trabajo cardiaco y el consumo de oxígeno miocárdico, además de aumentar el gasto cardiaco. 7 La pasó rápido. Parece ser que es poco utilizada. 8 Examen! Además, el profesor dice que también sale mucho en el MIR. 9 Obviamente, al hincharse en diástole y empujar sangre retrógradamente hacia el corazón, si el paciente ya tenía una insuficiencia de la válvula aórtica previamente, ésta empeorará con este flujo de sangre que la válvula no podrá sostener. En el caso de la insuficiencia mitral, el dispositivo es beneficioso debido a que disminuye la postcarga, facilitando que la sangre salga a la aorta y no vuelva a la aurícula. A.A., E.G., R.C. D. A. Pascual Figal 4
283 TEMA IC-2 CARDIOLOGÍA CMG Aquí tenemos un esquema de la hemodinámica que produce este artefacto: Existen diferentes tipos de asistencias ventriculares: internas, externas, de flujo continuo o pulsátil, uni- o biventriculares. En la siguiente imagen tenemos un ejemplo de dispositivo de asistencia ventricular. Se trata de un dispositivo que saca sangre del ventrículo y la lleva a la aorta, impulsada por la bomba (pump): Si sigue sin responder a los tratamientos tras utilizar todas estas armas terapéuticas se puede plantear una asistencia cardiaca o un transplante urgente (es raro que esté disponible). Se considerará que no responde al tratamiento cuando a pesar de apoyo ionotrópico o circulatorio cuando: Los signos de hipoperfusión sean persistentes. Presente un NYHA IV persistente o recurrente. No se haya resuelto el factor causal. FEV<25%. Diámetro telediastólico >70mm. Otros criterios: BNP, Noradrenalina, Na +, Cr, QRS C. Asistencia cardiaca: Los dispositivos de asistencia ventricular (VAD), son bombas utilizadas para proporcionar asistencia circulatoria a enfermos en fallo cardiaco severo. La asistencia puede practicarse sobre uno o sobre los dos ventrículos, y para ello se han desarrollado varios tipos de dispositivos en función de las diferentes necesidades que se han de satisfacer. Indicaciones de la asistencia cardiaca: Puente al transplante cardiaco. Ante la dificultad para encontrar corazones donados de urgencia este dispositivo puede ser muy útil. Hay pacientes que pueden estar subsistiendo con este dispositivo, esperando un donante, hasta un año. Puente a la recuperación de: una miocarditis (suele durar unos siete días pero en ese breve periodo el paciente se puede morir), un fallo primario de injerto o un IAM por ejemplo. Se está valorando como terapia final o destino. Por ejemplo, en pacientes que no pueden recibir un trasplante. Complicaciones: Fracaso multiorgánico. Embolismos. Trombosis del dispositivo. Sangrado. Infecciones. A.A., E.G., R.C. D. A. Pascual Figal 5
284 TEMA IC-2 CARDIOLOGÍA CMG En esta imagen vemos (siguiendo la flecha) los diferentes escalones del manejo de la IC aguda: Como vemos en el esquema, tras el fracaso de todo el arsenal terapéutico disponible (primero vasodilatadores, luego agentes inotrópicos, y por último medidas de apoyo circulatorio) sólo queda la posibilidad del trasplante. A.A., E.G., R.C. D. A. Pascual Figal 6
285 TEMA IC-3 CARDIOLOGÍA CMG Insuficiencia Cardiaca TRASPLANTE CARDIACO I NTRODUCCIÓN El trasplante cardiaco es una alternativa al tratamiento de IC para un grupo específico de pacientes. Estos pacientes tienen que cumplir una serie de requisitos: Su patología debe ser terminal. Su expectativa de vida debe ser inferior a un año. Tratamiento médico realizado debe ser máximo y no deben existir otras opciones terapéuticas. No deben presentar contraindicaciones: Existencia de patologías extracardiacas que puedan limitar la vida por sí mismas o por incrementar el riesgo de rechazo. Existencia de infección u otras complicaciones de la inmunosupresión. IMPORTANTE: Toda decisión de trasplante debe ser tomada tras agotar el resto de posibilidades terapéuticas, porque el trasplante NO es una curación. Manejo del posible candidato... En la unidad de transplante del servicio de cardiología se lleva a cabo un protocolo con los posibles candidatos a transplante: Nos llega un paciente y lo introducimos en el algoritmo de pretrasplante: se hará entonces un estudio exhaustivo de su cardiopatía, una optimización máxima de su tratamiento, una estratificación del riesgo (evaluación pronóstica). Es decir: 1º Estudio exhaustivo de la cardiopatía. 2º Optimización máxima terapéutica. 3º Evaluación pronóstica. Según los resultados de estos tres pasos se realizará el trasplante o un seguimiento estrecho, tras el cual se reevaluará al paciente. No se nos puede olvidar, antes de realizar el trasplante valorar las posibles contraindicaciones, ya sea el trasplante urgente (supone el 25% de todos los trasplantes) o electivo. En este tema repasaremos someramente la optimización máxima terapéutica (en realidad ya lo vimos en los dos temas anteriores), y nos centraremos en la evaluación pronóstica. Posteriormente veremos indicaciones (selección del receptor), algunas generalidades de contraindicaciones, trasplante urgente, y otras cosicas. A.A., E.G., R.C. D. A. Pascual Figal 1
286 TEMA IC-3 CARDIOLOGÍA CMG T RATAMIENTO OPTIMIZADO Recordamos a modo de lista las principales armas terapéuticas para que recordéis lo explicado en los temas anteriores: E Educación y rehabilitación Tratamiento médico: IECAs o ARA II β-bloqueantes Espironolactona Apropiado uso de diuréticos DAI y resincronización. Revascularización (si es viable). Valorar otros tratamientos posibles, como la reparación mitral, reducción ventricular VALUACIÓN PRONÓSTICA o o Arritmias ventriculares: también son de mal pronóstico. Caquexia: Esta enfermedad metabólica que aparece como estadio final de la IC es, por supuesto, de mal pronóstico. Se habla de caquexia cuando existe pérdida de peso de más del 7,5% en los últimos 6 meses. 1 PARÁMETROS FUNCIONALES Son de gran relevancia 2. Recordamos de nuevo que los requisitos indicados son de mal pronóstico: o NYHA IV (también, aunque menos, el III). o VO 2 máx. < 14ml/kg/min. 3 o VE/VCO 2 >34. 4 Estos valores se obtienen en la prueba de esfuerzo cardiopulmonar, para evaluar el pronóstico se tendrá más en cuenta el consumo pico de oxígeno (VO 2 máx.) que la fracción de eyección. o Test de los 6 minutos < 300m: Si el paciente anda en 6 minutos menos de 300 metros, esto será de mal pronóstico. PARÁMETROS CLÍNICOS Los parámetros clínicos a evaluar que se muestran a continuación son aquellos que empeoran el pronóstico: o o o o Una IC de larga evolución, es de mal pronóstico. Etiología isquémica: Esta etiología empeora el pronóstico con respecto a las demás. Múltiples ingresos, descompensaciones o apoyo ionotrópico i.v.: Cuando un paciente tiene carpeta gorda, gran número de descompensaciones y necesita de apoyo de inotrópicos como la dobutamina, lógicamente su pronóstico es menos favorable. Intolerancia a IECAs y/o β-bloqueantes: La intolerancia a estos fármacos es sugestiva de gran afectación cardiaca. Por ello es de mal pronóstico. 1 La IC comienza su clínica con manifestaciones hemodinámicas, continúa con hormonales, para terminar con las manifestaciones metabólicas. La caquexia es de estas últimas. 2 Aprendeos las cifras porque el profesor dijo que saldría una pregunta de los datos pronósticos. Además dijo que preguntaría bastante de este tema porque éramos pocos en la clase. 3 La VO 2 máxima es el consumo pico de oxígeno al que puede llegar el paciente. Tiene mayor valor pronóstico que la fracción de eyección. 4 Este parámetro muestra la relación entre la ventilación y la producción de CO 2 (equivale a la ventilación necesaria por unidad de producción de CO 2 ), es decir, refleja la ineficacia ventilatoria. Un valor >34 es mal pronóstico. A.A., E.G., R.C. D. A. Pascual Figal 2
287 TEMA IC-3 CARDIOLOGÍA CMG Clasificación funcional de la NYHA 5 La NYHA (New York Heart Association) define cuatro clases de IC, sobre la base de la valoración subjetiva que hace el médico durante la anamnesis, fundamentado sobre la presencia y severidad de la disnea: Grado I: no se experimenta limitación física al movimiento, no aparecen síntomas con la actividad física rutinaria, a pesar de haber disfunción ventricular (confirmada por ejemplo, por ecocardiografía); Grado II: ligera limitación al ejercicio, aparecen los síntomas con la actividad física diaria ordinaria (por ejemplo subir escaleras) resultando en fatiga, disnea, palpitaciones y angina, entre otras. Desaparecen con el reposo o la actividad física mínima, momento en que el paciente se está más cómodo. Grado III: marcada limitación al ejercicio. Aparecen los síntomas con las actividades físicas menores (como el caminar) y desaparecen con el reposo. Grado IV: limitación muy severa, incapacidad para realizar cualquier actividad física. Aparecen los síntomas aún en reposo. PARÁMETROS HEMODINÁMICOS o o o o o FEVI <20%: Como ya se dijo anteriormente, tiene menor valor pronóstico que la VO 2 máx. FEVD 6 <35%: Ésta es muy importante, ya que empeora considerablemente el pronóstico. Índice Cardiaco < 2 l/min m 2 : El índice cardiaco es el gasto cardiaco (GC) por m 2 de superficie corporal del paciente. Su valor normal es de 2,5 l/min m 2. Volumen Sistólico < 40ml. Presión en la AD 7 > 10 mmhg. o o o o PCP 8 >25 mmhg. Ésta presión, medida con un catéter de Swanz-Ganz, tiene como valor normal 15 mm Hg 9. La PCP aumenta retrógradamente, es decir, se produce primero aumento de presión en el VI, que hace que aumente la de la AI y, de ahí, la presión se transmite retrógradamente a los capilares pulmonares. Cuando esta situación se produce de manera crónica, se provoca un mecanismo defensivo con fibrosis y vasoconstricción en la vasculatura pulmonar, y la PCP permanecerá entre 20 y 25. Por esto, en un episodio agudo, en el que aún no se ha producido el mecanismo compensatorio, con tan sólo 20 mmhg de PCP se puede producir edema pulmonar. Mala respuesta del GC al ejercicio (en la prueba de esfuerzo). Insuficiencia mitral severa funcional. Indica dilatación del anillo. PARÁMETROS GICOS o o o Patrón de llenado persistente restrictivo. ELECTROFISIOLÓ- Arritmias ventriculares, como extrasístoles ventriculares o fibrilación ventricular. Reducción de la variabilidad de la frecuencia cardiaca: Lo normal es que la FC tenga algunas variaciones, como aumentar por la mañana o que aumente con el ejercicio. La reducción de esta variabilidad es de mal pronóstico. Conducción intraventricular prolongada (QRS > mseg). Cuanto más ancho es el QRS peor es el pronóstico, ya que a mayor QRS, mayor es la duración de la despolarización ventricular, y menor efectiva será la sincronía eléctrico-mecánica. La solución a esta situación es la terapia de resincronización (marcapasos biventricular). 5 Esta clasificación se utiliza a lo largo de los temas de IC y la dimos en PG el año pasado. Es importante. 6 Fracción de eyección del ventrículo derecho. 7 AD: Aurícula derecha. 8 PCP: Presión capilar pulmonar. 9 Ponemos los valores normales porque el profesor Pascual dijo que eran importantes, y que a lo mejor los preguntaba. A.A., E.G., R.C. D. A. Pascual Figal 3
288 TEMA IC-3 CARDIOLOGÍA CMG PARÁMETROS BIOQUÍMICOS INDICACIONES RELATIVAS o o o Péptidos natriuréticos: ANP. BNP (>100pg/ml). Porción NT pro-bnp (>5.000 pg/ml). Como ya se dijo estas determinaciones tiene valor diagnóstico (sólo tienen alto el valor predictivo negativo) y valor pronóstico, ya que son reflejo del sufrimiento del miocardio. Catecolaminas plasmáticas: Su concentración elevada es de mal pronóstico. Pero son muy difíciles de medir. Sodio sérico (<130mEq/l). Son las situaciones en las que es difícil decidir si se trasplantan o no. VO 2 entre 10 y 14 ml/kg/min o del 55% de lo previsto. Múltiples ingresos por SCA (síndrome coronario agudo) no susceptible de revascularización. Inestabilidad del balance hídrico (función renal). INDICACIONES INSUFICIENTES Estas situaciones NO indican trasplante. S ELECCIÓN DEL RECEPTOR Con respecto a la selección del receptor del corazón donado tenemos una serie de indicaciones, algunas absolutas y otras relativas. También existen algunas situaciones que NO son indicación. 10 FEVI severamente deprimida 11 : NO indica trasplante. Es más importante la situación funcional. Historia previa de síntomas clase III-IV. Arritmias ventriculares previas. VO 2 máx. >15 ml/kg/min ó > del 55% de lo previsto. INDICACIONES ABSOLUTAS Para estas situaciones SIEMPRE está indicado el trasplante. Compromiso hemodinámico por: Shock cardiogénico refractario. Dependencia de aminas. VO 2 < 10 ml/kg/min. Síntomas severos de isquemia limitante no susceptible de revascularización. Arritmias ventriculares refractarias. T RASPLANTE URGENTE Los trasplantes urgentes suponen el 25% del total de trasplantes cardiacos. Buscamos el máximo beneficio clínico en casos de urgencia sin otras posibilidades terapéuticas. Las situaciones en las que se indica código 0 12 son: ARRITMIAS malignas incontroladas ( tormenta arrítmica 13 ). 10 Según el profesor Pascual es más importante que sepamos valorar el pronóstico que esto. De las indicaciones dijo que sobre todo le interesaba que conociéramos las que son insuficientes. 11 Esto es pregunta de examen. 12 Código 0 significa que el primer corazón disponible en España se destinará a ese paciente. 13 Se define la tormenta arrítmica o tormenta eléctrica como episodios repetidos de taquicardias ventriculares sostenidas o fibrilación ventricular a pesar del tratamiento. A.A., E.G., R.C. D. A. Pascual Figal 4
289 TEMA IC-3 CARDIOLOGÍA CMG FALLO CARDIACO (shock) refractario con necesidad de cualquiera de estos tres dispositivos : C Balón de contrapulsación. Ventilación mecánica. Asistencia ventricular mecánica. ONTRAINDICACIONES 14 Contraindican el trasplante de corazón las patologías extracardiacas que puedan limitar la vida por sí mismas o por incrementar el riesgo de rechazo, de infección u otras complicaciones de la inmunosupresión. Aquí tenemos una lista de situaciones que lo contraindican. Edad superior a 65 años. Enfermedad sistémica de mal pronóstico. Enfermedad del miocardio infiltrativa. Hipertensión arterial pulmonar (HTAP) irreversible: Para protegerse del edema ocasionado por la IC, en la vasculatura pulmonar se producen cambios irreversibles que aumentan las resistencias vasculares y producen la hipertensión arterial pulmonar. Este mecanismo será positivo para evitar que empeore el edema pulmonar, pero es negativo pues se hace irreversible y ocasiona insuficiencia ventricular derecha. De esta manera, cuando el paciente recibe el trasplante, el nuevo corazón tiene un VD normal 15, con lo que éste no podrá soportar las altas presiones de la red pulmonar y se dilatara y fracasará, entrando en shock. 14 En cuanto a las condiciones que pueden excluir un trasplante, dijo el profesor que no teníamos que sabernos la lista. Prestad atención a la más importante de ellas la hipertensión pulmonar. El resto de contraindicaciones importantes están en negrita. 15 La pared ventricular derecha de un corazón normal es prácticamente papel de fumar. Por esto, la HTAP es la principal causa de muerte en quirófano, y también la principal contraindicación del trasplante. La presión sistólica de la arteria pulmonar (PAPS) normal es de 30mmHg, y viene determinada por el gasto cardiaco y la resistencia vascular pulmonar (RVP que se mide en unidades Wood). Para realizar un trasplante es importante valorar la resistencia pulmonar a través del catéter de Swan-Ganz (cateterismo derecho), ya que nos indicará el estado en el que se encuentra la arteria. Así, a todo paciente candidato a trasplante se le hace un cateterismo derecho. El número mágico para saber si está contraindicado o no es el valor de la resistencia en la arteria pulmonar: RVP > 6 Unidades Wood. 16 Otros datos de relevancia son el GTP >15 mmhg 17 y la PAPS>60 mmhg 18. Si las resistencias pueden ser reducidas a menos de 3 unidades Wood, manteniendo la presión arterial sistémica mayor de 80 mmhg, se considera reversible, pero el riesgo sigue siendo alto. Se prueba la reversibilidad con O 2, (ya que éste es el mejor vasodilatador pulmonar), con otros vasodilatadores pulmonares (prostaglandinas i.v.) y con apoyo inotrópico (dobutamina i.v.). Un paciente con una PAPS de 40 mmhg, con elevadas resistencias y bajo gasto cardiaco, tiene peores condiciones para un trasplante que otro paciente con PAPS de 60 mmhg, con resistencias bajas y gasto conservado. 16 RVP: Resistencia vascular pulmonar. Este parámetro no se puede medir directamente, así que se obtiene de la siguiente manera: Donde AP es arteria pulmonar, presión wedge es presión capilar pulmonar y VM es el volumen minuto. El resultado se expresa en unidades Wood, en honor al primer médico que las utilizó. Una unidad Wood corresponde a 80 dynas/segundo/cm-5 en el sistema internacional Todas estas cosas no hay que saberlas por supuesto xd 17 El GTP es el gradiente transpulmonar, el resultado de restar a la presión arterial pulmonar media, la presión capilar pulmonar. 18 PAPS: Presión arterial pulmonar sistólica. A.A., E.G., R.C. D. A. Pascual Figal 5
290 TEMA IC-3 CARDIOLOGÍA CMG Esto se debe a que en este último caso, si mejoramos las condiciones hemodinámicas, se mejorará la hipertensión pulmonar, al tener la arteria menos resistencia y mejor estado vascular. Aunque ambas (resistencias periféricas y GC) son los responsables de los valores de tensión arterial pulmonar, lo importante son las resistencias vasculares (que pueden ser irreversibles como mecanismo compensatorio como ya se ha visto), y no el gasto cardiaco, ya que éste es reversible tras el trasplante. R EGISTRO ESPAÑOL Número de transplantes por año Tras este importante receso continuamos con la lista de contraindicaciones al trasplante cardiaco: Enfermedad pulmonar irreversible. Arteriopatías periférica o cerebral severa. Complicación tromboembólica reciente (<6semanas). Insuficiencia renal (con aclaramiento de creat. <30-50ml/min). Insuficiencia hepática. Úlcera péptica activa. Diverticulosis activa. Diabetes Mellitus insulino-dependiente con afectación de órganos diana. Bacteriemia activa no controlada con Atb (excepto si es por llevar dispositivos de asistencia ventricular). VIH. Hepatitis B y C. Neoplasias. El desarrollo del trasplante cardiaco como alternativa terapéutica se ha debido al desarrollo de los inmunosupresores (la ciclosporina fue el primero en los años 70-80). En España, el máximo llegó a 350 al año. Actualmente se hacen de 250 a 300. Ha disminuido el número porque ha mejorado la terapéutica de la IC. El paciente tipo receptor de un trasplante cardiaco es un varón (existe predominio masculino) de 50 años. Número de trasplantes cardiacos infantiles Enfermedad psiquiátrica: - Alcohol: Al menos abstinencia >6 meses. - Retraso mental: Importante si adherencia al tratamiento. Obesidad severa: peso > 140%. Osteoporosis severa. Como vemos, el número de trasplantes de corazón infantiles es muy fluctuante, ya que existe muy poca disponibilidad de donantes. Patología de base El tipo de patología de base que obliga al trasplante es bastante heterogénea, aunque existen tres principales, la cardiopatía isquémica, la MCD idiopática y las valvulopatías: A.A., E.G., R.C. D. A. Pascual Figal 6
291 TEMA IC-3 CARDIOLOGÍA CMG 44% Cardiopatía isquémica. 33% Miocardiopatía dilatada idiopática. 9% Valvulopatías. 14% Otras Técnicas quirúrgicas Existen dos técnicas principalmente en la cirugía del trasplante de corazón: A. Implante con anastomosis biauricular: Es la técnica antigua, aunque es la que se realiza actualmente en el HUVA. En ella se deja en su sitio la porción posterior de las aurículas del receptor. B. Implante con anastomosis bicaval: Es la única modificación de la técnica operatoria en años recientes. Se cambia la anastomosis de la aurícula derecha por anastomosis a nivel de las cavas superior e inferior. Es la técnica más fisiológica, ya que se conserva mejor la geometría de la aurícula derecha y se evitan arritmias auriculares. En la imagen que sigue podemos ver la situación antes de la realización de la técnica bicava, con la aurícula derecha eliminada totalmente y conservándose la parte posterior de la aurícula izquierda. R ECHAZO DEL INJERTO El riesgo de rechazo es mayor al principio y se controla con la inmunosupresión inicial, que después se va reduciendo a la vez que se monitoriza la aparición de rechazo mediante biopsias endomiocárdicas. Se hacen aproximadamente 10 biopsias programadas el primer año para conocer el rechazo y así monitorizar la reducción progresiva de la inmunosupresión durante este primer año. Los rechazos se tratan con aumento de la inmunosupresion, bolos intravenosos de esteroides y a veces también con plasmafére- A.A., E.G., R.C. D. A. Pascual Figal 7
292 TEMA IC-3 CARDIOLOGÍA CMG sis cuando existe disfunción ventricular asociada 19. Las complicaciones del trasplante son en parte por el propio trasplante y en parte por la propia inmunosupresión, necesaria para evitar el rechazo. Las principales complicaciones son: infecciones (citomegalovirus), insuficiencia renal, complicaciones óseas, neurológicas, neoplasias Las neoplasias más frecuentes son los linfomas y las de la piel. ran la retirada total de la inmunosupresión 20. Actualmente la vida media es de 10 años. ENFERMEDAD VASCULAR DEL IN- JERTO Supervivencia La principal causa de mortalidad en el trasplante cardiaco es el fracaso primario del injerto que es el fallo precoz (en el quirófano o en las primeras 24 horas) del corazón implantado. La mortalidad precoz es del 15%. El principal factor favorecedor es la hipertensión pulmonar del receptor pero también influye la edad del donante y el tiempo de isquemia en el traslado del órgano (idealmente debe ser menor de 180 minutos totales). La supervivencia al trasplante cardiaco, como ocurre en el resto de trasplantes, ha ido mejorando gracias al avance de los inmunosupresores, el objetivo es poder llegar a la tolerancia total del injerto sin necesidad de inmunosuprerores. Hay algunos pacientes que tole- 19 La plasmaféresis, también llamada recambio de plasma, es una técnica que permite la separación de la sangre en sus dos componentes, celular y plasmática. Posteriormente se substituye el plasma del enfermo que contiene los anticuerpos por albúmina o plasma de otros sujetos sanos que, junto con sus células sanguíneas se transfunden de nuevo al paciente. De esta manera se eliminan los anticuerpos del torrente circulatorio. Se produce una obliteración difusa, concéntrica 21 y progresiva de los vasos coronarios del injerto, debida a la proliferación de la íntima. Está presente en el 42% de los trasplantes cardiacos a partir de los 5 años del trasplante. Es la principal causa de muerte a largo plazo en los pacientes con trasplante cardiaco que sobreviven más de un año. Ocasiona el 20% de todas las muertes. Su etiología es multifactorial, ya que intervienen tanto factores inmunológicos como no inmunológicos. La clínica con la que aparece es bastante inespecífica, con arritmias, dolor torácico, insuficiencia cardiaca, e incluso, muerte súbita. Para su diagnóstico es de elección la ecografía intravascular coronaria (IVUS). 20 Aunque actualmente hay un grupo de investigación multidisciplinar en el HUVA que estudia este aspecto del trasplante y la inmunotolerancia (especialmente en trasplante hepático) mediante el análisis de moléculas de histocompatibilidad HLA-C. 21 Recordemos que la arterioesclerosis coronaria habitual se produce de manera focal. En la enfermedad vascular del injerto la coronariopatía no se produce focalmente, sino en toda la coronaria. A.A., E.G., R.C. D. A. Pascual Figal 8
293 TEMA IC-3 CARDIOLOGÍA CMG ZONA SE ACABARON LAS ZONAS! Terminó la comisión! Y ahora, como este es el final, vamos a ponernos un poco románticos con las dedicatorias de algunos de los comisionistas, e incluso con un poema muy peculiar : Pepe: Bueno, llegó la hora de despedirse de esta comisión. Ya me jodería tener que escribirte estas líneas que tanto le gustan a algun@s (más algunas que algunos). Quiero que sepas que he decir GRACIAS a todos mis compañeros de comisión por la ardua tarea ejercida. A Carlos por su gran labor y puntualidad, a María, por trabajarse tanto esta altruista encomienda, y por estar ahí siempre que la he necesitado, a Pedro 22 y sobre todo a May, por el trabajo desempeñado, por la puntualidad, por su gran gran gran disposición, y por ayudarme cuando me encontré sobrecargado durante esta cardiocomisión 07/08, así como por todo lo que tú ya sabes y que callo, pues paso de empalagar a la sociedad general. También le agradezco a la Dra. Justicia (IAG-EGEtc, alias La justicia me vicia ) su riguroso trabajo revisándonos todos los temas, así como la compadezco por ser cómplice de penas de mis más oscuros y lascivos deseos. A Einyel por ser mi otro yo, y saber compartir este mandato autoimpuesto. Y a Rabben y Esther por currarse, aunque ocultos a mis ojos, la comisión que hoy tienes en las manos. Y por último, y no por ello menos importante, te agradezco a ti, compañero, el confiar en esta comisión para estudiar Cardiología. Espero que sepas apreciar el enorme trabajo que lleva detrás, que comprendas que sólo con ganas se puede lograr. Y ojala te animes y te solidarices, para que quizás, creas conveniente participar en otra comisión el próximo año, ya que juntos es como mejor se escalan las montañas que nos llevan hasta la morada de Asclepíades. Un abrazo. Ángel: Parece mentira que hayamos terminado, aunque en realidad, ya era hora!!! Primero agradecer su trabajo a Pedro, María, May, Carlos, Pepe, Irene, Rubén y Esther, sois todos unos pedazo de comisionistas y habéis hecho la comisión buscando el mayor rigor, y con mucha motivación, lo que no es fácil con las clases que a veces nos dan... Especial mención a Pepe, May y Carlos con los que he trabajado codo con codo y han tenido, como yo, que pasarse horas y horas buscando y rebuscando qué seleccionar y qué no seleccionar del Harrison (temario de examen de cardiopatía isquémica ) para la comisión; y a Rubén y Esther, porque éste es nuestro segundo año juntos en una comisión y de nuevo ha sido genial trabajar con vosotros: Esos paseíllos a la -1, con buzones asesinos y trozos de bizcocho, xd. Por cierto, comiquísimo el arritmioema, xddd. A más de uno nos va a servir para memorizar algunos de esos interminables nombres :D. Sé que no es común, pero tengo que mencionar aquí también a profesores, porque hemos tenido la suerte de que tanto Alberola, como Pascual, como Gimeno han revisado los temas con muy buena disposición y nos han ofrecido toda clase de ayuda. Especialmente Alberola (fenómeno donde los haya) que hasta me corrigió la Zona ECG de IAM, cuando eso tenía que haberlo hecho Valdés 22 Por qué? Por enseñarnos a los demás lo que es la meticulosidad, el trabajo duro y la dedicación, por ayudarme a resolver todo lo que no me quedaba claro, por estar ahí y por los Por qué? A.A., E.G., R.C. D. A. Pascual Figal 9
294 TEMA IC-3 CARDIOLOGÍA CMG También agradecerle a Miguel su ayuda porque, además de haber impulsado todo este tinglado de comisiones fabulosas y haber tenido bastante que ver en que saliéramos felices y contentos en las batas xd, ha contribuido a las zonas ECG haciendo de menor tamaño las imágenes. No se me olvidan los agradecimientos al resto de comisionistas, porque este año continúa el buen nivel de las comisiones, y me sigo sintiendo muy orgulloso de pertenecer a esta clase. Animo sinceramente a los que aún no se han decidido a participar en ninguna comisión para que lo hagan al año que viene, porque es una experiencia muy gratificante. Tampoco se me olvidan los revisores no oficiales de las comisiones, porque lo bueno de nuestra clase, de nuestras comisiones y de nuestra página, es que todo aquel que es usuario de una comisión es potencialmente también un revisor, que puede detectar una incorrección, o puede preguntar sobre algo dudoso en la página, y también puede ayudar con esto al estudio de los demás. Por último, gracias a mi compañera de fatigas y de risas, la que me aguanta y me hace feliz, mi screening y apoyo constante. Gracias Paola Mireia. Espero que la comisión os sea útil y didáctica, y os anime a saber e investigar más. Por nuestra parte hemos intentado hacer hincapié en la comprensión del ECG porque es una herramienta que, como la Rx de tórax, todo médico debería comprender y saber interpretar. Quería ser breve pero está visto que no puedo, xd. Ánimo a todos con la cardio! Carlos: Solo quería decir que participar en la realización de esta comisión me ha resultado muy agradable y que ha sido muy llevadera gracia al trabajo en grupo de los comisionistas de cardio; en definitiva, que ha sido un placer trabajar junto a vosotros y para el resto de compañeros espero que os sea de utilidad y facilite el estudio de esta asignatura. Rubén: Cuando Ángel me dijo este verano: y si nos hacemos de cardio?, pensé: Madre mía! Este tío está loco!!!!!!!, CARDIO!!!!! (Cardiología, completo, que asusta más). Después de ver la grandiosa y perfectísisisisima comisión de PG del año pasado, no me sentía con fuerza (cojones, vamos) como para hacer algo que se le pareciese de lejos. Acepté el reto y no me arrepiento. No he logrado aquella hazaña que mis compgñeros hicieron, sacando temas que parecían tratados, de la nada, pero he trabajado muy a gusto y con el ánimo que implica ser comisionista de una asignatura preciosa ( verdad Irene?) y para una clase que se lo merece. Quisiera agradecer a Ángel el haberme metido en este fregao y a Esther mil cosas!!. Gracias a los dos por las correcciones que hacen aprender, por esos paseos de camino al GRAN MAESTRO (Alberola, está claro, máquina donde los halla), por risas, prisas, subrayados, negritas, diapositivas, formatos Espero contar con vosotros cada año como hasta ahora, compañeros de viaje, comicompis besabrazos y demás muestras de empalagoso afecto para vosotros pjjj! Gracias al resto de cardiomisionistas que, aunque de manera independiente, han trabajado por el mismo objetivo que yo, con sus quebraderos de cabeza, troponinas, CK-MB, ST, soplos, insuficiencias, sistolo-diastólicas y sistólicas pesahombres aisladas (pesahombre, es con h verdad?, baha ). Como no, acordarme del resto de comisionistas que me hacen la vida más suave, como la vaselina de nuestra querida madrina. Gracias a todos por ser así y por darme el sustrato de mi orgullo por pertenecer a una clase tan chula como esta. Como esto todavía es más corto que los post de la Tribuna de Josemi, ahí va un resumen de la creación: A.A., E.G., R.C. D. A. Pascual Figal 10
295 TEMA IC-3 CARDIOLOGÍA CMG ARRITMIOEMA POR RUBÉN CARRASCO TORRES Que tranquilo va el corazón, Cuando normal es su conducción, Sin cardiopatía estructural, Ni alteración funcional. Si me noto palpitación, El diagnóstico diferencial, amor, Si me noto sudaera, El examen de cardio me espera. Pero, y si examen no hay ni amor me desvela? Haz un electro, a ver que muestra, Coge la comisión, que mola mogollón, En la parte de arritmias estará la solución. Va rápido, o va lento? QRS ancho o estrecho? Mira la onda P, antes de fibrilar, Y el ST, no la vayas a cagar. Prepara la adenosina, Que ante dudas, te salvará No vaya a ser que tenga Una taquicardia sinusal. Si lo que pasa es de tipo Paroxístico supraventricular, En bolo adenosina, y si has acertado, Lo curarás. No te asustes si, acelerado ves, un ritmo nodal Porque aunque se llame tal que TC no paroxística de la unión auriculoventricular, Con to ese nombre, inocente es como la que más. Llámese accesoria, La vía pecaminosa que preexcitarme quiere, Taquicárdico me mantiene como amor que retiene, Con un PR corto cuya onda delta sostiene. Uno era Ortega y Gasset, Y Wolf-Parkinson- White, tres, Por si duda alguna había, Sobre la estrofa anterior que yo escribía. Vaya gracia si la aurícula se pone a temblar, Es muy frecuente, es verdad, Puñetera, también, no te voy a engañar, Repásatela por si hubiese que anticoagular. Si el QRS engorda, el bloqueo te ronda, Pero ojo si la cosa viene de abajo, Que el ventrículo es de todo menos majo, Antes que complejo ancho, en los ojos ajo. Y en las cosas serias, empiezas a entrar, Cuando el ventrículo dice de fibrilar, De muerte súbita no quiero ni hablar, Pues triste mi arritmioema, se empezaría a tornar. Menos mal que tenemos, chulos marcapasos, Que ponen a tono, a los lentos casos, Wenckebach, Mobitz, qué más da? Te metemos los cables y a funcionar! Y con esto acabo, este humilde poema, Con el fin de alegrar algunos corazones, Que Dios nos libre de usar, las últimas letras, Y que seamos médicos con un par de..razones. María: Ahora q acabo de re-revisar las endocarditis x enésima vez, no estoy muy inspirada q digamos, pero como es mi primera comisión me hace ilusión escribir unas líneas sin tener q comprobar lo q escribo con diapositivas, apuntes y bibliografía!! Mi parte de la comisión se la dedico a los futuros cardiólogos de la clase, y a mis compis de la comisión, sobre todo a Pedro y a Pepito x haber aguantado la gran epidemia de mails sin adjuntos, adjuntos sin mail, comentarios kilométricos ( de distintos colores ) pero sobre todo las re-revisiones!! Espero q os sirva la comisión, aunq sea un poquito!!mucha ánimo con el estudio y suerte! Esther: Quiero empezar dando las gracias a todas esas personas que hacen que para mí medicina no signifique sólo estudiar: desde las que comenzaron a formar parte de mi vida en primero, pasando por las que compartieron inolvidables prácticas, hasta las últimas adquisiciones de este año: os quiero un montón!! Sois geniales!! No me puedo resistir de, un año más, recalcar a una amiga, que ya me acompañaba antes de empezar la carrera, Lidia, muchas gracias, especialmente este año, por esas conversaciones interminables y esos gestos y miradas que valen más que mil palabras A.A., E.G., R.C. D. A. Pascual Figal 11
296 TEMA IC-3 CARDIOLOGÍA CMG Ahora, me gustaría centrarme en todos mis compañeros comisionistas, esos que facilitan enormemente mi estudio, pero que se pasan tardes enteras delante del ordenador dándole forma y sentido a clases que, en ocasiones, no lo tienen. No os podéis ni llegar a imaginar lo necesarios que sois para mí (y supongo que para la mayoría de gente), muchísimas gracias por vuestro trabajo y esfuerzo!! Dar las gracias principalmente a todos los que han hecho posible que esta comisión de cardiología salga adelante: Pepe, Ángel, Rubén, May, Carlos, María, Pedro e Irene Azenaia. Pero muy especialmente a mis comicompis: Ángel y Rubén, esos que el primer día de clase, allá por septiembre, se me acercaron para decirme Esther, tenemos que hacerte una proposición. Cuando escuché la asignatura de la que me querían hacer participe creo que me temblaron hasta las piernas, este año la cosa iría de asuntos del corazón Pero enseguida acepté, porque como he dicho por ahí alguna vez, soy una arrítmica total xdd, musicalmente hablando. Además no podía dejar pasar la oportunidad de trabajar de nuevo codo con codo con ellos: todo un nivelazo!! son lo máximo, no sólo como estudiantes y comisionistas, sino también como personas y amigos. Farmacocardiólogos, ya sabéis que os tengo un montonazo de empalagoso afecto, a ver con qué reaparecemos el año que viene Besabrazos!! Por cierto, Rubén, grandioso tu arritmioema, es buenísimo, nunca dejarás de sorprenderme xd He de reconoceros que hacer esta comisión en ocasiones se me ha hecho cuesta arriba, pero el esfuerzo a merecido la pena. Estoy muy contenta por dos motivos: primero, porque por fin he aprendido, más o menos, a interpretar un ECG!! Y segundo, por saber que a mucha gente esta comisión le está siendo muy útil, interesante e incluso puede llegar a hacer feliz a alguna persona (Irene, gracias por TODO, en esta ocasión, gracias por tu apoyo y pasión contagiosa por la cardiología y cardiólogos xd) No quiero terminar sin mencionar a Miguel, ese programa milagroso que no sólo hace posible que los ECG gigantes ocupen un espacio casi insignificante, sino que también es capaz de tener pequeños grandes detalles, como asimilar que mi nombre lleva una H intercalada (ya era hora!! jajajajaja) y, el más importante: La inteligencia es una constante que se mantiene en el tiempo, mientras que la población es un ente que va creciendo Muchas gracias!! Bueno, y ya por fin, para terminar, recordar una frase que dijo el grandioso Alberola en una de sus clases explicando la desfibrilación: ya sabéis, en caso de duda, 300 (au, au, auuuu ) lo dijo de verdad, eh!! jajajaja Ya falta nada para irnos de viaje: yujuuuu!!! Cuarto será un año inolvidable, sin duda alguna. Mucho ánimo y suerte para todos!! Irene: Revisando todos los temas de esta comisión he aprendido muchas cosas cardiología? (más quisiera yo que con una leída fuera suficiente); sobre todo he descubierto grandes cualidades de mis compañeros cardiocomisionistas: he logrado penetrar en sus más íntimas faltas de ortografía, en sus expresiones en ocasiones extrañas, en la curiosa manía de no poner puntos al final de las frases, en su intento de aportar un lenguaje igualitario ( mezclando artículos femeninos con nombres masculinos y adjetivos femeninos!), y un largo etcétera de trapos sucios gramaticales jeje Obviando lo anteriormente comentado, he de aplaudir la labor de los participantes de esta larga y dura...( no penséis mal, mentes sucias) comisión. Sin duda, ha sido un arduo trabajo componer temas tan complejos y, bajo mi humilde criterio, tan bien resueltos. Tampoco cabe duda de que nuestro trabajo es mejorable si así lo creéis sólo hay una forma de demostrarlo: participad en una comisión! (esto va por MMC y su incansable labor para lograr la solidaridad del grupo ). Por otra parte, es imprescindible que cite a dos personas que, a pesar de no ser cardiocomisionistas, me han echado una mano en momentos de acúmulo masivo de temas para revisar: José Miguel ( todos sabemos que trabajas en la sombra!) y Emilio ( no tiene pinta de estar mucho en la sombra-te dedico la gracia porque es muy tuya-). Gracias a los dos porque sois unos cracks y me hacéis muy buen papel (jeje). A.A., E.G., R.C. D. A. Pascual Figal 12
297 TEMA IC-3 CARDIOLOGÍA CMG Para el final dejo algunas cosas pendientes: 1. Un autógrafo para Irene Martínez, la persona más emocionada con una comisión que se haya visto (fan nº1!! Así da gusto). 2. Me quito el sombrero ante el poema de Rubén, es genial. 3. En tinta china están los halagos hacia Pedro (solicitados explícitamente por el interesado). 4. Bravo por los recuadros interesantísimos insertados por Ángel, Rubén, etc, bravo por los por qué y los esquemas de cápsulas de Pedro. 5. Me encanta estudiar cardio y ver a Heidi o al doctor House en la comisión. 6. Pepe, muy conseguido el formato del título de aneurismas, jeje. Un saludo a tod@s. May: Por segundo año, me siento muy orgullosa de haber podido participar en una comisión de apuntes, y más, es una asignatura tan preciosa como es Cardiología. Quisiera agradecer el enorme esfuerzo que han hecho mis compañeros en la realización de cada tema; y la paciencia de todos vosotros, esperando que saliera cada tema. Creo que el resultado final ha merecido la pena, no créeis?. Ha sido un placer compartir este trabajo con vosotros, chicos: Carlos, Pepe, Ángel, Rubén, Esther, María, Pedro e Irene Y no quisiera enrollarme más! A estudiar a tope, que este será el último examen antes de emprender rumbo a Punta Cana!!! Ánimo!! PD: Espartanooss!! Au! Au! Auuu!!!! - Que pedazo novatadas!! J A.A., E.G., R.C. D. A. Pascual Figal 13
298
299 MIOCARDITIS
300 TEMA Mioc-1 CARDIOLOGÍA CMG MIOCARDITIS DEFINICIÓN La miocarditis es la inflamación del miocardio causada por agentes de diversa naturaleza. Es una enfermedad poco común (aunque realmente se encuentra infradiagnosticada). Actualmente, tienden a diferenciarse tres tipos de miocarditis: A. Miocarditis aguda o activa: enfermedad inflamatoria del miocardio originada por agentes infecciosos o no, que cursa con necrosis 1 y/o degeneración de miocitos adyacentes. La necrosis es detectable ya en los 7-10 primeros días. Este tipo de miocarditis puede causar la muerte del paciente en un breve periodo de tiempo, pudiéndose llamar entonces Miocarditis aguda fulminante. B. Miocarditis crónica: inflamación del miocardio crónica con contractilidad normal; por lo que la FE se conservará por encima del 55%; aunque, en ocasiones, podemos encontrar alteraciones regionales de la contracción. C. Miocarditis inflamatoria: inflamación del miocardio crónica con contractilidad ventricular alterada; por lo que la FE estará disminuida por debajo del 55%. Esta miocarditis es la que evolucionará hasta la dilatación ventricular o miocardiopatía dilatada. Se dilatan ambos ventrículos, pero en mayor magnitud el ventrículo izquierdo. 1 Por ello, en ocasiones lo pacientes pueden presentar un cuadro clínico idéntico a un infarto agudo de miocardio. J. A., M.C., P.F. Ruipérez 2
301 TEMA Mioc-1 CARDIOLOGÍA CMG AMPLIACIÓN DE CONTENIDO DE INTERÉS. Estos tres tipos de miocarditis, realmente, no son más que tres formas de presentación de una misma entidad. Para entender esto mejor, veamos resumidamente el proceso fisiopatológico de la miocarditis. Como ya hemos mencionado, la miocarditis es una inflamación del miocardio causado por un agente de diversa naturaleza. Cuando el corazón se inflama no puede trabajar efectivamente y se produce la clínica. Además, en ocasiones, la respuesta inmunitaria destinada a destruir el agente causante puede dañar al propio miocardio, empeorando aún más la situación. Si se dañan demasiadas células del músculo cardíaco, éste se debilita, pudiendo acontecer diferentes situaciones: A. En algunos casos, este proceso es muy rápido y da lugar a una insuficiencia cardiaca congestiva o incluso a una muerte súbita ( miocarditis aguda ). B. Más comúnmente, el corazón trata de regenerarse por sí solo. El músculo cardíaco se regenera cambiando las células dañadas o muertas del músculo cardíaco por tejido cicatricial. El tejido cicatricial no es como el tejido muscular cardíaco porque no se contrae y no puede contribuir a la acción de bombeo del corazón. Cuando este tejido es mínimo, las secuelas son prácticamente inexistentes ( miocarditis crónica ) C. Si el tejido cicatricial formado es considerable, puede ocasionar la aparición de una miocardiopatía dilatada ( miocarditis inflamatoria ). Ahora podemos entender como un mismo agente puede causar los tres tipos de miocarditis y por qué el que se presente como uno u otro dependerá del agente y de la susceptibilidad personal del paciente. FIN DEL CONTENIDO AMPLIADO ETIOLOGÍA 2 A. Miocarditis virales: Es la etiología más frecuente de todas; en torno al 3-6% de las miocarditis. De ellas, el 50% son causadas por enterovirus 3. Virus tan frecuentes en nuestro medio como el de la gripe, pueden ocasionar miocarditis (fundamentalmente durante un episodio gripal fuerte ). Sin embargo, estas miocarditis son en la mayoría de las ocasiones reversibles y no dejan secuelas. En un principio se pensaba que el daño era causado por el propio virus, no obstante, actualmente la hipótesis más aceptada es la de la lesión inmunitaria; esto es, la infección vírica sólo sería el desencadenante de la respuesta inmunitaria nociva. 2 Posiblemente esto lo encontréis diferente a vuestros apuntes; el profesor dio una lista con todas las posibles etiologías y yo las he agrupado en cuatro apartados para que sea más fácil recordarlas. Las anotaciones entre paréntesis fueron comentadas en clase. 3 Concretamente, el más frecuente es el virus Coxsackie B J. A., M.C., P.F. Ruipérez 3
302 TEMA Mioc-1 CARDIOLOGÍA CMG B. Miocarditis infecciosas: Causadas por bacterias (muchos tipos), hongos, rickettsias y parásitos. Esta última etiología era hasta hace poco muy rara en España, sin embargo, actualmente están aumentando las miocarditis por esta causa; concretamente, por Tripasonoma cruzi (agente etiológico de la enfermedad de Chagas) C. Miocarditis no infecciosas: Encontramos miocarditis secundarias a reacciones alérgicas, fármacos, en el periparto y en enfermedades sistémicas. De entre las causadas por reacciones alérgicas, destacamos las reacciones de hipersensibilidad. A diferencia del resto, se caracterizan por la presencia de un infiltrado eosinofílico. Señalamos fármacos, como algunos antineoplásicos utilizados antiguamente en el tratamiento del cáncer de mama, que causaban miocarditis. Por ello, era frecuente que las mujeres se sometieran a ecocardiografias al iniciar el tratamiento. Ocurría lo mismo con las primeras formulaciones del tamoxifeno, actualmente en desuso. FORMAS DE PRESENTACIÓN La miocarditis tiene dos formas básicas de presentación: asintomática o sintomática. El siguiente esquema resume perfectamente las diferentes situaciones que nos podemos encontrar. En ocasiones, en el preparto o postparto las mujeres sufren miocarditis que curan espontáneamente. La etiología no está totalmente aclarada, postulándose dos teorías 4 : a) Miocarditis vírica: durante el embarazo el estado de inmunosupresión fisiológico aumenta la susceptibilidad a virus cardiopáticos; b) Miocarditis autoinmune: los anticuerpos fetales darían una reacción cruzada con los miocitos maternos. En cuanto a enfermedades sistémicas desencadenantes de miocarditis, destacamos sobretodo, colagenopatías, aunque también, hemocromatosis, amiloidosis, sarcoidosis D. Miocarditis por cocaína Se verá detenidamente al final del tema. 4 En clase sólo se menciono la segunda pero como me han parecido igual de lógicas las dos, he decido poner ambas. J. A., M.C., P.F. Ruipérez 4
303 TEMA Mioc-1 CARDIOLOGÍA CMG Realizaremos sobre el esquema una serie de aclaraciones: - La forma asintomática puede revertir espontáneamente sin secuelas o no. En el último caso, el problema es que, al no mostrar síntomas, el cuadro se diagnosticará muy tarde y el daño miocárdico producido deteriorará la contractilidad y disminuirá la función ventricular, generándose por ello la miocardiopatía dilatada. - Ante la forma sintomática de presentación fulminante, podrán producirse arritmias, fibrilación auricular o diversos fallos ventriculares que conducirán a la insuficiencia cardiaca y a la muerte; o bien, recuperarse completamente. La necrosis miocárdica puede traducirse en dolor precordial y ondas q en el ECG lo que puede confundirnos con un episodio de infarto agudo de miocardio (IAM). Dado que el pericardio se encuentra en contigüidad con el miocardio, es frecuente que las miocarditis aparezcan acompañadas de pericarditis. El resto de síntomas de la miocarditis son muy inespecíficos y pueden simular brotes de colagenopatías, episodios gripales, fiebre reumática CLÍNICA Como hemos visto, las miocarditis muestran una amplia gama de presentación. Podemos encontrarnos desde miocarditis asintomáticas hasta miocarditis que evolucionan a insuficiencia cardiaca congestiva (ICC) (con elevada mortalidad a los 5 años), o incluso que acaban en muerte súbita. En gran parte de los pacientes se reconoce un antecedente de síndrome vírico de tipo gripal. La dilatación ventricular ocasiona alteraciones de la conducción eléctrica por lo que podemos encontrar bloqueos y/o arritmias 5 que pueden causar la muerte súbita del paciente Las alteraciones del flujo sanguíneo en el corazón predisponen a los fenómenos tromboembólicos sistémicos y pulmonares 6 5 Como es lógico, las arritmias serán ventriculares porque es en los ventrículos donde se produce el daño. Las principales arritmias que encontraremos serán la taquicardia ventricular (TV), los extrasístoles ventriculares (EV) y la fibrilación ventricular (FV). Una vez establecida la ICC pueden aparecer arritmias supraventriculares. 6 Por qué? El flujo a través del corazón esta alterado por la propia inflamación, la dilatación consecuente, las alteraciones de la contracción, las arritmias ventriculares La FA consecuente a la ICC... DIAGNOSTICO EXPLORACIÓN FÍSICA Los pacientes con miocarditis presentan un mal estado general, febrícula, una mala coloración Un dato importante que nos puede ayudar en el diagnóstico diferencial es que la taquicardia que sufren estos pacientes no guarda relación con la temperatura 7. 7 Por qué? En los episodios febriles la taquicardia es consecuencia del aumento de temperatura y tiene como finalidad la disipación de calor. En las miocarditis, que pueden cursar con fiebre, la taquicardia es consecuencia de una alteración miocárdica J. A., M.C., P.F. Ruipérez 5
304 TEMA Mioc-1 CARDIOLOGÍA CMG En la auscultación cardiaca pueden hallarse un tercer y cuarto ruido 8. Si se escuchan soplos debemos tener en cuenta que SIEM- PRE serán sistólicos y nunca diastólicos 9. Si existe pericarditis podrá auscultarse un roce pericárdico. C. Electrocardiograma. Es siempre patológico, aunque en ocasiones podemos encontrar anomalías difusas de la repolarización como el aplanamiento de la onda T. También podemos hallar arritmias ventriculares (FV, EV, TV), bloqueos auriculoventriculares (desde bloqueos de primer grado con alargamiento del intervalo PR hasta bloqueos completos) y bloqueos de rama (izquierda o derecha). El bloqueo de rama izquierda es un SIG- NO DE MUY MAL PRONÓSTICO 11. También podemos encontrar signos electrocardiográficos de pericarditis D. Ecocardiograma EXPLORACIONES COMPLEMENTARIAS A. Analítica. Por una parte, encontraremos los marcadores de infección típicos, como el aumento de VSG, leucocitosis con desviación a la izquierda, elevación de la PCR ; por otra, marcadores de isquemia miocárdica tales como CPK, CPK-MB, aumentadas de 2 a 5 veces, así como Troponina I y T, también aumentadas. B. Radiología. Mientras no se haya establecido la miocardiopatía dilatada la placa de tórax será normal. Una vez establecida, podemos llegar a observar una importante cardiomegalia. En los pulmones podremos observar signos de edema 10 (redistribución) e incluso de TEP. 8 Por qué? Si recordamos la etiología del tercer y cuarto ruido veremos que estos suelen aparecer cuando el corazón trabaja con grandes volúmenes. 9 Por qué? La dilatación ventricular puede producir insuficiencia de las válvulas AV. En la insuficiencia de estas válvulas, la sangre regurgita retrógradamente en sístole y no en diástole. 10 Por qué? El corazón debilitado no bombearía efectivamente toda la sangre y esta se acumularía retrógradamente causando el edema. Ocurriría igual que con la radiografía de tórax. En un principio será normal, pero una vez establecida la miocardiopatía dilatada podremos encontrar disfunción del ventrículo izquierdo, trombos cardiacos, hipocinesias/acinesias completas 12 (el hecho de encontrar hipocinesias/acinesias regionales nos orientaría más hacia un diagnóstico de IS- QUEMIA, no de miocarditis, ya que ésta afecta al miocardio en su totalidad). E. Gammagrafia. Los isótopos más usados son el galio 67 (67Ga) y el tecnecio 99m (99mTc). En la literatura se describe también el indio 111 (111In). F. Estudios inmunohistoquímicos. Buscaremos células inmunitarias en el miocardio y células intersticiales activadas G. Biopsia endomiocárdica. Como sabemos, la biopsia cardiaca es una técnica muy invasiva. Además, en las miocarditis en particular, debemos añadir que el hecho de que una biopsia nos dé un resultado negati- 11 Posible pregunta de examen según el profesor 12 Disminución/ausencia de movimiento que afecta a toda la pared ventricular J. A., M.C., P.F. Ruipérez 6
305 TEMA Mioc-1 CARDIOLOGÍA CMG vo no nos permite excluir el diagnóstico de miocarditis 13. Estas dos últimas técnicas se utilizan, sobre todo, cuando nos encontramos ante un paciente con clínica compatible en el que se han descartado otras patologías más frecuentes y el resto de técnicas diagnósticas no confirman la miocarditis. H. Resonancia Magnética Miocárdica. Actualmente, se esta convirtiendo en una de las principales técnicas para el diagnóstico de miocarditis. Siempre se hace una RMN a los sospechosos de miocardiopatía. Además de ser poco invasiva, la utilización de diferentes secuencias de pulso y/o contrastes permite diferenciar áreas de inflamación e infiltración leucocitaria, edema, fibrosis y, localizarlas en las diferentes capas del corazón (endocárdica, epicárdica ) TRATAMIENTO Actualmente, no existe un tratamiento efectivo 14 para las miocarditis. A pesar de los muchos tratamientos específicos que se han probado, ninguno ha demostrado ser efectivo. Lo que veremos a continuación son estrategias que intentan controlar las complicaciones y manifestaciones sistémicas de la enfermedad y, en la medida de lo posible, el empeoramiento del paciente. 1. Controlar manifestaciones sistémicas y limitar actividad física del paciente (aunque aparentemente esté curado), durante 1 año (en deportistas y gente joven) o 6 meses (no deportistas). 2. Los IECAs y diuréticos son beneficiosos 3. En caso de arritmias administraremos antiarrítmicos que no depriman la función ventricular: sólo hay uno, la amiodarona. 4. Las arritmias ventriculares malignas pueden ser causa de muerte súbita en estos pacientes, por lo que en algunos puede estar indicado el uso de desfibriladores automáticos implantables (DAI) En caso de bloqueos, podemos colocar un marcapasos temporal que podrá convertirse en definitivo en función de la no reversión del bloqueo. 6. La administración de antivíricos e interferón (tratamiento etiológico) no tiene demostrada su eficacia. 13 Por qué? Cuando tomamos una biopsia estamos obteniendo una pieza de endocardio, pero si la miocarditis es fundamentalmente epicárdica nos dará negativa. También puede ser negativa si la miocarditis es focal. 14 El profesor expuso una diapositiva con una serie de tratamientos específicos de discutible eficacia. Tras insistir en varias ocasiones en que no lo copiáramos porque no lo iba a preguntar, decidí no copiarlo para evitar la tentación de algunos, hizo bien q si no ya me veo a más de uno estudiándoselo!! 15 Son dispositivos, similares a los marcapasos, capaces de detectar y revertir arritmias ventriculares malignas. También se conocen como Desfibriladores cardioversores automáticos implantables (DCAI). En la dirección dialnet.unirioja.es/servlet/fichero_articulo?articulo= &orden=85053, existe un documento de 4 páginas donde podéis leer un poco sobre su uso. J. A., M.C., P.F. Ruipérez 7
306 TEMA Mioc-1 CARDIOLOGÍA CMG 7. Como última medida se recurriría al trasplante o a la implantación de asistencia circulatoria, siempre y cuando la esperanza de vida sea buena. La asistencia circulatoria consiste en unos dispositivos que se introducen en el corazón y que hacen la función de bomba. Sólo pueden utilizarse como máximo durante un mes por lo que se emplean como medio de soporte mientras conseguimos un corazón. Por último, algunas advertencias: 1. El uso de corticoides (que en un principio parecía la solución) es controvertido 2. Estos pacientes presentan una elevada sensibilidad a los digitálicos por lo que, en caso de utilizarlos, deberemos ajustar la dosis porque si no les provocaremos una intoxicación digitálica. 3. Los inmunosupresores no están indicados en las miocarditis agudas o activas. 4. Los AINEs están contraindicados en los primeros 15 días de la enfermedad porque pueden causar necrosis miocárdica (en caso de no quedar más remedio se puede usar paracetamol). Sí pueden emplearse en fases tardías de la enfermedad. MIOCARDITIS POR COCAÍNA 16 La cocaína es la causa más frecuente de miocarditis en jóvenes. La asociación entre el consumo de cocaína y la aparición de un cuadro de miocarditis está más que demostrada. Se sabe que existe una gran relación causaefecto. Simplemente mencionar que el consumo de una única raya de cocaína puede ocasionar la aparición de miocarditis en un plazo no superior a la hora y media siguiente. Cuáles son los principales efectos farmacológicos de la cocaína? La cocaína bloquea la recaptación de catecolaminas al unirse a sus receptores específicos. En consecuencia, se produce una elevación de catecolaminas 17 en sangre que provoca taquicardia e hipertensión sobre el sistema circulatorio (se han llegado a observar presiones sanguíneas de hasta 260 mmhg). El aumento de la frecuencia cardiaca y de la poscarga ventricular, hacen que el corazón trabaje al limite de su capacidad. Este aumento de demanda se suma a una disminución del aporte dado que la cocaína produce vasoconstricción coronaria. Este desequilibrio entre demanda y aporte predispone al daño miocárdico en forma de angina e, incluso, infarto agudo. Además, el bloqueo de los canales de sodio provoca anestesia local y estabilización de membranas, lo que puede provocar alteraciones de la conducción, que en el miocardio, se traducen en arritmias. 16 Posible pregunta de examen según el profesor. En la comisión me he limitado a poner lo que el profesor mencionó en clase (añadiendo cosas puntuales), pero he encontrado un artículo muy breve para aquellos que estén interesados sobre la cardiotoxicidad de la cocaína. La dirección es: 17 También producen hemorragia cerebral. Siempre que en un joven veamos una hemorragia cerebral debemos sospechar de la cocaína como causa etiológica. J. A., M.C., P.F. Ruipérez 8
307 TEMA Mioc-1 CARDIOLOGÍA CMG Cuáles son los efectos sobre el corazón? 1. Depresión transitoria, o no, de la función ventricular 2. Áreas de cicatriz miocárdica (como expresión de necrosis de miocitos) 3. Tendencia a la miocardiopatía dilatada. J. A., M.C., P.F. Ruipérez 9
308
309 MIOCARDIOPATÍAS
310 TEMA MCP-1 CARDIOLOGÍA CMG MIOCARDIOPATÍAS MIOCARDIOPATÍA HIPERTRÓFICA D Nota de l@s comisionistas: Los dos temas de miocardiopatías son muy largos, pero no asustéis, en realidad las preguntas que van a salir son fáciles. El profesor Gimeno ha revisado los temas y dice que lo que hay que saber del tema son las generalidades, el diagnóstico, el tratamiento de la obstrucción, algo de fisiopatología, y saber que existen marcadores de riesgo de muerte súbita para identificar a los de alto riesgo y tratamientos efectivos. Poquica cosa. EFINICIÓN DE MIOCARDIOPATÍA Se entiende por miocardiopatías, el conjunto de enfermedades primarias del músculo cardiaco en las que no se identifica una causa o el mecanismo de producción es difícil de descubrir (idiopática). En el 50% de estas patologías se identifican mutaciones genéticas. No son consecuencia de procesos como HTA, enfermedad coronaria, valvulopatía, etc. C LASIFICACIÓN Las miocardiopatías se clasifican en diferentes entidades según el tipo de alteración que sufre el músculo cardiaco: Miocardiopatía Hipertrófica (MCH). Miocardiopatía Dilatada (MCD). Miocardiopatía Restrictiva (MCR). Otras miocardiopatías: - Espongiforme. - Arritmogénica del ventrículo derecho (displasia del ventrículo derecho). - Etc. MIOCARDIOPATÍA HIPERTRÓFICA (MCH) DEFINICIÓN Se trata de una miocardiopatía en la que existe una hipertrofia miocárdica en ausencia de otros factores que causen estrés hemodinámico suficiente para causar dicho grado de hipertrofia. A.A., E.G., R.C. J. R. Gimeno Blanes 1
311 TEMA MCP-1 CARDIOLOGÍA CMG EPIDEMIOLOGÍA La MCH es una patología que afecta a 1:500 individuos. Con estos datos de prevalencia, se puede estimar que el número de afectados por MCH es de unas personas en España y alrededor de las 2400 en Murcia. Podemos observar afectación familiar en el 60% de los casos, presentándose ésta con un patrón de herencia autosómica dominante. La enfermedad suele desarrollarse en la adolescencia y en la mayoría de los casos no limita, ni la calidad, ni duración de la vida. No obstante, es la causa más importante de muerte súbita en menores de 35 años 1 Por ello, es de vital importancia, realizar un estudio cardiológico completo a las personas enfermas o de riesgo. AMPLIACIÓN DE CONTENIDO DE INTERÉS. Respecto a la relación entre MCH y MS (muerte súbita), se expondrán a continuación una serie de datos que no fueron tratados detenidamente en clase pero que se encuentran en las diapositivas: En el marco de la MCH, existen diversos factores de riesgo para la MS. Entre ellos, podemos diferenciar entre los clásicos, y los identificados recientemente. Entre los clásicos, tenemos los siguientes: TVNS (TV no sostenida) en holter ( 3 latidos a >120 lpm), síncopes de repetición inexplicados, respuesta presora anormal (incapacidad para aumentar la TAS >25 mmhg o caída de la TAS >10mm tras alcanzar un máximo), hipertrofia severa ( 30 mm), historia familiar de muerte súbita (en menores de 40 años) y FV (fibrilación ventricular). De ellos, el más frecuente es la respuesta presora anormal (31.8%), seguida de la TVNS (19.7%). El que mayor VPP (valor predictivo positivo) tiene a los 5 años es la FV (34.2%), seguida de la historia familiar de MS y la hipertrofia severa (11.7%). Entre los factores de riesgo recientes tenemos la obstrucción severa ( 90 mmhg). Otros marcadores de riesgo para MS son, el realce de gadolinio en la RMN, la aparición de una TV en la prueba de esfuerzo o la presencia de mutaciones malignas. Si se observan las tasas anuales de mortalidad súbita o descarga apropiada de DAI según número de factores de riesgo vemos que, el porcentaje de eventos es de un 0.35% en ausencia de factores de riesgo y asciende al 7% cuando se tienen 4 de éstos. En relación a esto último, podemos decir que cuando el paciente no tiene ningún factor de riesgo (bajo riesgo), puede hacer una vida activa sin limitaciones, aunque debe evitar el ejercicio físico extenuante. Cuando la persona afectada de MCH es portador de 2 factores riesgo clásicos (alto riesgo), debe considerarse el tratamiento con amiodarona o la implantación de un DAI (Desfibrilador Automático Implantable). En cualquier caso, debe tenerse en cuenta que, ante un evento de miocardiopatía hipertrófica, siempre debe remitirse dicho paciente al cardiólogo para su valoración y seguimiento. A continuación, se pueden observar una serie de gráficos que muestran las tasas anuales de eventos en la MCH, así como éstas, en el marco de otras cardiopatías distintas a la MCH. Con ello, se puede objetivar la relevancia de dicha patología en términos de morbimortalidad: GRÁFICO 1. 1 A partir de esta edad la causa más importante es la cardiopatía isquémica. A.A., E.G., R.C. J. R. Gimeno Blanes 2
312 TEMA MCP-1 CARDIOLOGÍA CMG ETIOLOGÍA Cerca del 50% de los pacientes con MCH tiene antecedentes heredofamiliares compatibles con una transmisión autosómica dominante. Se han identificado más de 500 mutaciones distintas de 12 genes que codifican las proteínas del sarcómero. GRÁFICO 2. GRÁFICO 3. Como breve comentario a las gráficas decir que, el evento con una tasa anual más alta en el seno de la MCH es, con 1.02%, la MS. Le siguen el ACV (0.56%) y la muerte por IC o transplante (0.52%). [Gráfico 1]. Si se observa el gráfico 2, donde se reflejan las tasas anuales de eventos en las distintas cardiopatías, se aprecia que la tasa de MS en la MCH es una de las más bajas (1%), siendo superada con creces por la MS en la miocardiopatía arritmogénica del VD (15%) y por el Sd. De Brugada (10%). Respecto al gráfico número 3, siendo éste de índole similar al anterior, vemos como la MS en la MCH no ocupa un papel muy llamativo. Para terminar este apartado, comentar por último que, este cuarto gráfico muestra como, complementando los datos mostrados, la tasa anual de MS (IC 95%) observada en distintos trabajos seleccionados parece estar disminuyendo como podemos apreciar en la imagen. ANATOMÍA PATOLÓGICA Respecto a la anatomía patológica, se comentarán dos aspectos: la descripción macroscópica y la microscópica. En relación al aspecto macroscópico, si se observa una pieza de necropsia típica de un paciente con miocardiopatía hipertrófica, se contemplará una hipertrofia ventricular izquierda que se mostrará de distinto grado y heterogeneidad según el caso concreto. A continuación puede verse una pieza donde se objetiva una hipertrofia ventricular severa de predomino septal, reducción de la cavidad ventricular izquierda y afectación de la pared del ventrículo derecho: En lo referente al aspecto microscópico, los pacientes con MCH muestran un patrón característico que se denomina myocyte disarray (miocitos desalineados), difícil de identificar in vivo. También pueden presentar un grado variable de fibrosis y engrosamiento de las pequeñas arterias coronarias intramurales. FIN DEL CONTENIDO AMPLIADO A.A., E.G., R.C. J. R. Gimeno Blanes 3
313 TEMA MCP-1 CARDIOLOGÍA CMG PATRONES DE HIPERTROFIA Los distintos pacientes afectados de MCH pueden tener diferentes patrones de distribución de la hipertrofia: o Septal, en un 70% de los casos. Es la variante más sintomática y además constituye la llamada forma obstructiva. o Concéntrica, en el 20%. o Apical, el 10% restante. A continuación podemos ver unas imágenes que muestran gráficamente las distintas alternativas: HETEROGENEIDAD Existe una gran heterogeneidad entre los afectados de MCH, es decir, los patrones, manifestaciones clínicas, etc. pueden cambiar mucho de un paciente a otro. Esto sucede incluso dentro de una misma familia con MCH. Un tercio de los pacientes presentan obstrucción en el tracto de salida del ventrículo izquierdo. Éstos son los más sintomáticos. A continuación, se muestran unas imágenes ecocardiográficas y de RMN de alta resolución en las que se pone de manifiesto la heterogeneidad de la MCH en varios pacientes: A.A., E.G., R.C. J. R. Gimeno Blanes 4
314 TEMA MCP-1 CARDIOLOGÍA CMG No obstante, la MCH puede debutar con una muerte súbita aunque, afortunadamente, suele comenzar con otros síntomas. La tasa de muerte súbita en estos pacientes es del 1% aproximadamente. Síntomas de la MCH: o Dolor torácico. o Disnea. o Síncope o presíncope. o Palpitaciones. Aquí vemos una imagen brutalmente precisa de un paciente con obstrucción del tracto de salida. SINTOMATOLOGÍA La MCH es una patología que puede mostrarse en cualquier fase de la vida, aunque suele ser en la adolescencia (10-15 años) cuando aparecen las primeras manifestaciones (estirón puberal). Después del máximo de hipertrofia alrededor de los 20 años, el grosor disminuye aproximadamente 0,5 mm/año a lo largo de la vida del individuo. Eventos Graves a los que puede dar lugar: o o o o Muerte súbita. Insuficiencia cardiaca terminal. Accidente Cerebrovascular. Endocarditis. Desencadenantes de los síntomas: o o Ejercicio. Comidas abundantes. Mecanismos subyacentes: o o o o o Obstrucción a tracto de salida VI. Insuficiencia mitral. Disfunción diastólica. Isquemia miocárdica. Arritmias (fibrilación auricular, bradiarritmias, ). o Síncope vasovagal 2, respuesta vascular periférica anormal, En más del 50% de los casos, los pacientes con MCH se encuentran asintomáticos u oligosintomáticos, siendo el diagnóstico de la enfermedad un hallazgo casual. 2 El síncope puede ser cardiogénico, secundario a una arritmia por ejemplo, o en relación con la obstrucción. A.A., E.G., R.C. J. R. Gimeno Blanes 5
315 TEMA MCP-1 CARDIOLOGÍA CMG Explicación a algunos mecanismos fisiopatológicos La MCH se caracteriza por dos rasgos habituales: la hipertrofia ventricular, que frecuentemente es de predominio septal y dificulta el llenado, y un gradiente dinámico de presión del infundíbulo del VI relacionado con la estenosis de la región subaórtica, a consecuencia de la aposición mesosistólica de la valva mitral anterior contra el tabique hipertrófico, es decir, el movimiento sistólico anterior de la válvula mitral. Dicho de otra forma: si un tren pasase a nuestro lado, notaríamos como, debido al efecto Venturi, existe una fuerza que nos arrastra hacia él. De igual manera sucede cuando, en sístole, el flujo de sangre que eyecta el VI (tren) atrae hacia sí el velo anterior de la válvula mitral (personaje atraído por el tren). Sucede porque la sangre tiene que pasar a gran velocidad por un orificio demasiado estrecho (fijaos en la imagen inferior, el trayecto de la flecha), lo que provoca un efecto Venturi. Este hecho se produce en mitad o al final de la sístole, cuando el ventrículo se está vaciando y el cono de salida se está haciendo cada vez más estrecho (ya que se suma el vaciado del ventrículo al engrosamiento del septo). Puede implicar la aparición de una insuficiencia mitral al arrastrar la valva anterior. La maniobra de Valsalva también empeora la situación ya que disminuye la precarga (recordemos que aumenta la presión intratorácica al intentar una espiración con la glotis cerrada) y facilita la estrechez del cono de salida al haber un corazón menos lleno. Las taquicardias son mal toleradas en esta enfermedad ya que, en un corazón con problemas diastólicos (de llenado ventricular por la hipertrofia), si se aumenta la frecuencia, se acortará la diástole 5 y se agravará considerablemente el cuadro. EXPLORACIÓN FÍSICA Entre los signos más frecuentes hallados en la exploración física de un paciente con MCH, podemos encontrar algunos tales como: o o o Pulso arterial bisferiens: Es un pulso con dos cimas por el colapso mesositólico en las formas obstructivas Latido de la punta 6 : sostenido (impulso auricular, triple impulso). Es vigoroso. Soplo sistólico dinámico en el borde esternal izquierdo irradiado a focos aórtico y mitral la intensidad se modifica con la precarga o la postcarga. - Aumentan el soplo (disminución de la precarga, o disminución de la postcarga): en bipedestación, con maniobra de Valsalva, con nitrito de amilo (vasodilatador), - Reducen el soplo (por aumento de la postcarga): posición en cuclillas, o aumento de resistencias periféricas. IMPORTANTE: El tratamiento debería ser con un β-bloqueante 3, pero NUNCA con vasodilatadores, pues agravarían la situación 4. o Soplo pansistólico (durante toda la sístole) mitral irradiado a axila. 3 Los β-bloqueantes son un tratamiento perfecto para estos corazones hiperdinámicos. 4 Esto es debido a que los vasodilatadores disminuirían las postcarga, lo que haría disminuir el anillo aórtico, y aumentar el efecto Venturi. 5 Recordad que en las taquicardias el aumento de la FC se realiza a expensas de acortar la diástole, ya que la sístole siempre dura lo mismo. 6 Según el profesor, tanto el pulso bisferiens, como el latido en punta, son dos signos que no se utilizan en la práctica clínica, pero que se preguntan en los exámenes. A.A., E.G., R.C. J. R. Gimeno Blanes 6
316 TEMA MCP-1 CARDIOLOGÍA CMG Si a un paciente con estos síntomas y signos en urgencias, se le da un nitrato (cafinitrina) o cualquier otro vasodilatador se puede agravar su situación. CAMBIOS HEMODINÁMICOS En la imagen A podemos ver este hecho gráficamente, marcada la extrasístole con un punto rojo y el latido postextrasistólico con un cuadrado azul. La presión aórtica en este último disminuye, porque la postcarga está disminuida por la pausa tras la extrasístole. Todo esto aumenta el gradiente, y así el efecto Venturi y también el soplo que se produce. Un hecho característico de la MCH es la variabilidad y labilidad del gradiente en el tracto de salida del VI. En la producción de este gradiente dinámico están involucrados tres mecanismos básicos, que actúan reduciendo el volumen ventricular y probablemente acentuando la aposición de la valva anterior de la mitral contra el septo. Estos mecanismos son: Aumento de la contractilidad. Descenso de la precarga. Descenso de la postcarga. La maniobra de Valsalva es otra situación en la que aumenta el gradiente: Disminuciones en la contractilidad o aumentos en la precarga o postcarga que aumentan el volumen del VI, reducen y en ocasiones abolen el gradiente. Uno de los estímulos más potentes para aumentar el gradiente, es la potenciación postextrasistólica 7 : El aumento en la contractilidad que se produce en el latido que sigue a la extrasístole es tan marcado que sobrepasa el posible efecto del aumento en el llenado ventricular que origina la pausa compensatoria y determina un aumento en el gradiente y del soplo. En los registros de presión arterial invasiva aparecen cambios característicos consistentes en una acentuación de la forma de la curva y en un descenso o por lo menos no aumento en la presión. 7 Toda esta explicación es para que lo entendáis, en realidad sólo hay que saber que tanto una extrasístole como la maniobra de Valsalva producen cambios en la precarga, postcarga y contractilidad, influyendo en el gradiente en el tracto de salida del VI. DIAGNÓSTICO Es preciso realizar ecocardiografía y ECG para descartar o confirmar el diagnóstico. Cada una de estas pruebas por separado no es suficiente. Esto es debido a que el ECG puede ser normal en un 5% de pacientes con ECO patológico. También puede haber pacientes con ECO normal y ECG patológico. En los familiares de pacientes con la enfermedad, existen criterios diagnósticos específicos. En ellos, la presencia de alteraciones electrocardiográficas y/o ecocardiográficas más sutiles puede ser suficiente para realizar el diagnóstico. A.A., E.G., R.C. J. R. Gimeno Blanes 7
317 TEMA MCP-1 CARDIOLOGÍA CMG ELECTROCARDIOGRAMA En el 95% de los casos el ECG es llamativo y anormal (aunque muy poco específico). Un ECG, a menudo, constituye el primer hallazgo de MCH. Se puede observar un ECG típico: Crecimiento VI y alteración de la repolarización: - Q de pseudonecrosis (presentes en derivaciones inferolaterales) Voltajes altísimos (R altas y S profundas). - Descenso del ST u onda T negativa (en derivaciones precordiales). Una T negativa muy profunda indica hipertrofia apical (forma japonesa). Si realizamos un Holter o tenemos la suerte de realizar un ECG en el momento oportuno, se pueden ver arritmias: extrasístoles auriculares o ventriculares, taquicardia ventricular no sostenida, fibrilación auricular o flutter auricular. No son específicos ni diagnósticos de la enfermedad. * Ver zona ECG. ECOCARDIOGRAMA Un grosor > 15 mm en cualquier segmento de la pared ventricular izquierda es indicativo de miocardiopatía hipertrófica. Este aumento de grosor puede darse: o o A nivel del septo interventricular (la forma más frecuente). Otras distribuciones: medioventricular, concéntrica, apical, También puede observarse una obstrucción dinámica del tracto de salida del VI (30%) en ECO-Doppler. En relación a ello, nos podemos fijar en: o o SAM: Movimiento sistólico anterior de la válvula mitral. Jet de regurgitación mitral posterior. En general, la función sistólica global del VI puede ser normal o incluso estar aumentada en reposo. Lo que sí se puede ver es una alteración de la función diastólica. En algunos casos puede no haber hipertrofia, aunque si hiciéramos una biopsia veríamos la típica histología de la enfermedad. * Ver zona ECO. RMN La RMN es una herramienta con una alta calidad de imagen (supera a la ECO) pero es muy cara y más molesta para el paciente, por lo que no suele usarse de forma rutinaria. Permite ver la distribución y severidad de la hipertrofia. También se puede evaluar con ella la función sistólica y dimensiones de las cavidades, así como las características del miocardio. Con la RMN podemos ver incluso zonas de fibrosis, que son típicas de esta patología. Cuando se observa una hipercaptación parcheada (>50%) con gadolinio, es marcador de riesgo de muerte súbita y de remodelado ventricular progresivo. PRUEBA DE ESFUERZO Con una prueba de esfuerzo se puede evaluar la severidad de la enfermedad. Para ello se utiliza la capacidad funcional, que habitualmente se encuentra en torno al 80% de lo esperado. En el 25% de los pacientes, la respuesta tensional es anormal, presentándose vasodilatación muscular anormal (barorreceptores del ventrículo izquierdo). Por esto, la presión sistólica no aumenta como debería aumentar, y a veces, incluso disminuye (por el acortamiento de la diástole que impide el llenado). Esto constituye, como veíamos anteriormente, un marcador de riesgo de muerte súbita. A.A., E.G., R.C. J. R. Gimeno Blanes 8
318 TEMA MCP-1 CARDIOLOGÍA CMG TRATAMIENTO El tratamiento se establece en base a dos objetivos: 1. Alivio sintomático. 2. Prevención de la muerte súbita. Para realizar un manejo sintomático adecuado hay que considerar los fenómenos de gradiente/obstrucción del tracto de salida del VI (30%), que constituyen una causa importante de síntomas limitantes en una minoría de pacientes. Existe obstrucción con gradientes 30 mmhg, obstrucción lábil cuando se dan cambios en la precarga, postcarga y contractilidad (por ejemplo, vasodilatadores, diuréticos, hipovolemia, etc.), y disfunción diastólica cuando la rigidez del miocardio hipertrofiado está aumentada. A. Tratamiento farmacológico β-bloqueantes o verapamil Es preferible el uso de β-bloqueantes, más que verapamil. Constituyen la primera línea de tratamiento en el alivio sintomático de pacientes con dolor torácico, disnea y síncope durante el ejercicio por obstrucción del tracto de salida del VI. Inicialmente, son efectivos en el 60-80% de los pacientes. Respecto a su acción tienen un efecto cronotropo negativo, enlenteciendo la frecuencia cardiaca (facilitando el llenado), e inotropo negativo, disminuyendo la fuerza de la contracción (disminuyendo la obstrucción). Se usan en caso de arritmias supraventriculares o ventriculares. En ocasiones se utilizan antiarrítmicos (amiodarona) para la prevención de muerte súbita en pacientes de riesgo intermedio, aunque es de eficacia inferior al desfibrilador. Profilaxis antibiótica de endocarditis en pacientes con gradiente B. Tratamiento no farmacológico Miectomía quirúrgica 8 Consiste en la resección del fragmento del septo interventricular vía aórtica, consiguiendo con ello la abolición del gradiente y de la regurgitación mitral. Existe una gran experiencia y resultados en torno a esta intervención, pues se realiza desde hace más de 30 años. La mortalidad asociada al procedimiento es del 5%. Posiblemente, presenta mejores resultados (mejoría 90%) que la ablación septal alcohólica pero con un mayor riesgo. Es la técnica de elección en pacientes sintomáticos jóvenes. Diuréticos y vasodilatadores Como se ha repetido a lo largo de este texto, deben usarse con cautela, en descompensaciones o en casos de disfunción sistólica. Pueden aumentar la obstrucción y ser contraproducentes. Antiarrítmicos y anticoagulantes En esta figura se puede ver el procedimiento para la miectomía septal. 8 El profesor dijo que esta técnica no se hace apenas, debido a que conlleva riesgos. Además, al leer lo que hemos puesto en el tema ha añadido él mismo lo siguiente: Es cierto, quizá debería indicarse con más frecuencia. Ayy Qué poca confianza tienen los internistas en los cirujanos A.A., E.G., R.C. J. R. Gimeno Blanes 9
319 TEMA MCP-1 CARDIOLOGÍA CMG Ablación septal alcoholica Consiste en la instilación de alcohol a través de una rama septal, provocando así un pequeño infarto localizado. Existe menos experiencia (< 10 años) en esta técnica que en la miectomía. La mortalidad oscila entre el 1-2% y la mejoría ronda el 70-90%. Marcapasos DDD 9 Se coloca un cable auricular y otro ventricular en el lado derecho. Con esto, se provoca una alteración de la sincronización para evitar la contracción prematura del septo. La mortalidad asociada al proceso es menor del 1% y la mejoría, del 40%. Lo importante del marcapasos es que, al estimular en la punta del ventrículo derecho, la despolarización (y así la estrechez) van de abajo a arriba, disminuyendo así la posibilidad de estrechez del cono de salida arterial y así el gradiente. ESTUDIO FAMILIAR Y GENÉTICO Para identificar a los afectados y realizar estratificación de riesgo, es importante hacer un screening familiar. Recordar que es una enfermedad familiar en el 60% de los casos y que los asintomáticos también pueden estar en riesgo. Los estudios genéticos también son importantes en la investigación y diagnóstico de casos dudosos (hipertrofia leve). Presentan, hasta la fecha, poco valor pronóstico, aunque existen algunas mutaciones malignas. No presentan utilidad terapéutica. 9 Ver Arritmias VIII. A.A., E.G., R.C. J. R. Gimeno Blanes 10
320 TEMA MCP-1 CARDIOLOGÍA CMG ZONA ECG Fig. 1: ECG de una MCH en el que se observa un crecimiento ventricular izquierdo (R altas, que se salen del papel cuadriculado, y S profundas) y alteraciones de la repolarización (descenso del ST y T negativas). Fig. 2: ECG de una MCH. Véase la presencia de ondas Q o QS de V3 a V6. A.A., E.G., R.C. J. R. Gimeno Blanes 11
321 TEMA MCP-1 CARDIOLOGÍA CMG Fig. 3: ECG típico de hipertrofia apical (forma Japonesa), donde se observa la presencia de ondas T negativas y muy profundas. Fig. 4: ECG de un paciente con MCH que presenta fibrilación auricular (FA) y que lleva incorporado un marcapasos ventricular (espigas del marcapasos señaladas con flecha). A.A., E.G., R.C. J. R. Gimeno Blanes 12
322 TEMA MCP-1 CARDIOLOGÍA CMG Fig. 5: ECG de un paciente con MCH que desarrolla una taquicardia ventricular polimórfica y que a continuación entra en FV. Esto pone de manifiesto el riesgo que existe de sufrir un evento de muerte súbita por arritmias ventriculares malignas en el marco de la MCH. A.A., E.G., R.C. J. R. Gimeno Blanes 13
323 TEMA MCP-1 CARDIOLOGÍA CMG ZONA ECO Fig. 1: Ecocardiografía 2D en la que se observa una hipertrofia severa asimétrica del septo interventricular. Fig. 2: Ecocardiografías 2D que muestran una obstrucción dinámica en sístole + SAM (movimiento sistólico anterior de la válvula mitral). La imagen A muestra el corazón en diástole y la B, en sístole, donde se aprecia lo que se ha indicado. A.A., E.G., R.C. J. R. Gimeno Blanes 14
324
325 TEMA MCP-2 CARDIOLOGÍA CMG MIOCARDIOPATÍAS MIOCARDIOPATÍA DILATADA, MIOCARDIOPATÍA RESTRICTIVA Y OTRAS MIOCARDIOPATÍAS Nota de l@s comisionistas En este tema también hay exceso de información, como en el anterior. El profesor dice literalmente que lo importante es la dilatada y la restrictiva, saber de qué van, cómo se diagnostican y cuál es el tratamiento. La espongiforme y la displasia de ventrículo derecho son raras y solo necesitáis saber que existen y alguna generalidad. Un chollo de tema eh? C LASIFICACIÓN Recordemos que las miocardiopatías se clasifican en diferentes entidades según el tipo de alteración que sufre el músculo cardiaco: Miocardiopatías Hipertróficas (MCH). Miocardiopatías Dilatadas (MCD). Miocardiopatías Restrictivas (MCR). Otras miocardiopatías: - Espongiforme. - Arritmogénica del ventrículo derecho (displasia del ventrículo derecho). - Etc. MIOCARDIOPATÍA DILATADA (MCD) DEFINICIÓN Una MCD idiopática es una patología del músculo cardiaco, en la que existe una dilatación y disfunción ventricular izquierda, o de ambos ventrículos, en ausencia de otros factores que causen estrés hemodinámico suficiente para provocar dicho evento. ETIOLOGÍA En ocasiones existe relación con tóxicos (alcohol), agentes infecciosos (virus), fármacos (como los antineoplásicos), alteraciones metabólicas o incluso el embarazo. Éstos pueden no ser la única causa de la MCD y en ocasiones actúan como desencadenantes o agravantes de una MCD idiopática. La enfermedad se muestra en el 20-30% con carácter familiar. En estos casos puede identificarse alteraciones genéticas en proteínas del citoesqueleto. La herencia suele ser autosómica dominante. Recordemos que en la MCH las proteínas alteradas son del sarcómero. En la dilatada, suele pertenecer al citoesqueleto (como por ejemplo la desmina), aunque esto no siempre es así, ya que también existen por alteración de proteínas del sarcómero. A.A., E.G., R.C. J.R Gimeno Blanes 1
326 TEMA MCP-2 CARDIOLOGÍA CMG HISTORIA NATURAL Estamos ante una patología que afecta a 1/ personas (frente a 1/500 que afectaba la MCH). Es algo más frecuente en varones jóvenes, de entre años, y en las personas de raza negra. Es una enfermedad que progresa lentamente, por lo que tiene un largo periodo asintomático. Por lo general, se presenta como fallo cardiaco izquierdo, siendo los síntomas más frecuentes el cansancio, la fatiga y la disnea. Menos frecuente es que los pacientes presenten dolor torácico. También puede haber fallo cardiaco derecho, presentándose entonces, síntomas como congestión hepática, ingurgitación yugular y edemas. Normalmente el fallo cardiaco derecho se produce con la larga evolución de la enfermedad. Respecto al pronóstico, éste depende del estadio. En los últimos años, los nuevos fármacos (IECAs, ARAII, β-b, espironolactona ) han mejorado drásticamente el pronóstico de estos pacientes. No obstante, en los estadios avanzados, la mortalidad es superior al 50% en 5 años. El tratamiento en los casos más graves consiste en la implantación de marcapasos, DAI e incluso trasplante cardiaco. La muerte suele ser por insuficiencia cardiaca en más de 50% de los casos, o por muerte súbita, entre el 30-40% de los casos. EXPLORACIÓN FÍSICA En la auscultación cardiaca podemos identificar taquicardia y soplo de insuficiencia mitral 1. También pueden detectarse extratonos (tercer y cuarto ruido, o galope). En relación a la auscultación pulmonar, pueden existir crepitantes pulmonares debidos a la IC izquierda. Se pueden objetivar signos de estasis venoso, hepático y edemas, consecuencia de la IC derecha. 1 Ya que la dilatación del ventrículo produce una dilatación del anillo valvular, lo que provoca una insuficiencia mitral. Los pacientes con MCD estables pueden no presentar estos signos. Éstos son característicos de la insuficiencia cardiaca cualquiera que sea su causa, más que de la MCD en sí misma. ANALÍTICA Es interesante la valoración de parámetros tales como creatinina, iones, hierro, hormonas tiroideas, etc., así como las causas, y consecuencias de las posibles alteraciones que puedan manifestar. Especial importancia tienen los parámetros renales, ya que la función renal se suele afectar por el bajo gasto. RX DE TÓRAX Ante una MCD podremos ver una placa típica de insuficiencia cardiaca, presentándose pues cardiomegalia, redistribución vascular apical, signos de edema intersticial o alveolar y derrame pleural. En ocasiones sólo se aprecia cardiomegalia (si el paciente está compensado). ELECTROCARDIOGRAMA El ECG de un paciente con MCD puede mostrar (ver zona ECG): Taquicardia sinusal. Trastornos de la conducción (son muy frecuentes: eje desviado a la izquierda, y bloqueo de rama izquierda). Aumento de la onda P (debido al crecimiento auricular izquierdo). Ensanchamiento del QRS: Por la disminución de la eficacia de la conducción en el ventrículo dilatado (bloqueos de rama etc.). Fibrilación auricular en casos avanzados, por la sobrecarga auricular. HOLTER Mediante un registro holter podemos observar, en pacientes con MCD, arritmias no sostenidas auriculares y ventriculares. Estos hallazgos son inespecíficos. A.A., E.G., R.C. J.R Gimeno Blanes 2
327 TEMA MCP-2 CARDIOLOGÍA CMG ECOCARDIOGRAMA La ecocardiografía es la prueba fundamental para detectar y diagnosticar esta patología. Con ella podemos objetivar el grado de disfunción ventricular izquierda y calcular la fracción de eyección lo cual, se hace de la siguiente manera: FE % = 100 x ((VolTD - VolTS) / VolTD) VolTD: Volumen telediastólico. VolTS: Volumen telesistólico. Según el valor de la fracción de eyección, clasificamos la función sistólica en: o Función sistólica normal: FE > 55% o Disfunción sistólica leve: FE: 45-55% o Disfunción sistólica moderada: FE: 35-45% o Disfunción sistólica severa: FE < 35% CATETERISMO CARDIACO Ante una disfunción sistólica, es preciso confirmar que las coronarias del paciente son normales y que detrás del cuadro no hay una cardiopatía isquémica (que es la causa más frecuente de disfunción sistólica). Una vez que los catéteres están en el corazón, pueden realizarse distintas determinaciones hemodinámicas izquierdas como la presión aórtica y la del VI. También puede realizarse un estudio derecho, midiendo presiones en AD, VD, Art. Pulmonar, Presión capilar pulmonar y cálculo del gasto cardiaco y de las resistencias pulmonares. Estudio de repercusión del fallo ventricular izquierdo sobre el circuito pulmonar también es una determinación interesante y factible. Algunas de estas recomendaciones son: Llevar una dieta sin sal, controlar los factores riesgo (HTA), evitar el alcohol (recordemos que es cardiotóxico), evitar el ejercicio extenuante, llevar una vida sana y mantener un peso adecuado. Los fármacos que son útiles de cara al tratamiento de la MCD son: Inhibidores de la Enzima Convertidora de Angiotensina (IECAs). Antagonistas de los Receptores de Angiotensina II (ARA II). Antagonistas de la aldosterona como la espironolactona. Β-bloqueantes: Tienen un efecto paradójico, ya que mejoran la supervivencia en disfunción sistólica. Están contraindicados en las descompensaciones. Las dosis deben ser bajas, y si hay que aumentarlas se hará de manera progresiva y siempre con cautela. Diuréticos y nitratos controlan los síntomas. Se utilizan especialmente en descompensaciones. Anticoagulación: Si existe FA. Antiarrítmicos en algunos casos seleccionados. Amiodarona principalmente, pero sólo en ocasiones. En realidad, son fármacos que mejoran el pronóstico de la insuficiencia cardiaca. DISPOSITIVOS Y TRANSPLANTE CARDIACO Desfibrilador implantable (DAI) Se usa en caso de arritmias sintomáticas o alto riesgo de muerte súbita. TRATAMIENTO FARMACOLÓGICO Ante todo, es importante que el paciente adquiera una serie medidas que, complementando el tratamiento farmacológico ayudarán al control de la enfermedad. Marcapasos biventricular En los corazones con MCD existe una descoordinación de la contracción, con bamboleo y QRS muy ancho. Su función es resincronizar la contracción de ambos ventrículos y con ello, mejorar la eficacia del latido cardiaco. A.A., E.G., R.C. J.R Gimeno Blanes 3
328 TEMA MCP-2 CARDIOLOGÍA CMG Estimula el VD y la cara lateral del VI 2. La estimulación se produce en los dos lugares indicados por flecha. Trasplante cardiaco Es la última opción y se considera en casos graves. El órgano trasplantado es otra enfermedad ya que, tras su implantación, se precisa de un tratamiento crónico con inmunosupresores. Debe establecerse un seguimiento estrecho para evitar el rechazo y la infección. La supervivencia es del 80% a los 5 años. MCD PERIPARTO Se trata de una entidad rara y de mecanismo desconocido. Su diagnóstico es más frecuente en el primer mes postparto. Aproximadamente 2/3 de las pacientes, recuperan su FE normal, aunque este hecho puede tardar meses o años. En torno a un 30% de las pacientes presentan síntomas insuficiencia cardiaca, otro 30% tienen un parto prematuro, y la mortalidad en embarazos sucesivos varía en torno al 0-20%. Debido a esto, se desaconsejan nuevos embarazos, puesto que existe un alto riesgo de recurrencias. MIOCARDIOPATÍA RESTRICTIVA (MCR) PRONÓSTICO Y ESTRATIFICACIÓN DEL RIESGO 3 En los últimos tiempos se ha conseguido una mejoría importante del pronóstico con las incorporaciones de nuevos esquemas terapéuticos. Actualmente, las cifras son del 5% de mortalidad anual, en pacientes con una FE<35%. De éstos, el 40-50% mueren por un evento de MS. Lo importante es que hay que estudiar cada caso de forma individual para saber qué pacientes se benefician de un DAI. En general los pacientes con arritmias ventriculares sostenidas, especialmente si son mal toleradas, o síncopes de repetición son candidatos a DAI. 2 Esta terapia de resincronización se explica en el tema 1 de insuficiencia cardiaca. Fijaos que las armas terapéuticas son las mismas. 3 Este apartado está tal cual en las diapositivas de clase, pero el profesor lo pasó rápidamente. La MCR es una miocardiopatía infrecuente y sus criterios diagnósticos, en ocasiones, son confusos. No suele ser familiar. En ella tenemos un corazón acartonado, que no se distiende correctamente. Por esto, predomina la disfunción diastólica y, en ocasiones, también se acompaña de diferentes grados de disfunción sistólica. Esta patología puede presentarse a cualquier edad, aunque es más frecuente en la edad adulta (40-60 años), con lo que es más tardía en su aparición que la MCD. También a diferencia de la MCD, es rápidamente progresiva y suele tener un mal pronóstico en meses, o en 1-2 años. Su diagnóstico suele establecerse por ecocardiografía, presentando un tamaño ventricular normal y el grosor ventricular normal o muy levemente aumentado. Hay que hacer diagnóstico diferencial siempre con enfermedad por depósito. A.A., E.G., R.C. J.R Gimeno Blanes 4
329 TEMA MCP-2 CARDIOLOGÍA CMG Los ventrículos son rígidos y las aurículas están muy aumentadas a consecuencia del incremento de presión en los ventrículos. Sus síntomas son, según el lado del corazón afectado: Fallo cardiaco derecho: congestión hepática y edemas. Éste es el que suele predominar. Fallo cardiaco izquierdo: cansancio, fatiga y disnea. Aquí vemos una imagen de RMN con el típico patrón de MCR: Ventrículos de pared engrosada y unas aurículas enormes. Estos pacientes tienen tendencia a sufrir accidentes embólicos y ACV 4, por la existencia de grandes trombos que se generan en las enormes aurículas que suelen tener estos pacientes. El tratamiento suele ser sintomático y se usan fármacos como diuréticos y vasodilatadores a dosis bajas. También pueden emplearse anticoagulantes para prevenir las embolias y los ACV. Es muy importante realizar un seguimiento estrecho a estos pacientes. En ocasiones, la única opción es el trasplante cardiaco. Una característica de la MCR es la disminución y, casi pérdida, de los voltajes eléctricos del corazón. Esto se hace muy patente en el ECG 5. Otra característica es la evolución a FA, que es muy frecuente 6. 4 Accidente cerebrovascular. 5 Esto llega a ser tan patente que, en una ocasión, un paciente con amiloidosis que presentaba una MCR, al intentar hacer una ecocardiografía (que requiere control electrocardiográfico), el aparato no detectaba voltajes y se hizo casi imposible su realización. 6 Esto es pregunta de examen. OTRAS MIOCARDIOPATÍAS MIOCARDIOPATÍA ESPONGIFORME Es una patología debida a la falta de compactación del ventrículo izquierdo. Se trata de una entidad parecida a la MCD pero con una mayor tendencia a embolias y parece que también a la muerte súbita. Así mismo, presenta menos disfunción sistólica y un ventrículo izquierdo menos dilatado. Puede ser familiar. Suele aparecer en el ápex cardiaco, y es difícil de ver porque los ultrasonidos no atraviesan bien el aire del pulmón, ni el calcio de las costillas. Últimamente está de moda su diagnóstico debido a que los nuevos equipos de ecocardiografía que permiten ver mejor el ápex. El corazón en su desarrollo embriológico tiene trabéculas que desaparecen en el ventrículo izquierdo cuando el corazón queda completamente formado. El ventrículo derecho, en cambio, sí mantiene parte de estas trabéculas que pueden verse en un adulto normal. A.A., E.G., R.C. J.R Gimeno Blanes 5
330 TEMA MCP-2 CARDIOLOGÍA CMG En definitiva la hipertrabeculación del ventrículo izquierdo no es normal y es la que caractariza esta miocardiopatía. La evolución y el pronóstico de esta enfermedad no están del todo claros. Es compatible con una vida normal en muchos casos, aunque es cierto que tienen una mayor tendencia a desarrollar una MCD. El tratamiento cuando hay disfunción sistólica es similar al de la MCD. Aquí tenemos una pieza de necropsia donde vemos la típica morfología en trabéculas: En la siguiente imagen vemos una ecocardiografía donde se ve la falta de compactación (hipertrabeculación o aspecto espongiforme) en el miocardio del VI: MIOCARDIOPATÍA ARRITMOGÉNI- CA DEL VENTRÍCULO DERECHO La miocardiopatía arritmogénica del ventrículo derecho (MAVD) o displasia arritmogénica del ventrículo 7, consiste en la sustitución del músculo del VD por tejido adiposo o fibroadiposo. Parece tener una base molecular y la alteración afecta 5 proteínas del desmosoma. Es una entidad muy rara en nuestro país, aunque es bastante frecuente en algunas regiones, como la del Véneto en Italia. En Italia es la principal causa de muerte súbita en atletas jóvenes. Suele afectar a varones jóvenes (20-30 años) y se caracteriza por la aparición de arritmias originadas en el VD. En estos pacientes, el VI suele ser normal. La aparición de síncope y muerte súbita en el marco de la MAVD está muy estrechamente relacionada con el ejercicio. Normalmente, no hay síntomas de insuficiencia cardiaca. Su diagnóstico es complicado por ecocardiografía, ya que la pared del VD es muy fina. En cuanto al tratamiento, es muy importante no realizar ejercicio físico. Los antiarrítmicos estarían indicados si existen taquicardias, y se puede valorar la implantación de un DAI en casos de alto riesgo. A continuación vemos una pieza de necropsia en la que se ven las alteraciones de la pared del VD: 7 Esta patología se hizo desgraciadamente famosa el verano pasado, ya que se dijo fue la causa de la muerte súbita del futbolista del Sevilla FC Antonio Puerta. A.A., E.G., R.C. J.R Gimeno Blanes 6
331 TEMA MCP-2 CARDIOLOGÍA CMG ZONA ECG Para que sea más amena y didáctica, esta zona ECG se basará en un caso clínico donde, a parte de aprender los apasionantes electrodetalles que tenemos sobre miocardiopatías, veremos la importancia del screening familiar en este tipo de patologías. Comenzamos!: Tenemos una familia tal que así: En ella, el padre falleció a los 45 años, aparentemente de un IAM. La pareja, la cual no tenían relación de consanguinidad, tuvo cuatro hijos (A, B, C y D). De los cuatro, dos de ellos son gemelos (A y B). A los 41 años, el sujeto A fue de diagnosticado de MCD tras presentar un cuadro de disnea y este ECG (Fig.1): Fig. 1: ECG del sujeto A en el que se observan las ondas P algo ensanchadas (crecimiento auricular izquierdo), PR normal, QRS ancho, BRI y alteraciones de la repolarización. A.A., E.G., R.C. J.R Gimeno Blanes 7
332 TEMA MCP-2 CARDIOLOGÍA CMG Por los conocimientos que tenemos sobre la enfermedad, sabemos que el riesgo de que su hermano gemelo, el sujeto B, esté también afectado es alto. Además, el sujeto B estaba pendiente de de una consulta por alergia. Éste no presenta síntomas ni está diagnosticado de MCD. Se procede a realizarle un ECG y observamos lo siguiente: Fig. 2: ECG del sujeto B en el que se observan las mismas alteraciones que veíamos en su hermano. Seguramente la consulta por alergia era en realidad por disnea por la enfermedad. De momento, nuestra familia queda así: Ambos gemelos presentan patrones electrocardiográficos de MCD pero, qué pasa con sus hermanos? Los sujetos C y D no presentan síntoma alguno pero, recordemos que estamos ante una enfermedad que progresa muy lentamente y cuyo periodo de latencia es bastante alto (a diferencia de la MCR que, como se ha visto, evoluciona con una velocidad bastante alta). Para asegurarnos, citamos al sujeto C y a la D y les realizamos un ECG que podemos ver en las figuras 3 y 4. A.A., E.G., R.C. J.R Gimeno Blanes 8
333 TEMA MCP-2 CARDIOLOGÍA CMG Fig. 3: ECG del sujeto C y triste sorpresa! Por desgracia, este hermano presenta un ECG bastante sugerente y compatible con una MCD donde observamos esas ondas P algo ensanchadas (CAI), un PR normal, QRS ancho, BRI (aunque menos evidente) y alteraciones de la repolarización. Fig. 4: ECG de la sujeto D y ES NORMAL! Con una FC de unos 63 lpm, ondas P normales, PR dentro de la duración establecida, QRS estrecho, sin presencia de bloqueos de rama y sin alteraciones de la repolarización. A.A., E.G., R.C. J.R Gimeno Blanes 9
334 TEMA MCP-2 CARDIOLOGÍA CMG De los cuatro hermanos, 3 tienen una MCD (75%) y una tiene un corazón normal (25%). Sabiendo como sabemos que en el 20-30%, la MCD se presenta con carácter familiar y suele ser una enfermedad autosómica dominante (mirad que porcentajes tan curiosos), si la madre es, cardiológicamente, normal, el padre debía tener algo más que un IAM. Miremos como queda ahora la familia: Y, por si quedaba alguna duda: Ahora, fuera del caso anteriormente expuesto: Fig. 5: ECG de una miocardiopatía arritmogénica del ventrículo derecho. A.A., E.G., R.C. J.R Gimeno Blanes 10
335 TEMA MCP-2 CARDIOLOGÍA CMG ZONA ECO Aquí tenemos las ecocardiografías de los sujetos A y D del caso expuesto en la zona ECG. Fig. 1: Sujeto A, con MCD: Fig. 4: Sujeto D, no vemos dilatación del ventrículo: A.A., E.G., R.C. J.R Gimeno Blanes 11
336
337
338 TEMA PER-1 CARDIOLOGÍA CMG PATOLOGÍA PERICÁRDICA I. INTRODUCCIÓN A LA PATO- LOGÍA PERICÁRDICA ANATOMÍA DEL PERICARDIO El pericardio 1 es una membrana que envuelve y separa al corazón de las estructuras vecinas. Está formado por una doble hoja que se invagina sobre sí misma en la llegada de los grandes troncos venosos y arteriales. La hoja interna se denomina pericardio visceral (epicardio) y la externa pericardio parietal. De ello deducimos que el pericardio encierra entre sus dos hojas una cavidad (cavidad pericárdica); esta cavidad es virtual y dentro de ella hay una pequeña cantidad de líquido lubrificante que facilita el deslizamiento de una hoja sobre la otra. Se puede decir que la disposición del corazón y el pericardio se asemeja a un puño introducido dentro de un globo lleno de agua. Las principales funciones del pericardio son: 1. Previene la súbita dilatación cardiaca en situaciones de sobrecarga de volumen. 2. Previene el desplazamiento y la torsión. 3. Previene la transmisión de infecciones. 4. Facilita el llenado auricular, al transmitir la presión negativa que se genera en la cavidad torácica durante la inspiración y generar un efecto succión. Esta es su función más importante y en ocasiones es impedida por la aparición de calcificaciones pericárdicas. 1 Piricardio en la Región de Murcia. Esquema PER1 1 AMPLIACIÓN DE CONTENIDO DE INTERÉS. Histológicamente el pericardio parietal está constituido por tejido fibroso (pericardio fibroso). Internamente, este tejido fibroso es tapizado por un mesotelio (pericardio seroso) que, al reflejarse, tapiza igualmente el corazón. El mesotelio seroso secreta el líquido que se acumula en la cavidad pericárdica; su volumen en condiciones normales no supera los 50 ml. La presión de esta cavidad es ligeramente mayor que la presión intrapleural (1 a 4 mmhg). El pericardio está inervado por terminaciones procedentes de los nervios frénicos y del plexo vagal esofágico. Contiene mecanorreceptores sensibles al estiramiento, quimiorreceptores y vasos linfáticos que, junto con las venas, intervienen en el drenaje del líquido pericárdico. La irrigación arterial procede fundamentalmente de las mamarias internas y de la arteria pericardicofrénica. FIN DEL CONTENIDO AMPLIADO J. A., P. F., M.C. Soria 2
339 TEMA PER-1 CARDIOLOGÍA CMG GRANDES SÍNDROMES PERI- CÁRDICOS Las enfermedades del pericardio abarcan diversos procesos cuya etiología es muy amplia. Independientemente de ésta, los síndromes relacionados con la patología pericárdica se agrupan en 2 : Pericarditis aguda. Derrame pericárdico (con o sin compresión). Pericarditis constrictiva. compresión). Por último, las pericarditis agudas, con o sin derrame, pueden evolucionar a formas crónicas en las que se produce un aumento de la rigidez del pericardio que provoca una importante restricción del llenado ventricular (pericarditis constrictiva). De aquí en adelante veremos individualmente cada una de estas patologías: pericarditis aguda, derrame pericárdico (con o sin compresión) y pericarditis constrictiva De las dos posibles vías finales de todos los mecanismos patológicos que llevan al fallo cardiaco (muerte súbita e insuficiencia cardiaca), la vía final de las enfermedades del pericardio es la aparición de insuficiencia cardiaca (IC). Esquema PER1 2 Para no perder la visión global a lo largo de este gran tema, a continuación vamos a definir e interrelacionar brevemente estos tres grandes síndromes. Son muchos los microorganismos que infectan al ser humano y que pueden producir procesos inflamatorios del pericardio (pericarditis agudas). Durante estos procesos puede aumentar la cantidad de líquido contenido en el espació pericárdico (derrame pericárdico). El derrame puede deberse también a otras causas y según la cantidad de líquido acumulado podrá producir compresión cardiaca (derrame pericárdico con compresión o taponamiento cardiaco) o no (derrame pericárdico sin 2 También pueden existir defectos congénitos como ausencia parcial o total del pericardio; que en el primero de los casos puede dar lugar a la herniación y a la estrangulación del corazón. También se describen quistes (como los producidos por la hidatidosis) y tumores pericárdicos. J. A., P. F., M.C. Soria 3
340 TEMA PER-1 CARDIOLOGÍA CMG II. PERICARDITIS AGUDA CONCEPTO La pericarditis aguda es un síndrome clínico en el que, por diferentes mecanismos y etiologías, la inflamación del pericardio da lugar a un cuadro caracterizado fundamentalmente por dolor torácico, roce pericárdico y cambios electrocardiográficos. Esquema PER1 3 be en más del 90% de los casos de pericarditis aguda. Las infecciones bacterianas pueden conducir a pericarditis bacteriana (también llamada pericarditis purulenta). Igualmente, algunas infecciones micóticas pueden producir pericarditis. Además, la pericarditis también puede estar asociada con enfermedades sistémicas como cáncer, insuficiencia renal (pericarditis urémica), leucemia, SIDA, enfermedades autoinmunes, tuberculosis, fiebre reumática e hipotiroidismo. Los trastornos cardíacos que pueden causar pericarditis son, entre otros: IAM y miocarditis. Algunas veces, tratamientos como la radioterapia del tórax y el uso de inmunosupresores también inducen esta condición. Por último, la pericarditis puede ser el resultado de una lesión o trauma en el tórax, el esófago o el corazón (pericarditis traumática). Dentro de este último grupo se incluyen aquellas pericarditis producidas por actos quirúrgicos que, sumadas a las producidas por tratamientos como la radioterapia del tórax o el uso de inmunosupresores, se engloban dentro de las pericarditis iatrogénicas. Pericardio Normal Pericardio Inflamado Figura PER1 1 ETIOLOGÍA 3 Esquema PER1 4 La principal etiología es viral (ecovirus y coxackie) o idiopática 4. Esta última se descri- 3 Las etiologías que se comentaron en clase son las que aparecen en negrita. 4 Las pericarditis idiopáticas (causa desconocida) son en su mayoría virales, pero no se hacen las pruebas necesarias para diagnosticarlas por la dificultad que ello supone. Debemos entender por tanto que hablar de cuál de las dos etiologías es la más frecuente es muy relativo (lo digo de cara al examen). J. A., P. F., M.C. Soria 4
341 TEMA PER-1 CARDIOLOGÍA CMG ANATOMÍA PATOLÓGICA Como siempre, vamos a caracterizar tanto macro como microscópicamente la pericarditis aguda. viral y no suele aparecer en ancianos), mal estado general y mialgias. Para el diagnóstico suelen exigirse dos de los siguientes tres criterios: dolor torácico, fiebre y alteraciones electrocardiográficas o la auscultación de un roce pericárdico. Microscópicamente observamos inflamación de las hojas pericárdicas con infiltrado por polimorfonucleares, neovascularización y depósitos de fibrina (que originan las adherencias fibrosas). Macroscópicamente apreciamos adherencias fibrosas, como ya hemos mencionado, que pueden darse entre pericardio-epicardio, pericardio-pericardio y/o pericardio-estructuras adyacentes. Podemos encontrar un poco aumentado el líquido intrapericárdico (exudado intrapericárdico), si éste es abundante hablamos de derrame pericárdico. Esquema PER1 5 Según lo visto anteriormente, entenderemos que el diagnóstico se fundamentará en la clínica y en el electrocardiograma. Esquema PER1 4 Esquema PER1 6 DIAGNÓSTICO La triada diagnóstica clásica de la pericarditis es dolor torácico, roce pericárdico y alteraciones electrocardiográficas dinámicas 5, que suelen ser precedidas (unas dos semanas antes) de catarro banal con fiebre (orienta a I. CLÍNICA ANAMNESIS (SÍNTOMAS) Dolor torácico Su localización suele ser retroesternal (zona precordial), aunque en ocasiones puede desviarse hacia la izquierda (zona precordial del hemitórax izquierdo). Es de de carac- 5 Estas alteraciones tienen una evolución típica durante días o semanas, que veremos más adelante. J. A., P. F., M.C. Soria 5
342 TEMA PER-1 CARDIOLOGÍA CMG terísticas pleuríticas 6 y se puede irradiar al cuello, espalda o al trapecio izquierdo (estas características, parecidas a las de los cuadros isquémicos, obligan al diagnóstico diferencial). Puede acompañarse de sensación de falta de aire. Ocasionalmente también puede localizarse en la región epigástrica, simulando un abdomen agudo. Suele aumentar en intensidad con la inspiración profunda, la tos, la deglución y la posición supina 7, pero se suele aliviar con la incorporación hacia delante (anteversión de tórax) en la posición de sentado. Como ya hemos comentado, es uno de los pilares más importantes para el diagnóstico. Esquema PER1 7 Fiebre Más bien se trata de febrícula, de bajo grado, pero mantenida. Taquipnea El paciente tiende a hipoventilar (para no aumentar el dolor 8 ) y como mecanismo de defensa corporal aparece la taquipnea. 6 El dolor de tipo pleurítico es aquel que se desencadena con los movimientos respiratorios (el paciente se hace consciente de la respiración y suele acompañarse de sensación disneica). Es severo y de comienzo agudo. Es un dolor localizado y más intenso en el tercio inferior del tórax. 7 La inspiración profunda, la tos, la deglución y la posición supina van a aumentar el roce del pericardio con las estructuras adyacentes. 8 Al hipoventilar, el pulmón se expande menos, y la presión que ejerce sobre el pericardio es por tanto menor. Ello disminuye el dolor pericárdico. Síntomas en función de la etiología Tos, expectoración, pérdida de peso... EXPLORACIÓN FÍSICA (SÍGNOS) Roce pericárdico Es un hallazgo patognomónico en la pericarditis aguda. Es producido por la fricción de las hojas pericárdicas inflamadas y se asemeja al ruido que produce la fricción de cuero. Se da en aproximadamente el 60-85% de los casos. Puede localizarse en distintos momentos del latido cardiaco; así se definen roces presistólicos, roces sistólicos, roces protodiastólicos o roces de suma (suma de varios componentes) 9. Se ausculta mejor a nivel de mesocardio y en la parte baja del borde esternal izquierdo, sobretodo al final de la espiración, con el paciente inclinado hacia delante 10. Es independiente de la existencia de derrame y, a veces, se puede confundir con un soplo sistólico mitral o tricuspídeo. Es característica del roce pericárdico su inconstancia 11, por lo que deberemos repetir en varias ocasiones la auscultación. II. EXPLORACIONES COMPLE- MENTARIAS A. ELECTROCARDIOGRAMA 12 Conforme evoluciona la pericarditis el electrocardiograma va variando y por ello se describen varias fases: Fase 1 (aguda) En el ámbito de días. Los cambios son generalizados (se observan en todas las derivaciones menos en avr y V1). Hay un descenso del segmento PR (que indica inflamación de pericardio próxima a las aurículas) y elevación del ST con concavidad hacia arriba (diferencia con el IAM). Todos estos cambios son signos de lesión subepicárdica. 9 Podéis encontrar más información en Guías Clínicas sobre Pericarditis en fisterra.com. 10 En esta posición el corazón se aproxima a la pared torácica. 11 La auscultación varía con el tiempo y con el tratamiento (p.ej, los antiinflamatorios disminuyen el roce). 12 En el anexo de la última página se incluye un ejemplo de electrocardiograma de pericarditis aguda. J. A., P. F., M.C. Soria 6
343 TEMA PER-1 CARDIOLOGÍA CMG Fase 2 (subaguda) En el ámbito de días a semanas. Inicialmente (fase 2 temprana) se produce la normalización del intervalo PR y el segmento ST se aplana y vuelve a ser isoeléctrico. Seguidamente (fase 2 tardía), las ondas T se van aplanando poco a poco. Fase 3 En el ámbito de semanas a meses. Se produce una inversión generalizada de las ondas T. Fase 4 El ECG retorna a estadio previo al episodio de pericarditis. No ocurre obligatoriamente y, en algunos casos, persisten las ondas T negativas durante meses, sin que ello signifique la persistencia de la enfermedad. Sólo el 50% de los casos presentan los 4 estadios de evolución. Se han descrito casos en los que ha habido ausencia total de cambios electrocardiográficos. A diferencia de lo que ocurre en el IAM, hay ausencia de ondas Q. B. DIAGNÓSTICO DE LABORATORIO Marcadores inespecíficos de inflamación Aumento de reactantes de fase aguda (VSG, leucocitosis, fibrinógeno, PCR ) Marcadores de necrosis miocárdica Troponinas, mioglobina, CK-MB serán positivos si existe afectación miocárdica asociada (miopericarditis 13 ). Estos marcadores pueden confundirnos con la cardiopatía isquémica. Orientación al diagnóstico etiológico Se pueden hacer determinaciones del título de anticuerpos específicos (aglutinaciones, test serológicos,...). Estas pruebas no se suelen realizar porque, independientemente del resultado, el tratamiento no va a variar; lógicamente, lo más frecuente es buscar anticuerpos antivirales. C. ECOCARDIOGRAMA No es necesario para el diagnóstico, aunque se suele hacer. Aunque sea negativo no podemos descartar la pericarditis. Sólo sirve para verificar si hay derrame asociado o signos de taponamiento (aunque tal hallazgo no establece el diagnóstico). D. RADIOLOGÍA DE TÓRAX Aunque su utilidad es muy escasa en el diagnóstico de la pericarditis aguda, se realiza casi de forma sistemática. Puede revelar alteraciones pulmonares o mediastínicas asociadas y la existencia de derrame pericárdico (cardiomegalia fundamentalmente; el resto de la semiología se estudiará en el apartado correspondiente). Esquema PER Miocarditis y pericarditis al mismo tiempo. Es frecuente que determinados microorganismo infecten ambas estructuras al extenderse de una a otra. J. A., P. F., M.C. Soria 7
344 TEMA PER-1 CARDIOLOGÍA CMG B. ELECTROCARDIOGRÁFICO B.1 Con IAM Pueden diferenciarse porque en el IAM las alteraciones son localizadas (se ven en determinadas derivaciones, en función de la localización de la zona isquémica), la evolución es diferente, los segmentos ST no presentan concavidad superior y pueden aparecer ondas Q. También nos orienta hacia el IAM el hecho de que la elevación del segmento ST y las ondas T negativas coinciden en el tiempo, mientras que en la pericarditis suceden en fases distintas (I y III, respectivamente). Imagen PER1 2 Esquema PER1 9 B.2 Patrón de repolarización precoz juvenil 14 Este patrón electrocardiográfico se describe en personas jóvenes (sobre todo en deportistas) y es asintomático. Se piensa que es debido a una hipertonía vagal (pacientes vagotónicos). Los cambios que aparecen en este patrón no son evolutivos y se modifican con el ejercicio (maniobra de Handgrip 15 ) por la estimulación simpática. Los cambios consisten en una onda T picuda, ausencia de onda S y punto J elevado. La localización es principalmente inferolateral. El cociente ST/T es menor de 0,25, mientras que en la pericarditis es mayor de 0,25. Clínicamente se diferencia de pericarditis en la ausencia de fiebre (y en que el paciente permanece asintomático). III. DIAGNÓSTICO DIFERENCIAL A. CLÍNICO Principalmente deberemos hacerlo con cardiopatía isquémica (irradiación) y con otras etiologías de dolor torácico como, por ejemplo, disección aórtica, tromboembolismo pulmonar Esquema PER Este patrón electrocardiográfico lo encontramos en jóvenes y se piensa que es debido a una hipertonía vagal. 15 Consiste en apretar fuerte los puños (ejercicio isométrico). J. A., P. F., M.C. Soria 8
345 TEMA PER-1 CARDIOLOGÍA CMG TRATAMIENTO Podemos dividirlo en tres apartados: a) Tratamiento de la enfermedad de base Tuberculosis, insuficiencia renal semanas) y colchicina (1-2 mg al día durante 6 semanas y después 0,5 mg al día hasta completar el año). Si la fiebre persiste y hay afectación del estado general, administraremos corticoides. Si no se consigue respuesta se administrarán inmunosupresores (azitropina) o incluso intervención quirúrgica para quitar el pericardio (pericardioectomía). b) Tratamiento del primer episodio de pericarditis Guardar reposo mientras dure el dolor y la fiebre (fase aguda). Habitualmente, no es preciso el ingreso hospitalario (salvo si existe derrame pericárdico). El tratamiento farmacológico consistirá en ácido acetilsalicílico (500mg cada 6 horas durante 3 semanas). Si existen contraindicaciones, administraremos otros AINEs a dosis bajas. Si no hay buena respuesta, administraremos indometacina (25-50 mg cada 6 horas durante 3 semanas) o ibuprofreno (600 mg cada 8 horas durante 3 semanas). Si la respuesta sigue siendo nula a los 5 o 6 días, la última opción 16 sería la prednisona (60-80 mg al día). Antes de este tratamiento inmunosupresor deberemos descartar la tuberculosis porque podríamos complicar el cuadro. NUNCA administrar anticoagulantes por el riesgo de transformación hemorrágica (hemopericardio). c) Tratamiento de las formas recidivantes Debemos comprobar que se ha realizado un buen diagnóstico ( etiología autoinmune?) y tratamiento ( habremos abusado de los esteroides?). Si no ha habido irregularidades, deberemos atender al número de recidiva del que se trate y al tiempo entre episodios. Si es la primera o segunda recidiva y han pasado más de 6 semanas entre episodios, debemos prescribir el mismo tratamiento que para el primer episodio. Si la recurrencia es la tercera o mayor, o si han pasado menos de seis semanas (pericarditis incesante) deberemos administras AINEs (6 Esquema PER1 11 PRONÓSTICO Y COMPLICACIONES El curso de la pericarditis es habitualmente benigno y normalmente cura sin secuelas. La principal complicación es la recurrencia del cuadro. En algunos casos se pueden repetir los episodios y más raramente, pueden evolucionar hacia una pericarditis con derrame (que si es moderado, seguirá teniendo un buen pronóstico, pero si es intenso el pronóstico empeorará) o a pericarditis constrictiva (en cuyo caso el pronóstico será de gravedad interme- 16 Se utiliza como última opción en un primer episodio porque los corticoides aumentan el riesgo de recurrencia. J. A., P. F., M.C. Soria 9
346 TEMA PER-1 CARDIOLOGÍA CMG dia). En caso de que la infección se extienda al pericardio puede producirse una miopericarditis que podrá derivar en una insuficiencia cardiaca (ver tema de miocarditis). Si la pericarditis es por tuberculosis, secundaria a insuficiencia renal o a neoplasia, el pronóstico es malo. Esquema PER1 12 J. A., P. F., M.C. Soria 10
347 TEMA PER-1 CARDIOLOGÍA CMG ANEXO I Ejemplo de electrocardiograma de pericarditis aguda en estadio I. Obsérvese los cambios generalizados (excepto en avr y V1): descenso del segmento PR, onda T positivas en derivaciones con ST elevado de concavidad superior. Elevación ST de concavidad superior y ondas T positivas Descenso PR J. A., P. F., M.C. Soria 11
348
349 TEMA PER-2 CARDIOLOGÍA CMG PATOLOGÍA PERICÁRDICA III. DERRAME PERICÁRDICO INTRODUCCIÓN Se define derrame pericárdico como el aumento del volumen de líquido en la cavidad pericárdica. Como ya comentamos en la introducción del tema, el líquido acumulado normalmente en la cavidad pericárdica no supera los 50 ml, lo que significa una presión intrapericárdica de 1 a 4 mmhg. El pericardio, en condiciones normales, puede almacenar hasta unos ml sin variar prácticamente su presión; se define por tanto el volumen de reserva pericárdico como aquel volumen máximo hasta el cual la presión intrapericárdica no varía. Si se supera este volumen, la presión intrapericárdica aumenta rápidamente (en la curva de presión-volumen veremos una inflexión o rodilla ). Sin embargo, este parámetro no es constante, dado que, si el aumento de volumen en la cavidad se produce lentamente, el pericardio va aumentado su distensibilidad, lo que se traduce en un mayor volumen de reserva pericárdico (en la curva presión-volumen la rodilla se desplaza hacia la derecha, hacia la zona de mayor volumen). Cuando la presión intrapericárdica aumenta por encima de la presión de las cavidades cardiacas se altera la función cardiaca. Al ser la presión de la aurícula derecha la más baja (sólo 5 mmhg), ésta es la primera en ser superada y ello se traduce en una alteración del llenado auricular. Esquema PER2 1 Una vez entendida la fisiología pericárdica, podemos comprender cómo un derrame que se instaura en poco tiempo (en el ámbito de horas) puede llegar a producir trastornos en el llenado del corazón. Por el contrario, si el derrame es de instauración lenta, se pueden alcanzar más de 200 ml sin efectos hemodinámicos importantes. Hablamos en el primer caso de derrame pericárdico con compresión o taponamiento cardiaco y en el segundo de derrame pericárdico sin compresión. Por tanto, el que se dé una u otra forma dependerá de: a) Velocidad de formación del derrame (de acumulación de líquido): si el derrame se forma en semanas o meses es más posible que no aparezca compresión. b) Cuantía del derrame: cuanto mayor séale derrame, mayor posibilidad de que se produzca compresión. J. A., P. F., M.C. Soria 1
350 TEMA PER-2 CARDIOLOGÍA CMG c) Características físicas del pericardio: si el pericardio está fibrosado y no permite la dilatación, el derrame será compresivo. Al contrario, si está sano, podrá alcanzar mayores volúmenes sin producir taponamiento cardiaco. Esquema PER2 2 Dadas las diferencias entre ambos cuadros, los estudiaremos por separado, empezando por el derrame pericárdico sin compresión. J. A., P. F., M.C. Soria 2
351 TEMA PER-2 CARDIOLOGÍA CMG DERRAME PERICÁRDICO SIN COMPRESIÓN. CONCEPTO También puede aparecer en el curso de insuficiencias renales (urémica), hipotiroidismo, neoplasias, tuberculosis, insuficiencia cardiaca congestiva, postpericardiotomía El derrame pericárdico sin compresión (DPSC) se produce cuando el líquido contenido en la cavidad pericárdica no ejerce una mayor presión en la aurícula o en el ventrículo, ya que no aumenta la presión intrapericárdica. En este caso, no se constantan síntomas de compresión. La presión intrapericárdica aumenta cuando se supera un determinado volumen de líquido pericárdico, denominado volumen de reserva pericardico. ETIOLOGÍA La principal etiología de este cuadro es la viral (sobre todo se trata de pericarditis agudas evolucionadas). FISIOPATOLOGÍA La producción de síntomas y signos en un derrame pericárdico depende de: a) Presiones intrapericárdicas: al ser normales, no producirán síntomas de compresión cardiaca. b) Compresión de estructuras vecinas: la compresión de la tráquea y/o pulmón produce tos y disnea, la del nervio recurrente, voz bitonal y la del esófago, disfagia. También se puede producir irritación del diafragma y/o de los nervios frénicos y aparecer hipo. J. A., P. F., M.C. Soria 3
352 TEMA PER-2 CARDIOLOGÍA CMG DIAGNÓSTICO La clínica, por ser inespecífica, no es muy útil. Igualmente ocurre con el electrocardiograma, las pruebas de laboratorio, el TAC o la RMN. Fundamentalmente nos serviremos del ecocardiograma y la radiología de tórax. En muchas ocasiones el diagnóstico es casual. Esquema PER2 6 II. EXPLORACIONES COMPLE- MENTARIAS A. RADIOLOGÍA DE TÓRAX I. CLÍNICA Esquema PER2 5 ANAMNESIS (SÍNTOMAS) El paciente puede no mostrar síntomas (formas asintomáticas), mostrar ligeras molestias o síntomas por compresión de estructuras vecinas (tos, disnea, disfagia, hipo, voz bitonal ). Varía desde la absoluta normalidad a la silueta cardiaca en garrafa (pedículo vascular estrecho y cardiomegalia (índice cardiotorácico grande). Esta semiología aparece cuando el derrame es superior a 100 ml, por lo que la ausencia de este patrón no nos puede hacer descartar el diagnóstico de DPSC. No hay signos de congestión venosa pulmonar (diagnóstico diferencial con insuficiencia cardiaca). En ocasiones podemos apreciar signos de atelectasia en la localización que describimos para el signo de Ewart. En la fluoroscopia, el corazón aparece quieto 2. EXPLORACIÓN FÍSICA (SÍGNOS) No se palpa el latido apical debido al líquido acumulado entre la pared torácica y el corazón. Por la misma razón, en la auscultación encontraremos los tonos cardiacos apagados. En ocasiones puede aparecer un roce pericárdico o el llamado signo de Ewart 1, que consiste en soplo tubárico y matidez a la percusión debajo del ángulo inferior de la escápula izquierda. Este signo se produce a consecuencia de la atelectasia (hipoventilación) inducida por la compresión de los bronquios izquierdos. Imagen PER2 1 1 La descripción siguiente corresponde al llamado signo de Ewart II. El signo de Ewart I (no nombrado por el profesor) consiste en una prominencia anormal del borde superior de la primera costilla que aparece en algunos casos de derrame. 2 La cavidad pericárdica está llena de líquido y dentro se encuentra el corazón latiendo. Como las densidades radiológicas son similares, no apreciaremos el latido cardiaco dentro del pericardio y, por tanto, parecerá que el corazón está quieto. J. A., P. F., M.C. Soria 4
353 TEMA PER-2 CARDIOLOGÍA CMG B. ELECTROCARDIOGRAMA Como ya comentamos, el ECG es de poca ayuda. Podemos encontrar un patrón de bajo voltaje porque la transmisión del potencial se ve mermada por el líquido acumulado. El criterio para diagnosticar tal patrón es que la suma (en mm.) de la amplitud de las ondas R en DI, DII y DIII y la profundidad de las ondas S en las mismas derivaciones sea menor de 15 mm. También suele encontrarse un aplanamiento o inversión de las ondas T de forma generalizada. C. ECOCARDIOGRAMA Es fundamental para el diagnóstico porque nos permite ver el derrame y, además, nos sirve para cuantificar su severidad. Distinguiremos tres grados de severidad en función del grosor del pericardio: derrame ligero (aproximadamente 10 mm de grosor que se corresponden con un derrame de menos de 100 ml.), moderado (hasta 2 cm de grosor que se corresponden con un derrame de entre 100 y 500 ml.) y severo (mayor de 2 cm de grosor que se corresponden con un derrame de más de 500 ml.). Además, el ecocardiograma detecta el tipo de derrame (localizado o difuso) y es capaz de discriminar, a través de las diferentes densidades ecocardiográficas, si está compuesto por sangre o si es un trasudado; pero no permite identificar la causa. D. TC/RMN Sólo se solicitan en ocasiones puntuales. E. PRUEVAS INVASIVAS (CATETERISMO CARDIACO) Es una opción diagnóstica pero su uso es muy poco frecuente. TRATAMIENTO Esquema PER2 7 Dependerá del grado de severidad: Derrame pericárdico ligero (<10 mm): No precisa estudio etiológico ni tratamiento. Lo que haremos es un seguimiento de estos pacientes cada 6 meses durante 1 año. Derrame pericárdico moderado (10 mm a 2 cm): En este caso, llevaremos a cabo un estudio etiológico para descartar ciertas causas como hipotiroidismo (estudio de función tiroidea), insuficiencia renal (analítica general) o enfermedad autoinmune (anticuerpos antitejido). Una vez identificada la causa deberemos proceder a su tratamiento. Si, por el contrario, no se identifica la causa se pueden administrar AINEs aunque su eficacia no está demostrada. Realizaremos una revisión cada 3 meses durante un año. J. A., P. F., M.C. Soria 5
354 TEMA PER-2 CARDIOLOGÍA CMG Derrame pericárdico severo (más de 2 cm): El estudio etiológico será igual que en el tipo anterior. El tratamiento será también diagnóstico, ya que realizaremos una pericardiocentesis. Si esta aclara la etiología, pondremos tratamiento específico. Si no se identifica la causa del derrame, como ocurre en la mayoría de los casos, no tendremos más remedio que recurrir a los AINEs. Deberemos realizar revisiones cada 3 meses durante un año. Si en una de esas revisiones encontramos una recidiva deberemos: si es la primera recidiva, volver a practicar la pericardiocentesis; si es la segunda, abrir una ventana pericárdica quirúrgicamente que comunique pericardio y pleura (pericardiostomía) o proceder a la exéresis del pericardio (pericardiectomía). Por último, comentar algunas especificaciones sobre las diferentes técnicas quirúrgicas. El rendimiento diagnóstico de la pericardiocentesis es muy bajo. Si requerimos realizar una biopsia pericárdica para el diagnóstico, el método de elección será el drenaje quirúrgico subxifoideo. La ventana pericárdica se utiliza en casos de derrames repetidos en los que no podemos actuar sobre la causa. Esquema PER2 8 J. A., P. F., M.C. Soria 6
355 TEMA PER-2 CARDIOLOGÍA CMG DERRAME PERICÁRDICO CON COMPRESIÓN TAPONAMIENTO CARDIACO CONCEPTO ETIOLOGÍA El derrame pericárdico con compresión (DPCC), taponamiento cardiaco o derrame pericárdico a tensión 3, se produce cuando el incremento del volumen intrapericárdico es lo suficientemente pronunciado, o se produce en un breve espacio de tiempo, como para incrementar la presión intrapericárdica y producir un compromiso de la función cardiaca. Este compromiso consiste en que la elevada presión intrapericárdica interfiere en el llenado auricular y ventricular (lo reduce), disminuyendo el volumen eyectado en cada latido. El DPCC tiene como causa más frecuente el sangrado intrapericárdico agudo, que puede ser provocado por neoplasias, aparecer como complicación de pericarditis urémica o tuberculosa, por coagulopatías (anticoagulación iatrogénica), disección aórtica,.. También puede aparecer (aunque es muy poco frecuente) como una posible evolución de un derrame pericárdico sin compresión. Imagen PER2 2 Esquema PER2 9 3 También llamado constricción pericárdica (no confundir con pericarditis constricitiva) J. A., P. F., M.C. Soria 7
356 TEMA PER-2 CARDIOLOGÍA CMG ESQUEMA PER2 10 FISIOPATOLOGÍA En el derrame con compresión se produce un aumento de la presión intrapericárdica por un lado y una compresión de las estructuras vecinas (igual que en el DPSC pero con mayor intensidad). La compresión de estructuras vecinas puede producir tos o disnea (por compresión del pulmón o la tráquea), voz bitonal (si se ve afectado el recurrente) o disfagia (si el comprimido es el esófago). Dada la etiología, el hipo es menos frecuente. Sin embargo, los síntomas más llamativos son los debidos al aumento de la presión intrapericárdica. Inicialmente, los aumentos del volumen pericárdico por el derrame no se acompañan de aumentos de presión intrapericárdica (por la existencia del llamado volumen de reserva de la cavidad pericárdica). Pero al llegar a cierto volumen crítico, pequeños incrementos de volumen producen un gran incremento de presión (por ello, pequeñas evacuaciones de derrames pericárdicos conllevan una importante mejora de la sintomatología). Como ya comentamos en la introducción al derrame pericárdico, la velocidad de instauración es fundamental, pues cuanto menor sea, mayores volúmenes serán tolerados. Cuando la presión intrapericárdica sobrepasa las presiones de las cavidades (concretamente, la primera en verse afectada es la aurícula derecha), se altera su llenado. Prácticamente para el mismo nivel de presión intrapericárdica se altera también el llenado ventricular derecho, lo que disminuye el gasto cardiaco. Realmente, el gasto cardiaco izquierdo sólo disminuye en las fases avanzadas de la enfermedad 4. 4 En el contenido ampliado podéis encontrar una explicación detallada de lo que ocurre con el gasto cardiaco. Es aconsejable que lo leáis una vez hayáis terminado de estudiar el tema porque aparecen muchos conceptos que se explican más adelante J. A., P. F., M.C. Soria 8
357 TEMA PER-2 CARDIOLOGÍA CMG AMPLIACIÓN DE CONTENIDO DE INTERÉS. El gasto cardíaco se mantiene normal o baja de forma imperceptible y la presión sistólica del ventrículo izquierdo y la presión arterial sistólica descienden muy ligeramente durante la inspiración. Esta situación ha sido denominada "taponamiento del corazón derecho".sin embargo, en sentido estricto, la situación aún no puede ser catalogada como taponamiento cardíaco. Si sigue aumentando el líquido pericárdico, la presión intrapericárdica aumenta aún más, ya que pequeños incrementos de volumen originan importantes incrementos de las presiones intrapericárdicas (ya ha sido superada la capacidad de distensión del pericardio y la reserva pericárdica). Paralelamente aumentan las presiones diastólicas de los ventrículos derecho e izquierdo, llegando un momento en el que las presiones intrapericárdica y diastólica del ventrículo derecho, que ya estaban igualadas previamente, se equilibran con la presión diastólica del ventrículo izquierdo. De forma paralela, el volumen de la cavidad ventricular derecha se hace progresivamente menor, disminuyendo el gasto cardíaco y apareciendo pulso paradójico (descenso inspiratorio > 10 mmhg de la presión sistólica arterial), aunque sólo en algunos enfermos. A partir de este momento, mínimos aumentos del líquido pericárdico originan grandes aumentos de la presión intrapericárdica (se mueve en la parte más perpendicular de la curva de volumenpresión), de forma que aumentan considerablemente las presiones equilibradas en todas las cámaras cardíacas, oponiéndose al llenado y disminuyendo el volumen ventricular, hasta el punto de existir una reducción crítica del volumen latido a cualquier frecuencia cardiaca. Este descenso del gasto cardíaco es tanto mayor cuanto más elevado es el nivel en el que se igualan patológicamente estas tres presiones, pudiendo alcanzar un nivel tal que el gasto cardíaco sea totalmente insuficiente para las necesidades metabólicas del individuo. En esta situación aparece pulso paradójico en el 100 % de los pacientes. FIN DEL CONTENIDO AMPLIADO Esta situación, además de afectar a las cavidades, comprime a las venas y arterias que llegan o salen del corazón. Así, la vena cava cuando entra en el pericardio esta comprimida, acumulándose el volumen antes de entrar en él por la presión venosa central aumentada. Esquema PER2 11 J. A., P. F., M.C. Soria 9
358 TEMA PER-2 CARDIOLOGÍA CMG DIAGNÓSTICO Debemos sospechar taponamiento cardiaco en un paciente con la siguiente clínica: taquipnea, taquicardia, hipotensión, ingurgitación yugular y Kussmault positivo. La confirmación se realiza mediante ecocardiograma. Es mucho más importante, existiendo algunos signos patognomónicos como el pulso yugular de morfología característica y el pulso paradójico arterial de Kussmault. Otros signos (no patognomónicos) serían: ingurgitación yugular, taquipnea, taquicardia, pulso parvus arterial, hepatomegalia, presión arterial sistólica menor de 100 mmhg, tonos cardiacos apagados. También puede haber roce pericárdico y signos de insuficiencia cardiaca anterógrada. Esquema PER2 12 Esquema PER2 14 AMPLIACIÓN DE CONTENIDO DE INTERÉS. Pulso yugular de morfología característica (desaparece seno y pero se conserva el seno x ) I. CLÍNICA Esquema PER2 13 ANAMNESIS (SÍNTOMAS) Los síntomas son muy inespecíficos. Podemos encontrar disnea, ortopnea, dolor torácico atípico, dolor en hipocondrio derecho 5... EXPLORACIÓN FÍSICA (SÍGNOS) 5 El dolor en hipocondrio derecho revela éstasis venoso hepático (hepatomegalia dolorosa). El pulso venoso yugular muestra dos ondas positivas y dos ondas negativas o senos: La onda a corresponde a la sístole auricular, y por tanto, precede ligeramente al primer ruido cardíaco, y la onda v, que se debe a la última fase del retorno venoso mientras la válvula tricúspide permanece aún cerrada, por lo que alcanza su máximo justo en el momento de abrirse la válvula, poco después del segundo ruido cardíaco. Estas dos ondas positivas visibles y casi coincidentes con los dos ruidos cardíacos dejan entre sí a las dos ondas negativas o senos (que coinciden respectivamente con la sístole y la diástole, respectivamente). El seno x se corresponde con la caída de la presión por la relajación auricular, que coincide con la sístole ventricular, y el seno y con la caída de presión que tiene lugar desde el momento en que la sangre penetra por la válvula tricúspide hacia el ventrículo (llenado ventricular pasivo). Existe una tercera onda c positiva, muy diminuta, que sigue al primer ruido cardíaco y probablemente se debe al abombamiento hacia J. A., P. F., M.C. Soria 10
359 TEMA PER-2 CARDIOLOGÍA CMG la aurícula de la válvula tricúspide, al principio de la sístole ventricular. FIN DEL CONTENIDO AMPLIADO En el DPCC, al estar elevadas las presiones intracavitarias, el llenado ventricular pasivo no se produce y desaparece el seno y. Sin embargo, el seno x se mantiene debido a dos mecanismos coincidentes en el tiempo: 1) El vaciado auricular sólo se produce durante la contracción auricular. Por ello, inmediatamente después, conforme las aurículas se relajan, la sangre puede pasar desde las venas a la aurícula; b) En la sístole ventricular (que coincide en el tiempo como podéis ver en el ECG) origina un desplazamiento de todo el plano valvular hacia el ápex del ventrículo 6. Esta disminución del volumen que ocupa el ventrículo en el saco pericárdico rígido (y por tanto de volumen constante) permite una mayor expansión auricular (digamos que el ventrículo se encoje y le deja sitio a la aurícula ). Con todo ello, el mecanismo más importante de la presencia del seno x predominante es el primero ( el vaciado venoso se produce solamente tras la contracción auricular ). Independientemente de la morfología, la presión venosa central estará elevada. Esquema PER2 15 Pulso paradójico arterial de Kussmault. Durante la inspiración se aumenta el retorno venoso a las cavidades derechas debido a la presión negativa que se genera en la cavidad torácica. En situaciones normales, este incremento del volumen se tolera sin más porque todavía existe volumen pericárdico de reserva 7. En un taponamiento pericárdico, el aumento de la presión intrapericárdica impide esa adaptación y se produce un abombamiento del tabique interventricular hacia el ventrículo izquierdo. Ello hace disminuir el volumen latido y consecuentemente la presión arterial. Se suele decir que existe Kussmault positivo cuando se observa un descenso de 10 mmhg o más en la presión arterial sistólica de un paciente coincidiendo con el latido posterior a una inspiración profunda 8. Esquema PER2 16 AMPLIACIÓN DE CONTENIDO DE INTERÉS. Triada clínica del taponamiento agudo Se conoce como Tríada clínica del taponamiento agudo a los tres siguientes datos: 1) Descenso de la TA sistémica, 2) 6 En la contracción ventricular, el acortamiento se producía principalmente a expensas del diámetro longitudinal (Fisiología de 2º). 7 El corazón, en condiciones normales, tiene espacio para aumentar su tamaño; pero cuando el pericardio está tan lleno de líquido, el corazón ni siquiera puede aumentar un poco su tamaño para adaptar el aumento de retorno venoso en inspiración. 8 Se puede diagnosticar taponamiento cardiaco si tomamos la TA del paciente en inspiración y en espiración y comprobamos que la PA disminuye más de 10 mmhg con la inspiración. J. A., P. F., M.C. Soria 11
360 TEMA PER-2 CARDIOLOGÍA CMG Aumento de la presión venosa sistémica; y 3) Corazón pequeño y silencioso. FIN DEL CONTENIDO AMPLIADO II. EXPLORACIONES COMPLE- MENTARIAS A. ELECTROCARDIOGRAMA Es un método inespecífico, pero en ocasiones puede iniciar la sospecha de DPCC, ya que, a veces, el corazón se mueve dentro del saco pericárdico (bamboleo cardiaco o swinging heart 9 ) a causa del derrame. En estos casos el ECG mostrará cambios anárquicos en el voltaje y eje de los complejos QRS (alternancia eléctrica). B. RADIOLOGÍA DE TÓRAX Tampoco es diagnóstica. Podrá haber o no cardiomegalia dependiendo de la velocidad de formación y cuantía del líquido acumulado. Además podremos apreciar, si existieran, signos de insuficiencia cardiaca izquierda (redistribución pulmonar) y/o derrame pleural. Imagen PER2 3 C. ECOCARDIOGRAMA Es muy útil y gracias a él podemos observar signos que nos indiquen DPCC. Algunos ejemplos son: Colapso de aurícula derecha: la pared auricular, más débil que la ventricular, se invagina debido a la elevada presión intrapericárdica, sobre todo, en espiración debido al aumento de la presión intratorácica. Se produce en las cavidades derechas porque en ellas la presión es más baja. Colapso de ventrículo derecho: similar al anterior pero en el ventrículo. Por tanto, revela mayor intensidad de derrame. Variación recíproca de diámetros ventriculares: en inspiración, aumenta el diámetro (volumen) del ventrículo derecho y en espiración el del ventrículo izquierdo; la explicación de este fenómeno es similar a la que vimos para el signo de Kussmault. En un plano de cuatro cavidades podemos observar el movimiento paradójico del tabique. En la modalidad Doppler podemos observar aumento del flujo tricuspídeo (aproximadamente de un 25%) y disminución del mitral (también un 25%) en inspiración. Entre los posibles signos aportados por el eco-doppler, el más útil para el diagnóstico de taponamiento es precisamente el que acabamos de comentar; la disminución/aumento exagerada de los flujos mitral y tricuspídeo. Tanto las venas suprahepáticas como la vena cava inferior aparecen dilatadas y sin colapso inspiratorio 10 y pueden presentar flujo diastólico disminuido o reverso en espiración No confundir con el corazón quieto en la fluoroscopia. Como se explicó, no vemos al corazón por moverse por las densidades radiológicas, pero el corazón se mueve dentro del pericardio, y en mayor medida conforme mayor es el derrame (el corazón flota en el pericardio). 10 Las venas aparecen dilatadas porque la PVC está aumentada. Además, por esta misma razón, no se colapsan en inspiración; recordemos que en inspiración aumenta la presión intraabdominal y, por ello, se pueden colapsar las venas que discurren por la cavidad abdominal. 11 Por qué? Al espirar aumenta la presión en la caja torácica y la sangre venosa encuentra mayor impedimento para avanzar e, incluso, puede llegar a retroceder. J. A., P. F., M.C. Soria 12
361 TEMA PER-2 CARDIOLOGÍA CMG Esquema PER2 17 D. CATETERISMO CARDIACO Es una prueba invasiva, que no se suele usar normalmente, aunque dé el diagnóstico de certeza. Si lo hiciésemos revelaría un aumento de la presión de la aurícula derecha con la morfología típica descrita anteriormente; además, el comportamiento de las presiones de la aurícula derecha, el ventrículo derecho (sólo en diástole) y de la presión intrapericárdica sería paralelo. En casos muy severos se pueden llegar a igualar las presiones derechas e izquierdas. Por último, también nos sirve para demostrar la existencia del pulso paradójico. TRATAMIENTO TRATAMIENTO MÉDICO Es importantísimo no cometer el error de dar diuréticos, al confundir el cuadro con una ICC, pues descenderíamos tanto la presión venosa sanguínea que el llenado cardiaco sería nulo. Precisamente debemos expandir la volemia, utilizando fármacos expansores de volumen, para aumentar la presión venosa y que el llenado cardiaco sea suficiente. También es importante mantener la frecuencia cardiaca por encima del nivel de bradicar- J. A., P. F., M.C. Soria 13
362 TEMA PER-2 CARDIOLOGÍA CMG dia 12 ; en cuyo caso administraremos isoproterenol (beta-agonista) para conseguir una frecuencia de lpm. Por otro lado, debemos evitar la anticoagulación por riesgo de sangrado pericárdico. TRATAMIENTO QUIRÚRGICO El objetivo será aliviar la presión intrapericárdica mediante el vaciamiento de líquido acumulado. Lo más normal es hacer una pericardiocentesis o poner un drenaje quirúrgico subxifoideo, pero también pueden estar indicados el dejar una ventana pericárdica 13 (particularmente cuando ha habido más de dos recidivas y no podemos actuar sobre la causa, como en el derrame crónico severo sin compresión) o realizar una pericardioectomía (a menudo se realiza tras taponamiento por hemopericardio). La pericardiocentesis se puede realizar con control electrocardiográfico: se conecta la derivación V1-V2 a la aguja con la que se hace la punción y se pincha por debajo del apéndice xifoides. Se va avanzando poco a poco hasta el pericardio, para no herir el miocardio podemos usar el electrocardiograma (si tocamos el epicardio la aguja registrara una onda de lesión 14 ). También se puede realizar pericardiocentesis con control ecográfico (vía subxifoidea o apical) y con control radiológico. 12 La diástole larga no es efectiva ya que el llenado ventricular se produce fundamentalmente en el último tercio, con la contracción auricular. 13 Consiste en realizar una apertura lo suficientemente grande para permitir drenar el líquido coleccionado a pleura y evitar que se continúe almacenando alrededor del corazón, drenando siempre a través de dicha ventana, además de tener la opción de obtener muestras significativas de tejido para determinar el diagnóstico o causa de dichas alteraciones. 14 En el momento en que llegamos a epicardio asciende el segmento ST, por lo que sabemos que hemos pasado la cavidad pericárdica. Desde este punto sólo tenemos que retroceder un poco para volver a la cavidad y poder drenar el líquido acumulado. J. A., P. F., M.C. Soria 14
363 TEMA PER-2 CARDIOLOGÍA CMG J. A., P. F., M.C. Soria 15
364
365 TEMA PER-3 CARDIOLOGÍA CMG PATOLOGÍA PERICÁRDICA IV. PERICARDITIS CONSTRICTIVA CONCEPTO Y ETIOLOGÍA Se denomina pericarditis constrictiva (PC) al aumento de rigidez del pericardio con deterioro del llenado diastólico y posible compromiso de estructuras vecinas. Normalmente se origina por la cronificación de procesos inflamatorios (pericarditis aguda), aunque, como veremos más adelante, existen otras etiologías. Tras ese proceso pericárdico inicial, aparece más o menos tardíamente la sintomatología (que termina por ser seriamente invalidante). En la evolución de la enfermedad se distinguen tres fases: ESQUEMA PER3 1 Fase aguda: los fenómenos inflamatorios producen depósitos de fibrina y efusión pericárdica (derrame pericárdico). Esta fase sería equivalente a una pericarditis aguda. Fase subaguda: se produce la reabsorción del derrame. Fase crónica: se produce fibrosis, engrosamiento y cicatrización del pericardio, apareciendo adherencias y/o fusión entre sus hojas. Posteriormente se produce la calcificación de determinadas áreas (calcificación selectiva), pero en ocasiones se puede producir la calcificación de todo el pericardio (calcificación homogénea). IMAGEN PER3 1 La principal etiología ya ha sido comentada; la cronificación de un proceso inflamatorio. Las dos siguientes etiologías más importantes, ambas iatrogénicas, son la irradiación y tras la cirugía. J. A., P. F., M.C. Soria 1
366 TEMA PER-3 CARDIOLOGÍA CMG FISIOPATOLOGÍA Y CLÍNICA El pericardio fibrocalcificado es inextensible y sólo permite un tercio de la expansión diastólica 1. Por tanto, el volumen del corazón será constante a lo largo del segundo y tercer tercio diastólico, es decir, se habrá detenido el llenado diastólico. En el momento en que el corazón choca con el pericardio (al finalizar el primer tercio) se ausculta un knock o chasquido pericárdico brusco. ESQUEMA PER3 2 Podemos ver como el llenado ventricular es más rápido en PC. Ello se debe a la elevada presión auricular, pues ese volumen que no llena el ventrículo queda en la aurícula y se suma al retorno venoso. Por su morfología, esta curva se conoce como dip-plateau (colapso-meseta) o curva en raíz cuadrada ( ). Esta curva NO ES PATOGNOMÓNICA DE PERICARDITIS CONSTRICTIVA pues la podemos encontrar también en un ventrículo izquierdo poco distensible o en cardiopatías restrictivas. La morfología de la curva de presión venosa cambia con respecto a la que vimos en el taponamiento cardiaco (seno x predominante). En la pericarditis constrictiva el seno y es el predominante. Por qué no desciende la presión auricular tras la contracción auricular (seno x)? Porque la aurícula nunca llega a vaciarse; el llenado está frenado a partir del 2º tercio diastólico y la contracción auricular es telediastólica. Por qué desciende la presión auricular rápidamente tras la contracción ventricular (seno y)? Tras la contracción ventricular se inicia la relajación, y es este el único momento en el que pasa sangre desde la aurícula al ventrículo. Por ello, la caída es tan pronunciada. La siguiente tabla muestra la evolución del volumen ventricular durante el ciclo cardiaco. N es la curva que dibujaría un corazón normal y PC es la que dibujaría un corazón con pericarditis constrictiva. En ambas curvas, el aumento final de volumen se debe a la contracción auricular. ESQUEMA PER3 4 ESQUEMA PER3 3 1 Esto es, si el tamaño telesistólico del corazón es de 100 y el telediastólico es de 200; con el pericárdico rígido solo puede aumentar hasta 133. Otro efecto de esta rigidez es que no existe transmisión de la presión negativa intratorácica al interior del saco pericárdico, por lo que no se produce el efecto de succión de sangre venosa hacia la aurícula. Por tanto, la presión venosa aumentada (ingurgitación yugular) no desciende en inspiración. Además, como ese retorno venoso (atraído en la inspiración) no llega a entrar en el corazón (a no ser que coincida con el primer tercio diastólico) se produce una elevación de la presión venosa durante J. A., P. F., M.C. Soria 2
367 TEMA PER-3 CARDIOLOGÍA CMG la inspiración; es el llamado pulso paradójico venoso de Kussmault 2 (PATOGNÓMONICO DE PERICARDITIS CONSTRICTIVA). DIAGNÓSTICO Se realiza, sobre todo, por la clínica, por ecocardiografía y por TAC/RNM. ESQUEMA PER3 5 ESQUEMA PER3 6 CLÍNICA Además de los comentados (chasquido pericárdico protodiastólico, seno y predominante y Kussmault venoso), también se producen síntomas y signos de insuficiencia cardiaca (IC). Las primeras manifestaciones son de IC derecha (aumento de PVC): ingurgitación yugular, distensión abdominal por ascitis, dolor en hipocondrio derecho por hepatomegalia, edemas en MMII (Es mucho menos intenso que en otras insuficiencias cardiacas derechas. Por ello, son más llamativas la ascitis y la hepatomegalia) Posteriormente, pueden (no siempre) aparecer signos retrógrados de IC izquierda (aumento de PVCP): disnea, ortopnea, tos, y en casos severos signos anterógrada de IC izquierda (de bajo gasto): fatiga, hipotensión arterial, síncopes de esfuerzo, oliguria, insuficiencia prerrenal 2 El del derrame pericárdico era pulso paradójico ARTERIAL de Kussmault. Se les puede llamar Kussmault venoso o Kussmault arterial, respectivamente. A. DIAGNÓSTICO POR LA CLÍNICA Para el diagnóstico clínico (la clínica fue vista en el apartado anterior) se exigirán: antecedentes de pericarditis, signos de IC derecha y hepatomegalia y ascitis mucho más intensos que edemas. B. DX POR MÉTODOS COMPLEMENTA- RIOS Pruebas de laboratorio: no aportan datos específicos para el diagnóstico sindrómico y, raras veces, para el diagnóstico etiológico. Es importante recordar que estos enfermos tienen un intenso estasis venoso crónico, con la consiguiente disfunción hepática; las alteraciones bioquímicas hepáticas propias de ésta (hiperbilirrubinemia, hipoalbuminemia, enzimas elevadas ) pueden inducir a error diagnóstico al atribuirlas a enfermedad hepática primaria (p. ej., cirrosis hepática). Igualmente ocurre con la congestión intestinal (causa malabsorción que puede manifestarse como hipoproteinemia) y renal (la congestión renal puede manifestarse como proteinuria o albuminuria). J. A., P. F., M.C. Soria 3
368 TEMA PER-3 CARDIOLOGÍA CMG Radiología de tórax: siempre que se sospecha de pericarditis constrictiva suele pedirse una placa de tórax poco penetrada. De este modo apreciaremos mejor las calcificaciones que aparecen como líneas blancas y suelen predominar en las proyecciones laterales. En ocasiones también podemos observar derrame pleural derecho 3. puntos a la que estudiamos para el taponamiento cardiaco. Técnicas de imagen: el TAC, y sobre todo la RMN, son muy útiles. Gracias a ambas técnicas podemos estudiar el engrosamiento-calcificación del pericardio y la fibrosis-calcificación del epicardio. Este último dato es muy importante, dado que, si el epicardio está afectado, aunque retiremos el pericardio no solucionaremos el problema. IMAGEN PER3 2 Electrocardiograma: podemos observar un patrón de bajo voltaje (Suma de amplitud de R y S en derivaciones I, II y III menor de 15 mm), aplanamiento generalizado de ondas T, y, en un 50% de los casos, fibrilación auricular crónica. Ecocardiograma 4 : muestra signos de engrosamiento y calcificación del pericardio. Es frecuente observar dilatación biauricular (pero mucho menos intensa que en las miocardiopatías restrictivas) y movimientos paradójicos y vibraciones del tabique interventricular cuando la aurícula se contrae. También se puede apreciar dilatación y disminución de flujo en espiración de las venas suprahepáticas y cava inferior. En modo Doppler podemos observar la disminución del flujo mitral (25%) y aumento del tricuspídeo (25%) en inspiración. Como vemos, la exploración ecocardiográfica es similar en algunos IMAGEN PER3 3 Cateterismo cardiaco: aunque es una técnica muy útil, dada su naturaleza invasiva, sólo se reserva para casos en los que existe duda diagnóstica (son los llamados casos de constricción oculta ). Para realizarlo se inyectan unos 500 cc de suero salino y se estudian las diferentes presiones en situaciones de hipo-, normo- e hipervolemia. Con esta técnica podemos encontrar muchas alteraciones que nos orienten hacia el diagnóstico (muchas de las cuales coinciden con el taponamiento cardiaco; como, por ejemplo, la igualación de las presiones diastólicas ventriculares) pero vamos a destacar la presencia del dip-plateau en la onda de presión ventricular y del seno y predominante en la onda de presión venosa. 3 Esto es lo que aparecía en las diapositivas del Dr.Soria; sin embargo, en el Farreras pone que los derrames son principalmente bilaterales, y que en caso de ser unilaterales suelen serlo izquierdos. 4 En las diapositivas del Dr.Soria podéis encontrar más esquemas y dibujos sobre la ecocardiográfia de la pericarditis constrictiva que no se comentaron en clase. J. A., P. F., M.C. Soria 4
369 TEMA PER-3 CARDIOLOGÍA CMG ESQUEMA PER3 7 ESQUEMA PER3 8 J. A., P. F., M.C. Soria 5
370 TEMA PER-3 CARDIOLOGÍA CMG TRATAMIENTO A. TRATAMIENTO MÉDICO Puede ser muy útil en las fases iniciales de la enfermedad. Trataremos de disminuir la presión venosa sistémica con diuréticos y con restricción del consumo de sal. Es necesario tener en cuenta varias premisas a la hora de tratar a estos pacientes. No es deseable la reducción excesiva de la presión venosa ni de la presión de llenado ventricular izquierdo, ya que ello daría lugar a una reducción del gasto cardiaco con disminución de la tensión arterial. Por ello, el uso de diuréticos, aunque contribuya a mejorar la sintomatología congestiva sistémica y pulmonar, debe ser cauteloso, procurando mantener una presión de llenado ventricular relativamente elevada. El tratamiento habitual de la insuficiencia cardiaca (por ejemplo, el empleo de vasodilatadores como los IECAs) no es adecuado. Sólo en casos de fibrilación auricular están recomendados los digitálicos (digoxina). Por otro lado, una taquicardia moderada puede ser beneficiosa al contribuir al mantenimiento del gasto cardiaco. nes importantes, afectación del pericardio visceral o epicarditis concomitante. La mortalidad se sitúa entre el 7 y el 14% y la recuperación completa en el 50% (en aquellos casos en los que no se produce la recuperación completa, se debe a que se ha visto afectado el epicardio). ESQUEMA PER3 9 B. TRATAMIENTO QUIRÚRGICO Se debe realizar siempre que fracase el tratamiento médico o en aquellos casos en los que el control por parte del mismo sea insuficiente dado que una pericarditis constrictiva leve, dejada a su libre evolución, produce un deterioro biológico y aumenta la mortalidad quirúrgica. Se describen dos técnicas en función del uso de circulación extracorpórea (CEC): a) Pericardioectomía sin CEC: es la más utilizada pero con ella sólo se puede resecar el pericardio anterior (la exéresis sólo se puede realizar con esta técnica de frénico a frénico 5 ); y b) Pericardioectomía con CEC: se emplea cuando es necesaria una resección exhaustiva como es el caso de presencia de calcificacio- 5 Aquí vendría eso de y tiro porqué me toca J. A., P. F., M.C. Soria 6
371 SD. AÓRTICO AGUDO
372 TEMA SAA-1 CARDIOLOGÍA CMG Sd AÓRTICO AGUDO INTRODUCCIÓN En este tema vamos a estudiar el Síndrome Aórtico Agudo, el cual no es una entidad como tal, sino que está compuesto por tres patologías que pueden presentar el mismo cuadro clínico. El síndrome aórtico agudo (SAA) no es más que un proceso agudo de la pared aórtica que afecta a la capa media e incluye la disección aórtica, el hematoma intramural y la úlcera penetrante. Este hecho condiciona un riesgo de rotura elevado con una alta morbimortalidad asociada. A continuación vamos a definir estas tres patologías, para después estudiar la etiopatogenia, el cuadro clínico, diagnóstico, pronóstico y tratamiento del SAA. Disección Aórtica Esta es la patología aórtica aguda más importante, siendo un error frecuente asociar SAA con disección aórtica exclusivamente. Se define como la rotura de la íntima circunferencialmente o, con menor frecuencia, transversalmente, exponiendo una capa media enferma al flujo pulsátil intraluminal. Dicho flujo pulsátil va diseccionando la aorta 1 a lo largo de sus fibras elásticas y va creando una falsa luz, de modo que, conforme pasa la sangre, se va abriendo poco a poco. Se crea por tanto, un nuevo canal por donde pasa el flujo sanguíneo. La disección suele propagarse en sentido distal hacia la aorta descen- dente y sus ramas principales, pero también puede hacerlo en sentido proximal. Dicho de otra manera, la disección aórtica no es más que un desgarro de la capa íntima (que actúa como puerta de entrada de la sangre), quedando separada de la capa media y formándose dos luces (luz falsa y luz verdadera). Como consecuencia de este proceso, el nuevo canal comprime a la luz verdadera, de modo que los vasos que nacen de la aorta no presentan flujo 2, lo que compromete el riego de la zona vascularizada por dichas arterias. Por lo general, es una patología muy poco frecuente, con una elevada mortalidad precoz, que va aumentando un 1% cada hora que se retrase el diagnóstico y tratamiento. Supone el 85% de los casos de SAA. Como veremos más adelante, la disección se localiza más frecuentemente en la Aorta Ascendente (AA), a nivel de la pared lateral derecha de la aorta 3 ; ó en la Aorta Descendente (AD), debajo del ligamento arterioso. Imagen SAA Con cada sístole, el flujo de sangre rasga, cual bisturí, la capa íntima de la arteria, y va haciendo cada vez más grande la rotura. 2 Recordad que de la aorta salen los principales troncos arteriales y arterias del organismo. 3 Al ser aquí donde hay una mayor fricción hidráulica. J. A., M.J.S., C.C. Valdés 2
373 TEMA SAA-1 CARDIOLOGÍA CMG Hematoma Intramural En este caso se produce un hematoma a nivel de la capa media de la aorta por rotura de vasa vasorum 4. En este caso no hay puerta de entrada de la sangre, pues no hay disección de la íntima. Su incidencia es del 13%. Imagen SAA - 3 CLASIFICACIÓN DEL SAA Úlcera Penetrante La úlcera penetrante aórtica es aquella placa aterosclerótica que, tras una erosión y ulceración inicial, rompe la lámina elástica interna y penetra en la capa media. En esta última patología se rompe (o disecciona) la íntima, lo que supone la entrada de sangre a la media, que distiende (ó levanta) la pared arterial, la cual puede romperse y provocar la salida de sangre al exterior. Su incidencia es del 5%. 4 Vasa vasorum: son vasos localizados en la adventicia, cuya función es proveer de alimentos a los tejidos más externos de estas paredes, ya que su gran espesor impide la difusión de sustancias. Las clasificaciones más aceptadas del SAA son la clasificación de DeBakey y la clasificación de Standford. La clasificación de DeBakey distingue tres tipos de SAA, según afecte la patología a toda la longitud de la aorta (tipo I), a la aorta proximal (tipo II), o a la aorta distal (tipo III). Nos vamos a basar en la clasificación descriptiva de Standford, donde se distinguen dos tipos de SAA: un Tipo A ó proximal, y un Tipo B ó Distal. Tipo A ó Proximal: la lesión se localiza en la Aorta ascendente o en el cayado aórtico (proximal a la arteria subclavia izquierda). Engloba a los tipos I y II de la clasificación de DeBakey. En el tipo I la disección aórtica se inicia en la Aorta ascendente (AA) y se extiende hasta la Aorta descendente; en el tipo II el desgarro se limita a la proximal ó ascendente. Tipo B ó Distal: corresponde al tipo III de DeBakey, donde la disección se produce tras la salida de los grandes troncos arteriales (es decir, en la aorta descendente) y por tanto, distal a la arteria subclavia izquierda. J. A., M.J.S., C.C. Valdés 3
374 TEMA SAA-1 CARDIOLOGÍA CMG En resumen, la clasificación de Standford consta de Tipo A, donde la disección se inicia en la Aorta ascendente, y Tipo B donde se produce en la Aorta descendente. Por otra parte, DeBakey establece tres tipos, el I en el cual la disección comienza en la AA y se extiende hasta la AD, el II quedando limitada la disección a la AA, y el III donde el desgarro ocurre en la AD. Esta clasificación tiene implicación pronóstica y terapeútica: el SAA tipo A tiene un peor pronóstico 5 y su tratamiento es quirúrgico de inicio; el SAA tipo B tiene mejor pronóstico y el manejo inicial es médico. En cuanto a la frecuencia de aparición, en la AA se da el 65% de las disecciones aórticas, en la AD se produce el 20%, en el cayado ocurre el 10%, y finalmente, en la aorta abdominal se da el 5% restante. 6 Tipo 1 (DeBAKEY) Tipo 2 (DeBAKEY) Tipo 3 (DeBAKEY) ETIOPATOGENIA El sustrato de base de estas patologías es la presencia de una degeneración de la capa media, con deterioro de las fibras colágenas y elásticas, y la existencia de una necrosis medioquística (que como ya sabemos, es común a muchas enfermedades hereditarias que afectan a la capa elástica y muscular de la aorta, como el Síndrome de Marfan 7 ). Además, sobre este sustrato de base pueden actuar diferentes factores de riesgo, que detallamos a continuación: Edad avanzada (60-70 años), y el sexo (es dos veces más frecuente en el hombre que en la mujer (2:1)) La HTA (80%) 8 Presencia de una válvula aórtica bicuspídea (en un 7-14% de los casos) Embarazo (aparece en un 50% de mujeres embarazadas < 40 años, en el 3º trimestre, que poseen dicho sustrato de base). Tipo A o Proximal Tipo B o Distal (Standford) (Standford) Esquema SAA - 1 Trauma (accidente), tanto por causa iatrogénica (por ejemplo durante la realización de un cateterismo donde se disecciona la aorta) o en una intervención quirúrgica. Otros factores menos importantes son: válvula aórtica unicuspídea (esta estenosis es típica del RN), Coar, Noonan 9, arteritis y cocaína. 5 Lógico, pues en el tipo A se ha afectado la aorta ascendente y consecuentemente los grandes troncos arteriales que nacen de ella, que, recordemos, son el tronco braquiocefálico (de donde nace la carótida primitiva derecha y la subclavia derecha), arteria carótida común izquierda y la arteria subclavia izquierda. 6 Hay que precisar, que en la disección aórtica nos estamos refiriendo casi exclusivamente a la Aorta Torácica, que es donde se dan la mayoría de estos episodios; al contrario de lo que ocurría con los aneurismas que eran mucho más frecuentes en la Aorta abdominal. 7 Los pacientes con Síndrome de Marfan presentan frecuentemente valvulopatías como la Insuficiencia Aórtica. Además, la Disección aórtica es la principal causa de morbilidad y mortalidad en estos pacientes. (Harrison). 8 La HTA es uno de los factores que predisponen a la disección aórtica, de hecho coexiste en el 70% de los pacientes con Disección Aórtica. (Harrison). 9 Es un trastorno genético que causa desarrollo anormal de múltiples partes del cuerpo. Se le solía llamar síndrome similar a Turner, debido a que ciertos síntomas, como membranas en el cuello y tórax con forma anormal, se asemejan a los que se observan en el síndrome de Turner. J. A., M.J.S., C.C. Valdés 4
375 TEMA SAA-1 CARDIOLOGÍA CMG CUADRO CLÍNICO SÍNTOMAS: El síntoma fundamental es el DOLOR 10. Éste aparece en el 74-90% de los casos, y se define como un dolor de inicio brusco, con máxima intensidad inicial 11, de carácter desgarrante (asemejándose a un clavo), que se irradia en el sentido de la disección (en un 70% de los casos). Dicho dolor puede asociarse con diaforesis. Su localización es muy importante, pues tiene cierto carácter diagnóstico, ya que nos orienta sobre la localización de la disección: Cuando el dolor es sólo anterior, en un 90% de los casos estamos ante una disección de la AA. A veces se irradia hacia el cuello, garganta, mandíbula y cara, lo que es sugestivo de esta misma localización. Cuando es sólo interescapular, en un 90% de los casos la disección es de AD. Aquí puede irradiarse hacia la espalda, abdomen ó EEII. Otros síntomas menos frecuentes serían la ICC secundaria a IA aguda, el síncope (en un 4-5%, siendo indicativo de mal pronóstico), accidente vascular encefálico (AVE), paro cardiaco, neuropatía periférica isquémica, paraplejía, o incluso muerte súbita. SIGNOS: En la disección aórtica hay más signos que en el IAM, donde la clínica era totalmente inespecífica y con pocos signos. Éstos son: HTA: aparece en el 80-90% de los pacientes con disección distal. Hipotensión arterial: es más frecuente en disecciones proximales, debido a que la sangre pasa a luz falsa, quedando muy poco flujo en la luz verdadera. Déficit de pulso (aunque frecuentemente hay ausencia del mismo): se da en un 50% de las disecciones proximales. Soplo de insuficiencia aórtica: aparece en el 16-67% de las disecciones proximales. En ocasiones, el paciente presenta una IAo previa (por lo que ya tenía el soplo de antes), pero si se acompaña de una IC se debe pensar en una posible disección aórtica. La IAo se produce por el desgarro circunferencial, que ensancharía la raíz de la aorta, ó por la rotura del anillo valvular. Signos neurológicos: se manifiestan en un 6-19% de las disecciones proximales. Así, pueden haber ACV si se afecta el tronco cerebral (aparece en un 3-6% de los pacientes con afectación de dicho tronco) y daño espinal, que es más frecuente en las disecciones distales. Por obstrucción de la a. carótida el paciente puede tener hemiplejía y/o hemianastesia, y por la isquemia medular, paraplejía. Otros menos frecuentes son: IAM Inferior 12. Extensión al abdomen: afectación renal 5-8%; isquemia mesentérica 3-5%. Déficit de pulso femoral 12% Derrame pleural Izquierdo; disfonía, obstrucción vía aérea. Hemoptisis, hematemesis, SVCS, Síndrome de Horner Hay que hacer diagnóstico diferencial con el IAM y el embolismo pulmonar, que, si recordamos, junto a la disección aórtica eran las patologías más graves que cursan con dolor torácico y requieren una intervención urgente. 11 IMPORTANTISIMO: esta característica es la que nos diferencia la disección aórtica, de un posible IAM, pues en este último el dolor va aumentando progresivamente y no tiene intensidad máxima inicial. 12 Porque las disecciones suelen darse en el lado derecho, afectándose la a. coronaria derecha, que es la que causa este IAM. 13 El síndrome de Claude-Bernard-Horner, bien conocido por nosotros, es causado por la interrupción del simpático. Este nervio pasa cerca de la a.carótida, por lo que la afectación de dicha arteria es la que explicaría la asociación de este Sd. a la disección aórtica. J. A., M.J.S., C.C. Valdés 5
376 TEMA SAA-1 CARDIOLOGÍA CMG TC CUADRO DIAGNÓSTICO Ante un paciente con mal estado general y del que sospechamos una disección aórtica, las exploraciones complementarias que podemos solicitar son: Permite distinguir perfectamente la luz verdadera de la falsa, pues al inyectar contraste se teñirá la luz verdadera. RADIOLOGÍA DE TÓRAX Signos no específicos y rara vez diagnósticos. Se observa ensanchamiento mediastínico en un 81-90% de los casos. También puede verse el denominado Signo del calcio (separación mayor de 1 cm entre la íntima calcificada y la adventicia. Este signo es sugestivo, aunque no diagnóstico de la misma). Se visualiza con frecuencia derrame pleural izquierdo. La placa de tórax es normal hasta en un 12% de los pacientes. RMN Imagen SAA - 5 Ventajas similares al TC, pero tiene como desventaja que tarda más tiempo en realizarse, y la rapidez en los síndromes aórticos agudos es esencial. Por ello, no se suele usar tanto como el TC. ECOCARDIOGRAFÍA TRANSESOFÁGICA Puede asociarse a un Doppler y distinguir entre la luz verdadera y la falsa. Se ve peor que el TC, pero no irradia al paciente y es también rápida. AORTOGRAFÍA Imagen SAA - 4 Esta es una técnica invasiva, donde pueden observarse dos luces en la Aorta, la verdadera y la falsa. También permite visualizar la extensión de la disección, la puerta de entrada, el colgajo de la íntima, etc. De entrada, y siempre que sea posible, se emplean dos exploraciones: la Eco Transesofágica y el TAC (es mucho más rápido que la RMN y la calidad de las imágenes es semejante). La disponibilidad de la Ecocardio Transesofágica es escasa, mientras que la mayoría de hospitales disponen de un TAC, por ello se tiende a usar más el TAC. Sin embargo, cada una nos va a aportar información diferente. En efecto, con la Ecocardio podremos ver si el paciente presenta IC, derrame pericárdico mientras que el TAC permite ver el estado de las coronarias (para descartar IAM), la aorta, la función cardiaca, la existencia de áreas patológicas, además de ser mucho menos molesto La Ecocardio Transesofágica consiste básicamente en meterle al pobre paciente un tubo por la boca, cosa que le hace poca J. A., M.J.S., C.C. Valdés 6
377 TEMA SAA-1 CARDIOLOGÍA CMG Podemos decir que la ECO es mucho más específica (del problema en cuestión) como técnica que el TC. Lo ESENCIAL, es decir, lo que hay que visualizar con estas pruebas es el Colgajo, (la parte de íntima despegada, que separa la luz verdadera de la falsa), y la extensión de la disección, el estado de la válvula aórtica, etc. PATRONES DIAGNÓSTICOS Qué diferencias vamos a apreciar en las diferentes patologías causantes de SAA desde el punto de vista diagnóstico? Pondremos como ejemplo el más usado, el TC. Imagen SAA Disección aórtica. Apreciamos el colgajo, que separa netamente las dos luces de la aorta. 3. Úlcera penetrante. Con esta patología seremos capaces de ver un abombamiento en la aorta, lleno de sangre, con una puerta de entrada detectable. 2. Hematoma intramural. En este caso no vemos el colgajo, pero sí podemos distinguir que se ha creado un ensanchamiento de la pared de la aorta, relleno de sangre no circulante, que se aprecia de un color más oscuro en el TC. gracia cuando soporta un dolor tan intenso como el de una disección. J. A., M.J.S., C.C. Valdés 7
378 TEMA SAA-1 CARDIOLOGÍA CMG Como curiosidad, comentaremos que es posible que se fusionen ambos comportamientos diagnósticos, y nos podemos encontrar, por ejemplo, con disecciones aórticas que tengan un componente de hematoma intramural, como en la imagen: 1. TRATAMIENTO GENERAL - Hay que iniciar el tratamiento inmediatamente con la administración de Betabloqueantes 15, nitroprusiato 16 y otros hipotensores. El objetivo es bajar la TA, es suficiente con una PAS de 120/ En las disecciones tipo A la corrección ha de ser urgente, pues la mortalidad es del 20%. - En las tipo B es mejor estabilizar médicamente al paciente (no hay riesgo de IAM ni de valvulopatías, al no afectar a la AA). El tratamiento médico tiene una mortalidad del 15-20%, aún mayor en el tratamiento quirúgico - La supervivencia a los 10 años es del 60%. PRONÓSTICO Imagen SAA - 9 Mientras que el tratamiento del hematoma intramural ó de la úlcera penetrante se puede realizar más lentamente, en el caso de la disección aórtica el tratamiento es URGENTE. Los pacientes con un hematoma intramural son sometidos a seguimiento, pero no son intervenidos de manera inmediata. Por tanto, deducimos que el pronóstico en las dos primeras patologías es mucho mejor que el de la disección aórtica. 2. INDICACIÓN QUIRÚRGICA: - Todas las disecciones proximales (se afecta la AA y los grandes troncos arteriales, por tanto el pronóstico es mucho peor) - Disecciones distales, sólo si: La disección progresa comprometiendo a un órgano vital 17. Hay amenaza de ruptura 18. Hay insuficiencia aórtica masiva, que crea una IC intratable. La disección se extiende retrógradamente hacia la AA. La disección se da por el Síndrome de Marfan 19. TRATAMIENTO El tratamiento depende de la patología ante la que nos encontremos. La más grave, como ya sabemos, es la disección aórtica. Explicaremos en primer lugar el tratamiento general, para después ver cuáles son las indicaciones de cirugía y de tratamiento médico. 15 Para bajar la TA y contractibilidad cardiaca, con el fin de disminuir la fuerza de desgarramiento. Si existen contraindicaciones (como el asma) no se da. 16 Para bajar la PAS. 17 Como ocurre en la isquemia mesentérica, que afecta al Intestino Delgado, afectación de la arteria renal, etc. 18 En este caso el paciente mostrará dolor persistente. 19 Por la alteración estructural que tiene la pared de la Aorta por esta enfermedad. J. A., M.J.S., C.C. Valdés 8
379 TEMA SAA-1 CARDIOLOGÍA CMG 3. INDICACIÓN DE TRAT. MÉDICO: - Disecciones distales no complicadas, es decir, ante hematoma normal y úlcera que parece estable. - Disecciones aisladas y estables del arco aórtico. - Disecciones crónicas estables no complicadas, de más de 2 semanas desde el inicio. - Úlcera penetrante que no rompe (si tiende a romper, se opera). J. A., M.J.S., C.C. Valdés 9
380
381 CARDIOPATÍA ISQUÉMICA
382 TEMA Car-1 CARDIOLOGÍA CMG CARDIOPATÍA ISQUÉMICA ARTERIOSCLEROSIS CARDIOPATÍA ISQUÉMICA Se entiende por síndrome isquémico o cardiopatía isquémica a la falta de oxígeno por perfusión insuficiente a las células musculares cardiacas, secundaria a un desequilibrio entre el aporte y la demanda de oxígeno que llevan las coronarias al miocardio. Vamos a empezar a estudiar este tema explicando la causa más frecuente de cardiopatía isquémica, la aterioesclerosis. I ARTERIOSCLEROSIS NTRODUCCIÓN La arteroesclerosis es la primera causa de muerte e incapacidad en el mundo desarrollado 1, por ser la causa fundamental de la Cardiopatía isquémica. Se trata de una enfermedad vascular sistémica y constituye la principal causa de trombosis y hemorragias vasculares. Cuando aparece, lo hace de manera difusa por todo el territorio vascular, aunque tiene localizaciones preferentes como son el corazón (mostrando predilección por la parte proximal de la arteria descendente anterior izquierda), el SNC (donde causa isquemia transitoria e ictus), el sistema vascular periférico (claudicación intermitente y gangrena), la aorta 1 Aunque en Preventiva digan que no, en Valdeslandia es que sí. descendente, el riñón (enfermedad aterotrombótica), etc. Se cree que la enfermedad se desarrolla de manera intermitente, no sólo en el espacio, sino también en el tiempo, extendiéndose la aterogénesis durante varios decenios. Se alternan, en la formación de la placa, periodos de inactividad con otros de rápida formación. Las manifestaciones clínicas de la enfermedad aparecen a partir de los 45 años, pero la enfermedad se inicia mucho antes, de hecho, se estima el inicio de la enfermedad entre los 10 y 20 años, momento en el cual es totalmente asintomática. Es a esta edad (10 20 años), cuando aparecen las primeras lesiones, que consisten en la Estría Grasa, la cual evoluciona hacia Estría Fibrosa (a los años), llegando posteriormente a desembocar en la lesión típica de la enfermedad, la placa ateromatosa. Todo esto puede conllevar el desarrollo de una lesión crónica hacia los 45 años, tal y como ocurre en el caso de la Angina de pecho estable (que es la que se asocia al esfuerzo) y/o en la claudicación intermitente. Este proceso también puede darse de forma brusca (aguda) en cuyo caso causa un IAM, accidente cerebrovascular o muerte súbita de origen cardiaco. Dado este comienzo tan precoz toman especial relevancia el conocer, corregir y evitar los numerosos factores de riesgo que llevan a la aparición de Ateroesclerosis. Se dice que la arteriosclerosis es una enfermedad de la íntima (la capa más interna de las tres que constituyen la pared arterial), aunque en realidad, participa la arteria en su J. A., C. C., M.J.S. Valdés 1
383 TEMA Car-1 CARDIOLOGÍA CMG totalidad, siendo demostrada, por ejemplo, la implicación de la célula muscular lisa (CML). Ésta pertenece a la capa media, pero la lesión induce su crecimiento y transporte a la capa íntima. L A ARTERIA NORMAL Es vital recordar la estructura normal de la pared arterial para comprender perfectamente el proceso. Como ya se ha dicho, está compuesta de tres capas: Se localiza entre la elástica interna y externa. Contiene células musculares lisas incluidas en una matriz extracelular rica en colágeno y elastina. Su disposición varía en las arterias elásticas (Aorta), donde las CML se disponen concéntricamente emparedadas entre bandas de elastina; y las arterias musculares, donde las CML se disponen de forma más laxa dentro de la matriz. ADVENTICIA Es una estructura colágena densa, con fibras elásticas, colágenas y muchos fibroblastos. Posee escasas CML y muchos vasos y nervios (vasa vasorum, vasa nervorum). C ÉLULAS IMPLICADAS EN LA AE CÉLULA ENDOTELIAL INTIMA FIGURA CA1-1 Es la capa más interna. Sus componentes principales son el endotelio, su membrana basal y la elástica interna. Es una capa delgada, tapizada por fuera por células endoteliales y por células musculares que se incluyen en la matriz extracelular. Bajo su membrana basal, la elástica interna constituye el borde de la íntima y la separa de la capa media. Aquí es donde se forma la placa arteroesclerótica. Podemos decir que se trata de una capa constituida por tejido conectivo con escasas células. MEDIA Cuando está en perfecto estado tiene una función protectora gracias a la gran cantidad de efectos que produce. Posee tres características muy importantes. Es anticoagulante (de modo que las plaquetas y hematíes no se pegan en las paredes de los vasos), es antiinflamatoria (los leucocitos y los monocitos tienden a no adherirse a estas células) y regula el tono vascular. Esto se consigue por la producción de sustancias vasodilatadoras, como las prostaciclinas y sobre todo NO, quizás el vasodilatador más importante en la regulación del flujo; y sustancias vasoconstrictoras, como las endotelitas y la angiotensina II. CÉLULA MUSCULAR LISA En los vasos sanos, se localiza en la capa media, donde se comporta como una célula funcional y no mitógena. Las sustancias liberadas por los monocitos y plaquetas fijadas a la pared vascular, activan a las CML, que adquieren la capacidad de proliferar. Las plaquetas (al liberar sus sustancias), la convierten en una célula inestable que atrae a más plaquetas y a leucocitos. Finalmente la CML pasa de la capa media a la íntima. J. A., C. C., M.J.S. Valdés 2
384 TEMA Car-1 CARDIOLOGÍA CMG MACRÓFAGOS Como bien sabemos, proceden de los monocitos circulantes en sangre. Liberan gran cantidad de sustancias quimioatrayentes, y cuando se cargan de lípidos se convierten en células espumosas, de gran importancia en el desarrollo de la enfermedad arteroesclerótica. PLAQUETAS Cuando se adhieren, se activa su gran cantidad de organelas internas. Inducen la fagocitosis y liberan fibrinógeno. LINFOCITOS T Se observan en todas las fases de la enfermedad. L A AE Debemos tener claro, antes de comenzar, que la lesión característica de la AE es la placa ateromatosa, y queda constituida por los siguientes elementos: Celulares: CML, macrófagos, linfocitos T. Matriz conectiva: compuesta por colágeno, fibras elásticas y proteoglicanos. Lipídicos: colesterol. Según la clasificación de Stary, las lesiones de esta enfermedad son de tres tipos. Éstos son la Estría Grasa (grados I y II), el engrosamiento difuso de la íntima (grado III) y la placa fibrosa o ateromatosa (grados IV y V), siendo esta última la lesión más importante. A continuación veremos cada una más detenidamente: ESTRÍA GRASA Su desarrollo puede diferenciarse en una serie de etapas: 1. FORMACIÓN DE LA ESTRÍA GRASA Se ha demostrado en estudios experimentales con animales y humanos, que ésta representa la lesión inicial de la enfermedad, observándose en niños y jóvenes. Su formación parece deberse a la acumulación localizada de lipoproteínas en ciertas regiones de la íntima. Este depósito se da por la combinación de múltiples factores, tales como el aumento de permeabilidad del endotelio 2 (que actuaría como una gotera, permitiendo el paso de las lipoproteínas), y alteraciones de la matriz extracelular (que facilita la adhesión en la pared arterial). Constituye una formación longitudinal, con cierto relieve. El proceso parece ser que se cronifica debido a que las lipoproteínas, una vez que atraviesan la íntima, se van a localizar en el espacio extracelular de la íntima y se van a asociar con moléculas de proteoglicanos de la matriz extracelular arterial. También se ha visto un desequilibrio en los componentes de la matriz extracelular en aquellas zonas donde se inicia la lesión. Aparece sobre todo en zonas donde el flujo es turbulento como ocurre justo antes de las ramificaciones arteriales, o en las curvaturas vasculares. RECLUTAMIENTO DE LEUCOCITOS Tras la acumulación de lípidos extracelulares, el segundo paso en la formación de la estría grasa es el reclutamiento de leucocitos, destacando sobre todo los monocitos y linfocitos. Una vez las lipoproteínas se encuentran estables en el espacio extracelular de la íntima, van a sufrir dos tipos de alteraciones 3, de las que destacamos la oxidación. Los LDL van a pasar a ser LDLox gracias a los proteoglicanos y glucosaminoglicanos del tejido conectivo existente. Estos LDLox, entre los que señalamos la lisofosfatidilcolina, pueden desencadenar una pequeña respuesta inflamatoria, que hará aparecer en la íntima a los monocitos y linfocitos T. 2 Como factores que debilitan el endotelio conocemos la hipercolesterolemia, el tabaquismo, la HTA o la DM. 3 la Oxidación de lipoproteínas y la Glucosilación no enzimática. J. A., C. C., M.J.S. Valdés 3
385 TEMA Car-1 CARDIOLOGÍA CMG Se cree que en el reclutamiento, también intervienen una serie de moléculas de adherencia o receptores que se expresan en la superficie de las células endoteliales. El número de estos receptores aumenta con la oxidación de las LDL, por lo que así se relacionan la acumulación lipídica con el reclutamiento leucocitario. Dentro de estos receptores, destacan la molécula de adherencia vascular 1 (VCAM- 1), la de adherencia intercelular (ICAM-1) y Selectina P. Concretamente, la lisofosfatidilcolina (resultado de la oxidación de LDL) aumenta la expresión de VCAM-1. Normalmente la VCAM-1 no se expresa en aquellas regiones con flujo laminar, de ahí que las zonas con AE sean zonas con flujo turbulento 4. Además, en estas zonas laminares, el endotelio produce NO, que, además de ser un potente vasodilatador, puede actuar como un autacoide antiinflamatorio, limitando también la expresión de VCAM-1. La expresión de estos receptores también se ve inducida por ciertas citocinas tales como TNF alfa e IL-1. Estas citocinas van a ser secretadas por los macrófagos y linfocitos, al ser estimuladas primeramente por las LDLox, y posteriormente entre sí. La función de esas citocinas es atraer a más leucocitos, estimular la proliferación de CML 5 y atraer plaquetas, además de estimular la creación de receptores. AMPLIACIÓN DE CONTENIDO DE INTERÉS. Se ha demostrado que en esta captación no interviene siempre el receptor de LDL (como podría pensarse, pues la LDL es una liporpoteina), ya que en pacientes con carencia congénita de estos receptores (como en la hipercolesterolemia familiar) aparecen estas células. Otra razón que lo justifica, es que el receptor LDL dimisnuye mucho su expresión en situaciones de hipercolesterolemia (pues el colesterol exógeno suprime la expresión del receptor de LDL). Los receptores que pueden mediar el proceso son los receptores depuradores o carroñeros que captan lipoproteínas modificadas, y los receptores de las LDL oxidasas que captan las betalipoproteinas de muy baja densidad. FIN DEL CONTENIDO AMPLIADO Los macrófagos cargados de lípidos pueden abandonar la pared arterial y cumplir una función limpiadora de lípidos de la arteria. Por tanto, la formación de un ateroma por el cúmulo de lípidos se da cuando los lípidos penetran en la pared arterial por medio de los fagocitos mononucleares y por otras vías en mayor cantidad de los que salen. El proceso de reclutamiento es el siguiente: una vez adheridos a la superficice de la célula endotelial (por medio de la interacción con un receptor del tipo VCAM-1), los monocitos y linfocitos penetran en la capa endotelial y se estabilizan en la íntima. FORMACIÓN DE CÉLULAS ESPUMOSAS Una vez dentro de la íntima, los monocitos se transforman en macrófagos, y comenzarán a fagocitar partículas lipoproteínicas mediante una endocitosis mediada por receptores. Pasarán a ser células espumosas cuando se carguen de lípidos. Figura CA1-2. Por último, decir, que los macrófagos cargados de lípidos pueden liberar citocinas y factores de crecimiento, que desencadenan los acontecimientos celulares que complican la lesión (estimulando, por ejemplo, la producción de células musculares lisas ) 4 Es esta una de las causas de que la arteriosclerosis se de en las bifurcaciones y curvaturas de las arterias. 5 Y su migración a la capa íntima de la arteria. J. A., C. C., M.J.S. Valdés 4
386 TEMA Car-1 CARDIOLOGÍA CMG PLACA FIBROSA O ATEROMATOSA Es la lesión más importante de la AE. Va a estar causada por la evolución de las estructuras pertenecientes a la estría grasa y el engrosamiento difuso de la íntima. - Las lesiones son de color blanco, elevadas y obstructivas (muy importante) - Suelen localizarse en la aorta abdominal y en las arterias coronarias. CRECIMIENTO Y REMODELAMIENTO La placa de ateroma crece, pero lo hace alejándose de la luz (crecimiento abluminal). A la vez que crece, se va remodelando, induciendo a los vasos afectados a aumentar su diámetro (fenómeno que se conoce como agrandamiento compensador ), y permitiendo así que la luz de estos no disminuya significativamente. La luz del vaso comienza a estrecharse tardíamente, se estima que a partir de que la placa cubra el 40% de la circunferencia de la elástica interna. Esto hay que tenerlo muy en cuenta, pues hay casos en los que una obstrucción avanzada (del 30%) no presenta ningún síntoma. Figura CA1-3 Las CML que proliferan en la íntima van a dedicarse a producir proteínas, perdiendo su capacidad contráctil. Las fibras colágenas y elásticas, y los proteoglicanos sintetizados van a incrementar la cantidad de tejido conectivo de la íntima. Debido a este aumento de células (CML, macrófagos y linfocitos) y tejido conjuntivo, se va a formar la cápsula fibrosa. Ésta rodea al cúmulo de lípidos y células espumosas, y constituye el límite de la placa, limitando por tanto su crecimiento. Llegado este punto, la cápsula puede romperse y provocar un proceso agudo, o bien puede seguir creciendo, poniendo de manifiesto un proceso crónico. Las características de la placa fibrosa o ateromatosa son: - Tiene crecimiento abluminal: no crecen hacia la luz arterial - Posee tres componentes, la cápsula fibrosa (que la envuelve), el centro lipídico (donde se almacena la grasa, por lo que veremos células espumosas) y células (como las CMLy células de la sangre entre las que se incluyen a los macrófagos, linfocitos T ). Lesion initiation No symptoms Figura CA1-4 + Symptoms AMPLIACIÓN DE CONTENIDO DE INTERÉS. Evolución y complicación del Ateroma. Se ha observado que no todas las estrías grasas conducen a ateroma, de hecho, la característica esencial de la estría grasa es el depósito de macrófagos cargados de lípidos, mientras que en la placa fibrosa es la acumulación de tejido fibroso, por tanto, si en la estría grasa no se almacena tejido fibroso no evolucionará a placa fibrosa. Las CML sintetizan la mayor parte de la matriz extracelular de la lesión arterioesclerótica. J. A., C. C., M.J.S. Valdés 5
387 TEMA Car-1 CARDIOLOGÍA CMG Las últimas investigaciones han puesto de manifiesto que los mecanismos que podrían favorecer la emigración y proliferación de CML en la lesión inicial, y desencadenar la acumulación de matriz extracelular, son las citocinas y algunos factores de crecimiento estimulados por lipoproteínas modificadas (que regulan las funciones de las CML). Por ejemplo, el PDGF (factor de crecimiento de origen plaquetario) sintetizado por células activas del endotelio, pueden estimular la emigración de las CML, lo que permitiría que las CML de la túnica media emigren a la íntima. EL TGF Beta (factor de crecimiento transformador) puede estimular la producción de colágeno intersticial por parte de las CML. Observamos, poco a poco, la evolución de la estría grasa a una lesión fibrosa donde hay más CML y matriz extracelular. FASES PATOGÉNICAS DE STARY Debemos detallar un poco más el proceso patogénico de esta enfermedad. Como hemos visto, todo comienza con un daño endotelial, el cual puede deberse a diversos causas. Así, puede darse por lípidos oxidados que se introducen en las células endoteliales, por la producción de radicales libres que oxidan al colesterol, por problemas en la TA, etc. En definitiva, dicha lesión va a provocar que monocitos, linfocitos T y plaquetas se adhieran a la pared arterial, penetrando en el interior de la misma. Aquí, liberan sustancias que estimulan la producción de más monocitos, plaquetas, linfocitos T, CML, las cuales proliferan y se van acumulando. Poco a poco, se produce la emigración de las CML que facilitan la formación de la placa fibrosa, la cual puede continuar creciendo o bien, revertirse con el tratamiento adecuado. Veamos pues fase a fase la patogenia de la arterioesclerosis: Fase I -II: En este estadío, los lípidos se van almacenando progresivamente. Esta fase es asintomática. Fase III: Supone el engrosamiento difuso de la íntima, y es una fase poco importante clínicamente. Figura CA1-5 El ateroma puede evolucionar y complicarse con la trombosis y coagulación de la sangre. Así, la estría grasa avanzada producen pequeñas fisuras endoteliales, apareciendo microtrombos ricos en plaquetas, por la exposición de la matriz (muy trombógena) de la membrana basal subyacente, a la sangre. También se ha observado que las placas de ateroma establecidas tienden a acumular calcio, y de hecho, en las placas de AE se han identificado proteinas especializadas en la unión al calcio como osteopontina, osteocalcina, etc. FIN DEL CONTENIDO AMPLIADO Fase IV - V: Una vez acumulada la grasa, el proceso da un giro, de tal manera, que la placa fibrosa se rompe y contacta directamente con la sangre. El contenido de la placa es procoagulante y proagregante, lo que, al contactar con la sangre, dará lugar a un trombo. Dependiendo del tamaño del trombo, las consecuencias serán mayores o menores. A Si el trombo no obstruye totalmente el vaso, sino que estrecha su luz, se produce una súbita hipoxia del miocardio afectado, desencadenándose un síndrome agudo, que es la angina inestable o un infarto no Q. Con el tiempo, progresará hacia un síndrome crónico, el cual podrá sufrir futuras roturas. Este J. A., C. C., M.J.S. Valdés 6
388 TEMA Car-1 CARDIOLOGÍA CMG síndrome crónico no es más que la Angina Estable. B En cambio, es posible que el fragmento sea de gran tamaño, de modo que el coágulo sea tal que obstruya el vaso súbitamente al 100%. Esto ocasiona, como es de suponer, un Síndrome Agudo (sin sintomatología previa en la mayoría de casos). La principal consecuencia de este síndrome, es la detención brusca del flujo coronario, lo que ocasiona un déficit de aporte de oxigeno, Angina inestable (que tiene una mortalidad del 5% en el primer año), IAM o infarto Q (cuya mortalidad es del 20% en ese momento) o incluso Muerte súbita. Los IAM se producen cuando no hay circulación colateral desarrollada (pues recordemos que el estímulo hipóxico de crisis isquémicas repetidas induce el desarrollo de circulación colateral). Si el paciente sobrevive a la obstrucción, el trombo formado se organizará, (concepto de AP). CONCEPTOS DE PLACA SIMPLE Y COMPLICADA, ESTABLE Y VULNE- RABLE No todos los ateromas muestran la misma tendencia a la rotura, y de hecho, las placas se clasifican en vulnerables y estables según su facilidad para romperse o no. Esta capacidad depende del contenido lipídico (la cantidad de lípidos) y del grosor de la capa fibrosa (la cantidad de tejido fibroso). A Placa Estable. Así, si tenemos una capa fibrosa densa y gruesa, ésta se romperá con más dificultad y si lo hace, ocasionará un síndrome crónico. Es, por tanto, una placa estable. Este tipo de placa dará sintomatología cuando la luz de la arteria se reduzca ostensiblemente, existiendo personas asintomáticas aún con tan sólo un 30% de la luz vascular normal libre. Estas placas crecen más lentamente que las inestables., y van a producir procesos crónicos (anginas estables o de esfuerzo). B Placa Inestable. Por el contrario, si la placa fibrosa (ó casquete) es delgada, con gran cantidad de grasa y de macrófagos, tenderá a romperse con facilidad, ocasionando cuadros agudos. Es una placa inestable. Suele tener un crecimiento más rápido que la estable. Al romperse, ocasinará trombos, que llevarán a procesos agudos, más peligrosos que los crónicos. Se ha observado que en la zona de rotura de la placa predominan macrófagos y Lt, con escasas CML. También, que las células localizadas en la zona de rotura poseen marcadores de inflamación, como el Ag HLA-DR, que no aparecen en células de arterias sanas. Estas zonas suelen ser la zona de transición entre el endotelio normal y la placa ateromatosa. Por otra parte, se pueden clasificar las placas en simples y complicadas. A Placa Simple. La placa fibrosa simple es aquella que obstruye el flujo, de forma crónica. La magnitud de los síntomas viene dada por la estenosis en la luz del vaso, y no por el tamaño de la cápsula. B Placa Complicada. La placa de tipo complicada va a producir la obstrucción aguda del flujo. Entre los responsables de la mayor o menor vulnerabilidad de la placa fibrosa se incluyen los mediadores de la inflamación. Así, la citosina IFN-gamma (derivada de los Lt, y que induce la expresión del Ag HLA-DR) inhibe el crecimiento y la síntesis de colágeno por la CML, resultando una placa fibrosa débil, que se rompe con relativa facilidad. RESUMEN CONCEPTUAL Por si acaso nos hemos liado con tanto término, conviene, una vez expuestos los conceptos en los que puede evolucionar una placa, verlos conjuntamente para aclararnos. La AE es la principal causa de Cardiopatía Isquémica. Dependiendo de que la placa fibrosa sea simple o complicada, las manifestaciones y síntomas de la enfermedad serán diferentes. Ante una placa estable, se va a ir produciendo un crecimiento progresivo de la placa, que obstruirá cada vez más la arteria coronaria J. A., C. C., M.J.S. Valdés 7
389 TEMA Car-1 CARDIOLOGÍA CMG en cuestión. Esto va a permitir un flujo coronario en reposo, pero ante un aumento de la demanda, el miocardio recibirá menos oxígeno del que necesita. Es un Síndrome Crónico, una Angina Estable. Ante una placa inestable, ésta tenderá a romperse. Se formará un trombo, que puede ocluir total o obstruir parcialmente a la arteria coronaria. Se ocasionará un Síndrome Coronario Agudo. MANIFESTACIÓN DE LA ROTURA EN EL ECG La rotura de la placa puede reflejarse en el ECG de dos maneras: ELEVACIÓN DEL SEGMENTO ST Indica que el vaso está obstruido, por lo que no hay aporte de oxígeno, con la consiguiente isquemia. Estamos ante un síndrome coronario agudo. Es preciso intervenir rápidamente. DESCENSO DEL SEGMENTO ST Aquí la placa fragmentada da lugar a un trombo, que permite el paso de la sangre. No hay obstrucción total, y tampoco isquemia. Es también un síndrome coronario agudo, pues ocurre de repente. Volviendo a la cardiopatía isquémica, hay que señalar que esta enfermedad es causada por la isquemia miocárdica, debido a la obstrucción del flujo por la AE. Sus manifestaciones pueden ser cronicas (que es la angina estable) o agudas (angina inestable, infarto). Este punto se tratará mas adelante. E TIOLOGÍA DE LA AE Concretamente, no se conoce una causa clara de la AE hasta el día de hoy. No obstante, sí tenemos evidencia de una serie de factores de riesgo cardiovasculares. Se podría decir que influyen directamente en las posibilidades que tiene un individuo de sufrir la clínica de un episodio arteriosclerótico. Se clasifican en: 1. Modificables y no modificables 2. Mayores y menores en función de la importancia que tengan en la producción de la AE Los no modificables son aquellos que no podemos evitar ni cambiar. Nos referimos a : la edad (a más edad, peor estado arterial), los factores genéticos (los antecedentes de cardiopatía en familiares de primer orden), el sexo (es posible que los estrógenos de la mujer la protejan hasta la menopausia) Los modificables son aquellos sobre los cuales podemos tomar el control, y cambiarlos. Por ejemplo: la obesidad, el tabaco, el sedentarismo... Sin duda alguna, los que mayor importancia tienen son los modificables mayores. Esto es debido a que son aquellos sobre los que podemos influir, y que además demuestran una amplia causalidad en la evolución de la AE. Los modificables mayores más importantes son: La diabetes mellitus. Es, sin duda, el más importante. Un diabético va a ver elevadas sus posibilidades de sufrir un episodio AE mucho más que un no diabético similar. Los niveles de LDL/HDL Los niveles de colesterol El tabaco La HTA Estos factores de riesgo alteran las funciones normales del endotelio vascular, que son: el control local del tono vascular, el mantenimiento de una superficie anticoagulante y la J. A., C. C., M.J.S. Valdés 8
390 TEMA Car-1 CARDIOLOGÍA CMG defensa contra las células inflamatorias. La pérdida de estas defensas conlleva una constricción inadecuada, formación de coágulos luminales e interacciones anormales con monocitos y plaquetas. Este último fenómeno conduce al desarrollo de placas ateroscleróticas, que producen una disminución de la sección transversal de los vasos, una estenosis. NIVELES DE COLESTEROL El colesterol total mide la cantidad de las diferentes partículas ricas en colesterol que circulan por el plasma, que son, entre otras, las HDL, las LDL, las VLDL, incluso los TAG (triacilgliceridos libres)... A causa de esto, el colesterol total tiene poco interés en este aspecto. Se deben analizar los niveles de HDL y LDL, los dos más importantes, pues, como veremos más adelante, el riesgo de sufrir los síntomas de la AE está en proporción a la cantidad de estas lipoproteínas en sangre. Centrándonos en los niveles de colesterol, podemos ver que una población cambia, con el tiempo, sus niveles de colesterol al migrar a un país determinado. Esto indica que este parámetro se encuentra influenciado por el ambiente. Analizando cada tipo de lipoproteínas, se ha comprobado que unos niveles de HDL bajos predisponen a enfermedad AE. Se ha establecido como factor de riesgo tener unos niveles inferiores a 55 mg/dl en la mujer, mientras que en el hombre se establece ese límite en los 45 mg/dl. Con los niveles de LDL funciona al revés que con los de HDL. Por ello, unos niveles bajos de LDL van a dar una menor probabilidad de sufrir un accidente AE, así como uno niveles altos de LDL van a aumentar el riesgo de sufrirlo. Cuanto más bajos sean los niveles de LDL, mejor. No obstante, cabe añadir que los niveles de LDL que se toman como moderadamente patológicos son, en la población sana, los que superan los 130 mg/dl TABACO Se ha comprobado que el tabaco tiene efectos perjudiciales para el flujo sanguíneo. Varios de sus componentes van a producir vasoconstricción, y van a limitar el flujo sanguíneo, pues dañan a la célula endotelial. Ya se han enumerado las características e importancia de las células endoteliales, y sabemos cómo su mal funcionamiento afecta al proceso AE. Con un solo cigarrillo ya dañamos algunas células endoteliales de nuestro cuerpo. El tabaco podría favorecer la trombosis o algún otro determinante de la estabilidad de la placa aterosclerótica, así como la evolución de la propia lesión aterosclerótica. Además en los fumadores se muestran altos niveles de fibrinógeno. No debemos olvidar que los fumadores pasivos sufren también de los perjuicios que los cigarros causan al sistema vascular. De cada tres cigarros que te fumas a mi lado, uno es mío también HTA Cuanto mayor sea el tiempo de evolución de la HTA mayor alteración se producirá. La localización de los efectos varía con la enfermedad. Se ha demostrado que el tratamiento de la HTA conlleva un descenso de los niveles de AE. DIABETES MELLITUS Es el factor de riesgo más importante. Acelera la aterogénesis. Provoca una alta mortalidad. Las dislipemias asociadas a la diabetes fomentan también la aterogénesis. La combinación de resistencia a la insuliuna elevación de los triglicéridos y disminución de las HDL, acompañada por lo general de obesidad central e hipertensión (tan común en diabéticos tipo II) parece acelerar el desarrollo de aterogénesis. La hiperglucemia favorece la glucosilación no enzimática de las LDL. Estas LDL modificadas, al igual que las LDL oxidadas, desencadenarían los episodios iniciales de la aterogénesis. Se puede correlacionar la cantidad de hidratos de carbono en sangre con el riesgo a sufrir un J. A., C. C., M.J.S. Valdés 9
391 TEMA Car-1 CARDIOLOGÍA CMG accidente cardiovascular por AE. A más glucosa en sangre, mayor riesgo. OTROS FR Se sabe que hay otros factores de riesgo que se encuentran ligados a una mayor incidencia del síndrome AE, de entre los cuales, los más científicamente probados son: Síndrome metabólico Inflamatorios: Fbng, PCR Obesidad Sedentarismo Otros son: Lipídicos: TAG, LpA (inhibe fibrinólisis por competición), VLDL Homocisteína (estimula la trombosis). Infecciosos: clamidia, citomegalovirus, HP, virus herpético Hematológicos Conducta y estrés Oxidantes Hormonales: estrógenos Alcohol Prevención primaria: tratar al paciente actuando sobre los factores de riesgo antes de sufrir la enfermedad aterosclerótica. Prevención secundaria: tratar al paciente actuando sobre los factores de riesgo cuando ya ha sufrido la enfermedad aterosclerótica. Es más agresiva. Suma de Factores de Riesgo CV: Efecto Multiplicativo del Riesgo Tabaco Hipertensión (TAS 195 mmhg) x3 X4.5 x9 x16 X1.6 x6 x4 Figura CA1-6. Colesterol (300 mg/dl) PESO DE LOS DISTINTOS FR El riesgo al que está expuesto un individuo es linealmente proporcional al grado de exposición a un determinado factor de riesgo. No todos los factores de riesgo tienen el mismo peso ante una determinada lesión. Sabemos que la HTA actúa sobre todo en los accidentes cerebrales, mientras que el tabaco tiene especial relevancia en los accidentes AE a nivel de las coronarias. Según diversos estudios, como el Framingham, se sabe que los efectos de sufrir varios factores de riesgo no siempre son sumatorios, sino que, en determinadas situaciones, pueden ser incluso mucho más que exponenciales. Para terminar, cabe destacar los tipos de prevención que podemos llevar a cabo: J. A., C. C., M.J.S. Valdés 10
392 TEMA Car-1 CARDIOLOGÍA CMG ANEXO En último lugar, hemos añadido un par de gráficas que puso Valdés en clase, y con las que se puede determinar el riesgo individual que una persona tiene de sufrir un accidente arterioscleroso, según los distintos FR que tenga el individuo Varones Riesgo de enfermedad coronaria mg/dl mmol/l No fumador mg/dl mmol/l CARDIOVASCULAR Fumador mg/dl mmol/l Mujeres Riesgo de enfermedad coronaria No fumadora mg/dl mmol/l Fumadora edad edad Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) edad edad mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol Varones con diabetes Riesgo de enfermedad coronaria mg/dl mmol/l No fumador mg/dl mmol/l Fumador mg/dl mmol/l Mujeres con diabetes Riesgo de enfermedad coronaria No fumadora mg/dl mmol/l Fumadora edad edad Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) Presión Arterial Sistólica (mmhg) edad 60 edad 50 edad Presión Arterial Sistólica (mmhg) edad edad mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol mmol/l mg/dl Colesterol J. A., C. C., M.J.S. Valdés 11
393 TUMORES CARDIACOS
394 TEMA TUM-1 CARDIOLOGÍA CMG TUMORES CARDIACOS INTRODUCCIÓN Comenzaremos señalando que la patología que nos ocupa tiene muy poca relevancia en la clínica diaria. Un profesional va a diagnosticar un tumor cardiaco sólo en un % de sus pacientes. Muchos de estos tumores van a ser difícilmente diagnosticables, lo que conlleva que en las necropsias se encuentren tumores cardiacos con mayor frecuencia, concretamente del 0,28%. El tumor que con más frecuencia va a encontrar el médico es el mixoma de Aurícula Izquierda. Por suerte, es curable. Atendiendo a su evolución, los tumores cardiacos se pueden dividir en dos grupos. 1 A. Benignos: Mixoma (30%), lipoma (10%), fibroelastoma papilar (9%), rabdomioma 2 (8%), hemangioma, teratoma, mesotelioma. Los cuatro primeros son los que aparecen con mayor frecuencia. B. Malignos: Angiosarcoma (9%), rabdomiosarcoma (6%), fibrosarcoma (3%). Si tratamos la incidencia de estos tumores en mayores de 16 años, encontramos que un 85% de los tumores cardiacos son benignos, mientras que sólo un 15% son malignos. La incidiencia varía sensiblemente con esta nueva consideración: A. Benignos (85%): 1) Mixoma (46,9%). Es el más frecuente 2) Lipoma (21,5%) 3) Fibroelastoma papilar (16,2%) 1 Entre paréntesis la incidencia clínica en la población general. 2 Los más frecuentes en niños B. Malignos (15%) 1) Sarcomas en general. CARACTERÍSTICAS GENERALES 3 Los tumores cardiacos primarios son mucho menos frecuentes que los metastáticos 4. Los tumores cardiacos primarios benignos son más frecuentes que los malignos 5. El tumor cardiaco más frecuente es el mixoma 6. Se diagnostican muchos en la actualidad 7. Se pueden curar con cirugía 8. El elemento fundamental en el diagnóstico es un alto índice de sospecha, por lo que las pruebas complementarias dirigidas son vitales ante hallazgos sugerentes que nos hagan sospechar. 9 3 Importantísisisisisisismo sabérselo. 4 Importante 5 Importante 6 Importante 7 Importante 8 Importante 9 Importante. No sé si entendéis la moraleja... EXAMEN J. A., P. F., M.C. Ruipérez 2
395 TEMA TUM-1 CARDIOLOGÍA CMG MIXOMA El 30-50% de los tumores cardiacos son mixomas. Los hay de dos tipos etiológicos: Aislados (idiopáticos). Constituyen la mayoría de los mixomas. Se dan casi siempre en la Aurícula Izquierda. El tratamiento quirúrgico es fácil y evita recidivas. Hereditarios o Familiares. Tienen características especiales. Cuando se eliminan, suelen recidivar en el mismo lugar de origen o en otras zonas. Este tumor suele diagnosticarse en pacientes que rondan los 50 años y es más frecuente en mujeres. La localización más habitual es la aurícula izquierda (86%). Estos tumores se suelen asociar a tumores mixomatosos en otros órganos (en un 57%), destacando las alteraciones neoplásicas endocrinas (30%). Debemos destacar la existencia del llamado Síndrome de Carney. Es una patología caracterizada por la existencia de mixomas en varias localizaciones además del corazón. La pigmentación de la piel es irregular y la actividad endocrina es excesiva. Tiende a aparecer en individuos más jóvenes, y la probabilidad de recurrencia del tumor es mayor que en los mixomas hereditarios únicos. Como dato curioso pero relevante, destacamos que las personas que sufren este síndrome son en un 68% pecosas. En el siguiente cuadro resumimos las características citadas. SINDROME DE CARNEY Mixomas en otros sitios Actividad endocrina excesiva (dismenorreas, alteraciones de la menstruación, manos sudorosas) Aparece en gente joven Tienen pecas (68%) Mayor probabilidad de recurrencia Pigmentación irregular MIXOMA IDIOPÁTICO Imagen TUM1-1 Es mucho más frecuente que el hereditario o familiar. PRESENTACIÓN CLÍNICA MIXOMA HEREDITARIO / FAMILIAR Es un tumor poco frecuente, ya que representa el 10% de los mixomas. La transmisión es de tipo autosómica dominante. Por ello, cuando se sospecha de este tumor siempre es obligatorio hacer una ECO, tanto al paciente como a sus familiares de primer grado. Es de destacar que en este tipo de mixoma, el riesgo de recidiva es del 20%. Presumiblemente, podemos encontrarnos con una serie de datos sistémicos inespecíficos: fiebre, caquexia, malestar general, artralgias, fenómeno de Raynaud 10, erupción cutánea, embolias sistémicas. 10 Se caracteriza por que los dedos de las manos se tornan de color blanco debido a la falta de flujo sanguíneo, luego azules debido al consumo de oxígeno y finalmente rojos a medida que el flujo sanguíneo retorna. J. A., P. F., M.C. Ruipérez 3
396 TEMA TUM-1 CARDIOLOGÍA CMG Siempre que se encuentre este cuadro deberemos realizar un diagnóstico diferencial con algunas infecciones o colagenopatías. DATOS DE LABORATORIO La gammaglobulina se encontrará aumentada, al igual que la velocidad de sedimentación, encontraremos leucocitosis, anemia, trombocitosis, trombocitopenia. FENÓMENOS EMBÓLICOS Es de suma importancia tener siempre en cuenta que los mixomas son tumores muy susceptibles a la rotura. Por ello van a dar embolias sistémicas múltiples. El 60% de los pacientes con mixoma va a presentar vasculitis sistémicas. DIAGNÓSTICO MEDIANTE EXPLORACIO- NES COMPLEMENTARIAS Siempre hay que mantener alto índice de sospecha. Fundamentalmente, las técnicas que nos ayudan al diagnóstico son la ECO y el RMN. ECO. Suele ser definitiva, pues permite apreciar muy bien la formación tumoral en la cavidad cardiaca pertinente (como sabemos, en la AI casi siempre). Con la ECO podremos apreciar que en sístole, el tumor se meterá en el ventrículo, asemejándose la imagen ecográfica a una estenosis mitral. Por el contrario, en diástole se quedará en la AI. Por ello, la ECO resulta la exploración más útil. MANIFESTACIONES CARDÍACAS Están relacionadas con la localización cardiaca del tumor más que con la histología del mismo. Por ejemplo, si invade el pericardio, va a ocasionar una sintomatología semejante a la de los tumores pericárdicos. O bien, si se encuentra en la AI, seguramente el tumor se introduzca por la válvula mitral (por lo que se auscultará un soplo de estenosis mitral), y, al acostar al paciente, el tumor se moverá y se saldrá de la válvula (y se dejará de oír el soplo). CASO CLÍNICO DE EJEMPLO Chica de 23 años. Debuta con fiebre sospechosa, acompañada de artralgias y dolores musculares. Sufre luego una embolia retiniana. En un principio se piensa como causante del cuadro una arteritis generalizada. Posteriormente se manifiesta un bloqueo auriculoventricular completo y un IAM, falleciendo la paciente al poco tiempo. En la autopsia se encuentra un mixoma con multitud de émbolos sistémicos. Imagen TUM1-2 RMN. En casos dudosos de ECO, la resonancia suele aclarar las dudas 11. ECG. No es útil, excepto en tumores que afecten al músculo miocárdico, ya que se apreciarán alteraciones en la conducción. Rx. Si el tumor no sobrepasa los límites de la cavidad, no lo apreciaremos. Biopsia. Puede ser útil, pero, ante un tumor que puede embolizar, la técnica 11 EXAMEN: Las 2 principales técnicas para el diagnóstico del mixoma son ECO y RNM. J. A., P. F., M.C. Ruipérez 4
397 TEMA TUM-1 CARDIOLOGÍA CMG podría ser peligrosa. Por ello NO se usa. Isótopos, tomografía, angiografía. Uso nulo. Cuando se presente un paciente que en auscultación tenga retumbos característicos de estenosis mitral, con ausencia de chasquido de apertura, y que van variando con los días o la posición, siempre habrá que sospechar de mixoma. Si comprimen alguna rama del fascículo de Hiss, ocasionarán un bloqueo de rama, o del nodo auriculoventricular. 4. Tumores Del Ventrículo Derecho. Si son muy avanzados, ocasionarán síntomas de insuficiencia cardiaca derecha. Tienen alto riesgo de embolias, y su sintomatología es progresiva. Clínica Por Localización TUMORES MIOCÁRDICOS 1. Tumores Cardiacos En Aurícula Izquierda. Van a obstruir el flujo aurícula-ventrículo izquierdo. Pueden dar dos tipos de clínica: Clínica de estenosis mitral Clínica de insuficiencia mitral Son muy poco frecuentes y raros. Provocan alteración de la función ventricular e infiltración miocárdica. En consecuencia, simulan miocardiopatías y producen trastornos de la conducción y del ritmo (angiomas y mesoteliomas). Con frecuencia pueden incluso llegar perforar la pared, produciendo roturas miocárdicas. Los síntomas serán de comienzo brusco, intermitentes y relacionados con la posición vertical. La auscultación dependerá del tipo de clínica que den (EM o IM). 2. Tumores De Aurícula Derecha Van a obstruir el flujo aurícula-ventrículo derecho. Dos tipos de clínica característica: clínica de estenosis tricuspídea clínica de insuficiencia tricuspídea 3. Tumores En Ventrículo Izquierdo Si obstruyen la cámara tracto de salida del VI van a dar un soplo sistólico. Si la obstrucción es completa, provocarán una pérdida de conocimiento, un síncope. Imagen TUM1-3 Si comprimen una arteria van a dar una angina. J. A., P. F., M.C. Ruipérez 5
398
399 TEMA VV-0 CARDIOLOGÍA CMG VALVULOPATÍAS INTRODUCCIÓN Entendemos por valvulopatías las alteraciones orgánicas y funcionales que afectan a las válvulas cardiacas. Funcionalmente pueden manifestarse como estenosis o insuficiencias valvulares, aunque no es infrecuente la asociación de estenosis e insuficiencia en lo que se denomina valvulopatía mixta o doble. Las valvulopatías pueden ser sintomáticas o asintomáticas, pueden darse en una situación clínica de compensación o descompensación y, en general, todas presentan una semiología auscultatoria fundamental para el diagnóstico. TEMARIO J. A., P. F., M.C. Ruipérez 1
400
401 TEMA VV 1 CARDIOLOGÍA CMG VALVULOPATÍAS 1 ESTENOSIS MITRAL CONCEPTO La estenosis mitral (EM) es una situación patológica producida por un estrechamiento u obstrucción de la válvula mitral que genera una dificultad de flujo sanguíneo auriculoventricular izquierdo diastólico. Es una enfermedad que se caracteriza por progresar lentamente. de los casos se fusionan las comisuras valvulares (30%), seguida de la fusión de las cúspides valvulares (15%) y de las cuerdas tendinosas (10%). En el resto de los casos se produce una fusión combinada de varios componentes del aparato valvular. La EM puede presentarse aislada (EM pura: incidencia 25%) o asociada a otras valvulopatías (EM combinada: incidencia 40%). Es más frecuente en el sexo femenino 1. La severidad de la EM se puede establecer en función del área valvular según los datos de la siguiente tabla. Imagen VV1 1 Esquema VV1 1 La alteración anatómica de la EM consiste en un engrosamiento de las valvas y fusión de los distintos elementos que conforman el aparato valvular y subvalvular. En la mayoría Esquema VV1 2 1 El 66% de las EM se reconocen en mujeres. Esta mayor incidencia se debe a la mayor predisposición de las mujeres a padecer fiebre reumática (principal causa de la estenosis mitral). J. A., P. F., M.C. Ruipérez 1
402 TEMA VV 1 CARDIOLOGÍA CMG ETIOLOGÍA La cardiopatía reumática o, por extensión, la fiebre reumática 2, constituye la etiología más frecuente y representa casi el 90-99% de los casos. Como segunda etiología más frecuente 3 encontramos la fibrosis y calcificación progresiva del anillo mitral que poco a poco va extendiéndose hacia el resto del aparato valvular. Esta última etiología es inherente al envejecimiento del organismo, por lo que la encontraremos casi exclusivamente en personas ancianas (mayores de 75 años aprox.). También existen casos de EM congénita (muy poco frecuente) y EM asociadas a cardiopatías congénitas 4 (en el síndrome de Lutembacher suele hallarse EM asociada a comunicación interauricular (CIA)). Otras etiologías menos frecuentes son la EM que acompaña al carcinoma maligno, a la fibroelastosis endomiocárdica y a la mucopolisacaridosis. Con la válvula mitral normal puede producirse una semiología acústica de estenosis en aquellos casos en los que existe una obstrucción a la entrada del ventrículo izquierdo (mixoma auricular izquierdo, tumores septales, trombos auriculares grandes o aquellos que se forman en prótesis de válvula mitral ) o bien si el área es relativamente estrecha por aumento del flujo auriculoventricular izquierdo, como sucede en algunas cardiopatías congénitas. A este tipo de EM con válvula mitral intacta se las denomina EM funcional o relativa. Esquema VV1 3 HISTORIA NATURAL La EM se suele producir a los dos años del episodio de fiebre reumática (que generalmente se da en la edad infantil o en la adolescencia). Después, suelen ser necesarios 10 años (o incluso 20 años) para que aparezcan los primeros síntomas, es decir, éstos aparecen a partir de la 3ª a 4ª década de la vida. La presencia de hipertensión pulmonar tiene una influencia significativamente negativa sobre el pronóstico a largo plazo 5. Este hecho se fundamenta en la importante participación que la hipertensión pulmonar tiene en la aparición de insuficiencia cardiaca derecha. Hace años (en la podríamos llamar era prequirúrgica), la supervivencia, una vez realizado el diagnóstico de EM, era: a) Para los, asintomáticos, del 80% a 10 años; b) Para los poco sintomáticos con tratamiento médico adecuado, del 60% a 5 años; y c) Para los muy sintomáticos, menor del 15% a 5 años. 2 La cardiopatía reumática es una condición en la que la fiebre reumática daña de forma permanente las válvulas del corazón. La fiebre reumática es una secuela de la infección, normalmente en forma de faringoamigdalitis, por determinados serotipos de Streptococcus pyogenes (betahemolítico). La incidencia de la EM se ha reducido a nivel mundial en los últimos 30 años (particularmente en los países desarrollados) debido a la reducción del número de casos de fiebre reumática. 3 Todos estos datos se corresponden a nuestro medio, y podrían ser extrapolables a otros países desarrollados de características similares, pero no a países en vías de desarrollo o subdesarrollados 4 Aunque parezca lo mismo es un poco diferente. La EM congénita es aquella EM que es consecuencia directa del proceso malformativo, mientras que la EM asociado a cardiopatía congénita es aquella EM que aparece como consecuencia de un proceso malformativo congénito, aunque inicialmente la válvula mitral sea normal. En el ejemplo del Síndrome de Lutembacher, la cardiopatía congénita sería la CIA y, ésta, por las alteraciones anatomofuncionales que provoca, predispone a la EM. Esquema VV1 4 5 Como veremos, la hipertensión pulmonar va a ser una consecuencia de la estenosis mitral que nos ocupa. J. A., P. F., M.C. Ruipérez 2
403 TEMA VV 1 CARDIOLOGÍA CMG FISIOPATOLOGÍA La EM ocasiona una resistencia al flujo aurículoventricular que trae consigo: a) Consecuencias retrógradas: la sangre no es capaz de atravesar dicha resistencia y se acumula en la aurícula izquierda, que consecuentemente se hipertrofia y dilata. Las contracciones auriculares se hacen más potentes para intentar mantener un llenado ventricular adecuado 6. Además, la sangre acumulada en la aurícula va elevando poco a poco la presión que se va a transmitir retrógradamente al territorio pulmonar 7 produciendo congestión venosa pulmonar y edema instersticial e intraalveolar. Con el tiempo, la dilatación auricular izquierda, con su fibrosis y cicatrices, produce una actividad eléctrica anormal que es el origen de arritmias auriculares, principalmente, arritmia completa por fibrilación auricular (ACxFA). Estas arritmias empeoran el pronóstico ya que dan lugar a una alteración significativa del llenado ventricular con una caída del gasto cardiaco superior al 20% 8. reactiva de la íntima y media de los vasos pulmonares 10 ). La hipertensión pulmonar provoca hipertrofia y dilatación del ventrículo derecho que, a su vez, puede provocar insuficiencia ventricular derecha (ICD) o insuficiencia tricuspídea (IT) 11. En ambas situaciones, ICD e IT, encontraremos síntomas de congestión visceral y edema. b) Consecuencias anterógradas: la disminución del flujo auriculo-ventricular disminuye el llenado ventricular y, por tanto, el gasto cardiaco izquierdo (GC sistémico). A pesar de ello, las manifestaciones de bajo gasto no son apreciables hasta estadíos muy avanzados de EM o en situaciones de esfuerzo (ejercicio, estrés, relaciones sexuales ) 12 La sintomatología va a depender del gradiente transvalvular 13. Este gradiente va a depender del área valvular, del gasto cardiaco y de la frecuencia cardiaca. Otra alteración fisiopatológica importante de la EM es la hipertensión pulmonar: Inicialmente, es la consecuencia de la transmisión retrógada de la congestión venocapilar pulmonar. Con el paso del tiempo, la hipertensión pulmonar se debe a modificaciones orgánicas obliterativas e irreversibles 9 de los vasos pulmonares (concretamente, el proceso es el siguiente: la hipertensión venocapilar induce una vasoconstricción arteriolar reactiva que, mantenida en el tiempo, lleva a una hiperplasia 6 Recordemos que las contracciones auriculares aseguran un 20%-30% de llenado ventricular extra en la que se denomina fase de llenado activo. 7 Provocando elevación de la presión venocapilar pulmonar (PVCP) 8 Por qué? Porque perdemos ese llenado extra auricular. 9 Por ello, aunque se intervenga quirúrgicamente la válvula mitral, no se desaparecerá la hipertensión pulmonar. Esquema VV La hiperplasia de la íntima y de la media de los vasos pulmonares evita en un principio que se produzca el transudado de líquido a los alveolos por la hipertensión venocapilar (digamos que las paredes se refuerzan). Sin embargo, con el tiempo, este engrosamiento parietal termina por producir hipertensión pulmonar. 11 Por qué? La dilatación ventricular provoca dilatación del anillo valvular. Esta es una de las causas más frecuentes de insuficiencia tricuspídea como veremos en el tema correspondiente. 12 Por qué? Recordemos que en la taquicardia la menor duración del ciclo cardiaco se produce, sobretodo, a expensas de la diástole y que es durante ésta durante se produce el llenado ventricular. 13 El gradiente transvalvular mitral es la diferencia de presión entre la aurícula izquierda y el ventrículo izquierdo. El aumento del mismo nos indica una mayor dificultad de paso de la sangre y, por tanto, más síntomas anterógrados y retrógrados. J. A., P. F., M.C. Ruipérez 3
404 TEMA VV 1 CARDIOLOGÍA CMG CLÍNICA ANAMNESIS La EM puede ser silente, pero no es lo habitual (suele serlo cuando se presenta como enfermedad geriátrica). Generalmente, sus síntomas tienen un comienzo gradual, aunque no es infrecuente una presentación inicial dramática desencadenada por algún evento precipitante: embarazo, embolismo, desarrollo de ACxFA y situaciones que aumente la actividad simpática y eleven la frecuencia cardiaca. Debemos tener en cuenta que es una enfermedad más frecuente en inmigrantes 14 y en ancianos (es una de las llamadas enfermedades geriátricas ) El principal síntoma es la disnea provocada por la hipertensión venocapilar pulmonar, que es lentamente progresiva. Inicialmente a grandes esfuerzos, para posteriormente llegar a ser de mínimos esfuerzos, de decúbito y con crisis de disnea paroxística nocturna. La máxima expresión de la EM es el edema agudo de pulmón (EAP) o asma cardial 15. Otros síntomas son las palpitaciones secundarias a la presencia de ACxFA o flutter 16, tos de esfuerzo y hemoptisis (producida por rotura de capilares pulmonares, venas bronquiales, bronquitis o, incluso, por infartos pulmonares). Aprox. un 15% de los pacientes presentan dolor precordial que puede ser secundario a exacerbaciones transitorias de la hipertensión venocapilar pulmonar o de origen coronario (arterioesclerosis o embolismo). El desarrollo de hipertensión arterial pulmonar puede contribuir a la producción de fatiga, disnea y dolor precordial. Tardíamente, la hipertensión pulmonar, al descompensar el ventrículo derecho, produce sintomatología de ICD. 14 Ya hemos comentado que en los países desarrollados, gracias a los antibióticos, la fiebre reumática es muy poco frecuente. 15 Se denomina así porque la dificultad respiratoria deriva de una enfermedad cardiaca, no pulmonar. 16 Las arritmias auriculares son frecuentes en pacientes con una estenosis mitral de años de evolución. Estas arritmias suelen acelerar la progresión de los demás síntomas. Los fenómenos tromboembólicos son muy frecuentes en los pacientes con EM y pueden ser la primera manifestación de esta enfermedad. Una de las consecuencias más graves de éstos fenómenos son los accidentes cerebrovasculares (ACV). La ACxFA es la condición que más predispone a la formación de trombos; tanto es así, que el 80% de los pacientes con EM que padecen fenómenos tromboembólicos presentan ACxFA. Otros datos que resaltan la frecuencia de los tromboembolismos son que el 20% de los pacientes con EM presentaron trombos antes de la cirugía y el 25% antes de ser anticoagulados 17. Reseñar que la frecuencia de tromboembolismos no tiene relación con el grado de estrechez de la válvula mitral, pero sí presenta correlación directa con la edad, el tamaño auricular izquierdo e, inversamente, con el gasto cardiaco. Según lo visto, podemos entender porque TODOS LOS PACIENTES CON EM Y FIBRILACIÓN AURICULAR RECIBEN TRA- TAMIENTO ANTIACOAGULANTE PROFI- LÁCTICO. Un síntoma, muchas veces inadvertido, es la ronquera que en ocasiones pueden presentar estos pacientes como consecuencia de la parálisis del nervio laríngeo recurrente izquierdo motivada por la compresión que ejerce la aurícula izquierda dilatada. Por último, advertir que la endocarditis bacteriana (EBS) puede complicar esta enfermedad. EXPLORACIÓN FÍSICA La exploración física de la EM, al ser tan específica, sigue siendo la base del diagnóstico clínico. Una buena exploración física con un aceptable nivel de auscultación permite el diagnóstico exacto por parte de médicos no especializados que parten de una primera manifestación inespecífica como puede ser un ACV o un EAP. Dentro del apartado de inspección, es relativamente frecuente la presencia de manchas de color rojo intenso en los pómulos de la cara, lo que le da el nombre de chapetas malares o facies mitral, típicas de pacientes con estenosis mitral severa con gasto cardiaco bajo y vasoconstricción generalizada. El pulso arterial puede ser pequeño si el paciente presenta un gasto cardiaco bajo. 17 Que barato sale hacer estadísticas, no? J. A., P. F., M.C. Ruipérez 4
405 TEMA VV 1 CARDIOLOGÍA CMG Cabe destacar, dentro de la palpación, la presencia de un frémito diastólico consecuencia de la transmisión del retumbo que se produce durante el paso de sangre en la válvula estenosada. Si la válvula no está calcificada 18 y es móvil, en estenosis mitrales moderadas o severas, podemos palpar el primer ruido 19, al estar éste muy reforzado. palpar también el impulso del VD y el componente pulmonar del segundo ruido (S2(A)) en aquellos pacientes que padezcan hipertensión pulmonar 20. La auscultación cardiaca consiste en un primer ruido (S1) reforzado, sístole limpia y chasquido de apertura mitral del cual parte un retumbo con refuerzo presistólico 21. Esta auscultación puede variar dependiendo del grado de estrechez, de la motilidad valvular (calcificada o no) y del ritmo cardiaco. Si la estenosis mitral es grave, el retumbo ocupa toda la diástole, signo de gradiente permanente 22. Podemos afirmar según esto, que la duración del retumbo se relaciona con la gravedad de la EM. Si la válvula esta calcificada o inmóvil, S1 está apagado, así como el chasquido de apertura que puede hasta faltar. Con la fibrilación auricular, la intensidad del primer ruido es variable y desaparece el refuerzo presistólico 23. En presencia de hipertensión pulmonar grave, S2 puede desdoblarse, y el componente pulmonar del segundo ruido esta reforzado (S2(A)) 24 y puede aparecer un pequeño soplo diastólico de insuficiencia pulmonar, conocido como soplo de Graham Steel 25. A veces, el uso de ciertas maniobras puede poner en evidencia o clarificar esta valvulopatía. Auscultar al paciente en decúbito lateral izquierdo magnifica la auscultación 26. Poner al paciente de pie retrasa el chasquido de apertura y disminuye el retumbo al disminuir el retorno venoso y reducir la presión auricular izquierda; lo contrario que sucede con el ejercicio (el ejercicio isométrico puede poner de manifiesto el retumbo de una estenosis mitral leve 27 ). En la auscultación pulmonar podremos encontrar estertores húmedos. 18 Esto vale para todas las valvulopatías: las válvulas calcificadas son más rígidas y su movimiento es reducido y lento por lo que los ruidos que generan (o movimiento de sangre) será SIEMPRE menor que si la válvula no estuviese calcificada. 19 Más adelante, cuando veamos la auscultación, expondremos la etiología del primer ruido. 20 Por qué? Podremos palpar el VD porque la HTP provoca hipertrofia ventricular derecha y S2(A) porque al existir HTP el cierre de la válvula pulmonar es más brusco. 21 Por qué? La alteración anatómica de la válvula mitral (y, por tanto, de la hemodinámica asociada) hace que S1, que en condiciones normales es producido por el cierre de las válvulas AV, aumente su intensidad (se refuerce). Como durante toda la sístole la válvula mitral permanece cerrada, no se apreciará ningún sonido anormal en esta fase del ciclo. Al inicio de la diástole, se abren las válvulas AV, y la válvula mitral estenosada provoca un chasquido (según algunos autores, el chasquido de apertura es debido al frenado brusco que sufre la válvula al haber perdido su elasticidad). Nada más abrirse, la sangre comienza a atravesar la válvula. Como ésta es más estrecha, el flujo a su través es mayor, adquiriendo la sangre un flujo turbulento que genera el retumbo diastólico (se denomina retumbo a los soplos diastólicos de llenado ventricular). Con el paso de la sangre, las presiones entre las dos cámaras se van igualando, el flujo va disminuyendo y, por tanto, la intensidad del soplo también. Sin embargo, recordemos que al final de la diástole se produce la contracción auricular que explicaría el refuerzo presistólico. 22 Es decir, el gradiente nunca llega a desaparecer y el soplo ocupa toda la diástole. 23 Por qué? Porque desaparece la contracción auricular. Esquema VV Ver nota al pie Por qué? Igual que vimos que la dilatación del VD puede provocar insuficiencia tricuspídea, la dilatación de la raíz de la arteria pulmonar como consecuencia de la hipertensión pulmonar puede provocar insuficiencia pulmonar. 26 Por qué? Al poner al paciente en decúbito lateral izquierdo, el corazón, y más concretamente, el ventrículo izquierdo, se aproxima a la pared torácica. 27 El ejercicio isométrico es aquel que realizamos contra una gran resistencia a lo largo de un corto recorrido. Se realiza este tipo de ejercicio porque es el más cómodo para el paciente y él médico. Generalmente, el médico, simplemente, pide al paciente que le dé un fuerte apretón de manos mientras lo ausculta. Con el ejercicio aumenta el retorno venoso y, por tanto, el gradiente. Una ventaja, de este tipo de ejercicio es que aumenta menos la frecuencia cardiaca que el isotónico (el que hacemos al correr o montar en bici) y, por tanto, nos permite una mejor auscultación de la diástole. J. A., P. F., M.C. Ruipérez 5
406 TEMA VV 1 CARDIOLOGÍA CMG DIAGNÓSTICO EXPLORACIONES COMPLEMENTARIAS Electrocardiograma: es a veces normal, excepto por la presencia de una onda P bimodal ( P mitral 28 ), siempre y cuando esté conservado el ritmo sinusal. La fibrilación auricular es la arritmia más frecuente y suele existir, aproximadamente, en más del 40% de los pacientes con EM sintomática. Si existe hipertensión pulmonar, existirá crecimiento ventricular derecho, el cual desvía el eje de cardiaco hacia la derecha. Sí, además, hay crecimiento auricular derecho, encontraremos una onda P más alta y ancha de lo normal. Radiología de tórax: si la EM es significativa, los pacientes muestran crecimiento auricular izquierdo (flecha roja). El edema intersticial produce una serie de cambios radiológicos en los campos pulmonares, apareciendo las líneas A y B de Kerley 29. Si hay edema intraalveolar y trasudado, lo que quiere decir que la estenosis es más severa, aparece la imagen de EAP con la morfología típica en alas de mariposa. El crecimiento auricular y ventricular derecho 30 con dilatación de arteria pulmonar, junto a crecimiento auricular izquierdo, es observado en estenosis mitral severa 31. En este último caso, observaremos una morfología típica del borde izquierdo de la silueta cardiaca con 4 arcos o dilataciones. Por último, si somos hábiles, podríamos detectar un aumento de la angulación de la carina, como consecuencia del crecimiento auricular izquierdo. (flecha azul) Ecocardiograma: TÉCNICA DE ELEC- CIÓN PARA EL DIAGNÓSTICO Y LA VA- 28 Por qué? Por el crecimiento de la aurícula izquierda. Su semiología electrocardiográfica es: Ancho superior a 0,12 en D2 (Círculo azul en imagen) y bifásica (+/-) en V1 (Círculo rojo en imagen) 29 Aparecen normalmente en EM severa de larga evolución. Las líneas A son rectas, densas y largas y se dirigen hacia el hilio. Las líneas B, más frecuentes, son densas, cortas y horizontales y se observan en los ángulos costodiafragmáticos. 30 Llamado doble contorno derecho. (Flecha amarilla) 31 La transmisión retrógrada de la elevación de presión ha afectado a todas las estructuras: aurícula izquierda, arteria pulmonar, ventrículo derecho y aurícula derecha. Debemos encontrar, por tanto, casi de forma obligatoria, edemas. LORACIÓN DE LA ESTENOSIS MITRAL. Con el ecocardiograma transtorácico podemos determinar el tamaño y la forma del orificio. Con la aplicación Doppler pueden determinarse gradientes transvalvulares con mayor exactitud que los obtenidos con otras técnicas invasivas (presión de enclavamiento pulmonar). También puede calculare la presión arterial pulmonar. El ecocardiograma transesofágico permite una mejor visualización anatómica de la válvula. Así puede valorarse la rigidez (válvula móvil o inmóvil), el engrosamiento (delgada o muy engrosada), la calcificación (sin calcio o calcificada) y el estado del aparato subvalvular (ecos escasos o múltiples cordones gruesos). A estos parámetros se les da un valor de 1 a 4 y se obtiene una puntuación (score de WILKINS) que permite seleccionar a los candidatos para la valvuloplastia mitral. Aquellos pacientes cuya puntuación sea igual o menor de 9 son los ideales para la valvuloplastia 32. Normalmente la presencia de trombos en aurícula izquierda o de insuficiencia mitral CONTRAINDICAN para la valvuloplastia. Imagen VV1 2 Imagen VV Por tanto, y como se dijo en clase, los pacientes con un score > 10 no se someterán a cirugía J. A., P. F., M.C. Ruipérez 6
407 TEMA VV 1 CARDIOLOGÍA CMG ANTICOAGULANTES 37 ESTÁN SIEMPRE INDICADOS EN LA FIBRILACIÓN AURICU- LAR CRÓNICA O PAROXÍSTICA. Los diuréticos son necesarios para disminuir la retención hidrosalina, con la consiguiente reducción de la precarga y congestión venocapilar pulmonar. Esquema VV1 7 El tratamiento quirúrgico actual es la valvuloplastia mitral 38 que sólo se realiza, salvo casos puntuales, si el paciente cumple los siguientes requisitos: score de Wilkins 9, ausencia de insuficiencia mitral y ausencia de trombos en aurícula izquierda. En los casos en que no es posible la valvuloplastia se pueden realizar dos tipos de tratamientos quirúrgicos, ambos con circulación extracorpórea; la comisurotomia valvular abierta 39 o la sustitución valvular (prótesis valvular) 40. TRATAMIENTO Los pacientes deben seguir una serie de recomendaciones al margen del tratamiento farmacológico o quirúrgico. La alimentación debe contener la menor cantidad de sal posible 33 y se será más exigente cuanto más severa sea la valvulopatía. Debe realizarse prevención de fiebre reumática 34. Igualmente se hará profilaxis antibiótica para prevenir la endocarditis bacteriana en las exodoncias, actos quirúrgicos, etc. El uso de digital está indicado sólo si el paciente está en ACxFA 35. No es útil para disminuir la FC si el paciente está en ritmo sinusal (usaremos betabloqueantes), ni sirve para prevenir la aparición de fibrilación auricular. En caso de FA, si no se consigue controlar la frecuencia con digitálicos, podemos asociar betabloqueantes o antagonistas de calcio (verapamil o diltiacem), siempre teniendo en cuenta los efectos sobre la función ventricular 36. LOS 33 Por qué? Al disminuir la volemia, disminuimos la precarga (y por tanto el gradiente transvalvular) y la congestión venocapilar pulmonar. 34 La profilaxis esta especialmente indicada en menores de 40 años y se realiza con penicilina, o eritromicina si se es alérgico a ésta. 35 En el caso de que la arritmia sea de inicio reciente es conveniente intentar conseguir devolver al paciente a ritmo sinusal mediante cardioversión (pero obligatoriamente el paciente debe estar bien anticoagulado) 36 Por qué? Con estos fármacos conseguimos disminuir la frecuencia cardiaca y aumentamos el tiempo de diástole (mejo- Esquema VV1 6 rando el llenado ventricular). Pero, como también deprimimos la contractilidad ventricular, podemos provocar una situación de bajo gasto. 37 Suelen utilizarse dicumarínicos (Sintrom ) 38 Este tratamiento consiste en introducir un catéter balón ( Balón de Inoue ) por la vena femoral. Al llegar al corazón se hace una punción transeptal y se hace avanzar con una guía el catéter hasta la aurícula izquierda donde se coloca en el orificio auriculoventricular. El balón se va hinchando lentamente para que adopte una morfología de reloj de arena, hasta estar su parte más estrecha en el orificio de la válvula mitral, y al seguir hinchándose separa las comisuras. 39 Es la técnica de elección en caso de trombos auriculares ya que permite su fácil retirada. Muestra una mortalidad del 1 al 3%; mortalidad que se eleva a aproximadamente el 6,7% si se trata de una reestenosis. 40 Es la técnica de elección en caso de que la válvula este muy estropeada (calcificada, insuficiencia mitral combinada ). Muestra una mortalidad del 6,4%; mortalidad que se eleva al 20% si se trata de un estadio funcional de EM grado IV (área menor de 1 cm 2 con signos de hipertensión venocapilar severa e insuficiencia de ventrículo derecho) J. A., P. F., M.C. Ruipérez 7
408
409 TEMA VV 2 CARDIOLOGÍA CMG VALVULOPATÍAS 2 INSUFICIENCIA MITRAL CONCEPTO ETIOLOGÍA 1 La insuficiencia mitral (IM) se produce por el cierre inadecuado de la válvula mitral, lo que permite el paso retrógrado de sangre desde el ventrículo izquierdo (VI) a la aurícula izquierda (AI) durante la sístole ventricular. El aparato valvular mitral está formado por las valvas mitrales, el anillo valvular mitral, las cuerdas tendinosas y los músculos papilares; la alteración de cualquiera de estos componentes puede producir IM. La IM se puede presentar como una patología aguda (IM aguda) o como una patología crónica (IM crónica). La IM aguda es una situación crítica siempre sintomática. La IM crónica suele permanecer asintomática durante un largo periodo de tiempo (IM crónica compensada), por lo que sus síntomas suelen aparecer en edades avanzadas (IM crónica descompensada). 1. SEGÚN MECANISMO FISIOPATOLÓGICO La etiología de la IM es muy variada. En función del mecanismo fisiopatológico, podemos distinguir entre: IM de carácter inflamatorio/autoinmune Entre ellas encontramos la causa más frecuente de IM, la fiebre reumática (cardiopatía reumática) 2. Son menos frecuentes las debidas a lupus eritematoso sistémico (LES) o esclerodermia. IM de carácter infeccioso Como la IM secundaria a endocarditis bacteriana (EBS). IM degenerativas Como la IM producida por calcificación del anillo valvular, por la degeneración mixomatosa o mixoide de las valvas y las que acompañan a los síndromes de Marfan, Ehlers Danlos y seudaxantoma elástico Esquema VV2 1 1 En clase sólo se explico la segunda clasificación etiológica (además, exclusivamente la de la IM crónica, pues la de la IM aguda no dio tiempo y la he sacado de la comisión del año pasado). En negrita se encuentran todas las etiologías que se comentaron en clase; el resto, aparecían en el libro del Dr. Ruipérez. 2 A diferencia de la estenosis mitral, la insuficiencia mitral reumática es más frecuente en varones. J. A., P. F., M.C. Ruipérez 1
410 TEMA VV 2 CARDIOLOGÍA CMG IM congénitas y asociadas a cardiopatías congénitas Como las hendiduras de la válvula mitral (alteración frecuente en los pacientes con síndrome de Down), los defectos en cojines endocárdicos, la válvula mitral en paracaídas, fibroelastosis endocárdica, transposición de grandes vasos IM estructurales Se producen por rotura o disfunción del aparato valvular. Pueden ser por roturas de cuerdas tendinosas (traumatismos, isquemia miocárdica que afecte a músculos papilares ) o secundarias a dilatación del anillo (una causa muy frecuente de dilatación del anillo valvular es la miocardiopatía dilatada (MCD) o la cardiopatía hipertensiva (CH); también la isquemia miocárdica que produzca aneurismas ventriculares ) IM iatrogénicas Comisurotomías inadecuadas, dehiscencia de prótesis mitrales IM asociada a prolapso válvula mitral Como veremos en el próximo tema, la IM asociada a prolapso de válvula mitral es una cardiopatía muy frecuente. Son la dilatación (secundaria a MCD o CH) y la calcificación. Anomalías de las cuerdas tendinosas Las congénitas y las roturas por traumatismos o isquemia Anomalías de los músculos papilares La isquemia miocárdica y la arteritis coronaria (síndrome de Kawasaki) IM aguda Anomalías de las válvulas Las causas principales son EBS, LES y degeneración mixomatosa. Anomalías del anillo EBS Anomalías de las cuerdas tendinosas Rotura espontánea (idiopática) y degeneración mixomatosa. Anomalías de los músculos papilares Dehiscencias de prótesis. 2. SEGÚN TIPO DE PRESENTACIÓN En función del tipo de presentación de IM (aguda o crónica) y del componente afectado encontramos la siguiente clasificación: IM Crónica Anomalías de las válvulas Las causas principales son fiebre reumática, EBS, degeneración mixomatosa y congénitas. Anomalías del anillo 3 Qué me aprendería YO? Las principales etiologías de la IM crónica son la fiebre reumática, la dilatación del anillo por MCD o MH, el prolapso de la válvula mitral y la degeneración-calcificación de la válvula. La EBS, junto a las roturas de cuerdas tendinosas espontánea o por traumatismos, son las principales etiologías de IM aguda. La isquemia, en función del área afectada, podrá producir IM crónica o aguda. Esquema VV2 2 4 La arteritis predispone a los infartos inferiores con afectación del músculo papilar posterior. J. A., P. F., M.C. Ruipérez 2
411 TEMA VV 2 CARDIOLOGÍA CMG FISIOPATOLOGÍA 5 En la IM, una fracción del volumen de sangre que debería ser expulsada a la aorta es eyectada retrógradamente a la AI (Volumen de regurgitación mitral (VRM)). Como consecuencia, el volumen sistólico eyectado a la aorta (Volumen de eyección aórtico (VEA)) es menor que el volumen sistólico total eyectado por el VI (Volumen sistólico de eyección ventricular (VSEV)) 6. En general, las consecuencias de la regurgitación sistólica mitral incluyen: Imagen VV2 1 A. CONSECUENCIAS RETRÓGRADAS Aumento de presión y volumen en AI. En función de la distensibilidad auricular se podrá producir: si esta es alta, clínica de dilatación auricular (fundamentalmente arritmias) y si es baja, clínica de hipertensión venocapilar pulmonar (congestión venosa pulmonar y edema agudo de pulmón) sobrecarga de volumen del VI cuando el volumen regurgitado vuelve al ventrículo en diástole junto con el retorno venoso pulmonar normal (esto es, aumento del volumen telediástolico (VTD) o precarga). Para mantener las demandas circulatorias normales y manejar el aumento de precarga (por ese volumen regurgitante adicional que se suma al retronó venoso pulmonar), el volumen efectivo eyectado por el ventrículo izquierdo debe incrementarse. Este incremento se efectúa fundamentalmente mediante el mecanismo de Frank-Starling (el aumento de precarga o VTD da lugar al estiramiento miofibrilar y al consiguiente aumento de fuerza de contracción). Otro mecanismo compensador, que en la IM tiene menor importancia, es la activación del sistema nervioso simpático. El menor flujo anterógrado hace disminuir la tensión arterial. Dicho descenso es detectado por los barorreceptores que estimulan una respuesta simpática que aumenta la frecuencia cardiaca y la fuerza de contracción. Cuando esta compensación desaparece, se produce la disfunción del VI y aparecen síntomas de bajo gasto cardiaco (debilidad, fatiga ). Se evalúa la funcionalidad del VI mediante el volumen telesistólico (VTS): si este aumenta, significa que el VI no está bombeando toda la sangre que le llega. Se acepta que una IM grave con un VTS < 30 ml es bien tolerada y la cirugía se puede demorar, que una IM grave con un VTS entre 30 y 90 ml requiere intervención quirúrgica aunque estén asintomáticos (suelen tolerar bien la intervención aunque el riesgo de la cirugía es alto), y que una IM grave con un VTS > 90 ml, por su elevada mortalidad, debe ser tratada de urgencia o quedaran secuelas irreversibles (disfunción de ventrículo izquierdo residual) B. CONSECUENCIAS ANTERÓGRADAS Reducción del volumen de expulsión a la aorta (y por tanto del gasto cardiaco efectivo 7 ) y 5 Este apartado es un poco larguillo pero sólo debéis entenderlo (os aconsejo que os ayudéis de los esquemas o, incluso, mejor que os los hagáis vosotros mismos). Quedaos fundamentalmente con los factores que influyen en la IM y con las diferencias entre IM aguda e IM crónica. 6 Expresado matemáticamente sería: VSEV = VRM + VEA. En condiciones normales, VRM es igual a 0. 7 El gasto cardiaco total indica el volumen que expulsa el VI, independientemente de su dirección, por unidad de tiempo; el gasto cardiaco efectivo indica el volumen que el VI expulsa a la aorta (esto es, el total menos el que regurgita) por unidad de tiempo. Por tanto, en la IM el GC total estará elevado, pero el GC efectivo estará disminuido. Esquema VV2 3 J. A., P. F., M.C. Ruipérez 3
412 TEMA VV 2 CARDIOLOGÍA CMG SEVERIDAD DE LA IM La severidad de la IM y las consecuencias hemodinámicas, tanto retrógradas como anterógradas, vienen determinadas por varios factores: 1) El gradiente de presión sistólica entre ventrículo y aurícula (GP (s) ) 8. 2) Las resistencias sistémicas totales 9 (resistencias vasculares periféricas o RVP). 3) El tamaño del orificio mitral durante la regurgitación. 4) La distensibilidad o compliance de la aurícula izquierda. 5) La rapidez de producción de la insuficiencia y la duración del proceso: IM aguda o IM crónica 6) El estado funcional del miocardio ventricular. Vamos a intentar ver cómo influye cada uno de estos factores. Nos encontramos al inicio de la sístole con un ventrículo lleno de sangre que comienza a contraerse y una válvula mitral insuficiente que permite el reflujo de sangre. Este paso de sangre se producirá solamente mientras la presión ventricular (PVI) supere la presión auricular (PAI), esto es, mientras exista un GP (s) (1). La PVI irá descendiendo paulatinamente a lo largo de la sístole por el escape de sangre a la aorta (y, por extensión, a la circulación sistémica) y a la aurícula izquierda. La sangre, que no es tonta, buscará siempre el camino más fácil y tenderá a salir por donde encuentre menos resistencia. De forma didáctica, podríamos decir que la dificultad de paso vendrá determinada por las RVP (2) y por el área del orificio mitral (3), respectivamente. Por otro lado, la sangre que regurgita a la AI tenderá a elevar su presión. La importancia de la PAI es que si ésta alcanza un determinado nivel, se transmite retrógradamente (porque la circulación venosa pulmonar es un circuito de baja presión) y producirá una elevación de la presión venocapilar pulmonar (PVCP). La relación entre el incremento de volumen y el incremento de presión en la AI es la llamada compliance o distensibilidad de la AI (4). Mientras más distensible sea la AI, más volumen aceptará sin incrementar su presión y, por tanto, menos se elevará la PVCP y, viceversa. El principal factor que determina la distensibilidad auricular es el 8 Su valor es la diferencia de presión entre el VI y la AI durante la sístole. Expresado matemáticamente: GP (s) =PVI (s) -PAI (s). 9 Hablar de resistencias sistémicas, refiriéndose a los vasos, es casi sinónimo de hablar de poscarga, refiriéndose al corazón. tiempo que haya estado sometida a una sobrecarga de presión (5). Si la IM se estableció de forma leve y fue progresando lentamente tendremos una AI distensible y pocos síntomas pulmonares, pero si la IM se estableció ya de inicio de forma severa, la AI será poco distensible (porque ese es su estado normal) y se producirá una súbita elevación de la PVCP. Estas dos situaciones clínicas se corresponden, respectivamente, con la IM crónica y la IM aguda. En ambas situaciones, la clínica de bajo gasto cardiaco depende de la funcionalidad contráctil del ventrículo izquierdo (6). Cuando ésta se altere, aparecerán los síntomas de bajo gasto. Bien, una vez explicados los factores, intentemos caracterizarlos ahora en cada uno de los dos tipos de IM de forma individual 10. A) IM AGUDA La IM aguda se puede producir, por ejemplo, por rotura de cuerdas tendinosas en un traumatismo. En ella, la compliance auricular es muy similar a la normal, lo cual implica que la AI es una cámara relativamente rígida, y cuando es súbitamente expuesta al volumen regurgitante, se dilata relativamente poco, pero incrementa fuertemente su presión. Este incremento de PAI disminuye el GP (s) y tiende a disminuir el volumen regurgitante. Sin embargo, la alta PAI es transmitida a la circulación pulmonar y, como consecuencia, se desarrolla rápidamente congestión y edema pulmonar y, a veces incluso, fallo derecho; todo ello convierte a la IM aguda en una urgencia vital. En la IM aguda, la sobrecarga de volumen del VI es, generalmente, bien tolerada siempre que la función ventricular sea normal. No obstante, si existe fallo ventricular asociado, se desarrolla un cuadro mixto de insuficiencia ventricular anterógrada (síntomas de bajo gasto) y retrógrada (síntomas pulmonares). B) IM CRÓNICA En contraste con la situación aguda, el desarrollo más gradual de la IM crónica (por ejemplo, debida a cardiopatía reumática) permite la adaptación de la aurícula izquierda, que aumenta su compliance y se dilata, lo que permite un mayor volumen auricular con incrementos menores de presión. Esta adaptación de la AI hace que la PVCP no se eleve tanto como en la IM aguda y, en general, el edema pulmonar no aparece. Sin embargo, la adaptación 10 Esto es volver sobre lo mismo, pero os servirá para aseguraros de que lo habéis entendido y os puede resolver algunas dudillas que hayan quedado. J. A., P. F., M.C. Ruipérez 4
413 TEMA VV 2 CARDIOLOGÍA CMG auricular hace que el flujo regurgitante sea mayor y, por el contrario, el flujo eyectivo aórtico tienda a disminuir. El VI se dilata, y aumenta el volumen diastólico y su fuerza de contracción por la ley de Frank-Starling, que tiende a mantener un flujo aórtico normal o casi normal. Esta situación de compensación puede mantenerse durante mucho tiempo, estando el paciente asintomático. No obstante, a largo plazo, la descompensación se produce. Cuando aparece la disfunción contráctil del VI, aumenta el volumen telesistólico (VTS) y disminuye la fracción de eyección anterógrada, con lo que se producen síntomas de bajo gasto (debilidad, fatigabilidad ). Con frecuencia, la dilatación auricular izquierda crónica predispone a la aparición de arritmias auriculares, sobre todo a la arritmia completa por fibrilación auricular (ACxFA). 11 función ventricular es deficitaria tendremos además una importante caída del gasto cardiaco. Los síntomas son de presentación aguda, fundamentalmente, una disnea súbita producida por un edema agudo de pulmón (EAP). A la auscultación encontraremos un primer ruido (S1) de intensidad disminuida 12 soplo sistólico corto y decreciente 13, y va acompañado de un tercer ruido (S3) 14 ; como el paciente está taquicárdico, la auscultación adquiere un ritmo de galope 15. Si sobreviven, estos pacientes desarrollan (a los 6-12 meses) de manera importante, un aumento de la resistencia vascular pulmonar e insuficiencia cardiaca derecha 16. B) IM CRÓNICA Ya hemos comentado los factores de los que depende la severidad de la IM; para la IM crónica, cabe destacar los siguientes: la gravedad de la regurgitación, la rapidez de avance, las cifras de presión arterial pulmonar y la presencia de daño miocárdico (isquémico, etc.). La sintomatología de la IM crónica presenta tres características: 1. Hay un intervalo largo para la presentación de síntomas en la IM crónica y es así hasta que falla el VI. 2. La debilidad crónica y la fatiga secundaria a bajo gasto son los síntomas más frecuentes. Esquema VV El edema agudo de pulmón es menos frecuente que en la EM. B.1. IM LEVE A MODERADA: MANIFESTACIONES CLÍNICAS No suele causar síntomas y generalmente pasa desapercibida por el paciente. La inspección es poco útil salvo en los casos de IM asociada a pro- A) IM AGUDA Cuando se produce una IM aguda, bruscamente tiene lugar una sobrecarga de volumen de las cavidades izquierdas que no están preparadas para soportarla. Esto trae como resultado un aumento importante de la PAI con hipertensión venocapilar pulmonar y congestión venosa. Si la 11 Recordad que estas arritmias empeoran el pronóstico ya que dan lugar a una alteración significativa del llenado ventricular con una caída del gasto cardiaco superior al 20%, por la falta de contracción auricular. 12 Por qué? Desaparece el componente mitral y queda sólo el tricuspídeo. 13 Por qué? El soplo sistólico es el producido por la regurgitación de sangre a través de la válvula mitral. Es corto porque las presiones entre AI y VI se igualan rápidamente (al ser baja la distensibilidad auricular) y decreciente porque la intensidad del flujo disminuye conforme va desapareciendo el gradiente. 14 Por qué? El tercer ruido cuando existe un rápido llenado ventricular. 15 Cuando aparecen los cuatros ruidos cardiacos (S1, S2, S3 y S4) también se habla de ritmo de galope. 16 Por qué? El mecanismo sería similar al que vimos en el apartado de fisiopatología de la estenosis mitral. J. A., P. F., M.C. Ruipérez 5
414 TEMA VV 2 CARDIOLOGÍA CMG lapso de válvula mitral 17 en los que nos puede orientar el aspecto marfanoide del paciente. Normalmente, se descubre por una exploración casual al detectar un soplo sistólico 18 apical que irradia a axila, con ausencia de un tercer ruido. No muestra cardiomegalia ni alteraciones electrocardiográficas. No obstante, es conveniente realizar un estudio ecocardiográfico que nos determine la gravedad, etiología de la lesión y función ventricular; este estudio nos servirá de referencia para futuros controles. B.2. IM SEVERA COMPENSADA La IM grave compensada puede ser tolerada perfectamente durante varios años. Suele ser el médico el que llama la atención al paciente sobre su enfermedad. En esta situación, existe cardiomegalia con crecimiento auricular y ventricular izquierdo, e igual sucede con los hallazgos electrocardiográficos. Se ausculta un S1 disminuido y un soplo holositólico 19 que irradia a axila (también puede ser palpable como un frémito o thrill), con la presencia de un tercer ruido (S3), reflejo del llenado rápido ventricular por el gran volumen que llega desde la AI 20. El soplo de IM se intensifica con el ejercicio isométrico, 21 como sucede al contener la respiración, cerrar las manos intensamente (maniobra de Hangrib) y al agacharse. Cuando estudiemos la estenosis aórtica veremos como el ejercicio isométrico también altera el soplo sistólico, pero en esta ocasión lo disminuye. Este dato nos servirá como diagnóstico diferencial. Por otro lado, el soplo sistólico de la IM disminuye al ponerse de pie bruscamente o al inhalar nitrito de amilo En el tema de prolapso de la válvula mitral profundizaremos en esta asociación. 18 Por qué? El soplo sistólico, como ya vimos en la IM aguda, es producido por el paso de sangre retrógrado a través de la válvula mitral. 19 Por qué? El soplo es holosistólico porque la alta compliance auricular permite que la aurícula acepte tal volumen de sangre que el reflujo se produce durante toda la sístole. 20 Por qué? A la Aurícula Izquierda, en IM, recibe sangre regurgitada del VI, y sangre oxigenada de las venas pulmonares. 21 En el tema de EM ya se explicaron algunas características del ejercicio isométrico. Decir aquí que el ejercicio isométrico es el que más eleva la tensión arterial o poscarga. Dicha elevación, dificulta la salida de la sangre a través de la aorta (en otras palabras, estamos aumentado la poscarga) y, por tanto, la sangre tenderá a escaparse por detrás. 22 Por qué? Al ponerse bruscamente de pie, la sangre se precipita hacia los miembros inferiores; es decir, estamos provocando una hipotensión que facilita la salida de sangre del VI y, por tanto, disminuye la intensidad del soplo regurgitante. El nitrito de amilo es una sustancia inhalable con efecto vasodilatador (esto es, disminuye las RVP). B.3. IM DESCOMPENSADA Cuando se produce la disfunción contráctil del VI, va a disminuir ostensiblemente el gasto cardiaco y aumentará la PAI, así como la PVCP. Esto trae consigo la aparición de síntomas típicos de insuficiencia cardiaca congestiva izquierda (IC- CI), como la disnea de esfuerzo evolutiva 23, disnea de decúbito u ortopnea. En ocasiones, antes de desarrollar estos síntomas, los pacientes comienzan a notar los síntomas de bajo gasto, tales como cansancio, astenia, debilidad y agotamiento fácil con poco esfuerzo. Si estos pacientes siguen evolucionando en su enfermedad, se quejaran de palpitaciones al caer en ACxFA y desarrollarán tardíamente insuficiencia cardiaca derecha (ICD). Como en esta situación el volumen auricular está muy aumentado, el volumen de llenado ventricular puede ser tan alto que la válvula mitral sea relativamente estrecha; hablamos entonces de una estenosis mitral (EM) funcional que se manifestará auscultatoriamente como un soplo o retumbo (similar al que vimos en la EM) que aparecerá después del S3. La aparición del soplo o retumbo es un SIGNO DE GRAVEDAD. B.4. HISTORIA NATURAL DE LA IM CRÓNICA La IM crónica es una enfermedad progresiva. Es progresiva porque la propia dilatación auricular y ventricular aumentan la insuficiencia de la válvula mitral. La velocidad de la progresión dependerá de la gravedad de la insuficiencia, del estado previo del miocardio, de la causa etiológica de la enfermedad Se acepta que una IM leve asintomática tiene una larga supervivencia, pero que una IM grave tratada exclusivamente de forma médica tiene una supervivencia a 5 años del 45%. Esquema VV Evolutiva? Conforme progresa la enfermedad son necesarios menores esfuerzos para que ésta se presente. J. A., P. F., M.C. Ruipérez 6
415 TEMA VV 2 CARDIOLOGÍA CMG la que si se observan signos de hipertensión venocapilar pulmonar como el edema intersticial con líneas A y B de Kerley. La radiografía de tórax no suele ser de gran utilidad en la IM crónica ligera o moderada, ya que supuestamente será normal, pero sí es muy importante cuando la enfermedad es grave 27, puesto que con ella evaluaremos de una manera objetiva la presencia de congestión venosa pulmonar (signo de fallo ventricular izquierdo). Esquema VV2 6 PRUEBAS COMPLEMENTARIAS ELECTROCARDIOGRAMA Los hallazgos más frecuentes en la IM crónica severa son la dilatación auricular izquierda 24 y la presencia de una ACxFA. En un tercio de los pacientes encontramos crecimiento ventricular izquierdo 25. En aquellos casos muy evolucionados y que presentan hipertensión arterial pulmonar, podremos encontrar crecimiento ventricular derecho 26, lo que sucede en un 15-20% de los casos. En la IM aguda el ECG puede ser normal, ya que no se dilatan las cavidades, y solamente observaremos datos patológicos pertenecientes a su enfermedad causal (p.e. infarto). RADIOLOGÍA DE TÓRAX En la IM crónica suele haber cardiomegalia a expensas de dilatación o el crecimiento de cavidades izquierdas, a diferencia de lo que sucede en la IM aguda, que no presenta cardiomegalia, pero en 24 Se produce aumento de la duración de la P, que va a presentar muescas. Es la famosa P mitral. 25 Aumentan las fuerzas que activan el ventrículo izquierdo lo que aumenta el voltaje en las ondas S de V1 y en las R de V5- V6 26 Están aumentadas las fuerzas que activan el ventrículo derecho, lo que aumenta el voltaje de R en V1-V2 y desvía el eje del QRS a la derecha ECOCARDIOGRAMA Imagen VV2 2 La ecocardiografía es muy útil (tanto para la IM aguda como para la crónica) para identificar la causa, valorar la gravedad y evaluar la progresión de la enfermedad al permitir calcular la función ventricular (por ejemplo, una FE < 30% debe alertarnos e intervenir rápidamente) y los volúmenes y diámetros ventriculares. Todos estos datos nos van a indicar la conducta que debemos seguir. En la IM severa, el ecocardiograma bidimensional mostrará dilatación y sobrecarga sistólica tanto de la AI, como del VI. Con esta técnica podemos ver las causas de la insuficiencia y las consecuencias hemodinámicas de la valvulopatía; aparte de poder valorar objetivamente la progresión de la enfermedad. Con el Doppler color se cuantifica el grado y la severidad de la IM, y se mide área regurgitante 28. Si los datos obtenidos con la técnica son insuficientes, podemos recurrir al ecocardiograma transesofágico, que nos ayuda a comprobar el estado valvular y decidir si 27 Imagen VV Veremos la imagen en mosaico, típica de la IM, a consecuencia de las turbulencias. J. A., P. F., M.C. Ruipérez 7
416 TEMA VV 2 CARDIOLOGÍA CMG hay que hacer una sustitución o una reparación válvula. 29 TRATAMIENTO 30 IM Aguda VENTRICULOGRAFÍA Imagen VV2 3 Actualmente se reserva para casos muy excepcionales, como es el caso de roturas de cuerdas tendinosas. Si la sobrecarga hemodinámica no es tolerada deberemos iniciar inmediatamente la cirugía (inserción de una prótesis valvular o reparación de la válvula). Si la sobrecarga es tolerada iniciaremos el tratamiento médico durante dos a cuatro semanas pero con casi toda seguridad el paciente acabará siendo sometido a cirugía. Esta demora de cirugía suele emplearse para tratar al paciente con antibióticos si existe un foco de endocarditis bacteriana activo (EBS) o para estabilizar al paciente en caso de que la IM aguda haya sido causada por un infarto agudo de miocardio (IAM). Recordad que toda IM aguda va a terminar irremediablemente en cirugía. En el tratamiento médico de la IM aguda es muy similar al que veremos para la IM crónica. En pacientes normotensos, hay que usar fármacos que favorezcan la salida de sangre hacia la aorta y de esa forma disminuyan el volumen regurgitante. Para ello podemos usar vasodilatadores potentes (fármacos que disminuyen la RVP o poscarga), como por ejemplo los IECAs. También podemos usar diuréticos para mejorar y disminuir la hipertensión venocapilar pulmonar o digitálicos por su acción ionotrópica positiva (mejoran la contractilidad). Si no podemos usar vasodilatadores por la hipotensión, tendremos que aplicar el balón de contrapulsación intraaórtico (BCIA) 31, que disminuye la poscarga y mejora el flujo anterógrado. IM Crónica Respecto al tratamiento médico, no está claro el uso de vasodilatadores en la IM asintomáticas. Si parece que son útiles en la IM sintomáticas los IE- CAs y otros vasodilatadores, ya que pueden mejorar el estado clínico del paciente al reducir la RVP Esquema VV En la siguiente imagen, obtenida mediante un ecocardiograma transesofágico, podemos apreciar el volumen de sangre que pasa del ventrículo izquierdo a la aurícula izquierda durante la contracción cardiaca. 30 Posible pregunta de examen. 31 El balón de contrapulsación intraaórtico está formado por un globo situado en la arteria aorta descendente (la implantación se realiza vía femoral), conectado a una consola que suministra gas (helio, normalmente) para su inflado y que controla su sincronía con el electrocardiograma. De esta forma, durante la sístole cardiaca el globo permanece desinflado (permitiendo la salida de sangre desde el ventrículo izquierdo a la aorta) y durante la diástole se produce el inflado del globo. La insuflación del globo durante la diástole tiene un efecto anterógrado (impulsa la sangre mejorando el gasto cardiaco) y otro retrógado (aumenta el flujo coronario). El desinflado también tiene un efecto anterógrado (disminuye las resistencias periféricas) y otro retrógado (disminuye el consumo de oxígeno miocárdico). J. A., P. F., M.C. Ruipérez 8
417 TEMA VV 2 CARDIOLOGÍA CMG (poscarga). Los diuréticos siguen siendo eficaces, y la digital está indicada en aquellos pacientes con IM severa e insuficiencia cardiaca. Igualmente está indicada en aquellos que estén en ACxFA, sin olvidar en estos pacientes la anticoagulación. Como en todas las valvulopatías, hay que hacer profilaxis antibiótica ante extracciones dentarias, etc., para prevenir la endocarditis. Los pacientes sintomáticos tienen indicación de cirugía (inserción de una prótesis valvular o reparación de la válvula). En los pacientes asintomáticos, la cirugía es aconsejable cuando la fracción de eyección del VI es inferior al 50-60%, el diámetro telesistólico es superior a 45 mm o el diámetro telediastólico es superior a 75 mm. La aparición de fibrilación auricular en una IM grave, la disfunción de ventrículo derecho o de hipertensión pulmonar superior a 50 mmhg son otros factores que inclinan a la cirugía en este grupo de pacientes (aunque es raro que estén asintomáticos si presentan estas alteraciones). En el resto de pacientes asintomáticos se deberá realizar un seguimiento periódico. Algunos factores que empeoran el pronóstico de la cirugía son: la presencia síntomas, presencia de disfunción ventricular, elevada edad del paciente, antecedentes de reparación, patología aguda Esquema VV2 8 J. A., P. F., M.C. Ruipérez 9
418 TEMA VV 2 CARDIOLOGÍA CMG INSUFICIENCIA MITRAL CONCEPTO La insuficiencia mitral (IM) se produce por el cierre inadecuado de la válvula mitral, lo que permite el paso retrógrado de sangre desde el ventrículo izquierdo (VI) a la aurícula izquierda (AI) durante la sístole ventricular. Se diferencian dos tipos: IM aguda e IM crónica (compensada o descompensada) ETIOLOGÍA FIOPATOLOGÍA IM aguda Disnea súbita, taquicardia ( ritmo de galope ) IM crónica Leve o moderada: asintomática, aspecto marfanoide, soplo sistólico... Severa compensada: tolerada varios años, cardiomegalia y signos electrocardiográficos, soplo holosistólico, S3 y auscultación dinámica (intensidad aumenta con ejercicio isométrico y disminuye con vasodilatadores). CLÍNICA Severa descompensada: signos de ICCI (congestión pulmonar y bajo gasto), palpitaciones (ACxFA) e ICD. Retumbo diastólico es SIGNO DE GRAVEDAD EXPLORACIONES COMPLEMTARIAS TRATAMIENTO J. A., P. F., M.C. Ruipérez 10
419 TEMA VV 3 CARDIOLOGÍA CMG VALVULOPATÍAS 3 PROLAPSO VALVULAR MITRAL INTRODUCCIÓN & CONCEPTO También conocido como síndrome de Barlow, síndrome del chasquido y soplo telesistólico, síndrome de la válvula mitral ondulante, es un síndrome bastante frecuente, pero muy variable en su presentación. El prolapso valvular mitral (PVM) consiste en un abombamiento de las valvas mitrales dentro de la aurícula izquierda (AI). Las valvas de la mitral, dentro de la AI, pueden coaptar perfectamente y no producir ninguna regurgitación (PVM silente), o no encajar los bordes valvulares y producir una insuficiencia mitral (PVM+IM). Según estudios ecocardiográficos en los que se utilizaron criterios diagnósticos estrictos la prevalencia del PVM es de un 2,4% en la población; siendo, por tanto, la anomalía cardiaca más prevalente. Aunque aparece en ambos sexos es más frecuente en mujeres 1 ; concretamente, es el doble de veces más frecuente en mujeres que en hombres. Afecta a personas de una amplia gama de edades, pero principalmente se diagnóstica entre los 14 y 30 años. Sin embargo, cuando se diagnóstica en paciente mayores de 50 años su pronóstico es peor, porque suelen tener asociada una IM grave. Es importante también saber que el PVM es la causa más frecuente de IM aislada. El PVM puede producir IM por dos mecanismos: a) Porque las valvas al prolapsar a la aurícula no coaptan perfectamente b) Porque la tensión excesiva de las cuerdas tendinosas y músculos papilares que se genera cuando la válvula prolapsa produce disfunción e isquemia de los músculos papilares y miocardio subyacente y predispone a la rotura de cuerdas y a la dilatación y calcificación del anillo valvular mitral; se genera de este modo un circulo vicioso. Este último mecanismo explicaría también la aparición de arritmias ventriculares en estos pacientes. Esquema VV3 1 1 Llego a ser diagnosticada en el 6% de las chicas jóvenes a las que se les realizaba una ecocardiografia. J. A., P. F., M.C. Ruipérez 1
420 TEMA VV 3 CARDIOLOGÍA CMG ETIOLOGÍA El PVM puede presentarse como una lesión primaria aislada, como una lesión asociada a enfermedades muy variadas, o puede ser debida a alteraciones ocurridas en deportistas o anoréxicas. Por lo tanto, la etiología del PVM puede ser: Primaria Secundaria a enfermedades Secundaria a alteraciones en deportistas o anoréxicas Se ha observado una mayor incidencia familiar de PVM aislada en algunos pacientes, lo que sugiere que pudiera tratarse de una enfermedad genética con herencia autosómica dominante. Algunas enfermedades a las que se asocia el PVM son: desproporción entre el tamaño del ventrículo izquierdo (que es excesivamente pequeño en estos pacientes 4 ) y el tamaño de la válvula mitral (que es normal); en tal situación, la disposición que adquieren las valvas no es la adecuada y prolapsan a la aurícula 5. AMPLIACIÓN DE CONTENIDO DE INTERÉS. La anatomía patológica en estos casos muestra un crecimiento anormal de las valvas de la mitral (especialmente de la posterior) y una sustitución de la matriz fibrosa de la valva (compuesta normalmente de tejido colágeno y elástico) por un tejido conectivo laxo (mixomatoso) rico en mucopolisacaridos ácidos. Adicionalmente, en las lesiones más severas, puede haber elongación de las cuerdas tendinosas, rotura de las mismas o engrosamiento de las valvas. Todas estas modificaciones van a deteriorar aún más la función del aparato valvular, por lo que la enfermedad va a retroalimentarse, entrando, como se ha dicho, en un patológico círculo vicioso. FIN DEL CONTENIDO AMPLIADO Enfermedades del tejido conectivo (síndrome de Marfan 2 ) Trastornos metabólicos (enfermedad de Hunter, de Fabry ) Síndromes de QT largo Cardiopatías congénitas. Como son la Enfermedad de Ebstein 3, comunicación interauricular (CIA). Mixomas. La válvula puede sufrir una degeneración. Se reconocen PVM, con mayor frecuencia que en la población general, en pacientes con anorexia y en deportistas. Para los pacientes con anorexia, y para otras de las enfermedades de las anteriormente mencionadas, se postula como posible mecanismo la existencia de una 2 En los pacientes afectados por este síndrome se diagnóstica casi en un 90% de los casos PVM. 3 Es una anomalía cardiaca congénita que afecta, principalmente, a la válvula tricúspide y, por tanto, la explicaremos en ese tema. 4 Que él VI es excesivamente pequeño en pacientes anoréxicos es lógico, pero y en los deportistas no debería ser más grande? Así es, lo que ocurre es que el tamaño sístolico del VI es relativamente menor. El corazón de los deportistas, por la hipertrofia que sufre, es mucho más efectivo y en una contracción expulsa mucha más sangre que en las personas normales (pensad, por ejemplo, la cantidad de sangre que expulsaba el corazón de Miguel Indurain para tener 28 latidos por minuto en reposo). Si expulsa más sangre quiere decir que su volumen se reduce más de lo normal 5 Recordad este dato: ventrículo pequeño -> PVM porque, como veremos más adelante, las maniobras que disminuyen el volumen del ventrículo predisponen al prolapso. J. A., P. F., M.C. Ruipérez 2
421 TEMA VV 3 CARDIOLOGÍA CMG Las manifestaciones clínicas van desde pacientes totalmente asintomáticos (la mayoría de los casos), hasta pacientes con clínica florida (sobre todo, si presentan algún grado de IM). Dicha clínica consiste en ansiedad excesiva, dolor torácico, cansancio y, si tienen IM severa, los relacionados con esta patología. Ansiedad, dolor torácico inespecífico, cansancio son síntomas neuropsiquiátricos que se han relacionado con la disfunción del sistema nervioso autónomo que sufren estos pacientes (concretamente sufren un aumento del tono simpático adrenérgico con aumento de secreción de catecolaminas (adrenalina)). Aunque es poco frecuente, también pueden padecer síncopes, presíncopes o mareos y palpitaciones por arritmias ventriculares 6. Las palpitaciones también pueden deberse a arritmias supraventriculares (ACxFA como vimos en la IM) o al síndrome Wolf-Parkinson-White (WPW) 7, ya que estos pacientes presentan cierta predisposición a padecerlo. DIAGNÓSTICO Esquema VV3 2 Cuando comienza la contracción (y por tanto, reducción de tamaño) del VI, se llega a un punto crítico en el que se produce el prolapso. Aparece entonces un clic proto-, meso- o telesistólico, seguido de un soplo sistólico si hay regurgitación mitral. Este signo auscultatorio, junto a la demostración del PVM mediante ecocardiografía, son los PRINCIPALES CRITE- RIOS DIAGNÓSTICOS. Se ha relacionado PVM y muerte súbita; aunque realmente es algo poco frecuente. Los datos encontrados indican que el prolapso aumenta ligeramente la incidencia de muerte súbita, sobre todo en aquellos pacientes con IM grave. También se ha identificado que este riesgo está presente cuando hay arritmias ventriculares complejas, QT largo y síncopes. Los pacientes con PVM tienen mayor riesgo de embolias y pueden padecer accidentes isquémicos cerebrales transitorios (AIT), amaurosis fugaces 8 y/o embolismos en la arteria central de la retina. Al parecer, este embolismo es consecuencia de la alteración de la válvula mixomatosa que inicia la agregación plaquetaria y la formación de pequeños trombos. ANAMNESIS Esquema VV3 3 6 Por qué? El mecanismo por el cual estos pacientes pueden padecer arritmias ventriculares fue comentado anteriormente. 7 Enfermedad congénita cardiaca que se incluye dentro de los denominados síndromes de preexcitación y que se caracteriza por la presencia de arritmias cardiacas. 8 Ceguera parcial transitoria que afecta a un solo ojo (monocular). J. A., P. F., M.C. Ruipérez 3
422 TEMA VV 3 CARDIOLOGÍA CMG cicio isométrico, fármacos que elevan las RVP ) o disminuyen la contractilidad retrasan dichos fenómenos hasta hacerlos incluso desaparecer. Esquema VV3 4 EXPLORACIÓN FÍSICA En la exploración física tenemos habitualmente un peso corporal bajo y hábito asténico. Algunos estereotipos, relacionados con determinadas enfermedades, pueden orientarnos hacia esta patología, como son los que presentan los pacientes con síndrome de Marfan, síndrome de espalda recta o tórax en quilla. Estos pacientes suelen presentar hipotensión arterial ortostática. La auscultación, que ya ha sido en parte comentada, muestra un chasquido o clic proto-, meso- o telesistólico a lo largo del borde esternal izquierdo, seguidos o no de un soplo proto-, meso- o telesistólico de morfología creciente. La duración del soplo determina la gravedad de la regurgitación: a mayor duración mayor gravedad. Esta auscultación es muy variable y presenta una vez sólo chasquido, otra el soplo, otra el chasquido y el soplo y otra no escuchamos nada. La auscultación dinámica tiene mucho valor en esta enfermedad. Todas aquellas maniobras que reducen el volumen del VI 9 (maniobra de Valsalva, adoptar posición ortostática, inhalar nitrito de amilo ) o aumentan la contractilidad del VI predisponen al prolapso de la válvula mitral y acercan los fenómenos auscultatorios, chasquido y soplo, al primer ruido cardiaco (S1). Por el contrario, las maniobras que aumentan el volumen del VI (ejer- 9 Ver nota al pie 4. Esquema VV3 5 PRUEBAS COMPLEMENTARIAS Electrocardiograma: es una técnica muy inespecífica para el diagnóstico de PVM. Suele ser normal, y en algunos casos observamos ondas T negativas en derivaciones II, III y avf 10. Radiología de tórax: también es muy inespecífica para el diagnóstico de PVM. El tamaño del corazón es normal y sólo en caso de IM severa podremos observar los signos radiológicos que describimos en el tema correspondiente. Ecocardiograma: es el método ideal para el diagnóstico y valoración del PVM. Permiten el diagnóstico de PVM silentes y con IM asociada. También el 10 Pueden contemplarse también arritmias auriculares y ventriculares bajo la forma de extrasístoles y taquicardias. La más común es la taquicardia auricular paroxística, sobre todo si está asociada a un WPW. J. A., P. F., M.C. Ruipérez 4
423 TEMA VV 3 CARDIOLOGÍA CMG ecocardiograma nos es útil para identificar las anomalías de las valvas 11, tales como su elongación, engrosamiento y textura. Igualmente el Doppler color, nos sirve para valorar y cuantificar la IM (en la imagen se verá un mosaico de colores en el orificio mitral que nos indican las diferentes direcciones de la sangre) HISTORIA NATURAL & PRONÓSTICO Generalmente, el pronóstico de esta enfermedad suele ser benigno y la mayoría de los pacientes no tiene complicaciones importantes (sobre todo en niños y asintomáticos). Hay una minoría de pacientes que desarrollan IM grave (sobre todo varones mayores de 50 años), endocarditis bacteriana (por lo que la profilaxis será la norma), embolismos arteriales (ACV, amaurosis fugaz, embolismo retinianos el infarto agudo de miocardio (IAM) por embolismo de coronarias es muy poco frecuente) y muerte súbita (sobre todo si la IM es severa). Imagen VV3 1 En aproximadamente un 15% de los pacientes la IM es progresiva y llega a ser grave en un período superior a 10 años. Otras técnicas: existen otras dos técnicas más a nuestro alcance para dilucidar los dolores torácicos de estos paciente: la gammagrafía de esfuerzo y la angiografía coronaria. Esquema VV3 7 TRATAMIENTO Esquema VV En la imagen VV3-1 podemos apreciar un PVM secundario a una rotura de las cuerdas 1) Aquellos pacientes asintomáticos, sin arritmias ni IM, deben ser aconsejados e informados de que su enfermedad tienen un excelente pronóstico (y así evitar aumentar la ansiedad que suelen padecer) y de que deben hacer una vida normal con revisiones periódicas cada 2 a 5 años. 2) Ante el riesgo de EBS ya hemos comentado la necesidad de profilaxis antibiótica. 3) Los betabloqueantes (para disminuir tono simpático) son la base del tratamiento en J. A., P. F., M.C. Ruipérez 5
424 TEMA VV 3 CARDIOLOGÍA CMG aquellos pacientes con taquicardias y dolores torácicos inespecíficos. El uso habitual de ansiolíticos también nos puede ser útil. 4) La antiagregación y anticoagulación es controvertida. Si sufre arritmias y/o tiene antecedentes de ACV se recomienda la anticoagulación. Si padece IM asociada se recomienda la antiagregación con ácido acetil salicílico (AAS). 5) Sí los pacientes presentan arritmias o episodios de síncope deben ser estudiados mediante dispositivos Holter. 6) Si padece de IM asociada se recomiendan la optimización de la poscarga mediante el empleado adecuado de IECAs. Hablamos de optimización porque sabemos que debemos reducir la poscarga para minimizar la IM pero, por otro lado, si la reducimos demasiado el tamaño ventricular caerá excesivamente y predispondremos al paciente al PVM. 7) Sí la IM asociada es grave el paciente será intervenido quirúrgicamente. Las técnicas disponibles son la reparación valvular y la sustitución protésica (prótesis biológica o metálica). Se tiende a escoger inicialmente la reparación (ya que la prótesis biológica degenera a los 10 años y la metálica obliga a la anticoagulación con dicumarínicos de por vida), sin embargo es importante conocer que en el 15% de las reparaciones, el proceso degenerativo que sufre la válvula obliga aproximadamente a los 5 años a la sustitución definitiva. Además, en determinadas enfermedades en las que la válvula está muy deteriorada (degeneración mixomatosa, por ejemplo) debemos practicar la sustitución ya de inicio. La siguiente tabla pretende resumir algunas de las pautas que acabamos de comentar en función del riesgo del paciente: Esquema VV3 8 J. A., P. F., M.C. Ruipérez 6
425 TEMA VV 3 CARDIOLOGÍA CMG PROLAPSO DE VÁLVULA MITRAL OTROS NOM- BRES COCEPTO ETIOLOGÍA CRITERIS DIAG- NÓSTICOS Síndrome de Barlow, síndrome del chasquido y soplo telesistólico, síndrome de la válvula mitral ondulante Abombamiento de las valvas mitrales en la aurícula izquierda. Las valvas pueden coaptar perfectamente o no (PVM+IM). Cardiopatía muy frecuente. Mujeres (2:1). A partir de 50 años se suele presentar asociada a IM. Causa más frecuente de IM aislada. Enfermedad genética con herencia autosómica dominante. Asociado a síndrome de Marfan, trastornos metabólicos (Hunter, Fabry ), síndrome de QT largo, enfermedad de Ebstein, CIA, degeneración mixoide Deportistas y anoréxicos por desproporción entre tamaño ventricular y tamaño valvular. Auscultación de soplo y demostración ecocardiográfica ANAMNESIS EXPLORACIÓN FÍSICA Bajo peso, asténico, Marfan, tórax en quilla, hipotensión ortostática EXPL. COMPL. ECG RXT ECOCARD Inespecífico. Normal u ondas T negativas en II, III y avf Inespecífica. Semiología de IM si aparece asociada. METODO IDEAL PARA DIAGNOSTICO Y VALORACIÓN DE PVM. Diagnóstico de PVM silentes o PVM+IM. Identificación de anomalías en valvas. Cuantificación de IM (Doppler color) PRONÓSTICO Y TRATAMIENTO J. A., P. F., M.C. Ruipérez 7
426
427 TEMA VV 4 CARDIOLOGÍA CMG VALVULOPATÍAS 4 ESTENOSIS AÓRTICA CONCEPTO La estenosis aórtica (EA) es la situación clínicopatológica que deriva de la obstrucción del tracto de salida de la sangre del ventrículo izquierdo (VI). Lo más frecuente es que dicha obstrucción se localice a nivel valvular (EA valvular). Sin embargo, hay otras situaciones donde la obstrucción se localiza inmediatamente por encima del plano valvular (EA supravalvular 1 ) y otras por debajo (EA subvalvulares, estenosis subaórticas o infundibulares). Estas últimas, dependiendo de su substrato anatomopatológico, pueden ser subaórticas fibrosas 2 (el substrato de la obstrucción son rodetes fibrosos) o subaórticas dinámicas (el substrato de la obstrucción es de tipo muscular). El área valvular aórtica normal es de 2 a 5 cm 2. Si la reducción es de hasta 1,2 cm 2, hablamos de EA leve, entre 1,2 y 0,8 cm 2 de EA moderada y si es menor de 0,8 cm 2 de EA severa. Actualmente se tiene a hablar de EA crítica cuando el área es menor de 0,5 cm 2. En la siguiente tabla encontramos otros parámetros que se utilizan para estratificar la EA. Esquema VV4 2 Esquema VV4 1 1 La estenosis supravalvular suele presentarse como una cardiopatía congénita ( Estenosis supravalvular aórtica congénita ) asociada al Síndrome de Williams. En la maravillosa comisión de Pediatría podéis encontrar más información sobre esta enfermedad genética. 2 Al final del tema resumiremos algunas peculiaridades sobre esta entidad que se comentaron en clase brevemente. Imagen VV4 1 J. A., P. F., M.C. M.J.S. Ruipérez 1
428 TEMA VV 4 CARDIOLOGÍA CMG ETIOLOGÍA La etiología de la EA puede ser congénita o adquirida. EA VALVULARES CONGÉNITAS Anatomopatológicamente, las EA valvulares congénitas, en función del número de valvas, pueden ser de tres tipos: Válvula tricúspide: las comisuras no se forman correctamente y queda en su lugar un pequeño reborde. El orificio puede ser central o estar desplazado (excéntrico). a estenosis. El tiempo medio para que llegue a ser severa es de unos 8 años. Lógicamente, la prevalencia aumentará con la edad, siendo su prevalencia de un 2 a un 4% en la población mayor de 65 años. Una serie de factores de riesgo han sido asociados a la degeneración aórtica, por ejemplo, edad avanzada, sexo masculino, tabaco, hipercolesterolemia, diabetes mellitus (DM), hipertensión arterial (HTA), IRC, enfermedad de Paget e hiperparatiroidismo, entre otros. Dado los factores de riesgo, es fácil entender que la EA es una enfermedad más prevalente en países desarrollados que en vías de desarrollo. La EA en pacientes mayores de 50 años, sobre todo varones, suele presentarse asociada a cardiopatía coronaria y por ello es obligatorio en estos pacientes practicar una coronariografía cuando se les opera de estenosis aórtica, para evaluar el estado de la arterioesclerosis. Otras formas de EA adquirida son las EA reumáticas 4 (en las que se produce fusión de las comisuras de las valvas), y resultan más raras las EA reumatoides (por ejemplo, las producidas por la artritis reumatoide y las asociadas a hiperlipidemia homocigótica tipo II) Imagen VV4 2 Válvula bicúspide: encontramos dos rebordes y un agujero (central o excéntrico). Suele ser asintomática durante muchos años, pero se puede ir calcificando poco a poco, produciendo estenosis aórtica severa calcificada en la edad adulta. Se suele asociar a coartación aórtica. 3 Válvula unicomisural: en la que sólo hay una abertura elíptica hacia un extremo de la válvula. EA VALVULARES ADQUIRIDAS Dentro del grupo de las EA adquiridas, la más frecuente es la de etiología degenerativa. La enfermedad degenerativa de la válvula aórtica constituye un proceso de envejecimiento en el colágeno debido, principalmente, al estrés mecánico que lleva a la calcificación y a la estenosis valvular. Este proceso está relacionado con la edad, así en un 16% de los casos, la esclerosis valvular aórtica progresa 3 Recordad que la válvula aórtica bicuspídea era un factor de riesgo importante en las disecciones aórticas. Esquema VV4 3 FISIOPATOLOGÍA La resistencia a la salida de la sangre del VI produce una sobrecarga de presión del mismo. Las presiones van a ir aumentando conforme va progresando la enfermedad e, igualmente, irá desarrollándose un gradiente valvular aórtico cada vez 4 En la era pre-antibiótica eran las más frecuentes. J. A., P. F., M.C. M.J.S. Ruipérez 2
429 TEMA VV 4 CARDIOLOGÍA CMG mayor. El paso de la sangre a través de la válvula estenótica produce un flujo turbulento que se manifiesta con la aparición de un soplo sistólico eyectivo que podremos palpar en la superficie corporal como un frémito o thrill sistólico. La sobrecarga de presión provoca una hipertrofia con aumento del grosor de la pared ventricular izquierda, esto es, se produce una hipertrofia ventricular izquierda concéntrica (HVIc), que trae consigo una reducción de la distensibilidad ventricular con restricción del llenado ventricular. La dificultad en el llenado ventricular aumenta la necesidad de contracción auricular izquierda 5 para contribuir al mismo. La HVI requiere más oxígeno para cubrir sus demandas metabólicas (aumento de demandas) y produce también una disminución del flujo sanguíneo coronario diastólico (descenso de aporte). El VI suele mantener durante bastante tiempo la contractilidad adecuada 6, hasta una edad muy avanzada pero una vez superada la reserva contráctil, se produce una disfunción sistólica con posterior dilatación ventricular y aparecen los síntomas. CLÍNICA ANAMNESIS En la historia natural de la enfermedad destaca la aparición tardía de los síntomas; durante este tiempo va aumentando progresivamente la estenosis y el gradiente. Los primeros síntomas aparecen, aproximadamente, en la 6ª a 7ª décadas de la vida 7, que es cuando disminuye el volumen eyectado. Las manifestaciones clínicas más importantes son la angina de pecho, los mareos y síncopes, la disnea de esfuerzo y la caída en insuficiencia cardiaca. La angina es el síntoma más frecuente en las EA críticas. Aproximadamente la padecen las dos terceras partes 8 de los pacientes, de los cuales el 50% no tiene lesiones arterioescleróticas coronarias significativas. Estos pacientes, de no tratarse quirúrgicamente, no suelen sobrevivir más de 5 años. La angina aparece por un desequilibrio entre las necesidades miocárdicas y el aporte de oxígeno por las coronarias. También puede aparecer angina por la presencia de lesiones arterioescleróticas en las coronarias y todavía es menos frecuente la angina debida a embolismo de calcio 9 en las coronarias. El síncope es ortostático y de esfuerzo. Es debido a la reducción de flujo sanguíneo cerebral que se produce durante el esfuerzo, ya que aquí la presión arterial disminuye como consecuencia de la vasodilatación periférica, y el gasto cardiaco permanece fijo por la obstrucción 10. Estos síncopes suelen tener pródromos y limitan la supervivencia a unos 3 años si no se tratan. Si suceden en reposo, hay que pensar que puedan ser debidos a arritmias ventriculares o a la aparición de bloqueo auriculoventricular de alto grado. La disnea es la expresión del aumento de la presión venocapilar pulmonar (PVCP). Este aumento se produce cuando se establece la insuficiencia cardiaca izquierda (ICI), es decir, cuando se produ- Esquema VV4 3 5 Por ello, si uno de estos pacientes entra en fibrilación auricular, el pronóstico empeora. 6 El volumen telesistólico es normal hasta fases tardías. 7 Posteriormente veremos que cada etiología tiene su particular periodo de presentación. Estos datos se refieren a la edad más frecuente de aparición de síntomas en general. 8 66% para los amantes de los porcentajes. 9 Más adelante veremos porque se producen émbolos cálcicos. 10 La obstrucción que representa la estenosis impide que se pueda elevar el gasto cardiaco. En las EA severas, el síncope ha sido atribuido también a la aparición de reflejos anormales (reflejo de Bezold-Jarisch) facilitados por la vigorosa contracción ventricular. J. A., P. F., M.C. M.J.S. Ruipérez 3
430 TEMA VV 4 CARDIOLOGÍA CMG ce la disfunción ventricular (en este momento, empieza a aumentar el volumen telesistólico porque el VI no bombea todo lo que le llega). Puede presentarse desde grandes esfuerzos hasta mínimos y también como disnea de decúbito, disnea paroxística nocturna (DPN) o edema agudo de pulmón (EAP). La presencia de este síntoma es de mal pronóstico, ya que de no intervenir quirúrgicamente, ensombrece el pronóstico a dos años 11. La auscultación, en mesocardio 14 y principalmente en el foco aórtico, muestra un clic o chasquido protosistólico 15 en aquellos pacientes con valvas móviles y no calcificadas. Este clic se ausculta fundamentalmente en las EA congénitas y no se escucha en las degenerativas (porque se calcifican con la edad; si acaso, lo auscultaremos en jóvenes). El primer ruido (S1) suele ser normal. Después de un mínimo espacio de tiempo se presenta el comentado clic seguido de un soplo sistólico expulsivo, romboidal 16 con máxima localización en ápex, en algunos casos, y en otros en foco aórtico. Mientras mayor sea la duración del soplo más grave será la EA porque más tiempo tardará en desaparecer el gradiente; así si el soplo es protosistólico la EA será ligera, si es protomesosistólico será moderada y si es holo- o protomesotelesistólico será grave 17. El componente aórtico del segundo ruido (S2(A)) esta disminuido o abolido 18. El soplo sistólico se irradia a las carótidas 19. Si aparece insuficiencia ventricular izquierda (IVI), al disminuir el gradiente, el soplo sistólico es más débil e incluso puede desaparecer. Todas las maniobras que disminuyan las RVP (inhalar nitrito de amilo, permanecer tiempo en bipedestación, fase de esfuerzo de la maniobra de Valsalva, etc ) aumentan el soplo 20. La intensidad del soplo va a modificarse dependiendo de la duración de la diástole o llenado ventricular; así, con diástoles largas aumenta y lo contrario sucede con diástoles cortas; lo observamos, por ejemplo, si hay fibrilación auricular o extrasístoles. Esquema VV4 4 EXLORACIÓN FÍSICA La palpación de la cara anterior del hemitórax izquierdo muestra un latido apical sostenido, sin desplazamiento del corazón 12. En el foco aórtico, y a veces en carótidas, se palpa un frémito o thrill sistólico, trasmisión del soplo sistólico eyectivo. El pulso radial es pequeño y tardío, pulso parvus et tardus Qué poético, no? 12 Por qué no se desplaza? Porque la hipertrofia es concéntrica y el VI, hasta fases muy avanzada, no crece de tamaño. 13 Por qué? El pulso es pequeño, es decir, tiene poca presión diferencial, porque la estenosis no permite el aumento de la presión sistólica y es tardío, es decir,el ascenso de presión es lento, porque la salida de sangre se produce poco a poco (conforme la disminución del tamaño ventricular va elevando lo suficiente la presión como para vencer la estenosis) 14 El mesocardio es un foco accesorio de auscultación que se localiza en el borde inferior esternal izquierdo. 15 Es un clic de apertura de la válvula aórtica. 16 Por qué? Es romboidal (crecento-decrecento) porque la velocidad de la sangre depende del gradiente (que es la fuerza impulsora ). Al principio este gradiente aumenta porque el ventrículo se contrae y la sangre sale cada vez más rápida, pero llegados a un punto, el gradiente comienza a disminuir, porque el ventrículo se vacía, y la sangre comienza a disminuir su velocidad. 17 Esto también se puede establecer para la cúspide del soplo o punto donde pasa de ser creciente a decreciente; mientras más alejado este del chasquido más grave será la EA. 18 Por qué? Al estar reducido el movimiento de las valvas aórticas (por la fusión de comisuras fundamentalmente) el cierre es mucho menos brusco. 19 Por qué? Porque la sangre tenía esa dirección cuando salió del ventrículo y adquirió su vibración. Los soplos mitrales, por el contrario, suelen irradiarse a la axila izquierda o a la espalda. 20 Por qué? Porque aumentamos el gradiente al disminuir la presión aórtica. Recordemos que el gradiente es la diferencia entre la presión del VI y la de aorta. J. A., P. F., M.C. M.J.S. Ruipérez 4
431 TEMA VV 4 CARDIOLOGÍA CMG PRUEBAS COMPLEMENTARIAS ELECTROCARDIOGRAMA Esquema VV4 5 COMPLICACIONES / RIESGOS ASOCIADOS La endocarditis bacteriana (EBS) es una complicación frecuente de la EA; así como las embolias cálcicas, que suelen producirse por el desprendimiento de las calcificaciones que se producen sobre zonas de degeneración de la válvula aórtica. La muerte súbita (MS) entra en el cuadro clínico de esta valvulopatía y suele darse en pacientes sintomáticos y con otras patologías cardiacas asociadas. Otra complicación de la EA severa es la aparición de arritmia completa por fibrilación auricular (ACxFA) y de las EA muy severas, la hipertensión pulmonar y la hipertensión venosa sistémica. También se ha asociado EA con hemorragias digestivas 21, aunque es algo muy poco frecuente. Lo más frecuente dentro de las alteraciones electrocardiográficas es el crecimiento ventricular izquierdo con sobrecarga sistólica 22 que se observa casi en el 85% de los pacientes con EA severa. Los descensos del ST indican sobrecarga de presión severa. Bien por infiltración fibrosa, bien por infiltración cálcica del sistema de conducción, situado en la cámara de salida del VI, podremos observar trastornos de la conducción interventricular, principalmente hemibloqueo anterior o bloqueo completo de rama izquierda del haz de Hiss. La presencia de crecimiento auricular izquierdo indica problemas en la distensibilidad o dificultad de llenado ventricular izquierdo y es un signo de severidad de la EA. La presencia de arritmia completa por fibrilación auricular (ACxFA) es rara en esta valvulopatía, por este motivo, si la encontramos, debemos descartar la coexistencia de una lesión mitral (estenosis o insuficiencia). RADIOLOGÍA DE TÓRAX El corazón puede tener tamaño normal traducción de la hipertrofia concéntrica del VI. La aorta ascendente suele estar dilatada 23. La dilatación ventricular (cardiomegalia) puede ser la expresión de la IVI que aparece con el tiempo. Es frecuente la presencia de calcificación valvular aórtica. ECOCARDIOGRAMA Esta técnica es muy útil para detectar el estado de la válvula y si esta calcificada o no. Con Doppler podemos calcular el gradiente, el área valvular y la disfunción ventricular sistólica 24. Con estos datos se puede conocer la severidad de la EA (tabla inicial) y hacer el seguimiento necesario de los pacientes para indicar el momento de la cirugía. Esquema VV En la bibliografía se menciona que la EA predispone a la angiodisplasia de colón (malformación de vasos sanguíneos del colon). 22 Recordad los criterios del patrón de hipertrofia ventricular izquierda (Criterios de Cornell y de Sokolow-Lyon). En el tema HTA-5 tenéis ejemplos de HVI. 23 Dilatación postestenótica 24 La disminución de la función sistólica hace que, en presencia de estenosis severas, los gradientes sean menores (porque la presión ventricular se eleva menos). J. A., P. F., M.C. M.J.S. Ruipérez 5
432 TEMA VV 4 CARDIOLOGÍA CMG HISTORIA NATURAL La EA severa puede estar asintomática muchos años. Estos pacientes suelen presentar síntomas en etapas tardías de la evolución de la enfermedad. La obstrucción valvular es progresiva y lenta. Como ya dijimos, cuando los pacientes desarrollan angina de pecho, síncope o disnea, la supervivencia es muy limitada. El estado de la función ventricular se relaciona inversamente con la supervivencia. Por otro lado, la etiología guarda relación con la edad de comienzo de los síntomas. Así, una EA por calcificación de una aorta bicúspide puede ser sintomática entre los 50 y 60 años. Las EA degenerativas dan síntomas a partir de los 70 a 80 años, y si la etiología es reumática, la sintomatología es más precoz, y los pacientes suelen se sintomáticos sobre los 30 a 40 años. Imagen VV TRATAMIENTO HEMODINÁMICA CORONOARIOGRAFÍA Como ya comentamos, es obligatoria en los pacientes mayores de 50 años por la asociación entre EA y arteriopatías coronarias 26. Esquema VV En esta serie de Ecocardiogramas podemos apreciar la calcificación de una válvula aórtica estenótica (arriba), así como el flujo turbulento anormal que ésta va a presentar en sístole ventricular (abajo). 26 Casi el 80% de las EA graves se acompañan de problemas coronarios. Los pacientes asintomáticos deben ser sometidos a tratamiento profiláctico para evitar la endocarditis bacteriana. En las EA severas debe desaconsejarse la realización de esfuerzos físicos intensos. Son muy importantes las revisiones periódicas, dado que el área valvular disminuye y los gradientes 27 aumentar progresivamente con el tiempo. El tratamiento médico tiene poco que hacer en los pacientes asintomáticos pero sí puede ser útil en los sintomáticos. Si aparece ACxFA debe efectuarse tratamiento de la misma con digitálicos (si es de comienzo reciente y el paciente está anticoagulado puede intentarse la cardioversión eléctrica) ya que la pérdida de la contribución auricular al llenado ventricular ocasiona aumento de su sintomatología. Los diuréticos son beneficiosos cuando se produce acumulación de líquidos, pero deben usarse con mucha precaución, ya que la hipovolemia reduce el gasto cardiaco con las consecuencias que de ello derivan, por lo que no se suelen aconsejar. Están contraindicados los betabloqueantes ya que disminuyen la contractilidad. Las estatinas, a dosis muy altas, presentan propiedades antiinflamatorias que pueden frenar la evolución de la degeneración valvular. Los IECAs, a 27 Aumentan 4 a 8 mmhg al año. J. A., P. F., M.C. M.J.S. Ruipérez 6
433 TEMA VV 4 CARDIOLOGÍA CMG dosis pequeñas, se emplean en pacientes con cardiopatía isquémica o insuficiencia cardiaca congestiva (ICC). Las indicaciones quirúrgicas se dividen en: a) Absolutas: síntomas con FE > 20% o sin síntomas con FE < 50%, y b) Relativas: FE <20% (porque la mortalidad se encuentra entre el 30 y 40% en la intervención) El tratamiento quirúrgico consiste en la sustitución quirúrgica de la válvula bajo circulación extracorpórea. Recientemente se ha empezado utilizar una nueva técnica, la sustitución valvular percutánea, que consiste en realizar una valvuloplastia con balón a través de un catéter insertado por la femoral y sustituir la válvula por una prótesis. Esta técnica se utiliza para ese grupo de pacientes con una baja FE (< 20%) y para pacientes añosos (>80 años) o con patologías respiratorias asociadas. La mortalidad quirúrgica es del 2 al 5% 28 para pacientes de menos de 70 años, del 8 al 10% para pacientes de 70 a 80 años y del 20% para pacientes mayores de 80 años. Por otra parte, la supervivencia de los pacientes con EA severa y sintomática que rechazaron el tratamiento quirúrgico no ha sido superior al 15% a los 5 años de iniciar los síntomas. Esquema VV Juraría que este es el primer porcentaje que aparece en todo el tema J. A., P. F., M.C. M.J.S. Ruipérez 7
434 TEMA VV 4 CARDIOLOGÍA CMG ESTENOSIS AÓRTICA La EA es la situación clínicopatológica que deriva de la obstrucción del tracto de salida de la sangre del ventrículo izquierdo (VI). Se diferencia tres tipo: valvular, supravalvular y subvalvular (fibrosa o dinámica) CONCEPTO ETIOLOGÍA Y FISIOPATOLOGÍA EA congénitas: tricúspides, bicúspides o unicomisurales. EA adquiridas: a) Degenerativa (factores de riesgo: edad (>65 años), sexo masculino, tabaco, hipercolesterolemia, diabetes mellitus (DM), hipertensión arterial (HTA), IRC, enfermedad de Paget e hiperparatiroidismo ). b) Reumáticas c) Reumatoides (artritis reumatoide y asociada a hiperlipidemia homocigótica tipo II). CLINICA, EXPLORACIÓN FÍSICA Y COMPLICAIONES Complicaciones: EBS, embolias cálcicas, muerte súbita, ACxFA, hemorragias digestivas J. A., P. F., M.C. M.J.S. Ruipérez 8
435 TEMA VV 4 CARDIOLOGÍA CMG EXPLORACIONES COMPLEMTARIAS Y TRATAMIENTO J. A., P. F., M.C. M.J.S. Ruipérez 9
436 TEMA VV 4 CARDIOLOGÍA CMG ESTENOSIS SUBA- ÓRTICA FIBROSA Es una enfermedad de etiología congénita que afecta principalmente a mujeres (relación con varones 2:1). El tratamiento es el mismo que el comentado, pero presenta ciertas peculiaridades: 1) En la auscultación no encontramos el chasquido de apertura; y el soplo es diastólico. 2) No se produce calcificación valvular; 3) En la radiología podemos apreciar dilatación aórtica; y 4) Para su diagnóstico se utiliza el ecocardiograma y el cateterismo. J. A., P. F., M.C. M.J.S. Ruipérez 10
437 TEMA VV 5 CARDIOLOGÍA CMG VALVULOPATÍAS 5 INSUFICIENCIA AÓRTICA AGUDA Vs CRÓNICA La insuficiencia aórtica (IAo) es una situación patológica en la que se produce una regurgitación de sangre de la aorta al ventrículo izquierdo (VI). Su etiología es muy variada y suelen intervenir en ella la afectación valvular por distintos motivos y la pérdida de soporte comisural 1. En los últimos años han aumentado los pacientes con IAo por pérdida del soporte comisural debida a una enfermedad de la raíz aórtica, representando casi el 50% de los operados por esta patología. Por su forma de presentación, la IAo se clasifica en: Insuficiencia aórtica aguda. Insuficiencia aórtica crónica. IAo AGUDA CONCEPTO La insuficiencia aórtica aguda (IAoA) es una situación patológica en la que se produce un paso súbito diastólico de un gran volumen de sangre desde la aorta a un VI normal o poco distensible. La IAoA constituye una situación médica muy grave, debido a la imposición súbita de una gran carga de volumen a un VI no preparado para ello. Esquema VV5-1 Figura VV5-1 1 Alteración de estructuras que dan soporte al aparato valvular del corazón J. A., P. F., M.C. Ruipérez 1
438 TEMA VV 5 CARDIOLOGÍA CMG ETIOLOGÍA Las causas de IAoA suelen ser pocas. Lo más frecuente es que la IAoA sea debida a: 1) Endocarditis bacterianas (EBS) 2) Traumatismos torácicos 3) Disección aguda de la aorta ascendente. En el primer caso la IAoA sería secundaria a una anomalía valvular, mientras que en los restantes estaría causada por una pérdida de soporte comisural. 1º - ESTABLECIMIENTO DE LA IAOA Cuando se establece la insuficiencia valvular, la sangre expulsada a la aorta durante la sístole, retorna bruscamente al VI durante la diástole. Esta sangre regurgitada constituirá el volumen regurgitante (VR) y se sumará al volumen que llena el ventrículo desde la aurícula. Nos encontraremos con un volumen de llenado ventricular o volumen telediastólico (VTD) aumentado. Además, debemos tener presente que ese VR se restará al volumen que, desde la aorta, avanzaría hacia las arterias. Ese volumen, denominado volumen sistólico anterógrado efectivo (VSAE), estará disminuido. Podemos hablar por tanto de dos tipos de consecuencias: a) Consecuencias retrógradas: como partimos de una situación aguda en la que la distensibilidad ventricular es baja (normal), pequeños incrementos del VTD, elevarán de forma notable la presión telediastólica (PTD) o precarga. Esquema VV5-2 b) Consecuencias anterógradas: disminución del volumen sistólico anterógrado efectivo (VSAE). El VSAE sería la diferencia entre el volumen latido (VL) y el VR. 2º - INTENTO DE COMPENSACIÓN FISIOPATOLOGÍA 2 Para sistematizar el estudio de la evolución fisiopatológica de la IAoA vamos a establecer tres fases: 1) Establecimiento de la IAoA. 2) Intento de compensación por parte del organismo (si la IAoA es muy severa esta fase es prácticamente inexistente). 3) Descompensación. El descenso del VSAE estimula la taquicardia compensadora 3 gracias a la cual se consigue mantener el gasto cardiaco (GC) efectivo 4. El GC también se mantiene gracias al aumento de la fuerza contráctil del miocardio. Este aumento de contractilidad es estimulado por el mecanismo de Frank-Starling (por aumento de la precarga o PTD) y por el SNS. Es muy importante entender que, al tratarse de una situación aguda, NO encontraremos hipertrofia ventricular izquierda (que si aparecerá en la IAoC). 2 La evolución fisopatológica no se explico en clase (sería por tanto contenido ampliado, aunque figura como contenido normal al ser considerado importante de cara a entender más rápidamente los siguientes apartados). En clase sí se explico el último apartado; las consecuencias hemodinámicas 3 La caída del VSAE produce hipotensión. La hipotensión estimula los baroreceptores que, a través del SNS, producen taquicardia. 4 Entendemos efectivo como el GC que realmente perfunde los órganos, porque parte de la sangre que bombea el corazón regresa al mismo. El GC total estaría realmente aumentado. J. A., P. F., M.C. Ruipérez 2
439 TEMA VV 5 CARDIOLOGÍA CMG 3º - DESCOMPENSACIÓN Con la evolución de la enfermedad esta compensación fracasa y se produce el fallo del ventrículo, lo que trae consigo: a) Consecuencias retrógradas: la sobrecarga de presión del VI se transmitirá retrógradamente; primero a la aurícula izquierda y, posteriormente, al sistema pulmonar. El aumento de la presión venocapilar pulmonar (PVCP) producirá edema de pulmón e insuficiencia respiratoria. b) Consecuencias anterógradas: el no mantenimiento del GC efectivo provocará una situación de shock o colapso circulatorio. Resumiendo: IAoA = I.Resp + Shock del corazón y el gasto cardiaco cae, la PAS disminuye. La presión arterial diastólica (PAD) estaría claramente disminuida debido al retorno de la sangre de la aorta al VI en diástole. La presión diferencial (PD=PAS-PAD) se mantendría o estaría ligeramente aumentada Se producen consecuencias sobre el miocardio? Sí. Como sabemos, la perfusión miocárdica se produce durante la diástole cardiaca. Sí la PAD disminuye, la presión de perfusión miocárdica también disminuirá. Si a esto sumamos que el corazón está trabajando más intensamente, llegaremos a una situación de disminución de aporte y aumento de demandas que puede determinar la aparición de isquemia miocárdica. FIN DEL CONTENIDO AMPLIADO Una vez entendido el proceso fisiopatológico de la IAoA podemos comprender que las consecuencias hemodinámicas, esto es, la gravedad de la IAoA, van a depender de: La rapidez de instauración de la IAo. Del volumen regurgitante (VR). De la resistencia vascular periférica (RVP). De la distensibilidad del ventrículo izquierdo. A su vez, al igual que ocurre en la insuficiencia mitral aguda, la cantidad de VR depende directamente de: 1) Del área del orificio regurgitante, 2) Del gradiente de presión diastólica entre la aorta y el VI (diferencia de presión entre aorta y VI); y 3) De la duración de la diástole. Esquema VV5 3 AMPLIACIÓN DE CONTENIDO DE INTERÉS. Qué ocurre con la tensión arterial? La presión arterial sistólica (PAS) inicialmente se mantendría gracias a los mecanismos compensadores (aumento de la contractilidad, frecuencia cardiaca y de las resistencias vasculares periféricas). Cuando se produce el fracaso Esquema VV5-4 J. A., P. F., M.C. Ruipérez 3
440 TEMA VV 5 CARDIOLOGÍA CMG HISTORIA CLÍNICA ANAMNESIS Siempre debemos sospechar IAoA en aquellos pacientes que de forma brusca e inesperada presenten un colapso hemodinámico (shock) e insuficiencia respiratoria. Debemos estar atentos a determinados síntomas y signos que pudiera orientarnos hacia una u otra etiología, por ejemplo: En los casos secundarios a EBS tendremos además los síntomas de la propia EBS; a saber: fiebre, malestar general En los casos de disección aórtica aguda existirá una historia de dolor intenso interescapular o torácico, síncope, disnea, debilidad, ausencia de pulsos La disección aórtica es frecuente en las personas afectadas por el síndrome de Marfan, por lo que el aspecto marfanoide (delgados, brazos largos ) podrá orientarnos hacia esta etiología 5. Ante un antecedente de traumatismo torácico con edema agudo de pulmón y shock circulatorio, debemos sospechar una IAoA aunque no se escuchen soplos. EXPLORACIÓN FÍSICA Los pacientes con IAoA impresionan de estar gravemente enfermos. Su cara es grisácea y sudorosa, y su expresión facial es de muerte inminente. La vasoconstricción periférica severa que sufren hace que su piel se encuentre pálida y/o subcianótica (grisácea). Además, presentan taquicardia y, generalmente, hipotensión. La presión diferencial puede ser normal o estar ligeramente aumen- 5 Si os gusta la egiptología y queréis saber más sobre el S. M. sin tener que empollaros el Harrison, aquí tenéis una página bastante curiosa para que no se os olvide: tada. Habitualmente presentan también congestión venosa y edemas. En la auscultación cardiaca 6, el primer ruido (S1) suele estar apagado 7. A veces, después de S1 se ausculta un soplo sistólico de insuficiencia mitral 8. El soplo protodiastólico en decrecento es de baja intensidad y más corto que el de la IAoC 9. Pueden tener un tercer (S3) y cuarto ruido (S4) 10. Este patrón se auscultaría fundamentalmente en el foco aórtico. En la auscultación pulmonar, suelen escucharse importantes estertores húmedos diseminados bibasales 11. Los signos de PD aumentada que habitualmente encontramos en la IAoC suelen estar ausentes. 6 La auscultación cardiaca de la IAoA no se comento en clase pero la he puesto (y explicado) porque aparecía en los apuntes del Dr.Ruipérez. 7 Por qué? En condiciones normales, S1 es audible porque el cierre de la mitral se produce de forma súbita (porque la presión intraventricular se eleva rápidamente con la contracción del VI). Sin embargo, en la IAoA la sangre que regurgita al VI, sumada a la que proviene de la aurícula, elevan lo suficiente la presión intraventricular como para que la válvula se encuentre, antes de iniciarse la sístole, prácticamente cerrada. Al ser el desplazamiento menor, el sonido del cierre es más suave. Aunque la válvula tricuspídea sí se comporte de forma normal, debemos recordar que el componente mitral de S1 es mucho más importante que el tricuspídeo. 8 Por qué? El elevado flujo sistólico de sangre en el tracto de salida del VI abriría levemente la válvula mitral (insuficiencia mitral funcional) debido a que ese gran flujo crearía un efecto Venturi (de succión) sobre dicha válvula (recordad la disposición anatómica del tracto de salida y la válvula mitral). Este soplo es el que ponía en los apuntes del Dr. Ruipérez, sin embargo, en muchos libros he encontrado que dicho soplo se debe a que se produce una estenosis aórtica relativa por el gran volumen que expulsa el VI. 9 Por qué? El soplo protodiastólico diastólico es el más sencillo de explicar de todos porque es el causado por la insuficiencia aórtica en sí misma. Es protodiastólico porque la regurgitación se produce desde el inicio de la diástole. Es en decrecento porque su intensidad va disminuyendo al disminuir la velocidad de la sangre regurgitada (porque el gradiente disminuye). Es más corto que el de la IAoC porque el gradiente desaparece antes (el VI es poco distensible y la presión intraventricular se eleva más rápidamente que en la IAoC) 10 Por qué? S3 aparece cuando el llenado ventricular es muy rápido, mientras que S4 aparece cuando la aurícula se contrae enérgicamente para llenar el ventrículo. 11 Por qué? Por el edema agudo de pulmón. Basales? Por efecto de la gravedad J. A., P. F., M.C. Ruipérez 4
441 TEMA VV 5 CARDIOLOGÍA CMG Ecocardiograma: el ecocardiograma tanto transtorácico como transesofágico es una técnica de gran ayuda. Nos permite identificar la causa y caracterizan la gravedad hemodinámica 14. Esquema VV5-6 Esquema VV5 5 TRATAMIENTO DIAGNÓSTICO EXPLORACIONES COMPLEMENTARIAS Electrocardiograma: no suele mostrar signos de crecimiento ventricular izquierdo 12, pero si son bastante comunes los trastornos inespecíficos de la repolarización (alteraciones del segmento ST y de la onda T). Radiología de tórax: No suele haber cardiomegalia 13. En las IAo cuya causa sea debida a un aneurisma aórtico o patología de la raíz aórtica, observamos dilatación de la aorta ascendente. Los campos pulmonares muestras signos de hipertensión venocapilar pulmonar (congestión y edema, líneas de Kerley ). 12 Por qué? Porque no hay hipertrofia ventricular, al tratarse de una patología aguda. 13 Por qué? Porque no hay hipertrofia ventricular. Espero que nadie falle si aparece una pregunta en el examen sobre esto. Dada la gravedad de la IAoA el tratamiento quirúrgico es inmediato. Mientras se está preparando al paciente, pueden usarse fármacos ionotrópicos positivos, para mejorar la contractilidad cardiaca, y en caso necesario vasodilatadores intravenosos 15 si lo permite la tensión arterial. Cuando la IAo es secundaria a EBS y el paciente está estable, puede haber un tiempo 14 Posible pregunta de examen. En la IAoA el ecocardiograma nos permite valorar la causa y la gravedad hemodinámica (Esto vale para el 99% de las valvulopatías, pero el profesor así lo dijo) 15 Por qué? Recordemos un poco de Fisiología de 2º. Cuando se producía la contracción ventricular, el gran volumen de sangre expulsado se almacenaba en la aorta, distendiendo sus paredes, para posteriormente avanzar hacia las arterias impulsada por el retroceso elástico de la pared aórtica. La razón de que la sangre no avance inicialmente es que las RVP ejercen un efecto barrera a esa sangre, que queda, por tanto, retenida en la aorta. Si nosotros disminuimos las RVP con fármacos vasodilatadores, un mayor porcentaje de sangre avanzará hacia las arterias en la misma sístole y, por tanto, el volumen regurgitado en diástole será menor. El problema es que estos fármacos producen hipotensión y, si el paciente presenta ya una alteración de la TA, y podríamos ocasionar una hipoperfusión de los órganos. Al igual que antes, el ejemplo no se dio en clase. J. A., P. F., M.C. Ruipérez 5
442 TEMA VV 5 CARDIOLOGÍA CMG de espera que nos permita tratarlo con antibióticos una semana, pero la cirugía no debe retrasarse más tiempo. Cuando la causa es una disección aórtica o un traumatismo torácico el paciente entra directo a quirófano. Sin discusión. de la compensación a largo plazo es la hipertrofia ventricular izquierda (que no encontrábamos en la IAoA). Como veremos, el cuadro de IAoC es muy similar al de insuficiencia mitral crónica. Es importante conocer que la mortalidad con tratamiento médico es superior al 75% y con tratamiento quirúrgico es del 25% en el primer año. Esquema VV5 7 ETIOLOGIA IAo CRÓNICA CONCEPTO La insuficiencia aórtica crónica (IAoC) es una situación clínica en la que se produce un reflujo diastólico de la aorta al ventrículo izquierdo de forma crónica. La principal característica fisiopatológica de este cuadro es que, como veremos, la PAS va a aumentar mucho, y la PAD se encontrará muy disminuida, es decir, tendremos una elevada presión diferencial. La IAoC es similar a la IAoA, pero con la diferencia de que el agente etiológico produce un menor grado de insuficiencia de forma que el organismos es capaz de soportar la nueva situación durante un largo periodo de tiempo. Así mismo, la principal manifestación Una causa común de la IAoC es la fiebre reumática (como en casi todas las valvulopatías). También podemos encontrar IAoC por: endocarditis bacteriana; enfermedad degenerativa 16 ; trastornos del tejido conectivo (como la medionecrosis quística de la aorta, asociada o no al síndrome de Marfan, la espondilitis anquilosante, la artritis reumatoide o psoriásica ), sífilis, aortitis 17, disección de aorta... En la etiología congénita destaca el síndrome de Laubry, el cual consiste en una comunicación interventricular alta combinada con insuficiencia aórtica, por pérdida de soporte comisural. Actualmente, la IAoC secundaria a la dilatación de la raíz de la aorta por trastornos del tejido conectivo se está convirtiendo en la principal etiología; añadido a la regresión 16 Se refiere a la degeneración valvular que sufrimos con el paso del tiempo todas las personas. Lógicamente, será una etiología propia de personas mayores. 17 Antiguamente era frecuente la aortitis sifilítica. Actualmente es un etiología muy rara. J. A., P. F., M.C. Ruipérez 6
443 TEMA VV 5 CARDIOLOGÍA CMG de la secundaría a fiebre reumática gracias a los antibióticos. En función del mecanismo de producción de la IAoC podemos clasificar la etiología en 18 : mantenimiento del volumen anterógrado sistólico efectivo (VSAE) con una fracción de eyección normal. A diferencia de la IAoA estos mecanismos son suficientes para mantener la función cardiaca dado que la insuficiencia es mucho más leve. Afectación de las valvas: fiebre reumática, EBS y artritis reumatoide o psoriásica Distorsión/dilatación de la raíz aórtica: aortitis, medionecrosis quística de la aorta, espondilitis anquilosante 19, síndrome de Marfan florido 20. Pérdida del soporte comisural: disección aórtica, síndrome de Laubry, sífilis, aortitis Figura VV5-3 Pero, además, la sobrecarga de volumen mantenida durante largo tiempo se traduce en una hipertrofia y alargamiento de la pared ventricular izquierda, también llamada hipertrofia ventricular excéntrica 22. Por tanto, esta hipertrofia es un mecanismo adaptativo que sufre el miocardio cuando se le exige un aumento de contractilidad de forma crónica. Esquema VV5-8 FISIOPATOLOGÍA Es importante tener presente, sobre todo de cara a la clínica, que en la IAoC nos encontramos con una PAS elevada, una PAD disminuida y una PD muy aumentada 23. La severidad de la IAoC depende de los mismos parámetros que vimos en la IAoA. En la IAoC se produce un reflujo de sangre desde la aorta al ventrículo izquierdo durante la diástole. Este volumen regurgitado produce un aumento del VTD que genera un aumento de la PTD. Inicialmente existe una compensación hemodinámica 21 que produce un 18 Esta es la clasificación que dio el Dr. Ruipérez en clase. 19 Se trata de la fusión de la columna vertebral, con calcificación de los ligamentos, que impiden el movimiento y se denomina comúnmente columna en caña de bambú 20 Ocasionará una dilatación de la raiz aórtica, pues esta enfermedad, con el tiempo va a producir un ensanchamiento del anillo valvular y la separación de las sigmoides. 21 Los mecanismos de compensación que actúan inicialmente son los que vimos en la IAoA: el mecanismo de Frank-Starling Esquema VV5-9 y el SNS producen aumento de la contractilidad y de la frecuencia cardiaca 22 El aumento de volumen (precarga) produce hipertrofia ventricular excéntrica, mientras que el aumento de presión (poscarga) produce hipertrofia ventricular concéntrica. 23 Por qué? La PAS aumenta porque la contractilidad cardiaca esta aumentada; la PAD disminuye por la misma razón que vimos en la IAoA y la PD porque depende de la PAS y de la PAD según la fórmula PD=PAS-PAD. J. A., P. F., M.C. Ruipérez 7
CALENDARIZACIÓN. Sesión 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
 Este Curso de Actualización está diseñado para ofrecer un panorama actual del conocimiento general de los principales temas electrocardiográficos a través de la revisión de sus bases anatómicas, fisiológicas,
Este Curso de Actualización está diseñado para ofrecer un panorama actual del conocimiento general de los principales temas electrocardiográficos a través de la revisión de sus bases anatómicas, fisiológicas,
Fármacos empleados en el tratamiento de la insuficiencia cardiaca Fármaco empleados en el tratamiento de la hipertensión arterial
 Fármacos empleados en el tratamiento de la insuficiencia cardiaca Fármaco empleados en el tratamiento de la hipertensión arterial El alumno conocerá los efectos farmacológicos de las drogas cardiacas,
Fármacos empleados en el tratamiento de la insuficiencia cardiaca Fármaco empleados en el tratamiento de la hipertensión arterial El alumno conocerá los efectos farmacológicos de las drogas cardiacas,
Taquicardia Ventricular Monomórfica
 Página nº 1 Introducción En condiciones normales el corazón se contrae de forma rítmica y sincrónica. Esta contracción es el resultado de un impulso eléctrico que se genera en la aurícula, llega al ventrículo
Página nº 1 Introducción En condiciones normales el corazón se contrae de forma rítmica y sincrónica. Esta contracción es el resultado de un impulso eléctrico que se genera en la aurícula, llega al ventrículo
http://www.cirugiacardiaca.net CIRUGÍA DE AORTA
 CIRUGÍA DE AORTA Qué es la arteria aorta? La aorta es la arteria más importante del organismo. Su función es llevar sangre oxigenada desde el corazón a todos nuestros órganos y por tanto de su correcto
CIRUGÍA DE AORTA Qué es la arteria aorta? La aorta es la arteria más importante del organismo. Su función es llevar sangre oxigenada desde el corazón a todos nuestros órganos y por tanto de su correcto
Filtro en vena cava inferior para TVP
 Filtro en vena cava inferior para TVP Trombosis venosa profunda Una trombosis venosa profunda (TVP) es un coágulo de sangre que se forma en una vena profunda. Se trata de una afección grave que ocurre
Filtro en vena cava inferior para TVP Trombosis venosa profunda Una trombosis venosa profunda (TVP) es un coágulo de sangre que se forma en una vena profunda. Se trata de una afección grave que ocurre
Preexcitación. Wolf-Parkinson-White (WPW). Jueves, 12 de Febrero de 2015 19:35 - Actualizado Martes, 16 de Junio de 2015 22:14
 Los síndromes de son aquellos en los que los estímulos eléctricos del corazón se conducen desde las aurículas a los ventrículos a través de una o más vías accesorias, además de por el nodo aurículo-ventricular
Los síndromes de son aquellos en los que los estímulos eléctricos del corazón se conducen desde las aurículas a los ventrículos a través de una o más vías accesorias, además de por el nodo aurículo-ventricular
ANEURISMAS DE AORTA TORÁCICA DISECCIONES AORTICAS
 ANEURISMAS DE AORTA TORÁCICA DISECCIONES AORTICAS Dr Jorge Centeno Rodríguez Servicio de Cirugía Cardiaca Hospital 12 de Octubre SERVICIO DE CIRUGÍA CARDIACA 1 ANEURISMAS ATEROSCLERÓTICOS ocurren mas frecuentemente
ANEURISMAS DE AORTA TORÁCICA DISECCIONES AORTICAS Dr Jorge Centeno Rodríguez Servicio de Cirugía Cardiaca Hospital 12 de Octubre SERVICIO DE CIRUGÍA CARDIACA 1 ANEURISMAS ATEROSCLERÓTICOS ocurren mas frecuentemente
CARDIOLOGÍA Trastornos del ritmo II
 CARDIOLOGÍA Trastornos del ritmo II Taquiarritmias Los mecanismos arritmogénicos son: aumento del automatismo, la actividad desencadenada (pospotenciales) y la reentrada La taquicardia sinusal se caracteriza
CARDIOLOGÍA Trastornos del ritmo II Taquiarritmias Los mecanismos arritmogénicos son: aumento del automatismo, la actividad desencadenada (pospotenciales) y la reentrada La taquicardia sinusal se caracteriza
Curso de Electricidad, Electrónica e Instrumentación Biomédica con Seguridad - CEEIBS -
 Curso de Electricidad, Electrónica e Instrumentación Biomédica con Seguridad - CEEIBS - 1/20 ECG - Actividad eléctrica del corazón Actividad eléctrica del corazón: El corazón es una bomba formada por tejido
Curso de Electricidad, Electrónica e Instrumentación Biomédica con Seguridad - CEEIBS - 1/20 ECG - Actividad eléctrica del corazón Actividad eléctrica del corazón: El corazón es una bomba formada por tejido
Aneurismas aórticos 1. INTRODUCCIÓN 2. ANEURISMAS DE AORTA TORÁCICA. 4Julia Cordón Llera. tema
 tema 4Julia Cordón Llera Aneurismas aórticos 1. INTRODUCCIÓN La aorta conduce la sangre expulsada del ventrículo izquierdo al sistema arterial sistémico. En los adultos tiene un diámetro que varía de los
tema 4Julia Cordón Llera Aneurismas aórticos 1. INTRODUCCIÓN La aorta conduce la sangre expulsada del ventrículo izquierdo al sistema arterial sistémico. En los adultos tiene un diámetro que varía de los
 BLS CABD Revise respuesta Active Sistema Médico De Emergencias Solicite desfibrilador CABD C = Circulación: valore circulación CABD C = Circulación: ejecute compresiones al tórax CABD C = Circulación:
BLS CABD Revise respuesta Active Sistema Médico De Emergencias Solicite desfibrilador CABD C = Circulación: valore circulación CABD C = Circulación: ejecute compresiones al tórax CABD C = Circulación:
Guía rápida para la lectura sistemática del ECG pediátrico
 Guía rápida para la lectura sistemática del ECG pediátrico FJ. Pérez-Lescure Picarzo Cardiología Infantil, Unidad de Pediatría, Fundación Hospital de Alcorcón, Madrid. Rev Pediatr Aten Primaria. 2006;8:319-26
Guía rápida para la lectura sistemática del ECG pediátrico FJ. Pérez-Lescure Picarzo Cardiología Infantil, Unidad de Pediatría, Fundación Hospital de Alcorcón, Madrid. Rev Pediatr Aten Primaria. 2006;8:319-26
AMQII: Profesor Bueno TEMA: 17: TRASTORNOS DEL RITMO Y DE LA CONDUCCIÓN CARDIACA
 AMQII: Profesor Bueno TEMA: 17: TRASTORNOS DEL RITMO Y DE LA CONDUCCIÓN CARDIACA 1 INTRODUCCIÓN El ritmo cardiaco normal: mecanismos de las arritmias: Normalmente un adulto en reposo tiene: 60-80 latidos
AMQII: Profesor Bueno TEMA: 17: TRASTORNOS DEL RITMO Y DE LA CONDUCCIÓN CARDIACA 1 INTRODUCCIÓN El ritmo cardiaco normal: mecanismos de las arritmias: Normalmente un adulto en reposo tiene: 60-80 latidos
TECNICAS EN RCP AVANZADA
 TECNICAS EN RCP AVANZADA 1. Desfibrilación La desfibrilación es una técnica esencial en la resucitación cardiopulmonar; es el único tratamiento definitivo posible de la Fibrilación Ventricular (FV). Debe
TECNICAS EN RCP AVANZADA 1. Desfibrilación La desfibrilación es una técnica esencial en la resucitación cardiopulmonar; es el único tratamiento definitivo posible de la Fibrilación Ventricular (FV). Debe
Infarto al miocardio. Signos y síntomas
 Infarto al miocardio S e denomina infarto del miocardio a la muerte celular de las miofibrillas causada por falta de aporte sanguíneo a una zona del corazón que es consecuencia de la oclusión aguda y total
Infarto al miocardio S e denomina infarto del miocardio a la muerte celular de las miofibrillas causada por falta de aporte sanguíneo a una zona del corazón que es consecuencia de la oclusión aguda y total
X-Plain Hipertensión esencial Sumario
 X-Plain Hipertensión esencial Sumario Introducción Hipertensión o presión arterial alta es una condición muy común que afecta a 1 de cada 4 adultos. Hipertensión también se llama el Asesino Silencioso
X-Plain Hipertensión esencial Sumario Introducción Hipertensión o presión arterial alta es una condición muy común que afecta a 1 de cada 4 adultos. Hipertensión también se llama el Asesino Silencioso
ECG BÁSICA ALTERACIONES DEL RITMO Y LA CONDUCCIÓN Maite Doñate Rodríguez
 Alteraciones del Ritmo y la Conducción 1 ECG BÁSICA ALTERACIONES DEL RITMO Y LA CONDUCCIÓN Maite Doñate Rodríguez INTERPRETACIÓN DEL ECG Sistemática Frecuencia y ritmo Intervalos PQ (PR), QRS, QT (y QTc)
Alteraciones del Ritmo y la Conducción 1 ECG BÁSICA ALTERACIONES DEL RITMO Y LA CONDUCCIÓN Maite Doñate Rodríguez INTERPRETACIÓN DEL ECG Sistemática Frecuencia y ritmo Intervalos PQ (PR), QRS, QT (y QTc)
Apuntes de Cirugia Cardiaca Dr.Antonio Ordoñez Fernandez Profesor titular de Cirugia Hospital Universitario Virgen del Rocio Universidad de Sevilla
 Apuntes de Cirugia Cardiaca Dr.Antonio Ordoñez Fernandez Profesor titular de Cirugia Hospital Universitario Virgen del Rocio Universidad de Sevilla Estos apuntes son una guia para que lo leas antes de
Apuntes de Cirugia Cardiaca Dr.Antonio Ordoñez Fernandez Profesor titular de Cirugia Hospital Universitario Virgen del Rocio Universidad de Sevilla Estos apuntes son una guia para que lo leas antes de
ACTUALIZACIONES EN MEDICINA INTERNA II VERSION MODULO I: CARDIOLOGIA-ENDOCRINOLOGIA-METABOLISMO
 ACTUALIZACIONES EN MEDICINA INTERNA II VERSION MODULO I: CARDIOLOGIA-ENDOCRINOLOGIA-METABOLISMO SOCIEDAD MEDICA DE SANTIAGO SOCIEDAD CHILENA DE MEDICINA INTERNA CLASE ECG practica Dr. Héctor Ugalde Medicina
ACTUALIZACIONES EN MEDICINA INTERNA II VERSION MODULO I: CARDIOLOGIA-ENDOCRINOLOGIA-METABOLISMO SOCIEDAD MEDICA DE SANTIAGO SOCIEDAD CHILENA DE MEDICINA INTERNA CLASE ECG practica Dr. Héctor Ugalde Medicina
ESTUDIO ELECTROFISIOLOGICO. ABLACION
 ESTUDIO ELECTROFISIOLOGICO. ABLACION Toda irregularidad del ritmo natural del corazón se denomina arritmia. Casi todos sentimos latidos irregulares o palpitaciones leves, que por lo general son inofensivas.
ESTUDIO ELECTROFISIOLOGICO. ABLACION Toda irregularidad del ritmo natural del corazón se denomina arritmia. Casi todos sentimos latidos irregulares o palpitaciones leves, que por lo general son inofensivas.
El corazón, al tener paredes musculares, puede dilatarse y contraerse, lo que le permite bombear la sangre.
 Fisiología del aparato circulatorio El corazón, al tener paredes musculares, puede dilatarse y contraerse, lo que le permite bombear la sangre. El corazón bombea la sangre de forma continua, mediante dos
Fisiología del aparato circulatorio El corazón, al tener paredes musculares, puede dilatarse y contraerse, lo que le permite bombear la sangre. El corazón bombea la sangre de forma continua, mediante dos
Cómo actuar cuando aparece dolor en el pecho
 Cómo actuar cuando aparece dolor en el pecho Como actuar cuando aparece dolor en el pecho Qué hacer ante una crisis de dolor? TOMAR NITROGLICERINA. Lo primero que debe hacer si aparece el dolor, es interrumpir
Cómo actuar cuando aparece dolor en el pecho Como actuar cuando aparece dolor en el pecho Qué hacer ante una crisis de dolor? TOMAR NITROGLICERINA. Lo primero que debe hacer si aparece el dolor, es interrumpir
Resincronización cardiaca y dispositivos de asistencia mecánica. Dr Javier Fdez Portales Director Unidad de Cardiología Intervencionista Cáceres
 Resincronización cardiaca y dispositivos de asistencia mecánica Dr Javier Fdez Portales Director Unidad de Cardiología Intervencionista Cáceres Bases fisiológicas para la estimulación eléctrica en disfunción
Resincronización cardiaca y dispositivos de asistencia mecánica Dr Javier Fdez Portales Director Unidad de Cardiología Intervencionista Cáceres Bases fisiológicas para la estimulación eléctrica en disfunción
HIPERPARATIROIDISMO. Anatomía. 1.- Qué son las glándulas paratiroideas?
 HIPERPARATIROIDISMO Anatomía 1.- Qué son las glándulas paratiroideas? Suelen ser 4 glándulas pequeñas (a veces son 5-6) situadas 2 a cada lado de la glándula tiroidea y colocadas en la porción superior
HIPERPARATIROIDISMO Anatomía 1.- Qué son las glándulas paratiroideas? Suelen ser 4 glándulas pequeñas (a veces son 5-6) situadas 2 a cada lado de la glándula tiroidea y colocadas en la porción superior
Reconocimiento y Manejo de Las ARRITMIAS CARDÍACAS
 Organiza: Comisión de Practicantes SMU Declarado Interés Institucional por Comité Ejecutivo SMU Reconocimiento y Manejo de Las ARRITMIAS CARDÍACAS Domingo 30 de Abril de 2006 Dr. Alejandro Pomi San Martín
Organiza: Comisión de Practicantes SMU Declarado Interés Institucional por Comité Ejecutivo SMU Reconocimiento y Manejo de Las ARRITMIAS CARDÍACAS Domingo 30 de Abril de 2006 Dr. Alejandro Pomi San Martín
Guía rápida para la lectura sistemática del ECG pediátrico. 2.ª Edic.
 Viernes 5 de febrero de 2010 Seminario: Cómo interpretar ECGs pediátricos y no sucumbir en el intento Moderador: Benjamín Herranz Jordán Pediatra, CS El Abajón. Área 6. Las Rozas, Madrid. Ponente/monitor:
Viernes 5 de febrero de 2010 Seminario: Cómo interpretar ECGs pediátricos y no sucumbir en el intento Moderador: Benjamín Herranz Jordán Pediatra, CS El Abajón. Área 6. Las Rozas, Madrid. Ponente/monitor:
Clase 6. Ciclo cardíaco. Acontecimientos eléctricos
 Clase 6 Ciclo cardíaco Acontecimientos eléctricos Generalidades del sistema cardiovascular La función principal del sistema vascular es transportar nutrientes y otros materiales de unos lugares a otros
Clase 6 Ciclo cardíaco Acontecimientos eléctricos Generalidades del sistema cardiovascular La función principal del sistema vascular es transportar nutrientes y otros materiales de unos lugares a otros
4 1 fuerzas eléctricas responsables de la activación auricular. Un segundo vector (2) correspondiente. con la despolarización ventricular central y
 5 el eje eléctrico cardiaco Vectores Un vector es la forma de representar una magnitud que tiene una dirección y un sentido determinados. Se representa un vector como una flecha cuyo tamaño sería su magnitud,
5 el eje eléctrico cardiaco Vectores Un vector es la forma de representar una magnitud que tiene una dirección y un sentido determinados. Se representa un vector como una flecha cuyo tamaño sería su magnitud,
Enfermedades cardiovasculares
 Enfermedades cardiovasculares Índice Introducción Qué es y cómo funciona el aparato cardiocirculatorio? Qué es la enfermedad coronaria? Por qué se desarrolla? Síntomas Tratamiento Dolor en el pecho Cómo
Enfermedades cardiovasculares Índice Introducción Qué es y cómo funciona el aparato cardiocirculatorio? Qué es la enfermedad coronaria? Por qué se desarrolla? Síntomas Tratamiento Dolor en el pecho Cómo
www.ciedd.oaxaca.gob.mx
 Día Mundial del Corazón 29 de septiembre El Día Mundial del Corazón fue creado en el año 2000 para informar a la gente de todo el mundo que las enfermedades cardíacas y los accidentes vasculares cerebrales
Día Mundial del Corazón 29 de septiembre El Día Mundial del Corazón fue creado en el año 2000 para informar a la gente de todo el mundo que las enfermedades cardíacas y los accidentes vasculares cerebrales
Accidente cerebrovascular
 Accidente cerebrovascular Introducción Un accidente cerebrovascular es una afección grave que ocurre cuando se reduce el aporte de sangre al cerebro. Si el aporte de sangre es insuficiente o nulo, las
Accidente cerebrovascular Introducción Un accidente cerebrovascular es una afección grave que ocurre cuando se reduce el aporte de sangre al cerebro. Si el aporte de sangre es insuficiente o nulo, las
El corazón y sus funciones. Circulación coronaria Dr. Alfonso del Rio Ligorit Cardiólogo. Profesor Titular de Cardiología. Servicio de Cardiología
 El corazón y sus funciones. Circulación coronaria Dr. Alfonso del Rio Ligorit Cardiólogo. Profesor Titular de Cardiología. Servicio de Cardiología Hospital Universitario "Lozano Blesa". Zaragoza 15 Pescado
El corazón y sus funciones. Circulación coronaria Dr. Alfonso del Rio Ligorit Cardiólogo. Profesor Titular de Cardiología. Servicio de Cardiología Hospital Universitario "Lozano Blesa". Zaragoza 15 Pescado
EXAMEN CURSO de ECG Y PCR 2013
 EXAMEN CURSO de ECG Y PCR 2013 1. Describa la correcta colocación de los electrodos para realizar un ECG de 12 derivaciones. ROJO: VERDE: AMARILLO: NEGRO: V1: V2: V3: V4: V5: V6: 2. Nombre las diferentes
EXAMEN CURSO de ECG Y PCR 2013 1. Describa la correcta colocación de los electrodos para realizar un ECG de 12 derivaciones. ROJO: VERDE: AMARILLO: NEGRO: V1: V2: V3: V4: V5: V6: 2. Nombre las diferentes
Fundamentos del trazado electrocardiográfico
 Clase 14 Fundamentos del trazado electrocardiográfico Los fenómenos de despolarización y repolarización que se registran en un electrocardiograma se representan a través de flechas llamadas vectores. Estos
Clase 14 Fundamentos del trazado electrocardiográfico Los fenómenos de despolarización y repolarización que se registran en un electrocardiograma se representan a través de flechas llamadas vectores. Estos
Qué es el herpes genital?
 Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
Qué es el herpes genital? Es una infección de transmisión sexual muy extendida causada por el virus del herpes simple (VHS) de tipo 2 (VHS-2) y de tipo 1 (VHS-1), que también es causa habitual del herpes
Curso de ECG R1 Medicina de Urgencia UC Catalina Baeza R.
 Alteraciones de la conducción y bloqueos Curso de ECG R1 Medicina de Urgencia UC Catalina Baeza R. Parte 1 BLOQUEOS DE RAMA Y FASCICULARES Bloques de rama y fasciculares Debajo del NAV (bajo Has de His)
Alteraciones de la conducción y bloqueos Curso de ECG R1 Medicina de Urgencia UC Catalina Baeza R. Parte 1 BLOQUEOS DE RAMA Y FASCICULARES Bloques de rama y fasciculares Debajo del NAV (bajo Has de His)
Uso de un desfibrilador externo semi-automático
 Uso de un desfibrilador externo semi-automático Este documento contiene información sobre el uso de un desfibrilador externo semiautomático (DESA) por personas ajenas al mundo sanitario, primeros intervinientes
Uso de un desfibrilador externo semi-automático Este documento contiene información sobre el uso de un desfibrilador externo semiautomático (DESA) por personas ajenas al mundo sanitario, primeros intervinientes
Cada vez que controlemos un paciente tenemos que considera los siguientes puntos: Frecuencia respiratoria Pulso Pº arterial Tº corporal
 1 SIGNOS VITALES Clase 26.03.03 (III parte) Cada vez que controlemos un paciente tenemos que considera los siguientes puntos: Frecuencia respiratoria Pulso Pº arterial Tº corporal Siempre se evalúa en
1 SIGNOS VITALES Clase 26.03.03 (III parte) Cada vez que controlemos un paciente tenemos que considera los siguientes puntos: Frecuencia respiratoria Pulso Pº arterial Tº corporal Siempre se evalúa en
Plan de mejora de las competencias lectoras en la ESO.
 Plan de mejora de las competencias lectoras en la ESO. TEXTO. EL ELECTROCARDIOGRAMA El latido del corazón se genera en el propio órgano. En la aurícula derecha hay un grupo de células, denominado marcapasos,
Plan de mejora de las competencias lectoras en la ESO. TEXTO. EL ELECTROCARDIOGRAMA El latido del corazón se genera en el propio órgano. En la aurícula derecha hay un grupo de células, denominado marcapasos,
Presión Venosa Central y Presión Arterial Media
 Presión Venosa Central y Presión Arterial Media Esteban Leal Facultad de Medicina de la UANL México CUIDADOS INTENSIVOS TEMAS Obtención de signos vitales Presión venosa central Presión arterial Presión
Presión Venosa Central y Presión Arterial Media Esteban Leal Facultad de Medicina de la UANL México CUIDADOS INTENSIVOS TEMAS Obtención de signos vitales Presión venosa central Presión arterial Presión
http://www.cirugiacardiaca.net CIRUGÍA CORONARIA.
 CIRUGÍA CORONARIA. La cirugía de las arterias coronarias, o cirugía de revascularización miocárdica consiste en restablecer el flujo sanguíneo en la arteria enferma realizando un bypass o injerto aortocoronario.
CIRUGÍA CORONARIA. La cirugía de las arterias coronarias, o cirugía de revascularización miocárdica consiste en restablecer el flujo sanguíneo en la arteria enferma realizando un bypass o injerto aortocoronario.
Cuida. y previene el asma INSPIRA PROGRAMA DE SALUD COMPLETO Y GRATUITO ESPACIOINSPIRA ESPACIO. Pregunta a tu farmacéutico e inscríbete
 a Novartis company ESPACIO INSPIRA PROGRAMA DE SALUD COMPLETO Y GRATUITO Impartido por un enfermero ESPACIOINSPIRA Respirar. Innovar. Respirar. Innovar. Pregunta a tu farmacéutico e inscríbete TU FARMACIA
a Novartis company ESPACIO INSPIRA PROGRAMA DE SALUD COMPLETO Y GRATUITO Impartido por un enfermero ESPACIOINSPIRA Respirar. Innovar. Respirar. Innovar. Pregunta a tu farmacéutico e inscríbete TU FARMACIA
INTERRUPCIÓN DEL ARCO AÓRTICO
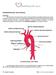 INTERRUPCIÓN DEL ARCO AÓRTICO Definición: De la porción transversa de la aorta normal emergen 3 grandes arterias que nutren la cabeza y los brazos: el tronco arterial braquiocefálico o arteria innominada
INTERRUPCIÓN DEL ARCO AÓRTICO Definición: De la porción transversa de la aorta normal emergen 3 grandes arterias que nutren la cabeza y los brazos: el tronco arterial braquiocefálico o arteria innominada
EL PACIENTE CON ARRITMIAS CARDIACAS COMO ACTUAMOS?
 EL PACIENTE CON ARRITMIAS CARDIACAS COMO ACTUAMOS? Centro Cardiovascular Hospital Clínico Universidad de Chile CLASIFICACIÓN DE LAS ARRITMIAS EXTRASÍSTOLES SUPRAVENTRICULARES VENTRICULARES TAQUIARRITMIAS
EL PACIENTE CON ARRITMIAS CARDIACAS COMO ACTUAMOS? Centro Cardiovascular Hospital Clínico Universidad de Chile CLASIFICACIÓN DE LAS ARRITMIAS EXTRASÍSTOLES SUPRAVENTRICULARES VENTRICULARES TAQUIARRITMIAS
DATOS SOBRE ENFERMEDADES CARDIOVAS- CULARES
 DATOS SOBRE ENFERMEDADES CARDIOVAS- CULARES o DEFINICIÓN Las Enfermedades Cardiovasculares son enfermedades que afectan al corazón y a los vasos sanguíneos, arterias y venas. a.- El corazón puede afectarse
DATOS SOBRE ENFERMEDADES CARDIOVAS- CULARES o DEFINICIÓN Las Enfermedades Cardiovasculares son enfermedades que afectan al corazón y a los vasos sanguíneos, arterias y venas. a.- El corazón puede afectarse
Tratamiento de las arritmias
 8 PLAN NACIONAL DE RCP LOS PROFESIONALES DEL ENFERMO CRÍTICO OBJETIVOS Proporcionar los conocimientos necesarios sobre las pautas de tratamiento: De los ritmos lentos: bradicardia y bloqueos auriculo-ventriculares.
8 PLAN NACIONAL DE RCP LOS PROFESIONALES DEL ENFERMO CRÍTICO OBJETIVOS Proporcionar los conocimientos necesarios sobre las pautas de tratamiento: De los ritmos lentos: bradicardia y bloqueos auriculo-ventriculares.
aneurisma aorta abdominal reparación endovascular
 CIRUJANOS VASCULARES, S.L. Dr. MIGUEL A. ARAUJO PAZOS Dr. JOSÉ PORTO RODRÍGUEZ Santa Engracia, 141 2º A TELF: 91 553 00 53 FAX: 91 533 48 17 28003 MADRID www.cirujanosvasculares.com contacto@cirujanosvasculares.com
CIRUJANOS VASCULARES, S.L. Dr. MIGUEL A. ARAUJO PAZOS Dr. JOSÉ PORTO RODRÍGUEZ Santa Engracia, 141 2º A TELF: 91 553 00 53 FAX: 91 533 48 17 28003 MADRID www.cirujanosvasculares.com contacto@cirujanosvasculares.com
MODULO EDUCATIVO I CONOCIMIENTO DE HIPERTENSION
 MODULO EDUCATIVO I CONOCIMIENTO DE HIPERTENSION MODULO EDUCATIVO I CONOCIMIENTO DE HIPERTENSION Qué es la presión arterial? Qué es la hipertensión arterial? Por qué sube la tensión? Tipos de hipertensión
MODULO EDUCATIVO I CONOCIMIENTO DE HIPERTENSION MODULO EDUCATIVO I CONOCIMIENTO DE HIPERTENSION Qué es la presión arterial? Qué es la hipertensión arterial? Por qué sube la tensión? Tipos de hipertensión
Basic life support (BLS). System of advanced cardiovascularlife support (ACLS): RCP de alta calidad, y para VF/VT sin pulso, desfibrilación en los
 Basic life support (BLS). System of advanced cardiovascularlife support (ACLS): RCP de alta calidad, y para VF/VT sin pulso, desfibrilación en los primeros minutos post-colapso. Cuidado post-paro integrado.
Basic life support (BLS). System of advanced cardiovascularlife support (ACLS): RCP de alta calidad, y para VF/VT sin pulso, desfibrilación en los primeros minutos post-colapso. Cuidado post-paro integrado.
Qué es la enfermedad coronaria? Por qué se desarrolla?
 Qué es la enfermedad coronaria? Por qué se desarrolla? Qué es la enfermedad coronaria? Por qué se desarrolla? Las arterias coronarias pueden tener dificultad para llevar un flujo sanguíneo adecuado al
Qué es la enfermedad coronaria? Por qué se desarrolla? Qué es la enfermedad coronaria? Por qué se desarrolla? Las arterias coronarias pueden tener dificultad para llevar un flujo sanguíneo adecuado al
Osciloscopio Funciones
 Uso del osciloscopio para determinar las formas de onda Uno de los procedimientos para realizar diagnósticos acertados, en las reparaciones automotrices, es el buen uso del osciloscopio. Este instrumento
Uso del osciloscopio para determinar las formas de onda Uno de los procedimientos para realizar diagnósticos acertados, en las reparaciones automotrices, es el buen uso del osciloscopio. Este instrumento
Medico Emergenciólogo SPMED
 ABEL GARCIA VILLAFUERTE Medico Emergenciólogo SPMED DESFIBRILACION La desfibrilación ventricular y la cardioversión son recursos terapéuticos que forman parte fundamental del soporte cardiaco vital avanzado.
ABEL GARCIA VILLAFUERTE Medico Emergenciólogo SPMED DESFIBRILACION La desfibrilación ventricular y la cardioversión son recursos terapéuticos que forman parte fundamental del soporte cardiaco vital avanzado.
TUMOR CEREBRAL 15 CUESTIONES LAS MÁS FRECUENTES. Dr. Pedro Pérez Segura Servicio de Oncología Médica Hospital Clínico San Carlos.
 TUMOR CEREBRAL LAS 15 CUESTIONES MÁS FRECUENTES Dr. Pedro Pérez Segura Servicio de Oncología Médica Hospital Clínico San Carlos. Madrid 1 2 QUÉ SÍNTOMAS PUEDE PRODUCIR UN TUMOR CEREBRAL? Los síntomas son
TUMOR CEREBRAL LAS 15 CUESTIONES MÁS FRECUENTES Dr. Pedro Pérez Segura Servicio de Oncología Médica Hospital Clínico San Carlos. Madrid 1 2 QUÉ SÍNTOMAS PUEDE PRODUCIR UN TUMOR CEREBRAL? Los síntomas son
TABLA DE DECISION. Consideremos la siguiente tabla, expresada en forma genérica, como ejemplo y establezcamos la manera en que debe leerse.
 TABLA DE DECISION La tabla de decisión es una herramienta que sintetiza procesos en los cuales se dan un conjunto de condiciones y un conjunto de acciones a tomar según el valor que toman las condiciones.
TABLA DE DECISION La tabla de decisión es una herramienta que sintetiza procesos en los cuales se dan un conjunto de condiciones y un conjunto de acciones a tomar según el valor que toman las condiciones.
Circulación Fetal. 2. Circulación Feto placentaria
 1. Introducción (Valeria Cordero) Si bien la circulación comienza en el embrión desde el principio de la cuarta semana, en que el corazón comienza a latir, y no será sino hasta la etapa fetal cuando esta
1. Introducción (Valeria Cordero) Si bien la circulación comienza en el embrión desde el principio de la cuarta semana, en que el corazón comienza a latir, y no será sino hasta la etapa fetal cuando esta
EL FONDO DE MANIOBRA Y LAS NECESIDADES OPERATIVAS DE FONDOS
 2 EL FONDO DE MANIOBRA Y LAS NECESIDADES OPERATIVAS DE FONDOS Las inversiones de una empresa están reflejadas en su activo. Una forma de clasificación de las diferentes inversiones es en función del plazo
2 EL FONDO DE MANIOBRA Y LAS NECESIDADES OPERATIVAS DE FONDOS Las inversiones de una empresa están reflejadas en su activo. Una forma de clasificación de las diferentes inversiones es en función del plazo
Distribución porcentual de consumidores de alcohol por patrón de consumo de alcohol según sexo, 1998. Patrón de consumo Hombres Mujeres
 CONSUMIDORES DE ALCOHOL POR PATRÓN DE CONSUMO El patrón de consumo de alcohol combina el número de copas consumidas con el lapso de tiempo durante el cual se consumen, para clasificar a la población. Distinguir
CONSUMIDORES DE ALCOHOL POR PATRÓN DE CONSUMO El patrón de consumo de alcohol combina el número de copas consumidas con el lapso de tiempo durante el cual se consumen, para clasificar a la población. Distinguir
Quieres conocer como se pone en marcha el Programa ECG. Estimulación Cognitiva Global dirigido a pacientes en fase leve, moderada o severa?
 Quieres conocer como se pone en marcha el Programa ECG. Estimulación Cognitiva Global dirigido a pacientes en fase leve, moderada o severa? Lo primero presentarme para que sepas quien hay detrás de estas
Quieres conocer como se pone en marcha el Programa ECG. Estimulación Cognitiva Global dirigido a pacientes en fase leve, moderada o severa? Lo primero presentarme para que sepas quien hay detrás de estas
Rincón Médico El glaucoma Dr. Mario Caboara Moreno Cirujano Oftalmólogo Centro Oftalmológico de los Altos - Tepatitlán, Jalisco
 Rincón Médico El glaucoma Dr. Mario Caboara Moreno Cirujano Oftalmólogo Centro Oftalmológico de los Altos - Tepatitlán, Jalisco Si bien todos los sentidos que poseemos los humanos son importantes y nos
Rincón Médico El glaucoma Dr. Mario Caboara Moreno Cirujano Oftalmólogo Centro Oftalmológico de los Altos - Tepatitlán, Jalisco Si bien todos los sentidos que poseemos los humanos son importantes y nos
PRESIÓN ARTERIAL. Dra. Silvia Luluaga de Baricco Médica Cardióloga
 Dra. Silvia Luluaga de Baricco Médica Cardióloga Presión Arterial, es la fuerza o empuje ejercido por la sangre sobre la pared de la arteria. Tensión Arterial, es la fuerza de igual magnitud pero en sentido
Dra. Silvia Luluaga de Baricco Médica Cardióloga Presión Arterial, es la fuerza o empuje ejercido por la sangre sobre la pared de la arteria. Tensión Arterial, es la fuerza de igual magnitud pero en sentido
Tratamiento de la enfermedad coronaria
 Tratamiento de la enfermedad coronaria Tratamiento de la enfermedad coronaria En la mayoría de las ocasiones, los pacientes con angina de pecho o infarto de miocardio pueden ser controlados con tratamiento
Tratamiento de la enfermedad coronaria Tratamiento de la enfermedad coronaria En la mayoría de las ocasiones, los pacientes con angina de pecho o infarto de miocardio pueden ser controlados con tratamiento
ECG Electrolitos y Fármacos. Adriano Pellegrini A.
 ECG Electrolitos y Fármacos Adriano Pellegrini A. Índice Potencial de acción. Potasio. Calcio. Magnesio. Bloqueadores canal de K. Bloqueadores canal de Na. Bloqueadores bomba Na-K ATPasa. Bloqueadores
ECG Electrolitos y Fármacos Adriano Pellegrini A. Índice Potencial de acción. Potasio. Calcio. Magnesio. Bloqueadores canal de K. Bloqueadores canal de Na. Bloqueadores bomba Na-K ATPasa. Bloqueadores
Sistemas de ingreso, intercambio y transporte de sustancias en el organismo. Sistema Circulatorio
 Sistema circulatorio Observe y explore comprensivamente esta presentación Sistemas de ingreso, intercambio y transporte de sustancias en el organismo: Sistema circulatorio. Esta le permitirá avanzar y
Sistema circulatorio Observe y explore comprensivamente esta presentación Sistemas de ingreso, intercambio y transporte de sustancias en el organismo: Sistema circulatorio. Esta le permitirá avanzar y
Un Nuevo Método de Tratamiento Para los Aneurismas Cerebrales
 Pipeline dispositivo de embolización Un Nuevo Método de Tratamiento Para los Aneurismas Cerebrales ACERCA DE LOS ANEURISMAS Qué es un aneurisma cerebral? Un aneurisma es una evaginación o protuberancia
Pipeline dispositivo de embolización Un Nuevo Método de Tratamiento Para los Aneurismas Cerebrales ACERCA DE LOS ANEURISMAS Qué es un aneurisma cerebral? Un aneurisma es una evaginación o protuberancia
Covarianza y coeficiente de correlación
 Covarianza y coeficiente de correlación Cuando analizábamos las variables unidimensionales considerábamos, entre otras medidas importantes, la media y la varianza. Ahora hemos visto que estas medidas también
Covarianza y coeficiente de correlación Cuando analizábamos las variables unidimensionales considerábamos, entre otras medidas importantes, la media y la varianza. Ahora hemos visto que estas medidas también
Capítulo 7: TÉCNICAS DIAGNÓSTICAS:
 Capítulo 7: TÉCNICAS DIAGNÓSTICAS: Dr. J. Carneado Ruiz. Cómo se diagnostica un ictus? Esto se hace mediante la evaluación de los síntomas y signos del paciente por un médico, preferentemente un Neurólogo.
Capítulo 7: TÉCNICAS DIAGNÓSTICAS: Dr. J. Carneado Ruiz. Cómo se diagnostica un ictus? Esto se hace mediante la evaluación de los síntomas y signos del paciente por un médico, preferentemente un Neurólogo.
VIII. Terapias no Farmacológicas en Arritmias. A. Cardioversión Eléctrica
 VIII. Terapias no Farmacológicas en Arritmias A. Cardioversión Eléctrica La cardioversión eléctrica y la desfibrilación son procedimientos utilizados para recuperar el ritmo sinusal en pacientes con arritmias
VIII. Terapias no Farmacológicas en Arritmias A. Cardioversión Eléctrica La cardioversión eléctrica y la desfibrilación son procedimientos utilizados para recuperar el ritmo sinusal en pacientes con arritmias
CLASE de PATOLOGÍA A ARTERIAL
 CLASE de PATOLOGÍA A ARTERIAL Profesor Dr. Anatole Luis Bender Cátedra de Cirugía a II Unidad Académica nº n 4 Hospital San Roque Facultad de Ciencias MédicasM Universidad Nacional de CórdobaC Aneurismas
CLASE de PATOLOGÍA A ARTERIAL Profesor Dr. Anatole Luis Bender Cátedra de Cirugía a II Unidad Académica nº n 4 Hospital San Roque Facultad de Ciencias MédicasM Universidad Nacional de CórdobaC Aneurismas
Hemorragias. Las hemorragias se pueden clasificar atendiendo a dos criterios. Atendiendo al tipo de vaso que se ha roto.
 Hemorragias. El sistema circulatorio es el responsable del transporte del oxigeno y los nutrientes a las células del organismo. También es responsable de mantener la temperatura interna del cuerpo. Llamamos
Hemorragias. El sistema circulatorio es el responsable del transporte del oxigeno y los nutrientes a las células del organismo. También es responsable de mantener la temperatura interna del cuerpo. Llamamos
Aneurisma de Aorta abdominal
 Aneurisma de Aorta abdominal Tratamiento actual Dra. Caridi Maria de los Angeles Ateneo IDIM 09/Noviembre/2011 Aneurisma Dilatación permanente y localizada de una arteria que tiene, al menos, el 50 % de
Aneurisma de Aorta abdominal Tratamiento actual Dra. Caridi Maria de los Angeles Ateneo IDIM 09/Noviembre/2011 Aneurisma Dilatación permanente y localizada de una arteria que tiene, al menos, el 50 % de
X-Plain La pancreatitis Sumario
 X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
X-Plain La pancreatitis Sumario La pancreatitis es una enfermedad poco común que provoca la inflamación del páncreas. A pesar de ser una enfermedad poco común, casi 80,000 norteamericanos padecen de pancreatitis
Las enfermedades más comunes son el hipotiroidismo, el hipertiroidismo y el nódulo tiroideo.
 TIROIDES Qué es la tiroides? La glándula tiroides, es una glándula que normalmente se localiza en la parte de adelante del cuello, su trabajo es formar las hormonas tiroideas y a través de la sangre, son
TIROIDES Qué es la tiroides? La glándula tiroides, es una glándula que normalmente se localiza en la parte de adelante del cuello, su trabajo es formar las hormonas tiroideas y a través de la sangre, son
Unidad I. 1.1 Sistemas numéricos (Binario, Octal, Decimal, Hexadecimal)
 Unidad I Sistemas numéricos 1.1 Sistemas numéricos (Binario, Octal, Decimal, Hexadecimal) Los computadores manipulan y almacenan los datos usando interruptores electrónicos que están ENCENDIDOS o APAGADOS.
Unidad I Sistemas numéricos 1.1 Sistemas numéricos (Binario, Octal, Decimal, Hexadecimal) Los computadores manipulan y almacenan los datos usando interruptores electrónicos que están ENCENDIDOS o APAGADOS.
CONCEPTOS DE LA FUERZA
 CONCEPTOS DE LA FUERZA PAPEL DE LA FUERZA EN EL RENDIMIENTO DEPORTIVO La mejora de la fuerza es un factor importante en todas las actividades deportivas, y en algunos casos determinantes (en el arbitraje
CONCEPTOS DE LA FUERZA PAPEL DE LA FUERZA EN EL RENDIMIENTO DEPORTIVO La mejora de la fuerza es un factor importante en todas las actividades deportivas, y en algunos casos determinantes (en el arbitraje
MOVIMIENTO ONDULATORIO
 1 Apunte N o 1 Pág. 1 a 7 INTRODUCCION MOVIMIENTO ONDULATORIO Proceso por el que se propaga energía de un lugar a otro sin transferencia de materia, mediante ondas mecánicas o electromagnéticas. En cualquier
1 Apunte N o 1 Pág. 1 a 7 INTRODUCCION MOVIMIENTO ONDULATORIO Proceso por el que se propaga energía de un lugar a otro sin transferencia de materia, mediante ondas mecánicas o electromagnéticas. En cualquier
Guía del superviviente de un infarto de miocardio para Evitar la muerte cardíaca súbita
 Guía del superviviente de un infarto de miocardio para Evitar la muerte cardíaca súbita Para más información, visite: St. Jude Medical at www.sjm.com Asociación Americana del Corazón (American Heart Association)
Guía del superviviente de un infarto de miocardio para Evitar la muerte cardíaca súbita Para más información, visite: St. Jude Medical at www.sjm.com Asociación Americana del Corazón (American Heart Association)
FUENTES DE ALIMENTACION
 FUENTES DE ALIMENTACION INTRODUCCIÓN Podemos definir fuente de alimentación como aparato electrónico modificador de la electricidad que convierte la tensión alterna en una tensión continua. Remontándonos
FUENTES DE ALIMENTACION INTRODUCCIÓN Podemos definir fuente de alimentación como aparato electrónico modificador de la electricidad que convierte la tensión alterna en una tensión continua. Remontándonos
Estas visiones de la información, denominadas vistas, se pueden identificar de varias formas.
 El primer paso en el diseño de una base de datos es la producción del esquema conceptual. Normalmente, se construyen varios esquemas conceptuales, cada uno para representar las distintas visiones que los
El primer paso en el diseño de una base de datos es la producción del esquema conceptual. Normalmente, se construyen varios esquemas conceptuales, cada uno para representar las distintas visiones que los
Por qué se produce? Dieta pobre en calcio Sedentarismo y falta de ejercicio Tabaquismo
 Osteoporosis bajo control www.lillyosteoporosis.com Qué es la osteoporosis? La osteoporosis es una enfermedad que se caracteriza por la pérdida progresiva del tejido óseo, por lo que los huesos se vuelven
Osteoporosis bajo control www.lillyosteoporosis.com Qué es la osteoporosis? La osteoporosis es una enfermedad que se caracteriza por la pérdida progresiva del tejido óseo, por lo que los huesos se vuelven
Ideas básicas sobre movimiento
 Ideas básicas sobre movimiento Todos conocemos por experiencia qué es el movimiento. En nuestra vida cotidiana, observamos y realizamos infinidad de movimientos. El desplazamiento de los coches, el caminar
Ideas básicas sobre movimiento Todos conocemos por experiencia qué es el movimiento. En nuestra vida cotidiana, observamos y realizamos infinidad de movimientos. El desplazamiento de los coches, el caminar
ES 1 097 480 U ESPAÑA 11. Número de publicación: 1 097 480. Número de solicitud: 201331388 A47G 29/00 (2006.01) 03.12.2013
 19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 1 097 480 Número de solicitud: 1331388 1 Int. CI.: A47G 29/00 (06.01) 12 SOLICITUD DE MODELO DE UTILIDAD U 22 Fecha de presentación:
19 OFICINA ESPAÑOLA DE PATENTES Y MARCAS ESPAÑA 11 21 Número de publicación: 1 097 480 Número de solicitud: 1331388 1 Int. CI.: A47G 29/00 (06.01) 12 SOLICITUD DE MODELO DE UTILIDAD U 22 Fecha de presentación:
Tabla 2. Clasificación de la angina de la Canadian Cardiovascular Society.
 Tabla 1: Características Angina de Pecho: - Dolor retroesternal (localización y características que sugieran enfermedad coronaria) - Provocado por ejercicio o estrés emocional - Alivio con el reposo o
Tabla 1: Características Angina de Pecho: - Dolor retroesternal (localización y características que sugieran enfermedad coronaria) - Provocado por ejercicio o estrés emocional - Alivio con el reposo o
El ecocardiograma. Capítulo 6. El ecocardiograma. Forma de realizar un ecocardiograma. El Doppler
 Capítulo 6 El ecocardiograma Dr. Leopoldo Pérez de Isla Médico especialista en Cardiología. Instituto Cardiovascular del Hospital Clínico San Carlos, Madrid El ecocardiograma La ecografía es una de las
Capítulo 6 El ecocardiograma Dr. Leopoldo Pérez de Isla Médico especialista en Cardiología. Instituto Cardiovascular del Hospital Clínico San Carlos, Madrid El ecocardiograma La ecografía es una de las
Qué puedo hacer con los desmayos inexplicables?
 Breve reseña Holter insertable subcutáneo 9526 Reveal Plus El Reveal Plus es un sistema de monitorización implantable activado por el paciente y de forma automática que registra los ECG subcutáneos y está
Breve reseña Holter insertable subcutáneo 9526 Reveal Plus El Reveal Plus es un sistema de monitorización implantable activado por el paciente y de forma automática que registra los ECG subcutáneos y está
Llagas que no cicatrizan
 Llagas que no cicatrizan Introducción Algunas llagas tienen dificultad para cicatrizar por sí solas. Las llagas que no cicatrizan son un problema bastante común. Las llagas abiertas que no cicatrizan también
Llagas que no cicatrizan Introducción Algunas llagas tienen dificultad para cicatrizar por sí solas. Las llagas que no cicatrizan son un problema bastante común. Las llagas abiertas que no cicatrizan también
ENFERMEDAD ARTERIAL DE LOS MIEMBROS INFERIORES
 ENFERMEDAD ARTERIAL DE LOS MIEMBROS INFERIORES Este manual contiene información dirigida al médico, enfermera y paciente, acerca de la enfermedad arterial de los miembros inferiores, su manejo y el tratamiento
ENFERMEDAD ARTERIAL DE LOS MIEMBROS INFERIORES Este manual contiene información dirigida al médico, enfermera y paciente, acerca de la enfermedad arterial de los miembros inferiores, su manejo y el tratamiento
Mamografía. El cuerpo está compuesto de células muy pequeñas. Las células normales del cuerpo crecen y mueren de una manera controlada.
 Mamografía Introducción Una mamografía es un examen que le permite al médico ver imágenes del interior de los senos o mamas. Las mamografías ayudan a detectar tempranamente el cáncer de mama. El éxito
Mamografía Introducción Una mamografía es un examen que le permite al médico ver imágenes del interior de los senos o mamas. Las mamografías ayudan a detectar tempranamente el cáncer de mama. El éxito
BRADIARRITMIAS. Dr. Juan José Fernández Domínguez. Médico de Emergencias. Grupo de Trabajo Cardio-Vascular. SUMMA 112.
 BRADIARRITMIAS Dr. Juan José Fernández Domínguez. Médico de Emergencias. Grupo de Trabajo Cardio-Vascular. SUMMA 112. Cuando La repetición el la impulso activación de este llega ciclo al llega haz de al
BRADIARRITMIAS Dr. Juan José Fernández Domínguez. Médico de Emergencias. Grupo de Trabajo Cardio-Vascular. SUMMA 112. Cuando La repetición el la impulso activación de este llega ciclo al llega haz de al
Tipos de Stents en un
 Página nº 1 Tipos de Stents en un Cateterismo Cardiaco La enfermedad coronaria se produce cuando la ateroesclerosis (acúmulo de lípidos o grasas y células inflamatorias paredes de las arterias provocados
Página nº 1 Tipos de Stents en un Cateterismo Cardiaco La enfermedad coronaria se produce cuando la ateroesclerosis (acúmulo de lípidos o grasas y células inflamatorias paredes de las arterias provocados
Vigilancia del crecimiento
 Vigilancia del crecimiento Indicaciones para comunicadoras y comunicadores Todos los niños y niñas tienen derecho a crecer y a desarrollar su potencial de talentos y capacidades. Esto sólo es posible cuando
Vigilancia del crecimiento Indicaciones para comunicadoras y comunicadores Todos los niños y niñas tienen derecho a crecer y a desarrollar su potencial de talentos y capacidades. Esto sólo es posible cuando
Retinopatía diabética
 Retinopatía diabética Introducción Las personas con diabetes tienen más probabilidades de desarrollar problemas en los ojos que pueden causar ceguera. La retinopatía diabética es una enfermedad que es
Retinopatía diabética Introducción Las personas con diabetes tienen más probabilidades de desarrollar problemas en los ojos que pueden causar ceguera. La retinopatía diabética es una enfermedad que es
2. CARGA DE TRABAJO: DEFINICIÓN DE CARGA FÍSICA Y MENTAL
 2. CARGA DE TRABAJO: DEFINICIÓN DE CARGA FÍSICA Y MENTAL Lo primero que hay que destacar en este apartado es que: LA CARGA DE TRABAJO ES UN FACTOR DE RIESGO PRESENTE EN TODAS LAS ACTIVIDADES LABORALES
2. CARGA DE TRABAJO: DEFINICIÓN DE CARGA FÍSICA Y MENTAL Lo primero que hay que destacar en este apartado es que: LA CARGA DE TRABAJO ES UN FACTOR DE RIESGO PRESENTE EN TODAS LAS ACTIVIDADES LABORALES
ELECTRICIDAD TIPOS DE ELECTRICIDAD. Corriente continua: Tensión, intensidad de corriente y resistencia no varían. Ejemplo: batería.
 Prevención de riesgo eléctrico ELECTRICIDAD Es un agente físico presente en todo tipo de materia que bajo ciertas condiciones especiales se manifiesta como una diferencia de potencial entre dos puntos
Prevención de riesgo eléctrico ELECTRICIDAD Es un agente físico presente en todo tipo de materia que bajo ciertas condiciones especiales se manifiesta como una diferencia de potencial entre dos puntos
La presión arterial y su nuevo órgano. Un recurso para la salud cardiovascular después de un trasplante de órgano. Compartir. Informar. Inspirar.
 La presión arterial y su nuevo órgano Un recurso para la salud cardiovascular después de un trasplante de órgano Compartir. Informar. Inspirar. Comprender la presión arterial La presión arterial es la
La presión arterial y su nuevo órgano Un recurso para la salud cardiovascular después de un trasplante de órgano Compartir. Informar. Inspirar. Comprender la presión arterial La presión arterial es la
Actividades físicas Varices Arritmias Anginas de pecho Hipertensión arterial Obesidad
 Actividades físicas Varices Arritmias Anginas de pecho Hipertensión arterial Obesidad RELACIÓN ENTRE LA ACTIVIDAD FÍSICA Y LA ESPERANZA DE VIDA las poblaciones más activas físicamente suelen vivir más
Actividades físicas Varices Arritmias Anginas de pecho Hipertensión arterial Obesidad RELACIÓN ENTRE LA ACTIVIDAD FÍSICA Y LA ESPERANZA DE VIDA las poblaciones más activas físicamente suelen vivir más
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ECOCARDIOGRAFIA. Principios básicos
 ECOCARDIOGRAFIA La ecocardiografía emplea ondas sonoras para producir una imagen del corazón y ver cómo funciona. Según el tipo de estudio ecocardiográfico que se realice, puede determinarse el tamaño,
ECOCARDIOGRAFIA La ecocardiografía emplea ondas sonoras para producir una imagen del corazón y ver cómo funciona. Según el tipo de estudio ecocardiográfico que se realice, puede determinarse el tamaño,
ARRITMIAS RAPIDAS COLEGIO DE MEDICOS DE SEGOVIA. 17 DICIEMBRE 2009. Dra. Rey García. UNIDAD DE CUIDADOS INTENSIVOS
 ARRITMIAS RAPIDAS COLEGIO DE MEDICOS DE SEGOVIA. 17 DICIEMBRE 2009 Dra. Rey García. UNIDAD DE CUIDADOS INTENSIVOS SISTEMA DE CONDUCCION NORMAL TAQUIARRITMIAS SUPRAVENTRICULARES SINUSALES Taquicardia sinusal
ARRITMIAS RAPIDAS COLEGIO DE MEDICOS DE SEGOVIA. 17 DICIEMBRE 2009 Dra. Rey García. UNIDAD DE CUIDADOS INTENSIVOS SISTEMA DE CONDUCCION NORMAL TAQUIARRITMIAS SUPRAVENTRICULARES SINUSALES Taquicardia sinusal
AFECCIONES MÉDICAS FIBRILACIÓN VENTRICULAR (FV)
 AFECCIONES MÉDICAS FIBRILACIÓN VENTRICULAR (FV) Qué es? La fibrilación es un latido o ritmo cardiaco anormalmente rápido y caótico. El ritmo cardiaco anormal se llama arritmia. Las arritmias pueden ser
AFECCIONES MÉDICAS FIBRILACIÓN VENTRICULAR (FV) Qué es? La fibrilación es un latido o ritmo cardiaco anormalmente rápido y caótico. El ritmo cardiaco anormal se llama arritmia. Las arritmias pueden ser
INFORMACIÓN PARA PACIENTES 9.1. PREVENCIÓN DEL CÁNCER COLORRECTAL DÓNDE SE LOCALIZA EL CÁNCER COLORRECTAL? Estómago. Intestino delgado.
 Anexo 9. INFORMACIÓN PARA PACIENTES 9.1. PREVENCIÓN DEL CÁNCER COLORRECTAL DÓNDE SE LOCALIZA EL CÁNCER COLORRECTAL? Cuando hablamos de CCR nos referimos a aquel cáncer que ocurre en el colon o en el recto.
Anexo 9. INFORMACIÓN PARA PACIENTES 9.1. PREVENCIÓN DEL CÁNCER COLORRECTAL DÓNDE SE LOCALIZA EL CÁNCER COLORRECTAL? Cuando hablamos de CCR nos referimos a aquel cáncer que ocurre en el colon o en el recto.
