Cómo se logra esa diversidad funcional? estructuras tridimensionales posibles. diversidad de secuencias primarias
|
|
|
- Valentín Lucero Ruiz
- hace 7 años
- Vistas:
Transcripción
1 Proteínas Proteínas cumplen diversas funciones en sistemas biológicos: enzimática (enzimas intervienen en todos procesos biológicos y químicos en la célula) estructural (colágeno, queratina, elastina) hormonal (insulina) de reserva (proteínas semillas y huevos) transporte (albúmina, proteínas transportadoras de ácidos grasos) contráctil (miosina, actina y tubulina) protectora (toxinas y alergenos) anticuerpos (inmunoglobulinas)
2 Cómo se logra esa diversidad funcional? diversidad de secuencias primarias Pro-Ile-Asp-Asn-Glu-Glnl-Arg-Gly-Met-Thr-Pro-Phe-Tyr-Trp-Pro-Phe-Tyr-Trp-Pro-Phe-Tyr-Trp Tyr-Trp-Leu-Ile-Asp-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-ThrPro-Phe-Tyr-Trp-Leu-Phe- Pro-Phe-Tyr--Lys-VaTrp-Leu-Ile-Asp-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-Thr Leu-Ile-Pro-Phe-Tyr-Trp-Asp-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-Thr-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-Thr Phe-Tyr-TrPro-p-Leu-Ile-Asp-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-Thr-Gln-Lys-Val-Gln-Lys-Val Pro-Phe-Tyr-Trp-Leu-Ile-Asp-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-Thr Ile-Asp-Asn-Glu-Gln-Lys-Val-Arg-Gly-Met-Thr-Pro-Phe-Tyr-Trp-Leu-Thr-Pro-Phe-Tyr-Trp-Thr-Pro-Phe-Tyr-Trp estructuras tridimensionales posibles Infinitas formas proteicas distintas dependiendo de la longitud de la cadena polipeptidica, tipo y proporción de aminoácidos presentes y la secuencia en que estos se encuentran
3 Niveles estructurales en las proteínas Estructura primaria: cadena lineal de aminoacidos unidos por enlace amida Estructura secundaria: disposición espacial periódica de los a.a. en segmentos de la cadena polipeptdidica Estructura terciaria: disposición espacial lograda cuando la cadena polipeptidica se pliega en una estructura tridimensional Estructura cuaternaria: disposición espacial de monómeros de proteínas
4 Plegamiento de proteínas Desplegado Nativo Conocer como ocurre el proceso de plegamiento es uno de los grandes problemas de la bioquímica importancia básica relevancia biotecnológica importancia médica Toda la información para el plegamiento se encuentra en la secuencia de aminoácidos (experimento de replegamiento de ribonucleasa (Anfinsen)
5 Proceso cooperativo no se acumulan estados parcialmente plegados
6 Paradoja de Levinthal: las proteínas no se pliegan explorando todas las conformaciones al azar Se fijan estados intermediarios parcialmente plegados
7 Conformación nativa: estado termodinámico en que se favorecen interacciones favorables y se minimizan desfavorables Qué fuerzas están implicadas en la estabilidad de proteínas? Interacciones electrostáticas (atractivas o repulsivas) su fuerza depende del medio Interacciones puente Hidrógeno: interacción entre átomo de hidrógeno unido covalentemente a átomo electronegativo (N, O, S) con otro átomo electronegativo Interacciones de van der Waals: dipolo-dipolo inducido, dipolo inducido-dipolo inducido entre átomos neutros Impedimentos estéricos Enlaces disulfuro: por oxidación de cisteínas Todas estas interacciones estabilizan la estructura de una proteína, pero no provocan su plegamiento en solución acuosa Interacciones hidrofóbicas
8 Porqué se pliegan las proteínas? Fuerza impulsora: efecto hidrofóbico (cadenas laterales apolares se esconden del solvente) G pleg = H pleg -T S pleg Cadenas laterales hidrofóbicas interaccionan con el agua ( H negativo). Al hacerlo, muchas moléculas de agua se estructuran a su alrededor ( S negativo) El sistema se rearregla para acomodar grupos hidrofóbicos escondidos del agua e hidrofílicos interaccionando con ella. La entropía del sistema aumenta y es la que dirige el proceso
9 Investigación en proteínas Proteoma: proteínas expresadas por el genoma función de proteínas interacciones entre proteínas en vía metabólica proceso dinámico (depende de estado fisiológico, edad, etc.) Pasos a seguir: Fraccionamiento celular Purificación Análisis de estructura
10 Material de partida: reconocer en que fracción celular se encuentra la proteína de interés.
11 Métodos de purificación: diferencias en solubilidad, tamaño, carga o afinidad por ligandos Importante! Ensayo para identificar proteína de interés Cuantificar proteína en cada paso de purificación
12 Precipitación salina (solubilidad) Las proteínas son menos solubles en soluciones concentradas de ciertas sales (carácter cosmotrópico de ciertos iones: aumentan la estructura del agua) proteínas presentan distinta solubilidad a alta concentración de sal Se precipitan las moléculas de proteína por interacción hidrofóbica entre aminoácidos de distintas moléculas
13 Diálisis (tamaño) Membrana porosa que permite el flujo de ciertas moléculas y retiene otras de acuerdo a su tamaño. Técnica muy utilizada para cambio de buffer o separación de proteínas grandes de moléculas pequeñas
14 Cromatografía de exclusión molecular: separa por tamaño molecular Se utiliza para: Separación de proteínas Desalado Cálculo de peso molecular (relación entre peso molecular y coeficiente de partición en una columna cromatográfica)
15 Cromatografía de intercambio iónico: separa de acuerdo a la carga de la molécula Intercambio aniónico Intercambio catiónico Cómo despego las proteínas unidas?
16 Cromatografía de afinidad Ventajas: especificidad Desventajas: especificidad Enzima-sustrato Antígeno anticuerpo Ligando-receptor Ligando-proteína transportadora Cómo despego las proteínas unidas?
17 HPLC: high pressure liquid cromatography aumenta la resolución disminuye la dilución de la muestra
18 Electroforesis en gel de poliacrilamida: separa por tamaño y carga (No se utiliza como método de separación sino de identificación y cuantificación) velocidad de migración Coeficiente de fricción ν = q E / f f = 6πηr E= campo eléctrico q= carga proteína η= viscosidad del medio r= radio proteína Condiciones nativas: migración depende de carga, masa y forma Soporte sólido actúa como tamiz
19 Electroforesis en condiciones desnaturalizantes: Se despliega la proteína y se la tapiza con cargas negativas con SDS Separa por masa molecular (relación inversamente proporcional entre la masa de una proteína y su movilidad relativa en un gel de electroforesis) Nos independizamos de la carga y la forma de la proteína Tinción con coomasie Técnica altamente resolutiva y económica
20 Isoelectroenfoque: separa por diferencia en pi velocidad de migración ν = q E / f
21 Electroforesis bidimensional isoelectroenfoque (carga) SDS-poliacrilamida (masa)
22 En cada calle se siembra igual cantidad de proteína total. Al final de la purificación la banda de la proteína de interés se hace más importante
23 Sedimentación diferencial Permite conocer masa, densidad, forma S= m(1-νρ)/f ν=volumen específico parcial ρ=densidad del medio f= coeficiente de fricción (1-νρ)= fuerza flotación ejercida por líquido
24 Obtenida la proteína pura.. Técnicas para estudiar distintos niveles de la estructura proteica Secuenciación (estructura primaria) Fluorescencia (estructura tridimensional y terciaria) NMR (estructura secundaria y terciaria) Rayos X (estructura secundaria y terciaria) Infrarrojo (estructura secundaria y terciaria) Dicroísmo Circular (estructura secundaria y terciaria)
25 Análisis de estructura primaria Determinación de composición de aminoácidos: hidrólisis con HCl 6N a 110ºC durante 24 hs y posterior análisis cromatográfico del producto.
26 Secuenciación de Edman: separa de a uno a la vez el residuo amino terminal En la práctica, los segmentos de aminoácidos no pueden ser muy largos: previamente a la secuenciación se somete a la proteína a proteólisis con distintas proteasas para obtener segmentos más cortos y fáciles de analizar Luego por solapamiento de secuencias se obtiene la secuencia de la proteína
27 Espectroscopía de emisión de fluorescencia Emisión siempre ocurre desde S 1 λ em > λ exc ; energía em < energía exc
28
29 Triptofano: muy sensible a la polaridad del medio Muy útil para medir cambios conformacionales Proteína con muchos triptofanos, se observa un promedio: pierde sensibilidad
30 ESPECTROSCOPÍA DE ABSORCIÓN EN EL INFRARROJO medición de transiciones vibracionales entre el estado basal y el primer estado vibracional las vibraciones características de átomos unidos covalentemente son: stretching y bending
31 la banda de absorción más utilizada para el estudio de la estructura de proteínas es la Amida I (C=O stretching) Espectro de absorción al infrarrojo de B-FABP Amida I (') t(0) t(3 hs) el espectro de IR de proteínas presenta varias bandas que son debidas a la vibración de los átomos involucrados en el enlace peptídico Absorbance Amida II (y cadenas laterales) 0.00 Amida II' Wavenumber (cm -1 )
32 Asignación de bandas (cm -1 ) Conformación en solución de H 2 O en solución de D 2 O hélice alfa cadena beta antiparalela cadena beta paralela desordenadas de acuerdo a los distintos arreglos de puente hidrógeno (distintas estructuras secundarias) la banda Amida I aparecerá en distintas posiciones B-FABP α-lactalbumina BSA Absorbance Absorbance Absorbancia ν (cm -1 ) ν (cm -1 ) ν (cm -1 )
33 Cristalografía de rayos X
34 Patrón de difracción de rayos X Mapa de densidad electrónica Cristal proteico conserva actividad biológica: estructura nativa Desventajas: no todas las proteínas son cristalizables costoso permite solo el estudio de proteínas en solución
35 Nuclear magnetic resonance (NMR) Núcleos atómicos intrínsicamente magnéticos: spin (rotación) Rotación genera momento magnético Al aplicar un campo magnético este momento puede adoptar dos orientaciones Se aplica pulso de radiación electromagnética (radiofrecuencia)
36 Entorno químico afecta la frecuencia con la que el núcleo resuena Determinación de estructura Proteína de 55 aminoácidos Más compleja la molécula, más complejo el espectro
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009
 2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009 El genoma haploide de un humano contiene 20,000-25,000 genes que codifican a proteínas. Transportadores Enzimas Receptores Estructurales Hormonas
2. ESTRUCTURA Y PROPIEDADES DE PROTEÍNAS. 25 Agosto, 2009 El genoma haploide de un humano contiene 20,000-25,000 genes que codifican a proteínas. Transportadores Enzimas Receptores Estructurales Hormonas
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Técnicas de Caracterización y purificación
 Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
Secuencia de Aminoácidos en las Proteínas. Tema 7 SECUENCIACIÓN PEPTÍDICA. Etapas para el conocimiento de una secuencia peptídica (I)
 Secuencia de Aminoácidos en las Proteínas Es característica para cada proteína Tema 7 SECUENCIACIÓN PEPTÍDICA Es codificada por una secuencia de nucleótidos del DNA Por lo tanto, es una forma de información
Secuencia de Aminoácidos en las Proteínas Es característica para cada proteína Tema 7 SECUENCIACIÓN PEPTÍDICA Es codificada por una secuencia de nucleótidos del DNA Por lo tanto, es una forma de información
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
Tema 6 Cuantificación de proteínas
 Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
Estructura 3D de proteínas
 Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
Estructura 3D de proteínas Aportaciones de la Bioinformática Structural Bioinformatics Laboratory Research Group on Biomedical Informatics (GRIB) Universitat Pompeu Fabra Sumario Conceptos básicos (I):
QUÍMICA DE LAS BIOMOLÉCULAS
 QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
PRECIPITACIÓN EN BREVE. Francisco José Guerra Millán
 PRECIPITACIÓN EN BREVE Francisco José Guerra Millán www.pacopepe.com.mx BREVE DESCRIPCIÓN La precipitación consiste en la separación química de los componentes de una disolución. Esta separación se realiza
PRECIPITACIÓN EN BREVE Francisco José Guerra Millán www.pacopepe.com.mx BREVE DESCRIPCIÓN La precipitación consiste en la separación química de los componentes de una disolución. Esta separación se realiza
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
a) Aminoácidos b) Estructura primaria
 Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Estructura de proteínas
 Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
Estructura de proteínas diversidad química de las cadenas laterales de los aa diversidad funcional Reconocimiento de ligandos catalisis Elementos estructurales Para que la cadena polipeptidica funcione
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
Purificación de proteínas
 Purificación de proteínas Purificación Proceso que cuenta con varias etapas cuyo objetivo es lograr la concentración diferencial de la proteína o molécula de interés Condiciones generales a evaluar Calidad
Purificación de proteínas Purificación Proceso que cuenta con varias etapas cuyo objetivo es lograr la concentración diferencial de la proteína o molécula de interés Condiciones generales a evaluar Calidad
Proteínas: Métodos para su Estudio
 Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
Proteínas: Métodos para su Estudio Propiedades Espectroscópicas Todos los aminoácidos absorben luz en la región infraroja Sólo Phe, Tyr, & Trp absorben UV Absorbancia a 280 nm es un buen diagnóstico para
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Análisis de proteínas
 Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
Análisis de proteínas Qué determina su estructura? Composición de las proteínas Las proteínas son polímeros de aminoácidos que se unen mediante una unión peptídica Todos los aminoácidos tienen un grupo
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
Polaridad de una molécula
 Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
Polaridad de una molécula Una molécula se considera polar si existe un momento dipolar neto debido a sus enlaces Depende de su geometría Una molécula formada por enlaces polares no necesariamente debe
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
Elucidación Estructural de Biomoléculas utilizando Resonancia Magnética Nuclear
 Universidad de Los Andes Facultad de Ciencias Postgrado Interdisciplinario en Química Aplicada Mención Estudio de Materiales Elucidación Estructural de Biomoléculas utilizando Resonancia Magnética Nuclear
Universidad de Los Andes Facultad de Ciencias Postgrado Interdisciplinario en Química Aplicada Mención Estudio de Materiales Elucidación Estructural de Biomoléculas utilizando Resonancia Magnética Nuclear
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Cuantificación y análisis químico de proteínas
 Cuantificación y análisis químico de proteínas Enlace peptídico R 1 R 2 Secuencia: AlaGluGlyLys o AEGK Puentes disulfuro COO- COO- COO- NH 2 NH 2 NH 2 Modificaciones Post-traduccionales I Análisis químico
Cuantificación y análisis químico de proteínas Enlace peptídico R 1 R 2 Secuencia: AlaGluGlyLys o AEGK Puentes disulfuro COO- COO- COO- NH 2 NH 2 NH 2 Modificaciones Post-traduccionales I Análisis químico
Paula Sceni Mariana Capello Daniela Igartúa. Proteínas
 Paula Sceni Mariana Capello Daniela Igartúa Proteínas Segundo cuatrimestre 2017 Aminoácidos y Proteínas Aminoácidos Las propiedades fisicoquímicas, como la carga neta, la solubilidad, la α reactividad
Paula Sceni Mariana Capello Daniela Igartúa Proteínas Segundo cuatrimestre 2017 Aminoácidos y Proteínas Aminoácidos Las propiedades fisicoquímicas, como la carga neta, la solubilidad, la α reactividad
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
Estructura secundaria de las proteínas
 Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
Estructura secundaria de las proteínas Niveles de estructuración en las proteínas Se refiere a cualquier segmento de una cadena polipeptídica y describe el arreglo espacial local de los átomos de la cadena
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS. Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo (+)
 GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
PÉPTIDOS Y PROTEÍNAS
 PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
PÉPTID Y PTEÍA 2 2 ' 2 ' n 2 -terminal (izquierda) 2 ' n2 -terminal (derecha) n
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Estructura tridimensional de las proteínas
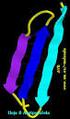 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Plegamiento y Estructura Terciaria
 Plegamiento y Estructura Terciaria Para el plegamiento apropiado y la formación correcta de los posibles enlaces disulfuro de una molécula proteica, no se requiere una mayor o especial información, que
Plegamiento y Estructura Terciaria Para el plegamiento apropiado y la formación correcta de los posibles enlaces disulfuro de una molécula proteica, no se requiere una mayor o especial información, que
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
Clasificación de las proteinas según su conformación
 lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
lasificación de las proteinas según su conformación Proteinas fibrosas (insolubles) olágeno α-queratina elastina tejido conectivo, tendones pelo, uñas tejido conectivo elástico Proteinas globulares (solubles)
Tema 3. Tema 3. Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos. Péptidos
 Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
Tema 3 Tema 3 Péptidos.. Enlace Peptídico. Péptidos naturales de interés Biológico. Péptidos Enlace Peptídico Nomenclatura de péptidos Características estructurales del enlace peptídico Estéreoespecificidad
PROTEÍNAS. Profa. María Moreno Biología 1º bach.
 PROTEÍNAS Profa. María Moreno Biología 1º bach. DEFINICIÓN Polímeros (macromoléculas) formados por la unión de varios aminoácidos por enlace peptídico. Biomoléculas más abundantes en los s.v., después
PROTEÍNAS Profa. María Moreno Biología 1º bach. DEFINICIÓN Polímeros (macromoléculas) formados por la unión de varios aminoácidos por enlace peptídico. Biomoléculas más abundantes en los s.v., después
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
PURIFICACION Y CARACTERIZACION DE LAS PROTEINAS.
 PURIFICACION Y CARACTERIZACION DE LAS PROTEINAS. 1 METODOS GENERALES DE PURIFICACION DE PROTEINAS. 1)Ruptura del material y obtención de un extracto libre de células. 2)Precipitación (sales, ph, alta temperatura,
PURIFICACION Y CARACTERIZACION DE LAS PROTEINAS. 1 METODOS GENERALES DE PURIFICACION DE PROTEINAS. 1)Ruptura del material y obtención de un extracto libre de células. 2)Precipitación (sales, ph, alta temperatura,
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
AMINOÁCIDOS, PEPTIDOS Y PROTEÍNAS. Profesor Carlos Urzúa Stricker
 AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
ESTRUCTURA DEL SEMINARIO:
 ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
ESTRUCTURA DEL SEMINARIO: S1.1. Introducción a la espectrofotometría 1 S1.2. Radiación electromagnética 1 S1.3. Espectroscopía ultravioleta/visible 2 S1.4. Colorimetría 5 S1.1. Introducción a la espectrofotometría
AMINOÁCIDOS SE PUEDEN UNIR POR ENLACES PEPTÍDICOS
 Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
Tema 4. Proteínas: funciones biológicas y estructura primaria. Enlace peptídico. Péptidos y proteínas. Diversidad de funciones biológicas. Niveles de organización estructural de las proteínas. Separación
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Las proteínas son las moléculas orgánicas más abundantes en las células, más del 50% del
 LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
SERIE Nº 4. Aminoácidos, Péptidos y Proteínas
 SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
PURIFICACIÓN DE PROTEÍNAS
 PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
ACIDOS NUCLEICOS nucleotidos. PROTEINAS aminoácidos. POLISACARIDOS monosacáridos
 AIDOS NULEIOS nucleotidos PROTEINAS aminoácidos POLISAARIDOS monosacáridos ESTRUTURA DE PROTEÍNAS: POLÍMEROS DE AMINOÁIDOS PRIMARIA NIVELES ESTRUTURALES SEUNDARIA TERIARIA Formas de representación de proteínas
AIDOS NULEIOS nucleotidos PROTEINAS aminoácidos POLISAARIDOS monosacáridos ESTRUTURA DE PROTEÍNAS: POLÍMEROS DE AMINOÁIDOS PRIMARIA NIVELES ESTRUTURALES SEUNDARIA TERIARIA Formas de representación de proteínas
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Formación del enlace peptídico por condensación de dos aminoácidos. Amida
 PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser Gly Tyr Ala Leu Ejemplo de un tetrapéptido
Bioquímica Estructural y Metabólica. Tema 2. Aminoácidos
 TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
TEMA 2. Aminoácidos. Estructura y propiedades de los aminoácidos. Estereoisomería. Clasificación de los aminoácidos según sus cadenas laterales. Aminoácidos esenciales y no esenciales. Modificaciones post-
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
I) Biomoléculas 5) Proteínas I-5 PROTEÍNAS
 I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
I-5 PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Interacciones moleculares en sistemas biológicos
 Interacciones moleculares en sistemas biológicos Qué es una molécula? Compuesto con estequeometría y estructura bien definida y no fácilmente disociable Qué es una macromolécula biológica? Molécula grande
Interacciones moleculares en sistemas biológicos Qué es una molécula? Compuesto con estequeometría y estructura bien definida y no fácilmente disociable Qué es una macromolécula biológica? Molécula grande
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas.
 Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Clase 5. Los aminoácidos: Precursores de transmisores. Unidades de las proteínas. Las enzimas. Los aminoácidos se clasifican en unas pocas categorías diferenciadas, basadas sobre todo en su solubilidad
Aminoácidos y péptidos
 Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
Aminoácidos y péptidos AMINOÁCIDOS: Moléculas orgánicas con un grupo amino (NH 2) y un grupo carboxilo (COOH). Los aminoácidos proteicos son α aminoácidos, que portan las dos funciones sobre el carbono
FUERZAS INTERMOLECULARES
 FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
FUERZAS INTERMOLECULARES Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben
Estructura y función de macromoléculas
 Estructura y función de macromoléculas PowerPoint Lectures for Biology, Seventh Edition Neil Campbell and Jane Reece Lectures by Chris Romero Las moléculas de la vida Dentro de las células, moléculas orgánicas
Estructura y función de macromoléculas PowerPoint Lectures for Biology, Seventh Edition Neil Campbell and Jane Reece Lectures by Chris Romero Las moléculas de la vida Dentro de las células, moléculas orgánicas
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO
 Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Alianza para el Aprendizaje de Ciencias y Matemáticas CÓMO SE PUEDE DETERMINAR LA SECUENCIA DEL DNA A PARTIR DE UNA PROTEÍNA? DR. MANUEL E. AQUINO GUÍA DEL MAESTRO ESTÁNDARES ATENDIDOS: 1. LA NATURALEZA
Estructura tridimensional de proteínas
 Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
Estructura tridimensional de proteínas 1. En solución acuosa, la conformación proteica esta determinada por dos factores prioritarios. Uno es la formación de un número máximo de enlaces de hidrógeno. El
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AGUA Y SOLUCIONES La molécula de agua La molécula de agua Líquido, sólido o gaseoso: existen los tres en la tierra Solvente Universal: por lo que es casi imposible
PROTEINAS AMINOACIDOS
 PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS.
 Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
Guía de Estudio Dirigido TEMA 5: ESTRUCTURA Y QUÍMICA DE AMINOACIDOS Y PROTEÍNAS. 1. Formular los siguientes aminoácidos: alanina, fenilalanina, lisina, histidina, isoleucina, treonina. Indicar para cada
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
Universidad Nacional de la Patagonia San Juan Bosco Facultad de Ciencias Naturales Química Biológica Introducción
 Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Química Biológica TP 4 PROTEINAS,. Introducción Las proteínas son biomoléculas formados por 20 L-α-aminoácidos distintos, unidos linealmente entre sí por enlaces peptídicos, en un número que varía entre
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
6. Cuál de las siguientes afirmaciones es cierta con relación a la composición de aminoácidos de las proteínas?
 Péptidos y proteínas 1. Un octapéptido compuesto de cuatro unidades repetidas de glicilalanilo tiene: a) Dos grupos aminos libres y dos grupos carboxilos libres. b) Un solo grupo amino libre en el residuo
Péptidos y proteínas 1. Un octapéptido compuesto de cuatro unidades repetidas de glicilalanilo tiene: a) Dos grupos aminos libres y dos grupos carboxilos libres. b) Un solo grupo amino libre en el residuo
TRABAJO PRÁCTICO Nº 2 CUANTIFICACIÓN DE PROTEÍNAS POR EL MÉTODO DE BRADFORD.
 AÑO 2010 PRIMER SEMESTRE LABORATORIO ASIGNATURA DE BIOQUÍMICA. PLAN COMÚN AGRONOMÍA E INGENIERÍA FORESTAL FACULTAD CIENCIAS SILVOAGROPECUARIAS TRABAJO PRÁCTICO Nº 2 CUANTIFICACIÓN DE PROTEÍNAS POR EL MÉTODO
AÑO 2010 PRIMER SEMESTRE LABORATORIO ASIGNATURA DE BIOQUÍMICA. PLAN COMÚN AGRONOMÍA E INGENIERÍA FORESTAL FACULTAD CIENCIAS SILVOAGROPECUARIAS TRABAJO PRÁCTICO Nº 2 CUANTIFICACIÓN DE PROTEÍNAS POR EL MÉTODO
