DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON Toxo IgM (REF )
|
|
|
- Jaime Coronel Rivero
- hace 7 años
- Vistas:
Transcripción
1 DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: - Supresiones: 4; LIAISON Toxo IgM (REF ) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Toxo IgM emplea la tecnología de la quimioluminiscencia (CLIA) en un ensayo inmunológico para la determinación cuantitativa de anticuerpos específicos de clase IgM dirigidos contra el Toxoplasma gondii en muestras de suero o plasma humano. El ensayo debe realizarse en el LIAISON Analyzer. 2. SUMARIO Y EXPLICACIÓN DEL TEST La toxoplasmosis es una enfermedad infecciosa de gran difusión causada por el parásito protozoario endocelular Toxoplasma gondii. La infección, que afecta tanto a los hombres como a los animales homeotermos, se puede contraer a través de la ingestión de alimentos infectados o contaminados con oocistos, por contagio directo de animales domésticos o por transmisión transplacentaria. En la literatura se habla también de la transmisión del Toxoplasma como consecuencia de transfusiones o trasplante de órganos. En el individuo adulto normal, la toxoplasmosis casi siempre tiene un proceso benigno: puede ser asintomática, con sintomatología modesta (dolor de cabeza, dolor de garganta, astenia) o, en algunos casos, con la aparición de linfadenopatía. Sólo excepcionalmente se manifiestan molestias más serias, tales como miocarditis, hepatitis, pneumonía, meningoencefalitis y retinocoroiditis. La prevalencia de respuesta positiva a los test serológicos aumenta con la edad de la población considerada e indica que el sujeto ha estado expuesto al Toxoplasma en el pasado. La protección de esta infección parasitaria depende generalmente de la inmunidad mediada por células. Por consiguiente, es más frecuente observar un proceso sintomático en los pacientes sometidos a terapia inmunosupresiva, tanto para prevenir el rechazo del órgano trasplantado, que como tratamiento antitumoral. La encefalitis por Toxoplasma se ha demostrado una importante causa de muerte en los pacientes afectados por el síndrome de inmunodeficiencia adquirida (SIDA). Si se adquiere durante la gestación, la toxoplasmosis puede causar graves consecuencias, tales como el aborto espontáneo, parto prematuro y mortalidad del feto, dado que el agente patógeno puede transmitirse al feto por vía transplacentaria. El feto cuya madre ha contraído la infección por Toxoplasma durante el primer trimestre de embarazo desarrolla graves lesiones en el sistema nervioso central que provocan casi siempre la muerte del feto. Si la infección se verifica durante el segundo trimestre de embarazo, el feto está expuesto a riesgos tales como la hidrocefalia, retardo mental o psicomotor, ceguera y calcificaciones cerebrales. Sin embargo la toxoplasmosis es común sobre todo en el tercer trimestre de embarazo, cuando causa retinocoroiditis y otras lesiones oculares, lesiones al sistema nervioso central e infección asintomática latente que puede dar origen a la enfermedad declarada. La IgM anti-toxoplasma aparece en circulación entre dos y cuatro semanas después de la aparición de la sintomatología clínica. Posteriormente disminuye gradualmente y desaparece después de tres-nueve meses. La presencia de anticuerpos de la clase IgM e IgA en ausencia o en presencia de pequeñas cantidades de anticuerpos de la clase IgG representa por consiguiente una indicación importante de toxoplasmosis aguda. Por el contrario, la presencia de anticuerpos de la clase IgM en presencia de niveles de IgG constantes o en decadencia indica toxoplasmosis subaguda. El diagnóstico diferencial de toxoplasmosis aguda obtenido a través del ensayo sérico de la IgM específica permite la adopción de medidas terapéuticas que reducen el riesgo de la enfermedad tanto en sujetos inmunocomprometidos, como en las mujeres embarazadas. Los niveles de la IgG anti-toxoplasma aumentan gradualmente y alcanzan un máximo entre dos y cinco meses después de que aparezca la sintomatología clínica. Por lo tanto, el ensayo sérico de la IgG es útil para diferenciar a la población que ha contraído la enfermedad de la no inmune. Esto es particularmente importante para la adopción de medidas profilácticas adecuadas en las mujeres fértiles susceptibles. 3. PRINCIPIO DEL ENSAYO El método para la determinación cuantitativa de IgM específica anti-toxoplasma gondii es un ensayo con captura de anticuerpos basado en el principio de la quimioluminiscencia (CLIA). Una IgG monoclonal de ratón anti-igm humana se emplea para recubrir las partículas magnéticas (fase sólida) y un anticuerpo monoclonal de ratón dirigido contra el antígeno mayor de superficie (SAG1) de Toxoplasma gondii está enlazado a un derivado del isoluminol (conjugado anticuerpoisoluminol). Durante la primera incubación, los anticuerpos IgM presentes en los calibradores, en las muestras o en los controles enlazan la fase sólida. Durante la segunda incubación, el anticuerpo conjugado reacciona con el antígeno de Toxoplasma gondii añadido antes y el complejo inmune que se ha formado de este modo reacciona con la IgM ya enlazada a la fase sólida. Después de cada incubación, se elimina el material no enlazado mediante un ciclo de lavado. A continuación, se añaden los reactivos starter que inducen una reacción de quimioluminiscencia. La señal luminosa, y por lo tanto la cantidad de conjugado anticuerpo-isoluminol, se mide con un fotomultiplicador en unidades relativas de luz (RLU, relative light units) e indica la concentración de IgM anti-toxoplasma gondii presente en los calibradores, en las muestras o en los controles. 35 / 43 ES - 200/ ,
2 4. MATERIALES SUMINISTRADOS Integral de reactivos Partículas magnéticas (2,3 ml) Calibrador 1 (1,5 ml) Calibrador 2 (1,5 ml) Antígeno (2,3 ml) Diluyente de muestras (28 ml) Conjugado (21 ml) Partículas magnéticas recubiertas con IgG monoclonal de ratón anti-igm humana, albúmina sérica bovina, tampón PBS, < 0,1% azida sódica. Suero/plasma humano que contiene niveles bajos de IgM anti-toxoplasma gondii, albúmina sérica bovina, tampón PBS, 0,2% ProClin 300 y un colorante amarillo inactivo. Las concentraciones de los calibradores (UA/mL) son calibradas contra una preparación interna de anticuerpos. Suero/plasma humano que contiene niveles altos de IgM anti-toxoplasma gondii, albúmina sérica bovina, tampón PBS, 0,2% ProClin 300 y un colorante azul inactivo. Las concentraciones de los calibradores (UA/mL) son calibradas contra una preparación interna de anticuerpos. Toxoplasma gondii inactivado (cepa RH), obtenido de trofozoítos sometidos a fragmentación y a extracción con detergentes, tampón PBS, 0,2% ProClin 300, conservantes. Albúmina sérica bovina, tampón PBS, 0,2% ProClin 300 y un colorante amarillo inactivo. Anticuerpos monoclonales de ratón dirigidos contra el antígeno mayor de superficie (SAG1) de Toxoplasma gondii conjugados con un derivado del isoluminol, IgG de ratón policlonal no específica, suero bovino fetal, albúmina sérica bovina, tampón PBS, 0,2% ProClin 300, conservantes y un colorante rojo inactivo. Número de ensayos 100 Todos los reactivos se suministran listos para su uso. El orden de los reactivos refleja el orden con el que se han ensamblado los contenedores en el integral de reactivos. Materiales requeridos, pero no suministrados Otros materiales requeridos LIAISON Module (REF ). Controles LIAISON Toxo IgM (negativo y positivo) LIAISON Starter Kit (REF ). (REF ). LIAISON Light Check (REF ). LIAISON Cleaning Kit (REF ). LIAISON Wash/System Liquid (REF ). LIAISON Waste Bags (REF ). 5. ADVERTENCIAS Y PRECAUCIONES Sólo para uso diagnóstico in vitro. Todas las unidades de suero y plasma utilizadas para la fabricación de los componentes de este kit se han analizado y se han encontrado no reactivas para la presencia de HBsAg, anti-hcv, anti-hiv-1 y anti-hiv-2. Sin embargo, visto que ningún método de análisis puede asegurar que los agentes patógenos estén ausentes, todo el material de origen humano se deberá considerar potencialmente infeccioso y manipularlo como tal. 6. NORMAS DE SEGURIDAD No coma, beba, fume o se maquille durante la ejecución del ensayo. No pipetee las soluciones con la boca. Evite el contacto directo con el material potencialmente infeccioso usando batas de laboratorio, gafas de protección y guantes desechables. Lávese cuidadosamente las manos al terminar el ensayo. Evite salpicaduras o formación de aerosoles. En caso de que esto sucediera, cada gota de reactivo se debe eliminar con una solución de hipoclorito sódico al 5% y el medio utilizado se deberá tratar como material residuo potencialmente infeccioso. Todas las muestras, los reactivos biológicos del kit y los materiales usados para efectuar el ensayo se deben considerar capaces de transmitir agentes infecciosos; por lo tanto los residuos se deberán eliminar de acuerdo con las reglamentaciones de las agencias autorizadas que tengan jurisdicción sobre el laboratorio, y con las normativas de cada país. El material desechable deberá ser incinerado; los residuos líquidos deberán ser descontaminados con una solución de hipoclorito sódico a una concentración final del 5% durante media hora como mínimo. Cualquier material que pueda ser reutilizado deberá ser tratado en autoclave con un tratamiento de exceso (overkill) (USP 24, 2000, p. 2143). Generalmente se considera que una hora a 121 C es un tiempo de esterilización adecuado; sin embargo se recomienda a cada usuario que verifique la eficacia del ciclo de descontaminación mediante una validación inicial y el uso rutinario de indicadores biológicos. Los reactivos que contienen ProClin 300 se clasifican como irritantes según las Directivas Europeas aplicables: R 43 - Posibilidad de sensibilización en contacto con la piel. S 24 - Evítese el contacto con la piel. S 37 - Úsense guantes adecuados. S 60 - Elimínense el producto y su recipiente como residuos peligrosos. 36 / 43 ES - 200/ ,
3 7. PREPARACIÓN DE LOS REACTIVOS INTEGRAL DE REACTIVOS Antes de quitar la protección de los contenedores, es esencial agitar horizontalmente el integral de reactivos con delicadeza y sumo cuidado. Evite la formación de espuma. Elimine la protección de los contenedores y gire hacia adelante y hacia atrás la ruedecilla dentada situada por debajo del contenedor de las partículas magnéticas hasta que la suspensión adopte una coloración morena. Este procedimiento da inicio a la resuspensión de las partículas magnéticas. Seque con sumo cuidado la superficie de cada pared para eliminar el líquido residual. Coloque el integral de reactivos en el área de los reactivos del instrumento con la etiqueta de los códigos de barras situada a la izquierda y déjelo agitar durante 30 minutos antes del uso. Durante este tiempo las partículas magnéticas serán mantenidas en agitación automáticamente para garantizar una resuspensión completa. Hágase referencia al manual operativo del instrumento para cargar las muestras e iniciar el ensayo. CONTROLES Hágase referencia a las instrucciones del juego de controles LIAISON Toxo IgM para preparar y manipular los controles. 8. CONSERVACIÓN Y ESTABILIDAD DEL INTEGRAL DE REACTIVOS Sellado: Estable a 2-8 C hasta la fecha de caducidad. Abierto en el instrumento o a 2-8 C: Estabilidad mínima cuatro semanas. Después de este intervalo de tiempo, se puede seguir usando el integral de reactivos, siempre que los controles permanezcan dentro de los límites esperados. Use siempre el mismo LIAISON Analyzer para un integral de reactivos ya abierto. Use las gradillas suministradas con el LIAISON Analyzer para la conservación del integral de reactivos en posición vertical. No congele. Mantenga el integral de reactivos en posición vertical durante la conservación para facilitar la resuspensión de las partículas magnéticas. Mantenga protegido de la luz directa. 9. RECOGIDA Y PREPARACIÓN DE LAS MUESTRAS El ensayo se puede efectuar en muestras de suero o plasma humano. Se pueden utilizar anticoagulantes como el citrato, el EDTA y la heparina. Recoja la sangre mediante punción venosa, déjela coagular y separe el suero del coágulo lo antes posible. Clarifique por filtración o centrifugación antes del ensayo las muestras que presenten material en suspensión, opalescencia, lipemia o residuos eritrocitarios. No use muestras fuertemente hemolizadas o lipémicas, ni muestras que presenten material suspendido o evidente contaminación microbiana. Elimine las eventuales burbujas de aire que pueda haber antes del ensayo. Si el ensayo se lleva a cabo dentro de los siete días sucesivos a la recogida, las muestras se pueden conservar a 2-8 C. En caso contrario, se deben subdividir en alícuotas congeladas a 20 C o a temperaturas inferiores. Si las muestras han sido descongeladas, agítelas con cuidado antes de realizar el ensayo. Dieciséis muestras de diferente reactividad se han conservado durante siete días a 2-8 C y se han sometido a cuatro ciclos de congelación y descongelación. Los resultados no han presentado diferencias significativas. El volumen mínimo de muestra necesario es 170 μl (20 μl de muestra μl de volumen muerto). 10. CALIBRACIÓN El ensayo de los calibradores contenidos en el integral de reactivos permite ajustar la curva predefinida memorizada por el fabricante (curva patrón) en el instrumento como se indica en los códigos de barras que aparecen en la etiqueta del integral de reactivos. Con una solución de los calibradores es posible realizar cuatro calibraciones. El instrumento se debe calibrar en triplicado cada vez que se verifique una de las siguientes condiciones: Se usa un nuevo lote de reactivos starter. La calibración anterior fue realizada más de cuatro semanas antes. Se usa un nuevo lote de integral de reactivos. El instrumento ha sufrido una intervención de asistencia técnica. Los valores de los controles están fuera de los rangos esperados. 11. PROCEDIMIENTO OPERATIVO Para obtener unas prestaciones analíticas ideales hay que respetar estrictamente las instrucciones del manual operativo del instrumento. Cada parámetro del test es identificado mediante el código de barras en la etiqueta del integral de reactivos. En caso de que el lector del código de barras no funcione correctamente, se deberán introducir manualmente los datos convenientes. Hágase referencia al manual operativo del instrumento para una información más detallada. El instrumento realiza las operaciones siguientes: 10 μl Controles o muestras. 100 μl Calibradores. +20μL Partículas magnéticas recubiertas μl Partículas magnéticas recubiertas. +220μL Diluyente de muestras μl Diluyente de muestras. Incubación seguida por un ciclo de lavado. +180μL Conjugado. +20μL Antígeno. Incubación seguida por un ciclo de lavado. Medición. 37 / 43 ES - 200/ ,
4 12. CONTROL DE CALIDAD El control de calidad se debe realizar analizando los controles LIAISON Toxo IgM (a) por lo menos una vez por cada día de trabajo, (b) cuando se usa un nuevo integral de reactivos, (c) cuando se calibra el kit, (d) cuando se usa un nuevo lote de reactivos starter, (e) cuando se determina la adecuación de las prestaciones del integral de reactivos abierto con más de cuatro semanas de anterioridad, o según las disposiciones legislativas y las reglamentaciones vigentes en cada país. Atención: Los controles LIAISON se deben analizar individualmente para evaluar las prestaciones del test. Los valores de los controles tienen que estar comprendidos entre los rangos esperados: cada vez que uno o ambos valores estén fuera de los rangos esperados habrá que volver a efectuar la calibración y probar de nuevo los controles. Si los valores experimentales de los controles estén de nuevo fuera de los rangos predefinidos después de la calibración, habrá que repetir el test usando un frasco de control no abierto. Si los valores de los controles estén fuera de los rangos esperados, los resultados de las muestras no deben ser notificados. Las prestaciones de otros controles se deben evaluar para asegurar su compatibilidad con este test antes del uso. Por lo tanto es indispensable establecer los intervalos de los valores de los materiales usados para el control de calidad. 13. INTERPRETACIÓN DE LOS RESULTADOS El instrumento calcula automáticamente las concentraciones de IgM anti-toxoplasma gondii expresadas en UA/mL y clasifica los resultados. Hágase referencia al manual operativo del instrumento para una información más detallada. Intervalo de ensayo UA/mL de IgM anti-toxoplasma gondii. Por lo general se reconoce que los ensayos que utilizan el método de captura de IgM pueden presentar test de dilución que dependen de la muestra (K. Hansen et al., J. Clin. Microbiol., 29 (1) : , 1991). Por lo tanto, los resultados de las muestras que son mayores que el intervalo de ensayo deben ser considerados y clasificados como superiores a 160 UA/mL. Los resultados de las muestras deben ser interpretados como sigue: Las muestras con concentraciones de IgM anti-toxoplasma gondii por debajo de 6 UA/mL se deben clasificar negativas. Las muestras con concentraciones de IgM anti-toxoplasma gondii entre 6 y 8 UA/mL se deben clasificar dudosas. La detección de otros marcadores de Toxoplasma gondii puede aportar informaciones útiles para la interpretación de los resultados. Las muestras con concentraciones de IgM anti-toxoplasma gondii iguales o por encima de 8 UA/mL se deben clasificar positivas. Un resultado positivo indica la presencia de IgM tras una infección aguda o una infección pasada con persistencia de IgM. Sin embargo, un resultado negativo no excluye con seguridad una toxoplasmosis aguda. Si se sospecha que el paciente ha estado expuesto al Toxoplasma gondii aunque el ensayo de IgM sea negativo, habrá que recoger y ensayar una segunda muestra por lo menos una o dos semanas más tarde. Los resultados del test se muestran de manera cuantitativa como positivos o negativos para la presencia de anticuerpos IgM anti-toxoplasma gondii. Sin embargo, el diagnóstico de una enfermedad infecciosa no se debe formular en base al resultado de un solo ensayo, sino que éste se debe validar con otras pruebas clínicas, procedimientos diagnósticos y con la opinión del médico. Nota - El kit LIAISON Toxo IgM mide la concentración de IgM anti-toxoplasma gondii con altísima sensibilidad y por consiguiente permite una detección muy precoz de los anticuerpos al inicio de la infección aguda. Para interpretar correctamente el significado de la reactividad para IgM, los laboratorios deben adoptar otros procedimientos diagnósticos (por ejemplo, determinación de la avidez de IgG y/o varios test para IgM) porque la IgM anti-toxoplasma puede persistir en el tiempo y las muestras que contienen bajos niveles de IgM persistente son positivas al test. Los laboratorios pueden adoptar también un valor límite más elevado para aumentar la especificidad diagnóstica del kit LIAISON Toxo IgM. Los anticuerpos IgM anti-toxoplasma aumentan rápidamente durante la fase precoz de la infección, mientras que la IgM persistente está presente a nivel inferior antes de desaparecer: la ventana de la positividad para IgM durante el curso de la infección se desplaza hacia la fase precoz. El riesgo de no detectar muestras de pacientes en fase aguda es insignificante y se reduce aún más si se recoge una segunda muestra de los pacientes negativos una o dos semanas más tarde. Si se elige el valor límite más elevado, los resultados de las muestras se deberán interpretar del siguiente modo: Las muestras con concentraciones de IgM anti-toxoplasma gondii por debajo de 10 UA/mL se deben clasificar negativas. Las muestras con concentraciones de IgM anti-toxoplasma gondii iguales o por encima de 10 UA/mL se deben clasificar positivas. La siguiente tabla muestra detalladamente los resultados observados durante la evaluación clínica. Lugar Número de muestras Valor límite Especificidad diagnóstica Toxoplasmosis aguda Sensibilidad diagnóstica IgM anti-toxo persistente Muestras positivas para IgM anti-toxo Pavia, Italia UA/mL 97,3% 99,6% 10 UA/mL 99,1% 91,8% París, Francia UA/mL 94,0% 100% 95,0% 97,3% 10 UA/mL 97,5% 100% 90,0% 94,6% CDC, GA, USA UA/mL 96,9% 100% 100% 10 UA/mL 96,9% 100% 100% Palo Alto, CA, 6-8 UA/mL 100% 100% 100% 100% 200 USA 10 UA/mL 100% 100% 94,0% 97,0% 38 / 43 ES - 200/ ,
5 14. LIMITACIONES DEL ENSAYO Para obtener resultados fiables es necesario atenerse estrictamente a las instrucciones de utilización y poseer una adecuada técnica manual. La contaminación bacteriana de las muestras o la inactivación mediante calentamiento pueden modificar los resultados del análisis. 15. PRESTACIONES METODOLÓGICAS DEL KIT Especificidad analítica La especificidad analítica se define como la capacidad que tiene el test para detectar exactamente el analito ante la presencia de factores potencialmente interferentes en la matriz de la muestra (por ejemplo, anticoagulantes, hemolisis, efectos de tratamientos de la muestra) o de reacciones cruzadas con anticuerpos potencialmente interferentes. Interferencias. Estudios controlados sobre los factores potencialmente interferentes han demostrado que las prestaciones del test no están influenciadas por anticoagulantes (citrato sódico, EDTA, heparina), hemolisis (hasta 1000 mg/dl de hemoglobina), lipemia (hasta 3000 mg/dl de triglicéridos), bilirrubinemia (hasta 20 mg/dl de bilirrubina) o por los ciclos de congelación y descongelación de las muestras. Reacciones cruzadas. Las reacciones cruzadas del ensayo LIAISON Toxo IgM se estudiaron para evaluar las interferencias potenciales por parte de anticuerpos dirigidos contra otros organismos que pueden causar síntomas clínicos similares a los de una infección por Toxoplasma (EBV, hcmv, virus de la rubéola, parvovirus B19), por parte de anticuerpos dirigidos contra otros organismos vectores de enfermedades infecciosas (Treponema pallidum, Borrelia burgdorferi, HSV, VZV, virus del sarampión, virus de la parotitis, HIV, HCV), así como también por parte de otras condiciones que derivan de una actividad atípica del sistema inmunitario (anticuerpos anti-nucleares, factor reumatoide, anticuerpos humanos anti-ratón [HAMA, human anti-mouse antibodies]). Las muestras para estos estudios se ensayaron anteriormente con otro ensayo para IgM anti- Toxoplasma comercializado y si resultaron negativas para la presencia de IgM anti-toxoplasma, se utilizaron para estudiar las reacciones cruzadas potenciales. La presencia de potenciales anticuerpos interferentes en las muestras ha sido detectada con ensayos de marca CE. Condición clínica Número de muestras esperadas negativas Resultados positivos o dudosos con LIAISON Anticuerpos IgM + IgG anti-parvovirus B Anticuerpos IgM anti-virus de la rubéola 15 0 Anticuerpos IgM anti-hcmv 17 0 Anticuerpos IgM anti-ebv 8 0 Anticuerpos anti-hcv 10 0 Anticuerpos anti-hiv 36 0 Anticuerpos IgM + IgG anti-hsv-1/ Anticuerpos IgM + IgG anti-borrelia burgdorferi 7 0 Anticuerpos IgM + IgG anti-virus de la parotitis 5 0 Anticuerpos IgM anti-virus del sarampión 5 0 Anticuerpos IgM anti-vzv 11 0 Anticuerpos IgM + IgG anti-treponema pallidum 5 0 Anticuerpos anti-nucleares (ANA/ENA) 12 0 Factor reumatoide (inmunoglobulinas anti-fc) 10 0 Anticuerpos humanos anti-ratón (HAMA) 14 0 Hipergammaglobulinemia 20 0 Total Precisión La repetibilidad y la reproducibilidad del ensayo (es decir las variaciones intra-ensayo e inter-ensayo) han sido determinadas utilizando muestras en diferentes concentraciones de analito. Los resultados se refieren a los grupos de pacientes tomados en consideración; no se trata de prestaciones garantizadas porque pueden existir diferencias entre los diferentes laboratorios. Repetibilidad. Para evaluar la repetibilidad se han analizado veinte replicados en la misma sesión analítica en el laboratorio donde se desarrolló el kit. Repetibilidad A B C D E F Media (UA/mL) 6,2 11,7 13,0 28,9 33,4 14,9 Desviación estándar (UA/mL) 0,43 1,29 1,21 3,16 4,24 1,07 Coeficiente de variación (%) 7,0 11,0 9,3 10,9 12,7 7,0 Valor mínimo (UA/mL) 4,9 8,2 10,3 20,6 23,9 12,1 Valor máximo (UA/mL) 6,7 13,0 15,1 32,9 38,4 16,1 39 / 43 ES - 200/ ,
6 Reproducibilidad. Para evaluar la reproducibilidad se han analizado veinte replicados en días diferentes (una o dos sesiones analíticas al día) utilizando tres lotes diferentes de integral. Los ensayos se realizaron en dos sitios, en el laboratorio donde se desarrolló el kit (sitio 1) y en un laboratorio independiente (sitio 2) utilizando los mismos instrumentos. Reproducibilidad - Sitio 1 A B C D E F LOTE Nr. 01 Media (UA/mL) 6,1 11,0 15,2 30,4 45,8 15,5 Desviación estándar (UA/mL) 0,50 1,41 1,77 3,80 5,52 2,20 Coeficiente de variación (%) 8,2 12,9 11,6 12,5 12,1 14,5 Valor mínimo (UA/mL) 5,2 8,3 11,9 23,0 31,0 12,2 Valor máximo (UA/mL) 6,8 14,0 18,8 36,4 53,3 22,5 LOTE Nr. 02 Media (UA/mL) 7,9 12,7 20,9 36,9 44,2 20,7 Desviación estándar (UA/mL) 0,38 1,42 1,53 4,23 4,61 2,40 Coeficiente de variación (%) 4,8 11,1 7,3 11,4 10,4 11,7 Valor mínimo (UA/mL) 7,3 10,2 17,7 24,6 32,9 17,7 Valor máximo (UA/mL) 8,6 15,5 23,1 44,5 51,2 27,6 LOTE Nr. 03 Media (UA/mL) 6,0 11,0 13,1 29,2 45,9 12,7 Desviación estándar (UA/mL) 0,52 1,23 0,92 3,65 2,95 1,80 Coeficiente de variación (%) 8,7 11,1 7,0 12,5 6,4 14,0 Valor mínimo (UA/mL) 5,1 8,4 11,1 19,5 41,1 10,9 Valor máximo (UA/mL) 6,9 12,5 15,2 35,3 51,8 19,4 Coeficiente de variación inter-lotes (%) 7,2 11,7 8,7 12,1 9,6 13,4 Reproducibilidad - Sitio 2 A B C D E F LOTE Nr. 01 Media (UA/mL) 6,5 10,4 15,3 29,8 36,9 18,3 Desviación estándar (UA/mL) 0,64 0,88 1,99 3,09 5,00 2,00 Coeficiente de variación (%) 9,9 8,5 13,0 10,3 13,5 11,1 Valor mínimo (UA/mL) 5,4 9,0 12,1 24,9 27,4 14,2 Valor máximo (UA/mL) 7,5 12,5 19,2 35,1 46,0 23,2 LOTE Nr. 02 Media (UA/mL) 9,3 15,9 24,1 42,7 46,6 29,0 Desviación estándar (UA/mL) 0,64 1,83 2,57 4,52 5,22 3,60 Coeficiente de variación (%) 6,9 11,5 10,7 10,6 11,2 12,4 Valor mínimo (UA/mL) 8,6 13,5 19,1 35,8 37,6 23,1 Valor máximo (UA/mL) 10,5 19,2 28,6 53,8 54,9 34,0 LOTE Nr. 03 Media (UA/mL) 6,7 11,7 11,8 26,7 27,0 14,6 Desviación estándar (UA/mL) 0,46 1,11 0,84 3,29 3,47 1,70 Coeficiente de variación (%) 6,9 9,5 7,2 12,3 12,9 11,9 Valor mínimo (UA/mL) 5,7 9,5 10,0 18,1 19,7 11,7 Valor máximo (UA/mL) 7,9 14,0 13,1 30,8 32,8 18,4 Coeficiente de variación inter-lotes (%) 7,9 9,8 10,3 11,1 12,5 11, Efecto arrastre El efecto arrastre (carryover) ha sido estudiado analizando una muestra negativa tanto antes como después de cuatro muestras elevadamente positivas. Los resultados obtenidos permiten demostrar que no se verifica el efecto arrastre utilizando el LIAISON Analyzer Efecto saturación con altas concentraciones Cuando se ensayen muestras que contengan unas concentraciones de anticuerpos sumamente elevadas, se pueden obtener unos niveles aparentes de anticuerpo inferiores al nivel real por efecto de la saturación. Sin embargo, un sistema bien optimizado con dos incubaciones excluye que se obtengan resultados subestimados, porque la señal analítica permanece siempre elevada (curva a saturación). La presencia de un efecto saturación ha sido evaluada analizando dos muestras positivas para IgM anti-toxoplasma gondii con alto título. Todas las muestras han presentado unos valores de concentración elevados, como esperado, indicando que la clasificación de las muestras es correcta. 40 / 43 ES - 200/ ,
7 15.5. Especificidad y sensibilidad diagnósticas La especificidad y la sensibilidad diagnósticas han sido evaluadas analizando, en principio, 789 muestras provenientes de diversas poblaciones (sujetos nunca infectados por Toxoplasma gondii, mujeres embarazadas, sujetos afectados por enfermedades autoinmunes, pacientes afectados por otras enfermedades infecciosas de sintomatología similar, pacientes hemodializados, pacientes sometidos a transplante de órgano, pacientes afectados por el SIDA, pacientes afectados por toxoplasmosis primaria, sujetos con toxoplasmosis pasada, pacientes afectados por supuesta toxoplasmosis reactivada, sujetos con persistencia de la IgM anti-toxoplasma gondii). Las muestras han sido examinadas con diferentes métodos de comparación y se ha empleado la regla del consenso general y los datos clínicos y serológicos para establecer los resultados esperados. 51 muestras han sido clasificadas dudosas con los métodos de referencia y por lo tanto han sido excluidas del análisis de los resultados. En la población presumiblemente negativa estudiada 5 muestras han resultado positivas, 4 muestras han resultado dudosas (reactivas) y 586 muestras han resultado negativas - especificidad diagnóstica: 98,49% (intervalo de confianza al 95%: 97,15-99,31%). En la población presumiblemente positiva estudiada ninguna muestra ha resultado negativa y 143 muestras han resultado positivas - sensibilidad diagnóstica: 100% (intervalo de confianza al 95%: 97,45-100%). Si se elige el valor límite más elevado, los resultados cambian del siguiente modo: En la población presumiblemente negativa estudiada 3 muestras han resultado positivas y 592 muestras han resultado negativas - especificidad diagnóstica: 99,50% (intervalo de confianza al 95%: 98,53-99,89%). En la población presumiblemente positiva estudiada 14 muestras han resultado negativas y 129 muestras han resultado positivas - sensibilidad diagnóstica: 90,21% (intervalo de confianza al 95%: 84,12-94,55%). Además de la evaluación clínica se han realizado otros estudios en laboratorios especializados para convalidar la capacidad del test de detectar correctamente la toxoplasmosis aguda. Han sido analizadas 279 muestras seleccionadas de las cuales 149 muestras provenientes de sujetos con toxoplasmosis aguda y 130 muestras provenientes de sujetos con toxoplasmosis pasada y persistencia de la IgM. En la población estudiada de pacientes con toxoplasmosis aguda 149 muestras han resultado por encima de 10 UA/mL - sensibilidad diagnóstica: 100% (intervalo de confianza al 95%: 97,56-100%). En la población estudiada de sujetos con persistencia de la IgM, 4 muestras han resultado por debajo de 6 UA/mL, 3 muestras han resultado comprendidas entre 6 y 8 UA/mL, 4 muestras han resultado comprendidas entre 8 y 10 UA/mL y 119 muestras han resultado por encima de 10 UA/mL - sensibilidad diagnóstica: 91,54% (intervalo de confianza al 95%: 85,37-95,70%). Otros estudios clínicos demostraron prestaciones iguales o mejores. Estudio prospectivo. Se analizaron 370 muestras no seleccionadas con el kit LIAISON Toxo IgM y con otro ensayo para IgM anti-toxoplasma. Estas muestras se recogieron para uso prospectivo y provienen de sujetos examinados con test serológicos anti-toxoplasma. El ensayo LIAISON Toxo IgM proporcionó 358 resultados negativos, tres dudosos y nueve positivos y mostró una concordancia del 97,8% con respecto al test de comparación. Los resultados discordantes se resolvieron utilizando otros ensayos para IgM anti-toxoplasma y un test para la avidez de la IgG. Se aplicó la regla del consenso para definir los resultados esperados. Una vez resueltas las discrepancias, la concordancia resultó del 99,2%. 41 / 43 ES - 200/ ,
8 Modificaciones: - Supresiones: - LIAISON Control Toxo IgM (REF ) 1. FINALIDAD DEL ENSAYO Los controles LIAISON Toxo IgM (negativo y positivo) deben ser usados en los ensayos de quimioluminiscencia (CLIA) LIAISON para verificar la fiabilidad de los ensayos. No se han establecido las prestaciones metodológicas de los controles LIAISON Toxo IgM en relación con otros ensayos o plataformas de instrumentos distintos de LIAISON y LIAISON XL. LIAISON analyzers. En el certificado de análisis se proporciona información específica sobre el lote de los controles, que debe introducirse manualmente en el software del analizador antes de colocar los frascos de los controles. Para obtener información detallada, consulte el manual del analizador. LIAISON XL analyzers. Los códigos de barras del certificado de análisis contienen información específica sobre el lote de los controles. Esta información debe leerse con el lector manual de código de barras del LIAISON XL Analyzer antes de introducir los frascos de los controles. Para obtener información detallada, consulte el manual del analizador. 2. MATERIALES SUMINISTRADOS Control negativo (2 x 0,7 ml) Suero/plasma humano no reactivo para IgM anti-toxoplasma gondii, estabilizado en tampón PBS, albúmina sérica bovina y 0,2% ProClin 300. Control positivo (2 x 0,7 ml) Suero/plasma humano reactivo para IgM anti-toxoplasma gondii, estabilizado en tampón PBS, albúmina sérica bovina, 0,2% ProClin 300 y un colorante amarillo inactivo. Todos los reactivos se suministran listos para su uso. El intervalo de las concentraciones para cada control está impreso en el certificado de análisis e indica los límites definidos por DiaSorin para los valores de los controles obtenidos con test fiables. Cada laboratorio es responsable de adoptar límites diferentes para cumplir exigencias específicas. 3. ADVERTENCIAS Y PRECAUCIONES Sólo para uso diagnóstico in vitro. Los controles no son específicos para lote de kit. Se pueden intercambiar también con lotes diferentes de integral de reactivos. Todos los materiales utilizados para la fabricación de los componentes de este kit se han analizado y se han encontrado no reactivos para la presencia de HBsAg, anti-hcv, anti-hiv-1 y anti-hiv-2. Sin embargo, visto que ningún método de análisis puede asegurar que los agentes patógenos estén ausentes, todo el material de origen humano se deberá considerar potencialmente infeccioso y manipularlo como tal. Observe las precauciones necesarias para la manipulación de los reactivos de laboratorio. Los residuos deben eliminarse de acuerdo con la reglamentación local. 4. NORMAS DE SEGURIDAD No coma, beba, fume o se maquille durante la ejecución del ensayo. No pipetee las soluciones con la boca. Evite el contacto directo con el material potencialmente infeccioso usando batas de laboratorio, gafas de protección y guantes desechables. Lávese cuidadosamente las manos al terminar el ensayo. Evite salpicaduras o formación de aerosoles. En caso de que esto sucediera, cada gota de reactivo se debe eliminar con una solución de hipoclorito sódico al 5% y el medio utilizado se deberá tratar como material residuo potencialmente infeccioso. Todas las muestras, los reactivos biológicos del kit y los materiales usados para efectuar el ensayo se deben considerar capaces de transmitir agentes infecciosos; por lo tanto los residuos se deberán eliminar de acuerdo con las reglamentaciones de las agencias autorizadas que tengan jurisdicción sobre el laboratorio, y con las normativas de cada país. Los reactivos que contienen ProClin 300 se clasifican como irritantes según las Directivas Europeas aplicables: R 43 - Posibilidad de sensibilización en contacto con la piel. S 24 - Evítese el contacto con la piel. S 37 - Úsense guantes adecuados. S 60 - Elimínense el producto y su recipiente como residuos peligrosos. 5. CONSERVACIÓN Y ESTABILIDAD En el momento de su llegada, los controles se deben mantener a 2-8 C en posición vertical para evitar el contacto de la solución con la tapa del frasco. No congele. Si los controles se conservan sellados y en posición vertical, ellos son estables a 2-8 C hasta la fecha de caducidad. Después de la apertura, los controles son estables durante ocho semanas si se conservan refrigerados a 2-8 C entre dos usos sucesivos. Evite la contaminación bacteriana de los controles. Los controles no se deben usar pasada la fecha de caducidad indicada en las etiquetas de los frascos. 6. PREPARACIÓN DE LOS REACTIVOS Coloque los frascos de los controles en las gradillas C del LIAISON Analyzer. Con una solución de control es posible realizar por lo menos 24 test. El volumen mínimo de control necesario es 420 μl (20 μl de control μl de volumen muerto). En el momento del uso, acondicione los controles a temperatura ambiente (20-25 C) antes de la apertura de los frascos y déjelos en el área de las muestras del instrumento sólo durante el tiempo requerido para realizar el test de control de calidad. Después del uso, tape los frascos lo antes posible y manténgalos a 2-8 C en posición vertical. Durante la manipulación de los controles, adopte las precauciones necesarias para evitar la contaminación microbiana. Toxo-m-es.fm LIAISON Control Toxo IgM (REF ) 42 / 43 ES - 200/ ,
9 7. MANIPULACIÓN Asegúrese de que no se coloquen uno tras otro en las gradillas del instrumento ni que se analizan en secuencia dos controles idénticos (negativos o positivos). Hágase referencia al manual operativo del instrumento LIAISON para una información más detallada. 8. VALORES ESPERADOS Los intervalos de las concentraciones de IgM anti-toxoplasma gondii de los controles están indicados en el certificado de análisis. Estos se han establecido considerando la variabilidad de las sesiones analíticas respecto a la curva predefinida memorizada por el fabricante, a fines de garantizar la precisión de los resultados analíticos y obtener indicaciones sobre la estabilidad y el deterioro de los reactivos. Si los valores experimentales de los controles están repetidamente fuera de los intervalos predefinidos, con mucha probabilidad, el ensayo se ha llevado a cabo de forma incorrecta. Toxo-m-es.fm LIAISON Control Toxo IgM (REF ) 43 / 43 ES - 200/ ,
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON HSV-1/2 IgG (REF )
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 11; Supresiones: - LIAISON HSV-1/2 IgG (REF 310800) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 11; Supresiones: - LIAISON HSV-1/2 IgG (REF 310800) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy LIAISON Anti-HBc (310130)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 13, 15.6; Supresiones: - LIAISON Anti-HBc (310130) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Anti-HBc
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 13, 15.6; Supresiones: - LIAISON Anti-HBc (310130) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Anti-HBc
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com. LIAISON HSV-1/2 IgM (REF 310820)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON HSV-1/2 IgM (REF 310820) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON HSV-1/2 IgM (REF 310820) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON HSV-1/2
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italy LIAISON Anti-HBs (310120), Anti-HBs Plus (310190)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Anti-HBs (310120), Anti-HBs Plus (310190) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Anti-HBs (310120), Anti-HBs Plus (310190) 1. FINALIDAD DEL ENSAYO El ensayo
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4, 11; Supresiones: -
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON CMV IgM II (REF 310755) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgM
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 11; Supresiones: - LIAISON CMV IgM II (REF 310755) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgM
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com. LIAISON Treponema Screen (310840)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Treponema Screen (310840) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Treponema
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italy www.diasorin.com Atención a las modificaciones! LIAISON Treponema Screen (310840) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON Treponema
DiaSorin S.p.A. Via Crescentino snc Saluggia (Vercelli) - Italia Modificaciones: Supresiones: LIAISON CMV IgG II (310745)
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italia www.diasorin.com Modificaciones: Supresiones: LIAISON CMV IgG II (310745) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgG II emplea
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (Vercelli) - Italia www.diasorin.com Modificaciones: Supresiones: LIAISON CMV IgG II (310745) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON CMV IgG II emplea
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4, 10, 11, Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4, 10, 11 Supresiones: 10
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11 Supresiones: 10 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4, 10, 11 Supresiones: 10 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de péptido C en
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de péptido C en
DiaSorin Deutschland GmbH Von-Hevesy-Str. 3, Dietzenbach - GERMANY Modificaciones: 4, 11, 12, 15.
 DiaSorin Deutschland GmbH Von-Hevesy-Str. 3, 63128 Dietzenbach - GERMANY www.diasorin.com 0197 Modificaciones: 4, 11, 12, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación
DiaSorin Deutschland GmbH Von-Hevesy-Str. 3, 63128 Dietzenbach - GERMANY www.diasorin.com 0197 Modificaciones: 4, 11, 12, 15.10 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - Italy Modificaciones: 4,10,11,15.9 Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4,10,11,15.9 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: 4,10,11,15.9 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de
DiaSorin S.p.A. Via Crescentino snc Saluggia (VC) - ITALY Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de prolactina
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación cuantitativa de prolactina
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com. Modificaciones: 11 Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: 11 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa de alfafetoproteína
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - ITALY www.diasorin.com Modificaciones: 11 Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para determinación cuantitativa de alfafetoproteína
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com. Modificaciones: Supresiones:
 DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación de tiroglobulina humana (htg)
DiaSorin S.p.A. Via Crescentino snc - 13040 Saluggia (VC) - Italy www.diasorin.com Modificaciones: Supresiones: 1. FINALIDAD DEL ENSAYO Ensayo in vitro para la determinación de tiroglobulina humana (htg)
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt
 Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
Nadia Isabel Hornquist Hurtarte Química Bióloga Clínica de Enfermedades Infecciosas Hospital Roosevelt Fase aguda: Entre el 40% a 90% sintomáticos (similar mononucleosis) Fase crónica: asintomaticos El
ScanGel ReverScan A1, B x 5 ml ReverScan A1, A2, B, O x 5 ml
 ScanGel ReverScan A1, B 86790 2 x 5 ml ReverScan A1, A2, B, O 86795 4 x 5 ml GLÓBULOS ROJOS TEST DE ORIGEN HUMANO PARA LA PRUEBA SÉRICA DEL TIPAJE ABO IVD Todos los productos fabricados y comercializados
ScanGel ReverScan A1, B 86790 2 x 5 ml ReverScan A1, A2, B, O 86795 4 x 5 ml GLÓBULOS ROJOS TEST DE ORIGEN HUMANO PARA LA PRUEBA SÉRICA DEL TIPAJE ABO IVD Todos los productos fabricados y comercializados
WITNESS RELAXIN (plasma, serum) RLX RLX u d 9 n n ersio V X RLX L R -W IO B S
 WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
WITNESS RELAXIN (plasma, serum) SBIO-W Version n 9 du 28.07.2010 WITNESS RELAXIN WITNESS RELAXIN GENERALIDADES El kit WITNESS RELAXIN permite diagnosticar la gestación en la perra y en la gata, y permite
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS
 HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
HBsAg CONFIRMATORY TEST Para la confirmación de muestras positivas con el UMELISA HBsAg PLUS INTERES CLÍNICO Con el descubrimiento del antígeno de superficie del virus de la Hepatitis B (1) se crearon
REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD. DECRETO EJECUTIVO No (De 27 de agosto de 2007 ) EL PRESIDENTE DE LA REPÚBLICA,
 1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
1 REPÚBLICA DE PANAMÁ MINISTERIO DE SALUD DECRETO EJECUTIVO No. 340 (De 27 de agosto de 2007 ) "Por el cual se modifica el Capítulo V del Título II del Decreto Ejecutivo 178 de 12 de julio de 2001, Que
INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia.
 Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
Analizador y FIA INSTRUCCIONES DE REFERENCIA RÁPIDA Uso exclusivo con el Analizador Sofia. Procedimiento de prueba Lea el Prospecto y el Manual del usuario detenidamente antes de usar las Instrucciones
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 USA Tel. +1.651.439.9710 Fax +1.651.351.5669
 DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 USA Tel. +1.651.439.9710 Fax +1.651.351.5669 Ensayo LIAISON N-TACT PTH (310910) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON N-TACT PTH emplea la tecnología
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 USA Tel. +1.651.439.9710 Fax +1.651.351.5669 Ensayo LIAISON N-TACT PTH (310910) 1. FINALIDAD DEL ENSAYO El ensayo LIAISON N-TACT PTH emplea la tecnología
Hoja de protocolo del instrumento QIAsymphony SP
 Hoja de protocolo del instrumento QIAsymphony SP Protocolo DNA_Blood_200_V7_DSP Información general Para uso en diagnóstico in vitro. Este protocolo está indicado para la purificación de ADN mitocondrial
Hoja de protocolo del instrumento QIAsymphony SP Protocolo DNA_Blood_200_V7_DSP Información general Para uso en diagnóstico in vitro. Este protocolo está indicado para la purificación de ADN mitocondrial
Examen de laboratorio: Chagas. Obtención de sangre Cantidad Características Conservación Procesa miento En capilares Heparinizados.
 Examen de laboratorio: Chagas Examen de laboratorio Microconcentra ción en Micrométodo en tubo centración Strout ELISA IFI HAI Tipo de muestra venosa o Venosa Suero o plasma sanguíneo Obtención de sangre
Examen de laboratorio: Chagas Examen de laboratorio Microconcentra ción en Micrométodo en tubo centración Strout ELISA IFI HAI Tipo de muestra venosa o Venosa Suero o plasma sanguíneo Obtención de sangre
LEER CAMBIOS SOMBREADOS
 BIO-FLASH Toxo IgM 3000-8554 50 tests BIO-FLASH Toxo IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-toxoplasma
BIO-FLASH Toxo IgM 3000-8554 50 tests BIO-FLASH Toxo IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-toxoplasma
TERMINOLOGÍA ANALÍTICA - PROCESO ANALÍTICO - TÉCNICA ANALÍTICA - MÉTODO ANALÍTICO - PROCEDIMIENTO ANALÍTICO - PROTOCOLO ANALÍTICO
 TERMINOLOGÍA ANALÍTICA - PROCESO ANALÍTICO - TÉCNICA ANALÍTICA - MÉTODO ANALÍTICO - PROCEDIMIENTO ANALÍTICO - PROTOCOLO ANALÍTICO PROCESO ANALÍTICO Conjunto de operaciones analíticas intercaladas que se
TERMINOLOGÍA ANALÍTICA - PROCESO ANALÍTICO - TÉCNICA ANALÍTICA - MÉTODO ANALÍTICO - PROCEDIMIENTO ANALÍTICO - PROTOCOLO ANALÍTICO PROCESO ANALÍTICO Conjunto de operaciones analíticas intercaladas que se
> NT-32 rev. 2 ENAC Tipo III: Métodos basados en métodos de referencia Tipo IV: Otros métodos.
 > NT-32 rev. 2 ENAC Tipo III: Métodos basados en métodos de referencia. Métodos descritos en procedimientos internos del laboratorio, que están basados claramente en métodos de referencia y que no suponen
> NT-32 rev. 2 ENAC Tipo III: Métodos basados en métodos de referencia. Métodos descritos en procedimientos internos del laboratorio, que están basados claramente en métodos de referencia y que no suponen
NycoCard CRP Single Test
 NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
NycoCard CRP Single Test ES DESCRIPCION DEL PRODUCTO Aplicaciones NycoCard CRP Single Test es un test de diagnóstico in vitro para medir de una forma rápida la proteína C reactiva (CRP) en la sangre humana.
AGENTES BIOLÓGICOS Antonio Lobato Gutiérrez
 AGENTES BIOLÓGICOS Antonio Lobato Gutiérrez Introducción Contaminantes biológicos Son organismos con un determinado ciclo de vida que al penetrar en el hombre, determinan en él un efecto adverso para su
AGENTES BIOLÓGICOS Antonio Lobato Gutiérrez Introducción Contaminantes biológicos Son organismos con un determinado ciclo de vida que al penetrar en el hombre, determinan en él un efecto adverso para su
GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA
 GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA S E R V I C I O D E N E O N A T O L O G Í A H G U A S H E I L A S E G U R A S Á N C H E Z R 3 T U T O R : H O N O R I O S Á N C H E Z Z A P L A N A Contenido Introducción
GUÍA ACTUALIZADA: TOXOPLASMOSIS CONGÉNITA S E R V I C I O D E N E O N A T O L O G Í A H G U A S H E I L A S E G U R A S Á N C H E Z R 3 T U T O R : H O N O R I O S Á N C H E Z Z A P L A N A Contenido Introducción
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA
 SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
SSI IMMUVIEW LEGIONELLA BLOOD TEST ANÁLISIS DE SANGRE IMMUVIEW LEGIONELLA Aplicación El análisis de sangre ImmuView Legionella de Statens Serum Institute se ha creado para el diagnóstico de una infección
RESULTADOS Y DISCUSIÓN
 RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
RESULTADOS Y DISCUSIÓN Estimación de la Concentración Proteica del Filtrado de Cultivo de Mycobacterium tuberculosis H37Rv La curva estándar con la que se estimó la concentración proteica del filtrado
GLOSARIO DE TÉRMINOS
 GLOSARIO DE TÉRMINOS Las definiciones dadas a continuación se han seleccionado con el criterio restrictivo de incluir solamente las que pueden ser de utilidad para los usuarios del Manual de animales terrestres.
GLOSARIO DE TÉRMINOS Las definiciones dadas a continuación se han seleccionado con el criterio restrictivo de incluir solamente las que pueden ser de utilidad para los usuarios del Manual de animales terrestres.
DiaSorin Inc 1951 Northwestern Ave - Stillwater, MN EE.UU. Tel Fax
 DiaSorin Inc 1951 Northwestern Ave - Stillwater, MN 55082 - EE.UU. Tel. +1.651.439.9710 - Fax +1.651.351.5669 Preste atención a los cambios! LIAISON Calcitonin II-Gen (310650) 1. INDICACIONES El ensayo
DiaSorin Inc 1951 Northwestern Ave - Stillwater, MN 55082 - EE.UU. Tel. +1.651.439.9710 - Fax +1.651.351.5669 Preste atención a los cambios! LIAISON Calcitonin II-Gen (310650) 1. INDICACIONES El ensayo
ScanGel ScanBrom ml
 ScanGel ScanBrom 86445 12 ml BROMELINA PARA PRUEBAS CRUZADAS IVD Todos los productos fabricados y comercializados por la sociedad Bio-Rad se hallan bajo un sistema de garantía de calidad desde la recepción
ScanGel ScanBrom 86445 12 ml BROMELINA PARA PRUEBAS CRUZADAS IVD Todos los productos fabricados y comercializados por la sociedad Bio-Rad se hallan bajo un sistema de garantía de calidad desde la recepción
ANÁLISIS CUANTITATIVO POR WDFRX
 ANÁLISIS CUANTITATIVO POR WDFRX El análisis cuantitativo se obtiene mediante la medida de las intensidades de las energías emitidas por la muestra. Siendo la intensidad de la emisión (número de fotones)
ANÁLISIS CUANTITATIVO POR WDFRX El análisis cuantitativo se obtiene mediante la medida de las intensidades de las energías emitidas por la muestra. Siendo la intensidad de la emisión (número de fotones)
PAMI 8: Diagnóstico de la infección por VIH
 PAMI 8: Diagnóstico de la infección por VIH SITUACIÓN ACTUAL DEL DIAGNÓSTICO EN ESPAÑA NUEVOS DIAGNÓSTICOS DE LA INFECCIÓN A finales del año 2013 la tasa anual de nuevos diagnósticos fue de 70,4/100.000.000
PAMI 8: Diagnóstico de la infección por VIH SITUACIÓN ACTUAL DEL DIAGNÓSTICO EN ESPAÑA NUEVOS DIAGNÓSTICOS DE LA INFECCIÓN A finales del año 2013 la tasa anual de nuevos diagnósticos fue de 70,4/100.000.000
qprotein (BCA) Kit para cuantificar proteinas totales PB-L Productos Bio-Lógicos
 qprotein () Kit para cuantificar proteinas totales PB-L http://www.pb-l.com.ar qprotein () Cat. no. RA03 CONTENIDO Componentes RA0301 RA0302 Buffer A 250 ml 500 ml Buffer B 5 ml 10 ml Proteína Patrón 5
qprotein () Kit para cuantificar proteinas totales PB-L http://www.pb-l.com.ar qprotein () Cat. no. RA03 CONTENIDO Componentes RA0301 RA0302 Buffer A 250 ml 500 ml Buffer B 5 ml 10 ml Proteína Patrón 5
LEER CAMBIOS SOMBREADOS
 BIO-FLASH CMV IgM 3000-8566 50 tests BIO-FLASH CMV IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-citomegalovirus
BIO-FLASH CMV IgM 3000-8566 50 tests BIO-FLASH CMV IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM anti-citomegalovirus
Estudio de la estabilidad del sistema Paratest usado para diagnóstico de las parasitosis intestinales Rev /01/2011
 1 Estudio de la estabilidad del sistema Paratest usado para diagnóstico de las parasitosis intestinales Rev. 00-10/01/2011 1. Introducción Las parasitosis intestinales representan un serio problema de
1 Estudio de la estabilidad del sistema Paratest usado para diagnóstico de las parasitosis intestinales Rev. 00-10/01/2011 1. Introducción Las parasitosis intestinales representan un serio problema de
MEDIDAS PREVENTIVAS EMBARAZADAS O EN LACTANCIA
 RUBEOLA con niños infectados y con sus secreciones respiratorias. con objetos contaminados. - Procesado y análisis de muestras, fundamentalmente las operaciones que generan aerosoles. - Manejo de objetos
RUBEOLA con niños infectados y con sus secreciones respiratorias. con objetos contaminados. - Procesado y análisis de muestras, fundamentalmente las operaciones que generan aerosoles. - Manejo de objetos
PRINCIPIO DE LA PRUEBA: USO PREVISTO:
 ESPECIFICACIONES DEL KIT: Cat. No Cantidad Reactivo Almacenamiento ADRT0011 1 x 20 PRUEBAS 1 x 3 ml Diluente USO PREVISTO: HIV 2-30 C El HIV-1/2 Plus Combo Rapid Test es un inmunoensayo de flujo lateral
ESPECIFICACIONES DEL KIT: Cat. No Cantidad Reactivo Almacenamiento ADRT0011 1 x 20 PRUEBAS 1 x 3 ml Diluente USO PREVISTO: HIV 2-30 C El HIV-1/2 Plus Combo Rapid Test es un inmunoensayo de flujo lateral
Técnico en Hematología y Hemoterapia. Sanidad, Dietética y Nutrición
 Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
Técnico en Hematología y Hemoterapia Sanidad, Dietética y Nutrición Ficha Técnica Categoría Sanidad, Dietética y Nutrición Referencia 166762-1501 Precio 50.36 Euros Sinopsis La sangre es la especialidad
One Step Dengue IgG/IgM Antibody Test
 One Step Dengue IgG/IgM Antibody Test Instrucciones de uso Formato: Cassette Espécimen: Suero/Plasma y Sangre Entera Numero de Catalogo: A03-08- 322 * Por favor, lea atentamente las instrucciones antes
One Step Dengue IgG/IgM Antibody Test Instrucciones de uso Formato: Cassette Espécimen: Suero/Plasma y Sangre Entera Numero de Catalogo: A03-08- 322 * Por favor, lea atentamente las instrucciones antes
QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente.
 CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
CROSS MATCH QUE ES? Es la búsqueda de anticuerpos preformados contra los linfocitos de un posible donante en el suero de un paciente. Pueden estar específicamente dirigidos contra los antígenos HLA o contra
GELES FORMULADOS CON REACTIVOS MONOCLONALES DE ORIGEN MURINO O HUMANO O GEL NEUTRO
 ScanGel ABO Complete/RH/K Duo 86719 2 x 24 tarjetas 86709 2 x 144 tarjetas ScanGel ABO Complete/RH1 Duo y ScanGel Monoclonal RH/K Phenotypes Duo tarjetas GELES FORMULADOS CON REACTIVOS MONOCLONALES DE
ScanGel ABO Complete/RH/K Duo 86719 2 x 24 tarjetas 86709 2 x 144 tarjetas ScanGel ABO Complete/RH1 Duo y ScanGel Monoclonal RH/K Phenotypes Duo tarjetas GELES FORMULADOS CON REACTIVOS MONOCLONALES DE
ACCUTREND GCT Manual formación. Ref:
 ACCUTREND GCT Manual formación Ref: 04898249001 Accutrend GCT Determinación inmediata de los principales factores de riesgo cardiovascular Gracias a la tecnología de la química seca es posible realizar
ACCUTREND GCT Manual formación Ref: 04898249001 Accutrend GCT Determinación inmediata de los principales factores de riesgo cardiovascular Gracias a la tecnología de la química seca es posible realizar
Taller de Validación de Métodos Verificación de Procedimientos de Medidas Cualitativos: Enfermedades Infecciosas. PONENTE: Gabriel A.
 Taller de Validación de Métodos Verificación de Procedimientos de Medidas Cualitativos: Enfermedades Infecciosas PONENTE: Gabriel A. Migliarino Agenda Introducción Evaluación de Procedimientos de Medida
Taller de Validación de Métodos Verificación de Procedimientos de Medidas Cualitativos: Enfermedades Infecciosas PONENTE: Gabriel A. Migliarino Agenda Introducción Evaluación de Procedimientos de Medida
Murex HBsAg Version 3
 es 9F80-01/-05 GE34/36 Primera edición 04/2009 Murex HBsAg Version 3 Enzimoinmunoanálisis para la detección del antígeno de superficie del virus de la hepatitis B en suero o plasma humanos Centro de Asistencia
es 9F80-01/-05 GE34/36 Primera edición 04/2009 Murex HBsAg Version 3 Enzimoinmunoanálisis para la detección del antígeno de superficie del virus de la hepatitis B en suero o plasma humanos Centro de Asistencia
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico
 TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
TOXOPLASMOSIS Patología Médica Facultad de Medicina de Granada. Prof. Juan Jiménez Alonso Curso académico 2002-2003 TOXOPLASMOSIS * Infección producida por T. Gondii, que es un protozoo intracelular que
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA
 La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
La varicela PETROLEROS ASOCIADOS S.A. RIESGOS DE SALUD PUBLICA VARICELA Definición: La varicela es una enfermedad infecciosa causada por un virus llamado Varicela zoster (VVZ). Cuando se produce la reactivación
Inmunohematología. Dra. Ana Cecilia Haro
 Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Inmunohematología 2016 Dra. Ana Cecilia Haro Sensibilización Aglutinación Ag + Ac Ag-Ac Enzimas LISS SAGH PEG Polibrene Albúmina Potencial zeta Tipo de Ac Densidad antigénica Tiempo de incubación Fuerza
Material tomado del Manual d Estades en Pràctiques Tutelades, Facultat de Farmàcia, UB.
 Material tomado del Manual d Estades en Pràctiques Tutelades, Facultat de Farmàcia, UB. Que hay que saber para implementar el servicio de cribado del VIH en la farmacia M.Angeles Via, Marian March Profesoras
Material tomado del Manual d Estades en Pràctiques Tutelades, Facultat de Farmàcia, UB. Que hay que saber para implementar el servicio de cribado del VIH en la farmacia M.Angeles Via, Marian March Profesoras
Anexo V. Guías de Bioseguridad para el Manejo de Muestras en el. Síndrome Respiratorio Agudo y Grave (SRAS)
 nexo V Guías de Bioseguridad para el Manejo de Muestras en el Síndrome Respiratorio gudo y Grave (SRS) Traducido de WHO: Biosafety guidelines for handling of SRS specimens. http://www.who.int/csr/srs/biosafety2003_04_25/en/)
nexo V Guías de Bioseguridad para el Manejo de Muestras en el Síndrome Respiratorio gudo y Grave (SRS) Traducido de WHO: Biosafety guidelines for handling of SRS specimens. http://www.who.int/csr/srs/biosafety2003_04_25/en/)
TECHNOLOGY. CROSSMATCH TEST canino. primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica.
 CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
CROSSMATCH TEST canino primer test inmunocromatografico para reaccion cruzada con antiglobulina canina especifica 20 minutos TECHNOLOGY - ahorra tiempo - facil manipulacion - resultados fiables - facil
Calidad de muestras. Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero
 Calidad de muestras Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero Calidad de muestras Factores intervinientes: Obtención de muestra Contenedores Anticoagulantes Manipulación Preparación
Calidad de muestras Bioquímica Lucrecia Drago Bioquímica María Fernanda Pontoriero Calidad de muestras Factores intervinientes: Obtención de muestra Contenedores Anticoagulantes Manipulación Preparación
Diagnóstico microbiológico de las hepatitis virales. Juan Carlos Rodríguez S. Microbiología Hospital General Universitario de Alicante
 Diagnóstico microbiológico de las hepatitis virales Juan Carlos Rodríguez S. Microbiología Hospital General Universitario de Alicante Hepatitis A. Características generales Provoca enfermedad aguda en
Diagnóstico microbiológico de las hepatitis virales Juan Carlos Rodríguez S. Microbiología Hospital General Universitario de Alicante Hepatitis A. Características generales Provoca enfermedad aguda en
BIO-FLASH. BIOKIT, S.A. - Can Malé s/n Lliçà d Amunt - Barcelona - SPAIN
 LEER CAMBIOS SOMBREADOS BIO-FLASH anti-hbc 3000-8578 100 tests BIO-FLASH anti-hbc es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos
LEER CAMBIOS SOMBREADOS BIO-FLASH anti-hbc 3000-8578 100 tests BIO-FLASH anti-hbc es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos
COMITÉ CIENTIFICO 23 de marzo VALOR DEL EXAMEN 47 PUNTOS, puntaje mínimo para certificados de aprovechamiento 33 puntos o más.
 Nombre del participante: Unidad Ejecutora: Fecha: Nombre de la actividad: SEMINARIO DE INTERPRETACION DE EXAMENES DE LABORATORIO I Y II Calificación: Correo electrónico: C.I. COD. COMITÉ CIENTIFICO 23
Nombre del participante: Unidad Ejecutora: Fecha: Nombre de la actividad: SEMINARIO DE INTERPRETACION DE EXAMENES DE LABORATORIO I Y II Calificación: Correo electrónico: C.I. COD. COMITÉ CIENTIFICO 23
A: Protocolo de Actuación para trabajos con Bromuro de Etidio.
 TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
TRABAJOS CON BROMURO DE ETIDIO Y ACRILAMIDA. 1 A: Protocolo de Actuación para trabajos con Bromuro de Etidio. Objeto: Dar instrucciones de seguridad para todos los procedimientos que utilicen Bromuro de
Congreso Nacional del Laboratorio Clínico 2015
 S6: Exactitud de los resultados. El nuevo enfoque: trazabilidad e incertidumbre Compatibilidad de resultados de medida. Estimación y tratamiento de errores sistemáticos Raúl Rigo Bonnin Laboratori Clínic
S6: Exactitud de los resultados. El nuevo enfoque: trazabilidad e incertidumbre Compatibilidad de resultados de medida. Estimación y tratamiento de errores sistemáticos Raúl Rigo Bonnin Laboratori Clínic
Septiembre 2015 artus CMV QS-RGQ Kit: Características de rendimiento
 Septiembre 2015 artus CMV QS-RGQ Kit: Características de rendimiento artus CMV QS-RGQ Kit, versión 1 4503363 Compruebe la disponibilidad de nuevas versiones de la documentación electrónica en www.qiagen.com/products/artuscmvpcrkitce.aspx
Septiembre 2015 artus CMV QS-RGQ Kit: Características de rendimiento artus CMV QS-RGQ Kit, versión 1 4503363 Compruebe la disponibilidad de nuevas versiones de la documentación electrónica en www.qiagen.com/products/artuscmvpcrkitce.aspx
Contenido. Bioseguridad Chile Ltda., Septiembre 2014i www.bioseguridadchile.cl nfo@bioseguridadchile.cl 1
 Contenido Control de Infecciones, Recolección y Manejo de Muestras... 2 Recomendaciones para la evaluación de los riesgos para el personal... 2 Recomendaciones para la recogida de muestras por parte del
Contenido Control de Infecciones, Recolección y Manejo de Muestras... 2 Recomendaciones para la evaluación de los riesgos para el personal... 2 Recomendaciones para la recogida de muestras por parte del
Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016
 Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016 Requiere de evaluación: Clínica: Signos y Síntomas (la mayoría asintomáticos) Bioquímica Serológica Histológica Virológica Determinar
Clínica de Enfermedades Infecciosas Hospital Roosevelt Febrero 2016 Requiere de evaluación: Clínica: Signos y Síntomas (la mayoría asintomáticos) Bioquímica Serológica Histológica Virológica Determinar
GESTION DE CALIDAD CONTROL DE CALIDAD
 GESTION DE CALIDAD CONTROL DE CALIDAD Marcela R. Perez Bioquímica Responsable del Departamento Calidad IBC Instituto de Bioquimica Clinica - Rosario PROCESOS Etapa Pre Analítica: Conjunto de todas las
GESTION DE CALIDAD CONTROL DE CALIDAD Marcela R. Perez Bioquímica Responsable del Departamento Calidad IBC Instituto de Bioquimica Clinica - Rosario PROCESOS Etapa Pre Analítica: Conjunto de todas las
Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian
 Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian Mononucleosis infecciosa Es causada por el virus EB en el 90 al 95% de los casos. Clínicamente, la MI se presenta con mayor frecuencia en la adolescencia
Mononucleosis infecciosa (MI) Dr. Daniel Stamboulian Mononucleosis infecciosa Es causada por el virus EB en el 90 al 95% de los casos. Clínicamente, la MI se presenta con mayor frecuencia en la adolescencia
ph DE LOS SUELOS I.N.V. E
 ph DE LOS SUELOS I.N.V. E 131 07 1. OBJETO 1.1 Este método de prueba cubre la determinación del ph de los suelos para usos diferentes de la prueba de corrosión. Tales determinaciones se usan en campos
ph DE LOS SUELOS I.N.V. E 131 07 1. OBJETO 1.1 Este método de prueba cubre la determinación del ph de los suelos para usos diferentes de la prueba de corrosión. Tales determinaciones se usan en campos
Página 1 de 11. Apartado 7.9: Filtro de partículas Se incluye este apartado sobre el filtro interno de partículas del analizador.
 PRINCIPALES CAMBIOS EN LAS NORMAS UNE-EN 2013 CON RESPECTO A LAS NORMAS UNE- EN 2005/2006, RELATIVAS A LOS METODOS DE REFERENCIA PARA LA DETERMINACION DE LAS CONCENTRACIONES DE OXIDOS DE NITROGENO, DIOXIDO
PRINCIPALES CAMBIOS EN LAS NORMAS UNE-EN 2013 CON RESPECTO A LAS NORMAS UNE- EN 2005/2006, RELATIVAS A LOS METODOS DE REFERENCIA PARA LA DETERMINACION DE LAS CONCENTRACIONES DE OXIDOS DE NITROGENO, DIOXIDO
Incertidumbre, Validación y Trazabilidad en el Laboratorio de Análisis Clínicos. Cómo cumplir con requisitos de la ISO 15189
 Incertidumbre, Validación y Trazabilidad en el Laboratorio de Análisis Clínicos Cómo cumplir con requisitos de la ISO 15189 Calidad en mediciones químicas Validación de métodos Estoy midiendo lo que intentaba
Incertidumbre, Validación y Trazabilidad en el Laboratorio de Análisis Clínicos Cómo cumplir con requisitos de la ISO 15189 Calidad en mediciones químicas Validación de métodos Estoy midiendo lo que intentaba
Toxoplasmosis. Dr. Renzo Tassara Oliveri. Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios
 Dr. Renzo Tassara Oliveri Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios Facultad de Medicina, Universidad de Chile Protozoo coccidio Zoonosis Parásito
Dr. Renzo Tassara Oliveri Profesor Asociado de Pediatría Depto. de Pediatría y Unidad de Parasitología Hospital San Juan de Dios Facultad de Medicina, Universidad de Chile Protozoo coccidio Zoonosis Parásito
SOLICITUD DE COTIZACIÓN REACTIVOS PARA LABORATORIO CLINICO Proceso de Compra Menor
 CAJA DE SALUD DE LA BANCA PRIVADA www.csbp.com.bo REGIONAL Cochabamba SOLICITUD DE COTIZACIÓN REACTIVOS PARA LABORATORIO CLINICO Proceso de Compra Menor N RL-06/13 N RL-06/13 Cochabamba 5 de Agosto de
CAJA DE SALUD DE LA BANCA PRIVADA www.csbp.com.bo REGIONAL Cochabamba SOLICITUD DE COTIZACIÓN REACTIVOS PARA LABORATORIO CLINICO Proceso de Compra Menor N RL-06/13 N RL-06/13 Cochabamba 5 de Agosto de
HIV TIPS Número 1 Octubre de 2009
 HIV TIPS Número 1 Octubre de 2009 Sabía usted que El VIH es un virus perteneciente a la familia Retroviridae, subfamilia Lentiviridae 4,5. Existen dos formas semejantes: VIH 1 y VIH 2, pero difieren en
HIV TIPS Número 1 Octubre de 2009 Sabía usted que El VIH es un virus perteneciente a la familia Retroviridae, subfamilia Lentiviridae 4,5. Existen dos formas semejantes: VIH 1 y VIH 2, pero difieren en
TEMA 14. Métodos inmunológicos para la identificación microbiana
 TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
TEMA 14 Métodos inmunológicos para la identificación microbiana Tema 14. Métodos inmunológicos para la identificación microbiana 1. Introducción 2. Detección de antígenos 2.1. Obtención de anticuerpos
EVALUACIÓN CIENTÍFICA DE LOS ADITIVOS ALIMENTARIOS
 EVALUACIÓN CIENTÍFICA DE LOS ADITIVOS ALIMENTARIOS La Evaluación científica de los aditivos alimentarios es el paso posterior a la solicitud por parte de la Comisión, dentro del procedimiento para la autorización
EVALUACIÓN CIENTÍFICA DE LOS ADITIVOS ALIMENTARIOS La Evaluación científica de los aditivos alimentarios es el paso posterior a la solicitud por parte de la Comisión, dentro del procedimiento para la autorización
Hipersensibilidad conocida a penciclovir, famciclovir o a los otros componentes de la formulación, por ejemplo propilenglicol.
 1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
1. NOMBRE DEL MEDICAMENTO Penciclovir Beecham bomba dosificadora Penciclovir Beecham crema 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Principio activo: Penciclovir al 1% DCI: penciclovir 3. FORMA FARMACÉUTICA
Papel de Laboratorio: Chikungunya Logros y retos para la vigilancia por laboratorio
 Papel de Laboratorio: Chikungunya Logros y retos para la vigilancia por laboratorio Reunión de la Sala Regional de Situación de Salud Tema: Chikungunya 2 de julio del 2015 Naomi Iihoshi SE-COMISCA Chikungunya
Papel de Laboratorio: Chikungunya Logros y retos para la vigilancia por laboratorio Reunión de la Sala Regional de Situación de Salud Tema: Chikungunya 2 de julio del 2015 Naomi Iihoshi SE-COMISCA Chikungunya
MÉTODO DE ENSAYO PARA MEDIR EL DETERIORO DE GEOTEXTILES A LA EXPOSICIÓN DE LUZ ULTRAVIOLETA Y AGUA, (APARATO DEL TIPO ARCO XENON). I.N.V.
 MÉTODO DE ENSAYO PARA MEDIR EL DETERIORO DE GEOTEXTILES A LA EXPOSICIÓN DE LUZ ULTRAVIOLETA Y AGUA, (APARATO DEL TIPO ARCO XENON). I.N.V. E 910 07 1. OBJETO 1.1 Esta norma de ensayo se puede utilizar para
MÉTODO DE ENSAYO PARA MEDIR EL DETERIORO DE GEOTEXTILES A LA EXPOSICIÓN DE LUZ ULTRAVIOLETA Y AGUA, (APARATO DEL TIPO ARCO XENON). I.N.V. E 910 07 1. OBJETO 1.1 Esta norma de ensayo se puede utilizar para
SensPERT TM TM Ehrlichia Test Kit
 SensPERT TM TM Ehrlichia Test Kit Distribuidor en España: Pº Pontones 7 tlf 914745799 Madrid 28005 Ehrlichia Test Kit Descripción : Detección específica de anticuerpos de E. canis en 10 minutos Principio
SensPERT TM TM Ehrlichia Test Kit Distribuidor en España: Pº Pontones 7 tlf 914745799 Madrid 28005 Ehrlichia Test Kit Descripción : Detección específica de anticuerpos de E. canis en 10 minutos Principio
Reglamento sobre RTE
 Directiva 10.240.4 del FSIS Anexo 5 Reglamento sobre RTE 9 CFR 430.1, Definiciones. Agente antimicrobiano. Una sustancia incluida o añadida a un producto RTE que tiene el efecto de reducir o eliminar un
Directiva 10.240.4 del FSIS Anexo 5 Reglamento sobre RTE 9 CFR 430.1, Definiciones. Agente antimicrobiano. Una sustancia incluida o añadida a un producto RTE que tiene el efecto de reducir o eliminar un
BIO-FLASH. BIOKIT, S.A. - Can Malé s/n - 08186 Lliçà d Amunt - Barcelona - SPAIN
 LEER CAMBIOS SOMBREADOS BIO-FLASH anti-hiv 1+2 3000-8575 100 tests BIO-FLASH anti-hiv 1+2 es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de
LEER CAMBIOS SOMBREADOS BIO-FLASH anti-hiv 1+2 3000-8575 100 tests BIO-FLASH anti-hiv 1+2 es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de
61/182 VALOR DIANA VALOR DIANA MÉTODO ALTERNATIVO A ALTA PROBABILIDAD ACEPTACIÓN LÍMITE DE ACEPTACIÓN LÍMITE DE MÉTODO ACEPTACIÓN
 VALOR DIANA VALOR DIANA MÉTODO ALTERNATIVO A ALTA PROBABILIDAD ACEPTACIÓN LÍMITE DE ACEPTACIÓN REGIÓN DE ACEPTACIÓN LÍMITE DE ACEPTACIÓN MÉTODO ALTERNATIVO B BAJA PROBABILIDAD ACEPTACIÓN REGIÓN DE ACEPTACIÓN
VALOR DIANA VALOR DIANA MÉTODO ALTERNATIVO A ALTA PROBABILIDAD ACEPTACIÓN LÍMITE DE ACEPTACIÓN REGIÓN DE ACEPTACIÓN LÍMITE DE ACEPTACIÓN MÉTODO ALTERNATIVO B BAJA PROBABILIDAD ACEPTACIÓN REGIÓN DE ACEPTACIÓN
TITULO DEL PROCEDIMIENTO RECUENTO DE LEUCOCITOS EN SANGRE TOTAL
 PAGINA: 1 de n RECUENTO DE LEUCOCITOS EN SANGRE TOTAL OBJETO Establecer el procedimiento para realizar el recuento de leucocitos o glóbulos blancos en el laboratorio CALIDAD. CAMPO DE APLICACIÓN Este procedimiento
PAGINA: 1 de n RECUENTO DE LEUCOCITOS EN SANGRE TOTAL OBJETO Establecer el procedimiento para realizar el recuento de leucocitos o glóbulos blancos en el laboratorio CALIDAD. CAMPO DE APLICACIÓN Este procedimiento
Toxoplasmosis. Toxoplasma gondii
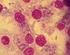 Toxoplasmosis Toxoplasma gondii Toxoplasma gondii Morfología Trofozoíto, taquizoíto o bradizoíto en forma de arco y mide de 7 μm de largo por 3 μm de ancho. En la parte anterior se encuentra el complejo
Toxoplasmosis Toxoplasma gondii Toxoplasma gondii Morfología Trofozoíto, taquizoíto o bradizoíto en forma de arco y mide de 7 μm de largo por 3 μm de ancho. En la parte anterior se encuentra el complejo
PRUEBAS DE DIAGNOSTICO. Hospital Roosevelt Laboratorio Clínica de Enfermedades Infecciosas Septiembre 2013
 PRUEBAS DE DIAGNOSTICO Hospital Roosevelt Laboratorio Clínica de Enfermedades Infecciosas Septiembre 2013 DIAGNÓSTICO DE LA INFECCIÓN POR EL VIH El diagnóstico definitivo de la infección por el VIH sólo
PRUEBAS DE DIAGNOSTICO Hospital Roosevelt Laboratorio Clínica de Enfermedades Infecciosas Septiembre 2013 DIAGNÓSTICO DE LA INFECCIÓN POR EL VIH El diagnóstico definitivo de la infección por el VIH sólo
INSTRUCTIVO DETERMINACIÓN DE GRUPOS A,B,O Y RH-D
 1. OBJETIVO: Desarrollar la clasificación de Grupo y Rh a los usuarios del Hospital Regional de Arica Dr. Juan Noé Crevani, de acuerdo con los antígenos y anticuerpos presentes en la sangre, esto con el
1. OBJETIVO: Desarrollar la clasificación de Grupo y Rh a los usuarios del Hospital Regional de Arica Dr. Juan Noé Crevani, de acuerdo con los antígenos y anticuerpos presentes en la sangre, esto con el
Fortel PROSTATE (PSA)
 Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
Fortel PROSTATE (PSA) Test para Screening Simple, realizable y confidencial [Seleccione la fecha] Un test visual fácil, para detectar niveles anormales del Antígeno Prostático Específico (PSA), sobre rango
LEER CAMBIOS SOMBREADOS
 BIO-FLASH Rubella IgM 3000-8560 50 tests BIO-FLASH Rubella IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM frente al
BIO-FLASH Rubella IgM 3000-8560 50 tests BIO-FLASH Rubella IgM es un inmunoensayo quimioluminiscente de dos pasos totalmente automatizado para la determinación cualitativa de anticuerpos IgM frente al
RESOLUCIÓN OIV/OENO 427/2010
 RESOLUCIÓN OIV/OENO 427/2010 CRITERIOS PARA LOS MÉTODOS DE CUANTIFICACIÓN DE LOS RESIDUOS, POTENCIALMENTE ALERGÉNICOS, DE PROTEÍNAS USADAS EN LA CLARIFICACIÓN DE LOS VINOS La ASAMBLEA GENERAL, De conformidad
RESOLUCIÓN OIV/OENO 427/2010 CRITERIOS PARA LOS MÉTODOS DE CUANTIFICACIÓN DE LOS RESIDUOS, POTENCIALMENTE ALERGÉNICOS, DE PROTEÍNAS USADAS EN LA CLARIFICACIÓN DE LOS VINOS La ASAMBLEA GENERAL, De conformidad
ISOINMUNIZACIÓN. Incompatibilidad ABO Incompatibilidad RhD Incompatibilidad no ABO no RhD (anti-lewis, anti-kell )
 Fecha: 4 de Mayo de 2011 Nombre: Dra. Neus Garrido Mollá R3 Tipo de Sesión: Seminario ISOINMUNIZACIÓN El término incompatibilidad se emplea para definir la situación en que dos individuos tienen un factores
Fecha: 4 de Mayo de 2011 Nombre: Dra. Neus Garrido Mollá R3 Tipo de Sesión: Seminario ISOINMUNIZACIÓN El término incompatibilidad se emplea para definir la situación en que dos individuos tienen un factores
DIAGNÓSTICO MOLECULAR CMV Y EBV
 DIAGNÓSTICO MOLECULAR CMV Y EBV DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) ALTA SENSIBILIDAD Y ESPECIFICIDAD DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) PCR PUNTO
DIAGNÓSTICO MOLECULAR CMV Y EBV DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) ALTA SENSIBILIDAD Y ESPECIFICIDAD DIAGNÓSTICO MOLECULAR REACCIÓN EN CADENA DE LA POLIMERASA (PCR) PCR PUNTO
TOXO IgG. Principio de la Prueba. Introducción. Contenido del Kit. Para uso diagnóstico in vitro solamente Uso Previsto
 TOXO IgG S diferenciar entre la infección de T. gondii ocurrida congénitamente (nivel constante) o neonatalmente (aumento en el título). Principio de la Prueba La prueba ImmunoComb Toxo IgG es un ensayo
TOXO IgG S diferenciar entre la infección de T. gondii ocurrida congénitamente (nivel constante) o neonatalmente (aumento en el título). Principio de la Prueba La prueba ImmunoComb Toxo IgG es un ensayo
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN EE. UU. Tel Fax
 DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 EE. UU. Tel. +1.651.439.9710 Fax +1.651.351.5669 Modificaciones: 1; 4-16 Supresiones: 1. INDICACIONES El LIAISON Testosterone es un inmunoensayo
DiaSorin Inc 1951 Northwestern Ave Stillwater, MN 55082 EE. UU. Tel. +1.651.439.9710 Fax +1.651.351.5669 Modificaciones: 1; 4-16 Supresiones: 1. INDICACIONES El LIAISON Testosterone es un inmunoensayo
ARTICULOS PUBLICADOS 4. ARTÍCULOS PUBLICADOS
 4. ARTÍCULOS PUBLICADOS 53 4.1. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999; 29: 182-190. 54 55 56 57 58 59 60 61 62 63 RESUMEN Objetivo:
4. ARTÍCULOS PUBLICADOS 53 4.1. Clinical study and follow-up of 100 patients with the antiphospholipid syndrome. Semin Arthritis Rheum 1999; 29: 182-190. 54 55 56 57 58 59 60 61 62 63 RESUMEN Objetivo:
12. Seguimiento de la ITU en población pediátrica
 12. Seguimiento de la ITU en población pediátrica 12.1. Urocultivo y/o análisis sistemáticos de orina Preguntas a responder: Se deben realizar urocultivos y/o análisis sistemáticos de orina durante el
12. Seguimiento de la ITU en población pediátrica 12.1. Urocultivo y/o análisis sistemáticos de orina Preguntas a responder: Se deben realizar urocultivos y/o análisis sistemáticos de orina durante el
50 kits de recolección de muestras con torunda multitest Aptima (N.º de catálogo PRD-03546) Cada kit contiene:
 Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
Uso previsto El kit de recolección de muestras con torunda se utiliza con los ensayos Aptima. El kit de recolección de muestras con torunda multitest Aptima se utiliza para que médico y paciente puedan
INMUNOLOGÍA EJERCICIOS
 INMUNOLOGÍA EJERCICIOS 1.- Define antígeno y anticuerpo. Explica la reacción antígeno-anticuerpo y sus consecuencias. 2.- Indica dos diferencias entre vacunación y sueroterapia y explica en qué consiste
INMUNOLOGÍA EJERCICIOS 1.- Define antígeno y anticuerpo. Explica la reacción antígeno-anticuerpo y sus consecuencias. 2.- Indica dos diferencias entre vacunación y sueroterapia y explica en qué consiste
Test de Bowie-Dick Nancy Moya R 2015
 Test de Bowie-Dick Nancy Moya R 2015 Objetivos Conocer el proceso de evaluación de una falla en las pruebas tipo Bowie Dick. Describir las causas comunes de las fallas en las pruebas Bowie Dick. Describir
Test de Bowie-Dick Nancy Moya R 2015 Objetivos Conocer el proceso de evaluación de una falla en las pruebas tipo Bowie Dick. Describir las causas comunes de las fallas en las pruebas Bowie Dick. Describir
DANAGENE BLOOD DNA KIT
 Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
Ref. 0601 100 ml Ref. 0602 200 ml DANAGENE BLOOD DNA KIT 1.INTRODUCCION DANAGENE BLOOD DNA Kit provee un método para la extracción de ADN genómico de alta calidad a partir de sangre total o médula ósea.
MONITOREO DE LABORATORIO DE EMBARAZADAS CON VIH, COINFECCIONES Y ENFERMEDADES EMERGENTES. Ingrid Escobar Laboratorio de Enfermedades Infecciosas
 MONITOREO DE LABORATORIO DE EMBARAZADAS CON VIH, COINFECCIONES Y ENFERMEDADES EMERGENTES Ingrid Escobar Laboratorio de Enfermedades Infecciosas GENERALIDADES Las infecciones de VIH, Hepatitis y Sífilis
MONITOREO DE LABORATORIO DE EMBARAZADAS CON VIH, COINFECCIONES Y ENFERMEDADES EMERGENTES Ingrid Escobar Laboratorio de Enfermedades Infecciosas GENERALIDADES Las infecciones de VIH, Hepatitis y Sífilis
