Validación del método analítico aplicable al estudio de estabilidad de risperidona solución oral 1 mg/ml
|
|
|
- María Concepción Coronel Lozano
- hace 8 años
- Vistas:
Transcripción
1 306 ARTÍCULOS ORIGINALES Validación del método analítico aplicable al estudio de estabilidad de risperidona solución oral 1 mg/ml Validation of an analytical method applicable to study of 1 mg/ml oral Risperidone solution stability Maikel Abreu Álvarez I ; Caridad Margarita García Peña II ; Lissette Martínez Miranda III ; Adriana Muñoz Cernada II ; Mirna Fernández Cervera IV ; Vivian Martínez Espinosa V I Máster en Tecnología y Control de Medicamentos. Empresa Farmacéutica "Juan R. Franco". La Habana, Cuba. II Máster en Tecnología y Control de Medicamentos. Investigadora Agregada. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). La Habana, Cuba. III Licenciada en Bioquímica. Investigadora Auxiliar. CIDEM. La Habana, Cuba. IV Doctora en Ciencias Farmaceuticas. Instituto de Farmacia y Alimentos (IFAL). La Habana, Cuba. V Técnico Medio en Química. CIDEM. La Habana, Cuba. RESUMEN Se validó un método analítico por cromatografía líquida de alta resolución, aplicable al estudio de estabilidad de risperidona solución oral 1 mg/ml. El método analítico validado resultó lineal, preciso, específico y exacto. Se desarrolló el estudio de estabilidad de la solución oral de risperidona 1 mg/ml y se determinó su fecha de vencimiento. El estudio de vida de estante se desarrolló por un periodo de 24 meses a temperatura ambiente; mientras que el estudio de estabilidad acelerada se efectuó sometiendo el producto a la influencia de la humedad y la temperatura; se realizó el análisis durante 3 meses. La formulación cumplió con las especificaciones de calidad descritas en la Farmacopea. Los resultados del estudio de estabilidad por vida de estante después de transcurridos los 24 meses indicaron que el producto mantiene los parámetros que determinan su calidad durante ese tiempo, y en los estudios acelerados no se observó degradación significativa (p> 0,05) del producto. Se estableció 2 años como fecha de vencimiento en las condiciones señaladas. Palabras clave: Risperidona, validación, estudios de estabilidad. ABSTRACT A validated analytical method by high-performance liquid chromatography (HPLC) was applicable to study of 1 mg/ml Risperidone oral solution stability. The above method was linear, accurate, specific and exact. A stability study of the 1 mg/ml Risperidone oral solution was developed determining its expiry date. The shelf life study was conducted for 24 months at room temperature; whereas the accelerated stability study was conducted with product under influence of humidity and temperature; analysis was made during 3 months. Formula fulfilled the quality 306
2 307 specifications described in Pharmacopeia. The results of stability according to shelf life after 24 months showed that the product maintains the parameters determining its quality during this time and in accelerated studies there was not significant degradation (p> 0.05) in the product. Under mentioned conditions expiry date was of 2 years. Key words: Risperidone, validation, stability studies. INTRODUCCIÓN Risperidona es un antipsicótico benzisoxazólico, con efectos antagonistas de receptores de dopamina D 2 y serotonina (5-HT 2 ), adrenérgicos (α 1 y α 2 ) e histamina (H 1 ). Es un antipsicótico atípico. La solución oral de risperidona 1 mg/ml se indica en el tratamiento de la psicosis crónica y aguda; manía. 1,2 La cromatografía líquida de alta resolución (CLAR) le brinda la posibilidad al analista de emplear esta herramienta para solucionar los inconvenientes de los métodos espectrofotométricos en los estudios de estabilidad, pues además de presentar una alta sensibilidad y exactitud, es en esencia un método separativo; lo que permite medir con gran selectividad el compuesto deseado, siempre y cuando se encuentre un sistema cromatográfico que asegure una adecuada separación. 3,4 La validación es el proceso establecido para la obtención de pruebas documentadas de que el método es lo suficientemente fiable para producir el resultado esperado. Los parámetros analíticos que pueden ser considerados en la validación de un método analítico, según se expresa en la United States Pharmacopoeia (USP 30), son: exactitud, precisión, especificidad, límite de detección, límite de cuantificación, linealidad, rango, tolerancia y robustez. 5,6 La estabilidad de los productos farmacéuticos representa un importante eslabón en el desarrollo y formulación de toda forma terminada. De esta manera se puede definir las condiciones de almacenamiento en el envase propuesto y establecer la vida útil del producto farmacéutico. Estos estudios contemplan la conservación de la potencia, pureza, características organolépticas y su efectividad. 7 El Centro para el Control Estatal de los Medicamentos de la República de Cuba (CECMED) exige para el registro de un nuevo medicamento la realización de los estudios de estabilidad. En el presente trabajo se empleó un método analítico validado en el Centro de Investigación y Desarrollo de Medicamentos (CIDEM) para el estudio de estabilidad del producto terminado. La presente investigación tuvo como objetivo validar el método de análisis para el estudio de estabilidad del producto terminado y realizar el estudio de estabilidad de una formulación de risperidona solución oral 1 mg/ml y determinar su fecha de vencimiento. MÉTODOS 307
3 308 La sustancia de referencia química de risperidona fue suministrada por el grupo de sustancias de referencia del CIDEM la cual fue analizada por el método cromatográfico establecido para realizar el control de la calidad de la materia prima, con una pureza de 99,8 %. El producto terminado en forma de solución oral, fue elaborado en el Laboratorio de Formas Terminadas del CIDEM, identificado como los lotes 6001, 6002 y 6003, fabricado en marzo de 2006, con fecha de vencimiento marzo de 2008, los cuales cumplieron con las especificaciones de calidad establecidas para el control de la calidad. Todos los reactivos utilizados fueron de grado HPLC, de la Merck, Alemania. En el ensayo se empleó un cromatógrafo (KNAUER) con detector UV/VIS (KNAUER) ajustado a 278 nm, un inyector con un loop de 20 µl e integrador (SHIMADZU CR 8 A). La separación se realizó isocráticamente empleando una columna Lichrosorb RP- 18 (5 µm) (250 x 4 mm) y un flujo de 1,5 ml/min. La fase móvil consistió en una mezcla desgasificada del solución amortiguadora fosfato de potasio 0,05 Molar a ph= 4,6, y acetonitrilo en una proporción de 55:45. La solución de referencia se obtuvo disolviendo risperidona, sustancia de referencia, en ácido clorhídrico hasta lograr una concentración final de 100 µg/ml. En la preparación de la solución de ensayo para la valoración, se disolvió una alícuota de la muestra de la solución oral ácido clorhídrico para obtener una concentración final de 100 µg/ml Validación del método analítico La validación fue realizada según la categoría I (USP 30) empleando el método reportado en USP 30; se evaluaron los parámetros que a continuación se describen. Para evaluar la especificidad del método cromatográfico utilizado se emplearon muestras de producto terminado y una muestra que contenía solo los exipientes (ácido benzoico, ácido tartárico, hidróxido de sodio, sacarina sódica, aceite esencial de naranja dulce, talco, alcohol etílico clase C, agua desionizada c.s.), las cuales se sometieron a condiciones extremas de temperatura (40 ºC) a ph ácido (ácido clorhídrico 1 M) y alcalino (hidróxido de sodio 1 N), además de medio oxidante (con peróxido de hidrógeno). Criterio de aceptación: No se debían obtener señales del placebo y de los productos de degradación en la zona de elusión del principio activo. Las áreas bajo las curvas del patrón y de la risperidona en el producto terminado debían ser similares. Para la linealidad se realizó una curva de calibración que compredió las concentraciones en el intervalo 20 y 200 µg/ml, se prepararon muestras con diferentes concentraciones de risperidona que representaron el 20, 50, 80, 100, 150 y 200 % de la concentración teórica del principio activo en la solución oral. Se determinó la ecuación de la recta, el coeficiente de correlación, la prueba de significación estadística de significación de la pendiente Sb rel (%), los coeficiente de variación de los factores de respuesta y el ensayo de proporcionalidad. Se realizó el cálculo de la precisión intermedia del método. La repetibilidad se hizo sobre la base de 10 determinaciones y se estudió la precisión intermedia haciendo las valoraciones por 2 analistas y en 3 diferentes días a 3 valores de concentración, con ellas se determinaron los valores medios, la desviación estándar y el coeficiente de variación. La precisión intermedia se determinó utilizando muestras de un lote de producto terminado. Se cuantificaron por el método cromatográfico propuesto y se determinaron mediante el procesamiento estadístico, la media, la desviación estándar, el coeficiente de variación y la existencia o no de diferencias significativas entre los analistas, los días y las tres concentraciones para los resultados de cada 308
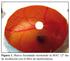
4 309 muestra. Para comprobar la precisión intermedia del método, se aplicaron las pruebas de Fisher y de la t Student para determinar si existían diferencias significativas entre los resultados al variar las condiciones de análisis. Para la exactitud se prepararon soluciones que contenían los excipientes a las cuales se le adicionaron concentraciones conocidas de risperidona que correspondían al 80, 100 y 120 % de lo declarado de principio activo, según la formulación propuesta, determinándose el porcentaje de recuperación, la desviación estándar y el coeficiente de variación. Se aplicó además el ensayo de Gochran con vistas a comprobar si la variación de la concentración producía diferencias significativas en los resultados y la prueba de la t de Student para determinar diferencias significativas entre la recuperación media y el 100 %. Estudio de estabilidad Este estudio se realizó por los métodos de vida de estante y estabilidad acelerada. Se emplearon muestras de los lotes 06001, y 06002, producidos en el Laboratorio de Formas Líquidas del CIDEM y envasados en frasco de vidrio ámbar con tapa Pilfer Proof, calidad hidrolítica II, de 125 ml de capacidad nominal, acabado 28 mm. Tapa plástica diámetro interno 28 mm. Estabilidad acelerada En los estudios de estabilidad acelerada, se almacenaron las muestras de los lotes estudiados en un horno a temperatura controlada de 40 ºC y 75 % de humedad relativa; se valoraron al inicio, 1, 2, 3 y 6 meses. Estabilidad por vida de estante En el estudio de estabilidad por vida de estante, los lotes estudiados se almacenaron a temperatura ambiente (30 ºC) y protegidos de la luz; se valoraron al inicio, a 3, 6, 9, 12, 18 y 24 meses de fabricados. Se realizó la determinación de la esterilidad a la solución oral al inicio y al final del estudio (24 meses), empleando para ello el método general para la realización del conteo microbiológico, reportado en la USP 30, Procesamiento estadístico de los datos Para el procesamiento estadístico de los datos se hizo un análisis descriptivo en el cual se calcularon la media y la desviación estándar para cada muestra. Se aplicó además el ensayo de normalidad (Anderson- Darling) y el ensayo de homogeneidad de varianza de Levene. Se aplicó el ensayo de comparación múltiple de medias de Student-Newman-Keuls, para determinar las diferencias entre grupos. El nivel de significación estadística, empleado en todos los casos, fue como mínimo de p< 0,05. Los datos fueron procesados utilizando el paquete estadístico MINITAB, versión RESULTADOS Validación del método analítico La figura muestra los resultados del estudio de especificidad del método. Como se observa en el cromatograma correspondiente a la muestra de excipientes (A), no se obtuvo ninguna señal en la zona de interés, al ser comparado con la señal obtenida para las soluciones estándar de referencias (B) y de la muestra de la solución oral 309
5 310 (C), lo cual indica que los excipientes o sustancias auxiliares de la solución no interfirieron en la determinación del principio activo. En cuanto a las muestras sometidas a condiciones drásticas de hidrólisis básica (D) e hidrólisis ácida (E), indicadas en los cromatogramas, la molécula resultó ser estable, sólo se pudo apreciar una ligera degradación por la disminución de la altura de los picos, sin la aparición de pequeños picos secundarios como posibles productos de degradación. En la tabla 1 se reportan los resultados del estudio de la linealidad del sistema, el coeficiente de regresión lineal fue de 0,9998 y el coeficiente de variación del factor de respuesta resultó igual a 4,2 %. Los resultados del estudio de precisión del método aparecen en la tabla 2. En el estudio de repetibilidad realizado, la media obtenida fue de 100,31 % y el coeficiente de variación fue de 0,22 %, mientras que los valores de F calculadas y los valores de t calculadas fueron menores que los valores tabulados, para un 95 % de confianza, para cada uno de los niveles estudiados. 310
6 311 Tabla 2. Estudio de la precisión intermedia del método analítico Niveles (%) Analista 1 (%) Analista 2 (%) Primer día Segundo día Tercer día Primer día Segundo día Tercer día 80 79,9 ± 0,2 80,1 ± 0,1 79,9 ± 0,1 79,9 ± 0,1 80,1 ± 0,1 79,9 ± 0, ,7 ± 0,2 99,9 ± 0,1 99,7 ± 0,2 99,9 ± 0,1 99,7 ± 0,1 99,9 ± 0, ,0 ± 0,1 120,0 ± 0,1 119,9 ± 0,2 119,9 ± 0,2 Análisis estadístico Prueba de Fischer 120,0 ± 0,2 119,9 ± 0,2 Niveles (%) por analistas Prueba de significación de Fisher por día ( F tab (5/5; 0.05) = 5,05 ) ( F tab ( 8/8; 0.05) = 3,44) Días ½ Días 2/3 Días 1/3 80 1,47 1,78 1,36 1, ,59 1,11 1,44 1, ,25 1,27 2,07 2,06 Límites exp Ftab Niveles (%) por analistas Prueba de significación de t de Student por día ( ttab (10; 0,05) = 2,22) (ttab (16; 0,05) = 2,12) Días ½ Días 2/3 Días 1/3 80 0,38 1,40 2,01 0,53 Límites Fexp Ftab 311
7 ,08 1,12 0,17 0, ,63 0,57 0,75 0,30 Coeficientes de variación Niveles (%) Analista 1 Analista 2 Límites 80 0,22 0, ,24 0, ,14 0,16 CV 2,0 % tcal: t calculada; Fcal: F calculada; ttab: t tabulada; Fcal: F tabulada; %: Los valores de porcentaje de principio activo (n= 3) se representan como valor medio ± desviación estándar relativa. Niveles: porcentaje de la concentración principio activo declarado en la formulación. 312
8 313 En la tabla 3 aparecen los resultados del estudio de exactitud. La recuperación media fue de 99,77 % y el valor de t calculada (1,44) y de G calculada (0,5000) fueron menores que los valores tabulados, para un 95 % de confianza, t tabulada 2,306 y G tabulada 0,8709. Estudio de estabilidad Los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa (HR), correspondiente a los lotes 06001, y (tabla 4), demostraron que el producto terminado no presentó cambios en los valores de los parámetros evaluados durante el estudio. 313
9 314 Los resultados del estudio de vida de estante, al inicio, 3, 6, 9, 12, 18 y 24 meses (tabla 5), muestran que el producto terminado cumplió con las especificaciones de calidad durante el estudio. 314
10 315 DISCUSIÓN Validación del método analítico Los resultados del estudio de especificidad del método (figura), demuestran la especificidad del método al no presentarse interferencias de picos adicionales en la zona de elución del producto principal, ya que los productos de degradación y los excipientes de la formulación presentan tiempos de retenciones diferentes al principio activo, todos inferiores al tiempo de retención del principio activo. Este estudio permitió concluir que el método cromatográfico resultó ser específico pues permite cuantificar el principio activo después de la degradación del mismo en muestras de medicamento sin interferencias de excipientes o producto de degradación. En cuanto a las muestras sometidas a condiciones drásticas no se observó la aparición de picos secundarios, atribuibles a un posible producto de degradación, ni interferencia en la determinación del principio activo, lo que demuestra la especificidad del método desarrollado. 4,5 Los resultados de los estudios de linealidad mostraron coeficiente de regresión y de determinación superiores a los exigidos en la Regulación del CECMED, 0,99 y 0,98 respectivamente, demostrándose la existencia de correlación con una probabilidad elevada, así como el grado de relación entre las variables concentración y respuesta detectada por el equipo empleado. También el coeficiente de variación de los factores de respuesta y la desviación estándar relativa de la pendiente fueron inferiores al normado como máximo para estos 315
11 316 indicadores: 5 y 2 %, respectivamente, ambos son considerados estimadores puntuales que permiten caracterizar la variabilidad. El valor del coeficiente de variación del factor de respuesta permitió demostrar que existía variabilidad en la relación respuesta y concentración para cada valor evaluado. El intervalo de confianza del intercepto incluyó al cero, lo que permitió excluir la significación del error del intercepto. Se demostrándose con estos resultados la linealidad del método propuesto.4-6 En los estudio de la repetibilidad realizado a una misma muestra, por el mismo analista, el mismo día, a través de 6 réplicas, se alcanzaron coeficientes de variación adecuados, lo que demostró la buena precisión del método, observándose una variabilidad de los resultados dentro de los límites establecidos para los métodos cromatográficos: C 2,0%. 4,5 Los valores que se obtuvieron en los estudios de precisión intermedia, de las pruebas de Fischer y t de Student, demostraron que no existían diferencias significativas entre las precisiones alcanzadas por los analistas en diferentes días para una probabilidad de 0,05%, ya que el valor de Fcalculada fue menor que la Ftabulada, estos resultados permitieron establecer que las precisiones son similares. Al realizar la prueba de t de Student el valor calculado resultó menor que el tabulado, para una probabilidad de 0,05, lo cual demostró que no existían diferencias significativas entre las medias alcanzadas, con un nivel de significación de un 5 %. Los valores de porcentaje de recobrado estuvieron dentro de los límites establecidos para los métodos cromatográficos ( %) y los valores del coeficiente de variación para cada uno de los valores de concentración estudiados resultaron ser menor que el 2 %. En la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud al aplicar la prueba de Cochran se obtuvo que las G calculadas fueron menores que la G tabulada para una probabilidad de 0,05, k= 3 y n= 3; por lo tanto, las varianzas de las concentraciones empleadas son equivalentes indicando que la concentración no influyó en la variabilidad de estos. Al realizar la prueba de significación entre la recuperación media y el 100,0 % de recuperación, el valor de t calculada resultó menor que la t tabulada. Estudio de estabilidad El conjunto de los resultados del estudio de estabilidad acelerada a 40 ºC y 75 % de humedad relativa, demostraron la estabilidad del producto. Se demostró la estabilidad térmica del producto ya que después de transcurridos 6 meses se mantuvo la concentración conforme con los límites establecidos en las especificaciones de calidad del producto terminado. De los resultados mostrados en la tabla 5 se infiere que el producto mantiene los parámetros que determinan su calidad, tanto en su etapa inicial como transcurridos 3, 6, 9, 12, 18 y 24 meses. Además, no se observan cambios en los aspectos organolépticos, el ph y la valoración de la concentración del principio activo durante el tiempo de almacenamiento estudiado. Los resultados de la esterilidad realizado el inicio y al final de estudio demostraron la estabilidad microbiológica del producto terminado. A partir de estos resultados se propusieron 2 años de validez, como tiempo de expiración para la formulación. No existieron diferencias significativas (p<0,05) entre las medias obtenidas en el tiempo inicial y el tiempo final de estudio. 316
12 317 En conclusión, el método analítico validado por CLAR para el estudio de estabilidad de la solución oral de risperidona 1 mg/ml, resultó específico, lineal, exacto y preciso en el intervalo de concentraciones estudiadas. Los resultados de los estudios de estabilidad acelerada y de vida de estante, reportados en la Regulación del CECMED para Buenas Prácticas de Fabricación de Productos Farmacéuticos, demostraron la estabilidad física, química y microbiológica del producto por espacio de 24 meses a temperatura ambiente, ya que en todos los casos los resultados se encontraron dentro de los límites establecidos en las especificaciones de calidad de la solución oral de risperidona 1 mg/ml. REFERENCIAS BIBLIOGRÁFICAS 1. Goodman A, Gilman A. Las bases farmacológicas de la terapéutica. Tomo II. 3ra. ed. La Habana: Editorial Científico Técnica; p PDR. Physician s Desk Reference. 57 ed. New York: Inc at Montuale; p Dierksneier G. Métodos cromatograficos. La Habana: Ed. Científico-Técnica; p. 1-4, Validation of Analytical Procedures. Technical Requirements for the Registration of Pharmaceuticals for Human Use. Geneve: International Conference on Harmonization, ICH-Q2A; Validation of Analytical Procedures. Technical Requirements For The Registration of Pharmaceuticals For Human Use. Geneve: International Conference on Harmonization, ICH-Q2A; United States Pharmacopoeial Convention. USP 30. United States Pharmacopoeia 30 and National Formulary No 25. Rockville: Marck Printing; Regulación No : Buenas Prácticas de Fabricación de Productos Farmacéuticos. La Habana: Centro Estatal para el Control de Medicamentos (CECMED); Recibido: 8 de abril de Aprobado: 17 de mayo de M. C. Caridad Margarita García Peña. Centro de Investigación y Desarrollo de Medicamentos (CIDEM). Ave. 26 No entre Boyeros y Puentes Grandes. CP Plaza de la Revolución, La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu 317
Validación de los métodos analíticos para el control de la calidad y el estudio de estabilidad del colirio de idoxiuridina 0,1 %
 Rev Cubana Farm 2005; 39(2) Centro de Investigación y Desarrollo de Medicamentos Validación de los métodos analíticos para el control de la calidad y el estudio de estabilidad del colirio de idoxiuridina
Rev Cubana Farm 2005; 39(2) Centro de Investigación y Desarrollo de Medicamentos Validación de los métodos analíticos para el control de la calidad y el estudio de estabilidad del colirio de idoxiuridina
Determinación simultánea por cromatografía líquida de alta resolución de albendazol y triclabendazol en triclazol 22 suspensión, para uso veterinario
 Revista Cubana de Farmacia 2013;47(2):167-177 ARTÍCULO ORIGINAL Determinación simultánea por cromatografía líquida de alta resolución de albendazol y triclabendazol en triclazol 22 suspensión, para uso
Revista Cubana de Farmacia 2013;47(2):167-177 ARTÍCULO ORIGINAL Determinación simultánea por cromatografía líquida de alta resolución de albendazol y triclabendazol en triclazol 22 suspensión, para uso
GUIA PARA LA ELABORACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACÉUTICOS VETERINARIOS. CAMEVET 2012
 GUIA PARA LA ELABORACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACÉUTICOS VETERINARIOS. CAMEVET 2012 GUIA PARA LA ELABORACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACÉUTICOS VETERINARIOS 1.
GUIA PARA LA ELABORACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACÉUTICOS VETERINARIOS. CAMEVET 2012 GUIA PARA LA ELABORACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACÉUTICOS VETERINARIOS 1.
REGLAMENTO RTCA 11.03.39: 06 TÉCNICO CENTROAMERICANO
 ANEXO DE LA RESOLUCIÓN No. 188-2006 (COMIECO-XL) REGLAMENTO RTCA 11.03.39: 06 TÉCNICO CENTROAMERICANO PRODUCTOS FARMACÉUTICOS. VALIDACIÓN DE MÉTODOS ANALÍTICOS PARA LA EVALUACIÓN DE LA CALIDAD DE LOS MEDICAMENTOS
ANEXO DE LA RESOLUCIÓN No. 188-2006 (COMIECO-XL) REGLAMENTO RTCA 11.03.39: 06 TÉCNICO CENTROAMERICANO PRODUCTOS FARMACÉUTICOS. VALIDACIÓN DE MÉTODOS ANALÍTICOS PARA LA EVALUACIÓN DE LA CALIDAD DE LOS MEDICAMENTOS
UOP 603-13: Análisis de Trazas de CO y CO2 en H2 e Hidrocarburos Gaseosos Ligeros por GC
 UOP 603-13: Análisis de Trazas de CO y CO2 en H2 e Hidrocarburos Gaseosos Ligeros por GC Análisis Rápido en
UOP 603-13: Análisis de Trazas de CO y CO2 en H2 e Hidrocarburos Gaseosos Ligeros por GC Análisis Rápido en
Validación y verificación de métodos de examen cuantitativos
 Temas selectos de Calidad en Serología (aplicación en el banco de sangre) Validación y verificación de métodos de examen cuantitativos Ignacio Reyes Ramírez entidad mexicana de acreditación, a.c. Introducción
Temas selectos de Calidad en Serología (aplicación en el banco de sangre) Validación y verificación de métodos de examen cuantitativos Ignacio Reyes Ramírez entidad mexicana de acreditación, a.c. Introducción
PAPEL DE LOS SISTEMAS INTEGRADOS DE GESTIÓN EN EL DESARROLLO DE MATERIALES DE REFERENCIA PARA LA INDUSTRIA FARMACÉUTICA
 PAPEL DE LOS SISTEMAS INTEGRADOS DE GESTIÓN EN EL DESARROLLO DE MATERIALES DE REFERENCIA PARA LA INDUSTRIA FARMACÉUTICA Autores: Mayra Castro Nodal 1, Janet Lora García 2, Ulises Jáuregui Haza 3. 1. Ingeniero
PAPEL DE LOS SISTEMAS INTEGRADOS DE GESTIÓN EN EL DESARROLLO DE MATERIALES DE REFERENCIA PARA LA INDUSTRIA FARMACÉUTICA Autores: Mayra Castro Nodal 1, Janet Lora García 2, Ulises Jáuregui Haza 3. 1. Ingeniero
GUIA DE VALIDACIÓN DE METODOS ANALITICOS
 GUIA DE VALIDACIÓN DE METODOS ANALITICOS Definiciones: ESPECIFICIDAD: Habilidad de evaluar inequívocamente el analito en presencia de componentes que se puede esperar que estén presentes. Típicamente éstos
GUIA DE VALIDACIÓN DE METODOS ANALITICOS Definiciones: ESPECIFICIDAD: Habilidad de evaluar inequívocamente el analito en presencia de componentes que se puede esperar que estén presentes. Típicamente éstos
Validación de métodos de ensayo
 Validación de métodos de ensayo Validación verificación de que los requisitos especificados son adecuados para un uso determinado Ejemplo: Un procedimiento de medición ordinariamente usado para la medición
Validación de métodos de ensayo Validación verificación de que los requisitos especificados son adecuados para un uso determinado Ejemplo: Un procedimiento de medición ordinariamente usado para la medición
Validación de Métodos
 Validación de Métodos Francisco Rojo Callejas Validación de Métodos Definiciones Parámetros básicos Requisitos Validación de Métodos El proceso de definir las condiciones analíticas y confirmar que el
Validación de Métodos Francisco Rojo Callejas Validación de Métodos Definiciones Parámetros básicos Requisitos Validación de Métodos El proceso de definir las condiciones analíticas y confirmar que el
Determinación por CLAR de las Vitaminas A y D en Aceite de Hígado de Tiburón
 Latin American Journal of Pharmacy (formerly Acta Farmacéutica Bonaerense) Lat. Am. J. Pharm. 27 (3): 419-24 (2008) Short communication Received: November 21, 2007 Accepted: March 15, 2008 Determinación
Latin American Journal of Pharmacy (formerly Acta Farmacéutica Bonaerense) Lat. Am. J. Pharm. 27 (3): 419-24 (2008) Short communication Received: November 21, 2007 Accepted: March 15, 2008 Determinación
INTERCAMBIABILIDAD. Adriana Martínez Martínez DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS. Dictaminadora Especializada
 INTERCAMBIABILIDAD Adriana Martínez Martínez Dictaminadora Especializada DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 PRUEBAS DE INTERCAMBIABILIDAD Prueba A. Buenas prácticas de
INTERCAMBIABILIDAD Adriana Martínez Martínez Dictaminadora Especializada DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 PRUEBAS DE INTERCAMBIABILIDAD Prueba A. Buenas prácticas de
Cuantificación de compuestos por cromatografía: Método del Patrón Externo
 Cuantificación de compuestos por cromatografía: Método del Patrón Externo Apellidos, nombre Departamento Centro Fernández Segovia, Isabel (isferse1@tal.upv.es) García Martínez, Eva (evgarmar@tal.upv.es)
Cuantificación de compuestos por cromatografía: Método del Patrón Externo Apellidos, nombre Departamento Centro Fernández Segovia, Isabel (isferse1@tal.upv.es) García Martínez, Eva (evgarmar@tal.upv.es)
RESOLUCIÓN OIV-OENO 521-2013 MÉTODO DE DETECCIÓN DE FTALATOS EN LAS BEBIDAS ESPIRITUOSAS POR CROMATOGRAFÍA DE GASES/ESPECTROMETRÍA DE MASAS
 RESOLUCIÓN OIV-OENO 521-2013 MÉTODO DE DETECCIÓN DE FTALATOS EN LAS BEBIDAS ESPIRITUOSAS POR CROMATOGRAFÍA DE GASES/ESPECTROMETRÍA DE MASAS LA ASAMBLEA GENERAL, Visto el artículo 2 párrafo 2 iv del acuerdo
RESOLUCIÓN OIV-OENO 521-2013 MÉTODO DE DETECCIÓN DE FTALATOS EN LAS BEBIDAS ESPIRITUOSAS POR CROMATOGRAFÍA DE GASES/ESPECTROMETRÍA DE MASAS LA ASAMBLEA GENERAL, Visto el artículo 2 párrafo 2 iv del acuerdo
VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA DETERMINACIÓN DE 3 VITAMINAS HIDROSOLUBLES EN UN SUPLEMENTO VITAMÍNICO
 Rev Cubana Farm 2000;34(2):93-9 Centro de Investigación y Desarrollo de Medicamentos VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA DETERMINACIÓN DE 3 VITAMINAS HIDROSOLUBLES EN UN SUPLEMENTO VITAMÍNICO Iverlis
Rev Cubana Farm 2000;34(2):93-9 Centro de Investigación y Desarrollo de Medicamentos VALIDACIÓN DEL MÉTODO ANALÍTICO PARA LA DETERMINACIÓN DE 3 VITAMINAS HIDROSOLUBLES EN UN SUPLEMENTO VITAMÍNICO Iverlis
Curso Comparabilidad de resultados
 Curso Comparabilidad de resultados Director: Gabriel A. Migliarino. Docente: Evangelina Hernández. Agenda Introducción. n. Protocolos iniciales de comparación de métodos. m * EP9-A2. CLSI. * Comparación
Curso Comparabilidad de resultados Director: Gabriel A. Migliarino. Docente: Evangelina Hernández. Agenda Introducción. n. Protocolos iniciales de comparación de métodos. m * EP9-A2. CLSI. * Comparación
Generalización del diseño y desarrollo tecnológico de una formulación inyectable de Ondansetron-4. aica. Empresa Laboratorios aica.
 Generalización del diseño y desarrollo tecnológico de una formulación inyectable de Ondansetron-4. aica Empresa Laboratorios aica. INTRODUCCIÓN La Empresa Laboratorios aica tiene como misión la Elaboración
Generalización del diseño y desarrollo tecnológico de una formulación inyectable de Ondansetron-4. aica Empresa Laboratorios aica. INTRODUCCIÓN La Empresa Laboratorios aica tiene como misión la Elaboración
EMPLEO DEL CONTROL ESTADISTICO DE PROCESO COMO PARTE DE UN PLAN DE ASEGURAMIENTO DE LA CALIDAD Acosta, S. 1, Lewis, C. 2 RESUMEN
 EMPLEO DEL CONTROL ESTADISTICO DE PROCESO COMO PARTE DE UN PLAN DE ASEGURAMIENTO DE LA CALIDAD Acosta, S. 1, Lewis, C. 2 1,2 Autoridad Regulatoria Nuclear Buenos Aires, Argentina sacosta@arn.gob.ar RESUMEN
EMPLEO DEL CONTROL ESTADISTICO DE PROCESO COMO PARTE DE UN PLAN DE ASEGURAMIENTO DE LA CALIDAD Acosta, S. 1, Lewis, C. 2 1,2 Autoridad Regulatoria Nuclear Buenos Aires, Argentina sacosta@arn.gob.ar RESUMEN
GPA2286: Análisis extendido para Gas Natural y Mezclas Gaseosas similares por Cromatografía de Gases de Temperatura programada
 GPA2286: Análisis extendido para Gas Natural y Mezclas Gaseosas similares por Cromatografía de Gases de Temperatura programada Tiempo de análisis inferior a 30 minutos Alta sensibilidad, linealidad, exactitud
GPA2286: Análisis extendido para Gas Natural y Mezclas Gaseosas similares por Cromatografía de Gases de Temperatura programada Tiempo de análisis inferior a 30 minutos Alta sensibilidad, linealidad, exactitud
MERCOSUR/GMC/RES Nº 53/96 Estabilidad de productos farmacéuticos VISTO: el Tratado de Asunción, el Protocolo de Ouro Preto, la Decisión 3/94 del
 MERCOSUR/GMC/RES Nº 53/96 Estabilidad de productos farmacéuticos VISTO: el Tratado de Asunción, el Protocolo de Ouro Preto, la Decisión 3/94 del Consejo del Mercado Común; las Resoluciones Nº 91/93 y 23/95
MERCOSUR/GMC/RES Nº 53/96 Estabilidad de productos farmacéuticos VISTO: el Tratado de Asunción, el Protocolo de Ouro Preto, la Decisión 3/94 del Consejo del Mercado Común; las Resoluciones Nº 91/93 y 23/95
Control de Calidad en la Industria Farmacéutica
 Área Análisis de Medicamentos Departamento de Química Orgánica Facultad de Ciencias Bioquímicas y Farmacéuticas Control de Calidad en la Industria Farmacéutica Dra. atricia M. Castellano DOSIS SOLA FACIT
Área Análisis de Medicamentos Departamento de Química Orgánica Facultad de Ciencias Bioquímicas y Farmacéuticas Control de Calidad en la Industria Farmacéutica Dra. atricia M. Castellano DOSIS SOLA FACIT
ESTADÍSTICA BÁSICA en LABORATORIOS (Físico - Químicos)
 ESTADÍSTICA BÁSICA en LABORATORIOS (Físico - Químicos) (Aplicaciones de Microsoft Excel ) Curso a distancia (EDICIÓN Junio 2012) ASECAL, S.L. MADRID-ESPAÑA RONDA DE TOLEDO, 8, LOCAL 1º- 28005 MADRID. Teléfono:
ESTADÍSTICA BÁSICA en LABORATORIOS (Físico - Químicos) (Aplicaciones de Microsoft Excel ) Curso a distancia (EDICIÓN Junio 2012) ASECAL, S.L. MADRID-ESPAÑA RONDA DE TOLEDO, 8, LOCAL 1º- 28005 MADRID. Teléfono:
CONTRATO DE SUMINISTROS PLIEGO DE PRESCRIPCIONES TÉCNICAS IÓNICO. OBJETO DEL CONTRATO: SUMINISTRO E INSTALACIÓN DE UN CROMATÓGRAFO
 UNIVERSIDAD DE JAÉN CONTRATO DE SUMINISTROS PLIEGO DE PRESCRIPCIONES TÉCNICAS OBJETO DEL CONTRATO: SUMINISTRO E INSTALACIÓN DE UN CROMATÓGRAFO IÓNICO. NÚMERO DE EXPEDIENTE 2013/06 PROCEDIMIENTO DE ADJUDICACIÓN
UNIVERSIDAD DE JAÉN CONTRATO DE SUMINISTROS PLIEGO DE PRESCRIPCIONES TÉCNICAS OBJETO DEL CONTRATO: SUMINISTRO E INSTALACIÓN DE UN CROMATÓGRAFO IÓNICO. NÚMERO DE EXPEDIENTE 2013/06 PROCEDIMIENTO DE ADJUDICACIÓN
COMPARACION DE DOS METODOLOGIAS PARA LA DETERMINACION DE NITROGENO TOTAL EN ABONOS O FERTILIZANTES
 COMPARACION DE DOS METODOLOGIAS PARA LA DETERMINACION DE NITROGENO TOTAL EN ABONOS O FERTILIZANTES El método comunitario 2.6.1. para la determinación del nitrógeno total en los abonos, descrito en el anexo
COMPARACION DE DOS METODOLOGIAS PARA LA DETERMINACION DE NITROGENO TOTAL EN ABONOS O FERTILIZANTES El método comunitario 2.6.1. para la determinación del nitrógeno total en los abonos, descrito en el anexo
PRODUCTOS FARMACEUTICOS. ESTUDIOS DE ESTABILIDAD DE MEDICAMENTOS PARA USO HUMANO
 NTON 19 002-09 REGLAMENTO TÉCNICO RTCA 11.01.04:09 CENTROAMERICANO PRODUCTOS FARMACEUTICOS. ESTUDIOS DE ESTABILIDAD DE MEDICAMENTOS PARA USO HUMANO CORRESPONDENCIA: Este Reglamento no tiene correspondencia
NTON 19 002-09 REGLAMENTO TÉCNICO RTCA 11.01.04:09 CENTROAMERICANO PRODUCTOS FARMACEUTICOS. ESTUDIOS DE ESTABILIDAD DE MEDICAMENTOS PARA USO HUMANO CORRESPONDENCIA: Este Reglamento no tiene correspondencia
turbidez en los medios de cultivo. La duración de la prueba de esterilidad es de 14 días. Las pruebas de toxicidad (específica y general), llamadas
 Para que una prueba se considere validada deberá cumplir los requisitos siguientes: Precisión: es la variación de los resultados de acuerdo a la desviación estándar o al coeficiente de variación. Exactitud:
Para que una prueba se considere validada deberá cumplir los requisitos siguientes: Precisión: es la variación de los resultados de acuerdo a la desviación estándar o al coeficiente de variación. Exactitud:
Control interno de los métodos de análisis
 Aseguramiento de la Calidad Control interno de los métodos de análisis Universidad Nacional Sede Medellín Facultad de Ciencias Escuela de Geociencias Orlando Ruiz Villadiego, Químico MSc. Coordinador Laboratorio
Aseguramiento de la Calidad Control interno de los métodos de análisis Universidad Nacional Sede Medellín Facultad de Ciencias Escuela de Geociencias Orlando Ruiz Villadiego, Químico MSc. Coordinador Laboratorio
Exactitud y precisión en el rendimiento del sistema Accu-Chek Aviva. Introducción. I. EXACTITUD Método
 Exactitud y precisión en el rendimiento del sistema Accu-Chek Aviva Introducción La exactitud del sistema fue evaluada según la norma ISO 15197:2003. Se obtuvieron muestras de sangre capilar de pacientes
Exactitud y precisión en el rendimiento del sistema Accu-Chek Aviva Introducción La exactitud del sistema fue evaluada según la norma ISO 15197:2003. Se obtuvieron muestras de sangre capilar de pacientes
Exactitud y precisión del sistema Accu-Chek Performa. Introducción I. EXACTITUD. Método
 Exactitud y precisión del sistema Accu-Chek Performa Introducción La exactitud del sistema se evaluó según la norma EN ISO 15197:2003 (Sistemas de ensayo para diagnóstico in vitro Requisitos para los sistemas
Exactitud y precisión del sistema Accu-Chek Performa Introducción La exactitud del sistema se evaluó según la norma EN ISO 15197:2003 (Sistemas de ensayo para diagnóstico in vitro Requisitos para los sistemas
Validación de un Método Instrumental
 Validación Validación de un Método Instrumental Un Proceso de Validación Consiste de al menos las siguientes etapas: Validación del Software Validación del Hardware ( Instrumento) Validación del Método
Validación Validación de un Método Instrumental Un Proceso de Validación Consiste de al menos las siguientes etapas: Validación del Software Validación del Hardware ( Instrumento) Validación del Método
QUÉ PREFIERE: MARCA PROPIA O MARCA COMERCIAL LÍDER?
 QUÉ PREFIERE: MARCA PROPIA O MARCA COMERCIAL LÍDER? Yeverino-Gutiérrez M., Gracia-Vásquez Y., Chapa-Cabrera Y., Casanova-Mina A., Sánchez-Salazar G., Méndez-Ramos M., Grimaldo-Mendoza I., Arteaga-Mac Kinney
QUÉ PREFIERE: MARCA PROPIA O MARCA COMERCIAL LÍDER? Yeverino-Gutiérrez M., Gracia-Vásquez Y., Chapa-Cabrera Y., Casanova-Mina A., Sánchez-Salazar G., Méndez-Ramos M., Grimaldo-Mendoza I., Arteaga-Mac Kinney
CURSO INTERNACIONAL DE POSGRADO
 CURSO INTERNACIONAL DE POSGRADO Córdoba, Argentina. 11 14 de octubre de 2011 Prof. Dra. MARCELA LONGHI DEPARTAMENTO DE FARMACIA FACULTAD DE CIENCIAS QUIMICAS UNIVERSIDAD NACIONAL DE CORDOBA ARGENTINA DATOS
CURSO INTERNACIONAL DE POSGRADO Córdoba, Argentina. 11 14 de octubre de 2011 Prof. Dra. MARCELA LONGHI DEPARTAMENTO DE FARMACIA FACULTAD DE CIENCIAS QUIMICAS UNIVERSIDAD NACIONAL DE CORDOBA ARGENTINA DATOS
ALERGENOS-DETERMINACIÓN DE LISOZIMA
 ALERGENOS-DETERMINACIÓN DE LISOZIMA Disertante: Brom. Carolina Chiconofri Departamento de Normas Analíticas Especiales Sub. De Investigación para la Fiscalización Instituto Nacional de Vitivinicultura
ALERGENOS-DETERMINACIÓN DE LISOZIMA Disertante: Brom. Carolina Chiconofri Departamento de Normas Analíticas Especiales Sub. De Investigación para la Fiscalización Instituto Nacional de Vitivinicultura
Estudio de estabilidad de tabletas de risperidona 3 mg
 196 ARTÍCULOS ORIGINALES Estudio de estabilidad de tabletas de risperidona 3 mg Study of stability of Risperidone (3 mg) tablets Caridad Margarita García Peña I ; Antonio Iraizoz Barrios I ; Vivian Martínez
196 ARTÍCULOS ORIGINALES Estudio de estabilidad de tabletas de risperidona 3 mg Study of stability of Risperidone (3 mg) tablets Caridad Margarita García Peña I ; Antonio Iraizoz Barrios I ; Vivian Martínez
Rosamil Rey, Ph.D. CHEM 4160
 Rosamil Rey, Ph.D. CHEM 4160 Los métodos analíticos se pueden clasificar en: Métodos Clásicos Métodos Instrumentales Métodos Clásicos Precipitación Extracción Destilación Medidas gravimétricas Medidas
Rosamil Rey, Ph.D. CHEM 4160 Los métodos analíticos se pueden clasificar en: Métodos Clásicos Métodos Instrumentales Métodos Clásicos Precipitación Extracción Destilación Medidas gravimétricas Medidas
Empresa de Productos Biológicos "Carlos J. Finlay" RESUMEN
 Rev Cubana Farm 1998;32(2):106-12 Empresa de Productos Biológicos "Carlos J. Finlay" VALIDACIÓN DE TÉCNICAS ANALÍTICAS UTILIZADAS EN EL CONTROL DE LA CALIDAD Miriam Díaz de Armas, 1 Idania Hernández Oramas,
Rev Cubana Farm 1998;32(2):106-12 Empresa de Productos Biológicos "Carlos J. Finlay" VALIDACIÓN DE TÉCNICAS ANALÍTICAS UTILIZADAS EN EL CONTROL DE LA CALIDAD Miriam Díaz de Armas, 1 Idania Hernández Oramas,
Equipos de medición. Intervalos de calibración e interpretación de Certificados de Calibración
 Equipos de medición. Intervalos de calibración e interpretación de Certificados de Calibración Equipos de Medición. Intervalos de calibración e interpretación de Certificados de Calibración Disertante:
Equipos de medición. Intervalos de calibración e interpretación de Certificados de Calibración Equipos de Medición. Intervalos de calibración e interpretación de Certificados de Calibración Disertante:
CAPÍTULO IV METODOLOGÍA PARA EL CONTROL DE INVENTARIOS. En este capítulo se presenta los pasos que se siguieron para la elaboración de un sistema de
 CAPÍTULO IV METODOLOGÍA PARA EL CONTROL DE INVENTARIOS En este capítulo se presenta los pasos que se siguieron para la elaboración de un sistema de inventarios para lograr un control de los productos.
CAPÍTULO IV METODOLOGÍA PARA EL CONTROL DE INVENTARIOS En este capítulo se presenta los pasos que se siguieron para la elaboración de un sistema de inventarios para lograr un control de los productos.
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS.
 FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS. 1.- Para determinar el contenido en plomo en una muestra de leche contaminada, se toma 1.0 ml de la leche y se diluye a un volumen final
FUNDAMENTOS DE ANÁLISIS INSTRUMENTAL. 4ª RELACIÓN DE PROBLEMAS. 1.- Para determinar el contenido en plomo en una muestra de leche contaminada, se toma 1.0 ml de la leche y se diluye a un volumen final
PROPUESTA DE DICTAMEN TÉCNICO
 PROPUESTA DE DICTAMEN TÉCNICO SOLICITUD DE APRECIACIÓN FAVORABLE DE LA REVISIÓN 1 DEL INFORME FINAL DEL PLAN DE PRUEBAS DEL PROCESO DE DESCLASIFICACIÓN DE CHATARRAS 1. IDENTIFICACIÓN 1.1. Solicitante Iberdrola
PROPUESTA DE DICTAMEN TÉCNICO SOLICITUD DE APRECIACIÓN FAVORABLE DE LA REVISIÓN 1 DEL INFORME FINAL DEL PLAN DE PRUEBAS DEL PROCESO DE DESCLASIFICACIÓN DE CHATARRAS 1. IDENTIFICACIÓN 1.1. Solicitante Iberdrola
GUIA PARA LA REALIZACION Y PRESENTACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACOLOGICOS DE USO VETERINARIO
 GUIA PARA LA REALIZACION Y PRESENTACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACOLOGICOS MINISTERIO DE AGRICULTURA SERVICIO AGRÍCOLA Y GANADERO INDICE I. INTRODUCCION.. 3 II. OBJETIVOS... 3 III.
GUIA PARA LA REALIZACION Y PRESENTACION DE ESTUDIOS DE ESTABILIDAD DE PRODUCTOS FARMACOLOGICOS MINISTERIO DE AGRICULTURA SERVICIO AGRÍCOLA Y GANADERO INDICE I. INTRODUCCION.. 3 II. OBJETIVOS... 3 III.
Lo que usted debe saber para Validar o Verificar sus métodos de ensayo Subdirección de Gestión de Calidad de Laboratorios de Salud Pública Septiembre
 Lo que usted debe saber para Validar o Verificar sus métodos de ensayo Subdirección de Gestión de Calidad de Laboratorios de Salud Pública Septiembre 2015 AGENDA 1 Definición 2 Por qué validar? 3 Previo
Lo que usted debe saber para Validar o Verificar sus métodos de ensayo Subdirección de Gestión de Calidad de Laboratorios de Salud Pública Septiembre 2015 AGENDA 1 Definición 2 Por qué validar? 3 Previo
Integrantes: Andrés Felipe Cárdenas Álvarez 2101302 Diana Katherine Carreño Moyano 2100993 Lorena Duarte Peña 2100968. Grupo: 4
 PRÁCTICA 8. DETERMINACIÓN DE CALCIO Y MAGNESIO EN UN LÁCTEO, LECHE ENTERA PARMALAT Integrantes: Andrés Felipe Cárdenas Álvarez 2101302 Diana Katherine Carreño Moyano 2100993 Lorena Duarte Peña 2100968
PRÁCTICA 8. DETERMINACIÓN DE CALCIO Y MAGNESIO EN UN LÁCTEO, LECHE ENTERA PARMALAT Integrantes: Andrés Felipe Cárdenas Álvarez 2101302 Diana Katherine Carreño Moyano 2100993 Lorena Duarte Peña 2100968
La selectividad en análisis químico
 La selectividad en análisis químico Ricard Boqué Grupo de Quimiometría y Cualimetría Universidad Rovira i Virgili (Tarragona) El concepto de selectividad en análisis químico ha sido objeto de una redefinición
La selectividad en análisis químico Ricard Boqué Grupo de Quimiometría y Cualimetría Universidad Rovira i Virgili (Tarragona) El concepto de selectividad en análisis químico ha sido objeto de una redefinición
Diseño y validación de un nuevo método para estimar reductores hidrosolubles asociados con la quitina
 Rev Cubana Farm 2005;39(3) Instituto de Farmacia y alimentos. Universidad de La Habana Diseño y validación de un nuevo método para estimar reductores hidrosolubles asociados con la quitina Yania Suárez
Rev Cubana Farm 2005;39(3) Instituto de Farmacia y alimentos. Universidad de La Habana Diseño y validación de un nuevo método para estimar reductores hidrosolubles asociados con la quitina Yania Suárez
II. ANÁLISIS DE SISTEMAS DE MEDICIÓN
 II. ANÁLISIS DE SISTEMAS DE MEDICIÓN INTRODUCCIÓN Siempre que registramos o medimos los resultados de un proceso nos encontramos con cierta variación en los datos obtenidos. Esta variación puede provenir
II. ANÁLISIS DE SISTEMAS DE MEDICIÓN INTRODUCCIÓN Siempre que registramos o medimos los resultados de un proceso nos encontramos con cierta variación en los datos obtenidos. Esta variación puede provenir
CENTRO DE SALUD FAMILIAR JUAN CARTES
 Páginas: 2 de 6 1. INTRODUCCION La estabilidad es la capacidad de un medicamento para mantenerse dentro de sus especificaciones físicas, químicas, microbiológicas, terapéuticas y toxicológicas, hasta su
Páginas: 2 de 6 1. INTRODUCCION La estabilidad es la capacidad de un medicamento para mantenerse dentro de sus especificaciones físicas, químicas, microbiológicas, terapéuticas y toxicológicas, hasta su
CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS
 CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS Para el proceso de purificación del aceite, se pudo observar, en el momento del filtrado algunas partículas sólidas retenidas en los diferentes filtros
CAPÍTULO III RESULTADOS Y ANÁLISIS DE RESULTADOS Para el proceso de purificación del aceite, se pudo observar, en el momento del filtrado algunas partículas sólidas retenidas en los diferentes filtros
5 Materiales y Métodos
 5 Materiales y Métodos Los tejidos de Cenchurs ciliaris utilizados en esta investigación fueron obtenidos por pretratamiento con H 2 SO 4 al 0.15 M, a 135ºC, para eliminar la hemicelulosa. Con los tejidos
5 Materiales y Métodos Los tejidos de Cenchurs ciliaris utilizados en esta investigación fueron obtenidos por pretratamiento con H 2 SO 4 al 0.15 M, a 135ºC, para eliminar la hemicelulosa. Con los tejidos
REGLAMENTO TÉCNICO RTCA 11.01.04:10 CENTROAMERICANO PRODUCTOS FARMACEUTICOS. ESTUDIOS DE ESTABILIDAD DE MEDICAMENTOS PARA USO HUMANO
 ANEXO DE LA RESOLUCIÓN No. 256-2010 (COMIECO-LIX) REGLAMENTO TÉCNICO RTCA 11.01.04:10 CENTROAMERICANO Primera Actualización PRODUCTOS FARMACEUTICOS. ESTUDIOS DE ESTABILIDAD DE MEDICAMENTOS PARA USO HUMANO
ANEXO DE LA RESOLUCIÓN No. 256-2010 (COMIECO-LIX) REGLAMENTO TÉCNICO RTCA 11.01.04:10 CENTROAMERICANO Primera Actualización PRODUCTOS FARMACEUTICOS. ESTUDIOS DE ESTABILIDAD DE MEDICAMENTOS PARA USO HUMANO
LA MEDIDA Y SUS ERRORES
 LA MEDIDA Y SUS ERRORES Magnitud, unidad y medida. Magnitud es todo aquello que se puede medir y que se puede representar por un número. Para obtener el número que representa a la magnitud debemos escoger
LA MEDIDA Y SUS ERRORES Magnitud, unidad y medida. Magnitud es todo aquello que se puede medir y que se puede representar por un número. Para obtener el número que representa a la magnitud debemos escoger
Desarrollo y validación de un método analítico para el control de calidad y estabilidad de fenilefrina 10 % colirio y tropicamida 1 %
 ARTÍCULOS ORIGINALES Desarrollo y validación de un método analítico para el control de calidad y estabilidad de fenilefrina 10 % colirio y tropicamida 1 % Development and validation of an analytical method
ARTÍCULOS ORIGINALES Desarrollo y validación de un método analítico para el control de calidad y estabilidad de fenilefrina 10 % colirio y tropicamida 1 % Development and validation of an analytical method
Gestión de Calidad de laboratorio clínico
 Gestión de Calidad de laboratorio clínico T.M. Luis Valenzuela Andrade Magíster en Aseguramiento de calidad en Laboratorio Clínicos, UNAB 2007 Product Manager Sistemas de Gestión de calidad Tecnigen Sistemas
Gestión de Calidad de laboratorio clínico T.M. Luis Valenzuela Andrade Magíster en Aseguramiento de calidad en Laboratorio Clínicos, UNAB 2007 Product Manager Sistemas de Gestión de calidad Tecnigen Sistemas
UNIVERSIDAD DEL SALVADOR PROGRAMA. UNIDAD ACADÉMICA: Campus San Roque González de Santa Cruz. CARRERA: Veterinaria. DIVISIÓN / COMISIÓN: Primer Año
 UNIVERSIDAD DEL SALVADOR PROGRAMA UNIDAD ACADÉMICA: Campus San Roque González de Santa Cruz. CARRERA: Veterinaria DIVISIÓN / COMISIÓN: Primer Año TURNO: Único OBLIGACIÓN ACADÉMICA: ESTADÍSTICA Y DISEÑO
UNIVERSIDAD DEL SALVADOR PROGRAMA UNIDAD ACADÉMICA: Campus San Roque González de Santa Cruz. CARRERA: Veterinaria DIVISIÓN / COMISIÓN: Primer Año TURNO: Único OBLIGACIÓN ACADÉMICA: ESTADÍSTICA Y DISEÑO
EVALUACIÓN DE INSTRUMENTOS DE MEDICIÓN PARA DETERMINAR LA HUMEDAD DEL TABACO NEGRO CUBANO
 Vol.8, No. 1, 2007 CUBA TABACO EVALUACIÓN DE INSTRUMENTOS DE MEDICIÓN PARA DETERMINAR LA HUMEDAD DEL TABACO NEGRO CUBANO José Guardiola y Yanisei Hartmann Instituto de Investigaciones del Tabaco. Carretera
Vol.8, No. 1, 2007 CUBA TABACO EVALUACIÓN DE INSTRUMENTOS DE MEDICIÓN PARA DETERMINAR LA HUMEDAD DEL TABACO NEGRO CUBANO José Guardiola y Yanisei Hartmann Instituto de Investigaciones del Tabaco. Carretera
Estudio de estabilidad de tabletas de propiltiouracilo 50 mg
 ARTÍCULOS ORIGINALES Estudio de estabilidad de tabletas de propiltiouracilo 50 mg Study of the 50 mg Propylthiouracil tablets stability María Olga Valdés Bendoyro I ; Caridad Margarita García Peña II ;
ARTÍCULOS ORIGINALES Estudio de estabilidad de tabletas de propiltiouracilo 50 mg Study of the 50 mg Propylthiouracil tablets stability María Olga Valdés Bendoyro I ; Caridad Margarita García Peña II ;
CRITERIOS ESPECÍFICOS PARA EVALUAR LA INCERTIDUMBRE EN PROCESOS DE MEDICIÓN EN LABORATORIOS QUIMICOS
 Página 1 de 6 TITULO: CRITERIOS ESPECIFICOS PARA EVALUAR LA INCERTIDUMBRE DE UN PROCESO DE MEDICIÓN EN LABORATORIOS QUÍMICOS Resumen: El presente documento contiene los criterios en lo referente a la evaluación
Página 1 de 6 TITULO: CRITERIOS ESPECIFICOS PARA EVALUAR LA INCERTIDUMBRE DE UN PROCESO DE MEDICIÓN EN LABORATORIOS QUÍMICOS Resumen: El presente documento contiene los criterios en lo referente a la evaluación
Validación de los métodos analíticos para el control de la calidad y estudio de estabilidad del salbutamol 0,5 % en solución nebulizadora
 Rev Cubana Farm 2005; 39(2) Centro de Investigación y Desarrollo de Medicamentos Validación de los métodos analíticos para el control de la calidad y estudio de estabilidad del salbutamol 0,5 % en solución
Rev Cubana Farm 2005; 39(2) Centro de Investigación y Desarrollo de Medicamentos Validación de los métodos analíticos para el control de la calidad y estudio de estabilidad del salbutamol 0,5 % en solución
Lección 16. INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO.
 Lección 16. INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO. Análisis cuantitativo: Conceptos básicos. Propiedades analíticas de interés. Trazabilidad. Materiales de referencia. Calibración instrumental y metodológica.
Lección 16. INTRODUCCIÓN AL ANÁLISIS CUANTITATIVO. Análisis cuantitativo: Conceptos básicos. Propiedades analíticas de interés. Trazabilidad. Materiales de referencia. Calibración instrumental y metodológica.
Las Reglas de Westgard más Six Sigma, igual a Mejores Métodos, Mejor Control de la Calidad. Gabriel Alejandro Migliarino
 Las Reglas de Westgard más Six Sigma, igual a Mejores Métodos, Mejor Control de la Calidad. Gabriel Alejandro Migliarino Agenda Introducción Definiciones Métrica Sigma Introducción Calidad Analítica y
Las Reglas de Westgard más Six Sigma, igual a Mejores Métodos, Mejor Control de la Calidad. Gabriel Alejandro Migliarino Agenda Introducción Definiciones Métrica Sigma Introducción Calidad Analítica y
4.1.5 Análisis de metales pesados en la materia en suspensión
 Preparación de las rectas de calibrado Para la determinación de los metales pesados en sedimentos, la metodología que se sigue para la construcción de las rectas de calibrado es similar que para las aguas
Preparación de las rectas de calibrado Para la determinación de los metales pesados en sedimentos, la metodología que se sigue para la construcción de las rectas de calibrado es similar que para las aguas
EL ANÁLISIS DE LA VARIANZA (ANOVA) 1. Comparación de múltiples poblaciones
 EL ANÁLISIS DE LA VARIANZA (ANOVA) 1. Comparación de múltiples poblaciones Ricard Boqué, Alicia Maroto Grupo de Quimiometría y Cualimetría. Universitat Rovira i Virgili. Pl. Imperial Tàrraco, 1. 43005Tarragona
EL ANÁLISIS DE LA VARIANZA (ANOVA) 1. Comparación de múltiples poblaciones Ricard Boqué, Alicia Maroto Grupo de Quimiometría y Cualimetría. Universitat Rovira i Virgili. Pl. Imperial Tàrraco, 1. 43005Tarragona
Investigación sobre el cambio en la aceleración de un carrito que rueda hacia abajo sobre un plano inclinado
 Investigación sobre el cambio en la aceleración de un carrito que rueda hacia abajo sobre un plano inclinado La investigación Pregunta de investigación: Es constante la aceleración de un carrito que cae
Investigación sobre el cambio en la aceleración de un carrito que rueda hacia abajo sobre un plano inclinado La investigación Pregunta de investigación: Es constante la aceleración de un carrito que cae
6. Reacciones de precipitación
 6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
6. Reacciones de precipitación Las reacciones de precipitación son aquellas en las que el producto es un sólido; se utilizan en los métodos gravimétricos de análisis y en las titulaciones por precipitación.
4 Pruebas y análisis del software
 4 Pruebas y análisis del software En este capítulo se presentan una serie de simulaciones donde se analiza el desempeño de ambos sistemas programados en cuanto a exactitud con otros softwares que se encuentran
4 Pruebas y análisis del software En este capítulo se presentan una serie de simulaciones donde se analiza el desempeño de ambos sistemas programados en cuanto a exactitud con otros softwares que se encuentran
Dispositivo de Permeación Integrado en el GC
 Dispositivo de Permeación Integrado en el GC Diseño Integrado en el GC Nivel de Calibración desde PPB a PPM No se necesitan Cilindros o Reguladores Opción doble Horno Rentable, Seguro, Limpio, Flexible,
Dispositivo de Permeación Integrado en el GC Diseño Integrado en el GC Nivel de Calibración desde PPB a PPM No se necesitan Cilindros o Reguladores Opción doble Horno Rentable, Seguro, Limpio, Flexible,
Laboratorio de Métodos Instrumentales I. Práctica No. 1 Determinación de fósforo en bebidas de cola por Espectrofotometría UV- Vis.
 Laboratorio de Métodos Instrumentales I Práctica No. 1 Determinación de fósforo en bebidas de cola por Espectrofotometría UV- Vis Equipo 1 Candy Lara Rentería Jessica Torres Gámez Salón 1 Mérida, Yucatán
Laboratorio de Métodos Instrumentales I Práctica No. 1 Determinación de fósforo en bebidas de cola por Espectrofotometría UV- Vis Equipo 1 Candy Lara Rentería Jessica Torres Gámez Salón 1 Mérida, Yucatán
NEO PEQUES MOCOSYTOS 150 ml BIEN ACEPTADO por los PEDIATRAS como TRATAMIENTO SINTOMÁTICO DE LOS CUADROS DE VÍAS AÉREAS SUPERIORES (CVAS)
 (Servicio Pediatría de la Fundació Hospital de Nens de Barcelona) NEO PEQUES MOCOSYTOS 150 ml BIEN ACEPTADO por los PEDIATRAS como TRATAMIENTO SINTOMÁTICO DE LOS CUADROS DE VÍAS AÉREAS SUPERIORES (CVAS)
(Servicio Pediatría de la Fundació Hospital de Nens de Barcelona) NEO PEQUES MOCOSYTOS 150 ml BIEN ACEPTADO por los PEDIATRAS como TRATAMIENTO SINTOMÁTICO DE LOS CUADROS DE VÍAS AÉREAS SUPERIORES (CVAS)
6.5. Documentación y archivo
 6.5. Documentación y archivo La documentación aportada por la validación de los controles de rutina durante el proceso de esterilización debe archivarse para acreditar la garantía de calidad del mismo.
6.5. Documentación y archivo La documentación aportada por la validación de los controles de rutina durante el proceso de esterilización debe archivarse para acreditar la garantía de calidad del mismo.
LABORATORIO DE QUÍMICA ANALÍTICA INFORME PRESENTADO A LA PROF. ANGELA SIFONTE
 LABORATORIO DE QUÍMICA ANALÍTICA INFORME PRESENTADO A LA PROF. ANGELA SIFONTE TURBIDIMETRÍA INFORME N 9. PRESENTADO POR LOS BRS.: WILLIAM CHEN CHEN C.I.: 16.113.714 YUSMARY DE ABREU C.I.: 15.914.973 CARACAS,
LABORATORIO DE QUÍMICA ANALÍTICA INFORME PRESENTADO A LA PROF. ANGELA SIFONTE TURBIDIMETRÍA INFORME N 9. PRESENTADO POR LOS BRS.: WILLIAM CHEN CHEN C.I.: 16.113.714 YUSMARY DE ABREU C.I.: 15.914.973 CARACAS,
7. ANALISIS DE RESULTADO. En ente capítulo se incluye un análisis de los resultados promedio obtenidos a partir de los
 7. ANALISIS DE RESULTADO. 7.1 Introducción. En ente capítulo se incluye un análisis de los resultados promedio obtenidos a partir de los ensayos realizados, para lo cual se muestran ciertas gráficas que
7. ANALISIS DE RESULTADO. 7.1 Introducción. En ente capítulo se incluye un análisis de los resultados promedio obtenidos a partir de los ensayos realizados, para lo cual se muestran ciertas gráficas que
CAPÍTULO 1 INTRODUCCIÓN. El Instituto Mexicano del Seguro Social (I.M.S.S.) es un organismo público
 CAPÍTULO 1 INTRODUCCIÓN El Instituto Mexicano del Seguro Social (I.M.S.S.) es un organismo público descentralizado con personalidad y patrimonio propios, de administración tripartita que incluye al Estado,
CAPÍTULO 1 INTRODUCCIÓN El Instituto Mexicano del Seguro Social (I.M.S.S.) es un organismo público descentralizado con personalidad y patrimonio propios, de administración tripartita que incluye al Estado,
Estabilidad de una formulación de zidovudina tabletas 300 mg
 ARTÍCULOS ORIGINALES Estabilidad de una formulación de zidovudina tabletas 300 mg Formula stability of 300 mg Zidovudine tablets Sergio Ibáñez Calvo I ; Caridad Margarita García Peña II ; Rafael León Rodríguez
ARTÍCULOS ORIGINALES Estabilidad de una formulación de zidovudina tabletas 300 mg Formula stability of 300 mg Zidovudine tablets Sergio Ibáñez Calvo I ; Caridad Margarita García Peña II ; Rafael León Rodríguez
FORMULARIO F-BIOF 01:
 INSTITUTO DE SALUD PÚBLICA DE CHILE DEPTO DE CONTROL NACIONAL/SUBDEPTO. DE SEGURIDAD/ SECCION DE BIOFARMACIA FORMULARIO F-BIOF 01: SOLICITUD DE AUTORIZACIÓN DE CENTROS PARA REALIZAR ESTUDIOS DE BIODISPONIBILIDAD/BIOEQUIVALENCIA
INSTITUTO DE SALUD PÚBLICA DE CHILE DEPTO DE CONTROL NACIONAL/SUBDEPTO. DE SEGURIDAD/ SECCION DE BIOFARMACIA FORMULARIO F-BIOF 01: SOLICITUD DE AUTORIZACIÓN DE CENTROS PARA REALIZAR ESTUDIOS DE BIODISPONIBILIDAD/BIOEQUIVALENCIA
PESADO EN LA BALANZA ANALÍTICA
 PESADO EN LA BALANZA ANALÍTICA Cuánto pesar? Pesar Manejo adecuado de la muestra Cálculos Manejar el vocabulario Tomar la canedad a pesar de la técnica o calcularlo uno mismo. Tipo de pesada Balanza verificada
PESADO EN LA BALANZA ANALÍTICA Cuánto pesar? Pesar Manejo adecuado de la muestra Cálculos Manejar el vocabulario Tomar la canedad a pesar de la técnica o calcularlo uno mismo. Tipo de pesada Balanza verificada
Instructivo técnico para el análisis de Humedad en Semillas. Tabla de Contenidos
 INSTRUCTIVO TÉCNICO PARA EL ANÁLISIS DE HUMEDAD EN SEMILLAS Tabla de Contenidos Contenido Página 1 OBJETIVOS Y ALCANCE...2 2 REFERENCIAS Y DOCUMENTOS RELACIONADOS...2 3 DEFINICIONES Y ABREVIATURAS...2
INSTRUCTIVO TÉCNICO PARA EL ANÁLISIS DE HUMEDAD EN SEMILLAS Tabla de Contenidos Contenido Página 1 OBJETIVOS Y ALCANCE...2 2 REFERENCIAS Y DOCUMENTOS RELACIONADOS...2 3 DEFINICIONES Y ABREVIATURAS...2
EQUIPO PORTÁTIL PARA LA DETERMINACIÓN DE CLORO DISPONIBLE EN SOLUCIONES CONCENTRADAS DE HIPOCLORITO
 UNIDAD DE APOYO TÉCNICO PARA EL SANEAMIENTO BÁSICO DEL ÁREA RURAL EQUIPO PORTÁTIL PARA LA DETERMINACIÓN DE CLORO DISPONIBLE EN SOLUCIONES CONCENTRADAS DE HIPOCLORITO Centro Panamericano de Ingeniería Sanitaria
UNIDAD DE APOYO TÉCNICO PARA EL SANEAMIENTO BÁSICO DEL ÁREA RURAL EQUIPO PORTÁTIL PARA LA DETERMINACIÓN DE CLORO DISPONIBLE EN SOLUCIONES CONCENTRADAS DE HIPOCLORITO Centro Panamericano de Ingeniería Sanitaria
PRACTICA No. 9 PREPARACION DE DISOLUCIONES
 1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 9 PREPARACION DE DISOLUCIONES INTRODUCCION:
1 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS QUÍMICAS Y FARMACIA ESCUELA DE QUÍMICA DEPARTAMENTO DE QUÍMICA GENERAL QUÍMICA GENERAL II PRACTICA No. 9 PREPARACION DE DISOLUCIONES INTRODUCCION:
Validación del método analítico para el control de la calidad y estudio de estabilidad de ribavirina inyectable 100 mg/ml
 485 ARTÍCULOS ORIGINALES Validación del método analítico para el control de la calidad y estudio de estabilidad de ribavirina inyectable 100 mg/ml Validation of a analytical method for quality control
485 ARTÍCULOS ORIGINALES Validación del método analítico para el control de la calidad y estudio de estabilidad de ribavirina inyectable 100 mg/ml Validation of a analytical method for quality control
Análisis de Sistemas de Medición MSA. Ing. Victor Reyes - TRAINix ASQ Ambos Nogales
 Análisis de Sistemas de Medición MSA Ing. Victor Reyes - TRAINix ASQ Ambos Nogales Agenda Sistemas de Medición Qué son? Uso de los datos de la medición Calidad de los datos El MSA y las normas de gestión
Análisis de Sistemas de Medición MSA Ing. Victor Reyes - TRAINix ASQ Ambos Nogales Agenda Sistemas de Medición Qué son? Uso de los datos de la medición Calidad de los datos El MSA y las normas de gestión
PAROXETINA STADA 20 mg comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA
 OBJETIVO PAROXETINA STADA 20 mg comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Paroxetina STADA 20 mg comprimidos EFG se ha realizado siguiendo las Directrices
OBJETIVO PAROXETINA STADA 20 mg comprimidos EFG RESUMEN DEL ESTUDIO DE BIOEQUIVALENCIA El Estudio de Bioequivalencia de Paroxetina STADA 20 mg comprimidos EFG se ha realizado siguiendo las Directrices
LABORATORIO ORGÁNICO
 LABORATORIO ORGÁNICO LABORATORIO ORGÁNICO Actualmente es uno de los centros más avanzados de Latinoamérica en el control de la seguridad alimentaria. El Laboratorio de Orgánico está compuesto por una serie
LABORATORIO ORGÁNICO LABORATORIO ORGÁNICO Actualmente es uno de los centros más avanzados de Latinoamérica en el control de la seguridad alimentaria. El Laboratorio de Orgánico está compuesto por una serie
Servicios de salud en la Cruz Roja Mexicana, Delegación Xalapa, Ver.
 Servicios de salud en la Cruz Roja Mexicana, Delegación Xalapa, Ver. Beatriz Meneses Aguirre RESUMEN En este documento se presenta información acerca del número de servicios que se han dado en el consultorio
Servicios de salud en la Cruz Roja Mexicana, Delegación Xalapa, Ver. Beatriz Meneses Aguirre RESUMEN En este documento se presenta información acerca del número de servicios que se han dado en el consultorio
VICH Cooperación Internacional para la Armonización de los Requisitos Técnicos relativos al Registro de Medicamentos Veterinarios
 VICH Cooperación Internacional para la Armonización de los Requisitos Técnicos relativos al Registro de Medicamentos Veterinarios DIRECTRIZ 3R DE LA VICH (CALIDAD) Enero de 2007 Revisión en el Paso 9 Para
VICH Cooperación Internacional para la Armonización de los Requisitos Técnicos relativos al Registro de Medicamentos Veterinarios DIRECTRIZ 3R DE LA VICH (CALIDAD) Enero de 2007 Revisión en el Paso 9 Para
Sistema de gestión de laboratorios IIQ- FI- UdelaR 2009
 Sistema de gestión de laboratorios IIQ- FI- UdelaR 2009 SGL- 2009 Introducción 1 Introducción SGL- 2009 Introducción 2 Objetivos del Curso a) Capacitar para la implementación de un sistema de gestión en
Sistema de gestión de laboratorios IIQ- FI- UdelaR 2009 SGL- 2009 Introducción 1 Introducción SGL- 2009 Introducción 2 Objetivos del Curso a) Capacitar para la implementación de un sistema de gestión en
N 20740-MEIC EL PRESIDENTE D ELA REPUBLICA Y EL MINISTRO DE ECONOMIA, INDUSTRIA Y COMERCIO
 N 20740-MEIC EL PRESIDENTE D ELA REPUBLICA Y EL MINISTRO DE ECONOMIA, INDUSTRIA Y COMERCIO En uso En uso de las potestades que les confiere el artículo 140, incisos 3) y 18) de la Constitución Política
N 20740-MEIC EL PRESIDENTE D ELA REPUBLICA Y EL MINISTRO DE ECONOMIA, INDUSTRIA Y COMERCIO En uso En uso de las potestades que les confiere el artículo 140, incisos 3) y 18) de la Constitución Política
Dr. José Vicente García Pérez. Resumen
 Estudio de la Aplicación de Ultrasonidos de Alta Intensidad en Sistemas Sólido-Líquido y Sólido-Gas. Influencia en la Cinética de Transporte de Materia y en la Estructura de los Productos Autor César Ozuna
Estudio de la Aplicación de Ultrasonidos de Alta Intensidad en Sistemas Sólido-Líquido y Sólido-Gas. Influencia en la Cinética de Transporte de Materia y en la Estructura de los Productos Autor César Ozuna
Modelo matemático de las autoclaves industriales
 AUTOMÁTICA Y ELECTRÓNICA Ingeniería Electrónica, Automática y Comunicaciones, Vol. XXIII, No. 2, 2002 Modelo matemático de las autoclaves industriales J. E. González y R. Misa Empresa Laboratorio Farmacéutico
AUTOMÁTICA Y ELECTRÓNICA Ingeniería Electrónica, Automática y Comunicaciones, Vol. XXIII, No. 2, 2002 Modelo matemático de las autoclaves industriales J. E. González y R. Misa Empresa Laboratorio Farmacéutico
GUÍA PARA SISTEMAS DE RASTREABILIDAD
 REQUISITOS GENERALES Y RECOMENDACIONES PARA IMPLEMENTAR RASTREABILIDAD DE ALIMENTOS AGROPECUARIOS PRIMARIOS Y PIENSOS 1 CAMPO DE APLICACIÓN Esta guía específica los requisitos mínimos que debe cumplir
REQUISITOS GENERALES Y RECOMENDACIONES PARA IMPLEMENTAR RASTREABILIDAD DE ALIMENTOS AGROPECUARIOS PRIMARIOS Y PIENSOS 1 CAMPO DE APLICACIÓN Esta guía específica los requisitos mínimos que debe cumplir
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503. GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN
 LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
LABORATORIO DE QUÍMICA ANALÍTICA E INSTRUMENTAL 502503 GUÍA No 2.3- METODOS DE SEPARACIÓN POR DESTILACIÓN I. EL PROBLEMA Dos líquidos completamente miscibles se pueden separar por métodos físicos llamados
CARDIOCHEK y CARDIOCHEK P.A
 CARDIOCHEK y CARDIOCHEK P.A NUEVA GENERACIÓN DE ANALIZADORES PORTÁTILES Introducción El Cardiochek y Cardiochek P.A son instrumentos portátiles que proporcionan medidas rápidas y precisas de múltiples
CARDIOCHEK y CARDIOCHEK P.A NUEVA GENERACIÓN DE ANALIZADORES PORTÁTILES Introducción El Cardiochek y Cardiochek P.A son instrumentos portátiles que proporcionan medidas rápidas y precisas de múltiples
CFS-GSEC-P-10-F-01. Criterios para la Verificación Metrológica de Balanzas
 Criterios para la Verificación Metrológica de Balanzas Junio 4 de 2015 Olivia León Becerril Carlos Dehmer Mariel Químico Analista Comisión de Control Analítico y Ampliación de Cobertura Propósito Describir
Criterios para la Verificación Metrológica de Balanzas Junio 4 de 2015 Olivia León Becerril Carlos Dehmer Mariel Químico Analista Comisión de Control Analítico y Ampliación de Cobertura Propósito Describir
Estabilidad del colirio de pilocarpina 2 %
 ARTÍCULOS ORIGINALES Estabilidad del colirio de pilocarpina 2 % Stability of 2 % Pilocarpine eyedrops Martha Botet García I ; Caridad Margarita García Peña II ; Vivian Martínez Espinosa III ; Bárbara Moreno
ARTÍCULOS ORIGINALES Estabilidad del colirio de pilocarpina 2 % Stability of 2 % Pilocarpine eyedrops Martha Botet García I ; Caridad Margarita García Peña II ; Vivian Martínez Espinosa III ; Bárbara Moreno
MEMORIA JUSTIFICATIVA
 AYUDAS DE LA UNIVERSIDAD DE SALAMANCA PARA LA INNOVACIÓN DOCENTE MEMORIA JUSTIFICATIVA TÍTULO DEL PROYECTO: INNOVACIÓN DOCENTE EN EL LABORATORIO QUÍMICO PARA ESTUDIANTES UNIVERSITARIOS INTERDISCIPLINARES.
AYUDAS DE LA UNIVERSIDAD DE SALAMANCA PARA LA INNOVACIÓN DOCENTE MEMORIA JUSTIFICATIVA TÍTULO DEL PROYECTO: INNOVACIÓN DOCENTE EN EL LABORATORIO QUÍMICO PARA ESTUDIANTES UNIVERSITARIOS INTERDISCIPLINARES.
TÉCNICO SUPERIOR UNIVERSITARIO EN PROCESOS INDUSTRIALES
 Pág. 1 de 16 TÉCNICO SUPERIOR UNIVERSITARIO EN PROCESOS INDUSTRIALES HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS 1. Nombre de la asignatura Control estadístico del proceso 2. Competencias Administrar
Pág. 1 de 16 TÉCNICO SUPERIOR UNIVERSITARIO EN PROCESOS INDUSTRIALES HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS 1. Nombre de la asignatura Control estadístico del proceso 2. Competencias Administrar
TÉCNICO SUPERIOR UNIVERSITARIO EN PROCESOS ALIMENTARIOS
 TÉCNICO SUPERIOR UNIVERSITARIO EN PROCESOS ALIMENTARIOS HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS 1. Nombre de la asignatura Estadística para el control de procesos 2. Competencias a la que
TÉCNICO SUPERIOR UNIVERSITARIO EN PROCESOS ALIMENTARIOS HOJA DE ASIGNATURA CON DESGLOSE DE UNIDADES TEMÁTICAS 1. Nombre de la asignatura Estadística para el control de procesos 2. Competencias a la que
4. Materiales y Métodos. Los equipos que a continuación se mencionan se encuentran en el laboratorio de
 39 4. Materiales y Métodos 4.1 Equipos Los equipos que a continuación se mencionan se encuentran en el laboratorio de Ingeniería Ambiental de la Universidad de las Américas Puebla y en el Laboratorio de
39 4. Materiales y Métodos 4.1 Equipos Los equipos que a continuación se mencionan se encuentran en el laboratorio de Ingeniería Ambiental de la Universidad de las Américas Puebla y en el Laboratorio de
GUIA ASISTENCIAL FECHAS DE VENCIMIENTO EN MEDICAMENTOS GPMASSF001-1 V5
 FECHAS DE VENCIMIENTO EN MEDICAMENTOS GPMASSF001-1 V5 BOGOTA, D.C. - 2014 Página 2 de 12 TABLA DE CONTENIDO 1 OBJETIVO... 3 2 ALCANCE... 3 3 DEFINICIONES Y SIGLAS... 4 3.1 TECNICO AUXILIAR DE FARMACIA
FECHAS DE VENCIMIENTO EN MEDICAMENTOS GPMASSF001-1 V5 BOGOTA, D.C. - 2014 Página 2 de 12 TABLA DE CONTENIDO 1 OBJETIVO... 3 2 ALCANCE... 3 3 DEFINICIONES Y SIGLAS... 4 3.1 TECNICO AUXILIAR DE FARMACIA
Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración
 Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración Fernández Pareja, Mª Teresa te_fer@topografia.upm.es Departamento de Ingeniería Topográfica y Cartografía
Evaluación de la capacidad óptima de medida y alcance de la acreditación de un laboratorio de calibración Fernández Pareja, Mª Teresa te_fer@topografia.upm.es Departamento de Ingeniería Topográfica y Cartografía
INCERTIDUMBRE Y PRECISIÓN
 INCERTIDUMBRE Y PRECISIÓN Alicia Maroto, Ricard Boqué, Jordi Riu, F. Xavier Rius Departamento de Química Analítica y Química Orgánica Instituto de Estudios Avanzados Universitat Rovira i Virgili. Pl. Imperial
INCERTIDUMBRE Y PRECISIÓN Alicia Maroto, Ricard Boqué, Jordi Riu, F. Xavier Rius Departamento de Química Analítica y Química Orgánica Instituto de Estudios Avanzados Universitat Rovira i Virgili. Pl. Imperial
