INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ALIMTA ( PEMETREXED ) (03/03/2008)
|
|
|
- Gregorio Montero Figueroa
- hace 8 años
- Vistas:
Transcripción
1 Centro de Información de Medicamentos Servicio de Farmacia INFORME A LA COMISIÓN DE FARMACIA Y TERAPÉUTICA ALIMTA ( PEMETREXED ) (03/03/2008) DATOS DEL SOLICITANTE Dr. José Lorenzo Gómez-Aldaravi Gutiérrez del Servicio de Oncología Médica solicita la inclusión del fármaco ALIMTA para las siguientes indicaciones: - Mesotelioma pleural maligno no resecable, en pacientes que no hayan recibido quimioterapia previamente. - Cáncer de pulmón no microcítico localmente avanzado o metastático, en pacientes que hayan sido tratados previamente con quimioterapia. DATOS DEL MEDICAMENTO DCI: PEMETREXED Grupo terapéutico: L01BA : Antimetabolitos: Análogos del Ácido Fólico. Forma farmacéutica: Polvo para concentrado para solución para perfusión. Polvo liofilizado blanco a amarillo pálido o amarillo verdoso. Composición por unidad: - Pemetrexed, di sódico (sal) 500 MG. - Manitol, ácido clorhídrico, hidróxido de sodio (excipientes). Presentación comercial: Código Nacional Nombre comercial Dosificación Laboratorio PVL + 4% IVA ALIMTA 500 MG/ vial LILLY S.A FARMACOLOGÍA Acción farmacológica: Pemetrexed es un antineoplásico perteneciente al grupo de antimetabolitos del ácido fólico que ejerce su acción mediante la interrupción de los procesos metabólicos esenciales dependientes del folato, necesarios para la replicación celular. Ello es debido a que inhibe múltiples enzimas como la timidilato sintetasa (TS), la dihidrofolato reductasa (DHFR) y la glicinamida ribonucleótido formiltransferasa (GARFT), que son enzimas dependientes de folato, claves para la biosíntesis de novo de los nucleótidos de timidita y purina. Pemetrexed se transporta al interior de las células tanto mediante el transportador de folato reducido como mediante sistemas transportadores de membrana proteicos unidos al folato. Una vez en la célula, Pemetrexed se convierte en formas poliglutamato mediante una enzima llamada folilpoliglutamato sintetasa de modo más rápido y eficaz en las células malignas. Las formas poliglutamato se retienen en las células y son inhibidores incluso más potentes de la TS y la GARFT. La poliglutamación es un proceso dependiente de tiempo y de la CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 1
2 concentración que ocurre en las células tumorales y, en menor medida, en tejidos normales. Los metabolitos poliglutamados poseen una semivida intracelular más larga que se traduce en una acción del fármaco prolongada en las células malignas. (1) Destacar que la farmacocinética del Pemetrexed no se ve influenciada por la administración concomitante de Cisplatino, Ácido Fólico (AF) por vía oral y Vitamina B12 (VB12) por vía intramuscular. Indicaciones clínicas: (4), (5), (6), (7)! MESOTELIOMA PLEURAL: en combinación con Cisplatino, está indicado para el tratamiento de pacientes con mesotelioma pleural maligno (MPM) no resecable que no hayan recibido quimioterapia previamente.! CÁNCER DE PULMÓN: en monoterapia, está indicado para el tratamiento de pacientes con cáncer de pulmón no microcítico (CPNM) localmente avanzado o metastásico que hayan sido tratados previamente con quimioterapia. Farmacocinética : Distribución Pemetrexed tiene un volumen de distribución de 9 l/m2. Estudios in vitro indican que Pemetrexed es transportado por las proteínas plasmáticas en aproximadamente un 81%, con lo que no se ve afectado de manera notable por los diferentes grados de disfunción renal. Metabolismo Pemetrexed sufre escaso metabolismo hepático. Forma de administración y preparación: Pemetrexed es sólo de uso hospitalario. Se debe administrar en una unidad de hospitalización donde existan instalaciones de monitorización y experiencia con el uso de agentes citotóxicos. Se bebe reconstituir cada vial de 500 mg con 20 ml de solución de cloruro sódico para inyección al 0,9%, sin conservantes, obteniendo una solución que contiene una concentración de 25 mg/ml de pemetrexed. Agitar cuidadosamente el vial hasta que el polvo esté completamente disuelto. La solución resultante es clara con un rango de color que puede variar desde incoloro a amarillo a amarillo-verdoso sin que esto afecte de forma negativa a la calidad del producto. El ph de la solución reconstituida está entre 6,6 y 7,8. Se debe diluir posteriormente hasta un volumen de 100 ml con solución para inyección de cloruro sódico al 0,9% sin conservantes, y administrar en perfusión intravenosa durante 10 minutos. La solución para perfusión es compatible con los sistemas y bolsas de infusión de cloruro de polivinilo y poliolefina. Precauciones en la preparación y administración: Excreción Pemetrexed es principalmente eliminado por Se recomienda el uso de guantes para su manejo. Si las soluciones de Pemetrexed entran en vía urinaria; entre un 70-90% de la dosis administrada contacto con la piel, se debe lavar la piel se recupera inalterada en orina en las primeras 24 horas tras su administración. El aclaramiento sistémico total de Pemetrexed es de 91,8 ml/min y la vida media de eliminación del plasma es de 3,5 horas en pacientes inmediatamente y con abundante con agua y jabón. Si las soluciones de Pemetrexed entran en contacto con mucosas lavar con agua abundante. No es un fármaco vesicante. con función renal normal ( aclaramiento de creatinina No existe un antídoto específico para las de 90 ml/min). La variabilidad del aclaramiento entre pacientes es moderada (19,3%). El área bajo la curva (AUC) y la concentración máxima en plasma, aumentan proporcionalmente con extravasaciones de Pemetrexed, las cuales no fueron valoradas como graves por el investigador. La extravasación debe ser tratada según la práctica clínica habitual con otros fármacos no vesicantes. la dosis. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 2
3 Posología:! MESOTELIOMA PLEURAL MALIGNO: 500 mg/m2 del área superficie corporal (ASC) administrados por perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días. La dosis recomendada de Cisplatino es de 75 mg/m2 (ASC) administrados en perfusión durante 2 horas, aproximadamente 30 minutos después de completar la perfusión de Pemetrexed durante el primer día de cada ciclo. Los pacientes deben recibir un tratamiento antiemético adecuado e hidratación apropiada antes de recibir Cisplatino, después o en ambas situaciones.! CÁNCER DE PULMÓN NO MICROCÍTICO: 500 mg/m2 (ASC) administrados como perfusión intravenosa durante 10 minutos el primer día de cada ciclo de 21 días. hematológica del ciclo anterior. De modo que el tratamiento debe retrasarse el tiempo que permita la recuperación suficiente. Después de la recuperación de la toxicidad los pacientes pueden volver a tratarse empleando las pautas de ajuste de dosis según ciertas situaciones, aplicables para Pemetrexed empleado como agente único o en combinación con Cisplatino: 1. Toxicidades hematológicas: modificación de la dosis de Pemetrexed como agente único o en combinación con Cisplatino: (Tabla 1) ANC< Ó = 500 cel/mm3 y nadir de plaquetas > 75% de la dosis previa de ó = cel/mm3 Pemetrexed y de Cisplatino Nadir de plaquetas < ó = cel/mm3 50% de la dosis previa de (independiente del ANC) Pemetrexed y de Cisplatino TABLA 1. Modificación dosis Pemetrexed y Cisplatino según toxicidades hematológicas. Monitorización Antes de cada dosis se debe realizar un recuento sanguíneo completo que incluya un recuento diferencial de células blancas (WCC) y un recuento de plaquetas. Antes de cada administración de quimioterapia se deben realizar pruebas bioquímicas sanguíneas para evaluar la función renal y hepática. Antes del comienzo de cada ciclo de quimioterapia, es necesario que el paciente presente: - recuento absoluto de neutrófilos (ANC) > ó = cel/mm3. - plaquetas > ó = cel/mm3. - Aclaramiento de creatinina > ó = 45 ml/min. - Bilirrubina total < ó = 1,5 veces el límite superior de la normalidad. - Fosfatasa alcalina (FA), aspartato transaminasa (AST o SGOT), alanina transaminasa (ALT o SGPT) < ó = 3 veces el límite superior de la normalidad. (Se aceptan valores de FA, AST Y ALT < ó = 5 veces el límite superior de la normalidad si existe afectación tumoral hepática). Ajuste de dosis 2. Toxicidades no hematológicas de grado 3-4 (excluyendo neurotoxicidad): se debe retrasar la administración hasta que la toxicidad se haya recuperado hasta un valor menor o igual al que el paciente presentaba antes del tratamiento. Los ajustes de dosis por toxicidad no hematológica (según los Criterios Comunes de Toxicidad del Instituto Nacional del Cancer-CTC) se resumen en la Tabla 2: DOSIS PEMETREXED (mg/m2) DOSIS CISPLATINO (mg/m2) Cualquier toxicidad grado 3 ó 4 75% de la dosis 75% de la dosis (excepto mucositis) previa previa Cualquier diarrea que requiera 75% de la dosis 75% de la dosis hospitalización (independiente del previa previa grado) o diarrea grado 3 ó 4 Mucositis grado 3 ó 4 50% de la dosis 100% de la dosis previa previa TABLA 2. Modificación dosis Pemetrexed y Cisplatino según toxicidades no hematológicas. 3. Neurotoxicidad: Los pacientes que presenten una neurotoxicidad de grado 3 ó 4, deben interrumpir el tratamiento. Si aparece neurotoxicidad de menor grado, el ajuste de dosis se resume en la Tabla 3: GRADO CTC DOSIS PEMETREXED (mg/m2) DOSIS CISPLATINO (mg/m2) Grado % de la dosis previa 100% de la dosis previa Grado 2 100% de la dosis previa 50% de la dosis previa Los ajustes de la dosis al comienzo de un nuevo ciclo deben basarse en el nadir de los recuentos hematológicos o en la máxima toxicidad no TABLA 3. Modificación dosis Pemetrexed y Cisplatino según neurotoxicidad. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 3
4 Destacar que el tratamiento con Pemetrexed debe suspenderse si el paciente presenta cualquier toxicidad hematológica o no hematológica grado 3 ó 4 tras dos reducciones de dosis, o inmediatamente si se observa neurotoxicidad grado 3 ó 4. Premedicación Para reducir la incidencia y gravedad de las reacciones cutáneas, se debe administrar un corticosteroide equivalente a 4 mg de Dexametasona (oral dos veces al día) el día anterior, el mismo día y el día de después de la administración de Pemetrexed. Posología en el anciano No se ha demostrado en ningún ensayo clínico en que los pacientes de 65 años de edad o mayores, posean un riesgo mayor de presentar efectos adversos Los pacientes tratados con Pemetrexed, deben recibir también un suplemento vitamínico: 1. ÁCIDO FÓLICO: tomar diariamente AF por vía oral o en un complejo poli vitamínico que que los pacientes menores de 65 años. Por lo que no contenga AF ( mcg). Deben son necesarios otros ajustes de dosis aparte de los recomendados para todos los pacientes. tomarse por lo menos cinco dosis de ácido fólico durante los 7 días previos a la primera dosis de Pemetrexed, y la dosis debe Posología en niños y adolescentes continuar durante todo el tratamiento hasta 21 días después de la última dosis de No se recomienda el uso de Pemetrexed a Pemetrexed. pacientes menores de 18 años, debido a que no se ha establecido la seguridad y la eficacia. 2. VITAMINA B12: Se debe administrar una inyección intramuscular de mcg de VB12 en la semana anterior a la primera Posología en insuficiencia renal dosis de Pemetrexed y a partir de ahí, una El Pemetrexed se elimina inalterado vez cada 3 ciclos. Tras la primera inyección principalmente por excreción renal. En estudios de VB12, las inyecciones posteriores se clínicos, los pacientes con un aclaramiento de pueden administrar el mismo día que la creatinina > ó = 45 ml/min (según la Fórmula perfusión de Pemetrexed. estandarizada de Cockroft y Gault), no requirieron ajustes de dosis diferentes de los recomendados para Interacciones: todos los pacientes. No existen suficientes datos sobre! MEDICAMENTOS NEFROTÓXICOS: El el uso de Pemetrexed en pacientes con aclaramiento de creatinina <45 ml/min, por lo tanto no se recomienda Pemetrexed se elimina inalterado, por vía renal principalmente mediante secreción tubular y, en menor el uso de Pemetrexed en estos pacientes. medida mediante filtración glomerular. La administración concomitante de fármacos nefrotóxicos Posología en insuficiencia hepática (p. ej. los amino glucósidos, diuréticos del asa, No se ha identificado ninguna relación entre la derivados del platino, ciclosporinas) podrían, farmacocinética de Pemetrexed y la AST, la ALAT o la bilirrubina total. Sin embargo, no se han estudiado específicamente pacientes con disfunción hepática tales como bilirrubina > 1,5 veces el límite superior de la normalidad, transaminasas > 3,0 veces el límite superior de la normalidad o ambas en ausencia de metástasis hepáticas, ó transaminasas> 5,0 veces el límite superior de la normalidad en presencia de metástasis hepáticas. potencialmente, producir un retraso en el aclaramiento de Pemetrexed. Esta combinación debe usarse con precaución. Si fuera necesario utilizar alguno de estos fármacos, el aclaramiento de creatinina debe vigilarse estrechamente.! PENICILINAS, PROBENECID: La administración concomitante de sustancias que también se eliminan por secreción tubular (p. ej. probenecid, penicilinas) pueden, potencialmente, resultar en un retraso en el aclaramiento de Pemetrexed. Se debe tener precaución cuando se administren estos fármacos en combinación con Pemetrexed. Si fuera necesario administrarlos, se CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 4
5 debe vigilar estrechamente el aclaramiento de elevada variabilidad intraindividual del estado de la creatinina.! ANTIINFLAMATORIOS NO ESTEROIDEOS: En pacientes con la función renal normal (aclaramiento de creatinina 90 ml/min), la administración de altas dosis de fármacos antiinflamatorios no esteroideos (AINEs, como ibuprofeno > mg/día) y ácido acetilsalicílico coagulación durante las enfermedades y la posibilidad de interacción entre los anticoagulantes orales y la quimioterapia antineoplásica requiere un aumento de la frecuencia de control del INR (Cociente Normalizado Internacional), si se decide tratar al paciente con anticoagulantes orales. a dosis elevadas ( 1,3g diarios) pueden disminuir la eliminación de Pemetrexed y, en consecuencia Contraindicaciones : aumentar la aparición de sus efectos adversos. Por a) Hipersensibilidad al Pemetrexed o a alguno tanto, debe tenerse precaución durante la de sus componentes. administración concomitante de altas dosis de AINEs o ácido acetilsalicílico con Pemetrexed en pacientes con la función renal normal. En pacientes con insuficiencia renal leve a moderada (aclaramiento de creatinina de 45 a 89 ml/min), debe b) Lactancia: No se sabe si el Pemetrexed se excreta en la leche materna y no se puede excluir la posibilidad de aparición de efectos adversos en el lactante. Por ello, durante el evitarse la administración concomitante de Pemetrexed tratamiento de Pemetrexed se debe con AINEs (p. ej. ibuprofeno) o ácido acetilsalicílico a interrumpir la lactancia materna. dosis elevadas durante 2 días antes, el mismo día y dos días después de la administración de Pemetrexed. c) Administración concomitante de la vacuna de la fiebre amarilla. En ausencia de datos relativos a la posible interacción con AINEs de semividas más largas como piroxicam o Reacciones adversas : rofecoxib, debe evitarse la administración concomitante 1. DEPRESIÓN MEDULAR: Pemetrexed puede con Pemetrexed durante al menos los cinco días suprimir la función de la médula ósea lo que se anteriores, el mismo día y dos días después de su manifiesta como neutropenia, trombocitopenica y administración. anemia. La mielosupresión es, normalmente la! VACUNA DE LA FIEBRE AMARILLA: Riesgo de toxicidad limitante de la dosis. padecer la enfermedad generalizada. Contraindicado. 2. ERUPCIONES EXANTEMÁTICAS: Se han! VACUNAS CON MICROORGANISMOS VIVOS comunicado reacciones cutáneas en pacientes que no ATENUADOS: Uso concomitante no recomendado han recibido un tratamiento previo con un porque existe la posibilidad de padecer la enfermedad sistémica, posiblemente fatal. El riesgo aumenta en pacientes que ya están immunodeprimidos por la enfermedad que sufren. Si existe, se debe emplear una vacuna con microorganismos inactivados (poliomelitis).! INHIBICIÓN METABÓLICA: El Pemetrexed sufre un metabolismo hepático limitado. Los resultados de los estudios in vitro con microsomas de hígado humano corticosteroide, el cual puede reducir la incidencia y la gravedad de las reacciones cutáneas. 3. DERRAME PLEURAL, ASCITIS: Se desconoce el efecto de la presencia de líquido en tercer espacio, tal como derrame pleural o ascitis, en el tratamiento con Pemetrexed. En pacientes con líquido en tercer espacio en cantidad clínicamente significativa, se debe drenar el derrame antes de la administración de Pemetrexed. indicaron que no es previsible que Pemetrexed 4. DESHIDRATACIÓN: Se ha observado produzca una inhibición clínicamente significativa del deshidratación severa a causa de la toxicidad aclaramiento metabólico de los fármacos gastrointestinal asociada al tratamiento con metabolizados a través de los citocromos CYP3A, CYP2D6, CYP2C9 y CYP1A2.! INTERACCIONES COMUNES A TODOS LOS CITOSTÁTICOS: Debido al aumento del riesgo de padecer trombosis, en pacientes con cáncer, es Pemetrexed en combinación con Cisplatino. 5. CARDIOPATÍA: Se han comunicado con poca frecuencia acontecimientos cardiovasculares graves, incluyendo infarto de miocardio, y acontecimientos cerebrovasculares, normalmente cuando se administra frecuente el empleo de tratamiento anticoagulante. La CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 5
6 en combinación con otro agente citotóxico. La mayoría de los pacientes en los que se ha observado estos efectos, tenían factores de riesgo previos. EVALUACIÓN DE LA EFICACIA La eficacia y seguridad de Pemetrexed para el tratamiento del MPM en combinación con el Cisplatino, y el tratamiento del CPNM en monoterapia han sido evaluados en dos ensayos clínicos controlados: 1. MESOTELIOMA PLEURAL MALIGNO : pacientes con Pemetrexed se les dio suplemento vitamínico. Los pacientes del brazo A recibieron más ciclos de tratamiento (media = 6; rango = 1-12) que los pacientes del brazo B (media = 4; rango =1-9), de manera similar, los pacientes que llevaron suplemento vitamínico recibieron más ciclos que los que no se les había administrado AF y VB12. La media de seguimiento fue de 10 meses. (Randomized Phase III Study of Pemetrexed in Combination with Cislatin Versus Cisplatin Alone in patients with Malignant Pleural Mesothelioma) Dicho estudio ha demostrado que los pacientes tratados con P/C poseen un aumento clínicamente (2) El pivotal estudio fase III EMPHACIS, significativo de la mediana de supervivencia de 2.8 multicéntrico, aleatorizado y de simple ciego meses (12.1 meses vs 9.3 meses; p < 0.05) sobre los evalúa la supervivencia y la toxicidad del pacientes que recibieron C en monoterapia. El Harzard ratio para la curva de supervivencia de pacientes tratamiento de Pemetrexed en combinación con tratados con P/C vs C fue Así pues la mediana Cisplatino (P/C) frente a Cisplatino (C) en del tiempo de progresión de la enfermedad fue monoterapia para el tratamiento de MPM no tratados previamente con quimioterapia. Las dosis prescritas en el protocolo fueron 500 mg/m2 de Pemetrexed y Cisplatino 75 mg/m2 (brazo A) significativamente mayor para el brazo A (5.7 meses vs 3.9 meses, p < ). Todas las respuestas fueron parciales: 41.3% de pacientes tratados con P/C vs 16.7 del grupo control. Con la administración conjunta de AF o Cisplatino 75 mg/m2 (brazo B), ambos y VB12 al brazo de P/C resultó estadísticamente administrados por vía intravenosa el primer día significativo la reducción de la toxicidad del del ciclo cada 21 días. Tras la selección de Pemetrexed. (Tabla 4) pacientes ajustados por los criterios de inclusión y exclusión, fueron randomizados 456 pacientes, 226 recibieron P/C y 222 recibieron C en monoterapia; de todos ellos se evaluó la eficacia y la toxicidad con intención de tratar (ITT). El Usando la Escala de Síntomas del Cáncer de Pulmón se demostró una mejoría estadísticamente significativa de los síntomas relevantes (dolor y disnea) asociados al MPM, en la rama de P/C (212 pacientes) resto de pacientes (n =8), nunca llegaron a recibir frente a la rama de C en monoterapia (218 pacientes). el tratamiento por distintas causas. Se realizó un También se demostraron diferencias estadísticamente análisis por subgrupos que valoraba la reducción significativas en los test de función pulmonar. (5) de la toxicidad de Pemetrexed al añadir AF y VB12, pero tras comprobarse un aumento de la mortalidad en el grupo que no llevaba suplemento vitamínico, se modificó el protocolo y a partir de la fecha (2 de diciembre de 1999) todos los CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 6
7 VARIABLES DE EFICAIA PEMETREXED/CISPLATINO (n = 226) CISPLATINO (n=222) Tiempo de supervivencia Mediana (meses) % IC Hazard ratio 0.77 P* 0.02 Tiempo de progresión de Mediana (meses) la enfermedad 95% IC Hazard ratio 0.68 tratamiento hasta 3 semanas después de finalizar con la última dosis de Pemetrexed) y VB12 intramuscular (1000 mcg, 1 2 semanas antes de iniciar el tratamiento y seguir hasta 9 semanas después de acabar con el tratamiento), todo ello para reducir la toxicidad. Los pacientes de ambos brazos, recibieron Dexametasona oral 4 8 mg dos veces al día, un día antes, el mismo día y un día después de la administración del tratamiento. P* Tasa de respuesta global Rango de respuesta (%) 95% IC P* <0.001 Tiempo hasta fracaso de Media (meses) tratamiento 95% IC P* TABLA 4 : Resultados de los parámetros del análisis de eficacia del tratamiento de MPM de Pemetrexed/Cisplatino vs Cisplatino con ITT. 2. CÁNCER DE PULMÓN NO MICROCÍTICO : (Randomized Phase III Trial of Pemetrexed Versus Docetaxel In Patiens with Non-Small-Cell Luna Cancer Previosly Treated with Qhemotherapy) (3) Ensayo multicéntrico de fase III, abierto, aleatorizado para el tratamiento del CPNM avanzado donde se compara la seguridad y la toxicidad del Pemetrexed frente al Docetaxel en pacientes que previamente habían recibido tratamiento.(cpnm P vs D). Se eligieron pacientes que a priori habían recibido tratamiento (n = 571), Al brazo A se le administró Pemetrexed intravenoso 500 mg/m2 (n = 265) y al brazo B Docetaxel intravenosos 75 mg/m2 (n = 276), el primer día de cada ciclo de 21 días (media de número de ciclos administrados fue 4) (4). Antes de administrar el tratamiento se perdieron 30 pacientes, 18 del brazo A y 12 del brazo B. Los pacientes asignados al brazo de Pemetrexed recibieron también un suplemento vitamínico de AF oral ( mcg, 1 2 semanas antes del inicio de tratamiento, y seguir con el Éste ensayo refiere que no hay diferencias estadísticamente significativas en la supervivencia libre de progresión (9.1% y 8.8%, p=0.105) y de la tasa de enfermedad estable (45.8% vs 46.4%) con el tratamiento con Pemetrexed respecto al Docetaxel. En ITT, la mediana del tiempo de supervivencia para el Pemetrexed fue de 8.3 meses frente a 7.9 meses para el Docetaxel, siendo confirmado en un estudio de no inferioridad realizado con resultados no estadísticamente significativos (p = 0.226). El tiempo de supervivencia global al año de finalizar el tratamiento fue 29.7% para ambas ramas del ensayo. (Tabla 5) VARIABLE PREMETREXED DOCETAXEL 95% IC P* (n = 283) ( n = 288) Superviviencia libre de progresión Tiempo de Progresión Tiempo hasta fracaso de tratamiento Duración de la respuesta Duración del beneficio clínico Tiempo de respuesta NE TABLA 5 : Variables de respuesta de IITT en CPNM en tratamiento de Pemetrexed vs Docetaxel (meses) ( NE : No evaluado) CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 7
8 EVALUACIÓN DE LA SEGURIDAD 1. MESOTELIOMA PLEURAL MALIGNO: (2) Según el ensayo clínico randomizado fase III en el que se evalúa la toxicidad de P/C vs C para el tratamiento de MPM, en el brazo control, la toxicidad severa es infrecuente. En el brazo del P/C, la neutropenia grado 3-4 (27.9%) y la leucopenia grado 3-4 (17.7%) fueron las toxicidades hematológicas más frecuentes. La toxicidad no hematológica de laboratorio, también fue infrecuente, con 5 episodios de disminución del aclaramiento de creatinina y 3 episodios de hiponatremia en todos los pacientes tratados con P/C. En ambas ramas del estudio, las nauseas, vómitos y la fatiga fueron las toxicidades más comunes, con >88% de efectos adversos grado 3. La incidencia de náuseas, vómitos, fatiga, diarrea, deshidratación y estomatitis fue superior estadísticamente significativa, en el brazo del P/C. Finalmente, 14 pacientes que recibían P/C murieron durante el tratamiento o en los 30 días posteriores de la última dosisl, frente a los 8 pacientes que murieron en el brazo de C en monoterapia (6.2% VS 3.6%).(Tabla 6) VARIABLES PEMETREXED/ CISPLATINO P* TOXICIDAD CISPLATINO (N = 226) (%) (N = 222) (%) Toxicidad Hemoglobina hematológica Leucocitos <0.001 Neutrofilos <0.001 Plaquetas < CÁNCER DE PULMÓN NO MICROCÍTICO:( 3) En el estudio de fase III donde se comparó el tratamiento de CPNM avanzado con Pemetrexed vs Docetaxel como tratamiento de segunda línea, se evaluó la toxicidad de los 541 pacientes que fueron tratados. Las muertes debidas al tratamiento fueron atribuidas al Docetaxel y al Pemetrexed en 5 y 3 pacientes, respectivamente. Los pacientes que recibieron Docetaxel experimentaron estadísticamente significativo, elevadas tasas de neutropenia, neutropenia febril, infecciones y hospitalizaciones debido a los efectos de la neutropenia, en comparación con los pacientes tratados con Pemetrexed. Así pues, el uso de factores estimulantes de colonias ( G-CSFs) durante el tratamiento por pacientes, fue substancialmente superior en la rama del Docetaxel (n=49 en Docetaxel; n=5 en Pemetrexed). Mientras que no hubieron diferencias estadísticamente significativas en neutropenia con infección, anemia y trombocitopenia. (Tabla 7) (Tabla 8) Destacar que la única toxicidad no hematológica estadísticamente significativa fue la alopecia, la cual mostró una elevada incidencia en los pacientes tratados con Docetaxel, así como el aumento de la tasa de ALAT que mostraron los pacientes de Pemetrexed. Toxicidad no Náusea hematológica Fatiga VARIABLES TOXICIDAD % PEMETREXED (n=265) % DOCETAXEL (n=276) P* Vómitos Diarrea Neutropenia <0.001 Neutropenia febril <0.001 Deshidratación Neutropenia con Estomatitis infección Anorexia Anemia Neutropenia febril Infección con grado 3-4 de neutropenia Trombocitopenia TABLA 7: Toxicidad Hematológica grado 3-4, en el tratamiento de CPNM con Pemetrexed vs Docetaxel Rash TABLA 6: Toxicidad más frecuente de grado 3-4 en ITT para el MPM del P/C vs C. CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 8
9 % PEMETREXED (n=265) % DOCETAXEL (N=276) P* > 1 hospitalización por neutropenia febril <0.001 > 1 hospitalización por reacción adversa de otro fármaco G-CSF / GM-CSF <0.001 Eritropoyetina RBC transfusión TABLA 8: Hospitalizaciones y cuidados de soporte de pacientes tratados con Pemetrexed vs Docetaxel en el tratamiento de CPNM EVALUACIÓN ECONÓMICA En nuestro hospital, los tratamientos que inician con Pemetrexed, se administran los 3 primeros ciclos y se valora la respuesta al tratamiento. Ésta respuesta se puede medir a través de 2 tipos de efectos: a. Resultados de actividad: centrados en la modificación de la masa tumoral y/o sus metástasis, obtenidos a partir de la exploración física, las pruebas de imagen y determinadas pruebas analíticas. Los criterios más utilizados para valorar la actividad de un tratamiento son los de la OMS: - Respuesta completa (RC): Desaparición de toda evidencia tumoral registrada en dos mediciones consecutivas en el plazo mínimo de un mes. - Respuesta parcial (RP): Reducción del 50% o más del área tumoral en dos mediciones realizadas en el plazo de un mes, sin aparición de lesiones nuevas. Supervivencia libre de enfermedad o Intervalo libre de enfermedad: Se emplea tras un tratamiento radical y se refiere al periodo de tiempo que transcurre desde la fecha del tratamiento hasta la primera recaída, que puede ser una recurrencia local o una metástasis a distancia. - Medida de la calidad de vida: Desde el punto de vista de la salud, la calidad de vida es un concepto que se refiere a los efectos de la enfermedad y el tratamiento sobre el bienestar físico, psicológico y social del paciente, tal y como lo recibe el mismo. Según esto, haremos una estimación del coste de tratamiento por paciente y ciclo para un individuo estándar de 70Kg y 1,70cm de altura, que tiene una superficie corporal estándar de 1,8m 2 en función de las distintas indicaciones del Pemetrexed: - Respuesta mínima o estabilización: Reducción de menos del 50% del área tumoral o aumento inferior al 25% de una o más lesiones. - Progresión: Incremento superior al 25% en el tamaño de cualquier lesión medible o aparición de nuevas lesiones, o ambas cosas. Mesotelioma pleural maligno OPCIONES DE TRATAMIENTO POSOLOGÍA DOSIS/70 Kg ALIMTA -Pemetrexed 500mg/m2 900 mg PLACIS -Cisplatino 75 mg/m2 135 mg COSTE POR CICLO (PVL + IVA) 2246,4 * ** b. Resultados relativos al paciente: Entre los que hay que destacar la supervivencia y la calidad de vida, los cuales son los que dan lugar a los índices de eficacia del tratamiento: - Medida de la supervivencia: Supervivencia global: Periodo de tiempo que transcurre desde el inicio del tratamiento hasta el fallecimiento del enfermo. TOTAL 2261,46 * PLACIS -Cisplatino 75 mg/m2 135 mg 15,06 * (Teniendo en cuenta que se ha ajustado a la relación dosis/precio de cada uno de los viales. Reconsiderar la estabilidad de los viales de ALIMTA reconstituidos: 24 horas en nevera) * Los cálculos están hechos con el PVL +4% IVA - descuento **El PVP del Placis 100mg = y Placis 50mg = CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 9
10 Cáncer de pulmón no microcítico OPCIONES DE TRATAMIENTO POSOLOGÍA DOSIS/70 Kg COSTE POR CICLO (PVP + IVA) ALIMTA -Pemetrexed 500mg/m2 900 mg 2246,4 La estimación, por parte del Servicio de Oncología, del consumo de Pemetrexed al año sería de pacientes lo que se estima un coste anual según la media de ciclos administrados en los respectivos ensayos clínicos: TAXOTERE -Docetaxel 75 mg/m2 135 mg (Teniendo en cuenta que se ha ajustado a la relación dosis/precio de cada uno de los viales. Reconsiderar la estabilidad de los viales de ALIMTA reconstituidos: 24 horas en nevera; y TAXOTERE : uso inmediato después de reconstituir el vial) * Los cálculos están hechos con el PVL +4% IVA - descuento a) Mesotelioma pleural maligno: # 13568,76 (6 ciclos Pemetrexed/Cisplatino) # 60,25 (4 ciclos Cisplatino) b) Cáncer de pulmón no microcítico: # 8985,6 (4 ciclos Pemetrexed) # 3792,48 (4 ciclos Docetaxel) CONCLUSIONES El tratamiento con Pemetrexed junto con Cisplatino y suplemento vitamínico para el tratamiento de MPM sin tratamiento previo de quimioterapia, resulta estadísticamente significativo superior al tiempo de supervivencia, al tiempo de progresión de la enfermedad y a las tasas de respuesta frente al Cisplatino en monoterapia. La adición de Ácido Fólico y Vitamina B12 reduce estadísticamente significativo, la toxicidad. Mientras que presenta mayor incidencia de toxicidad que al Cisplatino en monoterapia. Respecto al tratamiento de segunda línea del CPNM avanzado con Pemetrexed resulta clínicamente equivalente en cuanto a resultados de eficacia, pero clínicamente significativo en cuanto a la toxicidad. Ya que la mayor incidencia de neutropenia (con o sin complicaciones) con implicación de mayor riesgo del número de hospitalizaciones, así como el mayor requerimiento de G-CSF para los pacientes tratados con Docetaxel, podría suponer un mayor gasto para el Sistema Sanitario. En base a éstos resultados, el tratamiento con Pemetrexed podría ser considerado como tratamiento estándar de segunda línea para el CPNM. BIBLIOGRAFIA: 1. Kut V. et al. Expert Rev. Therapy 4 (4) 2004, Volgelzan NJ. Et al. Journal of Clinical Oncology 2003, 21: Nasser H. et al. Journal of Clinical Oncology 2004, 22: Micromedex 5. Ficha técnica ALIMTA 6. Monografía del producto ALIMTA 7. Catálogo de especialidades farmacéuticas COF CIM. Servicio de Farmacia. Complejo Hospitalario de Albacete. 10
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FT121112+1(N43)
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FT121112+1(N43) 1 1. NOMBRE DEL MEDICAMENTO ALIMTA 100 mg polvo para concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FT121112+1(N43) 1 1. NOMBRE DEL MEDICAMENTO ALIMTA 100 mg polvo para concentrado para solución para perfusión. 2. COMPOSICIÓN CUALITATIVA
Introducción. Nuevos anticoagulantes orales
 Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Progresos en la prevención del ACV asociado a la fibrilación auricular Dabigatrán, rivaroxabán y apixabán son anticoagulantes orales nuevos que pueden ser una alternativa a la warfarina en el tratamiento
Debe utilizarse la dosis eficaz mínima durante el periodo más corto posible a fin de reducir las reacciones adversas.
 ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
ANEXO III 1 ENMIENDAS A INCLUIR EN LAS SECCIONES RELEVANTES DEL RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO DE LOS MEDICAMENTOS QUE CONTIENEN NIMESULIDA (FORMULACIONES SISTÉMICAS) El texto añadido aparece
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL
 FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
FICHA DE INFORMACIÓN AL PACIENTE: PARACETAMOL 1.- QUÉ ES Y PARA QUE SE UTILIZA 1.1 Acción: Analgésico y antipirético (antitérmico, que reduce la fiebre). 1.2 Cómo actúa este fármaco: Inhibe un enzima que
ETOPOSIDO 100mg/5mL. 1. Identificación del Medicamento. Nombre Comercial. Etoposido 100mg/5mL Solución Inyectable. Nombre Genérico.
 ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
ETOPOSIDO 100mg/5mL 1. Identificación del Medicamento Nombre Comercial Etoposido 100mg/5mL Solución Inyectable Nombre Genérico Etoposido Concentración 100mg/5mL Denominación Común Internacional Etoposido
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: (erbitux
constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético.
 Qué es la glutamina? La glutamina es el más abundante aminoácido libre en el cuerpo humano, y constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético. La glutamina es un
Qué es la glutamina? La glutamina es el más abundante aminoácido libre en el cuerpo humano, y constituye aproximadamente el 60% de la reserva de aminoácidos del músculo esquelético. La glutamina es un
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
PROSPECTO: INFORMACIÓN PARA EL USUARIO Dipeptiven 200 mg/ml concentrado para solución para perfusión Alanilglutamina Lea todo el prospecto detenidamente antes de empezar a usar el medicamento. - Conserve
Ensayos Clínicos en Oncología
 Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Ensayos Clínicos en Oncología Qué son y para qué sirven? www.seom.org ESP 05/04 ON4 Con la colaboración de: Una parte muy importante de la Investigación en Oncología Médica se realiza a través de Ensayos
Importancia de la investigación clínica EN ONCOLOGÍA. ONCOvida. oncovida_20.indd 1 10/10/11 12:53
 Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Importancia de la investigación clínica EN ONCOLOGÍA 20 ONCOvida C O L E C C I Ó N oncovida_20.indd 1 10/10/11 12:53 ONCOvida C O L E C C I Ó N oncovida_20.indd 2 10/10/11 12:53 1 2 3 4 5 6 7 Por qué es
Equino: Alivio de la inflamación y el dolor en trastornos músculo-esqueléticos agudos y crónicos. Alivio del dolor asociado al cólico equino.
 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO Loxicom 20 mg/ml solución inyectable para bovino, cerdos y equino 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Un ml contiene: Sustancia activa: Meloxicam 20 mg
FICHA TECNICA. Adultos y niños: Aplicar cinco veces al día aproximadamente cada cuatro horas omitiendo la aplicación de la noche.
 FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
FICHA TECNICA 1. NOMBRE DEL MEDICAMENTO Aciclovir Teva 5% crema EFG 2. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada gramo de crema contiene: Aciclovir (D.O.E.)... 50 mg Excipientes. Ver 6.1 3. FORMA FARMACEUTICA
Para el desarrollo de una evaluación de tecnología, y su pregunta PICO correspondiente (poblaciónintervención-comparador-desenlace),
 Bogotá D.C., 4 de octubre de 2013 Doctor FÉLIX RÉGULO NATES SOLANO Director Dirección de Regulación de Beneficios, Costos y Tarifas del Aseguramiento en Salud Ministerio de Salud y Protección Social Cra.
Bogotá D.C., 4 de octubre de 2013 Doctor FÉLIX RÉGULO NATES SOLANO Director Dirección de Regulación de Beneficios, Costos y Tarifas del Aseguramiento en Salud Ministerio de Salud y Protección Social Cra.
FICHA TÉCNICA. Glucosa
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA NOMBRE DEL MEDICAMENTO Sueroral Hiposódico. COMPOSICION CUALITATIVA Y CUANTITATIVA Cada sobre contiene: COMPONENTES CANTIDADES mmol/l
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013
 FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
FICHA TECNICA LABORATORIO QUÍMICO FARMACÉUTICO INDUSTRIAL DELTA S.A. versión - 1.0. 2013 CETIRIZINA 10 mg COMPRIMIDOS RECUBIERTOS ANTIHISTAMINICO Página 1 CETIRIZINA 10 mg Comprimidos Recubiertos Principio
SIM EXPRESS Información dirigida a los profesionales de la salud Teriflunomida
 COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
COLEGIO DE FARMACÉUTICOS DE LA PROVINCIA DE SANTA FE 1ª Circunscripción DAP DEPARTAMENTO DE ACTUALIZACIÓN PROFESIONAL SIM Sistema de Información de Medicamentos 23/04/2015 SIM EXPRESS Información dirigida
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS
 INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
INFORME TECNICO PARA LA EVALUACION DE LOS MEDICAMENTOS INTRODUCCIÓN La selección de medicamentos es un proceso por el cual se elige, entre todos los fármacos comercializados, aquellos que, por presentar
RESCUVOLIN 10mg/mL 1. Identificación del Medicamento Nombre Comercial Nombre Genérico Concentración Denominación Común Internacional
 RESCUVOLIN 10mg/mL 1. Identificación del Medicamento Nombre Comercial Rescovulin 10mg/mL Nombre Genérico Folinato de Calcio Concentración 10mg/mL Denominación Común Internacional Folinato de Calcio (Leucovorina)
RESCUVOLIN 10mg/mL 1. Identificación del Medicamento Nombre Comercial Rescovulin 10mg/mL Nombre Genérico Folinato de Calcio Concentración 10mg/mL Denominación Común Internacional Folinato de Calcio (Leucovorina)
Anexo III. Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto
 Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Anexo III Modificaciones en las secciones relevantes de la Resumen de las Características del Producto y prospecto Nota: Esta Ficha Técnica o Resumen de las Características del producto y prospecto son
Manejo de Lenalidomida - Dexametasona en el Tratamiento del. Autora M.V. Mateos
 Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Autora M.V. Mateos Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Dra. María Victoria Mateos
Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Autora M.V. Mateos Manejo de Lenalidomida - Dexametasona en el Tratamiento del Mieloma Múltiple Dra. María Victoria Mateos
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización
 Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
Anexo I Conclusiones científicas y motivos para la modificación de las condiciones de las autorizaciones de comercialización Conclusiones científicas Teniendo en cuenta lo dispuesto en el Informe de Evaluación
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA.
 HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
HIPERTROFIA GINGIVAL EN PACIENTES CON TRANSPLANTE RENAL: TRATAMIENTO CON AZITROMICINA. Mª Victoria Rodríguez, Nelida Madrazo, Asunción Aguilera, Eva Mª Aguirre, Concepción Herrero, Mª Eugenia Plagaro,
Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes
 Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes antes de hidroxiurea después de hidroxiurea Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes 1 Este documento
Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes antes de hidroxiurea después de hidroxiurea Tratamiento con Hidroxiurea contra la Enfermedad de Células Falciformes 1 Este documento
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada ml contiene: Sustancia
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO CARPROSAN 50 mg/ml SOLUCIÓN INYECTABLE PARA BOVINO 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA Cada ml contiene: Sustancia
Clasificación de problemas relacionados con medicamentos
 Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
Clasificación de problemas relacionados con medicamentos (revisado 14-01-2010 vm) 2003-2010 Pharmaceutical Care Network Europe Foundation Esta clasificación puede ser utilizada libremente para la investigación
EICOSANOIDES, ANTIINFLAMATORIOS NO ESTEROIDES. 2) Nombre tres diferencias farmacocinéticas entre diclofenac y ácido acetilsalicílico.
 EICOSANOIDES, ANTIINFLAMATORIOS NO ESTEROIDES 1) Tres efectos de la intoxicación con ácido acetilsalicílico. 2) Nombre tres diferencias farmacocinéticas entre diclofenac y ácido acetilsalicílico. 3) Qué
EICOSANOIDES, ANTIINFLAMATORIOS NO ESTEROIDES 1) Tres efectos de la intoxicación con ácido acetilsalicílico. 2) Nombre tres diferencias farmacocinéticas entre diclofenac y ácido acetilsalicílico. 3) Qué
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Potactasol 1 mg polvo para concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
ANEXO I FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1 1. NOMBRE DEL MEDICAMENTO Potactasol 1 mg polvo para concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar?
 Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar? Salvador Blanch Tormo Servicio de Oncología Médica FUNDACIÓN INSTITUTO VALENCIANO DE ONCOLOGIA 11 de Junio de 2015 Sabes
Ensayos Clínicos en el cáncer de mama Qué son y en qué me beneficia participar? Salvador Blanch Tormo Servicio de Oncología Médica FUNDACIÓN INSTITUTO VALENCIANO DE ONCOLOGIA 11 de Junio de 2015 Sabes
6. Conservación y almacenaje de medicamentos
 6. Conservación y almacenaje de medicamentos 6.1. Normas generales de almacenamiento y conservación Los medicamentos deben conservarse en las condiciones idóneas para impedir su alteración. Los laboratorios
6. Conservación y almacenaje de medicamentos 6.1. Normas generales de almacenamiento y conservación Los medicamentos deben conservarse en las condiciones idóneas para impedir su alteración. Los laboratorios
HOJA DE INFORMACIÓN AL PACIENTE Y CONSENTIMIENTO INFORMADO
 HOJA DE INFORMACIÓN AL PACIENTE Y CONSENTIMIENTO INFORMADO Título del estudio: Estudio aleatorizado de quimioterapia adyuvante individualizada según los niveles de ARNm de BRCA1 en pacientes con cáncer
HOJA DE INFORMACIÓN AL PACIENTE Y CONSENTIMIENTO INFORMADO Título del estudio: Estudio aleatorizado de quimioterapia adyuvante individualizada según los niveles de ARNm de BRCA1 en pacientes con cáncer
Calcitonina Almirall 100 UI Solución inyectable Calcitonina sintética de salmón
 Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Lea todo el prospecto detenidamente antes de empezar a usar el medicamento - Conserve este prospecto. Puede tener que volver a leerlo. - Si tiene alguna duda, consulte a su médico o farmacéutico. - Este
Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos
 Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
Anexo II Modificaciones en la Ficha Técnica o Resumen de las Características del Producto y del Prospecto presentadas por la Agencia Europea de Medicamentos Esta Ficha Técnica o Resumen de las Características
APRENDIENDO CON NEFRON SUPERHEROE
 APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
APRENDIENDO CON NEFRON SUPERHEROE DIABETES - UN FACTOR DE RIESGO PARA LA ENFERMEDAD RENAL La Diabetes mellitus, generalmente conocida como diabetes, es una enfermedad en la que su cuerpo no produce suficiente
Tipos de Estudios Farmacoepidemiológicos
 Tipos de Estudios Farmacoepidemiológicos Marcela Jirón, PharmD, PhD, MSc Depto. de Ciencias y Tecnología Farmacéutica Universidad de Chile mjiron@ciq.uchile.cl Declaración de conflicto de intereses Sin
Tipos de Estudios Farmacoepidemiológicos Marcela Jirón, PharmD, PhD, MSc Depto. de Ciencias y Tecnología Farmacéutica Universidad de Chile mjiron@ciq.uchile.cl Declaración de conflicto de intereses Sin
Anticoncepción oral sin estrógenos Qué debes saber?
 Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
Anticoncepción oral sin estrógenos Qué debes saber? Anticoncepción oral sin estrógenos Qué debes saber? Qué es la píldora sin estrógenos? Cómo funciona? Cuándo iniciar el tratamiento con la píldora sin
EZETIMIBA COMPRIMIDOS 10 mg
 EZETIMIBA COMPRIMIDOS 10 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda o no está seguro
EZETIMIBA COMPRIMIDOS 10 mg Lea cuidadosamente este folleto antes de la administración de este medicamento. Contiene información importante acerca de su tratamiento. Si tiene cualquier duda o no está seguro
Generalización del diseño y desarrollo tecnológico de una formulación inyectable de Ondansetron-4. aica. Empresa Laboratorios aica.
 Generalización del diseño y desarrollo tecnológico de una formulación inyectable de Ondansetron-4. aica Empresa Laboratorios aica. INTRODUCCIÓN La Empresa Laboratorios aica tiene como misión la Elaboración
Generalización del diseño y desarrollo tecnológico de una formulación inyectable de Ondansetron-4. aica Empresa Laboratorios aica. INTRODUCCIÓN La Empresa Laboratorios aica tiene como misión la Elaboración
-Usar el preservativo, que evita el contagio de otras enfermedades de transmisión sexual.
 Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
Virus del Papiloma Humano (VPH) - Preguntas y respuestas 1. Qué es el virus del Papiloma Humano (VPH)? El virus papiloma humano (VPH) es un virus que se transmite por contacto entre personas infectadas,
FICHA TÉCNICA. Granisetrón está indicado para la prevención y tratamiento de las náuseas y vómitos asociados con quimioterapia y radioterapia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GRANISETRÓN G.E.S. 3 mg / 50 ml Solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada bolsa
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO GRANISETRÓN G.E.S. 3 mg / 50 ml Solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada bolsa
La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares.
 Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Pág. 1 de 5 La restricción del uso de Nitrofurantoína debido al riesgo de ocurrencia de efectos adversos graves hepáticos y pulmonares. El objetivo de esta alerta internacional es difundir información
Virus del Ébola ÉBOLA. Durante un brote, quienes mayor riesgo de infección corren son:
 ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
ÉBOLA Lo que se debemos saber. 1. Qué es la enfermedad provocada por el virus del Ébola? Denominada anteriormente Fiebre hemorrágica del Ébola, es una enfermedad grave y con frecuencia letal, cuya tasa
ALERGIA A MEDICAMENTOS
 ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
ALERGIA A MEDICAMENTOS 1 QUE REACCIONES ADVERSAS PUEDEN CAUSAR LOS MEDICAMENTOS? Los medicamentos tienen como función curar enfermedades pero sin embargo en ocasiones pueden causar problemas. Dentro de
Topotecán Actavis 1 mg polvo para concentrado para solución para perfusión EFG
 1. NOMBRE DEL MEDICAMENTO Topotecán Actavis 1 mg polvo para concentrado para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 1 mg de topotecán (como hidrocloruro).
1. NOMBRE DEL MEDICAMENTO Topotecán Actavis 1 mg polvo para concentrado para solución para perfusión EFG 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial contiene 1 mg de topotecán (como hidrocloruro).
Autor: Dres. Freynhagen R, Serpell M, Latymer M y colaboradores Fuente: SIIC Pain Practice 1-11, Nov 2013. Introducción y objetivos
 Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
Importancia de la titulación 05 ENE 15 Seguridad de la pregabalina para el tratamiento de los pacientes con dolor neuropático La pregabalina es una droga de primera línea para el tratamiento de pacientes
VARICELA INTRODUCCIÓN INDICACIONES
 VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
VARICELA 13 INTRODUCCIÓN La varicela es la enfermedad exantemática más común en la infancia y representa la manifestación de la primoinfección por el virus varicela zoster (VVZ). Se transmite por vía aérea
Qué es la tarjeta amarilla?
 Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Qué es la tarjeta amarilla? Es el formulario de recogida de sospechas de reacciones adversas, editada en color amarillo, y distribuida por el Centro Autonómico de Farmacovigilancia del Principado de Asturias
Terapia antifúngica combinada para la Criptococosis Meníngea. Dra. Jimena Prieto
 ANÁLISIS Terapia antifúngica combinada para la Criptococosis Meníngea Dra. Jimena Prieto 11 de abril de 2013 Objetivo Determinar si la terapia combinada (anfotericina B y flucitosina o anfotericina B
ANÁLISIS Terapia antifúngica combinada para la Criptococosis Meníngea Dra. Jimena Prieto 11 de abril de 2013 Objetivo Determinar si la terapia combinada (anfotericina B y flucitosina o anfotericina B
4.2 Posología y forma de administración
 1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
1. DENOMINACIÓN DEL MEDICAMENTO duphalac solución oral botellas duphalac solución oral sobres 2. COMPOSICIÓN CUANTITATIVA Y CUALITATIVA duphalac solución oral contiene: botellas: cada 100 ml de solución
PRINCIPALES PARÁMETROS FARMACOCINÉTICOS
 11 11 El programa de farmacología clínica que ha permitido la evaluación de las propiedades farmacocinéticas y farmacodinámicas de Victoza ha incluido 26 estudios (19 en individuos sanos y 7 en pacientes
11 11 El programa de farmacología clínica que ha permitido la evaluación de las propiedades farmacocinéticas y farmacodinámicas de Victoza ha incluido 26 estudios (19 en individuos sanos y 7 en pacientes
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD
 PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
PROTOCOLO DE ACTUACION ANTE LA DETECCION DE UN CASO DE TUBERCULOSIS EN LA COMUNIDAD 1. Detección de la infección tuberculosa. Prueba de la tuberculina. El diagnóstico de la infección se basa en el viraje
Qué es? Los Antimaláricos en Reumatología
 30 Qué es? Los Antimaláricos en Reumatología 30 Qué es? Los Antimaláricos en Reumatología Son un grupo de medicamentos (también llamados antipalúdicos) que se han usado clásicamente para tratar el paludismo
30 Qué es? Los Antimaláricos en Reumatología 30 Qué es? Los Antimaláricos en Reumatología Son un grupo de medicamentos (también llamados antipalúdicos) que se han usado clásicamente para tratar el paludismo
ANEXO 1. Protocolo Específico en Administración de Anfotericina B (Servicio de Medicina I del HNGAI)
 ANEXO 1 Protocolo Específico en Administración de Anfotericina B (Servicio de Medicina I del HNGAI) INTERVENCIÓN DE ENFERMERÍA 1. Control de funciones vitales: temperatura, pulso, presión arterial, peso,
ANEXO 1 Protocolo Específico en Administración de Anfotericina B (Servicio de Medicina I del HNGAI) INTERVENCIÓN DE ENFERMERÍA 1. Control de funciones vitales: temperatura, pulso, presión arterial, peso,
Prospecto: información para el usuario. Calcitonina Almirall 100 UI/ml solución inyectable. Calcitonina sintética de salmón
 Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
Prospecto: información para el usuario Calcitonina Almirall 100 UI/ml solución inyectable Calcitonina sintética de salmón Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque
MÁS QUE UN ESTORNUDO. Preguntas más frecuentes. Con la colaboración de: + que un estornud. www.masqueunestornudo.es. www.portalfarma.
 MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
MÁS QUE UN ESTORNUDO Preguntas más frecuentes Con la colaboración de: www.masqueunestornudo.es www.portalfarma.com Preguntas más frecuentes en la oficina de farmacia A continuación se detallan las preguntas
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS
 COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: Bortezomib
COMISIÓN DE FARMACIA Y TERAPÉUTICA INFORME DE INCLUSIÓN DE MEDICAMENTOS EN LA GUÍA FARMACOTERAPÉUTICA CENTRO DE INFORMACIÓN DE MEDICAMENTOS 1. SOLICITUD DEL FÁRMACO Principio activo solicitado: Bortezomib
GUÍA RÁPIDA. Comisión Farmacoterapéutica Autonómica Servei de Salut de les Illes Balears
 Guía para la elección de tratamiento anticoagulante oral en la prevención de las complicaciones tromboembólicas asociadas a la fibrilación auricular no valvular GUÍA RÁPIDA Comisión Farmacoterapéutica
Guía para la elección de tratamiento anticoagulante oral en la prevención de las complicaciones tromboembólicas asociadas a la fibrilación auricular no valvular GUÍA RÁPIDA Comisión Farmacoterapéutica
Para consultar la lista completa de excipientes, ver sección 6.1.
 1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
1. NOMBRE DEL MEDICAMENTO Betahistina NORMON 8 mg comprimidos EFG. Betahistina NORMON 16 mg comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido de Betahistina NORMON 8 mg contiene
GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR
 GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR CLÍNICA UNIVERSITARIA universidad de navarra QUÉ SON LOS ANTICOAGULANTES? Son sustancias utilizadas para la prevención y tratamiento de la trombosis,
GUÍA PARA EL EMPLEO DE HEPARINAS DE BAJO PESO MOLECULAR CLÍNICA UNIVERSITARIA universidad de navarra QUÉ SON LOS ANTICOAGULANTES? Son sustancias utilizadas para la prevención y tratamiento de la trombosis,
Tuberculosis Hospital Event
 Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Cuándo empezó la investigación por parte del Departamento de Salud Pública de El Paso? El Departamento de Salud Pública inició la investigación después de que se determinó que niños en el área post-parto
Prospecto: información para el usuario. Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG. Atosiban
 Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
Prospecto: información para el usuario Atosiban Genfarma 6,75 mg/0,9 ml solución inyectable EFG Atosiban Lea todo el prospecto detenidamente antes de que le administren el medicamento, porque contiene
DISEÑOS DE INVESTIGACIÓN
 DISEÑOS DE INVESTIGACIÓN María a Eugenia Mackey Estadística stica Centro Rosarino de Estudios Perinatales El diseño de un estudio es la estrategia o plan utilizado para responder una pregunta, y es la
DISEÑOS DE INVESTIGACIÓN María a Eugenia Mackey Estadística stica Centro Rosarino de Estudios Perinatales El diseño de un estudio es la estrategia o plan utilizado para responder una pregunta, y es la
INTERCAMBIABILIDAD. Adriana Martínez Martínez DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS. Dictaminadora Especializada
 INTERCAMBIABILIDAD Adriana Martínez Martínez Dictaminadora Especializada DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 PRUEBAS DE INTERCAMBIABILIDAD Prueba A. Buenas prácticas de
INTERCAMBIABILIDAD Adriana Martínez Martínez Dictaminadora Especializada DIRECCIÓN EJECUTIVA DE AUTORIZACIÓN DE PRODUCTOS Y ESTABLECIMIENTOS 1 PRUEBAS DE INTERCAMBIABILIDAD Prueba A. Buenas prácticas de
Que es del cual les presentamos un resumen (el original consta de 73 páginas) y al final presentamos nuestros comentarios. El estudio se publicó en:
 ESTUDIO MIMSA: Del estudio MIMSA se tomaron las pólizas con suma asegurada igual o mayor a un millón de dólares (destacadas en el cuadro anterior en color azul) y de ahí derivó el estudio denominado High
ESTUDIO MIMSA: Del estudio MIMSA se tomaron las pólizas con suma asegurada igual o mayor a un millón de dólares (destacadas en el cuadro anterior en color azul) y de ahí derivó el estudio denominado High
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC
 6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
6. Tratamiento de la dependencia tabáquica en pacientes fumadores con diagnóstico de EPOC La dependencia tabáquica presenta determinadas características, que pueden hacer que se considere una enfermedad
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Agua para preparaciones inyectables Serra Pamies disolvente para uso parenteral 2. COMPOSICION CUALITATIVA
Calculadora de Tamaño muestral GRANMO
 Calculadora de Tamaño muestral GRANMO Versión 7.12 Abril 2012 http://www.imim.es/ofertadeserveis/software-public/granmo/ Entre las distintas ofertas que existen para el cálculo del tamaño muestral, ofrecemos
Calculadora de Tamaño muestral GRANMO Versión 7.12 Abril 2012 http://www.imim.es/ofertadeserveis/software-public/granmo/ Entre las distintas ofertas que existen para el cálculo del tamaño muestral, ofrecemos
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA 3. FORMA FARMACÉUTICA 4. DATOS CLÍNICOS
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR NORMON 200 mg Comprimidos EFG. ACICLOVIR NORMON 800 mg Comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ACICLOVIR NORMON 200 mg Comprimidos EFG
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO ACICLOVIR NORMON 200 mg Comprimidos EFG. ACICLOVIR NORMON 800 mg Comprimidos EFG. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA ACICLOVIR NORMON 200 mg Comprimidos EFG
LAS VACUNAS PARA LA ALERGIA. Vacunas
 LAS VACUNAS PARA LA ALERGIA Vacunas 1 Qué son las vacunas para la alergia? La vacunación alérgica o inmunoterapia con alergenos consiste en la administración de pequeñas cantidades crecientes de un alergeno
LAS VACUNAS PARA LA ALERGIA Vacunas 1 Qué son las vacunas para la alergia? La vacunación alérgica o inmunoterapia con alergenos consiste en la administración de pequeñas cantidades crecientes de un alergeno
HEPATITIS A, B, C : APRENDE LAS DIFERENCIAS
 HEPATITIS A, B, C : APRENDE LAS DIFERENCIAS HEPATITIS A HEPATITIS B HEPATITIS C CAUSADO POR EL VIRUS CAUSADO POR EL VIRUS CAUSADO POR EL VIRUS DE LA DE LA HEPATITIS A (HAV) DE LA HEPATITIS B (HBV) HEPATITIS
HEPATITIS A, B, C : APRENDE LAS DIFERENCIAS HEPATITIS A HEPATITIS B HEPATITIS C CAUSADO POR EL VIRUS CAUSADO POR EL VIRUS CAUSADO POR EL VIRUS DE LA DE LA HEPATITIS A (HAV) DE LA HEPATITIS B (HBV) HEPATITIS
PROSPECTO: INFORMACIÓN PARA EL USUARIO. Zulex 333 mg Comprimidos recubiertos Acamprosato
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
PROSPECTO: INFORMACIÓN PARA EL USUARIO Zulex 333 mg Comprimidos recubiertos Acamprosato Lea todo el prospecto detenidamente antes de empezar a tomar el medicamento. Conserve este prospecto, ya que puede
FICHA TÉCNICA. Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO Coulergin 10 mg comprimidos recubiertos con película 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada comprimido contiene 10 mg de Cetirizina (DOE) dihidrocloruro.
FICHA TÉCNICA. Alivio local sintomático de las infecciones leves de boca y garganta que cursan con dolor y sin fiebre.
 FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STREPSILS CON LIDOCAINA pastillas para chupar. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla: Amilmetacresol hidrocloruro... 0,6mg Alcohol 2,4- diclorobencílico.......1,2mg
FICHA TÉCNICA 1. NOMBRE DEL MEDICAMENTO STREPSILS CON LIDOCAINA pastillas para chupar. 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Por pastilla: Amilmetacresol hidrocloruro... 0,6mg Alcohol 2,4- diclorobencílico.......1,2mg
Lactofilus polvo oral
 PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
PROSPECTO: INFORMACIÓN PARA EL USUARIO Lactofilus polvo oral Lea todo el prospecto detenidamente porque contiene información importante para usted. Este medicamento puede adquirirse sin receta. No obstante,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. 20 g/100 ml
 RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO Nombre del producto: CLORURO DE SODIO 20 % Forma farmacéutica: Solución concentrada para infusión IV Fortaleza: Presentación: Titular del Registro Sanitario,
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL
 TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
TECNOLOGÍA EN SALUD DE INTERÉS Lapatinib 1. INFORMACIÓN GENERAL Título del reporte: efectividad y seguridad de lapatinib (terapia anti-her2) en cáncer de mama HER2 positivo Autores: grupo desarrollador
ALANINA AMINOTRANSFERASA ALT/GPT ( IFCC )
 INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 2 En este segundo ejemplar del Boletin de Interferencias por Farmacos en pruebas clínicas, detallaremos
INTERFERENCIAS POR FÁRMACOS EN ANÁLISIS CLÍNICOS DEPARTAMENTO EDUCATIVO BIOSYSTEMS BOLETÍN NUMERO 2 En este segundo ejemplar del Boletin de Interferencias por Farmacos en pruebas clínicas, detallaremos
tarjeta de seguridad para el paciente tarjeta de seguridad para el paciente Qué es Soliris? Es importante que usted:
 Su médico le entregará una tarjeta de seguridad para el paciente en la que se describe el riesgo de contraer infecciones meningocócicas. Llévela siempre con usted durante el tratamiento y durante 3 meses
Su médico le entregará una tarjeta de seguridad para el paciente en la que se describe el riesgo de contraer infecciones meningocócicas. Llévela siempre con usted durante el tratamiento y durante 3 meses
FICHA TÉCNICA. Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml
 FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
FICHA TÉCNICA 1. DENOMINACIÓN DEL MEDICAMENTO HYALART 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada vial o jeringa precargada contiene: Ácido hialurónico (DCI) sal de sodio...20 mg/2ml 3. FORMA FARMACÉUTICA
La vacuna pentavalente oral contra rotavirus puede ser tolerable
 La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
La vacuna pentavalente oral contra rotavirus puede ser tolerable Para los lactantes atendidos en los centros médicos donde se realizó el estudio, la información clínica con respecto a los episodios de
1/ Frecuencia y fechas de reunión programada del CEIC.
 1/ Frecuencia y fechas de reunión programada del CEIC. El CEIC tiene programadas reuniones mensuales, excepto en el mes de Agosto. Estas reuniones tienen lugar entre los días 21 y 30 de cada mes (Normalmente
1/ Frecuencia y fechas de reunión programada del CEIC. El CEIC tiene programadas reuniones mensuales, excepto en el mes de Agosto. Estas reuniones tienen lugar entre los días 21 y 30 de cada mes (Normalmente
FICHA TÉCNICA. Se deberá respetar la dosis diaria recomendada independientemente de la extensión de la alopecia.
 agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
agencia española de medicamentos y productos sanitarios FICHA TÉCNICA 1. NOMBRE DE LA ESPECIALIDAD FARMACÉUTICA Regaxidil 5% solución cutánea 2. COMPOSICIÓN CUALITATIVA Y QUANTATIVA Cada ml de solución
EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P.
 CIRCULAR DEL PRODUCTO Cápsulas EMEND (aprepitant) I. CLASE TERAPÉUTICA * EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P. II. INDICACIONES EMEND en combinación
CIRCULAR DEL PRODUCTO Cápsulas EMEND (aprepitant) I. CLASE TERAPÉUTICA * EMEND (aprepitant) es un antagonista del receptor neuroquinina 1 (NK1) de la sustancia P. II. INDICACIONES EMEND en combinación
Se recomienda beber un vaso de agua después de cada dosis y abundante líquido durante el día.
 agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
agencia española de medicamentos y productos sanitarios 1. NOMBRE DEL MEDICAMENTO CISBEDAL 750 mg SOLUCIÓN ORAL 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada sobre de 15 ml de solución oral contiene:
+ Fidaxomicina Nuevo tratamiento en la infección por Clostridium difficile. Mª Victoria Gil Navarro 3 de Octubre de 2012
 + Fidaxomicina Nuevo tratamiento en la infección por Clostridium difficile! Informe Génesis y valoración por parte del grupo AFINF Mª Victoria Gil Navarro 3 de Octubre de 2012 + Infección Clostridium difficile
+ Fidaxomicina Nuevo tratamiento en la infección por Clostridium difficile! Informe Génesis y valoración por parte del grupo AFINF Mª Victoria Gil Navarro 3 de Octubre de 2012 + Infección Clostridium difficile
MIELOMA MULTIPLE. Se manifiesta en estos pacientes, debilidad, fatiga, y hemorragias como consecuencia de una medula ósea insuficiente.
 MIELOMA MULTIPLE 1. Qué es el mieloma múltiple? Es un cáncer de unas células llamadas plasmáticas, que nacen de nuestro sistema de defensa llamado también inmunológico, éstas células que producen a las
MIELOMA MULTIPLE 1. Qué es el mieloma múltiple? Es un cáncer de unas células llamadas plasmáticas, que nacen de nuestro sistema de defensa llamado también inmunológico, éstas células que producen a las
riesgos con Xolair. Información sobre Xolair (omalizumab)
 La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
La FDA aprueba cambios en la etiqueta del medicamento para el asma Xolair (omalizumab), los que incluyen la descripción de un riesgo ligeramente mayor de acontecimientos adversos cardíacos y cerebrales
Anexo II. Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA
 Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
Anexo II Conclusiones científicas y motivos para la suspensión de las autorizaciones de comercialización presentados por la EMA 5 Conclusiones científicas Resumen general de la evaluación científica de
COMBATIENDO EL CANCER DE PIEL
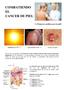 COMBATIENDO EL CANCER DE PIEL Primeros auxilios para la piel! Radiación UVB Quemadura solar Cancer de piel El sol no es un enemigo, es la fuente de la vida y durante miles de años tuvimos tiempo para adaptarnos
COMBATIENDO EL CANCER DE PIEL Primeros auxilios para la piel! Radiación UVB Quemadura solar Cancer de piel El sol no es un enemigo, es la fuente de la vida y durante miles de años tuvimos tiempo para adaptarnos
Innovaciones de CheckTheMeds
 Innovaciones de CheckTheMeds Nueva Tecnología de Información para el profesional Muy útil para ayudar en la evaluación global de pacientes pluripatológicos polimedicados CheckTheMeds Procesa globalmente
Innovaciones de CheckTheMeds Nueva Tecnología de Información para el profesional Muy útil para ayudar en la evaluación global de pacientes pluripatológicos polimedicados CheckTheMeds Procesa globalmente
PREGUNTAS FRECUENTES SOBRE VPH.
 PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
PREGUNTAS FRECUENTES SOBRE VPH. Qué es el VPH? El Virus del Papiloma Humano VPH es una familia de virus que afecta muy frecuentemente a los seres humanos. Existen alrededor de 100 tipos de VPH, de los
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO. Docetaxel Actavis 20 mg/ml concentrado para solución para perfusión
 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Docetaxel Actavis 20 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO 1. NOMBRE DEL MEDICAMENTO Docetaxel Actavis 20 mg/ml concentrado para solución para perfusión 2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA Cada
6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1)
 6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1) (1.1) Es importante valorar la intensidad, la frecuencia y la duración de los síntomas de reflujo,
6Estrategias diagnósticas y terapéuticas 6.1. DIAGNÓSTICO Y TRATAMIENTO INICIAL DE LA ERGE (ALGORITMO 1) (1.1) Es importante valorar la intensidad, la frecuencia y la duración de los síntomas de reflujo,
Una píldora diaria. Tres valores de laboratorio importantes
 Tres valores de laboratorio importantes Una píldora diaria Sensipar una vez al día* ayuda a reducir los niveles de HPT, calcio y fósforo en pacientes con hiperparatiroidismo secundario (HPTS) que reciben
Tres valores de laboratorio importantes Una píldora diaria Sensipar una vez al día* ayuda a reducir los niveles de HPT, calcio y fósforo en pacientes con hiperparatiroidismo secundario (HPTS) que reciben
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II
 EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
EVALUACIÓN CRÍTICA BASADA EN LA EVIDENCIA Sandra Convers-Páez EPIDEMIOLOGÍA CLÍNICA II MBE Cáncer de cuello uterino y VPH CA de cérvix: Segundo tipo de CA en las mujeres. Principal causa de muerte por
Guía para el Consentimiento Informado de Donantes Vivos
 Guía para el Consentimiento Informado de Donantes Vivos Propósito El Comité de Donantes Vivos de OPTN/UNOS preparó esta guía para ayudar a los profesionales de trasplantes a formular procesos de consentimiento
Guía para el Consentimiento Informado de Donantes Vivos Propósito El Comité de Donantes Vivos de OPTN/UNOS preparó esta guía para ayudar a los profesionales de trasplantes a formular procesos de consentimiento
Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento.
 Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento. ENTENDIENDO SU INFORME DE PATOLOGÍA Usualmente se realiza
Entendiendo su informe de patología. Cuidado de seguimiento después del tratamiento primario de cáncer colorrectal. Entendiendo el tratamiento. ENTENDIENDO SU INFORME DE PATOLOGÍA Usualmente se realiza
FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS DEL PRODUCTO
 Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
Anexo III Modificaciones a incluir en las secciones relevantes de la ficha técnica o resumen de las características del producto, etiquetado y prospecto 20 FICHA TÉCNICA O RESUMEN DE LAS CARACTERÍSTICAS
Algunas consideraciones sobre el Síndrome Antifosfolípido Primario
 Anexos Anexo 1 Algunas consideraciones sobre el Síndrome Antifosfolípido Primario El síndrome antifosfolípido, descrito inicialmente como lupus eritematoso sistémico, aparece en personas que no reúnen
Anexos Anexo 1 Algunas consideraciones sobre el Síndrome Antifosfolípido Primario El síndrome antifosfolípido, descrito inicialmente como lupus eritematoso sistémico, aparece en personas que no reúnen
TRATAMIENTO CON BUPRENORFINA: UN ADIESTRAMIENTO PARA PROFESIONALES MULTIDISCIPLINARIOS EN ADICCION. Módulo III Buprenorfina 101
 TRATAMIENTO CON BUPRENORFINA: UN ADIESTRAMIENTO PARA PROFESIONALES MULTIDISCIPLINARIOS EN ADICCION Módulo III Buprenorfina 101 Módulo III Metas del Módulo Este módulo repasa lo siguiente: El desarrollo
TRATAMIENTO CON BUPRENORFINA: UN ADIESTRAMIENTO PARA PROFESIONALES MULTIDISCIPLINARIOS EN ADICCION Módulo III Buprenorfina 101 Módulo III Metas del Módulo Este módulo repasa lo siguiente: El desarrollo
