Hay 20 aminoácidos diferentes, implicados en la formación de las proteínas, conocidos como los aminoácidos id estándares.
|
|
|
- Consuelo Aranda Vega
- hace 7 años
- Vistas:
Transcripción
1 Aminoácidos 1
2 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes, implicados en la formación de las proteínas, conocidos como los aminoácidos id estándares. d 2
3 Los α-aminoacidos ESQUELETO DIFERENCIAL O ESQUELETO COMUN CADENA LATERAL R CH C OH GRUPO α-carboxilo CARBONO α NH 2 GRUPO α-amino 3
4 O H 2 N CH OH H 2 C H 2 H N CH O C OH H Glicina (Gly) CH 2 CH 2 Prolina (Pro) Como se ha indicado, estos aspectos estructurales son comunes a todos los aminoácidos, id con la excepción de la glicina, que tiene un hidrógeno unido al carbono α, y de la prolina, que es propiamente un iminoácido, no un aminoácido. 4
5 Estereoquímica de los aminoácidos CHO COOH HO H H 2 N H CH 2 OH CH 2 OH L-Gliceraldehido (monosacárido) L-Serina (α-aminoácido) Todos los aminoácidos, con la excepción de la glicina, que tienen un carbono α asimétrico (quiral), pueden existir en principio en dos formas estereoquímicas, la forma L y la forma D. 5
6 Salvo contadas excepciones, todos los aminoácidos constituyentes de las proteínas presentan configuración L. (α-l-aminoacidos.) De aquí que omitiremos la designación de isómero óptico en nuestra discusión de las proteínas, puesto que siempre se supondrá que se trata del isómero L a menos que indique lo contrario. 6
7 Clasificación de los aminoácidos Desde el punto de vista nutricional: Aminoácidos esenciales, aquellos aminoácidos que no pueden ser sintetizados por el organismo a la velocidad y en la cantidad requerida y deben ser suministrados por la dieta. Aminoácidos no esenciales, aquellos aminoácidos que son sintetizados por el organismo 7
8 Los aminoácidos se pueden clasificar de acuerdo a su cadena lateral en: polar o no polar. A su vez los aminoácidos polares pueden subdividirse de acuerdo a los grupos funcionales que presentan en su cadena lateral polar como: Acidos, Básicos y Neutros. APOLAR Aminoácidos Según cadena lateral HIDRÓFOBOS POLAR HIDROFÍLICOS ÁCIDOS BASICOS NEUTROS 8
9 A. -Aminoácidos cadena lateral apolar Serán aquellos que contienen en su grupo R: 1.- Hidrógeno 2.- Cadena hidrocarbonada ciclada con el grupo α-amino 3.- Cadena hidrocarbonada 4. Cadena aromática 9
10 CH 3 O O C H 3 CH CH C OH H 2 N CH OH NH 2 H Valina (Val) Glicina (Gly) H 2 C H N CH O C OH CH 2 O OH CH 2 CH 2 HO NH 2 Prolina (Pro) Tirosina (Tyr) 10
11 B.-Aminoácidos cadena lateral polar básica Serán aquellos que contienen en su grupo R: 1. Otro grupo amino O H 2 N CH 2 CH 2 CH 2 CH2 OH NH 2 Lisina (Lys) 11
12 C.- Aminoácidos cadena lateral polar ácida Serán aquellos que contienen en su grupo R: 1. Otro grupo carboxilo O O HO C CH 2 CH 2 OH NH 2 Acido Glutámico (Glu) 12
13 D.- Aminoácidos cadena lateral polar neutra Serán aquellos que contienen en su grupo R: 1. Cadena con grupo amida 2. Cadena con grupo hidroxilo 3. Cadena con grupo sulfhidrilo 4. Cadena con grupo tioéter 13
14 CH 3 O NH 2 O HO CH OH O C CH 2 CH 2 OH NH 2 Treonina (Thr) O NH 2 Glutamina (Gln) O C H 3 S CH 2 CH 2 CH OH HS CH 2 OH NH 2 NH 2 Metionina (Met) Cisteína (Cys) 14
15 PROPIEDADES ÁCIDO-BASE DE LOS AMINOÁCIDOS El grupo ácido carboxílico (COOH) es un ácido, presenta dos formas las cuales dependen del ph de la solución donde se encuentran. R COOH H + R COO - + Forma ácida Forma básica 15
16 El grupo amino (NH 2 2) es una base, por lo tanto, presenta dos formas las cuales dependen del ph de la solución donde se encuentran. R NH 3 + H + + R NH 2 Forma ácida Forma básica 16
17 Si analizamos a los aminoácidos observamos que: a) Cuando un aminoácido está en una solución cuyo ph es inferior a 2, el grupo α-carboxilo está en su forma áid ácida (i (sin carga) yel grupo α-aminoi está en su forma ácida (con carga +1). El aminoácido se encuentra principalmente como la especie Protonada (carga neta positiva) O R CH C OH NH
18 b) Cuando un aminoácido está en una solución cuyo ph es superior a 9, el grupo α-carboxilob está en su forma básica (con carga -1) y el grupo α-amino está en su forma básica (sin carga). El aminoácido se encuentra preferentemente como la especie No-Protonada (carga neta negativa) O R CH C O - NH 2 18
19 c) Hay un valor de ph, característico para cada aminoácido, en el cual la disociación de cargas positivas y negativas se iguala y, por lo tanto, la carga total del aminoácido es nula, el aminoácido se encuentra como la especie Zwitterion. Aeste valor de ph se le denomina punto isoeléctrico (pi). 19
20 SISTEMAS DE EQUILIBRIO Caso 1: Aminoácido con cadena lateral Apolar o Polar Neutra (cadena lateral no ionizable) + H 3 N O OH + H N pka 3 O - 1 =2,34 pka 2 =9,69 O H 2 N O O - CH 3 CH 3 CH 3 Carga +1 Carga 0 Carga -1 ph<pka ph=pi 1 ph>pka 2 20
21 Caso 2: Aminoácido con cadena lateral Polar Ácida (cadena lateral ionizable) HO + H 3 N O OH + H 3 N O + H 3 N O - O - pka 1 =1,88 pka R =3,65 - pka 2 =9.60 HO O O O - H 2 N O O - O O O O Carga +1 Carga 0 Carga -1 Carga -2 ph<pka 1 ph=pi pka R <ph<pka 2 ph>pka 2 21
22 Caso 3: Aminoácido con cadena lateral Polar Básica (cadena lateral ionizable) + H 3 N O O O O OH + H 3 N H 2 N H 2 N O - O - O - pka 1 =2,18 pka 2 =8,95 pka R =10,53 NH 3 + NH 3 + NH 3 + NH 2 Carga +2 Carga +1 Carga 0 Carga -1 ph<pka 1 pka 1 <ph<pka 2 ph=pi ph<pka R 22
23 PROPIEDADES FÍSICAS DE LOS AMINOÁCIDOS Son insolubles en disolventes no polares, y su moderada solubilidad en agua depende del ph en el que se encuentren. Siendo menos soluble en agua cuando se encuentra como Zwitterion, es decir, cuando el ph = pi y más soluble a ph extremos, es decir, muy ácidos o muy básicos. A ph fisiológico (ph 7,4) el grupo α-carboxilo se encuentra desprotonado y el grupo α-amino protonado. 23
24 PROPIEDADES QUÍMICAS DE LOS AMINOÁCIDOS Dos moléculas de aminoácidos pueden establecer enlaces covalentes entre el carbono carboxilo del grupo α-carboxilo de un aminoácido y el nitrógeno del grupo α-amino de otro. Esta unión, denominada enlace peptídico, corresponde al grupo funcional amida y se produce con pérdida de agua. H H H O R H 2 N C COOH H + 2 N C COOH H 2 N C C N C COOH + H 2 O R R R H H 24
25 Enlace peptídico pp 25
26 Es posible seguir agregando unidades aminoacídicas con el mismo tipo de unión para formar tripéptidos, tetrapéptidos, pentapéptidos, etc. Cada vez que se añade un aminoácido a la cadena, debe eliminarse una molécula de agua. Así la porción de cada aminoácido que permanece en la cadena se denomina residuo de aminoácido. 26
27 Cadena Peptídica Toda cadena peptídica p tiene un extremo en el cual queda un aminoácido con su grupo α-amino libre; por convención, se considera a éste como el comienzo de la cadena (se escribe en el extremo izquierdo) y se le llama extremo amino o residuo N- terminal. Toda cadena polipeptídica tiene un extremo en el cual queda un aminoácido con su grupo α- carboxilo libre; por convención, se considera a éste como el final de la cadena (se escribe en el extremo derecho) y se le llama extremo carboxilo o residuo C-terminal. 27
28 28
29 Cuando la cadena polipeptídica p p tiene 50 unidades de aminoácidos, lo cual corresponde a una masa molecular aproximadamente mayor a 6000, la molécula es considerada una proteína. Por debajo de esa masa, se acostumbra a designarlos simplemente como péptidos. No hay un límite preciso entre péptidos y proteínas; el valor de 6000 como masa molecular es arbitrario y se ha elegido porque es la masa aproximada de insulina, hormona producida en el páncreas y primera proteína cuya estructura completa fue conocida con exactitud. 29
30 Proteínas 30
31 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de la estructura básica de los tejidos (músculos, tendones, piel, uñas, etc.) y, por otro, desempeñan funciones metabólicas y reguladoras (asimilación de nutrientes, transporte de oxígeno y de grasas en la sangre, inactivación de materiales tóxicos o peligrosos, etc.). 31
32 Clasificación de las proteínas Según su forma: Fibrosas: presentan cadenas polipeptídicas largas y una atípica estructura secundaria. Son insolubles en agua. Algunos ejemplos de estas son la queratina y colágeno. Globulares: se caracterizan por doblar sus cadenas en una forma esférica apretada o compacta. Son solubles en agua. La mayoría de las enzimas, anticuerpos, algunas hormonas, proteínas de transporte, ta spote,son ejemplo de proteínas pote asglobulares. 32
33 Según su composición química: Simples o holoproteínas, su hidrólisis sólo produce aminoácidos. Ejemplos de estas son la insulina y el colágeno. Conjugadas o heteroproteínas, su hidrólisis produce aminoácidos y otras sustancias no proteicas llamado grupo prostético. 33
34 El grupo prostético puede ser un ion metálico o moléculas orgánicas pequeñas, el cuál clasifica a las proteínas conjugadas, por ejemplo: Glucoproteínas, contiene glúcidos, un oligosacarido unido covalentemente a la proteína (inmunoglobulina G) Lipoproteínas, contiene lípidos, generalmente un ácido graso (LDL y HDL) Fosfoproteínas, contiene al ácido fosfórico (Caseína) Nucleoproteínas, contiene un ácido nucleico (Histona) 34
35 Estructura de una proteína La estructura de una proteína es muy compleja, razón por la cual resulta conveniente describirla en distintos niveles de organización. 35
36 1.- Estructura primaria La estructura primaria corresponde a la secuencia definida de los residuos de aminoácidos presentes en la proteína. Nos indica qué aminoácidos componen la cadena polipeptídica y el orden en que dichos aminoácidos id se encuentran. El orden de aminoácidos influye en la conformación final y, en consecuencia, en la función y especificidad de la proteína. 36
37 Para mayor comprensión de la estructura primaria, se debe tener en cuenta los siguientes hechos. a) Los cuatro átomos directamente vinculados al enlace peptídico (O, C, N e H) se encuentran en el mismo plano, al igual que los carbono α unidos al carbono y al nitrógeno del enlace amida. El enlace peptídico es coplanar. 37
38 b) Cada enlace peptídico tiene carácter parcial de doble enlace y no puede rotar libremente. c) El oxígeno carbonilo (C=O) tiene carga parcial negativa y el nitrógeno amidico (N-H) carga parcial positiva, lo que da lugar a un pequeño dipolo eléctrico. C H 3 O CH 3 O - CH 3 C N C N + H H 3 C H 38
39 d) Los átomos de oxígeno e hidrógeno de cada enlace peptídico se encuentran en disposición trans. 39
40 e) La rotación es libre en los enlaces C α -CyN-C α. Los ángulos de rotación de los enlaces se denominan por convención ψ (psi) para el enlace C α -C y φ (phi) para el enlace N-C α. 40
41 f) Cada enlace peptídico en relación con el siguiente guardan una suerte de disposición preferentemente trans. g) Las cadenas laterales ( R) de cada aminoácido, guardan una disposición preferentemente trans una con la otra. 41
42 h) Toda proteína posee un extremo amino terminal y un extremo carboxilo terminal. 42
43 2.- Estructura secundaria Los aminoácidos, a medida que van siendo enlazados durante la síntesis de proteínas y gracias a la capacidad de giro, adquieren una disposición espacial estable y regular, la estructura secundaria. La estructura secundaria corresponde a un plegamiento regular local de la proteína. Existen unas pocas clases básicas de estructuras secundarias, siendo las más comunes: a) La forma α-hélice b) La forma β-plegada 43
44 a) Estructura α -hélice Se produce cuando la cadena polipeptídica gira sobre si misma originando un cilindro donde los enlaces peptídicos se unen por fuerzas de atracción del tipo puente de hidrogeno a otro enlace peptídico. De esta forma se producen enrollamiento helicoidales en los que la cadena lateral de los aminoácidos se proyectan hacia el exterior de la hélice. α -hélice 44
45 45
46 Restricciones a la estabilidad de la α-hélice: Repulsión o atracción electrostática entre cadenas laterales próximas. Efecto estérico de tamaño. Efecto Prolina Interacciones entre los aminoácidos de los extremos de la hélice y el dipolo eléctrico inherente a esta estructura 46
47 b) Estructura β -plegada Hoja β -plegada Corresponde a un pliegue en forma de zigzag de manera que se establecen fuerzas de atracción del tipo puente de hidrógeno entre los enlaces peptídicos de forma transversal, que pueden ser intracatenarios, es decir, entre residuos de la misma cadena polipeptídica, o bien intercatenarios, es decir, entre residuos de cadenas polipeptídicas distintas. 47
48 48
49 Las interacciones adicionales que se producen entre las cadenas laterales de los aminoácidos pueden estabilizar o desestabilizar la estructura β-plegada. Cuando dos o más hojas plegadas paralela o antiparalelas se encuentran densamente empaquetadas en una proteína, los grupos R de las superficies de contacto deben ser relativamente pequeños para permitir el empaquetamiento. 49
50 Características de las dos formas de estructuras secundarias más comunes α-hélice La hélice es de tipo 3,6 r13 y dextrogira. El esqueleto es compacto. Se estabiliza por una interacción intermolecular puente de hidrógeno entre los enlaces peptídicos, de tal manera que cada oxigeno carbonilo del residuo n, esta unido por puente de hidrogeno al nitrógeno amida del residuo n+4, en dirección N C terminal. Por lo tanto, hay un puente de hidrogeno cada 4 enlaces peptídicos Los puentes de hidrógeno intrahelicoidales son casi paralelos al eje de la hélice con los grupos carbonilo apuntando hacia el extremo carboxilo-terminal. Todos los grupos R quedan proyectados hacia fuera de la hélice. El interior de la hélice es hidrofóbica hoja β-plegada El esqueleto se encuentra extendida en zig-zag. Se estabiliza por una interacción intermolecular puente de hidrógeno entre los enlaces peptídicos de forma transversal, que pueden ser intracatenarios, es decir, entre residuos de la misma cadena polipeptídica, o bien intercatenarios, es decir, entre residuos de cadenas polipeptídicas distintas. Los grupos R de las cadenas laterales por lo general son pequeños (glicina y alanina) para favorecer el empaquetamiento denso. Los grupos R de las cadenas laterales de residuos de aminoácidos adyacentes sobresalen de la estructura en direcciones opuestas. Las cadenas polipeptídicas pueden ser paralelas (con la misma orientación amino-carboxilo en el polipeptido) o antiparalelas (con orientaciones opuestas). 50
51 3.- Estructura terciaria La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular. Razón por la cual, algunos autores, a menudo, las denominan proteínas globulares. 51
52 A diferencia de la estructura secundaria, la estructura terciaria de la mayor parte de las proteínas es específica de cada molécula y es determinante en su función. Muchas proteínas globulares llevan un grupo prostético, moléculas pequeñas que pueden estar enlazadas de modo covalente o no covalente a la proteína y capacitarla para que cumpla funciones especiales. 52
53 El plegamiento para formar la estructura terciaria no es inmediato, primero se agrupan o combinan conformaciones α-hélice y β-plegada conformando lo que se denomina dominio, que luego se articulan para formar laestructura t terciaria i definitiva. iti Dominio es una región compacta plegada localmente Los dominios están unidos entre sí mediante una hebra de seguimiento La mayoría de las proteínas globulares pequeñas tienden a presentar un dominio, mientras que las más grandes presentan más de un dominio. 53
54 54
55 Los residuos hidrófobos se sitúan principalmente en el interior, mientras que los residuos hidrófilos están en la superficie i exterior, en contacto t con el agua. Estructura terciaria de la proteína triosa fosfato isomerasa (TPI) No todas las partes de las proteínas globulares pueden clasificarse convenientemente como hélice, lamina plegada o giros, a estas regiones se les denomina ovillos aleatorios 55
56 4.- Estructura cuaternaria Este nivel de organización es propio de aquellas proteínas formadas por más de una cadena polipeptídica. La estructura cuaternaria corresponde a agregados específicos de dos o más cadenas polipeptídicas plegadas. Cada una de estas cadenas polipeptídicas recibe el nombre de protómero o subunidad. 56
57 Las subunidades pueden ser idénticas o muy diferentes entre si. El número de subunidades varía desde dos como en la hexoquinasa, cuatro como en la hemoglobina, o muchos como la cápside del virus de la poliomielitis, que consta de 60 subunidades proteicas. La proteína más grandes, es la piruvato deshidrogenasa, que se localiza en las mitocondrias, contiene 72 cadenas polipeptídicas. 57
58 La fosfatasa alcalina totalmente funcional, mostrada abajo, contiene dos cadenas polipeptídicas, cada una con un sitio activo capaz de hidrolizar el fosfato. Este es un ejemplo de un homomultímero, donde ambas subunidades son idénticas. 58
59 Las proteínas con la estructura cuaternaria pueden también ser heteromultímeros, como en el caso de hemoglobina, cuyas subunidades no son del todo idénticas. La hemoglobina es una proteína con cuatro polipéptidos, dos alfaglobinas (una se muestra en blanco y la otra en verde) y dos beta-globinas (una se muestra en azul oscuro y la otra en tono púrpura). 59
60 Estabilización de la estructura terciaria y cuaternaria La estabilización es responsabilidad de las fuerzas de atracción que se generan entre las cadenas laterales de los aminoácidos que conforman la proteína. No Covalentes Puente de Hidrogeno y/o Van der Walls Covalentes Puente disúlfuro Ionicas Puente Salino 60
61 CARGA CARGA o PUENTE SALINO Principalmente interacciones entre aminoácidos ácidos y básicos ionizados. Dependientes del ph del medio PUENTES DE HIDROGENO FUERZAS DE VAN DER WAALS PUENTES DISULFURO Cadenas laterales dadoras o receptoras de puente -OH de Serina o Treonina -NH 2 de Asparagina no ionizado -COOHde Acido Glutámico no ionizadoi -NR 2 del anillo de Histidina. Cd Cadenas lt lateralesl apolares Enlace covalente que se produce entre residuos de Cisteína. 61
62 Fuerzas de Van der Walls --COO - + NH 3 - Puente Salino ----CH S----S----CH Puente Disúlfuro O H H O Puente de Hidrogeno 62
63 Propiedades de las proteínas Desnaturalización: Al desnaturalizarse una proteína, esta pierde solubilidad en el agua y precipita, se hace menos soluble o insoluble. A la conformación fisiológicamente activa de una proteína se denomina estructura nativa y es muy sensible a los cambios que pueden ocurrir en su entorno. La desnaturalización es un fenómeno que tiene lugar cuando estos cambios del entorno dan lugar a una alteración de la estructura nativa o natural de la proteína que provoca una pérdida de su actividad biológica, es decir, se pierde la conformación tridimensional resultando una estructura no nativa. 63
64 En algunos casos, las proteínas desnaturalizadas pueden volver a su estado original a través de un proceso llamado renaturalización. 64
65 AGENTES DENATURANTES DE PROTEINAS CALOR RADIACION DE MICROONDAS RADIACION ULTRAVIOLETA AGITACION MECANICA VIOLENTA DETERGENTES SOLVENTES ORGÁNICOS (ETANOL, ACETONA, 2-PROPANOL) ACIDOS Y BASES FUERTES SALES DE METALES PESADOS UREA Rompe las interacciones hidrofóbicas y los puentes de hidrogeno. Rompe las interacciones hidrofóbicas y los puentes de hidrogeno. Idem a las anteriores Provoca debilitamiento de las fuerzas de Interacción, alargando su longitud. Afecta los puentes de hidrogeno y los puentes salinos Interfieren con los puentes de hidrogeno y las interacciones hidrofóbicas Rompen puentes de hidrogeno, puentes salinos y si su efecto es muy prolongado puede provocar hidrólisis del enlace peptídico Interfieren con los puentes salinos y los puentes disulfuro Interfiere y rompe los puentes disulfuro 65
66 Función de la proteínas Función ESTRUCTURAL Algunas proteínas constituyen estructuras t celulares: l Ciertas glucoproteínas forman parte de las membranas celulares y actúan como receptores o facilitan el transporte de sustancias. Las histonas, forman parte de los cromosomas que regulan la expresión de los genes. Otras proteínas confieren elasticidad y resistencia a órganos y tejidos: El colágeno del tejido conjuntivo fibroso. La elastina del tejido conjuntivo elástico. La queratina de la epidermis. Las arañas y los gusanos de seda segregan fibroina para fabricar las telas de araña y los capullos de seda, respectivamente. 66
67 Función de TRANSPORTE En los seres vivos son esenciales los fenómenos de transporte, bien para llevar una molécula hidrofóbica a través de un medio acuoso. Transporta de oxígeno en vertebrados (hemoglobina la sangre de los Transporte de oxígeno en invertebrados (hemocianina) la sangre en los Transporta oxígeno en los músculos (mioglobina). Transportan lípidos por la sangre (lipoproteínas) o bien para transportar moléculas polares a través de barreras hidrofóbicas Transporte a través de la membrana plasmática Transportan electrones (citocromos) 67
68 Función ENZIMATICA Las proteínas con función enzimática son las más numerosas y especializadas. Actúan como biocatalizadores de las reacciones químicas del metabolismo celular. Función CONTRACTIL La actina y la miosina i constituyen las miofibrillas responsables de la contracción muscular. La dineina está relacionada con el movimiento de cilios y flagelo 68
69 Función DEFENSIVA Las inmunoglogulinas actúan como anticuerpos frente a posibles antígenos. La trombina y el fibrinógeno contribuyen a la formación de coágulos sanguíneos para evitar hemorragias. Las mucinas tienen efecto germicida y protegen a las mucosas. Algunas toxinas bacterianas, como la del botulismo, o venenos de serpientes, son proteinas fabricadas con funciones defensivas. 69
70 Función HORMONAL Algunas hormonas son de naturaleza proteica, como la insulina y el glucagón (que regulan los niveles de glucosa en sangre) o las hormonas segregadas por la hipófisis como la del crecimiento o la adrenocorticotrópica (que regula la síntesis de corticosteroides) o la calcitonina (que regula el metabolismo del calcio). Acción hormonal en células adyacentes Acción hormonal en células alejadas 70
71 Función de RESERVA La ovoalbúmina de la clara de huevo, la lactoalbúmina de la leche, la gliadina del grano de trigo y la hordeina de la cebada, constituyen la reserva de aminoácidos. Función REGULADORA Algunas proteínas regulan la expresión de ciertos genes y otras regulan la división celular (como la ciclina). 71
Aminoácidos Pi Primera Parte
 Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
Proteínas Aminoácidos Pi Primera Parte 1 Introducción a proteínas Las proteínas están constituidas básicamente por unidades elementales (monómeros) denominadas aminoácidos. Hay 20 aminoácidos diferentes,
inactivación de materiales tóxicos o peligrosos, etc.).
 Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Proteínas Estructuras 1 Conceptos generales Las proteínas desempeñan papeles cruciales en prácticamente todos los procesos biológicos. El alcance de sus funciones es enorme, por un lado, forman parte de
Los monómeros de las proteínas
 Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Las proteínas Los monómeros de las proteínas El carbono α de los aminoácidos es asimétrico y por eso pueden darse dos formas isoméricas que se distinguen como D y L. Los seres vivos sólo construyen a.a.
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH)
 Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Existen 20 aminoácidos diferentes y todos ellos tienen una parte común en su molécula que consisten en un grupo amino (NH3) y un grupo ácido, (COOH) como puede verse en el dibujo de los aminoácidos, que
Contenidos teóricos. Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente. Tema 3. Enzimas. Cinética y regulación.
 Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
Contenidos teóricos Unidad temática 1. Diseño molecular de vida. Tema 1. El agua como disolvente Tema 2. Principales biomoléculas presentes en los seres vivos y su relación estructura-función: proteínas,
TRABAJO SOBRE LAS PROTEÍNAS
 TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
TRABAJO SOBRE LAS PROTEÍNAS INDICE Concepto de Proteína Los Aminoácidos (clasificación y tipos, comportamiento químico) El Enlace Peptídico Estructura de las Proteínas Propiedades de las Proteínas Clasificación
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
PROTEÍNAS Son polímeros formados por la unión, mediante enlace peptídico, de monómeros llamados aminoácidos. Composición: C, H, O, N, S (P, Fe, Cu, I, ). FUNCIONES DE LAS PROTEÍNAS FUNCIONES DE LAS PROTEÍNAS
Existen más de 150 aminoácidos, aunque tan sólo 20 son aminoácidos proteicos. Todos ellos α.
 UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 6: PROTEÍNAS. 1.- CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS. - Son las biomoléculas orgánicas más abundantes en los seres vivos. - Químicamente están formadas por C, H, O, N y también pueden contener
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS
 UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
UNIDAD 5. AMINOÁCIDOS Y PROTEÍNAS Dr en C. MPA MVZ Carlos Gutiérrez Olvera AMINOÁCIDOS: Como su nombre lo implica, los aminoácidos son moléculas orgánicas que contienen un grupo amino (NH2) en uno de los
Biomoléculas PROTEÍNAS
 Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
Biomoléculas PROTEÍNAS Las proteínas son biomoléculas orgánicas, formadas por unidades menores llamadas aminoácidos. Son polímeros sintetizados a partir de la unión de varios monómeros a través de un enlace
PROTEÍNAS. Del griego proteion, primero
 PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEÍNAS Del griego proteion, primero Son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno (CHON). Pueden además contener azufre y en algunos tipos de proteínas, fósforo,
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEÍNAS Y AMINOÁCIDOS
 PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
PROTEÍNAS Y AMINOÁCIDOS Las proteínas son biomoléculas constituidas por C, H, O y N en su mayor parte. Son polímeros lineales de moléculas de α-aminoácidos, unidos por un enlace llamado enlace peptídico.
1º Bachillerato A Septiembre 2013
 1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
1º Bachillerato A Septiembre 2013 1. Aminoácidos 2. Enlace peptídico 3. Estructura de las proteínas (I) 4. Estructura de las proteínas (II) 5. Clasificación de las proteínas: homoproteínas 6. Clasificación
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
TEMA 4: LAS PROTEÍNAS 1. Características químicas y clasificación 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las
PROTEÍNAS : ESTRUCTURA Y FUNCIÓN
 COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
COLEGIO SAN FRANCISCO DEL ALBA DPTO BIOLOGÍA NIVEL: 4 MEDIO PROTEÍNAS : ESTRUCTURA Y FUNCIÓN PROFESORA: MARÍA JOSÉ ESCALONA. PROTEÍNAS (PROTEIOS= PRIMARIO) (C-H-O-N-S) Son biomoléculas esenciales para
Biomoléculas orgánicas III. Las proteínas
 Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
Biomoléculas orgánicas III Las proteínas Introducción Las proteínas son biomoléculas orgánicas formadas por Carbono, Hidrógeno, Oxígeno y Nitrógeno. En ocasiones aparecen Fósforo y Azufre. Su unidad básica
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS. A.- Concepto de prótidos y clasificación B.-Los aminoácidos
 TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
TEMA 5 BIOMOLÉCULAS ORGÁNICAS (III) PROTEÍNAS A.- Concepto de prótidos y clasificación B.-Los aminoácidos Estructura química y funciones Propiedades químicas. El enlace peptídico C.- Estructura tridimensional
AMINOÁCIDOS Y PROTEÍNAS
 4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
4/6/15 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS Grupo carboxilo Grupo amino Carbono α Cadena Lateral Ión dipolar o zwitterión Las proteínas tienen L-aminoácidos
Programa de Acceso Inclusivo, Equidad y Permanencia PAIEP U. de Santiago. Biología. Proteínas.
 Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
Proteínas. Los monómeros de las proteínas son veinte aminoácidos, donde 9 de estoss aminoácidos son esenciales, ya que no son producidos por nuestro organismo, por lo tanto deben ser adquiridos a través
AMINOACIDOS. Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 12/04/2012
 AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
AMINOACIDOS Aminoácidos: Moléculas orgánicas sencillas, que representan la unidad estructural de las proteínas. 1 FORMULA GENERAL H átomo carbono α grupo amino NH 2 C COOH grupo carboxilo R cadena lateral
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS INDICE 1. CARACTERÍSTICAS GENERALES DE LAS PROTEÍNAS 2. AMINOÁCIDOS 1. PROPIEDADES DE LOS AMINOÁCIDOS 2. CLASIFICACIÓN DE LOS AMINOÁCIDOS 3. EL ENLACE PEPTÍDICO 4. ESTRUCTURA DE LAS
TEMA 4: LAS PROTEÍNAS
 TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
TEMA 4: LAS PROTEÍNAS 1. Características generales 2. Aminoácidos: estructurara y propiedades 3. Los péptidos y las proteínas: propiedades químicas y estructurares 4. Clasificación de las proteínas 5.
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
Actividades de las proteínas Tema 1
 Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Actividades de las proteínas Tema 1 parte 4 BLOQUE 1: TEST 1. La triple hélice de colágeno es una estructura: a) Lámina beta b) Secundaria c) Alfa hélice d) Cuaternaria 2. La acción tampón de un aminoácido
Proteinas. Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia
 Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
Proteinas Professor: Verónica Pantoja. Lic. MSP. Técnico en masoterapia CARACTERÍSTICAS Contienen carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); y casi todas también poseen azufre (S). Son BIOPOLÍMEROS:
QUÍMICA DE LAS BIOMOLÉCULAS
 QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
QUÍMICA DE LAS BIMLÉCULAS AMINÁCIDS Y PRTEÍNAS Tema 11: Aminoácidos Tema 12: Proteínas A - Z Unidad 5: Aminoácidos y Proteínas Veterinaria AMINÁCIDS H 2 N CH C R H CLASIFICACIÓN: 1- AMINÁCIDS MNAMIN-MNCARBXÍLICS
Aminoácidos y Proteínas. Bioquímica Kinesiología UNLaM 2016
 Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
Aminoácidos y Proteínas Bioquímica Kinesiología UNLaM 2016 Proteínas Constituyen las moléculas orgánicas más abundantes de las células (50% del peso seco). Son macromoléculas, formadas por aminoácidos
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
U. D. 4 LAS PROTEÍNAS
 U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
U. D. 4 LAS PROTEÍNAS EL ALUMNO DEBERÁ CONOCER LAS UNIDADES O MONÓMEROS QUE FORMAN LAS MACROMOLÉCULAS BIOLÓGICAS Y LOS ENLACES DE ESTOS COMPONENTES, RECONOCER EN EJEMPLOS LAS CLASES DE BIOMOLÉCULAS Y LOS
Prof : Javier Cabello Schomburg, MS
 Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
Prof : Javier Cabello Schomburg, MS Las enzimas son biocatalizadores, quienes permiten la producción de las reacciones metabólicas Son especificas para cada reacción Las hormonas son sustancias producidas
PROTEINAS AMINOACIDOS
 PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PROTEINAS AMINOACIDOS 1 2 PROTEINAS Las proteínas son las moléculas constituyentes de los seres vivos que, además de ocupar el 50% del peso seco de los tejidos, tienen la máxima importancia por las funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS
 PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
PEPTIDOS Y PROTEINAS ESTRUCTURA Y CARACTERÍSTICAS CARACTERISTICAS En la célula o Estructura celular o Catálisis o ADN proteínas Macromoléculas abundantes La estructura tridimensional es única Funciones
Area Química Biológica Curso: Bioquímica. Tema 6: PROTEINAS. Dra. Silvia M. Varas
 Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
Area Química Biológica Curso: Bioquímica Tema 6: PROTEINAS Dra. Silvia M. Varas Las proteínas están formadas por unidades básicas que corresponden a los aminoácidos, los cuales se unen entre sí para formar
AMINOÁCIDOS. Funciones:
 AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
AMINOÁCIDOS Funciones: 1)Moléculas formadoras de las proteínas. 2)Precursores de vitaminas (β - alanina). 3)Intermediarios en las síntesis de otros aminoácidos. 4) Presentes en las paredes celulares de
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS
 EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
EJERCICIOS DE BIOQUÍMICA: PRÓTIDOS 1) Qué es un tetrapéptido?. Construye uno, formado por los siguientes aminoácidos: Ala, Cys, Ser y Tyr. 2) Haz corresponder los elementos de las dos columnas: -Cys -Hormona
PROTEÍNAS ESTRUCTURAS PRIMARIA, CUATERNARIA
 PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
PROTEÍNAS ESTRUCTURAS PRIMARIA, SECUNDARIA, TERCIARIA Y CUATERNARIA NIVELES DE ESTRUCTURACIÓN DE LAS PROTEÍNAS ESTRUCTURA PRIMARIA 1. Ordenamiento lineal de aminoácidos, en cadenas no ramificadas 2. Posición
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
Proteínas. Características generales
 Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas Características generales Son las macromoléculas más abundantes en las células. Constituyen hasta el 50% del peso. Forman moléculas específicas en cada especie, incluso entre individuos. Además,
Proteínas y Ácidos Nucleicos
 Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
Proteínas y Ácidos Nucleicos Mapa conceptual Biomoléculas. Biomoléculas inorgánicas: Moléculas que no presentan carbono en su estructura. Biomoléculas orgánicas: Moléculas que presentan carbono en su estructura.
NOMENCLATURA BASE + AZUCAR + FOSFATO: Base Azúcar Fosfatos Nucleótido Ac. nucleico
 NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
NUCLEOTIDOS Los nucleótidos están formados por una base orgánica unida a una azúcar la que tiene 1 a 3 grupos fosfatos. Las bases pueden ser Púricas: adenina y guanina; Pirimídicas: citocina, uracilo y
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4
 ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
ESTRUCTURA Y FUNCIÓN DE LAS PROTEÍNAS BIOLOGÍA SESIÓN 4 Creado bajo licencia Creative Commons AUTORES: Emilia Matallana Redondo Julia Yumbe Baca Biología SESIÓN 4 BIOLOGÍA Estructura Y Función De Las Proteínas
PROTEINAS AMINOÁCIDOS FUNCIONES DE LOS AMINOÁCIDOS
 PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
PROTEINAS Las proteínas son biomóleculas formadas básicamente por carbono, hidrógeno, oxígeno y nitrógeno. Pueden además contener azufre y en algunos tipos de proteínas, fósforo, hierro, magnesio y cobre
AMINOÁCIDOS y proteínas
 AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
AMINOÁCIDOS y proteínas La Luciferina es una proteína Marijose Artolozaga Sustacha, MSc Las proteínas son las macromoléculas biológicas más abundantes y variadas. Diferentes estructuras y funciones Las
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO
 IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
IV UNIDAD PROTEINAS Introducción al estudio de las Proteínas BIOQUIMICA DR. CAMONES MALDONADO 1 Las proteínas son biomóleculas formadas por C, H, O y N. Pueden además contener S. Se definen como polímeros
J. L. Sánchez Guillén. IES Pando - Oviedo Departamento de Biología y Geología
 J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
J. L. Sánchez Guillén IES Pando - Oviedo Departamento de Biología y Geología 1-GENERALIDADES Concepto: Las proteínas se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos,
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS
 TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
TEMA 2.- PROTEÍNAS. AMINOÁCIDOS Diversidad estructural y funcional de las proteínas. Aminoácidos: características estructurales y clasificación. Aminoácidos estándares y derivados. Aminoácidos esenciales
Proteínas Polímeros de aminoácidos ( resíduos) PM aa aprox 110 PM prot
 Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
Proteínas Polímeros de aminoácidos (50-2000 resíduos) PM aa aprox 110 PM prot 5000-200000 DiversasFunciones Estructurales (rígidas), Enzimas (más flexibles) Estructuras: primaria, secundaria, terciaria,
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS
 BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS LOS PRÓTIDOS Podemos definir a las proteínas como polímeros formados por la unión, mediante enlaces peptídicos, de moléculas de baja masa molecular llamadas
BIOMOLÉCULAS O PRINCIPIOS INMEDIATOS ORGÁNICOS LOS PRÓTIDOS Podemos definir a las proteínas como polímeros formados por la unión, mediante enlaces peptídicos, de moléculas de baja masa molecular llamadas
Estructura y propiedades de las proteínas
 Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Estructura y propiedades de las proteínas Matilde Julián Seguí Introducción Las proteínas son las macromoléculas biológicas más importantes. Hay gran variedad de proteínas y cumplen gran variedad de funciones
Composición: C, H, O, N, S (P, Fe, Cu, I, ).
 LOGO Composición: C, H, O, N, S (P, Fe, Cu, I, ). LAS PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS El C α es el del amino y el C 1 es el del carboxilo. GRUPO
LOGO Composición: C, H, O, N, S (P, Fe, Cu, I, ). LAS PROTEÍNAS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS ESTRUCTURA DE LOS AMINOÁCIDOS PROTEICOS El C α es el del amino y el C 1 es el del carboxilo. GRUPO
UNIVERSIDAD DEL QUINDÍO UNIDAD 4: PROTEÍNAS
 UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 4: PROTEÍNAS Las proteínas son biomóleculas formadas básicamente
UNIVERSIDAD DEL QUINDÍO ASIGNATURA: Bioquímica DOCENTE: Edwin David Morales Álvarez Correo Electrónico: davidmorales@uniquindio.edu.co UNIDAD 4: PROTEÍNAS Las proteínas son biomóleculas formadas básicamente
Tecnologías basadas en las proteínas. Nociones básicas sobre las proteínas
 Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
Tecnologías basadas en las proteínas Nociones básicas sobre las proteínas Contenido Nociones básicas sobre las proteínas Estructura de las proteínas: Primaria Secundaria Terciaria Cuaternaria Funciones
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA. CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA
 FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
FACULTAD DE QUÍMICA DEPARTAMENTO DE BIOQUÍMICA CURSO DE BIOQUÍMICA (CLAVE 1508) Licenciaturas de QFB y QA Prof. Laura Carmona Salazar Grupos: 09 Semestre: 14-I Este material es exclusivamente para uso
PROTEÍNAS. Lubert Stryer Jeremy M. Berg John L. Tymoczko Bioquimica (5. ed) Ed. Reverte. PROTEÍNAS generalidades
 PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
PROTEÍNAS Tema 1. Péptidos y proteínas: introducción general a proteínas. Funciones. Aminoácidos no proteicos. Enlace peptídico, características e importancia. Estructura de proteínas. Estructura primaria.
SERIE Nº 4. Aminoácidos, Péptidos y Proteínas
 SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
SERIE Nº 4. Aminoácidos Son sustancias que poseen por lo menos un grupo funcional amino (básico) y un grupo funcional carboxilo (ácido) unidos a un mismo átomo de carbono (carbono α), al que también se
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo griego
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica
 CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
CAPÍTULO 4 Y 5. AMINOÁCIDOS, PÉPTIDOS Y PROTEÍNAS Facultad de Agronomía Curso de Bioquímica INTRODUCCIÓN El término proteína fue utilizado por primera vez por el químico Gerardus Mulder en 1838. Vocablo
Composición química de la materia viva. Componentes orgánicos. Proteínas
 Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
Composición química de la materia viva. Componentes orgánicos. Proteínas Tema 1 parte 4 PROTEÍNAS: Concepto, clasificación (oligopéptidos, polipéptidos, holoproteínas, heteroproteínas). Aminoácidos: estructura
estructura primaria estructura secundaria estructura terciaria La estructura cuaternaria
 La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen
Estructura y función de proteínas
 Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
Estructura y función de proteínas Luciferina y uciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo, escamas, cuernos, lana, uñas y plumas.
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS
 DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
DEPARTAMENTO DE BIOQUÍMICA ESFUNO EUTM AMINOÁCIDOS Y PROTEÍNAS Biomoléculas Las moléculas de los sistemas biológicos estan compuestas principalmente por carbono, hidrógeno, oxígeno, nitrógeno, azufre y
Moléculas orgánicas. Proteínas y Lípidos
 Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
Moléculas orgánicas Proteínas y Lípidos PROTEINAS: Son moléculas formadas por O, C, H, y N. La mayoría también contiene S. Son macromoléculas formadas por monómeros (unidades) llamados aminoácidos, ya
Tema 5: aminoácidos y proteínas
 1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
1. Los aminoácidos 2. Propiedades de los aminoácidos 3. El enlace peptídico 4. Estructuras 1 aria y 2 aria de las proteínas 5. Estructuras 3 aria y 4 aria de las proteínas 6. Propiedades de las proteínas
PROTEINAS CITOESQUELETO AMINOACIDOS
 PROTEINAS CITOESQUELETO AMINOACIDOS 1 Constituyen, en nuestro estudio de la célula, el 3er. concepto químico funcional. Esta asociado en sus aspectos estructurales: - al citoesqueleto celular - a las fosfolipo-proteínas
PROTEINAS CITOESQUELETO AMINOACIDOS 1 Constituyen, en nuestro estudio de la célula, el 3er. concepto químico funcional. Esta asociado en sus aspectos estructurales: - al citoesqueleto celular - a las fosfolipo-proteínas
Quien determina sus propiedades químicas y biológicas es el grupo lateral R.
 PROTEÍNAS: Es un grupo de moléculas muy abundante en los seres vivos, constituyendo un promedio del 50% de su peso seco. Desempeñan diversas funciones biológicas, ya sean estructurales ya sea por estar
PROTEÍNAS: Es un grupo de moléculas muy abundante en los seres vivos, constituyendo un promedio del 50% de su peso seco. Desempeñan diversas funciones biológicas, ya sean estructurales ya sea por estar
a) Aminoácidos b) Estructura primaria
 Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
Estructura y función de proteínas a) Aminoácidos b) Estructura primaria Luciferina y luciferasa. Producción de luz. Hemoglobina. Transporte de oxígeno. Queratina: Principal componente estructural de pelo,
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
CLASIFICACION POR LA CADENA LATERAL POR SU REQUERIMIENTO POR SU POLARIDAD. Esenciales No esenciales CADENA LATERAL CON GRUPO
 AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
AMINOACIDOS Y PEPTIDOS Licda. Lilian Judith Guzmán Melgar 2016 29 AMINOACIDOS Compuestos que contienen un grupo carboxílico y un grupo amino. Los más importantes en el mundo biológico son los α-aminoácidos,
Soluciones del EXAMEN 2º BCHTO TEMAS LÍPIDOS Y PROTEÍNAS
 Soluciones del EXAMEN 2º BCHTO TEMAS LÍPIDOS Y PROTEÍNAS 1.- Los lípidos: a) Qué significa que los ácidos grasos son moléculas anfipáticas? Cómo se comportan estas moléculas en agua? Los ácidos grasos
Soluciones del EXAMEN 2º BCHTO TEMAS LÍPIDOS Y PROTEÍNAS 1.- Los lípidos: a) Qué significa que los ácidos grasos son moléculas anfipáticas? Cómo se comportan estas moléculas en agua? Los ácidos grasos
Aminoácidos. Los aminoácidos se agrupan en la figura según las propiedades de sus cadenas
 Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Aminoácidos Es esencial tener un conocimiento básico acerca de la química de las proteínas, para entender la nutrición y otros conceptos del metabolismo. Las proteínas se componen de carbono, hidrógeno,
Proteínas. Cual es la gracia? KEVLAR. polímeros biológicos es su versatilidad para formar una gran variedad estructuras con funciones especializadas.
 Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Estructura de Proteínas KEVLAR Dr. Mauricio Baez mauricio.baez@ciq.uchile.cl uchile cl Laboratorio de Bioquímica Facultad de Ciencias Químicas y Farmacéuticas Universidad de Chile Proteínas. Co-polímeros
Es una estructura determinada por la cadena polipeptídica de la estructura primaria.
 Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
Es una estructura determinada por la cadena polipeptídica de la estructura primaria. Se refiere a el plegamiento de los dominios y a la disposición final de los dominios en el polipéptido. Los dominios
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
Introducción al estudio de las proteínas
 Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Introducción al estudio de las proteínas ESQUEMA - Concepto de Proteína. Características - Clasificación de las proteínas - Funciones de las proteínas - Proteínas conjugadas - Niveles de organización estructural
Tema 4. Proteínas. Contenidos: Criterios de evaluación mínimos: CONCEPTOS ACORDADOS PARA LA PAEG EN LA UCLM. Proteínas:
 Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
Tema 4. Proteínas Contenidos: 1. Características químicas y clasificación general. 2. Aminoácidos. 1. Clasificación. 2. Propiedades. 3. Enlace peptídico. 3. Péptidos y proteínas. 1. Estructura de las proteínas.
puentes de hidrogeno enlaces covalentes Interacciones no-covalentes PUENTE DE HIDROGENO fuerte puente de hidrogeno menos fuerte puente de hidrogeno
 PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
PUENTE DE HIDROGENO enlaces covalentes puentes de hidrogeno fuerte puente de hidrogeno menos fuerte puente de hidrogeno electrones igualmente compartidas Orientación espacial importante en interacciones
Características generales y funciones.
 1.6.-Proteínas 1.6.1.- Características generales y funciones. Todas las proteínas contienen C, H, O y N, además la mayoría contienen S y algunas P, Fe, Zn y Cu. Las proteínas constituyen el grupo de moléculas
1.6.-Proteínas 1.6.1.- Características generales y funciones. Todas las proteínas contienen C, H, O y N, además la mayoría contienen S y algunas P, Fe, Zn y Cu. Las proteínas constituyen el grupo de moléculas
QUÍMICA DE PROTEÍNAS
 QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
QUÍMICA DE PROTEÍNAS ORGANIZACIÓN ESTRUCTURAL Se han descrito cuatro niveles en la estructura de las proteínas: 1. Primaria. Se refiere a la secuencia en que están unidos los aminoácidos, formando cadenas
AMINOÁCIDOS 3B EXPLIQUE EL COMPORTAMIENTO DEL ACIDO ASPARTICO A UNA SOLUCION CON PH DE 8
 AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
AMINOÁCIDOS 1A EXPLIQUE LOS AMINOACIDOS GLUCOCETOGENICOS Los aminoácidos glucocetogénicos son aquellos que producen acetil-coenzima A que posteriormente ayudara en la formación de lípidos, y los intermediarios
Las proteínas son las moléculas orgánicas más abundantes en las células, más del 50% del
 LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
LAS PROTEÍNAS CONCEPTO Y CARACTERÍSTICAS Concepto: Se pueden definir como polímeros formados por la unión, mediante enlaces peptídicos, de unidades de menor masa molecular llamadas aminoácidos. Son moléculas
Licenciatura en Ciencias Biológicas LABORATORIO Nº 3. Proteínas
 LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
LABORATORIO Nº 3 OBJETIVOS * Reconocer los que tipos de aminoácidos están presentes en una proteína mediante reacciones específicas. * Comprobar los distintos factores que pueden desnaturalizar a una proteína.
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo α-carboxilo de aá 1 Grupo α-amino de aá 2 Se libera agua CO NH Carbono α Extremo
L/O/G/O BIOQUÍMICA II
 L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
L/O/G/O BIOQUÍMICA II Objetivos Contenidos Niveles estructurales de una proteína Relación entre estructura y función 11/10/2011 Ing. Karla Dávila Estructura primaria La estructura primaria, se refiere
Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de
 Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
Polímeros Naturales Los polímeros naturales están presentes en sustancias como la celulosa, el caucho natural y la seda, pero su mayor relevancia está al interior de nuestro propio cuerpo y se denomina
LAS PROTEÍNAS. Fórmula general
 LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por
 PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S Por su naturaleza química
Conceptos básicos de biología molecular, I
 Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
Dr. Eduardo A. RODRÍGUEZ TELLO CINVESTAV-Tamaulipas 21 de mayo del 2013 Dr. Eduardo RODRÍGUEZ T. (CINVESTAV) Conceptos básicos de biología molecular 21 de mayo del 2013 1 / 28 1 Introducción Tarea Dr.
PROTEÍNAS AMINOÁCIDOS
 PROTEÍNAS Se trata de las biomoléculas más abundantes. Están constituidas mayoritariamente por C, H, O, N, que se organizan en monómero llamados aminoácidos. AMINOÁCIDOS Los aminoácidos se constituyen
PROTEÍNAS Se trata de las biomoléculas más abundantes. Están constituidas mayoritariamente por C, H, O, N, que se organizan en monómero llamados aminoácidos. AMINOÁCIDOS Los aminoácidos se constituyen
LAS PROTEÍNAS LOS AMINOÁCIDOS
 LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
LAS PROTEÍNAS Las proteínas: Los aminoácidos introducción. Propiedades. Actividad óptica y Comportamiento químico. Carácter anfótero. Clasificación de los aminoácidos proteicos. El enlace peptídico. Estructura
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO
 LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
LAS PROTEINAS: ESTRUCTURA Y PLEGAMIENTO ESTRUCTURA Y FUNCION DE LAS PROTEINAS. Las proteínas son polímeros de aminoácidos unidos por uniones amida, llamadas uniones peptídicas. La cadena polipéptídica
AMINOÁCIDOS, PEPTIDOS Y PROTEÍNAS. Profesor Carlos Urzúa Stricker
 AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
AMINÁIDS, PEPTIDS Y PRTEÍNAS Profesor arlos Urzúa Stricker H 3 N AMIN AIDS: BLQUES DE NSTRUIÓN DE LAS PRTEÍNAS Químicamente los aminoácidos son ácidos carboxílicos que poseen un grupo amino. H R H 3 N
PROTEÍNAS. Son las moléculas orgánicas más abundantes en la células (más del. 50% del peso seco). Están compuestas por aminoácidos.
 TEMA 4 PROTEÍNAS PROTEÍNAS Son las moléculas orgánicas más abundantes en la células (más del 50% del peso seco). Están compuestas por aminoácidos. AMINOÁCIDOS Los aminoácidos están compuestos por H C O
TEMA 4 PROTEÍNAS PROTEÍNAS Son las moléculas orgánicas más abundantes en la células (más del 50% del peso seco). Están compuestas por aminoácidos. AMINOÁCIDOS Los aminoácidos están compuestos por H C O
Proteínas y Enzimas. 1ª Parte: Proteínas. Tema 11 de Biología NS Diploma BI Curso
 Proteínas y Enzimas 1ª Parte: Proteínas Tema 11 de Biología NS Diploma BI Curso 2012-2014 Proteínas Grupo de moléculas orgánicas más abundantes de los seres vivos (50% del peso celular seco), formadas
Proteínas y Enzimas 1ª Parte: Proteínas Tema 11 de Biología NS Diploma BI Curso 2012-2014 Proteínas Grupo de moléculas orgánicas más abundantes de los seres vivos (50% del peso celular seco), formadas
 Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Aminoácidos I Br. Cecilia López Área Bioquímica Departamento de Biología Molecular y Celular Marzo 2012 Aminoácidos Proteínas Neurotransmisores (GABA, dopamina) Mediadores de la inflamación (Histamina)
Proteínas y Enzimas. 1ª Parte: Proteínas. Tema 10 de Biología NS Diploma BI Curso
 Proteínas y Enzimas 1ª Parte: Proteínas Tema 10 de Biología NS Diploma BI Curso 2013-2015 Proteínas Grupo de moléculas orgánicas más abundantes de los seres vivos (50% del peso celular seco), formadas
Proteínas y Enzimas 1ª Parte: Proteínas Tema 10 de Biología NS Diploma BI Curso 2013-2015 Proteínas Grupo de moléculas orgánicas más abundantes de los seres vivos (50% del peso celular seco), formadas
TEMA 3A Las proteínas (Tiempo estimado: 3 sesiones)
 TEMA 3A Las proteínas (Tiempo estimado: 3 sesiones) 1. LAS PROTEÍNAS: CARACTERÍSTICAS Las proteínas están constituidas básicamente por carbono, hidrógeno, oxígeno y nitrógeno, aunque pueden contener también
TEMA 3A Las proteínas (Tiempo estimado: 3 sesiones) 1. LAS PROTEÍNAS: CARACTERÍSTICAS Las proteínas están constituidas básicamente por carbono, hidrógeno, oxígeno y nitrógeno, aunque pueden contener también
Estructura tridimensional de las proteínas
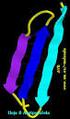 Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Estructura tridimensional de las proteínas CAPITULO 4 Biochemistry 6th Edition Campbell and Farrell NATURALEZA DE LAS PROTEINAS Proteínas Son polímeros de amino ácidos unidos por un enlace peptídico. El
Proteínas. Marijose Artolozaga Sustacha, MSc
 Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
Proteínas Marijose Artolozaga Sustacha, MSc Proteínas: Son polímeros de aminoácidos unidos por ENLACES PEPTÍDICOS: Grupo a-carboxilo de aá 1 Grupo a-amino de aá 2 Se libera agua CO NH Carbono a Extremo
