UTILIZACION DE ISOENZIMAS COMO MARCADORES MOLECULARES EN EL ESTUDIO DE LA VARIABILIDAD DE FRUTOS NATIVOS
|
|
|
- Arturo Miguel Ángel Ayala Velázquez
- hace 7 años
- Vistas:
Transcripción
1 Universidad de la República FACULTAD DE CIENCIAS UTILIZACION DE ISOENZIMAS COMO MARCADORES MOLECULARES EN EL ESTUDIO DE LA VARIABILIDAD DE FRUTOS NATIVOS TESINA DE GRADO Licenciatura en Bioquímica por Ana Claudia Othaix D'Angelo 2012 Tutoras: Mag. Qca. Gabriela Ferragut Mag. Qca. María Angélica Severi Laboratorio de Inmunología, Dr. Alberto Nieto - Salto. Regional Norte CenUR Noroeste Universidad de la República SALTO URUGUAY
2 AGRADECIMIENTOS Son tantas personas a las cuales debo parte de este logro que si las nombrara a todas seguramente duplicaría las páginas de este trabajo. Quiero dedicar esta tesis a todos los que creyeron en mí, a toda la gente que me apoyó, me alentó y me tuvo paciencia! A mis queridos padres que me respaldaron todo el tiempo, a mis hermanos, hermosos sobrinos, cuñados, tíos y primos que tan importantes son para mi. A mis queridos vecinos que tanto me apoyaron en un momento muy difícil y a todas mis adoradas amigas, las de 19 de abril que siempre están para alentar en los momentos de cansancio, las Coelho que me brindaron un lugar tranquilo para estudiar y que siempre están dispuestas a ayudarme, Julia que tantas veces se cruzó Montevideo para solucionarme los trámites en la facultad, Vero, Nati, Ana, Ale, Tico, Pata, Flor, Andrés, el Gordo... que sé, disfrutan tanto como yo este momento, a Lucha y Quique mi soporte informático, a Víctor que todos los lunes salía a juntarme hojas de naranjos! a mis compañeros de la Veterinaria y mis jefes que me permitían manejar mis horarios para que pudiera ir al laboratorio, y, sin dudas, a mis tutoras Gabriela y Magela que me impulsaron a lograr mis objetivos y que más de una vez quedaron sin almorzar para cubrir mis horarios, a la Sra. Ing. Agr. Beatriz Vignale quien tan amablemente nos proveyó del material necesario para este estudio y al Prof. Mario Caro que además de ser la base teórica de mi trabajo fue una fuente de inspiración y seguramente a muchos más que me estoy olvidando en este momento. A todos los que me conocen...
3
4 INDICE Pág. ABREVIATURAS... 1 RESUMEN INTRODUCCIÓN Frutos Nativos Fundamentación del trabajo Isoenzimas Electroforesis SGE PAGE MATERIALES Y MÉTODOS Material Vegetal Material de laboratorio Aparatos y equipos Reactivos y soluciones Recolección y conservación de muestras vegetales Electroforesis en geles de almidón Método de extracción de muestras para geles de almidón Preparación de geles de almidón Siembra en geles de almidón Corrida en geles de almidón Electroforesis en geles de poliacrilamida Método de extracción de muestras para geles de poliacrilamida 30 Preparación de los geles de poliacrilamida Siembra en geles de poliacrilamida Corrida en geles de poliacrilamida Revelado ACP: fosfatasa ácida EST: estearasa PRX: peroxidasa ALP: fosfatasa alcalina... 34
5 2.7 Conservación de geles de almidón RESULTADOS Preparación de muestras para SGE Método de extracción de muestras para SGE Estudio de la influencia de la edad de la hoja utilizadas en SGE 36 Estudio del tiempo de vida útil de las hojas luego de ser colectadas, para SGE Preparación de geles de almidón Tiempo de calentamiento de los geles de almidón Método de siembra en SGE Estudio de las condiciones de corrida en SGE Elección del buffer de corrida para SGE Estudio de la concentración de los geles de almidón Estudio de distintas variedades de Plantas Nativas por SGE Revelado con Fosfatasa Ácida Revelado con Fosfatasa Alcalina Revelado con Peroxidasa Revelado con Estearasa Preparación de muestras para PAGE Método de extracción de muestras para PAGE Estudio del método de conservación de la extracción vegetal para PAGE Elección del buffer de extracción para PAGE Tiempo de vida útil de las hojas luego de ser colectadas para PAGE Determinación del volumen de siembra Preparación de geles de poliacrilamida Estudio de la concentración de geles de poliacrilamida Elección del buffer de corrida para PAGE Uso de diferentes sistemas enzimáticos para el estudio de Plantas Nativas por PAGE DISCUSIÓN Condiciones de trabajo para la realización de SGE Condiciones de trabajo para la realización de PAGE... 70
6 5 CONCLUSIÓN BIBLIOGRAFÍA ANEXOS. 80
7 ABREVIATURAS ACP: fosfatasa ácida ALP: fosfatasa alcalina BC: buffer de corrida BE: buffer de extracción E.E.F.A.S.: Estación Experimental de Facultad de Agronomía de Salto EST: estearasas GOT: aspartato aminotransferasa o transaminasa glutámico-oxalacética Hk: hexoquinasa IDH: Isocitrato deshidrogenasa MDH: malato deshidrogenasa ME: enzima málica PAGE: electroforesis en geles de poliacrilamida PGM: fosfoglucomutasa PRX: peroxidasa. PVP: polivinilpirrolidona SDS: duodecil sulfato de sodio SGE: electroforesis en geles de almidón SkDH: sikimato deshidrogenasa TEMED: N, N, N', N'-tetrametiletilendiamina TMBZ: tetrametilbenzidina NaOH: hidróxido de sodio HCl: ácido clorhídrico 1
8 RESÚMEN De las 3600 especies de Mirtáceas conocidas, existen en nuestro país unas 30 especies que representan una población importante de nuestra flora leñosa, principalmente al norte del Uruguay. Muchas de ellas son conocidas por su importancia económica como productoras de aceites, especias, madera, leña, pulpa de celulosa, etc., y otras varias especies comestibles llamadas comúnmente Frutos Nativos. Se ha producido recientemente un impulso en el estudio y mejoramiento de éstas últimas, en el que se encuentran involucrados varios organismos e instituciones como ser INIA, Facultad de Química, Facultad de Agronomía, MGAP, Intendencias, etc.; debido no solo a que sus frutos son muy apetecibles, de sabor y aroma exótico, sino también a su alto valor nutritivo y potencial uso medicinal. Teniendo en cuenta que no se ha logrado aún el desarrollo de cultivos comerciales de primer nivel, como ocurre con otras especies frutales domesticadas, es que surge la necesidad de caracterizarlos y de realizar estudios que permitan conocer el material del que se dispone. Es por ello que se propone la caracterización de estos Frutos Nativos que sirva como complemento al estudio general de estas plantas de interés. Dentro de las Mirtáceas frutícolas que se van a estudiar se encuentran el Guayabo del país (Acca sellowiana (Berg.) Burret), la Pitanga (Eugenia uniflora L.), el Arazá (Psidium cattleianum Sab.), el Guaviyú (Myrcianthes pungens (Berg.) Legr.) y el Ubajay (Hexachlamys edulis (Berg.) Legr. et Kaus.). En el presente trabajo se planteó caracterizar los Frutos Nativos utilizando isoenzimas como marcadores moleculares a partir de extractos acuosos preparados a partir de hojas. Tomando como antecedente los estudios realizados en citrus con un objetivo similar y utilizando como herramientas para la caracterización la electroforesis en geles de almidón, técnica sencilla, eficiente, práctica y rápida, de relativo bajo costo y accesibilidad para la evaluación molecular. Si bien se ajustaron los parámetros de la electroforesis a las condiciones de laboratorio y a las especies en estudio, a diferencia de lo encontrado para citrus no se logró un patrón de bandas definido para las especies nativas. Por esto se comenzaron ensayos en geles de poliacrilamida dado su mayor poder de resolución obteniéndose algunos resultados preliminares prometedores. 2
9 1. INTRODUCCIÓN 1.1 Frutos Nativos En Uruguay existe una amplia gama de Plantas Nativas, dentro de las que se incluyen numerosas especies frutales comestibles de las que no existe una tradición de consumo o de comercialización sino solo un aprovechamiento doméstico y en forma estacional. Dentro de éstas se encuentran varias especies frutícolas subtropicales de la familia de las Mirtáceas. Una especie es nativa de una zona cuando su presencia como integrante de la vegetación natural no obedece a la introducción por parte del hombre.[1] La familia Myrtaceae está constituida por más de 100 géneros y 3600 especies, compuesta por plantas leñosas arbustivas o arbóreas perennes con árboles de hasta 100 metros de altura. Presentan hojas simples de márgenes enteros, opuestos o alternos y de forma variada. Se divide en dos subfamilias: (1) Leptospermoideae, ampliamente distribuida en Australia incluye los géneros Eucalyptus, Leptospermum y Melaleuca y (2) la subfamilia Mirtoideae, principalmente de América y Asia tropical es un importante componente de nuestra flora arbórea con 30 especies fundamentalmente del norte del país lo cual es muy apreciable en relación a la escasa flora leñosa del Uruguay. Algunos géneros nativos son Blepharocalyx Berg, Myrcianthes Berg, Eugenia L., Campomanesia Ruiz et Pavón, Psidium L., Calyptranthes Sw., Myrceugenia Berg, etc. Muchas de estas especies tienen importancia económica, como productoras de aceites (esencias), especias, madera, leña, pulpa de celulosa, frutas, etc..[2] Dentro de las Mirtáceas frutícolas se encuentran el Guayabo del país (Acca sellowiana (Berg.) Burret), la Pitanga (Eugenia uniflora L.), el Arazá (Psidium cattleianum Sab.), el Guaviyú (Myrcianthes pungens (Berg.) Legr.) y el Ubajay (Hexachlamis edulis (Berg.) Legr. et Kaus.). Actualmente estas plantas nativas se encuentran en forma silvestre fundamentalmente en la región Norte del país y cultivadas en parques, huertas y jardines familiares en forma dispersa en varias regiones. Existen también, aunque únicamente de 3
10 Guayabo del país, algunas plantaciones comerciales en la zona sur.[3] Acca sellowiana, GUAYABO DEL PAIS : originario del sur de Brasil y de la región noreste de Uruguay se halla presente además en el norte de Argentina y Chile, Bolivia y sur del Perú. En nuestro país habita serranías y quebradas de Rivera, Tacuarembó, Cerro Largo, este de Artigas y Salto y norte de Treinta y Tres, actualmente, se lo encuentra también en la región frutícola del sur, como ser en Maldonado y Canelones.[1] Se han encontrado ejemplares de más de 100 años de edad hasta plantaciones jóvenes con una gran variedad genética. Los ejemplares difieren en características de forma, color y vigor del árbol, hábito de crecimiento, densidad de ramas, tipo y color de hojas, forma, tamaño y color de los frutos, calidad interna, época de madurez. A su vez se han evaluado diferencias importantes a nivel productivo.[3] La fruta es comestible y tiene un valor nutricional muy importante por su alto contenido en vitamina C (35mg/100g en la pulpa, comparable con la naranja) y en Yodo 3mg/100g), también se usa con fines ornamentales y como fuente de compuestos medicinales.[2] Eugenia uniflora, PITANGA : especie común en zonas tropicales y subtropicales del noroeste de Argentina, sur de Brasil (desde Minas Gerais hasta Rio Grande do Sul) y Uruguay, escasas en Paraguay. En Uruguay su hábitat y distribución geográfica es sobre el Río Uruguay y sus afluentes, desde Artigas hasta Colonia, Cerro Largo, Durazno, Tacuarembó, Treinta y Tres y Rivera. En los departamentos del sur se encuentran asilvestradas. Habita diferentes tipos de bosques (serranos, ribereños, de quebradas y cerros chatos), tanto a la sombra como a pleno sol.[1] Presenta una gran diversidad genética, con diferencias a nivel vegetativo, productivo y de calidad de la fruta. Las plantas muestran gran adaptación, buen desarrollo y sanidad. Ofrece gran variabilidad en color de la fruta y gran diversidad de sabores.[3] Hexachlamys edulis, UBAJAY : Disperso por América del Sur tropical y subtropical. Se encuentra en estado silvestre sólo en los montes ribereños del litoral oeste del país, ubicados en las orillas del Río Uruguay y afluentes en Artigas, Paysandú, Río Negro, Salto y Soriano.[1] Presenta una buena adaptación a nuevas condiciones, gran desarrollo, son precoces y dan una buena producción. Tiene una alta variabilidad pero la mayoría no tiene las 4
11 características deseadas para la fruta en cuanto a sabor, aroma y textura.[3] La fruta es comestible y aporta vitaminas, el árbol es usado como productor de madera y las flores se utilizan para extraer aceites esenciales.[4] Myrcianthes pungens, GUAVIYÚ : Presente en la zona norte de nuestro país, también es nativo de Argentina y Sur de Brasil, en los bosques ribereños de las cuencas de los ríos Paraná y Uruguay. Dentro de nuestro país habita la zona de bosques ribereños de quebradas de Rivera, Tacuarembó en el noroeste, y todo el litoral oeste desde Artigas hasta Río Negro. También presentes en Cerro Largo y Treinta y Tres. Tienen una gran variabilidad y diferente comportamiento en cuanto a vigor, hábito de crecimiento, densidad de ramas, floración, cuajado y resistencia a enfermedades. No son precoces en cuanto a la producción, observándose los primeros frutos recién al cuarto año de plantación.[3] La fruta es comestible y aporta vitaminas, también se usa como planta ornamental.[4] Psidium cattleianum, ARAZÁ : originario de Uruguay, Argentina y Sur de Brasil. Habita una extensa zona del litoral de Brasil llegando escasamente a la región serrana de nuestro país. En Uruguay ha sido colectado en forma silvestre en Treinta y Tres, habitando sierras, orillas de bañados y arenales, y en Rocha en cerros próximos a Brasil. Se han observado dos tipos, de frutos rojos y de frutos amarillos, solo el rojo es nativo. Presentan muy baja variabilidad y alta adaptación a nuestras condiciones tal que no requieren mayor cuidado. Los frutos maduros desarrollan un alto nivel de aroma, alto contenido de azúcar y baja acidez, lo que los hace especialmente apetecibles en estado fresco, igualmente son muy usados para la preparación de mermeladas, jugos y como aromatizantes. Presentan muy buena sanidad tanto de planta como en fruta.[3] La fruta constituye una fuente natural de compuestos antioxidantes, los cuales inciden en la disminución del riesgo de cáncer y enfermedades cardiovasculares.[3,4] 5
12 Cuadro 1.1 Características de los Frutos Nativos estudiados. Nombre común Nombre científico Planta Filotaxia * Guayabo del país Acca sellowiana Arbusto o árbol pequeño que oscila entre 1-4 metros. simples opuesta ovales-coriáceas envés blanco plateado, hay verde oscuro Pitanga Ubajay Arazá Guaviyú Eugenia uniflora Desde arbusto a árbol pequeño. simples opuestas elípticas brillantes Hexachlamys edulis Árbol muy ramificado de 4-8 metros de altura. Follaje persistente o semicaduco. simples opuestas elípticas lanceoladas levemente discoloras Psidium cattleianum Arbusto de 2-4 metros. Tronco liso descamante. Perenne. simples opuestas obovadas coriáceas a crasas Myrcianthes pungens Árbol perenne Alcanza una altura importante. simples opuestas ápice punzante Flores solitarias vistosas 4 sépalos y 4 pétalos carnosos numerosos estambres rojos filamentosos pequeñas blancas tetrámeras 4 pétalos y 4 sépalos axilares color crema pentámeras floración muy abundante Blancas pentámeras solitarias 4 pétalos numerosos estambres Época de floración fines primavera principios verano fines invierno primavera principio primavera primavera verano primavera Época de fructificación fines veranootoño fines primaveraverano fines primaveraverano verano-otoño verano-otoño Fruto verde en madurez baya ovoidea rojo o morado baya globosa con costillas 2cm diámetro baya drupácea amarilla baya roja esférica y baya amarilla baya esférica violeta * Fotos tomadas en predio de E.E.F.A.S., en el marco del 5to Encuentro Nacional sobre Frutos Nativos, realizado en Marzo de 2010, en Regional Norte, Sede Salto, de la Universidad de la República. 6
13 En el Cuadro 1.1, aportado por la docente de Botánica, del Departamento de Biología Vegetal de Facultad de Agronomía, de Regional Norte Prof. Silvia González, se muestran algunas de las características de los frutos en cuestión. Desde hace algunos años ha aumentado el interés por estas especies debido no solo a que sus frutos son muy apetecibles, con un alto valor nutritivo y potencial uso medicinal, contribuyendo a una dieta saludable y rica en vitaminas, minerales, pigmentos y antioxidante, sino a que su sabor y aroma exótico los vuelven muy prometedores a la hora de diversificar y diferenciar la oferta de frutas en el mercado. [3] En países tales como Nueva Zelanda, Japón, Colombia, etc., se han desarrollado, desde ya hace varios años, programas de mejoramiento y cultivos comerciales de Guayabos del país, tanto para consumo interno como para exportación, a partir de material colectado en nuestro país hace más de un siglo atrás.[1,3,5] En nuestro país se desarrollan actualmente múltiples programas y proyectos que involucran diversos organismos e instituciones como ser INIA, Facultad de Química, Facultad de Agronomía, MGAP, Intendencias, escuelas y a la población en general, para el estudio de Frutos Nativos. Existe un grupo de estas especies de plantas nativas frutícolas que la Facultad de Agronomía viene estudiando con el fin de domesticarlas, seleccionarlas y mejorarlas genéticamente para llegar a lograr su producción a nivel de cultivo comercial.[3] Para su estudio, la Facultad de Agronomía, INIA y la Dirección de Montes Nativos del MGAP realizaron una prospección de materiales en parques, jardines, quintas frutales y áreas silvestres, en diferentes regiones del país. Una colección, de esta prospección, se instaló en la Estación Experimental de Salto de Facultad de Agronomía, una segunda en INIA Las Brujas y la tercera en el Centro Regional Sur. En estos centros se estudian las características de adaptación de las especies al cultivo sistematizado (sobrevivencia, crecimiento vegetativo, enfermedades), fenología 7
14 vegetativa y reproductiva, producción (número y peso de las frutas, alternancia productiva) y calidad de la fruta (calibre, color, firmeza, % y características de la pulpa, número de semillas, sólidos solubles, acidez, etc.).[3] Además, en estas colecciones, se evalúan parámetros de adaptación a suelos del Sur del país, como así también las ondas de crecimiento y las diferente fases de desarrollo de las especies.[3] Complementariamente con este programa se desarrolló el proyecto de investigación: Primer estudio sistemático de las poblaciones de Acca sellowiana (Berg.) Burret. como recurso genético, iniciado en el 2005, bajo la responsabilidad de la Ing. Agr. Dra. Clara Pritsch. Con el objetivo de evaluar la diversidad genética dentro de una muestra de materiales uruguayos seleccionados por su alto potencial agronómico, contrastando con materiales seleccionados de Brasil y Nueva Zelanda, mediante el uso de marcadores RAPDs (Amplificación aleatoria del ADN polimórfico). En el marco de este proyecto, en abril 2006, el Departamento de Producción Vegetal de Facultad de Agronomía realizó una primera degustación y encuesta sobre Guayabos del país que, dado que no se contaba con demasiada cantidad de fruta, solo se realizó en la misma facultad, abierto a estudiantes, docentes y funcionarios. En total se hicieron 95 degustaciones/encuestas de lo que resultó que el 43% de los encuestados no conocían la fruta, dentro de los cuales el 20% de ellos la encontró deliciosa y el 63% buena.[3] También se están realizando estudios en INIA para la Caracterización Nutricional de material seleccionado de Frutos Nativos en Pitanga, Arazá, Guayabo del país y Guaviyú, dadas sus buenas propiedades en relación a la salud, extracción de pigmentos y cosmética. Dentro de las cualidades más enfatizadas se encuentran el contenido de polifenoles y la capacidad antioxidante. El nivel de fenoles y capacidad antioxidante, al igual que otras características de la fruta, es influenciado por factores pre y poscosecha, por el genotipo, el estado de madurez y la temperatura de almacenamiento de la fruta.[6] El Plan de Soberanía Alimentaria del departamento de Treinta y Tres (dentro del Proyecto de materiales autóctonos de la Intendencia Municipal de este departamento) busca 8
15 contribuir al desarrollo local sustentable del departamento a través de varios programas y proyectos que trabajen conjuntamente, como ser el Programa de rescate y recuperación de recursos genéticos locales (Banco popular de semillas criollas), Desarrollo de sistemas de agricultura ecológica, Programa de responsabilidad, calidad e inocuidad alimentaria y capacitación en escuelas, entre otros. En mayo del 2003 se creó el Grupo CAA-OBETI, en pro de la conservación del monte nativo, asociación laica y sin fines de lucro dedicada al estudio y preservación de la flora nativa, a la difusión de conocimientos sobre la misma y a la acción concreta de plantar árboles nativos, prestar asesoramiento a escuelas, instituciones, etc.. Se instalaron además Quintas frutales orgánicas, con el fin de proveer de elementos que sirvan al maestro y al escolar para la enseñanza y para proveer de frutas a las escuelas. En el año 2006 se instaló un monte experimental en el CAF (Centro Agustín Ferreiro) en Canelones, con especies tradicionales como naranja, durazno, higuera, etc. y especies nativas como Guayabo del país y Arazá. En 2007 se plantaron 4 montes más en escuelas de los departamentos de Canelones, Río Negro, Soriano y Salto. En cada una se realizaron charlas teórico prácticas para presentar el proyecto a la comunidad y hacerla así partícipe del mismo. También dentro de los Proyectos de Producción Responsable, Unidad de Biodiversidad, que buscan promover la adopción de sistemas de manejo integrado de recursos naturales y biodiversidad, sostenibles desde el punto de vista social, económico y ambiental, existen varias iniciativas que incorporan Frutos Nativos (regeneración del bosque nativo). Alrededor de 10 proyectos que tienen como uno de sus ejes centrales el aprovechamiento de estos frutos. Existe también un proyecto de Aplicación de frutos autóctonos en la gastronomía. Históricamente los principales usos de las frutas estaban asociados a bebidas alcohólicas de alta graduación (caña) y a la producción casera de dulces y mermeladas. En los últimos años se desarrollaron algunos productos envasados como mermeladas, licores, chutneys. Otros posibles usos serían como saborizantes en helados, condimentos y alta gastronomía. El objetivo es potenciar las posibilidades culinarias de estas frutas tanto a través de recetas 9
16 existentes como a través de la exploración de nuevas combinaciones con los demás componentes de la cocina criolla. Es así que en nuestro país existe actualmente un interés creciente por estos Frutos Nativos desde diferentes puntos de vista pero que conllevan a múltiples proyectos de investigación y de mejoramiento de su producción y dado que no se ha logrado aún el desarrollo de cultivos comerciales de primer nivel, como ocurre con otras especies frutales domesticadas, es que surge la necesidad de caracterizarlos, de realizar estudios que permitan conocer el material del que se dispone y de establecer criterios de propagación vegetativa y búsqueda de portainjertos con fines comerciales, etc. Es en este contexto que en el presente trabajo se propone estudiar algunos de estos frutos nativos. Hacer una primera caracterización molecular que sea un aporte al estudio general de estas plantas de interés. 1.2 Fundamentación del trabajo El incremento de nuevos cultivos demandó el desarrollo de tecnologías diferentes para una identificación eficiente, práctica y rápida de los mismos. Entre estas tecnologías ganaron popularidad las técnicas de electroforesis por su relativo bajo costo y accesibilidad para la evaluación molecular.[7] Son muchos los trabajos donde se utilizan marcadores moleculares, empleando esta técnica, principalmente isoenzimas como herramientas de caracterización. Por ejemplo, B. de Andrade y col.[8], utilizaron las isoenzimas para la caracterización de cultivos de soja por medio de la observación de estearasas en geles de almidón, también se han utilizado las isoenzimas en el estudio de coníferas [9,10], Camucamu [11], yuca [7], maíz [12], aguacate [13] entre otros. En nuestro país, considerando la importancia económica de la producción citrícola, Caro y col. ( ) se dedicaron a la investigación de citrus con el objetivo de lograr un mejoramiento en la producción. Intentaron conseguir nuevas y mejores variedades de citrus por medio de cruzamiento de plantas. También estudiaron la influencia de los portainjertos 10
17 utilizados en la producción de la fruta. Buscaron además métodos de identificación de las variedades de citrus que impidan que ocurran casos de confusión del material a reproducir, que tendrían consecuencias económicas graves para el productor.[14,15,16,17,18,19,31] Dichos trabajos consistían en extraer las isoenzimas de las hojas de una colección de plantas de la Estación Experimental de Facultad de Agronomía de Salto (EEFAS), de plantines de citrus, algunos de ellos los obtenía por cruzamiento y otros de variedades ya existentes. La extracción de isoenzimas se realizaba por medio de machacado de dichas hojas contra una planchuela de mármol; con los extractos vegetales así conseguidos se realizaba una electroforesis en geles de almidón. Los estudios se basaban en que las isoenzimas de las hojas presentan un número limitado de bandas electroforéticas por lo que los utilizaba como marcadores genéticos, reconociendo las diferencias o igualdades de estos patrones de bandas por medio de los cuales podía diferenciar las variedades de citrus con las que trabajaba. La utilidad de esta herramienta se debe además a las peculiares características de las isoenzimas de ser codominantes, poco influenciadas por el medio ambiente y que pueden ser analizadas sin causar un daño en el plantín. Caro y col. estudiaron varios sistemas enzimáticos con el fin de encontrar marcadores genéticos para determinar el origen nuclear o cigótico de los plantines obtenidos a partir de semillas y así poder diferenciarlos.[ [14,15,16,17,18,19,31] Considerando el creciente interés de estudiar los Frutos Nativos y en base a los antecedentes descritos por Caro y col. se propone utilizar la técnica de electroforesis en geles de almidón por su sencillez y bajo costo para estudiar dichos frutos. 1.3 Isoenzimas En cada organismo, órgano o tejido, incluso en una misma célula, la mayoría de las enzimas existen en múltiples formas moleculares, llamadas isoenzimas, que tienen funciones idénticas o similares y exhiben la misma especificidad enzimática.[12,20,21,22,23] Dichas formas isoenzimáticas aunque catalizan la misma reacción bioquímica presentan algunas diferencias en la cadena de aminoácidos, las cuales pueden ser detectadas 11
18 por cromatografía, electroforesis, gel filtración, propiedades catalíticas, sedimentación, inmunoquímica o combinaciones de estos métodos.[12] Las isoenzimas pueden diferir en la estructura primaria porque son codificadas en diferentes genes, ya sean alélicos o no, pero, además, la estructura primaria puede sufrir otras modificaciones por conjugación con grupos reactivos, tales como grupos amino, carboxilo o hidroxilo de los residuos aminoacídicos de la cadena polipeptídica.[22] Las diferentes formas de la enzima generalmente difieren en su cinética o propiedades regulatorias, en el cofactor que usan o en su distribución subcelular. En muchos casos comparten un origen evolutivo común.[23] Así pues, las isoenzimas son variantes de una misma enzima (formas funcionalmente similares de la enzima) presentes en un mismo organismo, que comparten un sustrato en común pero difieren en su movilidad electroforética. Incluyen todos los polímeros de subunidades producidos por diferentes loci o por alelos diferentes del mismo locus. Diferentes individuos en una misma población pueden tener diferentes formas moleculares de la misma proteína. Esa variabilidad en cuanto a la estructura de las proteínas es producida por factores genéticos o epigenéticos.[24] Las isoenzimas son las proteínas más ampliamente usadas como marcadores moleculares y éstas fueron los primeros marcadores moleculares usados en genética de plantas.[24] Existen dos clases de marcadores genéticos: los morfológicos y los moleculares. (1) Los morfológicos, utilizados tradicionalmente en la caracterización e identificación de variedades, se ha basado en el empleo de caracteres morfológicos y/o agronómicos. No obstante, en las plantas tiene muchas limitantes pues su expresión puede estar sujeta a factores ambientales o fenológicos. Con frecuencia solo es posible evaluar estos marcadores a nivel de toda la planta y cuando esta llega a su estado adulto, lo cual puede significar una espera, no deseable, de varios años. Además, pueden ocurrir cambios epigenéticos que limitan el número de marcadores que pueden ser evaluados sin equivocación en la población segregante.[24] Por 12
19 otro lado, los (2) marcadores moleculares superan, en la gran mayoría de los casos, las limitaciones de los métodos tradicionales. Han sido definidos como cualquier diferencia no típica controlada genéticamente. Se puede considerar que cualquier molécula, orgánica o inorgánica, que sea característica de un organismo o proceso, es un marcador. Dentro de los marcadores moleculares se menciona la existencia de dos tipos: los de ADN y las proteínas (principalmente las isoenzimas).[24] Estos marcadores moleculares son fenotípicamente neutros (probablemente no están sujetas a fuertes fuerzas selectivas), presentan mayor segregación o polimorfismo que los morfológicos, son expresadas codominantemente, por lo que los genotipos homocigotos y heterocigotos pueden ser distinguidos con mucha precisión, pueden ser evaluados desde los primeros estadios del desarrollo de las plántulas, son aplicables a cualquier tipo de material vegetal, son independientes de la época del año en que se realiza el análisis, permiten la identificación correcta de la variedad sin necesidad de muchos caracteres y están libres de los efectos epistáticos.[21,24,25] Además, la metodología empleada para su análisis es rápida, sencilla y económica y ha generado una gama enorme de información práctica en la identificación de especies, híbridos, poblaciones naturales y cultivos de diversos organismos vivos; no obstante, el número es muy limitado y se restringe a regiones codificantes del genoma. Otro problema es que su detección depende, en gran medida, del tejido que se analice.[11,25] En sus investigaciones Caro y col. ( ) afirma que las isoenzimas en las hojas presentan un número limitado de bandas por lo cual constituye un instrumento útil para el estudio de la determinación varietal, en su caso de citrus[16] y utilizó una gran variedad de isoenzimas como ser IDH, GOT, PGM, ACP, MDH, SkDH, ME, Hk entre otras. Tomando como base las isoenzimas utilizadas por Caro y col. así como otras isoenzimas mencionadas en los estudios de referencia del presente trabajo y de acuerdo a las disponibilidades de nuestro laboratorio, se decidió ensayar con 4 sistemas enzimáticos.: ACP, ALP, EST, PRX. 13
20 Sistemas enzimáticos tales como la fosfatasa ácida, estearasa y peroxidasa muestran una considerable variación en el número total de enzimas que se expresan, en el número de enzimas por compartimento subcelular y en el número de subunidades por enzima, mientras que las enzimas con funciones bioquímicas bien definidas y en especial las que actúan en el metabolismo primario muestran un número de loci predecible, conservación de la localización subcelular y de la subunidad estructural.[7] Los sistemas enzimáticos se clasifican según su nivel de variabilidad genética en grupo I y grupo II. La fosfatasa ácida, estearasa y peroxidasa pertenecen al grupo II, siendo enzimas que utilizan sustratos múltiples, frecuentemente de origen externo, y que responden directamente a la variabilidad ambiental. [7] Fosfatasa ácida, ACP y fosfatasa alcalina, ALP: según lo mencionado en un trabajo de Caro y col.[16] la ACP se trata de proteína monomérica, codificada por un solo locus del que se encontraron dos alelos y que existen diversos tipos de fosfatasas en las células vegetales. La diferenciación entre ácida y alcalina se debe a su ph óptimo de catálisis, por debajo y por encima de ph 7,0 respectivamente. Estearasa, EST: grupo enzimático complejo y heterogéneo, de relativamente baja especificidad por el sustrato que hidrolizan in vitro un gran número de enlaces esteres tal como se muestra en la ecuación general [22]: R~COOR + HOH R~COOH + R OH Dado que presentan una enorme diferenciación en sus patrones enzimáticos han sido ampliamente usados en identificación de especies y cultivos de importancia agronómica tales como arveja (Pisum Sativum L.), calabaza (Cucurbita máxima), soja (Glycine max. L. Merrill), etc. [11] Peroxidasa, PRX: oxidan un amplio rango de sustancias incluyendo sustancias fenólicas, citocromo C, nitrito, verde de leucomalaquita pero no H2O2 mismo ni alcoholes. Son hemoproteínas que contienen como grupo prostético ferriprotoporfirina. Se han reportado 14
21 isoenzimas de peroxidasa en una variedad de plantas, incluso en varios casos son específicos de órganos o tejidos. [22] 1.4 Electroforesis El término electroforesis se refiere a la migración diferencial de partículas a través de una solución o una matriz de naturaleza porosa por acción de un campo eléctrico. El grado de movilidad de una molécula cargada dependerá de su tamaño y forma así como de la viscosidad del medio a través del cual se mueve. Siendo el movimiento directamente proporcional a las dos primeras e inversamente proporcional a la última.[26] La electroforesis es una técnica cromatográfica que permite la separación de una mezcla de moléculas eléctricamente cargadas en un campo eléctrico.[27] Estas partículas migran hacia el cátodo o ánodo en dependencia de una combinación de su carga neta, peso molecular y estructura tridimensional.[28] Por lo que cada molécula migrará una distancia característica en un campo eléctrico determinado y en un tiempo dado.[27] Así, si una mezcla de proteínas es sometida a electroforesis, se espera que cada tipo de molécula se concentre en una estrecha franja (banda) en determinado punto del gel. La velocidad de migración (V) de la partícula es directamente proporcional al producto de su carga efectiva (q) y el gradiente de potencial eléctrico (E) e inversamente proporcional al coeficiente de fricción (f) relativo a la talla y forma de la molécula, o sea, a la resistencia que ofrece el medio: v = qe / f La mayoría de las biomacromoléculas poseen determinada carga eléctrica con grupos aniónicos y catiónicos capaces de disociarse. La carga neta de la partícula esta dada por el ph del medio y puede ser modificada por interacción con pequeñas moléculas e iones u otras macromoléculas. De esto se deduce que el ph influye sobre la velocidad de migración de las moléculas.[28] 15
22 Las proteínas presentan cargas eléctricas debido a la presencia de aminoácidos básicos (arginina y lisina) y ácidos (ácidos aspártico y glutámico). Las proteínas complejas que presentan modificaciones postraduccionales tales como glicosilación, sulfatación y fosforilación tienen cargas adicionales. Dado que estas proteínas tienen una carga neta migrarán en un campo eléctrico siempre que el ph sea diferente a su punto isoeléctrico. La tasa de migración en este campo electroforético dependerá también de la densidad de carga, es decir de la relación carga/masa, cuanto mayor sea más migrará la molécula.[26] Se entiende por punto isoeléctrico al valor de ph en el cual la carga neta es cero y entonces la molécula no migra. Por encima del punto isoeléctrico la proteína adquiere carga negativa y migra como un anión hacia el Ánodo (polo positivo) y por debajo del punto isoeléctrico la carga se vuelve positiva y migra hacia el Cátodo (polo negativo) como un catión. A escala analítica, la electroforesis, es un método de alta sensibilidad, poder de resolución y versatilidad que puede ser utilizado como método de separación de mezclas complejas de ácidos nucleicos, proteínas y otras biomoléculas. Sirve, además, para conocer las características ácido-básicas de las proteínas presentes en una mezcla. También es útil para determinar otros parámetros como peso molecular, punto isoeléctrico y número de cadenas polipeptídicas de las proteínas.[28] La electroforesis es la técnica más útil para estudiar la variabilidad genética entre las poblaciones de animales y plantas.[27] Enzimas diferentes o formas alternativas de la misma enzima migran a diferentes tasas cuando se aplica corriente en forma directa a muestras procesadas en gel. La migración enzimática en los geles y la separación de enzimas con diferentes cargas resulta de la interacción de la corriente eléctrica, el ph en el gel y el ph en la bandeja (cubeta) del electrodo (sistema de gel).[9] El sistema de buffer debe ser elegido tal que mantenga un ph constante en la cuba y en la matriz y actúe como un electrolito conductor de corriente aceptable a través del campo eléctrico. Además no debe interactuar con las moléculas que se van a separar porque esto podría afectar la tasa de migración molecular y dar un resultado erróneo. No solo es 16
23 importante la composición del buffer sino también su fuerza iónica y su concentración. Si la concentración es demasiado baja la migración de las macromoléculas que están siendo separadas conducirá una larga porción de la corriente y no se resolverán adecuadamente. Si la concentración electrolítica es muy alta, la cantidad de corriente conducida aumentará mientras el voltaje disminuye lo que conlleva a la generación de calor y una disminución en la migración molecular.[26] En teoría, las electroforesis pueden ser llevadas a cabo entre ph 2,5 y 11, pero en la práctica los límites de ph son entre 3 y 10, dado que pueden ocurrir reacciones de desaminación a ph extremos. Si se va a llevar a cabo una electroforesis no disociante para separar moléculas tales como proteínas de acuerdo a su tamaño y densidad de carga, la elección del sistema de buffers es crítica. Cuanto más lejano sea el ph del buffer del punto isoeléctrico de las proteínas a ser separadas mayor será la carga que adquieran éstas. Las diferencias relativas alterarán el tiempo requerido para la separación electroforética de las proteínas. Si la electroforesis se lleva a cabo en presencia de un detergente aniónico como el duodecil sulfato de sodio (SDS), el rango de ph deja de ser un valor crítico porque el complejo polipéptido-detergente que se forma estará todo cargado negativamente.[26] Existen 2 modalidades de electroforesis: 1.ELECTROFORESIS LIBRE: El campo eléctrico se aplica a disoluciones o suspensiones. Históricamente es el origen de la electroforesis tal y como fue desarrollada por Arne Tiselius en Actualmente está en desuso por pobre resolución.[28] (Figura 1.2 A) 2.ELECTROFORESIS ZONAL: Es el método más utilizado para el análisis de mezcla de proteínas complejas. Consiste en la aplicación de las macromoléculas en una banda o zona angosta del soporte, a una distancia adecuada de los electrodos y durante la electroforesis las proteínas de diferentes movilidades viajan como bandas discretas que gradualmente se separan unas de otras.[26] (Figura 1.2 B) 17
24 Figura 1.2: Dos modalidades de electroforesis: (A) LIBRE, las moléculas cargadas migran hacia los electrodos, aunque no bien separadas por tratarse de una disolución. (B) ZONAL, sobre un soporte. (Imágenes extraídas de Plataformas de Proteómica del Ing. MORALES, D. & Ing. GALLO, L.E [28]) La electroforesis puede llevarse a cabo en una solución pero es más práctico hacerlo en un soporte sólido tal como almidón, poliacrilamida, agarosa, celulosa, etc.[26] Los más usados son agarosa, soportes de tipo I y poliacrilamida, soportes de tipo II. En los soportes de tipo I el tamaño de poro no opone impedimento al paso de las moléculas, se usa sobre todo para la separación de ácidos nucleicos, mientras que en los soportes de tipo II el tamaño de poro opone resistencia al paso de las moléculas, no solo evitan la convección y minimizan la difusión, sino que además participan en el proceso de separación dado que estos geles son medios porosos en los que el tamaño de poro es similar al de las proteínas, de tal modo que existe un efecto de tamizado molecular y la separación electroforética depende de la densidad de carga de las moléculas y de su tamaño.[28] Es de suma importancia que se seleccione la matriz electroforética adecuada para el tipo de ensayo que se va a realizar. El soporte de corrida debe ser química y físicamente inerte, para no interferir en la movilidad de las moléculas. Dependerá también del tipo de molécula a separar, del investigador y de los objetivos de estudio. Para tal fin, es conveniente conocer que el gel de agarosa presenta poros de mayor tamaño que los geles de almidón, y estos a su vez poros mayores que los de poliacrilamida. Por lo tanto, los dos primeros son recomendados para separar moléculas de elevado peso molecular. Otro factor a considerar es la reproductibilidad de los resultados en función de la matriz utilizada. En este sentido, por ejemplo, las propiedades de los geles de almidón van a depender del tipo y a veces del lote de 18
25 almidón utilizado, lo que puede disminuir, en algunos casos, la posibilidad de repetir los resultados.[7] Los medios sólidos presentan una ventaja adicional a la hora de almacenar la información, ya que perduran por algún tiempo, o permite preservarla por medio de la fotografía y de esta forma facilitar su registro.[7] La electroforesis es un método que tiene alto poder resolutivo porque se aplica una cantidad pequeña de proteína a una zona estrecha, mientras que la longitud del trayecto a recorrer es mucho mayor que la zona de aplicación.[29] Además el equipamiento que requiere es simple: una fuente de poder, una cuba y dos electrodos. La fuente de poder proporciona el campo eléctrico mediante dos electrodos, positivo y negativo, entre los que se establece une diferencia de potencial.[28] Hay 3 tipos de electroforesis zonales: 1.Con sistema de buffer continuo: se usa el mismo buffer en todo el recorrido de la muestra y al mismo ph, para muestras, gel y cuba. 2.Con sistema de buffer discontinuo: se usan distintos buffers en las muestra, gel y cuba, pudiendo diferir tanto en el ph como en la composición, incluso puede usarse un gel de apilamiento preparado con un buffer diferente. 3. Con sistema de buffer disociante: con detergente como SDS o urea en un sistema de buffer diseñado para disociar todas las proteínas en sus subunidades polipeptídicas individuales a costa de perder la actividad biológica de las proteínas.[26] La electroforesis puede separar proteínas que se diferencian incluso en un único aminoácido, lo cual se ve reflejado en sus diferentes movilidades electroforéticas (Ingram, 1957) y que pueden ser visualizadas en el gel como zonas de actividad por medio del procedimiento de tinción histoquímica que resulta en un patrón o arreglo de bandas llamado zimograma.[7,12,20] 19
26 La variación de estos patrones de bandas, entre los individuos analizados puede interpretarse genéticamente tal como se haría con cualquier otro marcador fenotípico. La simplicidad de la técnica de electroforesis para detectar isoenzimas ha hecho posible su uso y aplicación en la investigación genética de un gran número de especies vegetales. Los principales eventos que marcaron el uso de esta técnica fueron el desarrollo de electroforesis en geles de almidón y la demostración de que las isoenzimas pueden visualizarse en los geles por medio de tintes histoquímicos.[30] SGE La electroforesis horizontal en geles de almidón sigue siendo la preferida ya que es la técnica más versátil, económica, de fácil manipulación y buena resolución y, se puede analizar de forma rápida la variación para uno o varios loci variación de estos patrones de bandas, entre los individuos analizados puede interpretarse genéticamente tal como se haría con cualquier otro marcador fenotípico. Su gran ventaja es que un mismo gel puede cortarse en tajadas tal que puede ensayarse con varios sistemas enzimáticos diferentes, otra ventaja es que permite analizar sustratos sin purificar y una tercera ventaja es la inocuidad del almidón que no presenta peligro alguno para el operador. Además los recursos necesarios para desarrollar esta técnica son mínimos e incluso los puede construir el propio investigados. [21,30] PAGE Raymond y Weintraub en 1959 emplearon como soporte para la electroforesis un gel de poliacrilamida (PAGE), posteriormente el método fue perfeccionado por varios investigadores como Davis y Ornstein. La popularidad de este método creció rápidamente ya que logró un aumento de la resolución de los resultados.[29] Actualmente es la tecnología más usada para la separación de proteínas ya que es la técnica más eficaz para resolver mezclas complejas de proteína [28] 20
27 En general, se puede decir que las cualidades más atractivas para hacer uso de la poliacrilamida son la presencia de mayor poder de resolución, amplia variación en el diámetro de los poros, cuantificación de la concentración proteica y de la actividad enzimática, a través de las técnicas de densitometría. Sin embargo, su desventaja es que estos monómeros son compuestos extremadamente tóxicos en solución, y requieren de un manejo muy cuidadoso por parte del usuario.[7] La poliacrilamida es un soporte químicamente inerte, de propiedades uniformes, capaz de ser preparado de forma rápida y reproducible. Forma además geles transparentes con estabilidad mecánica, insolubles en agua, relativamente no iónicos y que permiten buena visualización de las bandas durante tiempo prolongado. Presenta la ventaja extra de que variando la concentración de polímeros se puede modificar de manera controlada el tamaño del poro.[29] Teniendo en cuenta los antecedentes tanto nacionales de citrus de Caro y col. así como de otros autores en las especies a estudiar, a saber Guayabo del país (Acca sellowiana (Berg.) Burret), Pitanga (Eugenia uniflora L.), Arazá (Psidium cattleianum Sab.), Guaviyú (Myrcianthes pungens (Berg.) Legr.) y Ubajay (Hexachlamis edulis (Berg.) Legr. et Kaus.)[3] y utilizando como muestras tanto hojas de citrus como referencia y hojas de Frutos Nativos, provenientes del jardín de introducción de la estación experimental de San Antonio, se propone la caracterización de los diferentes Frutos Nativos con posible interés comercial por medio de SGE. Para esto en una primera etapa nos propusimos en las condiciones del laboratorio de la Regional Norte, basándonos en los antecedentes y trabajos realizados por Caro y cols., utilizar la electroforesis de isoenzimas como marcadores moleculares en geles de almidón como tecnología sencilla y de bajo costo, para la caracterización de frutas nativas. En una segunda etapa, se estudiarán las mismas variables utilizando la técnica de electroforesis en geles de poliacrilamida debido a su mayor poder de resolución. 21
28 2. MATERIALES & MÉTODOS 2.1 Material Vegetal Hojas de árboles cercanos al laboratorio, de variedad desconocida: Arazá frente a Hogar de Ancianos. Ubajay frente a Regional Norte. Guayabo del país del Parque Harriague. Hojas de citrus de chacra próxima a la ciudad, de variedades Satsuma Ellendale Hojas provenientes de plantas de la colección de E.E.F.A.S.: Guayabo del país G01 G02 Guayabo VIII 2 San José Guayabo VIII 5 RN2 G03 Guayabo VII 2 Ca 261 G04 G05 Guayabo VIII 3 Teo clones Guayabo VIII 1 rara G06 Guayabo VII 4 G07 G08 G09 G10 G11 G12 Guayabo VII 4 J.P. Guayabo VIII 5 RN3 Guayabo VII - 8 TF3 Guayabo VII 1 clones Guayabo VII 2 clones Guayabo VII 5 clones 22
29 G13 G14 G14 G16 G17 G18 G19 G20 Guayabo VII 6 clones Guayabo VII 7 clones Guayabo IX 1 clones Guayabo VIII 2 clones Guayabo VIII 6 clones Guayabo VIII 7 clones Guayabo VIII 2 SV clones Guayabo VIII 6 RN2 clones G21 Guayabo H2 maceta 42 G22 Guayabo H2 maceta LL 3 VIII 14 G23 Guayabo H2 maceta 25 G24 Guayabo TF1 IV 15 G25 Guayabo H2 maceta 50 G26 Guayabo H2 maceta 43 G27 Guayabo H2 maceta 47 Arazá A01 Arazá rojo XIV 3 Guaviyú Gi01 Guaviyú Lussien VX 2 Gi02 Guaviyú Teo XV5 Ubajay U01 Ubajay cortina planta 2 Pitanga P01 Pitanga X 1 P02 Pitanga E.V. X 2 23
30 Citrus C01 Satsuma III 3 C02 Ellendale IV Material de laboratorio Aparatos y equipos Bomba de agua Fuente de poder Máquina de fotos Pellet pestle Cuba electroforética para geles de almidón de 24x14x5, 1680cm 3 (chica2) Cuba electroforética para geles de almidón de 25x14x5, 1750cm 3 (chica1) Cuba electroforética para geles de poliacrilamida Material básico de laboratorio Para gel de poliacrilamida: Casete Espaciadores Láminas de metal Láminas de vidrio Láminas de plástico Peine Pinzas Separadores 24
31 Para geles de almidón: Marcos de acrílico de: 180x80x4 área interna 100x50x4 85x85x5 Placas de vidrio para geles de almidón Reactivos y soluciones Acetato de sodio 0,05M ph 5,5 Acetato de sodio 1M ph 4,7 Acetona Ácido acético Ácido aspártico Acrilamida Almidón de papa hidrolizado para electroforesis Nº Sigma Azul de bromofenol Bisacrilamida Fast Blue RR Salt Fosfato de sodio 0,1M ph 6,2 Glicerol Glicina Agua oxigenada (H 2 O 2 ) 30% Ácido clorhídrico (HCl) Mercaptoetanol Metanol Cloruro de magnesio (MgCl 2 6H 2 O) 1M Sulfato de manganeso (MnSO4) 1M Persulfato de amonio Piridoxal-5-fosfato PVP TEMED TMBZ 25
32 Tris 0,1M ph 8,5 Tris 0,05M ph 8,5 Tris-HCl 0,04M ph 8,3 Tris-HCl 0,04M ph 8 Tritón α-cetoglutarato α-naftil butirato α-naftil fosfato de sodio β-naftil fosfato ácido Buffer de gel para SGE Tris-Citrato 0,03M ph 7,88 [14,17] Tris-Citrato 0,03M ph 8,5 Buffer de corrida para SGE Tris-Citrato 0.3M ph 7 [14,17,31] Tris-Citrato 0,3M ph 7,5 Tris-Citrato 0,03M ph 8,5 Tris-Citrato 0,3M ph 8,5 Borato de sodio 0,34M ph 8,2 [32] Borato de sodio 0,3M ph 8,6 [33] Buffer de gel para PAGE Tris-HCl 3M ph 8,8 Buffer de gel de apilamiento para PAGE Tris-HCl 0,5M ph 6,8 Buffer de corrida para PAGE Tris-HCl 0,04M, Glicina 0,2M ph 8,3 Tris-HCl 0,04M, Glicina 0,2M ph 8,3 Glicerol 20% 26
33 Azul de bromofenol Tris-HCl 0,04M, Glicina 0,2M ph 7,5 Tris-HCl 0,04M, Glicina 0,2M ph 7 Tris-HCl 0,04M ph 8,3 Tris-HCl 0,04M ph 8 Buffer de extracción PAGE: (BE1) Tris-HCl 0,1M y Mercaptoetanol 0,14M ph 7 [20] (BE2) Tris-HCl 0,1M, Mercaptoetanol 0,4% ph 7 Glicerol 20% Tritón 0,5% PVP 5% 2.3 Recolección y conservación de muestras vegetales Durante los ensayos preliminares, de puesta a punto del método, se recolectaron hojas de árboles cercanos al laboratorio, de variedades desconocidas de Frutos Nativos y hojas de citrus de una chacra citrícola cercana, de variedades conocidas. Para el estudio propiamente dicho de Frutos Nativos se utilizaron hojas de variedades claramente identificadas pertenecientes a la colección del Jardín de Introducción de E.E.F.A.S., ubicada en el Km 21,5 de la Ruta 31, construido con la prospección de materiales recolectados de todas partes del país y a cargo de la Ing. Agr. Beatriz Vignale. Las hojas se transportan hasta el laboratorio en bolsas de nailon cerradas, individuales, etiquetadas y en conservadora con refrigerantes. En el laboratorio, las hojas se conservan a 4ºC, acondicionadas en bolsas de nailon cerradas y etiquetadas. 27
34 2.4 Electroforesis en geles de almidón Método de extracción de muestras para geles de almidón Se coloca una hoja de muestra, con el envés hacia abajo, encima de un trozo de papel de filtro de 5x10mm ubicado sobre una plancha de mármol. Se presiona la hoja con un brazo de mortero tal que libera el contenido celular y el papel de filtro queda embebido en el líquido vegetal. Se procesan de 2 a 4 hojas por cada papel de filtro [16]. Los papeles de filtro procesados se conservan en heladera mientras se procesan las muestras restantes. Es importante mantener la temperatura durante todo el procesamiento por debajo de 4ºC, para evitar la desnaturalización de proteínas.[7] Se debe utilizar guantes de látex para evitar la degradación de las biomoléculas por acción de las nucleasas o proteasas presentes en la superficie de las manos.[34] Preparación de geles de almidón Una de las principales variables que determina que el gel sea adecuado es la calidad del almidón; otros factores son la calidad del agua destilada, la temperatura del laboratorio y del refrigerador y el tiempo que los geles son desgasificados. Los geles de almidón se preparan siguiendo la metodología utilizada por Cavalli, S.[35] Se disuelve el almidón con el buffer de gel en un matraz kitasato revolviendo con varilla de vidrio hasta lograr una solución opaca homogénea. Se calienta en mechero, agitando constantemente en remolino, hasta que se disuelva por completo. Se debe agitar constantemente para asegurar que el almidón se mantenga en suspensión.[9] En principio la solución queda transparente y espesa, casi solidificada, luego vuelve a quedar líquida y cada vez más transparente. Comienzan a formarse burbujas muy chicas en el fondo del matraz.[35] Según Thompson y col.[9] la formación de terrones o manchas blancas en la solución de gel caliente significa que el buffer no hirvió lo suficientemente rápido o que el almidón no 28
35 se mezcló bien con el buffer y sugiere descartar la solución. Cuando la solución queda completamente cristalina se retira del fuego e inmediatamente se pasa a bomba de vacío. Se desgasifica por unos 20 a 40 segundos hasta que aparezcan solo burbujas grandes. Si el almidón queda muy espeso o con demasiadas manchas blancas cuando se vierte del frasco de vacío se debe a que se desgasificó por demasiado tiempo y hay que descartar.[9] Se vuelca el gel dentro de un marco de acrílico apoyado sobre una placa de vidrio, ubicados sobre una superficie plana y nivelada, y se deja solidificar a temperatura ambiente, sin tapar. Las placas de vidrio y los marcos de acrílico se limpian previamente con alcohol y se dejan secar al aire. En caso de que se formen burbujas en la superficie del gel se eliminan pinchando con una aguja. Luego de dos horas de solidificación los geles están listos para usar o bien se pueden reservar por un par de días en heladera, en cámara húmeda cerrada para evitar que se sequen.[35] Se prepararon geles en distintas concentraciones (Tabla 2.1) para obtener distintos tamaños de poros (% de gel) y geles en distintos tamaños para su mejor manipulación. Se comenzó trabajando con geles de 180x80x4mm, luego con geles de 85x85x4 y finalmente 100x50x4mm. Tabla 2.1 Preparación de geles de almidón de distintas concentraciones [35] Gel % Buffer de gel (ml) Almidón (g) , , ,8 29
36 Siembra en geles de almidón Previo a la siembra, se dejan secar las muestras (papel de filtro embebido en líquido con extracción vegetal) en heladera para que queden rígidas y entren con facilidad en el gel, preservando así la integridad del mismo, sin necesidad de cortar el gel y sin causarle una ruptura excesiva por la inserción del papel. La siembra se realiza introduciendo directamente el papel de filtro en el gel, a unos 3cm de uno de los extremos. Entran 4 a 5mm de papel en el gel. Se quita el marco de acrílico del gel y se lo coloca en la cuba, con la siembra hacia el cátodo (negro).[9] Corrida en geles de almidón Las placas de vidrio con los geles sembrados se colocan en la cuba y se establece un puente con el buffer de corrida por medio de papeles de filtro cubiertos de algodón. Los puentes deben ser lo más corto posible y tanto el papel como el algodón deben embeberse con el buffer de corrida para evitar que se resequen y se corten los geles. Se tapa la cuba para evitar la desecación de los geles y se deja corriendo dentro de heladera para mantener constante la temperatura y la humedad. Se controla periódicamente: voltaje, intensidad de corriente y temperatura. La intensidad de corriente tiende a disminuir a medida que transcurre la corrida. Su aumento para mantener su valor constante a lo largo de la corrida causa un incremento del voltaje.[9] 2.5 Electroforesis en geles de poliacrilamida Métodos de extracción de muestras para geles de poliacrilamida 30
37 Se pican las hojas de muestra con bisturí sobre placa de vidrio o plancha de mármol y se prueban dos métodos de extracción: Para el método A, una adaptación en base a la referencia [11], se pasa el picadillo a un pocillo de porcelana y se agrega el buffer de extracción. Se presiona con varilla de vidrio. Se pasa a un tubo Eppendorf, previamente enfriado en heladera, que contiene otra porción del buffer de extracción. Se centrifuga a velocidad máxima a 0ºC por 20 minutos y luego se traspasa el sobrenadante a un Eppendorf limpio y se reserva en heladera si se va a usar en breve o se congela en caso contrario. Para el método B, las hojas picadas se pasan a un Eppendorf con una porción del buffer de extracción previamente enfriado en heladera, se mezcla con una Pellet Pestle, se agrega la otra porción del buffer de extracción y se deja actuar por unos minutos en heladera. Se probaron para la extracción dos buffers: BE1 y BE2. El buffer de extracción, BE1 y BE2 contiene Glicerol 20% para aumentar la densidad del extracto y facilitar así la siembra. Preparación de los geles de poliacrilamida Se limpian todas las partes constituyente del casete para preparar geles, primero con agua destilada y luego con alcohol y se dejan secar al aire. Se ensambla el casete y se reserva en una superficie nivelada y limpia. Cada gel se prepara entre una placa de vidrio y una de metal. El ancho de los separadores determina el ancho que tendrá el gel. Se prepara una solución de Acrilamida-Bisacrilamida (30:0,8) mezclando: Acrilamida 30g Bisacrilamida 0,8g Agua destilada 100ml Se disuelve, filtra y conserva en frasco oscuro a 4ºC.[33] 31
38 Para preparar el gel (Tabla 2.2) se agregan todos los componentes, excepto el TEMED, en un kitasato y se desgasifica. Luego se agrega éste y se agita gentilmente en remolino.[33] Se llena el casete con pipeta o jeringa de aguja ancha. Se completa hasta 4cm antes del borde superior y se deja solidificando a temperatura ambiente. Tabla 2.2 Preparación de geles PAGE: geles de resolución de distintas concentraciones y gel de apilamiento.[33] Solución de reserva Gel de apilamiento (ml) Gel de resolución (ml) 10% 9% 8,5% Acri-bis (30:0,8) 2,5 10,0 9,0 8,5 Buffer de apilamiento 5, Buffer de resolución - 3,75 3,75 3,75 Persulfato de amonio al 1,5% 1,0 1,5 1,5 1,5 TEMED 0,015 0,015 0,015 0,015 Agua destilada 11,5 14,75 15,75 16,25 Volumen total Se prepara el gel de apilamiento realizando el mismo procedimiento pero con las proporciones de reactivos correspondientes. Una vez que el gel de corrida se haya solidificado se completa el casete con el gel de apilamiento. Se colocan los peines, se cubre la parte superior del casete con algodón húmedo y se envuelve todo el casete en film. Se conserva en heladera. Los geles pueden conservarse por varios días en buen estado bajo estas condiciones. Siembra en geles de poliacrilamida Se realiza en forma directa, utilizando una micropipeta. Corrida en geles de poliacrilamida 32
39 Se coloca el gel en la cuba (el cual se encuentra entre una lámina de vidrio y una de metal) con la lámina de vidrio hacia afuera y se sujeta con pinzas. Primero se rellena la cámara detrás del gel con buffer de corrida y luego la cuba. Se quita el peine, se tapa la cuba y se conecta la bomba de agua. Se realiza primero una pre-corrida, solo del gel, por unos 15 minutos. Se apaga la fuente para realizar la siembra. Se siembra con micropipeta y se vuelve a encender la fuente. Se ajusta voltaje y corriente. La corrida se hace en conservadora con refrigerante y flujo de agua corriente. Se deja correr hasta que el frente alcance el límite inferior del gel controlando periódicamente: voltaje, intensidad de corriente y temperatura. Una vez finalizada la corrida, el gel se pasa a un recipiente limpio, con agua destilada y se lava con agitación por varios minutos, antes del revelado. 2.6 Revelado Los geles se lavan una media hora luego de la corrida, con 2 a 3 recambios de agua destilada, en agitador mecánico antes de revelar. ACP: fosfatasa ácida [20] En un matraz con agitador magnético se disuelve la sal de diazonio en el buffer (solución A) y luego se agrega la solución B. En este punto aparecen partículas en la suspensión. Se deja incubando en oscuridad, a 30ºC, por 1 a 5 horas o hasta que aparezcan bandas rojas o púrpuras. Transcurrido el tiempo de revelado se descarta la solución, se enjuaga el gel con agua corriente y se fija. Solución A: 100 ml Acetato de sodio 50mM ph5,5 33
40 1ml 100mg MgCl2 6H2O 1M Fast Blue RR Salt Solución B: 3ml β-naftil fosfato ácido 1% en 50% acetona (30mg naftil, 2ml acetona, 2ml agua) EST: estearasa [20] Primero se mezcla la sal de diazonio y el naftil butirato, luego se agrega el buffer. La solución debe ser preparada justo antes de comenzar la incubación. Se sumerge el gel en la solución y rápidamente se lleva a oscuridad. Incubar a 30ºC por 4 a 8 horas. 100ml Fosfato de sodio 0,1M ph 6,2 3 ml α-naftil butirato 1% en acetona 100mg Fast Blue RR Salt PRX: peroxidasa [20] Se incuba el gel en la solución A en oscuridad a 30ºC por 30 minutos. Se agrega la solución B y se agita lo suficiente para asegurar una buena mezcla. Aparecen bandas azules en unos pocos minutos a una hora. Solución A: 50ml Acetato de sodio 1M ph 4,7 50ml Metanol 50mg TMBZ (tetrametilbenzidina) Solución B: 2ml H 2 O 2 30% ALP: fosfatasa alcalina [20] Primero se disuelve la sal de diazonio en la solución de naftil (solución A), luego se agrega el buffer y los otros componentes. Se agita vigorosamente antes de agregar a los geles. 34
41 Se incuba en oscuridad, a 30ºC, por 1 a 5 horas o hasta que aparezcan bandas rojas o púrpuras. Una vez concluido el revelado se descarta la solución, se enjuaga con agua de la canilla y se fija. Solución A: 3ml α-naftil fosfato de sodio 1% en 50% acetona (30mg naftil, 2ml acetona, 2ml agua) 100mg Fast Blue RR Salt 100 ml Tris 50mM ph 8 5 1ml MgCl2 6H2O 1M 1ml MnSO 4 1M 2.7 Conservación de geles de almidón Luego del revelado se fijan los geles sumergiéndolos por 24 horas en acetato al 3%. Se pasan a un film y se envuelven lo más hermético posible. Se conservan en cámara húmeda en heladera. 35
42 3. RESULTADOS 3.1 Preparación de muestras para SGE Método de extracción de muestras para SGE Se utilizó el método de extracción sugerido por Caro y col. 1991[16], que consiste en presionar las hojas con un brazo de mortero sobre una plancha de mármol colocado encima de un trozo de papel de filtro de tal manera que el papel de filtro quede embebido en el líquido vegetal liberado. Estudio de la influencia de la edad de las hojas utilizadas en SGE Para estudiar si tiene alguna influencia en el desarrollo de la electroforesis de plantas Nativas, se realizó una corrida electroforética en geles de almidón usando hojas jóvenes y hojas maduras de la misma planta de Guayabo del país. (Figura 3.1) La corrida electroforética se realizó en un gel de almidón al 13% de 180x80x4mm y las hojas fueron colectadas y procesadas justo antes del ensayo. Se usó como buffer de corrida Tris Citrato 0,3M ph 7,5 y como buffer de gel Tris Citrato 0,03M ph 7,88. La corrida duró 5 horas, a 55V y generó una corriente relativamente constante entre 180 a 200mA. Se reveló con ACP. Se sembraron dos pares muestras hoja joven-hoja madura (par rojo y par azul) en este gel. Los carriles 1 y 5 de la figura 3.1 corresponden a las hojas jóvenes (GN) de cada par y los 2 y 6 a las hojas maduras (GV). Se puede observar una diferencia en la intensidad del color entre las corridas de hojas jóvenes y las de hojas maduras, siendo más intenso el color en las hojas jóvenes. 36
43 Figura 3.1: Estudio comparativo utilizando hojas jóvenes y de hojas maduras de Plantas Nativas en SGE. Se procesaron dos muestras para cada tipo de hoja (madura y joven). Los carriles 1 y 5 corresponden a hojas jóvenes y los 2 y 6 a hojas maduras. Se uso un gel de almidón al 13%, de 180x80x4mm, buffer de gel Tris-Citrato 0,03M ph 7,88 y buffer de corrida Tris-Citrato 0,3M ph 7,5. La corrida duró 5 horas, a 55V, que generó una corriente relativamente constante entre 180 a 200mA. Se puede observar una diferencia en la intensidad del color entre las corridas de hojas jóvenes y las de hojas maduras, siendo más intenso el color en las hojas jóvenes Revelado con ACP. [Guayabo del país: (GN) hojas jóvenes y (GV) hojas maduras] para SGE Estudio del tiempo de vida útil de las hojas luego de ser colectadas, La Tabla 3.1 muestra cuantos días de conservación pos colecta tienen las hojas utilizadas en los ensayos de electroforesis realizados. En este caso, y solo con fines 37
44 comparativos, se consideró como resultados positivo (sombreado en amarillo) la aparición de una o más bandas. Los resultados negativos incluyen manchas, chorretes y ausencia de resultados. En dicha tabla se muestra como hojas del mismo tiempo de conservación dan resultados positivos y negativos en diferentes ensayos, como ocurre para hojas de Ellendale de 1 día de conservación, hojas de Arazá de 0, 1 y 8 días y hojas de Guayabo del país de 0, 2, 3, 7 y 8 días. A modo de ejemplo se pueden observar los resultados positivos de las hojas de Guayabo del país de 44, 49 y 56 en las figuras 3.15, 3.8 y 3.13 respectivamente, de la variedad G04. En todos los casos las hojas colectadas se conservan a 4ºC dentro de bolsas de nailon cerradas, para mantener su humedad. Tabla 3.1 Tiempo de conservación desde la colecta de hojas a ser utilizadas en SGE. Las hojas utilizadas son de distintas variedades, tanto de citrus como de nativas y de diversas procedencias y se conservaron desde su colecta hasta su uso en bolsas de nailon cerradas, en heladera. Se considera resultado positivo (sombreado en amarillo) a la resolución de una o más bandas en el SGE y negativos a manchas, chorretes y ausencia de bandas. PLANTA Ellendale DIAS DESDE COLECTA Satsuma Arazá Guaviyú 2 8 Pitanga 2 8 Guayabo del país Ubajay
45 3.2 Preparación de geles de almidón Tiempo de calentamiento de los geles de almidón Los geles se prepararon siguiendo las indicaciones de Cavalli, S.[35]. En un kitasato se disolvió una determinada cantidad de almidón con el correspondiente volumen de buffer de gel y se calentó en mechero, agitando constantemente en remolino hasta que el almidón se disolvió por completo. Al comenzar el calentamiento la solución se quedó transparente y se espesó y, luego, volvió a quedar líquida y más transparente y se formaron burbujas en el fondo del matraz, en ese momento se retiró del fuego, inmediatamente se desgasificó por 20 a 40 segundos y se vertió en los moldes ya preparados. En la Tabla 3.2 se observa los distintos tiempos de calentamiento a los que se prepararon 3 geles de almidón de 100x50x4mm y 13% de concentración para determinar si la temperatura y tiempo a los que se realiza el calentamiento en la preparación de la solución de almidón afecta las características y/o comportamiento del gel, tal que cause una alteración o efecto en la corrida electroforética. El gel 1 se preparó como refiere Cavalli, S.[35] pero a los geles 2 y 3 se les aumentó el tiempo de calentamiento. Además se trabajó a menor distancia del mechero, prácticamente tocando la llama (inicialmente se mantenía a una distancia de unos 4 a 5cm) y hasta que los geles alcanzaron una temperatura alrededor de los 90ºC. La desgasificación también se hizo por más tiempo, normalmente se hacía unos 20 a 30 segundos pero de acuerdo a lo referido por el Ing. Agr. Gustavo Vargas (comunicación personal), quien trabajó usando estos geles en un estudio similar sobre boniatos, se los dejó unos 40 a 50 segundos, hasta que aparecieron burbujas grandes y desaparecieron las chiquitas. Se realizó una corrida electroforética con estos 3 geles preparados de forma idéntica salvo el tiempo de calentamiento (gel 1: 9min, gel 2: 13min. y gel 3: 14min). Se sembraron dos variedades de citrus como muestras (Ellendale y Satsuma), colectados el día anterior y conservados en bolsa de nailon cerrada, en heladera. Los tres geles se corrieron en la misma 39
46 cuba y al mismo tiempo. Se usó Tris-Citrato 0,3M ph 7,5 como buffer de corrida y Tris- Citrato 0,03M ph 7,88 como buffer de gel. La corrida procedió normalmente por 10 horas a voltaje bajo (23-26V) que generó una corriente de 50-52mA. Se reveló con ACP. (Figura 3.2) Tabla 3.2 Tiempo de calentamiento en la preparación de los geles. Preparación de 3 geles de almidón, variando únicamente el tiempo durante el que se calienta la solución de almidón durante su elaboración. GEL 1 GEL 2 GEL 3 INICIO 08:47:00 09:06:00 09:29:00 5 min 7 min 6 min TRANSPARENTA 08:52:00 09:13:00 09:35:00 Y ESPESA 2 min 3 min 3 min CHIRLO 08:54:00 09:16:00 09:38:00 2 min 3 min 5 min FINAL 08:56:00 09:19:00 09:43:00 En la figura 3.2 se muestran los 3 geles luego de realizada la corrida electroforética y revelados con ACP. En cada gel se sembró una muestra de Ellendale (E) y otra de Satsuma (S), en el gel 2 se sembró además un tercer carril con colorante para controlar el frente de corrida. A simple vista se observa que al aumentar el tiempo de calentamiento (del gel 1 al 3) los geles quedan cada vez más brillosos y más lisos. Aunque en ninguno de los geles se logró resolver bandas, en los geles 1 y 2 se observa la formación de manchas mientras que en el gel 3 no es tan claro pareciéndose más a un chorrete. No se observa una diferencia importante entre ambas variedades de citrus. Todos los geles preparados en estas condiciones resistieron sin problemas el proceso de lavado con agitación pos-corrida electroforética y revelado, no se rompieron con la manipulación y al cortarlos con tanza se observó cada vez menos poroso el interior al ir aumentando el tiempo de calentamiento. 40
47 Figura 3.2: Estudio del efecto del tiempo de calentamiento del almidón para la preparación de geles. Gel 1: 9min, gel 2: 13min. y gel 3: 14min. Los geles se corrieron simultáneamente y en la misma cuba, usando como muestra dos variedades de citrus. Geles al 13%, de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 7,88, buffer de corrida Tris-Citrato 0,3M ph 7,5, la corrida duró 10 horas a 23-26V (50-52mA). Revelados con ACP. En los geles 1 y 2 se observa la formación de manchas mientras que en el gel 3 no es tan claro. No se observa una diferencia importante entre ambas variedades de citrus(e = Ellendale, S = Satsuma y Col = colorante). Método de siembra en SGE La siembra se realizó secando previamente las muestras (trozo de papel de filtro embebido en extracto vegetal) sobre una placa de vidrio en heladera, de esta forma quedaron rígidas y se las pudo introducir directamente en el gel, a unos 3cm de uno de los extremos. Entran de 4 a 5mm del papel en el gel. En todos los geles sembrados de esta manera la corrida procedió en forma normal. 41
48 3.3 Estudio de las condiciones de corrida en SGE Elección del buffer de corrida para SGE Se comenzó trabajando con el buffer de corrida más utilizado por Caro y col. en sus ensayos para citrus, Tris Citrato 0,3M ph 7 [14, 16, 31] pero no se lograron resultados satisfactorios en nativas. qse ensayaron distintos buffer de corrida procurando optimizar los resultados para nativas. (Tabla 3.3) (Figura 3.3). Tabla 3.3 Muestra los distintos buffers de corrida utilizados en SGE. ph Tris Citrato 0,3M 7 Tris Citrato 0,3M 7,5 Tris Citrato 0,03M 8,5 Tris Citrato 0,3M 8,5 Borato de sodio 0,34M 8,2 Borato de sodio 0,3M 8,6 Se continuo los ensayos con 2 buffers (Tris Citrato y Borato de sodio) a diferentes ph (7, 7,5 y 8,5 para Tris Citrato y 8,2 y 8,6 para Borato de sodio) y concentración (0,3 y 0,03M para Tris Citrato y 0,3 y 0,34 para Borato de sodio) (Tabla 3.3). En la Figura 3.3 se observan seis corridas electroforéticas de distintas variedades de Guayabos del país (salvo los carriles 3 y 7, Ubajay y 4 estearasa del gel B) en geles de almidón al 13% usando distintos buffer de corrida. En (A) Tris Citrato 0,3M ph 7, antes de revelar, se pueden observar los chorretes verdes en cada carril. En (B), (C) y (D) se usa un buffer en base Tris citrato [(B) Tris Citrato 0,3M ph 7,5, (C) Tris Citrato 0,3M ph 8,5 y (D) Tris Citrato 0,03M ph 8,5] donde no se logra aun la resolución de bandas pero si se observan chorrete. Y, en (E) y (F) se utilizó un nuevo buffer en base Borato de sodio, (E) Borato de sodio 0,34M ph 8,2 y (F) Borato de sodio 0,3M ph 8,6, donde generó la aparición de una 42
49 banda claramente definida. Se puede observar una mejora notoria en la resolución de bandas de la figura A hasta la F. Figura 3.3: Estudio del efecto del buffer de corrida en la electroforesis de Plantas Nativas en geles de almidón. SGE de extractos de distintas variedades de Guayabos del país (salvo los carriles 3 y 7, Ubajay y 4 estearasa del gel B) en geles de almidón al 13% usando distintos buffer de corrida: (A) Tris Citrato 0,3M ph 7 (sin revelar), (B) Tris Citrato 0,3M ph 7,5, (C) Tris Citrato 0,3M ph 8,5, (D) Tris Citrato 0,03M ph 8,5, (E) Borato de sodio 0,34M ph 8,2 y (F) Borato de sodio 0,3M ph 8,6. Estudio de la concentración de los geles de almidón Para estudiar si geles de diferentes concentraciones de almidón logran distinta separación de las proteínas de Plantas Nativas por SGE, se prepararon geles de almidón al 9, 11 y 13% [14,16] de concentración y se realizaron corridas electroforéticas manteniendo las mismas condiciones de ph, temperatura, tiempo, etc. y con las mismas muestras, en cada caso. Distintas concentraciones del gel significa variar el tamaño del poro que podría generar una separación de las proteínas distinta en cada caso, acorde a su tamaño molecular. 43
50 Figura 3.4: Estudio del efecto de la concentración de los geles de almidón sobre la resolución de bandas en electroforesis para nativas. En ambas figuras (a y b) se muestran dos variedades distintas de Guayabo del país corridas en geles de almidón de 9, 11 y 13% de concentración y revelados con ACP. Hojas provenientes de E.E.F.A.S, de 1 a 7 días en heladera. Geles 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de sodio 0,3M ph 8,6. 5 horas de corrida entre 25 a 50V (20 a 70mA). En la figura 3.4a y 3.4b, se observan 2 variedades de Guayabos del país corridos en geles de almidón de distintas concentraciones (13, 11 y 9% respectivamente) y revelados con ACP. Las hojas provienen de E.E.F.A.S., de 1 a 7 días de conservación en heladera. Se usaron geles de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de sodio 0,3M ph 8,6. La corrida duró 13 horas entre 25 a 50V (20 a 70mA). En otro ensayo (Figura 3.5) se probaron geles de 9 y 11% de concentración utilizando Guayabo del país proveniente de E.E.F.A.S., de 7 días de colectada y corridas en una misma cuba con Tris-Citrato 0,03M ph 8,5 como buffer de gel y Borato de Sodio 0,3M ph 8,6 como buffer de corrida, la electroforesis duró 13 horas a 53V que generó una corriente de 72mA. Se reveló con ACP. 44
51 Figura 3.5: SGE de Guayabos del país provenientes de E.E.F.A.S., de 7 días de colectadas. Gel (A) 9% y (B) 11% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas de corrida a 53V que generó una corriente de 72mA. Revelado con ACP. En todos los casos se observó la resolución de una única banda de aspecto similar en cuanto a definición, forma y tamaño. 3.4 Estudio de distintas variedades de Plantas Nativas por SGE Se realizaron electroforesis de distintas variedades conocidas de algunas de las especies de plantas nativas proporcionadas por E.E.F.A.S. en las condiciones previamente ajustadas utilizándose distintos sistemas enzimáticos para su estudio. Se emplearon hojas desde recién colectadas hasta de 15 días de conservación en heladera. Se utilizó geles al 13% salvo los de la figuras 3.11 y En todos los casos se utilizó buffer de gel Tris-Citrato 0,03M ph 8,5 y Borato de sodio 0,3M ph 8,6 como buffer de corrida. Las corridas oscilaron entre 10 a 23 horas de duración con un voltaje de 40 a 55V. 45
52 Revelado con Fosfatasa Ácida En las figuras 3.6, 3.7, 3.8, 3.9 y 3.10 se muestran los resultados obtenidos en la electroforesis en geles de almidón al 13% para las distintas variedades de plantas nativas revelados con fosfatasa ácida. Figura 3.6: SGE de citrus (C01) y nativas (Guayabo del país (G04 y G06), Arazá (A01), Guaviyú (Gi01) y Pitanga (P01)), provenientes de E.E.F.A.S., de 8 y 19 días (G04) de colectadas. Gel 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 10 horas de corrida a 45-50V que generó una corriente relativamente constante entre 47 a 62mA. Revelado con ACP. Figura 3.7: SGE de Arazá, Guayabos del país y Ubajay provenientes de árboles, de variedades desconocidas, cercanos al laboratorio, recién colectados. Gel 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 23 horas 15 minutos de corrida a 41-46V (54-59mA pero, alcanzando un pico de 90mA). Revelado con ACP. 46
53 Figura 3.8: SGE de Guayabos del país provenientes de E.E.F.A.S., de 49 (G04), 23 (G06) y las restantes de 8 días de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 23 horas de corrida a 50V que generó una corriente de 54mA. Revelado con ACP. Figura 3.9: SGE de Guayabos del país provenientes de E.E.F.A.S., de 1 día de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas de corrida a 42V que generó una corriente de 50mA. Revelado con ACP. 47
54 Figura 3.10: SGE de Guayabos del país provenientes de E.E.F.A.S., de 1 día de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas 10 minutos de corrida a 44V (71mA). Revelado con ACP. En todos los casos anteriores se puede observar la aparición de una única banda para cada variedad sembrada. Revelado con Fosfatasa Alcalina En las figuras 3.11 y 3.12 se muestran los resultados obtenidos en la electroforesis en geles de almidón al 13% para las distintas variedades de Guayabo del país revelados con fosfatasa alcalina. Figura 3.11: SGE de Guayabo del país proveniente de E.E.F.A.S., de 1 día de colectada. Gel al 13% de 100x50x4mm, buffer de gel Tris- Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas de corrida a 42V que generó una corriente de 50mA. Revelado con ALP. 48
55 Figura 3.12: SGE de Guayabos del país provenientes de E.E.F.A.S., de 1 día de colectada. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas 10 minutos de corrida a 44V y de 69mA de corriente. Revelado con ALP. En ambos casos se puede observar la aparición de una única banda para cada variedad sembrada. Revelado con Peroxidasa En las figuras 3.13 y 3.14 se muestran los resultados obtenidos en la electroforesis en geles de almidón al 13% para las distintas variedades de Guayabos del país revelados peroxidasa. Figura 3.13: SGE de Guayabos del país provenientes de E.E.F.A.S., de 44 (G04), 17 (G06) y 2 días de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 9,5 horas de corrida a 51V y 59mA. Revelado con PRX. 49
56 Figura 3.14: SGE de Guayabos del país provenientes de E.E.F.A.S., de 49 (G04), 23 (G06) y 8 días de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 23 horas de corrida a 50V y 54mA de corriente. Revelado con PRX. En todos los casos se puede observar la aparición de una única banda para cada variedad sembrada. Revelado con Estearasa En las figuras 3.15, 3.16, 3.17 y 3.18 se muestran los resultados obtenidos en la electroforesis en geles de almidón al 13% para las distintas variedades de plantas nativas revelados estearasa. Figura 3.15: SGE de Ubajay (0días) y Guayabos del país provenientes de E.E.F.A.S., de 56 (G04) y 15 días de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 9,45 horas de corrida a 54V (67mA). Revelado con EST. 50
57 Figura 3.16: SGE de Arazá (A), Guayabos del país (G) y Ubajay (U), provenientes de árboles cercanos al laboratorio, recién colectados. Geles al 13% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 23 horas 15 minutos de corrida a 41-46V (54mA pero, alcanzando un pico de 90mA). Revelado con EST. Figura 3.17: SGE de Guayabos del país provenientes de E.E.F.A.S., de 1 día de colectadas. Geles al 13% de 100x50x4mm, buffer de gel Tris- Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas de corrida a 42V (48mA). Revelado con EST. 51
58 Figura 3.18: SGE de Guayabos del país provenientes de E.E.F.A.S., de 7 días de colectada. Gel al 11% de 100x50x4mm, buffer de gel Tris-Citrato 0,03M ph 8,5, buffer de corrida Borato de Sodio 0,3M ph 8,6, con 13 horas de corrida a 53V que generó una corriente de 45mA. Revelado con EST. El patrón de banda obtenido es similar en todos los casos expuestos anteriormente, independientemente del sistema enzimático utilizado para el revelado. Para todos los sistemas enzimáticos, utilizados en el revelado de la SGE, se puede observar la aparición de una única banda para cada variedad sembrada y aunque en todas las corridas se procedió a la separación hasta que el frente de corrida llegara al final de gel, la banda siempre aparece ubicada del medio del gel hacia la mitad superior. Se observa también para las muestras de Guayabo del país una continuación del sombreado luego de la banda lo cual no ocurre para las variedades de Arazá y Ubajay utilizados ni para el citrus. (Figuras 3.6, 3.9, 3.10, 3.11, 3.12, 3.15, 3.16, 3.17 y 3.18) Se realizan algunos ensayos en geles de poliacrilamida para estudiar si se obtiene una separación de bandas diferente o para confirmar si corresponde a una única banda, dada la mayor sensibilidad del método. 52
59 3.5 Preparación de muestras para PAGE Método de extracción de muestras para PAGE Se probaron dos métodos de extracción En ambos métodos se comienza por picar con bisturí las hojas ya limpias. En el primer método (A) las hojas ya picadas se machacan con varilla o con brazo de mortero, en pocillo de porcelana, con una parte del buffer de extracción, luego se traspasan a un Eppendorf que contiene otra porción del buffer de extracción, pre-enfriado en heladera, y se lo vuelve a la heladera por unos minutos para que actúe el buffer. En el segundo método (B) el picadillo de hojas se pasa a un Eppendorf con una porción del buffer de extracción, también previamente enfriado en heladera, se mezcla y presiona con una Pellet Pestle, se agrega la otra porción del buffer de extracción y se deja actuar por unas minutos en heladera. Para ambos métodos las hojas fueron proporcionadas por E.F.F.A.S. y corresponden a las variedades de Guayabo del país: (1) G20, (2) G19, (3) P02, (4) G03 y (5) G04. Con las muestras preparadas por ambos métodos se realizó una electroforesis en geles de poliacrilamida (Figura 3.19) al 8,5% con buffer de extracción Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7,0 y buffer de corrida Tris 0,04M Glicina 0,2M ph 8,3. La corrida duró 2 horas a 115V (60 a 20mA). Se reveló con ACP. En la figura 3.19 los carriles señalados con la letra A corresponden a las extracciones por el método A y los señalados con B a los del método B, a su vez los números (1 a 5) corresponden a los distintos tipos de muestras. O sea, el par A1 B1, de los dos primeros carriles, corresponde a la muestra 1 (G20) extraída por el método A y B respectivamente. Aunque no se logró una buena definición en la corrida, en la figura se puede observar que no existe una diferencia importante en la intensidad en cada una de las muestras procesadas por ambos métodos de extracción. 53
60 Figura 3.19: Comparación de dos métodos de extracción proteica, A y B, para hojas de Plantas Nativas usadas en PAGE. Geles de poliacrilamida al 8,5%. Buffer de extracción: Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7,0; buffer de corrida: Tris 0,04M Glicina 0,2M ph 8,3. Dos horas de corrida a 115V (60 a 20mA). Revelado con ACP. Hojas proporcionadas por E.F.F.A.S y corresponden a: (1) G20, (2) G19, (3) P02, (4) G03 y (5) G04. PAGE Estudio del método de conservación de la extracción vegetal para Con el fin de estudiar el efecto de la conservación de los extractos vegetales luego de procesados para ser utilizados en las electroforesis en geles de poliacrilamida se realizaron cinco extracciones de Guayabos del país, se alicuotaron, etiquetaron y congelaron hasta el momento de su uso. Una alícuota de cada variedad fue descongelada a distintos tiempos (1, 13 y 27 días) para la realización de una electroforesis (Figura 3.20). En la figura 3.20 se observan estas tres electroforesis con: (A) 1 día, (B) 13 días y (C) 27 días de congelamiento. Se utilizó geles de poliacrilamida al 8,5%, buffer de extracción Tris 0,1M, Mercaptoetanol 0,4%, Glicerol 20%, Tritón 0,5% y PVP 5% ph 7 y buffer de 54
61 corrida Tris 0,04M, Glicina 0,2M ph 8,3. Se sembraron 20μl de cada muestra. Las corridas procedieron durante 2 a 3hs a 100V (50-70mA) y se revelaron con ACP. No se observa una diferencia apreciable entre estos tres geles (A, B y C), ni variación en la intensidad de la tinción. En ninguno de los casos se observan bandas pero si una zona de tinción más intensa en la porción superior del gel. Incluso en el gel C, el de mayor tiempo de congelado, donde podría esperarse una disminución de color, la porción inferior del mismo se aprecia más oscura que la A y que la B respectivamente. Figura 3.20: Estudio del efecto del tiempo de congelamiento de los extractos vegetales utilizados en electroforesis. En la figura se observan tres electroforesis en geles de poliacrilamida de los mismos extractos vegetales, de cinco variedades de Guayabo del país, procesado el mismo día de su colecta, alicuotados y conservados en freezer hasta su utilización en la corrida electroforética: (A) 1 día, (B) 13 días y (C) 27 días de congelamiento. Geles de poliacrilamida al 8,5%, buffer de extracción Tris 0,1M, Mercaptoetanol 0,4%, Glicerol 20%, Tritón 0,5% y PVP 5% ph 7 y buffer de corrida Tris 0,04M, Glicina 0,2M ph 8,3, a 100V (50-70mA), 2 a 3hs, 20ul de siembra y reveladas con ACP. Elección del buffer de extracción para PAGE Se ensayaron dos buffers de extracción (Tabla 3.4), de igual ph pero de diferente composición. El BE2 es igual al BE1 pero contiene además Tritón y PVP. 55
62 Tabla 3.4 Composición de los buffer de extracción utilizados. Composición ph BE1 Tris-HCl 0,1M, Mercaptoetanol 0,14M 7 BE2 Tris 0,1M, Mercaptoetanol 0,4%, Glicerol 20%, Tritón 0,5% y PVP 5% 7 Se realizaron dos electroforesis, para las mismas muestras de Plantas Nativas (A01, U01, Gi01, P02, Gi02, G04, G02, G05, G03 Y G01, sembradas en ese orden) (Figura 3.21). En el gel A se utilizó el BE1 y en el gel B el BE2, usando siempre el mismo buffer de corrida, Tris 0,04M, Glicina 0,2M ph 8,3. Se manejó el mismo voltaje para todas las electroforesis (100V) que generó una corriente semejante en cada corrida (60-70mA). El tiempo de corrida fue de 2 horas para todos los casos y los 4 geles se revelaron con ACP. Figura 3.21: Estudio del efecto del buffer de extracción en PAGE. Se utilizaron dos buffer de extracción: BE1, Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7 (A) y BE2, Tris 0,1M, Mercaptoetanol 0,4%, Glicerol 20%, Tritón 0,5% y PVP 5% ph 7 (B) en 2 electroforesis en geles de poliacrilamida al 8,5%, buffer de corrida Tris 0,04M, Glicina 0,2M ph 8,3, a 100V (60mA) por 2 horas y revelados con ACP. En ambos geles se sembraron las mismas muestras y en el mismo orden: A01, U01, Gi01, P02, Gi02, G04, G02, G05, G03 Y G01. No se observa una diferencia remarcable entre estas electroforesis salvo un muy leve aumento en la intensidad del fondo al usar BE2, en B. 56
63 Tiempo de vida útil de las hojas luego de ser colectadas, para PAGE Las hojas colectadas se conservan en bolsas de nailon, cerradas y etiquetadas, en freezer y en algunos casos en heladera. Se realizaron ensayos usando hojas recién arrancadas hasta hojas conservadas en freezer por poco más de un mes. En la Tabla 3.5 se muestran los días de conservación de cada variedad de hojas utilizadas en PAGE, luego de ser colectadas. Al igual que para SGE, en este caso, y solo con fines comparativos, se consideró como resultados positivo (sombreado en amarillo) la aparición de una o más bandas y negativos a manchas, chorretes y ausencia de resultados. En dicha tabla se observa como hojas del mismo tiempo de conservación rinden tanto resultados positivos como negativos en diferentes ensayos. Por ejemplo, Arazá (Figura 3.22), Pitanga, Guaviyú y Guayabo del país de 15 días de conservación o Guayabo del país 1 y 28 días. Tabla 3.5 Tiempo de conservación desde su colecta de hojas utilizadas para PAGE. Las hojas utilizadas son de distintas variedades de nativas y proceden de E.E.F.A.S. y se conservaron desde su colecta hasta su uso en freezer y en algunos casos en heladera. Para este caso se considera resultado positivo (sombreado en amarillo) a la resolución de una o más bandas en el PAGE. Los resultados negativos incluyen manchas, chorretes y ausencia de resultados. PLANTA DIAS DESDE COLECTA Arazá Guaviyú Pitanga Guayabo del país Ubajay En la figura 3.22 se muestra, como ejemplo, algunas PAGE realizadas usando hojas de Arazá de distintos tiempos de conservación pos colecta. Se uso geles de poliacrilamida al 8,5% excepto el del día 30 para el que se usó un gel al 10%. Para los días 0, 14 y 15 se uso 57
64 BE2 (Tris 0.1M ph 7, Mercaptoetanol 0.4%, Glicerol 20%, Tritón 0,5%, PVP 5%) y para el resto BE1 (Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7,0) y buffer de corrida: Tris 0,04M Glicina 0,2M ph 8,3. En todos los casos se reveló con ACP. Dos horas de corrida promedio a V (de 20 a 115mA). En todas las electroforesis se obtuvieron, con mayor o menor definición, resultados. Figura 3.22: PAGE realizadas con muestras de Arazá de distintos tiempos de conservación pos colecta. Se usó el mismo buffer de corrida (Tris 0,04M Glicina 0,2M ph 8,3) y revelador (ACP) pero diferentes buffer de extracción, siendo para los geles del día 0, 14 y 15 BE2 (Tris 0.1M ph 7, Mercaptoetanol 0.4%, Glicerol 20%, Tritón 0,5%, PVP 5%) y para los restantes BE1 (Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7,0). Se utilizó geles al 8.5% salvo el gel de 30 días que es al 10%. Las corridas duraron 2 horas promedio a V. Determinación del volumen de siembra Se realizaron dos corridas electroforéticas, donde se sembraron distintos volúmenes de la misma muestra. En el gel de la figura 3.23 se muestran los resultados de la corrida electroforética de 3 muestras de extractos de nativas, sembradas a 10 y 20μl, en un gel de poliacrilamida al 8,5%, donde se usó buffer de extracción BF y, buffer de corrida Tris 0,04M, Glicina 0,2M ph 8,3, se aplicaron 100v (70-50mA) de corriente y la corrida duró dos horas. Se reveló con ACP. 58
65 Figura 3.23: Estudio del efecto del volumen de muestra sembrado, en la resolución de PAGE. Se sembró Ubajay (carriles 1 y 8), Arazá (carriles 4 y 9) y A01 (carriles 5 y 10), en 20 y 10μL respectivamente. Gel de poliacrilamida al 8,5%. Buffer de extracción Tris-HCl 0,1M, Mercaptoetanol 0,14M, 20% Glicerol, Azul de bromofenol ph 7,0; buffer de corrida Tris 0,04M Glicina 0,2M ph 8,3. Dos horas de corrida a 100V (70 a 50mA). Revelado con ACP. En un segundo ensayo, figura 3.24, se probó un mayor rango de volúmenes de muestras (5, 10, 15 y 20μL) para distintas variedades de Guayabo del país y para un citrus como control. Se sembró en un gel de poliacrilamida al 10%, se uso buffer de extracción BE2, buffer de corrida Tris 0,04M, Glicina 0,2M ph 8,3, 30V (95mA) y diez horas de corrida. Se reveló con ACP. No se observa una diferencia entre los corridas de las mismas variedades sembradas a distintos volúmenes, solamente una disminución en la intensidad del color de la corrida al disminuir el volumen pero manteniendo el mismo patrón. Aunque en la figura 3.23 no se logró una resolución de bandas y en la figura 3.24 sí, en ambas se puede observar claramente esta diferencia en la intensidad del color de las corridas. 59
66 Figura 3.24: Estudio del efecto del volumen de muestra sembrado en la resolución de PAGE. Siembras a distintos volúmenes (5, 10, 15 y 20μL) de variedades de Guayabo del país (carril 3 al 10) y de un citrus (carriles 1 y 2), en gel de poliacrilamida al 10%. Buffer de extracción: Tris-HCl 0,1M, Mercaptoetanol 0,14M, 20% Glicerol, Azul de bromofenol ph 7,0; buffer de corrida: Tris 0,04M Glicina 0,2M ph 8,3. Diez horas de corrida a 30V (95mA). Revelado con ACP. 3.6 Preparación de geles de poliacrilamida Estudio de la concentración de los geles de poliacrilamida Se trabajó con geles de poliacrilamida al 8,5, 9,0 y 10% de concentración, figura 3.25, A, B y C, respectivamente. Al aumentar el % de gel (concentración de acrilamida total) disminuye el tamaño de poro.[33] 60
67 En la figura 3.25 A se sembraron extractos de Guaviyú (carriles 1, 3 y 7), Arazá (carriles 4 y 8), Guayabo del país (5, 6 y 9), Ubajay (carril 2) y Pitanga (carril 10), en la figura 3.25 B se muestra una PAGE para muestras de Guayabo del país solamente y en la figura 3.25 C se sembró en los dos primeros carriles Satsuma y en los restantes tres variedades de Guayabo del país. Los tres geles se revelaron con ACP. En la figura se observa una mejora de la resolución de bandas desde el gel A al C, o sea del gel de menor (8.5%) al de mayor (10%) concentración. En el gel A solo se observa una banda en el carril 8 (Arazá), mientras que en el gel B se observa una banda para cada una de las muestras sembradas de Guayabo del país y en el gel C se pueden ver 2 bandas claramente identificadas para las muestras de citrus (carriles 1 y 2) y una única banda en los carriles restantes que corresponden a muestras de Guayabos del país. Aunque en esta figura se exponen los 3 geles de mejor resolución de todas las PAGE realizadas para cada caso, los resultados fueron algo variables para cada porcentaje de gel utilizado en el total de las PAGE realizadas, sin embargo se observa esta tendencia de obtener mejores definición de las bandas al utilizar geles de mayor concentración. 61
68 Figura 3.25: Estudio del efecto del % de los geles de poliacrilamida en la corrida electroforética. (A) Geles 8,5% (B) 9% (C) 10% de concentración. En la figura se muestran, a modo de ejemplo, los 3 geles de mejor resolución de todas las PAGE realizadas para cada porcentaje de gel ensayado. En la figura A se sembraron distintas plantas nativas, Guaviyú (carriles 1, 3 y 7), Arazá (carriles 4 y 8), Guayabo del país (5, 6 y 9), Ubajay (carril 2) y Pitanga (carril 10), en la figura B solamente se sembró Guayabo del país y en la C se sembró Satsuma en los 2 primeros carriles y tres variedades de Guayabos del país. Todos fueron revelados con ACP. 62
69 Elección del buffer de corrida para PAGE Se ensayaron 5 buffers de corrida (Tabla 3.6), un grupo de 3 buffers de igual composición (Tris 0,04M, Glicina 0,2M) pero de distintos ph y el otro grupo de 2 buffers, también de igual composición (Tris 0,04M) pero que varían en sus ph. Tabla 3.6 Composición de los buffer de corrida utilizados. Composición ph BC1 Tris 0,04M, Glicina 0,2M 8,3 BC2 Tris 0,04M, Glicina 0,2M 7,5 BC3 Tris 0,04M, Glicina 0,2M 7 BC4 Tris 0,04M 8,3 BC5 Tris 0,04M 8,0 En algunas corridas al BC1 se le agregó Glicerol y Azul de bromofenol que no altera la composición del buffer como tal. En la figura 3.26 se observa una PAGE para cada uno de los buffers ensayados, tal que (A) BC1, (B) BC2, (C) BC3, (D) BC4 y (E) BC5. Se utilizó la misma especie de plantas en todas ellas, Guayabo del país, salvo los dos primeros carriles de la figura A donde se sembró citrus Satsuma. Los mejores resultados se observan en los geles A (BC1) y C (BC3) que corresponden a buffer Tris 0,04M Glicina 0,2M, dado que se observan claramente las bandas generadas. 63
70 Figura 3.26: Estudio del efecto de los diferentes buffers de corridas utilizados para PAGE en distintas variedades de Guayabo del país. En (A), (B) y (C) se uso buffer de corrida Tris 0,04M Glicina 0,2M a ph 8,3, 7,5 y 7,0 respectivamente (BC 1, 2 y 3). En (D) y (E) se uso buffer Tris 0,04M a ph 8,3 y 8,0 (BC 4 y 5) en ese orden. Todos se revelaron con ACP. 64
71 3.7 Uso de diferentes sistemas enzimáticos para el estudio de Plantas Nativas por PAGE Se realizó electroforesis de dos geles de poliacrilamida al 10%, corridos en serie, cada uno de los cuales se reveló con un sistema enzimático diferente: el gel superior (A) con ACP y el inferior (B) con EST.(Figura 3.27) Se corrieron distintas variedades de Guayabo del país de 31 días de conservación congeladas, usando como buffer de extracción Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7, buffer de gel Tris-HCl 3M ph 8,8 y buffer de corrida Tris 0,04M ph 8,3 a 65V (40-60mA) por 2,5 horas (gel A) y 3 horas (gel B). Aunque se observa una diferencia importante en la intensidad de tinción entre ellos, en ninguno de los dos geles se llega a desarrollar un patrón de bandas. Figura 3.27: Estudio de Plantas Nativas por PAGE usando diferentes sistemas enzimáticos. Electroforesis realizada dos geles de poliacrilamida al 10%, de muestras de distintas variedades de Guayabo del país proporcionadas por E.F.F.A.S, de 31 días de cosechadas y conservadas congeladas. Se uso buffer de gel Tris-HCl 3M ph 8,8, buffer de extracción Tris-HCl 0,1M, Mercaptoetanol 0,14M ph 7 y buffer de corrida 0,04M ph 8,3. Las muestras se procesaron y se usaron en el momento. Los geles se corren en serie, compartiendo la misma fuente de poder. La electroforesis se realizó a 65V, lo que generó una corrida para el gel de la foto superior a 62mA de corriente por 2,5 horas y de 40mA para el gel de la foto inferior por 3 horas.(a) Se reveló con ACP y (B) con EST. 65
Actividad inmunoestimulante de extractos de frutas nativas
 Actividad inmunoestimulante de extractos de frutas nativas MSc. Gabriela Ferragut Laboratorio de Inmunología Dr. Alberto Nieto Regional Norte-Salto CenUR Litoral Norte UdelaR Frutas nativas Grupo Interdisciplinario
Actividad inmunoestimulante de extractos de frutas nativas MSc. Gabriela Ferragut Laboratorio de Inmunología Dr. Alberto Nieto Regional Norte-Salto CenUR Litoral Norte UdelaR Frutas nativas Grupo Interdisciplinario
Selección de Frutales Nativos
 Selección de Frutales Nativos Objetivo: Selección de frutales nativos con potencial comercial Inicio: 2000 Participantes: Facultad de Agronomía - INIA - MGAP Objetivos Material vegetal no domesticado Diversidad
Selección de Frutales Nativos Objetivo: Selección de frutales nativos con potencial comercial Inicio: 2000 Participantes: Facultad de Agronomía - INIA - MGAP Objetivos Material vegetal no domesticado Diversidad
Selección de frutales nativos
 Selección de frutales nativos Ing. Agr. Beatriz Vignale Estación Experimental Salto Facultad de Agronomía Universidad de la República Cuáles son, dónde están y qué características tienen? Etapas: Inicio:
Selección de frutales nativos Ing. Agr. Beatriz Vignale Estación Experimental Salto Facultad de Agronomía Universidad de la República Cuáles son, dónde están y qué características tienen? Etapas: Inicio:
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS. Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo (+)
 GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
GENERALIDADES Y APLICACIONES DE LA ELECTROFORESIS Electroforésis Separación de especies cargadas (anión (-) y catión (+) ) Influencia de campo cargado eléctricamente Movimiento al cátodo (-) o al anodo
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B
 ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
ELECTROFORESIS Q U Í M I C A B I O L Ó G I C A. D E P A R T A M E N T O D E B Q C A. F C N Y C S. U N P S J B 2 0 1 7 Que es la electroforesis? Qué permite analizar? Que factores influyen? Separar y analizar
DESARROLLO COGNOSCITIVO Y APRENDIZAJE
 Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
Prof. Jhonis Valbuena Cátedra: Análisis Instrumental La Electrofóresis es un método de la Química Analítica que utiliza corriente eléctrica controlada con la finalidad de separar biomolèculas según su
Electroforesis de proteínas en geles de poliacrilamida
 Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Electroforesis de proteínas en geles de poliacrilamida Electroforesis de proteínas en geles de poliacrilamida: Introducción y técnica básica La electroforesis de proteínas en geles con una matriz de poliacrilamida,
Introducción. Electroforesis zonal Campo aplicado a un soporte estabilizante Muestra dispuesta sobre una zona reducida del soporte
 Introducción Técnica analítica separativa: Transporte de moléculas cargadas bajo la acción de un campo eléctrico Movilidad electroforética depende de: La carga de la molécula Depende del medio ph Fuerza
Introducción Técnica analítica separativa: Transporte de moléculas cargadas bajo la acción de un campo eléctrico Movilidad electroforética depende de: La carga de la molécula Depende del medio ph Fuerza
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS
 ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
ELECTROFORESIS GENERALIDADES Y APLICACIONES CLINICAS Marcelo Castillo Navarrrete, T.M. MsCs (C) Facultad de Medicina Carrera Tecnología Médica 18 de Noviembre de 2004 Fundamentos de Electroforesis Alta
CARACTERIZACION GENETICA DEL GUAYABO DEL PAIS
 CARACTERIZACION GENETICA DEL GUAYABO DEL PAIS Pritsch C., Quezada M., Garcia AAF., Alvarez M., Machado G., Bernal J., Cazzulo Y., Malosetti M., Zaccari F., Rivas, M., Cabrera D., Vignale 6to Encuentro
CARACTERIZACION GENETICA DEL GUAYABO DEL PAIS Pritsch C., Quezada M., Garcia AAF., Alvarez M., Machado G., Bernal J., Cazzulo Y., Malosetti M., Zaccari F., Rivas, M., Cabrera D., Vignale 6to Encuentro
Electroforesis de proteínas
 Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
Electroforesis de proteínas Introducción general La electroforesis es un método de separación basado en la tasa diferencial de migración de especies cargadas al estar en un campo eléctrico de DC La electroforesis
CUANTIFICACIÓN DEL CONTENIDO EN COMPUESTOS FENÓLICOS Y ACTIVIDAD ANTIOXIDANTE DEL BUTIA.
 CUANTIFICACIÓN DEL CONTENIDO EN COMPUESTOS FENÓLICOS Y ACTIVIDAD ANTIOXIDANTE DEL BUTIA. Est. Ing.Alim. Beatriz Alicia Soto Acland Ing. Agr. Alicia Feippe, Ms Programa Nacional de Investigación en Producción
CUANTIFICACIÓN DEL CONTENIDO EN COMPUESTOS FENÓLICOS Y ACTIVIDAD ANTIOXIDANTE DEL BUTIA. Est. Ing.Alim. Beatriz Alicia Soto Acland Ing. Agr. Alicia Feippe, Ms Programa Nacional de Investigación en Producción
ELECTROFORESIS. Objetivo de la clase. *fundamentos *procedimientos *algunas aplicaciones. Conocer los métodos electroforéticos
 ELECTROFORESIS Objetivo de la clase Conocer los métodos electroforéticos *fundamentos *procedimientos *algunas aplicaciones Definición de electroforesis Proceso de separación que se basa en la diferente
ELECTROFORESIS Objetivo de la clase Conocer los métodos electroforéticos *fundamentos *procedimientos *algunas aplicaciones Definición de electroforesis Proceso de separación que se basa en la diferente
Tema 6 Cuantificación de proteínas
 Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
Tema 6 Cuantificación de proteínas Procedimiento de estudio de proteínas Selección de fuente Fraccionamiento de células Centrifugación Cromatografía Cromatografía en capa fina Cromatografía en columna
ELECTROFORESIS Fundamento.
 ELECTROFORESIS La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través
ELECTROFORESIS La electroforesis es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar biomoleculas según su tamaño y carga eléctrica a través
CROMATOGRAFÍA DE AMINOÁCIDOS
 CROMATOGRAFÍA DE AMINOÁCIDOS Electroforesis.- Es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar aminoácidos (y otras biomoléculas) según su
CROMATOGRAFÍA DE AMINOÁCIDOS Electroforesis.- Es un método de laboratorio en el que se utiliza una corriente eléctrica controlada con la finalidad de separar aminoácidos (y otras biomoléculas) según su
Monitoreo de un proceso de purificación de proteínas. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa
 Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
Monitoreo de un proceso de purificación de proteínas Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DEPARTAMENTO DE QUIMICA Y TECNOLOGÍA ASIGNATURA QUIMICA ANALITICA
 UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DEPARTAMENTO DE QUIMICA Y TECNOLOGÍA ASIGNATURA QUIMICA ANALITICA INFORME DE LABORATORIO PRACTICA DE DETERMINACION DE CONDUCTIVIDAD DE ELECTROLITOS
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DEPARTAMENTO DE QUIMICA Y TECNOLOGÍA ASIGNATURA QUIMICA ANALITICA INFORME DE LABORATORIO PRACTICA DE DETERMINACION DE CONDUCTIVIDAD DE ELECTROLITOS
IX.1.-Apéndice 1.- Soluciones amortiguadoras para la electroforesis.
 IX.- APÉNDICES. IX.1.-Apéndice 1.- Soluciones amortiguadoras para la electroforesis. Amortiguador C Tris 0.087 M Ácido bórico 0.0087 M EDTA 0.001 M ph 9.0 El mismo del electrodo Amortiguador D Tris 0.135
IX.- APÉNDICES. IX.1.-Apéndice 1.- Soluciones amortiguadoras para la electroforesis. Amortiguador C Tris 0.087 M Ácido bórico 0.0087 M EDTA 0.001 M ph 9.0 El mismo del electrodo Amortiguador D Tris 0.135
PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA
 INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
INTRODUCCIÓN PRÁCTICA 9 ELECTROFORESIS EN GEL DE AGAROSA La electroforesis es una técnica que permite separar moléculas cargadas eléctricamente, entre las cuales se encuentran los ácidos nucleicos (DNA
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa
 MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa Qué es la electroforesis? Es la técnica que permite la separación
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS. Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa.
 MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
MONITOREO DE UN PROCESO DE PURIFICACIÓN DE PROTEÍNAS Corrimiento electroforético de las muestras de la purificación de la lactato deshidrogenasa. Qué es la electroforesis? Es la técnica que permite la
PURIFICACIÓN DE ENZIMAS
 PURIFICACIÓN DE ENZIMAS MÉTODOS GENERALES DE EXTRACCIÓN Y PURIFICACIÓN CAMILO BECERRA (TUQ) MARÍA FERNANDA FERRERO (TUQ) INTRODUCCIÓN EN LA NATURALEZA EXISTEN CANTIDADES INIMAGINABLES DE COMPUESTOS, PERO
PURIFICACIÓN DE ENZIMAS MÉTODOS GENERALES DE EXTRACCIÓN Y PURIFICACIÓN CAMILO BECERRA (TUQ) MARÍA FERNANDA FERRERO (TUQ) INTRODUCCIÓN EN LA NATURALEZA EXISTEN CANTIDADES INIMAGINABLES DE COMPUESTOS, PERO
AVANCES EN LA PROPAGACIÓN POR ENRAIZAMIENTO DE ESTACAS SEMI-LEÑOSAS DE GUAYABO DEL PAÍS (ACCA SELLOWIANA (BERG) BURRET)
 AVANCES EN LA PROPAGACIÓN POR ENRAIZAMIENTO DE ESTACAS SEMI-LEÑOSAS DE GUAYABO DEL PAÍS (ACCA SELLOWIANA (BERG) BURRET) Cabrera, D. 1 ; Rodríguez, P. 1, Vignale, B. 2 Mara. V. 3 1. INIA Las Brujas. Programa
AVANCES EN LA PROPAGACIÓN POR ENRAIZAMIENTO DE ESTACAS SEMI-LEÑOSAS DE GUAYABO DEL PAÍS (ACCA SELLOWIANA (BERG) BURRET) Cabrera, D. 1 ; Rodríguez, P. 1, Vignale, B. 2 Mara. V. 3 1. INIA Las Brujas. Programa
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa
 Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
Trabajo Práctico 5: Electroforesis de proteínas Electroforesis de proteínas en Acetato de celulosa OBJETIVO: -Realizar electroforesis de las proteínas presentes en suero utilizando acetato de celulosa
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
Departamento de Biología de Sistemas Unidad Docente de Bioquímica y Biología Molecular ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE 1. FUNDAMENTO TEÓRICO La electroforesis es una técnica de
ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE
 1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo
1. FUNDAMENTO TEÓRICO ELECTROFORESIS EN GEL DE POLIACRILAMIDA CON SDS SDS-PAGE Departamento de Bioquímica La electroforesis es una técnica de separación de moléculas cargadas por migración en un campo
Flora Indígena en Montevideo. (Segunda entrega) Castillo del Parque Rodó.
 Flora Indígena en Montevideo. (Segunda entrega) Castillo del Parque Rodó. F. Muñoz Foto 1 Castillo Parque Rodó. El Castillo del Parque Rodó y el Lago del Parque Rodó, representan lugares ineludibles para
Flora Indígena en Montevideo. (Segunda entrega) Castillo del Parque Rodó. F. Muñoz Foto 1 Castillo Parque Rodó. El Castillo del Parque Rodó y el Lago del Parque Rodó, representan lugares ineludibles para
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo
 Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Purificación de la enzima lactato deshidrogenasa de músculo esquelético de pollo ESQUEMA GENERAL Sesión 1. Extracción y precipitación con sulfato de amonio. Sesión 2. Purificación por cromatografía Sesión
Los principales mecanismos que intervienen en la separación cromatográfica son:
 TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
TP 8 CROMATOGRAFIA EN PAPEL, Introducción Los métodos cromatográficos son un conjunto de técnicas empleadas para separar compuestos químicos de una mezcla. Su nombre significa escribir con color ya que
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Easy PDF Creator is professional software to create PDF. If you wish to remove this line, buy it now.
 1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
1 Virología y Micología Veterinaria Trabajo Práctico No. 4 ELECTROFORESIS La electroforesis es una técnica utilizada para separar grandes moléculas por tamaño a través de la aplicación de un campo eléctrico
Técnicas de Estudio de las células
 Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Técnicas de Estudio de las células Microscopia Preparaciones permanentes: Fijación Deshidratación Inclusión Corte Fijación: Acidos, solventes orgánicos como alcohol, aldehídos (Formaldehído, glutaraldehídos)
Identificación de nuevos genotipos de olivos en Uruguay a partir de marcadores moleculares y morfológicos.
 Identificación de nuevos genotipos de olivos en Uruguay a partir de marcadores moleculares y morfológicos. Pereira, J 1., Bernal, J 1., Martinelli, L 1., Villamil, J 2. y P. Conde 2. 1 Facultad de Agronomía,
Identificación de nuevos genotipos de olivos en Uruguay a partir de marcadores moleculares y morfológicos. Pereira, J 1., Bernal, J 1., Martinelli, L 1., Villamil, J 2. y P. Conde 2. 1 Facultad de Agronomía,
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD B. CROMATOGRAFÍA DE FILTRACIÓN EN GEL. 1. Principios. No requiere la unión de la proteína, lo cual
PURIFICACIÓN DE PROTEÍNAS
 PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
PURIFICACIÓN DE PROTEÍNAS ESQUEMA DE PURIFICACIÓN DE UNA PROTEÍNA tejido vegetal animal homogeneizar cultivo celular bacterias levaduras células mamíferos PREPARACIÓN EXTRACTO crudo fraccionamiento subcelular
Demostración de la naturaleza proteica de la enzima catalasa en vegetales. I.- Introducción:
 Demostración de la naturaleza proteica de la enzima catalasa en vegetales I.- Introducción: Las enzimas están en el centro de cada proceso bioquímico. Actuando en secuencias organizadas catalizan cientos
Demostración de la naturaleza proteica de la enzima catalasa en vegetales I.- Introducción: Las enzimas están en el centro de cada proceso bioquímico. Actuando en secuencias organizadas catalizan cientos
BIOQUÍMICA GENERAL. MSc. Dania Martín
 BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
BIOQUÍMICA GENERAL MSc. Dania Martín UNIDAD # 3: PROTEÍNAS Clase #7 OBJETIVOS Conceptuales Procedimentales Actitudinales CONTENIDOS Analizar el objeto de Diferenciar el objeto de Ser consciente de la 1.
SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS Elaborado por Lic. Fernando Andrade
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2014 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2014 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos.
 ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
ELEMENTOS QUÍMICOS DE LA MATERIA VIVA Materia constituida por combinación de elementos químicos. De los 92 elementos químicos que existen en la naturaleza 30 esenciales para organismos vivos. ÁTOMOS ÁTOMO
Trabajo Práctico N 3. Reconocimiento de sustancias ácidas, básicas y neutras. mediante el empleo de indicadores químicos.
 Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Trabajo Práctico N 3 Reconocimiento de sustancias ácidas, básicas y neutras mediante el empleo de indicadores químicos. Objetivos: Diferenciar mediante el empleo de indicadores u el cambio de color de
Técnicas de Caracterización y purificación
 Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Técnicas de Caracterización y purificación hidrofobicidad carga Propiedades de las proteínas utilizadas para caracterizar y purificar Carga Tamaño Forma Actividad biologica Hidrofobicidad PM Estabilidad
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas.
 Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Proceso que cuenta con varias etapas cuyo objetivo es separar una proteína de interés de una mezcla de proteínas. La selección de técnicas de purificación depende de las propiedades de las proteínas. Características
Electroforesis capilar
 Electroforesis capilar LUIS ENRIQUE MENDOZA POSTGRADO EN INGENIERÍA A BIOMÉDICA UNIVERSIDAD DE LOS ANDES MÉRIDA VENEZUELA NOVIEMBRE 2006 Electroforesis capilar AGENDA RESUMEN TIPOS DE ELECTROFORESIS EQUIPO
Electroforesis capilar LUIS ENRIQUE MENDOZA POSTGRADO EN INGENIERÍA A BIOMÉDICA UNIVERSIDAD DE LOS ANDES MÉRIDA VENEZUELA NOVIEMBRE 2006 Electroforesis capilar AGENDA RESUMEN TIPOS DE ELECTROFORESIS EQUIPO
FUNDAMENTOS. ELECTROFORESIS/ Versión 3.0/ MÓDULO 3/ CÁTEDRA DE FÍSICA/ FFYB/ UBA/
 FUNDAMENTOS. ELECTROFORESIS/ Versión 3.0/ MÓDULO 3/ CÁTEDRA DE FÍSICA/ FFYB/ UBA/ La electroforesis es una técnica separativa que se basa en el fenómeno de migración diferencial que experimentan partículas
FUNDAMENTOS. ELECTROFORESIS/ Versión 3.0/ MÓDULO 3/ CÁTEDRA DE FÍSICA/ FFYB/ UBA/ La electroforesis es una técnica separativa que se basa en el fenómeno de migración diferencial que experimentan partículas
SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS Elaborado por Lic. Fernando Andrade
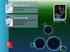 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS UNIDAD DIDÁCTICA DE QUÍMICA, PRIMER AÑO PRACTICA DE LABORATORIO 2016 SEMANA 29 PROPIEDADES FÍSICAS Y QUÍMICAS DE AMINOÁCIDOS Y PROTEÍNAS
PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS. Es un ácido capaz de formar sales con iones cargados
 Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Extracción de ADN Genética molecular PROPIEDADES FISICOQUÍMICAS DE LOS ÁCIDOS NUCLEICOS Es un ácido capaz de formar sales con iones cargados positivamente (cationes). Es soluble en soluciones concentradas
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS
 Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
Universidad de la República Oriental del Uruguay Facultad de Ingeniería Instituto de Ingeniería Eléctrica MANUAL DE USUARIO ELECTROFORESIS DICIEMBRE 2006 Tratamiento de Imágenes por Computadora Proyecto
UNIVERSIDAD TÉCNICA DEL NORTE
 UNIVERSIDAD TÉCNICA DEL NORTE FACULTAD DE INGENIERÍA EN CIENCIAS AGROPECUARIAS Y AMBIENTALES CARRERA DE INGENIERÍA AGROINDUSTRIAL AUTOR: ALEX RAMIRO CÓRDOVA MONTENEGRO ESTUDIO DEL MANEJO POSTCOSECHA DE
UNIVERSIDAD TÉCNICA DEL NORTE FACULTAD DE INGENIERÍA EN CIENCIAS AGROPECUARIAS Y AMBIENTALES CARRERA DE INGENIERÍA AGROINDUSTRIAL AUTOR: ALEX RAMIRO CÓRDOVA MONTENEGRO ESTUDIO DEL MANEJO POSTCOSECHA DE
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL
 CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD A. CROMATOGRAFÍA DE INTERCAMBIO IÓNICO. Usos 1.- Purificar Proteínas 2.- Concentrar Proteínas Ventajas
CROMATOGRAFÍA. A.- INTERCAMBIO IONICO: A.1. ANIONICA A.2. CATIONCA B.- FILTRACIÓN EN GEL C.- AFINIDAD A. CROMATOGRAFÍA DE INTERCAMBIO IÓNICO. Usos 1.- Purificar Proteínas 2.- Concentrar Proteínas Ventajas
LISTADO DE PROYECTOS DEL CAMPUS PRAKTIKUM UPV-FUNCAE ETS Ingeniería Agronómica y del Medio Natural Grado en Biotecnología
 1 Grado en Biotecnología Aprendiendo las técnicas básicas usadas en genética molecular de plantas BTC01 El alumno aprenderá de primera mano las técnicas básicas de genética molecular usando como material
1 Grado en Biotecnología Aprendiendo las técnicas básicas usadas en genética molecular de plantas BTC01 El alumno aprenderá de primera mano las técnicas básicas de genética molecular usando como material
Dando valor agregado al tamarillo
 UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS AGRONÓMICAS DEPTO. AGROINDUSTRIA Y ENOLOGÍA Dando valor agregado al Prof. Dra. Carmen Sáenz H. Bioquim. Ana M. Fabry Proyecto Validación técnico-comercial de especies
UNIVERSIDAD DE CHILE FACULTAD DE CIENCIAS AGRONÓMICAS DEPTO. AGROINDUSTRIA Y ENOLOGÍA Dando valor agregado al Prof. Dra. Carmen Sáenz H. Bioquim. Ana M. Fabry Proyecto Validación técnico-comercial de especies
LA CIENCIA DE LOS ALIMENTOS
 LA CIENCIA DE LOS ALIMENTOS Puede definirse como la ciencia que se centra en el estudio de los alimentos desde todos los puntos de vista posibles, teniendo en cuenta todos los factores involucrados, tanto
LA CIENCIA DE LOS ALIMENTOS Puede definirse como la ciencia que se centra en el estudio de los alimentos desde todos los puntos de vista posibles, teniendo en cuenta todos los factores involucrados, tanto
PROTEINAS. Clasificación. Propiedades químicas.
 PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
PROTEINAS Clasificación. Propiedades químicas. Son biopolímeros lineales formados por α L aminoácidos unidos por uniones peptídicas, formando heteropoliamidas de PM elevado, codificados genéticamente y
Técnicas de Biología Molecular. Biol 3051L
 Técnicas de Biología Molecular Biol 3051L Objetivos El cortar el DNA con enzimas de restricción y hacer corridas de geles usando electroforesis es muchas veces el primer paso para estudiar un gen. En este
Técnicas de Biología Molecular Biol 3051L Objetivos El cortar el DNA con enzimas de restricción y hacer corridas de geles usando electroforesis es muchas veces el primer paso para estudiar un gen. En este
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA
 UNIVERSIDAD NACIONAL AGRARIA LA MOLINA FACULTAD DE CIENCIAS Caracterización citogenética y molecular de las especies cultivadas del género Pachyrhizus Richard ex DC. Presentado por: Mónica Lucía Santayana
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA FACULTAD DE CIENCIAS Caracterización citogenética y molecular de las especies cultivadas del género Pachyrhizus Richard ex DC. Presentado por: Mónica Lucía Santayana
TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN.
 Trabajo Práctico 2.2 TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN. Desde el reconocimiento del ADN como "la molécula de la vida", se conoce que en ella se encuentran cifradas las instrucciones que
Trabajo Práctico 2.2 TÉCNICAS DE ANÁLISIS GENÉTICO: Extracción de ADN. Desde el reconocimiento del ADN como "la molécula de la vida", se conoce que en ella se encuentran cifradas las instrucciones que
El mejoramiento genético frutícola en INIA
 El mejoramiento genético frutícola en INIA PROGRAMA NACIONAL DE INVESTIGACIÓN EN PRODUCCIÓN FRUTÍCOLA Ing. Agr. PhD Roberto Zoppolo CONTENIDO Historia y cómo trabajamos Nuevas reglas de juego Objetivos
El mejoramiento genético frutícola en INIA PROGRAMA NACIONAL DE INVESTIGACIÓN EN PRODUCCIÓN FRUTÍCOLA Ing. Agr. PhD Roberto Zoppolo CONTENIDO Historia y cómo trabajamos Nuevas reglas de juego Objetivos
Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon.
 Biología Celular y Molecular para Medicina Jorge Contreras Pineda Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon. GENERALIDADES La electroforesis es una técnica de laboratorio
Biología Celular y Molecular para Medicina Jorge Contreras Pineda Práctica: Electroforesis de DNA y transferencia a membranas de celulosa o nylon. GENERALIDADES La electroforesis es una técnica de laboratorio
BIOLOGIA MOLECULAR. Dra. Ma. Laura Tondo
 TÉCNICAS BASADAS EN HIBRIDACIÓN MOLECULAR BIOLOGIA MOLECULAR 2016 Dra. Ma. Laura Tondo DESNATURALIZACION Y RENATURALIZACION DEL DNA Cómo se mantienen unidas las dos hebras del DNA? - Puentes de hidrógeno
TÉCNICAS BASADAS EN HIBRIDACIÓN MOLECULAR BIOLOGIA MOLECULAR 2016 Dra. Ma. Laura Tondo DESNATURALIZACION Y RENATURALIZACION DEL DNA Cómo se mantienen unidas las dos hebras del DNA? - Puentes de hidrógeno
Las proteínas. Dra. Nardy Diez García Investigadora
 Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Las proteínas Dra. Nardy Diez García Investigadora Son la clave de la vida Glicina o glicocola R=H Grupo Carboxilo Grupo Amino Es importante comprender estas propiedades porque son la clave de la estructura
Frutos Nativos Propagación y manejo de cultivo, evaluación y selección
 Frutos Nativos Propagación y manejo de cultivo, evaluación y selección Pobladores Productores Viveristas Chefs Industriales Artesanos Personal de apoyo Estudiantes Pasantes Técnicos Docentes Investigadores
Frutos Nativos Propagación y manejo de cultivo, evaluación y selección Pobladores Productores Viveristas Chefs Industriales Artesanos Personal de apoyo Estudiantes Pasantes Técnicos Docentes Investigadores
Mónica González, M. Gloria Lobo Rodrigo
 Mónica González, M. Gloria Lobo Rodrigo Instituto Canario de Investigaciones Agrarias mgonzal@icia.es 18-20 Octubre 2010, Tenerife Islas Canarias Primeras Jornadas de transferencia de I+D+i para una producción
Mónica González, M. Gloria Lobo Rodrigo Instituto Canario de Investigaciones Agrarias mgonzal@icia.es 18-20 Octubre 2010, Tenerife Islas Canarias Primeras Jornadas de transferencia de I+D+i para una producción
III. ESTUDIO DE CASO: INDUSTRIA PAPELERA
 III. ESTUDIO DE CASO: INDUSTRIA PAPELERA 3.1 Proceso de Fabricación más común del Papel La industria para la producción de papel se realiza a partir de la madera, mediante su trituración, tanto mecánica
III. ESTUDIO DE CASO: INDUSTRIA PAPELERA 3.1 Proceso de Fabricación más común del Papel La industria para la producción de papel se realiza a partir de la madera, mediante su trituración, tanto mecánica
 TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS. www.fcn.unp.edu.ar/sitio/farmacognosia/ Objetivo - Utilizar reacciones generales y técnicas de extracción y separación adecuadas para el análisis de proteínas
TRABAJO PRACTICO Nº 3. PROTEINAS Y ENZIMAS. www.fcn.unp.edu.ar/sitio/farmacognosia/ Objetivo - Utilizar reacciones generales y técnicas de extracción y separación adecuadas para el análisis de proteínas
MÉTODOS ELECTROQUÍMICOS
 MÉTODOS ELECTROQUÍMICOS INTRODUCCIÓN Son todos los métodos instrumentales que se emplean para medir corrientes eléctricas, carga y potenciales para aplicaciones analíticas. Los procesos a los cuales es
MÉTODOS ELECTROQUÍMICOS INTRODUCCIÓN Son todos los métodos instrumentales que se emplean para medir corrientes eléctricas, carga y potenciales para aplicaciones analíticas. Los procesos a los cuales es
Programas de mejora genética en cultivos del Valle del Jerte
 Programas de mejora genética en cultivos del Valle del Jerte El mejorador trata de construir un genotipo nuevo o identificarlo si ya existe en una población heterogénea E. Sánchez- Monge Centro de Investigaciones
Programas de mejora genética en cultivos del Valle del Jerte El mejorador trata de construir un genotipo nuevo o identificarlo si ya existe en una población heterogénea E. Sánchez- Monge Centro de Investigaciones
AGUILAR Y ENCINOS: DOS NUEVAS SELECCIONES DE AGUACATE. Salvador Sánchez Colín y Eduardo Campos Rojas 1 PRESENTACION
 AGUILAR Y ENCINOS: DOS NUEVAS SELECCIONES DE AGUACATE Salvador Sánchez Colín y Eduardo Campos Rojas 1 PRESENTACION La obtención y generación de frutales mejorados genéticamente, es una actividad que demanda
AGUILAR Y ENCINOS: DOS NUEVAS SELECCIONES DE AGUACATE Salvador Sánchez Colín y Eduardo Campos Rojas 1 PRESENTACION La obtención y generación de frutales mejorados genéticamente, es una actividad que demanda
M. AGUSTI Dr. Ingeniero Agrónomo Catedrático de Universidad Departamento de Producción Vegetal Universidad Politécnica. Valencia FRUTICULTURA
 M. AGUSTI Dr. Ingeniero Agrónomo Catedrático de Universidad Departamento de Producción Vegetal Universidad Politécnica. Valencia FRUTICULTURA Ediciones Mundi-Prensa Madrid Barcelona México 2004 INDICE
M. AGUSTI Dr. Ingeniero Agrónomo Catedrático de Universidad Departamento de Producción Vegetal Universidad Politécnica. Valencia FRUTICULTURA Ediciones Mundi-Prensa Madrid Barcelona México 2004 INDICE
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DIRECCIÓN DE ESCUELA DE AGRONOMÍA CURSO PROPEDÉUTICO ASIGNATURA: ELEMENTOS DE BIOLOGÍA
 UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DIRECCIÓN DE ESCUELA DE AGRONOMÍA CURSO PROPEDÉUTICO 2-2012 ASIGNATURA: ELEMENTOS DE BIOLOGÍA ÁCIDOS NUCLEICOS (1953) Son macromoléculas compuestas
UNIVERSIDAD CENTRAL DE VENEZUELA FACULTAD DE AGRONOMIA DIRECCIÓN DE ESCUELA DE AGRONOMÍA CURSO PROPEDÉUTICO 2-2012 ASIGNATURA: ELEMENTOS DE BIOLOGÍA ÁCIDOS NUCLEICOS (1953) Son macromoléculas compuestas
TAXONOMÍA MOLECULAR TAXONOMÍA MOLECULAR
 TAXONOMÍA MOLECULAR TAXONOMÍA MOLECULAR Microbiología a General Área Micología Dra. Alicia Luque CEREMIC Taxonomía clásica Carecen de reproducibilidad: los caracteres fenotípicos pueden variar con las
TAXONOMÍA MOLECULAR TAXONOMÍA MOLECULAR Microbiología a General Área Micología Dra. Alicia Luque CEREMIC Taxonomía clásica Carecen de reproducibilidad: los caracteres fenotípicos pueden variar con las
BASES QUÍMICAS DE LA VIDA. Ing. Balmore Martínez Ciencias Agronómicas UES 29/02/2016 1
 BASES QUÍMICAS DE LA VIDA. Ing. Balmore Martínez Ciencias Agronómicas UES 29/02/2016 1 O Toda la materia está formada a partir de 92 elementos químicos que se encuentran en forma natural. Ing. Balmore
BASES QUÍMICAS DE LA VIDA. Ing. Balmore Martínez Ciencias Agronómicas UES 29/02/2016 1 O Toda la materia está formada a partir de 92 elementos químicos que se encuentran en forma natural. Ing. Balmore
Química de la Vida. Br. Ángel E. Hernández C.
 Química de la Vida Br. Ángel E. Hernández C. Conceptos básicos Bioquímica Biología Molecular Átomo Partículas subatómicas Molécula Polaridad Solubilidad Compuesto Orgánico Inorgánico Solución Mezcla Carga
Química de la Vida Br. Ángel E. Hernández C. Conceptos básicos Bioquímica Biología Molecular Átomo Partículas subatómicas Molécula Polaridad Solubilidad Compuesto Orgánico Inorgánico Solución Mezcla Carga
CONDUCTIVIDAD. Definición:
 CONDUCTIVIDAD Definición: La conductividad es la capacidad de una solución acuosa para conducir una corriente eléctrica. Es igual al recíproco de la resistividad de la solución. Las medidas de conductividad
CONDUCTIVIDAD Definición: La conductividad es la capacidad de una solución acuosa para conducir una corriente eléctrica. Es igual al recíproco de la resistividad de la solución. Las medidas de conductividad
1. Nitrato de potasio para una nutrición vegetal eficiente.
 El nitrato de potasio es una fuente de potasio única por su valor nutricional y su contribución a la sanidad y rendimiento de las plantas. El nitrato de potasio ofrece las características químicas y físicas
El nitrato de potasio es una fuente de potasio única por su valor nutricional y su contribución a la sanidad y rendimiento de las plantas. El nitrato de potasio ofrece las características químicas y físicas
TEMA 6: PROTEÍNAS. Definición de proteínas y aminoácidos
 TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
TEMA 6: PROTEÍNAS Dra. Mariana L. Ferramola Bioquímica Lic. en Enfermería 2016 Definición de proteínas y aminoácidos Las proteínas son macromoléculas de gran abundancia. Son polímeros formados por monómeros
Uso de nuevas tecnologías para el desarrollo de variedades de arroces INIA
 Viviana Becerra Mario Paredes Gabriel Donoso Carmen Rojo Eduardo Gutiérrez Uberlinda Luengo Fernando Saavedra Uso de nuevas tecnologías para el desarrollo de variedades de arroces INIA Chile es el lugar
Viviana Becerra Mario Paredes Gabriel Donoso Carmen Rojo Eduardo Gutiérrez Uberlinda Luengo Fernando Saavedra Uso de nuevas tecnologías para el desarrollo de variedades de arroces INIA Chile es el lugar
ESTADOS DE LA MATERIA TEORÍA CINÉTICA
 ESTADOS DE LA MATERIA SOLIDOS: Dureza, forma propia, volumen CONSTANTE LÍQUIDOS: No tiene forma, volumen constante, poseen fluidez y viscosidad. GASES: No tienen forma, volumen variable, predominan fuerzas
ESTADOS DE LA MATERIA SOLIDOS: Dureza, forma propia, volumen CONSTANTE LÍQUIDOS: No tiene forma, volumen constante, poseen fluidez y viscosidad. GASES: No tienen forma, volumen variable, predominan fuerzas
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
ACUERDO DE TRABAJO. INIA Universidad de la República (Facultad de Agronomía) INVESTIGACIÓN EN FRUTOS NATIVOS
 ACUERDO DE TRABAJO INIA Universidad de la República (Facultad de Agronomía) INVESTIGACIÓN EN FRUTOS NATIVOS ACUERDO: En Montevideo, el día 24 del mes de abril de 2012, entre POR UNA PARTE, el Instituto
ACUERDO DE TRABAJO INIA Universidad de la República (Facultad de Agronomía) INVESTIGACIÓN EN FRUTOS NATIVOS ACUERDO: En Montevideo, el día 24 del mes de abril de 2012, entre POR UNA PARTE, el Instituto
PROBLEMAS ÁCIDO-BASE. 2-1 Indique si la disolución acuosa de las siguientes sales es ácida, básica o neutra. Suponer que todas son 0,1 M.
 PROBLEMAS ÁCIDO-BASE 2-1 Indique si la disolución acuosa de las siguientes sales es ácida, básica o neutra. Suponer que todas son 0,1 M. a) Cloruro potásico b) Fluoruro de metilamonio c) Hipoclorito sódico
PROBLEMAS ÁCIDO-BASE 2-1 Indique si la disolución acuosa de las siguientes sales es ácida, básica o neutra. Suponer que todas son 0,1 M. a) Cloruro potásico b) Fluoruro de metilamonio c) Hipoclorito sódico
Material elaborado por F. Agius, O. Borsani, P.Díaz, S. Gonnet, P. Irisarri, F. Milnitsky y J. Monza. Bioquímica. Facultad de Agronomía.
 AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
AMINOACIDOS Las proteínas de bacterias, hongos, plantas y animales están constituidas a partir de las mismas 20 unidades o monómeros: los á-aminoácidos. Los aminoácidos tienen un grupo amino y un grupo
BIOMOLÉCULAS. Son aquellas que se encuentran presentes tanto en la materia orgánica (viva) como en la materia inerte. Ellas son:
 Nombre Curso Fecha : : : Revisión FICHA DE BIOLOGÍA N 1 Profesora Verónica Abasto Córdova Biología 2 Medio BIOMOLÉCULAS Las biomoléculas son las moléculas constituyentes de los seres vivos. Están formadas
Nombre Curso Fecha : : : Revisión FICHA DE BIOLOGÍA N 1 Profesora Verónica Abasto Córdova Biología 2 Medio BIOMOLÉCULAS Las biomoléculas son las moléculas constituyentes de los seres vivos. Están formadas
FISICA QUIMICA
 FISICA QUIMICA 2018-1 DESARROLLO DE LA TEORIA DE LA DISOCIACION ELECTROLITICA. CONDUCCION DE LA ELECTRICIDAD. CONDUCCION ELECTROLITICA. ELECTROLISIS SOLUCIONES Se trata de un caso particular de dispersiones.
FISICA QUIMICA 2018-1 DESARROLLO DE LA TEORIA DE LA DISOCIACION ELECTROLITICA. CONDUCCION DE LA ELECTRICIDAD. CONDUCCION ELECTROLITICA. ELECTROLISIS SOLUCIONES Se trata de un caso particular de dispersiones.
ACTIVIDAD ENZIMÁTICA. Dra. Lilian González Segura Departamento de Bioquímica Facultad de Química
 ACTIVIDAD ENZIMÁTICA Dra. Lilian González Segura Departamento de Bioquímica Facultad de Química Porqué la gran mayoría de las reacciones en los seres vivos necesitan ser catalizadas para que ocurran a
ACTIVIDAD ENZIMÁTICA Dra. Lilian González Segura Departamento de Bioquímica Facultad de Química Porqué la gran mayoría de las reacciones en los seres vivos necesitan ser catalizadas para que ocurran a
La investigación participativa en Recursos Fitogenéticos como herramienta al servicio de agricultores y agricultoras
 La investigación participativa en Recursos Fitogenéticos como herramienta al servicio de agricultores y agricultoras María José Suso Llamas Instituto de Agricultura Sostenible (CSIC) Construyendo investigación
La investigación participativa en Recursos Fitogenéticos como herramienta al servicio de agricultores y agricultoras María José Suso Llamas Instituto de Agricultura Sostenible (CSIC) Construyendo investigación
CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS.
 MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
MORFOFISIOLOGÍA HUMANA I. PRIMER TRIMESTRE. PRIMER AÑO. CONFERENCIA 6 TÍTULO: COMPONENTES MOLECULARES: MACROMOLÉCULAS. PROTEÍNAS. Sabe Ud. que es la sangre? Adultos contienen de 5-6L Adultos contienen
3. Caracteres cuantitativos y variación continua Objetivos. Tema 3. Caracteres cuantitativos y variación continua
 3. Caracteres cuantitativos y variación continua Objetivos Tema 3. Caracteres cuantitativos y variación continua Fundamentos de Genética Grado en Bioquímica Universidad de Granada Prof. Ángel Martín Alganza
3. Caracteres cuantitativos y variación continua Objetivos Tema 3. Caracteres cuantitativos y variación continua Fundamentos de Genética Grado en Bioquímica Universidad de Granada Prof. Ángel Martín Alganza
II Simpósio de Melhoramento e Propagação Vegetativa de Plantas
 II Simpósio de Melhoramento e Propagação Vegetativa de Plantas 23 e 24 de Maio de 2013 Universidade Federal de Santa Maria Ing. Agr. PhD Roberto Zoppolo LA APLICACIÓN DE LA MULTIPLICACIÓN VEGETATIVA EN
II Simpósio de Melhoramento e Propagação Vegetativa de Plantas 23 e 24 de Maio de 2013 Universidade Federal de Santa Maria Ing. Agr. PhD Roberto Zoppolo LA APLICACIÓN DE LA MULTIPLICACIÓN VEGETATIVA EN
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN
 CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
CROMATOGRAFÍA LÍQUIDA DE ALTA RESOLUCIÓN Curso: Química Analítica II Loreto Ascar 2012 Esquema de las bases de la separación en cromatografía de: (a)absorción, (b) partición, (c) Intercambio iónico y (d)
Biotecnología y su aplicación a las ciencias agropecuarias. Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales
 Biotecnología y su aplicación a las ciencias agropecuarias Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales Niveles de organización en seres vivos Organismo Organo Tejido Celula La Célula:
Biotecnología y su aplicación a las ciencias agropecuarias Oris Sanjur Instituto Smithsonian de Investigaciones Tropicales Niveles de organización en seres vivos Organismo Organo Tejido Celula La Célula:
Purificación de Proteínas Parte II
 Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
Purificación de Proteínas Parte II Fase I. Obtención del extracto crudo Lisis celular. Válido para células sin pared celular como las células de tejidos animales, pero no es suficiente para células vegetales
H. REVISION DE LITERATURA Aspectos generales del maíz morado 3
 INDICE GENER.AL INDICE DE CUADROS INDICE DE FIGURAS RESUMEN 1. INTRODUCCION 1 H. REVISION DE LITERATURA 3 2.1. Aspectos generales del maíz morado 3 2.1.1. Origen y relaciones 3 2.1.2. Clasificación botánica
INDICE GENER.AL INDICE DE CUADROS INDICE DE FIGURAS RESUMEN 1. INTRODUCCION 1 H. REVISION DE LITERATURA 3 2.1. Aspectos generales del maíz morado 3 2.1.1. Origen y relaciones 3 2.1.2. Clasificación botánica
Lab. # 4 Análisis Químico de moléculas orgánicas. BIOL 3013-Laboratorio de Biología General I Dra. Varela Agront y Dra.
 Lab. # 4 Análisis Químico de moléculas orgánicas BIOL 3013-Laboratorio de Biología General I Dra. Varela Agront y Dra. Hernández Vale Objetivos Mencionar algunas de las biomoléculas más importantes para
Lab. # 4 Análisis Químico de moléculas orgánicas BIOL 3013-Laboratorio de Biología General I Dra. Varela Agront y Dra. Hernández Vale Objetivos Mencionar algunas de las biomoléculas más importantes para
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR
 INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
INTRODUCCION A LA BIOLOGIA CELULAR Y MOLECULAR - Componentes químicos de la célula - Un poco de química 1 Un poco de química El 99% del peso de una célula corresponde a C, H, N y O. La sustancia más abundante
MARCADORES GENÉTICOS
 MARCADORES GENÉTICOS MARCADORES GENÉTICOS La diferencia entre individuos se denotaba señalando diferencias en su aspecto externo (fenotipo) Marcadores Morfológicos Carácter Informativo Variación POLIMORFISMO
MARCADORES GENÉTICOS MARCADORES GENÉTICOS La diferencia entre individuos se denotaba señalando diferencias en su aspecto externo (fenotipo) Marcadores Morfológicos Carácter Informativo Variación POLIMORFISMO
DÉCIMA QUINTA ENCUESTA DE VIVEROS FORESTALES Año Dirección General Forestal Ministerio de Ganadería, Agricultura y Pesca
 DÉCIMA QUINTA ENCUESTA DE VIVEROS FORESTALES Año 2014 Dirección General Forestal Ministerio de Ganadería, Agricultura y Pesca Se agradece a todos las empresas y técnicos referentes del sector que atendieron
DÉCIMA QUINTA ENCUESTA DE VIVEROS FORESTALES Año 2014 Dirección General Forestal Ministerio de Ganadería, Agricultura y Pesca Se agradece a todos las empresas y técnicos referentes del sector que atendieron
Ensayos de restricción
 Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
Ensayos de restricción Vector con inserto= Vector recombinante 6500pb Objetivos de ensayos de restricción de plásmidos Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa.
FACTORES FÍSICOS Y QUÍMICOS QUE MODIFICAN LA VELOCIDAD DE LAS REACCIONES ENZIMÁTICAS
 FACTORES FÍSICOS Y QUÍMICOS QUE MODIFICAN LA VELOCIDAD DE LAS REACCIONES ENZIMÁTICAS I. INTRODUCCIÓN En general todas las enzimas, independiente del tipo de reacción que catalizan presentan características
FACTORES FÍSICOS Y QUÍMICOS QUE MODIFICAN LA VELOCIDAD DE LAS REACCIONES ENZIMÁTICAS I. INTRODUCCIÓN En general todas las enzimas, independiente del tipo de reacción que catalizan presentan características
Agua en el cuerpo: líquido intracelular y extracelular
 KILO POR KILO, EL CUERPO contiene más agua que cualquier otro componente. Después del oxígeno, el agua es el ingrediente más importante para la vida; sin ella, los procesos biológicos, y la vida, cesan
KILO POR KILO, EL CUERPO contiene más agua que cualquier otro componente. Después del oxígeno, el agua es el ingrediente más importante para la vida; sin ella, los procesos biológicos, y la vida, cesan
