|
|
|
- Juan Antonio Campos Acuña
- hace 6 años
- Vistas:
Transcripción
1
2
3
4
5
6 Minino de Cheshire, podrías decirme, por favor, qué camino debo seguir para salir de aquí? Esto depende en gran parte del si>o al que quieras llegar - dijo el Gato. - - No me importa mucho el si>o dijo Alicia. - - Entonces tampoco importa mucho el camino que tomes - - dijo el Gato siempre que llegue a alguna parte - - añadió Alicia como explicación. - - Oh, siempre llegarás a alguna parte - - aseguró el Gato- -, si caminas lo suficiente!
7 INTRODUCCION
8 INTRODUCCION Las alteraciones del equilibrio acido-básico son habituales: aproximadamente en el 90% de los pacientes ingresados en una U.C.I. se pueden encontrar alteraciones del equilibrio ácido-básico.
9 CONCEPTOS BÁSICOS La concentración de hidrogeniones [H + ] en el líquido extracelular viene determinada por el equilibrio entre la presión parcial de CO 2 (pco 2 ) y la concentración de bicarbonato (HCO 3 ) en el líquido: [H + ] (neq/l) = 24 x (pco 2 / HCO 3 ) En condiciones normales la [H + ] es de 40 neq/l. Corresponde a una pco 2 de 40 mmhg y a una [HCO 3 ] de 24 meq/l Por qué la [H + ] se mide en unidades de ph? La [H + ] en el líquido extracelular viene expresada en NANOequivalentes/Litro. Un nanoquivalente es 1x10-6 meq, por lo tanto hay millones de iones Cl -, Na +, y otros medidos en meq, más que H +. Esta es la justificación de la medición en unidades de ph de la [H + ] (logaritmo negativo base 10- de la [H + ] en neq/l.
10 CONCEPTOS BÁSICOS Términos. Ácido: toda sustancia capaz de ceder hidrogeniones. Base: toda sustancia capaz de aceptar hidrogeniones. Acidemia: aumento de la concentración de hidrogeniones. Alcalemia: disminución de la concentración de hidrogeniones. Acidosis y alcalosis: hacen referencia a los procesos fisiopatológicos responsables de dichos procesos. Los términos metabólicos o respiratorios se refieren según se modifiquen respectivamente la [HCO 3- ] o la PCO 2. Anión gap: para mantener la electroneutralidad las cargas positivas (cationes) deben igualar a las cargas negativas (aniones); si no ocurre así, aparece un anión gap cuyo valor normal es de 8 a 16 meq/l y que se calcula con la siguiente ecuación: Anión gap = Na - (Cl - + HCO 3- )
11 FISIOLOGÍA.
12 FISIOLOGÍA. Conceptos generales- En condiciones normales la concentración de hidrogeniones del líquido extracelular es baja (de unos 40 neq/l). Pequeñas fluctuaciones de la misma va a tener repercusiones importantes sobre procesos vitales. Límites relativamente estrechos, entre los cuales la concentración de hidrogeniones es compatible con la vida (16 y 160 neq/l, lo que equivale a un valor de ph de 7.80 a 6.80).
13 FISIOLOGÍA. Conceptos generales- El principal producto ácido del metabolismo celular es el dióxido de carbono (CO 2 ) que viene a representar un 98% de la carga ácida total sin ser un ácido pues no contiene H +, pero mediante su hidratación mediante una reacción reversible catalizada por la anhidrasa carbónica (A.C.) va a generar ácido carbónico (H 2 CO 3 ): AC El CO 2 va a ser eliminado prácticamente en su totalidad por los pulmones sin que se produzca una retención neta de ácido, por lo que se denomina ácido volátil.
14 FISIOLOGÍA. Conceptos generales- El metabolismo va a generar por catabolismo oxidativo de los aminoácidos sulfurados de las proteínas una serie de ácidos no volátiles, también denominados ácidos fijos, que representan de un 1-2% de la carga ácida. Estos ácidos fijos van a ser eliminados por el riñón el principal órgano responsable en la eliminación de los mismos.
15 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS- También denominados sistemas tampón o buffer. Representan la primera línea de defensa ante los cambios desfavorables de ph gracias a la capacidad que tienen para captar o liberar protones de modo inmediato en respuesta a las variaciones de ph que se produzcan. Un sistema tampón es una solución de un ácido débil y su base conjugada:
16 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS- La constante de disociación del ácido (K) viene expresada como: pk (pk=- log [K]): el valor de ph en el cual el ácido se encuentra disociado en un 50%. El pk representa el valor de ph en el que un sistema tampón puede alcanzar su máxima capacidad amortiguadora. Por tanto, cada sistema buffer tendrá un valor de pk característico. Puesto que lo que se pretende es mantener un ph alrededor de 7, serán buenos amortiguadores aquellos sistemas cuyo pk esté próximo a dicho valor. En este sentido, existen dos sistemas fundamentales que cumplen esta condición: los grupos imidazol de los residuos histidina de las proteínas, y el fosfato inorgánico. Sin embargo, como veremos a continuación el sistema más importante implicado en la homeostasis del ph es el amortiguador ácido carbónico/bicarbonato a pesar de tener un pk de 6.1.
17 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. PROTEINAS- A/ Amortiguador proteína. Las proteínas intracelulares con sus grupos ionizables con diferentes valores de pk contribuyen de forma importante en el mantenimiento del ph, mediante el intercambio de H + con iones unidos a proteínas (Na + y K + ) que se desplazan al medio extracelular para mantener la neutralidad eléctrica: Especial mención merece el sistema amortiguador hemoglobina, proteína más abundante de la sangre: Las propiedades amortiguadoras de la hemoglobina desempeñan un papel fundamental en el transporte sanguíneo del CO 2 tisular hasta su eliminación pulmonar. En el interior del hematíe, por acción de la A.C., el CO 2 se va a convertir en ácido carbónico que se disocia dando un H + que rápidamente será tamponado por la hemoglobina, y bicarbonato que saldrá fuera del hematíe en intercambio con iones cloro.
18 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. FOSFATO- Amortiguador fosfato Ejerce su acción fundamentalmente a nivel intracelular, ya que es aquí donde existe una mayor concentración de fosfatos y el ph es más próximo a su pk (6.8). Interviene, junto a las proteínas celulares de manera importante en la amortiguación de los ácidos fijos:
19 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. OSEA- Amortiguación ósea El hueso interviene en la amortiguación de la carga ácida captando los H + en exceso, o liberando carbonato a la sangre por disolución del hueso mineral. El papel más importante del hueso en la amortiguación ocurre en situaciones de acidosis crónica tales como en caso de insuficiencia renal crónica en la que la parathormona juega un papel fundamental. Este sistema de amortiguación también va a intervenir en presencia de una carga básica a través del depósito de carbonato en el hueso.
20 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. CARBÓNICO/BICARBONATO- Amortiguador carbónico/bicarbonato El sistema carbónico/bicarbonato no es un amortiguador muy potente desde el punto de vista estrictamente químico, ya que el pk del ácido carbónico de 6.1 está alejado del ph 7.4 que se quiere amortiguar. A pesar de ello, se trata del sistema de mayor importancia en la homeostasis del ph porque: -Se trata de un sistema que está presente en todos los medios tanto intracelulares como extracelulares. En el medio extracelular la concentración de bicarbonato es elevada (24 meq). -Es un sistema abierto. La concentración de cada uno de los dos elementos que lo componen son regulables; el CO2 por un sistema de intercambio de gases a nivel pulmonar, y el bicarbonato mediante un sistema de intercambio de solutos a nivel renal. Esto hace que la suma de las concentraciones del ácido y de la base no sea constante, lo cual aumenta muchísimo su capacidad amortiguadora.
21 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. CARBÓNICO/BICARBONATO- Amortiguador carbónico/bicarbonato Las reacciones de interés implicadas en este sistema son las siguientes: La relación existente entre el ácido y la base nos viene dada por la ecuación de Henderson-Hasselbalch:
22 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. CARBÓNICO/BICARBONATO- Amortiguador carbónico/bicarbonato Si consideramos el ph sanguíneo normal 7.4, y el pk del sistema 6.1, al aplicarlo a la fórmula obtendremos la relación entre la concentración de bicarbonato y de ácido carbónico: 7.4 = log [HCO 3- ] / [H 2 CO 3 ] log [HCO 3 - ] / [H 2 CO 3 ] = 1.3 [HCO 3 -] / [H 2 CO 3 ] = 20 Cualquier cambio de ph se va a traducir como una alteración de la relación carbónico/bicarbonato, puesto que el ph prácticamente sólo va a depender de dicha relación y no de los valores absolutos de las concentraciones de ambos. [HCO 3 -] / [H 2 CO 3 ] > 20 alcalosis [HCO 3 -] / [H 2 CO 3 ] < 20 acidosis
23 FISIOLOGÍA. AMORTIGUADORES FISIOLOGICOS. CARBÓNICO/BICARBONATO- Amortiguador carbónico/bicarbonato Es importante tener en cuenta que todos los sistemas buffer están interrelacionados y que se amortiguan unos a otros, de modo que todos los amortiguadores de un mismo compartimento van a variar conjuntamente ante un cambio en el ph. Esto nos va a permitir conocer los cambios de cada sistema si conocemos los que ha experimentado uno de ellos. En la clínica el sistema que se mide para la valoración del estado ácido-base es el sistema carbónico/bicarbonato. Ninguno de los sistemas de amortiguación de ph que acabamos de ver es capaz de eliminar del organismo los hidrogeniones en exceso, ya que van a intervenir de forma inmediata minimizando pero no impidiendo cambios en el ph, lo cual va a inducir posteriores respuestas compensatorias pulmonar y renal.
24 FISIOLOGÍA. COMPENSACIÓN RESPIRATORIA- El control de la concentración de ácido del organismo lo regula indirectamente la respiración manteniendo la presión parcial de dióxido de carbono (PCO 2 ) en sangre arterial. Como ya vimos, la concentración de ácido carbónico es proporcional a la PCO 2 sanguínea, que a su vez va a depender de la presión parcial de dicho gas a nivel del alveolo pulmonar. Al ser la PCO 2 de la sangre mayor que la alveolar, en condiciones normales se va a producir una difusión neta de CO 2 hacia el interior del alveolo desde donde será eliminado.
25 FISIOLOGÍA. COMPENSACIÓN RESPIRATORIA- La respuesta ventilatoria ante los cambios de ph es una respuesta rápida y está mediada por los quimiorreceptores de los corpúsculos carotideos y aórticos y del centro respiratorio bulbar. Dichos receptores son sensibles a los cambios de la concentración de H + del líquido extracelular, de manera que ante un descenso de ph, el aumento en la concentración de hidrogeniones estimula a los quimiorreceptores provocando una hiperventilación, aumentando de este modo la eliminación de CO 2, y disminuyendo por tanto la PCO 2 arterial. Por el contrario, si el ph se eleva el descenso de la concentración de hidrogeniones inhibe los quimiorreceptores provocando un descenso rápido de la ventilación, una reducción de la eliminación de CO 2, y por tanto una elevación de la PCO 2 arterial.
26 FISIOLOGÍA. COMPENSACIÓN RESPIRATORIA-
27 FISIOLOGÍA. COMPENSACIÓN RENAL- El riñón es el principal órgano implicado en la regulación del equilibrio ácido-base por dos motivos fundamentales: -Es la principal vía de eliminación de la carga ácida metabólica normal y de los metabolitos ácidos patológicos. -Es el órgano responsable de mantener la concentración plasmática de bicarbonato en un valor constante, gracias a su capacidad para reabsorber y generar bicarbonato de modo variable en función del ph de las células tubulares renales. Por tanto, en una situación de acidosis se producirá un aumento en la excreción de ácidos y se reabsorberá más bicarbonato, mientras que en una situación de alcalosis ocurrirá lo contrario, es decir, se retendrá más ácido y se eliminará más bicarbonato. Por este motivo, el ph urinario va a experimentar cambios, pudiendo oscilar entre 4.5 y 8.2.
28 FISIOLOGÍA. COMPENSACIÓN RENAL- Reabsorción de bicarbonato El bicarbonato es filtrado continuamente hacia la luz del túbulo renal (generalmente asociado a iones Na + ) de modo que en el filtrado glomerular intacto la concentración de bicarbonato es prácticamente igual a la del plasma, de ahí la importancia del proceso de reabsorción del mismo. A la concentración fisiológica de bicarbonato plasmático (24 meq/ l), prácticamente todo el bicarbonato filtrado va a ser reabsorbido. Este proceso tiene lugar fundamentalmente en el túbulo contorneado proximal (TCP) donde se reabsorbe un 85%. El resto es reabsorbido en el asa de Henle (10-15%) y en el túbulo contorneado distal (TCD) y colector.
29 FISIOLOGÍA. COMPENSACIÓN RENAL- Reabsorción de bicarbonato La reabsorción de bicarbonato se desencadena por la secreción de H + a la luz del TCP en intercambio con iones Na + por acción de un cotransporte Na + - H + lo que permite mantener la neutralidad eléctrica. Los H + secretados a la luz tubular reaccionan con el bicarbonato filtrado formando ácido carbónico que se disocia en CO 2 y agua por acción de la anhidrasa carbónica. El CO 2 producido puede difundir de nuevo al interior de la célula tubular donde reacciona con agua transformándose en ácido carbónico, el cual se va a disociar en bicarbonato que se reabsorberá hacia el capilar peritubular, y un hidrogenión que es secretado y amortiguado por el bicarbonato filtrado como ya hemos visto. De este modo los hidrogeniones se eliminan formando parte de una molécula de agua, y por tanto sin acidificar la orina. NO van a acidificar la orina En este proceso de intercambio Na + - H + los iones potasio pueden competir con los hidrogeniones, de manera que en una situación de hiperpotasemia se va a intercambiar más K + que H + por Na + por lo que al secretarse pocos H + se reabsorberá poco bicarbonato. En situaciones de hipopotasemia ocurrirá lo contrario, es decir, aumentará la recuperación de bicarbonato y la excreción de hidrogeniones.
30 FISIOLOGÍA. COMPENSACIÓN RENAL- Producción renal de bicarbonato sí van a acidificar la orina Si a pesar del proceso de reabsorción la concentración de bicarbonato plasmático permanece por debajo del valor normal, en las células tubulares se va a sintetizar bicarbonato. Esto sucede fundamentalmente en el túbulo contorneado distal a partir del CO 2 procedente de la sangre o del propio metabolismo de la célula tubular por acción de la A.C. El H 2 CO 3 así generado se disocia en bicarbonato que se reabsorbe hacia la sangre y un hidrogenión que es eliminado. En este caso los hidrogeniones sí van a acidificar la orina, de ahí la gran importancia de los amortiguadores urinarios.
31 FISIOLOGÍA. COMPENSACIÓN RENAL- Producción renal de bicarbonato Aproximadamente un tercio de los H + secretados van a ser titulados sobre fosfato y el resto sobre amoniaco, siendo por tanto la cantidad de ácido libre que se elimina por la orina mínima. La producción renal de amoniaco representa aproximadamente un 60% en la eliminación de H+ asociada a ácidos no volátiles. Este se va a producir principalmente por desaminación de la glutamina en las células del túbulo renal y difunde fácilmente a través de la membrana hacia la luz del túbulo dónde se combina con H + formando iones amonio, un ácido muy débil que es eliminado por la orina.
32 FISIOLOGÍA. COMPENSACIÓN RENAL- Llamamos acidez titulable de la orina a la que se puede medir, lo cual no indica el total de H + secretados, ya que los iones amonio por su debilidad prácticamente no contribuyen a la acidez titulable, y los H + amortiguados con bicarbonato se van a eliminar formando parte de una molécula de agua. Por este motivo la acidez titulable corresponde casi en su totalidad a los hidrogeniones que se encuentran como fosfato
33 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA.
34 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 1. ph: es un parámetro indicador de la acidez o alcalinidad de una muestra de sangre. Por su relación con la pco 2, el ph se considera que tiene un componente respiratorio, y por su relación con la concentración de bicarbonato plasmático y el exceso de base estándar se considera que tiene un componente metabólico, pudiendo así distinguirse entre desequilibrios respiratorios y metabólicos. Rango de referencia del ph en el adulto:
35 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 2. pco 2 : es la presión parcial de dióxido de carbono en la fase gaseosa en equilibrio con la sangre. El dióxido de carbono difunde rápidamente a través de las membranas celulares y puede considerarse igual a cero en el aire inspirado normal. Por tanto su determinación es una medida directa de la idoneidad de la ventilación alveolar en relación con el índice metabólico. Los valores altos y bajos de pco 2 en sangre arterial indican hipercapnia e hipocapnia respectivamente. Rango de referencia de pco 2 en adultos: varones: mmhg; mujeres: mmhg.
36 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 3. po 2 : es la presión parcial de extracción del oxígeno de la sangre arterial. Este parámetro refleja los cambios producidos: en la po 2 arterial, la concentración de oxígeno y la afinidad de la hemoglobina por el oxígeno sobre la capacidad de la sangre arterial para suministrar oxígeno a los tejidos. Rango de referencia de po 2 en el adulto: mmhg.
37 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 4. HCO 3- real: es la concentración de bicarbonato en el plasma de la muestra. Se calcula utilizando los valores de ph y pco 2 en la ecuación de Henderson-Hasselbalch. Encontramos valores elevados en la alcalosis metabólica y como mecanismo de compensación en la acidosis respiratoria. Los niveles bajos se detectan en la acidosis metabólica y como mecanismo compensatorio en la alcalosis respiratoria. Rango de referencia en el adulto de la HCO 3 -real: mmol/l.
38 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 5. HCO 3- estándar: es la concentración de carbonato de hidrógeno en el plasma de sangre equilibrada con una mezcla de gases con una pco 2 de 40 mmhg y una po 2 mayor o igual a 100 mmhg. Un bicarbonato estándar bajo indicaría una acidosis metabólica si por el contrario fuera alto, sería indicativo de una alcalosis metabólica. Rango de referencia en el adulto de la HCO 3 -estándar: mmol/l.
39 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 6. Exceso/deficit de base: Es la concentración de base en sangre total valorable con un ácido o una base fuerte hasta un ph de 7.4 a una pco 2 de 40 y a 37ºC. El valor numérico del exceso (o déficit) de base representa la cantidad teórica de ácido o base que habría que administrar para corregir una desviación de ph. Rango de referencia en el adulto : +2 / - 2 meq/l
40 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 7. SO 2 : es la saturación de oxígeno. Hace referencia al porcentaje de la hemoglobina oxigenada en relación con la cantidad de hemoglobina capaz de transportar oxígeno. Rango de referencia de SO 2 en el adulto : 95-99%.
41 IV.- PRINCIPALES PARAMETROS IMPLICADOS EN EL EQUILIBRIO ACIDOBASE. VALORES DE REFERENCIA. 8. FiO 2 : es la concentración de oxígeno inspirado fraccional. Representa la concentración calculable de oxígeno que se administra al paciente. Se utiliza para adecuar la oxigenoterapia en función de la clínica y del análisis de los gases sanguíneos.
42 MÉTODO PROGRESIVO DE INTERPRETACIÓN ACIDOBÁSICA
43 Etapa l: IDENTIFICAR EL TRASTORNO ACIDOBÁSICO PRIMARIO PASO 1: si la PaCO 2 o el ph se encuentran fuera de rango de la normalidad, existe una alteración acido-básica (aunque la normalidad no excluye dicha alteración). PASO 2: en caso de que el ph o la PaCO 2 se encuentren alterados, habrá que valorar su sentido de variación. en el mismo sentido (ph, PaCO 2 ; ph, PaCO 2 ), el trastorno acido-básico primario es METABÓLICO. en sentidos opuestos (ph, PaCO 2 ; ph, PaCO 2 ) el trastorno acido-básico primario es RESPIRATORIO.
44 PASO 3: Si ph (N), PaCO 2 (N) puede haber un trastorno acido-básico mixto. ph (N), PaCO 2 ( ) trastorno respiratorio ph ( ), PaCO 2 (N) trastorno metabólico
45 Ejemplo. ph arterial de 7,38 y una PaCO 2 de 58 mmhg. El ph es normal, por lo que existe un trastorno acidobásico mixto, metabólico y respiratorio. La PaCO 2 está elevada, por lo que el trastorno respiratorio es una acidosis, y por tanto el trastorno metabólico debe ser una alcalosis. Por lo tanto, se trata de una acidosis respiratoria y alcalosis metabólica combinadas. En esta situación no existe trastorno acidobásico primario; ambos trastornos son equivalentes en cuanto a gravedad (por lo que el ph es normal). Recuérdese que las respuestas compensatorias a un trastorno acidobásico primario nunca son lo suficientemente intensas como para corregir el ph, pero actúan para reducir la gravedad del cambio de ph. Por lo tanto, un ph normal en presencia de un trastorno acidobásico implica que existe una alteración acidobásica mixta, respiratoria y metabólica. A veces, es más sencillo pensar en esta situación como una situación de hipercompensación? para uno de los trastornos acidobásicos.
46 ETAPA 2: EVALUAR LAS RESPUESTAS COMPENSATORIAS (EN CASO DE IDENTIFICAR UN TRASTORNO ACIDO- BÁSICO PRIMARIO) El objetivo de este paso es determinar si las respuestas compensatorias son adecuadas y si hay trastornos acidobásicos asociados.
47 PASO 4: Si existe ACIDOSIS O ALCALOSIS METABÓLICA PRIMARIA, se usará la concentración de bicarbonato sérico medida en las siguientes ecuaciones para identificar la PaCO 2 esperada: Si las PaCO 2 medida y esperada son iguales, la afección está totalmente compensada. Si la PaCO 2 medida es mayor (>) que la PaCO 2 esperada, existe acidosis respiratoria asociada. Si la PaCO 2 medida es menor (<) que la PaCO 2 esperada, existe alcalosis respiratoria asociada.
48 PASO 5: Si existe una acidosis o alcalosis respiratoria (ph, PaCO 2 ; ph, PaCO 2 ; el TRASTORNO ACIDO-BÁSICO PRIMARIO ES RESPIRATORIO), se usará la PaCO 2 para calcular el ph esperado a partir de las ecuaciones (ver tabla). Se compara el ph medido con el ph esperado para determinar si la afección es aguda, está parcialmente compensada o está totalmente compensada. ALTERACIÓN ACIDOBÁSICA acidosis respiratoria aguda, no compensada acidosis respiratoria crónica, compensada COMPARACIÓN ph MEDIDO/ ph ESPERADO inferior(<) mayor (>) SITUACION ASOCIADA acidosis metabólica asociada alcalosis metabólica asociada alcalosis respiratoria aguda, no compensada mayor (>) alcalosis metabólica asociada alcalosis respiratoria crónica, compensada inferior (<) acidosis metabólica asociada
49 ETAPA 3: USAR EL ANÍON GAP PARA EVALUAR LA ACIDOSIS METABÓLICA El hiato o intervalo aniónico (anion gap), es un cálculo de aniones no medidos que ayuda a identificar la causa de la acidosis metabólica. El hiato aniónico es un cálculo de la abundancia relativa de aniones no medidos, y se usa para determinar si una acidosis metabólica se debe a una acumulación de ácidos no volátiles (p.ej., ácido láctico) o a una pérdida neta de bicarbonato (p. ej., diarrea)
50 ETAPA 3: USAR EL ANÍON GAP PARA EVALUAR LA ACIDOSIS METABÓLICA El hiato o intervalo aniónico (anion gap), es un cálculo de aniones no medidos que ayuda a identificar la causa de la acidosis metabólica. El segundo hiato o intervalo es una comparación del cambio del hiato aniónico y el cambio en la concentración sérica de HCO 3- : el intervalo entre los dos (denominado hiato-hiato) puede descubrir trastornos metabólicos mixtos (p.ej., acidosis o alcalosis metabólica) que, de otro modo, no se detectarían. En el apartado siguiente se describen estas dos determinaciones.
51 Determinación del hiato aniónico Para alcanzar el equilibrio electroquímico, la concentración de aniones cargados negativamente debe ser igual a la concentración de cationes cargados positivamente. Todos los iones participan en este equilibrio, incluyendo los que se miden habitualmente, como el sodio (Na), el cloruro (Cl) y el bicarbonato (HCO 3 ), y los que no se miden. Los cationes no medidos (CNM) y los aniones no medidos (ANM) se incluyen en la siguiente ecuación de equilibrio electroquímico: Na + + CNM = (Cl - + HCO 3- ) + ANM Reordenando los términos en esta ecuación, se obtiene la siguiente: Na + - (Cl - + HCO 3- ) = ANM CNM = ANION GAP VALORES DE REFERENCIA Originalmente en 12 ± 4 meq/l (intervalo = 8 a 16 meq/l). Con la adopción de nuevos sistemas automáticos que miden con más exactitud los electrólitos séricos, el valor normal del anion gap ha descendido a 7 ± 4 meq/l (intervalo = 3 a 11 meq/l)
52 Influencia de la albúmina La albúmina es una importante fuente de aniones no medidos, y una reducción del 50% de la concentración de albúmina causará una reducción del 75% del hiato aniónico. Dado que la hipoalbuminemia es habitual en los pacientes de la UCI, en todos ellos debe considerarse la influencia de la albúmina en el anión gap. Un método para ajustar el anion gap en pacientes con hipoalbuminemia consiste en la aplicación de la siguiente ecuación (en la que el factor 4,5 es la concentración normal de albúmina en g/dl) AG ajustado = AG observado + 2,5 x [4,5 - albúmina medida (g/dl)] AG ajustado = [Na + - (Cl - + HCO 3- )] + 2,5 x [4,5 - albúmina medida (g/dl)] La diferencia podría transformar un anión gap aparentemente normal en uno elevado.
53 Interpretación del hiato aniónico
54 HIATO ANIÓNICO ELEVADO Cuando se añade al espacio extracelular un ácido fijado, el ácido se disocia para producir hidrogeniones y aniones. Los hidrogeniones se combinan con bicarbonato (HCO 3 ) para formar ácido carbónico. La disminución de HCO 3 produce un aumento del anión gap según la relación ANION GAP = Na + - (Cl - (N)+ HCO 3- ) elevado CAUSAS DE ACIDOSIS METABOLICAS CON ANION GAP AUMENTADO Insuficiencia renal Acidosis láctica Cetoacidosis (diabética, alcoholica, de ayuno) Rabdomiolisis Ingestión de: salicilatos metanol o formaldehido etilenglicol paraldehido tolueno etanol citrato (transfusión masiva)
55 HIATO ANIÓNICO NORMAL Se genera por pérdida de iones HCO 3 - y ganancia de Cl -. Hay discrepancias sobre quién es el origen (como pierde bicarbonato, gana Cloro, o, como gana Cloro, pierde bicarbonato). ANION GAP = Na + - (Cl - + HCO 3- ) normal CAUSAS DE ACIDOSIS METABOLICA CON ANION GAP NORMAL o HIPERCLORÉMICAS Administración de ácidos Hiperalimentación con soluciones de aminoacidos que contengan ClH Colestiramina Administración de ácido clorídrico en el tratamiento de la alcalosis metabólica severa Pérdidas de bicarbonato Gastrointestinal: Diarrea Drenaje biliar o pancreático Ureterosigmoidostomia Renal: Acidosis tubular renal proximal (tipo 2) Cetoacidosis (particularmente durante el tratamiento) Posthipocapnia crónica Alteración de la excreción renal de ácido Con hipopotasemia: Acidosis tubular renal distal (tipo 1) Con hiperpotasemia Acidosis tubular renal distal hiperkaliemica Hipoaldosteronismo Perfusión renal reducida
56 HALLAZGOS DE LABORATORIO EN LAS ALTERACIONES PRIMARIAS DE LOS TRASTORNOS DEL EQUILIBRIO ÁCIDO-BASE
57 Manifestaciones clínicas: - Dependientes del nivel de pco2 y de su rapidez de instauración. - Predominan los síntomas neurológicos: cefalea, somnolencia, confusión y coma. - Ingurgitación de los vasos retinianos y papiledema. - Se asocia a hipertensión pulmonar y cor pulmonale. Tratamiento: - Debe dirigirse a la enfermedad causal. - Puede ser necesaria la ventilación mecánica en las formas graves y/o acompañadas de hipoxemia. - La oxigenoterapia puede disminuir o anular el estímulo respiratorio en éstos pacientes.
58 Manifestaciones clínicas: - Síntomas de hipocalcemia - Deterioro del nivel de conciencia - Síncope - Arritmias Tratamiento: - Causal. Se trata la hiperventilación con fármacos (sedantes) o haciendo respirar al paciente en una bolsa de papel.
59 Clínica: Hiperventilación compensadora Hipotensión Arritmias ventriculares Deterioro del nivel de conciencia, confusión y cefalea Las formas crónicas pueden conllevar retraso en el crecimiento en los niños y desmineralización ósea en el adulto. Tratamiento: Corregir la causa de la acidosis. Aporte del déficit de bases (bicarbonato sobre todo si el ph es inferior a 7,2). La corrección debe ser lenta (más de 12 h.).
60 Manifestaciones clínicas: - Tetania secundaria a hipocalcemia - Hiperirritabilidad - Convulsiones - Trastornos mentales - Depresión respiratoria - Cambios ECG semejantes a la hipokaliemia Tratamiento: - Administrar NaCl o KCl dependiendo de la severidad de la hipokaliemia; - En casos de alcalosis severa o persistente puede requerirse cloruro amónico.
61
62 SEGURO QUE ESTO ES MÁS FÁCIL Si con>núas, lo hago TIEMPO, TIEMPO, TIEMPO!
63 Sí, sí muy claro!, para la acidez, omeprazol o bicarbonato
64
EQUILIBRIO ÁCIDO-BASE
 EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
EQUILIBRIO ÁCIDO-BASE - Departamento de Fisiopatología - Facultad de Medicina Br. Inés Lujambio CONCEPTOS BÁSICOS. Ácido: toda sustancias capaz de ceder protones de hidrógeno (H + ). HCl H + + Cl - Base:
Control del Equilibrio ácido-base
 Control del Equilibrio ácido-base Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia
Control del Equilibrio ácido-base Escala de ph ph Concentración de H + en Eq/L 1 0.1 2 0.01 3 0.001 4 0.0001 5 0.00001 6 0.000001 7 0.0000001 7.4 0.0000004 8 0.00000001 9 0.000000001 ÁLCALI: sustancia
Actualización en Medio Interno Conceptos básicos
 Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
Actualización en Medio Interno Conceptos básicos Bioquímica Lucrecia Drago Bioquímica M. Fernanda Pontoriero Ácidos Moléculas capaces de liberar H + HCl H + + Cl H 2 CO 3 H + + HCO 3 Bases Moléculas capaces
Equilibrio Acido-Base
 UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Conceptos
UNIVERSIDAD DE SAN CARLOS DE GUATEMALA FACULTAD DE CIENCIAS MÉDICAS FASE I, Unidad Didáctica: BIOQUÍMICA MÉDICA 2º AÑO CICLO ACADÉMICO 2,007 Equilibrio Acido-Base Dr. Mynor A. Leiva Enríquez Conceptos
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS
 EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
EQUILIBRIO ÁCIDO-BASE MANTENIMIENTO DE LA HOMEOSTASIS EQUILÍBRIO ÁCIDO-BASE La regulación de ph a nivel celular, es necesaria para la supervivencia. Los ácidos y bases entran continuamente en la sangre
6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 6. MANTENIMIENTO DEL ph EN EL MEDIO EXTRACELULAR ESQUEMA - Composición iónica de los medios corporales - Capacidad tampón - Mantenimiento
[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x
![[A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x [A-] Citrato 3- ph = pka + log. 7 = log [AH] Citrato 2- 7 = log = = x x](/thumbs/55/35730009.jpg) Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
Una reacción enzimática transcurre en 10 ml de una disolución cuya concentración total de citrato es 120 mm y su ph inicial es de 7. Durante la reacción se producen 0.2 miliequivalentes de un ácido. Calcular
METABOLISMO ACIDO / BASE
 METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
METABOLISMO ACIDO / BASE Dr Sergio Octavio GRANADOS TINAJERO Hospital Angeles de Villahermosa, Villahermosa, Tabasco, México. Course : 3 Year : 2003 Language : Spanish Country : Mexico City : Baja California
lunes 27 de febrero de 12 Desequilibrio Acido-Base
 Desequilibrio Acido-Base Equilibrio Ácido-Base H + es un anión con muy baja concentración en el cuerpo humano. Na + 3.5 millones de veces mas que H + Escala de ph: mide el grado de acidez de una solución.
Desequilibrio Acido-Base Equilibrio Ácido-Base H + es un anión con muy baja concentración en el cuerpo humano. Na + 3.5 millones de veces mas que H + Escala de ph: mide el grado de acidez de una solución.
SOLUCIONES BUFFERS. pk = valor de ph en el cual las concentraciones del ácido y la sal son iguales
 SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
SOLUCIONES BUFFERS Constituidas por un ácido débil y su base conjugada (sal) permite la adición de ácido o base sin variar considerablemente el ph. La capacidad búffer es máximo una unidad por encima y
GASES EN SANGRE. modifican el ph sanguineo.
 GASES EN SANGRE ESTADO ACIDO-BASE ESTADO DE OXIGENACION Detectar o confirmar alteraciones metabolicas y/o respiratorias que modifican el ph sanguineo. Determinar si la oxigenacion tisular es la adecuada.
GASES EN SANGRE ESTADO ACIDO-BASE ESTADO DE OXIGENACION Detectar o confirmar alteraciones metabolicas y/o respiratorias que modifican el ph sanguineo. Determinar si la oxigenacion tisular es la adecuada.
Cátedra de Fisiología Humana CAPÍTULO I CAPITULO III. Equilibrio Acido Base PH. Carrera de Enfermería. Universidad Nacional del Nordeste
 CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
CAPÍTULO I Cátedra de Fisiología Humana CAPITULO III Equilibrio Acido Base PH Carrera de Enfermería. Universidad Nacional del Nordeste 37 CAPITULO 3: Cada soluto del organismo, el sodio, el potasio, el
Revista de Actualización Clínica Volumen
 ACIDOSIS METABOLICA Vargas Flores Tatiana 1 Colaboración: Condori Canaza Claudia 2 RESUMEN El ph responsable del equilibrio ácidobase a nivel del líquido extracelular tiene un valor de 7,35 a 7,40; el
ACIDOSIS METABOLICA Vargas Flores Tatiana 1 Colaboración: Condori Canaza Claudia 2 RESUMEN El ph responsable del equilibrio ácidobase a nivel del líquido extracelular tiene un valor de 7,35 a 7,40; el
1.- FOSFATO MONOSUSTITUIDO/FOSFATO DISUSTITUIDO (H2PO4 - /HPO4 = )
 1. FOSFATO MONOSUSTITUIDO/FOSFATO DISUSTITUIDO (H2PO4 /HPO4 = ) El ácido fosfórico (H 3 PO 4 ), además de formar parte de numerosos compuestos orgánicos (ácidos nucleicos, fosfolípidos, azúcares, etc.)
1. FOSFATO MONOSUSTITUIDO/FOSFATO DISUSTITUIDO (H2PO4 /HPO4 = ) El ácido fosfórico (H 3 PO 4 ), además de formar parte de numerosos compuestos orgánicos (ácidos nucleicos, fosfolípidos, azúcares, etc.)
ESTADO ACIDO BASE ACIDOSIS METABOLICA. ETIOLOGÍA DE LA ACIDOSIS METABÓLICA Inhabilidad Para Secretar La Carga Acida De La Dieta +
 ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
ESTADO ACIDO BASE Los siguientes pasos son usados para evaluar los desordenes acidobase: 1.Determinar la anormalidad de base acidosis metabólica y/o alcalosis metabólica. 2.Determinar los factores contribuyentes
INTERPRETACION DE LOS GASES ARTERIALES
 INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
INTERPRETACION DE LOS GASES ARTERIALES ph PaO2 PaCO2 HCO3 BE Hb SaO2 Bloque 6 Modulo 2 Dr Erick Valencia Anestesiologo Intensivista. Que son los Gases Arteriales? Una muestra de sangre anticoagulada que
Líquidos corporales Compartimiento Equilibrio de líquidos. Q.F. Adriana Cordero
 Líquidos corporales Compartimiento Equilibrio de líquidos Q.F. Adriana Cordero INTRODUCCIÒN El agua y los solutos disueltos en cada uno de los compartimentos corporales de fluidos constituyen los líquidos
Líquidos corporales Compartimiento Equilibrio de líquidos Q.F. Adriana Cordero INTRODUCCIÒN El agua y los solutos disueltos en cada uno de los compartimentos corporales de fluidos constituyen los líquidos
EQUILIBRIO ACIDO - BASE
 EQUILIBRIO ACIDO - BASE Carrera de Médicos Especialistas Universitarios en Medicina Crítica y Terapia Intensiva. Universidad de Buenos Aires CONCEPTOS GENERALES EQUILIBRIO ACIDO-BASE EN FORMA ESTEQUIOMÉTRICA
EQUILIBRIO ACIDO - BASE Carrera de Médicos Especialistas Universitarios en Medicina Crítica y Terapia Intensiva. Universidad de Buenos Aires CONCEPTOS GENERALES EQUILIBRIO ACIDO-BASE EN FORMA ESTEQUIOMÉTRICA
Organización Funcional y el Medio Interno
 Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
Organización Funcional y el Medio Interno Aproximadamente el 50 % del cuerpo humano es líquido y la mayor parte es intracelular, la tercera parte es extracelular, la misma que se encuentra en movimiento
1. Líquidos corporales. 2. Anatomía y función renal. 3. Hormonas ADH y aldosterona
 1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
1. Líquidos corporales 2. Anatomía y función renal 3. Hormonas ADH y aldosterona Propiedades de la Homeostasis 1. Importancia tanto del sistema nervioso como del endocrino. 2. Controles antagónicos. 3.
Carvajal Ramos M, Sánchez Sánchez M, Cornide Santos I, Panadero Carlavilla FJ
 ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE Carvajal Ramos M, Sánchez Sánchez M, Cornide Santos I, Panadero Carlavilla FJ El ph refleja la concentración de cationes de hidrógeno presentes en una determinada
ALTERACIONES DEL EQUILIBRIO ÁCIDO-BASE Carvajal Ramos M, Sánchez Sánchez M, Cornide Santos I, Panadero Carlavilla FJ El ph refleja la concentración de cationes de hidrógeno presentes en una determinada
Agua, electrolitos, balance acido-base. Dra. Luz E. Cuevas-Molina NURS 1231
 Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
Agua, electrolitos, balance acido-base Dra. Luz E. Cuevas-Molina NURS 1231 1 Introducción Para mantener la homoestasis debe haber un balance entre las cantidades de fluido y electrolitos Los electrolitos
Trastornos del equilibrio ácido-base
 NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
NOTA DELS COMISSIONARIS: hi ha aclaracions i correccions importants al document Fe d errades, és important que us el mireu de cara a l examen!! Trastornos del equilibrio ácidobase INTRODUCCIÓN CONCEPTOS
SGUICEL009QM11-A16V1. Ácido base I: conceptos y teorías
 SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
SGUICEL009QM11-A16V1 Ácido base I: conceptos y teorías Ítem Alternativa Habilidad 1 B Reconocimiento 2 A Comprensión 3 E Reconocimiento 4 E Comprensión 5 E ASE 6 E Comprensión 7 D Comprensión 8 E Comprensión
8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 8. CASOS PRACTICOS DE ALTERACIONES DEL EQUILIBRIO ACIDO BASE A continuación se presentan una serie de casos prácticos resueltos,
Tema 9: Interpretación de una gasometría
 Tema 9: Interpretación de una gasometría Concepto de gasometría Gasometría en muestras de sangre (arterial, capilar, venosa) Valores normales Hipoxemia Hipercapnia e hipocapnia Acidosis y alcalosis: Introducción
Tema 9: Interpretación de una gasometría Concepto de gasometría Gasometría en muestras de sangre (arterial, capilar, venosa) Valores normales Hipoxemia Hipercapnia e hipocapnia Acidosis y alcalosis: Introducción
2. Sobre los valores de las diferentes presiones parciales de los gases, marca con una cruz (X) la respuesta correcta según corresponda.
 Semana 7 Consolidación 7. 1. Acerca de la mecánica de la ventilación pulmonar, escribe en el espacio en blanco (V) si son verdaderos o (F) si son falsos los siguientes planteamientos: a) _F_ Los intercostales
Semana 7 Consolidación 7. 1. Acerca de la mecánica de la ventilación pulmonar, escribe en el espacio en blanco (V) si son verdaderos o (F) si son falsos los siguientes planteamientos: a) _F_ Los intercostales
Acidosis y Alcalosis Metabolica.
 Acidosis y Alcalosis Metabolica. Acidosis metabólica Se caracteriza por: ph arterial bajo (concentración alta de hidrogeniones) Reducción en la concentración plasmática de HCO3. Hiperventilación compensatoria.
Acidosis y Alcalosis Metabolica. Acidosis metabólica Se caracteriza por: ph arterial bajo (concentración alta de hidrogeniones) Reducción en la concentración plasmática de HCO3. Hiperventilación compensatoria.
TALLER DE ANALISIS DE GASES ARTERIALES
 TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
TALLER DE ANALISIS DE GASES ARTERIALES Dr. Menfil A Orellana-Barrios Medicina Interna Cursos Precongreso Congreso de Residentes 2012 HGSJDD www.drmenfilorellana.wordpress.com Para qué se utilizan los Gases
Programa 3º Curso. Curso (Prof. M García-Caballero)
 Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Programa 3º Curso Departamento de Cirugía Curso 2008-09 Equilibrio i hidroelectrolítico lí i y ácido-base (Prof. M García-Caballero) http://www.cirugiadelaobesidad.net/ CAMBIOS DE FLUIDOS Y ELECTROLITOS
Fisiopatología del aparato respiratorio II _ Pruebas complementarias
 Fisiopatología del aparato respiratorio II _ Pruebas complementarias Gasometría arterial (GSA) Gasometría arterial: Punción de una arteria periférica Determina el equilibrio ácido-base: - ph - Las concentraciones
Fisiopatología del aparato respiratorio II _ Pruebas complementarias Gasometría arterial (GSA) Gasometría arterial: Punción de una arteria periférica Determina el equilibrio ácido-base: - ph - Las concentraciones
7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE
 Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Departamento de Bioquímica y Biología Molecular ph y equilibrios acido-base 7. ESTUDIO DEL EQUILIBRIO ACIDO BASE DE UN PACIENTE ESQUEMA - Estudio del equilibrio ácido-base de un paciente - Trastornos del
Trastornos respiratorios. Acidosis y alcalosis
 Trastornos respiratorios Acidosis y alcalosis Acidosis Respiratoria Trastorno que se caracteriza por aumento primario de la paco2 con elevación de la concentración de H+ en sangre, disminución del ph y
Trastornos respiratorios Acidosis y alcalosis Acidosis Respiratoria Trastorno que se caracteriza por aumento primario de la paco2 con elevación de la concentración de H+ en sangre, disminución del ph y
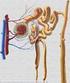
Tema 34 Fisiología del sistema excretor. Filtración glomerular. Presiones y permeabilidad. Aclaramiento renal.
 Tema 34 Fisiología del sistema excretor. Filtración glomerular. Presiones y permeabilidad. Aclaramiento renal. 1. Funciones generales del sistema excretor. 2. Anatomía del sistema excretor. 3. La nefrona.
Tema 34 Fisiología del sistema excretor. Filtración glomerular. Presiones y permeabilidad. Aclaramiento renal. 1. Funciones generales del sistema excretor. 2. Anatomía del sistema excretor. 3. La nefrona.
Conclusiones. Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente
 Gases en Sepsis Conclusiones Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente El análisis de los gases no debe retrasar tomar el Lactato e iniciar EGDT No tratamos solo números
Gases en Sepsis Conclusiones Siempre antes del análisis, esta la Clínica o que espero yo en mi paciente El análisis de los gases no debe retrasar tomar el Lactato e iniciar EGDT No tratamos solo números
TALLER DE GASES ARTERIALES
 TALLER DE GASES ARTERIALES MOP 24 de Agosto 2010 Objetivos Aprender a reconocer los trastornos del equilibrio ácido-base: Acidosis metabólica y respiratoria, alcalosis metabólica y respiratoria. Familiarizarse
TALLER DE GASES ARTERIALES MOP 24 de Agosto 2010 Objetivos Aprender a reconocer los trastornos del equilibrio ácido-base: Acidosis metabólica y respiratoria, alcalosis metabólica y respiratoria. Familiarizarse
Fisiología renal Rafael Porcile. Universidad Abierta Interamericana
 Fisiología renal Rafael Porcile rafael.porcile@vaneduc.edu.ar D E P A R T A M E N T O D E C A R D I O L O G I A C A T E D R A D E F I S I O L O G Í A Universidad Abierta Interamericana rafael.porcile@vaneduc.edu.ar
Fisiología renal Rafael Porcile rafael.porcile@vaneduc.edu.ar D E P A R T A M E N T O D E C A R D I O L O G I A C A T E D R A D E F I S I O L O G Í A Universidad Abierta Interamericana rafael.porcile@vaneduc.edu.ar
Fisiología y envejecimiento Aparato urinario. Tema 11
 Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Tema 11 Funciones generales. Anatomía Nefrona Filtración glomerular Reabsorción tubular Secreción tubular Micción Envejecimiento Funciones generales * Mantenimiento de la homeostasis hídrica y electrolítica.
Pauta de corrección guía IV medio Homeostasis
 Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
Pauta de corrección guía IV medio Homeostasis Actividad 1.- Registra la temperatura ambiental en un día cada una hora. Así mismo registra la temperatura corporal que tu cuerpo tiene en cada hora. Grafica
TRASTORNOS DEL EQUILIBRIO ÁCIDO-BASE
 TRASTORNOS DEL EQUILIBRIO ÁCIDO-BASE AUTORES: MARIA JOSE RUIZ MARQUEZ CARMEN ORTIZ GARCIA JUAN JOSE SANCHEZ LUQUE ANA PEÑA AGÜERA LABORATORIO DEL HOSPITAL CLÍNICO UNIVERSITARIO VIRGEN DE LA VICTORIA DE
TRASTORNOS DEL EQUILIBRIO ÁCIDO-BASE AUTORES: MARIA JOSE RUIZ MARQUEZ CARMEN ORTIZ GARCIA JUAN JOSE SANCHEZ LUQUE ANA PEÑA AGÜERA LABORATORIO DEL HOSPITAL CLÍNICO UNIVERSITARIO VIRGEN DE LA VICTORIA DE
Concepto de ph. Bases
 Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
Concepto de ph El concepto de ph nace de dos tipos de especies químicas llamadas ácidos y bases, las que se pueden clasificar como tal y predecir su potencia o fuerza de acuerdo al valor de su ph. Características
El sistema excretor es el encargado de eliminar las sustancias tóxicas y los desechos de nuestro cuerpo. La sangre recoge, en cada tejido y órgano,
 El sistema excretor es el encargado de eliminar las sustancias tóxicas y los desechos de nuestro cuerpo. La sangre recoge, en cada tejido y órgano, desechos que son producto del metabolismo celular. Estos
El sistema excretor es el encargado de eliminar las sustancias tóxicas y los desechos de nuestro cuerpo. La sangre recoge, en cada tejido y órgano, desechos que son producto del metabolismo celular. Estos
DESORDEN ACIDO BASICO
 DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
DESORDEN ACIDO BASICO Cuando se habla de regulacion del equilibrio acido base, se habla en realidad de la Regulacion de la concentracion de iones hidrogenos en los liquidos corporales 1 Como la concentracion
VARIACIONES SANGUÍNEAS: - pco2 - EL ph ESTIMULO C.R.B., NO COMPENSA DISNEA - po2 - NaHCO3 5 mmol/l
 Fisiopatología Del Equilibrio Ácido-Base: Acidosis PH debe ser menor a 7.35. a) Acidosis Respiratorias b) Acidosis Metabólicas También se habla de acidosis compensadas y no compensadas. Una acidosis puede
Fisiopatología Del Equilibrio Ácido-Base: Acidosis PH debe ser menor a 7.35. a) Acidosis Respiratorias b) Acidosis Metabólicas También se habla de acidosis compensadas y no compensadas. Una acidosis puede
Equilibrio Químico. CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A.
 Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
Equilibrio Químico CI4102 Ingeniería Ambiental Profesor Marcelo Olivares A. Introducción Las reacciones químicas que se ha considerado hasta este punto se denominan irreversibles debido a que ellas proceden
ALTERACIONES DEL EQUILIBRIO ACIDO-BASE
 ALTERACIONES DEL EQUILIBRIO ACIDO-BASE El equilibrio ácido-base puede alterarse por dos tipos de mecanismos fundamentales. a) Cambios en la función respiratoria, con aumento o disminución de la P a CO
ALTERACIONES DEL EQUILIBRIO ACIDO-BASE El equilibrio ácido-base puede alterarse por dos tipos de mecanismos fundamentales. a) Cambios en la función respiratoria, con aumento o disminución de la P a CO
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ
 MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
MEDIO INTERNO ACIDOSIS METABÓLICA DRA. STELLA MARIS DIEGUEZ HTAL. GRAL DE AGUDOS DR. T. ÁLVAREZ 1-Historia clínica G D Varón de 1 año y 5 meses MOTIVO DE CONSULTA retraso del crecimiento ANTECEDENTES RNTPAEG
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales. Verónica Pantoja. Lic. MSP.
 Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Bioelementos y biomoléculas 1-Moleculas inorganicas Sales minerales Professor: Kinesiologia Verónica Pantoja. Lic. MSP. 1.Precipitadas Formando estructuras sólidas, insolubles, con función esquelética.
Tema 2. El agua, el ph y los equilibrios iónicos
 Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Tema 2. El agua, el ph y los equilibrios iónicos -Interacciones débiles en sistemas acuosos: puentes de hidrógeno, fuerzas de van der Waals e interacciones iónicas. -Enlaces hidrofóbicos. -Estructura y
Fisiopatología Del Equilibrio Ácido-Base: Alcalosis
 Fisiopatología Del Equilibrio Ácido-Base: Alcalosis La alcalosis mucho menos frecuente que la acidosis, pero muy complicada para el organismo. Cuando el organismo sufre alcalosis va a tener problemas bastante
Fisiopatología Del Equilibrio Ácido-Base: Alcalosis La alcalosis mucho menos frecuente que la acidosis, pero muy complicada para el organismo. Cuando el organismo sufre alcalosis va a tener problemas bastante
Alteraciones de los Fluidos Corporales, Electrolitos
 Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Alteraciones de los Fluidos Corporales, Electrolitos Introducción Abner J. Gutiérrez Chávez, MVZ, MC. Facultad de Medicina Veterinaria y Zootecnia, UNAM. Dpto. Producción Animal: Rumiantes Existen diversas
Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D.
 Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D. Vallejos Javier Serial Marcos Sebastián Rausch Ricardo Simón Laura Solé Juan
Dra. María Eugenia Victoria Bianchi Dr. Gustavo Borda Dra Marcela Young. Estudiantes por Concurso según Resolución 1311/95-C-D. Vallejos Javier Serial Marcos Sebastián Rausch Ricardo Simón Laura Solé Juan
UNIVERSIDAD AUSTRAL DE CHILE INSTITUTO DE FARMACOLOGIA Prof. Marcos Moreira Espinoza 1
 INSTITUTO DE FARMACOLOGIA Prof. Marcos Moreira Espinoza 1 EQUILIBRIO ACIDO-BASE La función celular es óptima cuando el ph del LEC es 7.4 ([H+] de 40 nmoles/litro). Sin embargo hay muchas situaciones, especialmente
INSTITUTO DE FARMACOLOGIA Prof. Marcos Moreira Espinoza 1 EQUILIBRIO ACIDO-BASE La función celular es óptima cuando el ph del LEC es 7.4 ([H+] de 40 nmoles/litro). Sin embargo hay muchas situaciones, especialmente
JORNADA CIENTÍFICA COMENTARIOS INTERPRETATIVOS EN EL INFORME ANALÍTICO Y SEGURIDAD DEL PACIENTE
 JORNADA CIENTÍFICA COMENTARIOS INTERPRETATIVOS EN EL INFORME ANALÍTICO Y SEGURIDAD DEL PACIENTE SOCIEDAD ANDALUZA DE ANÁLISIS CLÍNICOS (SANAC) Antequera, 27 de Enero de 2011 COMENTARIOS INTERPRETATIVOS
JORNADA CIENTÍFICA COMENTARIOS INTERPRETATIVOS EN EL INFORME ANALÍTICO Y SEGURIDAD DEL PACIENTE SOCIEDAD ANDALUZA DE ANÁLISIS CLÍNICOS (SANAC) Antequera, 27 de Enero de 2011 COMENTARIOS INTERPRETATIVOS
Tarjeta pedagógica EL SISTEMA RESPIRATORIO. Biología. Cómo obtienen los seres vivos la energía de las moléculas? RECOMENDACIONES:
 Así como es indispensable incorporar materia del medio, también es EL SISTEMA RESPIRATORIO importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Así como es indispensable incorporar materia del medio, también es EL SISTEMA RESPIRATORIO importante liberar la energía química que se encuentra almacenada en las distintas moléculas orgánicas incorporadas.
Líquidos y Electrolitos en Cirugía. R o d o l f o A. C a b r a l e s MD D o c e n t e A r e a d e C i r u g í a
 Líquidos y Electrolitos en Cirugía R o d o l f o A. C a b r a l e s MD D o c e n t e A r e a d e C i r u g í a OBJETIVOS Reconocer las bases teóricas de la homeostasis de líquidos y electrolitos en condiciones
Líquidos y Electrolitos en Cirugía R o d o l f o A. C a b r a l e s MD D o c e n t e A r e a d e C i r u g í a OBJETIVOS Reconocer las bases teóricas de la homeostasis de líquidos y electrolitos en condiciones
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES
 TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
TEMA 7: REACCIONES DE TRANSFERENCIA DE PROTONES 1. Concepto de ácido y de base De las distintas teorías que existen de ácidos y bases, sólo vamos a exponer dos de las más utilizadas, la teoría de Arrhenius
FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA
 FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA PRINCIPIOS BASICOS: FÍSICA DE LOS GASES La ventilación y la perfusión pulmonares y la transferencia de los gases obedecen estrictamente a fuerzas
FISIOLOGIA RESPIRATORIA DR. JOSÉ CARLOS MORALES NÁJERA PRINCIPIOS BASICOS: FÍSICA DE LOS GASES La ventilación y la perfusión pulmonares y la transferencia de los gases obedecen estrictamente a fuerzas
Equipo 5 Sistemas amortiguadores
 Equipo 5 Sistemas amortiguadores Anaya Gutiérrez Erick Jesús García García Esmira Jazmin García Montesinos Ana Paola Gonzales Galindo Jesús Antonio Jóse Ruíz Diego Mendez Silva Clara Anaid Yépez Cancino
Equipo 5 Sistemas amortiguadores Anaya Gutiérrez Erick Jesús García García Esmira Jazmin García Montesinos Ana Paola Gonzales Galindo Jesús Antonio Jóse Ruíz Diego Mendez Silva Clara Anaid Yépez Cancino
Ventilación Pulmonar. -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón
 Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
Ventilación Pulmonar -durante al ejercicio- Elaborado por Lic. Manuel Salazar Leitón Funciones básicas de la ventilación pulmonar Intercambio gaseoso con el ambiente. Regular el acidez en sangre. Comunicación
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS
 ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS C03-. DIURÉTICOS Clasificación ATC C03A-. DIURÉTICOS DE BAJO TECHO, TIAZIDAS C03AA.Tiazidas solas C03AX.Tiazidas asociadas a otras sustancias concentrado
ANÁLISIS DUPLICIDAD TERAPÉUTICA SUBGRUPO C03-DIURÉTICOS C03-. DIURÉTICOS Clasificación ATC C03A-. DIURÉTICOS DE BAJO TECHO, TIAZIDAS C03AA.Tiazidas solas C03AX.Tiazidas asociadas a otras sustancias concentrado
ACIDIFICANTES EN ALIMENTOS PARA GATOS
 ACIDIFICANTES EN ALIMENTOS PARA GATOS Flávia Maria de Oliveira Borges Saad Médica Veterinária, MSc., PhD Nutrição Animal Universidade Federal de Lavras - DZO - UFLA POR QUÉ UTILIZAR ACIDIFICANTES EN ALIMENTOS
ACIDIFICANTES EN ALIMENTOS PARA GATOS Flávia Maria de Oliveira Borges Saad Médica Veterinária, MSc., PhD Nutrição Animal Universidade Federal de Lavras - DZO - UFLA POR QUÉ UTILIZAR ACIDIFICANTES EN ALIMENTOS
Anatomía y Fisiología del Sistema Urinario y Escretor
 Anatomía y Fisiología del Sistema Urinario y Escretor La excreción Es el proceso biológico por el que un ser vivo elimina de su organismo las sustancias tóxicas, adquiridas por la alimentación o producidas
Anatomía y Fisiología del Sistema Urinario y Escretor La excreción Es el proceso biológico por el que un ser vivo elimina de su organismo las sustancias tóxicas, adquiridas por la alimentación o producidas
ENFERMERÍA CLÍNICA I Felicitas Merino de la Hoz TEMA 1.2.2 DESEQUILIBRIOS ACIDOBÁSICOS
 TEMA 1.2.2 DESEQUILIBRIOS ACIDOBÁSICOS ÍNDICE 1. Introducción. 2. Análisis e interpretación de los gases arteriales. 3. Alteraciones del equilibrio ácido- base. 3.1. Acidosis respiratoria. 3.2. Alcalosis
TEMA 1.2.2 DESEQUILIBRIOS ACIDOBÁSICOS ÍNDICE 1. Introducción. 2. Análisis e interpretación de los gases arteriales. 3. Alteraciones del equilibrio ácido- base. 3.1. Acidosis respiratoria. 3.2. Alcalosis
ENFOQUE SISTEMÁTICO PARA LA INTERPRETACIÓN DE GASES SANGUÍNEOS EN LA PRÁCTICA CLÍNICA
 Capítulo V ENFOQUE SISTEMÁTICO PARA LA INTERPRETACIÓN DE GASES SANGUÍNEOS EN LA PRÁCTICA CLÍNICA INTRODUCCIÓN L a determinación que se conoce como GASES SANGUÍNEOS permite, por una parte, la valoración
Capítulo V ENFOQUE SISTEMÁTICO PARA LA INTERPRETACIÓN DE GASES SANGUÍNEOS EN LA PRÁCTICA CLÍNICA INTRODUCCIÓN L a determinación que se conoce como GASES SANGUÍNEOS permite, por una parte, la valoración
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas.
 La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
La solubilidad es la medida de la capacidad de disolverse una cierta sustancia en un determinado medio, a una temperatura y presión determinadas. Las proteínas en disolución muestran grandes cambios en
15/03/2010. Definición:
 ph Definición: El ph es una medida de la acidez El ph es una medida de la acidez o alcalinidad de una sustancia. Es un valor numérico que expresa la concentración de iones de hidrógeno (H + ). El ph no
ph Definición: El ph es una medida de la acidez El ph es una medida de la acidez o alcalinidad de una sustancia. Es un valor numérico que expresa la concentración de iones de hidrógeno (H + ). El ph no
FISIOPATOLOGIA. Concentración normal H+: 40 nmoles/l. -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3
 FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
FISIOPATOLOGIA Concentración normal H+: 40 nmoles/l -PH : 6.8-7.35 < -( H+) : 16-160 nmoles/l -PCO2: 36-44 mmhg -BE: -3 a 3 FISIOPATOLOGIA ACIDO-BASE ACIDO: sustancia capaz de ceder protones BASE: sustancia
INDICE Parte 2. Pág 8.4 LOS AMORTIGUADORES FISIOLOGICOS
 Capítulo 8 Parte 2/4 8.4 LOS AMORTIGUADORES FISIOLOGICOS Los sistemas buffers que hay en la sangre y en el extracelular ya fueron señalados en la Tabla 8.III. Los analizaremos uno por uno: a) Bicarbonato
Capítulo 8 Parte 2/4 8.4 LOS AMORTIGUADORES FISIOLOGICOS Los sistemas buffers que hay en la sangre y en el extracelular ya fueron señalados en la Tabla 8.III. Los analizaremos uno por uno: a) Bicarbonato
INSUFICIENCIA RENAL AGUDA
 INSUFICIENCIA RENAL AGUDA La insuficiencia renal aguda es un síndrome clínico que se produce por una reducción brusca de la filtración glomerular con retención progresiva de productos nitrogenados en sangre
INSUFICIENCIA RENAL AGUDA La insuficiencia renal aguda es un síndrome clínico que se produce por una reducción brusca de la filtración glomerular con retención progresiva de productos nitrogenados en sangre
Fisiopatología Equilibrio Hidrosalino. Potasio
 Fisiopatología Equilibrio Hidrosalino Potasio Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile Valdivia- Chile FISIOPATOLOGIA DEL EQUILIBRIO DEL K+:
Fisiopatología Equilibrio Hidrosalino Potasio Prof. Marcos Moreira Espinoza Instituto de Farmacología y Morfofisiología Universidad Austral de Chile Valdivia- Chile FISIOPATOLOGIA DEL EQUILIBRIO DEL K+:
SALES MINERALES , CO 3. Aniones: Cl -, PO 4. , NO 3, Cationes: Na +, Ca 2+, Mg 2+, Fe 2+, Fe 3+, K +
 SALES MINERALES Aniones: Cl -, PO 4 3-, CO 3 2-, NO 3, Cationes: Na +, Ca 2+, Mg 2+, Fe 2+, Fe 3+, K + SALES PRECIPITADAS Vieira SALES PRECIPITADAS: CaCO 3 Exoesqueleto de Ca Sales de Ca: caparazones
SALES MINERALES Aniones: Cl -, PO 4 3-, CO 3 2-, NO 3, Cationes: Na +, Ca 2+, Mg 2+, Fe 2+, Fe 3+, K + SALES PRECIPITADAS Vieira SALES PRECIPITADAS: CaCO 3 Exoesqueleto de Ca Sales de Ca: caparazones
COLEGIO SAN FRANCISCO JAVIER GUIAS
 COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
COLEGIO SAN FRANCISCO JAVIER GUIAS Código PGF 03 R07 2009 08 V03 Estudiante: Guía Nº: 2 Profesor: Andrés Fernando Rosero Ortiz Grado: 11 Asignatura: Química Sección: ABCD Tema: Equilibrio químico Equilibrio
METABOLISMO DE CALCIO y FOSFORO
 METABOLISMO DE CALCIO y FOSFORO CONTENIDO Y DISTRIBUCION CORPORAL DE CALCIO, FOSFATO Y MAGNESIO: ADULTO: 1kg de calcio ~ 1,7% del peso corporal 5º elemento en abundancia en el cuerpo humano 1 TOTAL DE
METABOLISMO DE CALCIO y FOSFORO CONTENIDO Y DISTRIBUCION CORPORAL DE CALCIO, FOSFATO Y MAGNESIO: ADULTO: 1kg de calcio ~ 1,7% del peso corporal 5º elemento en abundancia en el cuerpo humano 1 TOTAL DE
Lección 24. Fármacos Diuréticos UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS. Ricardo Brage e Isabel Trapero - Farmacología Lección 24
 Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Ricardo Brage e Isabel Trapero - Lección 24 UNIDAD VII: PROBLEMAS CARDIOVASCULARES Y SANGUÍNEOS Lección 24 Fármacos Diuréticos Guión Ricardo Brage e Isabel Trapero - Lección 24 1. BASES CONCEPTUALES. 2.
Tema 1. Introducción
 Tema 1. Introducción - Bioquímica: concepto, y objetivos - Importancia de la Bioquímica en la Lic. De Farmacia - Composición química del cuerpo humano: Bioelementos Bioelementos primarios o principales
Tema 1. Introducción - Bioquímica: concepto, y objetivos - Importancia de la Bioquímica en la Lic. De Farmacia - Composición química del cuerpo humano: Bioelementos Bioelementos primarios o principales
Equilibrio acido-base
 Equilibrio acido-base Vamos a ver otro de los grandes problemas que tiene el organismo. El organismo siempre tiene una lucha para tratar de mantener el equilibrio ácido-base. Cuando se habla de equilibrio
Equilibrio acido-base Vamos a ver otro de los grandes problemas que tiene el organismo. El organismo siempre tiene una lucha para tratar de mantener el equilibrio ácido-base. Cuando se habla de equilibrio
ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO
 Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
Toxicología alimentaria Diplomatura de Nutrición humana y dietética Curso 2010-2011 ABSORCIÓN, DISTRIBUCIÓN Y ELIMINACIÓN DE LOS TÓXICOS EN EL ORGANISMO Dr. Jesús Miguel Hernández-Guijo Dpto. Farmacología
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica.
 capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
capnografia volumetrica NICO Claudia Eyzaguirre G. Enfermera clínica. El CO2 es un producto final del O2 utilizado por las células después del metabolismo celular. Una vez que el CO2 alcanza los pulmones
Componentes químicos de
 Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Componentes químicos de las célulasc Componentes químicos Las células están compuestas por una enorme cantidad y variedad de moléculas que pueden clasificarse en: Componentes inorgánicos Componentes orgánicos
Química. Equilibrio ácido-base Nombre:
 Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
Química DEPARTAMENTO DE FÍSICA E QUÍMICA Equilibrio ácido-base 25-02-08 Nombre: Cuestiones y problemas 1. a) Qué concentración tiene una disolución de amoníaco de ph =10,35? [1½ PUNTO] b) Qué es una disolución
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS.
 PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PRÁCTICA 15 CÁLCULO TEÓRICO Y EXPERIMENTAL DE ph DE DISOLUCIONES DE ÁCIDOS, BASES Y SALES. DISOLUCIONES REGULADORAS. OBJETIVOS En esta práctica se tratarán aspectos de interés relacionados con los equilibrios
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE.
 PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE http://emestrada.wordpress.com Complete los siguientes equilibrios ácido-base identificando, de forma razonada, los
PROBLEMAS RESUELTOS SELECTIVIDAD ANDALUCÍA 000 QUÍMICA TEMA 6: EQUILIBRIOS ÁCIDO-BASE http://emestrada.wordpress.com Complete los siguientes equilibrios ácido-base identificando, de forma razonada, los
Un adulto sano, suele ser capaz de mantener los equilibrios hidroelectrolíticos y ácido-base.
 BALANCE HIDRICO BALANCE HIDRICO Para conservar la salud y mantener las funcíones corporales, es necesario un EQUILIBRIO líquido, electrolítico y ácido báse. El requerimiento es: aporte y eliminación armónico
BALANCE HIDRICO BALANCE HIDRICO Para conservar la salud y mantener las funcíones corporales, es necesario un EQUILIBRIO líquido, electrolítico y ácido báse. El requerimiento es: aporte y eliminación armónico
LABORATORIO Nº 3 Determinación de la capacidad amortiguadora de un buffer
 LABORATORIO Nº 3 - Es obligatorio la asistencia al práctico con túnica y lentes de seguridad. - El protocolo de la práctica y el fundamento teórico de la misma deben haber sido leídos por el estudiante
LABORATORIO Nº 3 - Es obligatorio la asistencia al práctico con túnica y lentes de seguridad. - El protocolo de la práctica y el fundamento teórico de la misma deben haber sido leídos por el estudiante
Reacciones de transferencia de protones Ácidos y bases
 Tema 6 Reacciones de transferencia de protones Ácidos y bases Probablemente no haya otro tipo de equilibrio tan importante con el de ácidos y bases B. M. Mahan y R. J. Myers Química. Curso Universitario
Tema 6 Reacciones de transferencia de protones Ácidos y bases Probablemente no haya otro tipo de equilibrio tan importante con el de ácidos y bases B. M. Mahan y R. J. Myers Química. Curso Universitario
El equilibrio hidroelectrolítico
 El equilibrio hidroelectrolítico 8/1/11 Rui Perestrelo, El agua corresponde al 80% del peso corporal de un lechón recién nacido y al 52% de un animal de 100 kg, y representa entre el 34 y el 39% de la
El equilibrio hidroelectrolítico 8/1/11 Rui Perestrelo, El agua corresponde al 80% del peso corporal de un lechón recién nacido y al 52% de un animal de 100 kg, y representa entre el 34 y el 39% de la
, H 2 SO 4, HSO 4-. HClO 4, ClO 4-, H 2 O, H 3 O +, OH -, S =, H 2 S, HS -, NH 3, NH 4+, CO 3 =, HCO 3
 1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
1 Aplicando la teoría de Bronsted y Lowry, razonar si son ciertas o falsas las siguientes afirmaciones a) Un ácido reacciona con su base conjugada dando lugar a una disolución neutra b) Un ácido reacciona
La Química Analítica nos permite medir, monitorear o caracterizar una, varias especies o procesos químicos para la resolución de diversos problemas:
 QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
QUÍMICA ANALÍTICA I Documento de apoyo (1) : Formación de soluciones analíticas. Dr. Alejandro Baeza. Semestre 2010-II. Antecedentes La Química Analítica nos permite medir, monitorear o caracterizar una,
Fisiologia respiratorio
 Fisiologia respiratorio MVR/LC El proceso respiratorio Ventilación pulmonar: inspiración y espiración. Intercambio gaseoso entre el aire y la sangre. Transporte de los gases por la sangre. Intercambio
Fisiologia respiratorio MVR/LC El proceso respiratorio Ventilación pulmonar: inspiración y espiración. Intercambio gaseoso entre el aire y la sangre. Transporte de los gases por la sangre. Intercambio
TEMA 8. APARATOS PARA LA NUTRICIÓN
 TEMA 8. APARATOS PARA LA NUTRICIÓN DEPARTAMENTO BIOLOGÍA http://biologiageologiaiesricardobernardobelenruiz.wordpress.com/e-s-o/3o-e-s-o/curso-2012-2013/ I.E.S. Ricardo Bernardo APARATO EXCRETOR El sistema
TEMA 8. APARATOS PARA LA NUTRICIÓN DEPARTAMENTO BIOLOGÍA http://biologiageologiaiesricardobernardobelenruiz.wordpress.com/e-s-o/3o-e-s-o/curso-2012-2013/ I.E.S. Ricardo Bernardo APARATO EXCRETOR El sistema
Cuidados de enfermería a pacientes con trastornos del ion potasio
 MEDICO QUIRúRGICA Cuidados de enfermería a pacientes con trastornos del ion potasio Bertv Suñé Ysamat* El 98 por ciento del potasio orgánico es intracelular; es el catión más importante de este compartimento.
MEDICO QUIRúRGICA Cuidados de enfermería a pacientes con trastornos del ion potasio Bertv Suñé Ysamat* El 98 por ciento del potasio orgánico es intracelular; es el catión más importante de este compartimento.
A continuación se detallan cada una de las propiedades coligativas:
 PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
PREGUNTA (Técnico Profesional) Se prepara una solución con 2 mol de agua y 0,5 mol de un electrolito no volátil. Al respecto, cuál es la presión de vapor a 25 ºC de esta solución, si la presión del agua
MEDIO INTERNO HOMEOSTASIS. Estructura del medio interno. Se denomina asi al medio extracelular, el medio que rodea a las celulas
 MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
MEDIO INTERNO Se denomina asi al medio extracelular, el medio que rodea a las celulas HOMEOSTASIS Estructura del medio interno El agua representa el 40-60% del peso corporal del organismo. 1 Distribución
La acidosis metabólica es un trastorno ácido-base que tiende a producir acidemia (descenso en el ph) por cambios primarios en la
 Fecha actualización: 27/09/16 Algoritmos diagnósticos: Equilibrio ácido base Use CTRL+F para buscar en este artículo Roberto Alcazar Arroyo Elena Corchete Prats Servicio de Nefrología Hospital Infanta
Fecha actualización: 27/09/16 Algoritmos diagnósticos: Equilibrio ácido base Use CTRL+F para buscar en este artículo Roberto Alcazar Arroyo Elena Corchete Prats Servicio de Nefrología Hospital Infanta
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación
 Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
Un equilibrio heterogéneo muy especial: Equilibrio de Precipitación Los equilibrios heterogéneos son aquellos en los cuales los reactivos y productos se presentan en distintos estados de agregación (sólido,
MC I Medio. El Agua y los iones. Manuel Mallol Simmonds
 El Agua y los iones MC I Medio El agua es una molécula ampliamente estudiada bajo los prismas de diferentes ciencias naturales. En la biología, el agua permite la existencia y desarrollo de la vida tal
El Agua y los iones MC I Medio El agua es una molécula ampliamente estudiada bajo los prismas de diferentes ciencias naturales. En la biología, el agua permite la existencia y desarrollo de la vida tal
EQUILIBRIO ACIDO BASE
 EQUILIBRIO ACIDO BASE ASPECTO FISIOLÓGICO CONCENTRACIÒN NORMAL DE HIDROGENIONES 35 A 45 NM / L HAY MECANISMOS QUE ACTÚAN PERMANENTEMENTE PARA MANTENER ESTE RANGO FUERA DE ESTE HAY ALTERACIÓN DEL FUNCIONAMIENTO
EQUILIBRIO ACIDO BASE ASPECTO FISIOLÓGICO CONCENTRACIÒN NORMAL DE HIDROGENIONES 35 A 45 NM / L HAY MECANISMOS QUE ACTÚAN PERMANENTEMENTE PARA MANTENER ESTE RANGO FUERA DE ESTE HAY ALTERACIÓN DEL FUNCIONAMIENTO
Sistema respiratorio. Fisiología Licenciatura en Enfermería. Dra. Maria Eugenia Victoria Bianchi Año 2012
 Sistema respiratorio Enfermería. Dra. Maria Eugenia Victoria Bianchi Año 2012 Volúmenes y capacidades Volumen corriente:(vt) es el volumen de aire inspirado y expirado en una respiración normal Volumen
Sistema respiratorio Enfermería. Dra. Maria Eugenia Victoria Bianchi Año 2012 Volúmenes y capacidades Volumen corriente:(vt) es el volumen de aire inspirado y expirado en una respiración normal Volumen
Acidosis metabólica en Medicina Intensiva
 Acidosis metabólica en Medicina Intensiva Curso Alteraciones nefrológicas y de medio interno en Medicina Intensiva Hospital Español - 20/11/14 Dr Jordán Tenzi - UMI Hospital Español Alteraciones metabólicas
Acidosis metabólica en Medicina Intensiva Curso Alteraciones nefrológicas y de medio interno en Medicina Intensiva Hospital Español - 20/11/14 Dr Jordán Tenzi - UMI Hospital Español Alteraciones metabólicas
